Изобретение относится к области фармакологии и медицины, в частности - онкологии, и может быть использовано для создания магниточувствительных липосомальных форм для целевой доставки противоопухолевых лекарственных средств.
Большинство известных противоопухолевых химиотерапевтических средств характеризуются серьезными недостатками, к которым, в первую очередь, относятся низкая селективность, быстрое выведение из организма, высокая общая токсичность. Многие средства, обладающие противоопухолевой активностью, плохо растворимы в воде, что затрудняет создание наиболее эффективных инъекционных форм, характеризующихся максимальной биодоступностью. Применение липосомальных форм позволяет уменьшить общую токсичность и повысить селективность противоопухолевых химиотерапевтических средств за счет пассивной избирательности, основанной на известном эффекте повышенной проницаемости и накопления (ППН) [Y. Matsumura, Н. Maeda. "A new concept for macromolecular therapeutics in cancer chemotherapy. Mechanism of tumoritropic accumulation of proteins and the antitumor agents smancs" / Canser Res. 1986, No 46, p.6387-6392]. Для проявления эффекта ППН большое значение имеет размер липосом, определяющий способность избирательного проникновения везикул в сосуды, питающие опухоль, а также степень их захватывания ретикуло-эндотелиальной системой (РЭС) в кровеносном русле. В отличие от капилляров сосудов, питающих здоровые ткани, диаметр пор в которых составляет 60-80 нм, размер дефектов кровеносных сосудов, питающих опухоли, для разных типов новообразований колеблется от нескольких сотен нанометров до нескольких микрон. Поэтому, для предотвращения накопления липосом в здоровых тканях оптимальный размер липосом должен начинаться от 90 нм [Д.Г. Гуревич и др. «Влияние размеров липосом на уровень и селективность накопления тиосенса в опухоли», Российский биотерапевтический журнал, 2007, №2, т. 6, с. 45-49]. Однако, когда средний диаметр липосом превышает 300 нм, время циркуляции в крови уменьшается по сравнению с липосомами меньшего диаметра, а сами липосомы накапливаются в селезенке [Litzinger D. С.et al. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes / Biochimica et Biophysica Acta (BBA)-Biomembranes. 1994, т. 1190, №1, с. 99-107]. С учетом этих ограничений, для целевой доставки противоопухолевых средств предпочтительны липосомы с размером 90 - 300 нм. По данным работы [О.И. Саквина, А.Ю. Барышников «Липосомы в направленной доставке противоопухолевых препаратов» / Российский биотерапевтический журнал. 2008. т. 7, №4, с. 80 - 85] оптимальный средний размер частиц не превышает 200 нм.
Использование лишь пассивной избирательности, как правило, недостаточно для достижения уровня селективности, обеспечивающего необходимое снижение общего токсического эффекта препарата и повышения его противоопухолевой эффективности. Одним из подходов, позволяющих совместить возможности пассивного и активного транспорта химиопрепарата в опухоль, является создание магнитных липосом, в которых вместе с лекарственным средством инкапсулированы частицы, обладающие магнитными свойствами, позволяющие целенаправленно концентрировать лекарственное средство в опухоли под действием внешнего магнитного поля. Требования к размерам липосом для адресной доставки противоопухолевых препаратов, о которых говорилось выше, в полной мере применимы и к липосомам, содержащим носители магнитных свойств.
Анализ источников, касающихся получения и практического использования магнитных липосомальных средств адресной доставки противоопухолевых средств, показывает, что в них недостаточно внимания уделяется требованиям к размерным характеристикам липосом, которым должны удовлетворять предназначенные для этой цели препараты.
В работе [A,A. Kuznetsov, V.I. Filippov, et al. "Application of magnetic liposomes for magnetically guided transport of muscle relaxants and anti-cancer photodynamic drugs" / J. of Magnetism and Magnetic Materials. 2001, v. 225. p. 95-100] описан способ инкапсулирования миорелаксантов и противоопухолевых лекарственных средств - фотосенсибилизатора Фотосенс и каталитической системы Терафтал - в магнитолипосомы на основе ферромагнитных частиц субмикронного размера (10-50 нм), в качестве которых используют коллоидное железо, полученное плазмохимическим способом, или коллоидные частицы магнетита в воде, стабилизированные желатином. Этанольный раствор лецитина и холестерина упаривают на роторном испарителе и к полученной пленке прибавляют смесь лекарственного средства с магнитными частицами. После обработки на ультразвуковой бане и отделения не прореагировавших компонентов получают нагруженные лекарственным средством магнитные липосомы, содержащие магнитные частицы в водной фазе внутри липосом. Для включения магнитных частиц в липидный бислой их вводят в этанольный раствор липидных компонентов, который упаривают на роторном испарителе, после чего к полученной пленке прибавляют водный раствор лекарственного средства, не содержащий магнитных частиц. В работе в эксперименте на животных показана возможность использования полученных магнитолипосом для адресной доставки лекарственных средств в пораженный орган. Однако, следует отметить, что в работе не уделено какого-либо внимания размеру получаемых магнитных липосом, что, как отмечалось выше, имеет особенно важное значение с точки зрения повышения селективности и снижения общей токсичности препаратов, используемых в химиотерапии опухолей.
В заявке [CN 101590017 А, опубл. 02.12.2009,] описано получение магнитолипосом противоопухолевого средства Таксол (Паклитаксел), практически нерастворимого в воде и проявляющего высокую токсичность в отношении органов пищеварения, кроветворения, иммунной системы. Для получения препарата при температуре 72±3°С получают эмульсию, включающую стеариновую кислоту, поверхностно-активное вещество Твин 80 и этанол, при интенсивном перемешивании прибавляют по каплям дистиллированную воду и магнитную жидкость. Суспензию впрыскивают в воду при охлаждении на ледяной бане, подвергают диализу и лиофильной сушке. Получают твердый магнитолипосомальный препарат с размером частиц 170 - 190 нм, однако из описания не ясно, на какой стадии в систему вводят противоопухолевое средство, а также конкретные условия проведения операций, обеспечивающие получение магнитных липосом указанного размера.
В патенте Китая [CN 103040756 В, опубл. 14.10.2015] описан способ получения пэгилированных магнитных липосом эпирубицина гидрохлорида. Наночастицы магнетита размером 10 - 30 нм получают соосаждением хлоридов двух- и трехвалентного железа, растворенных в деоксигенированной дистиллированной воде, при нагревании до 80°С в атмосфере азота в присутствии водного раствора аммиака. Смесь взятых в нужном количестве фосфатидилхолина, холестерина, монометилового эфира полиэтиленглиголя (mPEG) и наночастиц магнетита в абсолютном этаноле медленно вводят в раствор сульфата аммония (0,1 мол/л), обрабатывают в ультразвуковой ванне (30 мин, 60°С), упаривают на роторном испарителе в вакууме до исчезновения запаха этанола и подвергают в течение суток диализу против фосфатно-солевого буфера. Полученные «пустые» магнитные липосомы смешивают на водяной бане при 55°С с нужным количеством эпирубицина гидрохлорида. Существенным недостатком изобретения является то, что способ позволяет получать магнитолипосомы, размер которых, по данным авторов, составляет около 50 нм, что позволяет им беспрепятственно проникать в здоровые ткани, увеличивая общую токсичность препарата. Также следует отметить, что использование диализа для очистки усложняет процесс и значительно увеличивает время приготовления.
Описан способ получения магниточувствительных липосом - систем доставки лекарственных веществ с контролируемым высвобождением. [RU 2357724 С1, опубл. 10.06.2009]. Способ включает растворение фосфолипидов в хлороформе, добавление носителя магнитных свойств и воздействие ультразвуком, при этом в качестве источника фосфолипидов используют барсучий жир, в качестве носителя магнитных свойств используют полученный газофазным способом ферромагнитный нанопорошок железа, никеля или кобальта с размером частиц 2-5 нм, заключенный в углеродную оболочку. Полученную липосомальную систему стерилизуют в камере бетатрона. В результате получают крупные магнитолипосомы, размером от 1 до 7 мкм, что значительно превышает оптимальные размеры, позволяющие обеспечить эффективную избирательную доставку лекарственного средства в опухоль. Следует отметить, что использование в качестве источника фосфолипидов барсучего жира может приводить к аутоимунным реакциям.
Известны публикации, касающиеся влияния последовательно повторяющихся процедур замораживания - оттаивания фосфолипидной эмульсии на степень включения в липосому лекарственного средства и размер получаемых липосом. В работе [«Изготовление липосомальных наноконтейнеров как транспортеров лекарственных средств» http://pandia.ru/text/77/414/79986.php] отмечается, что в результате многократно повторяющихся циклов замораживания фосфолипидных дисперсий с последующим оттаиванием образуются липосомы с высоким процентным включением иммобилизируемых веществ. По данным работы [Pick, V. "Liposomes with a large trapping capability prepared by freezing" / Arch, Biochem. and Biophys. 1981, Vol. 212, p. 186-194] при повторении процедуры замораживание - оттаивание происходит слияние липосом и увеличение их размеров. В работе [Castile J. D., Taylor К. M. G. "Factors affecting the size distribution of liposomes produced by freeze-thaw extrusion" / International Journal of Pharmaceutics, v. 188, Issue 1, 15 October 1999, p 87-95] показано, что добавление к яичному лецитину холестерина приводит к укрупнению получаемых мультиламелярных везикул в процессе нескольких циклов замораживания (жидкий азот, 3 мин.) - оттаивания (50°С, 3 мин.). Максимальный размер липосом получен после пяти циклов в присутствии хлористого натрия. Добавление полимерных ПАВ Полаксомеров Р338 and Р407 способствует уменьшению среднего диаметра липосом. Следует отметить, что упомянутые исследования проведены на липосомах, не содержащих носителей магнитных свойств.
В качестве прототипа настоящего изобретения взят описанный в работе [Javier Alonso et al,"Superparamagnetic Nanoparticles Encapsulated in Lipid Vesicles for Advanced Magnetic Hyperthermia and Biodetection" / Journal of Applied Physics 2016, 119: 083904] способ получения суперпарамагнитных наночастиц, инкапсулированных в фосфолипидные везикулы, предназначенные для гипертермии опухолей. Для получения магнитных липосом в качестве липидного компонента взят синтетический 1-пальмитоил-2-олеил-sn-глицеро-3-фосфатидилхолин (1-palmitoyl-2-oleoyl-sn-glycero-3-phosphotidylcholine (РОРС). В качестве носителя суперпарамагнитных свойств взяты наночастицы маггемита γ-Fe2O3 (размер 12,8±1,7 нм, величина намагниченности насыщения более 30 emu/g), полученные термодеструкцией ацетилацетоната железа(III) в присутствии олеиновой кислоты и олеиламина. Раствор 10 мг РОРС в хлороформе смешивают с 0,4 мг γ-Fe2O3 в гексане. После упаривания растворителя в аргоне на роторном испарителе остаток вакуумируют, полученную пленку гидратируют ультрачистой водой при перемешивании с последующим мягким озвучиванием. Затем образец подвергают 5-кратной процедуре замораживания - оттаивания в интервале температур от минус 80 до плюс 50°С, после чего полученную дисперсию многократно (31 раз) экструдируют через поликарбонатную мембрану с диаметром пор 100 нм. Полученный образец представляет собой содержащие магнитные наночастицы униламелярные везикулы, размер которых определяется размерами пор мембраны. Наночастицы, не вошедшие в состав липосом, отделяют гель-фильтрацией. Таким образом, для получения магнитных липосом нужного размера требуется многократно повторенная процедура экструзии образца через пористую мембрану, что связано с дополнительными затратами времени и необходимостью использования специального оборудования. Поскольку способ по прототипу предназначен для получения «пустых», не содержащих лекарственного средства липосом, неочевидно, что он позволяет получать нагруженные противоопухолевым средством магнитолипосомы оптимального для противоопухолевой терапии размерного диапазона.
Проблема, решаемая настоящим изобретением, состоит в разработке простого, не требующего больших затрат времени способа, позволяющего без дополнительной сепарации по размерам получать как пустые, так и нагруженные противоопухолевым средством магнитные липосомы, размерные характеристики которых соответствуют оптимальному для противоопухолевой терапии диапазону, а именно: размер частиц не выходит за пределы диапазона 90 - 300 нм, а средний размер не превышает 200 нм.
Проблема решена предлагаемым способом получения магнитных липосом, включающим получение суспензии, включающей фосфатидилхолин и магнитные наночастицы, ее обработку ультразвуком и последующую повторяющуюся процедуру ее замораживания - оттаивания, отличающимся тем, что указанная суспензия при необходимости включает дополнительно противоопухолевое средство, в качестве магнитных наночастиц используют наночастицы магнетита в форме водного золя, а указанная повторяющаяся процедура замораживания - оттаивания включает замораживание указанной суспензии при температуре жидкого азота, последующее ее плавное оттаивание при комнатной температуре и дополнительно включает ее последующую обработку ультразвуком, при этом указанную процедуру повторяют не менее трех раз.
Таким образом, каждая, повторяемая, как минимум, трижды, процедура замораживания - оттаивания, включает не только замораживание и оттаивание, как таковые, но и дополнительно включает последующее озвучивание образца в условиях, обычно применяемых при работе с липосомальными формами. Использование только сочетания замораживание - оттаивание или только ультразвуковой обработки по отдельности не позволяет получить требуемый результат так же быстро и просто, как это возможно предлагаемым способом.
В случае получения «пустых», не содержащих противоопухолевое средство магнитных липосом, указанная суспензия представляет собой водную суспензию, содержащую фосфолипид и наночастицы магнетита. Суспензию получают гидратацией пленки фосфолипида, полученной упариванием раствора фосфолипида в органическом растворителе, путем добавления к ней водного золя наночастиц магнетита. Один из возможных вариантов осуществления способа для получения «пустых» липосом описан в Примере 1.
При необходимости получения магнитных липосом, нагруженных противоопухолевым средством, указанная суспензия представляет собой водную суспензию, содержащую фосфолипид, наночастицы магнетита и противоопухолевое средство. При этом, если противоопухолевое средство растворимо в воде, суспензию получают гидратацией пленки фосфолипида, полученной упариванием раствора фосфолипида в органическом растворителе, путем добавления к ней водного золя наночастиц магнетита, содержащего дополнительно водорастворимое противоопухолевое средство. Возможность получения заявляемым способом магнитных липосом, содержащих водорастворимое противоопухолевое средство, продемонстрирована в Примере 2, в котором в качестве водорастворимого противоопухолевого средства взят рубомицина гидрохлорид.
Если противоопухолевое средство не растворимо в воде, суспензию получают гидратацией пленки фосфолипида, полученной упариванием раствора фосфолипида в органическом растворителе, содержащего дополнительно не растворимое в воде противоопухолевое средство, путем добавления к ней водного золя наночастиц магнетита. Возможность получения заявляемым способом магнитных липосом, содержащих не растворимое в воде противоопухолевое средство, продемонстрирована в Примере 3, в котором в качестве не растворимого в воде противоопухолевого средства взят феофорбид А.
Перечень иллюстраций, поясняющих сущность изобретения, приведен ниже.
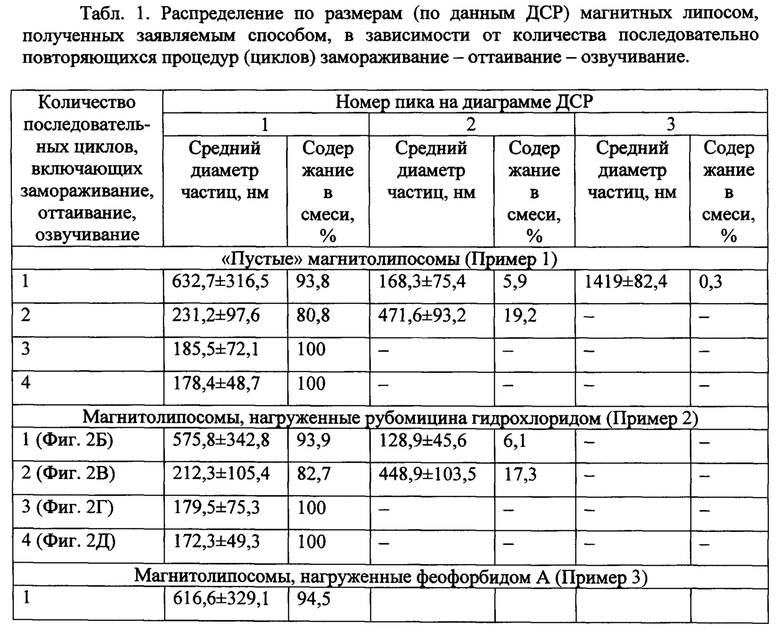
Фиг. 1. Электронная микрофотография наночастиц магнетита, использованных для получения магнитных липосом заявляемым способом (LEO-912 АВ, Zeiss, Германия).
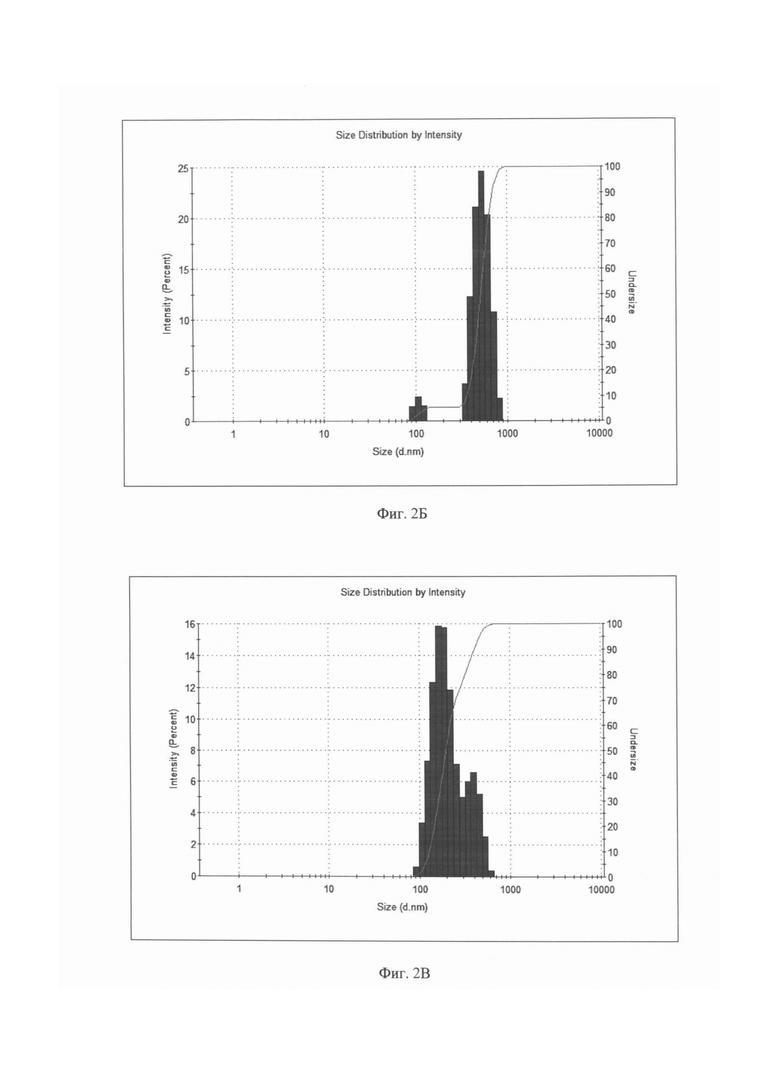
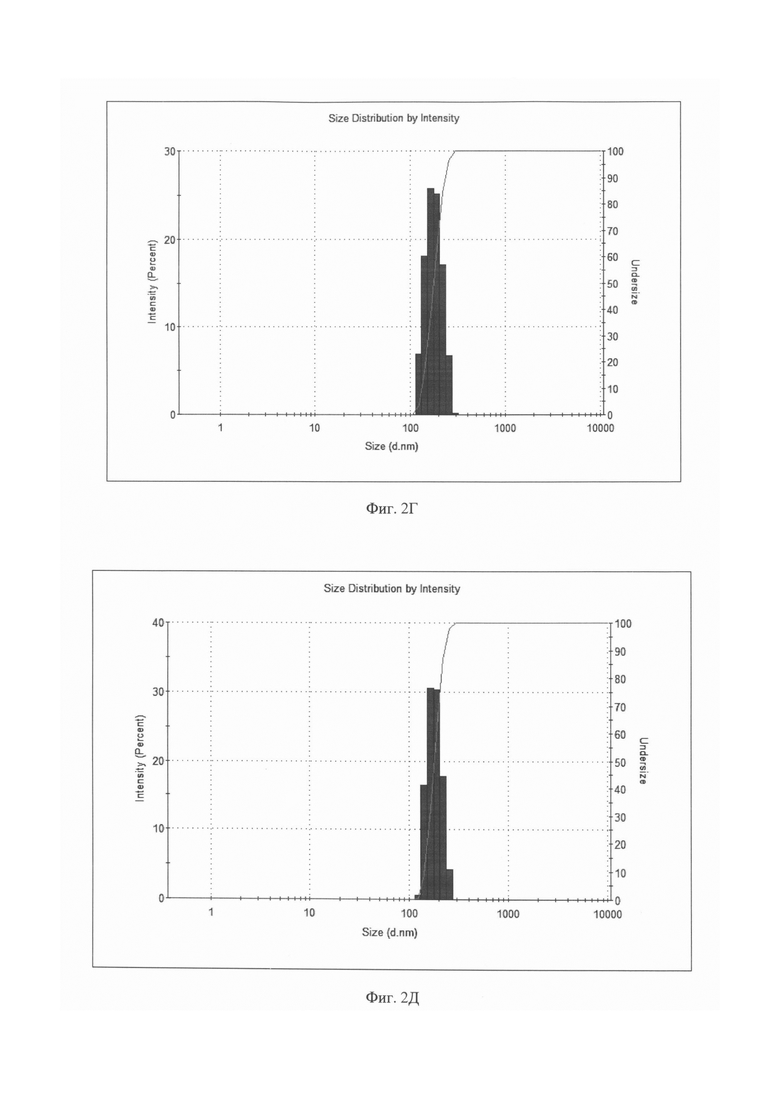
Фиг. 2 (А - Д). Распределение по размерам магнитолипосом, содержащих рубомицина гидрохлорид, по данным динамического светорассеяния (ДСР) (Malvern Zetasizer Nano ZS, Malvern Instruments Ltd., Великобритания).
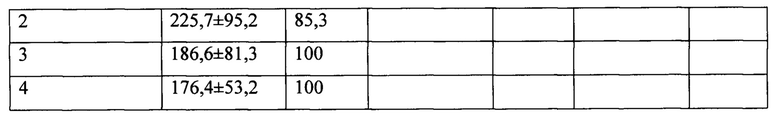
2A. После однократной ультразвуковой обработки (70W, 40KHz, комнатная температура, 5 мин) суспензии, содержащей фосфатилхолин, наночастицы магнетита, рубомицина гидрохлорид без проведения процедуры замораживание - оттаивание с последующим озвучиванием.
2Б. Образец обработан аналогично 2А и дополнительно подвергнут однократной процедуре замораживания - оттаивания с последующим озвучиванием в тех же условиях в течение 15 минут.
2В. Образец обработан аналогично 2А и дополнительно подвергнут двукратной процедуре замораживания - оттаивания с последующим озвучиванием в тех же условиях в течение 15 минут.
2Г. Образец обработан аналогично 2А и дополнительно подвергнут трехкратной процедуре замораживания - оттаивания с последующим озвучиванием в тех же условиях в течение 15 минут.
2Д. Образец обработан аналогично 2А и дополнительно подвергнут четырехкратной процедуре замораживания - оттаивания с последующим озвучиванием в тех же условиях в течение 15 минут.
В основе изобретения лежат результаты проведенных авторами исследований влияния условий проведения процедуры замораживания - оттаивания с последующим дополнительным озвучиванием на размер получаемых магнитолипосомальных глобул.
В качестве фосфолипида использован фосфатидилхолин из соевого лецитина, однако, очевидно, что аналогично может быть использован фосфатидилхолин другого происхождения, включая синтетический.
В качестве магнитных наночастиц могут быть использованы наноразмерные носители магнитных свойств, образующие водные золи. Для иллюстрации возможности осуществления изобретения нами использованы суперпарамагнитные наночастицы магнетита Fe3O4, полученные способом термического разложения, как описано в работе [Л.Х. Комиссарова и др. «Разработка технологии получения монодисперсных наночастиц магнетита малого размерного диапазона и оценка их токсичности на мышах» / Технологии живых систем, 2017., т. 14, №4, с. 51-57].
Получение наночастиц магнетита
Раствор ацетилацетоната железа(III) в триэтиленгликоле (66,6 мг/мл) нагревают при постоянном перемешивании в атмосфере аргона до температуры 110 - 120°С и выдерживают в течение 30 мин., после чего температуру быстро поднимают до 250°С и продолжают нагревание в течение 600 минут. После охлаждения к полученной суспензии добавляют 40 мл этилацетата и наночастицы осаждают постоянным Sm-Co магнитом (150 мТл). Осадок последовательно пятикратно промывают ацетоном, этанолом и водой и ресуспендируют в дистиллированной воде с получением водного золя с концентрацией наночастиц магнетита 30 мг/мл. Для хранения образца используют инертную атмосферу и температуру 2 - 4°С.
Электронная микрофотография полученных наночастиц магнетита (просвечивающий электронный микроскоп LEO-912 АВ, Zeiss, Германия, ускоряющее напряжение 120 кВ) показана на Фиг. 1. Средний диаметр наночастиц составляет 6,12±1,07 нм. Величина намагниченности насыщения, составляющая 62,3 emu/g, позволяет легко управлять их перемещением даже с помощью бытового магнита.
Варьируя условия реакции, можно получать частицы различного размера. Так, если нагревание проводят при температуре 285°С в течение 1 часа, получают наночастицы магнетита размером 8,23±1,32 нм, для которых величина намагниченности насыщения составляет 68,7 emu/g.
Полученные магнитные наночастицы характеризуются низкими показателями острой токсичности: значение LD50 составляет 155,6 мг/кг, с 95%-ным доверительным интервалом от 137,7 до 175,8 мг/кг., что более, чем на порядок превышает дозы магнитоуправляемых носителей, используемые для доставки противоопухолевых препаратов в органы-мишени [Christoph A., Wolfgang A., Hulin P., et al. "Magnetic mitoxantrone nanoparticles detection by histology, X-ray and MRI after magnetic tumor targeting" / J. of Magn. and Magn. Materials. 2001, v. 225. p. 187-193].
В основе изобретения лежат результаты проведенных авторами исследований влияния состава и условий получения магнитных липосом на размеры получаемых липосомальных глобул. В экспериментах с «пустыми» магнитными липосомами, а также с магнитолипосомами, нагруженными химиотерапевтическими средствами - феофорбидом А и рубомицина гидрохлоридом, было обнаружено, что, если обработанную ультразвуком липосомальную суспензию, включающую фосфатидилхолин и наночастицы магнетита в форме водного золя, или фосфатидилхолин, наночастицы магнетита и дополнительно - противоопухолевый препарат, подвергать последовательно повторяющейся процедуре, включающей глубокое быстрое замораживание при температуре жидкого азота, затем плавное оттаивание при температуре, близкой к комнатной, и последующую УЗ обработку в мягких условиях, то, по мере увеличения количества повторов (циклов), размерный состав липосом становится все более однородным: количество фракций на диаграмме ДСР уменьшается, средний размер липосом также последовательно уменьшается, а их распределение по размерам становится все более узким. При этом, как показали эксперименты, после трех циклов средний размер магнитных липосом не превышает 200 нм, минимальный размер не выходит за пределы 90 нм, а максимальный не превышает 300 нм. Дальнейшее увеличение количества повторов практически не дает заметного эффекта.
Оттаивание образца удобно проводить на водяной бане при температуре, близкой к комнатной, предпочтительно, в пределах 20 - 30°С. Тот же температурный диапазон предпочтителен и для проведения последующего озвучивания. Время озвучивания подбирают экспериментально с учетом характеристик используемого УЗ-оборудования. Как правило, при использовании обычных лабораторных УЗ-ванн оно не превышает 15 минут. Увеличение времени озвучивания не целессобразно, т.к. необходимый диапазон размеров получаемых липосом достигается при времени озвучивания 5-15 минут. Отклонения времени и температуры от указанных величин в разумных пределах не влияют существенно на достижение результата.
Результаты проведенных исследований показаны в Табл. 1, где приведены данные по изменению размерных характеристик магнитных липосом разного состава в зависимости от количества повторов процедуры замораживание - оттаивание - озвучивание.
Получение магнитных липосом, содержащих и не содержащих противоопухолевое средство, описано в Примерах 1-3.
В случае получения «пустых» магнитолипосом (Пример 1) после проведения однократной процедуры замораживание - оттаивание - озвучивание исходной суспензии магнитных липосом на диаграмме ДСР присутствует три пика, соответствующих липосомам со средним размером от приблизительно 170 до приблизительно 1420 нм. Более 90% приходится на глобулы со средним размером около 630 нм. По мере повторения циклов однородность образца повышается: после второго цикла на диаграмме остается 2 пика, а после третьего средний размер частиц, представленных единственным пиком, составляет около 185 нм, при этом все частицы попадают в диапазон 90 - 300 нм Дальнейшее повторение процедуры приводит к получению частиц, попадающих в тот же размерный диапазон.
Аналогичные закономерности получены и для магнитных липосом, нагруженных противоопухолевыми средствами. Для наглядности динамика изменения размерного распределения магнитных липосом, содержащих рубомицин, в зависимости от количества последовательных циклов замораживание - оттаивание - озвучивание, показана на диаграммах, представленных на Фиг. 2А-2Д. На Фиг. 2А показано распределение по размерам магнитолипосом, полученных после первоначальной 5-минутной УЗ-обработки суспензии, включающей фосфатидилхолин, химиопрепарат и наночастицы магнетита, без использования цикла замораживание - оттаивание - озвучивание. Образец крайне неоднороден и включает липосомы с размером в диапазоне от 300 до 700 нм, а так же глобулы, превышающие по размеру 1 мкм. Увеличение времени УЗ обработки до 35 минут (на диаграмме не показано) хотя и увеличивает долю частиц меньшего размера, однако, не позволяет достичь требуемого результата. После первого цикла замораживание - оттаивание - озвучивание картина меняется (см. Фиг. 2Б): средний размер частиц существенно снижается, происходит четкое разделение на две фракции, к первой, содержащей около 6% частиц, относятся липосомы со средним диаметром около 130 нм, основную фракцию (более 80%) составляют частицы, средний диаметр которых превышает 575 нм. Повторение цикла приводит к дальнейшей реструктуризации размерного состава магнитных липосом (см. Фиг. 2В), при этом средний размер более, чем 80% частиц, составляет 212 нм, однако образец еще содержит более 17% частиц, средний размер которых составляет около 450 нм. После третьего цикла (Фиг. 2Г) распределение представляет собой один пик, соответствующий среднему размеру липосом около 180 нм и не содержащему частиц с размером, выходящим за пределы диапазона 90-300 нм. Проведение дополнительного четвертого цикла замораживание - оттаивание - озвучивание (см. Фиг. 2Д) практически не меняет картину и с точки зрения решения поставленной задачи -получения магнитных липосом размером 90 - 300 нм и средним размером, не превышающем 200 нм, является излишним.
Как видно из Таблицы 1, аналогичные закономерности изменения размерного состава магнитолипосом в зависимости от количества повторов цикла замораживание - оттаивание - озвучивание, характерны и для магнитолипосом, нагруженных феофорбидом А.
Из данных, приведенных в Табл. 1 также видно, что в процессе последовательного повторения циклов замораживание - оттаивание - озвучивание в указанных условиях происходит не только уменьшение среднего размера магнитных липосомальных частиц, но и сужение размерного диапазона, свидетельствующее о получении образцов магнитных липосом все более однородных по размерному составу.
Таким образом, как для препаратов магнитных липосом, не содержащих лекарственное средство, так и для магнитных липосом, нагруженных феофорбидом А или рубомицина гидрохлоридом, зависимости изменения размеров частиц от количества циклов замораживание - оттаивание - озвучивание носят близкий характер. Это говорит о том, что выявленные закономерности, имеют общий характер и могут быть использованы для получения различных по химическому составу магнитных липосом оптимального, с точки зрения возможности их применения в онкологии, размера.
Приведенные ниже примеры демонстрируют возможность реализации изобретения, при этом не охватывают всех возможных вариантов, описываемых формулой изобретения.
Пример 1. Получение «пустых» магнитных липосом, не содержащих противоопухолевое средство.
80 мг фосфатидилхолина растворяют в 2,5 мл хлороформа, раствор упаривают досуха на роторно-вакуумном испарителе при температуре, не превышающей 40°С. К образовавшейся на стенках тонкой фосфолипидной пленке прибавляют 3 мл водного золя наночастиц магнетита (средний диаметр 6,12±1,07 нм, концентрация 10 мг/мл), и озвучивают в УЗ-ванне при комнатной температуре в течение 5 мин, мощность 70W, частота 40KHz. Затем проводят 3-кратную процедуру, включающую быстрое замораживание при температуре жидкого азота, плавное оттаивание на водяной бане при температуре 20 - 30°С и последующее озвучивание полученной суспензии в тех же условиях в течение 15 мин. Следует отметить, что приведенные в этом и последующих примерах конкретные условия озвучивания (время, температура), зависящие от свойств образцов и характеристик УЗ-оборудования, подбираются экспериментально. Отклонение от приведенных в примерах значений в разумных пределах не влияет на результат.
По результатам измерения с помощью метода динамического светорассеяния (Malvern Zetasizer Nano ZS, Malvern Instruments Ltd., Великобритания) средний размер полученных магнитных липосом составляет 185,5±72,1 нм (см. Табл. 1). Величина намагниченности насыщения для полученного образца магнитных липосом составляет 15,2 emu/g, что позволяет осуществлять контролируемую доставку магнитолипосомального препарата к области опухоли с помощью воздействия внешнего магнитного поля [Gang J. et al. "Magnetic poly ε-caprolactone nanoparticles containing Fe3O4 and gemcitabine enhance anti-tumor effect in pancreatic cancer xenograft mouse model / Journal of drug targeting. 2007. v. 15. №.6. p. 445-453.].
Образец хранят в герметичной, продутой азотом емкости при температуре 2 - 4°С в течение 15 дней. После разбавления стерильной или бактериостатической водой для инъекций до нужной концентрации образец может быть использован для гипертермии опухолей.
Для предотвращения окисления фосфолипида и увеличения срока хранения в образец могут быть добавлены разрешенные для внутривенного введения антиоксиданты и/или консерванты в эффективном количестве. Если предполагается дальнейшее хранение суспензии магнитных липосом в замороженном состоянии, в образец добавляют криопротектор из класса моно- или дисахаридов, например, сахарозу.
Пример 2. Получение магнитных липосом, нагруженных рубомицином
Рубомицина гидрохлорид. 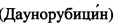 - водорастворимый цитостатический препарат, относящийся к антрациклиновым антибиотикам.
- водорастворимый цитостатический препарат, относящийся к антрациклиновым антибиотикам.
Навеску рубомицина гидрохлорида массой 6 мг растворяют в 1,25 мл дистиллированной воды. К полученному раствору добавляют 0,25 мл водного золя наночастиц магнетита (средний диаметр наночастиц 8,23±1,32 нм) с концентрацией наночастиц 30 мг/мл. Смесь, содержащую рубомицин в концентрации 4 мг/мл и наночастицы магнетита в концентрации 5 мг/мл, озвучивают при комнатной температуре в течение 15 мин (мощность 70 W, частота 40KHz). Навеску фосфатидилхолина массой 40 мг растворяют в 1,5 мл хлороформа, раствор упаривают досуха на роторно-вакуумном испарителе при температуре, не превышающей 40°С. К образовавшейся на стенках колбы тонкой липидной пленке прибавляют 1,5 мл приготовленного, как описано выше, раствора рубомицина гидрохлорида, содержащего наночастицы магнетита. Полученную суспензию озвучивают в условиях, как в Примере 1, а затем проводят 3-кратную процедуру, включающую быстрое замораживание при температуре жидкого азота, плавное оттаивание при комнатной температуре не выше 30°С и последующее озвучивание полученной суспензии в УЗ-ванне в условиях, аналогичных Примеру 1. Средний размер полученных магнитных липосом, нагруженных рубомицином по данным ДСР составляет 179,5±75,3 нм (см. Табл. 1).
Величина намагниченности насыщения для полученного образца магнитных липосом составляет 9,6 emu/g, что позволяет осуществлять адресную доставку препарата под действием магнитного поля. Коэрцитивная сила образца менее 4 кА/м, остаточная намагниченность менее 0,5 emu/g. Таким образом, образец практически не обладает остаточной намагниченностью, что исключает возможность неконтролируемой агрегации наночастиц после воздействия агнитного поля.
Образец хранят в герметичной, продутой азотом емкости при температуре 2-4°С. Визуальный контроль и контроль методом ДСР показывают, что в этих условиях образец сохраняет стабильность не менее двух недель.
Для обеспечения криостабильности образцов магнитных липосом, нагруженных рубомицином, в водный раствор, содержащий лекарственное средство и наночастицы магнетита, добавляют сахарозу до концентрации 40 мг/мл. Заявляемым способом получают стабильную суспензию, содержащую магнитные липосомы со средним диаметром 173,0±74,9 нм. После трехкратного замораживания образца при температуре минус 20°С с последующим оттаиванием при 6°С размер магнитных липосом практически не изменяется и составляет 173,5±92,3 нм. В замороженном состоянии при температуре минус 20°С образец может храниться не менее двух месяцев и сразу после размораживания готов к применению.
Пример 3. Получение магнитолипосом, нагруженных феофорбидом А
Феофорбид А - практически нерастворимый в воде противоопухолевый препарат, представляющий собой продукт распада хлорофилла, и применяемый в качестве фотосенсибилизатора в фотодинамической терапии опухолей.
В 1,5 мл хлороформа растворяют 40 мг фосфатидилхолина и 1 мг феофорбида А. Полученный раствор упаривают досуха на роторно-вакуумном испарителе при температуре, не превышающей 40°С. К образовавшейся на стенках тонкой липидной пленке прибавляют 1,5 мл водного золя наночастиц магнетита с концентрацией 5 мг/мл. Средний диаметр наночастиц 8,23±1,32 нм. Полученную суспензию озвучивают как в Примере 1, а затем проводят 3-кратную процедуру, включающую быстрое замораживание при температуре жидкого азота, оттаивание на водяной бане при температуре 25°С с последующим озвучиванием полученной суспензии в УЗ-ванне, как в Примере 1. Средний размер полученных липосом по данным ДСР составляет 186,6±81,3 нм. Образец хранят в герметичной, продутой азотом емкости при температуре 2 - 4°С. Визуальный контроль и контроль методом фотонной корелляционной спектроскопии показывают, что в этих условиях образец сохраняет стабильность не менее двух недель.
Магнитные свойства магнитолипосом, нагруженных феофорбидом А, аналогичны тем, которые получены для магнитолипосом, нагруженных рубомицином.
Для обеспечения криостабильности магнитных липосом, нагруженных феофорбидом А, в водный золь, содержащий наночастицы магнетита, добавляют сахарозу до концентрации 40 мг/мл. Все остальные процедуры выполняют, как описано выше. Получают стабильную суспензию, содержащую магнитные липосомы со средним диаметром 184,5±83,3 нм. После трехкратного замораживания при температуре минус 20°С с последующим оттаиванием при 6°С размер магнитных липосом практически не изменяется и составляет 185,9±81,8 нм. В замороженном состоянии при температуре минус 20°С образец может храниться не менее двух месяцев, и сразу после размораживания готов к применению.
Таким образом, предложенный способ получения магнитных липосом легко осуществим, не требует использования специального оборудования и позволяет быстро получать магнитные липосомы, размерные характеристики которых отвечают требованиям, предъявляемым к липосомальным препаратам, применяемым для терапии опухолей. Применение дополнительных сепарирующих процедур для получения частиц нужного размера, не требуется. Способ позволяет получать как «пустые», не содержащие химиопрепарата магнитолипосомы, которые могут быть использованы для гипертермии опухолей, так и нагруженные противоопухолевым средством магнитные липосомы для химиотералевтического лечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МАГНИТОЧУВСТВИТЕЛЬНЫХ ЛИПОСОМ | 2007 |
|
RU2357724C1 |
| ЛИПОСОМАЛЬНОЕ СРЕДСТВО НА ОСНОВЕ УБИХИНОЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2605616C1 |
| НАНОСИСТЕМА НА ОСНОВЕ РАСТИТЕЛЬНЫХ ФОСФОЛИПИДОВ ДЛЯ ВКЛЮЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2009 |
|
RU2391966C1 |
| ЛИПОСОМАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2007 |
|
RU2494729C2 |
| КОМПОЗИЦИЯ ДЛЯ ВСТРАИВАНИЯ ЛЕКАРСТВЕННЫХ СУБСТАНЦИЙ В ЛИПИДНУЮ МАТРИЦУ, КОМПОЗИЦИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА С ФОСФОЛИПИДНО-ЖИРНОКИСЛОТНОЙ СИСТЕМОЙ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2463056C1 |
| Способ получения липосомальной формы бетулина, обладающей гепатопротекторной активностью | 2019 |
|
RU2740553C2 |
| СРЕДСТВО, УЛУЧШАЮЩЕЕ ПРОТИВООПУХОЛЕВЫЙ ЭФФЕКТ, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ОКСАЛИПЛАТИН, И ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО | 2009 |
|
RU2492863C2 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2476216C1 |
| Способ лечения онкологических заболеваний с помощью инъекций лекарственного препарата | 2018 |
|
RU2706427C1 |
| СРЕДА ДЛЯ КРИОКОНСЕРВАЦИИ СЕМЕНИ БЫКА И СПОСОБ ЕЁ ПРИГОТОВЛЕНИЯ | 2014 |
|
RU2577882C1 |
Изобретение относится к фармацевтической промышленности, а именно к способу получения магнитных липосом. Способ получения магнитных липосом включает получение суспензии, включающей фосфатидилхолин и магнитные наночастицы, ее обработку ультразвуком и последующую повторяющуюся процедуру ее замораживания-оттаивания, в качестве магнитных наночастиц используют наночастицы магнетита в форме водного золя, где повторяющаяся процедура замораживания-оттаивания включает замораживание указанной суспензии при температуре жидкого азота, последующее ее плавное оттаивание при комнатной температуре и дополнительно включает ее последующую обработку ультразвуком мощностью 70 Вт и частотой 40 кГц при температуре 20-30°С в течение 5-15 мин, при этом указанную процедуру повторяют не менее трех раз. Предложенный способ является эффективным для получения магнитных липосом оптимального размера. 11 з.п. ф-лы, 2 ил., 1 табл., 3 пр.
1. Способ получения магнитных липосом, включающий получение суспензии, включающей фосфатидилхолин и магнитные наночастицы, ее обработку ультразвуком и последующую повторяющуюся процедуру ее замораживания-оттаивания, отличающийся тем, что в качестве магнитных наночастиц используют наночастицы магнетита в форме водного золя, а указанная повторяющаяся процедура замораживания-оттаивания включает замораживание указанной суспензии при температуре жидкого азота, последующее ее плавное оттаивание при комнатной температуре и дополнительно включает ее последующую обработку ультразвуком мощностью 70 Вт и частотой 40 кГц при температуре 20-30°С в течение 5-15 мин, при этом указанную процедуру повторяют не менее трех раз.
2. Способ по п. 1, отличающийся тем, что для получения указанной суспензии фосфатидилхолин растворяют в органическом растворителе, полученный раствор упаривают на роторном испарителе и к полученной пленке добавляют наночастицы магнетита в форме водного золя.
3. Способ по п. 1, отличающийся тем, что указанная суспензия включает дополнительно противоопухолевое средство.
4. Способ по п. 3, отличающийся тем, что противоопухолевое средство представляет собой водорастворимое противоопухолевое средство.
5. Способ по п. 4, отличающийся тем, что для получения указанной суспензии фосфатидилхолин растворяют в органическом растворителе, полученный раствор упаривают на роторном испарителе и к полученной пленке добавляют наночастицы магнетита в форме водного золя, содержащего дополнительно водорастворимое противоопухолевое средство.
6. Способ по п. 4 или 5, отличающийся тем, что водорастворимое противоопухолевое средство представляет собой рубомицина гидрохлорид.
7. Способ по п. 3, отличающийся тем, что противоопухолевое средство представляет собой противоопухолевое средство, не растворимое в воде.
8. Способ по п. 7, отличающийся тем, что для получения указанной суспензии фосфатидилхолин растворяют в органическом растворителе, в полученном растворе растворяют дополнительно противоопухолевое средство, не растворимое в воде, полученный раствор упаривают на роторном испарителе и к полученной пленке добавляют наночастицы магнетита в форме водного золя.
9. Способ по п. 7 или 8, отличающийся тем, что противоопухолевое средство, не растворимое в воде, представляет собой феофорбид А.
10. Способ по любому из пп. 1-9, отличающийся тем, что к наночастицам магнетита в форме водного золя добавляют дополнительно эффективное количество криопротектора.
11. Способ по п. 10, отличающийся тем, что в качестве криопротектора используют сахарозу.
12. Способ по любому из пп. 1-11, отличающийся тем, что к наночастицам магнетита в форме водного золя добавляют дополнительно эффективное количество антиоксиданта или консерванта.
| Javier Alonso et al., Superparamagnetic nanoparticles encapsulated in lipid vesicles for advanced magnetic hyperthermia and biodetection // JOURNAL OF APPLIED PHYSICS 119, 083904, 2016, II | |||
| MATERIALS AND METHODS | |||
| WO 1990004943 A, 17.05.1990 | |||
| KUZNETSOV A.A | |||
| et al., Application of magnetic liposomes for magnetically guided transport of muscle relaxants and anti-cancer photodynamic drugs // Journal of Magnetism and Magnetic Materials 225, 2001, р.р | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМ | 1999 |
|
RU2216315C2 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНИТОЧУВСТВИТЕЛЬНЫХ ЛИПОСОМ | 2007 |
|
RU2357724C1 |
| CN 103040756 B, 14.10.2015 | |||
| CN101590017 A, 02.12.2009. | |||
Авторы
Даты
2019-08-20—Публикация
2018-08-23—Подача