Изобретение относится к медицине и ветеринарии, молекулярно-биологическим исследованиям в области выявления ДНК (дезоксирибонуклеиновая кислота) микроорганизмов и может быть использовано для количественного анализа кокковой микрофлоры и определения дисбиотических состояний кожи и слизистых оболочек (прежде всего урогенитального тракта) человека или животных.
Своевременное определение состояния биоценоза определенной локализации, определение отношения нормальной микрофлоры к условно-патогенной позволят врачу правильно определиться с диагнозом и выбрать наиболее эффективный для лечения препарат.
Например, урогенитальные (мочеполовые) инфекции могут долгое время протекать без симптомов и обнаруживаться лишь при профилактических осмотрах. Но в то же время, они зачастую приводят к таким грозным осложнениям, как бесплодие, простатит, артрит, привычное невынашивание беременности и др. Поэтому важна их своевременная диагностика.
Урогенитальные инфекции могут быть вызваны разными микроорганизмами, среди которых есть патогенные (возбудители ИППП (инфекции, передающиеся половым путем)) и условно-патогенные. Патогенные микробы никогда не входят в состав нормальной микрофлоры человека, и при их обнаружении требуется лечение. Методы диагностики таких заболеваний достаточно хорошо разработаны и внедрены в клиническую практику. Условно-патогенные микроорганизмы встречаются и у здоровых людей, и только при наступлении каких-либо предрасполагающих факторов (ослабление иммунитета, сопутствующие заболевания, вирусная инфекция, повреждение кожи и слизистых оболочек, и др.) эти микроорганизмы приводят к развитию заболевания. К ним относятся: кокки, микоплазмы, гарднереллы, кандиды и др. Так, например, Staphylococcus aureus является возбудителем таких заболеваний кожи, как пиодермия, эксфолиативный дерматит (пузырчатка новорожденных), синдром ошпаренной кожи, везикулопустуллез, гидроаденит, абсцесс, панариции, фурункулы; Staphylococcus haemolyticus - различных воспалительных процессов кожи, слизистых и внутренних органов; Streptococcus agalactiae и Streptococcus pyogenes - стрептодермии, импетиго, эктимы; Enterococcus faecalis - воспалительных процессов слизистой мочеполовой систем женщин и мужчин.
Из-за присутствия условно-патогенных микроорганизмов у здоровых людей, простые методы диагностики (ИФА (иммуноферментный анализ), классическая ПЦР (полимеразная цепная реакция)) неинформативны. Для выявления дисбиотических нарушений требуется проведение количественного анализа, направленного на определение соотношения нормальной и условно-патогенной микрофлоры.
В настоящее время существуют наборы реагентов для исследования микрофлоры урогенитального тракта мужчин методом ПЦР в режиме реального времени «Андрофлор» и «Андрофлор Скрин» (ДНК-Технология, Москва, http://www.dna-technologv.ru/files/images/broshura/Androflor.pdf).
Недостатком данной тест-системы является обобщенный критерий «нормофлоры», состояние которой определяется как сумма Staphylococcus spp., Streptococcus spp., Corynebacterium spp.Хотя внутри этих групп существуют как представители нормальной микрофлоры урогенитального тракта, так и условнопатогенные виды, такие как Staphylococcus aureus, Staphylococcus haemolyticus, Streptococcus agalactiae, Streptococcus pyogenes.
Для оценки флоры урогенитального тракта у мужчин существует коммерческая система «Септоскрин» (Литех, г. Москва, http://www.lytech.ruA Главным недостатком для оценки биоценоза урогенитального тракта у мужчин этой системы являются отсутствие критерия «нормофлоры», т.е. того, что считать нормой; в ней выявляются только микроорганизмы, являющиеся возбудителями гнойно-септических заболеваний урогенитального тракта.
Критерий «нормальная микрофлора» - это сложная система, которая является больше индивидуальной величиной. Однако известно, что, например, негемолитические стафиликокки и стрептококки составляет большую часть нормальной микрофлоры слизистых оболочек (исключая влагалище и цервикальный канал у женщин, где рН≈5,0-5,5) и кожи человека (Методики клинических лабораторных исследований. Под ред. Меньшикова В.В., 2009). В то же время, Staphylococcus epidermidis, часто обнаруживают как ассоцианта негонококковых уретритов у мужчин (Орехов Д.П. и др. Идентификация условно-патогенной микрофлоры методом массспектрометрии (MALDI TOF MS) у пациентов с негонококковыми уретритами // Международный журнал прикладных и фундаментальных исследований. - 2014. - №. 5-1.). Таким образом очевидна необходимость комплексной количественной оценки выявляемых микроорганизмов и их «выравнивания» на эндогенный контроль исследуемого биоматериала.
Известен ряд способов определения дисбиотических состояний в различных средах организма бактериологическими методами (http://www.findpatent.ru/patent/261/2619834.html. http://www.findpatent.ru/patent/226/2260808.html. http://www.findpatent.ru/patent/206/2069001.html), комбинацией бактериологического и микроскопического методов (http://www.findpatent.ru/patent/229/2293986.html) иммунологическими методами (http://www.findpatent.ru/patent/233/2338197.htmn а также косвенными методами (http://www.findpatent.ru/patent/243/2433400.html, http://www.findpatent.ru/patent/232/2324191.html). Все перечисленные способы характеризуются трудоемкостью, длительностью лабораторного анализа, неоднозначными критериями «нормы» и «патологии» или не высокой диагностической ценностью.
Задачей предлагаемого решения является создание молекулярно-генетической панели для ускоренного высокоспецифичного выявления дисбиотических нарушений кожи и слизистых оболочек человека методом изотермальной ПЦР с использованием распространенного ПЦР-оборудования.
Поскольку первоочередная роль в биоценозе слизистых оболочек принадлежит кокковой микрофлоре (Методики клинических лабораторных исследований. Под ред. Меньшикова В.В., 2009. Орехов Д.П. и др. Идентификация условно-патогенной микрофлоры методом массспектрометрии (MALDI TOF MS) у пациентов с негонококковыми уретритами // Международный журнал прикладных и фундаментальных исследований. - 2014. - №. 5-1.), предлагаемое решение нацелено на определение количественного соотношения следующих микроорганизмов: Staphylococcus epidermidis, Staphylococcus aureus, Staphylococcus haemolyticus, Streptococcus agalactiae, Streptococcus pyogenes, Enteroococcus faecalis. Кроме того, данная группа микроорганизмов является превалирующей в патологическом материале, полученном из урогенитального тракта и других слизистых оболочек, а также кожи.
Поставленная задача решается за счет того, что:
• Определены оптимальные фрагменты генома каждого из микроорганизмов, а также ДНК человека, с позиции специфичности;
• Получены праймеры и зонды для этих фрагментов для LAMP.
• Создан способ расчета дисбиотических состояний по пороговому циклу LAMP.
При определении специфичных фрагментов геномов микроорганизмов используют ресурсы NCBI а также доступные для анализа отечественные и зарубежные публикации.
Анализируя литературу и сиквенсы геномов заявленных микроорганизмов и человека, выбраны следующие фрагменты, удовлетворяющие условиям специфичности для дальнейшего получения праймеров:
- Staphylococcus epidermidis - фрагмент гена atlE (автолизин и амидаза),
- Staphylococcus aureus - фрагмент гена nuc (termonuclease),
- Staphylococcus haemolyticus - фрагмент гена mvaA (acetyl-CoA C-acyltransferase),
- Streptococcus agalactiae - фрагмент гена glck (glucose kinase),
- Streptococcus pyogenes - фрагмент гена gcaD (N-acetylglucosamine-1 -phosphate uridyltransferase),
- Enterococcus faecalis - фрагмент гена chitinase,
- Homo sapiens - фрагмент гена COMT (Catechol-O-methyl transferase).
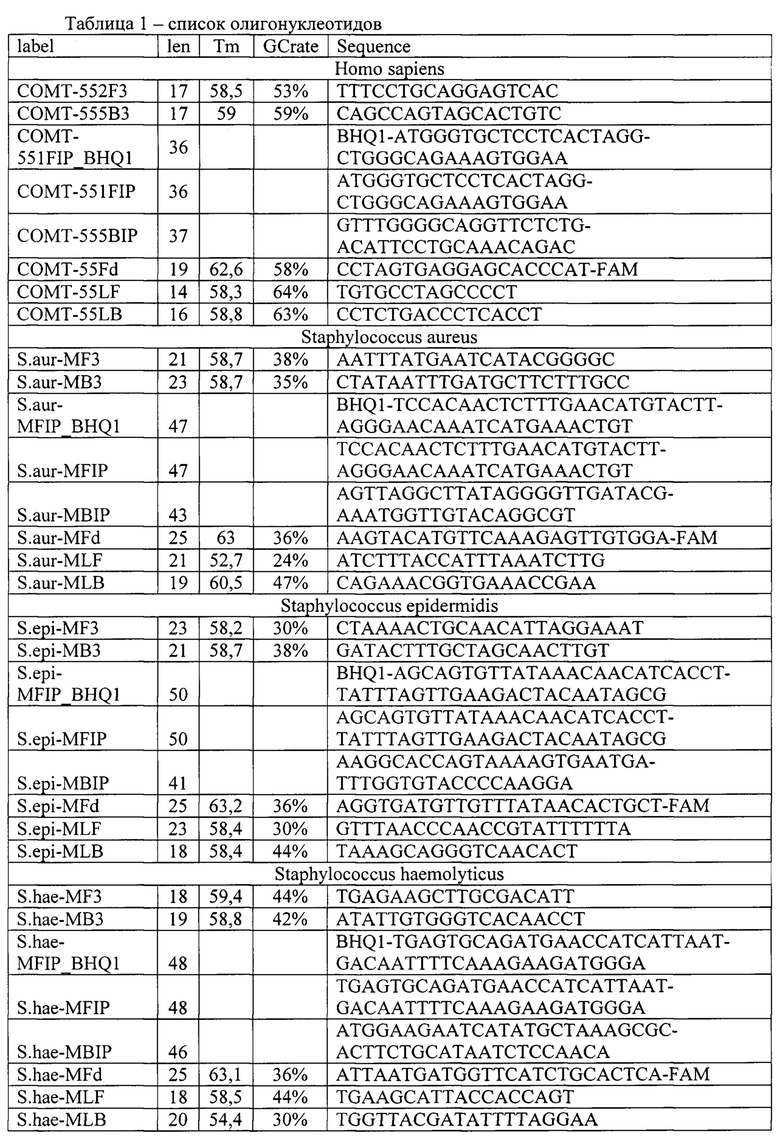
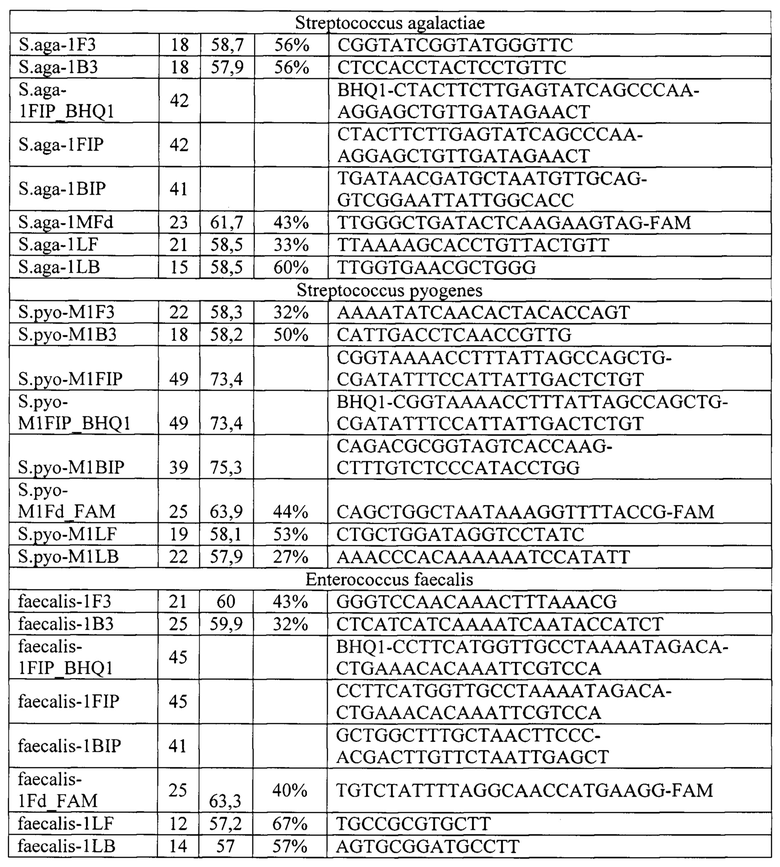
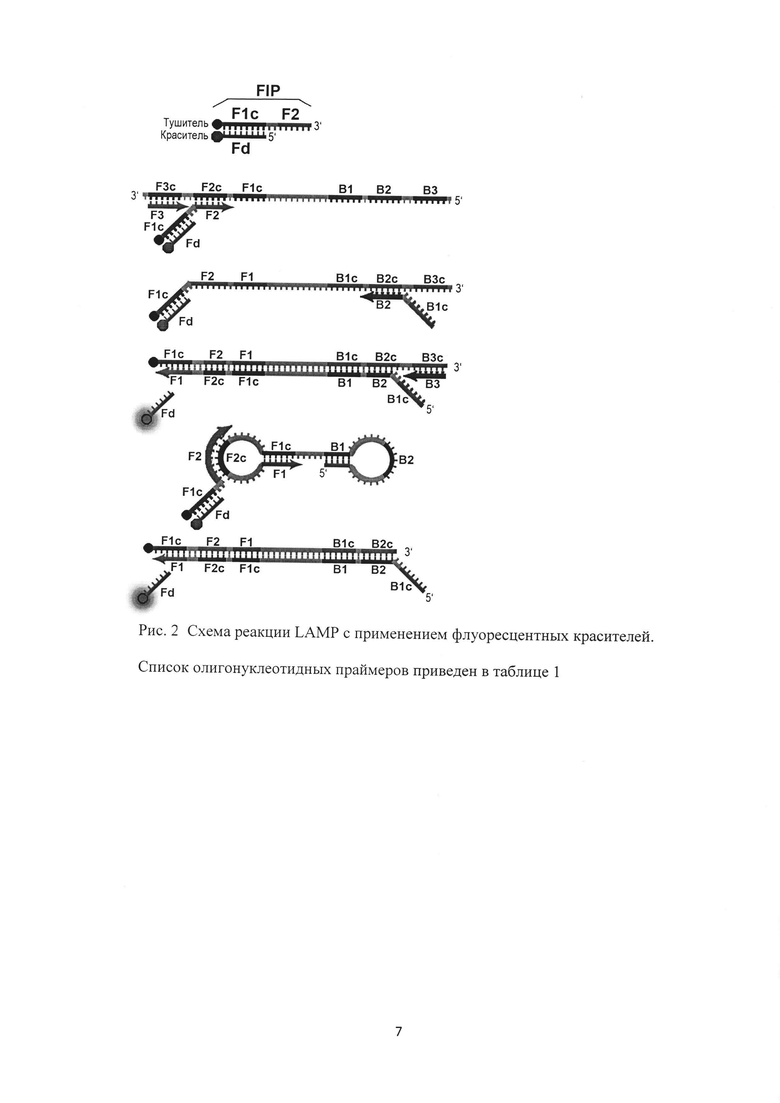
Получение праймеров и зондов, специфичных в отношении выбранных ДНК-мишеней микроорганизмов (Staphylococcus epidermidis, Staphylococcus aureus, Staphylococcus haemolyticus, Streptococcus agalactiae, Streptococcus pyogenes, Enteroococcus faecalis), а также «гена домашнего хозяйства» человека (в качестве эндогенного внутреннего контрольного образца и контроля взятия материала) для LAMP осуществляется с помощью программы автоматического подбора праймеров для LAMP PrimerExplorer V5. Петлевые праймеры LF и LB подбирают вручную, располагая их между участками, соответственно, F2 и F1c, В2 и В1с и напрявляя их 3'-концами к концам ампликона. Полученные олигонуклеотидные праймеры конструируют таким образом, чтобы быть нацеленными на шесть определенных регионов гена-мишени, которые обозначаются как F3c, F2c и F1c на 3'-конце и В1с, В2с и В3с на 5'-конце, первый внешний праймер F3 состоит из F3 региона, который комплементарен F3c фрагменту гена-мишени, второй внешний праймер В3 состоит из ВЗ региона, который комплементарен В3с участку гена-мишени, третий праймер - внутренний FIP содержит F2 фрагмент на 3'-конце, который комплементарен F2c, а также такую же последовательность, как и Flc регионом ДНК мишени на 5'-конце, четвертый праймер BIP также является внутренним и состоит из региона В2 на 3'-конце и такой же последовательности, как и В1 с регионом на 5'-конце и зонды, для количественного выявления кокковой микрофлоры используют метод LAMP (Loop mediated isothermal amplification - Петлевая изотермическая амплификация), основанный на автоматическом цикле синтеза ДНК цепи со смещением при использовании ДНК-полимераз с высокой активностью смещения и четырех или шести специально созданных праймеров.
Для обеспечения возможности проведения реакции с оптической детекцией в режиме реального времени гаситель флуоресцентного сигнала (BHQ1, BHQ2 или другой) помещают на 5'-конец праймера FIP. Сами флуоресцентные красители (FAM, HEX, VIC, ROX, Су5, Су5.5 или другой) помещают на 3'-конец олигонуклеотида Fd, комплементарного участку F1c олигонуклеотида FIP. Таким образом исходными продуктами для зондов были олигонуклеотид Fd с одной из флуоресцентных меток (FAM, HEX, VIC, ROX, Су5, Су5.5 или других) и внешний праймер FIP с модификацией гасителя флуоресценции (BHQ1, BHQ2 или других). Схема проведения реакции LAMP с возможностью детектирования флуоресцентного сигнала представлена на рис. 2.
Полученные описанным способом праймеры (олигонуклеотиды) для выявления и количественной оценки микроорганизмов Staphylococcus epidermidis, Staphylococcus aureus, Staphylococcus haemolyticus, Streptococcus agalactiae, Streptococcus pyogenes, Enteroococcus faecalis, а также мишени гена домашнего хозяйства человека в качестве внутреннего контрольного образца и контроля взятия материала, представлен в таб. 1.
Способ расчета дисбиотических состояний по пороговому циклу LAMP заключается в определении соотношений количества условно-патогенной микрофлоры к количеству нормальной микрофлоры и/или количества нормальной микрофлоры к количеству клеток человека (внутренний контрольный образец или контроль взятия материала) и количества условно-патогенной микрофлоры к количеству клеток человека (внутренний контрольный образец или контроль взятия материала). Соотношение может быть выражено как в относительных величинах или процентах, так и в абсолютных, т.е. количестве клеток, с использованием калибровочных образцов. Соотношение рассчитывается по формуле:
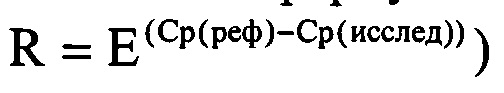
где:
R - соотношение,
Ср(реф) -пороговый цикл (Ср, Ct, Cq или другие) прохождения реакции по мишени, относительно которой рассчитывается соотношение,
Ср(исслед) -пороговый цикл (Ср, Ct, Cq или другие) прохождения реакции по мишени, соотношение которой определяется относительно мишени «реф».
Е - эффективность реакций.
В качестве нормальной микрофлоры приняты микроорганизмы:
- Staphylococcus epidermidis,
В качестве условно-патогенной микрофлоры приняты микроорганизмы:
- Staphylococcus aureus,
- Staphylococcus haemolyticus,
- Streptococcus agalactiae,
- Streptococcus pyogenes,
- Enterococcus faecalis.
Использование заявляемого решения позволяет достигать технический результат: создание молекулярно-генетической панели для ускоренного высокоспецифичного выявления дисбиотических нарушений кожи и слизистых оболочек человека методом изотермальной ПЦР с использованием распространенного ПЦР-оборудования.
Основными преимуществами предлагаемого способа являются:
• Использование доступного ПЦР-оборудования,
• Меньшие требования к аппаратному оснащению (т.к. не требуется точного термоциклирования), что позволит реализовать мобильную ПЦР-лабораторию,
• Мишенью являются представители нормальной и условно-патогенной микрофлоры, играющие первостепенную роль в формировании биоценоза,
• Время реакции до 90 мин,
• Высокая специфичность анализа за счет применения 4-6 праймеров, комплементарных ДНК-матрице,
• Меньшая чувствительность к загрязнениям,
• Универсальность исследуемых биоматериалов,
• Универсальная схема постановки реакции,
• Комплексность оценки этиологической роли выделяемых микроорганизмов,
• Стандартизация подхода к необходимости применения антибактериальных препаратов на основании выраженности дисбаланса микробного пейзажа,
• Наличие алгоритма интерпретации количественных результатов.
Технический результат достигнут за счет того, что способ количественного выявления кокковой микрофлоры включает в себя:
• Проведение выделения ДНК из биологического материала.
• Проведение анализа методом LAMP.
• Анализ результатов реакции.
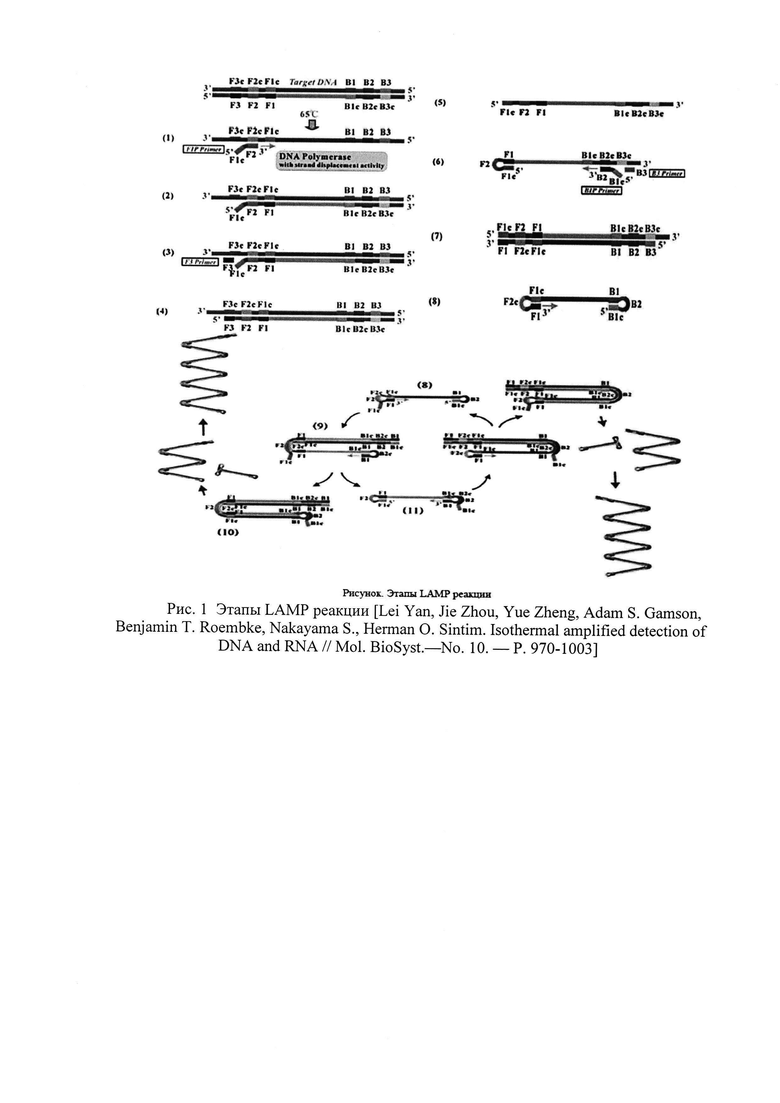
Метод LAMP основан на автоматическом цикле синтеза ДНК цепи со смещением при использовании ДНК-полимераз с высокой активностью смещения и четырех (шести) специально созданных праймеров. Четыре праймера сконструированы таким образом, чтобы быть нацеленными на шесть определенных регионов гена-мишени. Последние обозначаются как F3c, F2c и F1c на 3'-конце и В1с, В2с и В3с на 5'-конце. Различают внешние (Outer) и внутренние (Inner) праймеры. Первый внешний праймер F3 (Forward Outer Primer) состоит из F3 региона, который комплементарен F3c фрагменту гена-мишени. Второй внешний праймер В3 (Backward Outer Primer) состоит из В3 региона, который комплементарен В3с участку гена-мишени. Третий праймер - внутренний FIP (Forward Inner Primer) содержит F2 фрагмент на 3'-конце, который комплементарен F2c, а также такую же последовательность, как и Flc регион ДНК мишени на 5'-конце. Четвертый праймер BIP (Backward Inner Primer) также является внутренним и состоит из региона В2 на 3'-конце и такой же последовательности, как и В1 с регион на 5'-конце [15. Saharan P., Dhingolia S., Khatri P., Duhan J.S., Gahlavat S.K. Loop-mediated isothermal amplification (LAMP) based detection of bacteria: Review // African Journal of Biotechnology. - 2014. - 13. - P. 1920-1928].
Этапы LAMP показаны на рисунке 1. Реакция протекает в изотермических условиях, так как денатурация цепей происходит за счет их смещения. Сама реакция инициируется внутренними праймерами, содержащими смысловые и бессмысленные последовательности ДНК мишени. При рабочей температуре F2 регион внутреннего праймера FIP гибридизируется с мишенью, и цепь достраивается с помощью ДНК-полимеразы. Затем внешний праймер F3 присоединяется к F3c фрагменту мишени, и полимераза достраивает цепь, при этом смещая только что синтезированную последовательность. Смещенная цепь формирует петлеобразные структуры на 5'-конце, так как F1c участок гибридизируется с F1 регионом. На 3'-конце праймеры также гибридизируются с мишенью, и в итоге получается новая цепь с петлеобразными структурами на обоих концах. С такой, похожей на гантель ДНК начинается второй этап - цикл экспоненциальной амплификации. Цепи с несколькими инвертированными повторяющимися последовательностями ДНК мишени могут быть синтезированы благодаря повторениям процессов достраивания и смещения цепей [Lei Yan, Jie Zhou, Yue Zheng, Adam S. Gamson, Benjamin T. Roembke, Nakayama S., Herman O. Sintim. Isothermal amplified detection of DNA and RNA // Mol. BioSyst - No. 10. - P. 970-1003]. В целях осуществления детекции «в реальном времени» по оптическому каналу, в систему вводились следующие дополнения: модификация 5'-конца праймера FIP (BIP) гасителем флуоресценции (BHQ1/BHQ2) и использование дополнительного зонда Fd (Bd), комплементарного F1c (B1c) участку праймера FIP (BIP) с модификацией 3'-конца красителем флуоресценции (FAM/VIC/ROX/Cy5) [Tanner N. A., Zhang Y., Evans Jr Т. С.Simultaneous multiple target detection in real-time loop-mediated isothermal amplification // Biotechniques. - 2012. - V. 53. - №. 2. - P. 81-89]. Схема проведения реакции LAMP с возможностью детектирования флуоресцентного сигнала представлена на рис. 2.
Специфичность всех подобранных праймеров была подтверждена путем проверки в Nucleotide BLAST. Температура плавления, а также нежелательная комплементарность олигонуклеотидов друг к другу проверялась в OligoAnalyzer 3.1 (https://eu.idtdna.com/calc/analyzer).
| название | год | авторы | номер документа |
|---|---|---|---|
| Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации РНК коронавируса человека SARS-CoV-2 методом изотермической ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2021 |
|
RU2778855C1 |
| Способ выявления и оценки уровня патогенности возбудителей оппортунистических инфекций у женщин репродуктивного возраста и новорожденных детей для прогнозирования течения и развития осложнений инфекционных заболеваний | 2016 |
|
RU2638453C1 |
| Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов и способ выявления ДНК возбудителя бруцеллеза | 2022 |
|
RU2795987C1 |
| СПОСОБ ДИАГНОСТИКИ ДИСБИОТИЧЕСКИХ НАРУШЕНИЙ В БИОПТАТАХ СЛИЗИСТЫХ НОСА, ГЛОТКИ У ДЕТЕЙ РАННЕГО И ДОШКОЛЬНОГО ВОЗРАСТА С ПОСТОЯННО РЕЦИДИВИРУЮЩИМИ ОСТРЫМИ РЕСПИРАТОРНЫМИ ИНФЕКЦИЯМИ | 2013 |
|
RU2576839C2 |
| СПОСОБ ВЫЯВЛЕНИЯ STREPTOCOCCUS MUTANS МЕТОДОМ ИЗОТЕРМИЧЕСКОЙ ПЕТЛЕВОЙ АМПЛИФИКАЦИИ | 2022 |
|
RU2799413C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ГЕНОВ ТОКСИНОВ ПОСРЕДСТВОМ МУЛЬТИПЛЕКСНОЙ ПЦР С ПОСЛЕДУЮЩИМ СЕКВЕНИРОВАНИЕМ | 2019 |
|
RU2751591C2 |
| Набор реагентов для выявления Streptococcus mutans методом изотермической петлевой амплификации | 2022 |
|
RU2796603C1 |
| СПОСОБ ТАРГЕТНОЙ АМПЛИФИКАЦИИ ГЕНОМОВ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ ОРГАНОВ РЕПРОДУКЦИИ ЧЕЛОВЕКА С ЦЕЛЬЮ ОДНОВРЕМЕННОЙ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЕЙ С НАБОРОМ ПРАЙМЕРОВ | 2015 |
|
RU2625006C1 |
| Способ профилактики инфекций, связанных с оказанием медицинской помощи, у пациентов, находящихся в хроническом критическом состоянии | 2023 |
|
RU2818910C1 |
| НАБОР ПРАЙМЕРОВ ДЛЯ ВЫЯВЛЕНИЯ STREPTOCOCCUS MUTANS МЕТОДОМ ИЗОТЕРМИЧЕСКОЙ ПЕТЛЕВОЙ АМПЛИФИКАЦИИ | 2022 |
|
RU2799414C1 |
Изобретение относится к области биотехнологии. Для решения поставленной задачи определяют оптимальные фрагменты генома каждого из микроорганизмов, а также ДНК человека, с позиции специфичности: получают набор олигонуклеотидных праймеров и зондов для этих фрагментов для LAMP, сконструированных таким образом, чтобы быть нацеленными на шесть определенных регионов гена-мишени, которые обозначаются как F3c, F2c и F1 с на 3'-конце и В1с, В2с и В3с на 5'-конце, первый внешний праймер F3 состоит из F3 региона, который комплементарен F3c фрагменту гена-мишени, второй внешний праймер В3 состоит из В3 региона, который комплементарен В3с участку гена-мишени, третий праймер - внутренний FIP содержит F2 фрагмент на 3'-конце. который комплементарен F2c, а также такую же последовательность, как и F1c региона ДНК мишени на 5'-конце, четвертый праймер BIP также является внутренним и состоит из региона В2 на 3'-конце и такой же последовательности, как и В1с региона на 5'-конце, и зонды, для количественного выявления кокковой микрофлоры используют метод LAMP, основанный на автоматическом цикле синтеза ДНК цепи со смешением при использовании ДНК-полимераз с высокой активностью смещения и четырех или шести специально созданных праймеров; создают способ расчета дисбиотических состояний по пороговому циклу LAMP. Использование заявляемого решения позволяет достигать технический результат: создание молекулярно-генетической панели для ускоренного высокоспецифичного выявления дисбиотических нарушений кожи и слизистых оболочек человека методом изотермальной ПЦР с использованием распространенного ПЦР-оборудования. 2 ил., 1 табл.
1. Способ получения ДНК-праймеров и зондов для выявления дисбиотических состояний, в котором используют:
(а) для выявления дисбиотических состояний используют следующие микроорганизмы и ДНК-мешени, удовлетворяющие условиям специфичности, и наделяют их критериями нормы, условнопатогенной микрофлоры:
норма: Staphylococcus epidermidis - фрагмент гена atlE,
условно-патогенная микрофлора: Staphylococcus aureus - фрагмент гена termonuclease, Staphylococcus haemolyticus - фрагмент гена acetyl-CoA C-acyltransferase, Streptococcus agalactiae - фрагмент гена glucose kinase. Streptococcus pyogenes - фрагмент гена N-acetylglucosamine-1-phosphate uridyltransferase, Enterococcus faecalis - фрагмент гена chitinase,
экзогенный внутренний контроль или контроль взятия материала: Homo sapiens - фрагмент гена Catechol-O-methyl transferase,
(б) получение праймеров и зондов для LAMP осуществляется с помощью программы автоматического подбора праймеров для LAMP PrimerExplorer V5, петлевые праймеры LF и LB подбирают вручную, располагая их между участками, соответственно. F2 и F1c, В2 и В1с и напрявляя их 3'-концами к концам ампликона.
(в) для обеспечения возможности проведения LAMP с оптической детекцией в режиме реального времени гаситель флуоресцентного сигнала помещают на 5'-конец праймера FIP, флуоресцентные красители помещают на 3'-конец олигонуклеотида Fd, комплементарного участку F1c олигонуклеотида FIP.
2. Способ по п. 1, отличающийся тем. что полученные описанным способом олигонуклеотидные праймеры и зонды для выявления и количественной оценки микроорганизмов Staphylococcus epidermidis, Staphylococcus aureus, Staphylococcus haemolyticus, Streptococcus agalactiae, Streptococcus pyogenes, Enteroococcus faecalis, a также мишени гена домашнего хозяйства человека в качестве внутреннего контрольного образца и контроля взятия материала:
Homo sapiens:


В качестве красителей флуоресценции могут быть использованы: FAM, HEX, VIC, R6G, TAMRA ROX, Cy5, Cy5.5; в качестве гасителей флуоресценции - BHQ1, BHQ2, BHQ3.
3. Набор для выявления дисбиотических состояний в биологическом образце путем выявления и количественной оценки микроорганизмов Staphylococcus epidermidis, Staphylococcus aureus, Staphylococcus haemolyticus. Streptococcus agalactiae, Streptococcus pyogenes, Enteroococcus faecalis, а также мишени гена домашнего хозяйства человека в качестве внутреннего контрольного образца и контроля взятия материала, содержащий для каждого из указанных микроорганизмов олигонуклеотидные праймеры и зонды, полученные в соответствии со способом по п. 1.
4. Набор по п. 3 отличающийся тем, что он включает в себя 7 комбинаций олигонуклеотидных праймеров и зондов, по одной для каждого из перечисленных микроорганизмов и мишени гена домашнего хозяйства человека, приведенных в п. 2 и/или гомологичных им по меньшей мере на 95%.
5. Набор по п. 3 отличающийся тем, что основан на методе LAMP.
6. Способ выявления дисбиотических состояний в биологическом образце, отличающийся тем, что используют:
(а) исследуемый биологический образец,
(б) набор для проведения реакции LAMP,
(в) набор праймеров и зондов по п. 3.
характеризующийся тем, что он предусматривает следующие стадии:
• выделяют ДНК из образца (а).
• проводят реакции LAMP с использованием набора (б) и наборов праймеров и зондов (в),
• определяют количество продуктов LAMP посредством флуоресцентной спектрометрии в присутствии зондов (в).
7. Способ по п. 6 отличающийся тем, что в нем в качестве показателя количественного соотношения используют соотношение сигналов реакции по микроорганизмам, относящимся к нормальной микрофлоре, условно-патогенной микрофлоре и/или экзогенному внутреннему контролю или контролю взятия материала.
| СПОСОБ ДИАГНОСТИКИ СОСТОЯНИЯ ИММУННОЙ СИСТЕМЫ ПАЦИЕНТА И НАБОР ПРАЙМЕРОВ, ЗОНДОВ И СТАНДАРТНЫХ ОБРАЗЦОВ ДЛЯ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ ДНК МОЛЕКУЛ TREC, KREC И КОЛИЧЕСТВА ГЕНОМ ЭКВИВАЛЕНТОВ ДНК | 2015 |
|
RU2587540C1 |
| КАРДЫМОН О.Л., и др., Молекулярно-генетические методы для исследования микробиома кишечника, Российский журнал гастроэнтерологии гепатологии колопроктологии, 26 (4), 2016, с.4-13 | |||
| ЕВСТИГНЕЕВА Н.П., и др., Идентификация условно-патогенной микрофлоры методом времяпролетной масс-спектрометрии (MALDI TOF MS) у пациентов с негонококковыми уретритами, международный журнал прикладных и фундаментальных исследований, N 5, 2014, с.48-53. | |||
Авторы
Даты
2019-09-03—Публикация
2018-05-07—Подача