Предпосылки создания изобретения
Возбудимость головного мозга определяется как уровень возбуждения животного, состояние в диапазоне от комы до судорог, и регулируется различными нейромедиаторами. В общем случае нейромедиаторы ответственны за регуляцию проводимости ионов через мембраны нейронов. В состоянии покоя мембрана нейрона обладает потенциалом (или мембранным напряжением) приблизительно -70 мВ, при этом внутренняя часть клетки является отрицательно заряженной по сравнению с наружной частью клетки. Потенциал (напряжение) является результатом равновесия ионов (K+, Na+, Cl-, органические ионы) в полупроницаемой мембране нейрона. Нейромедиаторы находятся в пресинаптических пузырьках и высвобождаются под влиянием потенциала действия нейрона. При выходе в синаптическое углубление химический медиатор раздражения, такой как ацетилхолин, будет вызывать деполяризацию мембраны (изменение потенциала от -70 мВ до -50 мВ). Этот эффект передается постсинаптическими никотиновыми рецепторами, которые стимулируются ацетилхолином с целью повышения проницаемости мембраны в отношении ионов Na+. Пониженный мембранный потенциал стимулирует нейронное возбуждение в форме потенциала постсинаптического действия.
В случае комплекса рецептора ГАМК (GRC) эффект возбудимости головного мозга переносится нейромедиатором ГАМК. ГАМК имеет сильное влияние на общую возбудимость головного мозга, потому что до 40% нейронов головного мозга используют ГАМК как нейромедиатор. ГАМК регулирует возбудимость отдельных нейронов посредством регулирования проводимости ионов хлора через мембрану нейронов. ГАМК взаимодействует со своим сайтом распознавания на GRC для усиления потока ионов хлора по направлению электрохимического градиента GRC в клетку. Повышение уровня содержания этого аниона внутри клетки вызывает гиперполяризацию трансмембранного потенциала, делая нейрон менее чувствительным к возбуждающим сигналам (например, пониженная возбудимость нейронов). Другими словами, чем выше концентрация иона хлора в нейроне, тем ниже возбудимость головного мозга (уровень возбуждения).
Хорошо известно, что GRC отвечает за проявление состояния тревоги, припадочной активности и седативного эффекта. Таким образом, ГАМК и лекарственные средства, которые действуют как ГАМК или способствуют действию ГАМК (например, терапевтически используемые барбитураты и бензодиазепины (BZ), такие как валиум) оказывают свое терапевтическое действие при взаимодействии со специфическими регуляторными сайтами на GRC. Накопленные доказательства теперь указывают, что кроме участка связывания бензодиазепина и барбитурата GRC содержит отдельный участок для нейроактивных стероидов (Lan N.C. et al., Neurochem. Res. 16:347-356 (1991)).
Нейроактивные стероиды могут быть эндогенными стероидами. Наиболее активными эндогенными нейроактивными стероидами являются 3α-гидрокси-5-восстановленный прегнан-20-он и 3α-21-дигидрокси-5-восстановленный прегнан-20-он, метаболиты гормональных стероидов прогестерона и дезоксикортикостерона, соответственно. Способность этих стероидных метаболитов изменять возбудимость головного мозга обнаружена в 1986 г. (Majewska, M. D. et al., Science 232:1004-1007 (1986); Harrison, N. L. et al., J Pharmacol. Exp. Ther. 241:346-353 (1987)).
Было продемонстрировано, что гормон яичников прогестерон и его метаболиты обладают сильным действием на возбудимость головного мозга (Backstrom, T. et al., Acta Obstet. Gynecol. Scand. Suppl. 130:19-24 (1985); Pfaff, D.W and McEwen, B. S., Science 219:808-814 (1983); Gyermek et al., J Med Chem. 11: 117 (1968); Lambert, J. et al., Trends Pharmacol. Sci. 8:224-227 (1987)). Уровни прогестерона и его метаболитов изменяются в зависимости от фазы менструального цикла. Было широко описано, что содержание прогестерона и его метаболитов снижается перед началом менструации. Ежемесячное повторение определенных физических симптомов перед началом менструации также было описано. Эти симптомы, которые стали ассоциироваться с предменструальным синдромом (PMS), включают стресс, состояние тревоги и мигрени (Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Пациенты с PMS имеют ежемесячный рецидив симптомов, которые наблюдаются перед менструацией и отсутствуют после менструации.
Подобным образом снижение прогестерона также временно коррелирует с увеличением частоты припадков у женщин-эпилептиков, т.е. менструальной эпилепсией (Laidlaw, J., Lancet, 1235-1237 (1956)). Более прямая корреляция была отмечена в отношении снижения метаболитов прогестерона (Rosciszewska et al., J. Neurol. Neurosurg. Psych. 49:47-51 (1986)). Кроме того, у пациентов с первичной генерализованной малой эпилепсией время припадков коррелировало с возникновением симптомов предменструального синдрома (Backstrom, T. et al., J. Psychosom. Obstet. Gynaecol. 2:8-20 (1983)). Было обнаружено, что стероид дезоксикортикостерон эффективен при лечении пациентов с эпилептическими приступами, коррелирующими с их менструальными циклами (Aird, R.B. and Gordan, G., J. Amer. Med. Soc. 145:715-719 (1951)).
Синдромом, также связанным с низкими уровнями прогестерона, является послеродовая депрессия (PND). Сразу после родов уровни прогестерона резко падают, приводя к началу PND. Симптомы PND варьируют от мягкой депрессии до психоза, требующего госпитализации. PND также ассоциируется с состоянием острой тревоги и раздражительностью. PND-ассоциированная депрессия не поддается лечению классическими антидепрессантами, а у женщин с PND повышена частота возникновения PMS (Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)).
Вместе взятые, эти наблюдения подразумевают существенную роль прогестерона и дезоксикортикостерона и, более специфически, их метаболитов в гомеостатической регуляции возбудимости головного мозга, которая проявляется как усиление эпилептической активности или симптомов, связанных с менструальной эпилепсией, PMS и PND. Корреляция между пониженными уровнями прогестерона и симптомами, связанными с PMS, PND и менструальной эпилепсией (Backstrom, T. et al., J Psychosom.Obstet. Gynaecol. 2:8-20 (1983)); Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)), подсказала применение прогестерона в их лечении treatment (Mattson et al., “Medroxyprogesterone therapy of catamenial epilepsy,” in Advances in Epileptology: XVth Epilepsy International Symposium, Raven Press, New York (1984), pp. 279-282, and Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Однако прогестерон не является постоянно эффективным при лечении вышеупомянутых синдромов. Например, не существует связи доза-ответ для прогестерона при лечении PMS (Maddocks et al., Obstet. Gynecol. 154:573-581 (1986); Dennerstein et al., Brit. Med J 290:16-17 (1986)).
Необходимы новые и улучшенные нейроактивные стероиды, которые действуют в качестве агентов для модуляции возбудимости головного мозга, а также в качестве средств для профилактики и лечения заболеваний, связанных с центральной нервной системой. Соединения, композиции и способы, описанные в настоящем документе, направлены к этой цели.
Сущность изобретения
Настоящее изобретение основано, частично, на желании обеспечить новыми 19-нор соединениями (т.е. C19 десметил), например, относящимися к прогестерону, дезоксикортикостерону и их метаболитам, с хорошей эффективностью, фармакокинетическими свойствами (PK), биодоступностью при пероральном введении, способностью к формулированию, стабильностью, безопасностью, выведением и/или метаболизмом. Одним из основных свойств соединений, как описано в настоящем документе, является дизамещение в положении С3 (например, одним заместителем, представляющим собой 3α гидроксигруппу). Заявители настоящего изобретения предполагают, что дизамещение в положении С-3 исключит возможность окисления гидроксигруппы до кетона, предотвратит дальнейший метаболизм и уменьшит возможность для вторичных путей выведения, таких как глюкуронирование. Также авторы настоящего изобретения предполагают, что общий эффект C3 дизамещения должен быть в улучшении общих параметров PK и снижения потенциальных токсичностей и побочных эффектов, которые могут быть, в некоторых вариантах осуществления, при введении перорально и/или при длительном введении. Еще одной ключевой особенностью соединений, описанных в настоящем документе, является присутствие водорода в положении C19 ("19-нор"), а не метильной группы. Авторы настоящего изобретения предполагают, что 19-нор соединения по сравнению с их аналогами C19-метил, будут иметь улучшенные физические свойства, такие как улучшенная растворимость. Авторы настоящего изобретения предполагают, более того, повышение растворимости, например, когда кольцевая система АВ находится в цис-конфигурации.
Таким образом, в одном из аспектов изобретение относится к соединению формулы (I):

и его фармацевтически приемлемой соли;
где:
 представляет собой одинарную или двойную связь;
представляет собой одинарную или двойную связь;
R1 представляет собой замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил;
R2 представляет собой водород, галоген, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил или -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил;
R3a представляет собой водород или -ORA3, где RA3 представляет собой водород, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил, и R3b представляет собой водород; или R3a и R3b объединены с образованием оксо (=O)группы;
в каждом случае R4a и R4b независимо представляет собой водород, замещенный или незамещенный C1-6 алкил или галоген;
при условии, если связь р представляет собой двойную связь, то связь q представляет собой одинарную связь, при условии, если связь q представляет собой двойную связь, то связь р представляет собой одинарную связь и R4b отсутствует; и при условии, если обе связи р и q являются одинарными связями, то водород в С5 находится в альфа- или бета- конфигурации.
A имеет формулу (A-1) или формулу (A-2):
 (A-1), или
(A-1), или 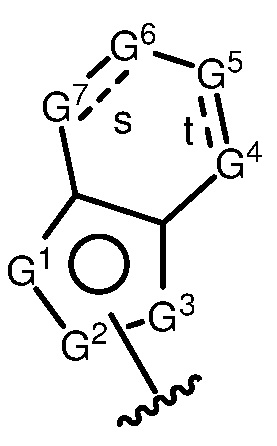 (A-2), где точка присоединения находится в G1 или G2 в формуле (A-1) и точка присоединения находится в G2 или G3 в формуле (A-2)
(A-2), где точка присоединения находится в G1 или G2 в формуле (A-1) и точка присоединения находится в G2 или G3 в формуле (A-2)
G1 представляет собой N, NRN1, O, S, C или C-RG1, как позволяет валентность;
G2 представляет собой N, NRN2, O, S, C, -C=N- или C-RG2, как позволяет валентность;
G3 представляет собой N, NRN3, O, S, C или C-RG3, как позволяет валентность;
G4 представляет собой N, NRN4, C-RG4 или C-(RG4)2, как позволяет валентность;
G5 представляет собой N, NRN5, C-RG5 или C-(RG5)2, как позволяет валентность;
G6 представляет собой N, NRN6, C-RG6 или C-(RG6)2, как позволяет валентность; и
G7 представляет собой N, NRN7, C-RG7 или C-(RG7)2, как позволяет валентность;
в каждом случае RG1, RG2, RG3, RG4, RG5, RG6, и RG7 независимо представляет собой водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6- членный гетероциклил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
в каждом случае RN1, RN2, RN3, RN4, RN5, RN6 и RN7 независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, или азотную защитную группу; и
в каждом случае RGA независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, кислород-защитную группу, если присоединен к кислороду, азот-защитную группу, если присоединен к азоту, или две RGA группы взяты с промежуточными атомами с образованием замещенного или незамещенного карбоциклического или гетероциклического кольца.
В некоторых вариантах осуществления G4 представляет собой N или NRN4, и/или G5 представляет собой N или NRN5, и/или G6 представляет собой N или NRN6, и/или G7 представляет собой N или NRN7.
Соединения формулы (I), их подвиды и их фармацевтически приемлемые соли, все вместе называемые в настоящем описании “соединения по настоящему изобретению”.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый наполнитель. В некоторых вариантах осуществления соединение по настоящему изобретению представлено в эффективном количестве в фармацевтической композиции. В некоторых вариантах осуществления соединение по настоящему изобретению представлено в терапевтически эффективном количестве. В некоторых вариантах осуществления соединение по настоящему изобретению представлено в профилактически эффективном количестве.
Соединения по настоящему изобретению, как описано в настоящем документе, действуют, в некоторых вариантах осуществления, как ГАМК модуляторы, например, воздействуя на ГАМКА рецептор либо положительным либо отрицательном образом. В качестве модуляторов возбудимости центральной нервной системы (ЦНС), что опосредованно их способностью модулировать ГАМКА рецептор, такие соединения должны обладать ЦНС-активностью.
Таким образом, в другом аспекте, представлены способы лечения нарушений, связанных с ЦНС, у индивида, нуждающегося в этом, включающие введение индивиду эффективного количества соединения по настоящему изобретению. В некоторых вариантах осуществления нарушения, связанные с ЦНС, выбраны из группы, состоящей из нарушения сна, нарушения настроения, расстройства шизофренического спектра, судорожного расстройства, нарушения памяти и/или когнитивной способности, нарушения движения, расстройства личности, аутизма, боли, черепно-мозговой травмы, сосудистого заболевания, расстройства злоупотребления психоактивными веществами и/или абстинентный синдром, и шум в ушах. В некоторых вариантах осуществления соединение вводят перорально, подкожно, внутривенно или внутримышечно. В некоторых вариантах осуществления соединение вводят длительное время.
Другие цели и преимущества станут очевидными специалистам в данной области при рассмотрении следующего подробного описания, примеров и формулы изобретения.
Определения
Химические определения
Ниже более подробно приведены определения конкретных функциональных групп и химических терминов. Химические элементы обозначены в соответствии с Периодической таблицей элементов версии CAS, Handbook of Chemistry and Physics, 75th Ed., которая приведена на внутренней стороне обложки, а определение конкретных функциональных групп в общем виде приведено в настоящем описании. Кроме того, общие принципы органической химии, а также конкретные функциональные фрагменты и их реакционная способность описаны Thomas Sorrell, Organic Chemistry, University Science Books, Sausalito, 1999; Smith and March, March’s Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; and Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
Соединения, описанные в настоящем документе, могут содержать один или несколько асимметрических центров, и, таким образом, могут существовать в различных изомерных формах, например в виде стереоизомеров и/или диастереомеров. Например, соединения, описанные в настоящем документе, могут быть в форме индивидуального энантиомера, диастереомера или геометрического изомера, или могут представлять собой смесь стереоизомеров, включая рацемические смеси и смеси, обогащенные одним или более стереоизомером. Изомеры можно выделить из смеси с помощью методов, известных специалистам в данной области, включая хиральную высокоэффективную жидкостную хроматографию (ВЭЖХ) и получение и кристаллизацию хиральных солей, или же могут быть получены с использованием методов асимметрического синтеза. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972). Кроме того, настоящее изобретение охватывает соединения, описанные в настоящем документе, как индивидуальные изомеры, по существу свободные от других изомеров, и альтернативно, как смеси различных изомеров.
Когда указан диапазон значений, предполагается, что он охватывает каждое значение и поддиапазон в пределах указанного диапазона. Например “C1-6 алкил” охватывает C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5, и C5-6 алкил.
Предполагается, что приведенные далее термины имеют значения, представленные с ними ниже и полезные для понимания описания и предлагаемой области настоящего изобретения. При описании изобретения, которое может включать соединения, фармацевтические композиции, содержащие такие соединения, и способы применения таких соединений и композиций, следующие термины, если присутствуют, имеют следующие значения, если не указано иначе. Также надо понимать, что при описании любых определенных в настоящем описании далее фрагментов они могут быть замещенными разнообразными заместителями, и предполагается, что соответствующие определения включают такие замещенные фрагменты в свою область, как показано ниже. Если не указано иное, термин "замещенный" следует определять, как указано ниже. Следует также понимать, что используемые в настоящем описании термины "группы" и "радикалы" можно считать взаимозаменяемыми. Формы единственного числа могут использоваться в настоящем описании для означения одного или более одного (т.е., по меньшей мере одного) объектов. Например, "аналог" означает один аналог или более одного аналога.
“Алкил” относится к радикалу насыщенной углеводородной группы с прямой или разветвленной цепью, содержащей от 1 до 20 атомов углерода (“C1-20 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 12 атомов углерода (“C1-12 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 10 атомов углерода (“C1-10 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 9 атомов углерода (“C1-9 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 8 атомов углерода (“C1-8 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 7 атомов углерода (“C1-7 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 6 атомов углерода (“C1-6 алкил”, также упоминается в настоящем документе как “низший алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 5 атомов углерода (“C1-5 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 4 атомов углерода (“C1-4 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 3 атомов углерода (“C1-3 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 1 до 2 атомов углерода (“C1-2 алкил”). В некоторых вариантах осуществления алкильная группа имеет 1 атом углерода (“C1 алкил”). В некоторых вариантах осуществления алкильная группа имеет от 2 до 6 атомов углерода (“C2-6 алкил”). Примеры C1-6 алкильных групп включают метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) и н-гексил (C6). Дополнительные примеры алкильных групп включают н-гептил (C7), н-октил (C8) и тому подобное. Если не указано иное, в каждом случае алкильная группа независимо является необязательно замещенной, т.е. незамещенной ("незамещенный алкил") или замещенной ("замещенный алкил") одним или несколькими заместителями, например, например, от 1 до 5 заместителей, от 1 до 3 заместителей, или 1 заместителем. В некоторых вариантах осуществления алкильная группа представляет собой незамещенный C1-10 алкил (например, CH3). В некоторых вариантах осуществления алкильная группа представляет собой замещенный C1-10 алкил. Общепринятые алкильные аббревиатуры Me (-CH3), Et (-CH2CH3), iPr (-CH(CH3)2), nPr (-CH2CH2CH3), n-Bu (-CH2CH2CH2CH3) или i-Bu (-CH2CH(CH3)2).
Как используется в настоящем описании “алкилен”, “алкенилен” и “алкинилен” относятся к двухвалентному радикалу алкильной, алкенильной и алкинильной группы, соответственно. Когда диапазон или число атомов углерода используется для конкретной "алкилен", "алкенилен" и "алкинилен" группы, следует понимать, что диапазон или число относится к диапазону или числу атомов углерода в линейном двухвалентном углероде. "Алкилен", "алкенилен" и "алкиниленовые" группы могут быть замещенными или незамещенными одним или несколькими заместителями, как описано в настоящем документе.
"Алкилен" относится к алкильной группе, в которой два атома водорода удалены с получением двухвалентного радикала, и которая может быть замещенной или незамещенной. Незамещенные алкиленовые группы включают, но ими не ограничиваются, метилен (-CH2-), этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), бутилен (-CH2CH2CH2CH2-), пентилен (-CH2CH2CH2CH2CH2-), гексилен (-CH2CH2CH2CH2CH2CH2-) и тому подобное. Типичные замещенные алкиленовые группы, например, замещенные одной или несколькими алкильными (метильными) группами, включают, но ими не ограничиваются, замещенный метилен (-CH(CH3)-, (-C(CH3)2-), замещенный этилен (-CH(CH3)CH2-,-CH2CH(CH3)-, -C(CH3)2CH2-,-CH2C(CH3)2-), замещенный пропилен (-CH(CH3)CH2CH2-, -CH2CH(CH3)CH2-, -CH2CH2CH(CH3)-, -C(CH3)2CH2CH2-, -CH2C(CH3)2CH2-, -CH2CH2C(CH3)2-) и тому подобное.
“Алкенил” относится к радикалу углеводородной группы с прямой или разветвленной цепью, содержащей от 2 до 20 атомов углерода и одну или несколько углерод-углеродных двойных связей (например, 1, 2, 3 или 4 углерод-углеродных двойных связей), и необязательно одну или несколько углерод-углеродных тройных связей (например, 1, 2, 3 или 4 углерод-углеродных тройных связей) (“C2-20 алкенил”). В некоторых вариантах осуществления, алкенил не содержит тройных связей. В некоторых вариантах осуществления алкенильная группа имеет от 2 до 10 атомов углерода (“C2-10 алкенил”). В некоторых вариантах осуществления алкенильная группа имеет от 2 до 9 атомов углерода (“C2-9 алкенил”). В некоторых вариантах осуществления алкенильная группа имеет от 2 до 8 атомов углерода (“C2-8 алкенил”). В некоторых вариантах осуществления алкенильная группа имеет от 2 до 7 атомов углерода (“C2-7 алкенил”). В некоторых вариантах осуществления алкенильная группа имеет от 2 до 6 атомов углерода (“C2-6 алкенил”). В некоторых вариантах осуществления алкенильная группа имеет от 2 до 5 атомов углерода (“C2-5 алкенил”). В некоторых вариантах осуществления алкенильная группа имеет от 2 до 4 атомов углерода (“C2-4 алкенил”). В некоторых вариантах осуществления алкенильная группа имеет от 2 до 3 атомов углерода (“C2-3 алкенил”). В некоторых вариантах осуществления алкенильная группа имеет 2 атома углерода (“C2 алкенил”). Одна или несколько углерод-углеродных двойных связей могут быть внутренними (такими как в 2-бутениле) или концевыми (такими как в 1-бутениле). Примеры C2-4 алкенильных групп включают этенил (C2), 1-пропенил (C3), 2-пропенил (C3), 1-бутенил (C4), 2-бутенил (C4), бутадиенил (C4), и тому подобное. Примеры C2-6 алкенильных групп включают вышеупомянутые C2-4 алкенильные группы, а также пентенил (C5), пентадиенил (C5), гексенил (C6), и тому подобное. Дополнительные примеры алкенила включают гептенил (C7), октенил (C8), октатриенил (C8), и тому подобное. Если не указано иное, в каждом случае алкенильная группа независимо является необязательно замещенной, т.е. незамещенной ("незамещенный алкенил") или замещенной ("замещенный алкенил") одним или несколькими заместителями например, например, от 1 до 5 заместителей, от 1 до 3 заместителей, или 1 заместителем. В некоторых вариантах осуществления алкенильная группа представляет собой незамещенный C2-10 алкенил. В некоторых вариантах осуществления алкенильная группа представляет собой замещенный C2-10 алкенил.
"Алкенилен" относится к алкенильной группе, где два атома водорода удалены с получением двухвалентного радикала, и которые могут быть замещенными или незамещенными. Примеры незамещенных двухвалентных алкениленовых групп включают, но ими не ограничиваются, этенилен (-CH=CH-) и пропенилен (например, -CH=CHCH2-, -CH2-CH=CH-). Типичные замещенные алкениленовые группы, например, замещенные одним или несколькими алкильными (метил) групп, включают, но ими не ограничиваются, замещенный этилен (-C(CH3)=CH-, -CH=C(CH3)-), замещенный пропилен (например, -C(CH3)=CHCH2-, -CH=C(CH3)CH2-, -CH=CHCH(CH3)-, -CH=CHC(CH3)2-, -CH(CH3)-CH=CH-,-C(CH3)2-CH=CH-, -CH2-C(CH3)=CH-, -CH2-CH=C(CH3)-), и тому подобное.
“Алкинил” относится к радикалу углеводородной группы с прямой или разветвленной цепью, содержащей от 2 до 20 атомов углерода и одну или несколько углерод-углеродных тройных связей (например, 1, 2, 3 или 4 углерод-углеродных тройных связей), и необязательно одну или несколько углерод-углеродных двойных связей (например, 1, 2, 3 или 4 углерод-углеродных двойных связей) (“C2-20 алкинил”). В некоторых вариантах осуществления алкинил не содержит двойных связей. В некоторых вариантах осуществления алкинильная группа имеет от 2 до 10 атомов углерода (“C2-10 алкинил”). В некоторых вариантах осуществления алкинильная группа имеет от 2 до 9 атомов углерода (“C2-9 алкинил”). В некоторых вариантах осуществления алкинильная группа имеет от 2 до 8 атомов углерода (“C2-8 алкинил”). В некоторых вариантах осуществления алкинильная группа имеет от 2 до 7 атомов углерода (“C2-7 алкинил”). В некоторых вариантах осуществления алкинильная группа имеет от 2 до 6 атомов углерода (“C2-6 алкинил”). В некоторых вариантах осуществления алкинильная группа имеет от 2 до 5 атомов углерода (“C2-5 алкинил”). В некоторых вариантах осуществления алкинильная группа имеет от 2 до 4 атомов углерода (“C2-4 алкинил”). В некоторых вариантах осуществления алкинильная группа имеет от 2 до 3 атомов углерода (“C2-3 алкинил”). В некоторых вариантах осуществления алкинильная группа имеет 2 атома углерода (“C2 алкинил”). Одна или несколько углерод-углеродных тройных связей могут быть внутренними (такими как в 2-бутиниле) или концевыми (такими как в 1-бутиниле). Примеры C2-4 алкинильных групп включают, без ограничения, этинил (C2), 1-пропинил (C3), 2-пропинил (C3), 1-бутинил (C4), 2-бутинил (C4) и тому подобное. Примеры C2-6 алкенильных групп включают указанные выше C2-4 алкинильные группы, а также пентинил (C5), гексинил (C6) и подобные. Дополнительные примеры алкинила включают гептинил (C7), октинил (C8) и подобные. Если не указано иное, в каждом случае алкинильная группа независимо является необязательно замещенной, т.е. незамещенной ("незамещенный алкинил") или замещенной ("замещенный алкинил") одним или несколькими заместителями например, например, от 1 до 5 заместителей, от 1 до 3 заместителей, или 1 заместителем. В некоторых вариантах осуществления алкинильная группа представляет собой незамещенный C2-10 алкинил. В некоторых вариантах осуществления алкинильная группа представляет собой замещенный C2-10 алкинил.
"Алкинилен" ” относится к линейной алкинильной группе, где два атома водорода удалены с получением двухвалентного радикала, и которые могут быть замещенными или незамещенными. Примерные двухвалентные алкиниленовые группы включают, но ими не ограничиваются, замещенный или незамещенный этинилен, замещенный или незамещенный пропинилен, и тому подобное.
Термин “гетероалкил”, как используется в настоящем описании, относится к алкильной группе, как определено в настоящем описании, которая дополнительно содержит 1 или несколько (например, 1, 2, 3 или 4) гетероатомов (например, кислород, сера, азот, бор, кремний, фосфор) в исходной цепи, где один или несколько гетероатомов встроены между соседними атомами углерода в исходной углеродной цепи, и/или один или несколько гетероатомов встроены между атомом углерода и родительской молекулой, т.е. между точкой присоединения. В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 до 10 атомов углерода и 1, 2, 3 или 4 гетероатомов (“гетероC1-10 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 до 9 атомов углерода и 1, 2, 3 или 4 гетероатомов (“гетероC1-9 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 до 8 атомов углерода и 1, 2, 3 или 4 гетероатомов (“гетероC1-8 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 до 7 атомов углерода и 1, 2, 3 или 4 гетероатомов (“гетероC1-7 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 до 6 атомов углерода и 1, 2 или 3 гетероатомов (“гетероC1-6 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 до 5 атомов углерода и 1 или 2 гетероатома (“гетероC1-5 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 до 4 атомов углерода и 1 или 2 гетероатома (“гетероC1-4 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 до 3 атомов углерода и 1 гетероатом (“гетероC1-3 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 до 2 атомов углерода и 1 гетероатом (“гетероC1-2 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 1 атом углерода и 1 гетероатом (“гетероC1 алкил”). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, имеющую от 2 до 6 атомов углерода и 1 или 2 гетероатома (“гетероC2-6 алкил”). Если не указано иное, в каждом случае гетероалкильная группа является независимо незамещенной ("незамещенный гетероалкил") или замещенной ("замещенный гетероалкил") одним или несколькими заместителями. В некоторых вариантах осуществления гетероалкильная группа представляет собой незамещенный гетероC1-10 алкил. В некоторых вариантах осуществления гетероалкильная группа представляет собой замещенный гетероC1-10 алкил.
Термин “гетероалкенил”, как используется в настоящем описании, относится к алкенильной группе, как определено в настоящем описании, которая дополнительно содержит один или несколько (например, 1, 2, 3 или 4) гетероатомов (например, кислород, сера, азот, бор, кремний, фосфор), где один или несколько гетероатомов встроены между соседними атомами углерода в исходной углеродной цепи и/или один или несколько гетероатомов встроены между атомом углерода и родительской молекулой, т.е. между точкой присоединения. В некоторых вариантах осуществления гетероалкенильная группа относится к группе, имеющей от 2 до 10 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома (“гетероC2-10 алкенил”). В некоторых вариантах осуществления гетероалкенильная группа имеет от 2 до 9 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома (“гетероC2-9 алкенил”). В некоторых вариантах осуществления гетероалкенильная группа имеет от 2 до 8 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома (“гетероC2-8 алкенил”). В некоторых вариантах осуществления гетероалкенильная группа имеет от 2 до 7 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома (“гетероC2-7 алкенил”). В некоторых вариантах осуществления гетероалкенильная группа имеет от 2 до 6 атомов углерода, по меньшей мере одну двойную связь и 1, 2 или 3 гетероатома (“гетероC2-6 алкенил”). В некоторых вариантах осуществления гетероалкенильная группа имеет от 2 до 5 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома (“гетероC2-5 алкенил”). В некоторых вариантах осуществления гетероалкенильная группа имеет от 2 до 4 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома (“гетероC2-4 алкенил”). В некоторых вариантах осуществления гетероалкенильная группа имеет от 2 до 3 атомов углерода, по меньшей мере одну двойную связь и 1 гетероатом (“гетероC2-3 алкенил”). В некоторых вариантах осуществления гетероалкенильная группа имеет от 2 до 6 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома (“гетероC2-6 алкенил”). Если не указано иное, в каждом случае гетероалкенильная группа является независимо незамещенной ("незамещенный гетероалкенил") или замещенной ("замещенный гетероалкенил") одним или несколькими заместителями. В некоторых вариантах осуществления гетероалкенильная группа представляет собой незамещенный гетероC2-10 алкенил. В некоторых вариантах осуществления гетероалкенильная группа представляет собой замещенный гетероC2-10 алкенил.
Термин “гетероалкинил”, как используется в настоящем описании, относится к алкинильной группе, как определено в настоящем описании, которая дополнительно содержит один или несколько (например, 1, 2, 3 или 4) гетероатомов (например, кислород, сера, азот, бор, кремний, фосфор), где один или несколько гетероатомов встроены между соседними атомами углерода в исходной углеродной цепи и/или один или несколько гетероатомов встроены между атомом углерода и родительской молекулой, т.е. между точкой присоединения. В некоторых вариантах осуществления гетероалкинильная группа относится к группе, имеющей от 2 до 10 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома (“гетероC2-10 алкинил”). В некоторых вариантах осуществления гетероалкинильная группа имеет от 2 до 9 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома (“гетероC2-9 алкинил”). В некоторых вариантах осуществления гетероалкинильная группа имеет от 2 до 8 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома (“гетероC2-8 алкинил”). В некоторых вариантах осуществления гетероалкинильная группа имеет от 2 до 7 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома (“гетероC2-7 алкинил”). В некоторых вариантах осуществления гетероалкинильная группа имеет от 2 до 6 атомов углерода, по меньшей мере одну тройную связь и 1, 2 или 3 гетероатома (“гетероC2-6 алкинил”). В некоторых вариантах осуществления гетероалкинильная группа имеет от 2 до 5 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома (“гетероC2-5 алкинил”). В некоторых вариантах осуществления гетероалкинильная группа имеет от 2 до 4 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома (“гетероC2-4 алкинил”). В некоторых вариантах осуществления гетероалкинильная группа имеет от 2 до 3 атомов углерода, по меньшей мере одну тройную связь и 1 гетероатом (“гетероC2-3 алкинил”). В некоторых вариантах осуществления гетероалкинильная группа имеет от 2 до 6 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома (“гетероC2-6 алкинил”). Если не указано иное, в каждом случае гетероалкинильная группа является независимо незамещенной ("незамещенный гетероалкинил") или замещенной ("замещенный гетероалкинил") одним или несколькими заместителями. В некоторых вариантах осуществления гетероалкинильная группа представляет собой незамещенный гетероC2-10 алкинил. В некоторых вариантах осуществления гетероалкинильная группа представляет собой замещенный гетероC2-10 алкинил.
Как используется в настоящем описании, "алкилен", "алкенилен", "алкинилен", "гетероалкилен", "гетероалкенилен" и "гетероалкинилен" относятся к двухвалентному радикалу алкильной, алкенильной, алкинильной группы, гетероалкильной, гетероалкенильной и гетероалкинильной группы, соответственно. Когда диапазон или число атомов углерода обеспечивается для конкретной "алкилен", "алкенилен," "алкинилен", "гетероалкилен", "гетероалкенилен" или "гетероалкинилен" группы, следует понимать, что диапазон или число относится к диапазону или числу атомов углерода в линейной двухвалентной цепи углерода. "Алкилен", "алкенилен", "алкинилен", "гетероалкилен", "гетероалкенилен" и "гетероалкинилен" группы могут быть замещенными или незамещенными одним или несколькими заместителями, как описано в настоящем документе.
“Арил” относится к радикалу моноциклической или полициклической (например, бициклической или трициклической) 4n+2 ароматической кольцевой системе (например, содержащей 6, 10 или 14π электронов в циклическом расположении), содержащей 6-14 атомов углерода в кольце и ноль гетероатомов, представленных в ароматической кольцевой системе (“C6-14 арил”). В некоторых вариантах осуществления арильная группа имеет шесть атомов углерода в кольце (“C6 арил”; например, фенил). В некоторых вариантах осуществления арильная группа имеет десять атомов углерода в кольце (“C10 арил”; например, нафтил, такой как 1-нафтил и 2-нафтил). В некоторых вариантах осуществления арильная группа имеет четырнадцать атомов углерода в кольце (“C14 арил”; например, антрацил). “Арил” также включает кольцевые системы, где арильное кольцо, определенное выше, является конденсированным с одной или несколькими карбоциклическими или гетероциклическими группами, где радикал или точка присоединения расположена на арильном кольце, и в таких случаях, число атомов углерода продолжает обозначать число атомов углерода в арильной кольцевой системе. Типичные арильные группы включают, но ими не ограничиваются, группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, as-индацена, s-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плейадена, пирена, пирантрена, рубицена, трифенилена и тринафталина. В особенности, арильные группы включают фенил, нафтил, инденил и тетрагидронафтил. Если не указано иное, в каждом случае арильная группа является независимо необязательно замещенной, т.е. незамещенной ("незамещенный арил") или замещенной ("замещенный арил") одним или несколькими заместителями. В некоторых вариантах осуществления арильная группа представляет собой незамещенный C6-14 арил. В некоторых вариантах осуществления арильная группа представляет собой замещенный C6-14 арил.
В некоторых вариантах осуществления арильная группа заменена одной или несколькими группами, выбранными из галогена, C1-C8 алкила, C1-C8 галогеналкила, циано, гидрокси, C1-C8 алкокси и амино.
Примеры характерных замещенных арилов включают следующие

где один из R56 и R57 может быть водородом, и по меньшей мере один из R56 и R57 независимо друг от друга выбран из C1-C8 алкила, C1-C8 гелогеналкила, 4-10-членного гетероциклила, алканоила, C1-C8 алкокси, гетероарилокси, алкиламино, ариламино, гетероариламино, NR58COR59, NR58SOR59 NR58SO2R59, COOалкила, COOарила, CONR58R59, CONR58OR59, NR58R59, SO2NR58R59, S-алкила, SOалкила, SO2алкила, Sарила, SOарила, SO2арила; или R56 и R57 могут быть объединены с образованием циклического кольца (насыщенного или ненасыщенного) из 5-8 атомов, необязательно содержащего один или несколько гетероатомов, выбранных из группы N, O или S. R60 и R61 независимо представляют собой водород, C1-C8 алкил, C1-C4 галогеналкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, замещенный C6-C10 арил, 5-10-членный гетероарил или замещенный 5-10-членный гетероарил.
Другие типичные арильные группы, имеющие конденсированную гетероциклическую группу, включают следующие:

где каждый W выбран из C(R66)2, NR66, O, и S; и каждый Y выбран из карбонила, NR66, O и S; и R66 независимо представляет собой водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, и 5-10-членный гетероарил.
“Конденсированный арил” относится к арилу, содержащему два из его кольцевых атомов углерода, общих со вторым арильным или гетероарильным кольцом или с карбоциклильным или гетероциклильным кольцом.
"Аралкил" представляет собой подгруппу алкила и арила, как определено в настоящем описании, и относится к необязательно замещенной алкильной группе, замещенной необязательно замещенной арильной группой.
“Гетероарил” относится к радикалу 5-10-членной моноциклической или бициклической 4n+2 ароматической кольцевой системы (например, имеющей 6 или 10 общих для этих колец π электронов в циклическом расположении), содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы (“5-10-членный гетероарил”). В гетероарильных группах, которые содержат один или несколько атомов азота, точкой присоединения может быть атом углерода или азота, как позволяет валентность. Гетероарильные бициклические кольцевые системы могут включать один или несколько гетероатомов в одном или обоих кольцах. "Гетероарил" включает кольцевые системы, где гетероарильное кольцо, определенное выше, является конденсированным с одной или несколькими карбоциклильными или гетероциклильными группами, где точка присоединения находится на гетероарильном кольце, и в таких случаях, число членов кольца продолжает обозначать число членов кольца в гетероарильной кольцевой системе. "Гетероарил" также включает кольцевые системы, где гетероарильное кольцо, определенное выше, является конденсированным с одной или несколькими арильными группами, где точка присоединения находится либо на арильном либо на гетероарильном кольце, и в таких случаях, число членов кольца продолжает обозначать число кольцевых атомов в конденсированной (арильной/гетероарильной) кольцевой системе. В бициклических гетероарильных группах, где одно кольцо не содержит гетероатом (например, индолил, хинолинил, карбазолил и подобные), точка присоединения может находиться на любом кольце, т.е. либо на кольце, содержащем гетероатом (например, 2-индолил), либо на кольце, которое не содержит гетероатом (например, 5-индолил).
В некоторых вариантах осуществления гетероарильная группа представляет собой 5-10-членную ароматическую кольцевую систему, содержащую атомы углерода в кольце и 1-4 гетероатома в кольце, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-10-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-8-членную ароматическую кольцевую систему, содержащую атомы углерода в кольце и 1-4 гетероатома в кольце, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-8-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-6-членную ароматическую кольцевую систему, содержащую атомы углерода в кольце и 1-4 гетероатома в кольце, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-6-членный гетероарил"). В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1-3 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1-2 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1 гетероатом в кольце, выбранный из азота, кислорода и серы. Если не указано иное, в каждом случае гетероарильная группа является независимо необязательно замещенной, т.е. незамещенной ("незамещенный гетероарил") или замещенной ("замещенный гетероарил") одним или несколькими заместителями. В некоторых вариантах осуществления гетероарильная группа представляет собой незамещенный 5-14-членный гетероарил. В некоторых вариантах осуществления гетероарильная группа представляет собой замещенный 5-14-членный гетероарил.
Примеры 5-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, пирролил, фуранил и тиофенил. Примеры 5-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Примеры 5-членных гетероарильных групп, содержащих три гетероатома, включают, без ограничения, триазолил, оксадиазолил и тиадиазолил. Примеры 5-членных гетероарильных групп, содержащих четыре гетероатома, включают, без ограничения, тетразолил. Примеры 6-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, пиридинил. Примеры 6-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения, пиридазинил, пиримидинил и пиразинил. Примеры 6-членных гетероарильных групп, содержащих три или четыре гетероатома, включают, без ограничения, триазинил и тетразинил, соответственно. Примеры 7-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, азепинил, оксепинил и тиепинил. Примеры 5,6-бициклических гетероарильных групп включают, без ограничения, индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Примеры 6,6-бициклических гетероарильных групп включают, без ограничения, нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил.
Примеры характерных гетероарилов включают следующие:

где каждый Y выбран из карбонила, N, NR65, O, и S; и R65 независимо представляет собой водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил и 5-10-членный гетероарил.
"Гетероаралкил" представляет собой подгруппу алкила и гетероарила, как определено в настоящем описании, и относится к необязательно замещенной алкильной группе, замещенной необязательно замещенной гетероарильной группой.
“Карбоциклил” или “карбоциклический” относится к радикалу неароматической циклической углеводородной группы, имеющей от 3 до 10 атомов углерода в кольце (“C3-10 карбоциклил”) и ноль гетероатомов в неароматической кольцевой системе. В некоторых вариантах осуществления карбоциклическая группа содержит от 3 до 8 атомов углерода в кольце (“C3-8 карбоциклил”). В некоторых вариантах осуществления карбоциклическая группа содержит от 3 до 6 атомов углерода в кольце (“C3-6 карбоциклил”). В некоторых вариантах осуществления карбоциклическая группа содержит от 3 до 6 атомов углерода в кольце (“C3-6 карбоциклил”). В некоторых вариантах осуществления карбоциклическая группа содержит от 5 до 10 атомов углерода в кольце (“C5-10 карбоциклил”). Примеры C3-6 карбоциклических групп включают, без ограничения, циклопропил (C3), циклопропенил (C3), циклобутил (C4), циклобутенил (C4), циклопентил (C5), циклопентенил (C5), циклогексил (C6), циклогексенил (C6), циклогексадиенил (C6) и подобные. Примеры C3-8 карбоциклических групп включают, без ограничения, указанные выше C3-6 карбоциклические группы, а также циклогептил (C7), циклогептенил (C7), циклогептадиенил (C7), циклогептатриенил (C7), циклооктил (C8), циклооктенил (C8), бицикло[2.2.1]гептанил (C7), бицикло[2.2.2]октанил (C8), и подобные. Примеры C3-10 карбоциклических групп включают, без ограничения, указанные выше C3-8 карбоциклические группы, а также циклононил (C9), циклононенил (C9), циклодецил (C10), циклодеценил (C10), октагидро-1H-инденил (C9), декагидронафталинил (C10), спиро[4.5]деканил (C10), и подобные. Как проиллюстрировано приведенными выше примерами, в некоторых вариантах осуществления карбоциклическая группа является либо моноциклической ("моноциклический карбоциклил") либо содержит конденсированную, связанную мостиковой связью или спиро кольцевую систему, такую как бициклическая система ("бициклический карбоциклил") и может быть насыщенной или может быть частично ненасыщенной. "Карбоциклил" также включает кольцевые системы, где карбоциклическое кольцо, определенное выше, является конденсированным с одной или несколькими арильными или гетероарильными группами, где точка присоединения находится на карбоциклическом кольце и в таких случаях, число атомов углерода продолжает обозначать число атомов углерода в карбоциклической кольцевой системе. Если не указано иное, в каждом случае карбоциклическая группа является независимо необязательно замещенной, т.е. незамещенной ("незамещенный карбоциклил") или замещенной ("замещенный карбоциклил") одним или несколькими заместителями. В некоторых вариантах осуществления карбоциклическая группа представляет собой незамещенный C3-10 карбоциклил. В некоторых вариантах осуществления карбоциклическая группа представляет собой замещенный C3-10 карбоциклил.
В некоторых вариантах осуществления "карбоциклил" представляет собой моноциклическую насыщенную карбоциклическую группу, имеющую от 3 до 10 атомов углерода в кольце ("C3-10 циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит от 3 до 8 атомов углерода в кольце ("C3-8 циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит от 3 до 6 атомов углерода в кольце ("C3-6 циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит от 5 до 6 атомов углерода в кольце ("C5-6 циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит от 5 до 10 атомов углерода в кольце ("C5-10 циклоалкил"). Примеры C5-6 циклоалкильных групп включают циклопентил (C5) и циклогексил (C5). Примеры C3-6 циклоалкильных групп включают указанные выше C5-6 циклоалкильные группы, а также циклопропил (C3) и циклобутил (C4). Примеры C3-8 циклоалкильных групп включают указанные выше C3-6 циклоалкильные группы, а также циклогептил (C7) и циклооктил (C8). Если не указано иное, в каждом случае циклоалкильная группа является независимо незамещенной ("незамещенный циклоалкил") или замещенной ("замещенный циклоалкил") одним или несколькими заместителями. В некоторых вариантах осуществления циклоалкильная группа представляет собой незамещенный C3-10 циклоалкил. В некоторых вариантах осуществления циклоалкильная группа представляет собой замещенный C3-10 циклоалкил.
“Гетероциклил” или “гетероциклический” относится к радикалу 3-10-членной неароматической кольцевой системы, содержащей атомы углерода в кольце и от 1 до 4 гетероатомов в кольце, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния (“3-10-членный гетероциклил”). В гетероциклических группах, которые содержат один или несколько атомов азота, точка присоединения может представлять собой атом углерода или азота, как позволяет валентность. Гетероциклическая группа может быть либо моноциклической ("моноциклический гетероциклил"), либо конденсированной, связанной мостиковой связью или спиро кольцевой системой, такая как бициклическая система ("бициклический гетероциклил") и может быть насыщенной или может быть частично ненасыщенной. Гетероциклические бициклические кольцевые системы могут включать один или несколько гетероатомов в одном или обоих кольцах. "Гетероциклил" также включает кольцевые системы, где гетероциклическое кольцо, определенное выше, является конденсированным с одной или несколькими карбоциклическими группами, где точка присоединения находится либо на карбоциклическом либо на гетероциклическом кольце, или кольцевые системы, где гетероциклическое кольцо, определенное выше, является конденсированным с одной или несколькими арильными или гетероарильными группами, где точка присоединения находится на гетероциклическом кольце, и в таких случаях, число членов кольца продолжает обозначать число членов кольца в гетероциклической кольцевой системе. Если не указано иное, в каждом случае гетероциклил является независимо необязательно замещенным, т.е. незамещенным ("незамещенный гетероциклил") или замещенным ("замещенный гетероциклил") одним или несколькими заместителями. В некоторых вариантах осуществления гетероциклическая группа представляет собой незамещенный 3-10-членный гетероциклил. В некоторых вариантах осуществления гетероциклическая группа представляет собой замещенный 3-10-членный гетероциклил.
В некоторых вариантах осуществления гетероциклическая группа представляет собой 5-10-членную неароматическую кольцевую систему, содержащую атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния ("5-10-членный гетероциклил"). В некоторых вариантах осуществления гетероциклическая группа представляет собой 5-8-членную неароматическую кольцевую систему, содержащую атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-8-членный гетероциклил"). В некоторых вариантах осуществления гетероциклическая группа представляет собой 5-6-членную неароматическую кольцевую систему, содержащую атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-6-членный гетероциклил"). В некоторых вариантах осуществления 5-6-членный гетероциклил содержит 1-3 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил содержит 1-2 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил содержит один гетероатом в кольце, выбранный из азота, кислорода и серы.
Примеры 3-членных гетероциклических групп, содержащих один гетероатом, включают, без ограничения, азиридинил, оксиранил, тиоренил. Примеры 4-членных гетероциклических групп, содержащих один гетероатом, включают, без ограничения, азетидинил, оксетанил и тиетанил. Примеры 5-членных гетероциклических групп, содержащих один гетероатом, включают, без ограничения, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Примеры 5-членных гетероциклических групп, содержащих два гетероатома, включают, без ограничения, диоксоланил, оксасульфуранил, дисульфуранил и оксазолидин-2-он. Примеры 5-членных гетероциклических групп, содержащих три гетероатома, включают, без ограничения, триазолинил, оксадиазолинил и тиадиазолинил. Примеры 6-членных гетероциклических групп, содержащих один гетероатом, включают, без ограничения, пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Примеры 6-членных гетероциклических групп, содержащих два гетероатома, включают, без ограничения, пиперазинил, морфолинил, дитианил, диоксанил. Примеры 6-членных гетероциклических групп, содержащих два гетероатома, включают, без ограничения, триазинанил. Примеры 7-членных гетероциклических групп, содержащих один гетероатом, включают, без ограничения, азепанил, оксепанил и тиепанил. Примеры 8-членных гетероциклических групп, содержащих один гетероатом, включают, без ограничения, азоканил, оксеканил и тиоканил. Примеры 5-членных гетероциклических групп, конденсированных с C6 арильным кольцом (также называемые в настоящем описании как 5,6-бициклическое гетероциклическое кольцо) включают, без ограничения, индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, бензоксазолинонил и тому подобное. Примеры 6-членных гетероциклических групп, конденсированных с арильным кольцом (также называемые в настоящем описании как 6,6-бициклическое гетероциклическое кольцо) включают, без ограничения, тетрагидрохинолинил, тетрагидроизохинолинил и тому подобное.
Конкретные примеры гетероциклических групп приведены в следующих иллюстративных примерах:

где каждый W выбран из CR67, C(R67)2, NR67, O и S; и где каждый Y выбран из NR67, O и S; и R67 независимо представляет собой водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, 5-10-членный гетероарил. Эти гетероциклические кольца могут быть необязательно замещены одной или несколькими группами, выбранными из группы, состоящей из ацила, ациламино, ацилокси, алкокси, алкоксикарбонила, алкоксикарбониламино, амино, замещенного амино, аминокарбонила (карбамоила или амидо), аминокарбониламино, аминосульфонила, сульфониламино, арила, арилокси, азидо, карбоксила, циано, циклоалкила, галогена, гидрокси, кето, нитро, тиола, -S-алкила, -S-арила, -S(O)-алкила, -S(O)-арила, -S(O)2-алкила, и -S(O)2-арила. Замещающие группы включают карбонил или тиокарбонил, которые дают, например, лактам и производные мочевины.
"Гетеро", когда используется для описания соединения или группы, присутствующей на соединении, означает, что один или более атомов углерода в соединении или группе заменены гетероатомы азота, кислорода или серы. Гетеро может использоваться с любой из углеводородных групп, описанных выше, таких как алкил, например, гетероалкил, циклоалкил, например, гетероциклил, арил, например, гетероарил, циклоалкенил, например, циклогетероалкенил и подобные группы, имеющие от 1 до 5 и, в частности, от 1 до 3 гетероатомов.
“Ацил” относится к радикалу -C(O)R20, где R20 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, как определено в настоящем описании. "Алканоил" обозначает ацильную группу, где R20 представляет собой группу, отличную от водорода. Типичные ацильные группы включают, но ими не ограничиваются, формил (-CHO), ацетил (-C(=O)CH3), циклогексилкарбонил, циклогексилметилкарбонил, бензоил (-C(=O)Ph), бензилкарбонил (-C(=O)CH2Ph), -C(O)-C1-C8 алкил, -C(O)-(CH2)t(C6-C10 арил), -C(O)-(CH2)t(5-10-членный гетероарил), -C(O)-(CH2)t(C3-C10 циклоалкил), и -C(O)-(CH2)t(4-10-членный гетероциклил), где t равно целому числу от 0 до 4. В некоторых вариантах осуществления R21 представляет собой C1-C8 алкил, замещенный галогеном или гидрокси; или C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом, или незамещенным C1-C4 галогеналкокси или гидрокси.
“Ациламино” относится к радикалу -NR22C(O)R23, где каждый из R22 и R23 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, как определено в настоящем описании, или R22 представляет собой аминозащитную группу. Типичные “ациламино” группы включают, но не ограничены этим, формиламино, ацетиламино, циклогексилкарбониламино, циклогексилметилкарбониламино, бензоиламино и бензилкарбониламино. Конкретными примерами "ациламино" групп являются -NR24C(O)-C1-C8 алкил, -NR24C(O)-(CH2)t(C6-C10 арил), -NR24C(O)-(CH2)t(5-10-членный гетероарил), -NR24C(O)-(CH2)t(C3-C10 циклоалкил), и -NR24C(O)-(CH2)t(4-10-членный гетероциклил), где t равно целому числу от 0 до 4, и каждый R24 независимо представляет собой Н или C1-C8 алкил. В некоторых вариантах осуществления R25 представляет собой H, C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; и R26 представляет собой H, C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидроксилом; при условии, что по меньшей мере один из R25 и R26 отличен от Н.
“Ацилокси” относится к радикалу -OC(O)R27, где R27 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, как определено в настоящем описании. Типичные примеры включают, но ими не ограничиваются, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил и бензилкарбонил. В некоторых вариантах осуществления R28 представляет собой C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
“Алкокси” относится к группе -OR29, где R29 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил. Конкретными алкоксигруппами являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси и 1,2-диметилбутокси. Конкретными алкоксигруппами являются низшие алкоксигруппы, т.е. группы, содержащие от 1 до 6 атомов углерода. Дополнительные конкретные алкоксигруппы имеют от 1 до 4 атомов углерода.
В некоторых вариантах осуществления R29 представляет собой группу, которая имеет 1 или несколько заместителей, например, от 1 до 5 заместителей, и, в частности, от 1 до 3 заместителей, в частности, 1 заместитель, выбранных из группы, состоящей из амино, замещенного амино, C6-C10 арила, арилокси, карбоксила, циано, C3-C10 циклоалкила, 4-10-членного гетероциклила, галогена, 5-10-членного гетероарила, гидроксила, нитро, тиоалкокси, тиоарилокси, тиола, алкил-S(O)-, арил-S(O)-, алкил-S(O)2- и арил-S(O)2-. Типичные “замещенные алкокси” группы включают, но ими не ограничиваются, -O-(CH2)t(C6-C10 арил), -O-(CH2)t(5-10-членный гетероарил), -O-(CH2)t(C3-C10 циклоалкил), и -O-(CH2)t(4-10-членный гетероциклил), где t равно целому числу от 0 до 4, и любый присутствующие арильная, гетероарильная, циклоалкильная или гетероциклильная группы, сами по себе могут быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Конкретными типичными "замещенными алкокси" группами являются -OCF3, -OCH2CF3, -OCH2Ph, -OCH2-циклопропил, -OCH2CH2OH и -OCH2CH2NMe2.
“Амино” относится к радикалу -NH2.
“Замещенный амино” относится к аминогруппе формулы -N(R38)2 где R38 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, или аминозащитную группу, где по меньшей мере один из R38 не представляет собой водород. В некоторых вариантах осуществления, каждый R38 независимо выбран из водорода, C1-C8 алкила, C3-C8 алкенила, C3-C8 алкинила, C6-C10 арила, 5-10-членного гетероарила, 4-10-членного гетероциклила, или C3-C10 циклоалкила; или C1-C8 алкила, замещенного галогеном или гидрокси; C3-C8 алкенила, замещенного галогеном или гидрокси; C3-C8 алкинила, замещенного галогеном или гидрокси, или -(CH2)t(C6-C10 арил), -(CH2)t(5-10-членного гетероарила), -(CH2)t(C3-C10 циклоалкил), или -(CH2)t(4-10-членного гетероциклила), где t равно целому числу от 0 до 8, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; или обе группы R38 объединены с образованием алкиленовой группы.
Типичные "замещенные амино" группы включают, но ими не ограничиваются, -NR39-C1-C8 алкил, -NR39-(CH2)t(C6-C10 арил), -NR39-(CH2)t(5-10-членный гетероарил), -NR39-(CH2)t(C3-C10 циклоалкил), и -NR39-(CH2)t(4-10-членный гетероциклил), где t равно целому числу от 0 до 4, например, 1 или 2, каждый R39 независимо представляет собой H или C1-C8 алкил; и любые присутствующие алкильные группы, сами по себе могут быть замещены галогеном, замещенным или незамещенным амино, или гидрокси; и любая присутствующая арильная, гетероарильная, циклоалкильная или гетероциклильная группы, сами по себе могут быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Во избежание сомнений термин "замещенный амино" включает группы алкиламино, замещенный алкиламино, алкилариламино, замещенный алкилариламино, ариламино, замещенный ариламино, диалкиламино и замещенный диалкиламино, как определено ниже. Замещенный амино охватывает как монозамещенные аминогруппы, так и дизамещенные аминогруппы.
“Азидо” относится к радикалу -N3.
“Карбамоил” или “амидо” относится к радикалу -C(O)NH2.
"Замещенный карбамоил" или "замещенный амидо" относится к радикалу -C(O)N(R62)2, где каждый R62 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, или аминозащитную группу, где по меньшей мере один из R62 не представляет собой водород. В некоторых вариантах осуществления R62 выбран из H, C1-C8 алкила, C3-C10 циклоалкила, 4-10-членного гетероциклила, C6-C10 арила, аралкила, 5-10-членного гетероарила и гетероаралкила; или C1-C8 алкила, замещенного галогеном или гидрокси; или C3-C10 циклоалкила, 4-10-членного гетероциклила, C6-C10 арила, аралкила, 5-10-членного гетероарила или гетероаралкила, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеноалкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; при условии, что по меньшей мере один R62 отличен от H.
Типичные “замещенные карбамоильные” группы включают, но ими не ограничиваются, -C(O) NR64-C1-C8 алкил, -C(O)NR64-(CH2)t(C6-C10 арил), -C(O)N64-(CH2)t(5-10-членный гетероарил), -C(O)NR64-(CH2)t(C3-C10 циклоалкил) и -C(O)NR64-(CH2)t(4-10-членный гетероциклил), где t равно целому числу от 0 до 4, каждый R64 независимо представляет собой H или C1-C8 алкил и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы, сами по себе могут быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
“Карбокси” относится к радикалу -C(O)OH.
“Циано” относится к радикалу -CN.
“Гало” или ”галоген” относится к фтору (F), хлору (Cl), брому (Br) и йоду (I). В некоторых вариантах осуществления галогеновыми группами являются любой из фтора или хлора.
“Гидрокси” относится к радикалу -OH.
“Нитро” относится к радикалу -NO2.
“Циклоалкилалкил” относится к алкильному радикалу, в котором алкильная группа замещена циклоалкильной группой. Типичные циклоалкилалкильные группы включают, но ими не ограничиваются, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклогептилметил, циклооктилметил, циклопропилэтил, циклобутилэтил, циклопентилэтил, циклогексилэтил, циклогептилэтил и циклооктилэтил, и тому подобное.
"Гетероциклилалкил" относится к алкильному радикалу, в котором алкильная группа замещена гетероциклильной группой. Типичные гетероциклилалкильные группы включают, но ими не ограничиваются, пирролидинилметил, пиперидинилметил, пиперазинилметил, морфолинилметил, пирролидинилэтил, пиперидинилэтил, пиперазинилэтил, морфолинилэтил и тому подобные.
"Циклоалкенил" относится к замещенной или незамещенной карбоциклильной группе, имеющей от 3 до 10 атомов углерода, и имеющей одно циклическое кольцо или несколько конденсированных колец, включая конденсированную и связанную мостиковой связью кольцевые системы, и имеющей по меньшей мере один и, в частности, от 1 до 2 участков олефиновой ненасыщенности. Такие циклоалкенильные группы включают, в качестве примера, отдельные кольцевые структуры, такие как циклогексенил, циклопентенил, циклопропенил и тому подобные.
“Конденсированный циклоалкенил” относится к циклоалкенилу, в котором два из его кольцевых атомов углерода являются общими со вторым алифатическим или ароматическим кольцом, и где его олефиновая ненасыщенность расположена так, чтобы придать ароматичность циклоалкенильному кольцу
“Этилен” относится к замещенному или незамещенному -(C-C)-.
“Этенил” относится к замещенному или незамещенному -(C=C)-.
“Этинил” относится к -(C≡C)-.
“Азот-содержащая гетероциклильная” группа означает 4-7-членную не-ароматическую циклическую группу, содержащую по меньшей мере один атом азота, например, но без ограничения, морфолин, пиперидин (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидин (например 2-пирролидинил и 3-пирролидинил), азетидин, пирролидон, имидазолин, имидазолидинон, 2-пиразолин, пиразолидин, пиперазин и N-алкилпиперазины, такие как N-метилпиперазин. Конкретные примеры включают азетидин, пиперидон и пиперазон.
“Тиокето” относится к группе =S.
Алкильные, алкенильные, алкинильные, карбоциклильные, гетероциклильные, арильные и гетероарильные группы, определенные в настоящей заявке, являются необязательно замещенными (например, "замещенная" или "незамещенная" алкильная, "замещенная" или "незамещенная" алкенильная, "замещенная" или "незамещенная" алкинильная, "замещенная" или "незамещенная" карбоциклильная, "замещенная" или "незамещенная" гетероциклильная, "замещенная" или "незамещенная" арильная или "замещенная" или "незамещенная" гетероарильная группа). Как правило, термин "замещенный", независимо от того, стоит ли перед ним слово "необязательно" или нет, означает, что по меньшей мере один атом водорода, присутствующий в группе (например, по атому углерода или азота), заменен возможным заместителем, например, заместителем, который при замещении приводит к стабильному соединению, например, соединению, которое не подвержено самопроизвольному преобразованию, например, путем перегруппировки, циклизации, элиминирования или другой реакции. Если не указано иное, "замещенная" группа содержит заместитель в одном или нескольких замещаемых положениях этой группы, и когда более чем одно положение в какой-либо определенной структуре является замещенным, заместители являются одинаковыми или отличными друг от друга в каждом положении. Термин "замещенный" предполагается включение замены всех возможных заместителей органических соединений, любым из заместителей, описанных в настоящем документе, что приводит к образованию стабильного соединения. Для целей настоящего изобретения, гетероатомы, такие как азот, могут иметь водородные заместители и/или любые подходящие заместители, как описано в настоящем документе, которые соответствуют валентности гетероатомов и приводит к образованию стабильного соединения.
Примеры заместителей по атому углерода включают, но не ими ограничиваются, галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORaa, -ON(Rbb)2, -N(Rbb)2, -N(Rbb)3+X-, -N(ORcc)Rbb, -SH, -SRaa, -SSRcc, -C(=O)Raa, -CO2H, -CHO, -C(ORcc)2, -CO2Raa, -OC(=O)Raa, -OCO2Raa, -C(=O)N(Rbb)2, -OC(=O)N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -OC(=NRbb)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -C(=O)NRbbSO2Raa, -NRbbSO2Raa, -SO2N(Rbb)2, -SO2Raa, -SO2ORaa, -OSO2Raa, -S(=O)Raa, -OS(=O)Raa, -Si(Raa)3, -OSi(Raa)3 -C(=S)N(Rbb)2, -C(=O)SRaa, -C(=S)SRaa, -SC(=S)SRaa, -SC(=O)SRaa, -OC(=O)SRaa, -SC(=O)ORaa, -SC(=O)Raa, -P(=O)2Raa, -OP(=O)2Raa, -P(=O)(Raa)2, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -P(=O)2N(Rbb)2, -OP(=O)2N(Rbb)2, -P(=O)(NRbb)2, -OP(=O)(NRbb)2, -NRbbP(=O)(ORcc)2, -NRbbP(=O)(NRbb)2, -P(Rcc)2, -P(Rcc)3, -OP(Rcc)2, -OP(Rcc)3, -B(Raa)2, -B(ORcc)2, -BRaa(ORcc), C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил, и 5-14-членный гетероарил, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены 0, 1, 2, 3, 4, или 5 группами Rdd;
или два атома водорода, присоединенных к одному и тому же атому углерода, заменены группой =O, =S, =NN(Rbb)2, =NNRbbC(=O)Raa, =NNRbbC(=O)ORaa, =NNRbbS(=O)2Raa, =NRbb или =NORcc;
в каждом случае Raa независимо выбран из C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd; или две группы Raa объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rbb независимо выбран из водорода, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила, и 5-14-членного гетероарила, или две группы Rbb объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rcc независимо выбран из водорода, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, или две группы Rcc объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rdd независимо выбран из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORee, -ON(Rff)2, -N(Rff)2, -N(Rff)3+X-, -N(ORee)Rff, -SH, -SRee, -SSRee, -C(=O)Ree, -CO2H, -CO2Ree, -OC(=O)Ree, -OCO2Ree, -C(=O)N(Rff)2, -OC(=O)N(Rff)2, -NRffC(=O)Ree, -NRffCO2Ree, -NRffC(=O)N(Rff)2, -C(=NRff)ORee, -OC(=NRff)Ree, -OC(=NRff)ORee, -C(=NRff)N(Rff)2, -OC(=NRff)N(Rff)2, -NRffC(=NRff)N(Rff)2,-NRffSO2Ree, -SO2N(Rff)2, -SO2Ree, -SO2ORee, -OSO2Ree, -S(=O)Ree, -Si(Ree)3, -OSi(Ree)3, -C(=S)N(Rff)2, -C(=O)SRee, -C(=S)SRee, -SC(=S)SRee, -P(=O)2Ree, -P(=O)(Ree)2, -OP(=O)(Ree)2, -OP(=O)(ORee)2, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10-членного гетероциклила, C6-10 арила, 5-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или группами 5 Rgg, или два Rdd смежных заместителя могут быть объединены с образованием =О или =S;
в каждом случае Ree независимо выбран из C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, C6-10 арила, 3-10-членного гетероциклила и 3-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4, или 5 группами Rgg;
в каждом случае Rff независимо выбран из водорода, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10-членного гетероциклила, C6-10 арила и 5-10-членного гетероарила, или две группы Rff объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4, или 5 группами Rgg; и
в каждом случае Rgg независимо выбран из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -OC1-6 алкил, -ON(C1-6 алкил)2, -N(C1-6 алкил)2, -N(C1-6 алкил)3+X-, -NH(C1-6 алкил)2+X-, -NH2(C1-6 алкил)+X-, -NH3+X-, -N(OC1-6 алкил)(C1-6 алкил), -N(OH)(C1-6 алкил), -NH(OH), -SH, -SC1-6 алкил, -SS(C1-6 алкил), -C(=O)(C1-6 алкил), -CO2H, -CO2(C1-6 алкил), -OC(=O)(C1-6 алкил), -OCO2(C1-6 алкил), -C(=O)NH2, -C(=O)N(C1-6 алкил)2, -OC(=O)NH(C1-6 алкил), -NHC(=O)(C1-6 алкил), -N(C1-6 алкил)C(=O)(C1-6 алкил), -NHCO2(C1-6 алкил), -NHC(=O)N(C1-6 алкил)2, -NHC(=O)NH(C1-6 алкил), -NHC(=O)NH2, -C(=NH)O(C1-6 алкил),-OC(=NH)(C1-6 алкил), -OC(=NH)OC1-6 алкила, -C(=NH)N(C1-6 алкил)2, -C(=NH)NH(C1-6 алкил), -C(=NH)NH2, -OC(=NH)N(C1-6 алкил)2, -OC(NH)NH(C1-6 алкил), -OC(NH)NH2, -NHC(NH)N(C1-6 алкил)2, -NHC(=NH)NH2, -NHSO2(C1-6 алкил), -SO2N(C1-6 алкил)2, -SO2NH(C1-6 алкил), -SO2NH2,-SO2C1-6 алкила, -SO2OC1-6 алкила, -OSO2C1-6 алкила, -SOC1-6 алкила, -Si(C1-6 алкил)3, -OSi(C1-6 алкил)3 -C(=S)N(C1-6 алкил)2, C(=S)NH(C1-6 алкил), C(=S)NH2, -C(=O)S(C1-6 алкил), -C(=S)SC1-6 алкила, -SC(=S)SC1-6 алкила, -P(=O)2(C1-6 алкил), -P(=O)(C1-6 алкил)2, -OP(=O)(C1-6 алкил)2, -OP(=O)(OC1-6 алкил)2, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, C6-10 арила, 3-10-членного гетероциклила, 5-10-членного гетероарила; или два смежных заместителя Rgg могут быть объединены с образованием =О или =S; где X- представляет собой противоион.
“Противоион” или “анионный противоион” представляет собой отрицательно заряженную группу, связанную с положительно заряженной четвертичной аминогруппой для поддержания электронной нейтральности. Примеры противоионов включают галогенидные ионы (например, F-, Cl-, Br-, I-), NO3-, ClO4-, OH-, H2PO4-, HSO4-, SO4- сульфонатные ионы (например, метансульфонат, трифторметансульфонат, п-толуолсульфонат, бензолсульфонат, 10-камфорсульфонат, нафталин-2-сульфонат, нафталин-1-сульфоновая кислота-5-сульфонат, этан-1-сульфоновая кислота-2-сульфонат и подобные) и карбоксилатные ионы (например, ацетат, этаноат, пропаноат, бензоат, глицерат, лактат, тартрат, гликолят и подобные).
Атомы азота могут быть замещены или не замещены, как позволяет валентность, и включают атомы первичного, вторичного, третичного и четвертичного азота. Примеры заместителей по атомам азота включают, но ими не ограничиваются, водород, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRbb)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил и 5-14-членный гетероарил, или две Rcc группы, связанные с атомом азота, объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd, и где Raa, Rbb, Rcc и Rdd имеют значения, определенные выше.
Эти и другие примеры заместителей описаны более подробно в разделах “Подробное описание”, “Примеры” и в формуле изобретения. Изобретение не предназначено для ограничения каким-либо образом приведенным выше иллюстративным перечнем заместителей.
Другие определения
Термин "фармацевтически приемлемая соль" относится к таким солям, которые в рамках здравого медицинского суждения, пригодны для использования в контакте с тканями людей и низших животных и не обладают излишней токсичностью, не вызывают раздражение, аллергической реакции и т.п., и показывают приемлемое отношение польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Например, Berge et al., подробно описывают фармацевтически приемлемые соли в публикации J. Pharmaceutical Sciences (1977) 66:1-19. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соли, полученные из подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых нетоксичных кислотно-аддитивных солей являются соли аминогруппы, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или полученные с использованием других методов, которые применяют в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорасульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептаноат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, соль яблочной кислоты, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, соль валериановой кислоты и тому подобное. Фармацевтически приемлемые соли, полученные из соответствующих оснований, включают соли щелочных металлов, щелочноземельных металлов, соли аммония и соли N+(C1-4алкил)4. Примеры солей щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и тому подобные. Другие фармацевтически приемлемые соли в необходимых случаях включают нетоксичные соли аммония, четверичные аммониевые соли и катионы аминов, которые образованы такими противоионами, как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, сульфонат низшего алкила и арилсульфонат.
"Индивид", которому предполагается введение, включает, но ими не ограничивается, человека (т.е., мужчину или женщину любого возраста, например, педиатрического пациента (например, младенец, ребенок, подросток) или взрослого человека (например, молодой человек, человек среднего возраста или пожилой человек)) и/или животного, например, млекопитающего, такого как приматы (например, макак, макак-резус), крупный рогатый скот, свиньи, лошади, овцы, козы, грызуны, кошки и/или собаки. В некоторых вариантах осуществления индивидом является человек. В некоторых вариантах осуществления индивидом является животное. Термины “человек”, “пациент” и “индивид” используются в настоящем описании взаимозаменяемо.
Заболевание, нарушение, и состояние используются в настоящем описании взаимозаменяемо.
Если не указано иное, термины "лечить" и "лечение" означают меры, предпринимаемые во время болезни субъекта, которые позволяют ослабить тяжесть заболевания или нарушения, задержать или замедлить прогрессирование заболевания или нарушения.
Как используется в настоящем описании, и если не указано иное, термины "лечить" и "лечение" относятся к мерам, предпринимаемым во время болезни индивида, страдающего от указанного заболевания, нарушения или состояния, которые уменьшают тяжесть заболевания, нарушения или состояния, или тормозят или замедляют прогрессирование заболевания, нарушения или состояние ("терапевтическое лечение"), а также относятся к мерам, предпринимаемым до того, как индивид заболеет указанным заболеванием, нарушением или состоянием ("профилактическое лечение").
В общем, "эффективное количество" соединения означает количество, достаточное для достижения желаемого биологического эффекта. Как будет понятно специалистам с обычной квалификацией в данной области, эффективное количество соединения по настоящему изобретению может варьироваться в зависимости от таких факторов, как желаемый биологический результат, фармакокинетика соединения, заболевания, которое лечат, способа введения, и возраста, состояния здоровья, и состояния индивида. Эффективное количество охватывает терапевтическое и профилактическое лечение.
Как используется в настоящем описании, и если не указано иное, "терапевтически эффективное количество" соединения является количеством, достаточным для обеспечения терапевтического воздействия при лечении заболевания, нарушения или состояния, или для задержки или минимизации одного или нескольких симптомов, связанных с заболеванием, нарушением или состоянием. Терапевтически эффективное количество соединения означает количество терапевтического средства, используемого отдельно или в комбинации с другими способами лечения, которое обеспечивает терапевтический эффект при лечении заболевания, нарушения или состояния. Термин "терапевтически эффективное количество" может означать количество, которое улучшает общее лечение, ослабляет или устраняет симптомы или причины заболевания или состояния, или усиливает терапевтическую эффективность другого терапевтического средства.
Как используется в настоящем описании, и если не указано иное, "профилактически эффективное количество" соединения является количеством, достаточным для предотвращения заболевания, нарушения или состояния, или одного или нескольких симптомов, связанных с заболеванием, нарушением или состоянием, или устранения его рецидива. Профилактически эффективное количество соединения означает количество терапевтического средства, используемого отдельно или в комбинации с другими средствами, которое оказывает профилактическое воздействие по предотвращению заболевания, нарушения или состояния. Термин "профилактически эффективное количество" может означать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического средства.
Краткое описание фигур
На фиг. 1-13 представлены характерные спектры 1H-ЯМР для иллюстративных соединений, описанных в настоящем документе.
Подробное описание некоторых вариантов осуществления изобретения
Как описано в настоящем документе, настоящее изобретение относится к 3,3-дизамещенным 19-нор нейроактивным стероидам формулы (I):
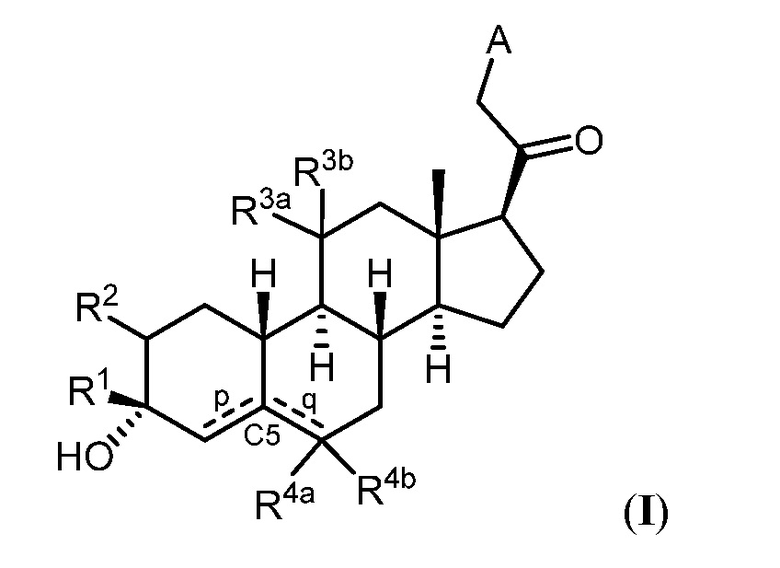
и к их фармацевтически приемлемым солям;
где:
 представляет собой одинарную или двойную связь, как позволяет валентность;
представляет собой одинарную или двойную связь, как позволяет валентность;
A представлено формулой (A-1) или формулой (A-2):
 (A-1), или
(A-1), или 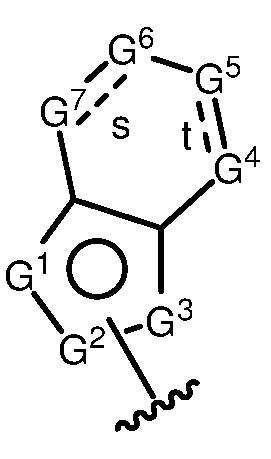 (A-2), где точка присоединения находится в G1 или G2 в формуле (A-1) и точка присоединения находится в G2 или G3 в формуле (A-2);
(A-2), где точка присоединения находится в G1 или G2 в формуле (A-1) и точка присоединения находится в G2 или G3 в формуле (A-2);
G1 представляет собой N, NRN1, O, S, C, или C-RG1, как позволяет валентность;
G2 представляет собой N, NRN2, O, S, C, -C=N-, или C-RG2, как позволяет валентность;
G3 представляет собой N, NRN3, O, S, C, или C-RG3, как позволяет валентность;
G4 представляет собой N, NRN4, C-RG4, или C-(RG4)2, как позволяет валентность;
G5 представляет собой N, NRN5, C-RG5, или C-(RG5)2, как позволяет валентность;
G6 представляет собой N, NRN6, C-RG6, или C-(RG6)2, как позволяет валентность; b
G7 представляет собой N, NRN7, C-RG7, или C-(RG7)2, как позволяет валентность;
в каждом случае RG1, RG2, RG3, RG4, RG5, RG6, and RG7 независимо представляет собой водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6- членный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
в каждом случае RGA независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, кислород-защитную группу, если присоединен к кислороду, азот-защитную группу, если присоединен к азоту, или две RGA группы взяты с промежуточными атомами с образованием замещенного или незамещенного карбоциклического или гетероциклического кольца;
R1 представляет собой замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил или замещенный или незамещенный C3-6 карбоциклил;
R2 представляет собой водород, галоген, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил, или -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил;
R3a представляет собой водород или -ORA3, где RA3 представляет собой водород, или замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил, и R3b представляет собой водород; или R3a и R3b объединены с образованием оксо (=O) группы;
каждый R4a или R4b независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, или галоген; и
при условии, если связь р представляет собой двойную связь, то связь q представляет собой простую связь, при условии, если связь q представляет собой двойную связь, то связь р представляет собой простую связь и R4b отсутствует; и при условии, если обе связи q и р представляют собой простые связи, то водород в С5 находится в альфа- или бета-конфигурации.
В некоторых вариантах осуществления G4 представляет собой N или NRN4, и/или G5 представляет собой N или NRN5, и/или G6 представляет собой N или NRN6, и/или G7 представляет собой N или NRN7.
На основании приведенного выше описания должно быть понятно, что соединения формулы (I) включают 3,3-дизамещенные 19-нор нейроактивные стероиды, где кольцевая система А/В соединения представляет собой цис-конфигурацию (как это представлено в формуле (I-A), где кольцевая система А/В соединения представляет собой транс-конфигурацию (как это представлено в формуле (I-B), где кольцо В соединения содержит C5-C6 двойную связь (как это представлено в формуле (I-C)), и в котором кольцо А соединения содержит двойную связь С4-С5 (как это представлено в формуле (ID)),


и их фармацевтически приемлемые соли.
Группа R1
Как в общем смысле определено в настоящем описании, R1 представляет собой замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил.
В некоторых вариантах осуществления R1 представляет собой замещенный или незамещенный C1-6 алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил, или замещенный или незамещенный C5-6алкил. Характерные R1 C1-6 алкильные группы включают, но ими не ограничиваются, замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) и н-гексил (C6), C1-6 алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или несколькими фтор-группами (например, -CF3, -CH2F, -CHF2, дифторэтил и 2,2,2-трифтор-1,1-диметил-этил), C1-6 алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или несколькими хлор-группами (например, -CH2Cl, -CHCl2), и C1-6 алкил, замещенный алкоксигруппами (например, -CH2OCH3 и -CH2OCH2CH3). В некоторых вариантах осуществления R1 представляет собой замещенный C1-6 алкил, например, R1 представляет собой галогеналкил, алкоксиалкил или аминоалкил. В некоторых вариантах осуществления R1 представляет собой Me, Et, n-Pr, n-Bu, i-Bu, фторметил, хлорметил, дифторметил, трифторметил, трифторэтил, дифторэтил, 2,2,2-трифтор-1,1-диметил-этил, метоксиметил, метоксиэтил или этоксиметил.
В некоторых вариантах осуществления R1 представляет собой незамещенный C1-3 алкил, например, R1 представляет собой -CH3, -CH2CH3 или -CH2CH2CH3.
В некоторых вариантах осуществления R1 представляет собой C1-6 алкил, замещенный один или несколькими атомами фтора; например, R1 представляет собой -CH2F, -CHF2 или -CF3.
В некоторых вариантах осуществления R1 представляет собой C1-6 алкил, замещенный одной или несколькими группами -ORA1, где RA1 представляет собой водород или замещенный или незамещенный алкил. В некоторых вариантах осуществления R1 представляет собой -CH2ORA1, например, где RA1 представляет собой водород, -CH3, -CH2CH3, или -CH2CH2CH3, например, для получения группы R1 формулы -CH2OH, -CH2OCH3, -CH2OCH2CH3 или -CH2OCH2CH2CH3.
В некоторых вариантах осуществления R1 представляет собой замещенный или незамещенный C2-6 алкенил, например, замещенный или незамещенный C2-3алкенил, замещенный или незамещенный C3-4алкенил, замещенный или незамещенный C4-5алкенил, или замещенный или незамещенный C5-6алкенил. В некоторых вариантах осуществления R1 представляет собой этенил (C2), пропенил (C3) или бутенил (C4), замещенный или незамещенный одним или более заместителями, выбранными из группы, состоящей из алкила, галогена, галогеналкила, алкоксиалкила или гидроксила. В некоторых вариантах осуществления R1 представляет собой этенил, пропенил или бутенил, незамещенный или замещенный алкилом, галогеном, галогеналкилом, алкоксиалкилом или гидрокси. В некоторых вариантах осуществления R1 представляет собой этенил.
В некоторых вариантах осуществления R1 представляет собой замещенный или незамещенный C2-6 алкинил, например, замещенный или незамещенный C2-3алкинил, замещенный или незамещенный C3-4алкинил, замещенный или незамещенный C4-5алкинил, или замещенный или незамещенный C5-6алкинил. В некоторых вариантах осуществления R1 представляет собой этинил, пропинил или бутинил, незамещенный или замещенный алкилом, галогеном, галогеналкилом (например, CF3), алкоксиалкилом, циклоалкилом (например, циклопропил или циклобутил) или гидроксилом. В некоторых вариантах осуществления R1 выбран из группы, состоящей из трифторэтинила, циклопропилэтинила, циклобутилэтинила и пропинила, фторпропинила и хлорэтинила. В некоторых вариантах осуществления R1 представляет собой этинил (C2), пропинил (C3) или бутинил (C4), незамещенный или замещенный одним или несколькими заместителями, выбранными из группы, состоящей из замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного карбоциклила и замещенного или незамещенного гетероциклила. В некоторых вариантах осуществления R1 представляет собой этинил (C2), пропинил (C3) или бутинил (C4), замещенный замещенным фенилом. В некоторых вариантах осуществления заместитель фенила дополнительно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, алкила, алкокси, трифторалкила, ацила, амино или амидо. В некоторых вариантах осуществления R1 представляет собой этинил (C2), пропинил (C3) или бутинил (C4), замещенный замещенным или незамещенным пирролилом, имидазолилом, пиразолилом, оксазолилом, тиазолилом, изоксазолилом, 1,2,3-триазолилом, 1,2,4-триазолилом, оксадиазолилом, тиадиазолилом или тетразолилом.
В некоторых вариантах осуществления R1 представляет собой этинил, пропинил или бутинил, незамещенный или замещенный алкилом, галогеном, галогеналкилом, алкоксиалкилом или гидроксилом. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный замещенным или незамещенным арилом. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный фенилом, незамещенным или замещенным галогеном, алкилом, алкокси, галогеналкилом, тригалогеналкилом или ацилом. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный замещенным или незамещенным карбоциклилом. В некоторых вариантах осуществления R3a представляет собой этинил или пропинил, замещенный замещенным или незамещенным, циклопропилом, циклобутилом, циклопентилом или циклогексилом. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный замещенным или незамещенным гетероарилом. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный замещенным или незамещенным пиридинилом или пиримидинилом. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный замещенным или незамещенным пирролилом, имидазолилом, пиразолилом, оксазолилом, тиазолилом, изоксазолилом, 1,2,3-триазолилом, 1,2,4-триазолилом, оксадиазолилом, тиадиазолилом, тетразолилом. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный замещенным или незамещенным гетероциклилом. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный замещенным или незамещенным пирролидинилом, пиперидинилом, пиперазинилом или морфолинилом. В некоторых вариантах осуществления R1 представляет собой пропинил или бутинил, замещенный гидроксилом или алкокси. В некоторых вариантах осуществления R1 представляет собой пропинил или бутинил, замещенный метокси или этокси. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный хлором. В некоторых вариантах осуществления R1 представляет собой этинил или пропинил, замещенный трифторметилом.
В некоторых вариантах осуществления R1 представляет собой замещенный или незамещенный C3-6 карбоциклил, например, замещенный или незамещенный C3-4карбоциклил, замещенный или незамещенный C4-5 карбоциклил, или замещенный или незамещенный C5-6 карбоциклил. В некоторых вариантах осуществления R1 представляет собой замещенный или незамещенный циклопропил или замещенный или незамещенный циклобутил.
Группы
 , R2, R3a, R3b, R4a и R4b
, R2, R3a, R3b, R4a и R4b
Как в общем смысле определено в настоящем описании, R2 представляет собой водород, галоген, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил, или -ORA2, где RA2 представляет собой водород, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил.
В некоторых вариантах осуществления R2 представляет собой водород. В некоторых вариантах осуществления R2 представляет собой галоген, например, фтор, хлор, бром или йод. В некоторых вариантах осуществления R2 представляет собой фтор или хлор. В некоторых вариантах осуществления R2 представляет собой замещенный или незамещенный C1-6алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил, или замещенный или незамещенный C5-6алкил. В некоторых вариантах осуществления R2 представляет собой замещенный или незамещенный C2-6 алкенил, В некоторых вариантах осуществления R2 представляет собой замещенный или незамещенный C2-6 алкинил, например, замещенный или незамещенный C2-3алкинил, замещенный или незамещенный C3-4алкинил, замещенный или незамещенный C4-5алкинил, или замещенный или незамещенный C5-6алкинил. В некоторых вариантах осуществления R2 представляет собой замещенный или незамещенный C3-6 карбоциклил, например, замещенный или незамещенный C3-4карбоциклил, замещенный или незамещенный C4-5 карбоциклил, или замещенный или незамещенный C5-6 карбоциклил. В некоторых вариантах осуществления R2 представляет собой замещенный или незамещенный циклопропил или замещенный или незамещенный циклобутил. В некоторых вариантах осуществления R2 представляет собой -CH3, -CH2CH3, -CH2CH2CH3 или замещенный или незамещенный циклопропил. В некоторых вариантах осуществления R2 представляет собой -ORA2. В некоторых вариантах осуществления RA2 представляет собой водород. В некоторых вариантах осуществления RA2 представляет собой замещенный или незамещенный алкил, например, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил, или замещенный или незамещенный C5-6алкил. В некоторых вариантах осуществления RA2 представляет собой водород, -CH3, -CH2CH3, или -CH2CH2CH3, т.е., для получения группы R2 формулы -OH, -OCH3, -OCH2CH3, или -OCH2CH2CH3. В некоторых вариантах осуществления R2 представляет собой не-водородный заместитель в альфа-конфигурации. В некоторых вариантах осуществления R2 представляет собой не-водородный заместитель в бета-конфигурации.
Как в общем смысле определено в настоящем описании, R3a представляет собой водород or -ORA3, где RA3 представляет собой водород или замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил, и R3b представляет собой водород; или R3a и R3b объединены с образованием оксо (=O) группы.
В некоторых вариантах осуществления и R3a и R3b оба являются водородом.
В некоторых вариантах осуществления R3a и R3b объединены с образованием оксо (=O) группы.
В некоторых вариантах осуществления R3a представляет собой -ORA3 и R3b представляет собой водород. В некоторых вариантах осуществления, где R3a представляет собой -ORA3, R3a находится в альфа- или бета-конфигурации (например, R- или S-конфигурации). В некоторых вариантах осуществления, где R3a представляет собой -ORA3, R3a находится в альфа-конфигурации. В некоторых вариантах осуществления, где R3a представляет собой -ORA3, R3a находится в бета-конфигурации. В некоторых вариантах осуществления RA3 представляет собой водород. В некоторых вариантах осуществления RA3 представляет собой замещенный или незамещенный C1-6 алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил, или замещенный или незамещенный C5-6алкил. В некоторых вариантах осуществления RA3 представляет собой водород, -CH3, -CH2CH3 или -CH2CH2CH3, т.e., для получения группы R3a формулы -OH, -OCH3, -OCH2CH3 или -OCH2CH2CH3.
Как в общем смысле определено в настоящем описании, в каждом случае R4a и R4b независимо представляет собой водород, замещенный или незамещенный C1-6 алкил или галоген, при условии, если  между C5 и C6 представляют собой простые связи, то водород в C5 и R4a независимо друг от друга представлены в альфа- или бета-конфигурации, и R4b отсутствует.
между C5 и C6 представляют собой простые связи, то водород в C5 и R4a независимо друг от друга представлены в альфа- или бета-конфигурации, и R4b отсутствует.
В некоторых вариантах осуществления  представляет собой одинарную связь, по меньшей мере один из R4a и R4b представляет собой водород. В некоторых вариантах осуществления
представляет собой одинарную связь, по меньшей мере один из R4a и R4b представляет собой водород. В некоторых вариантах осуществления  представляет собой одинарную связь, по меньшей мере один из R4a и R4b представляет собой замещенный или незамещенный C1-6 алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил, или замещенный или незамещенный C5-6алкил. В некоторых вариантах осуществления
представляет собой одинарную связь, по меньшей мере один из R4a и R4b представляет собой замещенный или незамещенный C1-6 алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил, или замещенный или незамещенный C5-6алкил. В некоторых вариантах осуществления  представляет собой одинарную связь, по меньшей мере один из R4a и R4b представляет собой C1 алкил, например, -CH3 или -CF3. В некоторых вариантах осуществления
представляет собой одинарную связь, по меньшей мере один из R4a и R4b представляет собой C1 алкил, например, -CH3 или -CF3. В некоторых вариантах осуществления  представляет собой одинарную связь, по меньшей мере один из R4a и R4b представляет собой галоген, например, фтор.
представляет собой одинарную связь, по меньшей мере один из R4a и R4b представляет собой галоген, например, фтор.
В некоторых вариантах осуществления  представляет собой одинарную связь, и оба R4a и R4b представляют собой водород. В некоторых вариантах осуществления
представляет собой одинарную связь, и оба R4a и R4b представляют собой водород. В некоторых вариантах осуществления  представляет собой одинарную связь, и оба R4a и R4b независимо представляют собой замещенный или незамещенный C1-6 алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил или замещенный или незамещенный C5-6алкил. В некоторых вариантах осуществления
представляет собой одинарную связь, и оба R4a и R4b независимо представляют собой замещенный или незамещенный C1-6 алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил или замещенный или незамещенный C5-6алкил. В некоторых вариантах осуществления  представляет собой одинарную связь, и оба R4a и R4b независимо представляют собой C1 алкил, например, -CH3 или -CF3. В некоторых вариантах осуществления
представляет собой одинарную связь, и оба R4a и R4b независимо представляют собой C1 алкил, например, -CH3 или -CF3. В некоторых вариантах осуществления  представляет собой одинарную связь, и оба R4a и R4b представляют собой галоген, например, фтор.
представляет собой одинарную связь, и оба R4a и R4b представляют собой галоген, например, фтор.
В некоторых вариантах осуществления, где  представляет собой одинарную связь, R4a представляет собой не-водородный заместитель в альфа-конфигурации. В некоторых вариантах осуществления, где
представляет собой одинарную связь, R4a представляет собой не-водородный заместитель в альфа-конфигурации. В некоторых вариантах осуществления, где  представляет собой одинарную связь, R4a представляет собой не-водородный заместитель в бета-конфигурации.
представляет собой одинарную связь, R4a представляет собой не-водородный заместитель в бета-конфигурации.
В некоторых вариантах осуществления  представляет собой двойную связь, и R4a представляет собой водород. В некоторых вариантах осуществления
представляет собой двойную связь, и R4a представляет собой водород. В некоторых вариантах осуществления  представляет собой двойную связь, и R4a представляет собой замещенный или незамещенный C1-6 алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил, или замещенный или незамещенный C5-6алкил. В некоторых вариантах осуществления
представляет собой двойную связь, и R4a представляет собой замещенный или незамещенный C1-6 алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил, или замещенный или незамещенный C5-6алкил. В некоторых вариантах осуществления  представляет собой двойную связь, и R4a представляет собой C1 алкил, например, -CH3 или -CF3. В некоторых вариантах осуществления
представляет собой двойную связь, и R4a представляет собой C1 алкил, например, -CH3 или -CF3. В некоторых вариантах осуществления  представляет собой двойную связь, и R4a представляет собой галоген, например, фтор.
представляет собой двойную связь, и R4a представляет собой галоген, например, фтор.
Группы A
Как в общем смысле определено в настоящем описании, A имеет формулу (A-1) или формулу (A-2)
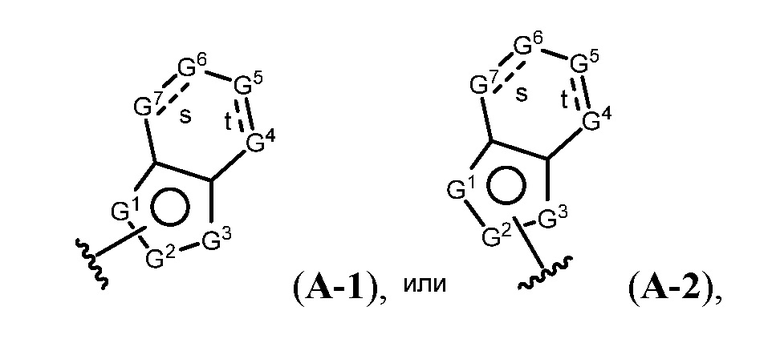
где:
точка присоединения находится в G1 или G2 в формуле (A-1) и точка присоединения находится в G2 или G3 в формуле (A-2);
G1 представляет собой N, NRN1, O, S, C или C-RG1, как позволяет валентность;
G2 представляет собой N, NRN2, O, S, C, -C=N- или C-RG2, как позволяет валентность;
G3 представляет собой N, NRN3, O, S, C или C-RG3, как позволяет валентность;
G4 представляет собой N, NRN4, C-RG4 или C-(RG4)2, как позволяет валентность;
G5 представляет собой N, NRN5, C-RG5 или C-(RG5)2, как позволяет валентность;
G6 представляет собой N, NRN6, C-RG6, или C-(RG6)2, как позволяет валентность; b
G7 представляет собой N, NRN7, C-RG7, или C-(RG7)2, как позволяет валентность;
в каждом случае RG1, RG2, RG3, RG4, RG5, RG6 и RG7 независимо представляет собой водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил;
в каждом случае RN2, RN4, RN5, RN6 и RN7 независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, или азотные защитные группы; и
в каждом случае RGA независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, кислород-защитную группу, если присоединен к кислороду, азот-защитную группу, если присоединен к азоту, или две RGA группы взяты с промежуточными атомами с образованием замещенного или незамещенного карбоциклического или гетероциклического кольца.
В некоторых вариантах осуществления G4 представляет собой N или NRN4, и/или G5 представляет собой N или NRN5, и/или G6 представляет собой N или NRN6, и/или G7 представляет собой N или NRN7; в некоторых вариантах осуществления A имеет формулу (A-1)  (A-1), где точка присоединения находится в G1 или G2. В некоторых вариантах осуществления A имеет формулу (A-1)
(A-1), где точка присоединения находится в G1 или G2. В некоторых вариантах осуществления A имеет формулу (A-1)  (A-1), где точка присоединения находится в G1. В некоторых вариантах осуществления A имеет формулу (A-1)
(A-1), где точка присоединения находится в G1. В некоторых вариантах осуществления A имеет формулу (A-1)  (A-1), где точка присоединения находится в G2. В некоторых вариантах осуществления A имеет формулу (A-2)
(A-1), где точка присоединения находится в G2. В некоторых вариантах осуществления A имеет формулу (A-2)  (A-2), где точка присоединения находится в G2 или G3. В некоторых вариантах осуществления A имеет формулу (A-2)
(A-2), где точка присоединения находится в G2 или G3. В некоторых вариантах осуществления A имеет формулу (A-2)  (A-2), где точка присоединения находится в G2. В некоторых вариантах осуществления A имеет формулу (A-2)
(A-2), где точка присоединения находится в G2. В некоторых вариантах осуществления A имеет формулу (A-2) 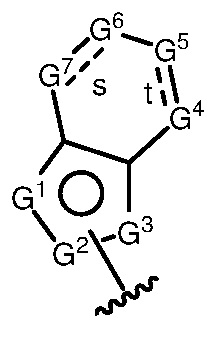 (A-2), где точка присоединения находится в G3. В некоторых вариантах осуществления A имеет одну из следующих формул:
(A-2), где точка присоединения находится в G3. В некоторых вариантах осуществления A имеет одну из следующих формул:  .
.
В некоторых вариантах осуществления A имеет одну из следующих формул:
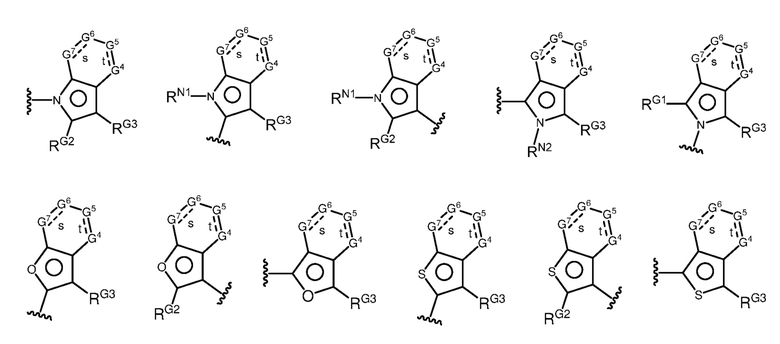

Как используется в настоящем описании,  представляет собой одинарную или двойную связь, как позволяет валентность. В некоторых вариантах осуществления связь s представляет собой двойную связь. В некоторых вариантах осуществления связь s представляет собой одинарную связь. В некоторых вариантах осуществления связь t представляет собой двойную связь. В некоторых вариантах осуществления связь t представляет собой одинарную связь.
представляет собой одинарную или двойную связь, как позволяет валентность. В некоторых вариантах осуществления связь s представляет собой двойную связь. В некоторых вариантах осуществления связь s представляет собой одинарную связь. В некоторых вариантах осуществления связь t представляет собой двойную связь. В некоторых вариантах осуществления связь t представляет собой одинарную связь.
В некоторых вариантах осуществления A имеет одну из следующих формул:

Как в общем смысле определено в настоящем описании, в каждом случае RG1 независимо представляет собой водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG1 представляет собой водород. В некоторых вариантах осуществления RG1 представляет собой галоген. В некоторых вариантах осуществления RG1 представляет собой F. В некоторых вариантах осуществления RG1 представляет собой Cl. В некоторых вариантах осуществления RG1 представляет собой Br. В некоторых вариантах осуществления RG1 представляет собой I. В некоторых вариантах осуществления RG1 представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG1 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RG1 представляет собой -CH2F, -CHF2 или -CF3. В некоторых вариантах осуществления RG1 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG1 представляет собой метил, этил, пропил, бутил, пентил или гексил. В некоторых вариантах осуществления RG1 представляет собой -CN. В некоторых вариантах осуществления RG1 представляет собой -NO2. В некоторых вариантах осуществления RG1 представляет собой замещенный или незамещенный карбоциклил, замещенный или незамещенный фенил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG1 представляет собой циклопропил или циклобутил. В некоторых вариантах осуществления RG1 представляет собой -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2 или -N(RGA)S(=O)2RGA. В некоторых вариантах осуществления RG1 представляет собой -NHRGA. В некоторых вариантах осуществления RG1 представляет собой -NH2. В некоторых вариантах осуществления RG1 представляет собой -NHRGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG1 представляет собой -NHRGA, где RGA представляет собой метил, этил или пропил. В некоторых вариантах осуществления RG1 представляет собой -N(RGA)2, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG1 представляет собой -N(CH3)RGA, где каждый RGA независимо представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG1 представляет собой -N(CH2CH3)RGA, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG1 представляет собой -ORGA. В некоторых вариантах осуществления RG1 представляет собой -OH. В некоторых вариантах осуществления RG1 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG1 представляет собой -O-метил, -O-этил или -O-пропил. В некоторых вариантах осуществления RG1 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный арил. В некоторых вариантах осуществления RG1 представляет собой -O-фенил.
Как в общем смысле определено в настоящем описании, в каждом случае RG2 представляет собой, независимо, водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG2 представляет собой водород. В некоторых вариантах осуществления RG2 представляет собой галоген. В некоторых вариантах осуществления RG2 представляет собой F. В некоторых вариантах осуществления RG2 представляет собой Cl. В некоторых вариантах осуществления RG2 представляет собой Br. В некоторых вариантах осуществления RG2 представляет собой I. В некоторых вариантах осуществления RG2 представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG2 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RG2 представляет собой -CH2F, -CHF2 или -CF3. В некоторых вариантах осуществления RG2 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG2 представляет собой метил, этил, пропил, бутил, пентил или гексил. В некоторых вариантах осуществления RG2 представляет собой -CN. В некоторых вариантах осуществления RG2 представляет собой -NO2. В некоторых вариантах осуществления RG2 представляет собой замещенный или незамещенный карбоциклил, замещенный или незамещенный фенил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG2 представляет собой циклопропил или циклобутил. В некоторых вариантах осуществления RG2 представляет собой -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2 или -N(RGA)S(=O)2RGA. В некоторых вариантах осуществления RG2 представляет собой -NHRGA. В некоторых вариантах осуществления RG2 представляет собой -NH2. В некоторых вариантах осуществления RG2 представляет собой -NHRGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG2 представляет собой -NHRGA, где RGA представляет собой метил, этил или пропил. В некоторых вариантах осуществления RG2 представляет собой -N(RGA)2, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG2 представляет собой -N(CH3)RGA, где каждый RGA независимо представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG2 представляет собой -N(CH2CH3)RGA, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG2 представляет собой -ORGA. В некоторых вариантах осуществления RG2 представляет собой -OH. В некоторых вариантах осуществления RG2 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG2 представляет собой -O-метил, -O-этил или -О-пропил. В некоторых вариантах осуществления RG2 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный арил. В некоторых вариантах осуществления RG2 представляет собой -O-фенил.
Как в общем смысле определено в настоящем описании, в каждом случае RG3 независимо представляет собой водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG3 представляет собой водород. В некоторых вариантах осуществления RG3 представляет собой галоген. В некоторых вариантах осуществления RG3 представляет собой F. В некоторых вариантах осуществления RG3 представляет собой Cl. В некоторых вариантах осуществления RG3 представляет собой Br. В некоторых вариантах осуществления RG3 представляет собой I. В некоторых вариантах осуществления RG3 представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG3 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RG3 представляет собой -CH2F, -CHF2 или -CF3. В некоторых вариантах осуществления RG3 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG3 представляет собой метил, этил, пропил, бутил, пентил или гексил. В некоторых вариантах осуществления RG3 представляет собой -CN. В некоторых вариантах осуществления RG3 представляет собой -NO2. В некоторых вариантах осуществления RG3 представляет собой замещенный или незамещенный карбоциклил, замещенный или незамещенный фенил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG3 представляет собой циклопропил или циклобутил. В некоторых вариантах осуществления RG3 представляет собой -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2 или -N(RGA)S(=O)2RGA. В некоторых вариантах осуществления RG3 представляет собой -NHRGA. В некоторых вариантах осуществления RG3 представляет собой -NH2. В некоторых вариантах осуществления RG3 представляет собой -NHRGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG3 представляет собой -NHRGA, где RGA представляет собой метил, этил или пропил. В некоторых вариантах осуществления RG3 представляет собой -N(RGA)2, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG3 представляет собой -N(CH3)RGA, где каждый RGA независимо представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG3 представляет собой -N(CH2CH3)RGA, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG3 представляет собой -ORGA. В некоторых вариантах осуществления RG3 представляет собой -OH. В некоторых вариантах осуществления RG3 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG3 представляет собой -O-метил, -O-этил или -O-пропил. В некоторых вариантах осуществления RG3 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный арил. В некоторых вариантах осуществления RG3 представляет собой -O-фенил.
Как в общем смысле определено в настоящем описании, в каждом случае RG4 независимо представляет собой водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG4 представляет собой водород. В некоторых вариантах осуществления RG4 представляет собой галоген. В некоторых вариантах осуществления RG4 представляет собой F. В некоторых вариантах осуществления RG4 представляет собой Cl. В некоторых вариантах осуществления RG4 представляет собой Br. В некоторых вариантах осуществления RG4 представляет собой I. В некоторых вариантах осуществления RG4 представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG4 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления R5 представляет собой -CH2F, -CHF2 или -CF3. В некоторых вариантах осуществления RG4 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG4 представляет собой метил, этил, пропил, бутил, пентил или гексил. В некоторых вариантах осуществления RG4 представляет собой -CN. В некоторых вариантах осуществления RG4 представляет собой -NO2. В некоторых вариантах осуществления RG4 представляет собой замещенный или незамещенный карбоциклил, замещенный или незамещенный фенил, замещенный или незамещенный гетероциклил, или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG4 представляет собой циклопропил или циклобутил. В некоторых вариантах осуществления RG4 представляет собой -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2 или -N(RGA)S(=O)2RGA. В некоторых вариантах осуществления RG4 представляет собой -NHRGA. В некоторых вариантах осуществления RG4 представляет собой -NH2. В некоторых вариантах осуществления RG4 представляет собой -NHRGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG4 представляет собой -NHRGA, где RGA представляет собой метил, этил или пропил. В некоторых вариантах осуществления RG4 представляет собой -N(RGA)2, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG4 представляет собой -N(CH3)RGA, где каждый RGA независимо представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG4 представляет собой -N(CH2CH3)RGA, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG4 представляет собой -ORGA. В некоторых вариантах осуществления RG4 представляет собой -OH. В некоторых вариантах осуществления RG4 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG4 представляет собой -O-метил, -O-этил, или -O-пропил. В некоторых вариантах осуществления RG4 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный арил. В некоторых вариантах осуществления RG4 представляет собой -O-фенил.
Как в общем смысле определено в настоящем описании, в каждом случае RG5 независимо представляет собой водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG5 представляет собой водород. В некоторых вариантах осуществления RG5 представляет собой галоген. В некоторых вариантах осуществления RG5 представляет собой F. В некоторых вариантах осуществления RG5 представляет собой Cl. В некоторых вариантах осуществления RG5 представляет собой Br. В некоторых вариантах осуществления RG5 представляет собой I. В некоторых вариантах осуществления RG5 представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG5 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления R5 представляет собой -CH2F, -CHF2 или -CF3. В некоторых вариантах осуществления RG5 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG5 представляет собой метил, этил, пропил, бутил, пентил или гексил. В некоторых вариантах осуществления RG5 представляет собой -CN. В некоторых вариантах осуществления RG5 представляет собой -NO2. В некоторых вариантах осуществления RG5 представляет собой замещенный или незамещенный карбоциклил, замещенный или незамещенный фенил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG5 представляет собой циклопропил или циклобутил. В некоторых вариантах осуществления RG5 представляет собой -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, или -N(RGA)S(=O)2RGA. В некоторых вариантах осуществления RG5 представляет собой -NHRGA. В некоторых вариантах осуществления RG5 представляет собой -NH2. В некоторых вариантах осуществления RG5 представляет собой -NHRGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG5 представляет собой -NHRGA, где RGA представляет собой метил, этил или пропил. В некоторых вариантах осуществления RG5 представляет собой -N(RGA)2, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG5 представляет собой -N(CH3)RGA, где каждый RGA независимо представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG5 представляет собой -N(CH2CH3)RGA, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG5 представляет собой -ORGA. В некоторых вариантах осуществления RG5 представляет собой -OH. В некоторых вариантах осуществления RG5 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG5 представляет собой -O-метил, -O-этил, или -O-пропил. В некоторых вариантах осуществления RG5 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный арил. В некоторых вариантах осуществления RG5 представляет собой -O-фенил.
Как в общем смысле определено в настоящем описании, в каждом случае RG6 независимо представляют собой водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG6 представляет собой водород. В некоторых вариантах осуществления RG6 представляет собой галоген. В некоторых вариантах осуществления RG6 представляет собой F. В некоторых вариантах осуществления RG6 представляет собой Cl. В некоторых вариантах осуществления RG6 представляет собой Br. В некоторых вариантах осуществления RG6 представляет собой I. В некоторых вариантах осуществления RG6 представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG6 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления R5 представляет собой -CH2F, -CHF2 или -CF3. В некоторых вариантах осуществления RG6 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG6 представляет собой метил, этил, пропил, бутил, пентил или гексил. В некоторых вариантах осуществления RG6 представляет собой -CN. В некоторых вариантах осуществления RG6 представляет собой -NO2. В некоторых вариантах осуществления RG6 представляет собой замещенный или незамещенный карбоциклил, замещенный или незамещенный фенил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG6 представляет собой циклопропил или циклобутил. В некоторых вариантах осуществления RG6 представляет собой -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, или -N(RGA)S(=O)2RGA. В некоторых вариантах осуществления RG6 представляет собой -NHRGA. В некоторых вариантах осуществления RG6 представляет собой -NH2. В некоторых вариантах осуществления RG6 представляет собой -NHRGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG6 представляет собой -NHRGA, где RGA представляет собой метил, этил или пропил. В некоторых вариантах осуществления RG6 представляет собой -N(RGA)2, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG6 представляет собой -N(CH3)RGA, где каждый RGA независимо представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG6 представляет собой -N(CH2CH3)RGA, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG6 представляет собой -ORGA. В некоторых вариантах осуществления RG6 представляет собой -OH. В некоторых вариантах осуществления RG6 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG6 представляет собой -O-метил, -O-этил или -O-пропил. В некоторых вариантах осуществления RG6 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный арил. В некоторых вариантах осуществления RG6 представляет собой -O-фенил.
Как в общем смысле определено в настоящем описании, в каждом случае RG7 независимо представляет собой водород, галоген, -NO2, -CN, -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2, -N(RGA)S(=O)2RGA, -S(=O)RGA, -S(=O)ORGA, -OS(=O)RGA, -S(=O)N(RGA)2, -N(RGA)S(=O)RGA, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG7 представляет собой водород. В некоторых вариантах осуществления RG7 представляет собой галоген. В некоторых вариантах осуществления RG7 представляет собой F. В некоторых вариантах осуществления RG7 представляет собой Cl. В некоторых вариантах осуществления RG7 представляет собой Br. В некоторых вариантах осуществления RG7 представляет собой I. В некоторых вариантах осуществления RG7 представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG7 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления R5 представляет собой -CH2F, -CHF2, или -CF3. В некоторых вариантах осуществления RG7 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG7 представляет собой метил, этил, пропил, бутил, пентил или гексил. В некоторых вариантах осуществления RG7 представляет собой -CN. В некоторых вариантах осуществления RG7 представляет собой -NO2. В некоторых вариантах осуществления RG7 представляет собой замещенный или незамещенный карбоциклил, замещенный или незамещенный фенил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероарил. В некоторых вариантах осуществления RG7 представляет собой циклопропил или циклобутил. В некоторых вариантах осуществления RG7 представляет собой -ORGA, -N(RGA)2, -C(=O)RGA, -C(=O)ORGA, -OC(=O)RGA, -OC(=O)ORGA, -C(=O)N(RGA)2, -N(RGA)C(=O)RGA, -OC(=O)N(RGA)2, -N(RGA)C(=O)ORGA, -S(=O)2RGA, -S(=O)2ORGA, -OS(=O)2RGA, -S(=O)2N(RGA)2 или -N(RGA)S(=O)2RGA. В некоторых вариантах осуществления RG7 представляет собой -NHRGA. В некоторых вариантах осуществления RG7 представляет собой -NH2. В некоторых вариантах осуществления RG7 представляет собой -NHRGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG7 представляет собой -NHRGA, где RGA представляет собой метил, этил или пропил. В некоторых вариантах осуществления RG7 представляет собой -N(RGA)2, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG7 представляет собой -N(CH3)RGA, где каждый RGA независимо представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RG7 представляет собой -N(CH2CH3)RGA, где каждый RGA независимо представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG7 представляет собой -ORGA. В некоторых вариантах осуществления RG7 представляет собой -OH. В некоторых вариантах осуществления RG7 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RG7 представляет собой -O-метил, -O-этил или -O-пропил. В некоторых вариантах осуществления RG7 представляет собой -ORGA, где RGA представляет собой замещенный или незамещенный арил. В некоторых вариантах осуществления RG7 представляет собой -O-фенил.
Как в общем смысле определено в настоящем описании, в каждом случае RN1 независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, или азотную защитную группу. В некоторых вариантах осуществления RN2 представляет собой водород. В некоторых вариантах осуществления RN2 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RN2 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RN2 представляет собой метил. В некоторых вариантах осуществления RN2 представляет собой этил. В некоторых вариантах осуществления RN2 представляет собой пропил. В некоторых вариантах осуществления RN2 представляет собой азотную защитную группу. В некоторых вариантах осуществления RN2 представляет собой Bn, BOC, Cbz, Fmoc, трифторацетил, трифенилметил или Ts.
Как в общем смысле определено в настоящем описании, в каждом случае RN2 независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, или азотную защитную группу. В некоторых вариантах осуществления RN2 представляет собой водород. В некоторых вариантах осуществления RN2 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RN2 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RN2 представляет собой метил. В некоторых вариантах осуществления RN2 представляет собой этил. В некоторых вариантах осуществления RN2 представляет собой пропил. В некоторых вариантах осуществления RN2 представляет собой азотную защитную группу. В некоторых вариантах осуществления RN2 представляет собой Bn, BOC, Cbz, Fmoc, трифторацетил, трифенилметил или Ts.
Как в общем смысле определено в настоящем описании, в каждом случае RN3 независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, или азотную защитную группу. В некоторых вариантах осуществления RN2 представляет собой водород. В некоторых вариантах осуществления RN2 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RN2 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RN2 представляет собой метил. В некоторых вариантах осуществления RN2 представляет собой этил. В некоторых вариантах осуществления RN2 представляет собой пропил. В некоторых вариантах осуществления RN2 представляет собой азотную защитную группу. В некоторых вариантах осуществления RN2 представляет собой Bn, BOC, Cbz, Fmoc, трифторацетил, трифенилметил или Ts.
Как в общем смысле определено в настоящем описании, в каждом случае RN4 независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, или азотную защитную группу. В некоторых вариантах осуществления RN4 представляет собой водород. В некоторых вариантах осуществления RN4 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RN4 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RN4 представляет собой метил. В некоторых вариантах осуществления RN4 представляет собой этил. В некоторых вариантах осуществления RN4 представляет собой пропил. В некоторых вариантах осуществления RN4 представляет собой азотную защитную группу. В некоторых вариантах осуществления RN4 представляет собой Bn, BOC, Cbz, Fmoc, трифторацетил, трифенилметил или Ts.
Как в общем смысле определено в настоящем описании, в каждом случае RN5 независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, или азотную защитную группу. В некоторых вариантах осуществления RN5 представляет собой водород. В некоторых вариантах осуществления RN5 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RN5 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RN5 представляет собой метил. В некоторых вариантах осуществления RN5 представляет собой этил. В некоторых вариантах осуществления RN5 представляет собой пропил. В некоторых вариантах осуществления RN5 представляет собой азотную защитную группу. В некоторых вариантах осуществления RN5 представляет собой Bn, BOC, Cbz, Fmoc, трифторацетил, трифенилметил или Ts.
Как в общем смысле определено в настоящем описании, в каждом случае RN6 независимо представляет собой водород, замещенный или незамещенный C1-6 алкил или азотную защитную группу. В некоторых вариантах осуществления RN6 представляет собой водород. В некоторых вариантах осуществления RN6 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RN6 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RN6 представляет собой метил. В некоторых вариантах осуществления RN6 представляет собой этил. В некоторых вариантах осуществления RN6 представляет собой пропил. В некоторых вариантах осуществления RN6 представляет собой азотную защитную группу. В некоторых вариантах осуществления RN6 is Bn, BOC, Cbz, Fmoc, трифторацетил, трифенилметил или Ts.
Как в общем смысле определено в настоящем описании, в каждом случае RN7 независимо представляет собой водород, замещенный или незамещенный C1-6 алкил или азотную защитную группу. В некоторых вариантах осуществления RN7 представляет собой водород. В некоторых вариантах осуществления RN7 представляет собой замещенный C1-6 алкил. В некоторых вариантах осуществления RN7 представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RN7 представляет собой метил. В некоторых вариантах осуществления RN7 представляет собой этил. В некоторых вариантах осуществления RN7 представляет собой пропил. В некоторых вариантах осуществления RN7 представляет собой азотную защитную группу. В некоторых вариантах осуществления RN7 представляет собой Bn, BOC, Cbz, Fmoc, трифторацетил, трифенилметил или Ts.
Как в общем смысле определено в настоящем описании, в каждом случае RGA независимо представляет собой водород, замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, замещенный или незамещенный C3-6 карбоциклил, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, кислород-защитную группу при прикреплении к кислороду, азотную защитную группу при прикреплении к азоту, или две группы RGA, взятые с промежуточными атомами с образованием замещенного или незамещенного гетероциклил или гетероарильного кольца. В некоторых вариантах осуществления RGA представляет собой водород. В некоторых вариантах осуществления RGA представляет собой замещенный или незамещенный C1-6 алкил, замещенный или незамещенный C2-6 алкенил, замещенный или незамещенный C2-6 алкинил, или замещенный или незамещенный C3-6 карбоциклил. В некоторых вариантах осуществления RGA представляет собой замещенный или незамещенный C1-6 алкил. В некоторых вариантах осуществления RGA представляет собой незамещенный C1-6 алкил. В некоторых вариантах осуществления RGA представляет собой метил, этил, пропил, бутил, пентил или гексил. В некоторых вариантах осуществления RGA представляет собой замещенный или незамещенный гетероциклил. В некоторых вариантах осуществления RGA представляет собой замещенный или незамещенный арил. В некоторых вариантах осуществления RGA представляет собой замещенный или незамещенный фенил. В некоторых вариантах осуществления RGA представляет собой азотную защитную группу. В некоторых вариантах осуществления RGA представляет собой кислород-защитную группу.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II),
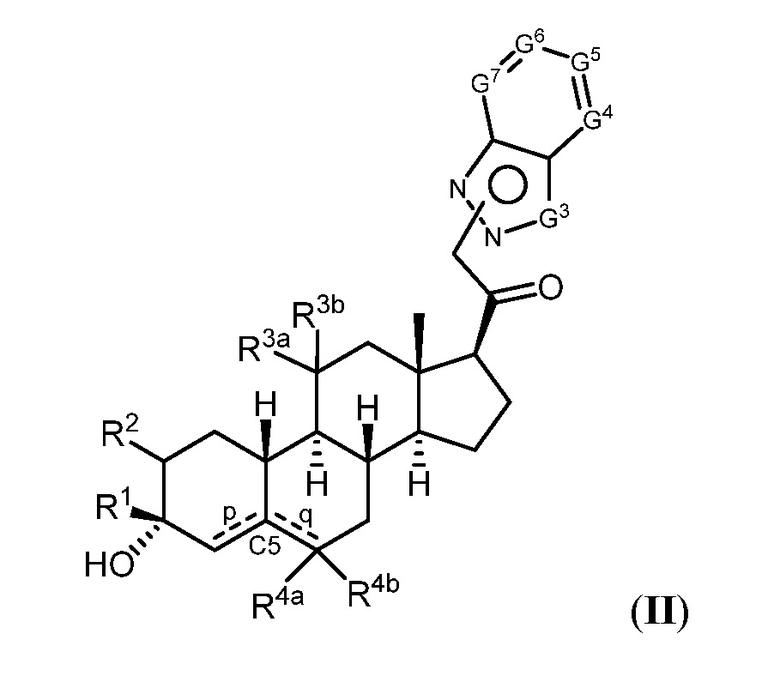
или его фармацевтически приемлемую соль. В некоторых вариантах осуществления точка присоединения в Формуле (II) находится в азоте в положении G1. В некоторых вариантах осуществления точка присоединения в Формуле (II) находится в азоте в положении G2.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II-a):

или его фармацевтически приемлемую соль. В некоторых вариантах осуществления точка присоединения в Формуле (II-a) находится в азоте в положении G1. В некоторых вариантах осуществления точка присоединения в Формуле (II-a) находится в азоте в положении G2.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение с одной из следующих формул:
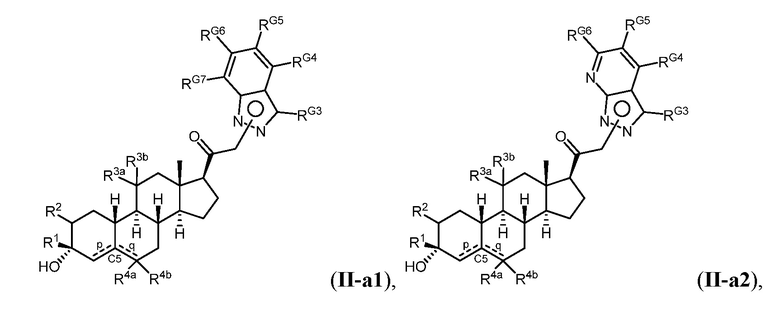
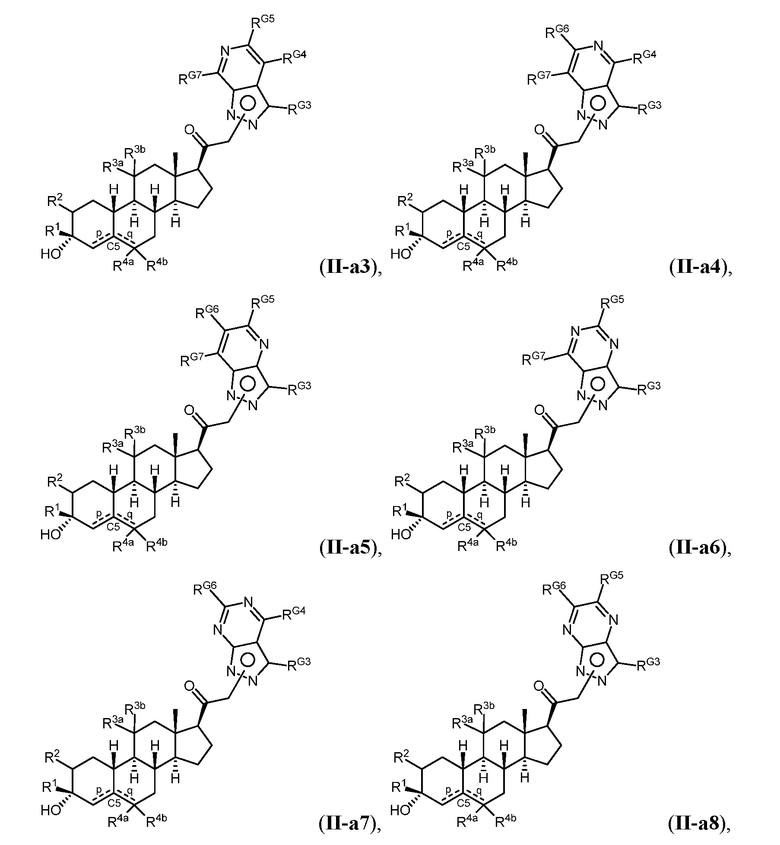
или его фармацевтически приемлемую соль. В некоторых вариантах осуществления точка присоединения в любой из формул (II-a1)-(II-a5) находится в азоте в положении G1. В некоторых вариантах осуществления точка присоединения в любой из формул (II-a1)-(II-a5) находится в азоте в положении G2.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение с одной из следующих формул:



или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (II-b):

или его фармацевтически приемлемую соль. В некоторых вариантах осуществления точка присоединения в любой формуле (II-b) находится в азоте в положении G1. В некоторых вариантах осуществления точка присоединения в любой формуле (II-b) находится в азоте в положении G2.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение с одной из следующих формул:
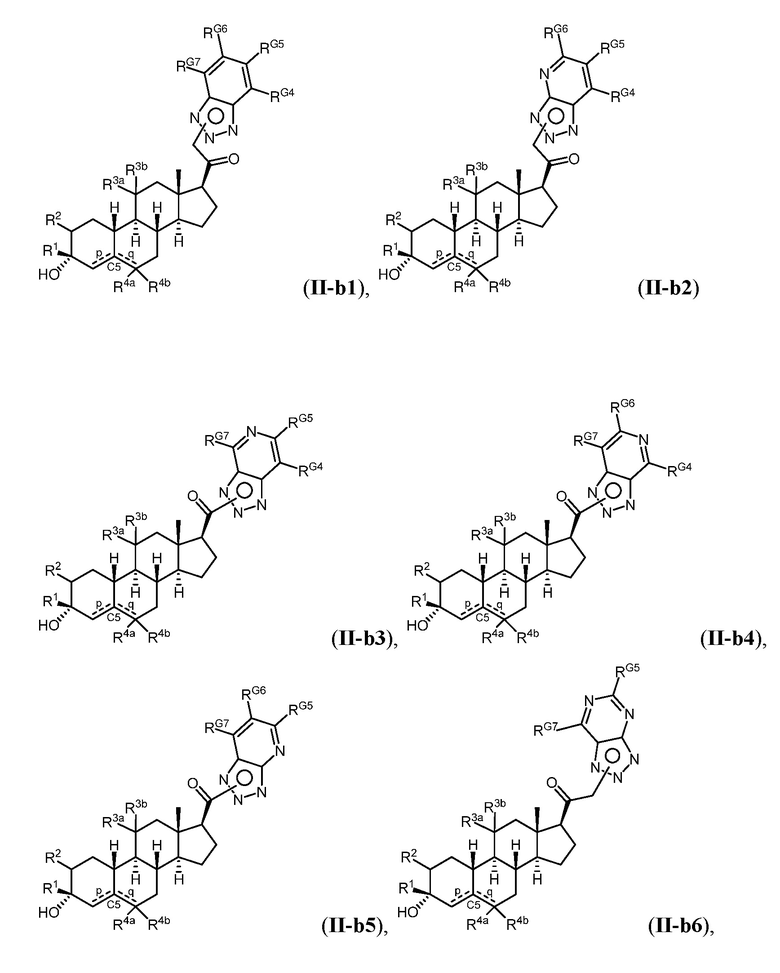

или его фармацевтически приемлемую соль. В некоторых вариантах осуществления точка присоединения в любой из формул (II-b1)-(II-b5) находится в азоте в положении G1. В некоторых вариантах осуществления точка присоединения в любой из формул (II-b1)-(II-b5) находится в азоте в положении G2.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение с одной из следующих формул:
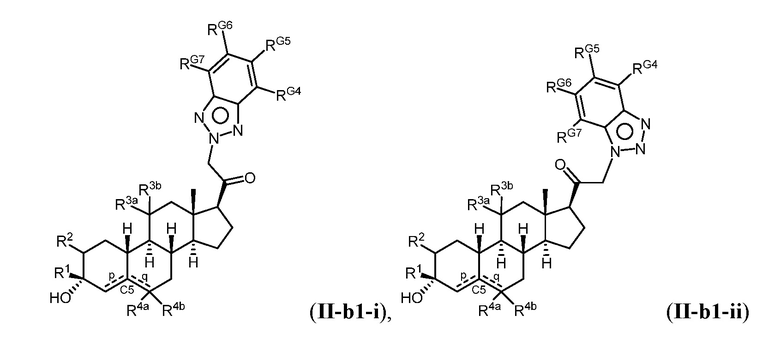

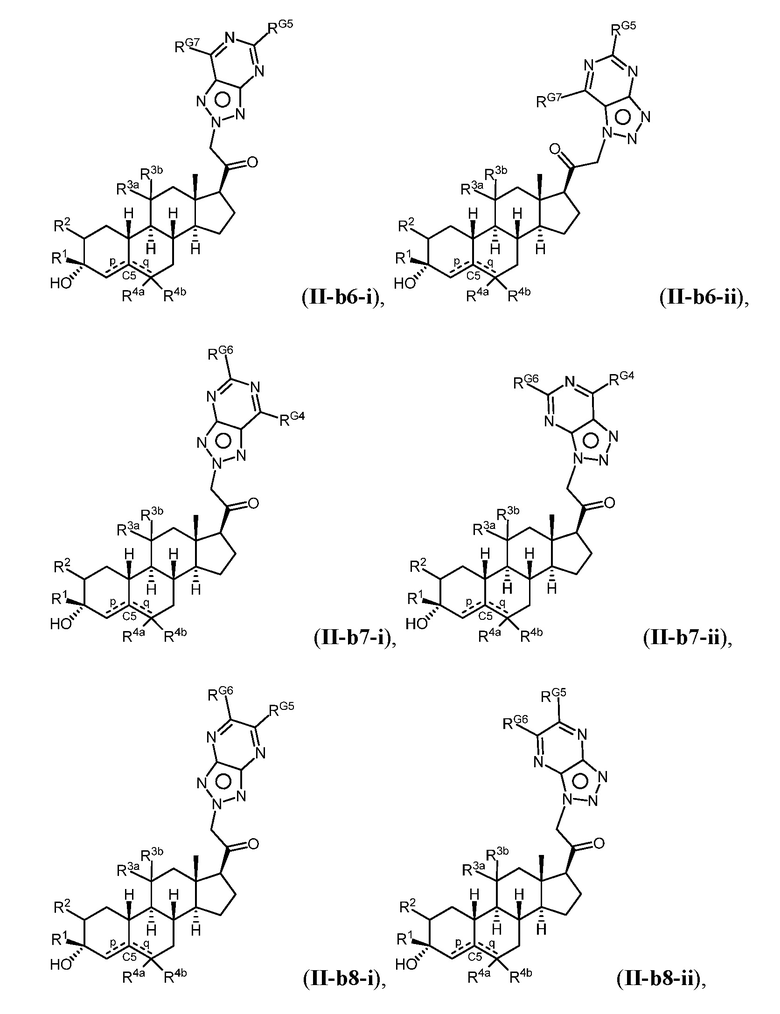
или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (III):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (III-a):
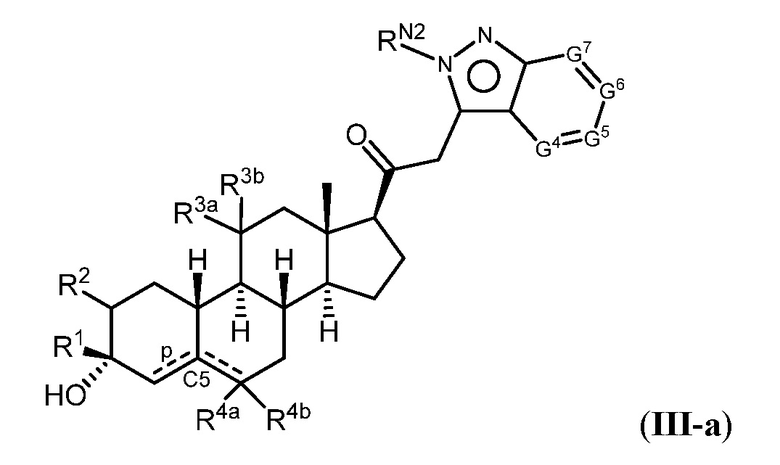
или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (III-b):
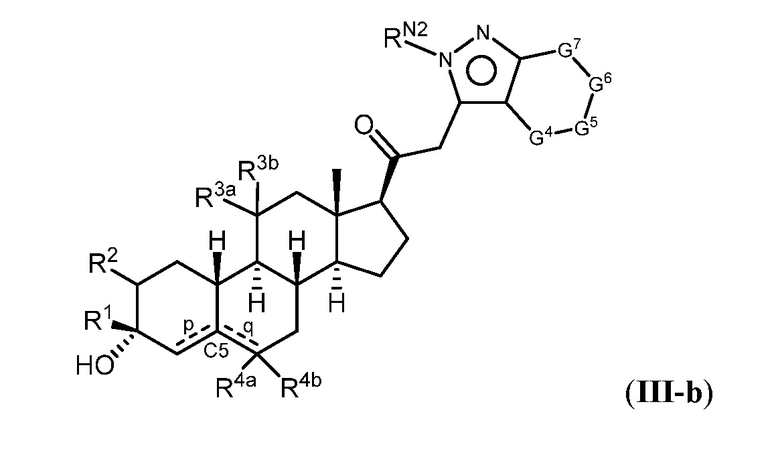
или его фармацевтически приемлемую соль.
В некоторых вариантах соединение формулы (I) представляет собой соединение формулы (III-b1):

или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (IV):
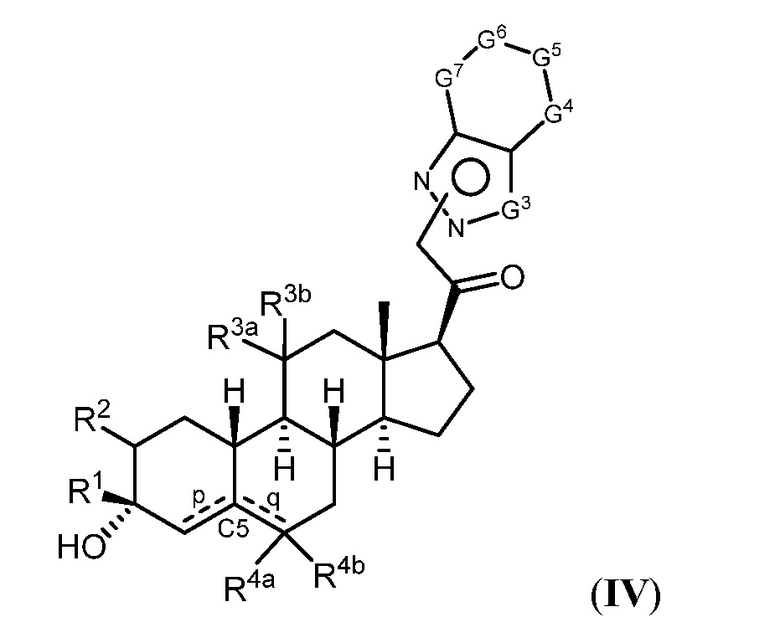
или его фармацевтически приемлемую соль. В некоторых вариантах осуществления точка присоединения в Формуле (IV) находится в азоте в положении G1. В некоторых вариантах осуществления точка присоединения в Формуле (IV) находится в азоте в положении G2.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (IV-a):

или его фармацевтически приемлемую соль. В некоторых вариантах осуществления точка присоединения в Формуле (IV-a) находится в азоте в положении G1. В некоторых вариантах осуществления точка присоединения в Формуле (IV-a) находится в азоте в положении G2.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (IV-a1):
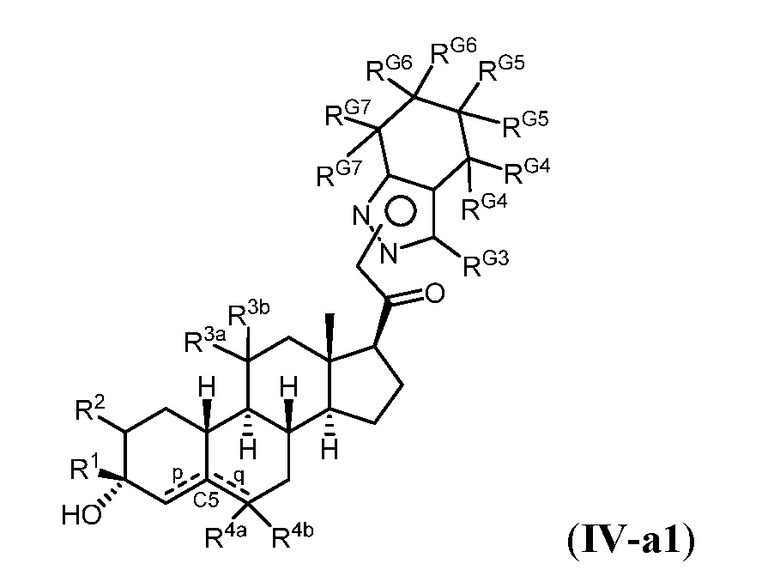
или его фармацевтически приемлемую соль. В некоторых вариантах осуществления точка присоединения в Формуле (IV-a1) находится в азоте в положении G1. В некоторых вариантах осуществления точка присоединения в Формуле (IV-a1) находится в азоте в положении G2.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение одной из следующих формул:
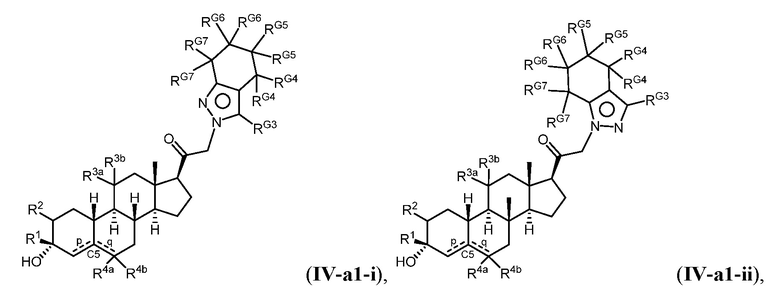
или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение одной из следующих формул:
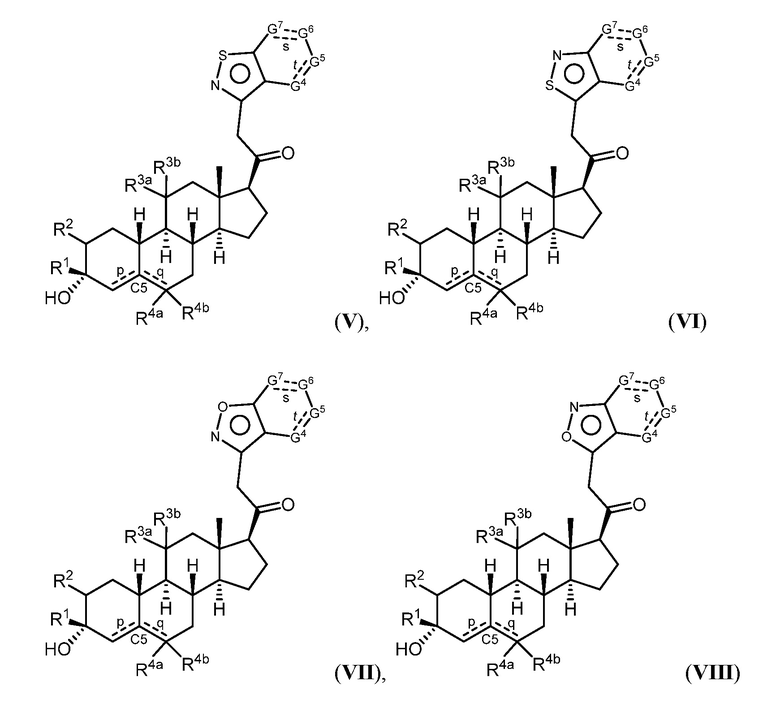

или его фармацевтически приемлемую соль.
Различные комбинации определенных вариантов осуществления дополнительно рассмотрены здесь.
Например, в некоторых вариантах осуществления, где R2 представляет собой водород или неводородный альфа-заместитель, изобретение относится к соединению формулы (I-A1), (I-B1), (I-C1) или (I-D1):

или к его фармацевтически приемлемой соли. В некоторых вариантах осуществления R1 представляет собой -CH3, -CH2CH3, -CH2F, -CHF2, -CF3, -CH2OCH3, или замещенный или незамещенный циклопропил. В некоторых вариантах осуществления R2 представляет собой -OH, -OCH3, -OCH2CH3, -OCH2CH2CH3, -CH3, -CH2CH3, -CH2CH2CH3, замещенный или незамещенный циклопропил, фтор или хлор. В некоторых вариантах осуществления R3a и R3b оба представляют собой водород. В некоторых вариантах осуществления R3a и R3b связаны с образованием =O (оксо). В некоторых вариантах осуществления, где кольцо B содержит C5-C6-двойную связь, R4a представляет собой водород, фтор, -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, и R4a и R4b представляют собой водород. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой фтор. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, R4a представляет собой неводородный заместитель и R4b представляет собой водород.
В некоторых вариантах осуществления, где R2 представляет собой водород или неводородный бета-заместитель, изобретение относится к соединению формулы (I-A2), (I-B2), (I-C2), или (I-D2):
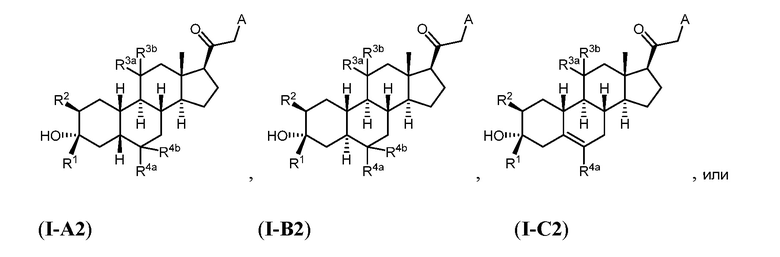
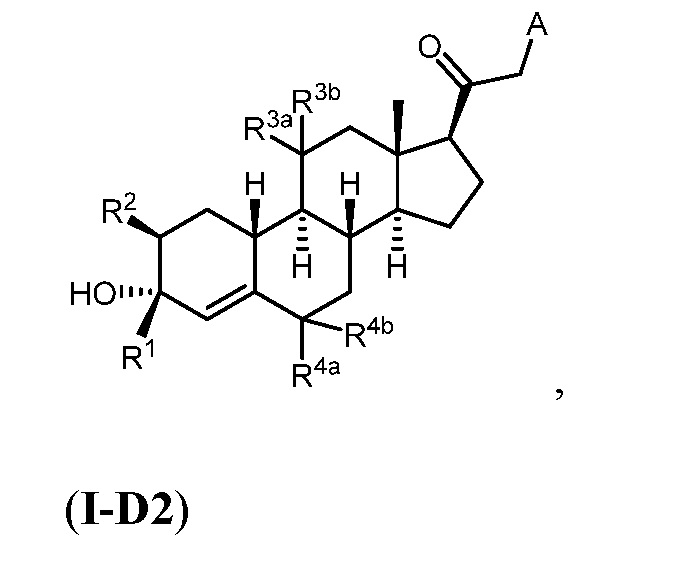
или к его фармацевтически приемлемой соли. В некоторых вариантах осуществления R1 представляет собой -CH3, -CH2CH3, -CH2F, -CHF2, -CF3, -CH2OCH3, или замещенный или незамещенный циклопропил. В некоторых вариантах осуществления R2 представляет собой -OH, -OCH3, -OCH2CH3, -OCH2CH2CH3, -CH3, -CH2CH3, -CH2CH2CH3, замещенный или незамещенный циклопропил, фтор или хлор. В некоторых вариантах осуществления оба R3a и R3b представляют собой водород. В некоторых вариантах осуществления R3a и R3b связаны с образованием =O (оксо). В некоторых вариантах осуществления, где кольцо B содержит C5-C6-двойную связь, R4a представляет собой водород, фтор, -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой водород. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой фтор. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, R4a представляет собой неводородный заместитель и R4b представляет собой водород.
В некоторых вариантах осуществления, где R3a представляет собой водород или неводородный альфа-заместитель и R3b представляет собой водород, изобретение относится к соединению формулы (I-A3), (I-B3), (I-C3) или (I-D3):
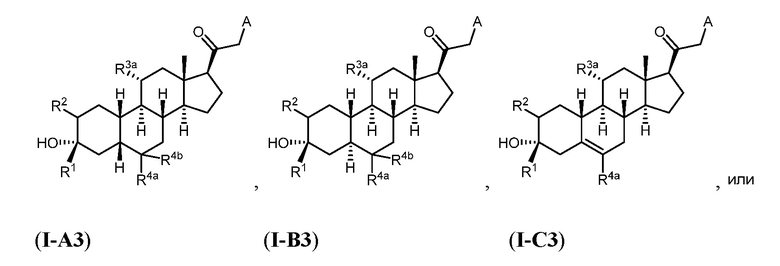

или к его фармацевтически приемлемой соли. В некоторых вариантах осуществления R1 представляет собой -CH3, -CH2CH3, -CH2F, -CHF2, -CF3, -CH2OCH3 или замещенный или незамещенный циклопропил. В некоторых вариантах осуществления R2 представляет собой -OH, -OCH3, -OCH2CH3, -OCH2CH2CH3, -CH3, -CH2CH3, -CH2CH2CH3, замещенный или незамещенный циклопропил, фтор или хлор. В некоторых вариантах осуществления R2 представляет собой неводородный заместитель в альфа-конфигурации. В некоторых вариантах осуществления R2 представляет собой неводородный заместитель в бета-конфигурации. В некоторых вариантах осуществления, где кольцо B содержит C5-C6-двойную связь, R4a представляет собой водород, фтор, -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой водород. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой фтор. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, R4a представляет собой неводородный заместитель и R4b представляет собой водород.
В некоторых вариантах осуществления, где R3a представляет собой водород или неводородный бета-заместитель, и R3b представляет собой водород, изобретение относится к соединению формулы (I-A4), (I-B4), (I-C4) или (I-D4):


или к его фармацевтически приемлемой соли. В некоторых вариантах осуществления R1 представляет собой -CH3, -CH2CH3, -CH2F, -CHF2, -CF3, -CH2OCH3 или замещенный или незамещенный циклопропил. В некоторых вариантах осуществления R2 представляет собой -OH, -OCH3, -OCH2CH3, -OCH2CH2CH3, -CH3, -CH2CH3, -CH2CH2CH3, замещенный или незамещенный циклопропил, фтор или хлор. В некоторых вариантах осуществления R2 представляет собой неводородный заместитель в альфа-конфигурации. В некоторых вариантах осуществления R2 представляет собой неводородный заместитель в бета-конфигурации. В некоторых вариантах осуществления, где кольцо B содержит C5-C6-двойную связь, R4a представляет собой водород, фтор, -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой водород. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляет собой -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляет собой фтор. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, R4a представляет собой неводородный заместитель и R4b представляет собой водород.
В некоторых вариантах осуществления, где R3a и R3b объединены с образованием оксогруппы, изобретение относится к соединению (I-A5), (I-B5), (I-C5), (I-D5):


или к его фармацевтически приемлемой соли. В некоторых вариантах осуществления R1 представляет собой -CH3, -CH2CH3, -CH2F, -CHF2, -CF3, -CH2OCH3, или замещенный или незамещенный циклопропил. В некоторых вариантах осуществления R2 представляет собой -OH, -OCH3, -OCH2CH3, -OCH2CH2CH3, -CH3, -CH2CH3, -CH2CH2CH3, замещенный или незамещенный циклопропил, фтор или хлор. В некоторых вариантах осуществления R2 представляет собой неводородный заместитель в альфа-конфигурации. В некоторых вариантах осуществления R2 представляет собой неводородный заместитель в бета-конфигурации. В некоторых вариантах осуществления, где кольцо B содержит C5-C6-двойную связь, R4a представляет собой водород, фтор, -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой водород. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой -CH3 или -CF3. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, оба R4a и R4b представляют собой фтор. В некоторых вариантах осуществления, где кольцо B не содержит C5-C6-двойную связь, R4a представляет собой неводородный заместитель и R4b представляет собой водород.
В некоторых вариантах осуществления, где R4a представляет собой неводородный заместитель, изобретение относится к соединению (I-A6) или (I-B6):
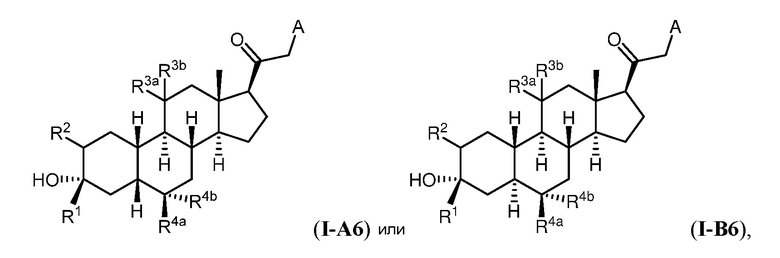
или к его фармацевтически приемлемой соли. В некоторых вариантах осуществления R1 представляет собой -CH3, -CH2CH3, -CH2F, -CHF2, -CF3, -CH2OCH3 или замещенный или незамещенный циклопропил. В некоторых вариантах осуществления R2 представляет собой -OH, -OCH3, -OCH2CH3, -OCH2CH2CH3, -CH3, -CH2CH3, -CH2CH2CH3, замещенный или незамещенный циклопропил, фтор или хлор. В некоторых вариантах осуществления R2 представляет собой неводородный заместитель в альфа-конфигурации. В некоторых вариантах осуществления R2 представляет собой неводородный заместитель в бета-конфигурации. В некоторых вариантах осуществления R3a и R3b представляют собой оба водород. В некоторых вариантах осуществления R3a и R3b связаны с образованием =O (оксо). В некоторых вариантах осуществления R4a представляет собой фтор, -CH3, или -CF3 и R4b представляет собой водород. В некоторых вариантах осуществления R4b представляет собой фтор, -CH3, или -CF3 и R4a представляет собой водород. В некоторых вариантах осуществления оба R4a и R4b представляют -CH3 или -CF3. В некоторых вариантах осуществления оба R4a и R4b представляют собой фтор.
В некоторых вариантах осуществления соединение формулы (I) выбрано из группы, состоящей из


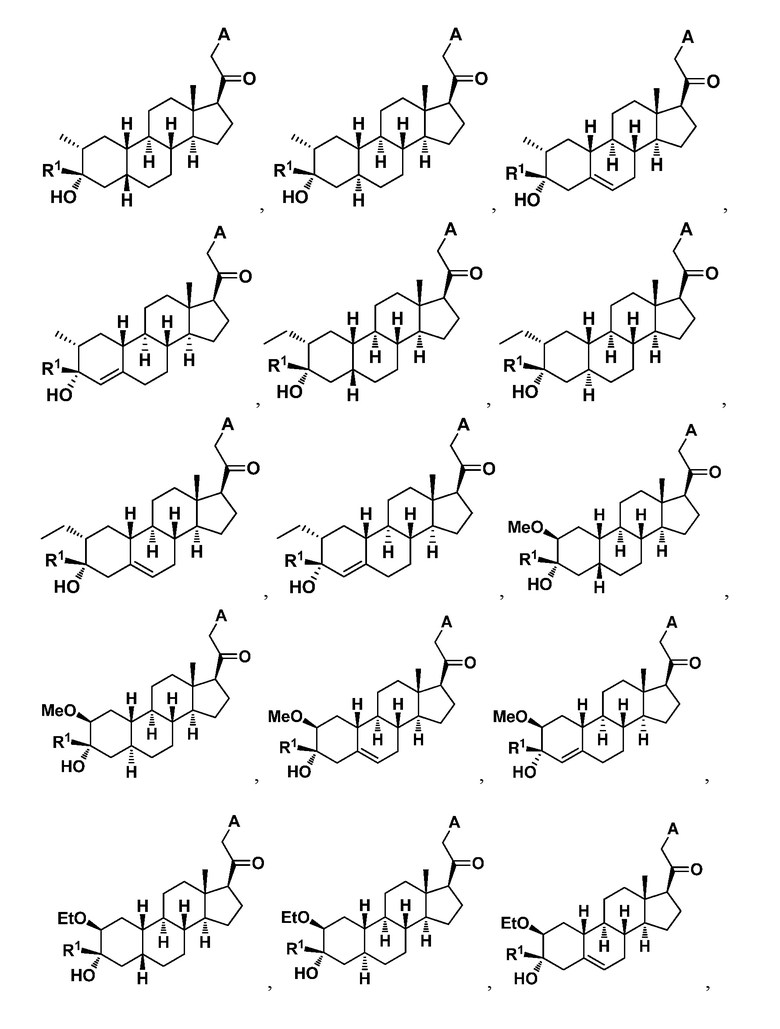

 , или их фармацевтически приемлемых солей.
, или их фармацевтически приемлемых солей.
В некоторых вариантах осуществления соединение формулы (I) выбрано из группы, состоящей из:
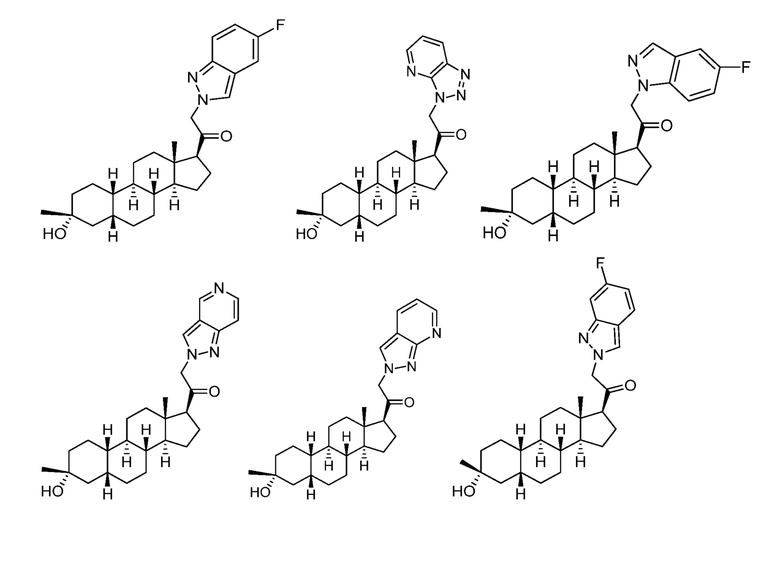
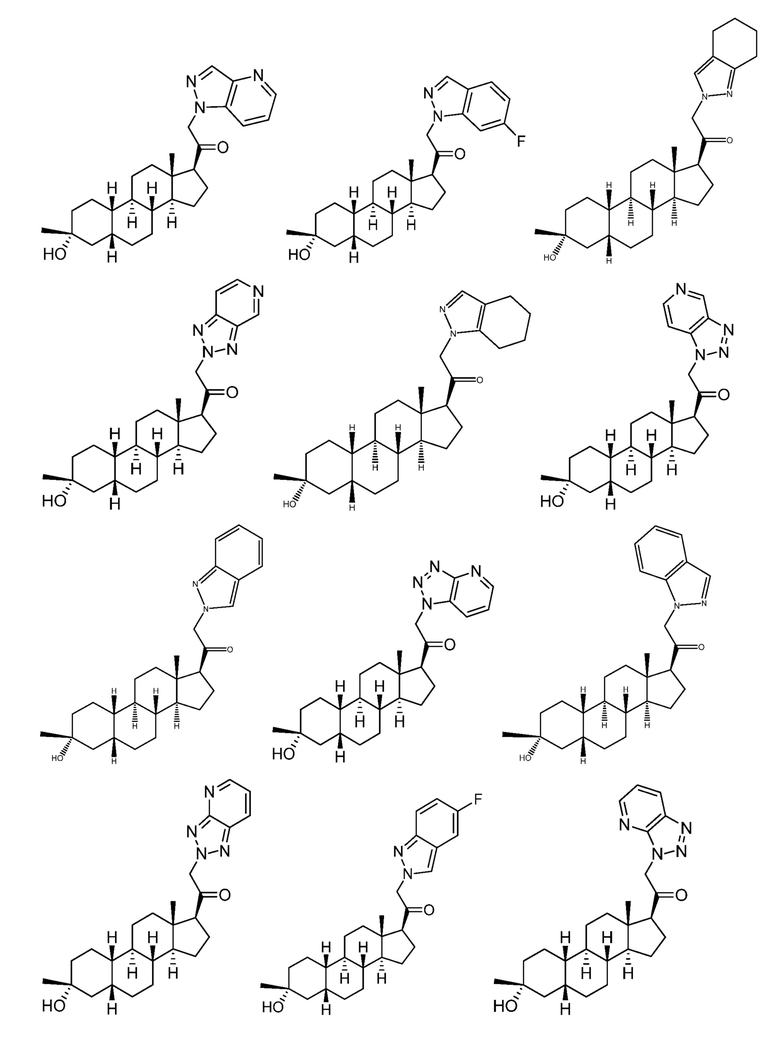

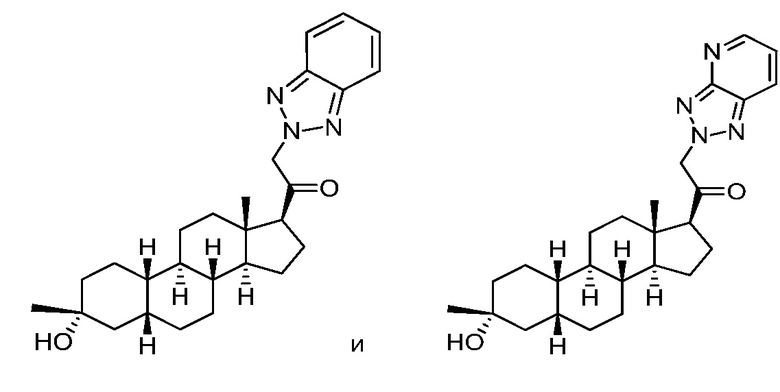 , или их фармацевтически приемлемых солей.
, или их фармацевтически приемлемых солей.
Фармацевтические композиции
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению (также упоминается как "активный ингредиент") и фармацевтически приемлемый наполнитель. В некоторых вариантах осуществления фармацевтическая композиция содержит эффективное количество активного ингредиента. В некоторых вариантах осуществления фармацевтическая композиция содержит терапевтически эффективное количество активного ингредиента. В некоторых вариантах осуществления фармацевтическая композиция содержит профилактически эффективное количество активного ингредиента.
Фармацевтические композиции, предлагаемые в настоящем описании, могут быть введены различными путями, включая, но ими не ограничиваясь, пероральное (энтерального) введение, парентеральное (в виде инъекции) введение, ректальное введение, чрескожное введение, внутрикожное введение, интратекальное введение, подкожное (SC) введение, внутривенное (IV) введение, внутримышечное (IM) введение и интраназальное введение.
Обычно соединения, представленные в настоящем описании, вводят в эффективном количестве. Количество фактически вводимого соединения обычно будет определяться врачом, с учетом соответствующих обстоятельств, включая подвергаемое лечению состояние, выбранный путь введения, фактически вводимое соединение, возраст, вес и реакцию конкретного пациента, тяжесть симптомов пациента и тому подобное.
При использовании для профилактики возникновения нарушений, связанных c ЦНС, представленные в настоящем описании соединения следует вводить индивиду, имеющему риск развития этого заболевания, как правило, по рекомендации и под наблюдением врача, с уровнями доз, описанными выше. Индивиды с риском развития конкретного состояния, как правило, включают тех, которые имеют семейный анамнез состояния, или тех, которые были идентифицированы путем генетического тестирования или скрининга как особенно восприимчивые к развитию заболевания.
Фармацевтические композиции, представленные в настоящем описании, также можно вводить в течение длительного времени (“длительное введение”). Длительное введение относится к введению соединения или его фармацевтической композиции в течение длительного периода времени, например, в течение 3 месяцев, 6 месяцев, 1 года, 2 лет, 3 лет, 5 лет и т.д., или может продолжаться бесконечно, например, в течение оставшегося периода жизни индивида. В некоторых вариантах осуществления длительное введение требуется, чтобы обеспечить постоянный уровень соединения в крови, например, в терапевтическом окне в течение длительного периода времени.
Фармацевтические композиции по настоящему изобретению могут дополнительно доставляться с использованием различных методов дозирования. Например, в некоторых вариантах осуществления фармацевтическая композиция может быть представлена в виде болюса, например, для того, чтобы повысить концентрацию соединения в крови на эффективном уровне. Размещение болюсной дозы зависит от желаемых системных уровней активного ингредиента по всему организму, например, внутримышечная или подкожная болюсная доза дает возможность медленного высвобождения активного ингредиента, в то время как болюс, доставляемый непосредственно в вену (например, через капельницу), дает возможность намного более быстрой доставки, которая быстро повышает концентрацию активного ингредиента в крови на эффективном уровне. В других вариантах осуществления фармацевтическую композицию можно вводить в виде непрерывной инфузии, например, при помощи капельницы, для обеспечения поддержания стабильной концентрации активного ингредиента в организме индивида. Кроме того, в других вариантах осуществления фармацевтическую композицию можно вводить сначала в виде болюсной дозы, с последующей непрерывной инфузией.
Композиции для перорального введения могут принимать форму нерасфасованных жидких растворов или суспензий, или сыпучих порошков. Однако гораздо чаще композиции представляют в виде единичных дозированных форм для облегчения точного дозирования. Термин "единичные дозированные формы" относится к физически дискретным единицам, подходящим в качестве единичных доз для людей и других млекопитающих, причем каждая единица содержит заданное количество активного вещества, рассчитанное для получения требуемого терапевтического эффекта, в сочетании с подходящим фармацевтическим эксципиентом. Типичные единичные дозированные формы включают предварительно заполненные, предварительно отмеренные ампулы или шприцы жидких композиций или пилюли, таблетки, капсулы или тому подобное в случае твердых композиций. В таких композициях, соединение обычно представляет собой компонент, содержащийся в меньших количествах (от приблизительно 0,1 до приблизительно 50% масс., или предпочтительно от приблизительно 1 до приблизительно 40% масс.), а остальное количество составляют различные растворители или эксципиенты и вспомогательные вещества, используемые в производственном процессе, полезные для получения требуемой лекарственной формы.
Для перорального введения, от одной до пяти и, особенно, от двух до четырех и обычно три пероральные дозы в день представляют собой типичные схемы введения. С использованием этих схем введения, каждая доза обеспечивает от приблизительно 0,01 до приблизительно 20 мг/кг соединения по настоящему изобретению, при этом предпочтительные дозы, каждая обеспечивает от приблизительно 0,1 до приблизительно 10 мг/кг и особенно от приблизительно 1 до приблизительно 5 мг/кг.
Трансдермальные дозы, как правило, выбирают так, чтобы обеспечить подобные или более низкие уровни в крови, чем те, которые достигаются с использованием доз, вводимых путем инъекции, обычно в количестве от приблизительно 0,01 до приблизительно 20% масс., предпочтительно, от приблизительно 0,1 до приблизительно 20% масс., предпочтительно, от приблизительно 0,1 до приблизительно 10% масс. и, более предпочтительно, от приблизительно 0,5 до приблизительно 15% масс.
Уровни доз для инъекций находятся в интервале от приблизительно 0,1 мг/кг/час до по меньшей мере 10 мг/кг/час, все на период времени от около 1 до около 120 часов, и особенно от 24 до 96 часов. Обеспечивающий предварительную нагрузку болюс от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг или больше также можно вводить для достижения адекватных стационарных уровней концентрации. Максимальная общая доза не должна превышать около 2 г/день для пациента, представляющего собой человека с массой тела 40-80 кг.
Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный носители с буферами, суспендирующими и диспергирующими агентами, красителями, ароматизаторами и тому подобное. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений подобной природы: связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; вещество, повышающее скольжение, такое как коллоидный диоксид кремния; подслащивающий агент, такой как сахароза или сахарин; или ароматизирующий агент, такой как мята перечная, метилсалицилат или апельсиновый ароматизатор.
Инъецируемые композиции обычно имеют в качестве основы инъецируемый стерильный физиологический раствор или забуференный фосфатом физиологический раствор или другие инъецируемые носители, известные в данной области. Как выше указывалось, активное соединение в таких композициях обычно является минорным компонентом, часто в количестве, составляющим от 0,05 до 10% масс., причем остальное количество составляет инъецируемый носитель и тому подобное.
Трансдермальные композиции обычно готовят в форме мази или крема, содержащих активный ингредиент(ы), для местного нанесения. При приготовлении в виде мази, активные ингредиенты, как правило, будут объединены с парафиновой или смешиваемой с водой мазевой основой. Альтернативно, активные ингредиенты могут быть приготовлены в виде крема, например, с кремовой основой масло-в-воде. Такие чрескожные составы хорошо известны в данной области и как правило содержат дополнительные ингредиенты для повышения кожного проникновения устойчивых активных ингредиентов или состава. Все такие известные чрескожные составы и ингредиенты включены в объем настоящего изобретения.
Соединение по настоящему изобретению можно также вводить путем чрескожного приспособления. Соответственно, чрескожное введение можно осуществить с использованием пластыря либо типа резервуара, либо пористой мембраны, или типа твердых матриц.
Вышеописанные компоненты для перорально вводимых, инъецируемых или местно вводимых композиций даны только в качестве примеров. Дополнительные материалы, а также способы получения композиций и тому подобное изложены в части 8 справочника Remington’s Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, который включен в настоящее описани в качестве ссылки.
Соединение по настоящему изобретению можно также вводить в виде форм замедленного высвобождения или систем доставки лекарственного препарата с замедленным высвобождением. Описание репрезентативных веществ для замедленного высвобождения можно найти в Remington's Pharmaceutical Sciences.
Настоящее изобретение также относится к фармацевтически приемлемым составам соединения по настоящему изобретению. В одном из вариантов осуществления состав содержит воду. В другом варианте осуществления состав содержит производное циклодекстрина. Наиболее типичные циклодекстрины представляют собой α-, β- и γ-циклодекстрины, состоящие из 6, 7 и 8 α-l,4-связанных глюкозных звеньев, соответственно, необязательно содержащие один или несколько заместителей на связанных сахарных звеньях, которые включают, но ими не ограничиваются, метилированное, гидроксиалкилированное, ацилированное и сульфоалкилэфирное замещение. В некоторых вариантах осуществления циклодекстрин представляет собой сульфоалкиловый эфир β-циклодекстрина, например, для примера, сульфобутиловый эфира β-циклодекстрина, также известный как Captisol®. См., например, США 5376645. В некоторых вариантах осуществления состав содержит гексапропил-β-циклодекстрин (например, 10-50% в воде).
Настоящее изобретение также относится к фармацевтически приемлемой кислотно-аддитивной соли соединения по настоящему изобретению. Кислота, которую можно использовать для получения фармацевтически приемлемой соли, представляет собой такую, которая образует нетоксичные кислотно-аддитивные соли, то есть соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидройодид, гидробромид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат, сукцинат, малеат, фумарат, бензоат, пара-толуолсульфонат, и тому подобные.
Следующие примеры составов иллюстрируют типичные фармацевтические композиции, которые могут быть получены в соответствии с настоящим изобретением. Настоящее изобретение, однако, не ограничивается следующими фармацевтическими композициями.
Примерный состав 1 - Таблетки: Соединение по настоящему изобретению может быть смешано в виде сухого порошка со связывающим веществом из сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества добавляют минорное количество стеарата магния. Смесь формуют в таблетки по 240-270 мг (80-90 мг активного соединения на таблетку) в таблеточном прессе.
Примерный состав 2 - Капсулы: Соединение по настоящему изобретению может быть смешано в виде сухого порошка с разбавителем из крахмала в массовом соотношении приблизительно 1:1. Данной смесью заполняют капсулы по 250 мг (125 мг активного соединения на капсулу).
Примерный состав 3 - Жидкость: Соединение по настоящему изобретению (125 мг) можно смешать с сахарозой (1,75 г) и ксантановой смолой (4 мг) и полученную смесь можно перемешать, пропустить через сито № 10 меш США, а затем смешать с предварительно приготовленным раствором микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия (11:89, 50 мг) в воде. Бензоат натрия (10 мг), вкусовое вещество и краситель разбавляли водой и добавляли при перемешивании. Затем добавляли достаточное количество воды для получения общего объема 5 мл.
Примерный состав 4 - Таблетки: Соединение по настоящему изобретению может быть смешано в виде сухого порошка со связывающим веществом из сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества добавляют минорное количество стеарата магния. Смесь формуют в таблетки по 450-900 мг (150-300 мг активного соединения) в таблеточном прессе.
Примерный состав 5 - Инъекция: Соединение по настоящему изобретению можно растворить или суспендировать в забуференной стерильной солевой водной среде для инъекций в концентрации приблизительно 5 мг/мл.
Примерный состав 6 - Таблетки: Соединение по настоящему изобретению может быть смешано в виде сухого порошка со связывающим веществом из сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества добавляют минорное количество стеарата магния. Смесь формуют в таблетки по 90-150 мг (30-50 мг активного соединения на таблетку) в таблеточном прессе.
Примерный состав 7 - Таблетки: Соединение по настоящему изобретению может быть смешано в виде сухого порошка со связывающим веществом из сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества добавляют минорное количество стеарата магния. Смесь формуют в таблетки по 30-90 мг (10-30 мг активного соединения на таблетку) в таблеточном прессе.
Примерный состав 8 - Таблетки: Соединение по настоящему изобретению может быть смешано в виде сухого порошка со связывающим веществом из сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества добавляют минорное количество стеарата магния. Смесь формуют в таблетки по 0,3-30 мг (0,1-10 мг активного соединения на таблетку) в таблеточном прессе.
Примерный состав 9 - Таблетки: Соединение по настоящему изобретению может быть смешано в виде сухого порошка со связывающим веществом из сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества добавляют минорное количество стеарата магния. Смесь формуют в таблетки по 150-240 мг (50-80 мг активного соединения на таблетку) в таблеточном прессе.
Примерный состав 10 - Таблетки: Соединение по настоящему изобретению может быть смешано в виде сухого порошка со связывающим веществом из сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества добавляют минорное количество стеарата магния. Смесь формуют в таблетки по 270-450 мг (90-150 мг активного соединения на таблетку) в таблеточном прессе.
Способы применения и лечения
Как описано в настоящем описании, настоящее изобретение направлено на разработку С21-замещенных нейроактивных стероидов, например, для действия в качестве модуляторов ГАМК. В некоторых вариантах осуществления эти соединения предусматриваются для использования в качестве терапевтических средств для индукции анестезии и/или седативного эффекта у индивида. В некоторых вариантах осуществления настоящего изобретения эти соединения предусматриваются для использования в качестве терапевтических средств для лечения нарушений, связанных с ЦНС (например, нарушение сна, расстройство настроения, расстройства шизофренического спектра, судорожное расстройство, расстройство памяти и/или когнитивные расстройства, нарушение движений, расстройство личности, расстройства аутистического спектра, боль, травматическое повреждение головного мозга, сосудистые заболевания, наркотическая зависимость и токсикомания и/или абстинентный синдром, или шум в ушах) у индивида, при необходимости (например, индивид с синдромом Ретта, с синдромом хрупкой Х-хромосомы или с синдромом Ангельмана).
Таким образом, в одном из аспектов настоящее изобретение относится к способу индукции седативного эффекта и/или анестезии у пациента, включающему введение индивиду эффективного количества соединения по настоящему изобретению или его композиции. В некоторых вариантах осуществления соединение вводят путем внутривенного введения.
Более ранние исследования (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987)) показали, что определенные 3α-гидроксилированные стероиды на несколько порядков более активны в качестве модуляторов комлекса рецептора GABA (GRC), чем другие, ранее описанные (см., например, Majewska et al., Science 232:1004-1007 (1986); Harrison et al., J Pharmacol. Exp. Ther. 241:346-353 (1987)). Majewska et al. и Harrison et al. показали, что 3α-гидроксилированные-5-восстановленные стероиды способны только на значительно более низкие уровни эффективности. Экспериментальные данные in vitro и in vivo показали, что высокая активность этих стероидов обуславливает их терапевтическое использование для модуляции возбудимости головного мозга через GRС (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987); Wieland et al., Psychopharmacology 118(l):65-71 (1995)).
Различные синтетические стероиды были получены как нейроактивные стероиды. См., например, патент США 5232917, который описывает нейроактивные стероидные соединения, применяемые для лечения стресса, состояния тревоги, бессоницы, эпилептических нарушений и нарушений настроения, поддающихся воздействию средств, активных в отношении GRC, таких как депрессия, терапевтически благоприятным образом. Далее, ранее было показано, что эти стероиды взаимодействуют с уникальным участком на GRC, который отличается от других известных участков взаимодействия (т.е. барбитураты, бензодиазепины и ГАМК), для которых ранее установлены терапевтически благоприятные воздействия на стресс, состояние тревоги, сон, нарушения настроения и эпилептические нарушения (см. например, Gee, K.W. and Yamamura, H.I., “Benzodiazepines and Barbiturates: Drugs for the Treatment of Anxiety, Insomnia and Seizure Disorders,” in Central Nervous System Disorders, Horvell, ed., Marcel-Dekker, New York (1985), pp. 123-147; Lloyd, K.G. and Morselli, P.L., “Psychopharmacology of GABAergic Drugs,” in Psychopharmacology: The Third Generation of Progress, H.Y. Meltzer, ed., Raven Press, N.Y. (1987), pp. 183-195; and Gee et al., European Journal of Pharmacology, 136:419-423 (1987). Эти соединения являются желательными вследствие продолжительности их действия, эффективности и активности при пероральном применении (наряду с другими формами введения).
Соединения по настоящему изобретению, описанные в настоящем описании, в основном, предназначены для модуляции функции ГАМК, и, следовательно, для действия в качестве нейроактивных стероидов для лечения и профилактики нарушений, связанных с ЦНС, у индивида. Модуляция, как используется в настоящем описании, относится к ингибированию или потенцированию функции ГАМК рецептора. Соответственно, соединения и фармацевтические композиции, представленные в настоящей заявке, могут использоваться в качестве терапевтических средств для профилактики и/или лечения заболеваний ЦНС у млекопитающих, включая человека и других млекопитающих. Таким образом, и как было указано выше, настоящее изобретение включает в свой объем и распространяется на перечисленные способы лечения, а также на соединения для таких способов, а также на применение таких соединений для получения лекарственных средств, пригодных для таких способов.
Примеры заболеваний ЦНС, связанных с модуляцией ГАМК, включают, но ими не ограничиваются, нарушения сна [например, инсомния], нарушения настроения [например, депрессия, дистимическое расстройство (например, легкая степень депрессии), биполярные расстройства (например, I и/или II), тревожные расстройства (например, генерализованное тревожное расстройство (GAD), социальная фобия), стрессы, посттравматическое стрессовое расстройство (PTSD), компульсивные расстройства (например, обсессивно-компульсивное расстройство (OCD))], расстройства шизофренического спектра [например, шизофрения, шизоаффективное расстройство], судорожные расстройства [например, эпилепсия (например, эпилептический статус (SE)), судорожные припадки], нарушения памяти и/или когнитивной способности [например, расстройства внимания (например, синдром дефицита внимания и гиперактивности (ADHD)), деменция (например, деменция при болезни Альцгеймера, деменция телец Леви, сосудистая деменция], нарушения движений [например, болезнь Гентингтона, болезнь Паркинсона], расстройства личности [например, антисоциальное расстройство личности, обсессивно-компульсивное расстройство личности], расстройства аутистического спектра (ASD) [например, аутизм, моногенетические причины аутизма, такие как синаптопатические, например, синдром Ретта, синдром хрупкой Х-хромосомы, синдром Ангельмана], боль [например, невропатическая боль, болевые синдромы, связанные с повреждениями, острая боль, хроническая боль], черепно-мозговую травму (TBI), сосудистые заболевания [например, инсульт, ишемия, сосудистая патология], расстройства, связанные со злоупотреблением психоактивными веществами и/или абстинентный синдром [например, привыкание к опиатам, кокаину и/или алкоголю], и шум в ушах.
В еще одном аспекте изобретение относится к комбинации соединения по настоящему изобретению и другого фармакологически активного агента. Соединения, представленные в настоящем документе, можно вводить в виде единственного активного агента, или они могут быть введены в комбинации с другими агентами. Введение в комбинации может осуществляться любым способом, очевидным для специалиста в данной области, включая, например, раздельное введение, последовательное введение, параллельное введение и введение в чередующемся порядке.
В другом аспекте изобретение относится к способу лечения или профилактики возбудимости головного мозга у индивида, восприимчивого к или имеющего заболевание, связанное с возбудимостью головного мозга, включающему введение индивиду эффективного количества соединения по настоящему изобретению индивиду.
В еще одном аспекте изобретение относится к способу лечения или профилактики стресса или тревоги у индивида, включающему введение индивиду, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению или его композиции.
В еще одном аспекте изобретение относится к способу облегчения или профилактики судорожной активности у индивида, включающему введение индивиду, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению.
В еще одном аспекте изобретение относится к способу облегчения или профилактики бессонницы у индивида, включающему введение индивиду, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению или его композиции.
В еще одном аспекте изобретение относится к способу индукции сна и практического поддержания уровня REM сна, который обнаруживается при нормальном сне, при котором существенное восстановление бессонницы не индуцируется, включающему введение эффективного количества соединения по настоящему изобретению.
В еще одном аспекте изобретение относится к способу облегчения или профилактики ПМС или PND у индивида, включающему введение индивиду, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению.
В еще одном аспекте изобретение относится к способу лечения или профилактики нарушений настроения у индивида, включающему введение индивиду, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению. В некоторых вариантах осуществления нарушение настроения представляет собой депрессию.
В еще одном аспекте изобретение относится к способу индукции анестезии у индивида, включающему введение индивиду эффективного количества соединения по настоящему изобретению.
В еще одном аспекте изобретение относится к способу повышения когнитивной деятельности или лечения расстройства памяти введением индивиду терапевтически эффективного количества соединения по настоящему изобретению. В некоторых вариантах осуществления расстройство представляет собой болезнь Альцгеймера. В некоторых вариантах осуществления расстройство представляет собой синдром Ретта.
В еще одном аспекте изобретение относится к способу лечения расстройства внимания введением индивиду терапевтически эффективного количества соединения по настоящему изобретению. В некоторых вариантах осуществления расстройство внимания представляет собой ADHD.
В некоторых вариантах осуществления соединение вводят индивиду постоянно. В некоторых вариантах осуществления соединение вводят индивиду перорально, подкожно, внутримышечно, или внутривенно.
Анестезия/Седативный эффект
Анестезия представляет собой фармакологически индуцированное и обратимое состояние амнезии, аналгезии, потери чувствительности, потери рефлексов скелетных мышц, пониженной ответной реакции на стресс, или все это одновременно. Эти эффекты могут достигаться с использованием одного лекарственного средства, которое само обеспечивает правильную комбинацию эффектов, или иногда с использованием комбинации лекарственных средств (например, снотворных, седативных, паралитических, анальгетических) для достижения очень специфических комбинаций результатов. Анестезия позволяет пациентам подвергаться операциям и другим процедурам без дистресса и боли, которые бы они иначе испытывали.
Седативный эффект представляет собой снижение раздражительности или возбуждения путем введения фармакологического средства, как правило, для облегчения медицинской процедуры или диагностической процедуры.
Седативный эффект и обезболивание включают континуум состояний сознания, начиная от минимальной седации (анксиолиз) до общей анестезии.
Минимальная седация также известна как анксиолиз. Минимальная седация представляет собой состояние, обусловленное действием лекарственного средства, в течение которого пациент обычно реагирует на словесные команды. Когнитивная функция и координация может быть нарушена. Как правило, дыхательные и сердечно-сосудистые функции остаются неизмененными.
Средняя седация/обезболивание (седация с сохранением сознания) представляет собой лекарственно-индуцированное подавление сознания, при котором пациент отвечает целенаправленно на вербальную комманду, либо просто, либо вместе с легкой тактильной стимуляцией. Как правило, никакие вмешательства не требуются для поддержания свободной проходимости дыхательных путей. Спонтанное дыхание, как правило, адекватно. Сердечно-сосудистая функция обычно сохраняется.
Глубокая седация/аналгезия представляет собой лекарственно-индуцированное подавление сознания, при котором пациент не может легко пробуждаться, но отвечает целенаправленно (не рефлекс отдергивания от болезненного стимула) после повторной или болезненной стимуляции. Независимая функция дыхания может быть нарушена, и пациенту может потребоваться помощь для поддержания проходимости дыхательных путей. Спонтанное дыхание может быть неадекватным. Сердечно-сосудистая функция обычно сохраняется.
Общая анестезия представляет собой состояние потери сознания, вызываемое лекарственным средством, в течение которого пациент не пробуждается, даже при болевом воздействии. Способность поддерживать самостоятельную дыхательную функцию часто нарушается и часто требуется помощь для поддержания проходимости дыхательных путей. Может потребоваться вентиляция с положительным давлением в связи со снижением спонтанного дыхания или снижением нервно-мышечной функции, индуцированным лекарственным средством. Сердечно-сосудистая функция может быть нарушена.
Седация в реанимации (ICU) позволяет уменьшение сознания пациентов окружающей среды и снижения их реакции на внешнее раздражение. Она может играть роль в уходе за критически больным пациентом и охватывает широкий спектр контроля симптомов, который варьируется у разных пациентов и у разных индивидуумов в ходе их заболевания. Глубокую седацию в интенсивной терапии используют для того, чтобы способствовать переносимости пациентами эндотрахеальной трубки, и для синхронизации аппарата искусственной вентиляции легких, часто с нервно-мышечными блокаторами.
В некоторых вариантах осуществления седация (например, продолжительная седация, непрерывная седация) индуцируется и поддерживается в отделении интенсивной терапии в течение длительного периода времени (например, 1 день, 2 дня, 3 дня, 5 дней, 1 неделя, 2 недели, 3 недели, 1 месяц, 2 месяца). Средства, вызывающие длительный седативный эффект, могут иметь длительную продолжительность действия. Седативные средства в отделении интенсивной терапии может иметь короткий период полувыведения.
Процедурная седация и аналгезия, также называемые как седация при сохраненном сознании, представляют собой способ введения седативных средств или диссоциативных средств с анальгетиками или без анальгетиков для индукции состояния, которое позволяет субъекту переносить неприятные процедуры, поддерживая при этом кардиореспираторную функцию
Тревожные расстройства
Тревожное расстройство является общим термином, охватывающим несколько различных форм ненормальной и патологической тревоги и страха. В настоящее время психиатрический диагностический критерий позволяют распознавать широкий спектр тревожных расстройств.
Генерализованное тревожное расстройство является распространенным хроническим заболеванием, характеризующимся длительным беспокойством, которое не сосредоточено ни на каком объекте или ситуации. Те, которые страдают от обобщенного тревожного расстройства, испытывают неопределенный постоянный страх и беспокойство, и становятся чрезмерно обеспокоенными повседневными вопросами. Генерализованное тревожное расстройство представляет собой наиболее распространенное тревожное расстройство, чтобы затронуть пожилых людей.
При паническом расстройстве, человек страдает от кратковременных приступов интенсивного страха и тревоги, часто отмечается дрожь, тряски, путаница, головокружение, тошнота, затрудненное дыхание. Эти панические атаки, определенные ААП, как страх или дискомфорт, который резко возникает и достигает максимума меньше чем за десять минут, могут продлиться в течение нескольких часов, и могут быть вызваны стрессом, страхом, или даже тренировкой; хотя конкретные причины не всегда очевидны. В дополнение к текущим неожиданным приступам тревоги, диагноз панического расстройства также требует, чтобы у сказанных нападений были хронические последствия: или беспокойство о потенциальных значениях нападений, постоянный страх перед будущими нападениями или существенные изменения в поведении имели отношение к нападениям. Также, те, которые страдают от панического беспорядка, испытывают признаки даже вне определенных панических эпизодов. Часто, нормальные изменения в сердцебиении замечены паническим страдальцем, принудив их думать, что что-то не так с их сердцем, или они собираются иметь еще один приступ тревоги. В некоторых случаях, повышенное внимание (сверхбдительность) к функционированию организма происходит во время приступов тревоги, где любое воспринятое физиологическое изменение интерпретируется как возможное опасное для жизни заболевание (т.е. чрезвычайная ипохондрия).
Обсессивно-компульсивное расстройство является одним из видов тревожных расстройств, прежде всего, характеризуется повторяющимися навязчивыми идеями (беспокойство, постоянные, и навязчивые мысли или изображения) и принуждения (убеждения совершить определенные действия или ритуалы). Патеррен мышления ОКР можно сравнить с суевериями, поскольку он включает веру в причинные отношения, где в действительности, каждый не существует. Часто процесс является полностью нелогичным; например, принуждение ходьбы в определенном порядке может использоваться, чтобы облегчить навязчивую идею нависшего вреда. И во многих случаях, принуждение полностью необъяснимо, просто убеждение закончить ритуал, вызванный нервозностью. В меньшинстве случаев больные ОКР могут испытать только навязчивые идеи, без каких-либо явных принуждений; намного меньшее число больных испытывает только принуждения.
Единственная большая категория тревожных расстройств соответствует фобии, которая включает все случаи, в которых страх и беспокойство вызваны определенным стимулом или ситуацией. Страдающие, как правило, ожидают ужасающие последствия от столкновения с объектом их страха, который может быть чем-либо от животного к местоположению к физиологической жидкости.
Посттравматическое стрессовое расстройство или PTSD представляет собой тревожное расстройство, которое возникает в результате травматического опыта. Посттравматический стресс может возникнуть в результате чрезвычайной ситуации, например, военные действия, изнасилование, ситуации заложника, или даже серьезный несчастный случай. Это может также следовать из долгосрочного (хронического) воздействия серьезного стрессора, например солдаты, которые выносят отдельные сражения, но не могут справиться с непрерывным боем. Общие симптомы включают воспоминания, замкнутые поведения и депрессию.
Нейродегенеративные заболевания и нарушения
Термин “нейродегенеративное заболевание” включает заболевания или нарушения, которые связаны с прогрессирующей утратой структуры или функции нейронов, или гибелью нейронов. Нейродегенеративные заболевания и нарушения, включают, но ими не ограничиваются, болезнь Альцгеймера (включая сопутствующие симптомы легкого, умеренного или тяжелого когнитивного нарушения); амиотрофический боковой склероз (БАС); гипоксические и ишемические повреждения; атаксию и конвульсии (в том числе для лечения и профилактики судорожных припадков, вызванных шизоаффективным расстройством или лекарственными средствами, используемыми для лечения шизофрении); доброкачественное беспамятство; отек головного мозга; мозжечковая атаксия, включая синдром нейроакантоцитоза Маклеода (MLS); закрытая травма черепа; кома; контузионные повреждения (например, повреждение спинного мозга и травма головы); деменции, включая мультиинфарктную деменцию и старческое слабоумие; расстройства сознания; синдром Дауна; медикаментозный или лекарственный паркинсонизм (например, острая акатизия, вызванная нейролептиками, острая дистония, паркинсонизм, или поздняя дискинезия, злокачественный нейролептический синдром, или лекарственно индуцированный постуральной тремор); эпилепсия; синдром хрупкой Х-хромосомы; синдром Жилль де ла Туретта; травма головы; понижение слуха и потеря слуха; болезнь Гентингтона; синдром Леннокса; леводопа-индуцированная дискинезия; умственная отсталость; двигательные расстройства, включая акинезию и акинетические синдромы (устойчивый) (включая кальцификацию базальных ганглиев, кортикобазальную дегенерацию, множественную системную атрофию, комплекс паркинсонизм-деменция-БАС, болезнь Паркинсона, постэнцефалитический паркинсонизм и прогрессирующий супрануклеарный паралич); мышечные спазмы и нарушения, связанные с мышечной спастичностью или слабостью, включая хорею (такие как доброкачественная наследственная хорея, хорея, вызванная лекарственным средством, гемибаллизм, болезнь Гентингтона, нейроакантоцитоз, хорея Сиденгама и симптоматическая хорея), дискинезия (включая тики, такие как комплексные тики, простые тики и симптоматические тики), миоклонус (включая генерализованный миоклонус и фокальный миоклонус), тремор (такой как тремор покоя, постуральный тремор и интенционный тремор) и дистония (включая аксиальную дистонию, дистонический писчий спазм, гемиплегическую дистонию, пароксизмальная дистония и фокальная дистония, такая как блефароспазм, оромандибулярная дистония и спастическая дисфония и кривошея); нейрональное повреждение, включая поражение зрения, ретинопатию или дегенерацию желтого пятна; нейротоксичное поражение, являющееся последствием острого нарушения мозгового кровообращения, тромбоэмболического инсульта, геморрагического инсульта, ишемии головного мозга, спазма сосудов головного мозга, гипогликемии, амнезии, гипоксии, недостатка кислорода, перинатальной асфиксии и остановки сердца; болезнь Паркинсона; припадок; эпилептический статус; инсульт; шум в ушах; тубулярный склероз, и нейродегенерация, индуцированная вирусной инфекцией (например, вызванная синдромом приобретенного иммунодефицита (СПИД) и энцефалопатия). Нейродегенеративные заболевания также включают, но ими не ограничиваются, нейротоксическое повреждение, которое сопровождает мозговой инсульт, тромбоэмболический инсульт, геморрагический инсульт, ишемию головного мозга, спазм сосудов головного мозга, гипогликемию, амнезию, гипоксию, недостаток кислорода, перинатальную асфиксию и остановку сердца. Способы лечения или профилактики нейродегенеративного нарушения также включают лечение или профилактику потери признака нейронной функции нейродегенеративного нарушения.
Эпилепсия
Эпилепсия представляет собой заболевание головного мозга, характеризующееся повторными припадками с течением времени. Типы эпилепсии могут включать, но ими не ограничиваются, генерализованную эпилепсию, например, детская абсанс-эпилепсия, ювенильная миоклоническая эпилепсия, эпилепсия с генерализованными тонико-клоническими судорогами при пробуждении, синдром Веста, синдром Леннокса-Гасто, парциальная эпилепсия, например, височная эпилепсия, лобная эпилепсия, доброкачественная эпилепсия детского возраста.
Эпилептический статус (SE)
Эпилептический статус (SE) может включать, например, судорожный эпилептический статус, например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; неконвульсивный эпилептический статус, например, генерализованный эпилептический статус, комплексный парциальный эпилептический статус; генерализованные периодические эпилептиформные разряды; и периодические латерализованные эпилептиформные разряды. Судорожный эпилептический статус характеризуется наличием судорожных припадков статуса эпилептических, и может включать ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус. Ранний эпилептический статус лечат терапией первой линии. Установившийся эпилептический статус характеризуется состоянием эпилептических припадков, которые сохраняются, несмотря на лечение терапией первой линии, и вводят терапии второй линии. Рефрактерный эпилептический статус характеризуется состоянием эпилептических припадков, которые сохраняются, несмотря на лечение терапией первой линии и терапией второй линии, и как правило вводят общую анестезию. Супер-рефрактерный эпилептический статус характеризуется состоянием эпилептических припадков, которые сохраняются, несмотря на лечение терапией первой линии и терапией второй линии, и общей анестезией в течение 24 часов или более.
Неконвульсивный эпилептический статус может включать, например, фокальный неконвульсивный эпилептический статус, например, комплексный парциальный неконвульсивный эпилептический статус, простой парциальный неконвульсивный эпилептический статус, неустойчивый неконвульсивный эпилептический статус; генерализованный неконвульсивный эпилептический статус, например, неконвульсивный эпилептический статус с поздним началом абсансов, неконвульсивный эпилептический статус атипичных абсансов, или неконвульсивный эпилептический статус типичных абсансов.
Композиции, описанные в настоящем документе, также могут быть введены в качестве профилактического средства индивиду, имеющему нарушения ЦНС, например, черепно-мозговую травму, эпилептический статус, например, судорожный эпилептический статус, например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; неконвульсивный эпилептический статус, например, генерализованный эпилептический статус, комплексный парциальный эпилептический статус; генерализованные периодические эпилептиформные разряды; и периодические латерализованные эпилептиформные разряды; до начала приступа.
Припадок
Припадок представляет собой физические обнаружения или изменения в поведении, которые происходят после всплеска аномальной электрической активности в головном мозге. Термин «припадок» часто используется взаимозаменяемо с "судорогой". Судороги представляют собой состояние, когда тело человека быстро и бесконтрольно трясется. Во время судорог, мышцы человека сокращаются и расслабляются неоднократно.
В зависимости от типа поведения и активности головного мозга, судороги делятся на две большие категории: генерализованные и парциальные (также называемые локальные или фокальные). Классификация типа припадка помогает врачам диагностировать, имеет ли пациент эпилепсию или нет.
Генерализованные припадки продуцируются электрическими импульсами по всему мозгу, тогда как парциальные припадки продуцируются (по меньшей мере первоначально) электрическими импульсами в сравнительно небольшом участке мозга. Часть мозга, вызывающего приступы, иногда называют фокусом.
Существует шесть типов генерализованных приступов. Наиболее распространенной и существенной, и, следовательно, наиболее хорошо известной, является генерализованная судорога, также называемая большим судорожным припадком. При этом типе припадка, больной теряет сознание и, как правило, падает. Потеря сознания сопровождается генерализованной жесткостью тела (так называемая "тоническая" фаза припадка) в течение от 30 до 60 секунд, а затем непроизвольным подергиванием ("клоническая" фаза) в течение от 30 до 60 секунд, после чего пациент впадает в глубокий сон («постиктальная» фаза или фаза после припадка). Во время “гранд-мал” припадков, могут произойти травмы и несчастные случаи, например, прикусывание языка и непроизвольное мочеиспускание.
Абсансы вызывают короткую потерю сознания (всего несколько секунд) с несколькими симптомами или без симптомов. Пациент, чаще всего ребенок, как правило, прерывает деятельность и безучастно смотрит. Эти приступы начинаются и заканчиваются внезапно и могут происходить несколько раз в день. Пациенты, как правило, не знают, что у них был припадок, за исключением того, что они могут быть осведомлены о "потери времени".
Миоклонические приступы состоят из спорадических рывков, как правило, на обеих сторонах тела. Иногда пациенты описывают рывки как краткие поражения электрическим током. Такой приступ может привести к падению или невольному бросанию предметов, находящихся в руках.
Клоническими судорогами являются повторяющиеся ритмические подергивания, которые включают обе стороны тела одновременно.
Тонические припадки характеризуются жесткостью мышц.
Атонические припадки состоят из внезапной и общей потери мышечного тонуса, особенно в руках и ногах, что часто приводит к падению.
Припадки, описанные в настоящем документе, могут включать эпилептические припадки; острые повторяющиеся припадки; кластерные судорожные припадки; длительные припадки; непрерывные припадки; пролонгированные припадки; рецидивирующие припадки; припадки эпилептического статуса, например, рефрактерного судорожного эпилептического статуса, неконвульсивного эпилептического статуса; рефрактерные припадки; миоклонические припадки; тонические припадки; тонико-клонические припадки; простые парциальные припадки; сложные парциальные припадки; вторично генерализованные припадки; атипичные абсансы; абсансы; атонические припадки; доброкачественные роландические припадки; фебрильные судороги; эмоциональные приступы; фокальные припадки; эпилептические припадки смеха; первично-генерализованные припадки; судороги младенческие; джексоновская эпилепсия; массивные билатеральные миоклонические приступы; мультифокальные припадки; неонатальные судороги; ночные припадки; затылочные эпилепсии; посттравматический приступы; слабовыраженные приступы; Sylvan seizures; зрительные рефлекторные эпилептические припадки; или абстинентные припадки.
Примеры
Для более полного понимания изобретения, описанного в настоящей заявке, ниже представлены следующие примеры. Примеры синтеза и биологические примеры, описанные в настоящей заявке, предназначены для иллюстрации соединений, фармацевтических композиций и способов, представленных в настоящей заявке, и никоим образом не должны рассматриваться как ограничивающие их объем.
Материалы и методы
Соединения по изобретению можно получить из легкодоступных исходных веществ, используя следующие общие способы и методики. Понятно, что если даны типичные или предпочтительные условия процесса (т.е. реакционные температуры, времена, мольные соотношения реагентов, растворители, давления и др.), то также можно применять другие условия процесса, если не указано по-другому. Оптимальные реакционные условия можно варьировать в зависимости от специфических реагентов или используемого растворителя, но специалист в данной области может определить такие условия посредством рутинных методик оптимизации.
Кроме того, как ясно специалистам в данной области, для предотвращения нежелательных взаимодействий определенных функциональных групп могут быть необходимы обычные защитные группы. Выбор подходящей защитной группы для специфической функциональной группы, а также подходящие условия введения и удаления защиты хорошо известны в данной области. Например, многочисленные защитные группы и их введение и удаление описаны в работе T. W. Greene and P. G. M. Wuts, Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991, и цитированных в ней ссылках.
Представленные в настоящем описании соединения могут быть выделены и очищены известными стандартными способами. Такие процедуры включают (но ими не ограничиваются), перекристаллизацию, колоночную хроматографию, ВЭЖХ или жидкостную хроматографию при сверхвысоких температурах (SFC). На следующих схемах представлены детали получения типичных замещенных биариламидов, которые были перечислены в настоящем документе. Представленные здесь соединения могут быть получены из известных или коммерчески доступных исходных веществ и реагентов специалистом в области органического синтеза. Примеры хиральных колонок, доступных для использования в разделении/очистки энантиомеров/диастереомеров, представленные в настоящем описании, включают, но ими не ограничиваются, CHIRALPAK® AD-10, CHIRALCEL® OB, CHIRALCEL® OB-H, CHIRALCEL® OD, CHIRALCEL® OD-H, CHIRALCEL® OF, CHIRALCEL® OG, CHIRALCEL® OJ и CHIRALCEL® OK.
Общий способ сверхкритической флюидной хроматографии (SFC): очистку SFC проводили с использованием препаративной Thar 200 SFC инструмент, снабженный Chiralpak AD-10 мкM, 200×50 мм ID. Соединения были разделены элюирование смесью углекислого газа и метанола или этанола (например, 20-35% метанол или этанол и 0,1% гидроксид аммония) при скорости потока 55-200 мл/мин и мониторинг при длине волны 220 нм.
1H-ЯМР данные, представленные в настоящем описании, могут быть частичным представлением полного ЯМР спектра соединения, например, соединения, описанного в настоящем документе. Например, представленные 1H ЯМР данные могут исключать область между δ (м.д.) от примерно 1 до примерно 2,5 млн.д. Копии полного спектра 1H-ЯМР для репрезентативных примеров приведены на фигурах.
Иллюстративный общий способ для препаративной ВЭЖХ: Колонка: Waters RBridge prep 10 мкм C18, 19*250 мм. Подвижная фаза: ацетонитрил, вода (NH4HCO3) (30 л вода, 24 г NH4HCO3, 30 мл NH3.H2O). Скорость потока: 25 мл/мин.
Типичный общий способ для аналитической ВЭЖХ: Подвижная фаза: A: вода (10 мM NH4HCO3), B: ацетонитрил Градиент: 5%-95% B в 1,6 или 2 мин Скорость потока: 1,8 или 2 мл/мин; колонка: XBridge C18, 4,6*50 мм, 3,5 мкм при 45 C.
Процедуры синтеза
Соединения по изобретению могут быть получены в соответствии с методами, описанными в данной области (Upasani et al., J. Med. Chem. 1997, 40:73-84; and Hogenkamp et al., J. Med. Chem. 1997, 40:61-72) и с использованием соответствующих реагентов, исходных материалов и способов очистки, известных специалистам в данной области. В некоторых вариантах осуществления соединения, описанные в настоящем документе, могут быть получены с использованием способов, показанных на общих схемах 1-4, включающих нуклеофильное замещение 19-нор прегнанбромида нуклеофилом. В некоторых вариантах осуществления нуклеофил взаимодействует с 19-нор прегнанбромидом в присутствии K2CO3 в THF.
Схема 1

Схема 2

Схема 3

Схема 4
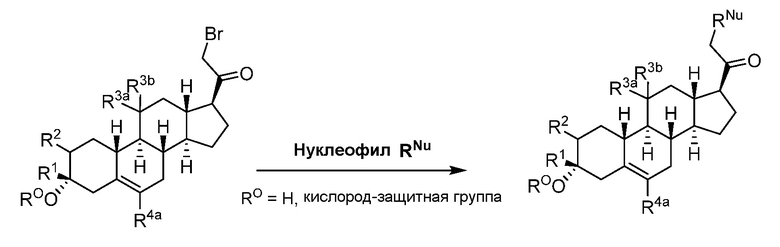
Пример 1. Синтез промежуточных соединений SA и SA

Синтез соединения SA-B. Соединение SA (50 г, 184 ммоль) и палладиевую чернь (2,5 г) в тетрагидрофуране (300 мл) и концентрированную бромистоводородную кислоту (1,0 мл) гидрогенизировали 10 атм водорода. После перемешивания при комнатной температуре в течение 24 часов, смесь фильтровали через слой целита и фильтрат концентрировали в вакууме с получением сырого соединения. После перекристаллизации из ацетона получали соединение SA-B (42,0 г, выход: 83,4%) в виде белого порошка.
1H ЯМР: (400 МГц CDCl3) δ 2,45-2,41 (м, 1H), 2,11-3,44 (м, 2H), 3,24 (с, 3H), 2,18-2,15 (м, 1H), 2,01-1,95 (м, 1H), 1,81-1,57 (м, 7H), 1,53-1,37 (м, 7H), 1,29-1,13 (м, 3H), 1,13-0,90 (м, 2H), 0,89 (с, 3H).
Синтез соединения SA-C. Раствор SA-B (42,0 г, 153,06 ммоль) в 600 мл безводного толуола добавляли по каплям к MAD раствору (459,19 ммоль, 3,0 экв., свежеприготовленный) под N2 при -78°C. После того как добавление было закончено, реакционную смесь перемешивали в течение 1 часа при -78°C. Затем 3,0M MeMgBr (153,06 мл, 459,19 ммоль) медленно добавляли по каплям к вышеуказанной смеси под N2 при -78°C. Затем реакционную смесь перемешивали в течение 3 часов при этой температуре. TLC (PE:EtOAc=3:1) показала, что реакция была завершена. Затем насыщенный водный NH4Cl медленно добавляли по каплям к вышеуказанной смеси при -78°C. После того как добавление было завершено, смесь фильтровади, осадок на фильтре промывали EtOAc, органический слой промывали водой и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали, очищали флэш-хроматографией на силикагеле (петролейный эфир/этилацетат 20:1-3:1) с получением соединения SA-C (40,2 г, выход: 90,4%) в виде белого порошка. 1H ЯМР: (400 МГц CDCl3) δ 2,47-2,41 (м, 1H), 2,13-2,03 (м, 1H), 1,96-1,74 (м, 6H), 1,70-1,62 (м, 1H), 1,54-1,47 (м, 3H), 1,45-1,37 (м, 4H), 1,35-1,23 (м, 8H), 1,22-1,10 (м, 2H), 1,10-1,01 (м, 1H), 0,87 (с, 3H).
Синтез соединения SA-D. К раствору PPh3EtBr (204,52 г, 550,89 ммоль) в THF (500 мл) добавляли раствор t-BuOK (61,82 г, 550,89 ммоль) в THF (300 мл) при 0°C. После того как добавление было закончено, реакционную смесь перемешивали в течение 1 часа 60°C, затем SA-C (40,0 г, 137,72 ммоль), растворенный в THF (300 мл) по каплям добавляли при 60°C. Реакционную смесь нагревали до 60°C в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и гасили насыщ. NH4Cl, экстрагировали EtOAc (3*500 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили и концентрировали, получая сырой продукт, который очищали с помощью колоночной флэш-хроматографии (петролейный эфир/этилацетат 50:1-10:1) с получением соединения SA-D (38,4 г, выход:92%) в виде белого порошка. 1H ЯМР: (400 МГц CDCl3) δ 5,17-5,06 (м, 1H), 2,42-2,30 (м, 1H), 2,27-2,13 (м, 2H), 1,89-1,80 (м, 3H), 1,76-1,61 (м, 6H), 1,55-1,43 (м, 4H), 1,42-1,34 (м, 3H), 1,33-1,26 (м, 6H), 1,22-1,05 (м, 5H), 0,87 (с, 3H).
Синтез соединения SA-E. К раствору SA-D (38,0 г, 125,62 ммоль) в сухом THF (800 мл) добавляли по каплям раствор BH3.Me2S (126 мл, 1,26 моль) на ледяной бане. После того как добавление было закончено, реакционную смесь перемешивали в течение 3 часов при комнатной температуре (14-20°C). TLC (петролейный эфир/этилацетат 3:1) показала, что реакция была завершена. Смесь охлаждали до 0°C и добавляли 3,0M водный раствор NaOH (400 мл) с последующим добавлением 30% водной H2O2 (30%, 300 мл). Смесь перешивали в течение 2 часов при комнатной температуре (14-20°C), и затем фильтровали, экстрагировали EtOAc (3*500 мл). Объединенные органические слои промывали насыщенным водным Na2S2O3, насыщенным солевым раствором, сушили над Na2SO4 и концентрировали в вакууме, получая сырой продукт (43 г, сырой) в виде бесцветного масла. Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения SA-F. К раствору SA-E (43,0 г, 134,16 ммоль) в дихлорметане (800 мл) при 0°C и PCC (53,8 г, 268,32 ммоль) добавляли порциями. Затем реакционную смесь перемешивали при комнатной температуре (16-22°C) в течение 3 часов. TLC (петролейный эфир/этилацетат 3:1) показала, что реакция была завершена, затем реакционную смесь фильтровали, промывали DCM. Органическую фазу промывали насыщенным водным раствором Na2S2O3, насыщенным солевым раствором, сушили над Na2SO4 и концентрировали в вакууме, получая сырой продукт. Сырой продукт очищали с помощью колоночной флэш-хроматографией (петролейный эфир/этилацетат 50:1-8:1) с получением соединения SA-F (25,0 г, выход:62,5%, после двух стадий) в виде белого порошка. 1H ЯМР (SA-F): (400 МГц CDCl3) δ 2,57-2,50 (м, 1H), 2,19-2,11 (м, 4H), 2,03-1,97 (м, 1H), 1,89-1,80 (м, 3H), 1,76-1,58 (м, 5H), 1,47-1,42 (м, 3H), 1,35-1,19 (м, 10H), 1,13-1,04 (м, 3H), 0,88-0,84 (м, 1H), 0,61 (с, 3H).
Синтез соединения SA. К раствору SA-F (10 г, 31,4 ммоль) и водн. HBr (5 капель, 48% в воде) в 200 мл MeOH добавляли по каплям бром (5,52 г, 34,54 ммоль). Реакционную смесь перемешивали при 17°C в течение 1,5 часов. Полученный раствор гасили насыщенным водным NaHCO3 при 0°C и экстрагировали EtOAc (150 мл × 2). Объединенные органические слои сушили и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием (PE:EA=15:1-6:1) с получением соединения SA (9,5 г, выход: 76,14%) в виде белого твердого вещества. LC/MS: Время удерживания=5,4 мин ; m/z 379,0, 381,1, 396,1.
Пример 2. Синтез соединений SA-1 и SA-2

К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 1H-бензо[d][1,2,3]триазол (80 мг, 0,67 ммоль) и соединение SA (100 мг, 0,25 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь вливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого вещества соединения SA-1 (15 мг, 13,7%) и соединения SA-2 (10 мг, 9,2%). Соединение SA-1: 1H ЯМР (500 МГц CDCl3), δ (м.д.), 8,08 (д, 1H), 7,49 (т, 1H), 7,38 (т, 1H), 7,33 (д, 1H), 5,44 (1H, AB), 5,40 (1H, AB),. 2,70 (т, 1H), 0,73 (с, 3H). Соединение SA-2: 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,88(д, 2H), 7,39 (д, 2H), 5,53-5,52 (м, 2H), 2,65 (т, 1H), 0,75 (с, 3H).
Пример 3. Синтез соединений SA-3 и SA-4
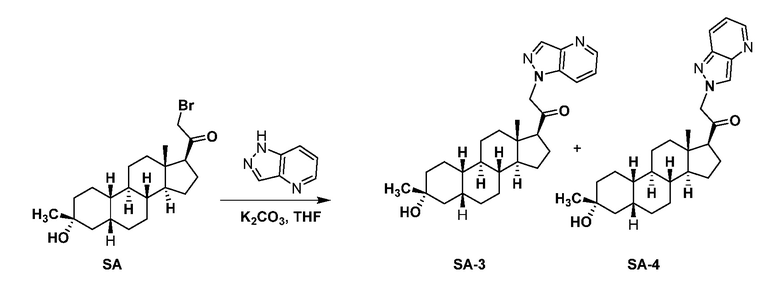
К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 1H-пиразоло[4,3-b]пиридин (80 мг, 0,67 ммоль) и соединение SA (100 мг, 0,25 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь вливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого вещества соединения SA-3 (17 мг, 15,5%) и соединения SA-4 (10 мг, 9,2%). Соединение SA-3: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,59 (д, 1H), 8,28 (с,1H), 7,59 (д, 1H), 7,29 (дд, 1H), 5,20 (1H, AB), 5,13 (1H, AB) 2,67 (т, 1H), 0,71 (с, 3H). Соединение SA-4: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,58(д, 1H), 8,22 (с, 1H), 8,04 (д, 1H), 7,25 (дд, 1H), 5,28 (1H, AB), 5,19 (1H, AB),. 2,67 (т, 1H) 0,72 (с, 3H).
Пример 4. Синтез соединений SA-5 и SA-6
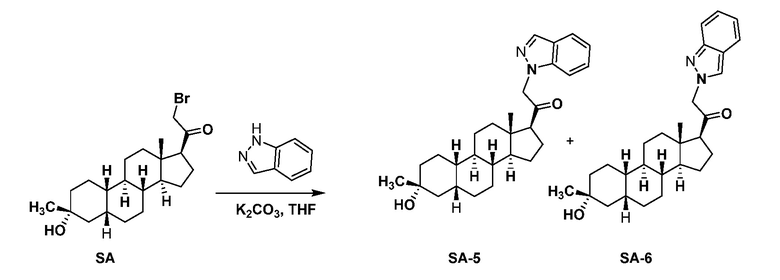
К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 1H-индазол (80 мг, 0,67 ммоль) и соединение SA (100 мг, 0,25 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь вливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого вещества соединения S5 (29 мг, 24,7%) и соединения S6 (12 мг, 11%). Соединение SA-5: 1H ЯМР (500 МГц CDCl3), δ (м.д.), 8,05 (с, 1H), 7,76-7,74 (д, 1H), 7,41-7,37 (т, 1H), 7,22-7,16 (д и т, 2H), 5,15 (1H, AB), 5,09 (1H, AB), 2,66 (т, 1H) 0,72 (с, 3H). Соединение SA-6: 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,93 (с, 1H), 7,70-7,66 (м, 2H), 7,28-7,26 (м, 1H), 7,08-7,07 (м,1H), 5,25 (1H, AB), 5,15 (1H, AB,), 2,64 (т, 1H), 0,72 (с, 3H).
Пример 5. Синтез соединений SA-7 и SA-8
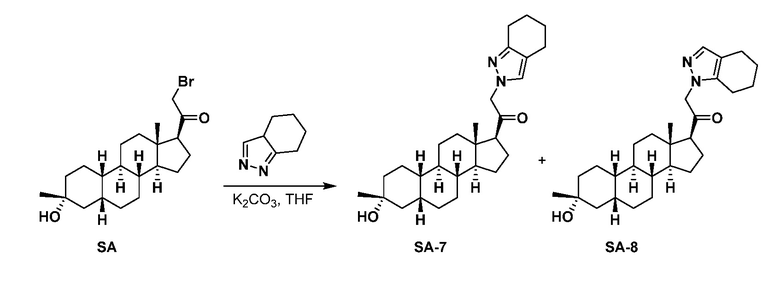
К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 4,5,6,7-тетрагидро-3aH-индазол (33 мг, 0,4 ммоль) и соединение SA (79 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали препаративной ВЭЖХ с обращенной фазой, получая соединение SA-7 виде белого твердого вещества (9 мг, 10%) и соединение SA-8 в виде белого твердого вещества (12 мг, 14%). Соединение SA-7: 1H ЯМР (400 МГц CDCl3), δ (м.д.) (400 МГц CD3OD) δ 7,74 (с, 1H), 5,34-5,19 (м, 2H), 2,80-2,74 (м, 3H), 2,65-2,62 (м, 2H), 2,22-2,11 (м, 2H), 1,92-1,70 (м, 11H), 1,53-1,39 (м, 9H), 1,30-1,15 (м, 8H), 0,92-0,84 (м, 1H), 0,73 (с, 3H). LC/MS: Время удерживания=1,33 мин; m/z=439,3 [M+H]. Соединение SA-8: 1H ЯМР (400 МГц CDCl3), δ (м.д.) (400 МГц CD3OD) δ 7,57 (с, 1H), 5,14-4,99 (м, 2H), 2,80-2,75 (м, 1H), 2,60-2,48 (м, 4H), 2,22-2,09 (м, 2H), 1,91-1,72 (м, 11H), 1,58-1,39 (м, 9H), 1,32-1,26 (м, 5H), 1,22-1,12 (м, 3H), 0,72 (с, 3H). LC/MS: Время удерживания=1,37 мин; m/z=439,3 [M+H].
Пример 6. Синтез соединений SA-9 и SA-10

К суспензии K2CO3 (25 мг, 0,18 ммоль) в THF (5 мл) добавляли 2H-пиразоло[4,3-c]пиридин (23 мг, 0,18 ммоль) и SA (36 мг, 0,09 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаточную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение SA-9 в виде белого твердого вещества (9 мг, 23%) и SA-10 в виде белого твердого вещества (5 мг, 13%). Соединение SA-9 1H ЯМР (400 МГц CDCl3), δ (м.д.), 9,14 (с, 1H), 8,45 (с, 1H), 8,19 (с, 1H), 7,13 (д, 1H), 5,18 (AB, 1H), 5,12 (AB, 1H), 2,67 (т, 1H) 0,72 (с, 3H). LC-MS: Время удерживания=2,21 мин, m/z=436,3 [M+H]+. Соединение SA-10 1H ЯМР (400 МГц CDCl3), δ (м.д.), 9,19 (с, 1H), 8,28 (д, 1H), 8,15 (с, 1H), 7,53 (д, 1H), 5,29 (AB, 1H), 5,21 (AB, 1H), 2,68 (т, 1H 0,72 (с, 3H). LC-MS: Время удерживания=2,16 мин, m/z=436,3 [M+H]+
Пример 7. Синтез соединений SA-11 и SA-12
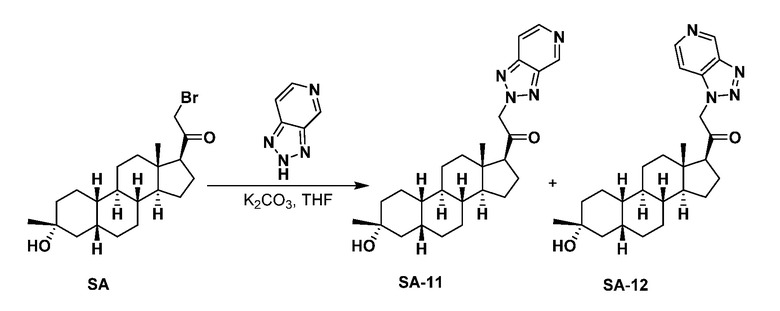
К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 2H-[1,2,3]триазоло[4,5-c]пиридин (46 мг, 0,36 ммоль) и SA (72 мг, 0,18 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаточную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение SA-11 в виде белого твердого вещества (23 мг, 29%) и SA-12 в виде белого твердого вещества (15 мг, 19%). Соединение SA-11 1H ЯМР (400 МГц CDCl3), δ (м.д.), 9,46 (с, 1H), 8,47 (д, 1H), 7,76 (дд, 1H), 5,62 (AB, 1H), 5,56 (AB, 1H), 2,69 (т, 1H)0,76 (с, 3H). LC-MS: Время удерживания=2,31 мин, m/z=437,3 [M+H]+. Соединение SA-12 1H ЯМР (400 МГц CDCl3), δ (м.д.), 9,50 (с, 1H), 8,58 (д, 1H), 7,30 (д, 1H), 5,49 (AB, 1H), 5,41 (AB, 1H), 2,75 (т, 1H) 0,73 (с, 3H). LC-MS: Время удерживания=2,24 мин, m/z=437,3 [M+H]+.
Пример 8. Синтез соединений SA-13, SA-14 и SA-15

К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 2H-[1,2,3]триазоло[4,5-b]пиридин (46 мг, 0,36 ммоль) и SA (72 мг, 0,18 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаточную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение SA-13 в виде белого твердого вещества (22 мг, 28%) и SA-14 в виде белого твердого вещества (6 мг, 7%) и SA-15 в виде белого твердого вещества (22 мг, 28%). Соединение SA-13 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,78 (д, 1H), 7,78 (д, 1H), 7,46 (м, 1H), 5,51 (AB, 1H), 5,42 (AB, 1H), 2,75 (т, 1H) 0,72 (с, 3H). LC-MS: Время удерживания=2,21 мин, m/z=437,5 [M+H]+. Соединение SA-14 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,83 (с, 1H), 8,26 (дд, 1H), 7,38 (дд, 1H), 5,60 (AB, 1H), 5,54 (AB, 1H), 2,69 (т, 1H), 0,76 (с, 3H). LC-MS: Время удерживания=2,29 мин, m/z=437,5 [M+H]+. Соединение SA-15 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,65 (дд, 1H), 8,41 (дд, 1H), 7,37 (дд, 1H), 5,56 (AB, 1H), 5,50 (AB, 1H), 2,77 (т, 1H) 0,75 (с, 3H). LC-MS: Время удерживания=2,32 мин, m/z=437,5 [M+H]+.
Пример 9. Синтез соединений SA-16 и SA-17
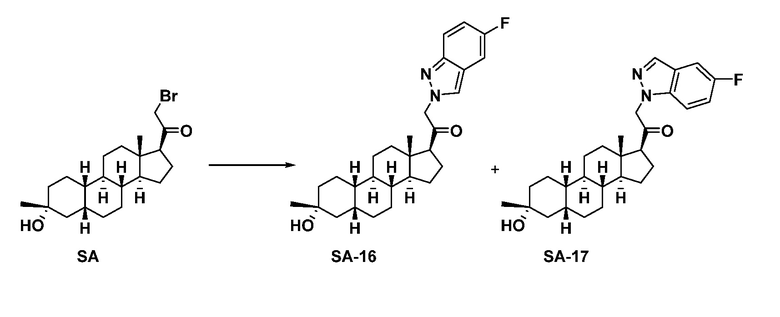
К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 5-фтор-1H-индазол (41 мг, 0,3 ммоль) и SA (100 мг, 0,252 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого вещества SA-16 (8,2 мг,7,2%), SA-17 (11 мг, 9,6%) SA-16: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 7,89 (с, 1H), 7,63 (1H, дд), 7,25 (1H, дд), 7,08 (1H, тд), 5,22 (AB1H), 5,15 (AB, 1H), 2,64 (1H, т) 0,71 (с, 3H). SA-17: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,00 (с, 1H), 7,37 (д, 1H), 7,16 (д, 2H), 5,15 (AB,1H), 5,10 (AB, 1H), 2,63 (1H, т)0,71 (с, 3H).
Пример 10. Синтез соединений SA-18 и SA-19
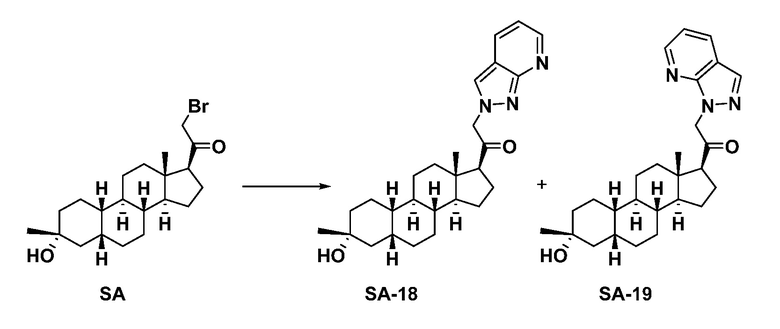
К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (6 мл) добавляли 1H-пиразоло[3,4-b]пиридин (36 мг, 0,3 ммоль) и SA (100 мг, 0,252 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого SA-18 (30 мг, 25,8%), SA-19 (27 мг, 24,5%). SA-18: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,69 (с, 1H), 8,05 (1H, д), 7,97(с,1H), 7,03 (1H, дд), 5,30 (AB,1H), 5,19 (AB, 1H), 2,67 (1H, т) 0,70 (с, 3H). LC-MS: Время удерживания=2,19 мин, m/z=436,1 (M++1). SA-19: 1H ЯМР (400 МГц CDCl3), δ (м.д.) 8,50 (1H, дд), 8,08 (с,1H), 8,06 (1H, д), 7,13 (1H, дд), 5,32 (AB, 1H), 5,29 (AB1H), 2,70 (1H, т), 0,73 (с, 3H). LC-MS: Время удерживания=2,26 мин, m/z=436,1 (M++1).
Пример 11. Синтез соединений SA-20 и SA-21

К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 1H-пиразоло[3,4-c]пиридин (36 мг, 0,3 ммоль) и SA (100 мг, 0,25 ммоль). Смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь вливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого вещества, SA-20 (10 мг, 9,1%), SA-21 (12 мг, 10,9%), SA-20: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 9,26 (с, 1H), 8,17 (1H, д), 7,98 (с, 1H), 7,53 (1H, д), 5,29 (AB,1H), 5,20 (AB,1H), 2,67 (1H, т) 0,72 (с, 3H). LC-MS: Время удерживания=2,19 мин, m/z=436,1 (M++1). SA-21: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,80 (с, 1H), 8,33 (1H, д), 8,10 (с,1H), 7,65 (1H, дд), 5,26 (AB, 1H), 5,24 (AB, 1H), 2,68 (1H, т), 0,72 (с, 3H). LC-MS: Время удерживания=2,29 мин, m/z=436,2 (M++1).
Пример 12. Синтез соединений SA-22 и SA-23
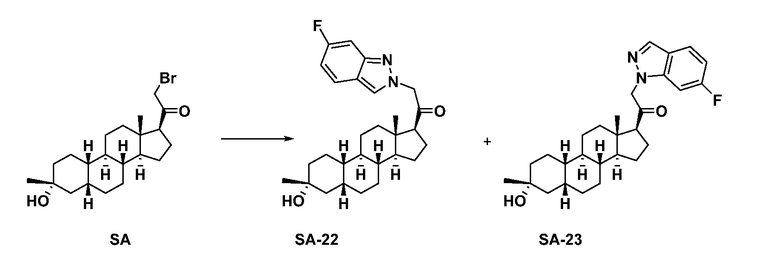
К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 6-фтор-1H-индазол (41 мг, 0,3 ммоль) и 9b (100 мг, 0,09 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого вещества, SA-22 (19 мг, 16,7%) и SA-23 (36 мг, 31,5%). SA-22: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 7,93 (с, 1H), 7,63 (1H, дд), 7,27 (1H, д), 6,90 (1H, т), 5,20 (AB, 1H), 5,15 (AB, 1H), 2,20 (1H, т), 1,27 (с, 3H), 0,70 (с, 3H). LC-MS: Время удерживания =2,42 мин, m/z=453,1 (M++1). SA-23: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,01 (с, 1H), 7,68(1H, т), 6,93 (1H, т), 6,85 (1H, д), 5,10 (AB, 1H), 5,05 (AB, 1H), 2,63 (1H, т), 0,71 (с, 3H). LC-MS: Время удерживания=2,47 мин, m/z=453,1 (M++1).
Пример 13. Синтез соединения SA-24 и SA-25
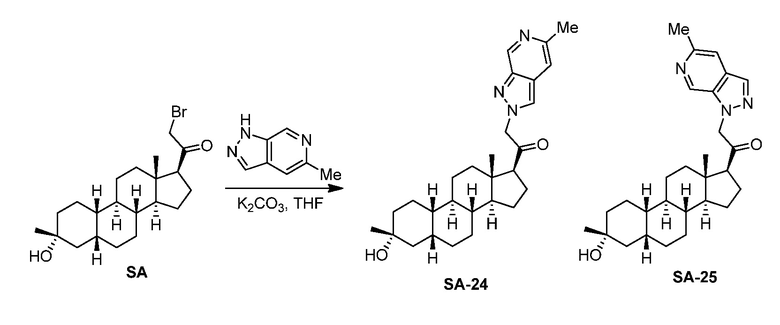
К раствору сырого реагента SA (249,5 мг, 0,629 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 5-метил-1H-пиразоло{3,4-c]пиридин (168 мг, 1,258 ммоль), затем карбонат калия (174 мг, 1,258 ммоль) и раствор перемешивали при 25°C в течение ночи. Затем реакционную смесь разбавляли этилацетатом (200 мл) и полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SA-24 (5 мг, 0,0106 ммоль, Выход=1,7% (2 стадии)) и продукт SA-25 (6 мг, 0,0128 ммоль, Выход=2,1% (2 стадии)) в виде белого твердого вещества. Соединение SA-24: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,19 (1H, с), 7,86 (1H, с), 7,32 (1H, с), 5,28 (1H, AB), 5,19 (1H, AB), 2,66 (1H, т), 2,61 (3H, с), 0,72 (3H, с). LCMS: Время удерживания=2,31 мин, m/z=450,2 [M+H]+ Соединение SA-25: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,67 (1H, с), 8,00 (1H, с), 7,45 (1H, с), 5,22 (1H, AB), 5,21 (1H, AB), 2,67 (1H, т), 2,66 (3H, с) 0,72 (3H, с). LCMS: Время удерживания=2,38 мин, m/z=450,2 [M+H]+
Пример 14. Синтез SA-26 и SA-27
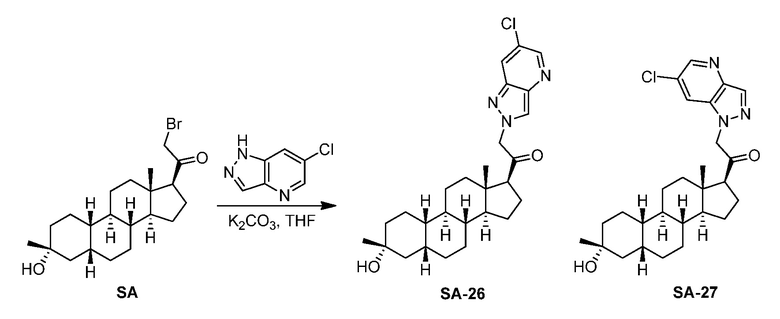
К раствору сырого реагента SA (249,5 мг, 0,629 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 6-хлор-1H-пиразоло[4,3-b]пиридин (192 мг, 1,256 ммоль), затем карбонат калия (174 мг, 1,256 ммоль) и этот раствор перемешивали при 25°C в течение ночи. Затем реакционную смесь разбавляли этилацетатом (200 мл) и полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SA-26 (10 мг, 0,0213 ммоль, Выход=3,4% (2 стадии)) и продукт SA-27 (14 мг, 0,0298 ммоль, Выход=4,8% (2 стадии)) в виде белого твердого вещества. Соединение SA-26: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,49 (1H, д), 8,20 (1H, с), 8,01 (1H, д), 5,26 (1H, AB), 5,17 (1H, AB), 2,66 (1H, т), 0,72 (3H, с). LCMS: Время удерживания=2,47 мин, m/z=470,1 [M+H]+ Соединение SA-27: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,52 (1H, с), 8,24 (1H, д), 7,57 (1H, дд), 5,16 (1H, AB), 5,09 (1H, AB), 2,68 (1H, т), 0,72 (3H, с). LCMS: Время удерживания=2,50 мин, m/z=470,1 [M+H]+
Пример 15. Синтез соединения SA-28 и SA-29
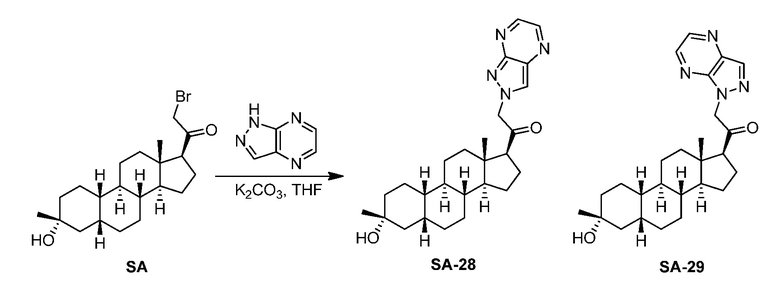
К раствору сырого реагента SA (249,5 мг, 0,629 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 1H-пиразоло[3,4-b]пиразин (151 мг, 1,256 ммоль), затем карбонат калия (174 мг, 1,256 ммоль) и полученный раствор перемешивали при 25°C в течение ночи. Затем раствор разбавляли этилацетатом (200 мл) и полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SA-28 (17,3 мг, 0,0396 ммоль, Выход=6,3% (2 стадии)) и продукт SA-29 (67,5 мг, 0,155 ммоль, Выход=25% (2 стадии)) в виде белого твердого вещества. Соединение SA-28: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,64 (1H, д), 8,56 (1H, д), 8,27 (1H, с), 5,35 (1H, AB), 5,23 (1H, AB), 2,70 (1H, t0,72 (3H, с). LCMS: Время удерживания=2,22 мин, m/z=437,2 [M+H]+ Соединение SA-29: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,59 (1H, д), 8,44 (1H, д), 8,34 (1H, с), 5,34 (1H, AB), 5,28 (1H, AB), 2,71 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,37 мин, m/z=437,2 [M+H]+
Пример 16. Синтез соединения SA-30 и SA-31
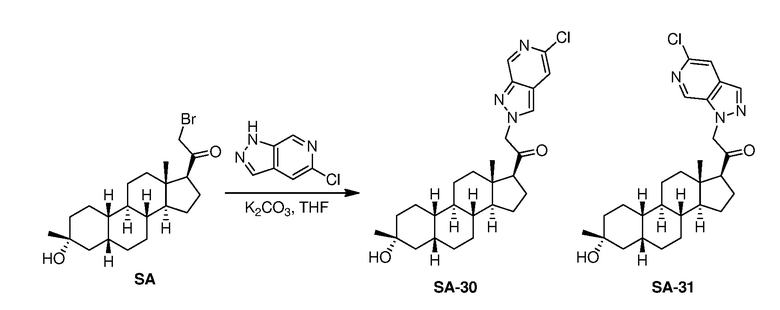
К раствору сырого реагента SA (249,5 мг, 0,629 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 5-хлор-1H-пиразоло[3,4-c]пиридин (192 мг, 1,256 ммоль), затем карбонат калия (174 мг, 1,256 ммоль) и полученный раствор перемешивали при 25°C в течение ночи. Затем раствор разбавляли этилацетатом (200 мл) и полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, с получением фракции 1 и 2. Фракция 1 представляла собой чистый продукт SA-30 (10,4 мг, 0,0221 ммоль, Выход=3,5% (2 стадии)) в виде белого твердого вещества. Фракция 2 не была чистой и должна была быть очищена хроматографией на силикагеле (элюент: петролейный эфир/этилацетат=2:3) с получением чистого продукта SA-31 (12,2 мг, 0,026 ммоль, Выход=4,1% (2 стадии)) в виде белого твердого вещества. Соединение SA-30: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,06 (1H, с), 7,95 (1H, с), 7,59 (1H, д), 5,31 (1H, AB), 5,22 (1H, AB), 2,68 (1H, т), 0,72 (3H, с). LCMS: Время удерживания=2,42 мин, m/z=470,1 [M+H]+ Соединение SA-31: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,55 (1H, с), 8,05 (1H, д), 7,67 (1H, д), 5,24 (1H, AB), 5,22 (1H, AB), 2,68 (1H, т),0,71 (3H, с). LCMS: Время удерживания=2,47 мин, m/z=470,1 [M+H]+.
Пример 17. Синтез SA-32, SA-33 и SA-34
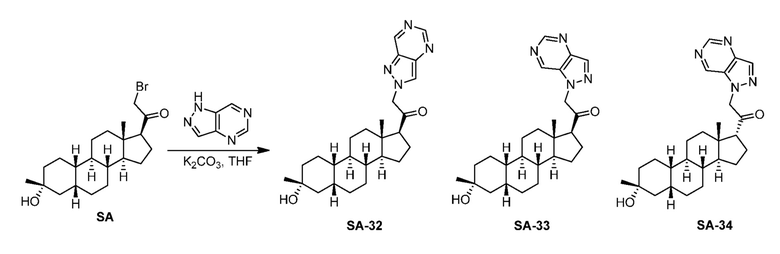
Синтез 1H-пиразоло[4,3-d]пиримидина
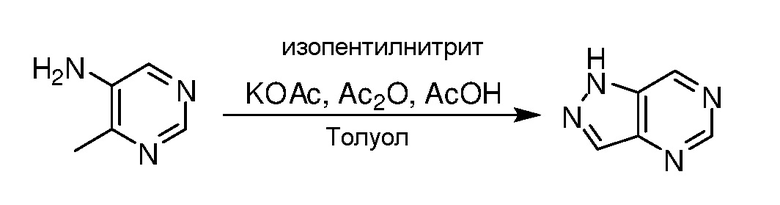
К раствору реагента (109 мг, 1,0 ммоль) в толуоле (1,5 мл) добавляли уксусный ангидрид (0,2 мл, 2,10 ммоль), уксусную кислоту (0,2 мл, 3,5 ммоль), затем ацетат калия (196 мг, 2,0 ммоль). Смесь нагревали с обратным холодильником и добавляли изопентилнитрит (0,168 мл, 1,25 ммоль) в толуоле (0,3 мл). Через 2 часа смесь выливали в воду (20 мл). Раствор подщелачивали добавлением твердого Na2CO3. Раствор экстрагировали этилацетатом (2×50 мл) и объединенные органические экстракты промывали насыщенным солевым раствором (50 мл), сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (элюент: петролейный эфир:этилацетат=1:2) с получением продукта (32 мг, 0,266 ммоль, Выход=27%) в виде желтого твердого вещества. 1H ЯМР (400 МГц d6-DMSO) δ (м.д.): 13,91 (1H, ушир.), 9,35 (1H, с), 9,04 (1H, с), 8,45 (1H, с).
Синтез SA-32, SA-33 и SA-34. К раствору сырого реагента (249,5 мг, 0,629 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 1H-пиразоло[4,3-d]пиримидин (151 мг, 1,256 ммоль), затем карбонат калия (174 мг, 1,256 ммоль) и полученный раствор перемешивали при 25°C в течение ночи. Затем раствор разбавляли этилацетатом (200 мл) и полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, с получением фракции 1, 2 и 3. Фракция 1 не была чистой и ее повторно очищали хроматографией на силикагеле (элюент: этилацетат) с получением продукта SA-32 (10,0 мг, 0,0229 ммоль, Выход=3,6% (2 стадии)). Фракция представляла собой чистый продукт SA-33 (56,8 мг, 0,130 ммоль, Выход=21% (2 стадии)). Фракция 3 представляла собой чистый побочный продукт SA-34 (7,3 мг, 0,0167 ммоль, Выход=2,7% (2 стадии)). Все продукты представляли собой белое твердое вещество. Соединение SA-32: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,43 (1H, с), 9,06 (1H, с), 8,22 (1H, с), 5,35 (1H, AB), 5,26 (1H, AB), 2,69 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,10 мин, m/z=437,1 [M+H]+ Соединение SA-33: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,14 (1H, с), 8,96 (1H, с), 8,30 (1H, с), 5,29 (1H, AB), 5,22 (1H, AB), 2,71 (1H, т), 0,72 (3H, с). LCMS: Время удерживания=2,18 мин, m/z=437,1 [M+H]+ Соединение SA-34: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,15 (1H, с), 8,98 (1H, с), 8,32 (1H, с), 5,35 (1H, AB), 5,19 (1H, AB), 2,89 (1H, дд), 0,99 (3H, с). LCMS: Время удерживания=2,24 мин, m/z=437,1 [M+H]+
Пример 18. Синтез соединения SA-35 и SA-36
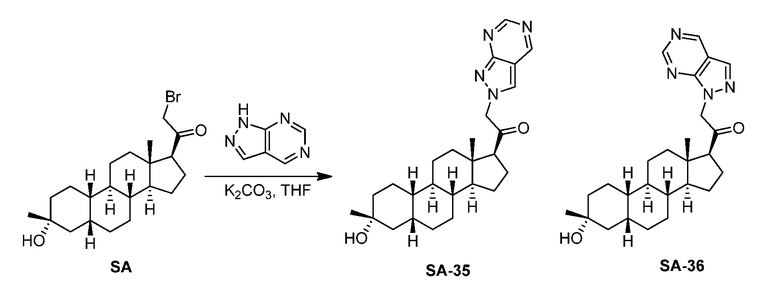
К раствору сырого реагента SA (249,5 мг, 0,629 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 1H-пиразоло[3,4-d]пиримидин (151 мг, 1,256 ммоль), затем карбонат калия (174 мг, 1,256 ммоль) и полученный раствор перемешивали при 25°C в течение ночи. Затем раствор разбавляли этилацетатом (200 мл) и полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SA-35 (21,7 мг, 0,0497 ммоль, Выход=7,9% (2 стадии)) и продукт SA-36 (59,4 мг, 0,136 ммоль, Выход=22% (2 стадии)) в виде белого твердого вещества. Соединение SA-35: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,37 (1H, с), 9,11 (1H, с), 8,17 (1H, с), 5,35 (1H, AB), 5,22 (1H, AB), 2,71 (1H, т1,28 (3H, с), 0,71 (3H, с). LCMS: Время удерживания=2,04 мин, m/z=437,1 [M+H]+ Соединение SA-36: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,21 (1H, с), 9,00 (1H, с), 8,20 (1H, с), 5,32 (1H, AB), 5,27 (1H, AB), 2,71 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,20 мин, m/z=437,1 [M+H]+
Пример 19. Синтез соединения SA-37 и SA-38

К суспензии SA (100 мг, 0,25 ммоль) в THF (25 мл) добавляли 2H-индазол-5-карбонитрил (107 мг, 0,75 ммоль) и K2CO3 (103 мг, 0,75 ммоль). Смесь перемешивали при 35°C в течение 15 часов. Затем реакционную смесь выливали в ледяную воду и экстрагировали EtOAc (100 мл × 3), промывали насыщенным солевым раствором (100 мл×3), сушили (MgSO4), фильтровали и упаривали в вакууме, затем очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-37 в виде белого твердого вещества (21 мг, 17% выход) и SA-38 в виде белого твердого вещества (28 мг, 23% выход). SA-37: 1H ЯМР (500 МГц CDCl3), δ (м.д.), 8,14 (с, 1H), 8,11 (с, 1H), 7,75 (дд, 1H), 7,39 (д, 1H), 5,28 (1H,AB), 5,20 (1H,AB), 2,67 (т, 1H), 1,27 (с, 3H), 0,71 (с, 3H). LCMS: Время удерживания=2,340 мин, MS (ESI) m/z: 460 [M+H]+. SA-38: 1H ЯМР (500 МГц CDCl3), δ (м.д.), 8,14 (с, 2H), 7,57 (д, 1H), 7,28 (д, 1H), 5,21 (1H, AB), 5,15 (1H, AB), 2,67 (т, 1H), 0,71 (с, 3H). LCMS: Время удерживания=2,372 мин, MS (ESI) m/z: 460 [M+H]+.
Пример 20. Синтез соединения SA-39 и SA-40 и SA-41
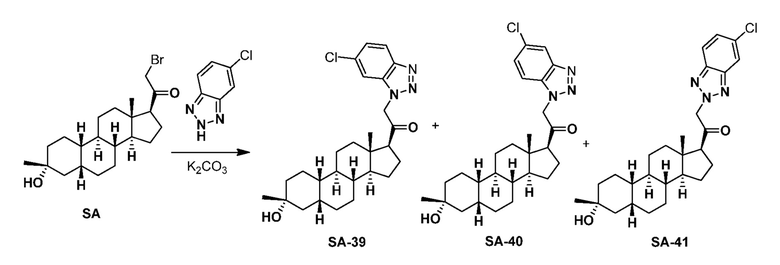
К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 5-хлор-2H-бензо[d][1,2,3]триазол (61 мг, 0,4 ммоль) и соединение SA (85 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов, затем остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-39 в виде белого твердого вещества (8 мг, 9%) и SA-40 в виде белого твердого вещества (7 мг, 8%) и SA-41 в виде белого твердого вещества (4 мг, 5%). Соединение SA-39: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,06 (д, 1H), 7,45 (м, 2H5,44 (AB, 1H), 5,37 (AB, 1H), 2,72 (т, 1H),0,72 (с, 3H). LC-MS: Время удерживания=2,47 мин, m/z=470,4 [M+H]+ Соединение SA-40: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,00 (с 1H), 7,46 (д, 1H), 7,29 (д, 1H), 5,43 (AB, 1H), 5,34 (AB, 1H), 2,73 (т, 1H),0,73 (с, 3H). LC-MS: Время удерживания=2,48 мин, m/z=470,4 [M+H]+ Соединение SA-41: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,87 (д, 1H), 7,82 (дд, 1H), 7,35 (дд, 1H), 5,53 (AB, 1H), 5,48 (AB, 1H), 2,66 (т, 1H), 0,74 (с, 3H). LC-MS: Время удерживания=2,61 мин, m/z=470,1 [M+H]+.
Пример 21. Синтез соединения SA-42 и SA-43 и SA-44
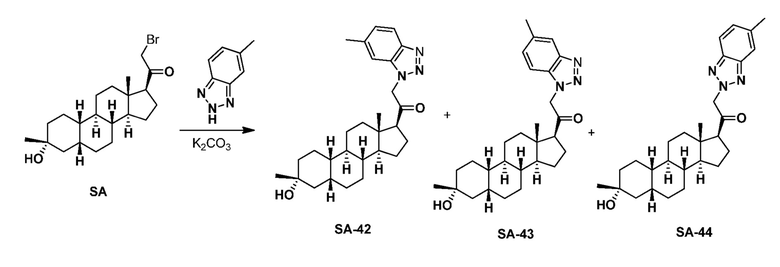
К суспензии K2CO3 (83 мг, 0,6 ммоль) в THF (5 мл) добавляли 5-метил-2H-бензо[d][1,2,3]триазол (80 мг, 0,6 ммоль) и соединение SA (118 мг, 0,3 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов, затем остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×20 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-42 в виде белого твердого вещества (19 мг, 14%) и SA-43 в виде белого твердого вещества (13 мг, 10%) и SA-44 в виде белого твердого вещества (5 мг, 5%). Соединение SA-42: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,93 (д, 1H), 7,19 (дд, 1H), 7,08 (с, 1H), 5,38 (AB, 1H), 5,33 (AB, 1H), 2,70 (т, 1H), 2,50 (с, 3H), 0,73 (с, 3H). LC-MS: Время удерживания=2,39 мин, m/z=450,4 [M+H]+ Соединение SA-43: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,82 (с, 1H), 7,31 (дд, 1H), 7,21 (д, 1H), 5,38 (AB, 1H), 5,35 (AB, 1H), 2,68 (т, 1H), 2,51 (с, 3H), 0,73 (с, 3H). LC-MS: Время удерживания=2,39 мин, m/z=450,4 [M+H]+ Соединение SA-44: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,75 (д, 1H), 7,60(с, 1H), 7,22 (д, 1H), 5,48 (AB, 1H), 5,46 (AB, 1H), 2,63 (т, 1H), 0,74 (с, 3H). LC-MS: Время удерживания=2,51 мин, m/z=450,4 [M+H].
Пример 22. Синтез соединения SA-45 и SA-46
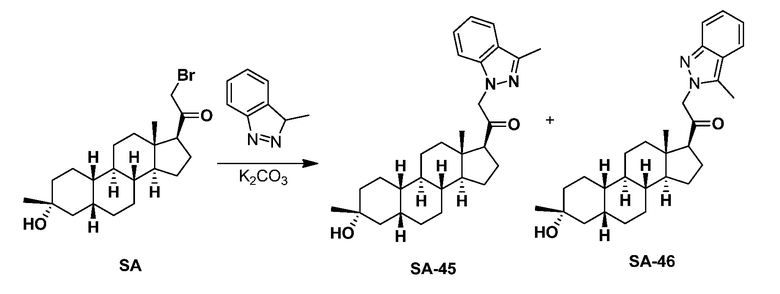
К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 3-метил-3H-индазол (53 мг, 0,4 ммоль) и соединение SA (85 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов, затем остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-45 в виде белого твердого вещества (23 мг, 26%) и SA-46 в виде белого твердого вещества (5 мг, 6%). Соединение SA-45: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,66 (д, 1H), 7,35 (тд, 1H), 7,26 (м, 1H), 7,02 (м, 1H), 5,05 (с, 2H), 2,63 (т, 1H), 2,57 (с, 3H 0,72 (с, 3H). LC-MS: Время удерживания=2,51 мин, m/z=449,2 [M+H]+ Соединение SA-46: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,60 (д, 1H), 7,56 (д, 1H), 7,24 (дд, 1H), 7,02 (т, 1H), 5,16 (с, 2H), 2,66 (т, 1H), 2,50 (с, 3H), 0,73 (с, 3H). LC-MS: Время удерживания=2,45 мин, m/z=449,3 [M+H]+
Пример 23. Синтез соединения SA-47, SA-48 и SA-49

К суспензии K2CO3 (83 мг, 0,6 ммоль) в THF (5 мл) добавляли 5-метокси-2H-бензо[d][1,2,3]триазол (89 мг, 0,6 ммоль) и соединение SA (118 мг, 0,3 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×20 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-47 в виде белого твердого вещества (34 мг, 24%) и SA-48 в виде белого твердого вещества (25 мг, 18%) и SA-49 в виде белого твердого вещества (22 мг, 16%). Соединение SA-47: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,88 (д, 1H), 6,98 (дд, 1H), 6,58 (д, 1H), 5,34 (AB, 1H), 5,28 (AB, 1H), 3,82 (с, 3H), 2,67 (т, 1H0,69 (с, 3H). LC-MS: Время удерживания=2,39 мин, m/z=466,2 [M+H]+ Соединение SA-48: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,38 (д, 1H), 7,21 (д, 1H), 7,15 (дд, 1H), 5,39 (AB, 1H), 5,34 (AB, 1H), 3,89 (с, 3H), 2,69 (т, 1H), 0,72 (с, 3H). LC-MS: Время удерживания=2,39 мин, m/z=466,2 [M+H]+ Соединение SA-49: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,73 (дд, 1H), 7,08-7,05 (м, 2H), 5,47 (AB, 1H), 5,42 (AB, 1H), 3,87 (с, 3H), 2,63 (т, 1H), 0,74 (с, 3H). LC-MS: Время удерживания=2,49 мин, m/z=466,2 [M+H]+
Пример 24. Синтез соединения SA-50 и SA-51
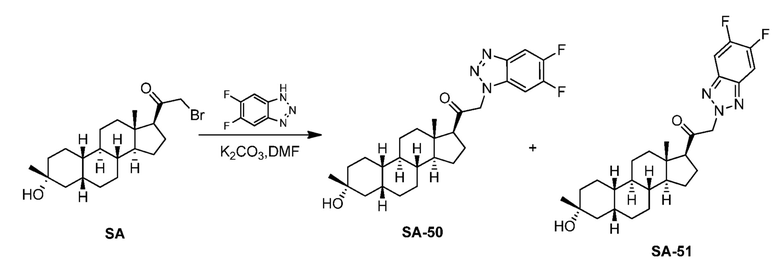
К раствору соединения SA (100 мг, 0,252 ммоль) и K2CO3 (75,6 мг, 0,504 ммоль) в 10 мл сухого DMF добавляли 5,6-дифтор-1H-бензо[d][1,2,3]триазол (78,0 мг, 0,504 ммоль) под N2 при комнатной температуре (18-22°C). Реакционную смесь перемешивали в течение 18 часов при этой температуре. Реакционную смесь выливали в воду и экстрагировали EtOAc (30 мл × 2). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ (HCl/H2O/CH3CN), получая целевое соединение SA-50 (25,0 мг, выход:14%) и SA-51 (87,9 мг, выход:49%) в виде не совсем белого твердого вещества. 1H ЯМР (SA-50): (400 МГц CDCl3) δ 7,62-7,58 (м, 2H), 5,53-5,43 (м, 2H), 2,68-2,64 (м, 1H), 2,24-2,12 (м, 2H), 1,89-1,75 (м, 6H), 1,50-1,40 (м, 7H), 1,37-1,28 (м, 9H), 1,19-1,10 (м, 3H), 0,74 (с, 3H). LC-MS: Время удерживания=1,36 мин, m/z=472,2 [M+H]+. 1H ЯМР (SA-51): (400 МГц CDCl3) δ 7,85-7,81 (м, 1H), 7,15-7,11 (м, 1H), 5,45-5,32 (м, 2H), 2,75-2,70 (м, 1H), 2,24-2,13 (м, 2H), 1,89-1,75 (м, 6H), 1,69-1,57 (м, 3H), 1,48-1,25 (м, 13H), 1,21-1,10 (м, 3H), 0,73 (с, 3H). LC-MS: Время удерживания=1,42 мин, m/z=472,3 [M+H]+
Синтез соединения A3.
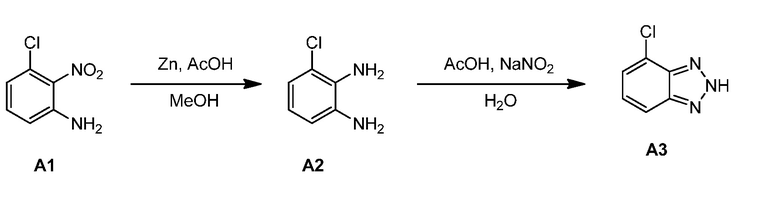
Синтез соединения A2. К раствору соединения A1 (2,0 г, 11,6 ммоль) и порошка Zn (7,6 г, 116 ммоль) в MeOH (40 мл) медленно добавляли AcOH (10 мл) при 0°C. Через 5 минут раствор перемешивали при комнатной температуре в течение 1 часа. TLC (PE/EtOAc=2/1) показала, что реакция завершена. Полученную реакционную смесь фильтровали через слой целита и промывали MeOH (120 мл). Фильтрат концентрировали в вакууме, получая сырой продукт A2 (1,7 г, сырой) в виде коричневого твердого вещества. Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения A3. К раствору соединения A2 (1,7 г, 11,6 ммоль, сырой) в AcOH/H2O (22 мл, 1/10) добавляли NaNO2 (1,2 г, 17,4 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 1 часа. TLC (DCM/MeOH=15/1) показала, что реакция завершена. Добавляли EtOAc (100 мл) и органический слой отделяли. Органический слой промывали водным NaHCO3 (30 мл), 1 н HCl (30 мл) и насыщенным солевым раствором. Слой концентрировали в вакууме и остаток очищали на колонке с силикагелем, элюируя DCM/MeOH=100/1, получая A3 (1,0 г, 56,2%) в виде коричневого твердого вещества. 1H ЯМР: (400 МГц DMSO-d6) δ 16,06 (ушир, 1H), 7,98-7,97 (м, 1H), 7,47-7,37 (м, 2H).
Пример 26. Синтез соединения SA-54

К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (6 мл) добавляли 2H-индазол-3-ол (36 мг, 0,3 ммоль) и SA (100 мг, 0,268 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Затем реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого вещества SA-54 (5 мг, 4,42%), SA-54: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,87 (с, 1H), 7,76 (д, 1H), 7,38 (т, 1H), 7,30 (д, 1H), 7,12 (т, 1H), 5,00 (AB, 1H), 4,85 (AB, 1H), 2,77 (т, 1H), 0,70 (с, 3H). LC-MS: Время удерживания=2,42 мин, m/z=451,1 (M++1)
Пример 27. Синтез соединения SA-55
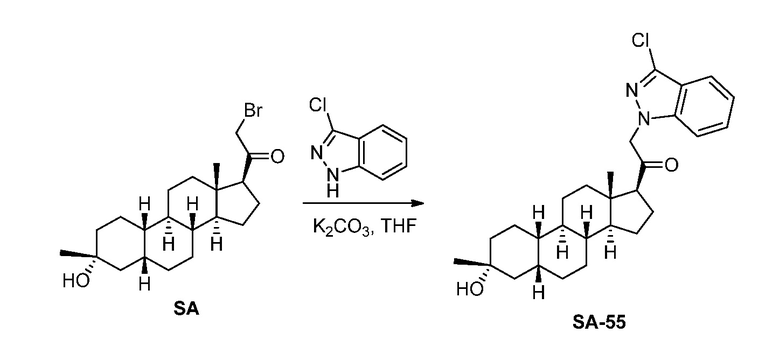
К суспензии K2CO3 (25 мг, 0,18 ммоль) в THF (5 мл) добавляли 3-хлор-1H-индазол (20 мг, 0,13 ммоль) и SA (36 мг, 0,09 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Затем реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого (32 мг, 85,6%). 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,68 (д, 1H), 7,42 (т, 1H) 7,21 (т, 1H) 7,16 (д, 1H), 5,08 (AB, 1H), 5,07(AB, 1H), 2,63 (1H, т), 0,71(с, 3H). LC-MS: Время удерживания=2,59 мин, m/z=469,3 (M++1).
Пример 28. Синтез соединения SA-56, SA-57 и SA-58

К суспензии K2CO3 (25 мг, 0,18 ммоль) в THF (5 мл) добавляли 6-хлор-1H-[1,2,3]триазоло[4,5-b]пиридин (20 мг, 0,23 ммоль) и SA (100 мг, 0,252 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Затем реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого SA-56 (6,6 мг, 5,6%), SA-57 (8 мг, 6,7%), SA-58 (8,1 мг, 6,8%). SA-56 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,68 (д, 1H), 7,77 (д, 1H) 5,50 (AB, 1H), 5,37 (AB, 1H), 2,75 (1H, т), 0,72 (с, 3H). LC-MS: Время удерживания=2,37 мин, m/z=471,4 (M++1). SA-57 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,74 (д, 1H), 8,23 (д, 1H) 5,55 (AB,1H), 5,53 (AB,1H,), 2,68 (1H, т), 0,75 (с, 3H). LC-MS: Время удерживания=2,45 мин, m/z=471,4 (M++1). SA-58 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,58 (д, 1H), 8,37 (д, 1H) 5,51 (AB, 1H), 5,50 (AB, 1H), 2,75 (1H, т), 0,74 (с, 3H). LC-MS: Время удерживания=2,48 мин, m/z=471,4 (M++1).
Пример 30. Синтез соединения SA-61, SA-62 и SA-63
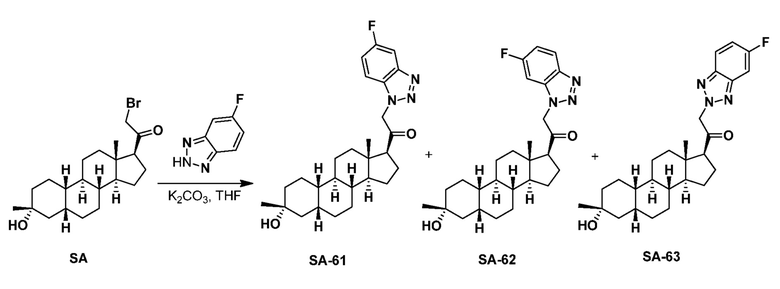
К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (49 мг, 0,36 ммоль) и 9b (72 мг, 0,18 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаточную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение SA-61 в виде белого твердого вещества (7 мг, 8,6%) и SA-62 в виде белого твердого вещества (7 мг, 8,6%) и SA-63 в виде белого твердого вещества (3 мг, 3,7%). Соединение SA-61 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,70 (дд, 1H), 7,30-7,26 (м, 2H), 5,44 (AB, 1H), 5,38 (AB, 1H), 2,71 (т, 1H), 0,72 (с, 3H). LC-MS: Время удерживания=2,34 мин, m/z=454,1 [M+H]+ Соединение SA-62 1H ЯМР (500 МГц CDCl3), δ (м.д.), 8,04 (дд, 1H), 7,15 (тд, 1H), 6,98 (дд, 1H), 5,40 (AB, 1H), 5,34 (AB, 1H), 2,72 (т, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,33 мин, m/z=454,4 [M+H]+ Соединение SA-63 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,87 (дд, 1H), 7,47 (дд, 1H), 7,20 (тд, 1H), 5,52 (AB, 1H), 5,48 (AB, 1H), 2,66 (т, 1H0,75 (с, 3H). LC-MS: Время удерживания=2,41 мин, m/z=454,3 [M+H]+
Пример 31. Синтез соединения SA-64, SA-65 и SA-66

К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 7-фтор-1H-бензо[d][1,2,3]триазол (50 мг, 0,36 ммоль) и SA (72 мг, 0,18 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаточную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение SA-64 в виде белого твердого вещества (8 мг, 9,8%) и SA-65 в виде белого твердого вещества (9 мг, 11%) и SA-66 в виде белого твердого вещества (17 мг, 20,8%). Соединение SA-64 1H ЯМР (400 МГц CDCl3), δ (м.д.), 7,43 (тд, 1H), 7,11 (д, 1H), 7,04 (дд, 1H), 5,45 (AB, 1H), 5,40 (AB, 1H), 2,71 (т, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,33 мин, m/z=454,3 [M+H]+ Соединение SA-65 1H ЯМР (400 МГц CDCl3), δ (м.д.), 7,86 (д, 1H), 7,28 (тд, 1H), 7,13 (дд, 1H), 5,54 (с, 2H), 2,71 (т, 1H), 1,28 (с, 3H), 0,73 (с, 3H). LC-MS: Время удерживания=2,39 мин, m/z=454,1 [M+H]+ Соединение SA-66 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,67 (д, 1H), 7,35-7,26 (м, 1H), 7,04 (дд, 1H), 5,57 (AB, 1H), 5,52 (AB, 1H), 2,67 (т, 1H), 0,75 (с, 3H). LC-MS: Время удерживания=2,45 мин, m/z=454,1 [M+H]+
Пример 32. Синтез соединения SA-67 и SA-69
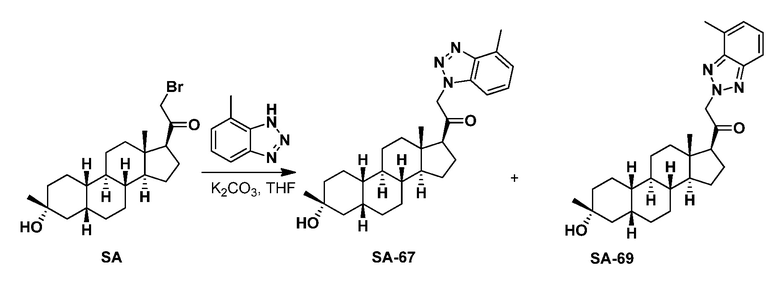
К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 7-метил-1H-бензо[d][1,2,3]триазол (48 мг, 0,36 ммоль) и SA (72 мг, 0,18 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаточную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение SA-67 в виде белого твердого вещества (26 мг, 32%) и SA-69 в виде белого твердого вещества (18 мг, 22%) и в виде белого твердого вещества побочного продукта (3 мг, 3,7%). Соединение SA-67 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,36 (т, 1H), 7,14-7,12 (м, 2H), 5,39 (с, 2H), 2,81 (с, 3H), 2,68 (т, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,38 мин, m/z=450,1 [M+H]+ Соединение SA-69 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,68 (д, 1H), 7,28 (дд, 1H,), 7,13 (д, 1H), 5,53 (AB, 1H), 5,49 (AB, 1H), 2,65 (т, 1H), 2,65 (с, 3H), 0,75 (с, 3H). LC-MS: Время удерживания=2,49 мин, m/z=450,1 [M+H]+
Пример 33. Синтез соединения SA-70, SA-71 и SA-72

К суспензии K2CO3 (100 мг, 0,72 ммоль) в THF (5 мл) добавляли 6-(трифторметокси)-1H-бензо[d][1,2,3]триазол (146 мг, 0,72 ммоль) и SA (144 мг, 0,36 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаточную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение SA-70 в виде белого твердого вещества (47 мг, 25%) и SA-71 в виде белого твердого вещества (37 мг, 19,8%) и SA-72 в виде белого твердого вещества (60 мг, 32%). Соединение SA-70 1H ЯМР (400 МГц CDCl3), δ (м.д.), 7,94 (с, 1H), 7,40-7,34 (м, 2H), 5,48 (AB, 1H), 5,40 (AB, 1H), 2,73 (т, 1H0,72 (с, 3H). LC-MS: Время удерживания=2,49 мин, m/z=520,0 [M+H]+ Соединение SA-71 1H ЯМР (500 МГц CDCl3), δ (м.д.), 8,09 (д, 1H), 7,26 (д, 1H), 7,19 (с, 1H), 5,45 (AB, 1H), 5,38 (AB, 1H), 2,73 (т, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,49 мин, m/z=520,0 [M+H]+ Соединение SA-72 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,91 (д, 1H), 7,72 (с, 1H), 7,28 (д, 1H), 5,55 (AB, 1H), 5,50 (AB, 1H), 2,67 (т, 1H), 0,75 (с, 3H). LC-MS: Время удерживания=2,59 мин, m/z=520,0 [M+H]+.
Пример 34. Синтез соединения SA-73, SA-74 и SA-75

К суспензии K2CO3 (67 мг, 0,50 ммоль) в THF (5 мл) добавляли 7-метокси-1H-бензо[d][1,2,3]триазол (74,6 мг, 0,50 ммоль) и соединение SA (100 мг, 0,25 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-73 в виде белого твердого вещества (12,8 мг, 0,027 ммоль, 11,0%), SA-74 в виде белого твердого вещества (19,2 мг, 0,041 ммоль, 16,5%) и SA-75 в виде белого твердого вещества (9,1 мг, 0,020 ммоль, 7,8%). SA-73: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,63 (1H, д), 7,23 (1H, т), 6,76 (1H, д), 5,59 (1H, AB), 5,58 (1H, AB), 3,89 (1H, с), 2,67 (1H, т0,73 (3H, с). LCMS: Время удерживания=2,44 мин. m/z=466,2 [M+H]+. SA-74: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,38 (1H, т), 6,87 (1H, д), 6,70 (1H, д), 5,37 (2H, с), 4,12 (3H, с), 2,68 (1H, t0,73 (3H, с). LCMS: Время удерживания=2,41 мин. m/z=466,2 [M+H]+. SA-75: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,44 (1H, д), 7,30 (1H, т), 6,64 (1H, д), 5,50 (2H, с), 4,03 (3H, с), 2,64 (1H, т), 0,74 (3H, с). LCMS: Время удерживания=2,50 мин. m/z=466,1 [M+H]+.
Пример 35. Синтез соединения SA-76, SA-77 и SA-78

Синтез соединения A3

Синтез соединения A2. К раствору соединения A1 (2,0 г, 11,6 ммоль) и порошка Zn (7,6 г, 116 ммоль) в MeOH (40 мл) медленно добавляли AcOH (10 мл) при 0°C. Через 5 минут, раствор перемешивали при комнатной температуре в течение 1 часа. TLC (PE/EtOAc=2/1) показала, что реакция завершена. Полученную реакционную смесь фильтровали через слой целита и промывали MeOH (120 мл). Фильтрат концентрировали в вакууме, получая сырой продукт A2 (1,7 г, сырой) в виде коричневого твердого вещества. Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения A3. К раствору соединения A2 (1,7 г, 11,6 ммоль, сырой) в AcOH/H2O (22 мл, 1/10) добавляли NaNO2 (1,2 г, 17,4 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 1 часа. TLC (DCM/MeOH=15/1) показала, что реакция завершена. Добавляли EtOAc (100 мл) и органический слой отделяли. Органический слой промывали водным NaHCO3 (30 мл), 1 н HCl (30 мл) и насыщенным солевым раствором. Слой концентрировали в вакууме и остаток очищали на колонке с силикагелем, элюируя DCM/MeOH=100/1, получая A3 (1,0 г, 56,2%) в виде коричневого твердого вещества. 1H ЯМР: (400 МГц DMSO-d6) δ 16,06 (ушир.с, 1H), 7,98-7,97 (м, 1H), 7,47-7,37 (м, 2H).
Синтез соединения SA-76, SA-77 и SA-78. К суспензии K2CO3 (67 мг, 0,50 ммоль) в THF (5 мл) добавляли 7-хлор-1H-бензо[d][1,2,3]триазол (76,8 мг, 0,50 ммоль) и соединение SA (100 мг, 0,25 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-76 в виде белого твердого вещества (19,8 мг, 0,042 ммоль, 16,8%), SA-77 в виде белого твердого вещества (8,5 мг, 0,018 ммоль, 7,2%) и SA-78 в виде белого твердого вещества (26,6 мг, 0,056 ммоль, 22,6%). SA-76: 1H ЯМР: (400 МГц CDCl3) δ 7,43-7,38 (м, 2H), 7,25-7,23 (м, 1H), 5,43 (д, 2H), 2,73-2,69 (м, 1H), 2,26-2,14(м, 1H), 1,89-1,74 (м, 6H), 1,75-1,62 (м, 1H), 1,55-1,37 (м, 8H), 1,35-1,26 (м, 8H), 1,19-1,11 (м, 3H), 0,73 (с, 3H).LCMS: Время удерживания=2,36 мин. m/z=470,3 [M+H]+. SA-77: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,00 (1H, д), 7,43 (1H, д), 7,30 (1H, т), 5,71 (2H, с), 2,72 (1H, т), 1,28 (с, 3H), 0,74 (с, 3H). LCMS: Время удерживания=2,40 мин. m/z=470,2 [M+H]+. SA-78: 1H ЯМР: (400 МГц CDCl3) δ 7,79 (д, 1H), 7,41 (д, 1H), 7,34-7,30 (м, 2H), 5,56 (с, 2H), 2,69-2,64 (м, 1H), 2,27-2,13 (м, 2H), 1,82-1,75(м, 5H), 1,51-1,43 (м, 11H),1,34-1,28 (м, 5H), 1,19-1,07 (м, 3H), 0,89-0,86 (м, 1H), 0,76 (с, 3H). LCMS: Время удерживания=2,45 мин. m/z=470,3 [M+H]+.
Пример 36. Синтез соединения SC-D2

Синтез соединений SC-A1 и SC-A2. К смеси реакционной смеси SA-F1 и SA-F2 (3,0 г, 10,0 ммоль, 1:1) добавляли сухой (Bu)4NF, затем смесь нагревали 100°C в течение ночи. Остаточную смесь выливали в 50 мл H2O и экстрагировали EtOAc (2×50 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали флэш-хроматографией (элюент: петролейный эфир/этилацетат=20:1) с получением смеси продуктов SC-A1 и SC-A2 (2,1 г, 6,5 ммоль, 65%) в виде белого твердого вещества.
Синтез соединений SC-B1 и SC-B2. К раствору реакционной смеси SC-A1 и SC-A2 (2,1 г, 6,5 ммоль) в безводном THF (30 мл) добавляли BH3.THF (1,0M, 13,0 мл, 13,0 ммоль), раствор перемешивали при 25°C в течение ночи. Затем реакцию гасили добавлением воды (5 мл). Добавляли 2M NaOH раствор (20 мл), затем 30% H2O2 (20 мл). Смесь перемешивали при комнатной температуре в течение 1 часа. Смесь разбавляли этилацетатом (200 мл), полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Смесь сырого продукта использовали непосредственно на следующей стадии без дополнительной очистки.
Синтез соединений SC-C1 и SC-C2. К раствору сырой реакционной смеси соединений SC-B1 и SC-B2 (2,2 г, 6,5 ммоль, теоретическое количество) в дихлорметане (40 мл) добавляли порциями пиридинийхлорхромат (Pcc) (2,8 г, 13,0 ммоль). Раствор перемешивали при 25°C в течение ночи. Затем смесь фильтровали через небольшой слой силикагеля и силикагель промывали дихлорметаном (3×50 мл). Все фильтраты объединяли и концентрировали в вакууме. Остаток очищали флэш-хроматографией (элюент: петролейный эфир/этилацетат=15:1) с получением продукта SC-C1 (910 мг, 2,7 ммоль, Выход=41% (2 стадии)) в виде белого твердого вещества и продукта SC-C2 (850 мг, 2,5 ммоль, Выход=39% (2 стадии)) в виде белого твердого вещества. Соединение SC-C1: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 4,17 (д, 2H), 2,53 (т, 1H), 0,62 (с, 3H). Соединение SC-C2: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 4,45 (AB×d, 1H), 4,39 (AB×d, 1H), 2,54 (т, 1H0,62 (с, 3H).
Синтез соединения SC-D2. К раствору реагента SC-C2 (100 мг, 0,301 ммоль) в метаноле (10 мл) добавляли 48% бромистоводородную кислоту (152 мг, 0,903 ммоль) с последующим добавлением брома (241 мг, 0,077 мл, 1,505 ммоль). Раствор нагревали при 25°C в течение 1,5 часов. Затем смесь выливали в холодную воду (50 мл). Полученное твердое вещество экстрагировали этилацетатом (2×50 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт SC-D2 использовали непосредственно без дополнительной очистки на следующей стадии.
Пример 37. Синтез соединения SA-79 и SA-80

К раствору соединения SC-D2 (120 мг, 0,29 ммоль) в THF (3 мл) добавляли K2CO3 (200 мг, 1,45 ммоль) и 2H-бензо[d][1,2,3]триазол (172 мг, 1,45 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи, затем реакционную смесь разбавляли EtOAc (20 мл). Полученный раствор промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с получением SA-79 (14 мг, 25%), SA-80 (9 мг, 17%) в виде белого твердого вещества. SA-79: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 8,08 (д, 2H), 7,49 (т, 1H,), 7,39 (т, 1H), 7,34 (д, 1H), 5,45 (AB, 1H), 5,40 (AB, 1H), 4,49 (ABxd, 1H), 4,39 (ABxd, 1H), 2,72 (т, 1H), 0,74 (с, 3H). LC-MS: Время удерживания=2,26 мин; m/z=454,4 (M+H)+ SA-80: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 7,89 (дд, 2H), 7,40 (дд, 2H), 5,54 (AB, 1H), 5,50 (AB, 1H), 4,49 (ABxd, 1H), 4,40 (ABxd, 1H), 2,67 (т, 1H), 0,77 (с, 3H). LC-MS: Время удерживания=2,38 мин; m/z=454,3 (M+H)+
Пример 38. Синтез соединения SA-81 и SA-82

К раствору соединения SC-D2 (120 мг, 0,29 ммоль) в THF (3 мл) добавляли K2CO3 (200 мг, 1,45 ммоль) и 1H-[1,2,3]триазоло[4,5-b]пиридин (173 мг, 1,45 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи, затем реакционную смесь разбавляли EtOAc (20 мл). Полученный раствор промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с получением SA-81 (9 мг, 14%), SA-82 (10 мг, 15%) в виде белого твердого вещества. SA-81: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 9,45 (с, 1H), 8,47 (д, 1H), 7,76 (дд, 1H), 5,62 (AB, 1H), 5,57 (AB, 1H), 4,48 (ABxd, 1H), 4,39 (ABxd, 1H),2,75 (т, 1H), 0,76 (с, 3H). LC-MS: Время удерживания=2,26 мин; m/z=455,3 (M+H)+ SA-82: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 9,51 (с, 1H), 8,59 (д, 1H), 7,30 (дд, 1H), 5,50 (AB, 1H), 5,41 (дд, 1H), 4,49 (ABxd, 1H), 4,39 (ABxd, 1H)), 2,76 (т, 1H), 0,74 (с, 3H). LC-MS: Время удерживания=2,19 мин; m/z=455,3 (M+H)+
Пример 39. Синтез соединения SA-83 и SA-84

Синтез соединений SA-83 и SA-84. К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 2H-тетразол (28 мг, 0,4 ммоль) и соединение SC-D2 (83 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов, затем остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-83 в виде белого твердого вещества (10 мг, 11%) и SA-84 в виде белого твердого вещества (5 мг, 6%). Соединение SA-83: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,59 (д, 1H), 8,22 (с, 1H), 8,04 (д, 1H), 7,23 (дд, 1H), 5,28 (AB, 1H), 5,21 (AB, 1H), 4,50 (AB×d, 1H), 4,38 (AB×d, 1H), 2,67 (т, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,11 мин, m/z=454,4 [M+H]+ Соединение SA-84: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,60 (дд, 1H), 8,29 (с, 1H), 7,59 (д, 1H), 7,30 (дд, 1H), 5,20 (AB, 1H), 5,14 (AB, 1H), 4,50 (AB×d, 1H), 4,38 (AB×d, 1H), 2,68 (т, 1H), 2,29 (с, 1H), 2,24-2,12 (м, 2H), 0,72 (с, 3H). LC-MS: Время удерживания=2,15 мин, m/z=454,4 [M+H]+
Пример 40. Синтез соединений SA-85 и SA-86

К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 2H-пиразоло[3,4-c]пиридин (47,6 мг, 0,4 ммоль) и соединение SC-D2 (85 мг, 0,2 ммоль) и смесь перемешивали при комнатной температуре в течение 15 часов. Остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-85 в виде белого твердого вещества (5 мг, 5,5%) и SA-86 в виде белого твердого вещества (10 мг, 11%). Соединение SA-85: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,26 (с, 1H), 8,17 (д, 1H), 7,98 (с, 1H), 7,53 (дд, 1H), 5,32 (AB, 1H), 5,23 (AB, 1H), 4,48 (AB×d, 1H), 4,39 (AB×d, 1H), 2,68 (т, 1H), 0,72 (с, 3H). LC-MS: Время удерживания=2,18 мин, m/z=454,1 [M+H]+ Соединение SA-86: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,8 (с, 1H), 8,33 (д, 1H), 8,09 (с, 1H), 7,65 (д, 1H), 5,28 (AB, 1H), 5,23 (AB, 1H), 4,48 (AB×d, 1H), 4,39 (AB×d, 1H), 2,69 (т, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,14 мин, m/z=454,1 [M+H]+
Пример 41. Синтез соединений SA-87, SA-88 и SA-89
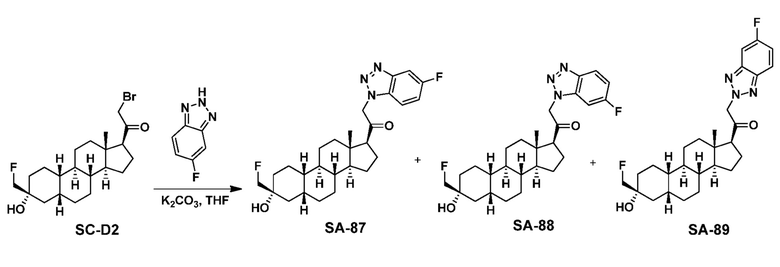
К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (55 мг, 0,4 ммоль) и SC-D2 (85 мг, 0,2 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 15 часов. Остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-87 в виде белого твердого вещества (11,4 мг, 12%) и SA-88 в виде белого твердого вещества (10,2 мг, 10,8%) и SA-89 в виде белого твердого вещества (21,5 мг, 23,0%). Соединение SA-87: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,70 (дд, 1H), 7,31-7,26 (м, 2H), 5,45 (AB, 1H), 5,38 (AB, 1H), 4,49 (AB×d, 1H), 4,38 (AB×d, 1H), 2,72 (т, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,26 мин, m/z=472,3 [M+H]+ Соединение SA-88: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,04 (дд, 1H), 7,15 (тд, 1H), 6,98 (дд, 1H), 5,41 (AB, 1H), 5,34 (AB, 1H), 4,49 (AB×d, 1H), 4,39 (AB×d, 1H), 2,72 (т, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,27 мин, m/z=472,3 [M+H]+ Соединение SA-89: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,86 (дд, 1H), 7,47 (дд, 1H), 7,20 (тд, 1H), 5,52 (AB, 1H), 5,48 (AB, 1H), 4,49 (AB×d, 1H), 4,39 (AB×d, 1H), 2,66 (т, 1H) 0,75 (с, 3H). LC-MS: Время удерживания=2,36 мин, m/z=472,0 [M+H]+
Пример 42. Синтез соединения SC-I2
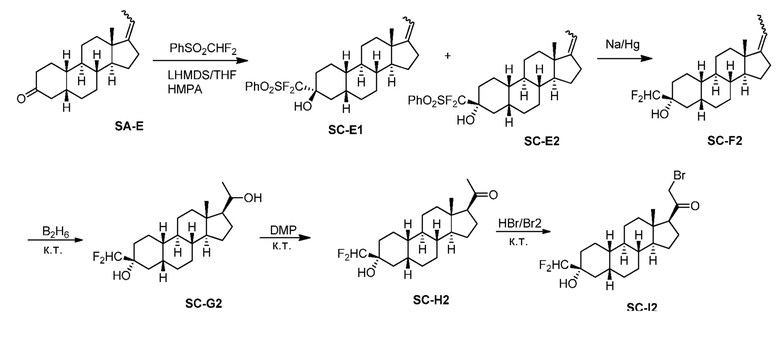
Синтез соединения SC-E1 и SC-E2. К раствору соединения 5 (800 мг, 2,79 ммоль) и PhSO2CF2H (540 мг, 2,79 ммоль) в THF (25 мл) и HMPA (0,5 мл) при -78°C под N2 добавляли по каплям LHMDS (4 мл, 1M в THF). После перемешивания при -78°C в течение 2 часов, реакционную смесь гасили насыщенным водным раствором NH4Cl (10 мл) и оставляли нагреваться до комнатной температуры, затем экстрагировали Et2O (20 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=10/1) с получением смеси соединения SC-E1 и SC-E2 (700 мг). Смесь дополнительно очищали с помощью хиральной ВЭЖХ, получая соединение SC-E1 (200 мг, t=4,31 мин). 1H ЯМР (400 МГц CDCl3), δ (м.д.), 7,99-7,97 (д, 2H), 7,77-7,75 (м, 1H), 7,64-7,60 (м, 2H), 5,14-5,08 (м, 1H), 0,88 (с, 3H); соединение SC-E2 (260 мг, t=5,66 мин). 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,00-7,98 (д, 2H), 7,77-7,75 (м, 1H), 7,64-7,60 (м, 2H), 5,14-5,09 (м, 1H), 0,88 (с, 3H).
Синтез соединения SF-F2. К раствору соединения SC-E2 (100 мг, 0,209 ммоль) и безводного Na2HPO4 (100 мг) в безводном метаноле (5 мл) при -20°C под N2 добавляли амальгаму Na/Hg (500 мг). После перемешивания при -20°C до 0°C в течение 1 часа, раствор метанола декантировали, и твердый остаток промывали Et2O (5×3 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над MgSO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (петролейный эфир/этилацетат=10/1) с получением соединения SC-F2 (36 мг, 0,106 ммоль, 51%). 1H ЯМР (400 МГц CDCl3), δ (м.д.), 6,02-5,88 (т, 1H), 5,17-5,15 (м, 1H), 0,88 (с, 3H).
Синтез соединения SC-G2. К раствору соединения SC-F2 (150 мг, 0,443 ммоль) в сухом THF (5 мл) добавляли комплекс боран-тетрагидрофуран (1,34 мл 1,0M раствора в THF). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь охлаждали на бане со льдом, затем медленно гасили 10%-ным водным NaOH (1 мл), затем 30% водным раствором H2O2 (1,2 мл). Смесь оставляли перемешиваться при комнатной температуре в течение 1 часа и затем экстрагировали EtOAc (3×10 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (10 мл), насыщенным солевым раствором (10 мл), сушили над MgSO4, фильтровали и концентрировали, получая сырое соединение SC-G2 (210 мг). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения SC-H2. К раствору сырого соединения SC-G2 (210 мг), растворенного в 10 мл H2O насыщенного дихлорметана (дихлорметан встряхивали с несколькими миллилитрами Н2О, затем отделяли от водного слоя), добавляли периодинат Десс-Мартина (380 мг, 0,896 ммоль). После перемешивания при комнатной температуре в течение 24 часов, реакционную смесь экстрагировали дихлорметаном (3×10 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (10 мл), насыщенным солевым раствором (10 мл), сушили над MgSO4, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (петролейный эфир/этилацетат=5:1), с получением соединения SC-H2 (90 мг, 0,254 ммоль, 57%) в виде белого твердого вещества.
Синтез соединения SC-I2. К раствору соединения SC-H2 (80 мг, 0,226 ммоль) в MeOH (5 мл) добавляли 2 капли HBr (48%) с последующим добавлением брома (100 мг, 0,63 ммоль). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь выливали в воду со льдом, затем экстрагировали этилацетатом (15 мл × 3), Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над MgSO4, фильтровали и концентрировали с получением сырого соединения SC-I2 (95 мг). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Пример 43. Синтез соединения SA-90 и SA-92

К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 1H-бензо[d][1,2,3]триазол (20 мг, 0,23 ммоль) и SC-I2 (100 мг, 0,23 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого вещества SA-90 (12,2 мг, 11%). SA-92 (6,6 мг, 6,0%). Побочный продукт (5 мг, 4,6%). SA-90 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,08 (д, 1H), 7,48 (т, 1H), 7,38 (т, 1H), 7,34 (д, 1H), 5,88 (т, 1H), 5,43 (AB, 1H), 5,41 (AB, 1H), 2,72 (1H, т), 0,71(с,3H). LC-MS:Время удерживания=2,35 мин, m/z=472,2 (M++1). SA-92 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,88 (дд, 2H), 7,40 (дд, 2H) 6,01(т, 1H), 5,53 (AB,1H), 5,48 (AB, 1H), 2,68 (т, 1H), 0,76 (с, 3H). LC-MS:Время удерживания=2,45 мин, m/z=472,3(M++1).
Пример 44. Синтез соединения SA-93 и SA-94
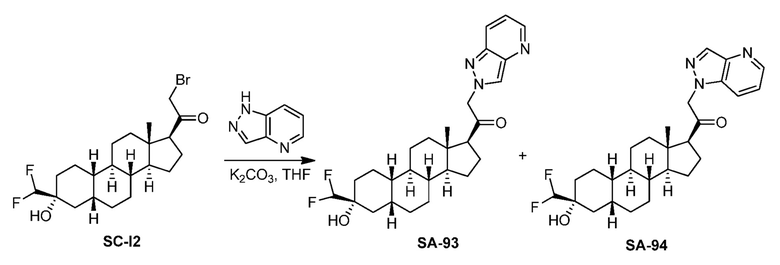
К суспензии K2CO3 (50 мг, 0,36 ммоль) в THF (5 мл) добавляли 2H-пиразоло[4,3-b]пиридин (50 мг, 0,42 ммоль) и SM (100 мг, 0,23 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали препаративной ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение в виде белого твердого SA-93 (9,3 мг, 8,6%). SA-94 (21 мг, 19,2%). Побочный продукт (6 мг, 5,6%). SA-93 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,58 (д, 1H), 8,21 (с, 1H), 8,06 (д, 1H), 7,22 (дд, 1H), 5,88 (т, 1H), 5,30 (AB, 1H), 5,26 (AB, 1H), 2,69 (т, 1H), 0,71 (с, 3H). LC-MS:Время удерживания=2,21 мин, m/z=472,3 (M++1). SA-94 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,60 (д, 1H), 8,28 (1H, с) 7,58 (д, 1H),7,31 (дд, 1H), 5,88 (т, 1H), 5,17 (AB, 1H), 5,15 (AB, 1H), 2,65 (т, 1H), 0,72 (с, 3H). LC-MS:Время удерживания=2,24 мин, m/z=472,2(M++1).
Пример 45. Синтез соединения SA-96 и SA-97
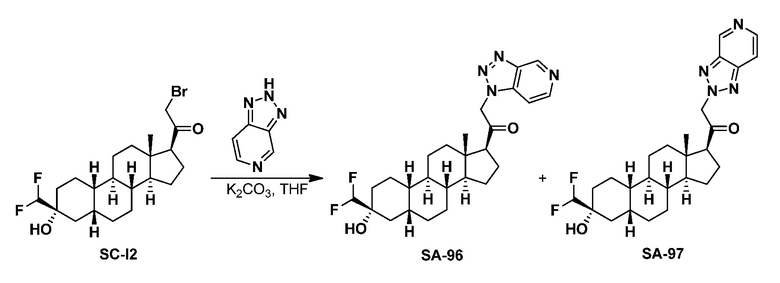
К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 2H-[1,2,3]триазоло[4,5-c]пиридин (48 мг, 0,4 ммоль) и 10 (86 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-96 в виде белого твердого вещества (30 мг, 31,8%) и SA-97 в виде белого твердого вещества (16 мг, 16,9%) и побочного продукта белого твердого вещества (2 мг, 2%). Соединение SA-96: 1H ЯМР (500 МГц, CDCl3) δ (м.д.): 9,50 (с, 1H), 8,58 (д, 1H), 7,30 (д, 1H), 5,88 (т, 1H), 5,49 (AB, 1H), 5,41 (AB, 1H), 2,75 (т, 1H), 2,27-2,16 (м, 2H), 0,74 (с, 3H). LC-MS: Время удерживания=2,24 мин, m/z=473,1 [M+H]+ Соединение SA-97: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,46 (с, 1H), 8,47 (д, 1H), 7,76 (дд, 1H), 5,87 (т, 1H), 5,62 (AB, 1H), 5,57 (AB, 1H), 2,70 (т, 1H), 2,28-2,16 (м, 2H), 0,76 (с, 3H). LC-MS: Время удерживания=2,31 мин, m/z=473,1 [M+H]+
Пример 46. Синтез соединения SA-99 и SA-100
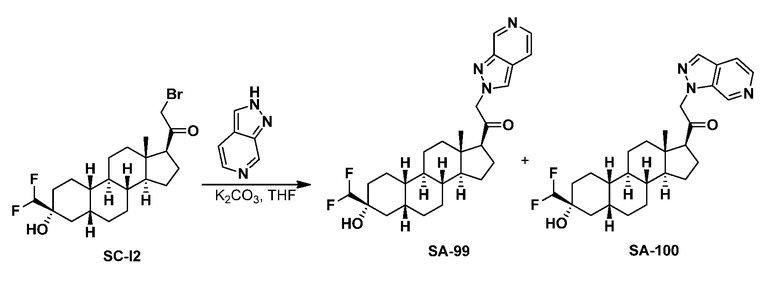
К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 2H-пиразоло[3,4-c]пиридин (48 мг, 0,4 ммоль) и 10 (86 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-99 в виде белого твердого вещества (4 мг, 4%) и SA-100 в виде белого твердого вещества (19 мг, 20%) и побочного продукта белого твердого вещества (4 мг, 4%). Соединение SA-99: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,25 (с, 1H), 8,17 (д, 1H), 7,53 (дд, 1H), 5,87 (т, 1H), 5,32 (AB, 1H), 5,23 (AB, 1H), 2,68 (т, 1H), 2,27-2,20 (м, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,12 мин, m/z=472,0 [M+H]+ Соединение SA-100: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,80 (с, 1H), 8,33 (д, 1H), 8,10 (с, 1H), 7,65 (дд, 1H), 5,87 (т, 1H), 5,28 (AB, 1H), 5,23 (AB, 1H), 2,69 (т, 1H), 2,24-2,13 (м, 2H), 0,73 (с, 3H). LC-MS: Время удерживания=2,18 мин, m/z=472,0 [M+H]+
Пример 47. Синтез соединения SA-102, SA-103 и SA-104

К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (55 мг, 0,4 ммоль) и 10 (86 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-102 в виде белого твердого вещества (15 мг, 15,3%) и SA-103 в виде белого твердого вещества (18,8 мг, 19%) и SA-104 в виде белого твердого вещества (16,3 мг, 16,5%). Соединение SA-102: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,70 (дд, 1H), 7,31-7,28 (м, 2H), 5,88 (т, 1H), 5,45 (AB, 1H), 5,38 (AB, 1H), 2,72 (т, 1H), 2,27-2,13 (м, 2H), 0,73 (с, 3H). LC-MS: Время удерживания=2,38 мин, m/z=490,1 [M+H]+ Соединение SA-103: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,04 (дд, 1H), 7,15 (тд, 1H), 6,98 (дд, 1H), 5,88 (т, 1H), 5,42 (AB, 1H), 5,34 (AB, 1H), 2,72 (т, 1H), 2,23-2,14 (м, 2H), 0,73 (с, 3H). LC-MS: Время удерживания=2,39 мин, m/z=490,1 [M+H]+ Соединение SA-104: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,86 (дд, 1H), 7,47 (дд, 1H), 7,20 (тд, 1H), 5,87 (т, 1H), 5,52 (AB, 1H), 5,47 (AB, 1H), 2,66 (т, 1H), 2,24-2,13 (м, 2H), 0,75 (с, 3H). LC-MS: Время удерживания=2,48 мин, m/z=490,1 [M+H]+
Пример 48. Синтез соединения SA-J


Синтез соединения SA-B. Соединение SA-A (500 мг, 1,84 ммоль) и 10% Pd/черный (20 мг) в тетрагидрофуране (5 мл) и концентрированную бромистоводородную кислоту (0,02 мл) гидрогенизировали баллонным водородом при 1 атм. После перемешивания при комнатной температуре в течение 24 часов, смесь фильтруют через слой целита и фильтрат концентрировали в вакууме. Перекристаллизация из ацетона давала соединение SA-B (367 мг, 1,34 ммоль, 73%). 1H ЯМР (400 МГц CDCl3), δ (м.д.) 2,61 (т, 1H), 2,5 (дд, 1H), 2,2 (м, 4H), 2,1 (м, 2H), 1,9 (м, 1H), 1,85 (м, 2H), 1,75 (1H), 1,65 (м, 3H), 1,55 (м, 2H), 1,45-1,1 (м, 6H), 0,98 (с, 3H).
Синтез соединения SA-C. К раствору соединения SA-B (274 мг. 1 ммоль) в метаноле (4 мл) добавляли йод (0,1 ммоль). После перемешивания при 60°C в течение 12 часов, ТСХ показала отсутствие SM и растворитель удаляли в вакууме. Неочищенный продукт растворяли в дихлорметане (20 мл) и промывали насыщенным NaHCO3 (15 мл), насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на оксиде алюминия (петролейный эфир/этилацетат=9:1), получая соединение SA-C (280 мг, 0,88 ммоль, 88%). 1H ЯМР (400 МГц CDCl3), δ (м.д.) 3,19 (с, 3H), 3,13 (с, 3H), 2,43 (дд, 1H), 2,1 (м, 1H), 1,9 (м, 2H), 1,8 (м, 4H), 1,65 (м, 2H), 1,6-1,1 (м, 13H), 0,83 (с, 3H).
Синтез соединения SA-D. К раствору метилтрифенилфосфонийбромида (10,26 г, 28,84 ммоль) в 30 мл THF, добавляли KOt-Bu (3,23 г, 28,80 ммоль). Реакционную смесь нагревали до 60°C в течение 1 часа. SA-C (3,23 г, 9,6 ммоль) добавляли к смеси, перемешивают при 60°C в течение 15 часов. Реакционную смесь экстрагировали 500 мл EtOAc, промывали насыщенным солевым раствором и упаривали в вакууме, затем очищали флэш-хроматографией на силикагеле (петролейный эфир/этилацетат=3:1) с получением SA-D, в виде белого твердого вещества (2,1 г, 65% выход).
Синтез соединения SA-E. К раствору SA-D (1 г, 3,1 ммоль) в 20 мл THF, добавляли 2M HCl 2 мл, перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили 5 мл H2O и экстрагировали 100 мл EtOAc, промывали насыщенным солевым раствором и упаривали в вакууме, а затем очищали хроматографией (PE:EtOAc=10:1) с получением SA-E в виде белого твердого вещества (710 мг, 83% выход). 1H ЯМР (400 МГц CDCl3), δ (м.д.) 4,65 (с, 1H), 4,63 (с, 1H), 2,6 (т, 1H), 2,5 (дд, 1H), 2,2 (м, 5H), 2,1 (м, 1H), 1,9-1,7 (мм, 4H), 1,6 (м, 3H), 1,5 (ушир.д, 1H), 1,4-1,1 (м, 7H), 0,82 (с, 3H).
Синтез соединения SA-F. К перемешиваемому раствору йодид триметилсульфония (6,4 г, 31,5 ммоль) в 10 мл DMSO добавляли NaH (60%; 800 мг, 31,5 ммоль). После перемешивания при комнатной температуре в течение 1 часа, суспензию SA-E (870 мг, 3,2 ммоль) в 5 мл DMSO добавляли по каплям. Через 15 часов реакционную смесь выливали в ледяную воду и экстрагировали 300 мл EtOAc, промывали 100 мл насыщенным солевым раствором, сушили и выпаривали в вакууме, затем очищали с помощью хроматографии (PE:EtOAc=10:1) с получением SA-F в виде белого твердого вещества(695 мг, 76% выход).
Синтез соединения SA-G. К раствору SA-F и его изомера (129 мг, 0,45 ммоль) в 10 мл THF, добавляли LiAlH4 (50 мг, 1,35 ммоль), перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили 5 мл H2O и экстрагировали 100 мл EtOAc, промывали насыщенным солевым раствором и упаривали в вакууме, а затем очищали хроматографией (петролейный эфир/этилацетат=3:1) с получением SA-G в виде белого твердого вещества (62 мг, 48% выход). 1H ЯМР (400 МГц CDCl3), δ (м.д.) 4,63 (с, 1H), 4,61 (с, 1H), 2,5 (м, 1H), 2,2 (м, 1H), 1,9 (д, 1H), 1,8 (д, 3H), 1,7 (м, 3H), 1,6 (с, 3H), 1,5-1,2 (мм, 13H), 1,1 (м, 4H), 0,82 (с, 3H).
Синтез соединения SA-H. К раствору SA-G (86 мг, 0,3 ммоль) в сухом THF (5 мл) добавляли комплекс боран-тетрагидрофуран (1 мл; 1,0M раствор в THF). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь охлаждали на бане со льдом, затем медленно гасили 10%-ным водным NaOH (1 мл), затем 30% водным раствором H2O2 (1 мл). После перемешивания при комнатной температуре в течение одного часа, смесь экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (100 мл), насыщенным солевым раствором (водн., 100 мл), сушили над MgSO4, фильтровали и концентрировали с получением SA-H в виде белого твердого вещества (83 мг, 91%). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения SA-I. К раствору SA-H (300 мг, 0,80 ммоль) в 15 мл DMF, добавляли PDC (2,7 г, 7,2 ммоль) и 1 мл H2O, перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь экстрагировали 100 мл EtOAc, промывали насыщенным солевым раствором и выпаривали в вакууме, затем очищали с помощью хроматографии (PE:EtOAc=1:1) с получением SA-I в виде белого твердого вещества 128 мг, 50% выход. 1H ЯМР (400 МГц DMSO-d6), δ (м.д.), 11,90 (с, 1H), 4,22 (с, 1H), 2,28 (т, 1H), 1,9 (м, 2H), 1,6 (2×м, 7H), 1,5-0,9 (multipleМ и с, 17H), 0,68 (с, 3H).
Синтез соединения SA-J. К раствору SA-I (200 мг, 0,61 ммоль) в 5 мл DMF, добавляли гидрохлорид N,O-диметилгидроксиламина (60 мг, 0,62 ммоль), HATU (236 мг, 0,62 ммоль), DIPEA 1 мл, и перемешивали при комнатной температуре в течение 3 часов, Реакционную смесь экстрагировали 100 мл EtOAc, промывали насыщенным солевым раствором и выпаривали в вакууме, затем очищали хроматографией (петролейный эфир/этилацетат=1:1) с получением SA-J в виде белого твердого вещества 110 мг, 55% выход. 1H ЯМР (400 МГц DMSO-d6), δ (м.д.), 3,64 (с, 3H), 3,19 (с, 3H), 2,70 (ушир.с, 1H), 2,17 (ушир.т, 1H), 1,8-1,6 (м, 8H), 1,5-1,2 (severalМ и с, 14H), 1,1 (м, 3H), 0,73 (с, 3H).
Пример 48. Синтез соединения SA-105
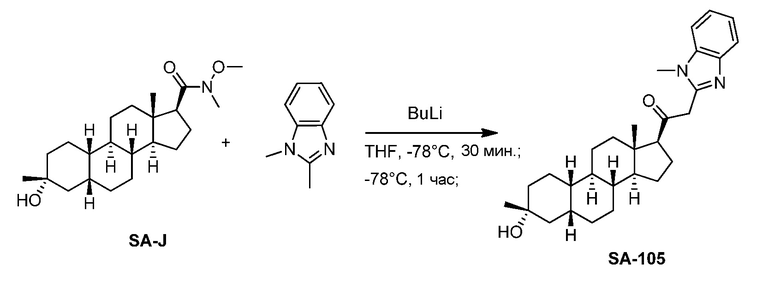
К перемешиваемому раствору 1,2-диметил-1H-бензо[d]имидазола (100 мг, 0,7 ммоль) в 10 мл THF добавляли BuLi (2,5M; 0,3 мл, 0,7 ммоль) при -78°C. После перемешивания при -78°C в течение 30 минут, раствор SA-J (50 мг, 0,14 ммоль) в 3 мл THF по каплям добавляли при -78°C. После перемешивания при -78°C в течение 1 часа, реакционную смесь выливали в ледяную воду и экстрагировали EtOAc (100 мл × 3). Объединенные экстракты промывали насыщенным солевым раствором (100 мл × 3), сушили (MgSO4), фильтровали и упаривали в вакууме, очищали с помощью препаративной ВЭЖХ, получая SA-105, в виде белого твердого вещества 13 мг, 21,43% выход. Продукт находится в виде смеси C-20 кетон и енол. 1H ЯМР (500 МГц CDCL3), δ (м.д.), 7,71-7,74, 7,37-7,41, 7,23-7,34, 7,16-7,18 (м, 4H,C-20 кетон и енол), 5,20 (с, 1H,C-20 енол), 4,11 (1H,AB), 4,05 (1H,AB),3,71 (3H,с, C-20 кетон), 3,57(3H, C-20 енол), 2,78 (1H, т, C-20 кетон), 2,40 (1H, т, C-20 енол), 0,70 (с, 3H). LCMS: Время удерживания=2,39 мин, m/z=449,3 [M+H]
Пример 49. Синтез соединения SA-106

К перемешиваемому раствору 1-метилизохинолина (197 мг, 1,375 ммоль) в 10 мл THF добавляли BuLi (2,5M; 0,55 мл, 1,375 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 40 минут, раствор SA-J (0,1 г, 0,275 ммоль) в 5 мл THF по каплям добавляли при 0°C. После перемешивания при комнатной температуре в течение 2 часов, реакционную смесь выливали в ледяную воду и экстрагировали EtOAc (100 мл × 3), промывали насыщенным солевым раствором (100 мл × 3), сушили (MgSO4), фильтровали и упаривали в вакууме, затем очищали с помощью препаративной ВЭЖХ, получая SA-106, в виде желтого твердого вещества 18 мг, 15% выход. 1H ЯМР (500 МГц CDCl3), δ (м.д.), 15,49 (ушир.с, 1H), 8,03 (д, 1H), 7,61-7,56 (м, 1H), 7,50 (д, 1H), 7,46 (т, 1H), 7,22 (д, 1H), 5,97 (с, 1H), 2,54 (т, 1H), 0,68 (с, 3H). LCMS: Время удерживания=2,090 мин, MS (ESI) m/z: 446 [M+H]+.
Пример 50. Синтез соединения SD-D
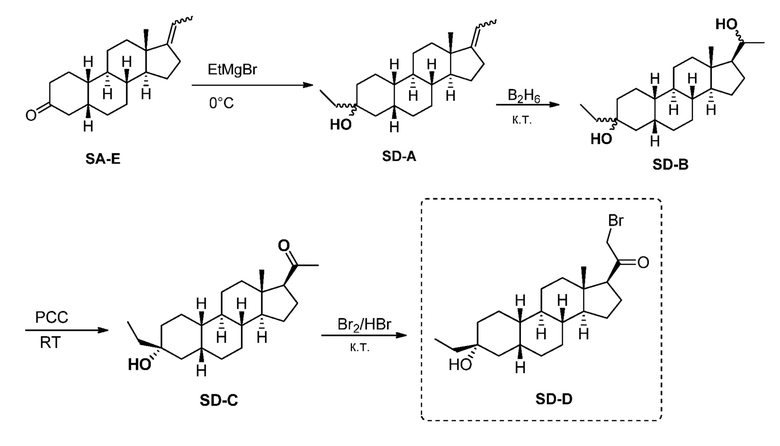
Синтез соединения SD-A. К раствору EtMgBr (5 ммоль, 1M в THF) в THF (20 мл) при 0°C добавляли раствор соединения SA-E (858 мг, 3 ммоль) в сухом THF (5 мл) с помощью шприцевого насоса в течение 30 минут. После перемешивания при 0°C в течение 5 часов, реакционную смесь оставляли нагреваться до и перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили ледяной водой и экстрагировали EtOAc (15 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Белый остаток очищали колоночной флэш-хроматографией (петролейный эфир/этилацетат=20:1-10:1), с получением соединения SD-A (900 мг).
Синтез соединения SD-B. К раствору соединения SD-A (200 мг, 0,66 ммоль) в сухом THF (5 мл) добавляли комплекс боран-тетрагидрофуран (2 мл 1,0M раствор в THF). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь охлаждали на бане со льдом, затем медленно гасили 10%-ным водным NaOH (1 мл), затем 30% водным раствором H2O2 (1,2 мл). Смесь оставляли перемешиваться при комнатной температуре в течение 1 часа и затем экстрагировали EtOAc (3×10 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (10 мл), насыщенным солевым раствором (10 мл), сушили над MgSO4, фильтровали и концентрировали с получением соединения SD-B (260 мг, сырой). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения SD-C. К раствору соединения SD-B (260 мг, сырой), растворенному в 10 мл дихлорметана добавляли PCC (449 мг). После перемешивания при комнатной температуре в течение 24 часов, реакционную смесь экстрагировали дихлорметаном (3×10 мл). Объединенные органические слои промывали 10%-ным водным NaCl (10 мл), насыщенным солевым раствором (10 мл), сушили над MgSO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (петролейный эфир/этилацетат=4:1-2:1) с получением указанного в заголовке SD-C (15 мг,) в виде белого твердого вещества. 1H ЯМР (500 МГц CDCl3), δ (м.д.), 2,49(1H, т), 2,09 (с, 3H)0,84(3H, т), 0,59 (с, 3H).
Синтез соединения SD-D. К раствору соединения SD-C (30 мг, 0,09 ммоль) в MeOH (5 мл) добавляли 2 капли HBr (48%), затем бром (100 мг, 0,62 ммоль). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь выливали в воду со льдом, затем экстрагировали этилацетатом (15 мл × 3), Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над MgSO4, фильтровали и концентрировали с получением соединения SD-D (36 мг, сырой). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Пример 51. Синтез соединения SA-107, SA-108 и SA-109
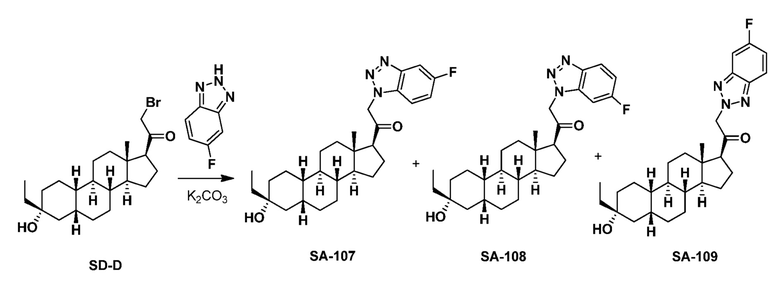
К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (55 мг, 0,4 ммоль) и SD-D (85 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-107 в виде белого твердого вещества (5,6 мг, 5,5%) и SA-108 в виде белого твердого вещества (8,4 мг, 8,5%) и SA-109 в виде белого твердого вещества (13,7 мг, 14,0%). Соединение SA-107: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,70 (д, 1H), 7,30-7,28 (м, 2H), 5,43 (AB, 1H), 5,39 (AB, 1H), 2,71 (т, 1H), 2,23-2,09 (м, 2H), 1,47 (кв, 2H), 0,93 (т, 3H), 0,74 (с, 3H). LC-MS: Время удерживания=2,32 мин, m/z=468,3 [M+H]+ Соединение SA-108: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,04 (дд, 1H), 7,15 (тд, 1H), 6,98 (дд, 1H), 5,39 (AB, 1H), 5,35 (AB, 1H), 2,71 (т, 1H), 2,25-2,08 (м, 2H), 1,47 (кв, 2H), 0,93 (т, 3H), 0,74 (с, 3H). LC-MS: Время удерживания=2,34 мин, m/z=468,3 [M+H]+ Соединение SA-109: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,86 (дд, 1H), 7,47 (дд, 1H), 7,20 (тд, 1H), 5,52 (AB, 1H), 5,48 (AB, 1H), 2,66 (т, 1H), 2,24-2,07 (м, 2H), 1,46 (кв, 2H), 0,93 (т, 3H), 0,75 (с, 3H). LC-MS: Время удерживания=2,43 мин, m/z=468,3 [M+H]+
Пример 52. Синтез соединений SA-110 и SA-111

К раствору соединения SC-D (120 мг, 0,29 ммоль) в THF (3 мл) добавляли K2CO3 (210 мг, 1,5 ммоль) и 2H-пиразоло[4,3-b]пиридин (180 мг, 1,5 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи, затем LCMS показала, что реакция была завершена. Реакционную смесь разбавляли EtOAc (20 мл) и полученный раствор промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с получением SA-110 (6 мг, 0,0113 ммоль, Выход=5%), SA-111 (8 мг, 0,0117 ммоль, Выход=6%) в виде белого твердого вещества. SA-110: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 8,58 (т, 1H), 8,22 (с, 1H), 8,04 (д, 1H), 7,23 (дд, 1H), 5,27 (AB, 1H), 5,21 (AB, 1H), 2,67 (т, 1H), 0,89 (т, 3H), 0,72 (с, 3H). LC-MS: Время удерживания=2,276 мин; m/z=450,4 (M+H)+ SA-111: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 8,60 (дд, 1H), 8,28 (с, 1H), 7,59 (д, 1H), 7,30 (дд, 1H), 5,19 (AB, 1H), 5,13 (AB, 1H), 2,67(т, 1H), 0,90 (т, 3H), 0,72 (с, 3H). LC-MS: Время удерживания=2,389 мин; m/z=450,2 (M+H)+
Пример 53. Синтез соединения SA-112, SA-113 и SA-114
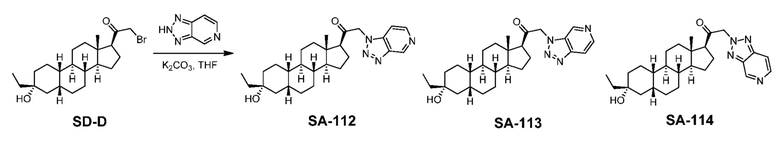
К раствору SD-D (160 мг, 0,39 ммоль) в THF (3 мл) добавляли 2H-[1,2,3]триазоло[4,5-c]пиридин (230 мг, 1,95 ммоль) и K2CO3 (270 мг, 1,95 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи, затем LCMS показала, что реакция была завершена. Реакционную смесь разбавляли EtOAc (40 мл) и промывали насыщенным солевым раствором (20 мл × 2), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с получением SA-112/SA-113 (смесь, 35 мг, 16%) и SA-114 (11 мг, 0,0244 ммоль, Выход=5%) в виде белого твердого вещества. ЯМР показал, СА-112/SA-113 представляет собой смесь двух соединений, и дальнейшую очистку с помощью хиральной ВЭЖХ с получением SA-112 (9 мг, 0,02 ммоль, Выход=5%), SA-113 (3 мг, 0,00666 ммоль, Выход=3%) в виде белого твердого вещества. SA-112: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 9,49 (д, 1H), 8,58 (д, 1H), 7,30 (дд, 1H), 5,49 (AB, 1H), 5,42 (AB, 1H), 2,75 (т, 1H), 0,90 (т, 3H), 0,76 (с, 3H). LC-MS: Время удерживания=2,291 мин; m/z=451,1 (M+H)+ SA-113: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 8,97 (д, 1H), 8,55 (д, 1H), 7,98 (д, 1H), 5,57 (AB, 1H), 5,52 (AB, 1H), 2,77 (т, 1H), 0,90 (т, 3H), 0,76 (с, 3H). LC-MS: Время удерживания=2,305 мин; m/z=451,1 (M+H)+ SA-114: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 9,46 (д, 1H), 8,47 (д, 1H), 7,76 (дд, 1H), 5,62 (AB, 1H), 5,57 (AB, 1H), 2,70 (т, 1H), 0,90 (т, 3H), 0,76 (с, 3H). LC-MS: Время удерживания=2,373 мин; m/z=451,4 (M+H)+
Пример 54. Синтез соединения SE-D2

1. Синтез соединения SE-A. Смесь соединения SA-F1 и SA-F2 (5,0 г, 16,7 ммоль) растворяли в сухом метаноле (250 мл), и Na металл (1,2 г, 50,0 ммоль) добавляли и раствор нагревали с обратным холодильником в течение 16 часов. Метанол затем упаривали, и остаток растворяли в дихлорметане и промывали H2O (3×50 мл) и насыщенным солевым раствором (100 мл), сушили над MgSО4, фильтровали и концентрировали. Сырое целевое соединение очищали хроматографией на силикагеле (петролейный эфир/этилацетат=10:1-5:1), и концентрировали с получением смеси продуктов SE-A1 и SE-A2 (4,6 г, 83%) в виде белого твердого вещества.
Синтез соединения SE-B. К раствору реакционной смеси SE-A1 и SE-A2 (4,6 г, 13,9 ммоль) в безводном THF (30 мл) добавляли BH3.THF (1,0M, 27,7 мл, 27,7 ммоль), раствор перемешивали при 25°C в течение ночи, затем реакцию гасили добавлением воды (5 мл). 2M NaOH раствор (30 мл) добавляли, затем 30% H2O2 (30 мл). Смесь перемешивали при комнатной температуре в течение 1 часа. Смесь разбавляли этилацетатом (200 мл) и полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Смесь сырого продукта использовали непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SE-C. К раствору неочищенной реакционной смеси SE-B1 и SE-B2 (4,9 г, 13,9 ммоль, теоретическое количество) в дихлорметане (40 мл) добавляли порциями пиридинийхлорхромат (PCC) (6,0 г, 27,8 ммоль). Раствор перемешивали при 25°C в течение ночи, затем смесь фильтровали через небольшой слой силикагеля и силикагель промывали дихлорметаном (3×50 мл). Все фильтраты объединяли и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии (элюент: петролейный эфир/этилацетат =15:1) с получением продукта SE-C1 (2,1 г, 6,03 ммоль, Выход=43% (2 стадии)) в виде белого твердого вещества и продукта SE-C2 (2,2 г, 6,32 ммоль, Выход=45% (2 стадии)) в виде белого твердого вещества. Соединение SE-C1: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 3,40 (с, 3H), 3,20 (с, 2H), 2,62-2,51 (м, 2H), 2,11 (с, 3H), 2,02-1,99 (м, 2H), 0,62 (с, 3H). Соединение SE-C2: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 3,42 (AB, 1H), 3,38 (AB, 1H), 3,40 (с, 3H), 2,65 (с, 1H), 2,54 (т, 1H), 2,16-2,14 (м, 1H), 2,11 (с, 3H), 2,02-1,98 (м, 1H), 0,61 (с, 3H).
Синтез соединения SE-D2. К раствору реагента SE-C2 (100 мг, 0,301 ммоль) в метаноле (10 мл) добавляли 48% бромистоводородную кислоту (152 мг, 0,903 ммоль) с последующим добавлением брома (241 мг, 0,077 мл, 1,51 ммоль). Раствор нагревали при 25°C в течение 1,5 часов, затем смесь выливали в холодную воду (50 мл) и полученное твердое вещество экстрагировали этилацетатом (2×50 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт SE-D2 использовали непосредственно без дополнительной очистки на следующей стадии.
Пример 55. Синтез соединения SA-115

К раствору соединения SE-D2 (120 мг, 0,28 ммоль) в THF (3 мл) добавляли K2CO3 (190 мг, 1,4 ммоль) и 2H-бензо[d][1,2,3]триазол (167 мг, 1,4 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи, затем реакционную смесь разбавляли EtOAc (20 мл). Полученный раствор промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с получением SA-115 (36 мг, 25%) в виде белого твердого вещества. 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 8,08 (д, 1H), 7,49 (т, 1H), 7,38 (т, 1H), 7,34 (д, 1H), 5,45 (AB, 1H), 5,39 (AB, 1H), 3,42 (AB, 1H), 3,40 (с, 3H), 3,39 (AB, 1H), 2,72 (т, 1H), 2,64 (с, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,37 мин; m/z=466,2 (M+H)+
Пример 56. Синтез соединения SA-116 и SA-117
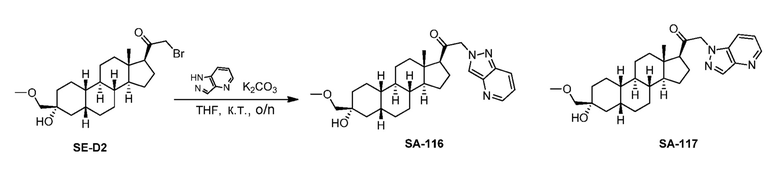
К раствору соединения SE-D2 (120 мг, 0,28 ммоль) в THF (3 мл) добавляли K2CO3 (190 мг, 1,4 ммоль) и 1H-пиразоло[4,3-b]пиридин (167 мг, 1,4 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи, реакционную смесь разбавляли EtOAc (20 мл). Полученный раствор промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с получением SA-116 (18 мг, 14%), SA-117 (13 мг, 10%) в виде белого твердого вещества. SA-116: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 8,59 (д, 1H), 8,23 (с, 1H), 8,04 (д, 1H), 7,23 (дд, 1H), 5,28 (AB, 1H), 5,21 (AB, 1H), 3,42 (AB, 1H), 3,40 (с, 3H), 3,39 (AB, 1H), 2,67 (т, 1H), 2,64 (с, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,22 мин; m/z=466,2 (M+H)+ SA-117: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 8,60 (д, 1H), 8,28 (с, 1H), 7,58 (д, 1H), 7,29 (дд, 1H), 5,19 (AB, 1H), 5,14 (AB, 1H), 3,42 (AB, 1H), 3,40 (с, 3H), 3,39 (AB, 1H), 2,67 (т, 1H), 2,6 (с, 1H), 0,72 (с, 3H). LC-MS: Время удерживания=2,26 мин; m/z=466,2 (M+H)+
Пример 57. Синтез соединения SA-118 и SA-119
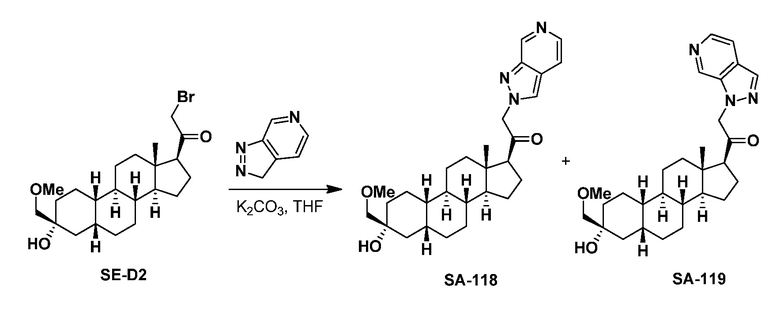
К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 3H-пиразоло[3,4-c]пиридин (47,6 мг, 0,4 ммоль) и 10 (85 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов, затем выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-118 в виде белого твердого вещества (21 мг, 22,5%) и SA-119 в виде белого твердого вещества (15 мг, 16,1%). Соединение SA-118: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,25 (с, 1H), 8,16 (д, 1H), 7,98 (с, 1H), 7,52 (дд, 1H), 5,32 (AB, 1H), 5,23 (AB, 1H), 3,42 (AB, 1H), 3,39 (AB, 1H), 3,40 (с, 3H), 2,67 (т, 1H), 2,26-2,19 (м, 1H), 2,14-2,12 (м, 1H), 0,71 (с, 3H). LC-MS: Время удерживания=2,11 мин, m/z=466,1 [M+H]+ Соединение SA-119: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,79 (с, 1H), 8,33 (д, 1H), 8,09 (с, 1H), 7,64 (д, 1H), 5,28 (AB, 1H), 5,23 (AB, 1H), 3,43 (AB, 1H), 3,40 (с, 3H), 3,39 (AB, 1H), 2,71-2,67 (м, 1H), 2,21-2,12 (м, 1H), 0,72 (с, 3H). LC-MS: Время удерживания=2,18 мин, m/z=466,1 [M+H]+
Пример 58. Синтез соединения SA-120, SA-121 и SA-122
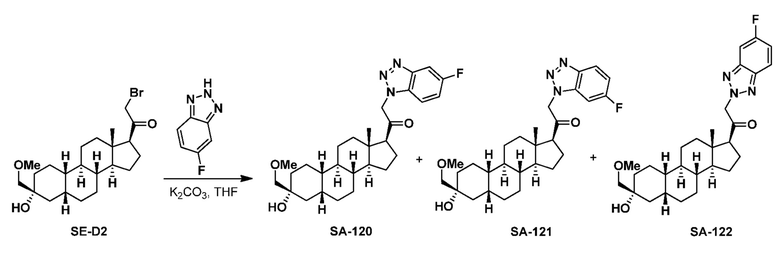
К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (55 мг, 0,4 ммоль) и 10 (85 мг, 0,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 часов, затем выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-120 в виде белого твердого вещества (6,0 мг, 6,2%) и SA-121 в виде белого твердого вещества (8,6 мг, 8,9%) и SA-122 в виде белого твердого вещества (12,6 мг, 13,0%). Соединение SA-120: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,70 (дд, 1H), 7,29-7,26 (м, 2H), 5,45 (AB, 1H), 5,38 (AB, 1H), 3,42 (AB, 1H), 3,39 (AB, 1H), 3,40 (с, 3H), 2,72 (т, 1H), 2,64 (с, 1H), 2,47 (с, 3H), 2,22-2,13 (м, 2H), 0,72 (с, 3H). LC-MS: Время удерживания=2,42 мин, m/z=484,2 [M+H]+ Соединение SA-121: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,04 (дд, 1H), 7,15 (тд, 1H), 6,98 (дд, 1H), 5,41 (AB, 1H), 5,34 (AB, 1H), 3,42 (AB, 1H), 3,39 (AB, 1H), 3,40 (с, 3H), 2,72 (т, 1H), 2,64 (с, 1H), 2,23-2,13 (м, 2H), 0,73 (с, 3H). LC-MS: Время удерживания=2,43 мин, m/z=484,2 [M+H]+ Соединение SA-122: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,86 (дд, 1H), 7,47 (дд, 1H), 7,20 (тд, 1H), 5,52 (AB, 1H), 5,47 (AB, 1H), 3,42 (AB, 1H), 3,39 (AB, 1H), 3,40 (с, 3H), 2,66 (т, 1H), 2,65 (с, 1H), 2,23-2,12 (м, 2H), 0,74 (с, 3H). LC-MS: Время удерживания=2,53 мин, m/z=484,2 [M+H]+
Пример 59. Синтез соединения SA-123, SA-124 и SA-125
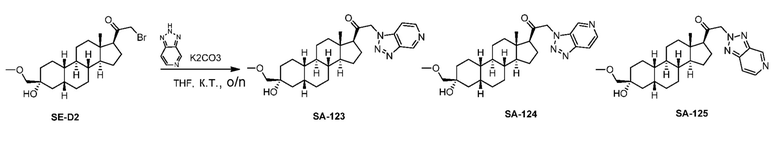
К раствору соединения SE-D2 (160 мг, 0,38 ммоль) в THF (3 мл) добавляли 2H-[1,2,3]триазоло[4,5-c]пиридин (230 мг, 1,9 ммоль) и K2CO3 (262 мг, 1,9 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи, затем LCMS показала, что реакция была завершена. Реакционную смесь разбавляли EtOAc (40 мл) и промывали насыщенным солевым раствором (20 мл x 2), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с получением SA-123/SA-124 (смесь, 40 мг, 23%) и SA-125 (33 мг, 19%) в виде белого твердого вещества. ЯМР показал смесь двух соединений, дальнейшая очистка методом хиральной ВЭЖХ которых дала в результате SA-123 (21 мг, 12%), SA-124 (9 мг, 5%) в виде белого твердого вещества. SA-123: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 9,47 (с, 1H), 8,56 (д, 1H), 7,29 (дд, 1H), 5,48 (AB, 1H), 5,40 (AB, 1H), 3,42 (AB, 1H), 3,40 (с, 3H), 3,39 (AB, 1H), 2,74 (т, 1H), 0,71 (с, 3H). LC-MS: Время удерживания=2,253 мин; m/z=467,1 (M+H)+ SA-124: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 8,96 (с, 1H), 8,54 (д, 1H), 7,98 (дд, 1H), 5,57 (AB, 1H), 5,50 (AB, 1H), 3,42 (AB, 1H), 3,40 (с, 3H), 3,39 (AB, 1H), 2,77 (т, 1H), 0,73 (с, 3H). LC-MS: Время удерживания=2,271 мин; m/z=467,1 (M+H)+ SA-125: 1H ЯМР: (500 МГц CDCl3), δ (м.д.), 9,46 (д, 1H), 8,47 (д, 1H), 7,76 (дд, 1H), 5,62 (AB, 1H), 5,57 (AB, 1H), 3,42 (AB, 1H), 3,40 (с, 3H), 3,39 (AB, 1H), 2,70 (т, 1H), 0,76 (с, 3H). LC-MS: Время удерживания=2,271 мин; m/z=467,2 (M+H)+
Пример 60. Синтез соединения SF-D2

Синтез соединения SF-A. Смесь соединения SA-F1 и SA-F2 (5,0 г, 16,7 ммоль) растворяли в сухом этаноле (250 мл), и добавляли Na (1,2 г, 50,0 ммоль). Раствор нагревали с обратным холодильником в течение 16 часов. Этанол выпаривали и остаток растворяли в дихлорметане и промывали H2O (3×50 мл) и насыщенным солевым раствором (100 мл), сушили над MgSО4, фильтровали и концентрировали. Сырой целевое соединение очищали хроматографией на силикагеле (петролейный эфир/этилацетат=10:1-5:1), и концентрировали с получением смеси продуктов SF-A1 и SF-A2 (4,5 г, 78%) в виде белого твердого вещества.
Синтез соединения SF-B. К раствору реакционной смеси SF-A1 и SF-A2 (4,5 г, 13,0 ммоль) в безводном THF (30 мл) добавляли BH3.THF (1,0M, 27,7 мл, 27,7 ммоль), раствор перемешивали при 25°C в течение ночи. Затем реакцию гасили добавлением воды (5 мл). 2M NaOH раствор (30 мл) добавляли, с последующим добавлением 30% H2O2 (30 мл). Смесь перемешивали при комнатной температуре в течение 1 часа. Смесь разбавляли этилацетатом (200 мл) и полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Смесь сырого продукта использовали непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SF-C. К раствору неочищенной реакционной смеси SF-B1 и SF-B2 (4,5 г, 13,0 ммоль, теоретическое количество) в дихлорметане (40 мл) добавляли порциями пиридинийхлорхромат (PCC) (5,7 г, 26,0 ммоль). Раствор перемешивали при 25°C в течение ночи. Затем смесь фильтровали через небольшой слой силикагеля и силикагель промывали дихлорметаном (3×50 мл). Все фильтраты объединяли и концентрировали в вакууме. Остаток очищали флэш-хроматографией (элюент: петролейный эфир/этилацетат=15:1) с получением продукта SF-C1 (2,0 г, 5,5 ммоль, Выход=42% (2 стадии)) в виде белого твердого вещества и продукта SF-C2 (1,8 г, 4,97 ммоль, Выход=38% (2 стадии)) в виде белого твердого вещества. Соединение SF-C2: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 3,53 (кв, 2H), 3,45 (AB, 1H), 3,41 (AB, 1H), 2,54 (т, 1H), 2,16-2,12 (м, 1H), 2,11 (с, 3H), 2,02-1,98 (м, 1H), 1,2 (т, 3H), 0,61 (с, 3H).
Синтез соединения SF-D2. К раствору реагента SF-C2 (100 мг, 0,301 ммоль) в метаноле (10 мл) добавляли 48% бромистоводородную кислоту (152 мг, 0,903 ммоль) с последующим добавлением брома (241 мг, 0,077 мл, 1,505 ммоль). Раствор нагревали при 25°C в течение 1,5 часов. Затем смесь выливали в холодную воду (50 мл). Полученное твердое вещество экстрагировали этилацетатом (2×50 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт SF-D2 использовали непосредственно без дополнительной очистки на следующей стадии.
Пример 61. Синтез соединения SA-126, SA-127 и SA-128

К суспензии K2CO3 (55 мг, 0,4 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (55 мг, 0,4 ммоль) и SF-D2 (85 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Остаток смеси выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток смеси очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SA-126 в виде белого твердого вещества (5,5 мг, 5,5%) и SA-127 в виде белого твердого вещества (8,4 мг, 8,5%) и SA-128 в виде белого твердого вещества (13,7 мг, 14,0%). Соединение SA-126: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,70 (д, 1H), 7,31-7,26 (м, 2H), 5,45 (AB, 1H), 5,38 (AB, 1H), 3,54 (кв, 2H), 3,46 (AB, 1H), 3,41 (AB, 1H), 2,73 (т, 1H), 2,25-2,17 (м, 2H), 1,21 (т, 3H), 0,72 (с, 3H). LC-MS: Время удерживания=2,40 мин, m/z=498,0 [M+H]+ Соединение SA-127: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,04 (дд, 1H), 7,15 (тд, 1H), 6,98 (дд, 1H), 5,41 (AB, 1H), 5,34 (AB, 1H), 3,54 (кв, 2H), 3,46 (AB, 1H), 3,41 (AB, 1H), 2,75 (с, 1H), 2,73 (т, 1H), 2,23-2,14 (м, 2H), 1,21 (т, 3H), 0,72 (с, 3H). LC-MS: Время удерживания=2,42 мин, m/z=498,0 [M+H]+ Соединение SA-128: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,86 (дд, 1H), 7,47 (д, 1H), 7,20 (тд, 1H), 5,52 (AB, 1H), 5,48 (AB, 1H), 3,54 (кв, 2H), 3,46 (AB, 1H), 3,41 (AB, 1H), 2,75 (с, 1H), 2,66 (т, 1H), 2,23-2,13 (м, 2H), 1,21 (т, 3H), 0,74 (с, 3H). LC-MS: Время удерживания=2,51 мин, m/z=498,0 [M+H]+
Пример 62. Синтез промежуточных соединений SB и SB
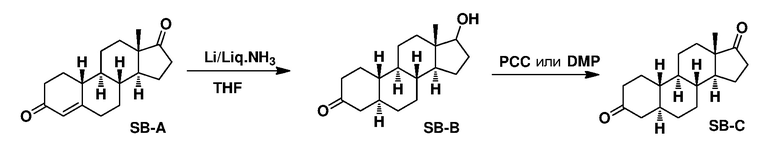
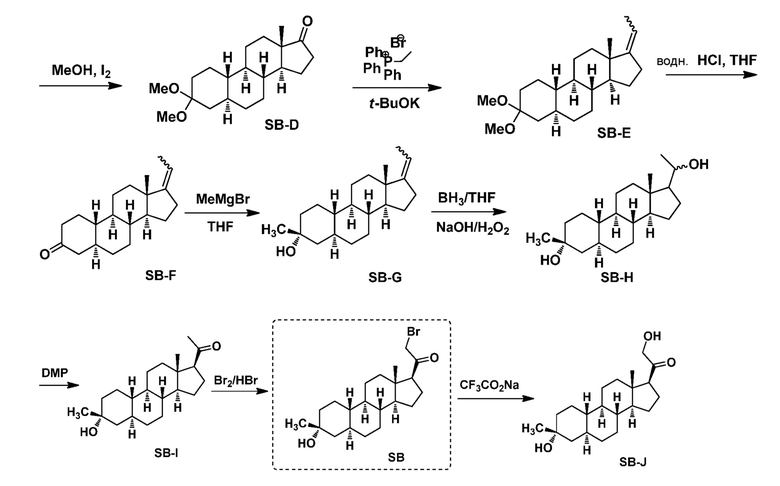
Синтез соединений SB-B и SB-C. Небольшие кусочки лития (7,63 г, 1,1 моль) добавляли к 2,7 л конденсированного аммиака в трехгорлой колбе при −70°C. Как только весь литий растворялся, синий раствор нагревали до −50°C. Раствор 19-норандрост-4-ен-3,17-дион SB-A (1, 30 г, 110 ммоль) и трет-BuOH (8,14 г, 110 ммоль) в 800 мл безводного тетрагидрофурана добавляли по каплям и перемешивали в течение 90 минут до тех пор, пока реакционная смесь не стала светло-желтого цвета. Добавляли хлорид аммония (70 г) и оставшийся избыток аммиака испарялся. Остаток экстрагировали 0,5 н HCl (500 мл) и дихлорметаном (500 мл × 2). Объединенные органические слои промывали насыщенным раствором NaHCO3, сушили над Na2SO4, фильтровали и концентрировали с получением смеси SB-B и SB-C (21 г, 70%), которую непосредственно использовали на следующей стадии без дополнительной очистки. Раствор SB-B и SB-C (21 г, 76 ммоль) в 50 мл безводного дихлорметана добавляли к суспензии пиридинийхлорхромата (PCC) (32,8 г, 152 ммоль) в 450 мл дихлорметана. После перемешивания при комнатной температуре в течение 2 часов, 2 н NaOH раствор (500 мл) добавляли к темно-коричневой реакционной смеси и перемешивали еще в течение 10 минут. Полученный раствор экстрагировали дихлорметаном, объединенные органические слои промывали 2 н HCl, насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (петролейный эфир/этилацетат=20:1-10:1) с получением соединения в заголовке SB-C(16,8 г, 80%) в виде белого твердого вещества. 1H ЯМР SB-B (400 МГц CDCl3), δ (м.д.), 3,65 (т, 1H), 0,77 (с, 3H). 1H ЯМР SB-C (400 МГц CDCl3), δ (м.д.), 0,88 (с, 3H).
Синтез соединения SB-D. К раствору соединения SB-C (16,8 г. 61,3 ммоль) в метаноле (250 мл) добавляли йод (1,54 г, 6,1 ммоль). После перемешивания при 60°C в течение 12 часов, растворитель удаляли в вакууме. Сырой продукт растворяли в дихлорметане (200 мл) и промывали насыщенным NaHCO3 (150 мл), насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на оксиде алюминия (петролейный эфир/этилацетат=100:1), получая соединение SB-D (14 г, 43,8 ммоль, 71%). 1H ЯМР (400 МГц CDCl3), δ (м.д.), 3,18 (с, 3H), 3,12 (с, 3H), 0,85 (с, 3H).
Синтез соединения SB-E. К суспензии t-BuOK (7,36 г, 65,7 ммоль) в THF (100 мл) при 0°C медленно добавляли этилтрифенилфосфония бромид (26 г, 70 ммоль). После перемешивания при 60°C в течение 3 часов, добавляли соединение SB-D (7 г, 21,9 ммоль) и смесь перемешивали при 60°C еще 2 часа. После охлаждения до комнатной температуры реакционную смесь выливали в насыщенный раствор хлорида аммония и экстрагировали EtOAc (2×500 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с получением сырого соединения SB-E (7,36 г, 100%). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения SB-F. Раствор сырого соединения SB-E (7,36 г, 21,9 ммоль) в THF (50 мл) подкисляли до рН=3 с помощью 1 н водным раствором HCl. После перемешивания при комнатной температуре в течение 12 часов, реакционную смесь экстрагировали этилацетатом (250 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат=30:1-20:1) с получением соединения SB-F (4,8 г, 16,7 ммоль, 76% для двух стадий). 1H ЯМР (400 МГц CDCl3), δ (м.д.), 5,12-5,10 (м, 1H), 1,64-1,63 (м, 3H), 0,77 (с, 3H).
Синтез соединения SB-G. К раствору MeMgBr (28 ммоль, 1M в THF) в THF (50 мл) при 0°C добавляли раствор соединения SB-F (4,8 г, 16,8 ммоль) в сухом THF (10 мл) с помощью шприцевого насоса в течение 30 минут. После перемешивания при 0°C в течение 5 часов, реакционную смесь оставляли нагреваться до и перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили водой, охлажденной льдом, и экстрагировали этилацетатом (150 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Белый остаток очищали колоночной флэш-хроматографией (петролейный эфир/этилацетат=20:1 до 10:1), получая соединение SB-G (2,5 г, 8,28 ммоль, 49%; Rf=0,35, PE: EtOAc=10:1). 1H ЯМР (400 МГц CDCl3), δ (м.д.), 5,05-5,03 (м, 1H), 1,21 (с, 3H), 0,90 (с, 3H).
Синтез соединения SB-H. К раствору соединения SB-G (2 г, 6,62 ммоль) в сухлм THF (50 мл) добавляли комплекс боран-тетрагидрофуран (20 мл; 1,0M раствор в THF). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь охлаждали на бане со льдом, затем медленно гасили 10%-ным водным NaOH (10 мл), затем 30%-ным водным раствором H2O2 (12 мл). После перемешивания при комнатной температуре в течение одного часа, смесь экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (100 мл), насыщенным солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали, получая сырое соединение SB-H (2 г, 100%). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения SB-I. К раствору сырого соединения SB-H (2 г, 6,62 ммоль) в 60 мл влажного дихлорметана (дихлорметан встряхивали с несколькими миллилитрами Н2О, затем отделяли от водного слоя) добавляли периодинат Десс-Мартина (5,5 г, 13 ммоль). После перемешивания при комнатной температуре в течение 24 часов, реакционную смесь экстрагировали дихлорметаном (3×100 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (100 мл), насыщенным солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (петролейный эфир/этилацетат=10:1 до 5:1), с получением соединения SB-I (1 г, 3,14 ммоль, 47% для двух стадий) в виде белого твердого вещества. 1H ЯМР (400 МГц CDCl3), δ (м.д.), 2,56 (т, 1H), 2,11 (с и м, 4H), 2,0 (дт, 1H), 1,8 (дм, 2H), 1,54 (м, 6 H) 1,43 (м, 1H), 1,34 (м, 2H),1,20 (м, 12H), 0,7 (м, 2H), 0,62(с, 3H).
Синтез соединения SB. К раствору соединения SB-I (600 мг, 1,89 ммоль) в MeOH (20 мл) добавляли 5 капель HBr (48%), затем бром (302 мг, 1,89 ммоль). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь выливали в воду со льдом, затем экстрагировали этилацетатом (100 мл×3). Объединенные органические слои промывали насыщенным солевым раствором (200 мл), сушили над MgSO4, фильтровали и концентрировали, получая сырое SB (600 мг).
Синтез соединения SB-J. Раствор соединения SB (600 мг, 1,5 ммоль) в ацетоне 10 мл обрабатывали CF3COOH (6,8 мл) и Et3N (9,5 мл). После кипячения с обратным холодильником в течение 30 минут, соль CF3COONa (4,49 г, 33 ммоль) добавляли по частям в течение 10 часов. Реакционную смесь оставляли охлаждаться до комнатной температуры и растворитель удаляли в вакууме. Остаток экстрагировали этилацетатом, сушили над MgSO4, фильтровали и концентрировали. Смесь очищали с помощью хроматографии на силикагеле (петролейный эфир/этилацетат=10:1-3:1) с получением SB-J (300 мг, выход: 50% для двух стадий). 1H ЯМР (400 МГц CDCl3), δ (м.д.), 4,23-4,13 (м, 2H), 2,48-2,44 (м, 1H), 2,24-2,17 (м, 1H), 1,20 (с, 3H), 0,64 (с, 3H).
Пример 63. Синтез соединения SB-1 и SB-2
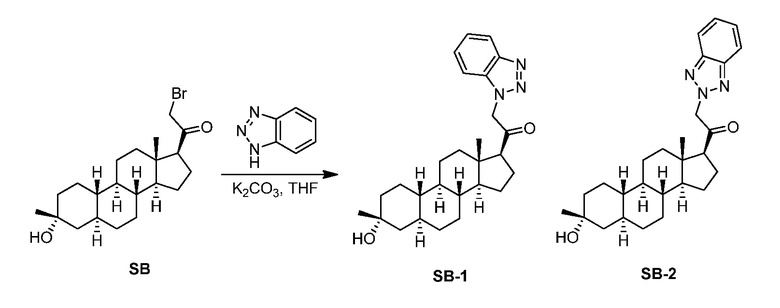
К раствору сырого соединения SB (250 мг, 0,629 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли бензотриазол (374 мг, 3,14 ммоль), затем карбонат калия (434 мг, 3,14 ммоль). Раствор нагревали при 60°C в течение ночи. Затем раствор разбавляли этилацетатом (200 мл). Полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, с получением фракции 1 и фракции 2. Фракция 1 представляла собой желаемый продукт SB-1 (34,0 мг, 0,0781 ммоль, две стадии в целом выход=12,4%), выделенный в виде белого твердого вещества. Фракцию 2 дополнительно очищали хроматографией на силикагеле (элюент: петролейный эфир/этилацетат=3:1) с получением желаемого продукта SB-2 (7,5 мг, 0,0172 ммоль, две стадии в целом выход=2,7%, более полярный) и побочный продукт (3,0 мг, 0,00689 ммоль, две стадии в целом выход=1,1%, менее полярный) в виде белых твердых веществ. Соединение SB-1: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,09 (1H, д), 7,50 (1H, д), 7,39 (1H, т), 7,34 (1H, д), 5,43 (1H, AB), 5,42 (1H, AB), 2,72 (1H, т), 2,15-2,27 (2H, м), 1,87-1,96 (1H, м), 1,22 (3H, с), 0,74 (3H, с). LC-MS: Время удерживания=2,38 мин, m/z=436,2 [M+H]+ Соединение SB-2: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,88 (2H, дд), 7,40 (2H, дд), 5,54 (1H, AB), 5,52 (1H, AB), 2,67 (1H, т), 2,12-2,28 (2H, м), 1,21 (3H, с), 0,76 (3H, с). LC-MS: Время удерживания=2,49 мин, m/z=436,2 [M+H]+
Пример 64. Синтез соединения SB-4 и SB-5
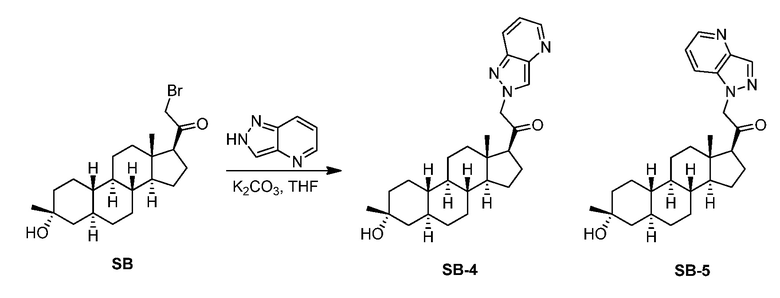
К раствору сырого соединения SB (249,6 мг, 0,629 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 1H-пиразоло[4,3-b]пиридин (374 мг, 3,14 ммоль), затем карбонат калия (434 мг, 3,14 ммоль). Раствор нагревали при 50°C в течение 2 часов. Затем раствор разбавляли этилацетатом (200 мл). Полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-4 (5,5 мг, 0,0126 ммоль, Выход=2,0% (2 стадии)) и продукт SB-5 (26,7 мг, 0,0613 ммоль, Выход=9,8% (2 стадии)) в виде белых твердых веществ. Соединение SB-4: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,59 (1H, д), 8,21 (1H, с), 8,04 (1H, д), 7,22 (1H, дд), 5,28 (1H, AB), 5,20 (1H, AB), 2,67 (1H, т), 2,09-2,29 (2H, м), 1,21 (3H, с), 0,73 (3H, с). LC-MS: Время удерживания=2,21 мин, m/z=436,4 [M+H]+ Соединение SB-5: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,60 (1H, д), 8,28 (1H, с), 7,59 (1H, д), 7,30 (1H, дд), 5,19 (1H, AB), 5,14 (1H, AB), 2,67 (1H, т), 2,09-2,25 (2H, м), 1,22 (3H, с), 0,72 (3H, с). LC-MS: Время удерживания=2,26 мин, m/z=436,4 [M+H]+
Пример 65. Синтез соединения SB-6, SB-7 и SB-8
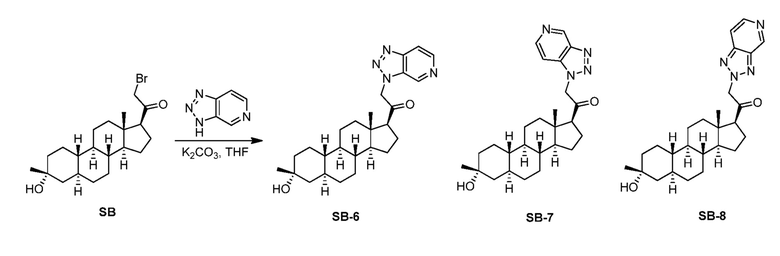
К раствору сырого соединения SB (374,3 мг, 0,942 ммоль, теоретическое количество) в безводном THF (7,5 мл) добавляли 1H-1,2,3-триазоло[4,5-c]пиридин (226 мг, 1,884 ммоль), затем карбонат калия (260 мг, 1,884 ммоль). Раствор нагревали при 50°C в течение двух часов, затем раствор разбавляли этилацетатом (200 мл). Полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, с получением желаемых продуктов SB-7 (48,9 мг, 0,112 ммоль, Выход=11,9% (2 стадии)) и SB-8 (42,3 мг, 0,0969 ммоль, Выход=10,3% (2 стадии)). Все продукты были белыми твердыми веществами. Соединение SB-7: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,50 (1H, д), 8,58 (1H, д), 7,30 (1H, дд), 5,49 (1H, AB), 5,41 (1H, AB), 2,75 (1H, т), 1,22 (3H, с), 0,74 (3H, с). LC-MS: Время удерживания=2,23 мин, m/z=437,3 [M+H]+ Соединение SB-8: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,46 (1H, д), 8,47 (1H, д), 7,76 (1H, дд), 5,61 (1H, AB), 5,58 (1H, AB), 2,70 (1H, т), 1,22 (3H, с), 0,76 (3H, с). LC-MS: Время удерживания=2,31 мин, m/z=437,4[M+H]+
Пример 66. Синтез соединения SB-9 и SB-10

К раствору сырого соединения SB (249,6 мг, 0,629 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 1H-пиразоло[3,4-c]пиридин (150 мг, 1,256 ммоль), затем карбонат калия (174 мг, 1,256 ммоль). Раствор нагревали при 50°C в течение 2 часов. Затем раствор разбавляли этилацетатом (200 мл). Полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-9 (7 мг, 0,016 ммоль, Выход=2,5% (2 стадии)) и продукт SB-10 (14,6 мг, 0,0335 ммоль, Выход=5,4% (2 стадии)) в виде белых твердых веществ. Соединение SB-9: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,26 (1H, с), 8,17 (1H, д), 7,99 (1H, с), 7,53 (1H, д), 5,32 (1H, AB), 5,24 (1H, AB), 2,69 (1H, т), 1,22 (3H, с), 0,73 (3H, с). LC-MS: Время удерживания=2,18 мин, m/z=436,4 [M+H]+ Соединение SB-10: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,80 (1H, с), 8,34 (1H, д), 8,10 (1H, с), 7,65 (1H, дд), 5,27 (1H, AB), 5,25 (1H, AB), 2,70 (1H, т), 1,22 (3H, с), 0,73 (3H, с). LC-MS: Время удерживания=2,21 мин, m/z=436,3 [M+H]+
Пример 67. Синтез соединения SB-11
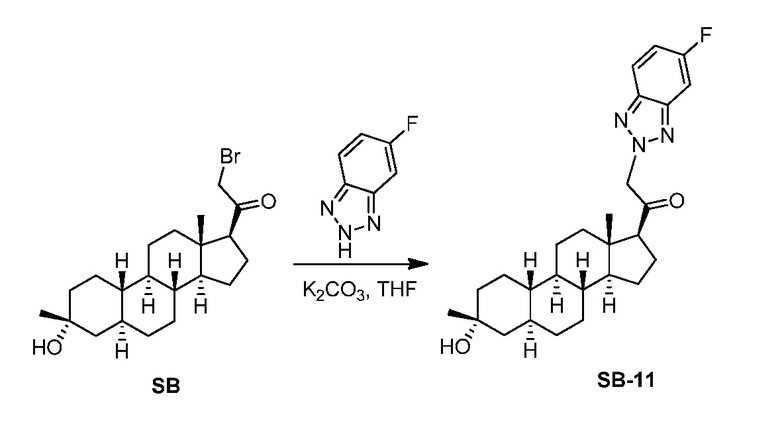
К суспензии K2CO3 (67 мг, 0,50 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (68,5 мг, 0,50 ммоль) и соединение SB (100 мг, 0,25 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая продукт SB-11 в виде белого твердого вещества (10,7 мг, 0,024 ммоль, 9,4%). SB-11: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,86 (1H, дд), 7,46 (1H, дд), 7,20 (1H, тд), 5,50 (1H, AB), 5,48 (1H, AB), 2,67 (1H, т), 1,21 (3H, с), 0,75 (3H, с). LCMS: Время удерживания=2,47 мин. m/z=454,3 [M+H]+.
Пример 68. Синтез соединения SG
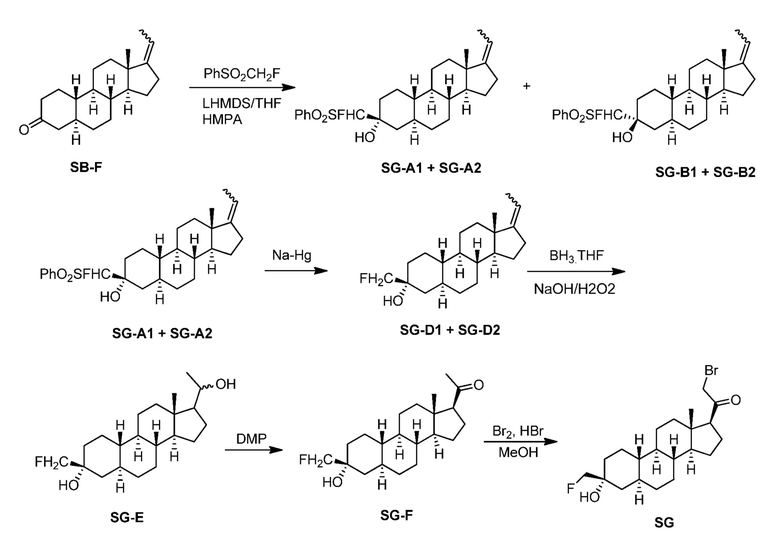
Синтез соединений SG-A и SG-B. К раствору соединения SB-F (1,3 г, 4,5 ммоль) и PhSO2CH2F (790 мг, 4,5 ммоль) в THF (25 мл) и HMPA (0,5 мл) при -78°C под N2 добавляли по каплям LHMDS (5,5 мл, 1M в THF). После перемешивания при -78°C в течение 2 часов, реакционную смесь гасили насыщенным водным раствором NH4Cl (10 мл) и оставляли нагреваться до комнатной температуры, затем экстрагировали Et2O (20 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле (петролейный эфир/этилацетат=10/1) с получением смеси соединения SG-A и SG-B (1,53 г). Смесь дополнительно очищали с помощью хиральной ВЭЖХ, получая соединение SG-A1 (220 мг, t=3,41 мин). 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,99-7,97 (м, 2H), 7,75-7,74 (м, 1H), 7,62-7,55 (м, 2H), 5,13-5,09 (м, 1H), 4,86-4,78 (д, 1H), 0,88 (с, 3H); SG-A2 (200 мг, t=3,66 мин); 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,96-7,95 (м, 1H), 7,71-7,69 (м, 1H), 7,62-7,58 (м, 2H), 5,13-5,09 (м, 1H), 4,87-4,77 (д, 1H), 0,88 (с, 3H); SG-B1 (235 мг, t=4,9 мин). 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,99-7,97 (м, 1H), 7,72-7,70 (м, 1H), 7,62-7,59 (м, 2H), 5,29-5,20 (д, 1H), 4,88-4,78 (м,1H), 0,88 (с, 3H); SG-B2 (220 мг, t=5,2 мин). 1H ЯМР (500 МГц CDCl3), δ (м.д.), 7,99-7,97 (м, 2H), 7,72 (м, 1H), 7,62-7,59 (м, 2H), 5,30-5,20 (д, 1H), 5,09-5,08 (м,1H), 0,88 (с, 3H).
Синтез соединения SG-D. К раствору соединения SG-A (200 мг, 0,434 ммоль) и безводного Na2HPO4 (100 мг) в безводном метаноле (15 мл) при -20°C под N2 добавляли амальгаму Na/Hg (400 мг). После перемешивания при -20°C до 0°C в течение 1 часа, раствор метанола декантировали и твердый остаток промывали Et2O (5×3 мл). Растворитель объединенной органической фазы удаляли в вакууме, и добавляли 20 мл насыщенного солевого раствора, с последующей экстракцией Et2O. Объединенную эфирную фазу сушили MgSO4, и эфир удаляли с получением сырого продукта, который затем очищали хроматографией на силикагеле (PE/EA=10/1) с получением продукта 99 мг, 69%. 1H ЯМР (500 МГц CDCl3), δ (м.д.), 5,12-5,10 (м, 1H,), 4,21-24,11 (д, 2H), 0,88 (с, 3H).
Синтез соединения SG-E. К раствору соединения SG-D (95 мг, 0,296 ммоль) в сухом THF (5 мл) добавляли комплекс боран-тетрагидрофуран (1 мл 1,0M раствор в THF). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь охлаждали на бане со льдом, затем медленно гасили 10%-ным водным NaOH (1 мл), затем 30% водным раствором H2O2 (1,2 мл). Смесь оставляли перемешиваться при комнатной температуре в течение 1 часа и затем экстрагировали EtOAc (3×10 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (10 мл), насыщенным солевым раствором (10 мл), сушили над MgSO4, фильтровали и концентрировали с получением соединения SG-E (120 мг сырой). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения SG-F. К раствору соединения SG-E (120 мг сырой), растворенного в 10 мл влажного дихлорметана (дихлорметан встряхивали с несколькими миллилитрами Н2О, затем отделяли от водного слоя) добавляли периодинат Десс-Мартина (300 мг, 707 ммоль). После перемешивания при комнатной температуре в течение 24 часов, реакционную смесь экстрагировали дихлорметаном (3×10 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (10 мл), насыщенным солевым раствором (10 мл), сушили над MgSO4, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (петролейный эфир/этилацетат=1:5) с получением соединения SG-F (70 мг, 70% для двух стадий) в виде белого твердого вещества. 1H ЯМР (500 МГц CDCl3), δ (м.д.), 4,21-4,11 (д, 2H), 2,19 (с, 3H), 0,62 (с, 3H).
Синтез соединения SG. К раствору реагента (200 мг, 0,594 ммоль) в метаноле (5 мл) добавляли 48% бромистоводородную кислоту (300 мг, 1,782 ммоль), с последующим добавлением брома (475 мг, 0,152 мл, 2,97 ммоль). Раствор нагревали при 25°C в течение 2 часов. Затем смесь выливали в холодную воду (50 мл). Полученное твердое вещество экстрагировали этилацетатом (2×100 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт использовали непосредственно без дополнительной очистки на следующей стадии.
Пример 69. Синтез соединения SB-12 и SB-13

К раствору неочищенного реагента SG (100 мг, 0,241 ммоль) в безводном THF (5 мл) добавляли 1H-бензо[d][1,2,3]триазол (57 мг, 0,483 ммоль), затем карбонат калия (67 мг, 0,483 ммоль). Раствор нагревали при 60°C в течение 2 часов, затем раствор охлаждали до комнатной температуры и разбавляли этилацетатом (100 мл). Полученный раствор промывали насыщенным солевым раствором (2×50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-12 (26 мг, 0,06 ммоль, Выход=25%) и продукт SB-13 (18 мг, 0,04 ммоль, Выход=17%) в виде белого твердого вещества. SB-12: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,08 (1H, д), 7,49 (1H, т), 7,38 (1H, т), 7,34 (1H, д), 5,44 (1H, AB), 4,18 (2H, д), 2,72 (1H, т), 0,74 (3H, с). LCMS: Время удерживания=2,30 мин, m/z=454 [M+H]+ SB-13: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,88 (1H, дд), 7,40 (1H, дд), 5,53 (1H, AB), 5,40 (1H, AB), 4,18 (2H, д), 2,66 (1H, т), 0,76 (3H, с). LCMS: Время удерживания=2,41 мин, m/z=454 [M+H]+
Пример 70. Синтез соединения SB-14 и SB-15

К раствору неочищенного реагента SG (100 мг, 0,241 ммоль) в безводном THF (5 мл) добавляли 3H-[1,2,3]триазоло[4,5-c]пиридин (140 мг, 1,2 ммоль), затем карбонат калия (170 г, 1,2 ммоль). Раствор нагревали при 60°C в течение 2 часов, затем раствор охлаждали до комнатной температуры и разбавляли этилацетатом (100 мл). Полученный раствор промывали насыщенным солевым раствором (2×50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-14 (20 мг, 0,04 ммоль, Выход=17%) и продукт SB-15 (18 мг, 0,04 ммоль, Выход=17%) в виде белого твердого вещества. SB-14: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,51 (1H, с), 8,58 (1H, д), 7,32 (1H, д), 5,50 (1H, AB), 5,42 (1H, AB), 4,18 (2H, д), 2,75 (1H, т), 0,74 (3H, с). LCMS: Время удерживания=2,18 мин, m/z=455 [M+H]+ SB-15: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,46 (1H, с), 8,47 (1H, д), 7,76 (1H, д), 5,62(1H, AB), 5,60 (1H, AB), 4,18 (2H, д), 2,70 (1H, т), 0,77(3H, с). LCMS: Время удерживания=2,41 мин, m/z=455 [M+H]+
Пример 71, Синтез соединения SB-16 и SB-17

К раствору неочищенного реагента SG (100 мг, 0,241 ммоль) в безводном THF (5 мл) добавляли 2H-пиразоло[4,3-b]пиридин (140 мг, 1,2 ммоль), затем карбонат калия (170 г, 1,2 ммоль). Раствор нагревали при 60°C в течение 2 часов, затем раствор охлаждали до комнатной температуры и разбавляли этилацетатом (100 мл). Полученный раствор промывали насыщенным солевым раствором (2×50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-16 (18 мг, 0,04 ммоль, Выход=17%) и SB-17 (40 мг, 0,09 ммоль, Выход=38%) в виде белого твердого вещества. SB-16: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,58 (1H, дд),8,28 (1H, с), 8,04 (1H, д), 7,22 (1H, дд), 5,28 (1H, AB), 5,20 (1H, AB), 4,17 (2H, д), 2,67 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,09 мин, m/z=454 [M+H]+ SB-17: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,60 (1H, дд), 8,22 (1H, с), 7,59 (1H, д), 7,30 (1H, дд), 5,20 (1H, AB), 5,13 (1H, AB), 4,18 (2H, д), 2,68(1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,13 мин, m/z=454 [M+H]+
Пример 72. Синтез соединения SB-18 и SB-19
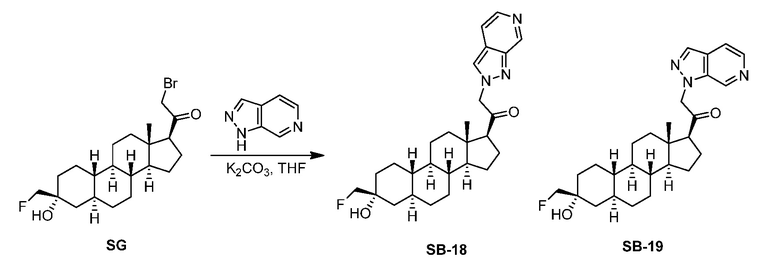
К раствору неочищенного реагента SG (246,9 мг, 0,595 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 1H-пиразоло[3,4-c]пиридин (142 мг, 1,188 ммоль), затем карбонат калия (164 мг, 1,188 ммоль). Раствор нагревали при 50°C в течение 2 часов. Затем раствор разбавляли этилацетатом (200 мл). Полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, с получением фракции 1 и 2. Фракция 1 представляла собой чистый продукт SB-18 (11,5 мг, 0,0254 ммоль, Выход=4,3% (2 стадии)). Но фракция 2 была нечистой, и сырой продукт далее очищали хроматографией на силикагеле (элюент: петролейный эфир/этилацетат=1:1) с получением чистого продукта SB-19 (13,9 мг, 0,0306 ммоль, Выход=5,2% (2 стадии)). Оба продукта представляли собой белое твердое вещество. SB-18: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,26 (1H, с), 8,17 (1H, д), 7,98 (1H, с), 7,53 (1H, дд), 5,32 (1H, AB), 5,23 (1H, AB), 4,17 (2H, д), 2,69 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,10 мин, m/z=454,1 [M+H]+ SB-19: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,80 (1H, с), 8,34 (1H, д), 8,10 (1H, с), 7,64 (1H, д), 5,27 (1H, AB), 5,25 (1H, AB), 4,18 (1H, д), 2,70 (1H, т), 0,74 (3H, с). LCMS: Время удерживания=2,26 мин, m/z=454,2 [M+H]+
Пример 73. Синтез соединения SG-20
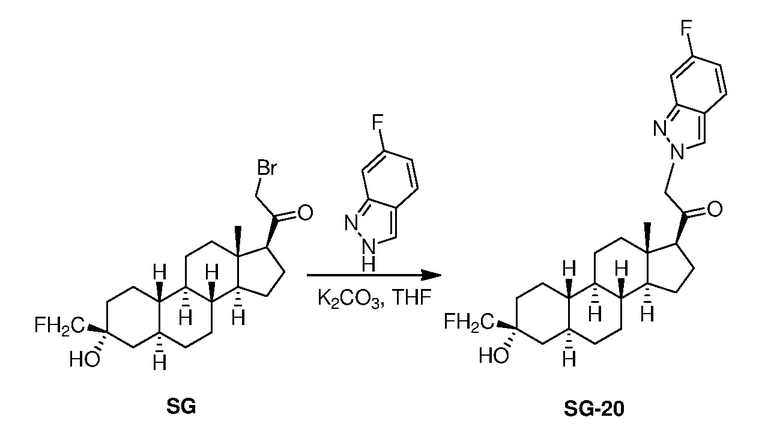
К суспензии K2CO3 (63 мг, 0,47 ммоль) в THF (10 мл) добавляли 6-фтор-2H-индазол (63,9 мг, 0,47 ммоль) и соединение SG (100 мг, 0,24 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SB-20 в виде белого твердого вещества (28,7 мг, 0,06 ммоль, 26,5%). SG-20: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,94 (1H, д), 7,63 (1H, дд), 7,27 (1H, дд), 6,89 (1H, тд), 5,19 (1H, AB), 5,14 (1H, AB), 4,17 (2H, д), 2,65 (1H, т), 0,72 (3H, с). LCMS: Время удерживания=2,33 мин. m/z=471,0 [M+H]+.
Пример 74. Синтез соединения SG-21, SG-22 и SG-23

К суспензии K2CO3 (63 мг, 0,47 ммоль) в THF (10 мл) добавляли 5-метокси-2H-бензо[d][1,2,3]триазол (70,1 мг, 0,47 ммоль) и соединение SG (100 мг, 0,24 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SG-21 в виде белого твердого вещества (12,8 мг, 0,026 ммоль, 11,5%), SG-22 в виде белого твердого вещества (25,4 мг, 0,053 ммоль, 22,1%) и SG-23 в виде белого твердого вещества (14,5 мг, 0,029 ммоль, 12,5%). SG-21: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,73 (д), 7,08-7,05 (м, 2H), 5,50 (AB), 5,43 (AB), 4,17 (d), 3,88 (3H, с), 2,65 (т,), 0,75 (с, 3H). LCMS: Время удерживания=2,34 мин. m/z=484,3 [M+H]+. SG-22: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,92 (1H, д), 7,01 (1H, дд), 6,61 (1H, д), 5,35 (1H, AB), 5,30 (1H, AB), 4,17 (2H, д), 3,89 (3H, с), 2,70 (1H, т), 0,74 (3H, с). LCMS: Время удерживания=2,36 мин. m/z=484,1 [M+H]+. SG-23: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,39 (1H, д), 7,21 (1H, д), 7,15 (1H, дд), 6,61 (1H, д), 5,37 (1H, AB), 5,35 (1H, AB), 4,17 (2H, д), 3,89 (3H, с), 2,69 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,36 мин. m/z=484,2 [M+H]+.
Пример 75. Синтез соединения SG-24 и SG-25

К суспензии K2CO3 (63 мг, 0,47 ммоль) в THF (10 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (64,4 мг, 0,47 ммоль) и соединение SG (100 мг, 0,24 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SG-24 в виде белого твердого вещества (25,6 мг, 0,054 ммоль, 22,5%) и SG-25 в виде белого твердого вещества (11,9 мг, 0,025 ммоль, 10,4%). SG-24: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 7,85 (1H, дд), 7,46 (1H, дд), 7,19 (1H, тд), 5,50 (1H, AB), 5,48 (1H, AB), 4,17 (2H, д), 2,66 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,39 мин. m/z=472,3 [M+H]+. SG-25: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,04 (1H, дд), 8,15 (1H, тд), 6,98 (1H, дд), 5,40 (1H, AB), 5,36 (1H, AB), 4,18 (2H, д), 2,72 (1H, т), 0,74 (3H, с). LCMS: Время удерживания=2,30 мин. m/z=472,3 [M+H]+.
Пример 76. Синтез соединения SB-26
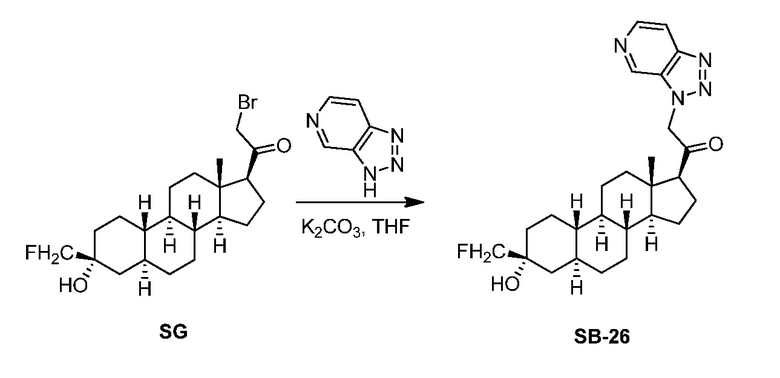
К суспензии K2CO3 (63 мг, 0,47 ммоль) в THF (10 мл) добавляли 3H-[1,2,3]триазоло[4,5-c]пиридин (56,4 мг, 0,47 ммоль) и соединение SG (100 мг, 0,24 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая продукт SB-26 в виде белого твердого вещества (24,5 мг, 0,054 ммоль, 22,5%). SB-26: 1H ЯМР (400 МГц CDCl3), δ (м.д.), 8,96 (1H, д), 8,55 (1H, д), 7,98 (1H, дд), 5,55 (1H, AB), 5,52 (1H, AB), 4,17 (д, 2H), 2,77 (t), 0,75 (с, 3H). LCMS: Время удерживания=2,24 мин. m/z=455,1 [M+H]+.
Пример 77. Синтез соединения SH

Синтез соединения SH-A. К раствору реагента SB-F (4,4 г, 15,38 ммоль) в сухом THF (50 мл) добавляли по каплям этилмагнийбромид (3M в THF , 51,28 мл) при 0°C. Затем раствор медленно нагревали и перемешивали при температуре окружающей среды в течение 15 часов. Насыщенный раствор NH4Cl (20 мл) добавляли, чтобы погасить реакцию, и полученный раствор экстрагировали этилацетатом (3×100 мл). Экстракты промывали насыщенным солевым раствором, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией (элюент: петролейный эфир:этилацетат=10:1) с получением продукта 8 (3,15 г, 10,00 ммоль, 64,8%) в виде белого твердого вещества.
Синтез соединения SH-B. К раствору реагента SH-A (500 мг, 1,58 ммоль) в безводном THF (10 мл) добавляли BH3.THF (1,0M, 7,23 мл, 7,23 ммоль) при комнатной температуре, и раствор перемешивали при 25°C в течение ночи. Затем реакцию гасили добавлением воды (5 мл), добавляли 2M NaOH раствор (10 мл), затем 30% H2O2 (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем смесь разбавляли этилацетатом (200 мл) и полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт SH-B использовали непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SH-C. К раствору реагента SH-B (6,53 г, 19,67 ммоль) в безводной DCM (100 мл), охлажденному на охлаждающей бане со льдом и водой, добавляли порциями хлорхромат пиридиния (8,48 г, 39,34 моль). Смесь перемешивали при температуре окружающей среды в течение ночи. Затем раствор разбавляли DCM (50 мл) и фильтровали. Объединенные органические растворы промывали насыщенным солевым раствором (100 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией (элюент: петролейный эфир:этилацетат=10:1) с получением продукта SH-B (2,5 г, 7,53 ммоль, выход 39%) в виде белого твердого вещества. SH-B: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 2,54 (1H, т), 2,11 (3H, с), 1,42-1,45 (2H, кв), 0,91 (3H, т), 0,62 (3H, с).
Синтез соединения SH. К раствору реагента SH-C (80 мг, 0,24 ммоль) в метаноле (5 мл) добавляли 48% бромистоводородную кислоту (148 мг, 0,884 ммоль), затем бром (241 мг, 0,077 мл, 1,505 ммоль). Раствор нагревали при 25°C в течение 1,5 часов, затем смесь выливали в холодную воду (50 мл). Полученное твердое вещество экстрагировали этилацетатом (2×50 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (20 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт SH использовали непосредственно без дополнительной очистки на следующей стадии.
Пример 79. Синтез соединения SB-29 и SB-30
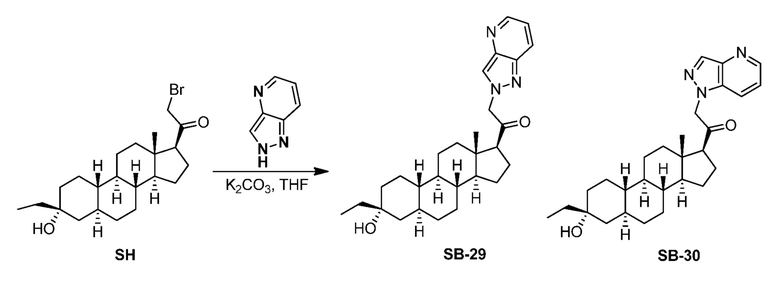
К раствору неочищенного реагента SH (100 мг, 0,241 ммоль) в безводном THF (5 мл) добавляли 2H-пиразоло[4,3-b]пиридин (142 мг, 1,2 ммоль), затем карбонат калия (170 мг, 1,2 ммоль) и раствор нагревали при 60°C в течение 2 часов. Затем реакционную смесь разбавляли этилацетатом (100 мл). Полученный раствор промывали насыщенным солевым раствором (2×50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-29 (7 мг, 0,015 ммоль, Выход=6,6%) и SB-30 (9 мг, 0,02 ммоль, Выход=8,3%) в виде белого твердого вещества. SB-29: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,58 (1H, с), 8,21 (1H, с), 8,04 (1H, д), 7,22 (1H, дд), 5,26 (1H, AB), 5,22 (1H, AB), 2,67 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,40 мин, m/z=450,2 [M+H]+ SB-30: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,60 (1H, дд), 8,28 (1H, с), 7,59 (1H, д), 7,30 (1H, дд), 5,17 (1H, AB), 5,15 (1H, AB), 2,67 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,43 мин, m/z=450,2 [M+H]+
Пример 80. Синтез соединения SB-31 и SB-32

К раствору сырого реагента SH (100 мг, 0,241 ммоль) в безводном THF (5 мл) добавляли 2H-пиразоло[3,4-c]пиридин (143 мг, 1,2 ммоль), затем карбонат калия (170 г, 1,2 ммоль). Раствор нагревали при 60°C в течение 2 часов, затем раствор охлаждали до комнатной температуры и разбавляли этилацетатом (100 мл). Полученный раствор промывали насыщенным солевым раствором (2×50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-32 (11 мг, 0,09 ммоль, Выход=8,3%) в виде белого твердого вещества. SB-32: 1H ЯМР (500 МГц CDCl3) δ(м.д.): 8,80(1H, с),8,33(1H, д), 8,10 (1H, с),7,67 (1H, д), 5,27 (1H,AB), 5,25 (1H,AB), 2,70 (1H, т), 1,45-1,51 (2H,q), 0,91 (3H, т), 0,73 (3H, с). LCMS: Время удерживания=2,46 мин, m/z=450 [M+H]+
Пример 81. Синтез соединения SB-33 и SB-34

К раствору сырого реагента SH (100 мг, 0,241 ммоль) в безводном THF (5 мл) добавляли 3H-[1,2,3]триазоло[4,5-c]пиридин (143 мг, 1,2 ммоль), затем карбонат калия (170 г, 1,2 ммоль). Раствор нагревали при 60°C в течение 2 часов, затем раствор охлаждали до комнатной температуры и разбавляли этилацетатом (100 мл). Полученный раствор промывали насыщенным солевым раствором (2×50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-33 (7 мг, 0,09 ммоль, Выход=8,3%) в виде белого твердого вещества. SB-34: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,46 (1H, с), 8,47 (1H, д), 7,76 (1H, д), 5,61 (1H,AB), 5,58 (1H,AB), 2,70 (1H, т), 1,27-1,42 (2H, кв), 0,91 (3H, т), 0,73 (3H, с). LCMS: Время удерживания=2,50 мин, m/z=451 [M+H]+
Пример 82. Синтез соединения SB-35 и SB-36

К раствору неочищенного реагента SH (100 мг, 0,241 ммоль) в безводном THF (5 мл) добавляли 1H-бензо[d][1,2,3]триазол (143 мг, 1,2 ммоль), затем карбонат калия (170 г, 1,2 ммоль). Раствор нагревали при 60°C в течение 2 часов, затем раствор охлаждали до комнатной температуры и разбавляли этилацетатом (100 мл). Полученный раствор промывали насыщенным солевым раствором (2×50 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-35 (15,4 мг, 0,18 ммоль, Выход=16,7%) и SB-36 (8 мг, 0,09 ммоль, Выход=8,3%) в виде белого твердого вещества. SB-35: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,09 (1H, д), 7,49 (1H, т), 7,38 (1H, т),7,34 (1H, т), 5,42 (1H,AB), 5,41 (1H,AB), 2,72 (1H, т), 1,45 (2H, кв), 0,91 (3H, т), 0,74 (3H, с). LCMS: Время удерживания=2,44 мин, m/z=450 [M+H]+ SB-36: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,88 (2H, дд), 7,40 (2H, дд), 5,53 (1H,AB), 5,51 (1H,AB), 2,67 (1H, т), 1,42-1,46 (2H, кв), 0,91 (3H, т), 0,73 (3H, с). LCMS: Время удерживания=2,64 мин, m/z=450 [M+H]+
Пример 83. Синтез соединения SB-37, SB-38 и SB-39

К суспензии K2CO3 (67 мг, 0,50 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (68,5 мг, 0,50 ммоль) и соединение SH (100 мг, 0,24 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SB-37 в виде белого твердого вещества (3,2 мг, 0,007 ммоль, 2,9%), SB-38 в виде белого твердого вещества (4,5 мг, 0,010 ммоль, 4,0%) и SB-39 в виде белого твердого вещества (10,9 мг, 0,022 ммоль, 9,3%). SB-37: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,70 (1H, д), 7,31-7,28 (2H, m), 5,43 (1H, AB), 5,38 (1H, AB), 2,72 (1H, т), 0,91(т), 0,73 (3H, с). LCMS: Время удерживания=2,43 мин. m/z=468,3 [M+H]+. SB-38: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,04 (1H, дд), 7,15 (1H, тд), 6,99 (1H, дд), 5,40 (1H, AB), 5,36 (1H, AB), 2,72 (1H, т), 0,91(т), 0,74 (3H, с). LCMS: Время удерживания=2,46 мин. m/z=468,3 [M+H]+. SB-39: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,85 (1H, дд), 7,46 (1H, дд), 7,20 (1H, тд), 5,50 (1H, AB), 5,48 (1H, AB), 2,66 (1H, т), 0,91(t), 0,74 (3H, с). LCMS: Время удерживания=2,53 мин. m/z=468,3 [M+H]+.
Пример 84. Синтез соединения SI

Синтез соединения SB-K. К раствору соединения SB-E (5 г, 15 ммоль) в сухом THF (20 мл) добавляли комплекс боран-тетрагидрофуран (30 мл 1,0M раствор в THF) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем медленно добавляли 10% водный раствор NaOH (56 мл). Смесь охлаждали на льду и медленно добавляли 30% водный раствор H2O2 (67 мл). Смесь перемешивают при температуре окружающей среды в течение 1 часа и затем экстрагировали EtOAc (3×100 мл). Объединенные экстракты EtOAc промывали 10% водным Na2S2O3 (100 мл), насыщенным солевым раствором (100 мл), сушили над MgSO4. Фильтрование и удаление растворителя дало сырой продукт 3,2 г для следующей стадии реакции.
Синтез соединения SB-L. К раствору соединения SB-K (3,2 г, 9 ммоль) в THF (40 мл) добавляли 2M HCl (3 мл). Реакционный раствор перемешивали при комнатной температуре в течение 12 часов, затем растворитель удаляли при пониженном давлении. Сырое целевое соединение очищали с помощью хроматографии на силикагеле (элюент: петролейный эфир/этилацетат=10:1-5:1) с получением 2,2 г продукта в виде белого твердого вещества, выход:81,40%.
Синтез соединения SB-M. К перемешиваемому раствору триметилсульфониум йодид (6,43 г, 31,5 ммоль) в 100 мл DMSO добавляли 60 масс.% NaH (1,26 г, 31,5 ммоль). После перемешивания при комнатной температуре (15°C) в течение 1 часа, раствор соединения SB-L (2,2 г, 7,2 ммоль) в 20 мл DMSO добавляли по каплям. Через 2,5 часа, реакционную смесь выливали в ледяную воду и экстрагировали эфиром (100 мл × 3). Объединенные эфирные слои промывали насыщенным солевым раствором (100 мл × 3), сушили (MgSO4), фильтровали и концентрировали, получая сырой продукт 1,6 г для следующей стадии реакции.
Синтез соединения SB-N. Соединение SB-M (1,6 г, 5 ммоль) растворяли в 60 мл H2O насыщенного CH2Cl2. (Использовали делительную воронку, CH2Cl2 встряхивали с несколькими миллилитрами H2O и затем отделяли от водного слоя). Добавляли DMP (4,2 г, 10 ммоль), и полученную реакционную смесь энергично перемешивали в течение 24 часов. Реакционный раствор разбавляли DCM (100 мл), промывали 10% водным Na2S2O3 (100 мл), насыщенным солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (элюент: петролейный эфир/этилацетат=20:1-10:1) с получением соединения, указанного в заголовке (1,2 г, 3,79 ммоль, 75%) в виде белого твердого вещества. H1 ЯМР (400 МГц CDCl3) δ (м.д.): 2,63 (с, 1H), 2,59 (с, 1H), 2,12 (с, 3H), 0,63 (с, 3H).
Синтез SI-A1 и SI-A2. Соединение SB-N (1,2 г, 3,8 ммоль) растворяли в сухом метаноле (250 мл), и добавляли Na (262 мг, 11,4 ммоль). Раствор кипятили с обратным холодильником в течение 16 часов. Метанол выпаривали и остаток растворяли в дихлорметане и промывали H2O (3×50 мл) и насыщенным солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали. Сырое целевое соединение очищали хроматографией на силикагеле (элюент: петролейный эфир/этилацетат=10:1-5:1) с получением SI-A1 (300 мг, 25%), SI-A2 (300 мг, 25%) в виде белого твердого вещества. SI-A1, 1H ЯМР (400 МГц CDCl3) δ (м.д.): 3,39 (с, 3H), 3,19 (с, 2H), 2,54 (т, 1H), 2,11(с, 3H), 0,61 (с, 3H). SI-A2, 1H ЯМР (400 МГц CDCl3) δ (м.д.): 3,39 (с, 5H), 3,37 (с, 2H), 2,52 (т, 1H), 2,11 (с, 3H), 0,62 (с, 3H).
Синтез соединения SI. Раствор SI-B2 (50 мг, 0,14 ммоль) в MeOH и обрабатывали 2 каплями HBr (48%) затем бром (6 капель). Смесь перемешивали при комнатной температуре в течение 1 часа и выливали в воду со льдом. Смесь экстрагировали EA (50 мл) и сушили над сульфатом натрия, фильтрация.
Пример 85. Синтез соединения SB-40 и SB-41
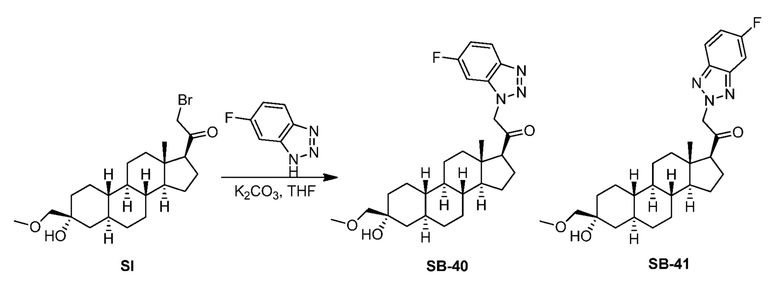
К суспензии K2CO3 (67 мг, 0,50 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (68,5 мг, 0,50 ммоль) и соединение SI (100 мг, 0,23 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SB-40 в виде белого твердого вещества (12,3 мг, 0,025 ммоль, 11,1%) и SB-41 в виде белого твердого вещества (16,2 мг, 0,033ммоль, 14,6%). SB-40: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,04 (1H, дд), 7,15 (1H, тд), 6,98 (1H, дд), 5,40 (1H, AB), 5,35 (1H, AB), 3,39 (с, 3H), 3,20 (с, 2H), 2,73 (1H, т), 0,73 (3H, с). LCMS: Время удерживания=2,33 мин. m/z=484,3 [M+H]+. SB-41: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,85 (1H, дд), 7,46 (1H, дд), 7,20 (1H, тд), 5,50 (1H, AB), 5,48 (1H, AB), 3,39 (с, 3H), 3,20 (с, 2H), 2,67 (1H, т), 0,75 (3H, с). LCMS: Время удерживания=2,42 мин. m/z=484,3 [M+H]+.
Пример 86. Синтез соединения SB-42, SB-43 и SB-44

К раствору неочищенного реагента SI (367,9 мг, 0,861 ммоль, теоретическое количество) в безводном THF (7,5 мл) добавляли 1H-1,2,3-триазоло[4,5-c]пиридин (206,8 мг, 1,722 ммоль), затем карбонат калия (238 мг, 1,722 ммоль). Раствор нагревали при 50°C в течение двух часов, затем раствор разбавляли этилацетатом (200 мл). Полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, с получением фракции 1, 2 и 3. Фракция 1 была не целевым основным продуктом на основе данных 1H ЯМР и NOESY, но побочным продуктом с неизвестной структурой. Фракция 2 представляла собой целевой продукт SB-43 (30 мг, 0,0643 ммоль, Выход=7,5% (2 стадии)). Фракция 3 представляла собой целевой продукт SB-44 (39,3 мг, 0,0842 ммоль, Выход=9,8% (2 стадии)). Все продукты представляли собой белые твердые вещества. Соединение SB-43: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,50 (1H, с), 8,58 (1H, д), 7,30 (1H, дд), 5,49 (1H, AB), 5,42 (1H, AB), 3,40 (3H, с), 3,20 (2H, с), 2,76 (1H, т), 0,73 (3H, с). LC-MS: Время удерживания=2,14 мин, m/z=467,2 [M+H]+ Соединение SB-44: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,46 (1H, с), 8,47 (1H, д), 7,76 (1H, дд), 5,61 (1H, AB), 5,58 (1H, AB), 3,40 (3H, с), 3,20 (2H, с), 2,71 (1H, т), 0,76 (3H, с). LC-MS: Время удерживания=2,22 мин, m/z=467,3 [M+H]+
Пример 87. Синтез соединения SB-45 и SB-46
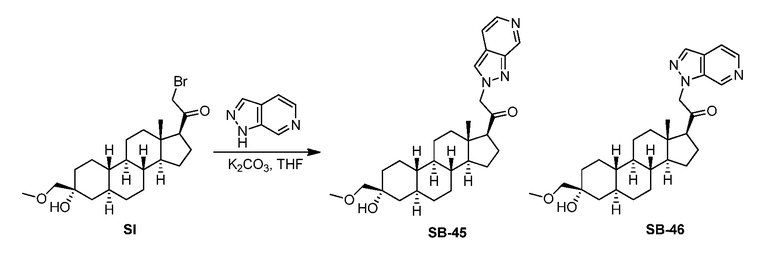
К раствору сырого реагента SI (245,3 мг, 0,573 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 1H-пиразоло[3,4-c]пиридин (137 мг, 1,148 ммоль), затем карбонат калия (159 мг, 1,148 ммоль). Раствор нагревали при 50°C в течение 2 часов, затем раствор разбавляли этилацетатом (200 мл). Полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-45 (5 мг, 0,011 ммоль, Выход=1,9% (2 стадии)) и продукт SB-46 (21,7 мг, 0,0466 ммоль, Выход=8,2% (2 стадии)) в виде белого твердого вещества. Соединение SB-45: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,26 (1H, с), 8,17 (1H, д), 7,99 (1H, с), 7,53 (1H, д), 5,32 (1H, AB), 5,24 (1H, AB), 3,39 (3H, с), 3,20 (2H, с), 2,69 (1H, т), 0,72 (3H, с). LC-MS: Время удерживания=2,22 мин, m/z=466,2 [M+H]+ Соединение SB-46: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,80 (1H, с), 8,34 (1H, д), 8,10 (1H, с), 7,65 (1H, дд), 5,27 (1H, AB), 5,25 (1H, AB), 3,40 (3H, с), 3,20 (2H, с), 2,70 (1H, т), 0,73 (3H, с). LC-MS: Время удерживания=2,29 мин, m/z=466,2 [M+H]+
Пример 88. Синтез соединения SB-47 и SB-48
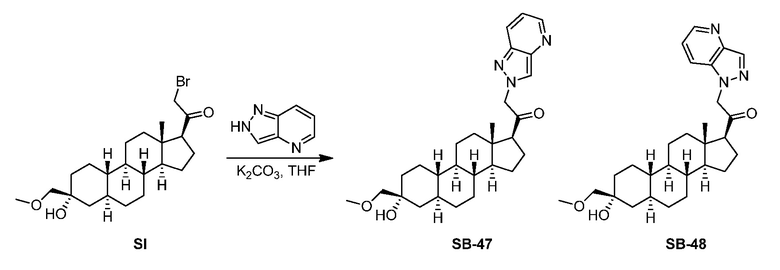
К раствору сырого реагента SI (245,3 мг, 0,574 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли 1H-пиразоло[4,3-b]пиридин (137 мг, 1,148 ммоль), затем карбонат калия (159 мг, 1,148 ммоль). Раствор нагревали при комнатной температуре в течение ночи, затем раствор разбавляли этилацетатом (200 мл). Полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, получая продукт SB-47 (18,3 мг, 0,0393 ммоль, Выход=6,8% (2 стадии)) и продукт SB-48 (57,1 мг, 0,213 ммоль, Выход=21% (2 стадии)) в виде бледно-желтого твердого вещества. Соединение SB-47: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,59 (1H, д), 8,21 (1H, с), 8,04 (1H, д), 7,22 (1H, дд), 5,27 (1H, AB), 5,21 (1H, AB), 3,39 (3H, с), 3,19 (2H, с), 2,67 (1H, т), 0,73 (3H, с). LC-MS: Время удерживания=2,15 мин, m/z=466,4 [M+H]+ Соединение SB-48: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,60 (1H, дд), 8,28 (1H, с), 7,59 (1H, т), 7,31 (1H, дд), 5,18 (1H, т), 5,15 (1H, AB), 3,39 (3H, с), 3,19 (2H, с), 2,68 (1H, т), 0,72 (3H, с). LC-MS: Время удерживания=2,19 мин, m/z=466,4 [M+H]+
Пример 89. Синтез соединения SB-49, SB-50 и SB-51

К раствору сырого реагента SI (245,3 мг, 0,574 ммоль, теоретическое количество) в безводном THF (5 мл) добавляли бензотриазол (342 мг, 2,87 ммоль), затем карбонат калия (397 мг, 2,87 ммоль). Раствор нагревали при 60°C в течение ночи. Затем раствор разбавляли этилацетатом (200 мл). Полученный раствор промывали насыщенным солевым раствором (2×100 мл), сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали препаративной ВЭЖХ с обращенной фазой, с получением фракции 1 и фракции 2. Фракция 1 представляла собой целевой продукт SB-49 (35,9 мг, 0,0771 ммоль, две стадии в целом выход=13,4%) в виде белого твердого вещества. Фракцию 2 дополнительно очищали с помощью хиральной препаративной ВЭЖХ с получением целевого продукта SB-50 (5,9 мг, 0,0127 ммоль, две стадии в целом выход=2,2%) и продукта SB-51 (4,0 мг, 0,00859 ммоль, две стадии в целом выход=1,5%) в виде белого твердого вещества. Соединение SB-49: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,08 (1H, д), 7,49 (1H, д), 7,38 (1H, д), 7,34 (1H, д), 5,43 (1H, AB), 5,40 (1H, AB), 3,39 (3H, с), 3,19 (2H, с), 2,72 (1H, т), 0,74 (3H, с). LC-MS: Время удерживания=2,37 мин, m/z =466,3 [M+H]+ Соединение SB-50: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,88 (2H, дд), 7,39 (2H, дд), 5,54 (1H, AB), 5,51 (1H, AB), 3,39 (3H, с), 3,19 (2H, с), 2,67 (1H, т), 0,75 (3H, с). LC-MS: Время удерживания=2,50 мин, m/z =466,2 [M+H]+ Соединение SB-51: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 7,89 (2H, дд), 7,40 (2H, дд), 5,56 (1H, AB), 5,48 (1H, AB), 3,38 (3H, с), 3,18 (2H, с), 2,74 (1H, дд), 0,92 (3H, с). LC-MS: Время удерживания=2,48 мин, m/z =466,2 [M+H]+
Пример 90. Синтез соединения SJ
Синтез соединения SB-O. К перемешиваемому раствору йодид триметилсульфония (8,1 г, 36,9 ммоль) в 100 мл DMSO добавляли NaH (60%; 1,26 г, 31,5 ммоль). После перемешивания при комнатной температуре в течение 1 часа, по каплям добавляли суспензию соединения SB-F (2,2 г, 7,2 ммоль) в DMSO (20 мл). Смесь перемешивали еще в течение 2,5 часов, затем выливали в воду со льдом и экстрагировали эфиром (100 мл × 3). Объединенные эфирные слои промывают насыщенным солевым раствором (100 мл × 3), сушили над MgSO4, фильтровали, и концетрировали, получая сырой продукт SB-O (2,2 г). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения SJ-A. Соединение SB-O (2,2 г, 7,3 ммоль) растворяли в сухом метаноле (250 мл), и добавляли Na (672 мг, 29,2 ммоль). Раствор перемешивали при кипении с обратным холодильником в течение 6 часов. Метанол выпаривали и остаток растворяли в дихлорметане и промывали H2O (3×50 мл) и насыщенным солевым раствором (100 мл) сушили над MgSО4, фильтровали и концентрировали. Сырое целевое соединение очищали с помощью хроматографии на силикагеле (петролейный эфир/этилацетат=10:1-5:1), и концентрировали с получением SJ-A (1,8 г, 82%) в виде белого твердого вещества. 1H ЯМР (500 МГц CDCl3), δ (м.д.), 5,03-5,01 (м, 1H), 3,43 (кв, 2H), 3,13 (с, 2H), 0,80 (с, 3H).
Синтез соединения SJ-B. К раствору соединения SJ-A (1,8 г, 5,2 ммоль) в сухом THF (50 мл) добавляли комплекс боран-тетрагидрофуран (20 мл 1,0M раствор в THF). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь охлаждали на бане со льдом, затем медленно гасили 10%-ным водным NaOH (10 мл), затем 30% водным раствором H2O2 (12 мл). Смесь оставляли перемешиваться при комнатной температуре в течение 1 часа и затем экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (100 мл), насыщенным солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали, получая сырое соединение SJ-B (1,8 г, 100%). Сырой продукт использовали на следующей стадии без дополнительной очистки.
Синтез SJ-C. К раствору сырого соединения SJ-B (1,8 г, 5,2 ммоль), растворенного в 60 мл H2O насыщенного дихлорметана (дихлорметан встряхивали с несколькими миллилитрами Н2О, затем отделяли от водного слоя), добавляли периодинат Десс-Мартина (4,4 г, 10,4 ммоль). После перемешивания при комнатной температуре в течение 24 часов, реакционную смесь экстрагировали дихлорметаном (3×100 мл). Объединенные органические слои промывали 10%-ным водным Na2S2O3 (100 мл), насыщенным солевым раствором (100 мл), сушили над MgSO4, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (петролейный эфир/этилацетат=10:1-5:1) с получением SJ-C (1 г, 2,8 ммоль, 56% для двух стадий) в виде белого твердого вещества. 1H ЯМР (400 МГц CDCl3), δ (м.д.), 3,52 (кв, 2H), 3,21 (с, 2H), 2,54 (т, 2H), 2,11 (с, 3H), 1,20 (т, 3H), 0,61 (с, 3H). LCMS: Время удерживания=7,25 мин. m/z=345,1 [M-17]+.
Синтез соединения SJ. К раствору соединения SJ-C (600 мг, 1,65 ммоль) в MeOH (20 мл) добавляли 5 капель HBr (48%), затем бром (264 мг, 1,65 ммоль). После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь выливали в воду со льдом, затем экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (200 мл), сушили над MgSO4, фильтровали и концентрировали с получением сырого соединения SJ (600 мг, 100%). Сырой продукт использовали на следующей стадии без дополнительной очистки. LCMS: Время удерживания=7,25 мин. m/z=463,1 [M+Na]+.
Пример 91. Синтез соединения SB-52 и SB-53

К суспензии K2CO3 (63 мг, 0,46 ммоль) в THF (10 мл) добавляли 1H-бензотриазол (55 мг, 0,46 ммоль) и соединение SJ (100 мг, 0,23 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SB-52 в виде белого твердого вещества (21,8 мг, 0,045 ммоль, 19,6%) и SB-53 в виде белого твердого вещества (9,7 мг, 0,020 ммоль, 8,7%). SB-52: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 8,08 (д, 1H), 7,49 (д, 1H), 7,38 (д, 1H), 7,34 (д, 1H), 5,44 (AB, 1H), 5,40 (AB, 1H), 3,53 (кв, 2H), 3,22 (с, 2H), 2,72 (т, 1H), 1,21 (т, 3H), 0,74 (с, 3H). LCMS: Время удерживания=2,43 мин. m/z=480,4 [M+H]+. SB-53: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,88 (дд, 2H), 7,39 (дд, 2H), 5,55 (AB, 1H), 5,49 (AB, 1H), 3,53 (кв, 2H), 3,22 (с, 2H), 2,37 (т, 1H), 1,20 (т, 3H), 0,76 (с, 3H). LCMS: Время удерживания=2,55 мин. m/z=480,4 [M+H]+.
Пример 92. Синтез соединения SB-54 и SB-55

К суспензии K2CO3 (63 мг, 0,46 ммоль) в THF (10 мл) добавляли 1H-пиразоло[4,3-b]пиридин (55 мг, 0,46 ммоль) и соединение SJ (100 мг, 0,23 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SB-54 в виде белого твердого вещества (23,1 мг, 0,048 ммоль, 20,1%) и SB-55 в виде белого твердого вещества (8,1 мг, 0,017 ммоль, 7,3%). SB-54: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,60 (1H, дд), 8,28 (1H, с), 7,59 (1H, т), 7,31 (1H, дд), 5,17 (1H, т), 5,15 (1H, AB), 3,53 (2H, кв), 3,22 (2H, с), 2,68 (1H, т), 1,21 (3H, т), 0,72 (3H, с). LCMS: Время удерживания=2,32 мин. m/z=480,4 [M+H]+. SB-55: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,58 (1H, д), 8,21 (1H, с), 8,04 (1H, д), 7,22 (1H, дд), 5,27 (1H, AB), 5,21 (1H, AB), 3,53 (2H, кв), 3,22 (2H, с), 2,67 (1H, т), 1,21 (3H, т), 0,73 (3H, с). LCMS: Время удерживания=2,27 мин. m/z=480,4 [M+H]+.
Пример 93. Синтез соединения SB-56 и SB-57

К суспензии K2CO3 (63 мг, 0,46 ммоль) в THF (10 мл) добавляли 1H-пиразоло [4,3-b]пиридин (55 мг, 0,46 ммоль) и соединение SJ (100 мг, 0,23 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SB-56 в виде белого твердого вещества (10,8 мг, 0,023 ммоль, 10,0%) и SB-57 в виде белого твердого вещества (28,1 мг, 0,059 ммоль, 25,5%). SB-56: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 8,80 (1H, с), 8,34 (1H, д), 8,10 (1H, с), 7,64 (1H, дд), 5,27 (1H, AB), 5,25 (1H, AB), 3,53 (2H, кв), 3,22 (2H, с), 2,70 (1H, т), 1,21 (3H, т), 0,73 (3H, с). LCMS: Время удерживания=2,43 мин. m/z=480,2 [M+H]+. SB-57: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,26 (1H, с), 8,17 (1H, д), 7,98 (1H, с), 7,53 (1H, д), 5,32 (1H, AB), 3,53 (2H, кв), 3,22 (2H, с), 2,68 (1H, т), 1,21 (3H, т), 0,72(3H, с). LCMS: Время удерживания=2,23 мин. m/z=480,3 [M+H]+.
Пример 94. Синтез соединения SB-58 и SB-59
К суспензии K2CO3 (63 мг, 0,46 ммоль) в THF (10 мл) добавляли 1H-[1,2,3]триазоло[4,5-c]пиридин (55 мг, 0,46 ммоль) и соединение SJ (100 мг, 0,23 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, с получением соединения SB-58 в виде белого твердого вещества (11,3 мг, 0,024 ммоль, 10,2%) и SB-59 в виде белого твердого вещества (20,1 мг, 0,042 ммоль, 18,2%). SB-58: 1H ЯМР (400 МГц CDCl3) δ (м.д.): 9,50 (1H, с), 8,58 (1H, д), 7,29 (1H, дд), 5,48 (1H, AB), 5,42 (1H, AB), 3,53 (2H, кв), 3,22 (2H, с), 2,68 (1H, т), 1,14 (3H, т), 0,67 (3H, с). LCMS: Время удерживания=2,37 мин. m/z=481,2 [M+H]+. SB-59: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 9,46 (1H, д), 8,47 (1H, д), 7,76 (1H, дд), 5,60 (1H, AB), 5,58 (1H, AB), 3,53 (2H, кв), 3,22 (2H, с), 2,70 (1H, т), 1,21 (3H, т), 0,76(3H, с). LCMS: Время удерживания=2,28 мин. m/z=481,1 [M+H]+.
Пример 95. Синтез соединения SB-60

К суспензии K2CO3 (67 мг, 0,50 ммоль) в THF (5 мл) добавляли 5-фтор-2H-бензо[d][1,2,3]триазол (68,5 мг, 0,50 ммоль) и соединение SJ (100 мг, 0,25 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь выливали в 5 мл H2O и экстрагировали EtOAc (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой, получая SB-60 в виде белого твердого вещества (5,9 мг, 0,012 ммоль, 4,8%). SB-60: 1H ЯМР (500 МГц CDCl3) δ (м.д.): 7,86 (1H, дд), 7,46 (1H, дд), 7,20 (1H, тд), 5,50 (1H, AB), 5,48 (1H, AB), 3,53 (кв), 3,22 (с, 2H), 2,67 (т), 1,21 (т), 0,75 (с, 3H). LCMS: Время удерживания=2,51 мин. m/z=498,3 [M+H]+.
Методы анализа
Соединения, представленные в настоящем описании, можно исследовать с использованием различных in vitro и in vivo анализов; примеры которых описаны ниже.
Стероидное ингибирование связывания TBPS
Анализ связывания TBPS, в котором использовали мембраны коры головного мозга крыс в присутствии 5 мкM ГАМК был описан (Gee et al, J. Pharmacol. Exp. Ther. 1987, 241, 346-353; Hawkinson et al, Mol. Pharmacol. 1994, 46, 977-985; Lewin, A.H et al., Mol. Pharmacol. 1989, 35, 189-194).
Кратко, кору головного мозга быстро удаляли после декапитации крыс Sprague-Dawley (200-250 г), под анестезией двуокисью углерода. Кору головного мозга гомогенизировали в 10 объемах 0,32М сахарозы, охлажденной на льду, используя гомогенизатор стекло/тефлон и центрифугировали при 1500 × g в течение 10 минут при 4°C. Полученные осадки центрифугировали при 10000 × g в течение 20 минут при 4°C, получая осадки P2. Осадки Р2 ресуспендировали в 200 мM NaCl/50 мM Na-K фосфатном буфере pH 7,4 и центрифугировали при 10000 × g в течение 10 минут при 4°C. Эту процедуру промывки повторяли дважды, и гранулы ресуспендировали в 10 объемах буфера. Аликвоты (100 мкл) суспензий мембран инкубировали с 3 нM [35S]-TBPS и 5 мкл аликвот тестируемого лекарственного средства, растворенного в диметилсульфоксиде (DMSO) (конечный 0,5%) в присутствии 5 мкМ GABA. Инкубационную смесь доводят буфером до конечного объема 1,0 мл. Неспецифическое связывание отмечают в присутствии 2 мкМ немеченого TBPS и изменяется от 15 до 25%. После инкубации 90 минут при комнатной температуре, анализы прекращают фильтрацией через стекловолоконные фильтры (Schleicher Schuell и No. 32), используя харвестера клеток (Brandel) и трижды промывают охлажденным льдом буфером. Связанную на фильтре радиоактивность измеряли методом жидкостной сцинтилляционной спектрометрии. Осуществляли не-линейную подгонку кривой общих данных для каждого лекарственного средства, усредненных для каждой концентрации, с использованием Prism (GraphPad). Данные подгоняли к модели частичного, вместо полного, ингибирования, если сумма квадратов была существенно ниже в соответствии с F-критерием. Аналогичным образом, данные подгоняли к двухкомпонентной, вместо однокомпонентной модели ингибирования, если сумма квадратов была существенно ниже в соответствии с F-критерием. Концентрацию испытываемого соединения, обеспечивающую 50% ингибирование (IC50) специфического связывания и максимальную степень ингибирования (Imax) определяли для отдельных экспериментов при помощи той же модели, которую использовали для общих данных, и затем рассчитывали средние значения ± SEM(стандартная ошибка среднего) отдельных экспериментов. Пикротоксин служил в качестве положительного контроля для этих исследований, так как было показано, что он сильно ингибирует связывание TBPS.
Проводили скрининг различных соединений с целью установления их активности как модуляторов связывания [35S]TBPS in vitro. Эти анализы осуществляли, или их можно осуществлять, в соответствии с обсуждаемыми выше процедурами.
Электрофизиологический пэтч-кламп анализ рекомбинантных ГАМКA рецепторов α1β2γ2 и α4β3δ
Электрофизиологию клетки использовали для измерения фармакологических свойств модуляторов ГАМКА рецепторов в гетерологичных клеточных системах. Каждое соединение тестировали на его способность влиять на ГАМК-опосредованные токи при субмаксимальной дозе агониста (ГАМК EC20=2 мкМ). Клетки LTK стабильно трансфицировали α1β2γ2 субъединицами ГАМК рецептора и клетки CHO транзиторно трансфицировали α4β3δ субъединицами с помощью Липофектаминового метода. Клетки пассировали при конфлюентности 50-80%, а затем высевали на 35 мм стерильные чашки для культивирования, содержащие 2 мл полной культуральной среды без антибиотиков или противогрибковых средств. Конфлюентные кластеры клеток электрически объдиняли (Pritchett et al., 1988). Поскольку ответы находящихся в отдалении клеткок нельзя было адекватно определить методом фиксации напряжения и из-за неопределенностей, связанных со степенью объединения (Verdoorn et al., 1990), клетки культивировали при плотности, которая позволяет осуществлять регистрацию отдельных клеток (без видимых соединений с другими клеткам).
Токи целых клеток измеряли при помощи усилителей HEKA EPC-10 с использованием программного обеспечения PatchMaster или с использованием высокопроизводительной системы QPatch platform (Sophion).. Растворы в ванне для всех экспериментов содержали (в мM): NaCl 137 мM, KCl 4 мM, CaCl2 1,8 мM, MgCl2 1 мM, HEPES 10 мM, D-глюкоза 10 мM, pH (NaOH) 7,4. В некоторых случаях также добавляли 0,005% кремофор. Внутриклеточный (пипетка) раствор содержал: KCl 130 мM, MgCl2 1 мM, Mg-ATP 5 мM, HEPES 10 мM, EGTA 5 мM, pH 7,2. В процессе осуществления экспериментов клетки и растворы поддерживали при комнатной температуре (19°C - 30°C). Для осуществляемых вручную пэтч-кламп регистраций, чашки с культурами клеток помещали на оборудованный на микроскопе держатель для чашек и непрерывно пропускали через них (1 мл/мин) раствор в ванночке. После образования гигаомного уплотнения между пэтч-электродами и клеткой (диапазон сопротивления на пипетке: 2,5 МОм - 6,0 Мом; диапазон сопротивления в месте уплотнения: >1 ГОм) клеточную мембрану на конце пипетки разрывали для обеспечения электрического прохода внутрь клетки (пэтч-кламп анализ в формате цельной клетки). Для экспериментов с использованием системы QPatch, клетки переносили в виде суспензии в систему QPatch в омывающий раствор и осуществляли автоматизированную запись в формате цельной клетки.
Фиксацию напряжения в клетках осуществляли при потенциале удерживания -80 мВ. Для анализа исследуемых препаратов, ГАМК-рецепторы стимулировали 2 мкM ГАМК после последовательной предварительной инкубации увеличивающимися концентрациями исследуемого препарата. Продолжительность предварительной инкубации составляла 30 сек, а продолжительность ГАМК стимула составляла 2 сек. Исследуемые препараты растворяли в DMSO с получением основных растворов (10 мM). Исследуемые препараты разбавляли в 0,01, 0,1, 1, и 10 мкM в омывающем растворе. Все концентрации исследуемых веществ были протестированы на каждой клетке. Относительное процентное потенцирование определяли как пиковую амплитуду в ответ на ГАМК EC20 в присутствии исследуемого препарата, деленное на пиковую амплитуду в ответ только на ГАМК EC20, умноженное на 100.
Анализ связывания TBPS иллюстративных соединений
Для таблицы 1, “A” означает IC50<10 нM, “B” означает IC50 от 10 нM до 50 нM, “C” означает IC50 от 50 нM до 100 нM, “D” означает IC50 от 100 нM до 500 нM, и “E” означает IC50>500 нM.
Биохимический анализ иллюстративных соединений на основе ГАМК альфа-1.
Биохимический анализ иллюстративных соединений ГАМК альфа-1 показан в таблице 2. Для таблицы 2, колонка “ГАМКa альфа1 (α1β2γ2)EC50 (нM)”: “A” означает EC50<100 нM, “B” означает EC50 от 100 нM до меньше или равно 500 нM, “C” означает EC50 от >500 нM до меньше или равно 1000 нM, “D” означает EC50 от >1000 нM до меньше или равно 2000 нM, и “E” означает EC50>2000 нM. Колонка “ГАМКa альфа1 (α1β2γ2)Emax (%)”:“a” означает Emax 0-500%; “b” означает Emax 500-1000%; “c” означает Emax>1000%.
Биохимический анализ иллюстративных соединений на основе ГАМК альфа-1.
Для таблицы 3: Биохимический анализ иллюстративных соединений на основе ГАМК альфа-1 и альфа 4 показан в таблице 3. Для таблицы 3. Рецепторы ГАМК-A α1β2γ2 и α4β3δ % эффективности измеряют при 10 мкM соединения: “A” означает значение эффективности 10-100%, “B” означает значение эффективности >100-500%, “C” означает значение эффективности >500%; “D” означает, что данные не определены или не доступны.
Другие варианты осуществления
В пунктах формулы изобретения единственное число существительного может означать один или более одного, если не указано иное или в противном случае очевидно из контекста. Пункты формулы изобретения или описания, где встречается союз «или» между одним или большим количеством членов группы, считаются удовлетворяющими требованиям, если один, более чем один или все члены группы присутствуют в, используются в, или иным образом имеют отношение к данному продукту или процессу, если не указано иное, или иное не следует из контекста. Изобретение включает варианты осуществления, в которых в точности один член группы присутствует в, используется в, или иным образом имеет отношение к данному продукту или процессу. Изобретение включает варианты осуществления, в которых более чем один, или все члены группы, присутствует в, используются в, или иным образом имеют отношение к данному продукту или процессу.
Кроме того, настоящее изобретение охватывает все варианты, комбинации, и изменения, в которых одно или более ограничений, элементов, условий, описательных терминов из одного или большего количества перечисленных пунктов формулы изобретения введены в другой пункт формулы изобретения. Например, любой пункт, который зависит от другого пункта, может быть изменен для включения одного или нескольких ограничений, найденных в любом другом пункте, зависимом от того же основного пункта. Там, где элементы представлены в виде списка, например, в группе формата Markush, следует понимать, что каждая подгруппа элементов также раскрыта, и любой элемент(ы) можно удалять из группы. Следует понимать, что, как правило, если изобретение или аспекты изобретения называют содержащим(ими) конкретные элементы и/или характерные особенности, некоторые варианты осуществления изобретения или аспекты изобретения состоят, или в основном состоят, из таких элементов, и/или характерных особенностей. Для простоты, такие варианты осуществления не были специальным образом описаны в тех же выражениях в настоящей заявке. Следует также отметить, что термины "включающий" и "содержащий" предназначены, чтобы быть открытыми и позволяют включение дополнительных элементов или стадий. Где даны диапазоны, конечные точки включены. Кроме того, следует понимать, что, если не указано особо или иным образом не очевидно из контекста и не понятно любому рядовому специалисту в данной области, значения, которые выражены в виде диапазона, могут предполагать любое конкретное значение или подгруппу в пределах заявленного диапазона в различных вариантах осуществления изобретения, до десятой доли целого нижнего предела диапазона, если из контекста с очевидностью не следует иное.
Настоящая заявка содержи ссылки на различные изданные патенты, опубликованные патентные заявк, журнальные статьи и другие публикации, которые все включены в настоящую заявку в качестве ссылки. В случае конфликта между каким-либо из включенных ссылочных документов и настоящим описанием, преимущество имеет настоящее описание. Кроме того, любой конкретный вариант осуществления настоящего изобретения, который подпадает под известный уровень техники, может быть явным образом исключен из любого одного или нескольких пунктов формулы изобретения. Поскольку такие варианты осуществления считаются известными специалистам в данной области, они могут быть исключены, даже если такое исключение явным образом не указано в настоящей заявке. Любой конкретный вариант осуществления настоящего изобретения может быть исключен из любого пункта формулы изобретения, по любой причине, независимо от того, связано это или нет с существующим уровнем техники.
Специалистам в данной области будет понятно, или удастся установить, используя не более чем рутинное экспериментирование, многочисленные эквиваленты конкретных воплощений, описанных в данном документе множество эквивалентов конкретных вариантов осуществления изобретения, описанных в настоящем документе. Объем представленных вариантов осуществления, описанных в настоящем документе, не предназначен быть ограниченным приведенным выше описанием, а скорее как изложено в прилагаемой формуле изобретения. Специалистам в данной области будет понятно, что различные изменения и модификации настоящего описания могут быть сделаны без отступления от сущности или объема настоящего изобретения, как определено в формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| 19-НОР C3, 3-ДИЗАМЕЩЕННЫЕ C21-N-ПИРАЗОЛИЛЬНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2675855C2 |
| 19-НОР C3,3-ДИЗАМЕЩЕННЫЕ C21-N-ПИРАЗОЛИЛЬНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2812930C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2018 |
|
RU2810331C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2018 |
|
RU2799448C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ, КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2699359C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ, ЗАМЕЩЕННЫЕ В ПОЛОЖЕНИИ 10 ЦИКЛИЧЕСКОЙ ГРУППОЙ, ДЛЯ ИСПОЛЬЗОВАНИЯ ПРИ ЛЕЧЕНИИ РАССТРОЙСТВ ЦНС | 2019 |
|
RU2796006C2 |
| С17-, С20- И С21-ЗАМЕЩЕННЫЕ НЕЙРОАКТИВНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2828261C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ, ИХ КОМПОЗИЦИИ И ПРИМЕНЕНИЕ | 2014 |
|
RU2696585C2 |
| ОКСИСТЕРОЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2742333C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2015 |
|
RU2733756C2 |





Изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли. В формуле (I)  представляет собой одинарную или двойную связь, как позволяет валентность; A имеет формулу (A-1) или формулу (A-2), где точка присоединения находится в G1 или G2 в формуле (A-1) и точка присоединения находится в G2 или G3 в формуле (A-2); G1 представляет собой N, NRN1 или C-RG1, как позволяет валентность; G2 представляет собой N или -C=N-, как позволяет валентность; G3 представляет собой N или C-RG3, как позволяет валентность; G4 представляет собой N или C-RG4, как позволяет валентность; G5 представляет собой N или C-RG5, как позволяет валентность; G6 представляет собой N или C-RG6, как позволяет валентность; и G7 представляет собой N или C-RG7, как позволяет валентность; в каждом случае RG1, RG2, RG3, RG4, RG5, RG6 и RG7 независимо представляет собой водород, галоген, -CN, -ORGA или незамещенный C1-6 алкил; в каждом случае RN1 представляет собой незамещенный C1-6 алкил; в каждом случае RGA независимо представляет собой водород, C1-6 алкил, замещенный фтором, или незамещенный C1-6 алкил; R1 представляет собой C1-6 алкил, замещенный фтором, метокси или этокси, или незамещенный C1-6 алкил; R2 представляет собой водород; R3a представляет собой водород и R3b представляет собой водород; каждый R4a или R4b независимо представляет собой водород; при условии, если связь р является двойной связью, то связь q представляет собой одинарную связь, при условии, если связь q представляет собой двойную связь, то связь р представляет собой одинарную связь и R4b отсутствует; и при условии, если обе связи q и р представляют собой одинарные связи, то водород в С5 находится в альфа- или бета-конфигурации. Изобретение также относится к фармацевтическим солям соединений, к фармацевтической композиции, к индивидуальным соединениям и их фармацевтически приемлемым солям. Технический результат: получены новые соединения формулы (I), обладающие свойством ГАМК-модулятора. 8 н. и 13 з.п. ф-лы, 13 ил., 3 табл., 95 пр.
представляет собой одинарную или двойную связь, как позволяет валентность; A имеет формулу (A-1) или формулу (A-2), где точка присоединения находится в G1 или G2 в формуле (A-1) и точка присоединения находится в G2 или G3 в формуле (A-2); G1 представляет собой N, NRN1 или C-RG1, как позволяет валентность; G2 представляет собой N или -C=N-, как позволяет валентность; G3 представляет собой N или C-RG3, как позволяет валентность; G4 представляет собой N или C-RG4, как позволяет валентность; G5 представляет собой N или C-RG5, как позволяет валентность; G6 представляет собой N или C-RG6, как позволяет валентность; и G7 представляет собой N или C-RG7, как позволяет валентность; в каждом случае RG1, RG2, RG3, RG4, RG5, RG6 и RG7 независимо представляет собой водород, галоген, -CN, -ORGA или незамещенный C1-6 алкил; в каждом случае RN1 представляет собой незамещенный C1-6 алкил; в каждом случае RGA независимо представляет собой водород, C1-6 алкил, замещенный фтором, или незамещенный C1-6 алкил; R1 представляет собой C1-6 алкил, замещенный фтором, метокси или этокси, или незамещенный C1-6 алкил; R2 представляет собой водород; R3a представляет собой водород и R3b представляет собой водород; каждый R4a или R4b независимо представляет собой водород; при условии, если связь р является двойной связью, то связь q представляет собой одинарную связь, при условии, если связь q представляет собой двойную связь, то связь р представляет собой одинарную связь и R4b отсутствует; и при условии, если обе связи q и р представляют собой одинарные связи, то водород в С5 находится в альфа- или бета-конфигурации. Изобретение также относится к фармацевтическим солям соединений, к фармацевтической композиции, к индивидуальным соединениям и их фармацевтически приемлемым солям. Технический результат: получены новые соединения формулы (I), обладающие свойством ГАМК-модулятора. 8 н. и 13 з.п. ф-лы, 13 ил., 3 табл., 95 пр.
 ,
, (A-1),
(A-1), 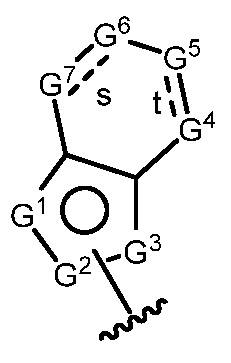 (A-2).
(A-2).
1. Соединение формулы (I)

или его фармацевтически приемлемая соль,
где  представляет собой одинарную или двойную связь, как позволяет валентность;
представляет собой одинарную или двойную связь, как позволяет валентность;
A имеет формулу (A-1) или формулу (A-2):
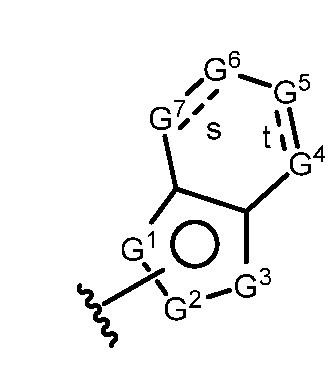 (A-1), или
(A-1), или 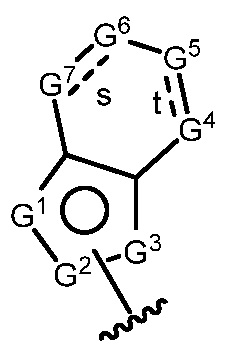 (A-2),
(A-2),
где точка присоединения находится в G1 или G2 в формуле (A-1) и точка присоединения находится в G2 или G3 в формуле (A-2);
G1 представляет собой N, NRN1 или C-RG1, как позволяет валентность;
G2 представляет собой N или -C=N-, как позволяет валентность;
G3 представляет собой N или C-RG3, как позволяет валентность;
G4 представляет собой N или C-RG4, как позволяет валентность;
G5 представляет собой N или C-RG5, как позволяет валентность;
G6 представляет собой N или C-RG6, как позволяет валентность; и
G7 представляет собой N или C-RG7, как позволяет валентность;
в каждом случае RG1, RG2, RG3, RG4, RG5, RG6 и RG7 независимо представляет собой водород, галоген, -CN, -ORGA или незамещенный C1-6 алкил;
в каждом случае RN1 представляет собой незамещенный C1-6 алкил;
в каждом случае RGA независимо представляет собой водород, C1-6 алкил, замещенный фтором, или незамещенный C1-6 алкил;
R1 представляет собой C1-6 алкил, замещенный фтором, метокси или этокси, или незамещенный C1-6 алкил;
R2 представляет собой водород;
R3a представляет собой водород и R3b представляет собой водород;
каждый R4a или R4b независимо представляет собой водород;
при условии, если связь р является двойной связью, то связь q представляет собой одинарную связь, при условии, если связь q представляет собой двойную связь, то связь р представляет собой одинарную связь и R4b отсутствует; и при условии, если обе связи q и р представляют собой одинарные связи, то водород в С5 находится в альфа- или бета-конфигурации.
2. Соединение по п.1, где соединение имеет формулу (II)
 ,
,
или его фармацевтически приемлемая соль.
3. Соединение по п.1, где соединение имеет формулу (II-a)
 ,
,
или его фармацевтически приемлемая соль.
4. Соединение по п.1, где соединение имеет одну из следующих формул:

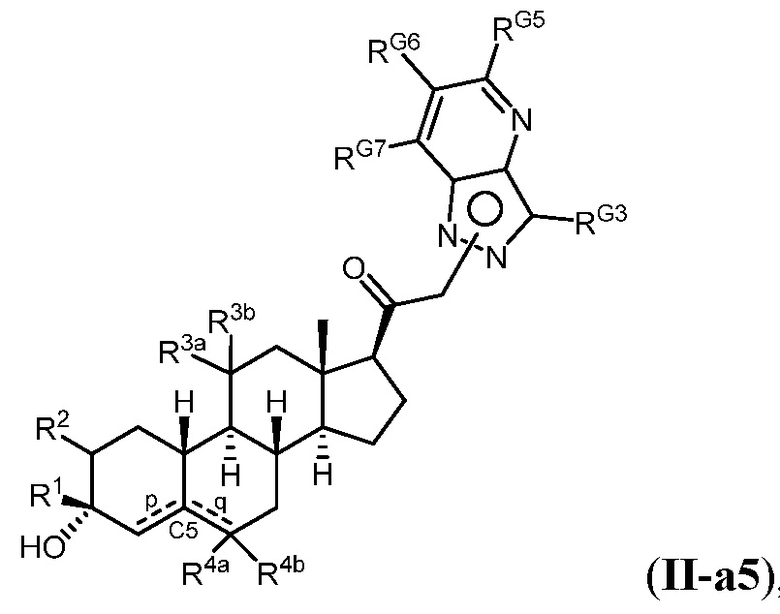
или его фармацевтически приемлемая соль.
5. Соединение по п.1, где соединение имеет одну из следующих формул:
 Р
Р

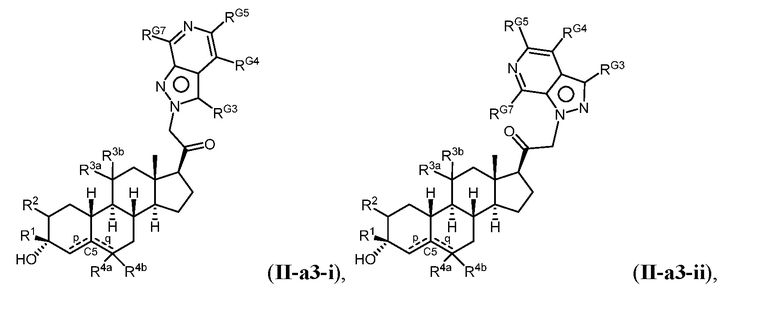
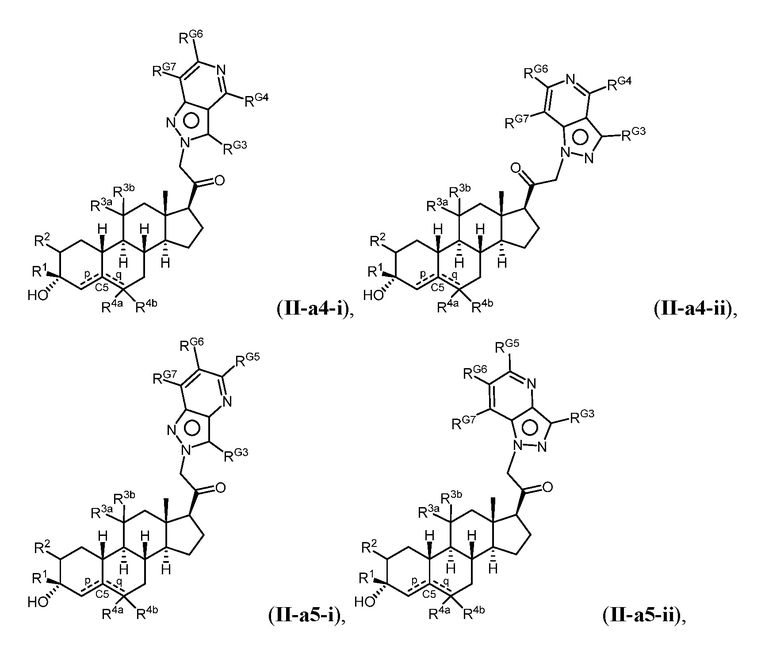
или его фармацевтически приемлемая соль.
6. Соединение по п.1, где соединение имеет формулу (II-b)
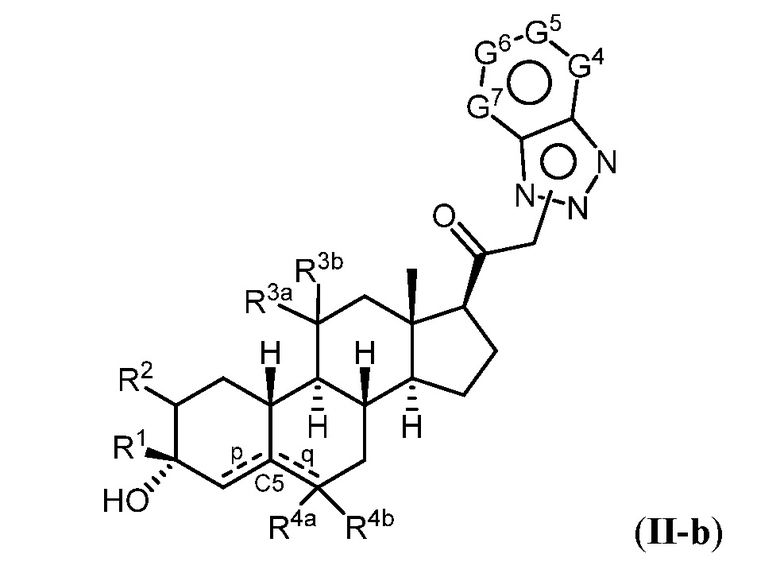 ,
,
или его фармацевтически приемлемая соль.
7. Соединение по п.1, где соединение имеет одну из следующих формул:
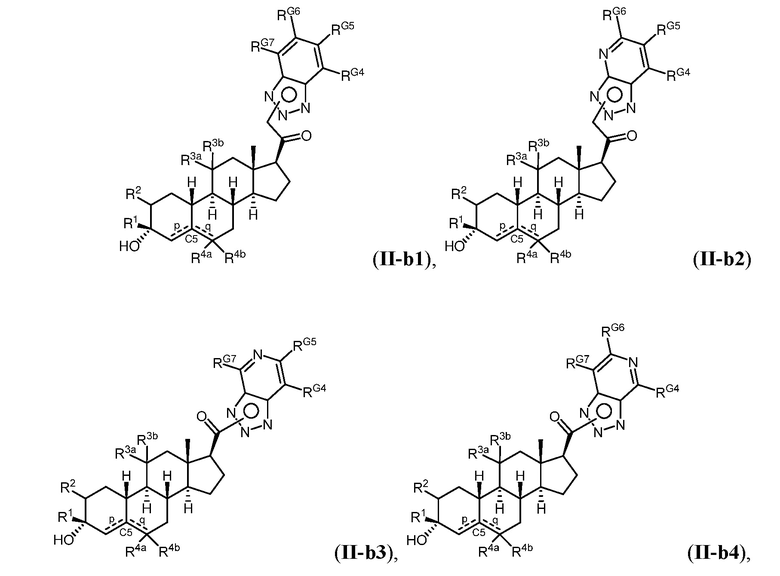

или его фармацевтически приемлемая соль.
8. Соединение по п.1, где соединение имеет одну из следующих формул:

или его фармацевтически приемлемая соль.
9. Соединение по п.1, где соединение имеет формулу (IV)
 ,
,
или его фармацевтически приемлемая соль.
10. Соединение по п.1, где соединение имеет формулу (IV-a)
 ,
,
или его фармацевтически приемлемая соль.
11. Соединение по п.1, где соединение имеет формулу (IV-a1)
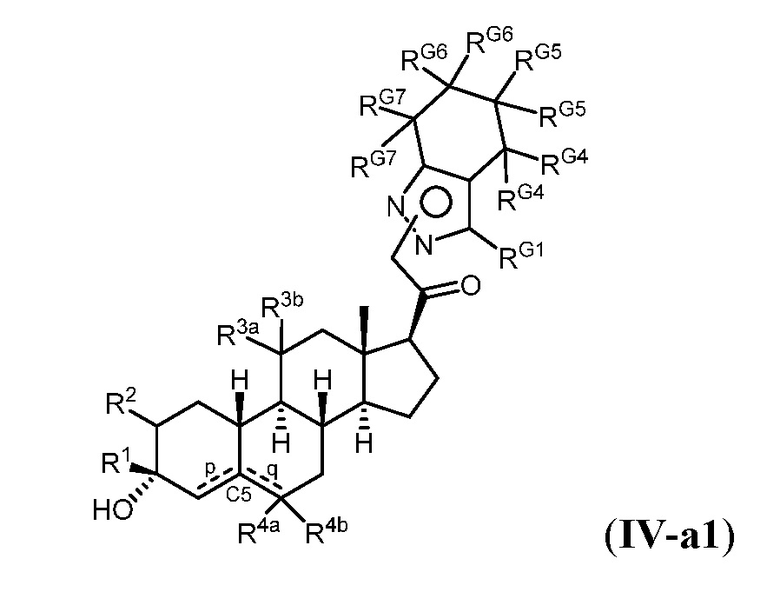 ,
,
или его фармацевтически приемлемая соль.
12. Соединение по п.1, где соединение имеет одну из следующих формул:

или его фармацевтически приемлемая соль.
13. Соединение по п.1, где соединение выбрано из группы, состоящей из:
 ,
,  ,
,
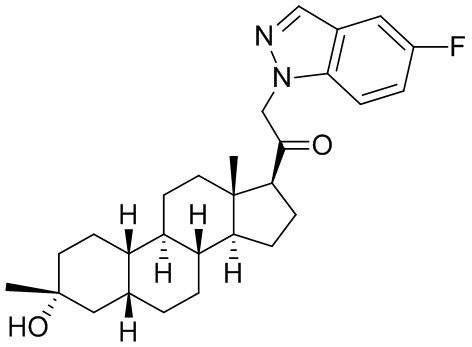 ,
, 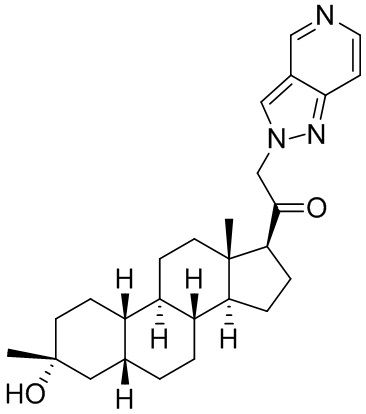 ,
,
 ,
,  ,
,
 ,
, 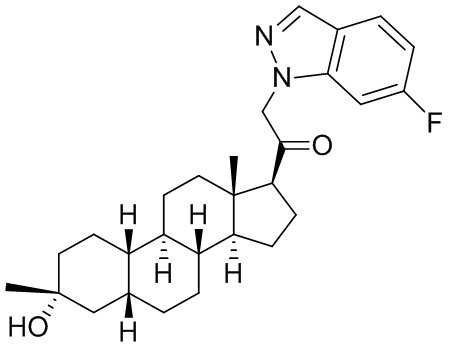 ,
,
 ,
,  ,
,
 ,
, 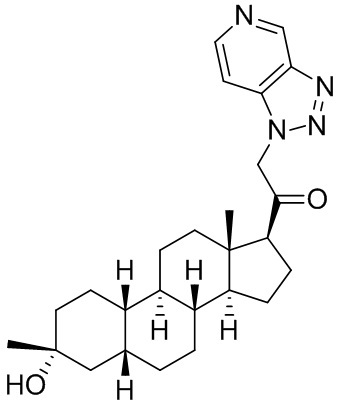 ,
,
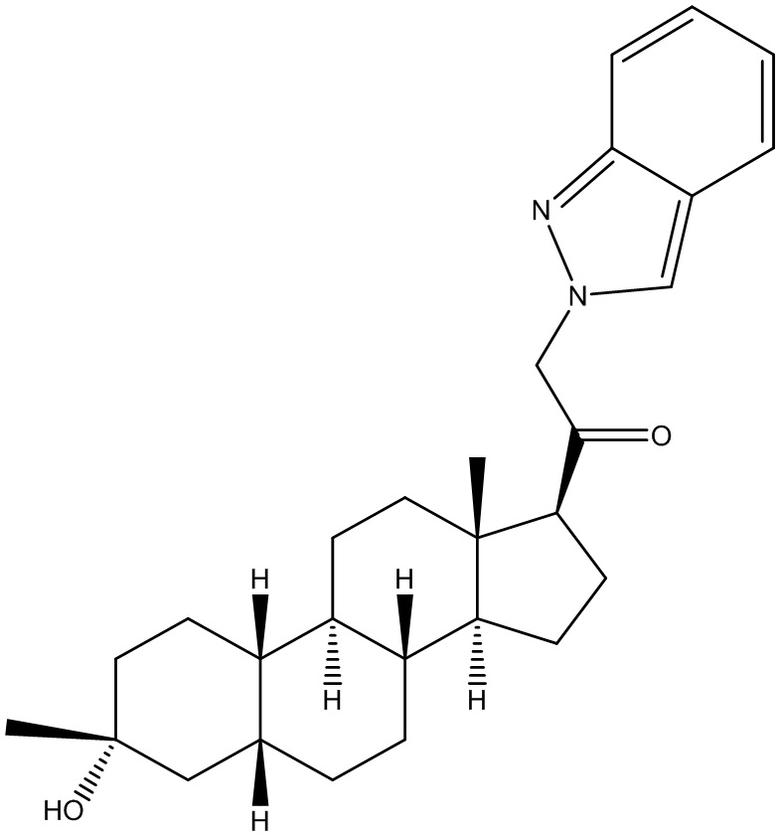 ,
,  ,
,
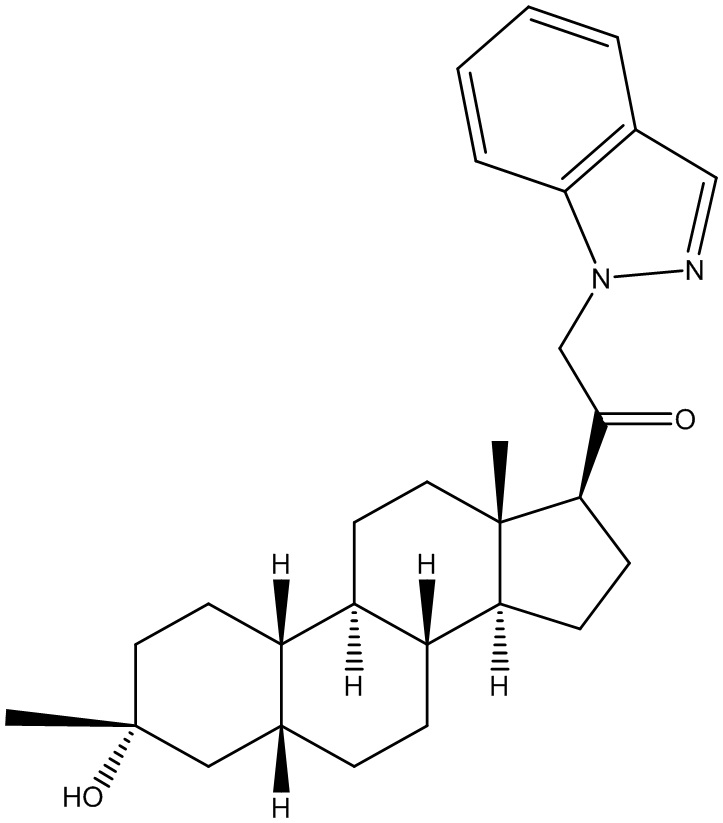 ,
,  ,
,
 ,
,  ,
,
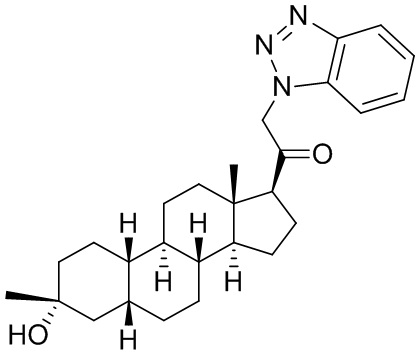 ,
,  ,
,
 и
и  ,
,
или его фармацевтически приемлемая соль.
14. Фармацевтически приемлемая соль соединения по п.1, где соединение выбрано из группы, состоящей из:
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 и
и  .
.
15. Соединение по п.1, где соединение выбрано из группы, состоящей из:
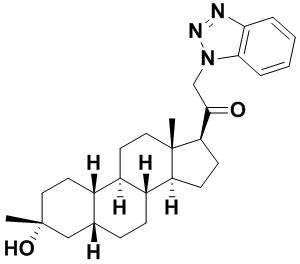 ,
,  ,
,
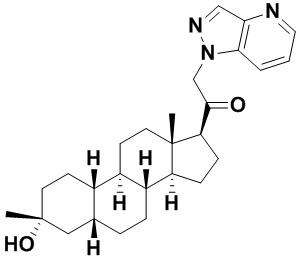 ,
,  ,
,
 ,
, 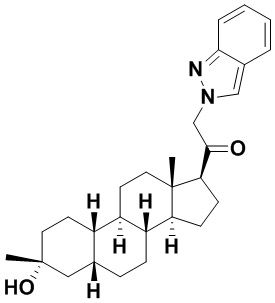 ,
,
 ,
, 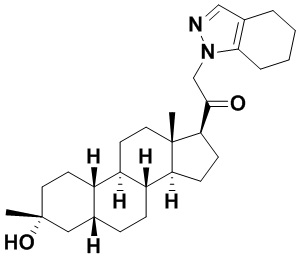 ,
,
 ,
,  ,
,
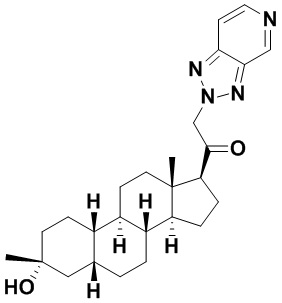 ,
,  ,
,
 ,
, 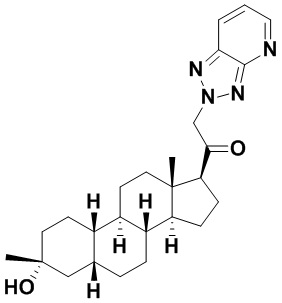 ,
,
 ,
,  ,
,
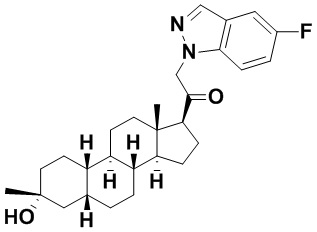 ,
,  ,
,
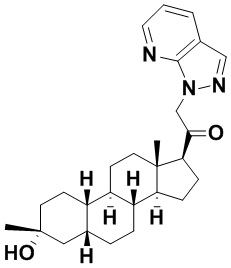 ,
,  ,
,
 ,
, 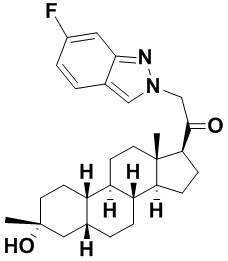 ,
,
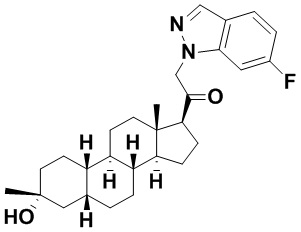 ,
, 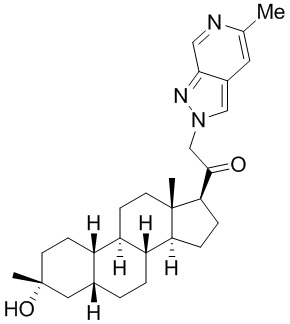 ,
,
 ,
, 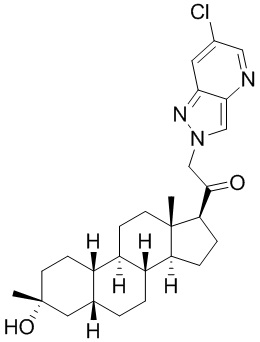 ,
,
 ,
,  ,
,
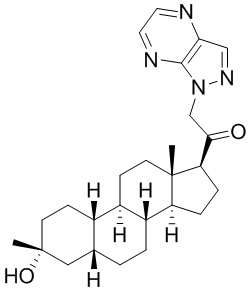 ,
, 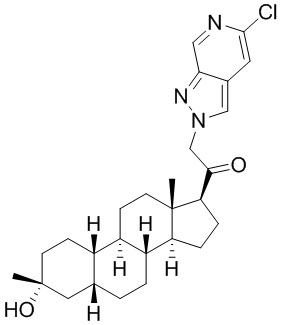 ,
,
 ,
, 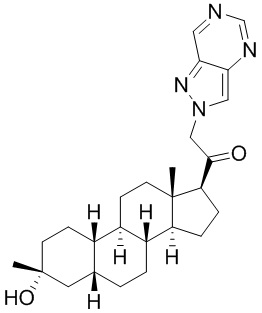 ,
,
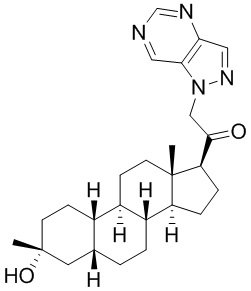 ,
, 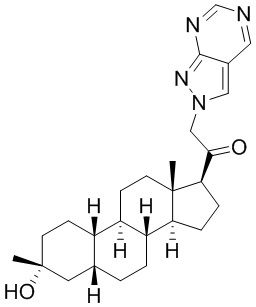 ,
,
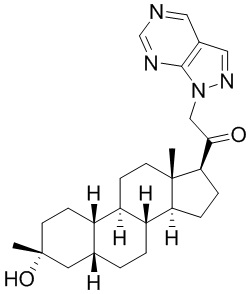 ,
, 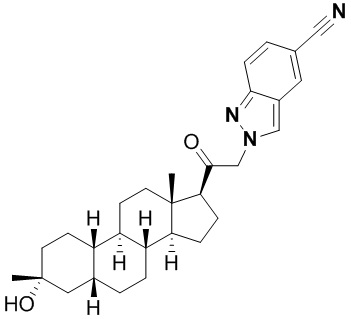 ,
,
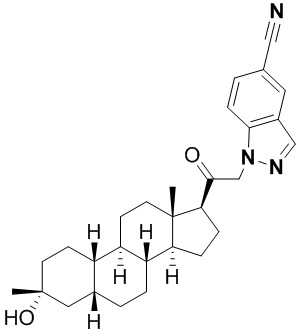 ,
, 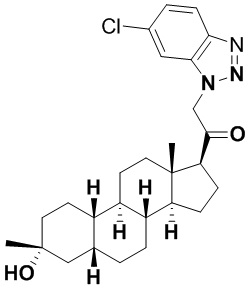 ,
,
 ,
, 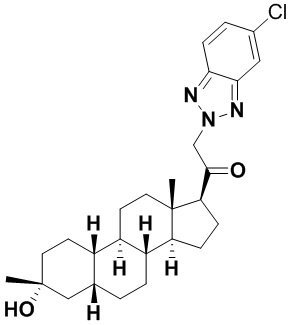 ,
,
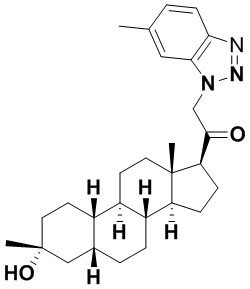 ,
,  ,
,
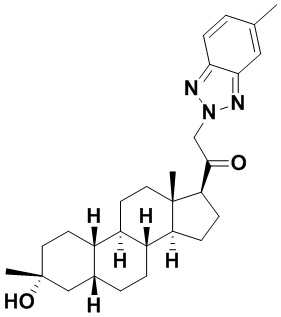 ,
, 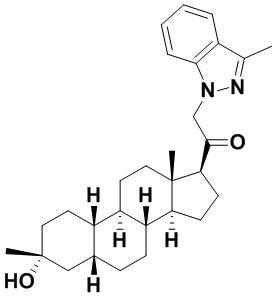 ,
,
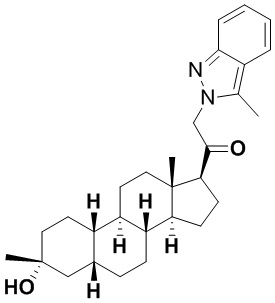 ,
,  ,
,
 ,
, 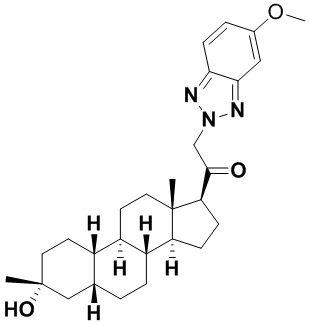 ,
,
 ,
,  ,
,
 ,
,  ,
,
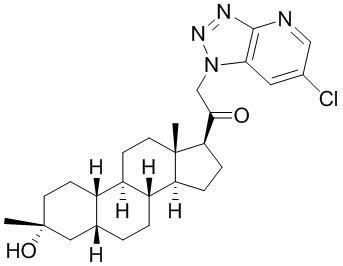 ,
,  ,
,
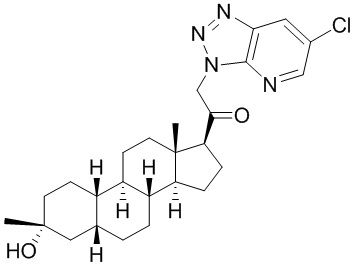 ,
, 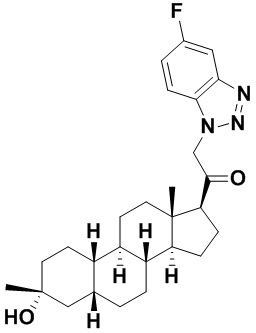 ,
,
 ,
, 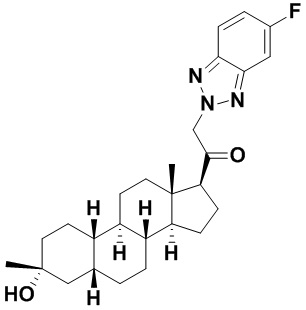 ,
,
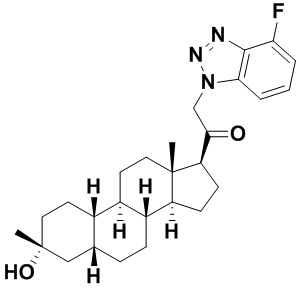 ,
, 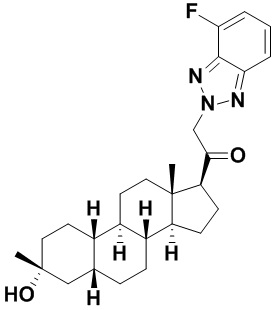 ,
,
 ,
,  ,
,
 ,
, 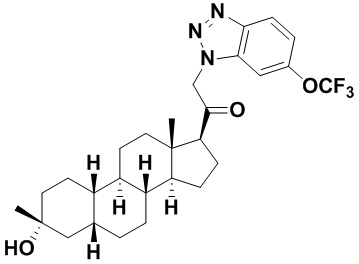 ,
,
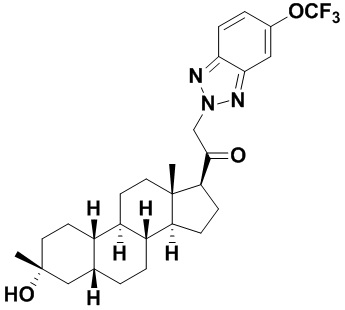 ,
, 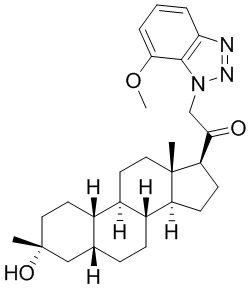 ,
,
 ,
, 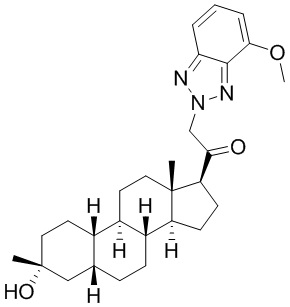 ,
,
 ,
,  ,
,
 ,
, 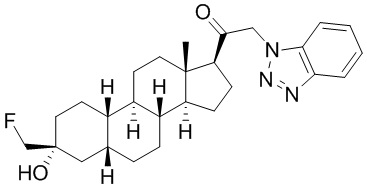 ,
,
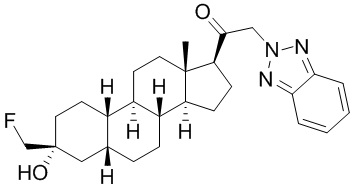 ,
,  ,
,
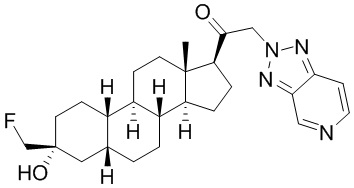 ,
, 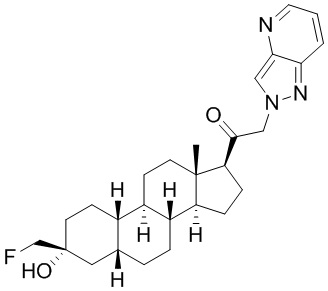 ,
,
 ,
, 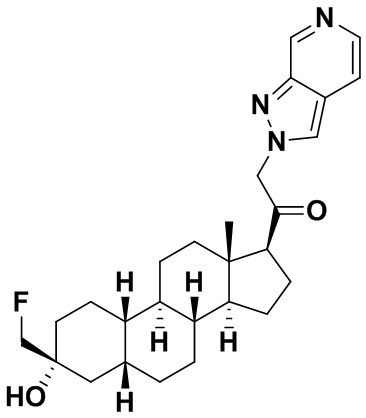 ,
,
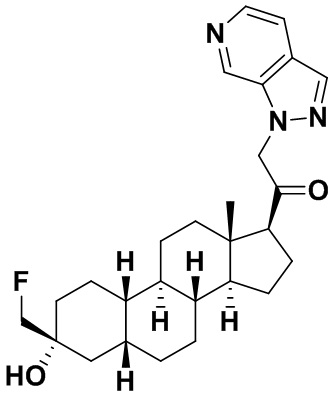 ,
,  ,
,
 ,
, 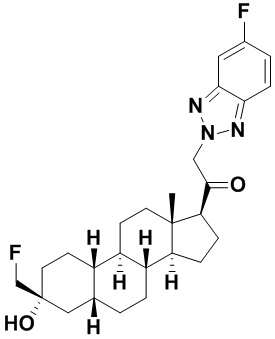 ,
,
 ,
, 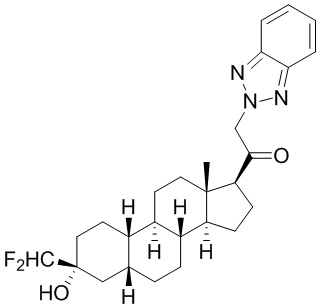 ,
,
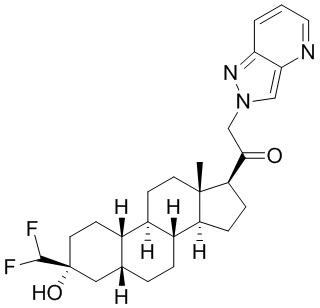 ,
,  ,
,
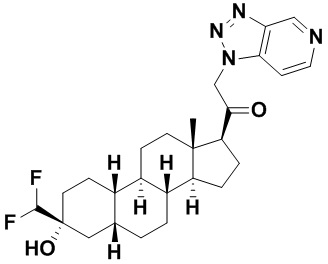 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
, 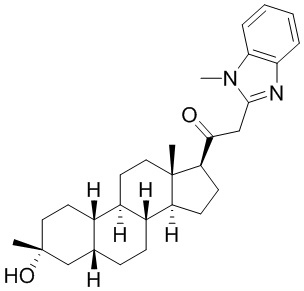 ,
,
 ,
,  ,
,
 ,
, 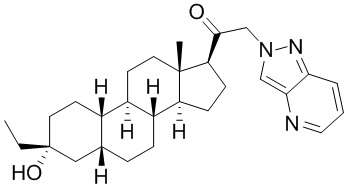 ,
,
 ,
, 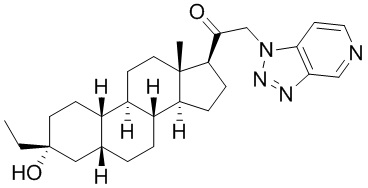 ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
, 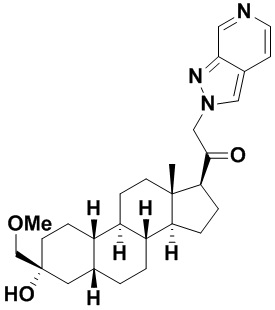 ,
,
 ,
,  ,
,
 ,
,  ,
,
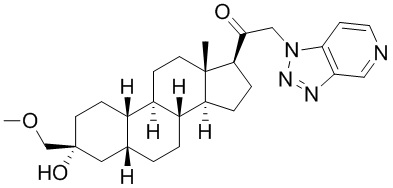 ,
,  ,
,
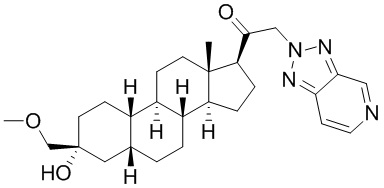 ,
,  ,
,
 ,
, 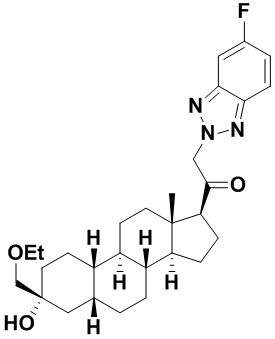 ,
,
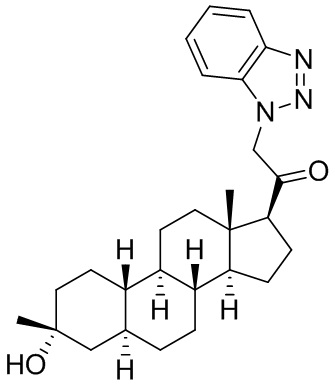 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
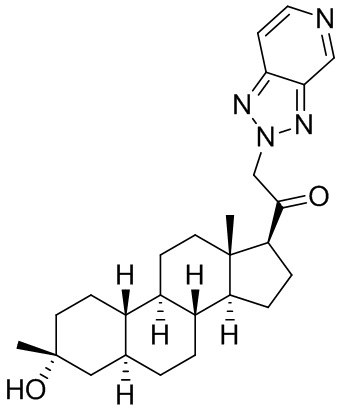 ,
,  ,
,
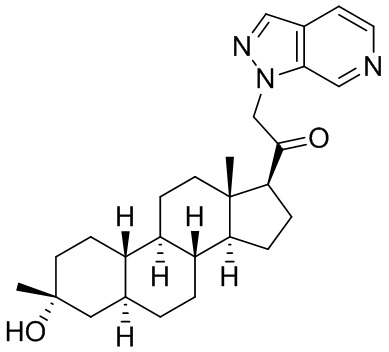 ,
, 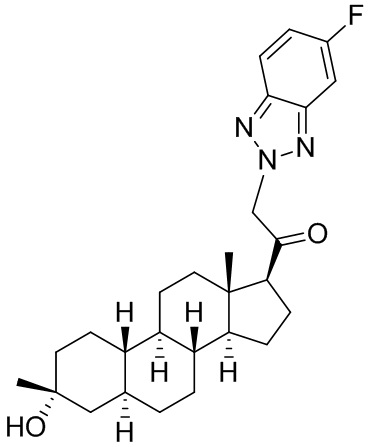 ,
,
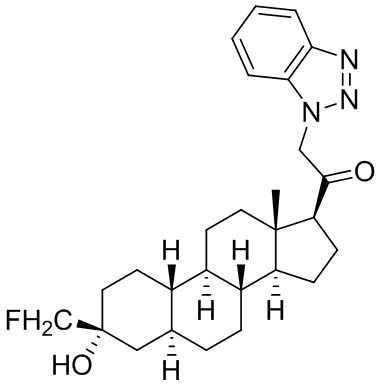 ,
, 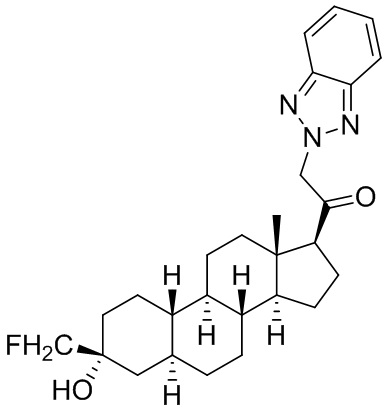 ,
,
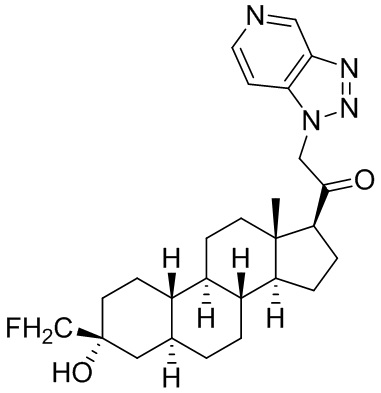 ,
, 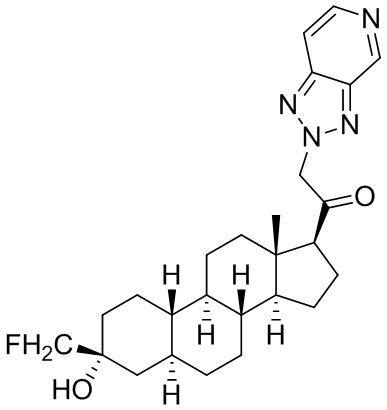 ,
,
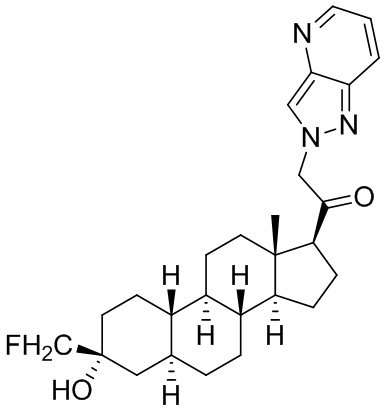 ,
,  ,
,
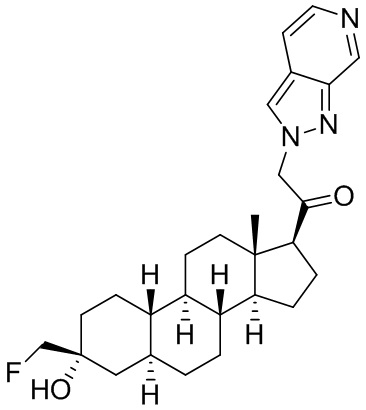 ,
,  ,
,
 ,
,  ,
,
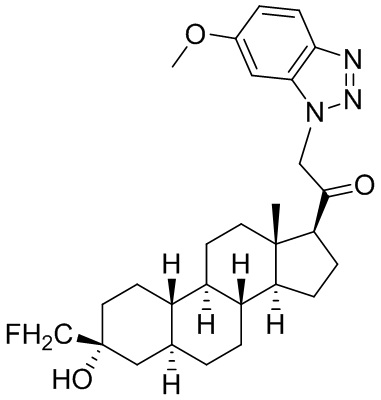 ,
, 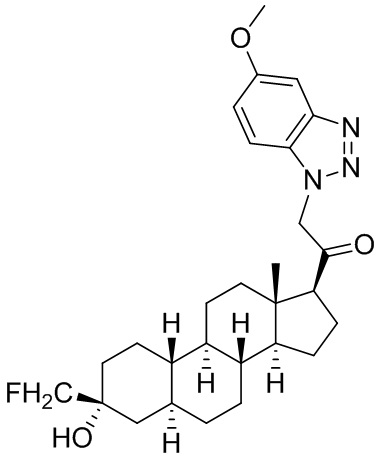 ,
,
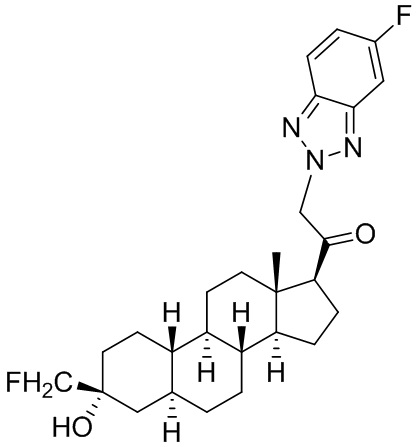 ,
,  ,
,
 ,
,  ,
,
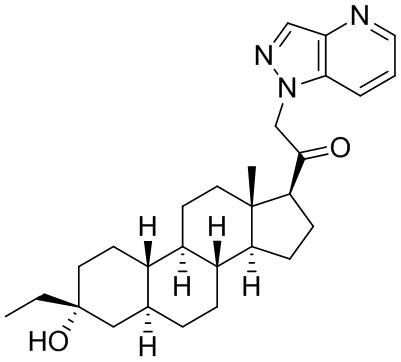 ,
, 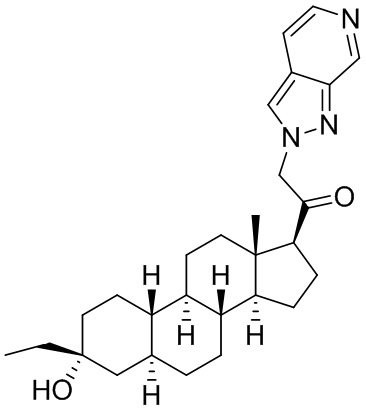 ,
,
 ,
,  ,
,
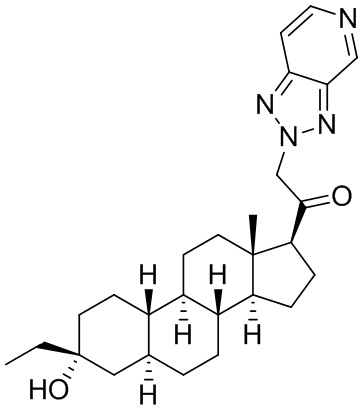 ,
, 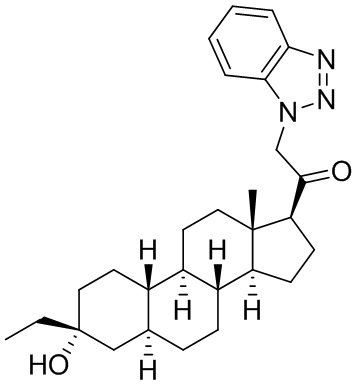 ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
, 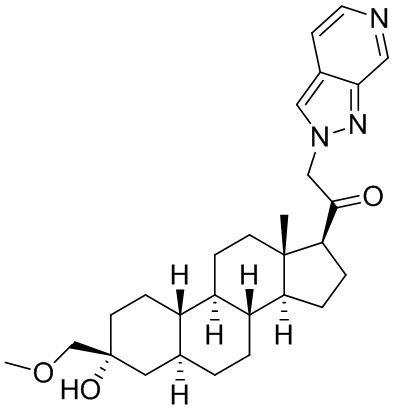 ,
,
 ,
,  ,
,
 ,
,  ,
,
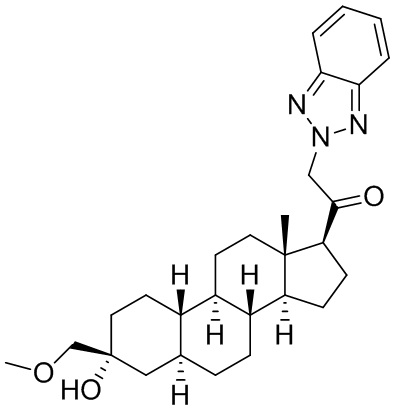 ,
, 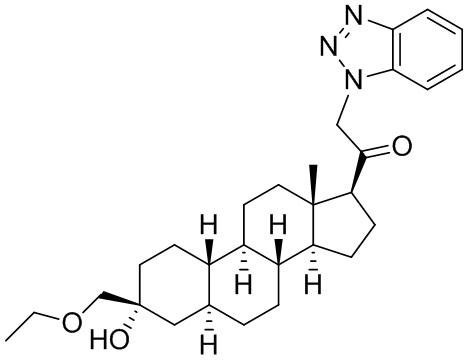 ,
,
 ,
, 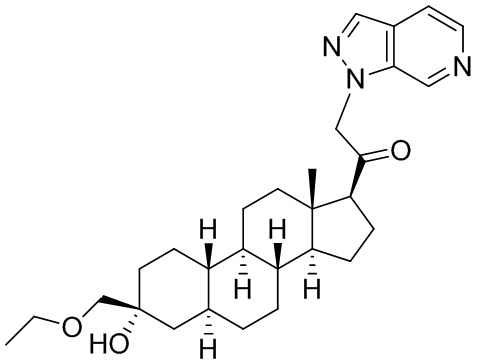 ,
,
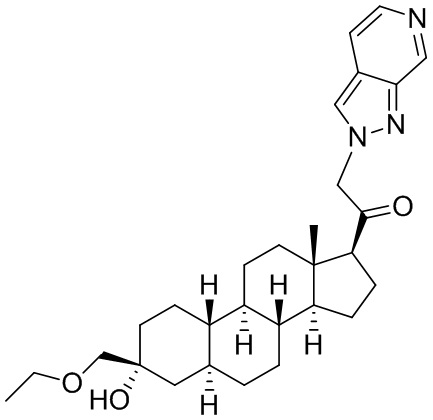 ,
,  ,
,
 и
и  .
.
16. Фармацевтически приемлемая соль соединения по п.1, где соединение выбрано из группы, состоящей из:
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
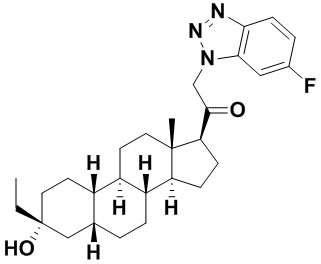 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  и
и  .
.
17. Фармацевтическая композиция, обладающая свойством ГАМК-модулятора, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из предшествующих пунктов или его фармацевтически приемлемой соли.
18. Соединение, выбранное из группы, состоящей из:
 ,
, 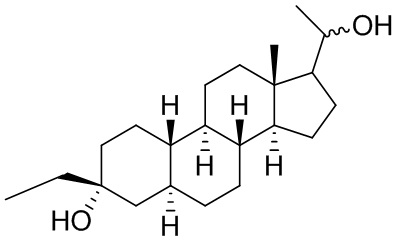 ,
, 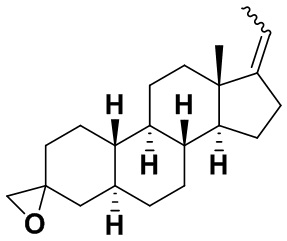 и
и 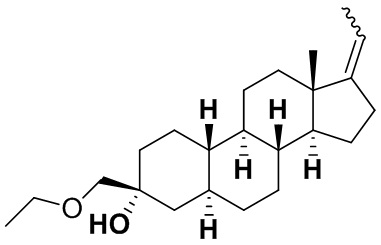 .
.
19. Фармацевтически приемлемая соль соединения, выбранного из группы, состоящей из:
 ,
,  ,
,  и
и  .
.
20. Соединение, выбранное из группы, состоящей из:
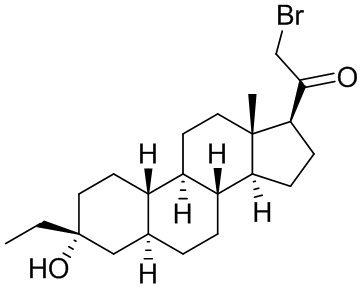 ,
,  и
и 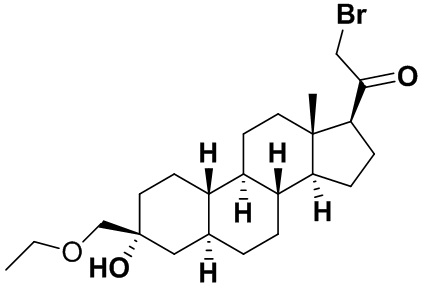 .
.
21. Фармацевтически приемлемая соль соединения, выбранного из группы, состоящей из:
 ,
,  и
и  .
.
| US 5939545 A, 17.08.1999 | |||
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РАЗЛИЧНЫХ НАРУШЕНИЙ, СПОСОБ ИНДУКЦИИ СНА И СПОСОБ ИНДУКЦИИ АНЕСТЕЗИИ С ИХ ИСПОЛЬЗОВАНИЕМ, СПОСОБ МОДУЛИРОВАНИЯ КОМПЛЕКСА РЕЦЕПТОР ГАМКa-ХЛОРИДНЫЙ ИОНОФОР | 1996 |
|
RU2194712C2 |
Авторы
Даты
2019-09-16—Публикация
2014-04-17—Подача