Родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 62/189,068, поданной 6 июля 2015 года, и 62/332,931, поданной 6 мая 2016 года, содержание каждой из которых полностью включено посредством отсылки.
Уровень техники
[0001] NMDA-рецепторы представляют собой гетеромерные комплексы, состоящие из субъединиц NR1, NR2 и/или NR3 и обладающие различными сайтами узнавания экзогенных и эндогенных лигандов. Такие сайты узнавания включают сайты связывания глицина, а также глутаматных агонистов и модуляторов. NMDA-рецепторы экспрессируются в периферических тканях и центральной нервной системе, где они участвуют в возбуждающей синаптической передаче. Активация указанных рецепторов вносит вклад в синаптическую пластичность при некоторых обстоятельствах и в эксайтотоксичность при других. Эти рецепторы являются лигандзависимыми ионными каналами, которые пропускают Ca2+ после связывания глутамата и глицина, и играют фундаментальную роль в возбуждающей нейротрансмиссии и нормальной функции ЦНС. Положительные модуляторы могут быть полезными в качестве терапевтических средств с потенциальным клиническим применением в качестве усилителей когнитивной функции и при лечении психических расстройств, при которых глутаматергическая передача снижена или нарушена (см., например, Horak et al., J. of Neuroscience, 2004, 24(46), 10318-10325). В то же время, отрицательные модуляторы могут быть полезными в качестве терапевтических средств с потенциальным клиническим применением при лечении психических расстройств, при которых глутаматергическая передача патологически повышена (например, терапевтически резистентная депрессия).
[0002] Оксистеролы (или оксистерины) являются производными холестерина и, как было показано, мощно и селективно модулируют функцию NMDA-рецепторов. Необходимы новые и улучшенные оксистеролы, которые модулируют NMDA-рецептор, для профилактики и лечения состояний, связанных с экспрессией и функцией NMDA. Соединения, композиции и способы, описанные в настоящей заявке, направлены на это.
Сущность изобретения
[0003] В настоящей заявке предложены замещенные оксистеролы, которые могут применяться для предотвращения и/или лечения целого ряда нарушений, в том числе, без ограничения, NMDA-опосредованных нарушений. Такие соединения, как ожидают, будут показывать улучшенную активность in vivo, фармакокинетические свойства (ФК), биодоступность при приеме внутрь, легкость включения в лекарственные формы, стабильность и/или безопасность по сравнению с другими оксистеролами. Также предложены фармацевтические композиции, включающие соединения настоящего изобретения, а также способы их применения и способы лечения.
[0004] В одном аспекте, в настоящей заявке предложены соединения согласно Формуле (I):
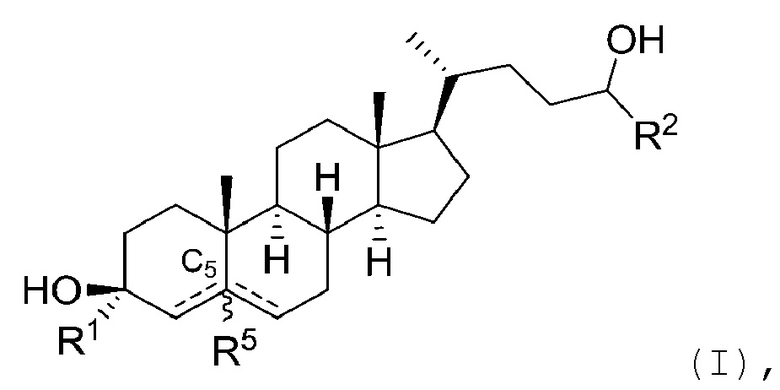
или их фармацевтически приемлемая соль, где: R1 является водородом или C1-6 алкилом; R2 является C1-6 алкилом, карбоциклилом или гетероциклилом; R5 отсутствует или является водородом; и  представляет собой одинарную или двойную связь, где в том случае, когда одна
представляет собой одинарную или двойную связь, где в том случае, когда одна  является двойной связью, другая
является двойной связью, другая  является одинарной связью, и R5 отсутствует.
является одинарной связью, и R5 отсутствует.
В некоторых вариантах осуществления R1 является водородом.
В некоторых вариантах осуществления R1 является C1-6 алкилом. В некоторых вариантах осуществления R1 является замещенным C1-6 алкилом. В некоторых вариантах осуществления R1 является незамещенным C1-6 алкилом. В некоторых вариантах осуществления R1 является метилом (например, -CH3, -CF3 или -CH2OCH3), этилом или изопропилом. В некоторых вариантах осуществления R1 является метилом (например, -CH3) или этилом (например, -CH2CH3).
В некоторых вариантах осуществления R2 является C1-6 алкилом или карбоциклилом. В некоторых вариантах осуществления R2 является замещенным C1-6 алкилом. В некоторых вариантах осуществления R2 является незамещенным C1-6 алкилом. В некоторых вариантах осуществления R2 является C1-4 алкилом. В некоторых вариантах осуществления R2 является замещенным C1-4 алкилом. В некоторых вариантах осуществления R2 является незамещенным C1-4 алкилом. В некоторых вариантах осуществления R2 является C1-3 алкилом. В некоторых вариантах осуществления R2 является замещенным C1-3 алкилом. В некоторых вариантах осуществления R2 является незамещенным C1-3 алкилом. В некоторых вариантах осуществления R2 является метилом, этилом (например, -CH2CH3, -CH2CF3, -CH(CH3)(CF3)), изопропилом, трет-бутилом или циклопропилом. В некоторых вариантах осуществления R2 является галогеналкилом. В некоторых вариантах осуществления R2 представляет собой -CH2CF3 или -CH(CH3)(CF3).
В некоторых вариантах осуществления R1 и R2 являются C1-6 алкилом. В некоторых вариантах осуществления R1 является C1-6 алкилом, и R2 является C1-6 алкилом, карбоциклилом или гетероциклилом. В некоторых вариантах осуществления R1 является метилом или этилом, и R2 является незамещенным или замещенным C1-6 алкилом (например, галогеналкилом). В некоторых вариантах осуществления R1 является метилом или этилом, и R2 является карбоциклилом или гетероциклилом.
В некоторых вариантах осуществления  представляет собой одинарную связь.
представляет собой одинарную связь.
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (I-A) или Формулы (I-B):
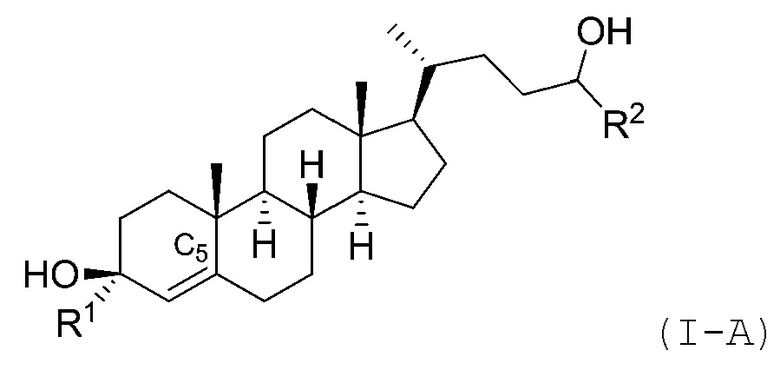 или
или 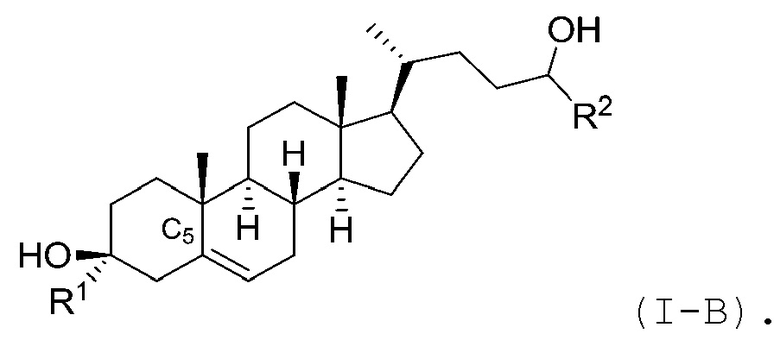
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (I-B-i) или Формулы (I-B-ii):
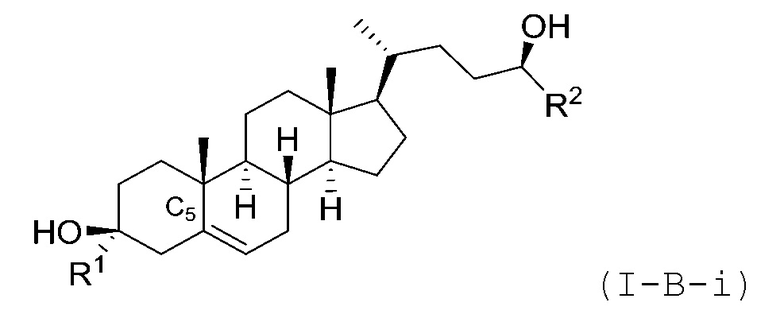 или
или 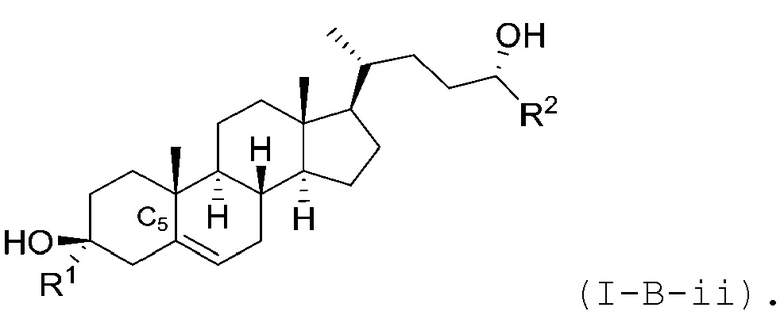
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (I-C):
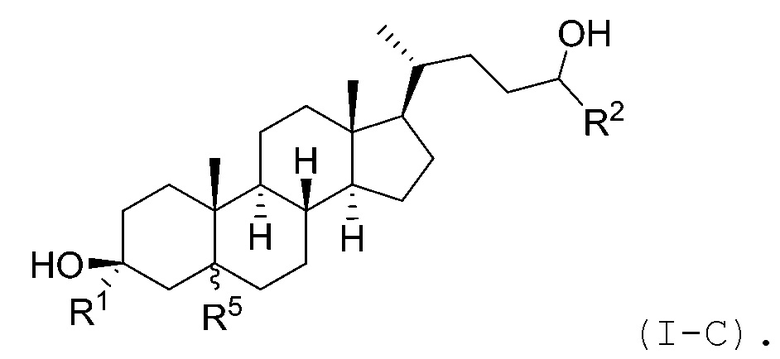
В некоторых вариантах осуществления соединение Формулы (I-C) является соединением Формулы (I-C-i) или (I-C-ii):
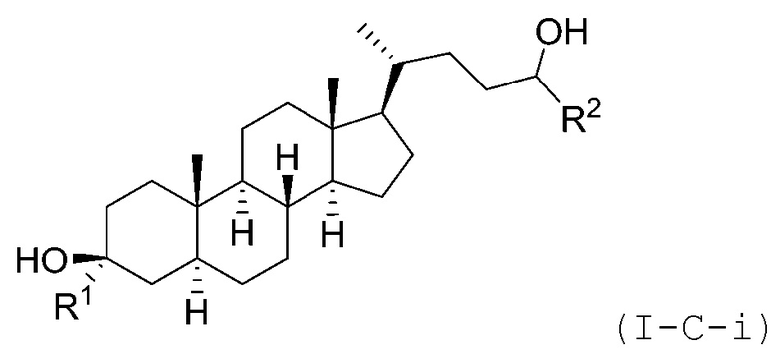 или
или 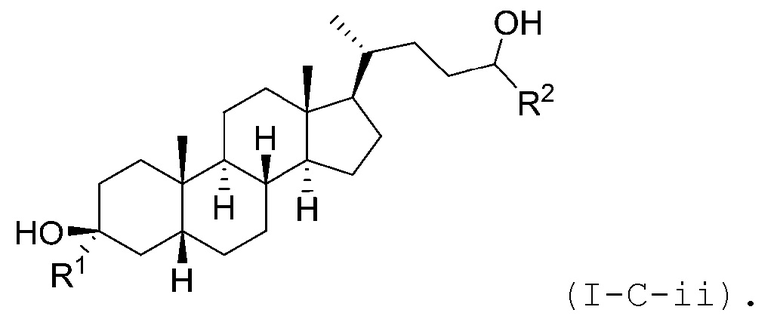
В некоторых вариантах осуществления соединение Формулы (I-C-i) является соединением Формулы (I-C-i-a) или (I-C-i-b):
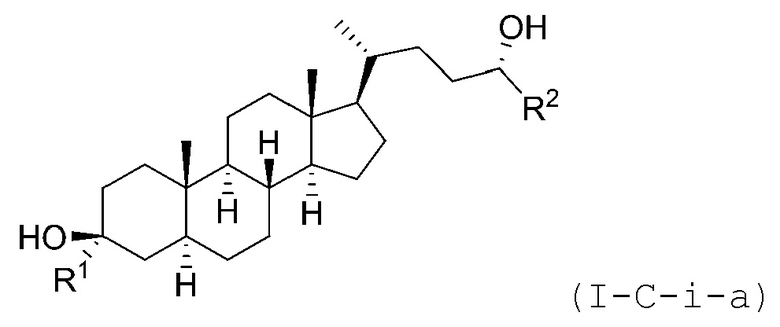 или
или 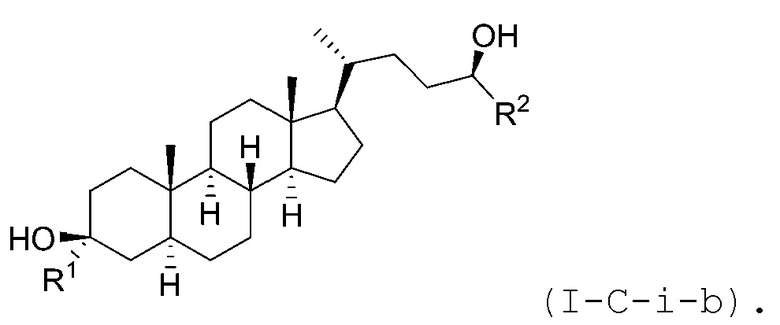
В некоторых вариантах осуществления соединение Формулы (I-C-ii) является соединением Формулы (I-C-ii-a) или (I-C-ii-b):
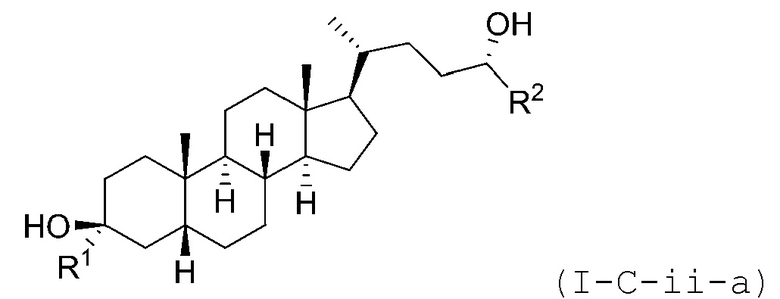 или
или 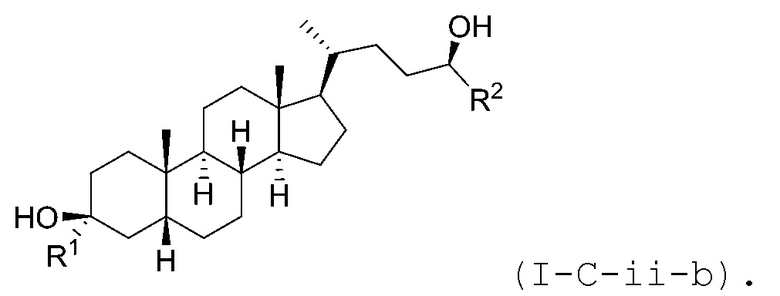
В некоторых вариантах осуществления R2 является C1-6 алкилом. В некоторых вариантах осуществления R2 является замещенным C1-6 алкилом. В некоторых вариантах осуществления R2 является C1-6 галогеналкилом.
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (II):
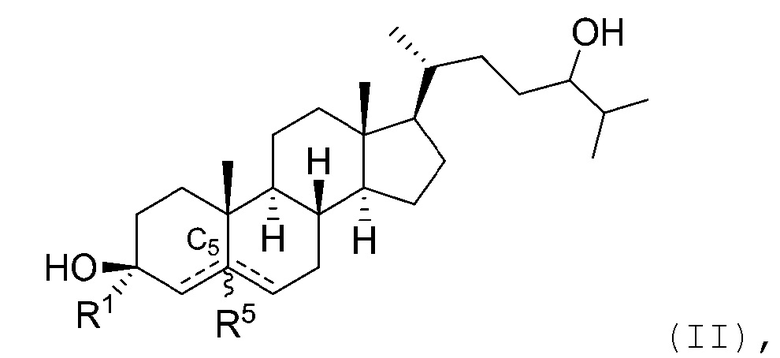
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (II) является соединением Формулы (II-A) или Формулы (II-B):
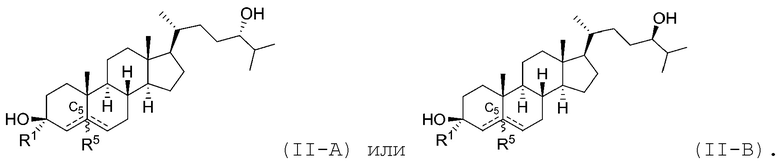
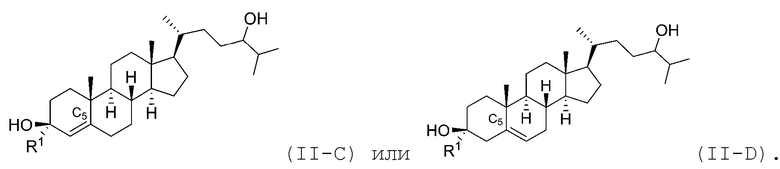
В некоторых вариантах осуществления соединение Формулы (II) является соединением Формулы (II-C) или Формулы (II-D):
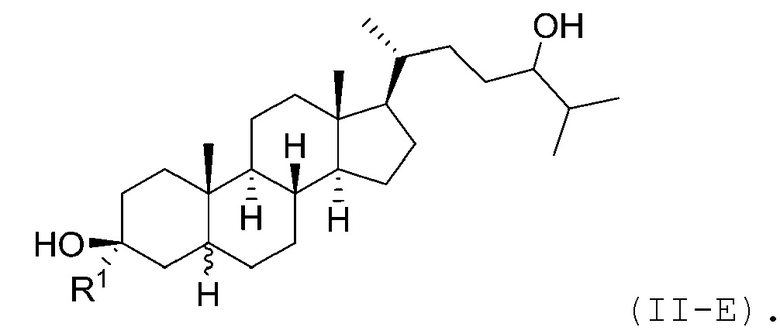
В некоторых вариантах осуществления соединение Формулы (II) является соединением Формулы (II-E):
В некоторых вариантах осуществления соединение Формулы (II-E) является соединением Формулы (II-E-i) или Формулы (II-E-ii):
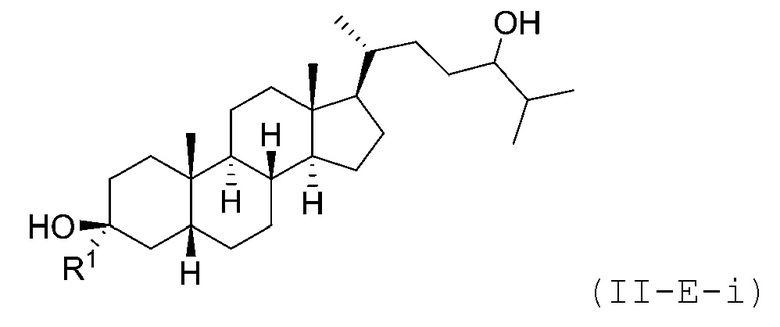 или
или 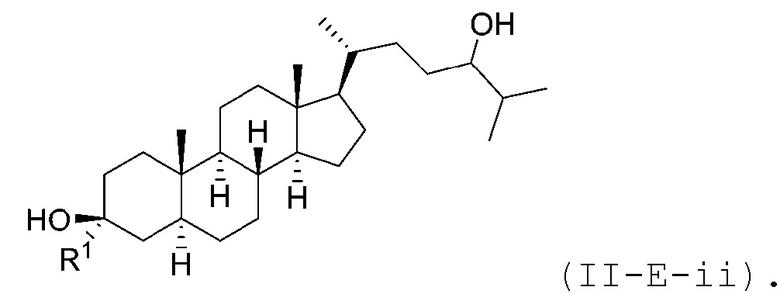
В некоторых вариантах осуществления соединение Формулы (II-E-i) является соединением Формулы (II-E-i-a) или Формулы (II-E-i-b):
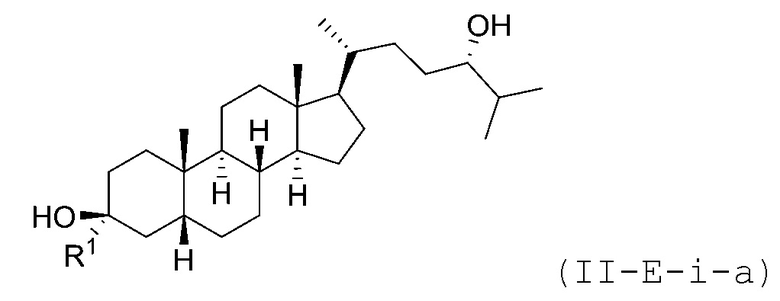 или
или 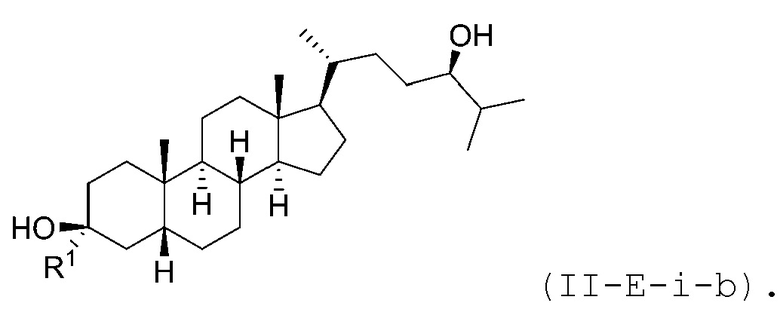
В некоторых вариантах осуществления соединение Формулы (II-E-ii) является соединением Формулы (II-E-ii-a) или Формулы (II-E-ii-b):
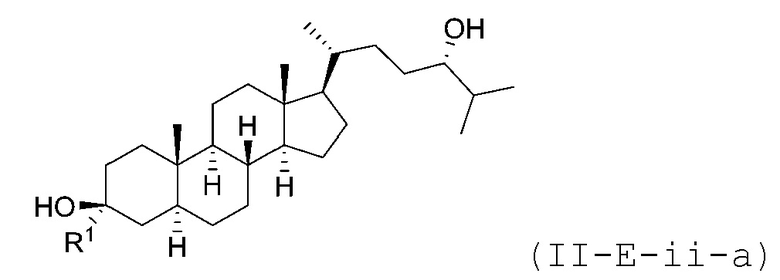 или
или 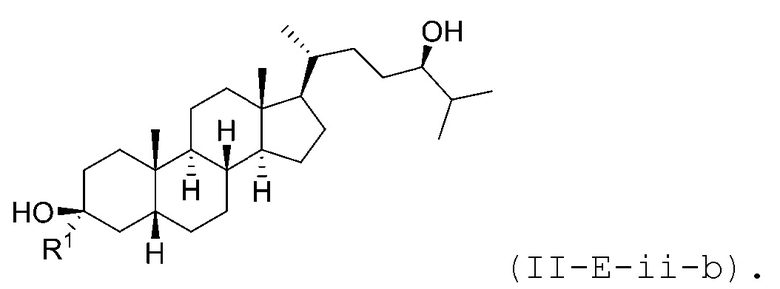
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (VII):
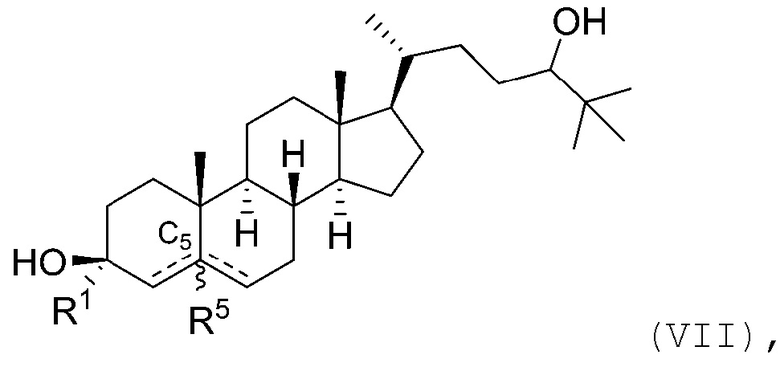
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (VII) является соединением Формулы (VII-A) или Формулы (VII-B):
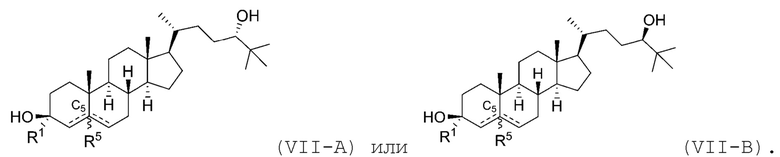
В некоторых вариантах осуществления соединение Формулы (VII) является соединением Формулы (VII-C) или Формулы (VII-D):
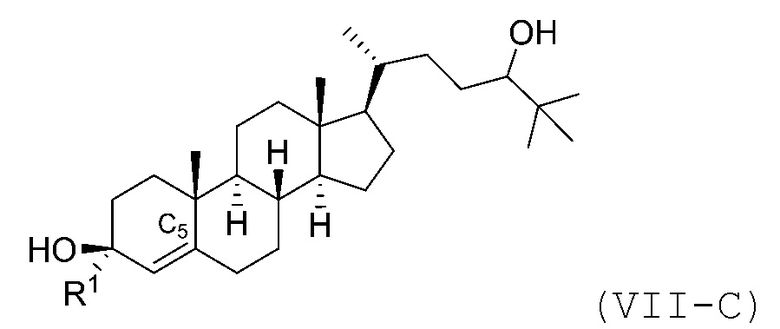 или
или 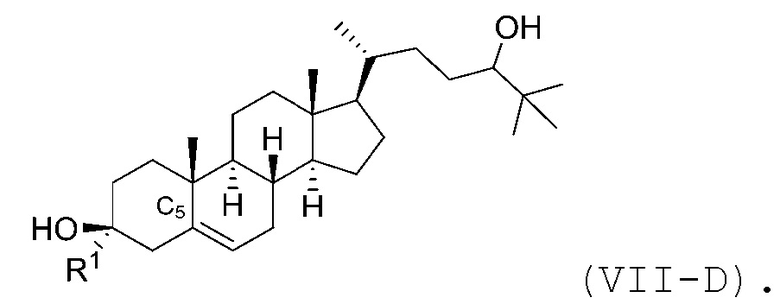
В некоторых вариантах осуществления соединение Формулы (VII) является соединением Формулы (VII-E):
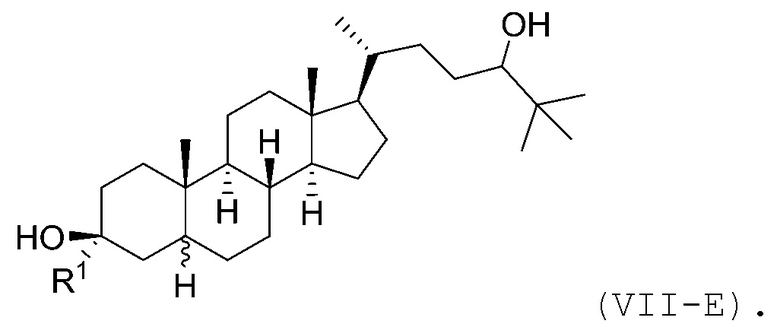
В некоторых вариантах осуществления соединение Формулы (VII-E) является соединением Формулы (VII-E-i) или Формулы (VII-E-ii):
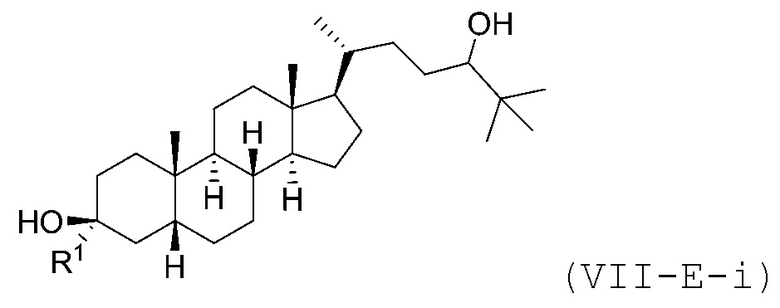 или
или 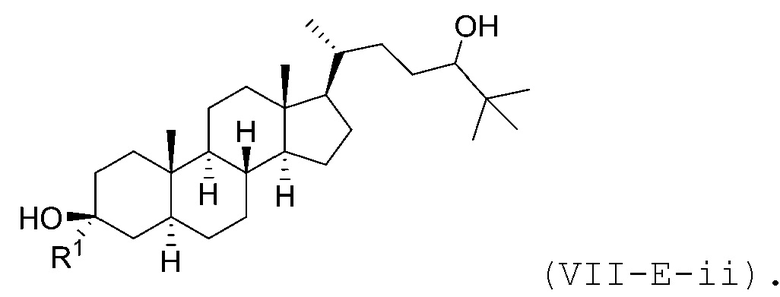
В некоторых вариантах осуществления соединение Формулы (VII-E-i) является соединением Формулы (VII-E-i-a) или Формулы (VII-E-i-b):
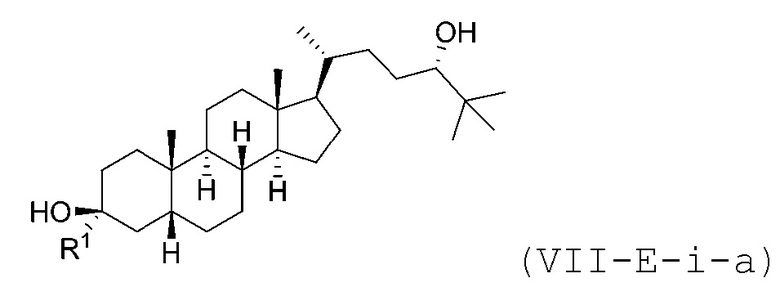 или
или 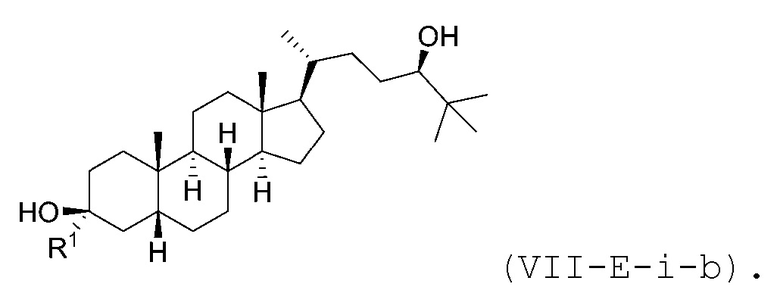 .
.
В некоторых вариантах осуществления соединение Формулы (VII-E-ii) является соединением Формулы (VII-E-ii-a) или Формулы (VII-E-ii-b):
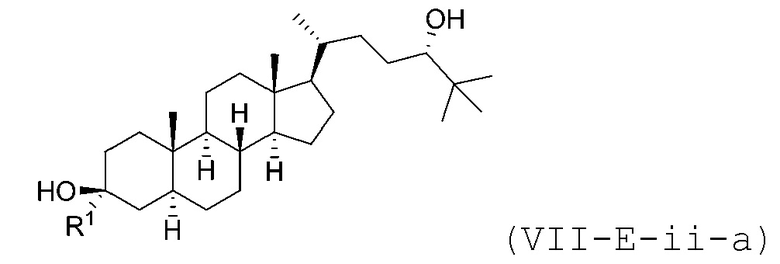 или
или 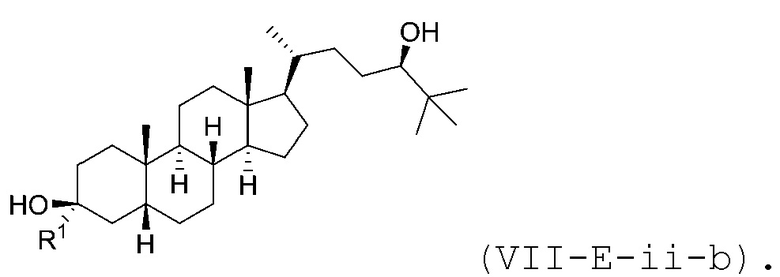
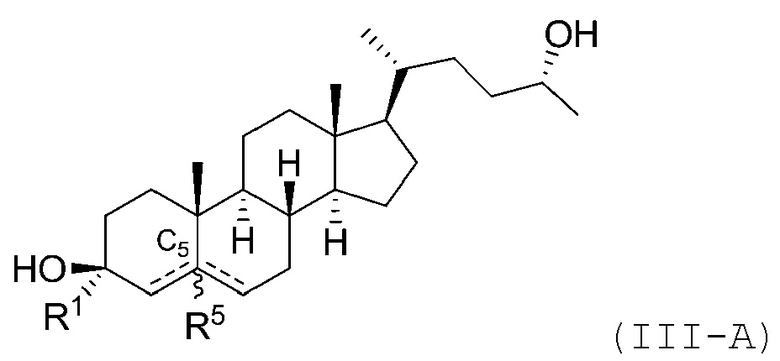
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (III):
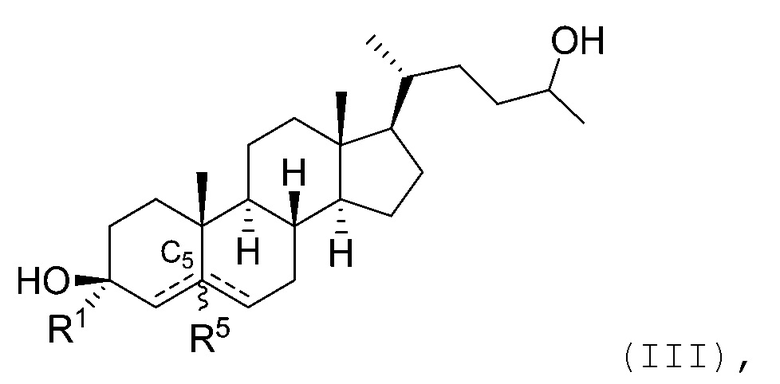
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (III) является соединением Формулы (III-A) или Формулы (III-B):
 или
или 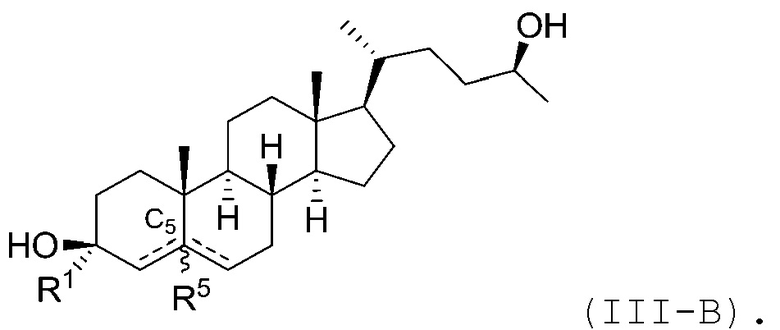
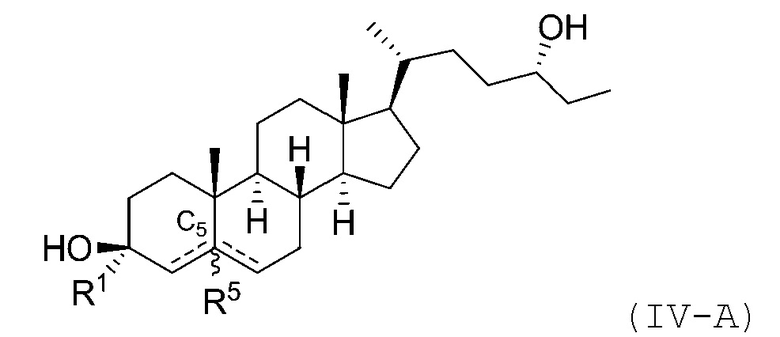
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (IV):
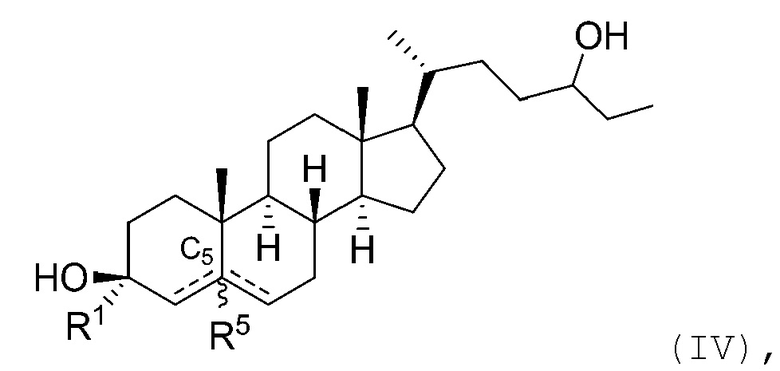
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (IV) является соединением Формулы (IV-A) или Формулы (IV-B):
 или
или 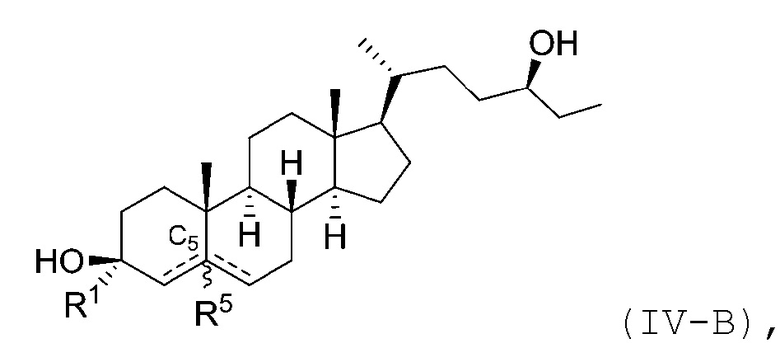
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления R2 является карбоциклилом или гетероциклилом. В некоторых вариантах осуществления R2 является карбоциклилом (например, циклопропилом, циклобутилом, циклопентилом, циклогексилом).
В некоторых вариантах осуществления R2 является гетероциклилом. В некоторых вариантах осуществления R2 является кислородсодержащим гетероциклом (например, тетрагидропираном).
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (V):
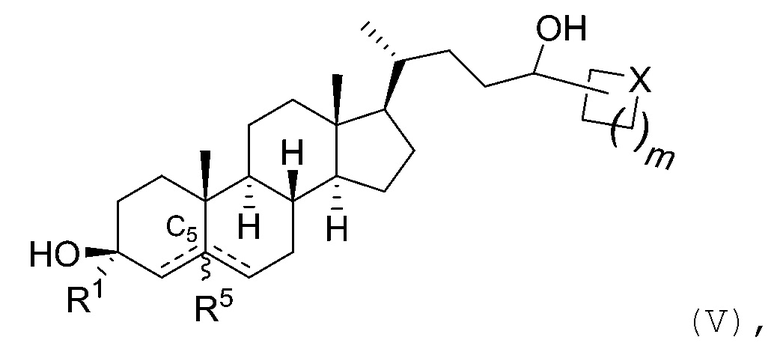
или его фармацевтически приемлемой солью, где X представляет собой -CH2-, -O-, -S- или -NRA-, и m является целым числом, выбранным из 0, 1, 2, 3, 4 или 5; где RA является водородом, алкилом, -C(O)RC, -C(O)N(RC)2 или -SO2N(RC)2; и каждый RC независимо является водородом, алкилом, арилом или гетероарилом. В некоторых вариантах осуществления X представляет собой -CH2-, -O-, -S- или -NH-.
В некоторых вариантах осуществления соединение Формулы (V) является соединением Формулы (V-A-i) или Формулы (V-A-ii):
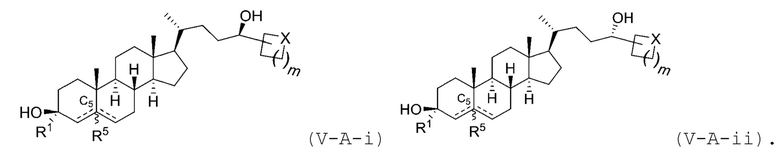
В некоторых вариантах осуществления соединение Формулы (V) является соединением Формулы (V-B):
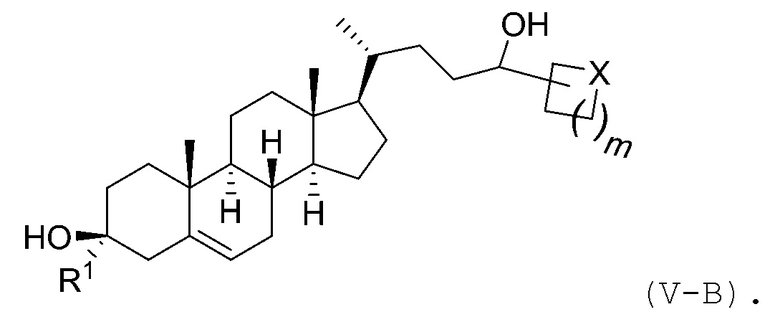
В некоторых вариантах осуществления X представляет собой -CH2-.
В некоторых вариантах осуществления X представляет собой -O-.
В некоторых вариантах осуществления m представляет собой 0, 1, 2 или 3.
В некоторых вариантах осуществления соединение Формулы (V) является соединением Формулы (V-B-i):
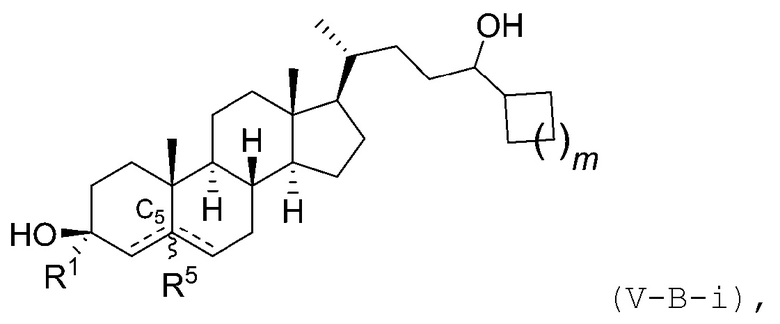
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (V) является соединением Формулы (V-C):
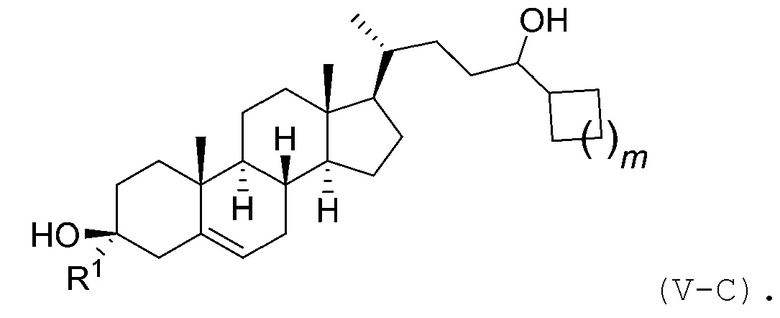
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (VI):
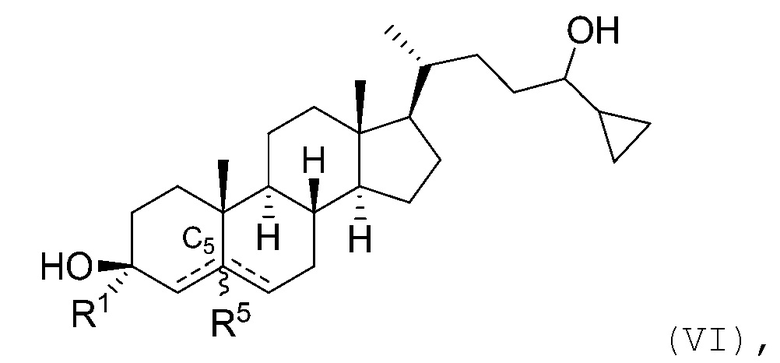
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (VI-A) или Формулы (VI-B):
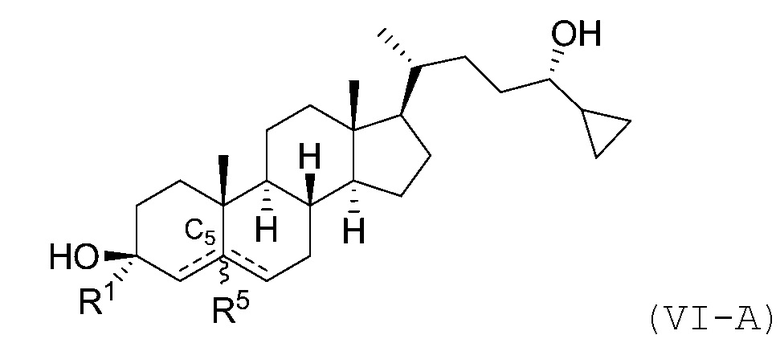 или
или 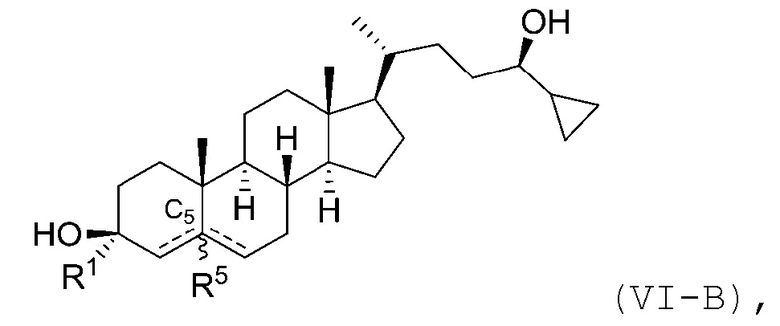
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления R1 является C1-6 алкилом. В некоторых вариантах осуществления R1 является метилом (например, -CH3, -CF3 или -CH2OCH3), этилом или изопропилом. В некоторых вариантах осуществления R1 является метилом, этилом или изопропилом. В некоторых вариантах осуществления R1 является метилом (например, -CH3). В некоторых вариантах осуществления R1 является этилом (например, -CH2CH3).
В некоторых вариантах осуществления соединение Формулы (I) выбрано из:
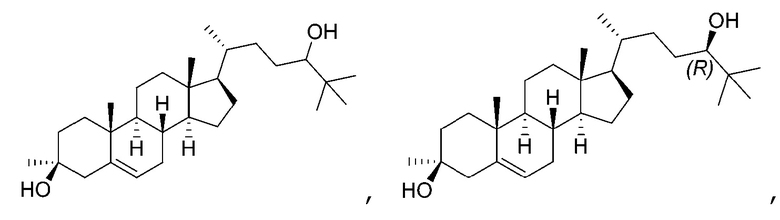
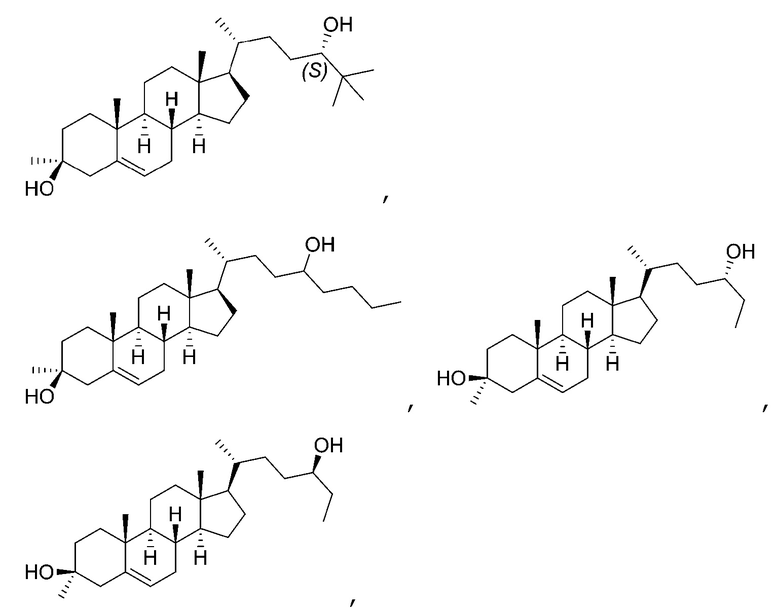
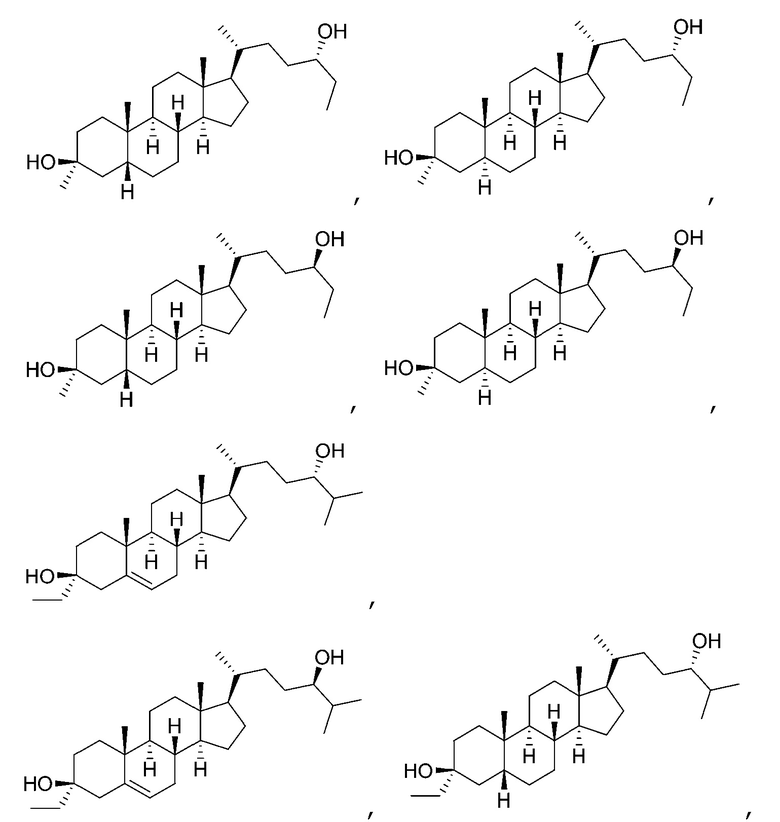
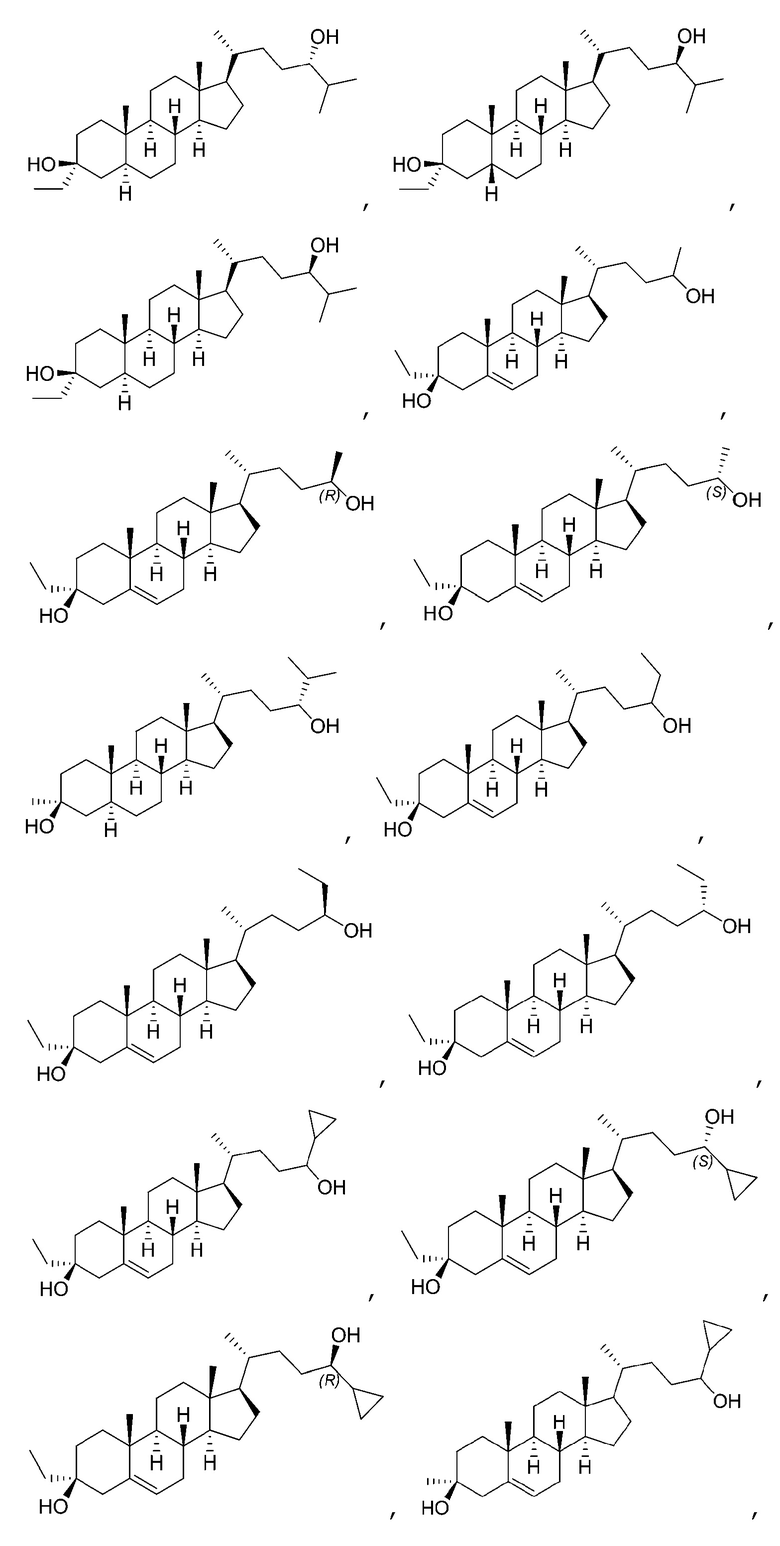
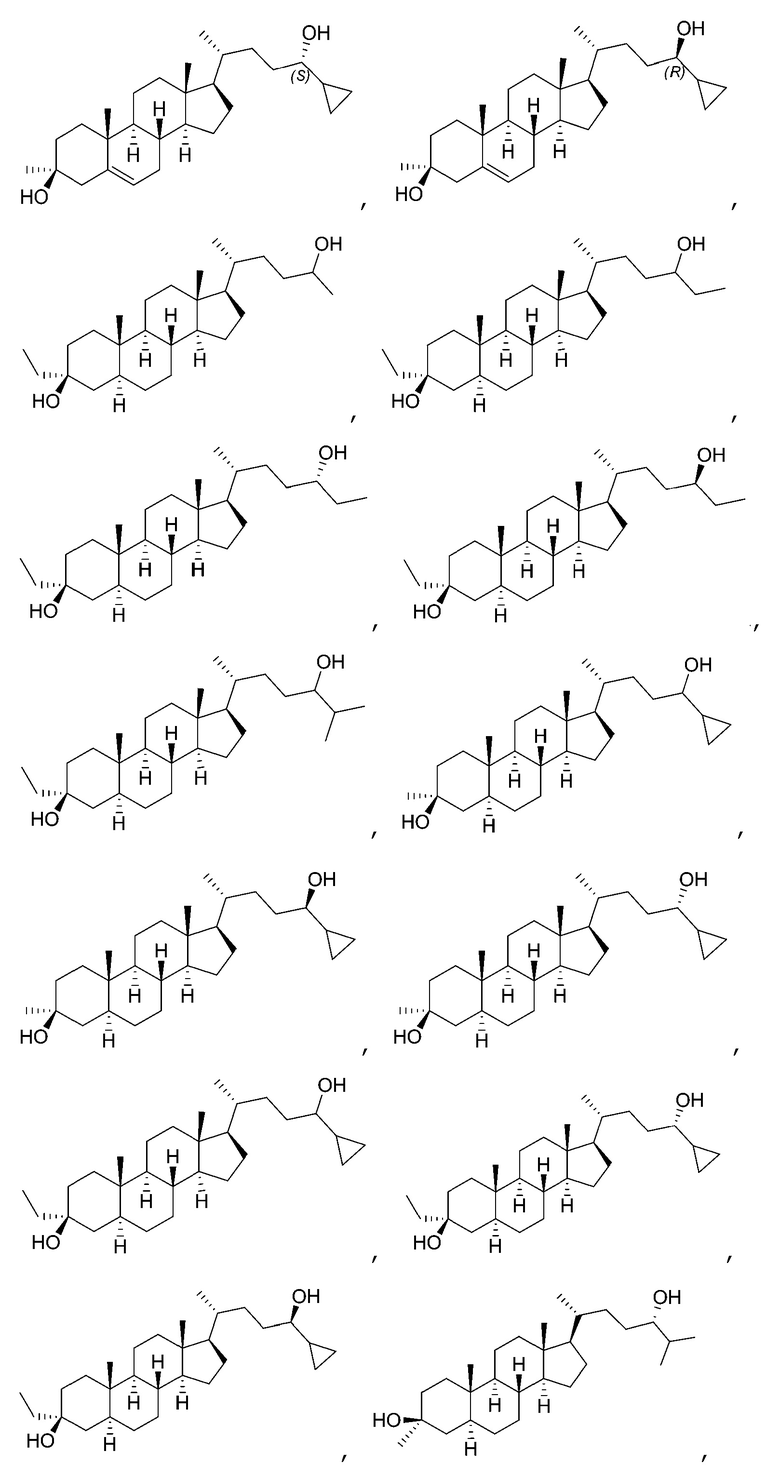
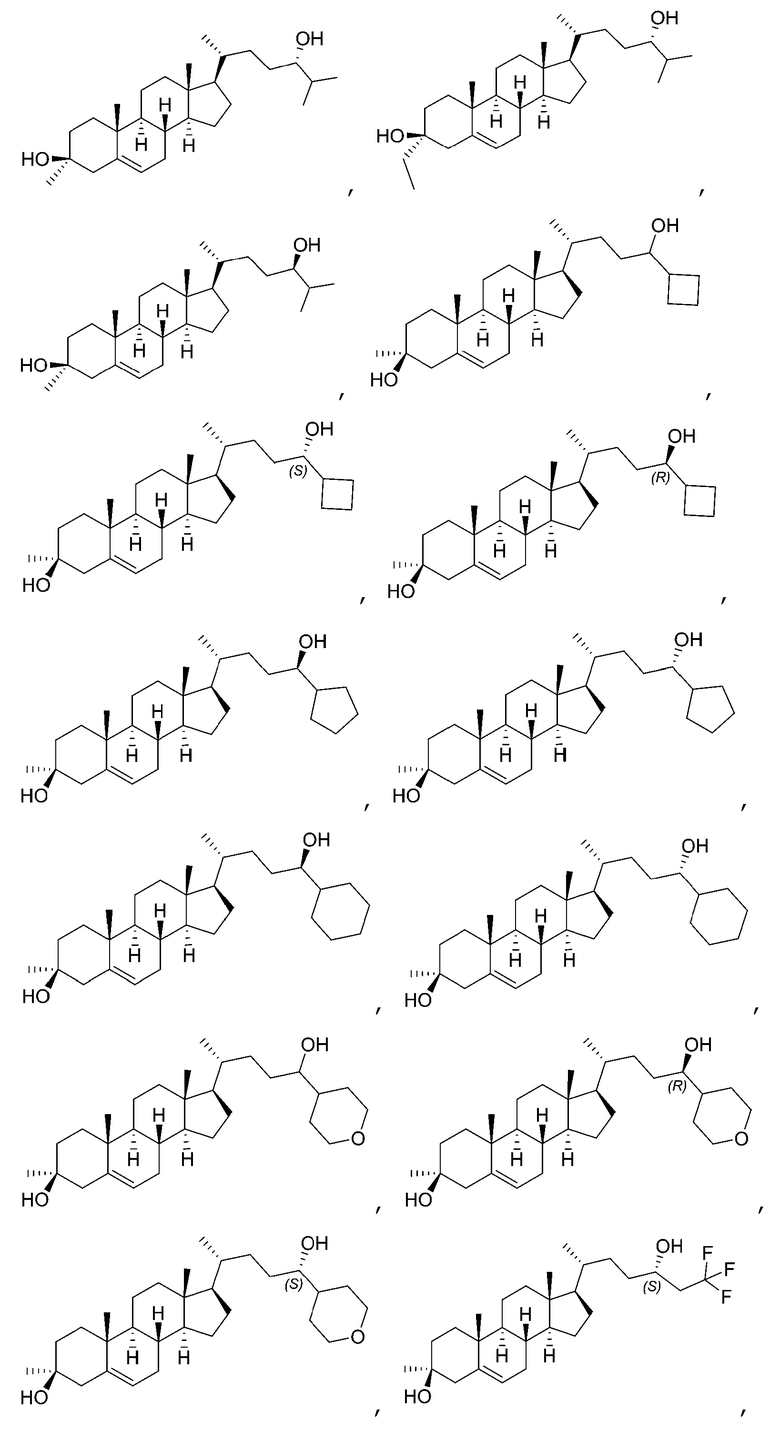
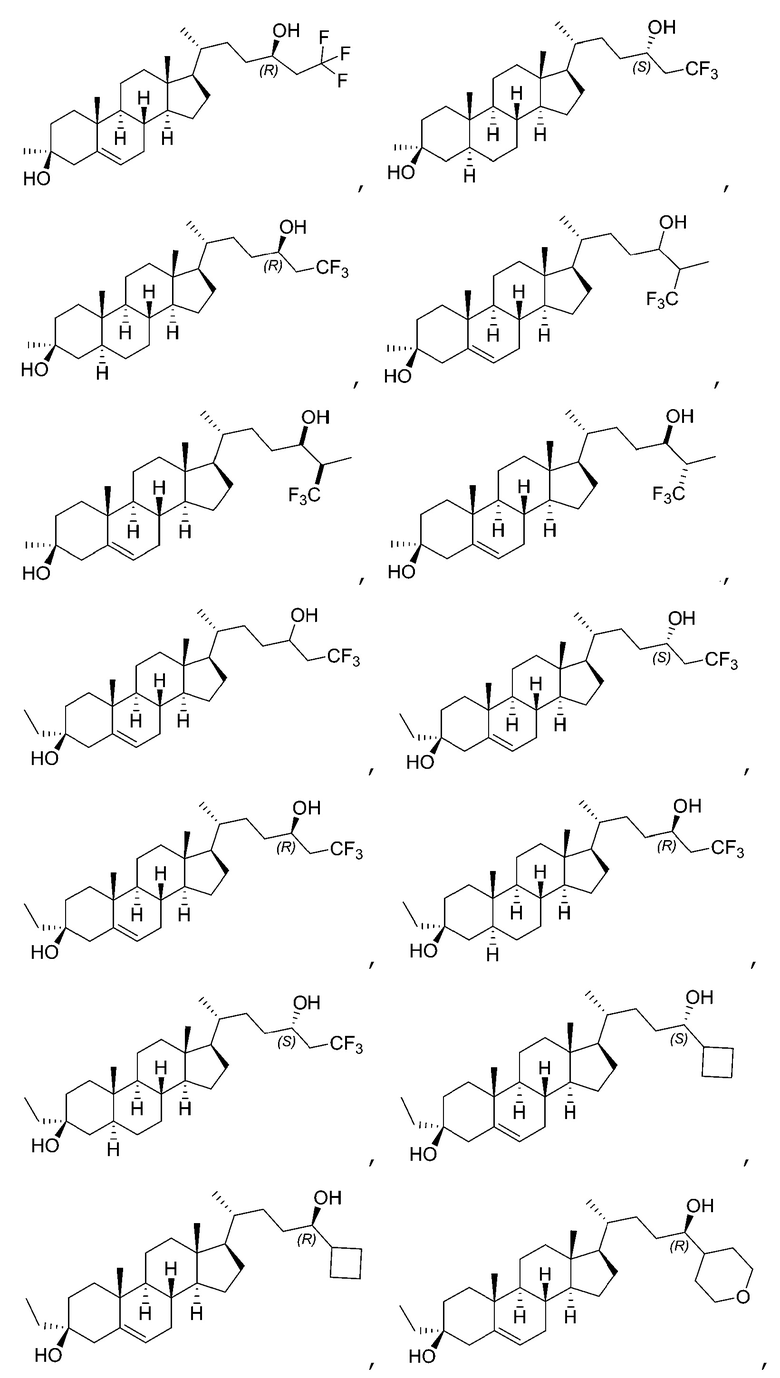
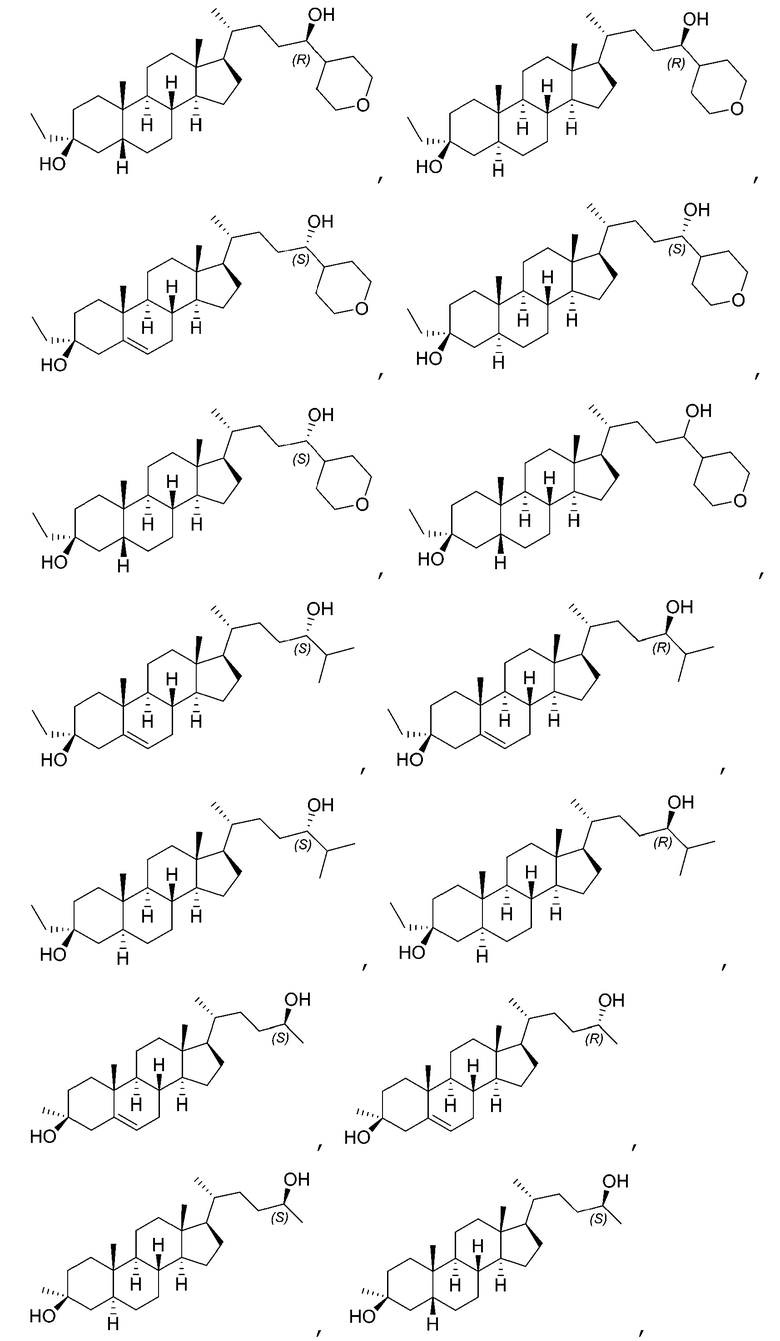
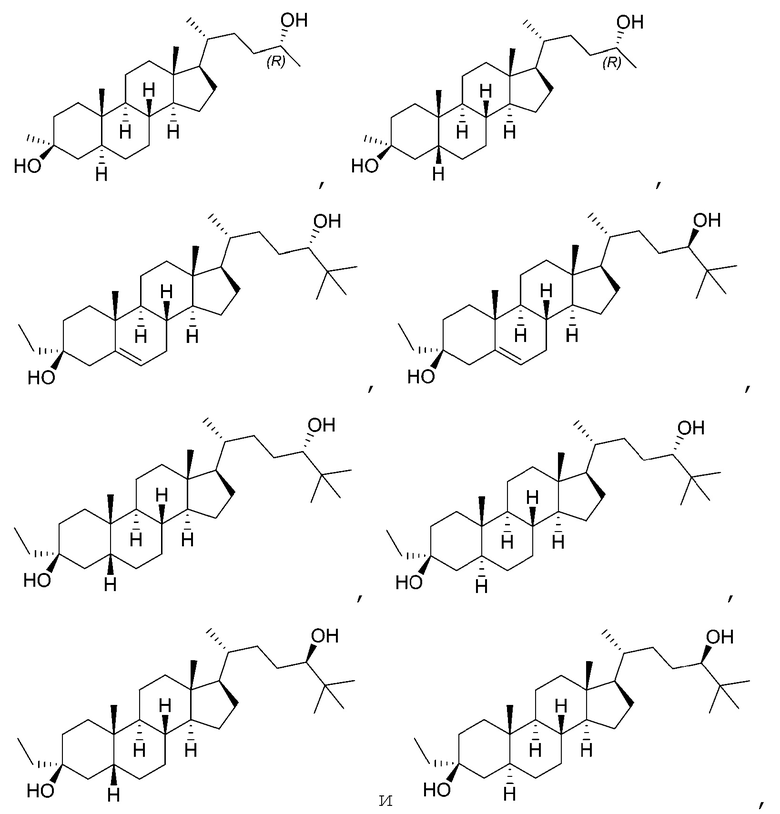
или их фармацевтически приемлемой соли.
[0005] В одном аспекте предложена фармацевтическая композиция, включающая соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемую соль), и фармацевтически приемлемый носитель.
[0006] В одном аспекте предложен способ индукции седативного эффекта или анестезии, включающий введение субъекту эффективного количества соединения, описанного в настоящей заявке (например, соединения Формулы (I) или его фармацевтически приемлемой соли), или его фармацевтической композиции.
[0007] В одном аспекте предложен способ лечения или предотвращения нарушения, описанного в настоящей заявке, включающий введение нуждающемуся в этом субъекту эффективного количества соединения, описанного в настоящей заявке (например, соединения Формулы (I) или его фармацевтически приемлемой соли), или его фармацевтической композиции.
[0008] В некоторых вариантах осуществления нарушением является нарушение со стороны желудочно-кишечного тракта (ЖКТ), например, запор, синдром раздраженного кишечника (СРК), воспалительное заболевание кишечника (ВЗК) (например, неспецифический язвенный колит, болезнь Крона), структурные нарушения, влияющие на ЖКТ, нарушения в анальной области (например, геморрой, внутренний геморрой, наружный геморрой, анальные трещины, перианальные абсцессы, анальный свищ), полипы толстой кишки, рак, колит.
[0009] В некоторых вариантах осуществления нарушением является воспалительное заболевание кишечника.
[0010] В некоторых вариантах осуществления нарушением является рак, диабет или нарушение синтеза стеринов.
[0011] В одном аспекте предложен способ лечения или предотвращения связанного с ЦНС состояния, включающий введение нуждающемуся в этом субъекту эффективного количества соединения, описанного в настоящей заявке (например, соединения Формулы (I) или его фармацевтически приемлемой соли), или его фармацевтической композиции. В некоторых вариантах осуществления связанным с ЦНС состоянием является расстройство адаптации, тревожное расстройство (в том числе обсессивно-компульсивное расстройство, посттравматическое стрессовое расстройство и социальная фобия), когнитивное расстройство (в том числе болезнь Альцгеймера и другие формы деменции), диссоциативное расстройство, расстройство питания, расстройство настроения (в том числе депрессия (например, послеродовая депрессия), биполярное расстройство, дистимическое расстройство, суицидальные проявления), шизофрения или другое психотическое расстройство (в том числе шизоаффективное расстройство), нарушения сна (в том числе бессонница), расстройство, связанное с употреблением психоактивных веществ, расстройство личности (в том числе обсессивно-компульсивное расстройство личности), расстройства аутистического спектра (в том числе связанные с мутациями в группе белков Shank (например, Shank3)), нарушения нервно-психического развития (в том числе синдром Ретта, комплекс туберозного склероза), рассеянный склероз, нарушения синтеза стеринов, боль (в том числе острая и хроническая боль), энцефалопатия, обусловленная состоянием здоровья (в том числе печеночная энцефалопатия и анти-NMDA-рецепторный энцефалит), эпилептическое расстройство (в том числе эпилептический статус и моногенные формы эпилепсии, такие как синдром Драве), инсульт, травматическое повреждение головного мозга, двигательное расстройство (в том числе болезнь Хантингтона и болезнь Паркинсона), нарушение зрения, потеря слуха и тиннитус.
[0012] В некоторых вариантах осуществления нарушением является нарушение синтеза стеринов.
[0013] Другие объекты и преимущества станут очевидными для специалистов в данной области при рассмотрении следующего Подробного описания, Примеров и Формулы изобретения.
Определения
Химические определения
[0014] Определения специфических функциональных групп и химических терминов более подробно описаны ниже. Химические элементы определены в соответствии с Периодической таблицей элементов Д.И. Менделеева, версии CAS, Handbook of Chemistry and Physics, 75th Ed., под обложкой, и специфические функциональные группы определены в общем, как описано там. Кроме того, общие принципы органической химии, а также специфические функциональные группы и реакционноспособность описаны в Thomas Sorrell, Organic Chemistry, University Science Books, Sausalito, 1999; Smith and March, March's Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; и Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
[0015] Соединения, описанные в настоящей заявке, могут включать один или более центров асимметрии и, таким образом, могут существовать в различных изомерных формах, например, энантиомерах и/или диастереомерах. Например, соединения, описанные в настоящей заявке, могут находиться в форме отдельного энантиомера, диастереомера или геометрического изомера, или могут находиться в форме смеси стереоизомеров, в том числе рацемических смесей и смесей, обогащенных одним или более стереоизомерами. Изомеры могут быть выделены из смесей с помощью способов, известных специалистам в данной области, включая хиральную жидкостную хроматографию высокого давления (ВЭЖХ) и образование и кристаллизацию хиральных солей; или предпочтительные изомеры могут быть получены с помощью асимметрических синтезов. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972). Изобретение дополнительно охватывает соединения, описанные в настоящей заявке, в виде индивидуальных изомеров, по существу не содержащих других изомеров, и, в альтернативе, в виде смеси разных изомеров.
[0016] Соединение, описанное в настоящей заявке, может также включать одно или более изотопных замещений. Например, H может находиться в любой изотопной форме, в том числе 1H, 2H (D или дейтерий) и 3H (T или тритий); C может находиться в любой изотопной форме, в том числе 12C, 13C и 14C; O может находиться в любой изотопной форме, в том числе 16O и 18O;и т.п.
[0017] В случае перечисления диапазона значений предполагается, что он охватывает каждое значение и поддиапазон внутри такого диапазона. Например, предполагается, что "C1-6 алкил" охватывает C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5 и C5-6 алкил.
[0018] Предполагается, что следующие термины имеют значения, представленные вместе с ними ниже, и полезны для понимания описания и предполагаемого объема настоящего изобретения. При описании изобретения, которое может включать соединения, фармацевтические композиции, содержащие такие соединения, и способы применения таких соединений и композиций, следующие термины, если таковые присутствуют, имеют следующие значения, если не указано иное. Также необходимо понимать, что при описании в настоящей заявке любая из групп, определенных ниже, может быть замещена рядом заместителей, и что соответствующие определения должны включать такие замещенные групы в пределах их объема, как изложено ниже. Если не указано иное, термин "замещенный" должен иметь определение, представленное ниже. Также следует понимать, что термины "группы" и "радикалы" при использовании в настоящем описании можно считать взаимозаменяемыми. Артикли "a" и "an" могут использоваться в оригинальном тексте настоящей заявки для обозначения одного или больше чем одного (т.е. по меньшей мере одного) грамматических объектов артикля. Например, "аналог" ("an analogue") означает один аналог или больше чем один аналог.
[0019] "Алифатический" относится к алкильной, алкенильной, алкинильной или карбоциклильной группе, как определено в настоящей заявке.
[0020] "Алкил" относится к радикалу насыщенной углеводородной группы с нормальной или разветвленной цепью, содержащему от 1 до 20 атомов углерода ("C1-20 алкилу"). В некоторых вариантах осуществления алкильная группа содержит 1-12 атомов углерода ("C1-12 алкил"). В некоторых вариантах осуществления алкильная группа содержит 1-10 атомов углерода ("C1-10 алкил"). В некоторых вариантах осуществления алкильная группа содержит 1-9 атомов углерода ("C1-9 алкил"). В некоторых вариантах осуществления алкильная группа содержит 1-8 атомов углерода ("C1-8 алкил"). В некоторых вариантах осуществления алкильная группа содержит 1-7 атомов углерода ("C1-7 алкил"). В некоторых вариантах осуществления алкильная группа содержит 1-6 атомов углерода ("C1-6 алкил", также указанный в настоящей заявке как "низший алкил"). В некоторых вариантах осуществления алкильная группа содержит 1-5 атомов углерода ("C1-5 алкил"). В некоторых вариантах осуществления алкильная группа содержит 1-4 атома углерода ("C1-4 алкил"). В некоторых вариантах осуществления алкильная группа содержит 1-3 атома углерода ("C1-3 алкил"). В некоторых вариантах осуществления алкильная группа содержит 1-2 атома углерода ("C1-2 алкил"). В некоторых вариантах осуществления алкильная группа содержит 1 атом углерода ("C1 алкил"). В некоторых вариантах осуществления алкильная группа содержит 2-6 атомов углерода ("C2-6 алкил"). Примеры C1-6 алкильных групп включают метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) и н-гексил (C6). Дополнительные примеры алкильных групп включают н-гептил (C7), н-октил (C8) и т.п. Если не определено иное, в каждом случае алкильная группа необязательно независимо замещена, т.е. не замещена ("незамещенный алкил") или замещена ("замещенный алкил") одним или более заместителями; например, 1-5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления алкильная группа является C1-10 незамещенным алкилом (например, -CH3). В некоторых вариантах осуществления алкильная группа является C1-10 замещенным алкилом. Стандартные сокращенные обозначения алкилов включают Me (-CH3), Et (-CH2CH3), iPr (-CH(CH3)2), nPr (-CH2CH2CH3), n-Bu (-CH2CH2CH2CH3) или i-Bu (-CH2CH(CH3)2).
[0021] При использовании в настоящей заявке "алкилен", "алкенилен" и "алкинилен" относятся к двухвалентному радикалу алкильной, алкенильной и алкинильной группы, соответственно. В том случае, когда для конкретной "алкиленовой", "алкениленовой" и "алкиниленовой" группы приведен диапазон или число атомов углерода, следует понимать, что такой диапазон или число относятся к диапазону или числу атомов углерода в линейной углеродной двухвалентной цепи. "Алкиленовая", "алкениленовая" и "алкиниленовая" группы могут быть замещены или не замещены одним или более заместителями, как описано в настоящей заявке.
[0022] "Алкилен" относится к алкильной группе, в которой удалены два водорода с получением двухвалентного радикала, и которая может быть замещенной или незамещенной. Незамещенные алкиленовые группы включают, без ограничения перечисленными, метилен (-CH2-), этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), бутилен (-CH2CH2CH2CH2-), пентилен (-CH2CH2CH2CH2CH2-), гексилен (-CH2CH2CH2CH2CH2CH2-) и т.п. Примеры замещенных алкиленовых групп, например, замещенных одной или более алкильными (метильными) группами, включают, без ограничения перечисленными, замещенный метилен (-CH(CH3)-, (-C(CH3)2-), замещенный этилен (-CH(CH3)CH2-, -CH2CH(CH3), -C(CH3)2CH2-, -CH2C(CH3)2-), замещенный пропилен (-CH(CH3)CH2CH2-, -CH2CH(CH3)CH2-, -CH2CH2CH(CH3)-, -C(CH3)2CH2CH2-, -CH2C(CH3)2CH2-, -CH2CH2C(CH3)2-) и т.п.
[0023] "Алкенил" относится к радикалу углеводородной группы с нормальной или разветвленной цепью, содержащему от 2 до 20 атомов углерода, одну или более углерод-углеродных двойных связей (например, 1, 2, 3 или 4 углерод-углеродных двойных связей) и, необязательно, одну или более углерод-углеродных тройных связей (например, 1, 2, 3 или 4 углерод-углеродных тройных связей) ("C2-20 алкенил"). В некоторых вариантах осуществления алкенил не содержит тройных связей. В некоторых вариантах осуществления алкенильная группа содержит 2-10 атомов углерода ("C2-10 алкенил"). В некоторых вариантах осуществления алкенильная группа содержит 2-9 атомов углерода ("C2-9 алкенил"). В некоторых вариантах осуществления алкенильная группа содержит 2-8 атомов углерода ("C2-8 алкенил"). В некоторых вариантах осуществления алкенильная группа содержит 2-7 атомов углерода ("C2-7 алкенил"). В некоторых вариантах осуществления алкенильная группа содержит 2-6 атомов углерода ("C2-6 алкенил"). В некоторых вариантах осуществления алкенильная группа содержит 2-5 атомов углерода ("C2-5 алкенил"). В некоторых вариантах осуществления алкенильная группа содержит 2-4 атома углерода ("C2-4 алкенил"). В некоторых вариантах осуществления алкенильная группа содержит 2-3 атома углерода ("C2-3 алкенил"). В некоторых вариантах осуществления алкенильная группа содержит 2 атома углерода ("C2 алкенил"). Одна или более углерод-углеродных двойных связей могут быть внутренними (такими как в 2-бутениле) или концевыми (такими как в 1-бутениле). Примеры C2-4 алкенильных групп включают этенил (C2), 1-пропенил (C3), 2-пропенил (C3), 1-бутенил (C4), 2-бутенил (C4), бутадиенил (C4) и т.п. Примеры C2-6 алкенильных групп включают вышеуказанные C2-4 алкенильные группы, а также пентенил (C5), пентадиенил (C5), гексенил (C6) и т.п. Дополнительные примеры алкенила включают гептенил (C7), октенил (C8), октатриенил (C8) и т.п. Если не определено иное, в каждой случае алкенильная группа необязательно независимо замещена, т.е. не замещена ("незамещенный алкенил") или замещена ("замещенный алкенил") одним или более заместителями, например, 1-5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления алкенильная группа является незамещенным C2-10 алкенилом. В некоторых вариантах осуществления алкенильная группа является замещенным C2-10 алкенилом.
[0024] "Алкенилен" относится к алкенильной группе, в которой удалены два водорода с получением двухвалентного радикала, и которая может быть замещенной или незамещенной. Примеры незамещенных двухвалентных алкениленовых групп включают, без ограничения перечисленными, этенилен (-CH=CH-) и пропенилен (например, -CH=CHCH2-, -CH2-CH=CH-). Примеры замещенных алкениленовых групп, например, замещенных одной или более алкильных (метильных) групп, включают, без ограничения перечисленными, замещенный этилен (-C(CH3)=CH-, -CH=C(CH3)-), замещенный пропилен (например, -C(CH3)=CHCH2-, -CH=C(CH3)CH2-, -CH=CHCH(CH3)-, -CH=CHC(CH3)2-, -CH(CH3)-CH=CH-, -C(CH3)2-H=CH-, -CH2-C(CH3)=CH-, -CH2-CH=C(CH3)-) и т.п.
[0025] "Алкинил" относится к радикалу углеводородной группы с нормальной или разветвленной цепью, содержащему от 2 до 20 атомов углерода, одну или более углерод-углеродных тройных связей (например, 1, 2, 3 или 4 углерод-углеродных тройных связей) и, необязательно, одну или более углерод-углеродных двойных связей (например, 1, 2, 3 или 4 углерод-углеродных двойных связей) ("C2-20 алкинил"). В некоторых вариантах осуществления алкинил не содержит двойных связей. В некоторых вариантах осуществления алкинильная группа содержит 2-10 атомов углерода ("C2-10 алкинил"). В некоторых вариантах осуществления алкинильная группа содержит 2-9 атомов углерода ("C2-9 алкинил"). В некоторых вариантах осуществления алкинильная группа содержит 2-8 атомов углерода ("C2-8 алкинил"). В некоторых вариантах осуществления алкинильная группа содержит 2-7 атомов углерода ("C2-7 алкинил"). В некоторых вариантах осуществления алкинильная группа содержит 2-6 атомов углерода ("C2-6 алкинил"). В некоторых вариантах осуществления алкинильная группа содержит 2-5 атомов углерода ("C2-5 алкинил"). В некоторых вариантах осуществления алкинильная группа содержит 2-4 атома углерода ("C2-4 алкинил"). В некоторых вариантах осуществления алкинильная группа содержит 2-3 атома углерода ("C2-3 алкинил"). В некоторых вариантах осуществления алкинильная группа содержит 2 атома углерода ("C2 алкинил"). Одна или более углерод-углеродных тройных связей могут быть внутренними (такими как в 2-бутиниле) или концевыми (такими как в 1-бутиниле). Примеры C2-4 алкинильных групп включают, без ограничения перечисленными, этинил (C2), 1-пропинил (C3), 2-пропинил (C3), 1-бутинил (C4), 2-бутинил (C4) и т.п. Примеры C2-6 алкенильных групп включают вышеуказанные C2-4 алкинильные группы, а также пентинил (C5), гексинил (C6) и т.п. Дополнительные примеры алкинила включают гептинил (C7), октинил (C8) и т.п. Если не определено иное, в каждом случае алкинильная группа необязательно независимо замещена, т.е. не замещена ("незамещенный алкинил") или замещена ("замещенный алкинил") одним или более заместителями; например, 1-5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления алкинильная группа является незамещенным C2-10 алкинилом. В некоторых вариантах осуществления алкинильная группа является замещенным C2-10 алкинилом.
[0026] "Алкинилен" относится к линейной алкинильной группе, в которой удалены два водороды с получением двухвалентного радикала, и которая может быть замещенной или незамещенной. Примеры двухвалентных алкиниленовых групп включают, без ограничения перечисленными, замещенный или незамещенный этинилен, замещенный или незамещенный пропинилен и т.п.
[0027] Термин "гетероалкил", при использовании в настоящей заявке, относится к алкильной группе, как определено в настоящей заявке, которая дополнительно включает 1 или более (например, 1, 2, 3 или 4) гетероатомов (например, кислорода, серы, азота, бора, кремния, фосфора) в исходной цепи, где один или более гетероатомов вставлены между смежными атомами углерода в исходной углеродной цепи, и/или один или более гетероатомов вставлены между атомом углерода и исходной молекулой, т.е. между точкой присоединения. В некоторых вариантах осуществления гетероалкильная группа относится к насыщенной группе, содержащей от 1 до 10 атомов углерода и 1, 2, 3 или 4 гетероатома ("гетероC1-10 алкил"). В некоторых вариантах осуществления гетероалкильная группа является насыщенной группой, содержащей 1-9 атомов углерода и 1, 2, 3 или 4 гетероатома ("гетероC1-9 алкил"). В некоторых вариантах осуществления гетероалкильная группа является насыщенной группой, содержащей 1-8 атомов углерода и 1, 2, 3 или 4 гетероатома ("гетероC1-8 алкил"). В некоторых вариантах осуществления гетероалкильная группа является насыщенной группой, содержащей 1-7 атомов углерода и 1, 2, 3 или 4 гетероатома ("гетероC1-7 алкил"). В некоторых вариантах осуществления гетероалкил группа является группой, содержащей 1-6 атомов углерода и 1, 2 или 3 гетероатома ("гетероC1-6 алкил"). В некоторых вариантах осуществления гетероалкильная группа является насыщенной группой, содержащей 1-5 атомов углерода и 1 или 2 гетероатома ("гетероC1-5 алкил"). В некоторых вариантах осуществления гетероалкильная группа является насыщенной группой, содержащей 1-4 атома углерода и 1 или 2 гетероатома ("гетероC1-4 алкил"). В некоторых вариантах осуществления гетероалкильная группа является насыщенной группой, содержащей 1-3 атома углерода и 1 гетероатом ("гетероC1-3 алкил"). В некоторых вариантах осуществления гетероалкильная группа является насыщенной группой, содержащей 1-2 атома углерода и 1 гетероатом ("гетероC1-2 алкил"). В некоторых вариантах осуществления гетероалкильная группа является насыщенной группой, содержащей 1 атом углерода и 1 гетероатом ("гетероC1 алкил"). В некоторых вариантах осуществления гетероалкильная группа является насыщенной группой, содержащей 2-6 атомов углерода и 1 или 2 гетероатома ("гетероC2-6 алкил"). Если не определено иное, в каждом случае гетероалкильная группа независимо не замещена ("незамещенный гетероалкил") или замещена ("замещенный гетероалкил") одним или более заместителями. В некоторых вариантах осуществления гетероалкильная группа является незамещенным гетероC1-10 алкилом. В некоторых вариантах осуществления гетероалкильная группа является замещенным гетероC1-10 алкилом.
[0028] Термин "гетероалкенил" при использовании в настоящей заявке относится к алкенильной группе, как определено в настоящей заявке, которая дополнительно включает один или более (например, 1, 2, 3 или 4) гетероатомов (например, кислорода, серы, азота, бора, кремния, фосфора), где один или более гетероатомов вставлены между смежными атомами углерода в исходной углеродной цепи, и/или один или несколько гетероатомов вставлены между атомом углерода и исходной молекулой, т.е. между точкой присоединения. В определенных вариантах осуществления гетероалкенильная группа относится к группе, содержащей от 2 до 10 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома ("гетероC2-10 алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит 2-9 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома ("гетероC2-9 алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит 2-8 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома ("гетероC2-8 алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит 2-7 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома ("гетероC2-7 алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит 2-6 атомов углерода, по меньшей мере одну двойную связь и 1, 2 или 3 гетероатома ("гетероC2-6 алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит 2-5 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома ("гетероC2-5 алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит 2-4 атома углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома ("гетероC2-4 алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит 2-3 атома углерода, по меньшей мере одну двойную связь и 1 гетероатом ("гетероC2-3 алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит 2-6 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома ("гетероC2-6 алкенил"). Если не определено иное, в каждом случае гетероалкенильная группа независимо не замещена ("незамещенный гетероалкенил") или замещена ("замещенный гетероалкенил") одним или более заместителями. В некоторых вариантах осуществления гетероалкенильная группа является незамещенным гетероC2-10 алкенилом. В определенных вариантах осуществления гетероалкенильная группа является замещенным гетероC2-10 алкенилом.
[0029] Термин "гетероалкинил" при использовании в настоящей заявке относится к алкинильной группе, как определено в настоящей заявке, которая дополнительно включает один или более (например, 1, 2, 3 или 4) гетероатомов (например, кислорода, серы, азота, бора, кремния, фосфора), где один или более гетероатомов вставлены между смежными атомами углерода в исходной углеродной цепи, и/или один или более гетероатомов вставлены между атомом углерода и исходной молекулой, т.е. между точкой присоединения. В некоторых вариантах осуществления гетероалкинильная группа относится к группе, содержащей от 2 до 10 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома ("гетероC2-10 алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит 2-9 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома ("гетероC2-9 алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит 2-8 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома ("гетероC2-8 алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит 2-7 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома ("гетероC2-7 алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит 2-6 атомов углерода, по меньшей мере одну тройную связь и 1, 2 или 3 гетероатома ("гетероC2-6 алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит 2-5 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома ("гетероC2-5 алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит 2-4 атома углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома ("гетероC2-4 алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит 2-3 атома углерода, по меньшей мере одну тройную связь и 1 гетероатом ("гетероC2-3 алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит 2-6 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома ("гетероC2-6 алкинил"). Если не определено иное, в каждом случае гетероалкинильная группа независимо не замещена ("незамещенный гетероалкинил") или замещена ("замещенный гетероалкинил") одним или более заместителями. В некоторых вариантах осуществления гетероалкинильная группа является незамещенным гетероC2-10 алкинилом. В определенных вариантах осуществления гетероалкинильная группа является замещенным гетероC2-10 алкинилом.
[0030] При использовании в настоящей заявке "алкилен", "алкенилен", "алкинилен", "гетероалкилен", "гетероалкенилен" и "гетероалкинилен" относятся к двухвалентному радикалу алкильной, алкенильной, алкинильной группы, гетероалкильной, гетероалкенильной и гетероалкинильной группы, соответственно. В случае, когда для конкретной "алкиленовой", "алкениленовой", "алкиниленовой", "гетероалкиленовой", "гетероалкениленовой" или "гетероалкиниленовой" группы приведен диапазон или число атомов углерода, следует понимать, что такой диапазон или число относятся к диапазону или числу атомов углерода в линейной углеродной двухвалентной цепи. "Алкиленовая", "алкениленовая", "алкиниленовая", "гетероалкиленовая", "гетероалкениленовая" и "гетероалкиниленовая" группы могут быть замещены или не замещены одним или более заместителями, как описано в настоящей заявке.
[0031] "Арил" относится к радикалу моноциклической или полициклической (например, бициклической или трициклической) 4n+2 ароматической кольцевой системы (например, содержащей 6, 10 или 14 π-электронов, распределенных в циклической структуре), содержащей 6-14 атомов углерода в кольце и ноль гетероатомов, представленных в ароматической кольцевой системе ("C6-14 арил"). В некоторых вариантах осуществления арильная группа содержит шесть атомов углерода в кольце ("C6 арил"; например, фенил). В некоторых вариантах осуществления арильная группа содержит десять атомов углерода в кольце ("C10 арил"; например, нафтил, такой как 1-нафтил и 2-нафтил). В некоторых вариантах осуществления арильная группа содержит четырнадцать атомов углерода в кольце ("C14 арил"; например, антрацил). "Арил" также включает кольцевые системы, в которых арильное кольцо, как определено выше, сконденсировано с одной или более карбоциклильными или гетероциклильными группами, где радикал или точка присоединения находятся на арильном кольце, и в таких случаях количество атомов углерода продолжает определять количество атомов углерода в арильной кольцевой системе. Типичные арильные группы включают, без ограничения перечисленными, группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, флуорена, гексацена, гексафена, гексалина, ассим-индацена, сим-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена, рубицена, трифенилена и тринафталина. В частности, арильные группы включают фенил, нафтил, инденил и тетрагидронафтил. Если не определено иное, в каждом случае арильная группа необязательно независимо замещена, т.е. не замещена ("незамещенный арил") или замещена ("замещенный арил") одним или более заместителями. В некоторых вариантах осуществления арильная группа является незамещенным C6-14 арилом. В некоторых вариантах осуществления арильная группа является замещенным C6-14 арилом.
[0032] В некоторых вариантах осуществления арильная группа замещена одной или более группами, выбранными из галогена, C1-C8 алкила, C1-C8 галогеналкила, циано, гидрокси, C1-C8 алкокси и амино.
[0033] Примеры репрезентативных замещенных арилов включают следующее:
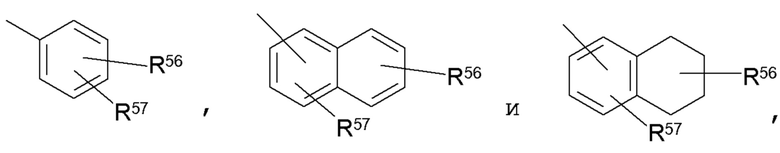
где один из R56 и R57 может быть водородом, при этом каждый по меньшей мере один из R56 и R57 независимо выбран из C1-C8 алкила, C1-C8 галогеналкила, 4-10-членного гетероциклила, алканоила, C1-C8 алкокси, гетероарилокси, алкиламино, ариламино, гетероариламино, NR58COR59, NR58SOR59, NR58SO2R59, COOалкила, COOарила, CONR58R59, CONR58OR59, NR58R59, SO2NR58R59, S-алкила, SOалкила, SO2алкила, Sарила, SOарила, SO2арила; или R56 и R57 могут быть соединены, с образованием циклического кольца (насыщенного или ненасыщенного), содержащего от 5 до 8 атомов, необязательно содержащего один или более гетероатомов, выбранных из группы N, O или S. R60 и R61 независимо являются водородом, C1-C8 алкилом, C1-C4 галогеналкилом, C3-C10 циклоалкилом, 4-10-членным гетероциклилом, C6-C10 арилом, замещенным C6-C10 арилом, 5-10-членным гетероарилом или замещенным 5-10-членным гетероарилом.
[0034] "Конденсированный арил" относится к арилу, два атома углерода в кольце которого входят во второе арильное или гетероарильное кольцо или гетероциклильное или карбоциклильное кольцо.
[0035] "Аралкил" является подклассом алкила и арила, как определено в настоящей заявке, и относится к необязательно замещенной алкильной группе, которая замещена необязательно замещенной арильной группой.
[0036] "Гетероарил" относится к радикалу 5-10-членной моноциклической или бициклической 4n+2 ароматической кольцевой системы (например, содержащей 6 или 10 π-электронов, распределенных в циклической структуре), содержащей атомы углерода в кольце и 1-4 гетероатомов в кольце, представленных в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-10-членный гетероарил"). В гетероарильных группах, которые содержат один или более атомов азота, точка присоединения может быть атомом углерода или азота, если позволяет валентность. Гетероарильные бициклические кольцевые системы могут включать один или более гетероатомов в одном или обоих кольцах. "Гетероарил" включает кольцевые системы, в которых гетероарильное кольцо, как определено выше, сконденсировано с одним или более карбоциклильными или гетероциклильными группами, где точка присоединения находится на гетероарильном кольце, и в таких случаях число членов в кольце продолжает определять число членов в кольце гетероарильной кольцевой системы. "Гетероарил" также включает кольцевые системы, в которых гетероарильное кольцо, как определено выше, сконденсировано с одной или более арильными группами, где точка присоединения находится на арильном или на гетероарильном кольце, и в таких случаях число членов в кольце определяет число членов в кольце конденсированой (арильной/гетероарильной) кольцевой системы. В бициклических гетероарильных группах, в которых одно кольцо не содержит гетероатом (например, индолил, хинолинил, карбазолил и т.п.), точка присоединения может находиться на любом кольце, т.е. любом кольце, несущем гетероатом (например, 2-индолил), или кольце, которое не содержит гетероатом (например, 5-индолил).
[0037] В некоторых вариантах осуществления гетероарильная группа является 5-10-членной ароматической кольцевой системой, содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, представленные в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-10-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа является 5-8-членной ароматической кольцевой системой, содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, представленные в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-8-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа является 5-6-членной ароматической кольцевой системой, содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, представленные в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-6-членный гетероарил"). В некоторых вариантах осуществления 5-6-членный гетероарил содержит 1-3 гетероатома в кольце, выбранные из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил содержит 1-2 гетероатома в кольце, выбранные из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил содержит 1 гетероатом в кольце, выбранный из азота, кислорода и серы. Если не определено иное, в каждом случае гетероарильная группа необязательно независимо замещена, т.е. не замещена ("незамещенный гетероарил") или замещена ("замещенный гетероарил") одним или более заместителями. В некоторых вариантах осуществления гетероарильная группа является незамещенным 5-14-членным гетероарилом. В некоторых вариантах осуществления гетероарильная группа является замещенным 5-14-членным гетероарилом.
[0038] Примеры 5-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения перечисленными, пирролил, фуранил и тиофенил. Примеры 5-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения перечисленными, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Примеры 5-членных гетероарильных групп, содержащих три гетероатома, включают, без ограничения перечисленными, триазолил, оксадиазолил и тиадиазолил. Примеры 5-членных гетероарильных групп, содержащих четыре гетероатома, включают, без ограничения перечисленными, тетразолил. Примеры 6-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения перечисленными, пиридинил. Примеры 6-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения перечисленными, пиридазинил, пиримидинил и пиразинил. Примеры 6-членных гетероарильных групп, содержащих три или четыре гетероатома, включают, без ограничения перечисленными, триазинил и тетразинил, соответственно. Примеры 7-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения перечисленными, азепинил, оксепинил и тиепинил. Примеры 5,6-бициклических гетероарильных групп включают, без ограничения перечисленными, индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Примеры 6,6-бициклических гетероарильных групп включают, без ограничения перечисленными, нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил.
[0039] Примеры репрезентативных гетероарилов включают следующее:
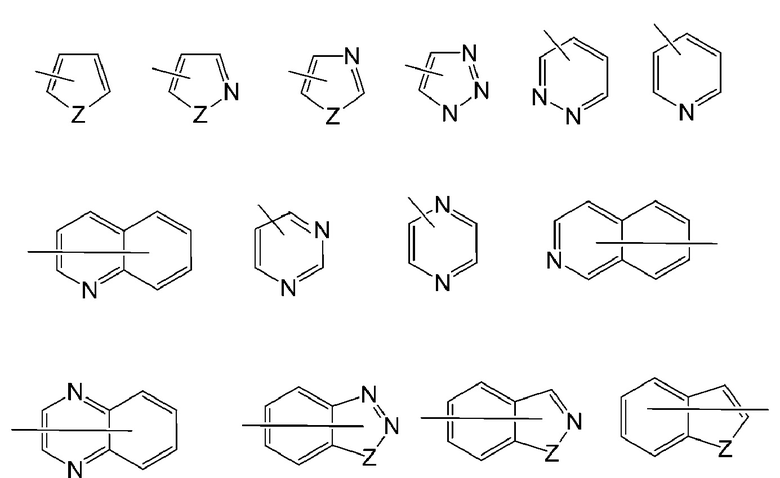
где каждый Z выбран из карбонила, N, NR65, O и S; и R65 независимо является водородом, C1-C8 алкилом, C3-C10 циклоалкилом, 4-10-членным гетероциклилом, C6-C10 арилом и 5-10-членным гетероарилом.
[0040] "Гетероаралкил" является подклассом алкила и гетероарила, как определено в настоящей заявке, и относится к необязательно замещенной алкильной группе, которая замещена необязательно замещенной гетероарильной группой.
[0041] "Карбоциклил" или "карбоциклический" относятся к радикалу неароматической циклической углеводородной группы, содержащей от 3 до 10 атомов углерода в кольце ("C3-10 карбоциклил") и ноль гетероатомов в неароматической кольцевой системе. В некоторых вариантах осуществления карбоциклильная группа содержит 3-8 атомов углерода в кольце ("C3-8 карбоциклил"). В некоторых вариантах осуществления карбоциклильная группа содержит 3-6 атомов углерода в кольце ("C3-6 карбоциклил"). В некоторых вариантах осуществления карбоциклильная группа содержит 3-6 атомов углерода в кольце ("C3-6 карбоциклил"). В некоторых вариантах осуществления карбоциклильная группа содержит 5-10 атомов углерода в кольце ("C5-10 карбоциклил"). Примеры C3-6 карбоциклильных групп включают, без ограничения перечисленными, циклопропил (C3), циклопропенил (C3), циклобутил (C4), циклобутенил (C4), циклопентил (C5), циклопентенил (C5), циклогексил (C6), циклогексенил (C6), циклогексадиенил (C6) и т.п. Примеры C3-8 карбоциклильных групп включают, без ограничения перечисленными, вышеуказанные C3-6 карбоциклильные группы, а также циклогептил (C7), циклогептенил (C7), циклогептадиенил (C7), циклогептатриенил (C7), циклооктил (C8), циклооктенил (C8), бицикло[2.2.1]гептанил (C7), бицикло[2.2.2]октанил (C8) и т.п. Примеры C3-10 карбоциклильных групп включают, без ограничения перечисленными, вышеуказанные C3-8 карбоциклильные группы, а также циклононил (C9), циклононенил (C9), циклодецил (C10), циклодеценил (C10), октагидро-1H-инденил (C9), декагидронафталинил (C10), спиро[4.5]деканил (C10) и т.п. Как проиллюстририровано в предыдущих примерах, в некоторых вариантах осуществления карбоциклильная группа либо является моноциклической ("моноциклический карбоциклил"), либо содержит конденсированную, мостиковую или спирокольцевую систему, такую как бициклическая система ("бициклический карбоциклил"), и может быть насыщенной или может быть частично ненасыщенной. "Карбоциклил" также включает кольцевые системы, в которых карбоциклильное кольцо, как определено выше, сконденсировано с одним или более арильными или гетероарильными группами, где точка присоединения находится на карбоциклильном кольце, и в таких случаях количество атомов углерода продолжает определять количество атомов углерода в карбоциклической кольцевой системе. Если не определено иное, в каждом случае карбоциклильная группа необязательно независимо замещена, т.е. не замещена ("незамещенный карбоциклил") или замещена ("замещенный карбоциклил") одним или более заместителями. В некоторых вариантах осуществления карбоциклильная группа является незамещенным C3-10 карбоциклилом. В некоторых вариантах осуществления карбоциклильная группа является замещенным C3-10 карбоциклилом.
[0042] В некоторых вариантах осуществления "карбоциклил" является моноциклической, насыщенной карбоциклильной группой, содержащей от 3 до 10 атомов углерода в кольце ("C3-10 циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит 3-8 атомов углерода в кольце ("C3-8 циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит 3-6 атомов углерода в кольце ("C3-6 циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит 5-6 атомов углерода в кольце ("C5-6 циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит 5-10 атомов углерода в кольце ("C5-10 циклоалкил"). Примеры C5-6 циклоалкильных групп включают циклопентил (C5) и циклогексил (C5). Примеры C3-6 циклоалкильных групп включают вышеуказанные C5-6 циклоалкильные группы, а также циклопропил (C3) и циклобутил (C4). Примеры C3-8 циклоалкильных групп включают вышеуказанные C3-6 циклоалкильные группы, а также циклогептил (C7) и циклооктил (C8). Если не определено иное, в каждом случае циклоалкильная группа независимо не замещена ("незамещенный циклоалкил") или замещена ("замещенный циклоалкил") одним или более заместителями. В некоторых вариантах осуществления циклоалкильная группа является незамещенным C3-10 циклоалкилом. В некоторых вариантах осуществления циклоалкильная группа является замещенным C3-10 циклоалкилом.
[0043] "Гетероциклил" или "гетероциклический" относится к радикалу 3-10-членной неароматической кольцевой системы, содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния ("3-10-членный гетероциклил"). В гетероциклильных группах, которые содержат один или более атомов азота, точка присоединения может быть атомом углерода или азота, если позволяет валентность. Гетероциклильная группа может быть либо моноциклической ("моноциклический гетероциклил"), либо конденсированной, мостиковой или спирокольцевой системой, такой как бициклическая система ("бициклический гетероциклил"), и может быть насыщенной или может быть частично ненасыщенной. Гетероциклильные бициклические кольцевые системы могут включать один или более гетероатомов в одном или обоих кольцах. "Гетероциклил" также включает кольцевые системы, в которых гетероциклильное кольцо, как определено выше, сконденсировано с одной или более карбоциклильными группами, где точка присоединения находится на карбоциклильном или на гетероциклильном кольце, или кольцевые системы, где гетероциклильное кольцо, как определено выше, сконденсировано с одной или более арильными или гетероарильными группами, где точка присоединения находится на гетероциклильном кольце, и в таких случаях число членов в кольце продолжает определять число членов в кольце гетероциклильной кольцевой системе. Если не определено иное, в каждом случае гетероциклил необязательно независимо замещен, т.е. не замещен ("незамещенный гетероциклил") или замещен ("замещенный гетероциклил") одним или более заместителями. В некоторых вариантах осуществления гетероциклильная группа является незамещенным 3-10-членным гетероциклилом. В некоторых вариантах осуществления гетероциклильная группа является замещенным 3-10-членным гетероциклилом.
[0044] В некоторых вариантах осуществления гетероциклильная группа является 5-10-членной неароматической кольцевой системой, содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния ("5-10-членный гетероциклил"). В некоторых вариантах осуществления гетероциклильная группа является 5-8-членной неароматической кольцевой системой, содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-8-членный гетероциклил"). В некоторых вариантах осуществления гетероциклильная группа является 5-6-членной неароматической кольцевой системой, содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-6-членный гетероциклил"). В некоторых вариантах осуществления 5-6-членный гетероциклил содержит 1-3 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил содержит 1-2 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил содержит один гетероатом в кольце, выбранный из азота, кислорода и серы.
[0045] Примеры 3-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения перечисленными, азиридинил, оксиранил, тиоренил. Примеры 4-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения перечисленными, азетидинил, оксетанил и тиетанил. Примеры 5-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения перечисленными, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Примеры 5-членных гетероциклильных групп, содержащих два гетероатома, включают, без ограничения перечисленными, диоксоланил, оксасульфуранил, дисульфуранил и оксазолидин-2-он. Примеры 5-членных гетероциклильных групп, содержащих три гетероатома, включают, без ограничения перечисленными, триазолинил, оксадиазолинил и тиадиазолинил. Примеры 6-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения перечисленными, пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Примеры 6-членных гетероциклильных групп, содержащих два гетероатома, включают, без ограничения перечисленными, пиперазинил, морфолинил, дитианил, диоксанил. Примеры 6-членных гетероциклильных групп, содержащих два гетероатома, включают, без ограничения перечисленными, триазинанил. Примеры 7-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения перечисленными, азепанил, оксепанил и тиепанил. Примеры 8-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения перечисленными, азоканил, оксеканил и тиоканил. Примеры 5-членных гетероциклильных групп, сконденсированных с C6 арильным кольцом (также указанных в настоящей заявке как 5,6-бициклическое гетероциклическое кольцо), включают, без ограничения перечисленными, индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, бензоксазолинонил и т.п. Примеры 6-членных гетероциклильных групп, сконденсированных с арильным кольцом (также указанных в настоящей заявке как 6,6-бициклическое гетероциклическое кольцо), включают, без ограничения перечисленными, тетрагидрохинолинил, тетрагидроизохинолинил и т.п.
[0046] "Гетеро" в случае использования для описания соединения или группы, присутствующей на соединении, подразумевает, что один или несколько атомов углерода в соединении или группе были замещены гетероатомом азота, кислорода или серы. Гетеро может быть применен к любой из гидрокарбильных групп, описанных выше, такой как алкил, например гетероалкил, циклоалкил, например гетероциклил, арил, например гетероарил, циклоалкенил, например циклогетероалкенил, и т.п., содержащей от 1 до 5 и, в частности, от 1 до 3 гетероатомов.
[0047] "Ацил" относится к радикалу -C(O)R20, где R20 является водородом, замещенным или незамещенным алкилом, замещенным или незамещенным алкенилом, замещенным или незамещенным алкинилом, замещенным или незамещенным карбоциклилом, замещенным или незамещенным гетероциклилом, замещенным или незамещенным арилом или замещенным или незамещенным гетероарилом, как определено в настоящей заявке. "Алканоил" является ацильной группой, в которой R20 является какой-либо группой кроме водорода. Репрезентативные ацильные группы включают, без ограничения перечисленными, формил (-CHO), ацетил (-C(=O)CH3), циклогексилкарбонил, циклогексилметилкарбонил, бензоил (-C(=O)Ph), бензилкарбонил (-C(=O)CH2Ph), -C(O)-C1-C8 алкил, -C(O)-(CH2)t(C6-C10 арил), -C(O)-(CH2)t(5-10-членный гетероарил), -C(O)-(CH2)t(C3-C10 циклоалкил) и -C(O)-(CH2)t(4-10-членный гетероциклил), где t является целым числом от 0 до 4. В некоторых вариантах осуществления R21 является C1-C8 алкилом, который замещен галогеном или гидрокси; или C3-C10 циклоалкилом, 4-10-членным гетероциклилом, C6-C10 арилом, арилалкилом, 5-10-членным гетероарилом или гетероарилалкилом, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
[0048] "Алкокси" относится к группе -OR29, где R29 является замещенным или незамещенным алкилом, замещенным или незамещенным алкенилом, замещенным или незамещенным алкинилом, замещенным или незамещенным карбоциклилом, замещенным или незамещенным гетероциклилом, замещенным или незамещенным арилом или замещенным или незамещенным гетероарилом. Конкретными алкоксигруппами являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси и 1,2-диметилбутокси. Конкретные алкоксигруппы являются низшими алкоксигруппами, т.е. содержащими 1-6 атомов углерода. Другие конкретные алкоксигруппы содержат от 1 до 4 атомов углерода.
[0049] В некоторых вариантах осуществления R29 является группой, которая имеет 1 или более заместителей, например 1-5 заместителей и, в частности, 1-3 заместителя, в частности 1 заместитель, выбранный из группы, состоящей из амино, замещенного амино, C6-C10 арила, арилокси, карбоксила, циано, C3-C10 циклоалкила, 4-10-членного гетероциклила, галогена, 5-10-членного гетероарила, гидроксила, нитро, тиоалкокси, тиоарилокси, тиола, алкил-S(O)-, арил-S(O)-, алкил-S(O)2- и арил-S(O)2-. Примеры замещенных алкоксигрупп включают, без ограничения перечисленными, -O-(CH2)t(C6-C10 арил), -O-(CH2)t(5-10-членный гетероарил), -O-(CH2)t(C3-C10 циклоалкил) и -O-(CH2)t(4-10-членный гетероциклил), где t является целым числом от 0 до 4, при этом любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы могут быть сами замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Конкретными примерами замещенных алкоксигрупп являются -OCF3, -OCH2CF3, -OCH2Ph, -OCH2-циклопропил, -OCH2CH2OH и -OCH2CH2NMe2.
[0050] "Амино" относится к радикалу -NH2.
[0051] "Замещенный амино" относится к аминогруппе формулы -N(R38)2, где R38 является водородом, замещенным или незамещенным алкилом, замещенным или незамещенным алкенилом, замещенным или незамещенным алкинилом, замещенным или незамещенным карбоциклилом, замещенным или незамещенным гетероциклилом, замещенным или незамещенным арилом, замещенным или незамещенным гетероарилом или аминозащитной группой, где по меньшей мере один из R38 не является водородом. В некоторых вариантах осуществления каждый R38 независимо выбран из водорода, C1-C8 алкила, C3-C8 алкенила, C3-C8 алкинила, C6-C10 арила, 5-10-членного гетероарила, 4-10-членного гетероциклила или C3-C10 циклоалкила; или C1-C8 алкила, замещенного галогеном или гидрокси; C3-C8 алкенила, замещенного галогеном или гидрокси; C3-C8 алкинила, замещенного галогеном или гидрокси, или -(CH2)t(C6-C10 арила), -(CH2)t(5-10-членного гетероарила), -(CH2)t(C3-C10 циклоалкила) или -(CH2)t(4-10-членного гетероциклила), где t является целым числом от 0 до 8, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; или обе группы R38 соединены с образованием алкиленовой группы.
[0052] Примеры "замещенных аминогрупп" включают, без ограничения перечисленными, -NR39-C1-C8 алкил, -NR39-(CH2)t(C6-C10 арил), -NR39-(CH2)t(5-10-членный гетероарил), -NR39-(CH2)t(C3-C10 циклоалкил) и -NR39-(CH2)t(4-10-членный гетероциклил), где t является целым числом от 0 до 4, например 1 или 2, каждый R39 независимо представляет собой H или C1-C8 алкил; при этом любые присутствующие алкильные группы могут быть сами замещены галогеном, замещенным или незамещенным амино или гидрокси; и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы могут быть сами замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Во избежание неопределенности термин "замещенный амино" включает алкиламиногруппы, замещенные алкиламиногруппы, алкилариламиногруппы, замещенные алкилариламиногруппы, ариламиногруппы, замещенные ариламиногруппы, диалкиламиногруппы и замещенные диалкиламиногруппы, как определено ниже. Замещенная аминогруппа охватывает как монозамещенные аминогруппы, так и дизамещенные аминогруппы.
[0053] "Карбокси" относится к радикалу -C(O)OH.
[0054] "Циано" относится к радикалу -CN.
[0055] "Галоген" относятся к фтору (F), хлору (Cl), брому (Br) и иоду (I). В некоторых вариантах осуществления галогеногруппой является фтор или хлор.
[0056] "Гидрокси" относится к радикалу -OH.
[0057] "Нитро" относится к радикалу -NO2.
[0058] "Циклоалкилалкил" относится к алкильному радикалу, в котором алкильная группа замещена циклоалкильной группой. Типичные циклоалкилалкильные группы включают, без ограничения перечисленными, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклогептилметил, циклооктилметил, циклопропилэтил, циклобутилэтил, циклопентилэтил, циклогексилэтил, циклогептилэтил и циклооктилэтил, и т.п.
[0059] "Гетероциклилалкил" относится к алкильному радикалу, в котором алкильная группа замещена гетероциклильной группой. Типичные гетероциклилалкильные группы включают, без ограничения перечисленными, пирролидинилметил, пиперидинилметил, пиперазинилметил, морфолинилметил, пирролидинилэтил, пиперидинилэтил, пиперазинилэтил, морфолинилэтил и т.п.
[0060] "Азотсодержащая гетероциклильная" группа означает 4-7-членную неароматическую циклическую группу, содержащую по меньшей мере один атом азота, например, без ограничения перечисленными, морфолин, пиперидин (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидин (например, 2-пирролидинил и 3-пирролидинил), азетидин, пирролидон, имидазолин, имидазолидинон, 2-пиразолин, пиразолидин, пиперазин, и N-алкилпиперазины, такие как N-метилпиперазин. Конкретные примеры включают азетидин, пиперидон и пиперазон.
[0061] "Тиокето" относится к группе =S.
[0062] Алкильные, алкенильные, алкинильные, карбоциклильные, гетероциклильные, арильные и гетероарильные группы, как определено в настоящей заявке, необязательно замещены (например, "замещенная" или "незамещенная" алкильная, "замещенная" или "незамещенная" алкенильная, "замещенная" или "незамещенная" алкинильная, "замещенная" или "незамещенная" карбоциклильная, "замещенная" или "незамещенная" гетероциклильная, "замещенная" или "незамещенная" арильная, "замещенная" или "незамещенная" гетероарильная группа). Как правило, термин "замещенный", независимо от того, предшествует ли ему термин "необязательно" или нет, означает, что по меньшей мере один водород, присутствующий на группе (например, атоме углерода или азота), замещен допустимым заместителем, например, заместителем, который при замене приводит к стабильному соединению, например, соединению, которое не подвергается спонтанному превращению, например, при перегруппировке, циклизации, элиминации, или другой реакции. Если не указано иное, "замещенная" группа имеет заместитель в одном или более замещаемых положениях группы, и в том случае, если замещены больше одного положения в той или иной структуре, заместители являются либо одинаковыми, либо отличаются в каждом положении. Предполагается, что термин "замещенный" включает замещение всеми допустимыми заместителями органических соединений, любым из заместителей, описанных в настоящей заявке, которое приводит к образованию устойчивого соединения. В настоящем изобретении предусмотрены любые возможные комбинации, обеспечивающие получение устойчивого соединения. В рамках настоящего изобретения, гетероатомы, такие как азот, могут иметь водородные заместители и/или любой подходящий заместитель, как описано в настоящей заявке, которые соответствуют валентности гетероатомов и приводят к образованию устойчивой молекулы.
[0063] Примеры заместителей атома углерода включают, без ограничения перечисленными, галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORaa, -ON(Rbb)2, -N(Rbb)2, -N(Rbb)3+X-, -N(ORcc)Rbb, -SH, -SRaa, -SSRcc, -C(=O)Raa, -CO2H, -CHO, -C(ORcc)2, -CO2Raa, -OC(=O)Raa, -OCO2Raa, -C(=O)N(Rbb)2, -OC(=O)N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -OC(=NRbb)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -C(=O)NRbbSO2Raa, -NRbbSO2Raa, -SO2N(Rbb)2, -SO2Raa, -SO2ORaa, -OSO2Raa, -S(=O)Raa, -OS(=O)Raa, -Si(Raa)3, -OSi(Raa)3 -C(=S)N(Rbb)2, -C(=O)SRaa, -C(=S)SRaa, -SC(=S)SRaa, -SC(=O)SRaa, -OC(=O)SRaa, -SC(=O)ORaa, -SC(=O)Raa, -P(=O)2Raa, -OP(=O)2Raa, -P(=O)(Raa)2, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -P(=O)2N(Rbb)2, -OP(=O)2N(Rbb)2, -P(=O)(NRbb)2, -OP(=O)(NRbb)2, -NRbbP(=O)(ORcc)2, -NRbbP(=O)(NRbb)2, -P(Rcc)2, -P(Rcc)3, -OP(Rcc)2, -OP(Rcc)3, -B(Raa)2, -B(ORcc)2, -BRaa(ORcc), C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил и 5-14-членный гетероарил, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены 0, 1, 2, 3, 4 или 5 группами Rdd;
или два геминальных водорода на атоме углерода замещены группой =O, =S, =NN(Rbb)2, =NNRbbC(=O)Raa, =NNRbbC(=O)ORaa, =NNRbbS(=O)2Raa, =NRbb или =NORcc;
в каждом случае Raa независимо выбран из C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, или две группы Raa соединены с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rbb независимо выбран из водорода, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, или две группы Rbb соединены с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rcc независимо выбран из водорода, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, или две группы Rcc соединены с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rdd независимо выбран из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORee, -ON(Rff)2, -N(Rff)2, -N(Rff)3+X-, -N(ORee)Rff, -SH, -SRee, -SSRee, -C(=O)Ree, -CO2H, -CO2Ree, -OC(=O)Ree, -OCO2Ree, -C(=O)N(Rff)2, -OC(=O)N(Rff)2, -NRffC(=O)Ree, -NRffCO2Ree, -NRffC(=O)N(Rff)2, -C(=NRff)ORee, -OC(=NRff)Ree, -OC(=NRff)ORee, -C(=NRff)N(Rff)2, -OC(=NRff)N(Rff)2, -NRffC(=NRff)N(Rff)2, -NRffSO2Ree, -SO2N(Rff)2, -SO2Ree, -SO2ORee, -OSO2Ree, -S(=O)Ree, -Si(Ree)3, -OSi(Ree)3, -C(=S)N(Rff)2, -C(=O)SRee, -C(=S)SRee, -SC(=S)SRee, -P(=O)2Ree, -P(=O)(Ree)2, -OP(=O)(Ree)2, -OP(=O)(ORee)2, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10-членного гетероциклила, C6-10 арила, 5-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены 0, 1, 2, 3, 4 или 5 группами Rgg, или два геминальных заместителя Rdd могут быть соединены с образованием =O или =S;
в каждом случае Ree независимо выбран из C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, C6-10 арила, 3-10-членного гетероциклила и 3-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены 0, 1, 2, 3, 4 или 5 группами Rgg;
в каждом случае Rff независимо выбран из водорода, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10-членного гетероциклила, C6-10 арила и 5-10-членного гетероарила, или две группы Rff соединены с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены 0, 1, 2, 3, 4 или 5 группами Rgg; и
в каждом случае Rgg независимо является галогеном, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -OC1-6 алкилом, -ON(C1-6 алкилом)2, -N(C1-6 алкилом)2, -N(C1-6 алкилом)3+X-, -NH(C1-6 алкилом)2+X-, -NH2(C1-6 алкилом) +X-, -NH3+X-, -N(OC1-6 алкил)(C1-6 алкилом), -N(OH)(C1-6 алкилом), -NH(OH), -SH, -SC1-6 алкилом, -SS(C1-6 алкилом), -C(=O)(C1-6 алкилом), -CO2H, -CO2(C1-6 алкилом), -OC(=O)(C1-6 алкилом), -OCO2(C1-6 алкилом), -C(=O)NH2, -C(=O)N(C1-6 алкилом)2, -OC(=O)NH(C1-6 алкилом), -NHC(=O)(C1-6 алкилом), -N(C1-6 алкил)C(=O)(C1-6 алкилом), -NHCO2(C1-6 алкилом), -NHC(=O)N(C1-6 алкилом)2, -NHC(=O)NH(C1-6 алкилом), -NHC(=O)NH2, -C(=NH)O(C1-6 алкилом), -OC(=NH)(C1-6 алкилом), -OC(=NH)OC1-6 алкилом, -C(=NH)N(C1-6 алкилом)2, -C(=NH)NH(C1-6 алкилом), -C(=NH)NH2, -OC(=NH)N(C1-6 алкилом)2, -OC(NH)NH(C1-6 алкилом), -OC(NH)NH2, -NHC(NH)N(C1-6 алкилом)2, -NHC(=NH)NH2, -NHSO2(C1-6 алкилом), -SO2N(C1-6 алкилом)2, -SO2NH(C1-6 алкилом), -SO2NH2, -SO2C1-6 алкилом, -SO2OC1-6 алкилом, -OSO2C1-6 алкилом, -SOC1-6 алкилом, -Si(C1-6 алкилом)3, -OSi(C1-6 алкилом)3 -C(=S)N(C1-6 алкилом)2, C(=S)NH(C1-6 алкилом), C(=S)NH2, -C(=O)S(C1-6 алкилом), -C(=S)SC1-6 алкилом, -SC(=S)SC1-6 алкилом, -P(=O)2(C1-6 алкилом), -P(=O)(C1-6 алкилом)2, -OP(=O)(C1-6 алкилом)2, -OP(=O)(OC1-6 алкилом)2, C1-6 алкилом, C1-6 пергалогеналкилом, C2-6 алкенилом, C2-6 алкинилом, C3-10 карбоциклилом, C6-10 арилом, 3-10-членным гетероциклилом, 5-10-членным гетероарилом; или два геминальных заместителя Rgg могут быть соединены с образованием =O или =S; где X- является противоионом.
[0064] "Противоион" или "анионный противоион" является отрицательно заряженной группой, связанной с катионной четвертичной аминогруппой, необходимой для поддержания электронной нейтральности. Примеры противоионов включают галоген-ионы (например, F-, Cl-, Br-, I-), NO3-, ClO4-, OH-, H2PO4-, HSO4-, SO42- сульфонат-ионы (например, метансульфонат, трифторметансульфонат, п-толуолсульфонат, бензолсульфонат, 10-камфорсульфонат, нафталин-2-сульфонат, нафталин-1-сульфоновую кислоту-5-сульфонат, этан-1-сульфоновую кислоту-2-сульфонат и т.п.) и карбоксилат-ионы (например, ацетат, этаноат, пропаноат, бензоат, глицерат, лактат, тартрат, гликолят и т.п.).
[0065] Атомы азота могут быть замещены или не замещены, если позволяет валентность, и включают первичные, вторичные, третичные и четвертичные атомы азота. Примеры заместителей атома азота включают, без ограничения перечисленными, водород, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRbb)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2Н(Rcc)2, -P(=O)(NRcc)2, C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил и 5-14-членный гетероарил, или две группы Rcc, присоединенные к атому азота, соединены с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены 0, 1, 2, 3, 4 или 5 группами Rdd, и где Raa, Rbb, Rcc и Rdd являются такими, как определено выше.
[0066] Эти и другие примеры заместителей более подробно описаны в Подробном Описании, Примерах и Формуле изобретения. Изобретение не должно быть каким-либо образом ограничено представленным выше примерным перечнем заместителей.
Другие определения
[0067] Термин "фармацевтически приемлемая соль" относится к таким солям, которые, в рамках обоснованного медицинского решения, подходят для применения в контакте с тканями людей и низших животных без развития неспецифической токсичности, раздражения, аллергической реакции и т.п., и соизмеримы с обоснованным соотношением эффективности/риска. Фармацевтически приемлемые соли известны в уровне техники. Например, фармацевтически приемлемые соли подробно описаны в Berge et al., J. Pharmaceutical Sciences (1977) 66:1-19. Фармацевтически приемлемые соли соединений настоящего изобретения включают соли, полученные из подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых, нетоксичных солей присоединения кислот являются соли аминогруппы, образованные с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, фосфорная кислота, серная кислота и хлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, виннокаменная кислота, лимонная кислота, ятарная кислота или малоновая кислота, или при использовании других методов, применяемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и т.п. Фармацевтически приемлемые соли, полученные из подходящих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммония и N+(C1-4алкила)4. Репрезентативные соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и т.п. Другие фармацевтически приемлемые соли включают, в соответствующих случаях, нетоксичные катионы аммония, четвертичного аммония и аминов, образованные с использование таких противоионов, как галоген-ион, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
[0068] "Субъект", которому предполагают производить введение, включает, без ограничения перечисленными, людей (т.е. мужчин или женщин любой возрастной группы, например, педиатрического субъекта (например, грудного, ребенка, подростка) или взрослого субъекта (например, молодого совершеннолетнего, взрослого средних лет или пожилого взрослого)) и/или не относящегося к человеку животного, например, млекопитающего, такого как приматов (например, макаки-крабоеды, макаки-резус), рогатый скот, свиней, лошадей, овец, коз, грызунов, кошек и/или собак. В некоторых вариантах осуществления субъектом является человек. В некоторых вариантах осуществления субъектом является не относящееся к человеку животное. Термины "человек", "пациент" и "субъект" используются в настоящей заявке попеременно.
[0069] Заболевание, нарушение и состояние используются в настоящей заявке попеременно.
[0070] При использовании в настоящей заявке, и если не указано иное, термины "лечить" и "лечение" предусматривают действие, которое происходит, когда субъект страдает указанным заболеванием, нарушением или состоянием, и которое уменьшает тяжесть заболевания, нарушения или состояния или задерживает или замедляет развитие заболевания, нарушения или состояния ("терапевтическое лечение"), а также предусматривают действие, которое происходит до того, как субъект начинает страдать указанным заболеванием, нарушением или состоянием ("профилактическое лечение").
[0071] Как правило, "эффективное количество" соединения относится к количеству, достаточному, чтобы вызывать требуемый биологический ответ. Как будет очевидно средним специалистам в данной области, эффективное количество соединения изобретения может изменяться в зависимости от таких факторов как требуемый биологический результат, фармакокинетика соединения, подвергаемое лечению заболевание, способ введения и возраст, состояние здоровья и общее состояние субъекта. Эффективное количество охватывает терапевтическое и профилактическое лечение.
[0072] При использовании в настоящей заявке, и если не указано иное, "терапевтически эффективное количество" соединения является количеством, достаточным для обеспечения терапевтической эффективности при лечении заболевания, нарушения или состояния, или для задержки или минимизации одного или более симптомов, связанных с заболеванием, нарушением или состоянием. Терапевтически эффективное количество соединения означает количество терапевтического средства, одного или в комбинации с другими методами лечения, которое обеспечивает терапевтическую эффективность при лечении заболевания, нарушения или состояния. Термин "терапевтически эффективное количество" может охватывать количество, которое улучшает общую терапию, уменьшает или предотвращает симптомы или причины заболевания или состояния, или увеличивает терапевтическую эффективность другого терапевтического средства.
[0073] При использовании в настоящей заявке, и если не указано иное, "профилактически эффективное количество" соединения является количеством, достаточным для предотвращения заболевания, нарушения или состояния или одного или более симптомов, связанных с заболеванием, нарушением или состоянием, или для предотвращения его рецидива. Профилактически эффективное количество соединения означает количество терапевтического средства, одного или в комбинации с другими средствами, которое обеспечивает профилактическую эффективность при профилактике заболевания, нарушения или состояния. Термин "профилактически эффективное количество" может охватывать количество, которое улучшает общую профилактику или увеличивает профилактическую эффективность другого профилактического средства.
Подробное описание некоторых вариантов осуществления изобретения
[1] Как в общем описано в настоящей заявке, в настоящем изобретении предложены оксистеролы, которые могут применяться для предотвращения и/или лечения целого ряда нарушений, включающих, без ограничения перечисленными, NMDA-опосредованные нарушения. Указанные соединения, как ожидают, продемонстрируют повышенную in vivo активность, фармакокинетические свойства (ФК), биодоступность при приеме внутрь, легкость включения в лекарственные формы, стабильность и/или безопасность по сравнению с другими оксистеролами.
Соединения
[0074] В одном аспекте настоящего изобретения представлено соединение Формулы (I):
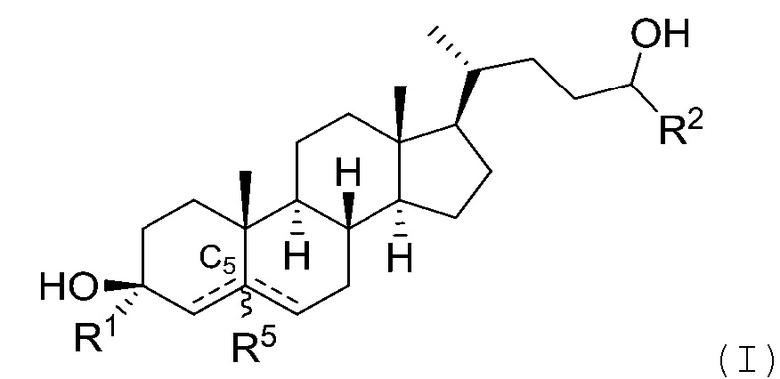
или его фармацевтически приемлемая соль, где: R1 является водородом или C1-6 алкилом; R2 является C1-6 алкилом, карбоциклилом или гетероциклилом; R5 отсутствует или является водородом; и  представляет собой одинарную или двойную связь, где в том случае, когда одна
представляет собой одинарную или двойную связь, где в том случае, когда одна  является двойной связью, другая
является двойной связью, другая  является одинарной связью, и R5 отсутствует.
является одинарной связью, и R5 отсутствует.
В некоторых вариантах осуществления R1 является водородом. В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (X):
или его фармацевтически приемлемой солью, где: R2 является C1-6 алкилом, карбоциклилом или гетероциклилом; R5 отсутствует или является водородом; и  представляет собой одинарную или двойную связь, где когда одна
представляет собой одинарную или двойную связь, где когда одна  является двойной связью, другая
является двойной связью, другая  является одинарной связью, и R5 отсутствует.
является одинарной связью, и R5 отсутствует.
В некоторых вариантах осуществления R1 является C1-6 алкилом. В некоторых вариантах осуществления R1 является замещенным C1-6 алкилом. В некоторых вариантах осуществления R1 является незамещенным C1-6 алкилом. В некоторых вариантах осуществления R1 является метилом (например, -CH3, -CF3 или -CH2OCH3), этилом или изопропилом.
В некоторых вариантах осуществления R1 является метилом (например, -CH3) или этилом (например, -CH2CH3).
В некоторых вариантах осуществления R2 является C1-6 алкилом или карбоциклилом. В некоторых вариантах осуществления R2 является замещенным C1-6 алкилом. В некоторых вариантах осуществления R2 является незамещенным C1-6 алкилом. В некоторых вариантах осуществления R2 является метилом (например, -CH3), этилом (например, -CH2CH3, -CH2CF3, -CH(CH3)(CF3)), изопропилом, трет-бутилом или циклопропилом. В некоторых вариантах осуществления R2 является галогеналкилом. В некоторых вариантах осуществления R2 является -CH2CF3 или -CH(CH3)(CF3). В некоторых вариантах осуществления R1 и R2 являются C1-6 алкилом. В некоторых вариантах осуществления R1 является C1-6 алкилом, и R2 является C1-6 алкилом, карбоциклилом или гетероциклилом. В некоторых вариантах осуществления R1 является метилом или этилом, и R2 является незамещенным или замещенным C1-6 алкилом (например, галогеналкилом). В некоторых вариантах осуществления R1 является метилом или этилом, и R2 является карбоциклилом или гетероциклилом.
В некоторых вариантах осуществления  представляет собой одинарную связь.
представляет собой одинарную связь.
[0075] В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (I-A) или Формулы (I-B):
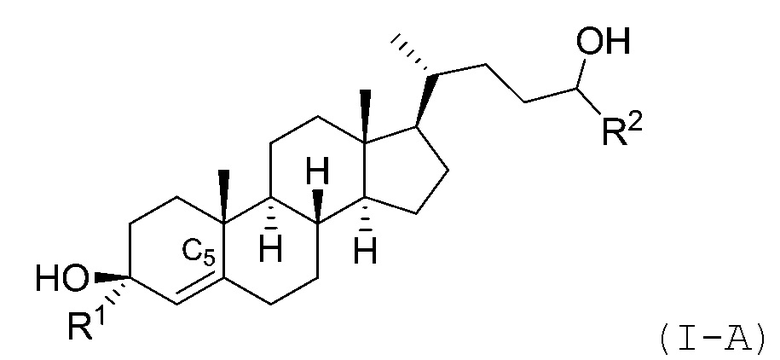 или
или 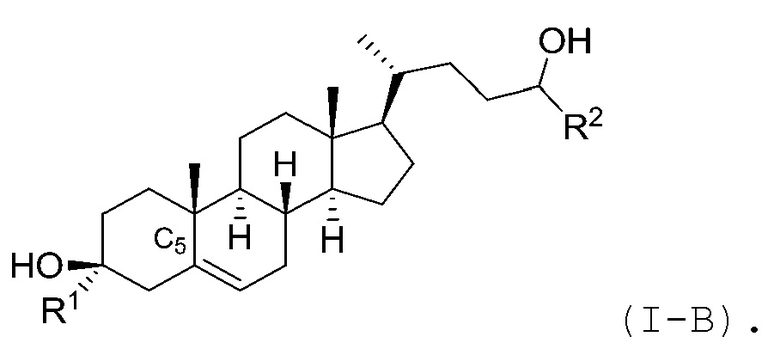
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (I-B-i) или Формулы (I-B-ii):
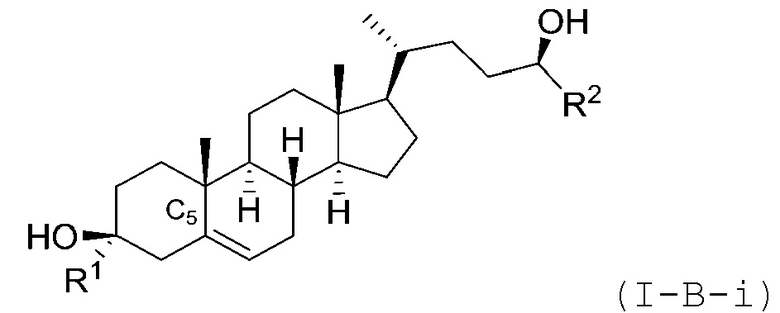 или
или 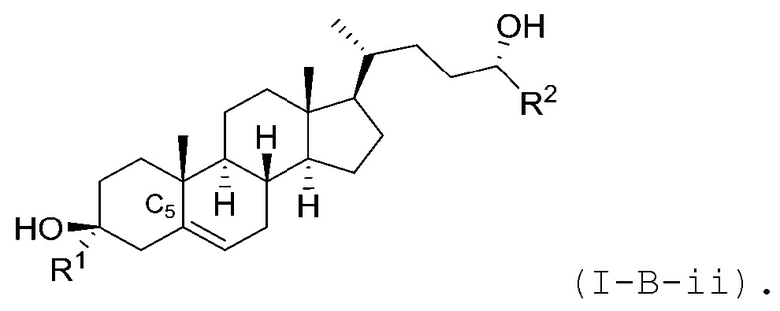
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (I-C):
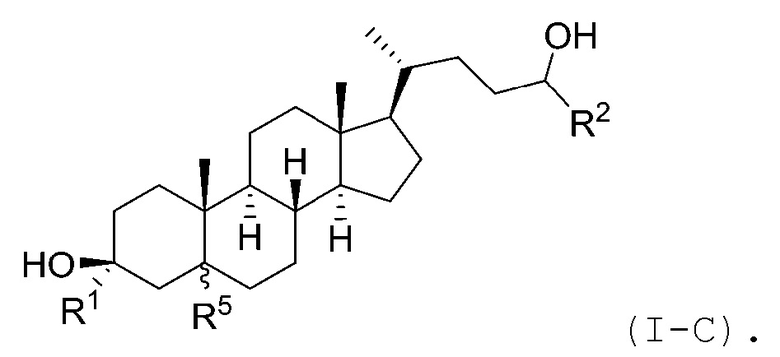 .
.
В некоторых вариантах осуществления соединение Формулы (I-C) является соединением Формулы (I-C-i) или (I-C-ii):
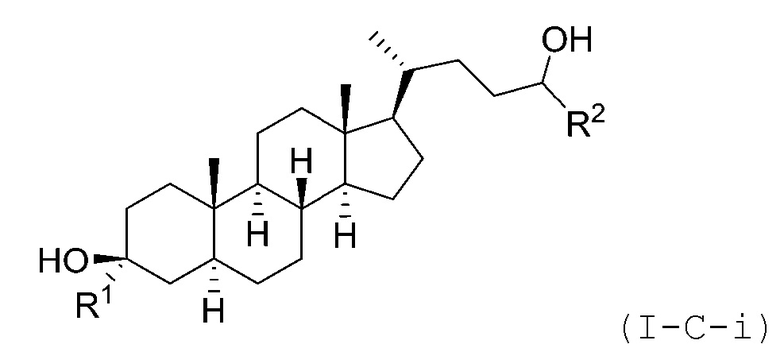 или
или 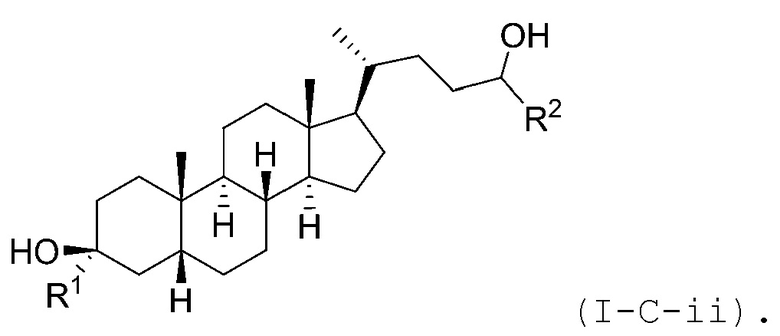
В некоторых вариантах осуществления соединение Формулы (I-C-i) является соединением Формулы (I-C-i-a) или (I-C-i-b):
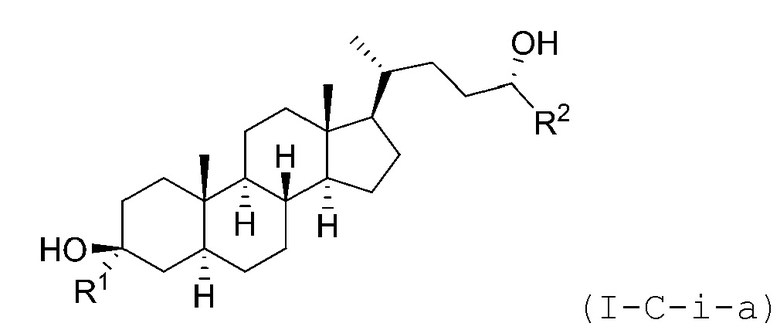 или
или 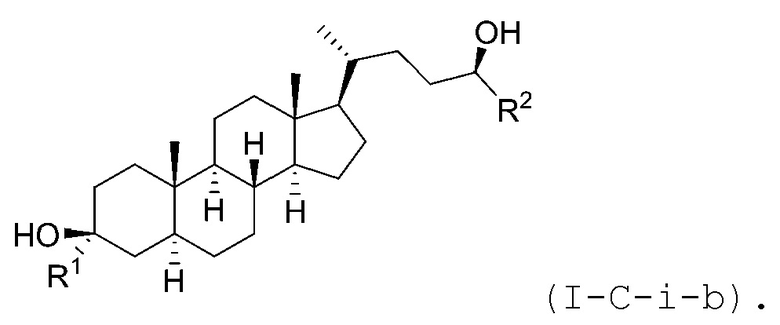
В некоторых вариантах осуществления соединение Формулы (I-C-ii) является соединением Формулы (I-C-ii-a) или (I-C-ii-b):
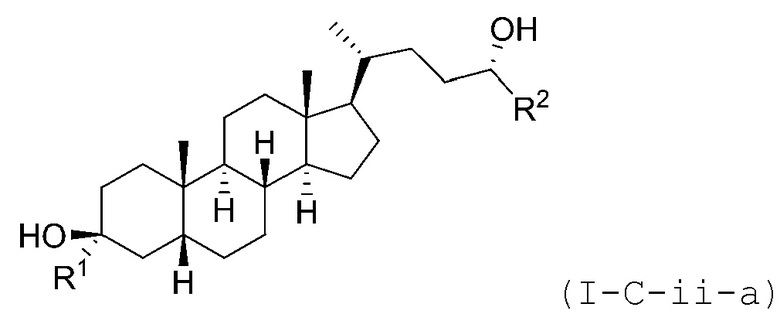 или
или 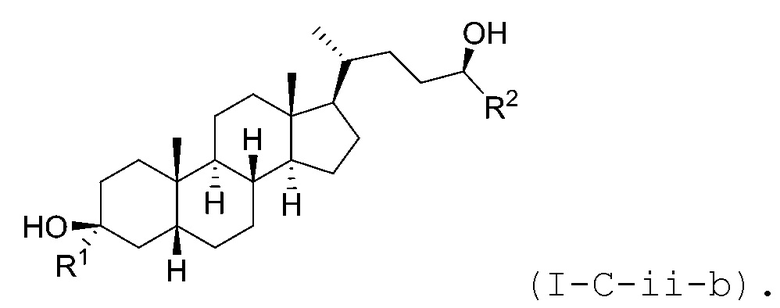
В некоторых вариантах осуществления R2 является C1-6 алкилом. В некоторых вариантах осуществления R2 является замещенным C1-6 алкилом. В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (II):
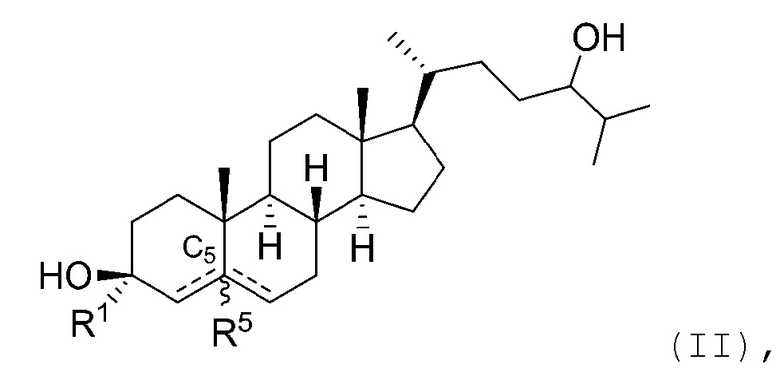
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (II) является соединением Формулы (II-A) или Формулы (II-B):
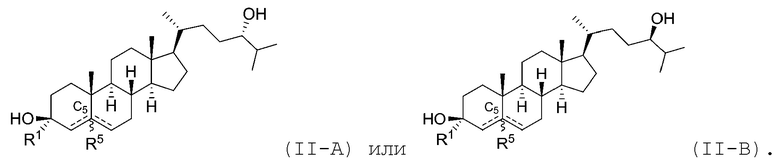
В некоторых вариантах осуществления соединение Формулы (II) является соединением Формулы (II-C) или Формулы (II-D):
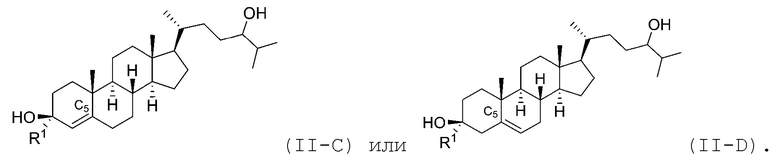
В некоторых вариантах осуществления соединение Формулы (II) является соединением Формулы (II-E):
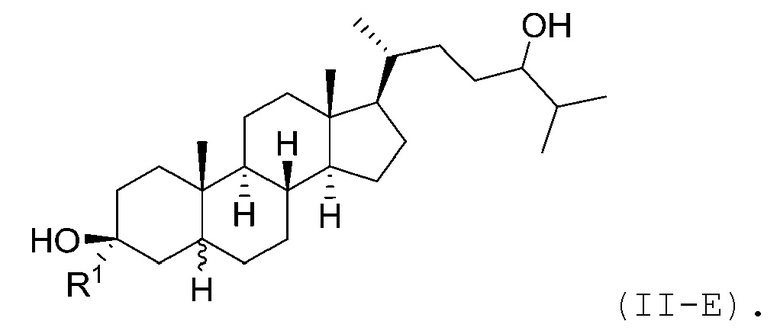
В некоторых вариантах осуществления соединение Формулы (II-E) является соединением Формулы (II-E-i) или Формулы (II-E-ii):
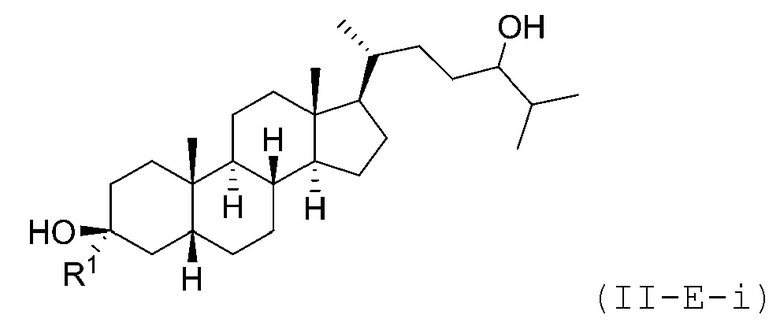 или
или 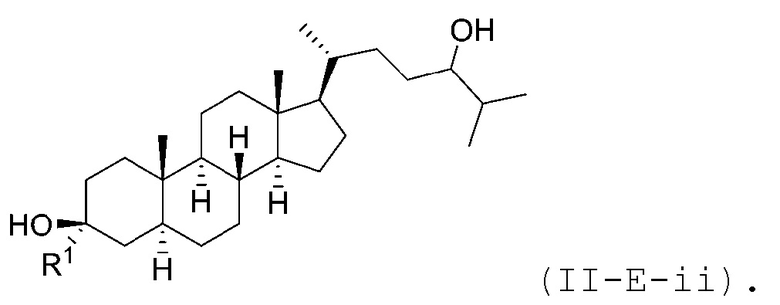
В некоторых вариантах осуществления соединение Формулы (II-E-i) является соединением Формулы (II-E-i-a) или Формулы (II-E-i-b):
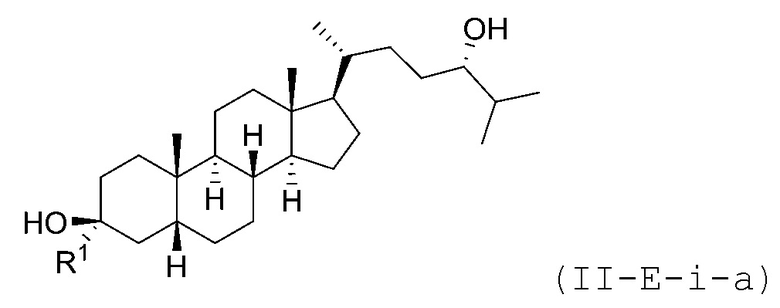 или
или 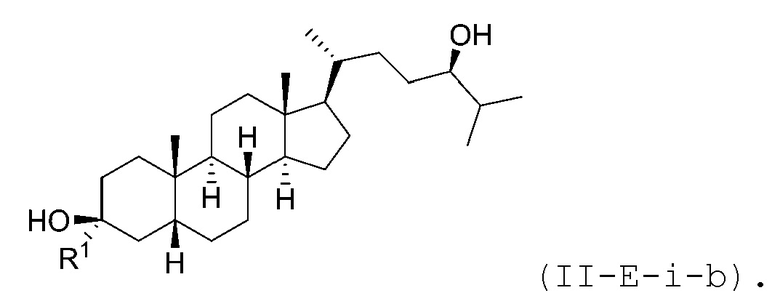
В некоторых вариантах осуществления соединение Формулы (II-E-ii) является соединением Формулы (II-E-ii-a) или Формулы (II-E-ii-b):
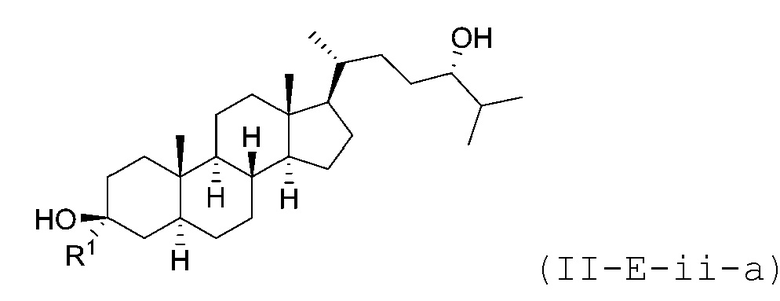 или
или 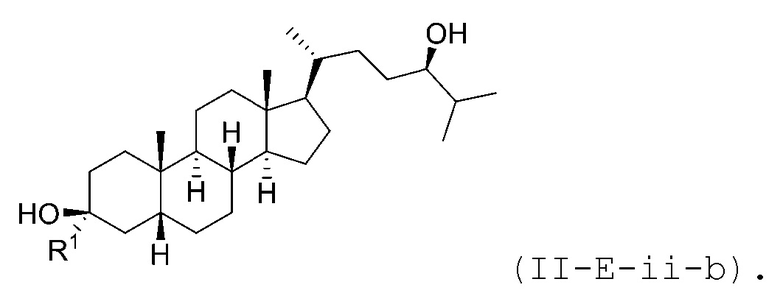
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (VII):
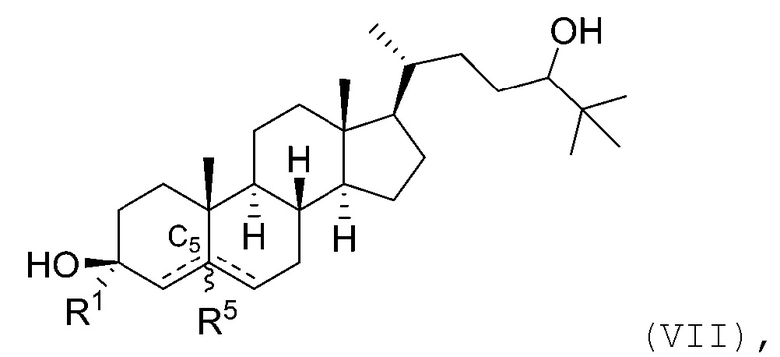
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (VII) является соединением Формулы (VII-A) или Формулы (VII-B):
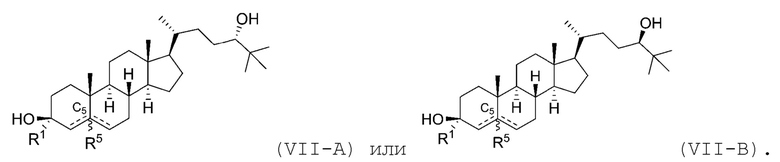
В некоторых вариантах осуществления соединение Формулы (VII) является соединением Формулы (VII-C) или Формулы (VII-D):
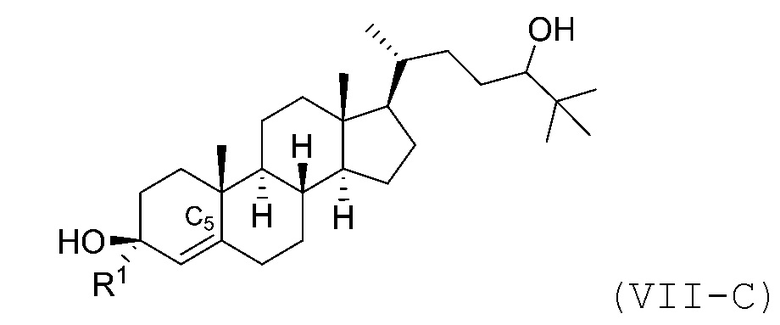 или
или
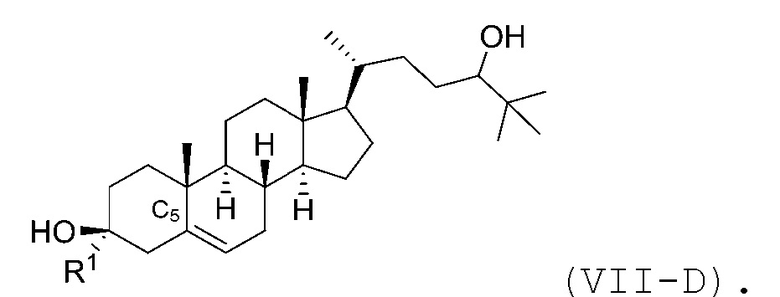
В некоторых вариантах осуществления соединение Формулы (VII) является соединением Формулы (VII-E):
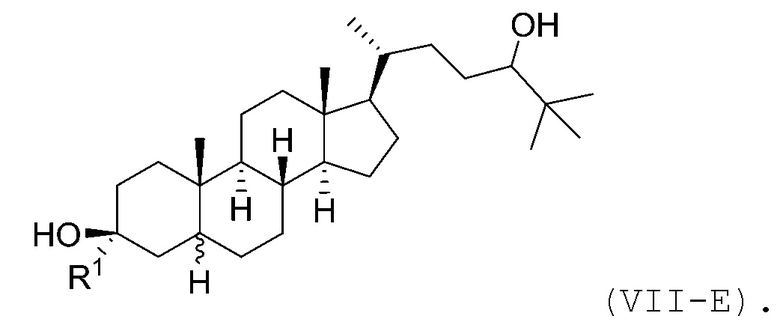
В некоторых вариантах осуществления соединение Формулы (VII-E) является соединением Формулы (VII-E-i) или Формулы (VII-E-ii):
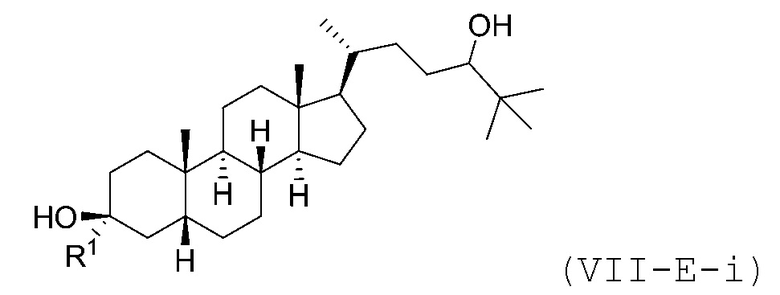 или
или 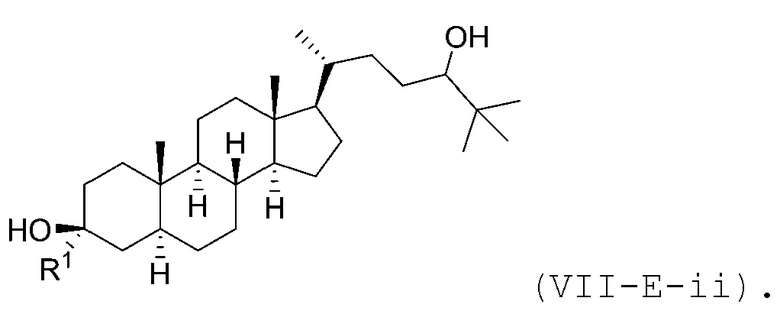
В некоторых вариантах осуществления соединение Формулы (VII-E-i) является соединением Формулы (VII-E-i-a) или Формулы (VII-E-i-b):
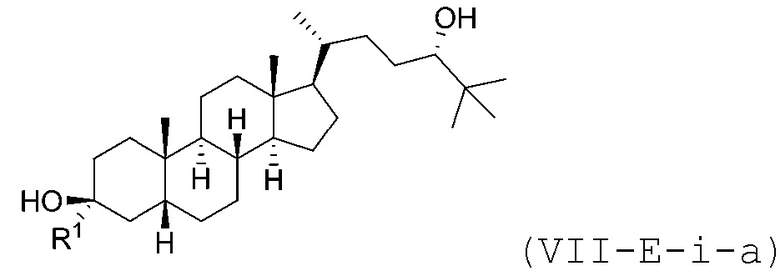 или
или 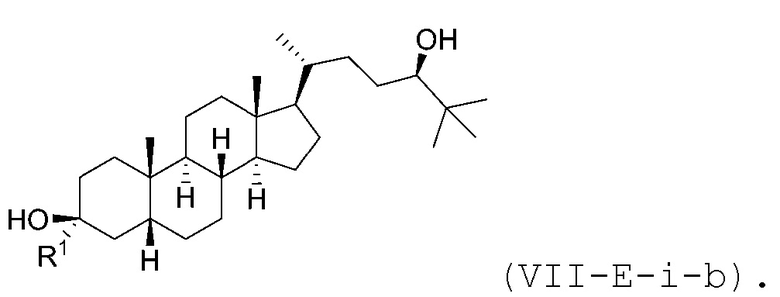
В некоторых вариантах осуществления соединение Формулы (VII-E-ii) является соединением Формулы (VII-E-ii-a) или Формулы (VII-E-ii-b):
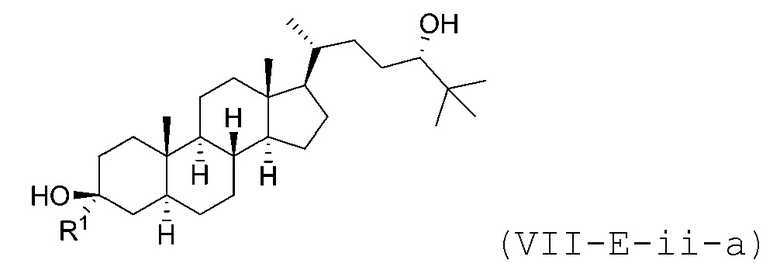 или
или 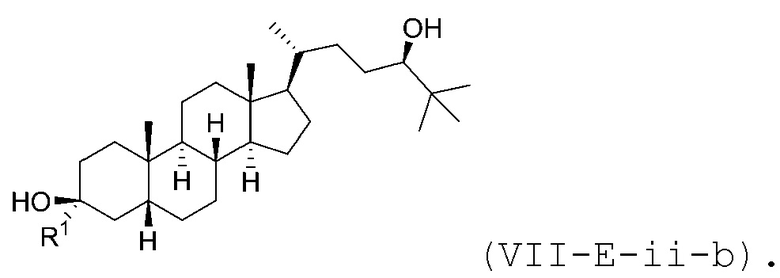
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (III):
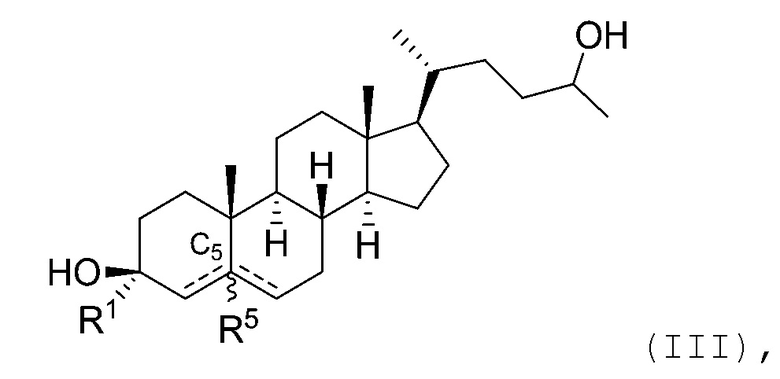
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (III) является соединением Формулы (III-A) или Формулы (III-B):
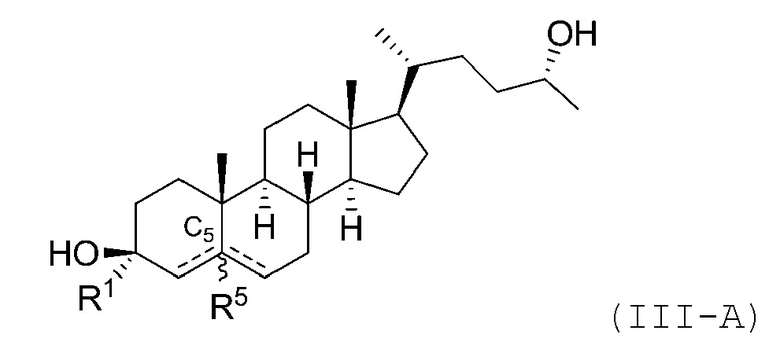 или
или 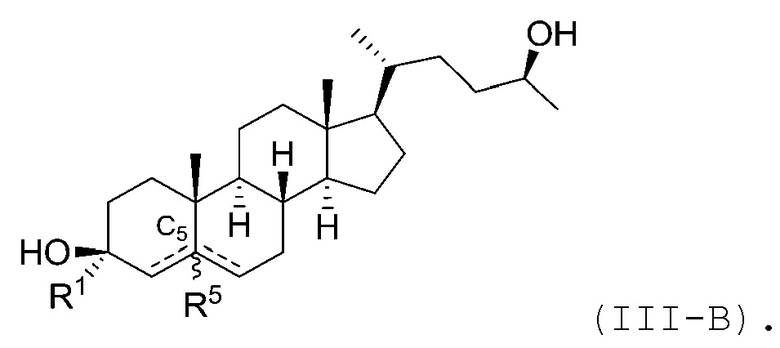
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (IV):
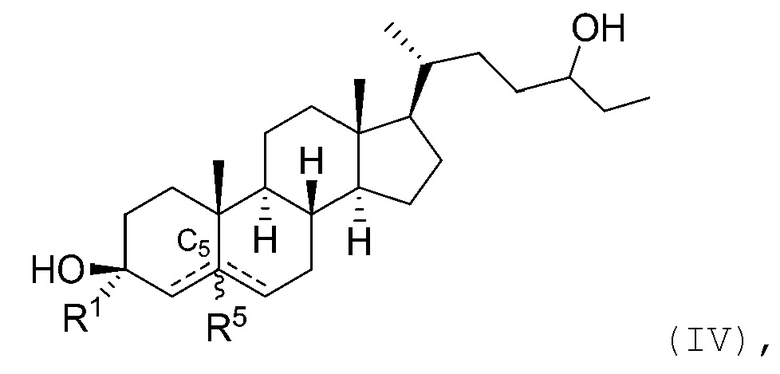
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (IV) является соединением Формулы (IV-A) или Формулы (IV-B):
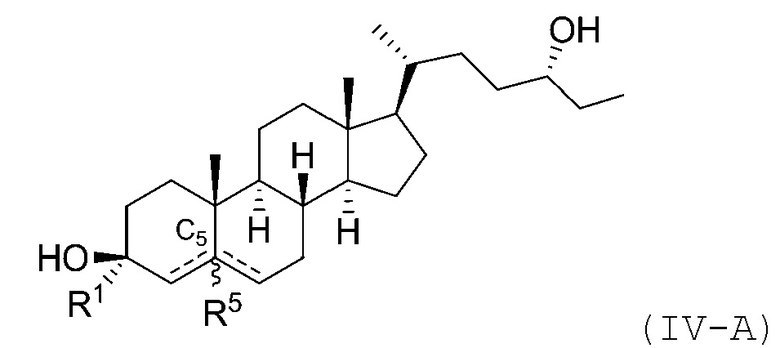 или
или 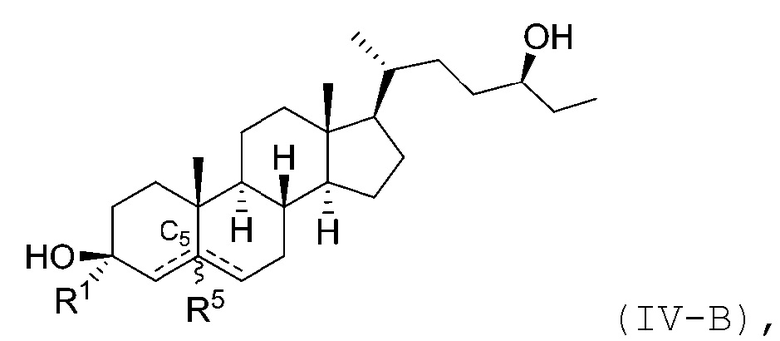
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления R2 является карбоциклилом или гетероциклилом. В некоторых вариантах осуществления R2 является карбоциклилом (например, циклопропилом, циклобутилом, циклопентилом, циклогексилом).
В некоторых вариантах осуществления R2 является гетероциклилом. В некоторых вариантах осуществления R2 является кислородсодержащим гетероциклом (например, тетрагидропираном).
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (V):
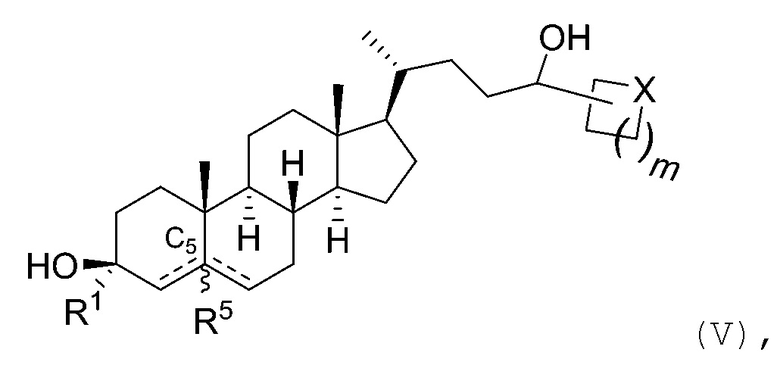
или его фармацевтически приемлемой солью, где X представляет собой -CH2-, -O-, -S- или -NRA-, и m является целым числом, выбранным из 0, 1, 2, 3, 4 или 5; где RA является водородом, алкилом, -C(O)RC, -C(O)N(RC)2 или -SO2N(RC)2; и каждый RC независимо является водородом, алкилом, арилом или гетероарилом. В некоторых вариантах осуществления X представляет собой -CH2-, -O-, -S- или -NH-.
В некоторых вариантах осуществления соединение Формулы (V) является соединением Формулы (V-A-i) или Формулы (V-A-ii):
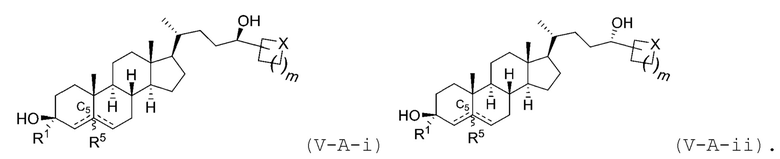
В некоторых вариантах осуществления соединение Формулы (V) является соединением Формулы (V-B):
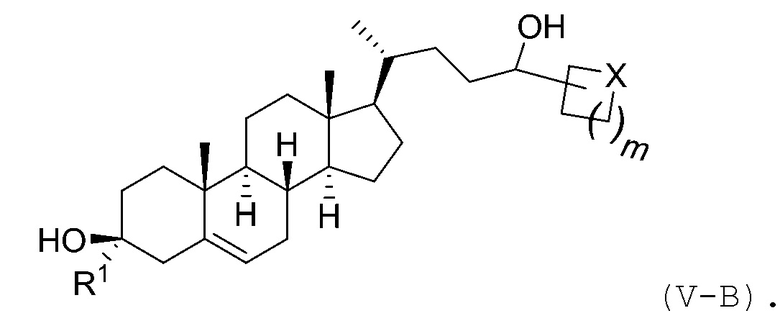
В некоторых вариантах осуществления X представляет собой -CH2-.
В некоторых вариантах осуществления X представляет собой -O-.
В некоторых вариантах осуществления m представляет собой 0, 1, 2 или 3.
В некоторых вариантах осуществления соединение Формулы (V) является соединением Формулы (V-B-i):
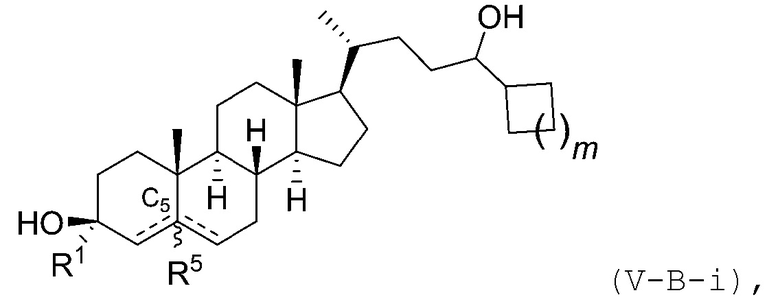
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (V) является соединением Формулы (V-C):
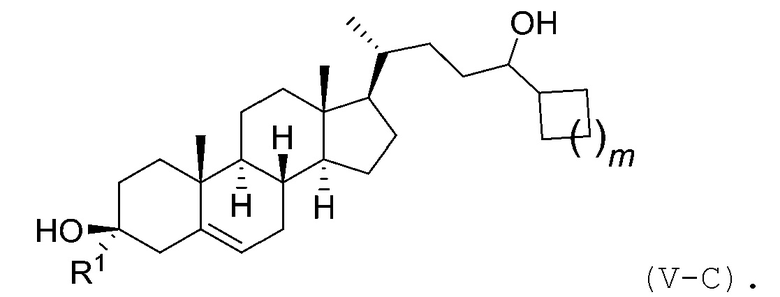
В некоторых вариантах осуществления соединение Формулы (I) является соединением Формулы (VI):
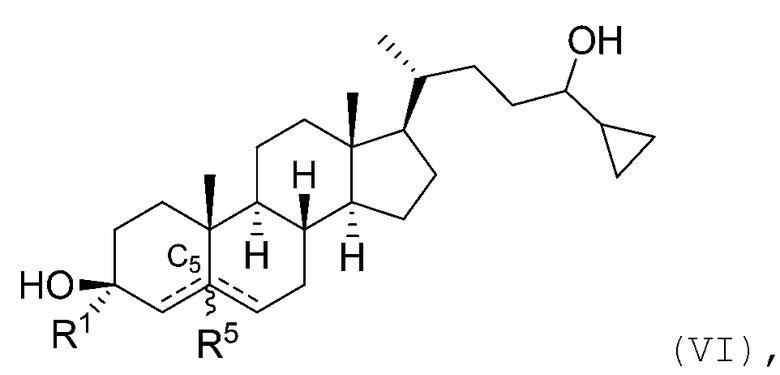
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления соединение Формулы (VI) является соединением Формулы (VI-A) или Формулы (VI-B):
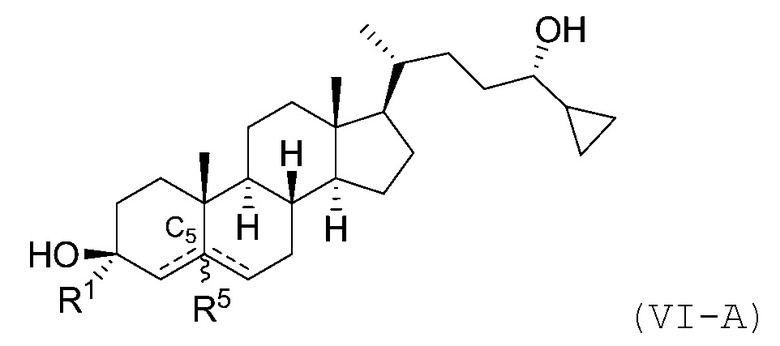 или
или 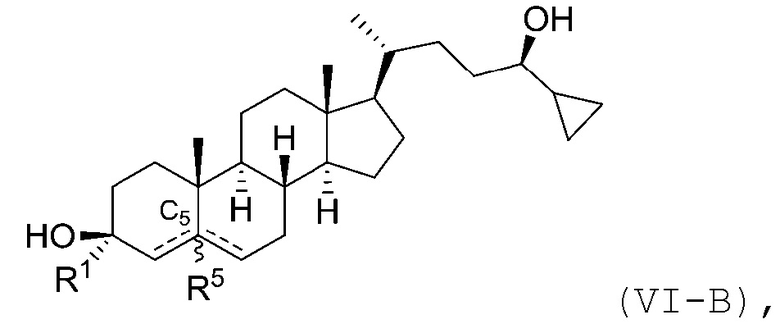
или его фармацевтически приемлемой солью.
В некоторых вариантах осуществления R1 является C1-6 алкилом. В некоторых вариантах осуществления R1 является метилом (например, -CH3, -CF3 или -CH2OCH3), этилом или изопропилом.
В некоторых вариантах осуществления R1 является метилом, этилом или изопропилом.
В некоторых вариантах осуществления соединение Формулы (I) выбрано из:
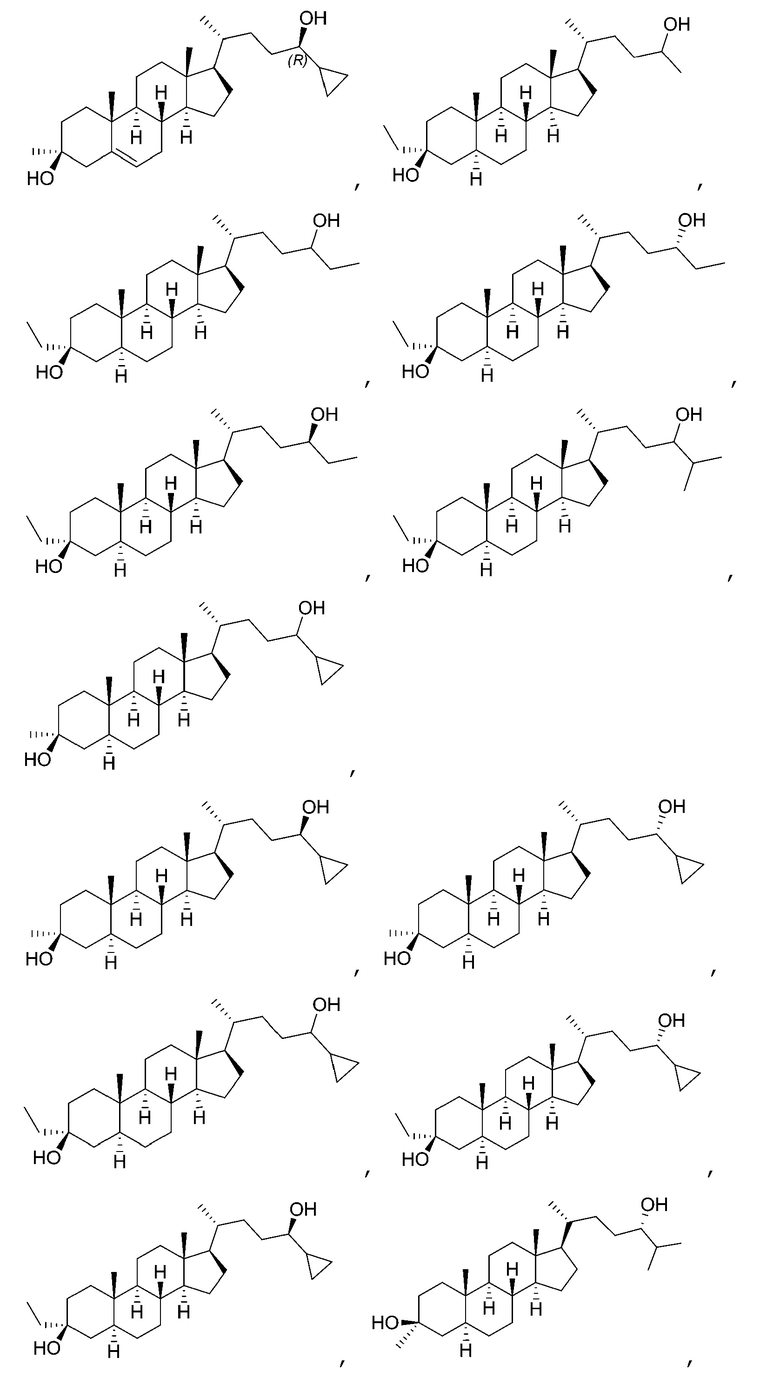
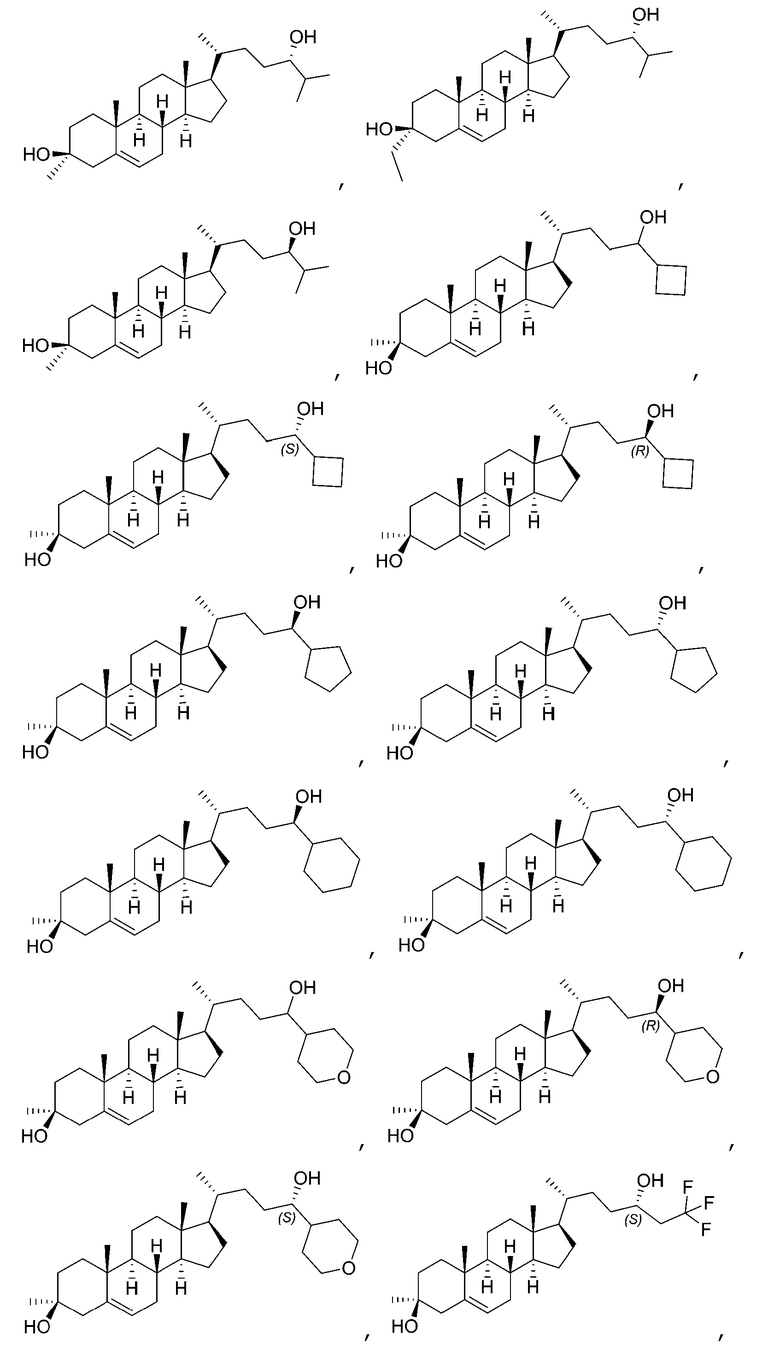
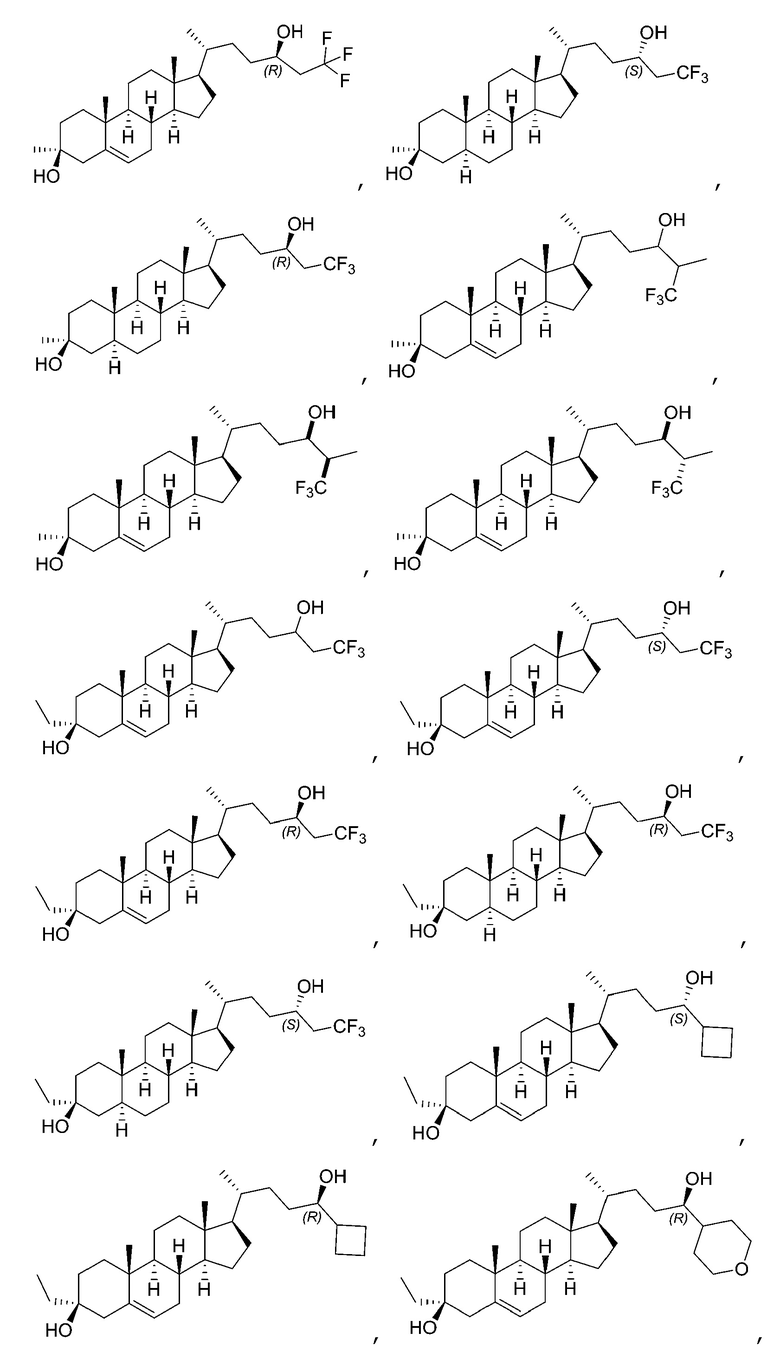
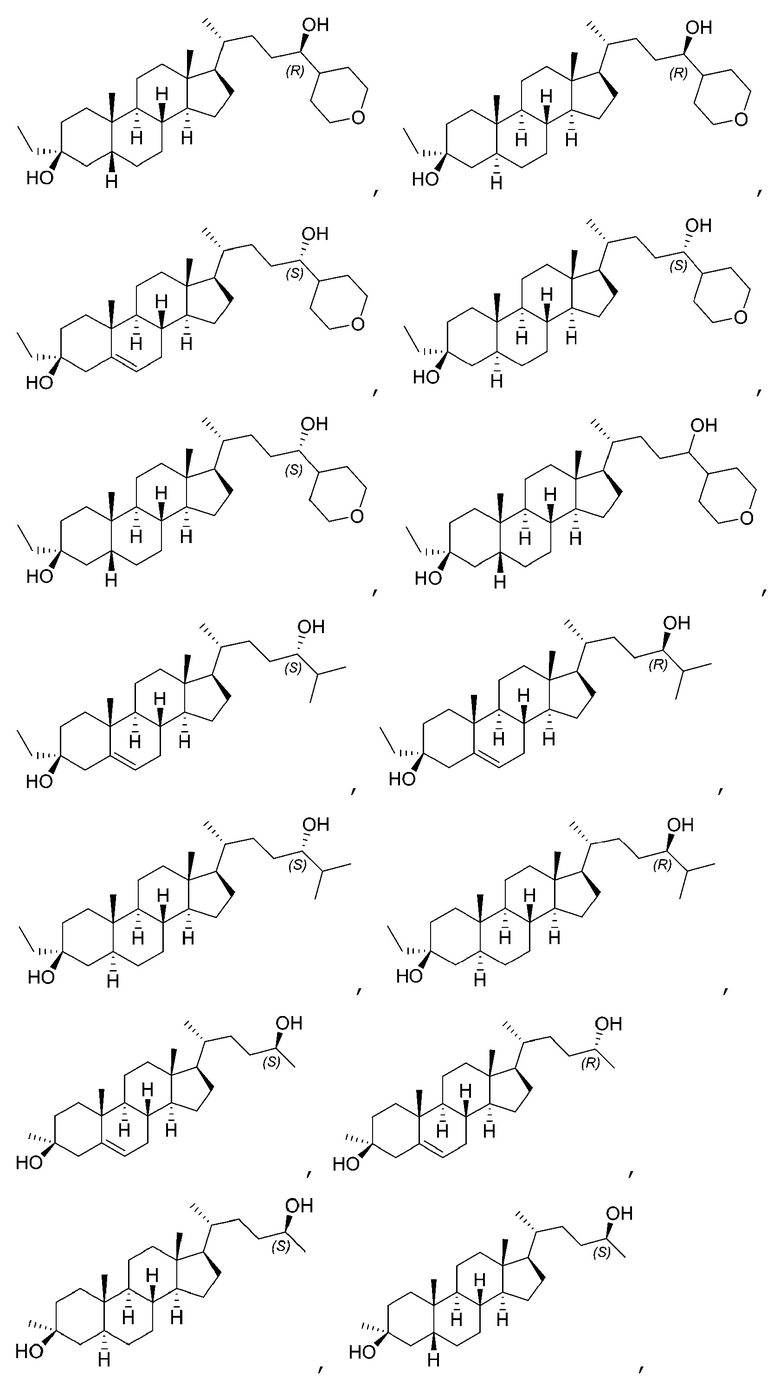
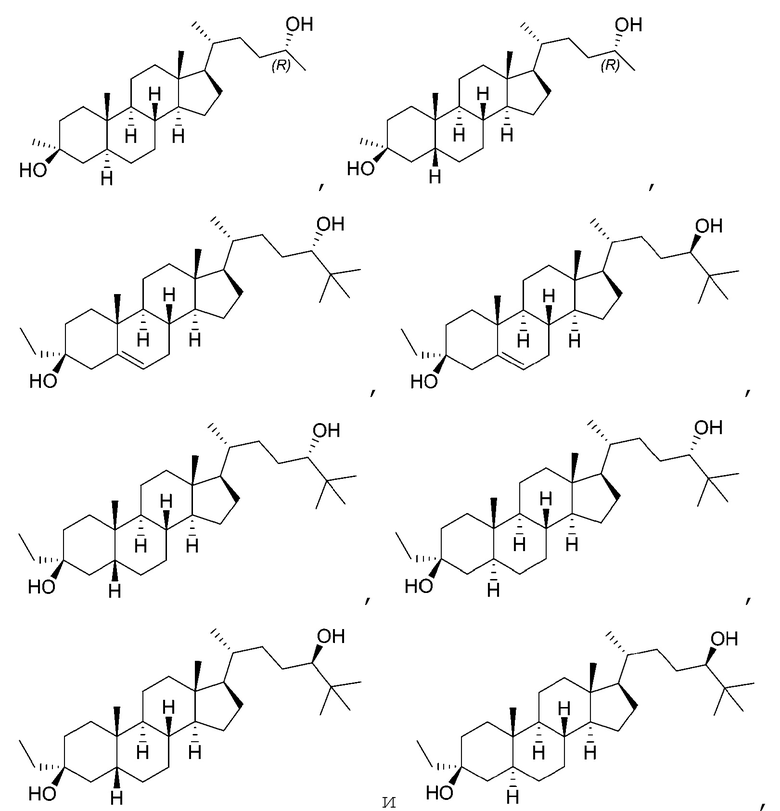
или их фармацевтически приемлемой соли.
В некоторых вариантах осуществления соединение Формулы (I) выбрано из:
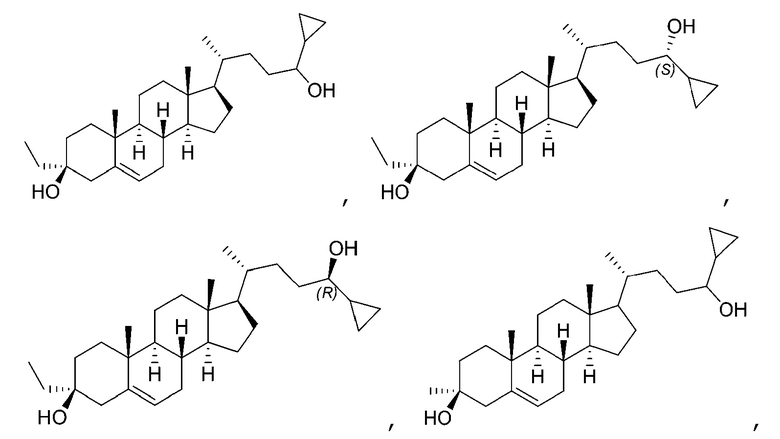
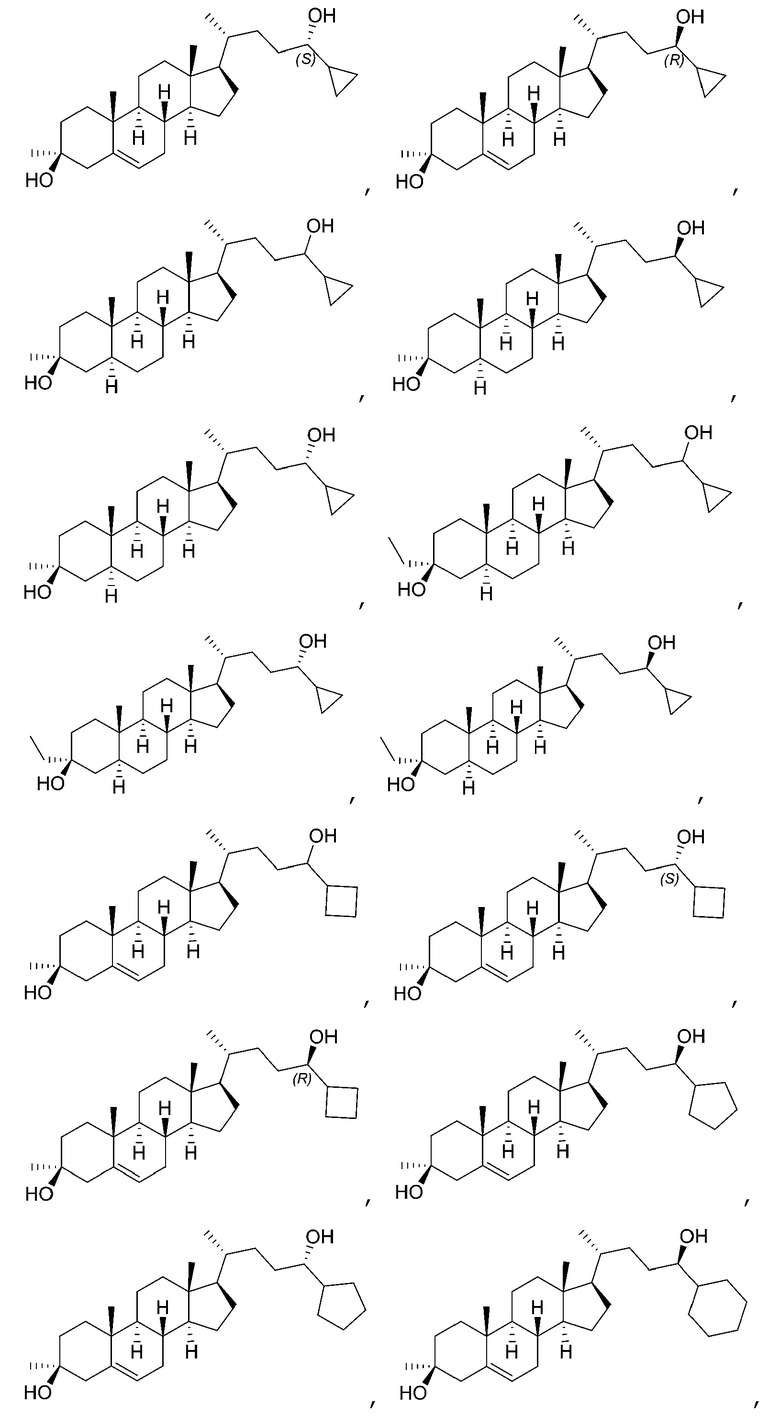
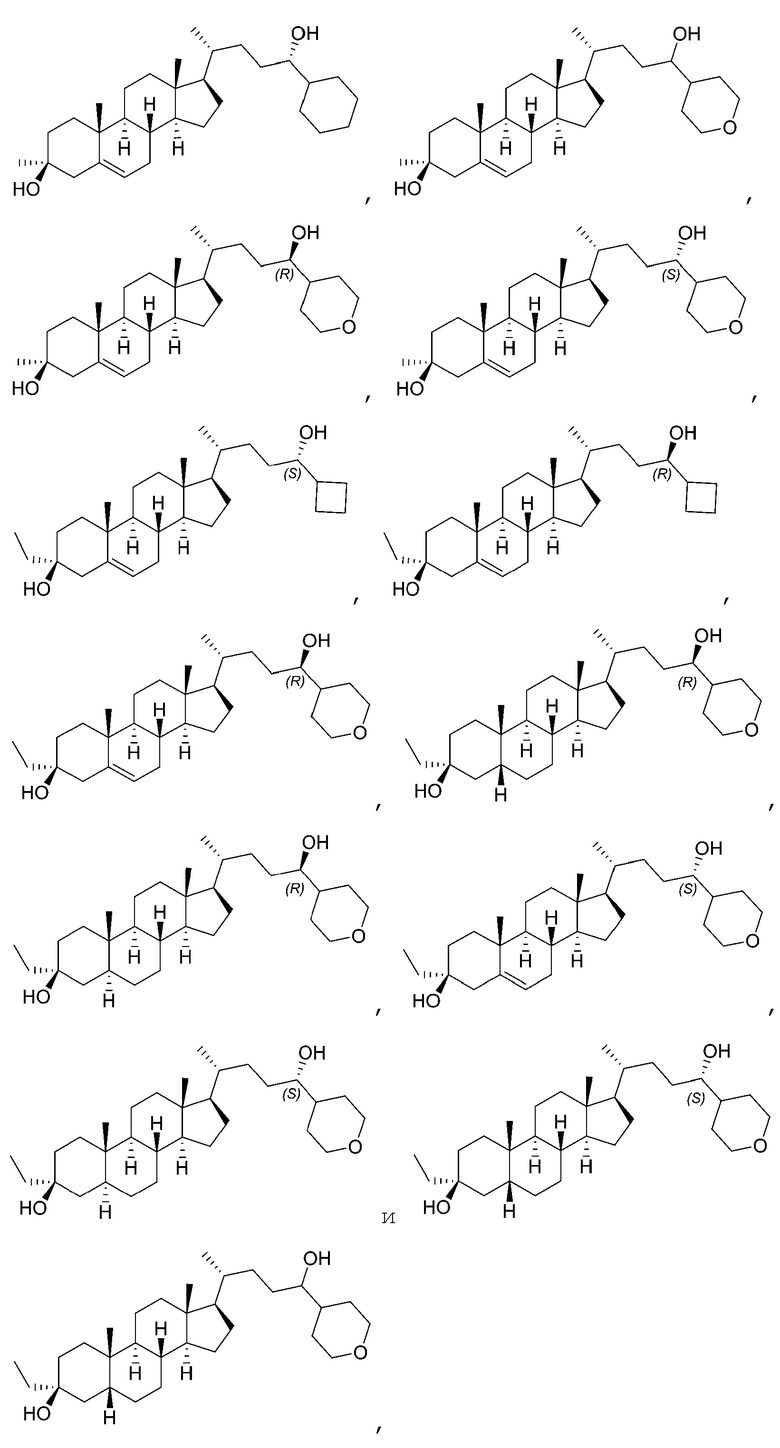
или их фармацевтически приемлемой соли.
Фармацевтические композиции
[0076] В другом аспекте изобретения предложена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и эффективное количество соединения, описанного в настоящей заявке (например, соединения Формулы (I)).
[0077] В случае применения в качестве лекарственных препаратов, соединения, предложенные в настоящей заявке, как правило, вводят в форме фармацевтической композиции. Такие композиции могут быть изготовлены способом, известным в области фармацевтики, и могут включать по меньшей мере одно активное соединение.
[0078] В одном варианте осуществления, в отношении фармацевтической композиции, носитель является носителем для парентерального, перорального или наружного применения.
[0079] Настоящее изобретение также относится к соединению, описанному в настоящей заявке (например, соединению Формулы (I) или его фармацевтической композиции), для применения в качестве лекарственного препарата или лекарственного средства.
[0080] Как правило, соединения, предложенные в настоящей заявке, вводят в терапевтически эффективном количестве. Количество соединения, вводимого фактически, как правило, будет определять врач с учетом соответствующих обстоятельств, включающих состояние, подлежащее лечению, выбранный путь введения, фактическое вводимое соединение, возраст, массу тела и отклик отдельного больного, тяжесть симптомов у больного и т.п.
[0081] Фармацевтические композиции, предложенные в настоящей заявке, можно вводить множеством путей, включающих пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. В зависимости от предполагаемого пути доставки, соединения, предложенные в настоящей заявке, предпочтительно изготовлены в форме композиций для инъекций или приема внутрь, или в виде предназначенных для трансдермального применения мазей, лосьонов или пластырей.
[0082] Композиции для перорального применения могут иметь форму нефасованных жидких растворов или суспензий, или нефасованных порошков. Однако чаще всего композиции представлены в стандартных лекарственных формах для облегчения точного дозирования. Термин "стандартная лекарственная форма" относится к физически дискретным единицам, подходящим в качестве стандартных доз для людей и других млекопитающих, при этом каждая единица содержит заданное количество активного материала, вычисленное так, чтобы оказывать требуемое терапевтическое воздействие, в сочетании с подходящим фармацевтическим вспомогательным веществом. Типичные стандартные лекарственные формы включают предварительно заполненные, дозированные ампулы или шприцы с жидкими композициями или пилюли, таблетки, капсулы и т.п. в случае твердых композиций. В таких композициях соединение обычно является минорным компонентом (от приблизительно 0,1 до приблизительно 50% по весу или предпочтительно от приблизительно 1 до приблизительно 40% по весу), а остальную часть составляют различные разбавители или носители и технологические добавки, требуемые для формования необходимой дозированной формы.
[0083] Жидкие формы, подходящие для перорального применения, могут включать подходящий водный или неводный разбавитель с буферными, суспендирующими и модифицирующими текучесть веществами, красителями, ароматизаторами и т.п. Твердые формы могут включать, например, любой из следующих компонентов или соединения с подобными свойствами: связующее вещество, такое как микрокристаллическую целлюлозу, трагакантовую камедь или желатин; вспомогательное вещество, такое как крахмал или лактозу, разрыхлитель, такой как альгиновую кислоту, Примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; скользящее вещество, такое как коллоидный диоксид кремния; подсластитель, такой как сахарозу или сахарин; или ароматическое вещество, такое как мяту перечную, метилсалицилат или апельсиновый ароматизатор.
[0084] Композиции для инъекций обычно основаны на стерильном растворе хлорида натрия или фосфатно-солевом буферном растворе для инъекций или других носителях для инъекций, известных в уровне техники. Как и выше, активное соединение в таких композициях обычно является минорным компонентом, часто составляющим от приблизительно 0,05 до 10% по весу, а остальную часть составляет носитель для инъекций и т.п.
[0085] Трансдермальные композиции, как правило, изготавливают в форме мази или крема для наружного применения, содержащих действующее вещество(а), обычно в количестве, изменяющемся в пределах от приблизительно 0,01 до приблизительно 20% по весу, предпочтительно от приблизительно 0,1 до приблизительно 20% по весу, предпочтительно от приблизительно 0,1 до приблизительно 10% по весу и более предпочтительно от приблизительно 0,5 до приблизительно 15% по весу. В случае изготовления в форме мази, действующие вещества, как правило, будут объединять либо с парафиновой, либо с водорастворимой мазевой основой. В альтернативе действующие вещества могут быть изготовлены в форме крема, например, с кремовой основой в виде эмульсии по типу масло в воде. Такие трансдермальные формы известны в уровне техники и обычно включают дополнительные компоненты для повышения проникновения в кожу или стабильности действующих веществ или лекарственной формы. Все такие известные трансдермальные формы и компоненты включены в объем настоящей заявки.
[0086] Соединения, предложенные в настоящей заявке, можно также вводить с помощью трансдермального устройства. Таким образом, трансдермальное введение может быть выполнено с применением трансдермального пластыря резервуарного типа или на основе пористой мембраны или твердой матрицы.
[0087] Вышеописанные компоненты композиций для перорального применения, для инъекций или наружного применения являются лишь репрезентативными. Другие материалы, а также методы обработки и т.п. приведены в 8 части Remington's Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, который включен в настоящую заявку посредством отсылки.
[0088] Вышеописанные компоненты композиций для перорального применения, для инъекций или наружного применения являются лишь репрезентативными. Другие материалы, а также методы обработки и т.п. приведены в 8 части Remington's The Science and Practice of Pharmacy, 21st edition, 2005, издатель: Lippincott Williams & Wilkins, который включен в настоящую заявку посредством отсылки.
[0089] Соединения согласно настоящему изобретению можно также вводить в формах с пролонгированным высвобождением или из систем доставки лекарственных средств с пролонгированным высвобождением. Описание репрезентативных материалов для пролонгированного высвобождения можно найти в Remington's Pharmaceutical Sciences.
[0090] Настоящее изобретение также относится к фармацевтически приемлемым лекарственным формам соединения, описанного в настоящей заявке (например, соединения Формулы (I)). В одном варианте осуществления лекарственная форма включает воду. В другом варианте осуществления лекарственная форма включает производное циклодекстрина. Наиболее распространенными циклодекстринами являются α-, β- и γ-циклодекстрины, состоящие из 6, 7 и 8 α-1,4-связанных глюкозных звеньев, соответственно, необязательно включающие один или более заместителей на связанных сахарных остатках, которые включают, без ограничения перечисленными, метилированное, гидроксиалкилированное, ацилированное и сульфоалкилэфирное замещение. В некоторых вариантах осуществления циклодекстрин является сульфоалкилэфиром β-циклодекстрина, например, сульфобутиловым эфиром β-циклодекстрина, также известным как Captisol®. См., например, U.S. 5,376,645. В некоторых вариантах осуществления лекарственная форма включает гексапропил-β-циклодекстрин. В более конкретном варианте лекарственная форма включает гексапропил-β-циклодекстрин (10-50% в воде).
[0091] Настоящее изобретение также относится к фармацевтически приемлемой соли присоединения кислоты соединения, описанного в настоящей заявке (например, соединения Формулы (I)). Кислота, которая может применяться для получения фармацевтически приемлемой соли, является такой кислотой, которая образует нетоксичную соль присоединения кислоты, т.е. соль, содержащую фармакологически приемлемые анионы, такие как гидрохлорид, гидроиодид, гидробромид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат, сукцинат, малеат, фумарат, бензоат, пара-толуолсульфонат и т.п.
[0092] Следующие примеры лекарственных форм иллюстрируют репрезентативные фармацевтические композиции, которые могут быть изготовлены в соответствии с настоящим изобретением. Впрочем, настоящее изобретение не ограничивается следующими фармацевтическими композициями.
[0093] Пример лекарственной формы 1 - Таблетки: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемая соль), может быть смешано в виде сухого порошка с сухим связующим веществом желатином в приблизительном отношении 1:2 по весу. Небольшое количество стеарата магния добавляют в качестве смазывающего вещества. Смесь формуют в таблетки по 240-270 мг (по 80-90 мг активного соединения в таблетке) в таблеточном прессе.
[0094] Пример лекарственной формы 2 - Капсулы: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемая соль), может быть смешано в виде сухого порошка с разбавителем крахмалом в приблизительном отношении 1:1 по весу. Смесью наполняют капсулы 250 мг (по 125 мг активного соединения в капсуле).
[0095] Пример лекарственной формы 3 - Жидкость: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемая соль), (125 мг) может быть смешано с сахарозой (1,75 г) и ксантановой камедью (4 мг), и полученная смесь может быть смешана, пропущена через сито с ячейками 2 мм (US меш 10), а затем смешана с ранее приготовленным раствором микрокристаллической целлюлозы и натрия карбоксиметилцеллюлозы (11:89, 50 мг) в воде. Бензоат натрия (10 мг), ароматизатор и краситель разбавляют водой и добавляют при перемешивании. Достаточное количество воды может быть затем добавлено для получения общего объема 5 мл.
[0096] Пример лекарственной формы 4 - Таблетки: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемой соли), может быть смешано в виде сухого порошка с сухим связующим веществом желатином в приблизительном отношении 1:2 по весу. Небольшое количество стеарата магния добавляют в качестве смазывающего вещества. Смесь формуют в таблетки по 450-900 мг (по 150-300 мг активного соединения) в таблеточном прессе.
[0097] Пример лекарственной формы 5 - Раствор для инъекций: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемая соль), может быть растворено или суспендировано в стерильной водной буферной солевой среде для инъекций до концентрации приблизительно 5 мг/мл.
[0098] Пример лекарственной формы 6 - Таблетки: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемая соль), может быть смешано в виде сухого порошка с сухим связующим веществом желатином в приблизительном отношении 1:2 по весу. Небольшое количество стеарата магния добавляют в качестве смазывающего вещества. Смесь формуют в таблетки по 90-150 мг (по 30-50 мг активного соединения в таблетке) в таблеточном прессе.
[0099] Пример лекарственной формы 7 - Таблетки: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемая соль), может быть смешано в виде сухого порошка с сухим связующим веществом желатином в приблизительном отношении 1:2 по весу. Небольшое количество стеарата магния добавляют в качестве смазывающего вещества. Смесь формуют в таблетки по 30-90 мг (по 10-30 мг активного соединения в таблетке) в таблеточном прессе.
[00100] Пример лекарственной формы 8 - Таблетки: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемая соль), может быть смешано в виде сухого порошка с сухим связующим веществом желатином в приблизительном отношении 1:2 по весу. Небольшое количество стеарата магния добавляют в качестве смазывающего вещества. Смесь формуют в таблетки по 0,3-30 мг (по 0,1-10 мг активного соединения в таблетке) в таблеточном прессе.
[00101] Пример лекарственной формы 9 - Таблетки: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемая соль), может быть смешано в виде сухого порошка с сухим связующим веществом желатином в приблизительном отношении 1:2 по весу. Небольшое количество стеарата магния добавляют в качестве смазывающего вещества. Смесь формуют в таблетки по 150-240 мг (по 50-80 мг активного соединения в таблетке) в таблеточном прессе.
[00102] Пример лекарственной формы 10 - Таблетки: Соединение, описанное в настоящей заявке (например, соединение Формулы (I) или его фармацевтически приемлемая соль), может быть смешано в виде сухого порошка с сухим связующим веществом желатином в приблизительном отношении 1:2 по весу. Небольшое количество стеарата магния добавляют в качестве смазывающего вещества. Смесь формуют в таблетки по 270-450 мг (по 90-150 мг активного соединения в таблетке) в таблеточном прессе.
[00103] Уровни дозы при инъекции изменяются в пределах от приблизительно 0,1 мг/кг/час до по меньшей мере 10 мг/кг/час, в течение от приблизительно 1 до приблизительно 120 часов, и в особенности 24-96 часов. Предварительную насыщающую болюсную инъекцию от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг или больше также могут вводить для достижения соответствующих уровней в стационарном состоянии. Максимальная суммарная доза, как ожидают, не будет превышать приблизительно 2 г/день для пациента весом 40-80 кг.
[00104] Для профилактики и/или лечения хронических заболеваний схема лечения обычно длится многие месяцы или годы, таким образом, прием внутрь предпочтителен для удобства и переносимости пациента. В случае приема внутрь репрезентативные схемы включают одну - пять и, в особенности, две - четыре и, как правило, три пероральных дозы в сутки. При использовании таких схем дозирования, каждая доза обеспечивает от приблизительно 0,01 до приблизительно 20 мг/кг соединения, предложенного в настоящей заявке, при этом каждая из предпочтительных доз обеспечивает от приблизительно 0,1 до приблизительно 10 мг/кг и, в особенности, от приблизительно 1 до приблизительно 5 мг/кг.
[00105] Трансдермальные дозы обычно подбирают так, чтобы они обеспечивали подобные или более низкие концентрации в крови, чем достигаемые при использовании доз для инъекции.
[00106] В случае применения для предотвращения возникновения расстройства ЦНС, соединения, предложенные в настоящей заявке, будут вводить субъекту, подверженному риску развития состояния, как правило, по совету и под наблюдением врача, при уровнях дозы, описанных выше. Субъекты, подверженные риску развития конкретного состояния, обычно включают субъектов, близкие родственники которых имели случаи такого состояния, или субъектов, которые по результатам генетического исследования или скрининга подвергаются особому риску развития такого состояния.
Способы лечения и применения
[00107] Соединения настоящего изобретения (например, соединение Формулы (I) и его фармацевтически приемлемые соли), как описано в настоящей заявке, обычно разработаны для модуляции функции NMDA и, таким образом, для действия в качестве оксистеролов для лечения и профилактики, например, ЦНС-связанных состояний у субъекта. В некоторых вариантах осуществления соединения, описанные в настоящей заявке (например, соединение Формулы (I) и его фармацевтически приемлемые соли), как описано в настоящей заявке, обычно разработаны для прохождения через гематоэнцефалический барьер (например, разработаны с возможностью транспорта через гематоэнцефалический барьер). Модуляция, при использовании в настоящей заявке, относится, например, к ингибированию или потенцированию функции NMDA-рецепторов. В некоторых вариантах осуществления соединение, описанное в настоящей заявке (например, соединение Формулы (I) и его фармацевтически приемлемые соли), может действовать в качестве отрицательного аллостерического модулятора (NAM) NMDA и ингибировать функцию NMDA-рецепторов. В некоторых вариантах осуществления настоящего изобретения, например, соединение Формулы (I) или его фармацевтически приемлемая соль могут действовать в качестве положительных аллостерических модуляторов (PAM) NMDA и потенцировать функции NMDA-рецепторов. В некоторых вариантах осуществления соединение, описанное в настоящей заявке (например, соединение Формулы (I) и его фармацевтически приемлемые соли), модулирует функцию NMDA, но не действует как отрицательный аллостерический модулятор (NAM) или положительный аллостерический модулятор (PAM) NMDA.
[00108] В некоторых вариантах осуществления нарушением является рак. В некоторых вариантах осуществления нарушением является диабет. В некоторых вариантах осуществления нарушением является нарушение синтеза стеринов. В некоторых вариантах осуществления нарушением является нарушение со стороны желудочно-кишечного тракта (ЖКТ), например, запор, синдром раздраженного кишечника (СРК), воспалительное заболевание кишечника (ВЗК) (например, неспецифический язвенный колит, болезнь Крона), структурные нарушения, влияющие на ЖКТ, нарушения в анальной области (например, геморрой, внутренний геморрой, наружный геморрой, анальные трещины, перианальные абсцессы, анальный свищ), полипы толстой кишки, рак, колит. В некоторых вариантах осуществления нарушением является воспалительное заболевание кишечника.
[00109] В некоторых вариантах осуществления является Синдром Смита-Лемли-Опица (СЛОС). В некоторых вариантах осуществления нарушением является десмостеролоз. В некоторых вариантах осуществления нарушением является ситостеролемия. В некоторых вариантах осуществления нарушением является церебросухожильный ксантоматоз (ЦСК). В некоторых вариантах осуществления нарушением является дефицит мевалонаткиназы (ДМК). В некоторых вариантах осуществления нарушением является мутация гена SC4MOL (дефицит СМО). В некоторых вариантах осуществления нарушением является болезнь Ниманна-Пика. В некоторых вариантах осуществления нарушением является расстройство аутистического спектра (ASD). В некоторых вариантах осуществления нарушение связано с фенилкетонурией.
[00110] Примеры состояний, связанных с модуляцией NMDA, включают, без ограничения перечисленными, нарушение со стороны желудочно-кишечного тракта (ЖКТ), например, запор, синдром раздраженного кишечника (СРК), воспалительное заболевание кишечника (ВЗК) (например, неспецифический язвенный колит, болезнь Крона), структурные нарушения, влияющие на ЖКТ, нарушения в анальной области (например, геморрой, внутренний геморрой, наружный геморрой, анальные трещины, перианальные абсцессы, анальный свищ), полипы толстой кишки, рак, колит, и заболевания ЦНС, например, как описано в настоящей заявке.
[00111] Примеры заболеваний ЦНС, связанных с модуляцией NMDA, включают, без ограничения перечисленными, расстройства адаптации, тревожные расстройства (в том числе обсессивно-компульсивное расстройство, посттравматическое стрессовое расстройство, социальную фобию, генерализованное тревожное расстройство), когнитивные расстройства (в том числе болезнь Альцгеймера и другие формы деменции (например, лобно-височную деменцию)), диссоциативные расстройства, расстройства питания, расстройства настроения (в том числе депрессию (например, послеродовую депрессию), биполярное расстройство, дистимическое расстройство, суицидальные проявления), шизофрению или другие психотические расстройства (в том числе шизоаффективное расстройство), нарушения сна (в том числе бессонницу), расстройства, связанные с употреблением психоактивных веществ, расстройства личности (в том числе обсессивно-компульсивное расстройство личности), расстройства аутистического спектра (в том числе связанные с мутациями в группе белков Shank (например, Shank3)), нарушения нервно-психического развития (в том числе синдром Ретта), рассеянный склероз, нарушения синтеза стеринов, боль (в том числе острую и хроническую боль, головные боли, например, мигренозные головные боли), эпилептические расстройства (в том числе эпилептический статус и моногенные формы эпилепсии, такие как синдром Драве и комплекс туберозного склероза (КТС)), инсульт, травматическое повреждение головного мозга, двигательные расстройства (в том числе болезнь Хантингтона и болезнь Паркинсона) и тиннитус. В некоторых вариантах осуществления соединение настоящего изобретения, например, соединение Формулы (I) и его фармацевтически приемлемые соли, может применяться для индукции седативного эффекта или анестезии. В некоторых вариантах осуществления соединение, описанное в настоящей заявке (например, соединение Формулы (I) и его фармацевтически приемлемые соли), может применяться при лечении или профилактике расстройств адаптации, тревожных расстройств, когнитивных расстройств, диссоциативных расстройств, расстройств питания, расстройств настроения, шизофрении или других психотических расстройств, нарушений сна, расстройств, связанных с употреблением психоактивных веществ, изменений личности, расстройств аутистического спектра, нарушений нервно-психического развития, нарушений синтеза стеринов, боли, эпилепсии, инсульта, травматического повреждения головного мозга, двигательных расстройств и нарушения зрения, потери слуха и тиннитуса. В некоторых вариантах осуществления нарушением является болезнь Хантингтона. В некоторых вариантах осуществления нарушением является болезнь Паркинсона. В некоторых вариантах осуществления нарушением является воспалительное заболевание (например, волчанка).
[00112] В другом аспекте предложен способ лечения или предотвращения возбудимости головного мозга у субъекта, подверженного риску развития или страдающего состоянием, связанным с возбудимостью головного мозга, включающий введение субъекту эффективного количества соединения настоящего изобретения, например, соединения Формулы (I) или его фармацевтически приемлемой соли.
[00113] В еще одном аспекте настоящего изобретения предложена комбинация соединения настоящего изобретения, например, соединения Формулы (I), или его фармацевтически приемлемой соли и другого фармакологически активного компонента. Соединения, предложенные в настоящей заявке, можно вводить в качестве единственного активного компонента, или их можно вводить в комбинации с другими средствами. Введение в комбинации можно выполнять с помощью любой методики, известной специалистам в данной области, включая, например, раздельное, последовательное, параллельное и поочередное введение.
Заболевания и нарушения
В настоящей заявке описаны способы лечения нарушения синтеза стеринов. Примеры нарушений описаны в настоящей заявке. Способы включают введение субъекту, например субъекту, страдающему нарушением синтеза стеринов, таким как СЛОС, соединения, модулирующего NMDA-рецепторы. Примеры соединений описаны в настоящей заявке.
Нарушения синтеза стеринов
[00114] В одном аспекте, в настоящей заявке описаны способы лечения нарушения синтеза стеринов. Холестерин играет важную роль в росте и развитии. Это - мембранный липид и предшественник многих молекул, которые играют важные роли в клеточном росте и дифференцировке, гликозилировании белков и сигнальных путях. Биосинтез холестерина включает множество ферментов и промежуточных соединений. Нарушения, вызванные дефицитом какого-либо из ферментов, участвующих в биосинтезе холестерина, приводят к накоплению промежуточных соединений и нарушению равновесия между биомолекулами, что приводит к нарушениям, включающим врожденные скелетные деформации, дисморфию черт лица, психомоторную заторможенность и задержку физического развития. В варианте осуществления нарушение синтеза стеринов или симптом нарушения синтеза стеринов можно лечить путем введения субъекту, страдающему нарушением синтеза стеринов, соединения, описанного в настоящей заявке, такого как соединения, модулирующего NMDA-рецепторы, как описано в настоящей заявке. Дополнительные нарушения описаны ниже.
Синдром Смита-Лемли-Опица
[00115] В одном аспекте, в настоящей заявке описаны способы лечения синдрома Смита-Лемли-Опица (или СЛОС, или дефицита 7-дегидрохолестерин-редуктазы). СЛОС является врожденным нарушением синтеза холестерина. В дополнение к микроцефалии, умеренной или тяжелой умственной отсталости, сенсорной гиперчувствительности, стереотипному поведению, дисморфии черт лица и синдактилии второго/третьего пальцев ног, характерным признаком данного заболевания являются пониженные уровни церебростерола (24(S)-гидроксихолестерина). СЛОС является аутосомно-рецессивным наследственным заболеванием, вызванным дефицитом конечного фермента в пути синтеза холестерина, и вызывает низкие, или соответствующие нижней границе нормальных значений, уровни холестерина в плазме и повышенные уровни 7- и 8-дегидрохолестерина (ДГХ; 7-ДГХ и 8-ДГХ). Общие методы лечения, применяемые в настоящее время, включают добавление холестерина в рацион, лечение ингибиторами 3-гидрокси-3-метилглутарил-кофермент A-редуктазы (ингибиторами ГМГ-КоА-редуктазы, также известными как статины) и лечение средствами, которые повышают синтез и/или накопление холестерина; и уменьшают накопление 7-ДГХ и 8-ДГХ, потенциально токсичных предшественников холестерина.
Десмостеролоз
[00116] Десмостеролоз является дефицитом десмостерол-редуктазы и характеризуется фенотипом, подобным СЛОС. В одном аспекте, в настоящей заявке описаны способы лечения десмостеролоза соединениями, описанными в настоящей заявке.
Ситостеролемия
[00117] Ситостеролемия является редким аутосомно-рецессивным нарушением, вызванным мутациями в двух генах белков-переносчиков АТФ-связывающей кассеты (ABC) (ABCG5 и ABCG8). Ситостеролемия повышает абсорбцию растительных стеринов и холестерина в кишечнике. У больных, как правило, наблюдают сухожильные и туберозные ксантомы, а также коронарную недостаточность в раннем возрасте. В одном аспекте, в настоящей заявке описаны способы лечения ситостеролемии соединениями, описанными в настоящей заявке.
Церебросухожильный ксантоматоз (ЦСК)
[00118] В одном аспекте, в настоящей заявке описаны способы лечения церебросухожильного ксантоматоза (также называемого церебральным холестерозом или синдромом Ван-Богарта-Шерера-Эпштейна) соединениями, описанными в настоящей заявке. ЦСК может быть вызван мутацией в гене CYP27A1, который продуцирует фермент стерин-27-гидроксилазу. Стерин-27-гидроксилаза превращает холестерин в желчные кислоты (например, хенодезоксихолевую кислоту), которые важны для абсорбции жиров в кишечнике. Ферментная дисфункция может приводить к накоплению холестерина в тканях. ЦСК характеризуется детской диареей, катарактами, сухожильными ксантомами, снижением умственных способностей и нарушением движения у взрослых.
Синдром с дефицитом мевалонаткиназы (ДМК)
[00119] Дефицит мевалонаткиназы (также называемый мевалоновой ацидурией (более тяжелая форма ДМК) или гипер-IgD синдромом (HIDS или гипериммуноглобулинемией D) с синдромом периодической лихорадки (более доброкачественная форма ДМК)) вызывает накопление мевалоновой кислоты в моче в результате недостаточной активности мевалонаткиназы. ДМК может приводить к задержке в развитии, гипотонусу, анемии, гепатоспленомегалии, дисморфическим чертам, олигофрении и общей задержке роста. Мевалоновая ацидурия характеризуется задержкой физического и умственного развития, задержкой роста, рекуррентными эпизодами лихорадки с рвотой и диареей, увеличенной печенью, селезенкой и лимфатическими узлами, микроцефалией (уменьшением размеров головы), катарактой, низким мышечным тонусом, низким ростом, определенными чертами лица, атаксией и анемией. HIDS характеризуется рекуррентными эпизодами лихорадки, ассоциированной с увеличенными лимфатическими узлами, болью в суставах, желудочно-кишечными нарушениями и кожной сыпью. В одном аспекте, в настоящей заявке описаны способы лечения ДМК соединениями, описанными в настоящей заявке.
Мутация в гене SC4MOL (дефицит СМО)
[00120] Дефицит гена SC4MOL является генетическим нарушением пути биосинтеза холестерина (например, вследствие мутаций в гене SC4MOL, кодирующем новую стериноксидазу). Дефицит SC4MOL характеризуется накоплением диметил- и монометилстеринов, которые могут быть обнаружены в крови, чешуйках кожи или первичных фибробластах кожи. В одном аспекте, в настоящей заявке описаны способы лечения дефицита СМО соединениями, описанными в настоящей заявке.
Болезнь Ниманна-Пика
[00121] Болезнь Ниманна-Пика является лизосомной болезнью накопления, вызванной генетической мутацией, которая нарушает метаболизм. Болезнь Ниманна-Пика приводит к патологическому накоплению холестерина и других жирных веществ (липидов) вследствие неспособности организма транспортировать вещества. Накопление вызывает повреждение пораженных областей.
Аутизм
[00122] В одном аспекте, в настоящей заявке описаны способы лечения расстройства аутистического спектра или аутизма. Расстройство аутистического спектра (ASD) и аутизм относятся к группе сложных нарушений развития головного мозга. Аутизм, как правило, характеризуется трудностями при социальном взаимодействии, например, при вербальной и невербальной коммуникации. Двигательные итерации также часто наблюдаются у больных аутизмом. Аутизм может быть ассоциирован с умственной отсталостью, трудностями в моторной координации и внимании, а также с нарушениями физического здоровья, например, нарушением сна и желудочно-кишечными нарушениями. Больные аутизмом могут также обладать выдающимися способностями в области зрительного восприятия, музыки, математики и искусства. Аутизм может относиться к аутическому расстройству, дезинтегративному расстройству детского возраста, первазивному расстройству развития без дополнительных уточнений (ПРР-БДУ) и синдрому Аспергера. Аутизм также относится к моногенетическим причинам аутизма, таким как синаптопатия, например, синдром Ретта, синдром ломкой Х-хромосомы, синдром Ангельмана.
Нарушения, связанные с фенилкетонурией
[00123] В одном аспекте, в настоящей заявке описаны способы лечения нарушений, связанных с фенилкетонурией (например, когнитивных растройств), соединениями, описанными в настоящей заявке. Фенилкетонурия может приводить к гипохолестеринемии и пониженному уровню витамина D. Было обнаружено, что общий холестерин и холестерин низкой плотности, и 25-гидроксивитамин D были понижены у субъектов, страдающих фенилкетонурией, по сравнению с субъектами, не страдающими фенилкетонурией (Clin. Chim. Acta 2013, 416: 54-59). 24S-гидроксихолестерин, 27S-гидроксихолестерин и 7α-гидроксихолестерин (например, отражающие периферическую и печеночную элиминацию холестерина, соответственно), как было показано, были значительно понижены у субъектов, страдающих фенилкетонурией, тогда как 7β-гидроксихолестерин (например, отражающий окислительный стресс) у субъектов, страдающих фенилкетонурией, был значительно повышен. Изменения уровней 24S-OHC и 7β-гидроксихолестерина коррелируют с уровнем фенилаланина, и уровни 27S-гидроксихолестерина могут коррелировать с уровнем 25-гидроксивитамина D у субъектов, страдающих фенилкетонурией.
Примеры
[00124] Для того, чтобы описанное в настоящем документе изобретение можно было понять в большей мере, представлены следующие примеры. Способы синтеза или промежуточные соединения можно найти, например, в WO 02014/160480*. Примеры синтеза и биологические примеры, описанные в настоящем описании, предложены для иллюстрации соединений, фармацевтических композиций и способов, представленных настоящем документе, и никоим образом не должны рассматриваться как ограничение их объема.
[00125] Стереохимия, представленная в настоящем описании (например, указание "R" или "S" в положении С24 стероида), может быть указана ориентировочно (например, случайным образом). Например, положение "С24" может быть показано в "R" конфигурации, когда абсолютная конфигурация соответствует "S". Положение "C24" также может быть показано в "S" конфигурации, когда абсолютная конфигурация соответствует "R".
[00126] Список сокращений
Me: метил; Ac: ацетил; Bu: бутил; t-Bu: трет-бутил; Ph: фенил; ТГФ: тетрагидрофуран; Na2SO4: сульфат натрия; NaHCO3: бикарбонат натрия; Na2S2O3: тиосульфат натрия; ПЭ: петролейный эфир; ДХМ: дихлорметан; ДМФА: N,N-диметилформамид; Et: этил; EtOAc: этилацетат; EtOH: этанол; MeOH: метиловый спирт; t-BuLi: трет-бутиллитий; MTBE: метил-трет-бутиловый эфир; HMPA: гексаметилфосфортриамид; n-BuLi: н-бутиллитий; TsCl: 4-метилбензол-1-сульфонилхлорид; Ph3PMeBr: бромид метилтрифенилфосфония; PCC: хлорхромат пиридиния; t-BuOK: трет-бутилат калия; TBAF: фторид тетра-н-бутиламмония; TBSCl: трет-бутил(хлор)диметилсилан; AlMe3: триметилалюминий; DMP: периодинан Десса-Мартина; (i-PrO)4Ti: тетраизопропилат титана; LAH: алюмогидрид лития; LDA: диизопропиламид лития; MAD: метилалюминий-бис(2,6-ди-т-бутил-4-метилфеноксид); n-BuLi: н-бутиллитий; BHT: 2,6-ди-т-бутил-п-крезол (бутилированный гидрокситолуол); DIEA: диизопропилэтиламин; NCS: N-хлорсукцинимид; iPrMgBr: изопропилмагнийбромид.
[00127] Способы синтеза
[00128] Пример 1. Синтез соединения 1.
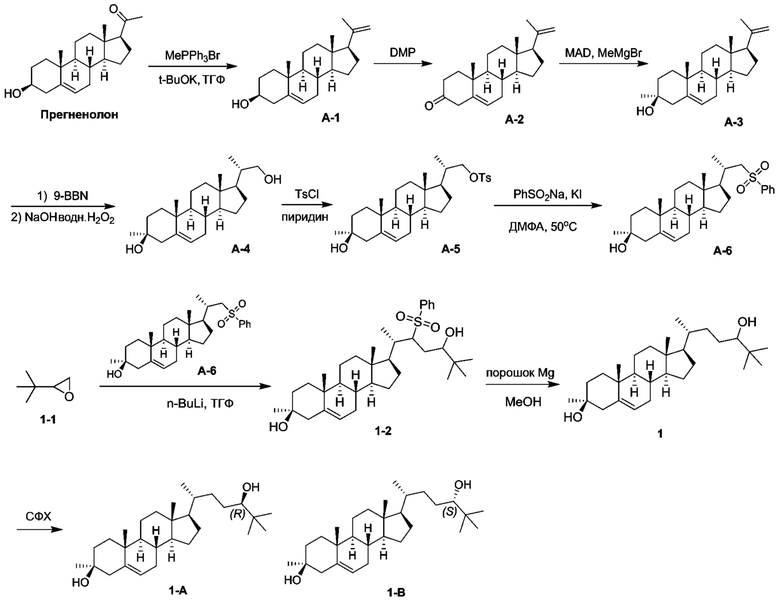

Стадия 1. Синтез Промежуточного соединения A-1. К суспензии PPh3MeBr (2,13 кг, 5,97 моль) в ТГФ (3000 мл) добавляли t-BuOK (688 г, 6,14 моль) при 20°C. Суспензия приобретала желтый цвет. После перемешивания при 50°C в течение 1 ч, при 50°C добавляли прегненолон (630 г, 2,05 моль). Реакционную смесь перемешивали при 50°C в течение 2 ч. После охлаждения до 20°C, смесь обрабатывали NH4Cl (10% водн., 5 л) и гептаном (3,5 л) и перемешивали в течение 15 минут. Органический слой отделяли, выпаривали в вакууме с получением неочищенного материала в виде густого масла, которое вливали в MTBE (10 л) при сильном перемешивании и перемешивали смесь при комнатной температуре в течение 16 часов. Образовавшееся почти белое твердое вещество собирали фильтрованием и промывали MTBE (3 л). Объединенный фильтрат смешивали с MeOH (10 л) и концентрировали до 6 л в вакууме. Образовавшееся почти белое твердое вещество собирали фильтрованием, промывали MeOH (3 л), сушили на воздухе, получив 700 г влажного почти белого твердого вещества. Объединенный фильтрат MeOH выпаривали в вакууме с получением густого масла. Масло вливали в MTBE (3 л) при сильном перемешивании и перемешивали смесь в течение 3 часов. Образовавшееся почти белое твердое вещество собирали фильтрованием и промывали MTBE (1 л). Объединенный фильтрат смешивали с MeOH (3 л) и концентрировали до 1,5 л в вакууме. Образовавшееся почти белое твердое вещество собирали фильтрованием, промывали MeOH (500 мл), сушили на воздухе, получив 150 г влажного почти белого твердого вещества. Предыдущие 700 г и партию 150 г объединяли, сушили в вакууме, получив A-1 (552 г, 88%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,40-5,30 (м, 1H), 4,85 (с, 1H), 4,71 (с, 1H), 3,60-3,50 (м, 1H), 2,36-2,18 (м, 2H), 2,08-1,96 (м, 2H), 1,92-1,78 (м, 3H), 1,76 (с, 3H), 1,73-1,48 (м, 9H), 1,38-1,03 (м, 4H), 1,01 (с, 3H), 1,00-0,91 (м, 1H), 0,58 (с, 3H).
Стадия 2. Синтез Промежуточного соединения A-2. К раствору A-1 (184 г, 585 ммоль) в ДХМ (2000 мл) порциями добавляли DMP (496 г, 1,17 моль) при 25°C, после чего добавляли воду (42 мл). Смесь перемешивали при 25°C в течение 30 мин, порциями добавляли воду (1500 мл) и NaHCO3 (750 г) с выделением газа. Затем смесь фильтровали через слой целита и промывали твердое вещество ДХМ (500 мл). Органический слой фильтрата отделяли, промывали Na2S2O3 (1000 мл, нас.), сушили над Na2SO4, фильтровали и выпаривали в вакууме при т-ре ниже 30°C с получением A-2 (250 г, неочищенный продукт) в виде светло-желтой смолы. Неочищенный продукт использовали на следующей стадии непосредственно.
Стадия 3. Синтез Промежуточного соединения A-3. К раствору BHT (769 г, 3,49 моль) в толуоле (1500 мл) добавляли AlMe3 (870 мл, 2М в толуоле, 1,74 моль) при 0°C. После перемешивания при 0°C в течение 1 ч, реакционную смесь охлаждали до -78°C и добавляли раствор A-2 (250 г неочищенного продукта, теоретическая масса: 182 г, 582 ммоль) в толуоле (1000 мл). После перемешивания при -78°C в течение 1 ч, добавляли MeMgBr (580 мл, 3М в эфире, 1,74 ммоль) при -78°C и перемешивали смесь при -78°C в течение еще 1 ч. Реакцию останавливали, вливая смесь порциями в лимонную кислоту (4000 мл, 20% водн.) с выделением газа. Еще две партии обрабатывали и объединяли вместе. Смесь экстрагировали EtOAc (10 л). Органический слой отделяли, промывали солевым раствором (5 л, 10%), NaHCO3 (5 л, нас. водн.), солевым раствором (5 л, нас.), сушили над Na2SO4 и выпаривали в вакууме. Неочищенный продукт очищали на колонке с силикагелем (элюирование ПЭ→EtOAc) с получением неочищенного A-3 (440 г) в виде светло-желтого твердого вещества. К раствору неочищенного A-3 (440 г) в ДХМ (6 л) добавляли DMAP (24,4 г) и Ac2O (51 г). Смесь перемешивали при 20°C в течение 1 ч. К смеси добавляли NaHCO3 (1 л, нас. водн.) и перемешивали в течение 10 мин. Органический слой отделяли, выпаривали в вакууме и растирали остаток в ПЭ (2 л). Твердое вещество промывали ПЭ (3×500 мл) и сушили в вакууме с получением A-3 (262 г) в виде почти белого твердого вещества. Объединенный фильтрат выпаривали, очищали на колонке с силикагелем (ПЭ/EtOAc =50/1→8/1) и растирали в ПЭ (1 л), получив A-3 (30 г). 1H-ЯМР (400 МГц, CDCl3) δ 5,35-5,28 (м, 1H), 4,85 (с, 1H), 4,71 (с, 1H), 2,48-2,37 (м, 1H), 2,08-1,94 (м, 3H), 1,92-1,85 (м, 1H), 1,82-1,33 (м, 14H), 1,29-1,08 (м, 7H), 1,02 (с, 3H), 1,00-0,93 (м, 1H), 0,59 (с, 3H).
Стадия 4. Синтез Промежуточного соединения A-4. A-3 (100 г, 304 ммоль) растворяли в 9-BBN (1,21 л, 0,5 М в ТГФ, 608 ммоль) при 0°C под N2. Раствор перемешивали при 65°C в течение 1 часа и снова охлаждали до 10°C. Осаждалось почти белое твердое вещество. Этанол (279 г, 6080 ммоль) и водный NaOH (304 мл, 5 М, 1520 ммоль) добавляли по каплям к смеси при т-ре ниже 10°C с получением прозрачного раствора. Затем по каплям добавляли перекись водорода (343 г, 30% в воде, 3040 ммоль) при т-ре ниже 10°C. Реакционную смесь перемешивали при 75°C в течение 1 часа. После повторного охлаждения до 20°C выпавшее в осадок белое твердое вещество собирали фильтрованием. Осадок на фильтре промывали водой (3×500 мл), сушили в вакууме с получением белого твердого вещества, которое растирали в этаноле (1,5 л) при нагревании с обратным холодильником, получив A-4 (92 г, 88%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,31-5,29 (м, 1H), 3,65-3,63 (м, 1H), 3,38-3,37 (м, 1H), 2,42 (д, J=12,4, 1H), 2,05-1,92 (м, 3H), 1,88-1,63 (м, 4H), 1,63-1,40 (м, 8H), 1,40-0,90 (м, 16H), 0,70 (с, 3H).
Стадия 5. Синтез Промежуточного соединения A-5. К раствору A-4 (124,5 г, 357 ммоль) в хлороформе (1 л) и пиридине (700 мл) добавляли TsCl (204 г, 1071 ммоль) при 15°C. Смесь перемешивали при 15°C в течение 2 ч. Смесь выпаривали в вакууме для удаления большей части хлороформа. Смесь пиридина добавляли в воду (6 л). Образовавшееся почти белое твердое вещество собирали фильтрованием и промывали водой (6×1 л). Почти белое твердое вещество растворяли в ДХМ (3,5 л), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением A-5 (163 г, 92%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 7,78 (д, J=8,0 Гц, 2H), 7,34 (д, J=8,4 Гц, 2H), 5,29-5,28 (м, 1H), 3,96 (дд, J=3,2, 9,6 Гц, 1H), 3,79 (дд, J=6,4, 9,2 Гц, 1H), 2,45 (с, 3H), 2,41 (д, J=13,6 Гц, 1H), 1,99-1,91 (м, 3H), 1,77-1,39 (м, 11H), 1,26-0,86 (м, 16H), 0,64 (с, 3H).
Стадия 6. Синтез Соединения A-6. К раствору A-5 (163 г, 325 ммоль) в ДМФА (1,7 л) добавляли KI (258 г, 1560 ммоль) при 15°C и перемешивали смесь при 60°C в течение 2 часов. Добавляли бензолсульфинат натрия (195 г, 975 ммоль) и перемешивали смесь при 60°C в течение 2 часов. Реакционную смесь охлаждали до 25°C и объединяли с другой партией 83 г A-5. Объединенную смесь вливали в воду (20 л), при этом образовывалось некое желтое твердое вещество. Смесь фильтровали и промывали осадок на фильтре водой (3×2 л). Полученный осадок на фильтре растворяли в ДХМ (5 л), промывали водой (2×1 л), солевым раствором (2×1 л), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением неочищенного продукта в виде желтого твердого вещества, которое перекристаллизовывали из толуола (2,5 л) с получением A-6 (150 г, 65%) в виде светло-желтого твердого вещества. Фильтрат после перекристаллизации выпаривали в вакууме с получением дополнительного неочищенного A-6 (30 г) в виде желтого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 7,91 (д, J=7,2 Гц, 2H), 7,69-7,61 (м, 1H), 7,60-7,50 (м, 2H), 5,28-5,27 (м, 1H), 3,14 (д, J=14,0 Гц, 1H), 2,85 (дд, J=9,6, 14,0 Гц, 1H), 2,41 (д, J=12,8 Гц, 1H), 2,17-2,03 (м, 1H), 2,02-1,87 (м, 3H), 1,81-1,65 (м, 3H), 1,60-1,32 (м, 8H), 1,25-0,85 (м, 15H), 0,65 (с, 3H). ЖХМС Rt=2,057 мин в 3,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C29H41O2S [M+H-H2O]+ 453, найдено 453.
Стадия 7. Синтез Соединения 1-2. В ТГФ (2 мл) под N2 при -70°C добавляли n-BuLi (1,69 мл, 4,24 ммоль) и по каплям добавляли суспензию A-6 (500 мг, 1,06 ммоль) в ТГФ (5 мл) с получением светло-желтой суспензии. После перемешивания при -70°C в течение 30 мин, добавляли раствор Соединения 1-1 (212 мг, 2,12 ммоль) в ТГФ (2 мл). Реакцию перемешивали при -70°C в течение 10 мин и перемешивали при 25°C в течение 16 ч. В реакционную смесь вливали воду (10 мл) и экстрагировали EtOAc (3×50 мл). Объединенную органическую фазу промывали солевым раствором (100 мл), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением неочищенного продукта, который очищали на колонке с силикагелем (ПЭ/EtOAc=10/1) с получением Соединения 1-2 (500 мг, неочищенный продукт) в виде желтого твердого вещества, которое использовали непосредственно.
Стадия 8. Синтез Соединения 1. К раствору Соединения 1-2 (500 мг, 0,876 ммоль) в MeOH (10 мл) добавляли порошок Mg (630 мг, 26,3 ммоль) при 60°C. Смесь перемешивали при 60°C в течение 2 ч и добавляли другую порцию порошка Mg (630 мг, 26,3 ммоль). Реакцию перемешивали при 60°C в течение еще 16 ч. После охлаждения в смесь приливали HCl (100 мл, 1M), пока реакционная смесь не становилась прозрачной, и экстрагировали ДХМ (2×30 мл). Объединенную органическую фазу сушили над Na2SO4, фильтровали, выпаривали и очищали на колонке с силикагелем (ПЭ/EtOAc=10/1→8/1) с получением Соединения 1 (104 мг, 28%) в виде почти белого твердого вещества.
Соединение 1: 1H-ЯМР (400 МГц, CDCl3) δ 5,31-5,30 (м, 1H), 3,19-3,05 (м, 1H), 2,44-2,40 (м, 1H), 2,08-1,91 (м, 3H), 1,91-1,57 (м, 6H), 1,52-1,35 (м, 11H), 1,74-1,12 (м, 10H), 1,11-1,01 (м, 5H), 0,90 (с, 9H), 0,68 (с, 3H). ЖХМС Rt=1,564 мин в 2 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C29H47 [M+H-2H2O]+ 395, найдено 395.
Стадия 9. Соединение 1 (0,83 г) очищали с помощью СФХ (Колонка: AD (250 мм×30 мм, 5 мкм), 0,1% NH3H2O EtOH, Градиент: от 30% до 100%, Скорость потока (мл/мин): 60 мл/мин, 25°C), с получением Соединения 1-A (379 мг, 46%) и Соединения 1-B (338 мг, 41%) в виде почти белого твердого вещества.
Соединение 1-A: 1H-ЯМР (400 МГц, CDCl3) δ 5,33-5,28 (м, 1H), 3,12-3,06 (м, 1H), 2,45-2,40 (м, 1H), 2,05-1,92 (м, 3H), 1,91-1,64 (м, 5H), 1,63-1,57 (м, 3H), 1,52-1,38 (м, 6H), 1,37-1,24 (м, 3H), 1,21-1,09 (м, 5H), 1,09-1,03 (м, 2H), 1,02-1,00 (м, 4H), 0,99-0,96 (м, 1H), 0,94 (д, J=6,8 Гц, 3H), 0,90 (с, 9H), 0,68 (с, 3H). ЖХМС Rt=1,361 мин в 2,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C29H47 [M+H-2H2O]+ 395, найдено 395.
Соединение 1-B: 1H-ЯМР (400 МГц, CDCl3) δ 5,32-5,30 (м, 1H), 3,16-3,14 (м, 1H), 2,45-2,40 (м, 1H), 2,05-1,92 (м, 3H), 1,90-1,66 (м, 4H), 1,63-1,57 (м, 2H), 1,52-1,38 (м, 6H), 1,37-1,24 (м, 5H), 1,21-1,09 (м, 5H), 1,09-0,95 (м, 5H), 0,94 (д, J=6,4 Гц, 3H), 0,90 (с, 9H), 0,69 (с, 3H). ЖХМС Rt=1,361 мин в 2,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C29H47 [M+H-2H2O]+ 395, найдено 395.
Пример 2. Синтез Соединения 2.
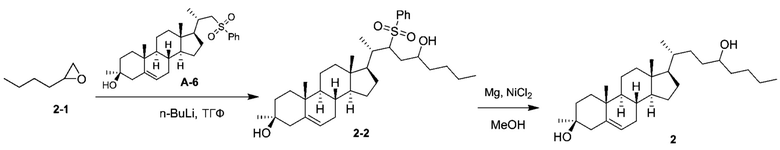
Синтез Соединения 2-2. В ТГФ (6 мл) добавляли n-BuLi (2,5 М, 2,65 ммоль, 1,05 мл, 2,5 экв.) под N2 при -70°C и по каплям добавляли суспензию A-6 (1,06 ммоль, 500 мг, 1,0 экв.) в ТГФ (3 мл) с получением светло-желтой суспензии. После перемешивания при -70°C в течение 30 мин, по каплям добавляли раствор Соединения 2-1 (1,27 ммоль, 127 мг, 1,2 экв.) в ТГФ (1 мл). Реакцию перемешивали при 15°C в течение 12 ч. Реакцию останавливали нас. NH4Cl (30 мл) и экстрагировали EtOAc (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали с получением Соединения 2-2 (560 мг, неочищенный продукт) в виде светло-желтой пены, которую использовали непосредственно на следующей стадии.
Синтез Соединения 2. К раствору Соединения 2-2 (560 мг, 0,98 ммоль) в MeOH (10 мл) добавляли NiCl2 (127 мг, 0,980 ммоль). После нагрева до 55°C добавляли стружку Mg (938 мг) и смесь перемешивали при 55°C в течение 30 минут. После этого добавляли другую порцию стружки Mg (938 мг) и перемешивали реакцию при 55°C в течение 16 ч. После охлаждения в смесь вливали HCl (100 мл, 1Н), пока реакционная смесь не становилась прозрачной, и экстрагировали ДХМ (2×30 мл). Объединенную органическую фазу сушили над Na2SO4, фильтровали и выпаривали. Неочищенный остаток очищали на колонке для флеш-хроматографии (0-10% EtOAc в ПЭ/ДХМ (об/об=2/1)) с получением Соединения 2 (26 мг, 6%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,29 (м, 1H), 3,54-3,52 (м, 1H), 2,44-2,40 (м, 1H), 2,05-1,90 (м, 3H), 1,85-1,58 (м, 4H), 1,56-1,24 (м, 18H), 1,23-0,92 (м, 19H), 0,68 (с, 3H). ЖХМС Rt=1,359 мин в 2,0 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C29H47 [M+H-2H2O]+ 395, найдено 395.
Пример 3. Синтез Соединений 3 и 4.
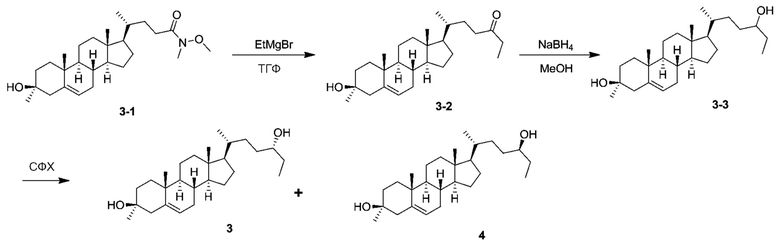
Синтез Соединения 3-2. К раствору Соединения 3-1* (7,0 г, 16,2 ммоль) в ТГФ (70 мл) по каплям добавляли этилмагнийбромид (26,9 мл, 80,9 ммоль, 3M в Et2O) при 0°C под атмосферой азота. Реакционную смесь перемешивали при 25°C в течение 12 ч. В смесь вливали насыщенный водный NH4Cl (100 мл) и экстрагировали EtOAc (2×200 мл). Объединенную органическую фазу промывали солевым раствором (200 мл), сушили над безводным Na2SO4, выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=20/1) с получением Соединения 3-2 (500 мг, 8%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,28 (м, 1H), 2,42-2,39 (м, 5H), 1,98-1,63 (м, 8H), 1,53-0,84 (м, 27H), 0,66 (с, 3H).
Синтез Соединения 3-3. К раствору Соединения 3-2 (500 мг, 1,24 ммоль) в MeOH (10 мл) порциями добавляли NaBH4 (93,8 мг, 2,48 ммоль). Реакционную смесь перемешивали при 25°C в течение 2 ч. В реакционную смесь вливали насыщенный водный NH4Cl (10 мл) и экстрагировали EtOAc (2×30 мл). Объединенную органическую фазу промывали солевым раствором (30 мл) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=20/1) с получением Соединения 3-3 (500 мг, неочищенный продукт), которое очищали с помощью препаративной ВЭЖХ с получением Соединения 3-3 (60 мг, 12%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,33-5,28 (м, 1H), 3,48-3,47 (м, 1H), 2,45-2,38 (м, 1H), 2,02-1,57 (м, 14H), 1,57-0,92 (м, 26H), 0,67 (с, 3H).
Синтез Соединений 3 и 4. Соединение 3-3 (60 мг, 149 мкмоль) в MeOH (5 мл) разделяли с помощью СФХ (Колонка: AD (250 мм×30 мм, 5 мкм); Условия: Основание-EtOH), с получением пика 1 Соединения 3 (33,6 мг, 56%) и пика 2 Соединения 4 (18,3 мг, 31%) в виде почти белого твердого вещества. Соединение 3: 1H-ЯМР (400 МГц, CDCl3) δ 5,32-5,28 (м, 1H), 3,48-3,46 (м, 1H), 2,46-2,39 (м, 1H), 2,02-1,57 (м, 11H), 1,54-0,92 (м, 29H), 0,67 (с, 3H). ЖХМС Rt=1,443 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C27H45O [M-H2O+H]+ 385, найдено 385. Соединение 4: 1H-ЯМР (400 МГц, CDCl3) δ 5,33-,28 (м, 1H), 3,48-3,46 (м, 1H), 2,45-2,41 (м, 1H), 2,02-1,57 (м, 11H), 1,54-0,92 (м, 29H), 0,68 (с, 3H). ЖХМС Rt=1,446 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. C27H45O [M-H2O+H]+ 385, найдено 385.
Пример 4. Синтез Соединений 6 и 7.
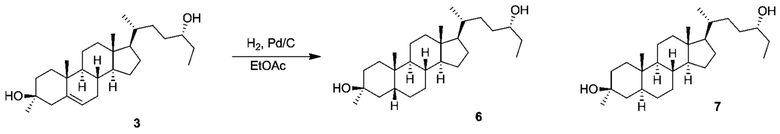
К раствору Соединения 3 (90 мг, 223 мкмоль) в EtOAc (10 мл) добавляли Pd/C (100 мг, 10%, сухой), после чего смесь перемешивали под водородом (0,35 МПа) при 50°C в течение 12 ч. Смесь фильтровали через слой целита и выпаривали фильтрат при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=20/1→10/1) с получением Соединения 6 (4,8 мг, 5%) и Соединения 7 (44,5 мг, 49%) в виде почти белых твердых веществ. Соединение 6: 1H-ЯМР (400 МГц, CDCl3) δ 3,47-3,46 (м, 1H), 2,05-1,82 (м, 4H), 1,79-1,57 (м, 2H), 1,55-0,90 (м, 38H), 0,64 (с, 3H). ЖХМС Rt=1,484 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C27H45 [M-2H2O+H]+ 369, найдено 369. Соединение 7: 1H-ЯМР (400 МГц, CDCl3) δ 3,49-3,46 (м, 1H), 1,97-1,90 (м, 1H), 1,90-1,55 (м, 1H), 1,55-1,62 (м, 4H), 1,53-1,24 (м, 19H), 1,23-0,82 (м, 15H), 0,80 (с, 3H), 0,64-0,63 (м, 4H). ЖХМС Rt=1,474 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C27H45 [M-2H2O+H]+ 369, найдено 369.
Пример 5. Синтез Соединений 8 и 9.
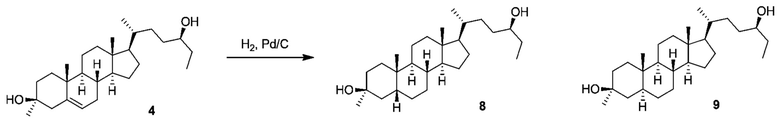
К раствору Соединения 4 (90 мг, 223 мкмоль) в EtOAc (10 мл) добавляли Pd/C (100 мг, 10%, сухой), после чего смесь перемешивали под водородом (0,35 МПа) при 50°C в течение 12 ч. Смесь фильтровали через слой целита и выпаривали фильтрат при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=20/1→10/1) с получением Соединения 8 (5,5 мг, 6%) и Соединения 9 (64,7 мг, 72%) в виде почти белых твердых веществ.
Соединение 8: 1H-ЯМР (400 МГц, CDCl3) δ 3,47-3,46 (м, 1H), 1,86-1,75 (м, 4H), 1,65-0,90 (м, 40H), 0,64 (с, 3H). ЖХМС Rt=1,484 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C27H45 [M-2H2O+H]+ 369, найдено 369.
Соединение 9: 1H-ЯМР (400 МГц, CDCl3) δ 3,47-3,46 (м, 1H), 1,97-1,90 (м, 1H), 1,90-1,78 (м, 1H), 1,70-1,58 (м, 6H), 1,50-0,90 (м, 35H), 0,64-0,63 (м, 4H). ЖХМС Rt=1,472 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C27H45 [M-2H2O+H]+ 369, найдено 369.
Пример 6. Синтез Соединений 10 и 11.
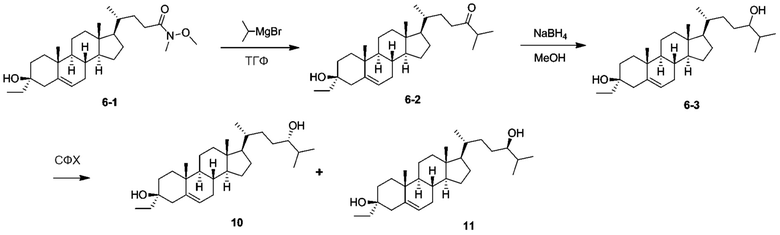
Синтез Соединения 6-2. К раствору Соединения 6-1* (3,6 г, 8,07 ммоль) в ТГФ (50 мл) по каплям добавляли изопропилмагнийбромид (16,1 мл, 32,2 ммоль, 2М в ТГФ) при 0°C под атмосферой азота. Реакционную смесь перемешивали при 25°C в течение 12 ч. В смесь вливали насыщенный водный NH4Cl (50 мл) и экстрагировали EtOAc (2×100 мл). Объединенную органическую фазу промывали солевым раствором (50 мл), сушили над безводным Na2SO4 и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=20/1) с получением Соединения 6-2 (600 мг, 17%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,26 (м, 1H), 2,61-2,51 (м, 1H), 2,38-2,34 (м, 3H), 2,01-1,59 (м, 8H), 1,55-1,25 (м, 11H), 1,23-0,83 (м, 21H), 0,67 (с, 3H).
Синтез Соединения 6-3. К суспензии Соединения 6-2 (500 мг, 1,16 ммоль) в MeOH (8 мл) порциями добавляли NaBH4 (87,7 мг, 2,32 ммоль). Реакционную смесь перемешивали при 25°C в течение 2 ч. В реакционную смесь вливали насыщенный водный NH4Cl (10 мл) и добавляли H2O (30 мл). Осадок почти белого твердого вещества фильтровали, собирали и сушили в вакууме с получением Соединения 6-3 (500 мг, 100%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,26 (м, 1H), 3,31-3,30 (м, 1H), 2,40-2,30 (м, 1H), 2,04-1,63 (м, 7H), 1,55-1,25 (м, 15H), 1,23-0,84 (м, 22H), 0,67 (с, 3H).
Синтез Соединений 10 и 11. Соединение 6-3 (500 мг, 1,16 ммоль) в MeOH (10 мл) разделяли с помощью СФХ в основных условиях (Колонка: AD (250 мм×30 мм, 5 мкм); Условия: основание-MeOH), с получением пика 1 Соединения 10 и пика 2 Соединения 11 (230 мг, 46%) в виде почти белого твердого вещества.
Соединение 10: 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,24 (м, 1H), 3,32-3,31 (м, 1H), 2,40-2,34 (м, 1H), 2,04-1,90 (м, 3H), 1,90-1,57 (м, 10H), 1,55-1,25 (м, 9H), 1,23-0,82 (м, 22H), 0,67 (с, 3H). ЖХМС Rt=1,648 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C29H49O [M-H2O+H]+ 413, найдено 413.
Соединение 11: 1H-ЯМР (400 МГц, CDCl3) δ 5,29-5,25 (м, 1H), 3,32-3,31 (м, 1H), 2,40-2,32 (м, 1H), 2,04-1,57 (м, 6H), 1,54-1,25 (м, 17H), 1,23-0,84 (м, 21H), 0,68 (с, 3H) ЖХМС Rt=1,641 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C29H49O [M-H2O+H]+ 413, найдено 413.
Пример 7. Синтез Соединений 12 и 13.
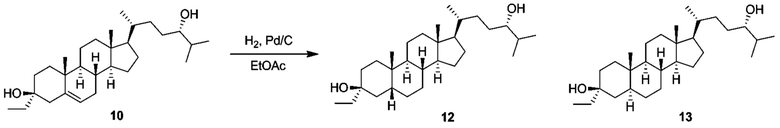
К раствору Соединения 10 (150 мг, 348 мкмоль) в EtOAc (15 мл) добавляли Pd/C (200 мг, 10%, сухой), после чего смесь перемешивали под водородом (0,35 МПа) при 50°C в течение 12 ч. Смесь фильтровали через слой целита и выпаривали фильтрат при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=30/1→20/1) с получением Соединения 12 (10,8 мг, 7%) и Соединения 13 (82,7 мг, 55%) в виде почти белых твердых веществ.
Соединение 12: 1H-ЯМР (400 МГц, CDCl3) δ 3,31-3,30 (м, 1H), 1,95-1,58 (м, 5H), 1,50-1,10 (м, 22H), 1,10-0,88 (м, 21H), 0,64 (с, 3H). ЖХМС Rt=1,680 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C29H49 [M-2H2O+H]+ 397, найдено 397.
Соединение 13: 1H-ЯМР (400 МГц, CDCl3) δ 3,31-3,30 (м, 1H), 1,97-1,80 (м, 1H), 1,80-1,75 (м, 1H), 1,75-1,58 (м, 4H), 1,58-1,25 (м, 17H), 1,25-0,82 (м, 24H), 0,64-0,63 (м, 4H). ЖХМС Rt=1,682 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C29H49 [M-2H2O+H]+ 397, найдено 397.
Пример 8. Синтез Соединений 14 и 15.
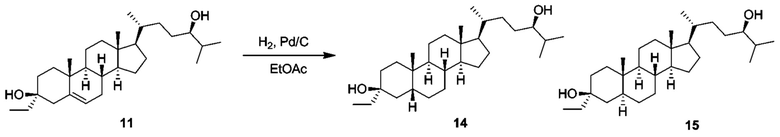
К раствору Соединения 11 (150 мг, 348 мкмоль) в EtOAc (15 мл) добавляли Pd/C (200 мг, 10%, сухой), после чего смесь перемешивали под водородом (0,35 МПа) при 50°C в течение 12 ч. Смесь фильтровали через слой целита и выпаривали фильтрат при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=30/1→20/1) с получением Соединения 14 (10,1 мг, 7%) и Соединения 15 (65,8 мг, 44%) в виде почти белых твердых веществ.
Соединение 14: 1H-ЯМР (400 МГц, CDCl3) δ 3,31-3,30 (м, 1H), 1,95-1,57 (м, 7H), 1,50-1,10 (м, 22H), 1,10-0,90 (м, 19H), 0,65 (с, 3H). ЖХМС Rt=1,702 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C29H49 [M-2H2O+H]+ 397, найдено 397.
Соединение 15: 1H-ЯМР (400 МГц, CDCl3) δ 3,31-3,30 (м, 1H), 1,95-1,90 (м, 1H), 1,90-1,76 (м, 1H), 1,76-1,57 (м, 4H), 1,5,57-1,25 (м, 18H), 1,25-0,70 (м, 23H), 0,64-0,63 (м, 4H). ЖХМС Rt=1,686 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C29H49 [M-2H2O+H]+ 397, найдено 397.
Пример 9. Синтез Соединений 16 и 17.
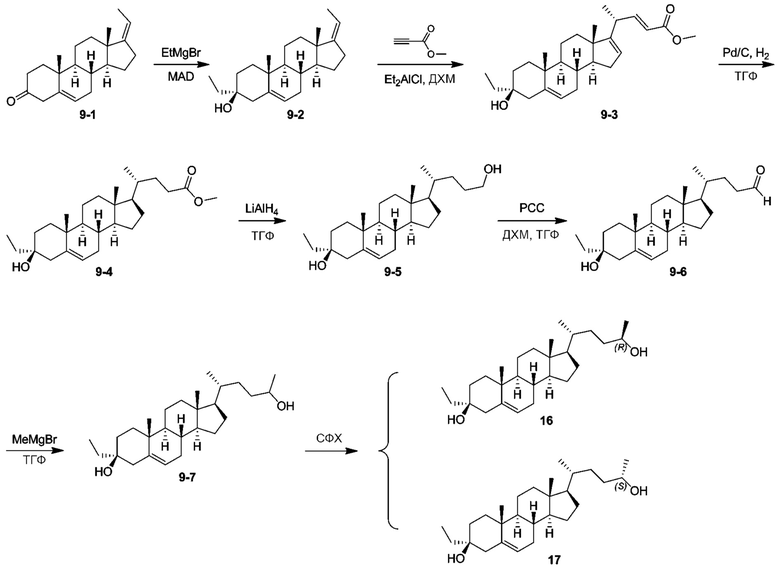

Синтез Соединения 9-2. К раствору 2,6-ди-трет-бутил-4-метилфенола (220 г, 1,0 моль) в толуоле (250 мл) по каплям добавляли AlMe3 (250 мл, 501 ммоль, 2 М в толуоле) при т-ре ниже 25°C. Раствор перемешивали при 25°C в течение 1 ч. Затем по каплям добавляли раствор Соединения 9-1 (50 г, 167 ммоль) в ДХМ (400 мл) при -78°C. После перемешивания при -78°C в течение 1 ч, по каплям добавляли EtMgBr (167 мл, 501 ммоль, 3М в диэтиловом эфире) при -78°C. Полученный раствор перемешивали при т-ре от -78°C до -50°C в течение 3 ч. Реакцию останавливали насыщенным р-ром лимонной кислоты (100 мл) при -78°C. После перемешивания при 25°C в течение 0,5 ч, полученную смесь фильтровали и фильтрат экстрагировали ДХМ (3×100 мл). Объединенный органический слой сушили над Na2SO4, фильтровали и выпаривали в вакууме. Реакцию проводили параллельно 2 раза. Неочищенный продукт объединяли и очищали на колонке с силикагелем (ПЭ/EtOAc=5/1) с получением 38 г неочищенного продукта в виде белого твердого вещества, которое перекристаллизовывали из ПЭ с получением Соединения 9-2 в виде почти белого твердого вещества (13,5 г, 13%). 1H-ЯМР (CDCl3) 400 МГц δ 5,33-5,26 (м, 1H), 5,23-5,10 (м, 1H), 2,45-1,90 (м, 6 H), 1,78-0,70 (м, 28H).
Синтез Соединения 9-3. К раствору Соединения 9-2 (13 г, 39,5 ммоль) и метилпропиолата (8,29 г, 98,7 ммоль) в безводном ДХМ (100 мл) под N2 при 0°C по каплям добавляли диэтилалюминийхлорид (1 М в гексане, 158 мл, 158 ммоль). Смесь перемешивали при 20°C в течение 16 часов. Реакционную смесь вливали в воду со льдом и экстрагировали ДХМ (3×300 мл). Экстракты сушили над безводным сульфатом натрия, фильтровали и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=5/1) с получением Соединения 9-3 (14 г, 86%) в виде почти белого твердого вещества. 1H-ЯМР (CDCl3) 400 МГц δ 6,93 (дд, J=15,6 Гц, 8,0 Гц, 1H), 5,81 (д, J=8,0 Гц, 1H), 5,42-5,38 (м, 1H), 5,33-5,24 (м, 1H), 3,73 (с, 3H), 3,05-2,95 (м, 1H), 2,40-2,30 (м, 1H), 2,10-1,95 (м, 3H), 1,90-1,65 (м, 4H), 1,60-1,25 (м, 9H), 1,88 (д, J=7,2 Гц, 3H), 1,15-0,95 (м, 6H), 0,84 (т, J=7,6 Гц, 3H), 0,78 (с, 3H).
Синтез Соединения 9-4. К раствору Соединения 9-3 (9 г, 21,8 ммоль) в ТГФ (100 мл) добавляли Pd/C (2 г, влажный 10%) при 15°C. После дегазации и заполнения сосуда H2 три раза, реакционную смесь перемешивали в течение 16 ч при 15°C с баллоном H2. Смесь фильтровали через слой целита. Фильтрат выпаривали в вакууме с получением неочищенного Соединения 9-4 (8,7 г, неочищенный продукт) в виде почти белого твердого вещества. 1H-ЯМР (CDCl3) 400 МГц δ 5,35-5,25 (м, 1H), 3,69 (с, 3H), 2,40-2,15 (м, 4H), 2,10-1,40 (м, 17H), 2,15-0,80 (м, 16H), 0,70 (с, 3H).
Синтез Соединения 9-5. К раствору Соединения 9-4 (5 г, 12,0 ммоль) в ТГФ (100 мл) при 0°C добавляли алюмогидрид лития (1,13 г, 30,0 ммоль). Затем реакцию перемешивали при 25°C в течение 5 минут. После этого реакцию останавливали водным раствором NH4Cl (50 мл) и водной лимонной кислотой (30 мл) до pH=4~5. Затем реакционный раствор экстрагировали EtOAc (3×100 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением неочищенного Соединения 9-5 (4 г, 80%) в виде почти белого твердого вещества. 1H-ЯМР (CDCl3) 400 МГц δ 5,35-5,25 (м, 1H), 3,18-3,05 (м, 2H), 2,40-2,32 (м, 1H), 2,08-1,80 (м, 18H), 1,80-0,80 (м, 19H), 0,68 (с, 3H).
Синтез Соединения 9-6. К раствору Соединения 9-5 (1 г, 2,57 ммоль) в ДХМ (15 мл) и ТГФ (15 мл) добавляли PCC (1,10 г, 5,14 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 2 часов. Объединенную органическую фазу сушили, выпаривали и очищали с помощью хроматографии CombiFlash (0~15% EtOAc в ПЭ) с получением Соединения 9-6 (700 мг, 70%) в виде почти белого твердого вещества. 1H-ЯМР (CDCl3) 400 МГц δ 9,77 (с, 1H), 5,30-5,26 (м, 1H), 2,46-2,35 (м, 2H), 2,04-1,57 (м, 12H), 1,50-0,83 (м, 23H), 0,68 (м, 3H).
Синтез Соединения 9-7. К раствору Соединения 9-6 (100 мг, 0,258 ммоль) в ТГФ (5 мл) добавляли метилмагнийбромид (0,513 мл, 1,54 ммоль) под N2. Полученную реакционную смесь перемешивали при 25°C в течение 1 часа. В реакционную смесь вливали насыщенный раствор NH4Cl (10 мл) и затем выпаривали с получением остатка, который экстрагировали EtOAc (3×10 мл). Объединенную органическую фазу сушили, выпаривали и очищали с помощью хроматографии CombiFlash (0~15% EtOAc в ПЭ) с получением Соединения 9-7 (10 мг, 10%) в виде почти белого твердого вещества. 1H-ЯМР (CDCl3) 400 МГц δ 5,30-5,24 (м, 1H), 3,80-3,74 (м, 1H), 2,38-2,35 (м, 1H), 2,05-0,83 (м, 40H), 0,68 (м, 3H). ЖХМС МС ЭРИ вычисл. для C27H45O [M-H2O+H]+ 385, найдено 385.
Синтез Соединений 16 и 17. Соединение 9-7 (150 мг, 0,372 ммоль) очищали с помощью СФХ (Колонка: AD (250 мм×30 мм, 10 мкм), Условия: основание-MEOH) с получением Соединения 16 (10,6 мг, 7%) и Соединения 17 (25,2 мг, 17%) в виде почти белых твердых веществ.
Соединение 16: 1H-ЯМР (400 МГц, CDCl3) δ 5,29-5,27 (м, 1H), 3,75-3,71 (м, 1H), 2,38-2,34 (м, 1H), 2,05-0,80 (м, 40H), 0,67 (с, 3H). ЖХМС tR=1,221 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C27H45O [M-H2O+H]+ 385, найдено 385.
Соединение 17: 1H-ЯМР (400 МГц, CDCl3) δ 5,29-5,27 (м, 1H), 3,75-3,71 (м, 1H), 2,38-2,34 (м, 1H), 2,05-0,80 (м, 40H), 0,67 (с, 3H). ЖХМС tR=1,216 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C27H45O [M-H2O+H]+ 385, найдено 385.
Пример 10. Синтез Соединений 18 и 19.
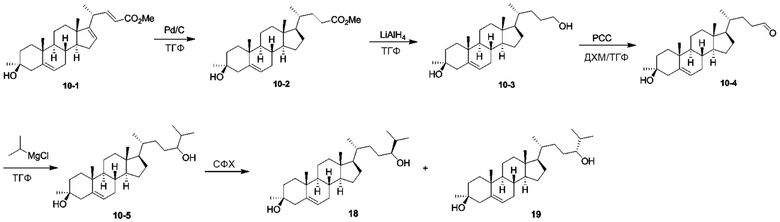
Синтез Соединения 10-2. Раствор Соединения 10-1* (2 г, 5,01 ммоль) и Pd/C (200 мг, 10%) в ТГФ (30 мл) гидрировали под давлением водорода 0,1 МПа при 25°C в течение 3 ч. Смесь фильтровали через слой целита и выпаривали фильтрат в вакууме с получением Соединения 10-2 (1,8 г, неочищенный продукт) в виде почти белого твердого вещества.
Синтез Соединения 10-3. К раствору Соединения 10-2 (1,8 г, 4,47 ммоль) в ТГФ (25 мл) по каплям добавляли раствор LiAlH4 (339 мг, 8,94 ммоль) в ТГФ (на 5 мл) при т-ре ниже 15°C. Раствор перемешивали при 15°C в течение 2 ч. Реакцию останавливали добавлением насыщенного водного NH4Cl (20 мл) при 0°C. Полученную смесь экстрагировали EtOAc (2×50 мл). Объединенный органический слой промывали солевым раствором (2×30 мл) и выпаривали в вакууме с получением Соединения 10-3 (1,6 г, неочищенный продукт) в виде светло-желтого твердого вещества.
Синтез Соединения 10-4. В смесь Соединения 10-3 (1,6 г, 4,27 ммоль) в ДХМ (10 мл) и ТГФ (10 мл) добавляли PCC (2,27 г, 10,6 ммоль) при 25°C. Реакцию перемешивали при 25°C в течение 3 ч. Раствор фильтровали и промывали осадок на фильтре ДХМ (25 мл). Объединенный фильтрат выпаривали в вакууме. Остаток очищали на колонке с силикагелем, элюируя ПЭ/EtOAc=8/1, с получением Соединения 10-4 (0,9 г, 54%) в виде почти белого твердого вещества.
Синтез Соединения 10-5. К раствору Соединения 10-4 (0,9 г, 2,41 ммоль) в ТГФ (30 мл) по каплям добавляли изопропилмагнийхлорид (3,61 мл, 7,23 ммоль, 2М в ТГФ) при -78°C. Смесь перемешивали при -78°C в течение 2 ч. Затем смеси позволяли нагреться до 25°C и перемешивали в течение 3 ч. Реакцию вливали в воду (100 мл) и экстрагировали EtOAc (2×30 мл). Объединенный органический слой промывали солевым раствором (50 мл), сушили над Na2SO4 и выпаривали в вакууме. Остаток очищали на колонке с силикагелем, элюируя ПЭ/EtOAc=5/1, с получением Соединения 10-5 (0,6 г, 57%) в виде почти белого твердого вещества.
Синтез Соединений 18 и 19. Соединение 10-5 (0,6 г) очищали с помощью СФХ в основных условиях (Колонка: AD (250 мм×30 мм, 5 мкм); Условия: основание-MeOH), с получением пика 1 Соединения 18 (140 мг, 23%) в виде почти белого твердого вещества и пика 2 Соединения 19 (220 мг, 37%) в виде светло-желтого твердого вещества.
Соединение 18: 1H-ЯМР (400 МГц, CDCl3) δ 5,35-5,27 (м, 1H), 3,38-3,26 (м, 1H), 2,52-2,37 (м, 1H), 2,07-1,92 (м, 3H), 1,90-1,59 (м, 6H), 1,56-1,35 (м, 7H), 1,33-1,21 (м, 3H), 1,18-1,10 (м, 7H), 1,03-1,00 (м, 6H), 0,97-0,87 (м, 10H), 0,68 (с, 3H). ЖХМС Rt=1,298 мин в 2 мин хроматографии, 30-90AB, МС ЭРИ вычисл. для C28H47O [M-H2O+H]+ 399, найдено 399.
Соединение 19: 1H-ЯМР (400 МГц, CDCl3) δ 5,33-5,25 (м, 1H), 3,30 (шс, 1H), 2,41 (д, J=13,2 Гц, 1H), 2,05-1,90 (м, 3H), 1,90-1,55 (м, 6H), 1,51-1,04 (м, 19H), 1,03-0,96 (м, 4H), 0,95-0,85 (м, 10H), 0,67 (с, 3H). ЖХМС Rt=1,294 мин в 2 мин хроматографии, 30-90AB, МС ЭРИ вычисл. для C28H47O [M-H2O+H]+ 399, найдено 399.
Пример 11. Синтез Соединения 20.
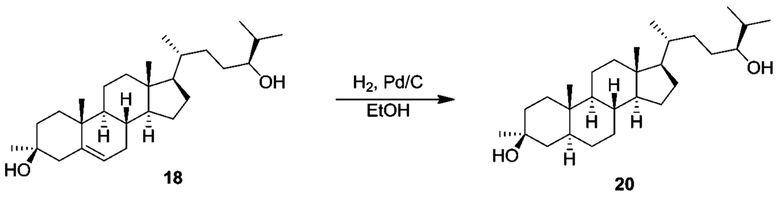
Смесь Соединения 18 (50 мг, 119 мкмоль) и Pd/C (50 мг, 10%) в EtOH (10 мл) гидрировали в течение 12 ч при 50°C под H2 (0,35 МПа). Реакционную смесь фильтровали через слой целита и промывали слой EtOAc (2×20 мл). Объединенные фильтраты выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=20/1→10/1) с получением Соединения 20 (38,5 мг, 76%) в виде почти белого порошка. 1H-ЯМР (400 МГц, CDCl3) δ 3,31-3,30 (м, 1H), 1,96-1,90 (м, 1H), 1,90-1,75 (м, 1H), 1,75-1,57 (м, 4H), 1,54-0,80 (м, 39H), 0,65-064 (м, 4H). ЖХМС Rt=1,578 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C28H47 [M-2H2O+H]+ 383, найдено 383.
Пример 12. Синтез Соединения 21.
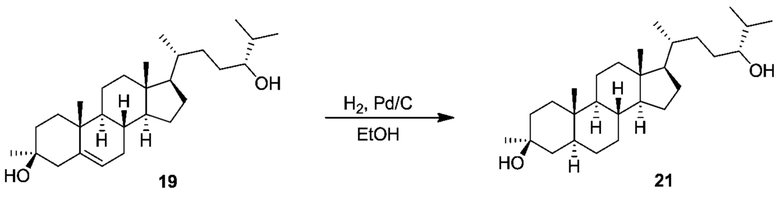
Смесь Соединения 19 (50 мг, 119 мкмоль) и Pd/C (50 мг, 10%) в EtOH (10 мл) гидрировали в течение 12 ч при 50°C под H2 (0,35 МПа). Реакционную смесь фильтровали через слой целита и промывали слой EtOAc (2×20 мл). Объединенные фильтраты выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=20/1→10/1) с получением Соединения 21 (9,8 мг, 20%) в виде почти белого порошка. 1H-ЯМР (400 МГц, CDCl3) δ 3,31-3,30 (м, 1H), 1,97-1,92 (м, 1H), 1,92-1,75 (м, 1H), 1,75-1,57 (м, 27H), 1,54-0,80 (м, 16H), 0,65-064 (м, 4H). ЖХМС Rt=1,535 мин в 2,0 мин хроматографии, 10-80 AB, МС ЭРИ вычисл. для C28H47 [M-2H2O+H]+ 383, найдено 383.
Пример 13. Синтез Соединений 22 и 23.
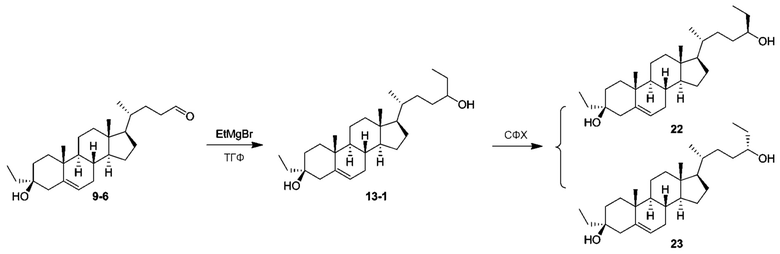
Синтез Соединений 22 и 23. К раствору Соединения 9-6 (340 мг, 879 мкмоль) в ТГФ (20 мл) при 0°C добавляли этилмагнийбромид (876 мкл, 3,0 М, 2,63 ммоль). Реакционную смесь перемешивали при 15°C в течение 2 часов, затем приливали насыщенный NH4Cl (10 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органические фазы промывали солевым раствором (60 мл), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением Соединения 13-1 в виде почти белого твердого вещества (240 мг). Твердое вещество очищали с помощью СФХ (Колонка: AD (250 мм×30 мм, 5 мкм); Условия: основание-MeOH), с получением пика 1 Соединения 22 (13 мг, 4%) в виде почти белого твердого вещества и пика 2 Соединения 23 (54,0 мг, с примесями) в виде почти белого твердого вещества.
Соединение 22: 1H-ЯМР (400 МГц, CDCl3) δ 5,31 (д, J=5,0 Гц, 1H), 3,49 (шс, 1H), 2,39 (д, J=11,0 Гц, 1H), 2,09-1,94 (м, 3H), 1,92-1,80 (м, 1H), 1,78-1,71 (м, 1H), 1,69-1,37 (м, 16H), 1,35-1,23 (м, 4H), 1,22-0,92 (м, 14H), 0,87 (т, J=7,5 Гц, 3H), 0,70 (с, 3H). ЖХМС Rt=2,334 мин в 4 мин хроматографии, 50-100AB, МС ЭРИ вычисл. для C28H47O [[M-H2O+H]+ 399, найдено 399.
Дальнейшая очистка Соединения 23. Соединение 23 (54 мг, 129 мкмоль, с примесями) очищали с помощью СФХ (Колонка: AD (250 мм×30 мм, 5 мкм); Условия: основание-MeOH) с получением светло-желтого твердого вещества (34 мг), которое дополнительно очищали при растирании с н-гексаном, с получением Соединения 23 (8,5 мг, 16%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,32 (шс, 1H), 3,51 (шс, 1H), 2,39 (д, J=13,1 Гц, 1H), 2,11-1,95 (м, 3H), 1,93-1,82 (м, 1H), 1,75 (д, J=13,3 Гц, 1H), 1,69-1,35 (м, 18H), 1,33-1,24 (м, 3H), 1,23-0,91 (м, 13H), 0,87 (т, J=7,4 Гц, 3H), 0,70 (с, 3H). ЖХМС Rt=2,340 мин в 4 мин хроматографии, 50-100AB, МС ЭРИ вычисл. для C28H47O [[M-H2O+H]+ 399, найдено 399.
Пример 14. Синтез Соединений 24, 25 и 26.
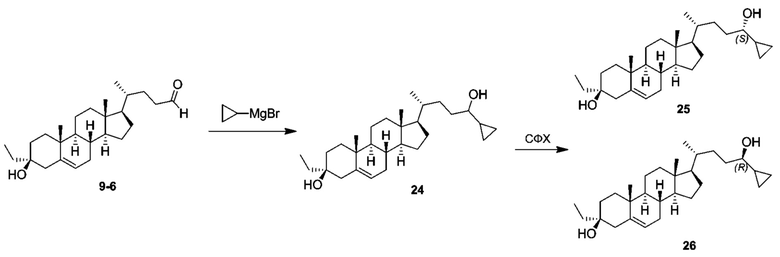
Синтез Соединения 24: К раствору Соединения 9-6 (0,7 г, 1,80 ммоль) в ТГФ (10 мл) порциями добавляли циклопропилмагнийбромид (180 мл, 90 ммоль, 0,5М в ТГФ). Смесь перемешивали при 15°C в течение 16 часов. В смесь вливали насыщенный раствор NH4Cl (100 мл) и затем экстрагировали EtOAc (2×30 мл). Объединенную органическую фазу сушили, выпаривали и очищали с помощью препаративной ВЭЖХ с получением Соединения 24 (50 мг, 6%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,29-5,27 (м, 1H), 2,81 (с, 1H), 2,38-2,34 (м, 1H), 2,05-0,85 (м, 38H), 0,67 (с, 3H), 0,60-0,45 (м, 2H), 0,30-0,15 (м, 2H). ЖХМС Rt=1,284 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C29H45 [M-2H2O+H]+ 393, найдено 393.
Синтез Соединений 25 и 26: 90 мг Соединения 24 (90 мг, 0,209 ммоль) очищали с помощью СФХ (Колонка: AD (250 мм×30 мм, 5 мкм); Условия: основание-MeOH) с получением пика 1 Соединения 25 (24,0 мг, 27%) и пика 2 Соединения 26 (11,1 мг, 12%) в виде почти белого твердого вещества.
Соединение 25: 1H-ЯМР (400 МГц, CDCl3) δ 5,29-5,27 (м, 1H), 2,82-2,79 (м, 1H), 2,43-2,40 (м, 1H), 2,05-0,80 (м, 38H), 0,67 (с, 3H), 0,55-0,40 (м, 2H), 0,30-0,15 (м, 2H). ЖХМС tR=1,280 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C29H45 [M-2H2O+H]+ 393, найдено 393.
Соединение 26: 1H-ЯМР (400 МГц, CDCl3) δ 5,29-5,27 (м, 1H), 2,82-2,79 (м, 1H), 2,43-2,40 (м, 1H), 2,05-0,80 (м, 38H), 0,67 (с, 3H), 0,55-0,40 (м, 2H), 0,30-0,15 (м, 2H). ЖХМС Rt=1,282 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C29H45 [M-2H2O+H]+ 393, найдено 393.
Пример 15. Синтез Соединений 27, 28 и 29.
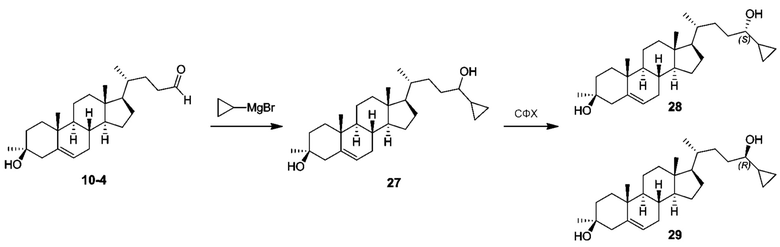
К раствору Соединения 10-4 (4 г, 10,7 ммоль) в ТГФ (50 мл) порциями добавляли циклопропилмагнийбромид (428 мл, 214 ммоль, 0,5М в ТГФ). Смесь перемешивали при 15°C в течение 16 часов. В смесь вливали насыщенный раствор NH4Cl (500 мл) и затем экстрагировали EtOAc (2×100 мл). Объединенную органическую фазу сушили, выпаривали и очищали с помощью хроматографии CombiFlash (0~20% EtOAc в ПЭ) с получением Соединения 27 (2 г, 45%) в виде почти белого твердого вещества.
Соединение 27: 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,29 (м, 1H), 2,80 (с, 1H), 2,43-2,40 (м, 1H), 2,02-1,43 (м, 16H), 1,40-0,80 (м, 20H), 0,67 (с, 3H), 0,55-0,40 (м, 2H), 0,30-0,15 (м, 2H). ЖХМС Rt=1,231 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C28H43 [M-2H2O+H]+ 379, найдено 379.
Синтез Соединений 28 и 29. 0,17 г Соединения 27 (170 мг, 0,409 ммоль) очищали с помощью СФХ (Колонка: AY (250 мм×30 мм, 10 мкм); Условия: основание-IPA) с получением пика 1 Соединения 28 (37 мг, 22%) и пика 2 Соединения 29 (50 мг, 30%) в виде почти белого твердого вещества.
Соединение 28: 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,29 (м, 1H), 2,82-2,79 (м, 1H), 2,43-2,40 (м, 1H), 2,05-0,80 (м, 36H), 0,67 (с, 3H), 0,55-0,40 (м, 2H), 0,30-0,15 (м, 2H). ЖХМС Rt=1,217 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C28H43 [M-2H2O+H]+ 379, найдено 379.
Соединение 29: 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,29 (м, 1H), 2,82-2,79 (м, 1H), 2,43-2,40 (м, 1H), 2,05-0,80 (м, 36H), 0,68 (с, 3H), 0,55-0,40 (м, 2H), 0,30-0,15 (м, 2H). ЖХМС Rt=1,218 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C28H43 [M-2H2O+H]+ 379, найдено 379.
Пример 16. Синтез Соединения 30.
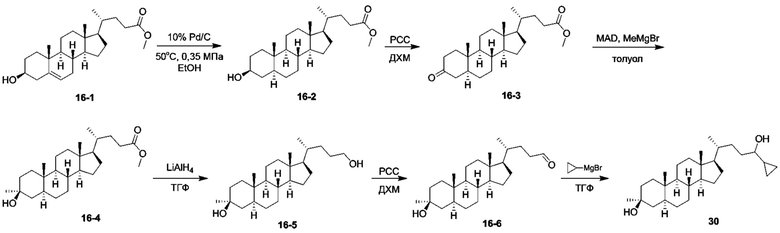
Синтез Соединения 16-2. К раствору Соединения 16-1 (5 г, 12,8 ммоль) в этаноле (100 мл) добавляли Pd/C (сухой, 10% на угле, 1 г). Смесь дегазировали и барботировали H2 три раза, и перемешивали при 50°C под давлением 0,35 МПа в течение 16 часов. Реакционную смесь фильтровали через слой целита и осадок на фильтре промывали ДХМ (100 мл). Фильтрат выпаривали с получением Соединения 16-2 (5 г, 100%) в виде почти белого твердого вещества, 1H-ЯМР (400 МГц, CDCl3) δ 3,66 (с, 3H), 3,63-3,53 (м, 1H), 2,41-2,29 (м, 1H), 2,26-2,16 (м, 1H), 1,98-1,89 (м, 1H), 1,86-1,55 (м, 6H), 1,51-1,17 (м, 12H), 1,15-0,95 (м, 5H), 0,94-0,82 (м, 5H), 0,79 (с, 3H), 0,67-0,56 (м, 4H).
Синтез Соединения 16-3. К раствору Соединения 16-2 (11 г, 28,1 ммоль) в ДХМ (200 мл) добавляли силикагель (9 г) и PCC (9,07 г, 42,1 ммоль). Потемневшую смесь перемешивали при 15°C в течение 16 часов. Реакционную смесь фильтровали и выпаривали фильтрат. Темный остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc/ДХМ=15/1/1) с получением Соединения 16-3 (10,5 г, 96%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,66 (с, 3H), 2,43-2,16 (м, 5H), 2,10-1,94 (м, 3H), 1,91-1,74 (м, 2H), 1,73-1,65 (м, 1H), 1,58-1,46 (м, 3H), 1,43-1,23 (м, 8H), 1,18-0,98 (м, 7H), 0,94-0,83 (м, 4H), 0,76-0,65 (м, 4H). ЖХМС Rt=1,257 мин в 2 мин хроматографии, 30-90AB, МС ЭРИ вычисл. для C25H41O3 [M+H]+ 389, найдено 389.
Синтез Соединения 16-4. К раствору 2,6-ди-трет-бутил-4-метилфенола (20,41 г, 92,5 ммоль) в безводном толуоле (70 мл) под N2 при 0°C по каплям добавляли триметилалюминий (2 М в толуоле, 23,1 мл, 46,2 ммоль). Смесь перемешивали при 0°C в течение 1 часа и охлаждали до -70°C. К вышеуказанному раствору по каплям добавляли раствор Соединения 16-3 (6 г, 15,4 ммоль) в безводном толуоле (100 мл). Смесь перемешивали при -70°C в течение 1 часа и затем по каплям добавляли метилмагнийбромид (3 М в диэтиловом эфире, 15,4 мл, 46,2 ммоль). Полученную смесь перемешивали при -70°C в течение 2 часов. В реакционную смесь вливали водную лимонную кислоту (200 мл) и три раза экстрагировали EtOAc и ТГФ (200 мл/50 мл). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc/ТГФ=20/1/1) с получением Соединения 16-4 (6 г, 96%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,66 (с, 3H), 2,40-2,16 (м, 2H), 1,99-1,90 (м, 1H), 1,89-1,73 (м, 2H), 1,68-0,83 (м, 29H), 0,80 (с, 3H), 0,70-0,60 (м, 4H). ЖХМС Rt=1,273 мин в 2 мин хроматографии, 30-90AB, МС ЭРИ вычисл. для C26H43O2 [M-H2O+H]+ 387, найдено 387.
Синтез Соединения 16-5. К раствору Соединения 16-4 (3 г, 7,41 ммоль) в безводном ТГФ (50 мл) при 0°C порциями добавляли LiAlH4 (421 мг, 11,1 ммоль). Смесь перемешивали при 0°C в течение 30 минут. В реакционную смесь вливали воду (5 мл) и водный NaOH (10%, 5 мл) по каплям, затем фильтровали через слой целита. Осадок на фильтре промывали ТГФ (5×20 мл). Фильтрат сушили над безводным сульфатом натрия, фильтровали и выпаривали с получением Соединения 16-5 (2,5 г, выход 90%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,61 (с, 2H), 1,97-1,94 (м, 1H), 1,89-1,75 (м, 1H), 1,68-1,52 (м, 6H), 1,50-1,18 (м, 16H), 1,17-0,84 (м, 11H), 0,80 (с, 3H), 0,70-0,60 (м, 4H). ЖХМС Rt=1,137 мин в 2 мин хроматографии, 30-90AB, МС ЭРИ вычисл. для C25H43O [M-H2O+H]+ 359, найдено 359.
Синтез Соединения 16-6. К раствору Соединения 16-5 (2 г, 5,31 ммоль) в безводном ДХМ (30 мл) добавляли силикагель (2,5 г) и PCC (2,28 г, 10,6 ммоль). Смесь перемешивали при 15°C в течение 16 часов. Реакционную смесь фильтровали и выпаривали фильтрат. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc/ТГФ=20/1/1) с получением Соединения 16-6 (1,3 г, 66%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 9,76 (с, 1H), 2,51-2,26 (м, 2H), 1,99-1,73 (м, 3H), 1,69-1,18 (м, 19H), 1,17-0,83 (м, 10H), 0,80 (с, 3H), 0,72-0,59 (м, 4H). ЖХМС Rt=1,212 мин в 2 мин хроматографии, 30-90AB, МС ЭРИ вычисл. для C25H39 [M-2H2O+H-]+ 339, найдено 339.
Синтез Соединения 30. К раствору циклопропилмагнийбромида (0,5 М в ТГФ, 21,2 мл, 10,6 ммоль) под N2 добавляли Соединение 16-6 (200 мг, 0,533 ммоль) при 25°C. Смесь перемешивали при 50°C в течение 16 часов. В реакционную смесь вливали водный NH4Cl (50 мл), экстрагировали EtOAc (3×50 мл), сушили над безводным сульфатом натрия, фильтровали и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=20/1) с получением Соединения 30 (100 мг, 45%) в виде почти белого твердого вещества, 1H-ЯМР (400 МГц, CDCl3) δ 2,85-2,75 (м, 1H), 2,00-1,93 (м, 1H), 1,93-1,73 (м, 1H), 1,73-0,83 (м, 34H), 0,80 (с, 3H), 0,70-0,59 (м, 4H), 0,57-0,43 (м, 2H), 0,30-0,16 (м, 2H) ЖХМС Rt=1,443 мин в 2 мин хроматографии, 10-80AB, МС ЭРИ вычисл. для C28H45 [M-2H2O+H]+ 381, найдено 381.
Пример 17. Синтез Соединений 31 и 32.
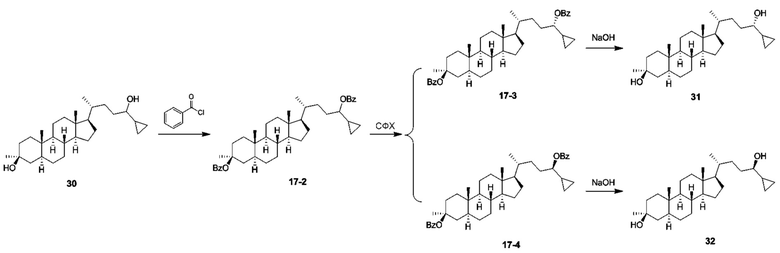
Синтез Соединения 17-2. К раствору Соединения 30 (440 мг, 1,05 ммоль) в пиридине (10 мл) добавляли бензоилхлорид (295 мг, 2,10 ммоль) при 25°C. Затем реакцию перемешивали при 50°C в течение 16 ч. Реакцию останавливали добавлением воды (10 мл) и экстрагировали EtOAc (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали в вакууме. Неочищенный продукт очищали на колонке с силикагелем (ПЭ/EtOAc=40/1) с получением Соединения 17-2 (420 мг, 64%) в виде желтого масла.
Синтез Соединений 17-3 и 17-4. Смесь Соединения 17-2 очищали с помощью разделения СФХ (колонка: AD (250 мм×30 мм, 10 мкм) градиент: B в A (A=NH3⋅H2O, B=EtOH), скорость потока: 30 мл/мин) с получением пика 1 Соединения 17-3 (170 мг, 41%) в виде почти белого твердого вещества и пика 2 Соединения 17-4 (160 мг, 38%) в виде почти белого твердого вещества.
Соединение 17-3: 1H-ЯМР (400 МГц, CDCl3) δ 8,06 (д, J=8,8 Гц, 2H), 7,99 (д, J=8,4 Гц, 2H), 7,58-7,48 (м, 2H), 7,48-7,38 (м, 4H), 4,55-4,45 (м, 1H), 2,11-0,77 (м, 37H), 0,73-0,55 (м, 5H), 0,52-0,45 (м, 2H), 0,39-0,31 (м, 1H).
Соединение 17-3: 1H-ЯМР (400 МГц, CDCl3) δ 8,06 (д, J=8,8 Гц, 2H), 7,99 (д, J=8,4 Гц, 2H), 7,58-7,48 (м, 2H), 7,48-7,38 (м, 4H), 4,55-4,45 (м, 1H), 2,11-0,77 (м, 37H), 0,73-0,55 (м, 5H), 0,52-0,45 (м, 2H), 0,39-0,31 (м, 1H).
Синтез Соединения 31. К раствору Соединения 17-3 (50 мг, 0,08 ммоль) в ТГФ (1 мл) и MeOH (1 мл) добавляли NaOH (63,5 мг, 1,59 ммоль) и H2O (1 мл) при 25°C. Раствор перемешивали при 50°C в течение 16 ч. Реакционный раствор экстрагировали EtOAc (2×5 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали в вакууме. Неочищенный продукт очищали на колонке с силикагелем (ПЭ/EtOAc=3/1) с получением требуемого продукта Соединения 31 (4,0 мг, 12%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 2,85-2,75 (м, 1H), 1,98-1,93 (м, 1H), 1,93-1,76 (м, 1H), 1,76-0,75 (м, 37H), 0,70-0,60 (м, 4H), 0,58-0,45 (м, 2H), 0,30-0,15 (м, 2H). ЖХМС Rt=1,437 мин в 2 мин хроматографии, 10-80AB, МС ЭРИ вычисл. для C28H45 381 ([M-2H2O+H]+), найдено 381.
Синтез Соединения 32. К раствору Соединения 17-4 (50 мг, 0,08 ммоль) в ТГФ (1 мл) и MeOH (1 мл) добавляли NaOH (63,5 мг, 1,59 ммоль) и H2O (1 мл) при 25°C. Реакционный раствор экстрагировали EtOAc (2×5 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали в вакууме. Неочищенный продукт очищали на колонке с силикагелем (ПЭ/EtOAc=3/1) с получением требуемого продукта Соединения 32 (8,0 мг, 24%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 2,84-2,76 (м, 1H), 1,96-1,92 (м, 1H), 1,90-1,73 (м, 1H), 1,73-0,83 (м, 34H), 0,81 (с, 3H), 0,70-0,61 (м, 4H), 0,58-0,44 (м, 2H), 0,29-0,19 (м, 2H). ЖХМС Rt=1,436 мин в 2 мин хроматографии, 10-80AB, МС ЭРИ вычисл. для C28H45 381 ([M-2H2O+H]+), найдено 381.
Пример 18. Синтез Соединения 33.
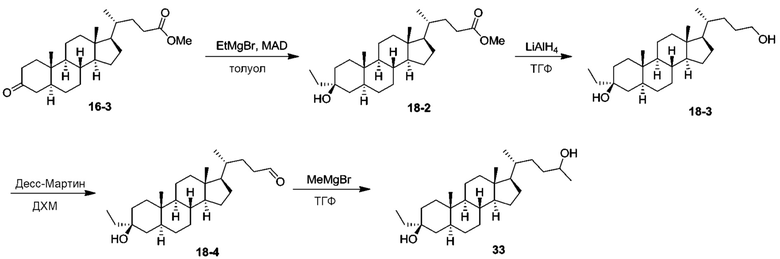
Синтез Соединения 18-2. К раствору 2,6-ди-трет-бутил-4-метилфенола (17 г, 77,1 ммоль) в толуоле (50 мл) добавляли триметилалюминий (19,2 мл, 2М в толуоле) при 10°C. Смесь перемешивали при 20°C в течение 1 ч. К раствору по каплям добавляли раствор Соединения 16-3 (5 г, 12,8 ммоль) в толуоле (20 мл) при -70°C под N2. Смесь перемешивали при -70°C в течение 1 часа. Раствор EtMgBr (12,7 мл, 3М) по каплям добавляли при -70°C. Смесь перемешивали при -70°C в течение еще 3 часов и затем в реакционную смесь вливали лимонную кислоту (150 мл, нас. водн.). Реакцию нагревали до 25°C. Органический слой отделяли и выпаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=200/1→10/1) с получением Соединения 18-2 (3,8 г) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 3,66 (с, 3H), 2,41-2,30 (м, 1H), 2,26-2,15 (м, 1H), 1,94 (тд, J=3,3, 12,5 Гц, 1H), 1,90-1,73 (м, 2H), 1,69-1,58 (м, 3H), 1,56-0,84 (м, 28H), 0,82 (с, 3H), 0,64 (с, 4H).
Синтез Соединения 18-3. LiAlH4 (500 мг, 13,17 ммоль) добавляли в ТГФ (50 мл) под N2 при 0°C. К смеси добавляли раствор Соединения 18-2 (1,5 г, 3,58 ммоль) в ТГФ (15 мл) при 0°C. Смесь перемешивали при 0°C в течение 20 мин. Добавляли воду (1 мл) в ТГФ (1 мл), при этом в растворе образовалось почти белое твердое вещество. Смесь фильтровали, выпаривали в вакууме с получением Соединения 18-3 (700 мг, неочищенный продукт) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,70-3,55 (ш, 2H), 1,98-1,90 (м, 1H), 1,90-1,72 (м, 1H), 1,72-0,72 (м, 39H), 0,64 (с, 3H).
Синтез Соединения 18-4. К раствору Соединения 18-3 (100 мг, неочищенный продукт) в ДХМ (5 мл) добавляли реактив Десса-Мартина (215 мг) при 0°C под N2. Смесь перемешивали при 20°C в течение 2 ч. Добавляли раствор NaHCO3 (215 мг) и Na2S2O3 (348 мг) в воде (10 мл). Смесь экстрагировали петролейным эфиром (3×10 мл). Органический слой отделяли, промывали водой (20 мл), сушили над Na2SO4, фильтровали и выпаривали в вакууме, с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=100/1→8/1) с получением Соединения 18-4 (52 мг) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 9,76 (с, 1H), 2,51-2,24 (м, 2H), 1,98-1,90 (м, 1H), 1,89-1,73 (м, 2H), 1,68-1,59 (м, 3H), 1,54-0,77 (м, 30H), 0,65 (с, 5H).
Синтез Соединения 33. К раствору Соединения 18-4 (52 мг, 0,134 ммоль) в ТГФ (1 мл) добавляли метилмагнийбромид (0,5 мл, 1,5 ммоль, 3М в эфире) при -70°C под N2. Смесь перемешивали при 20°C в течение 20 мин и затем добавляли насыщенный NH4Cl (4 мл), EtOAc (5 мл) и H2O (3 мл). Смесь экстрагировали EtOAc (3×6 мл), промывали насыщенным NaCl (2×15 мл), сушили над Na2SO4, фильтровали и выпаривали в вакууме, с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=100/1→12/1) с получением Соединения 33 (18,4 мг, 30%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,78-3,70 (м, 1H), 1,99-1,91 (м, 1H), 1,89-1,76 (м, 1H), 1,68-0,80 (м, 41H), 0,65 (с, 4H). ЖХМС Rt=1,448 мин в 2 мин хроматографии, 10-80AB_E, МС ЭРИ вычисл. для C27H45 [M-2H2O+H]+ 369, найдено 369.
Пример 19. Синтез Соединения 34.
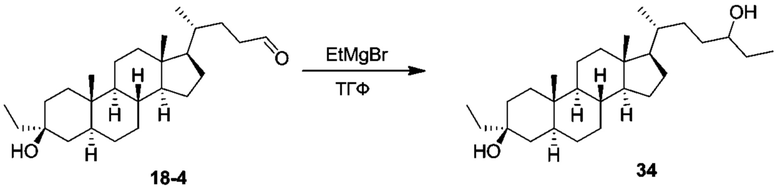
Синтез Соединения 34. К раствору Соединения 18-4 (250 мг, неочищенный продукт) в ТГФ (20 мл) добавляли этилмагнийбромид (2,2 мл, 6,6 ммоль, 3М в эфире) при -70°C под N2. Смесь перемешивали при 20°C в течение 1 ч и затем добавляли насыщенный NH4Cl (20 мл), EtOAc (20 мл) и H2O (10 мл). Смесь экстрагировали EtOAc (3×20 мл), промывали насыщенным NaCl (2×60 мл), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=100/1→12/1) с получением Соединения 34 (80 мг) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,53-3,42 (м, 1H), 2,00-1,92 (м, 1H), 1,89-1,75 (м, 1H), 1,69-1,58 (м, 3H), 1,56-0,84 (м, 37H), 0,82 (с, 3H), 0,68-0,59 (м, 4H). ЖХМС Rt=1,526 мин в 2 мин хроматографии, 10-80AB_E, МС ЭРИ вычисл. для C28H47 [M-2H2O+H]+ 383, найдено 383.
Пример 20. Синтез Соединений 35 и 36.
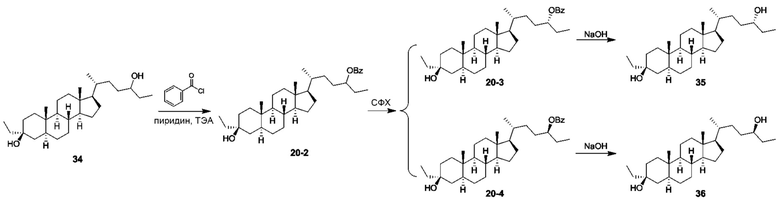
Синтез Соединения 20-2. К раствору Соединения 34 (64 мг, 0,153 ммоль) в пиридине (3 мл) добавляли бензоилхлорид (32,2 мг, 0,229 ммоль) и триэтиламин (23,1 мг, 0,229 ммоль). Смесь перемешивали при 25°C в течение 5 ч, а затем в реакционную смесь вливали насыщенный NH4Cl (6 мл). Смесь экстрагировали EtOAc (3×6 мл), промывали нас. NaCl (2×15 мл), сушили над Na2SO4, фильтровали, выпаривали в вакууме с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=50/1→10/1) с получением Соединения 20-2 (70 мг, неочищенный продукт). ЖХМС Rt=1,257 мин в 1,5 мин хроматографии, 5-95AB, МС ЭРИ вычисл. для C28H47 [M-BzOH-H2O+H]+ 383, найдено 383.
Синтез Соединений 20-3 и 20-4. (СФХ). Соединение 20-2 (70 мг, неочищенный продукт) разделяли с помощью СФХ (колонка: IC (250 мм×30 мм, 10 мкм); Условия: основание-IPA; Градиент: 35% B; скорость потока: 80 мл/мин), с получением Соединения 20-3 (18 мг, Rt=5,988 мин) и Соединения 20-4 (30 мг, Rt=6,229 мин).
Синтез Соединения 35. К раствору Соединения 20-3 (18 мг, 0,03442 ммоль) в ТГФ (1 мл) и MeOH (1 мл) добавляли водн. NaOH (1 мл, 20%). Смесь перемешивали при 20°C в течение 20 ч. Смесь выпаривали в вакууме, экстрагировали EtOAc (2×2 мл), промывали NaHCO3 (3×4 мл) и солевым раствором (2×3 мл), сушили над Na2SO4, фильтровали, выпаривали в вакууме с получением Соединения 35 (8,5 мг, 59%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,55-3,40 (м, 1H), 2,00-1,90 (м, 1H), 1,85-1,75 (м, 1H), 1,65-1,55 (м, 4H), 1,50-0,85 (м, 36H), 0,82 (с, 3H), 0,65-0,60 (м, 4H). ЖХМС tR=1,322 мин в 2 мин хроматографии, 30-90AB_E, МС ЭРИ вычисл. для C28H47 [M-2H2O+H]+ 383, найдено 383.
Синтез Соединения 36. К раствору Соединения 20-4 (30 мг, 0,057 ммоль) в ТГФ (1 мл) и MeOH (1 мл) добавляли водн. NaOH (1 мл, 20%). Смесь перемешивали при 20°C в течение 20 ч. Смесь выпаривали в вакууме, экстрагировали EtOAc (2×2 мл), промывали NaHCO3 (3×4 мл) и солевым раствором (2×3 мл), сушили над Na2SO4, фильтровали, выпаривали в вакууме с получением Соединения 36 (5,2 мг, 22%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,55-3,40 (м, 1H), 2,00-1,90 (м, 1H), 1,85-1,75 (м, 1H), 1,65-1,55 (м, 4H), 1,50-0,85 (м, 36H), 0,82 (с, 3H), 0,65-0,60 (м, 4H) ЖХМС tR=1,507 мин в 2 мин хроматографии, 30-90AB_E, МС ЭРИ вычисл. для C28H47 [M-2H2O+H]+ 383, найдено 383.
Пример 21. Синтез Соединения 37.
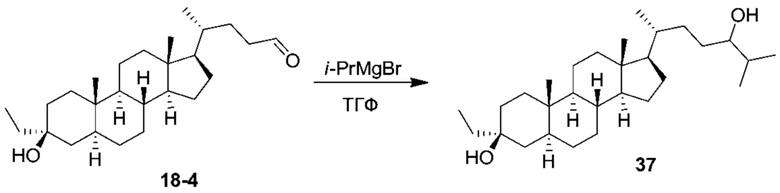
К раствору Соединения 18-4 (50 мг, неочищенный продукт) в ТГФ (20 мл) добавляли изопропилмагнийбромид (3,2 мл, 6,4 ммоль, 2 М в ТГФ) при -70°C под N2. Смесь перемешивали при 20°C в течение 1 ч. К смеси добавляли насыщенный NH4Cl (20 мл), EtOAc (20 мл) и H2O (10 мл). Смесь экстрагировали EtOAc (3×20 мл), промывали насыщенным NaCl (2×60 мл), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=100/1→12/1) с получением Соединения 37 (5,3 мг) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,35-3,27 (м, 1H), 1,96 (д, J=12,8 Гц, 1H), 1,88-1,76 (м, 1H), 1,73-1,58 (м, 5H), 1,53-0,84 (м, 37H), 0,82 (с, 3H), 0,68-0,59 (м, 4H). ЖХМС tR=1,371 мин в 2 мин хроматографии, 30-90AB_E, МС ЭРИ вычисл. для C29H49 [M-2H2O+H]+ 397, найдено 397.
Пример 22. Синтез Соединения 38.
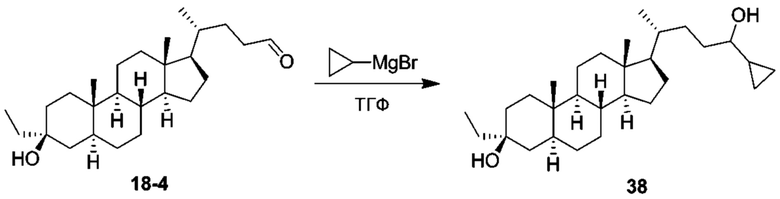
Раствор Соединения 18-4 (250 мг, неочищенный продукт) в ТГФ (20 мл) добавляли к циклопропилмагнийбромиду (12,8 мл, 6,4 ммоль, 0,5 М в ТГФ) при -70°C под N2. Смесь перемешивали при 20°C в течение 1 ч. К смеси добавляли насыщенный NH4Cl (20 мл), EtOAc (20 мл) и H2O (10 мл). Смесь экстрагировали EtOAc (3×20 мл), промывали насыщенным NaCl (2×60 мл), сушили над Na2SO4, фильтровали, выпаривали в вакууме с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=100/1→12/1) с получением Соединения 38 (110 мг, 40%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 2,85-2,75 (м, 1H), 2,00-1,92 (м, 1H), 1,89-1,76 (м, 1H), 1,69-1,59 (м, 4H), 1,55-0,85 (м, 32H), 0,82 (с, 3H), 0,65 (с, 4H), 0,56-0,43 (м, 2H), 0,29-0,16 (м, 2H). ЖХМС tR=1,518 мин в 2 мин хроматографии, 10-80AB_E, МС ЭРИ вычисл. для C29H47 [M-2H2O+H]+ 395, найдено 395.
Пример 23. Синтез Соединений 39 и 40.
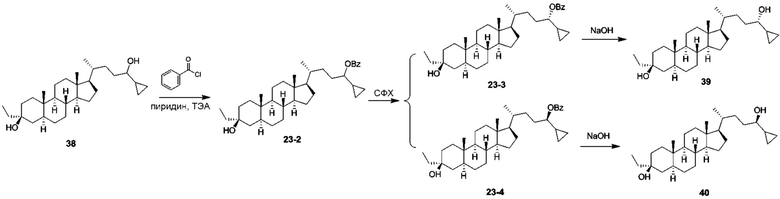
Синтез Соединения 23-2. К раствору Соединения 38 (80 мг, 0,186 ммоль) в пиридине (3 мл) добавляли бензоилхлорид (39,1 мг, 0,279 ммоль) и триэтиламин (28,1 мг, 0,279 ммоль). Смесь перемешивали при 25°C в течение 5 ч. В реакционную смесь вливали насыщенный NH4Cl (6 мл). Смесь экстрагировали EtOAc (3×6 мл), промывали насыщенным NaCl (2×15 мл), сушили над Na2SO4, фильтровали, выпаривали в вакууме с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=50/1→10/1) с получением Соединения 23-2 (80 мг, неочищенный продукт). ЖХМС tR=1,247 мин в 1,5 мин хроматографии, 5-95 AB_E, МС ЭРИ вычисл. для C29H47 [M-BzOH-H2O+H]+ 395, найдено 395.
Синтез Соединений 23-3 и 23-4. Соединение 23-2 (80 мг, неочищенный продукт) разделяли с помощью СФХ (колонка: IC (250 мм×30 мм, 10 мкм); Условия: основание-IPA; Градиент: 30% B; скорость потока: 50 мл/мин) с получением Соединения 23-3 (23 мг, Rt=6,153) и Соединения 23-4 (35 мг, Rt=6,357).
Синтез Соединения 39. К раствору Соединения 23-3 (23 мг, 0,04 ммоль) в ТГФ (1 мл) и MeOH (1 мл) добавляли водн. NaOH (2 мл, 20%). Смесь перемешивали при 20°C в течение 20 ч. Смесь выпаривали в вакууме, экстрагировали EtOAc (2×2 мл), промывали NaHCO3 (3×4 мл) и солевым раствором (2×3 мл), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением твердого вещества, которое очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=100/1→8/1) с получением Соединения 39 (9 мг, 49%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 2,85-2,75 (м, 1H), 2,00-1,92 (м, 1H), 1,89-1,76 (м, 1H), 1,75-1,59 (м, 6H), 1,55-0,89 (м, 30H), 0,82 (с, 3H), 0,70-0,60 (м, 4H), 0,56-0,43 (м, 2H), 0,29-0,16 (м, 2H) ЖХМС tR=1,484 мин в 2 мин хроматографии, 30-90AB_E, МС ЭРИ вычисл. для C29H47 [M-2H2O+H]+ 395, найдено 395.
Синтез Соединения 40. К раствору Соединения 23-4 (35 мг, 0,065 ммоль) в ТГФ (1 мл) и MeOH (1 мл) добавляли водн. NaOH (2 мл, 20%). Смесь перемешивали при 20°C в течение 20 ч. Смесь выпаривали в вакууме, экстрагировали EtOAc (2×2 мл), промывали NaHCO3 (3×4 мл) и солевым раствором (2×3 мл), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением Соединения 40 (14 мг, 50%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 2,85-2,75 (м, 1H), 2,00-1,92 (м, 1H), 1,89-1,76 (м, 1H), 1,69-1,59 (м, 2H), 1,55-0,85 (м, 34H), 0,82 (с, 3H), 0,65 (м, 4H), 0,56-0,43 (м, 2H), 0,29-0,16 (м, 2H) ЖХМС tR=1,510 мин в 2 мин хроматографии, 30-90AB_E, МС ЭРИ вычисл. для C29H47 [M-2H2O+H]+ 395, найдено 395.
Пример 24. Синтез Соединения 41.
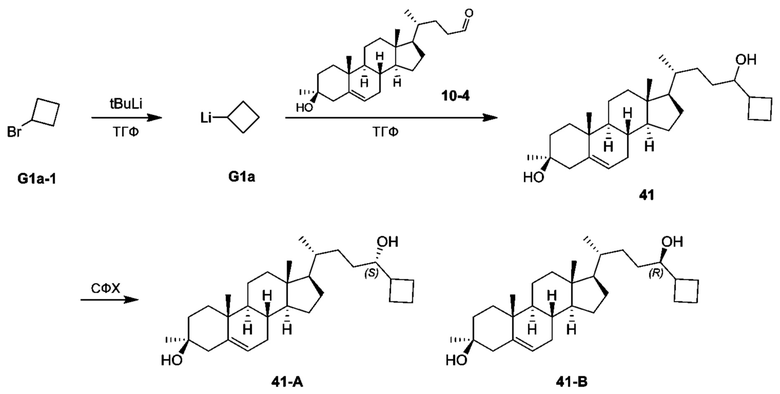

Стадия 1 . К раствору G1a-1 (1 г, 7,4 ммоль) в ТГФ (7 мл) под N2 по каплям добавляли t-BuLi (9,25 мл, 1,6 М в смеси пентанов, 14,8 ммоль) при -60°C. После добавления смесь медленно нагревали до -40°C в течение 0,5 ч с получением раствора G1a в ТГФ, который использовали непосредственно на следующей стадии.
Стадия 2 . В ТГФ (2 мл) под N2 добавляли G1a (0,87 мл, 0,46 М в ТГФ и смеси пентанов, 0,402 ммоль) при -70°C. После перемешивания при -70°C в течение 5 мин, добавляли раствор Соединения 10-4 (50 мг, 0,314 ммоль) в ТГФ (3 мл). Реакционную смесь постепенно нагревали до 15°C в течение 10 часов. В смесь вливали 10 мл нас. NH4Cl и экстрагировали 50 мл EtOAc. Отделенную органическую фазу промывали 10 мл солевого раствора, сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали с помощью хроматографии на силикагеле, элюируя ПЭ/EtOAc=10/1~2/1, с получением Соединения 41 (7,3 мг, 13%) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 5,35-5,25 (м, 1H), 3,49-3,32 (м, 1H), 2,48-2,38 (м, 1H), 2,38-2,25 (м, 1H), 2,05-1,71 (м, 12H), 1,50-0,86 (м, 29H), 0,72-0,63 (м, 3H). ЖХМС Rt=1300 мин в 2 мин хроматографии, 30-90AB_E.M, МС ЭРИ вычисл. для C29H45 [M-2H2O+H]+ 393, найдено 393.
Стадия 3 . Соединение 41 (800 мг, 1,86 ммоль) разделяли с помощью СФХ (Колонка: AD (250 мм×30 мм, 5 мкм). Условия: 0,1% NH3H2O EtOH. Градиент: 40% B. Скорость потока: 40 мл/мин), с получением Соединения 41-A (123 мг, 15%) в виде почти белого твердого вещества и Соединения 41-B (109 мг, 14%) в виде почти белого твердого вещества.
Соединение 41-A: 1H-ЯМР (400 МГц, CDCl3) δ 5,32-5,28 (м, 1H), 3,46-3,38 (м, 1H), 2,46-2,27 (м, 2H), 2,02-1,67 (м, 13H), 1,55-1,36 (м, 8H), 1,31-1,22 (м, 2H), 1,19-1,06 (м, 8H), 1,05-0,89 (м, 10H), 0,67 (с, 3H). ЖХМС Rt=1,321 мин в 2,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C29H45 [M+H-2H2O]+ 393, найдено 393.
Соединение 41-B: 1H-ЯМР (400 МГц, CDCl3) δ 5,33-5,28 (м, 1H), 3,49-3,42 (м, 1H), 2,45-2,39 (м, 1H), 2,36-2,28 (м, 1H), 2,04-1,66 (м, 12H), 1,53-1,22 (м, 10H), 1,20-0,98 (м, 12H), 0,96-0,77 (м, 7H), 0,68 (с, 3H). ЖХМС Rt=1,316 мин в 2,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C29H45 [M+H-2H2O]+ 393, найдено 393.
Пример 25. Синтез Соединения 42.
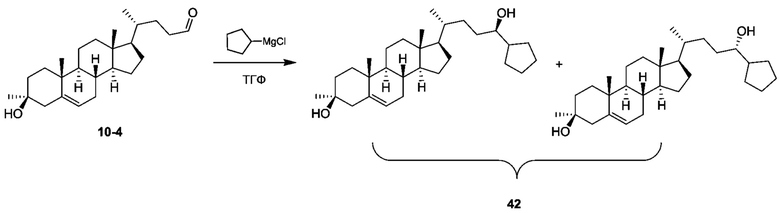
В ТГФ (1 мл) под N2 добавляли циклопентилмагнийхлорид (0,402 мл, 1,0 М в ТГФ, 0,402 ммоль) при -70°C. После перемешивания при -70°C в течение 5 мин, добавляли раствор Соединения 10-4 (50 мг, 0,134 ммоль) в ТГФ (4 мл). Реакционную смесь постепенно нагревали до 15°C в течение 18 часов. В смесь вливали 10 мл насыщенного NH4Cl и экстрагировали 50 мл EtOAc. Отделенную органическую фазу промывали 10 мл солевого раствора, сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали на колонке для флеш-хроматографии, элюируя ПЭ/EtOAc=10/1~2/1, с получением Соединения 42 (4,1 мг, 7%) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 5,35-5,25 (м, 1H), 3,40-3,29 (м, 1H), 2,46-2,37 (м, 1H), 2,05-1,60 (м, 12H), 1,55-0,82 (м, 32H), 0,72-0,61 (м, 3H). ЖХМС Rt=1,389 мин в 2 мин хроматографии, 30-90AB_E.M, МС ЭРИ вычисл. для C30H47 [M-2H2O+H]+ 407, найдено 407.
Пример 26. Синтез Соединения 43.
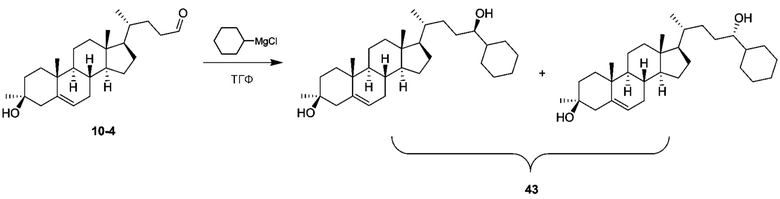
В ТГФ (1 мл) под N2 добавляли циклогексилмагнийхлорид (0,402 мл, 2,0 М в ТГФ, 0,804 ммоль) при -70°C. После перемешивания при -70°C в течение 5 мин, добавляли раствор Соединения 10-4 (100 мг, 0,268 ммоль) в ТГФ (1 мл). Реакционную смесь постепенно нагревали до 15°C в течение 18 ч. В смесь вливали 10 мл нас. NH4Cl и экстрагировали 50 мл EtOAc. Отделенную органическую фазу промывали 10 мл солевого раствора, сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали на колонке для флеш-хроматографии, элюируя ПЭ/EtOAc 10/1→2/1, с получением Соединения 43 (20 мг, 16%) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 5,40-5,25 (м, 1H), 3,40-3,26 (м, 1H), 2,51-2,30 (м, 1H), 2,09-1,91 (м, 3H), 1,90-1,59 (м, 10H), 1,55-0,85 (м, 33H), 0,68 (с, 3H). ЖХМС Rt=1,490 мин в 2 мин хроматографии, 30-90AB_E.M, МС ЭРИ вычисл. для C31H49 [M-2H2O+H]+ 421, найдено 421.
Пример 27. Синтез Соединения 44.
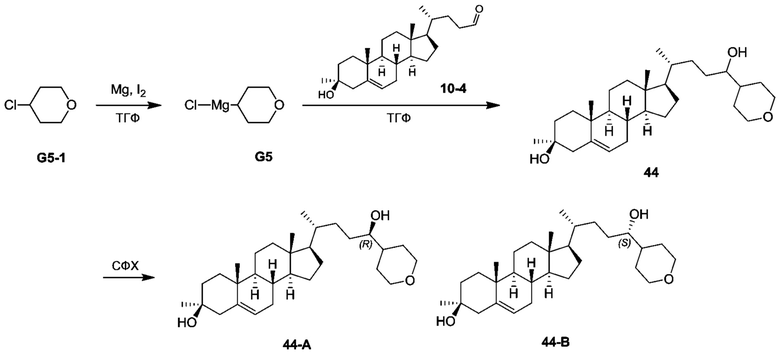
Стадия 1 . К энергично перемешиваемой суспензии стружек Mg (602 мг, 24,8 ммоль) и иода (31,3 мг, 0,124 ммоль) в ТГФ (5 мл) под N2 добавляли G5-1 (0,15 г, 1,24 ммоль). Смесь нагревали до 60°C. После начала реакции медленно добавляли G5-1 (1,35 г, 11,16 ммоль) в ТГФ (6 мл). После добавления смесь перемешивали при 60°C в течение 2 ч с получением серой суспензии G5 в ТГФ, которую использовали непосредственно на следующей стадии.
Стадия 2 . В ТГФ (2 мл) под N2 добавляли G5 (0,402 мл, 1,0 М в ТГФ, 0,402 ммоль) при -70°C. После перемешивания при -70°C в течение 5 мин, добавляли раствор Соединения 10-4 (50 мг, 0,314 ммоль) в ТГФ (3 мл). Реакционную смесь постепенно нагревали до 15°C и перемешивали в течение 18 часов. В смесь вливали 10 мл насыщенного NH4Cl и экстрагировали 50 мл EtOAc. Отделенную органическую фазу промывали 10 мл солевого раствора, сушили над Na2SO4 и выпаривали. Остаток очищали на колонке для флеш-хроматографии, элюируя ПЭ/EtOAc=10/1→2/1, с получением Соединения 44 (10 мг, 16%) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 5,38-5,25 (м, 1H), 4,11-3,89 (м, 2H), 3,42-3,24 (м, 3H), 2,47-2,36 (м, 1H), 2,04-1,91 (м, 3H), 1,90-1,59 (м, 6H), 1,53-1,45 (м, 14H), 1,40-0,86 (м, 17H), 0,68 (с, 3H). ЖХМС Rt=1,187 мин в 2 мин хроматографии, 30-90AB_E.M, МС ЭРИ вычисл. для C30H49O2 [M-H2O+H]+ 441, найдено 441.
Стадия 3 . Продукт Соединение 44 (830 мг, 1,80 ммоль) очищали с помощью СФХ (Колонка: AD (250 мм×30 мм, 5 мкм); Условия: 0,1% NH3H2O IPA; Градиент 40%B; Время элюирования в градиенте (мин): 30; Скорость потока (мл/мин): 60), с получением Соединения 44-A (142 мг, 17%) в виде белого твердого вещества и Соединения 44-B (220 мг, 27%) в виде белого твердого вещества.
Соединение 44-A: 1H-ЯМР (400 МГц, CDCl3) δ 5,33-5,28 (м, 1H), 4,05-3,96 (м, 2H), 3,43-3,30 (м, 3H), 2,46-2,38 (м, 1H), 2,05-1,92 (м, 3H), 1,91-1,66 (м, 4H), 1,65-1,57 (м, 2H), 1,54-1,41 (м, 10H), 1,40-1,20 (м, 5H), 1,19-1,06 (м, 7H), 1,05-0,88 (м, 9H), 0,68 (с, 3H). ЖХМС Rt=1,167 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C30H49O2 [M+H-H2O]+ 441, найдено 441.
Соединение 44-B: 1H-ЯМР (400 МГц, CDCl3) δ 5,34-5,27 (м, 1H), 4,06-3,97 (м, 2H), 3,43-3,28 (м, 3H), 2,47-2,38 (м, 1H), 2,04-1,92 (м, 3H), 1,89-1,66 (м, 4H), 1,64-1,57 (м, 5H), 1,53-1,35 (м, 9H), 1,33-1,21 (м, 3H), 1,21-1,07 (м, 7H), 1,06-0,90 (м, 9H), 0,68 (с, 3H). ЖХМС Rt=1,163 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C30H49O2 [M+H-H2O]+ 441, найдено 441.
Пример 28. Синтез Соединений 45 и 46.
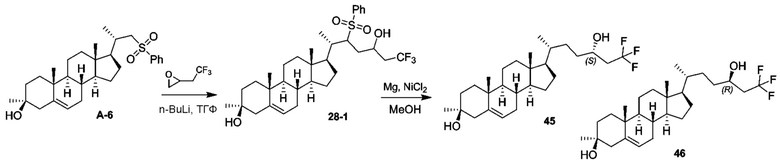
Синтез Соединения 28-1. В ТГФ (5 мл) под N2 при -70°C добавляли n-BuLi (2,96 мл, 2,5 М в гексане, 7,42 ммоль). После этого по каплям добавляли суспензию A-6 (1 г, 2,12 ммоль) в ТГФ (8 мл) с получением светло-желтой суспензии. После перемешивания при -70°C в течение 30 мин, добавляли раствор 2-(2,2,2-трифторэтил)оксирана (320 мг, 2,52 ммоль) в ТГФ (5 мл). Реакционную смесь перемешивали при -70°C в течение 10 мин, нагревали до 15°C и перемешивали в течение 16 ч. Реакцию останавливали насыщенным NH4Cl (40 мл), экстрагировали EtOAc (3×100 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали с получением Соединения 28-1 (1,15 г, неочищенный продукт) в виде светло-желтого твердого вещества, которое использовали непосредственно на следующей стадии.
Синтез Соединений 45 и 46. К раствору Соединения 28-1 (1,15 г, 1,92 ммоль) в 25 мл сухого MeOH под N2 добавляли магниевую стружку (0,2 г, 8,22 ммоль) (активированную 0,5% водной HCl, водой, сухим EtOH и MTBE) и NiCl2 (49,7 мг, 0,384 ммоль) с перемешиванием при 50°C, чтобы инициировать непрерывное выделение водорода. После добавления десяти порций по 0,2 г магниевой стружки, в реакционную смесь вливали 2M HCl (250 мл) при 10°C до растворения твердой фазы. Смесь экстрагировали EtOAc (400 мл). Органический слой промывали насыщенным NaHCO3 (50 мл), солевым раствором (50 мл), сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали на колонке для флеш-хроматографии, элюируя ПЭ:EtOAc=20:1-5:1, с получением 300 мг неочищенного продукта в виде почти белого твердого вещества. Неочищенный продукт затем очищали с помощью СФХ (Колонка: Chiralpak AD-3 150×4,6 мм, внутр.диам. 3 мкм; Подвижная фаза: A: CO2; B: метанол (0,05% DEA) Градиент: от 5% до 40% B за 5 мин, выдерживание 40% 2,5 мин, затем 5% B 2,5 мин; Скорость потока: 2,5 мл/мин; Темп. колонки: 35°C), с получением Соединения 45 (99,9 мг, 11%) и Соединения 46 (84 мг, 10%).
Соединение 45: 1H-ЯМР (400 МГц, CDCl3) δ 5,38-5,25 (м, 1H), 4,06-3,88 (м, 1H), 2,48-2,35 (м, 1H), 2,32-2,18 (м, 2H), 2,08-1,90 (м, 3H), 1,87-1,63 (м, 4H), 1,60-1,45 (м, 12H), 1,40-0,83 (м, 16H), 0,68 (с, 3H). ЖХМС Rt=1,203 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C27H42F3O [M+H-H2O]+ 439, найдено 439. СФХ Rt=4,933 мин в 10 мин хроматографии, AD_3_MeOH_DEA_5_40_25ML.
Соединение 46: 1H-ЯМР (400 МГц, CDCl3) δ 5,35-5,25 (м, 1H), 4,01-3,88 (м, 1H), 2,45-2,35 (м, 1H), 2,32-2,18 (м, 2H), 2,05-1,91 (м, 3H), 1,90-1,60 (м, 4H), 1,60-1,45 (м, 12H), 1,40-0,83 (м, 16H), 0,69 (с, 3H). ЖХМС Rt=1,205 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C27H42F3O [M+H-H2O]+ 439, найдено 439. СФХ Rt=5,640 мин в 10 мин хроматографии, AD_3_MeOH_DEA_5_40_25ML.
Пример 29. Синтез Соединения 47.
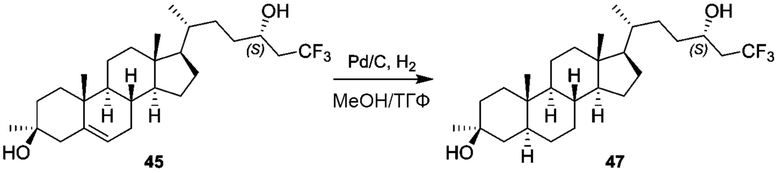
К раствору Соединения 45 (140 мг, 0,307 ммоль) в MeOH/ТГФ (10 мл/1 мл) добавляли Pd/C (сухой, 10%, 350 мг) под Ar. После дегазации три раза током N2, реакционную смесь дегазировали три раза током H2. Реакционную смесь перемешивали в течение 16 ч при 55°C в атмосфере H2 (0,35 МПа). Катализатор удаляли на вакуумном фильтре, и фильтрат выпаривали с получением неочищенного продукта, который очищали на колонке с силикагелем (EtOAc в ПЭ, 10%-15%) с получением Соединения 47 (30 мг, 21%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 3,96-3,94 (м, 1H), 2,30-2,21 (м, 2H), 1,97-1,93 (м, 1H), 1,92-1,81 (м, 2H), 1,80-1,58 (м, 4H), 1,55-1,26 (м, 6H), 1,24-1,20 (м, 11H), 1,19-0,93 (м, 11H), 0,80 (с, 3H), 0,66-0,62 (м, 4H). ЖХМС Rt=1,220 мин в 2 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C27H44F3O [M+H-H2O]+ 441, найдено 441.
Пример 30. Синтез Соединения 48.
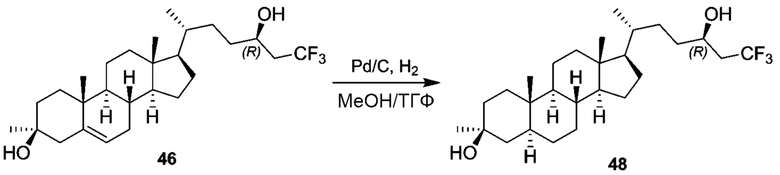
К раствору Соединения 46 (102 мг, 0,223 ммоль) в MeOH/ТГФ (10 мл/1 мл) добавляли Pd/C (сухой, 10%, 350 мг) под Ar. После дегазации три раза током N2, реакционную смесь дегазировали три раза током H2. Реакционную смесь перемешивали в течение 16 ч при 55°C под атмосферой H2 (0,35 МПа). Катализатор удаляли на вакуумном фильтре, и фильтрат выпаривали с получением неочищенного продукта, который очищали на колонке с силикагелем (EtOAc в ПЭ, 10%-15%) с получением Соединения 48 (25 мг, 24%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 4,00-3,95 (м, 1H), 2,29-2,26 (м, 2H), 1,97-1,93 (м, 1H), 1,92-1,81 (м, 2H), 1,80-1,58 (м, 4H), 1,55-1,26 (м, 6H), 1,24-1,20 (м, 11H), 1,19-0,93 (м, 11H), 0,80 (с, 3H), 0,66-0,64 (м, 4H). ЖХМС Rt=1,218 мин в 2 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C27H44F3O [M+H-H2O]+ 441, найдено 441.
Пример 31. Синтез соединений 49, 50 и 51.
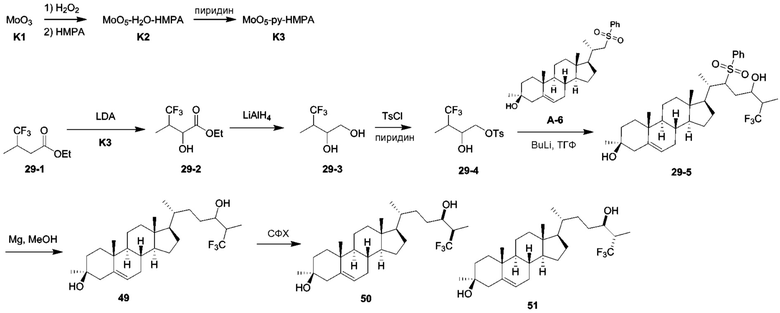
Синтез K2. К 150 мл 30% H2O2 в воде добавляли MoO3 (3 г, 208 ммоль). Смесь перемешивали при 40°C в течение 5 ч, в результате чего образовался желтый раствор, содержащий суспендированное белое твердое вещество. После охлаждения до 20°C суспензию фильтровали через 1 см слой целита. Желтый фильтрат охлаждали до 10°C (в ледяной бане с перемешиванием на магнитной мешалке) и по каплям добавляли HMPA (37,2 г, 208 ммоль). Образовался желтый кристаллический осадок. После фильтрации желтый продукт перекристаллизовывали из 100 мл EtOH при -20°C с получением 52 г неочищенного K2 в виде желтого твердого вещества.
Синтез K3. K2 (52 г, 138 ммоль) сушили над P2O5 в вакууме в течение 6 ч с получением 50 г желтого твердого вещества. Желтое твердое вещество растворяли в 150 мл ТГФ при 20°C. Добавляли пиридин (11,1 г, 140 ммоль). После перемешивания при 20°C в течение 10 мин получали желтое кристаллическое вещество. После фильтрования осадок на фильтре промывали ТГФ (50 мл), MTBE (200 мл) и сушили в вакууме с получением 48 г неочищенного K3 в виде желтого твердого вещества, которое использовали непосредственно.
Синтез Соединения 29-2. К раствору диизопропиламина (1,81 мл, 12,9 ммоль) в ТГФ (80 мл) под N2 при -70°C по каплям добавляли раствор n-BuLi (5,15 мл, 12,9 ммоль, 2,5 М в гексане). После перемешивания при -70°C в течение 10 мин, реакционную смесь постепенно нагревали до 10°C в течение 0,5 ч. После охлаждения до -70°C добавляли раствор Соединения 29-1 (2 г, 10,8 ммоль) в ТГФ (20 мл). Реакционную смесь перемешивали в течение 0,5 ч. Добавляли K3 (7,06 г, 16,2 ммоль). После перемешивания при -20°C в течение 3 ч, в смесь вливали 200 мл насыщенного Na2SO3 и экстрагировали MTBE (2×200 мл). Объединенную органическую фазу промывали 100 мл солевого раствора, сушили над Na2SO4, фильтровали и выпаривали с получением 2,1 г неочищенного продукта в виде коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ 4,55 (с, 1H), 4,37-4,24 (м, 2H), 3,16-3,03 (м, 1H), 2,78-2,66 (м, 1H), 1,32 (т, J=6,8 Гц, 3H), 1,09 (д, J=6,8 Гц, 3H).
Синтез Соединения 29-3. К раствору Соединения 29-2 (2,1 г, 10,4 ммоль) в ТГФ (100 мл) порциями добавляли LiAlH4 (789 мг, 20,8 ммоль) при -10°C под N2. Реакционную смесь перемешивали при 15°C в течение 2 ч. Реакцию останавливали водой (1 мл), 15% водным раствором NaOH (1 мл) и по каплям добавляли воду (3 мл) при 0°C. После перемешивания при 15°C в течение 15 мин, добавляли 2 г MgSO4 при 15°C. Смесь перемешивали при этой температуре в течение 1 ч. После вакуумного фильтрования через целит и промывки ДХМ (2×100 мл), органический слой выпаривали в вакууме с получением 2 г неочищенного продукта в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 4,09-4,03 (м, 1H), 3,69-3,61 (м, 2H), 2,39-2,27 (м, 1H), 2,21 (д, J=4,0 Гц, 1H), 1,20 (д, J=7,2 Гц, 3H).
Синтез Соединения 29-4. К раствору Соединения 29-3 (2 г, 12,6 ммоль) в пиридине (15 мл) порциями добавляли TsCl (2,87 г, 15,1 ммоль) в течение 5 минут при 0°C. Реакционный раствор перемешивали при 15°C в течение 16 ч. В реакционную смесь вливали 2Н HCl (95 мл) до pH=1-2 при 0°C. Внутреннюю температуру поддерживали на уровне ниже 30°C, и смесь экстрагировали MTBE (2×250 мл). Объединенный органический слой сушили над Na2SO4, фильтровали, выпаривали и очищали на колонке (0-20% EtOAc в ПЭ) с получением Соединения 29-4 (2,1 г, 53%) в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 7,80 (д, J=8,4 Гц, 2H), 7,37 (д, J=8,4 Гц, 2H), 4,22-4,15 (м, 1H), 4,06-3,97 (м, 2H), 2,47 (с, 3H), 2,41-2,29 (м, 1H), 2,18 (д, J=4,8 Гц, 1H), 1,14 (д, J=7,2 Гц, 3H).
Синтез Соединения 29-5. В ТГФ (3,5 мл) под N2 при -70°C добавляли диизопропиламин (2,35 ммоль, 237 мг) с последующим добавлением n-BuLi (2,22 ммоль, 0,89 мл, 2,5М в гексане). Реакции позволяли нагреться до 15°C и повторно охлаждали до -70°C. По каплям добавляли суспензию A-6 (0,637 ммоль, 300 мг) в ТГФ (1,5 мл) с получением светло-желтой суспензии. После перемешивания при -70°C в течение 30 мин, добавляли раствор Соединения 29-4 (700 мкмоль, 218 мг) в ТГФ (1,5 мл) в течение 5 мин (экзотермическая реакция, поддерживали внутреннюю T<-70°C). Реакцию перемешивали при 15°C в течение 12 ч. Реакцию останавливали насыщенным NH4Cl (30 мл) и экстрагировали EtOAc (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали с получением Соединения 29-5 (400 мг, неочищенный продукт) в виде светло-желтой пены, которую использовали непосредственно на следующей стадии.
Синтез Соединения 49. К раствору Соединения 29-5 (400 мг, 0,654 ммоль) в MeOH (5 мл) добавляли порошок Mg (940 мг, 39,2 ммоль) при 55°C. Смесь перемешивали при 55°C в течение 16 ч. В смесь вливали HCl (30 мл, 1Н), пока смесь не становилась прозрачной, и экстрагировали ДХМ (3×10 мл). Объединенную органическую фазу промывали насыщенным NaHCO3 (20 мл), сушили над Na2SO4, фильтровали, выпаривали и очищали с помощью хроматографии CombiFlash (0-15% EtOAc в PE) с получением Соединения 49 (80 мг, 26%) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 5,31-5,30 (м, 1H), 3,96-3,95 (м, 1H), 2,43-2,40 (м, 1H), 2,23-2,15 (м, 1H), 2,05-1,91 (м, 3H), 1,90-1,62 (м, 4H), 1,61-1,58 (м, 3H), 1,56-1,42 (м, 7H), 1,41-1,36 (м, 1H), 1,33-1,22 (м, 2H), 1,20-1,16 (м, 5H), 1,15-1,10 (м, 4H), 1,09-1,07 (м, 1H), 1,06-1,03 (м, 4H), 1,02-0,93 (м, 4H), 0,68 (с, 3H). ЖХМС Rt=1,295 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C28H44F3O [M+H-H2O]+ 453, найдено 453.
Синтез Соединений 50 и 51. Соединение 49 (55 мг, 0,116 ммоль) разделяли с помощью СФХ (колонка: AD (250 мм×30 мм, 5 мкм), градиент: (A=0,05% NH3/H2O, B=MeOH); скорость потока: 120 мл/мин) с получением Соединения 50 (15 мг, 27%) и Соединения 51 (11 мг, 20%) в виде почти белых твердых веществ.
Соединение 50: 1H-ЯМР (400 МГц, CDCl3) δ 5,31-5,30 (м, 1H), 3,96-3,95 (м, 1H), 2,43-2,40 (м, 1H), 2,23-2,15 (м, 1H), 2,05-1,91 (м, 3H), 1,90-1,58 (м, 3H), 1,56-1,45 (м, 7H), 1,44-1,35 (м, 5H), 1,34-1,20 (м, 1H), 1,19-1,11 (м, 10H), 1,10-0,85 (м, 9H), 0,68 (с, 3H). ЖХМС Rt=1,292 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C28H44F3O [M+H-H2O]+ 453, найдено 453. СФХ Rt=5,077 мин в 10 мин хроматографии, AD_3_MeOH_DEA_5_40_25ML, (УФ 210 нм).
Соединение 51: 1H-ЯМР (400 МГц, CDCl3) δ 5,31-5,30 (м, 1H), 3,96-3,95 (м, 1H), 2,43-2,40 (м, 1H), 2,23-2,15 (м, 1H), 2,05-1,91 (м, 3H), 1,90-1,58 (м, 6H), 1,56-1,36 (м, 8H), 1,35-1,22 (м, 3H), 1,20-1,11 (м, 9H), 1,10-0,97 (м, 5H), 0,96-0,90 (м, 4H), 0,68 (с, 3H). ЖХМС Rt=1,294 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C28H44F3O [M+H-H2O]+ 453, найдено 453. СФХ Rt=5,412 мин в 10 мин хроматографии, AD_3_MeOH_DEA_5_40_25ML, (УФ 210 нм).
Пример 32. Синтез соединений 52, 53 и 54.
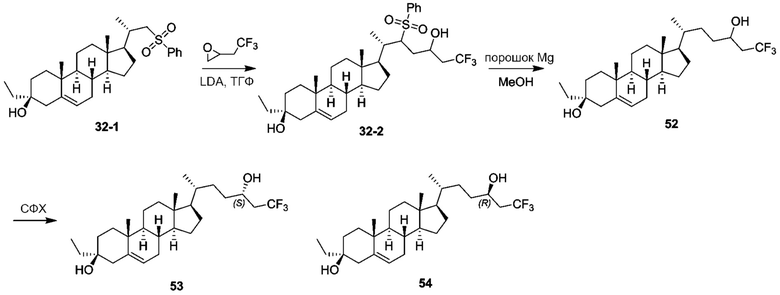
Стадия 1 . К раствору диизопропиламина (781 мг, 7,72 ммоль) в ТГФ (8 мл) по каплям добавляли раствор n-BuLi (2,8 мл, 2,5 М в гексане, 7,10 ммоль) под N2 при -78°C. Смесь нагревали до 0°C. К суспензии 32-1 (1,5 г, 3,09 ммоль) в ТГФ (15 мл) по каплям добавляли только что приготовленный раствор LDA под N2 при -78°C. Смесь перемешивали при -78°C в течение 30 мин. Добавляли раствор 2-(2,2,2-трифторэтил)оксирана (583 мг, 4,63 ммоль) в ТГФ (6 мл). Смесь перемешивали при -78°C в течение 30 мин и позволяли нагреться до 25°C, после чего перемешивали в течение 48 ч. В реакционную смесь вливали воду (100 мл) и HCl (1 М, водн.) до pH=5 при 15°C. Смесь экстрагировали EtOAc (500 мл). Отделенную органическую фазу промывали солевым раствором, сушили над Na2SO4, фильтровали и выпаривали. Неочищенный продукт очищали на колонке для флеш-хроматографии (10~50% EtOAc в ПЭ) с получением 32-2 (1,4 г, 74%) в виде почти белого твердого вещества, которое использовали непосредственно.
Стадия 2 . К раствору 32-2 (1,4 г, 2,29 ммоль) в 20 мл сухого MeOH добавляли порошок Mg (1,64 г, 68,7 ммоль) под N2 при 60°C. В реакционную смесь вливали 2М HCl (250 мл) при 10°C до растворения твердой фазы. После экстрагирования EtOAc (400 мл), органический слой промывали нас. NaHCO3 (50 мл), солевым раствором (50 мл), сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали на колонке для флеш-хроматографии, элюируя ПЭ/EtOAc=20:1-5:1, с получением Соединения 52 (510 мг, 47%) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,28 (м, 1H), 3,98-3,96 (м, 1H), 2,35-2,25 (м, 3H), 2,05-2,00 (м, 6H), 1,96-1,60 (м, 6H), 1,57-1,04 (м, 11H), 1,03-0,92 (м, 8H), 0,86-0,83 (м, 6H), 0,68 (с, 3H). ЖХМС Rt=1,299 мин в 2 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C28H44F3O [M+H-H2O]+ 453, найдено 453.
Стадия 3 . Соединение 52 (510 мг, 1,08 ммоль) очищали с помощью разделения СФХ (Колонка: AD (250 мм×30 мм, 5 мкм); Подвижная фаза: Сверхкритический CO2/MeOH+NH3H2O=40/40; Скорость потока: 60 мл/мин; Длина волны: 220 нм) с получением Соединения 53 (208 мг, 41%) в виде почти белого твердого вещества и Соединения 54 (212 мг, 42%) в виде почти белого твердого вещества.
Соединение 53: 1H-ЯМР (400 МГц, CDCl3) δ 5,29-5,27 (м, 1H), 3,96-3,93 (м, 1H), 2,40-2,20 (м, 3H), 2,06-1,92 (м, 3H), 1,88-1,59 (м, 6H), 1,52-1,34 (м, 8H), 1,33-1,22 (м, 2H), 1,05-1,00 (м, 10H), 0,96-0,93 (м, 5H), 0,85 (т, J=7,6 Гц, 3H), 0,68 (с, 3H). ЖХМС Rt=1,304 мин в 2 мин хроматографии, 30-90AB, МС ЭРИ вычисл. для C28H44F3O [M+H-H2O]+ 453, найдено 453.
Соединение 54: 1H-ЯМР (400 МГц, CDCl3) δ 5,29-5,27 (м, 1H), 4,00-3,95 (м, 1H), 2,41-2,16 (м, 3H), 2,08-1,79 (м, 4H), 1,77-1,68 (м, 2H), 1,67-1,56 (м, 4H), 1,52-1,34 (м, 9H), 1,32-1,16 (м, 3H), 1,16-0,96 (м, 8H), 0,94-0,92 (м, 4H), 0,85 (т, J=7,6 Гц, 3H), 0,68 (с, 3H). ЖХМС Rt=1,305 мин в 2 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C28H44F3O [M+H-H2O]+ 453, найдено 453.
Пример 33. Синтез Соединения 55.
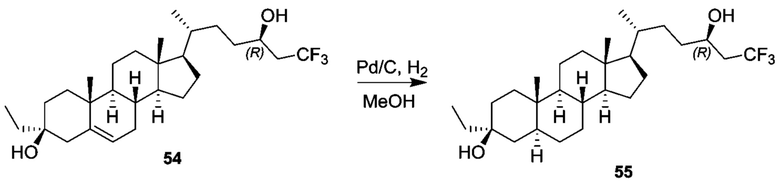
К раствору Соединения 54 (186 мг, 0,395 ммоль) в MeOH (20 мл) добавляли Pd/C (сухой, 10%, 350 мг) под Ar. После дегазации три раза током N2, реакционную смесь дегазировали три раза током H2. Реакционную смесь перемешивали в течение 16 ч при 55°C под атмосферой H2 (0,35 МПа). Катализатор удаляли на вакуумном фильтре и выпаривали фильтрат с получением неочищенного продукта, который очищали на колонке с силикагелем (EtOAc в PE, 10%-15%) с получением Соединения 55 (26 мг, 13%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,00-3,94 (м, 1H), 2,33-2,22 (м, 2H), 1,97-1,93 (м, 1H), 1,92-1,81 (м, 2H), 1,80-1,58 (м, 4H), 1,55-1,26 (м, 8H), 1,24-1,20 (м, 11H), 1,19-0,93 (м, 11H), 0,82 (с, 3H), 0,67-0,61 (м, 4H). ЖХМС Rt=1,273 мин в 2 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C28H46F3O [M+H-H2O]+ 455, найдено 455.
Пример 34. Синтез Соединения 56.
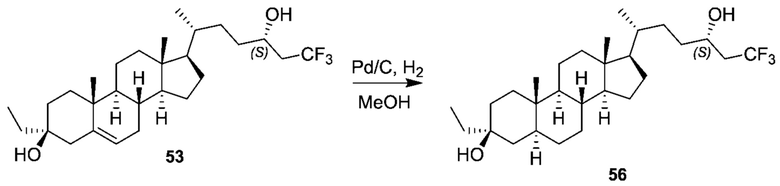
К раствору Соединения 53 (183 мг, 0,389 ммоль) в MeOH (20 мл) добавляли Pd/C (сухой, 10%, 350 мг) под Ar. После дегазации три раза током N2, реакционную смесь дегазировали три раза током H2. Реакционную смесь перемешивали в течение 16 ч при 55°C под атмосферой H2 (0,35 МПа). Катализатор удаляли на вакуумном фильтре и выпаривали фильтрат с получением неочищенного продукта, который очищали на колонке с силикагелем (EtOAc в ПЭ, 10%-15%), с получением Соединения 56 (20 мг, 10%) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 3,96-3,93 (м, 1H), 2,30-2,20 (м, 2H), 1,97-1,93 (м, 1H), 1,92-1,81 (м, 2H), 1,80-1,58 (м, 4H), 1,55-1,26 (м, 8H), 1,24-1,20 (м, 11H), 1,19-0,93 (м, 11H), 0,82 (с, 3H), 0,66-0,64 (м, 4H). ЖХМС Rt=1,268 мин в 2 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C28H46F3O [M+H-H2O]+ 455, найдено 455.
Пример 35. Синтез Соединений 57 и 58.
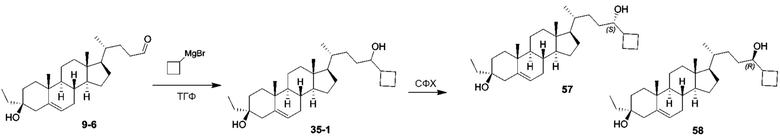
Стадия 1 . К суспензии Mg (1 г, 41,1 ммоль) и I2 (10 мг) в ТГФ (1 мл) по каплям добавляли раствор бромциклобутана (2,5 г, 18,5 ммоль) в ТГФ (4 мл) при 60°C. Смесь перемешивали при 60°C в течение 1 ч. Затем раствор циклобутилмагнийбромида (18,55 ммоль в 15 мл ТГФ) добавляли к раствору 9-6 (0,5 г, 1,29 ммоль) в ТГФ (10 мл) при 0°C. Смесь перемешивали при 0°C в течение 1 ч и вливали NH4Cl (10 мл, нас. водн.). Смесь экстрагировали EtOAc (30 мл). Органический слой отделяли, выпаривали в вакууме и очищали на силикагеле (ПЭ/EtOAc=10/1→7/1) с получением неочищенного продукта, который перекристаллизовывали из MeCN (50 мл) с получением 35-1 (100 мг, 18%, доставлено 50 мг) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,33-5,21 (м, 1H), 3,50-3,38 (м, 1H), 2,42-2,24 (м, 2H), 2,09-1,61 (м, 13H), 1,55-1,21 (м, 13H), 1,20-0,89 (м, 14H), 0,85 (т, J=7,6 Гц, 3H), 0,70-0,64 (м, 3H). ЖХМС Rt=1,612 мин в 2,0 мин хроматографии, 30-90AB_E, слабый МС. МС МС ЭРИ вычисл. для C30H49O [M+H-H2O]+ 425,3778, найдено 425,3779.
Стадия 2 . 440 мг 35-1 разделяли с помощью СФХ (Оборудование: SFC-14; Метод: Колонка: AD (250 мм×30 мм, 5 мкм); Условия: 0,1% NH3H2O EtOH; Начальный B: 40%; Конечный B: 40%; Время элюирования в градиенте (мин): 100%B Время удерживания (мин): Скорость потока (мл/мин): 60 мл/мин; Введения проб: 160) с получением Соединения 57 (100 мг, 23%, доставлено 50 мг) и Соединения 58 (130 мг, СФХ с примесями). Соединение 57 с примесями (130 мг) очищали с помощью СФХ (Колонка: AD (250 мм×30 мм, 5 мкм); Условия: 0,1% NH3H2O EtOH, 40% B; Скорость потока (мл/мин): 60) с получением Соединения 58 (112 мг, 26%) в виде почти белого твердого вещества.
Соединение 57: 1H-ЯМР (400 МГц, CDCl3) δ 5,35-5,22 (м, 1H), 3,480-3,37 (м, 1H), 2,40-2,28 (м, 2H), 2,09-1,61 (м, 13H), 1,55-1,21 (м, 13H), 1,20-0,89 (м, 14H), 0,85 (т, J=7,6 Гц, 3H), 0,67 (с, 3H). ВЭЖХ Rt=5,51 мин в 8,0 мин хроматографии, 50-100_AB_E. МС МС ЭРИ вычисл. для C30H49O [M+H-H2O]+ 425,3778, найдено 425,3770.
Соединение 58: 1H-ЯМР (400 МГц, CDCl3) δ 5,35-5,22 (м, 1H), 3,480-3,37 (м, 1H), 2,40-2,28 (м, 2H), 2,09-1,61 (м, 13H), 1,55-1,21 (м, 14H), 1,20-0,89 (м, 13H), 0,85 (т, J=7,6 Гц, 3H), 0,68 (с, 3H). ЖХМС Rt=1,361 мин в 2,0 мин хроматографии, 30-90 AB_E, МС ЭРИ вычисл. для C30H47 [M+H-2H2O]+ 407, найдено 407.
Пример 36. Синтез соединений 36-6, 59, 59-A, 59-B, 60, 60-A и 60-B.
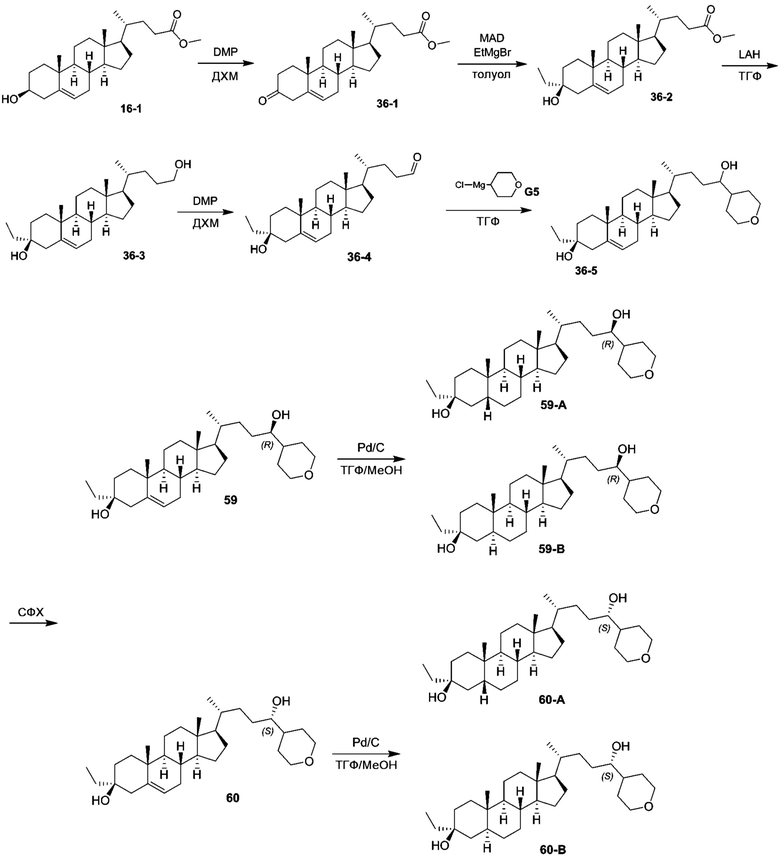
Стадия 1 . К раствору 16-1 (20 г, 51,4 ммоль) в ДХМ (200 мл) добавляли DMP (43,2 г, 102 ммоль) при 30°C. Реакционную смесь перемешивали при 30°C в течение 1 ч. В реакционную смесь вливали насыщенный водный NaHCO3 (100 мл). Смесь фильтровали. Слой ДХМ отделяли и водную фазу экстрагировали ДХМ (100 мл). Объединенную органическую фазу промывали насыщенным водным Na2S2O3 (150 мл), солевым раствором (150 мл), сушили над Na2SO4, фильтровали и выпаривали с получением 36-1 (20 г, неочищенный продукт) в виде желтого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,37-5,31 (м, 1H), 3,66 (с, 3H), 3,32-3,24 (м, 1H), 2,86-2,78 (м, 1H), 2,49-2,19 (м, 5H), 2,08-2,02 (м, 3H), 1,91-1,75 (м, 2H), 1,55-1,39 (м, 5H), 1,38-1,27 (м, 5H), 1,20-1,01 (м, 5H), 0,94-0,91 (м, 3H), 0,73-0,66 (м, 4H).
Стадия 2 . К раствору BHT (73,9 г, 336 ммоль) в безводном толуоле (100 мл) под N2 при 0°C по каплям добавляли триметилалюминий (2 М в толуоле, 77,5 мл, 155 ммоль). Смесь перемешивали при 15°C в течение 1 часа и охлаждали до -70°C. Раствор 36-1 (20 г, 51,7 ммоль) в толуоле (50 мл) добавляли при т-ре ниже -60°C. Полученную смесь перемешивали при -70°C в течение 1 часа. По каплям добавляли этилмагнийбромид (51,6 мл, 3,0 М в диэтиловом эфире, 155 ммоль) при т-ре ниже -60°C. Реакционную смесь перемешивали при -70°C еще в течение 1 часа. В реакционную смесь вливали насыщенную лимонную кислоту (400 мл) при -70°C. Смесь медленно нагревали до 15°C и экстрагировали этилацетатом (3×400 мл). Объединенный органический слой промывали солевым раствором (500 мл), сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали с помощью хроматографии CombiFlash (0%~20% EtOAc в ПЭ) с получением 36-2 (13 г, 60%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,31-5,25 (м, 1H), 3,66 (с, 3H), 2,47-2,16 (м, 4H), 2,07-1,69 (м, 6H), 1,66-1,59 (м, 3H), 1,55-1,38 (м, 6H), 1,36-1,23 (м, 4H), 1,20-1,00 (м, 7H), 0,98-0,81 (м, 7H), 0,67 (с, 3H).
Стадия 3 . К раствору 36-2 (25 г, 60,0 ммоль) в ТГФ (500 мл) под N2 при 0°C порциями добавляли LiAlH4 (3,41 г, 90,0 ммоль). Реакцию перемешивали при 0°C в течение 30 мин. Реакцию останавливали 1 М HCl (300 мл) при 0°C и экстрагировали EtOAc (3×300 мл). Объединенную органическую фазу промывали солевым раствором (500 мл), сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали с помощью хроматографии CombiFlash (0%~20% EtOAc в ПЭ/ДХМ (об/об=1/1)) с получением 36-3 (3 г, чистый) и (10 г, с примесями) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,34-5,24 (м, 1H), 3,67-3,55 (м, 2H), 2,41-2,30 (м, 1H), 2,07-1,91 (м, 3H), 1,88-1,60 (м, 5H), 1,55-1,33 (м, 10H), 1,30-1,20 (м, 3H), 1,17-1,01 (м, 8H), 1,00-0,89 (м, 5H), 0,85 (т, J=7,4 Гц, 3H), 0,68 (с, 3H).
Стадия 4 . К раствору 36-3 (3 г, 7,71 ммоль) в ДХМ (100 мл) добавляли DMP (6,52 г, 15,4 ммоль) при 20°C. Реакционную смесь перемешивали при 20°C в течение 10 мин. В реакционную смесь вливали насыщенный водный NaHCO3 (100 мл) при 20°C. Смесь фильтровали. Слой ДХМ отделяли и водную фазу экстрагировали ДХМ (50 мл). Объединенную органическую фазу промывали насыщенным водным Na2S2O3 (150 мл), солевым раствором (150 мл), сушили над Na2SO4, фильтровали и выпаривали с получением 36-4 (3 г, неочищенный продукт) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 9,80-9,73 (м, 1H), 5,32-5,24 (м, 1H), 2,51-2,29 (м, 3H), 2,07-1,93 (м, 3H), 1,88-1,70 (м, 3H), 1,65-1,57 (м, 4H), 1,50-1,24 (м, 10H), 1,21-1,04 (м, 5H), 1,02-0,96 (м, 1H), 0,98-0,82 (м, 8H), 0,68 (с, 3H).
Стадия 5 . К энергично перемешиваемой суспензии стружки Mg (1,76 г, 72,8 ммоль) и иода (46,1 мг, 0,182 ммоль) в ТГФ (2 мл) под N2 добавляли 1,2-дибромэтан (68,3 мг, 0,364 ммоль) и 10% раствора 4-хлортетрагидро-2H-пирана (4,4 г, 36,4 ммоль) в ТГФ (18 мл). Смесь нагревали до 60°C и, по мере того как реакционная смесь становилась прозрачной и начинала проходить реакция Гриньяра, медленно добавляли оставшуюся часть раствора 4-хлортетрагидро-2H-пирана в ТГФ в течение 30 мин. Реакционную смесь перемешивали при 65°C в течение 2 ч с получением раствора (тетрагидро-2H-пиран-4-ил)магнийхлорида в ТГФ (~2M). Раствор Гриняра использовали без последующей очистки. Раствор 36-4 (800 мг, 2,06 ммоль) в ТГФ (150 мл) под N2 добавляли к реактиву Гриняра при 15°C одной порцией. После перемешивания при 15°C в течение 2 мин, в смесь вливали 200 мл нас. NH4Cl и экстрагировали 200 мл EtOAc. Отделенную органическую фазу промывали 200 мл солевого раствора, сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали с помощью хроматографии CombiFlash (0%~30% EtOAc в ПЭ/ДХМ (об/об=1/1)), с получением 36-5 (550 мг, 56%) в виде почти белого твердого вещества, и 50 мг 36-5 были доставлены. 1H-ЯМР (400 МГц, CDCl3) δ 5,32-5,25 (м, 1H), 4,06-3,96 (м, 2H), 3,42-3,29 (м, 3H), 2,39-2,33 (м, 1H), 2,07-1,79 (м, 6H), 1,77-1,60 (м, 7H), 1,51-1,38 (м, 10H), 1,35-1,21 (м, 4H), 1,16-1,01 (м, 8H), 0,97-0,90 (м, 4H), 0,85 (т, J=7,4 Гц, 3H), 0,71-0,66 (м, 3H). ЖХМС Rt=1,212 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C31H51O2 [M+H-H2O]+ 455, найдено 455.
Стадия 5 . 36-5 (500 мг, 1,05 ммоль) очищали с помощью СФХ (Колонка: AD (250 мм×30 мм, 5 мкм); Условия: 0,1% NH3H2O IPA; Градиент 40%B; Время элюирования в градиенте (мин): 30; Скорость потока (мл/мин): 60), с получением Соединения 59 (210 мг, 42%, доставлено 50 мг) в виде почти белого твердого вещества и Соединения 60 (200 мг, 40%, доставлено 45 мг) в виде почти белого твердого вещества.
Соединение 59 (пик 1): 1H-ЯМР (400 МГц, CDCl3) δ 5,32-5,25 (м, 1H), 4,06-3,96 (м, 2H), 3,43-3,29 (м, 3H), 2,40-2,32 (м, 1H), 2,07-1,79 (м, 4H), 1,77-1,60 (м, 4H), 1,55-1,35 (м, 14H), 1,34-1,17 (м, 5H), 1,15-0,90 (м, 12H), 0,85 (т, J=7,4 Гц, 3H), 0,68 (с, 3H). ЖХМС Rt=1,221 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C31H51O2 [M+H-H2O]+ 455, найдено 455.
Соединение 60 (пик 2): 1H-ЯМР (400 МГц, CDCl3) δ 5,31-5,26 (м, 1H), 4,06-3,96 (м, 2H), 3,43-3,29 (м, 3H), 2,40-2,33 (м, 1H), 2,07-1,93 (м, 4H), 1,88-1,61 (м, 9H), 1,54-1,38 (м, 9H), 1,34-1,06 (м, 8H), 1,05-0,90 (м, 9H), 0,85 (т, J=7,4 Гц, 3H), 0,68 (с, 3H). ЖХМС Rt=1,218 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C31H51O2 [M+H-H2O]+ 455, найдено 455.
Стадия 6 . К раствору Соединения 59 (150 мг, 0,317 ммоль) в MeOH (5 мл) и ТГФ (5 мл) добавляли сухой Pd/C (300 мг) при 15°C. Смесь дегазировали и барботировали H2 несколько раз, а затем перемешивали под давлением H2 0,35 МПа при 55°C в течение 72 часов. Реакционную смесь фильтровали через слой целита и промывали ТГФ (2×5 мл). Фильтрат выпаривали. Остаток очищали с помощью хроматографии CombiFlash (0-30% EtOAc в ПЭ/ДХМ (об/об=1/1)) с получением Соединения 59-A (20 мг, 13%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,06-3,94 (м, 2H), 3,43-3,27 (м, 3H), 2,00-1,67 (м, 6H), 1,55-1,48 (м, 4H), 1,45-1,32 (м, 13H), 1,29-1,12 (м, 11H), 1,07-0,89 (м, 12H), 0,65 (с, 3H). ЖХМС Rt=1,261 мин в 2,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C31H51O [M+H-2H2O]+ 439, найдено 439.
Стадия 7 . К раствору Соединения 59 (50 мг, 0,105 ммоль) в MeOH (5 мл) и ТГФ (5 мл) добавляли сухой Pd(OH)2 (300 мг) при 15°C. Смесь дегазировали и несколько раз барботировали H2, перемешивали под давлением H2 0,35 МПа при 55°C в течение 72 часов. Реакционную смесь фильтровали через слой целита и промывали ТГФ (2×5 мл). Фильтрат выпаривали. Остаток очищали с помощью хроматографии CombiFlash (0%~30% EtOAc в ПЭ/ДХМ (об/об=1/1)) с получением Соединения 59-B (10 мг, 20%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,05-3,95 (м, 2H), 3,42-3,29 (м, 3H), 1,99-1,91 (м, 1H), 1,89-1,58 (м, 6H), 1,56-1,35 (м, 14H), 1,33-1,16 (м, 8H), 1,14-0,95 (м, 6H), 0,94-0,80 (м, 10H), 0,69-0,58 (м, 4H). ЖХМС Rt=1,253 мин в 2,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C31H51O [M+H-2H2O]+ 439, найдено 439.
Стадия 8 . К раствору Соединения 60 (150 мг, 0,317 ммоль) в MeOH (5 мл) и ТГФ (5 мл) добавляли сухой Pd/C (300 мг) при 15°C. Смесь дегазировали и несколько раз барботировали H2, перемешивали под давлением H2 0,35 МПа при 55°C в течение 72 часов. Реакционную смесь фильтровали через слой целита и промывали с ТГФ (2×5 мл). Фильтрат выпаривали. Остаток очищали с помощью хроматографии CombiFlash (0%~30% EtOAc в ПЭ/ДХМ (об/об=1/1)) с получением Соединения 60-A (33 мг) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,06-3,95 (м, 2H), 3,43-3,26 (м, 3H), 2,00-1,59 (м, 9H), 1,53-1,35 (м, 11H), 1,34-1,10 (м, 13H), 1,08-0,84 (м, 13H), 0,65 (с, 3H). ЖХМС Rt=1,261 мин в 2,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C31H51O [M+H-2H2O]+ 439, найдено 439.
Стадия 9 . К раствору Соединения 60 (150 мг, 0,317 ммоль) в MeOH (5 мл) и ТГФ (5 мл) добавляли сухой Pd/C (300 мг) при 15°C. Смесь дегазировали и несколько раз барботировали H2, перемешивали под давлением H2 0,35 МПа при 55°C в течение 72 часов. Реакционную смесь фильтровали для удаления Pd/C и выпаривали фильтрат. Остаток очищали с помощью хроматографии CombiFlash (0%~30% EtOAc в ПЭ/ДХМ (об/об=1/1)) с получением Соединения 60-B (40 мг, 26%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,06-3,95 (м, 2H), 3,43-3,27 (м, 3H), 2,03-1,91 (м, 1H), 1,86-1,74 (м, 1H), 1,72-1,57 (м, 8H), 1,54-1,34 (м, 10H), 1,33-1,15 (м, 8H), 1,15-0,96 (м, 7H), 0,94-0,79 (м, 10H), 0,72-0,56 (м, 4H). ЖХМС Rt=1,250 мин в 2,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C31H51O [M+H-2H2O]+ 439, найдено 439.
Стадия 10 . К раствору 36-5 (150 мг, 0,317 ммоль) в MeOH (5 мл) и ТГФ (5 мл) добавляли сухой Pd/C (300 мг) при 15°C. Смесь дегазировали и несколько раз барботировали H2, перемешивали под давлением H2 0,35 МПа при 55°C в течение 72 часов. Реакционную смесь фильтровали через слой целита и промывали ТГФ (2×5 мл). Фильтрат выпаривали. Остаток очищали с помощью хроматографии CombiFlash (0%~30% EtOAc в ПЭ/ДХМ (об/об=1/1)) с получением 36-6 (30 мг) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 4,07-3,94 (м, 2H), 3,43-3,25 (м, 3H), 2,00-1,59 (м, 7H), 1,50-1,36 (м, 11H), 1,34-1,10 (м, 15H), 1,07-0,82 (м, 13H), 0,65 (с, 3H). ЖХМС Rt=1,261 мин в 2,0 мин хроматографии, 30-90 AB, МС ЭРИ вычисл. для C31H51O [M+H-2H2O]+ 439, найдено 439.
Пример 37. Альтернативный синтез 10, 11, 13 и 15.
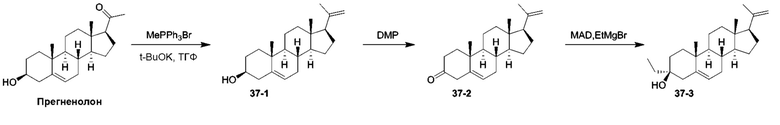
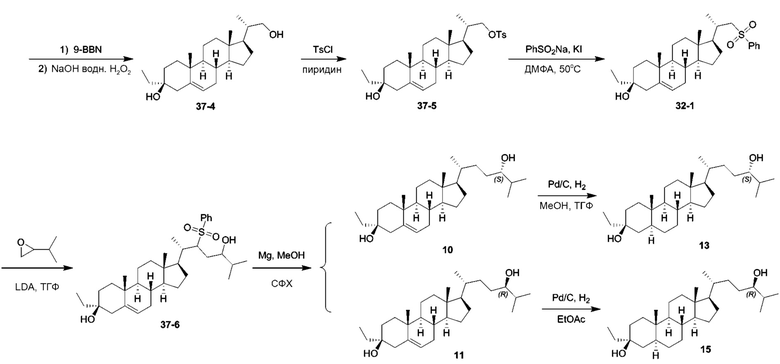

Стадия 2 . К смеси DMP (539 г, 1271 ммоль) в ДХМ (800 мл) добавляли 37-1 (200 г, 636 ммоль) в ДХМ (2,2 л) при 30°C. Реакционную смесь перемешивали при 40°C в течение 1 ч. В реакционную смесь вливали насыщенный водный NaHCO3 (1,2 л) при 10°C. Смесь фильтровали. Фазу ДХМ из фильтрата отделяли и промывали насыщенным водным NaHCO3/Na2S2O3 (1:1, 2×1 л), солевым раствором (1 л), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением желтого твердого вещества, которое растирали в MeCN (700 мл) с получением 37-2 (115 г, 58%) в виде почти белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 5,38-5,31 (м, 1H), 4,86 (с, 1H), 4,72 (с, 1H), 3,28 (дд, J=2,8, 16,8 Гц, 1H), 2,82 (дд, J=1,6, 16,8 Гц, 1H), 2,56-2,40 (м, 1H), 2,35-2,24 (м, 1H), 2,11-1,99 (м, 3H), 1,95-1,85 (м, 1H), 1,85-1,77 (м, 1H), 1,76 (с, 3H), 1,73-1,61 (м, 3H), 1,56-1,39 (м, 3H), 1,31-1,19 (м, 2H), 1,19 (с, 3H), 1,18-0,99 (м, 3H), 0,61 (с, 3H).
Стадия 3. К смеси BHT (405 г, 1839 ммоль) в толуоле (400 мл) по каплям добавляли AlMe3 (459 мл, 2 М, 919 ммоль) при 0°C. Полученную смесь перемешивали при 15°C в течение 1 ч. По каплям добавляли 37-2 (115 г, 368 ммоль) в толуоле (500 мл) при -70°C. Смесь перемешивали при -70°C в течение 1 ч. По каплям добавляли EtMgBr (368 мл, 3 М, 1104 ммоль) при -70°C. Реакционную смесь перемешивали при -70°C в течение 1 ч. Реакционную смесь вливали в насыщенную водную лимонную кислоту (2 л). Водную фазу экстрагировали этилацетатом (2×1,5 л). Объединенную органическую фазу промывали солевым раствором (2 л), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением почти белого твердого вещества, которое очищали перекристаллизацией в MeCN (900 мл) с получением 37-3 (80 г, 63%) в виде почти белого твердого вещества. Фильтрат выпаривали в вакууме с получением твердого вещества, которое очищали с помощью хроматографии на силикагеле (ПЭ:EtOAc=20:1) с получением почти белого твердого вещества, которое дополнительно очищали перекристаллизацией в MeCN (150 мл) с получением 37-3 (17 г, 14%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,34-5,24 (м, 1H), 4,85 (с, 1H), 4,71 (с, 1H), 2,40-2,33 (м, 1H), 2,07-1,94 (м, 3H), 1,91-1,82 (м, 3H), 1,82-1,73 (м, 4H), 1,73-1,52 (м, 8H), 1,50-1,32 (м, 4H), 1,29-1,05 (м, 5H), 1,05-0,90 (м, 1H), 0,85 (т, J=7,6 Гц, 3H), 0,58 (с, 3H).
Стадия 4 . К смеси 37-3 (97 г, 283 ммоль) и димера 9-BBN (79 г, 324 ммоль) добавляли ТГФ (650 мл) при 15°C под N2. Реакционную смесь перемешивали при 30°C в течение 1 ч. Смесь охлаждали до 15°C. Добавляли этанол (129 г, 2,83 ммоль) при 15°C. По каплям добавляли водный NaOH (478 мл, 5 М, 2390 ммоль) при 15°C. По каплям добавляли H2O2 (320 г, 30%, 2,83 ммоль) при 15°C. Полученную смесь перемешивали при 60°C в течение 1 ч. Реакционную смесь охлаждали до 20°C. Получали почти белое твердое вещество. Твердое вещество отфильтровывали и промывали водой (2×800 мл). Объединенное твердое вещество очищали при растирании в MeCN (200 мл) с получением 15-3a-1 (91 г, с примесями) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,32-5,23 (м, 1H), 3,67-3,60 (м, 1H), 3,42-3,33 (м, 1H), 2,40-2,33 (м, 1H), 2,08-1,90 (м, 3H), 1,89-1,69 (м, 2H), 1,66-1,60 (м, 3H), 1,56-1,24 (м, 9H), 1,23-1,07 (м, 5H), 1,05 (д, J=6,8 Гц, 3H), 1,03 (с, 3H), 1,02-0,90 (м, 2H), 0,85 (т, J=7,2 Гц, 3H), 0,70 (с, 3H).
Стадия 5 . К раствору 37-4 (91 г, 252 ммоль) в хлороформе (500 мл) и пиридине (350 мл) добавляли TsCl (132,2 г, 694 ммоль) при 15°C. Смесь перемешивали при 15°C в течение 2 часов. Объединенную реакционную смесь выпаривали в вакууме с удалением большей части хлороформа. К полученной пиридиновой смеси добавляли воду (3 л). Полученное почти белое твердое вещество отфильтровывали с получением почти белого твердого вещества, которое промывали водой (6×4 л). Почти белое твердое вещество растворяли в ДХМ (3,5 л), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением 37-5 (127 г, 98%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 7,78 (д, J=8,4 Гц, 2H), 7,34 (д, J=8,0 Гц, 2H), 5,30-5,20 (м, 1H), 4,00-3,90 (м, 1H), 3,80-3,70 (м, 1H), 2,45 (с, 3H), 2,40-2,30 (м, 1H), 2,10-1,90 (м, 3H), 1,75-1,60 (м, 6H), 1,55-1,30 (м, 5H), 1,25-0,95 (м, 13H), 0,90-0,80 (м, 5H), 0,64 (с, 3H).
Стадия 6 . К раствору 37-5 (127 г, 246 ммоль) в ДМФА (1 л) добавляли KI (196 г, 1,18 моль) при 15°C. Смесь перемешивали при 50°C в течение 1 ч. К полученной смеси добавляли PhSO2Na (148 г, 737 ммоль). Смесь перемешивали при 50°C в течение 16 ч. Реакционную смесь вливали в воду (4 л) с образованием некоторого желтого твердого вещества. Смесь фильтровали. Осадок на фильтре промывали водой (3×2 л). Полученный осадок на фильтре растворяли в ДХМ (3 л), промывали водой (3×1 л), солевым раствором (2×2 л), сушили над Na2SO4, фильтровали, выпаривали в вакууме с получением неочищенного продукта в виде желтого твердого вещества, которое перекристаллизовывали из MeCN (400 мл) с получением 32-1 (45 г, 34%) в виде светло-желтого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 7,95-7,88 (м, 2H), 7,68-7,62 (м, 1H), 7,61-7,53 (м, 2H), 5,30-5,22 (м, 1H), 3,20-3,08 (м, 1H), 2,91-2,79 (м, 1H), 2,40-2,30 (м, 1H), 2,09-1,87 (м, 4H), 1,74-1,60 (м, 4H), 1,50-1,36 (м, 7H), 1,24-0,98 (м, 13H), 0,90-0,80 (м, 4H), 0,65 (с, 3H).
Стадия 7 . К раствору диизопропиламина (7,28 г, 72,1 ммоль) в ТГФ (20 мл) под N2 при -70°C добавляли n-BuLi (27,1 мл, 2,5 М, 67,9 ммоль). Полученную смесь перемешивали при 0°C в течение 30 мин. Смесь повторно охлаждали до -70°C. К смеси добавляли 32-1 (10 г, 20,6 ммоль) в ТГФ (50 мл) при -70°C. Реакционную смесь перемешивали при -70°C в течение 1 ч. Добавляли 2-изопропилоксиран (2,12 г, 24,7 ммоль) в ТГФ (10 мл) при -70°C. Реакционную смесь медленно нагревали до 15°C и перемешивали при 15°C в течение 16 ч. В реакционную смесь вливали насыщенный водный NH4Cl (100 мл) при 0°C. Смесь экстрагировали EtOAc (2×200 мл). Объединенную органическую фазу промывали солевым раствором (150 мл), сушили над Na2SO4, фильтровали и выпаривали в вакууме с получением 37-6 (12 г, неочищенный продукт) в виде желтого твердого вещества. ЖХМС Rt=3,784 и 3,859 мин в 7 мин хроматографии, 30-90AB_7MIN_E.M, МС ЭРИ вычисл. для C35H53O3S [M+H-H2O]+ 553, найдено 553.
Стадия 8 . К раствору 37-6 (12 г, 21,0 ммоль) в 200 мл безводного MeOH добавляли порошок Mg (30,6 г, 1260 ммоль) и NiCl2 (27,0 мг, 0,21 ммоль) с перемешиванием под N2 при 50°C, чтобы вызвать непрерывное выделение водорода. В реакционную смесь вливали 2 М HCl (100 мл) до растворения твердой фазы. Смесь экстрагировали EtOAc (3×200 мл). Объединенный органический слой промывали нас. NaHCO3 (50 мл), солевым раствором (50 мл), сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали с помощью хроматографии на силикагеле, элюируя ПЭ/EtOAc=20/1~8/1, с получением 5,6 г почти белого твердого вещества, которое очищали с помощью СФХ (Колонка: Chiralpak AD 250×30 мм, внутр. диам. 5 мкм; Подвижная фаза: A: CO2, B: метанол (0,1% NH3H2O); Градиент: от 35% до 35% B; Скорость потока: 60мл/мин) с получением Соединения 10 (2,2 г, 24%), Соединения 11 (2,2 г, 24%) в виде почти белого твердого вещества.
Соединение 10: 1H-ЯМР (400 МГц, CDCl3) δ 5,32-5,23 (м, 1H), 3,38-3,24 (м, 1H), 2,41-2,32 (м, 1H), 2,10-1,92 (м, 3H), 1,91-1,78 (м, 1H), 1,76-1,58 (м, 6H), 1,53-1,22 (м, 11H), 1,19-0,98 (м, 9H), 0,98-0,80 (м, 14H), 0,68 (с, 3H). ЖХМС Rt=1,346 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C29H47 [M+H-2H2O]+ 395, найдено 395.
Соединение 11: 1H-ЯМР (400 МГц, CDCl3) δ 5,32-5,23 (м, 1H), 3,38-3,24 (м, 1H), 2,41-2,32 (м, 1H), 2,10-1,92 (м, 3H), 1,91-1,78 (м, 1H), 1,76-1,55 (м, 6H), 1,50-1,22 (м, 11H), 1,19-0,98 (м, 9H), 0,98-0,80 (м, 14H), 0,68 (с, 3H). ЖХМС Rt=1,344 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C29H47 [M+H-2H2O]+ 395, найдено 395.
Стадия 8A . К раствору Соединения 10 (1,6 г, 3,71 ммоль) в MeOH/ТГФ (130 мл/20 мл) добавляли Pd/C (сухой, 10%, 5 г) под Ar. После дегазации три раза током N2, реакционную смесь дегазировали три раза током H2. Реакционную смесь перемешивали в течение 16 ч при 55°C в атмосфере H2 (0,35 МПа). Катализатор удаляли на вакуумном фильтре и выпаривали фильтрат с получением неочищенного продукта, который очищали на колонке с силикагелем (EtOAc в ПЭ, 5%-10%) с получением Соединения 13 (815 мг, 50%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,31-3,30 (м, 1H), 2,00-1,92 (м, 1H), 1,89-1,78 (м, 1H), 1,58 (м, 5H), 1,57-1,48 (м, 3H), 1,47-1,30 (м, 8H), 1,30-1,16 (м, 7H), 1,15-0,94 (м, 6H), 0,93-0,85 (м, 13H), 0,82 (с, 3H), 0,70-0,60 (м, 4H). ЖХМС Rt=1,392 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C29H49 [M+H-2H2O]+ 397, найдено 397.
Стадия 8B. Смесь Соединения 11 (1,6 г, 3,71 ммоль) и Pd/C (5 г, 10%, сухой) в этилацетате (250 мл) перемешивали при 50°C под H2 (0,35 МПа) в течение 16 ч. Реакционную смесь фильтровали. Осадок на фильтре промывали ТГФ (4×20 мл). Объединенный фильтрат выпаривали в вакууме с получением твердого вещества, которое очищали с помощью хроматографии на силикагеле (PE:EtOAc=20:1) с получением Соединения 15 (974 мг, 61%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 3,31-3,30 (м, 1H), 2,00-1,92 (м, 1H), 1,89-1,78 (м, 1H), 1,69-1,58 (м, 5H), 1,57-1,48 (м, 3H), 1,47-1,30 (м, 8H), 1,30-1,16 (м, 7H), 1,15-0,94 (м, 6H), 0,93-0,85 (м, 13H), 0,82 (с, 3H), 0,70-0,60 (м, 4H). ЖХМС Rt=1,389 мин в 2 мин хроматографии, 30-90AB_2MIN_E.M, МС ЭРИ вычисл. для C29H49 [M+H-2H2O]+ 397, найдено 397.
Пример 38. Синтез соединений 66, 67, 68 и 69.
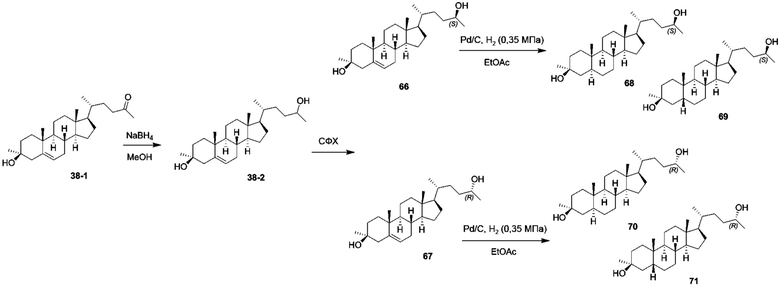
Стадия 1 . К раствору соединения 38-1 (1,0 г, 2,60 ммоль) в MeOH (15 мл) порциями добавляли NaBH4 (0,21 г, 5,7 ммоль) при 0°C. Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. В реакционную смесь вливали водный насыщенный NH4Cl (5 мл) и экстрагировали CH2Cl2 (3×20 мл). Органический слой промывали солевым раствором, сушили над Na2SO4 и выпаривали при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc=15/1→10/1) с получением требуемого продукта (0,82 г, 82%) в виде почти белого порошка. 1H-ЯМР (400 МГц, CDCl3) δ 5,35-5,29 (м, 1H), 3,76-3,73 (м, 1H), 2,45-2,40 (м, 1H), 2,01-1,95 (м, 3H), 1,94-1,68 (м, 4H), 1,67-1,53 (м, 4H), 1,51,63-1,19 (м, 18H), 1,18 (с, 3H), 1,02 (с, 3H), 0,95 (д, J=6,4 Гц, 3H), 0,68 (с, 3H).
Стадия 2 . Раствор 38-1 (0,6 г, 15,4 ммоль) в MeOH (20 мл) очищали с помощью препаративной СФХ с получением Соединения 66 (180 мг, 30%) и Соединения 67 (240 мг, 40%). Абсолютную конфигурацию Соединения 66 и Соединения 67 подтверждали методом Мошера.
1H-ЯМР (Соединение 66): (400 МГц, CDCl3) δ 5,35-5,28 (м, 1H), 3,80-3,70 (м, 1H), 2,48-2,38 (м, 1H), 2,07-1,65 (м, 10H), 1,65-1,20 (м, 13H), 1,20-0,95 (м, 12H), 0,95 (д, J=6,8 Гц, 3H), 0,63 (с, 3H).
1H-ЯМР (Соединение 67): (400 МГц, CDCl3) δ 5,34-5,28 (м, 1H), 3,80-3,70 (м, 1H), 2,47-2,40 (м, 1H), 2,04-1,93 (м, 2H), 1,93-1,68 (м, 2H), 1,68-1,21 (м, 15H), 1,20-0,96 (м, 16H), 0,95 (д, J=6,8 Гц, 3H), 0,68 (с, 3H).
Стадия 3A . К раствору соединения Соединение 66 (140 мг, 0,36 ммоль) в EtOAc (5 мл) добавляли 5% Pd/C (56 мг) под N2. Суспензию дегазировали в вакууме и несколько раз барботировали H2. Затем смесь перемешивали под H2 (0,35 МПа) при 50°C в течение 12 часов. Смесь фильтровали через слой целита и промывали слой EtOAc (2×5 мл). Объединенные фильтраты выпаривали досуха с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc/EtOAc=12/1→10/1) с получением Соединения 68 (80 мг, 57%) и Соединения 69 (18 мг, 13%) в виде почти белого порошка.
1H-ЯМР (Соединение 68) (400 МГц, CDCl3) δ 3,80-3,70 (м, 1H), 1,98-1,93 (м, 1H), 1,88-1,78 (м, 1H), 1,67-1,27 (м, 16H), 1,24-0,94 (м, 14H), 0,92 (д, J=6,4 Гц, 3H), 0,80 (с, 3H), 1,07 (с, 3H), 0,62 (м, 4H).
1H-ЯМР (Соединение 69) (400 МГц, CDCl3) δ 3,80-3,70 (м, 1H), 1,98-1,95 (м, 1H), 1,95-1,79 (м, 3H), 1,64-1,23 (м, 18H), 1,23-1,00 (м, 14H), 0,96 (с, 3H) 0,92 (д, J=6,0 Гц, 3H), 0,62 (с, 3H).
Стадия 3B . К раствору соединения Соединение 67 (120 мг, 0,30 ммоль) в EtOAc (5 мл) добавляли 5% Pd/C (48 мг) под N2. Суспензию дегазировали в вакууме и несколько раз барботировали H2. Затем смесь перемешивали под H2 (0,35 МПа) при 50°C в течение 12 часов. Смесь фильтровали через слой целита и промывали слой EtOAc (2×5 мл). Объединенные фильтраты выпаривали досуха с получением неочищенного продукта, который очищали с помощью колоночной хроматографии на силикагеле (ПЭ/EtOAc/EtOAc=12/1→10/1) с получением Соединения 70 (78 мг, 65%) и Соединения 71 (26 мг, 21%) в виде почти белого порошка.
Соединение 70: 1H-ЯМР: (400 МГц, CDCl3) δ 3,80-3,70 (м, 1H), 1,98-1,93 (м, 1H), 1,88-1,78 (м, 1H), 1,67-1,35 (м, 18H), 1,24-0,85 (м, 19H), 0,80 (с, 3H), 0,67-0,61 (м, 4H).
Соединение 71: 1H-ЯМР: (400 МГц, CDCl3) δ 3,80-3,70 (м, 1H), 2,00-1,93 (м, 1H), 1,93-1,77 (м, 3H), 1,67-1,25 (м, 19H), 1,25-0,80 (м, 18H), 0,64 (с, 3H).
Пример 39. Синтез соединений 72, 73, 74-A, 74-B, 75-A и 75-B.
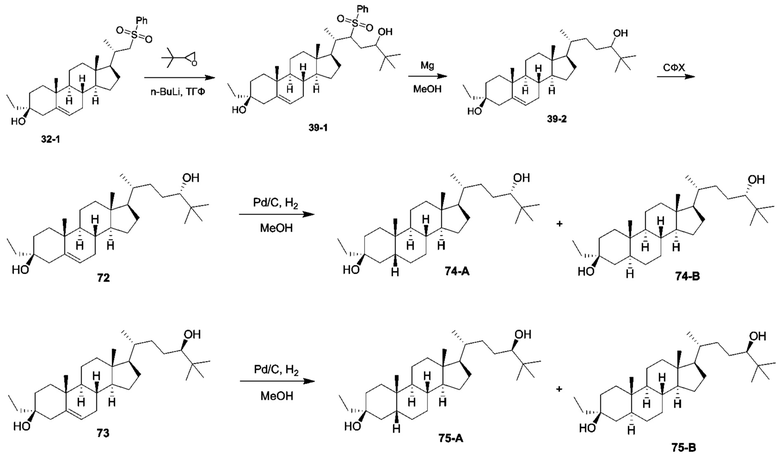
Стадия 1 . nBuLi (2,06 мл, 2,5 М в гексане, 5,15 ммоль) по каплям добавляли в ТГФ (3 мл) под N2 при -70°C с последующим добавлением суспензии 32-1 (1 г, 2,06 ммоль) в ТГФ (5 мл). После перемешивания при -70°C в течение 30 мин, по каплям добавляли раствор 2-(трет-бутил)оксирана (309 мг, 3,09 ммоль) в ТГФ (2 мл). Смесь перемешивали при -70°C в течение 30 мин и позволяли нагреться до 20°C, и перемешивали при 20°C в течение 16 ч. Реакцию останавливали, добавляя в реакционную смесь 30 мл нас.NH4Cl при 20°C. Органический слой отделяли. Водную фазу экстрагировали EtOAc (2×30 мл). Объединенный органический слой, сушили над Na2SO4, фильтровали, выпаривали и очищали с помощью хроматографии CombiFlash (0-15% EtOAc в ПЭ) с получением содержащего примеси 39-1 (700 мг, с примесями) в виде почти белого твердого вещества.
Стадия 2. Раствор 39-1 (700 мг, 1,19 ммоль) в MeOH (30 мл) нагревали при 55°C. Добавляли порошок Mg (1,15 г, 47,5 ммоль) одной порцией. Смесь перемешивали при 55°C в течение 2 ч. В смесь вливали HCl (2Н, 100 мл), пока реакция не становилась прозрачной, и экстрагировали ДХМ (3×50 мл). Объединенную органическую фазу промывали нас. NaHCO3 (100 мл), сушили над Na2SO4, фильтровали, выпаривали и очищали с помощью хроматографии CombiFlash (0-15% EtOAc в ПЭ) с получением 39-2 (400 мг, 76%) в виде почти белого твердого вещества. 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,29 (м, 1H), 3,18-3,12 (м, 1H), 2,40-2,30 (м, 1H), 2,08-1,80 (м, 4H), 1,76-1,69 (м, 1H), 1,68-1,58 (м, 2H), 1,56-1,33 (м, 10H), 1,32-1,22 (м, 5H), 1,21-1,05 (м, 4H), 1,02 (с, 3H), 1,01-0,96 (м, 5H), 0,95-0,83 (м, 9H), 0,82-0,78 (м, 3H), 0,69 (с, 3H). ЖХМС tR=1,375 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C30H49 [M+H-2H2O]+ 409, найдено 409.
Стадия 3 . 350 мг 39-2 разделяли с помощью СФХ (колонка: AD (250 мм×30 мм, 5 мкм), градиент: 30-30% B (A=0,05% NH3/H2O, B=MeOH), скорость потока: 60 мл/мин) с получением Соединения 72 (160 мг, 46%) и Соединения 73 (120 мг, 34%) в виде почти белого твердого вещества.
Соединение 72: 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,29 (м, 1H), 3,18-3,12 (м, 1H), 2,40-2,30 (м, 1H), 2,08-1,80 (м, 4H), 1,76-1,69 (м, 1H), 1,68-1,58 (м, 2H), 1,56-1,33 (м, 10H), 1,32-1,22 (м, 5H), 1,21-1,05 (м, 4H), 1,02 (с, 3H), 1,01-0,96 (м, 5H), 0,95-0,83 (м, 9H), 0,82-0,78 (м, 3H), 0,69 (с, 3H). ЖХМС tR=1,389 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C30H49 [M+H-2H2O]+ 409, найдено 409.
Соединение 73: 1H-ЯМР (400 МГц, CDCl3) δ 5,30-5,29 (м, 1H), 3,18-3,12 (м, 1H), 2,40-2,30 (м, 1H), 2,08-1,80 (м, 4H), 1,76-1,69 (м, 1H), 1,68-1,58 (м, 2H), 1,56-1,33 (м, 10H), 1,32-1,22 (м, 5H), 1,21-1,05 (м, 4H), 1,02 (с, 3H), 1,01-0,96 (м, 5H), 0,95-0,83 (м, 9H), 0,82-0,78 (м, 3H), 0,69 (с, 3H). ЖХМС tR=1,424 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C30H49 [M+H-2H2O]+ 409, найдено 409.
Стадия 4 . Синтез Соединений 74-A и 74-B. К раствору Соединения 72 (110 мг, 0,247 ммоль) в MeOH (30 мл) добавляли Pd/C (сухой, 200 мг). Смесь перемешивали при 50°C в течение 72 ч под H2 (0,35 МПа). Смесь фильтровали, выпаривали и очищали с помощью хроматографии CombiFlash (0-15% EtOAc в ПЭ) с получением Соединения 74-A (19 мг, 17%) в виде почти белого твердого вещества и Соединения 74-B (18 мг, 16%) в виде почти белого твердого вещества.
Соединение 74-A: 1H-ЯМР (400 МГц, CDCl3) δ 3,01-3,06 (м, 1H), 2,01-1,94 (м, 1H), 1,93-1,70 (м, 5H), 1,39-1,58 (м, 4H), 1,50-1,21 (м, 13H), 1,20-1,11 (м, 5H), 1,10-0,97 (м, 5H), 0,96 (с, 3H), 0,95-0,91 (м, 5H), 0,89 (с, 9H), 0,65 (с, 3H). ЖХМС tR=1,425 мин в 2 мин хроматографии, 30-90AB_ELSD, чистота 99,4%, МС ЭРИ вычисл. для C30H51 [M+H-2H2O]+ 411, найдено 411.
Соединение 74-B: 1H-ЯМР (400 МГц, CDCl3) δ 3,11-3,07 (м, 1H), 1,98-1,94 (м, 1H), 1,88-1,58 (м, 6H), 1,56-1,40 (м, 5H), 1,39-1,15 (м, 10H), 1,13-1,02 (м, 5H), 1,01-0,96 (м, 3H), 0,95-0,92 (м, 4H), 0,91-0,83 (м, 12H), 0,81 (с, 3H), 0,70-0,50 (м, 4H). ЖХМС tR=1,424 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C30H51 [M+H-2H2O]+ 411, найдено 411.
Стадия 5 . Синтез Соединений 75-A и 75-B. К раствору Соединения 73 (70 мг, 0,157 ммоль) в MeOH (30 мл) добавляли Pd/C (сухой, 150 мг). Смесь перемешивали при 50°C в течение 72 ч под H2 (0,35 МПа). Смесь фильтровали, выпаривали и очищали с помощью хроматографии CombiFlash (0-15% EtOAc в ПЭ) с получением Соединения 75-A (10 мг, 14%) в виде почти белого твердого вещества и Соединения 75-B (12 мг, 17%) в виде почти белого твердого вещества.
Соединение 75-A: 1H-ЯМР (400 МГц, CDCl3) δ 3,20-3,10 (м, 1H), 2,00-1,94 (м, 1H), 1,94-1,70 (м, 4H), 1,70-1,10 (м, 19H), 1,20-1,00 (м, 9H), 1,00-0,80 (м, 17H), 0,65 (с, 3H). ЖХМС tR=1,424 мин в 2 мин хроматографии, 30-90AB_ELSD, МС ЭРИ вычисл. для C30H51 [M+H-2H2O]+ 411, найдено 411.
Соединение 75-B: 1H-ЯМР (400 МГц, CDCl3) δ 3,16-3,13 (м, 1H), 1,98-1,94 (м, 1H), 1,90-1,80 (м, 1H), 1,70-1,58 (м, 4H), 1,56-1,36 (м, 8H), 1,34-1,16 (м, 9H), 1,15-0,96 (м, 7H), 0,95-0,91 (м, 4H), 0,89 (с, 9H), 0,88-0,84 (м, 3H), 0,82 (с, 3H), 0,70-0,60 (м, 4H). ЖХМС tR=1,416 мин в 2 мин хроматографии, 30-90AB_ELSD, чистота 98,0%, МС ЭРИ вычисл. для C30H51 [M+H-2H2O]+ 411, найдено 411.
Материалы и методы
[00129] Соединения, предложенные в настоящей заявке, могут быть получены из легко доступных исходных материалов при использовании следующих общих методов и процедур, например, как описано в WO 2013/036835 и WO 2014/160480. Следует понимать, что в случаях, когда приведены типичные или предпочтительные условия процесса (т.е. температура реакции, время, молярные отношения реагентов, растворители, давление и т.д.), также могут использоваться другие условия процесса, если не указано иное. Оптимальные условия реакции могут изменяться в зависимости от конкретных используемых реагентов или растворителя, но при этом такие условия могут быть определены специалистом в данной области при стандартной оптимизации.
[00130] Кроме того, как будет очевидно специалистам в данной области, стандартные защитные группы могут потребоваться для предохранения некоторых функциональных групп от протекания нежелательных реакций. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящие условия защиты и снятия защиты, известны в уровне техники. Например, многочисленные защитные группы, их введение и удаление описаны в T. W. Greene and P. G. M. Wuts, Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991, а также в ссылках, цитируемых там.
[00131] Соединения, предложенные в настоящей заявке, могут быть выделены и очищены с помощью известных стандартных методик. Такие методики включают (без ограничения перечисленными) перекристаллизацию, колоночную хроматографию, ВЭЖХ или сверхкритическую флюидную хроматографию (СФХ). Соединения, предложенные в настоящей заявке, могут быть получены из известных или коммерчески доступных исходных материалов и реагентов специалистом в области органического синтеза. Примеры хиральных колонок, доступные для применения в разделении/очистке энантиомеров/диастереомеров, предложенных в настоящей заявке, включают, без ограничения перечисленными, CHIRALPAK® AD-10, CHIRALCEL® OB, CHIRALCEL® OB-H, CHIRALCEL® OD, CHIRALCEL® OD-H, CHIRALCEL® OF, CHIRALCEL® OG, CHIRALCEL® OJ и CHIRALCEL® OK.
[00132] 1H-ЯМР, представленный в настоящей заявке (например, для области между δ (м.д.) от приблизительно 1 до приблизительно 4 м.д.), следует понимать как примерную интерпретацию спектра ЯМР (например, примерные интегрирования пиков) соединения. Пример общей методики препаративной ВЭЖХ: Колонка: Waters RBridge prep 10 мкм C18, 19×250 мм. Подвижная фаза: ацетонитрил, вода (NH4HCO3) (30 л воды, 24 г NH4HCO3, 30 мл NH3⋅H2O). Скорость потока: 25 мл/мин.
[00133] Пример общей методики аналитической ВЭЖХ: Подвижная фаза: A: вода (10 мМ NH4HCO3), B: Градиент ацетонитрила: 5%-95% B за 1,6 или 2 мин; Скорость потока: 1,8 или 2 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм при 45 C.
Потенцирование NMDA
[00134] Потенцирование NMDA оценивали при использовании локальной фиксации потенциала на любых целых клетках млекопитающих, которые экспрессируют NMDA-рецепторы.
Локальная фиксация потенциала на целых клетках млекопитающих (Ionworks Barracuda (IWB))
Метод локальной фиксации потенциала на целой клетке использовали для исследования действия соединений на глутаматные рецепторы GlunN1/GluN2A, экспрессируемые в клетках млекопитающих. Результаты показаны в Таблице 1.
Клетки HEK293 трансформировали ДНК аденовируса 5 и трансфицровали кДНК, кодирующей гены GRIN1/GRIN2A человека. Стабильные трансфенктанты отбирали при использовании генов устойчивости к G418 и зеоцину, встроенных в экспрессионную плазмиду, и селективного пресса, поддерживаемого G418 и зеоцином в среде. Клетки культивировали в модифицированной по Дульбекко среде Игла/питательной смеси (D-MEM/F-12) с добавкой 10% эмбриональной бычьей сыворотки, 100 мкг/мл пенициллина G натриевой соли, 100 мкг/мл стрептомицина сульфата, 100 мкг/мл зеоцина, 5 мкг/мл бластицидина и 500 мкг/мл G418.
Действие тестируемых изделий оценивали в формате ответа в зависимости от концентрации по 8 точкам (лунки в 4 повторностях/концентрация). Все тестируемые и контрольные растворы содержали 0,3% ДМСО и 0,01% Kolliphor® EL (C5135, Sigma). Композиции тестируемых изделий наносили на 384-луночный планшет для соединений при помощи автоматизированной системы для работы с жидкостями (SciClone ALH3000, Caliper LifeScienses). Измерения производили при использовании платформы Ion Works Barracuda согласно следующей методике:
Электрофизиологические процедуры:
a) Внутриклеточный раствор (мМ): 50 мМ CsCl, 90 мМ CsF, 2 мМ MgCl2, 5 мМ ЭГТА, 10 мМ HEPES. pH доводили до 7,2 CsOH.
b) Внеклеточный раствор, HB-PS (состав в мМ): NaCl, 137; KCl, 1,0; CaCl2, 5; HEPES, 10; Глюкоза, 10; pH доводили до 7,4 NaOH (охлажденным перед применением).
c) Исходный потенциал: -70 мВ, потенциал при нанесении агониста/PAM: -40 мВ.
Процедура регистрации:
a) Внеклеточный буфер наносят в лунки PPC планшета (по 11 мкл в лунку). Суспензию клеток наносят пипеткой в лунки (по 9 мкл в лунку) плоского электрода PPC.
b) Конфигурацию регистрации показателей на целой клетке устанавливают при перфорации участка мембраны с регистрацией мембранных токов встроенными усилителями фиксации потенциала.
c) Выполняют две регистрации (сканирования). Первую, во время предварительного применения одного тестируемого изделия (продолжительность предварительного применения - 5 мин), и вторую, во время совместного применения тестируемых изделий и агониста (EC20 L-глутамата и 30 мкм глицина) для определения положительного модулирующего действия тестируемого изделия.
Применение тестируемого изделия: Первое предварительное применение состоит из добавления 20 мкл 2× концентрации раствора тестируемого изделия, а второе - из 20 мкл 1× концентрации тестируемого изделия и агониста при расходе 10 мкл/с (общее время применения составляет 2 секунды).
Таблица 1.
% потенцирования при 3 мкМ
В Таблице 1 "A" означает 10-75%, "B" означает потенцирование от >75% до 150%; "C" означает потенцирование >150%; и "ND" означает "не поддается определению" или "не определяли".
Другие варианты осуществления
[00135] В оригинальном тексте формулы изобретения такие артикли как "a", "an" и "the" могут означать один или больше одного, если не указано иное или иным образом не следует из контекста. Пункты формулы изобретения или части описания, которые включают "или" между одним или более членами группы, считаются удовлетворенными, если один, больше одного или все члены группы присутствуют, используются или относятся к определенному продукту или процессу, если не указано обратное или иным образом не следует из контекста. Изобретение включает в себя варианты осуществления, в которых только один член группы присутствует в, применяется в или иным образом относится к данному продукту или процессу. Изобретение включает варианты осуществления, в которых больше одного или все члены группы присутствуют в, применяются в или относятся к конкретному продукту или процессу.
[00136] Кроме того, изобретение охватывает все варианты, комбинации и перестановки, в которых одно или более ограничений, элементов, положений и описательных терминов из одного или более перечисленных пунктов формулы изобретения включены в другой пункт формулы изобретения. Например, любой пункт формулы изобретения, который зависит от другого пункта формулы изобретения, может быть изменен для включения одного или более ограничений, присутствующих в любом другом пункте формулы изобретения, который зависит от того же независимого пункта формулы изобретения. В случае, когда элементы представлены в виде списков, например, в формате групп Маркуша, каждая подгруппа элементов также раскрыта, при этом любой элемент(ы) может быть удален из группы. Следует понимать, что в большинстве случаев, когда изобретение или аспекты изобретения указаны как содержащие определенные элементы и/или признаки, некоторые варианты осуществления изобретения или аспекты изобретения состоят или по существу состоят из таких элементов и/или признаков. В целях простоты такие варианты осуществления не представлены дословно. Также необходимо отметить, что термины "включающий" и "содержащий" предусмотрены как открытые и допускают включение дополнительных элементов или этапов. В случае, когда указаны диапазоны, включены конечные точки. Кроме того, если не указано иное или иным образом не следует из контекста и известно специалисту в данной области техники, значения, которые выражены в виде диапазонов, могут принимать любое конкретное значение или субдиапазон в пределах указанных диапазонов в различных вариантах осуществления изобретения, до десятой единицы нижней границы диапазона, если из контекста прямо не следует иное.
[00137] Настоящая заявка относится к различным выданным патентам, опубликованным заявкам на патент, журнальным статьям и другим публикациям, которые включены в настоящий документ посредством отсылки. Если существует конфликт между какими-либо включенными ссылками и настоящим описанием, описание должно иметь преимущественную силу. Кроме того, любой конкретный вариант осуществления настоящего изобретения, который относится к предшествующему уровню техники, может быть прямо исключен из какого-либо одного или более пунктов формулы изобретения. Поскольку такие варианты осуществления считаются известными среднему специалисту в данной области техники, они могут быть исключены, даже если такое исключение прямо не указано в настоящем документе. Любой конкретный вариант осуществления изобретения может быть исключен из любого пункта формулы изобретения по любой причине, независимо от того, связано ли это с существованием предшествующего уровня техники.
[00138] Специалистам в данной области техники известны, или они сумеют установить с применением не более чем стандартных экспериментов, многие эквиваленты конкретных вариантов осуществления, описанных в настоящем документе. Объем настоящих вариантов осуществления, описанных в настоящем документе, не ограничивается представленным выше описанием, а соответствует изложенному в прилагаемой формуле изобретения. Специалисты в данной области техники сумеют оценить, что различные изменения и модификации могут быть внесены в настоящее описание без отклонения от сущности или объема настоящего изобретения, как определено в следующей формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2015 |
|
RU2733756C2 |
| ОКСИСТЕРОЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2744267C2 |
| БОРСОДЕРЖАЩИЕ ИНГИБИТОРЫ PDE4 | 2019 |
|
RU2793936C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С NTRK | 2016 |
|
RU2744974C2 |
| АНИЛИДЫ АМИНОКИСЛОТ В КАЧЕСТВЕ НИЗКОМОЛЕКУЛЯРНЫХ МОДУЛЯТОРОВ IL-17 | 2019 |
|
RU2815505C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ, КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2699359C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2808166C2 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2684103C2 |
| КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С KIT | 2014 |
|
RU2706235C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2689777C1 |
Изобретение относится к соединению формулы (I-C-i) или его фармацевтически приемлемым солям. В формуле (I-C-i) R1 является C1-6 алкилом и R2 является -CH2CF3, этилом, изопропилом или циклопропилом. Изобретение также относится к фармацевтической композиции и способу положительного аллостерического модулирования NMDA-рецептора. Технический результат: получены новые соединения формулы (I-C-i), которые обладают свойством положительного аллостерического модулятора NMDA и могут применяться при лечении NMDA-опосредованных нарушений. 3 н. и 14 з.п. ф-лы, 1 табл., 39 пр.
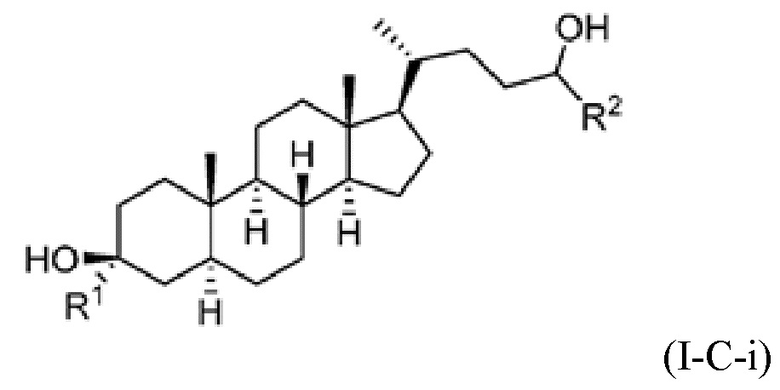
1. Соединение формулы (I-C-i):
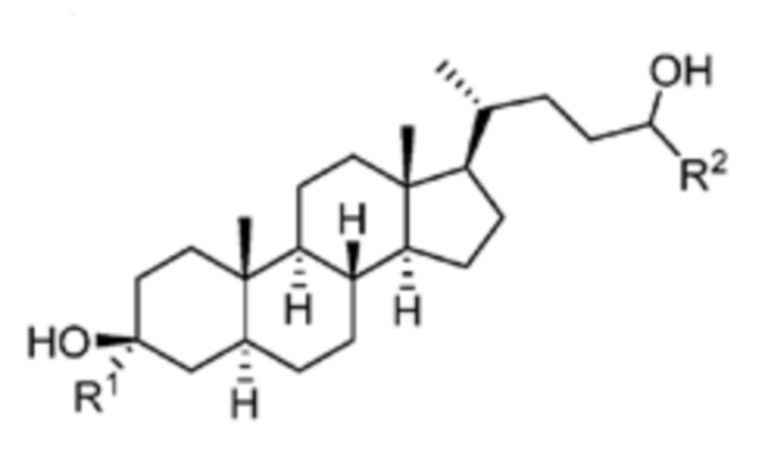 (I-C-i)
(I-C-i)
или его фармацевтически приемлемая соль, где:
R1 является C1-6 алкилом; и
R2 является -CH2CF3, этилом, изопропилом или циклопропилом.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, где R1 является метилом, этилом или изопропилом.
3. Соединение по п. 1 или его фармацевтически приемлемая соль, где R1 является метилом или этилом.
4. Соединение по п. 1 или его фармацевтически приемлемая соль, где R2 является этилом или изопропилом.
5. Соединение по п. 1 или его фармацевтически приемлемая соль, где соединение Формулы (I-C-i) выбрано из группы, состоящей из:
 ,
,  ,
,
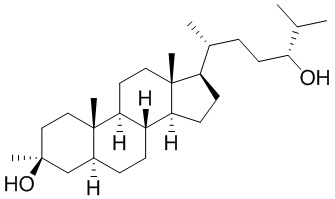 ,
, 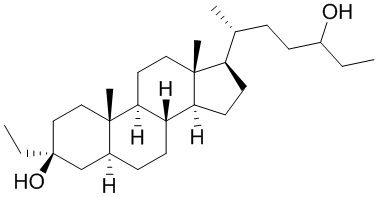 ,
, 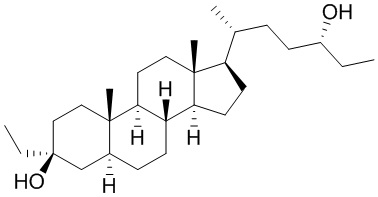 ,
, 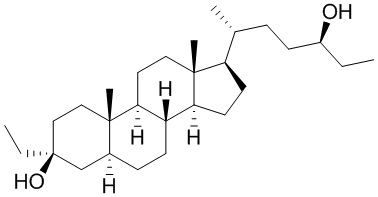 ,
, 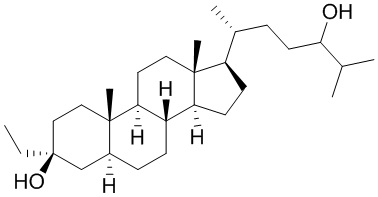 ,
, 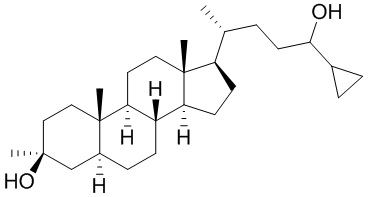 ,
,
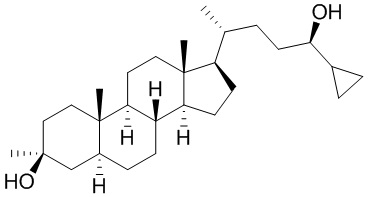 ,
, 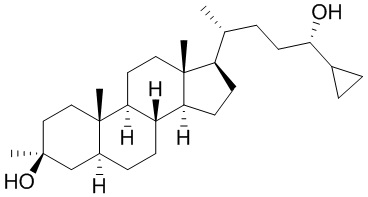 ,
, 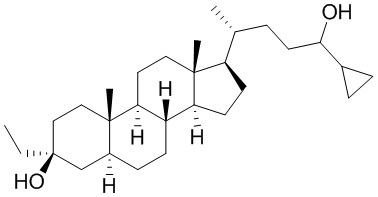 ,
, 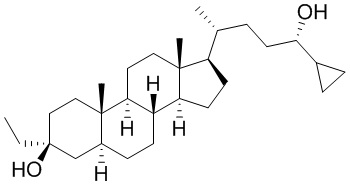 ,
, 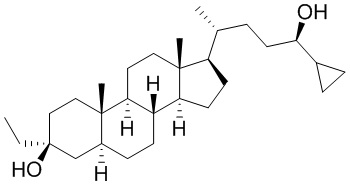 ,
, 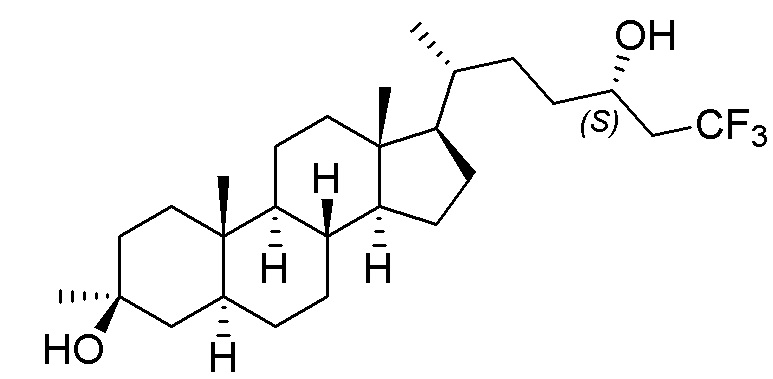 ,
, 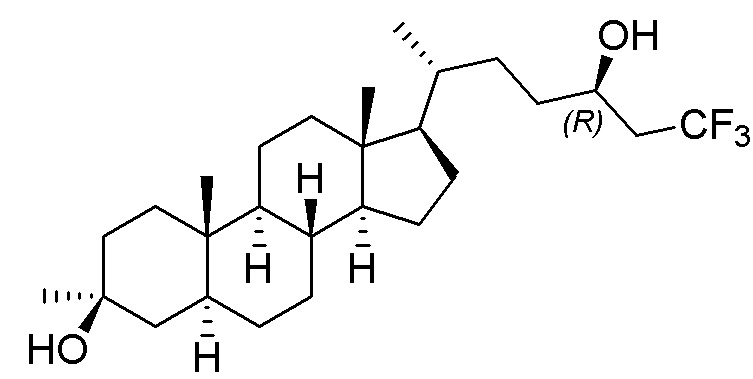 ,
, 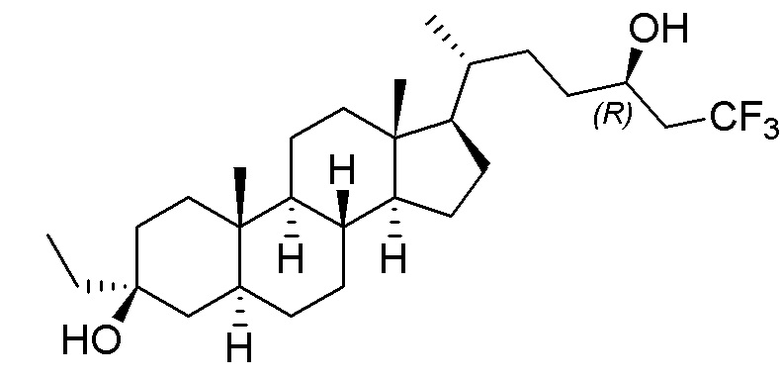 ,
, 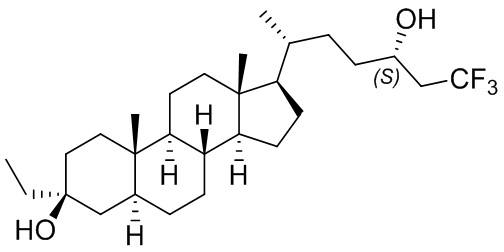 ,
,
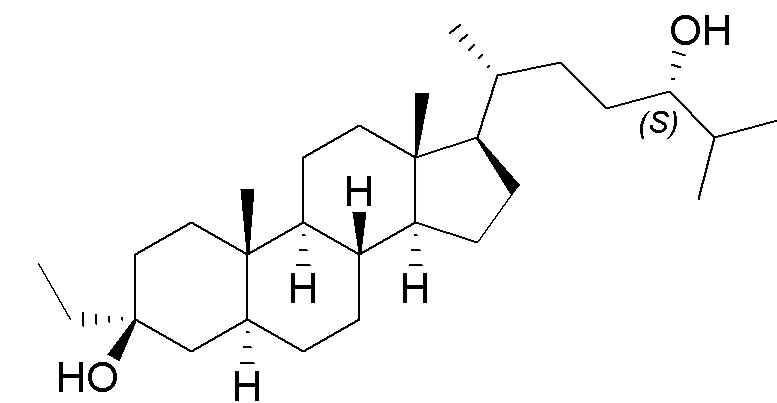 и
и 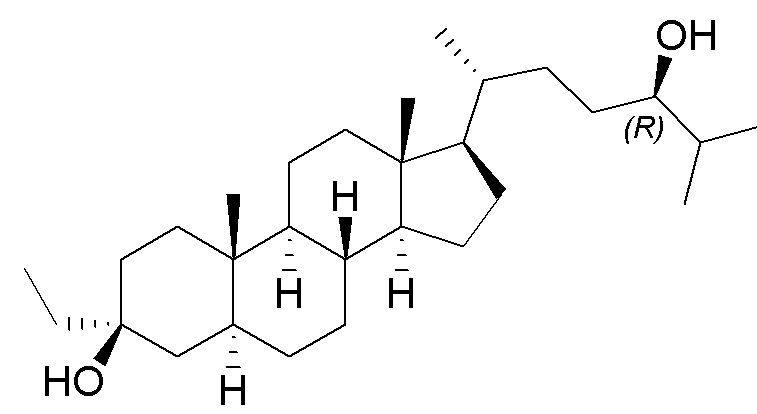 .
.
6. Соединение по п. 1 или его фармацевтически приемлемая соль, где соединение формулы (I-C-i) представляет собой соединение формулы (I-C-i-a) или формулы (I-C-i-b):
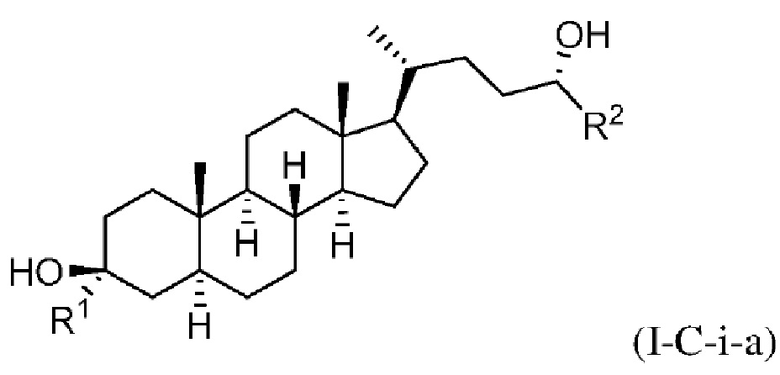 или
или
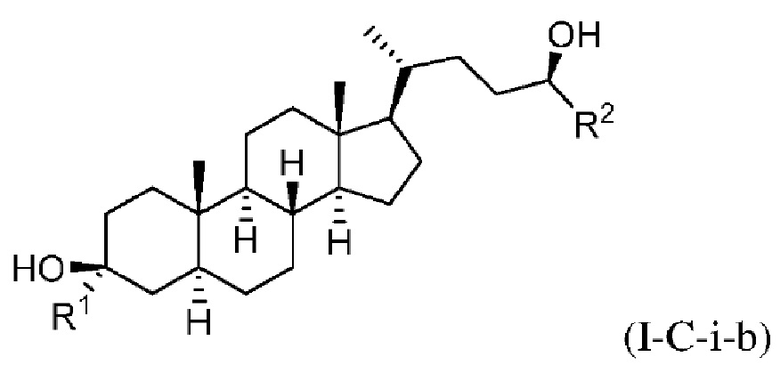 .
.
7. Соединение по п. 1 или его фармацевтически приемлемая соль, где соединение формулы (I-C-i) выбирают из группы, состоящей из:
 ,
,  ,
, 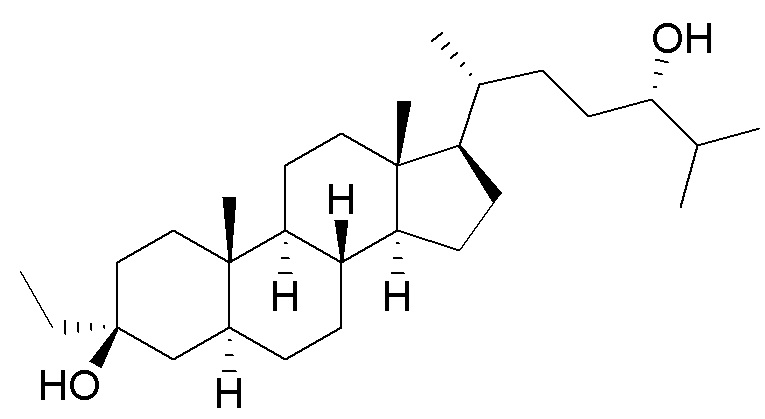 и
и 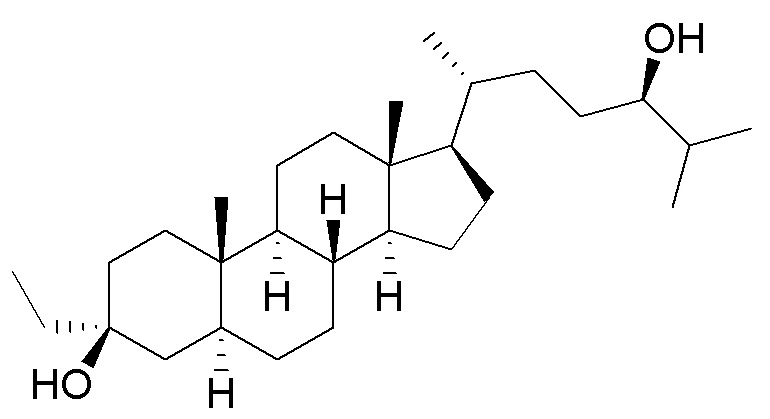 .
.
8. Соединение по п. 7, где соединение представляет собой:
 .
.
9. Соединение по п. 7, где соединение представляет собой:
 .
.
10. Соединение по п. 7, где соединение представляет собой:
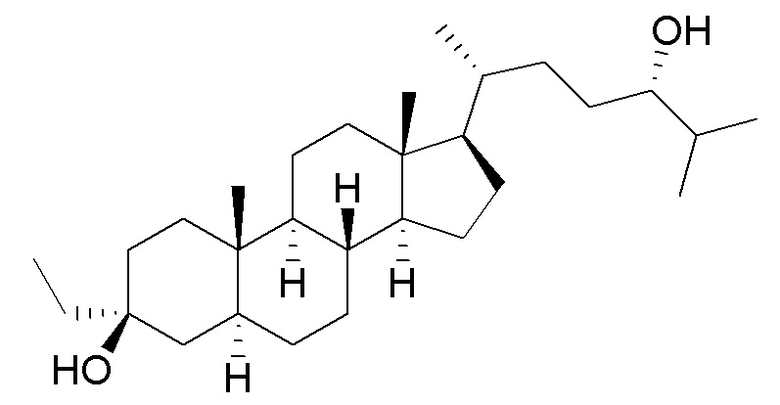 .
.
11. Соединение по п. 7, где соединение представляет собой:
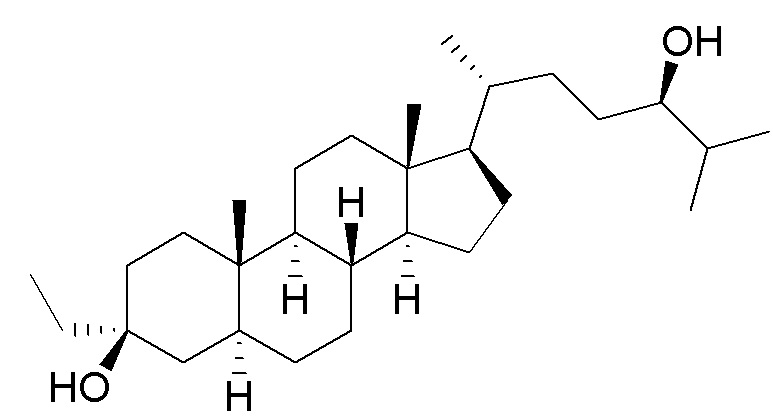 .
.
12. Соединение по п. 7, где соединение представляет собой фармацевтически приемлемую соль:
 .
.
13. Соединение по п. 7, где соединение представляет собой фармацевтически приемлемую соль:
 .
.
14. Соединение по п. 7, где соединение представляет собой фармацевтически приемлемую соль:
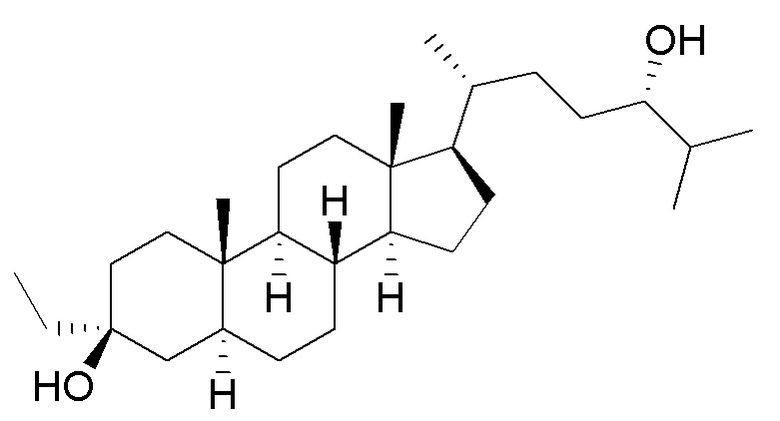 .
.
15. Соединение по п. 7, где соединение представляет собой фармацевтически приемлемую соль:
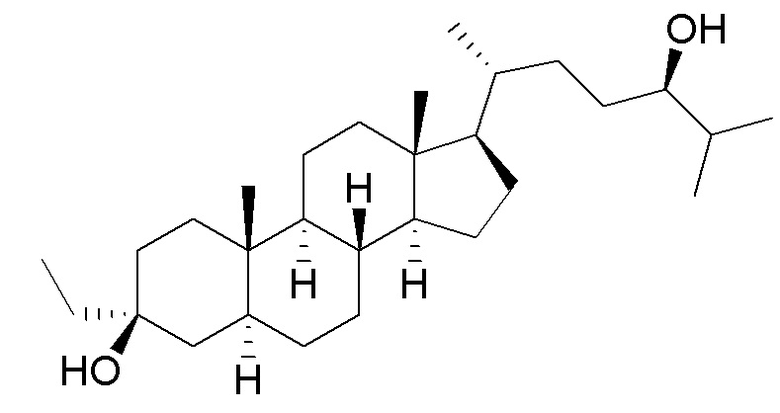 .
.
16. Фармацевтическая композиция для положительного аллостерического модулирования NMDA-рецептора, содержащая эффективное количество соединения по любому из пп. 1-15 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
17. Способ положительного аллостерического модулирования NMDA-рецептора, включающий контактирование NMDA-рецептора с эффективным количеством соединения по любому из пп. 1-15, или его фармацевтически приемлемой соли, или фармацевтической композиции по п. 16.
| WO 2013036835 A1, 14.03.2013 | |||
| WO 2014160480 A1, 02.10.2014 | |||
| WO 2014160441 A1, 02.10.2014 | |||
| S | |||
| M | |||
| Paul et al | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РАЗЛИЧНЫХ НАРУШЕНИЙ, СПОСОБ ИНДУКЦИИ СНА И СПОСОБ ИНДУКЦИИ АНЕСТЕЗИИ С ИХ ИСПОЛЬЗОВАНИЕМ, СПОСОБ МОДУЛИРОВАНИЯ КОМПЛЕКСА РЕЦЕПТОР ГАМКa-ХЛОРИДНЫЙ ИОНОФОР | 1996 |
|
RU2194712C2 |
Авторы
Даты
2021-02-04—Публикация
2016-07-06—Подача