Изобретение относится к биотехнологии и медицине, в частности, к области экстракорпоральных методов лечения, которую можно определить как терапевтический аферез (ТА). Методы терапевтического афереза используются в случаях, когда медикаментозное лечение не эффективно, не может быть назначено или как лечение выбора. В настоящее время применяются различные методы терапевтического афереза. Наиболее эффективными и селективными являются методы на основе сорбционных технологий. Особенностью сорбционных технологий является связывание различных компонентов крови или других биологических жидкостей с сорбционными материалами за счет аффинных, ионообменных (электростатических) и гидрофобных взаимодействий.
Повышение уровня атерогенных апоВ100-содержащих липопротеидов в крови приводит к развитию атеросклероза с сопряженным с ним риском сердечнососудистых осложнений [1]. К атерогенным липопротеидам относят липопротеиды низкой (ЛНП) и очень низкой плотности (ЛОНП), а также липопротеид(а) [Лп(а)].
Для снижения уровня атерогенных липопротеидов применяются различные гиполипидемические препараты, однако, в случае резистентности больного к лекарственной терапии назначается терапевтический аферез [2]. В российских рекомендациях по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза указывается, что для лечения тяжелых форм рефрактерных дислипидемий целесообразно применять экстракорпоральные методы лечения [3]
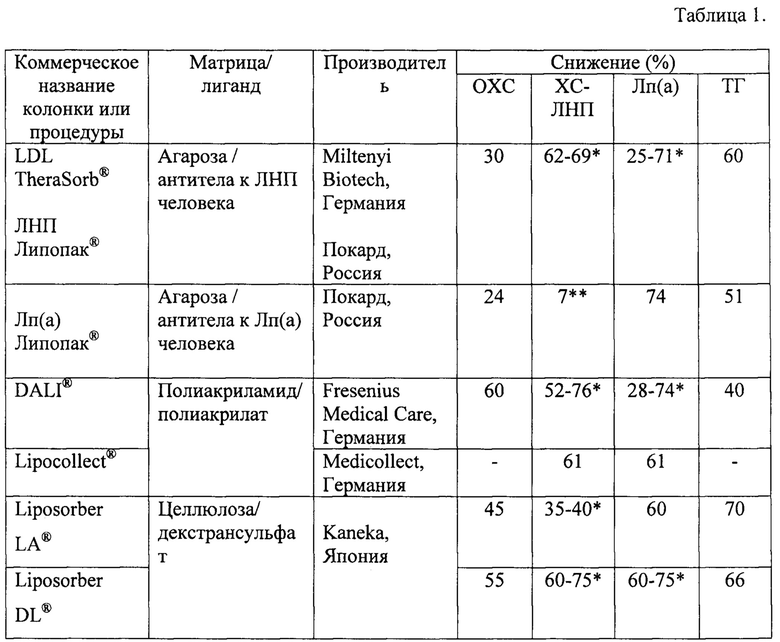
В настоящее время известны и применяются в клинической практике несколько сорбционных систем для удаления атерогенных липопротеидов. В таблице 1 показаны Основные характеристики сорбционных систем для удаления атерогенных липопротеидов (адаптировано из [4-10]).
Сорбенты «LDL TheraSorb» и «ЛНП Липопак®» представляют собой иммуносорбенты, так как содержат поликлональные антитела барана против ЛНП человека, иммобилизованные на гранулах агарозы [7, 11]. Сорбент «Лп(а) Липопак®» также является иммуносорбентом и содержит поликлональные антитела барана против Лп(а) человека, иммобилизованные на агарозную матрицу [7]. Отличительным свойством иммуносорбентов является аффинное взаимодействие с удаляемым компонентом, однако использование специфических антител - продуктов животного происхождения - обуславливает длительный и дорогостоящий процесс производства сорбента. Разрабатываемый сорбент не является иммуносорбентом, а является сорбентом на основе синтетического лиганда, соответственно не содержит белков животного и бактериального происхождения, безопасен, относительно дешев в изготовлении, может быть стерилизован автоклавированием. Сорбенты «Liposorber LA» и «Liposorber DL» представляют собой иммобилизованный на гранулах целлюлозы декстрансульфат [12, 13]. В колонках DALI® [14] и Lipocollect® [15] используются сорбенты гранулами из полиакриламида или пористого стекла соответственно, покрытые отрицательно заряженным полиакрилатом. Удаление ЛНП, ЛОНП и Лп(а) происходит посредством электростатического взаимодействия отрицательно заряженных групп сорбентов с положительно заряженными группами липопротеидов. Недостатком данных сорбентов является то, что, в отличие от разрабатываемого сорбента, кроме липопротеидов эти системы связывают положительно заряженные ионы кальция и магния, а также ряд других компонентов плазмы крови. [16].
Современные представления об атеросклерозе как о хроническом воспалительном заболевании, в развитии которого участвуют атерогенные липопротеиды, так же, как и результаты последних клинических исследований, позволяют предположить, что клинически оправданным может оказаться удаление из организма не только ЛНП и Лп(а), но и других молекул - участников воспалительного процесса [17].
Одним из возможных кандидатов для удаления является С-реактивный белок (СРБ), так как в результате расщепления пентамерной изоформы меняются свойства этой молекулы - переход СРБ в мономерную форму ускоряет агрегацию тромбоцитов и секрецию серотонина, вызывает адгезию нейтрофилов и активацию эндотелия, повышает концентрации компонентов воспалительного ответа, таких как моноцитный хемоаттрактантный белок-1, интерлейкин-8 и другие, что способствует развитию атеросклероза [18]. В ряде проспективных исследований показана взаимосвязь повышенной концентрации СРБ с сердечно-сосудистыми осложнениями и общей смертностью [19]. Описано снижение концентрации СРБ на процедуре терапевтического афереза с использованием системы для прямой гемоперфузии DALI®. Аферез липопротеидов проводили еженедельно, контролируя уровень СРБ до и после каждой процедуры. Максимальное снижение уровня СРБ за процедуру составило 35%. [20].
Удаление СРБ из кровотока у животных в модели инфаркта миокарда с использованием сорбента на основе сефарозы с иммобилизованным фосфохолином приводило к достоверному уменьшению постинфарктной зоны некроза с максимальным снижением уровня СРБ до 50% [21]. Согласно полученным в рамках недавно инициированного мультицентрового исследования CAMI1 данным, при проведении терапевтического афереза пациенту с инфарктом миокарда с использованием колонки PentraSorb® CRP («Pentracor», Германия), активным компонентом которой является тот же сорбент на основе сефарозы с иммобилизованным фосфохолином, уровень СРБ снижался на 56% после первой процедуры и на 52% после второй. На Фиг. 1 показана Динамика изменения уровня СРБ (%) при проведении процедур терапевтического афереза у пациента с инфарктом миокарда с использованием колонки PentraSorb® CRP. [22]:
Таким образом, в настоящее время описаны и широко применяются в клинической практике сорбенты для удаления атерогенных липопротеидов, начаты клинические исследования, направленные на изучение снижения повреждения тканей после острого инфаркта миокарда с помощью афереза СРБ [22].
Необходимо отметить, что описанные выше системы для терапевтического афереза предназначены для селективной сорбции какого-либо одного патогенного компонента, в то время как все более очевидной становится необходимость комплексного удаления атеротромбогенных и провоспалительных факторов, особенно при терапии сердечно-сосудистых патологий у пациентов с резистентностью к медикаментозной терапии и тяжелыми формами рефрактерных дислипидемий.
Известно семейство иммуносорбентов на основе наиболее стабильной и инертной агарозной матрицы [15] с иммобилизованными поликлональными антителами барана против атерогенных апоВ100-содержащих липопротеидов (ЛНП и Лп(а)) [7, 11]. Данные сорбенты обладают наилучшими характеристиками по специфичности и емкости, однако основным их недостатком является использование в процессе производства продуктов животного происхождения - специфических антител, определяющее длительный процесс получения, невозможность стерилизации автоклавированием конечного продукта (необходимость соблюдения асептических условий на протяжении всего процесса производства колонок) и, как следствие, высокую стоимость. Кроме того, высокая специфичность данных сорбентов обуславливает невозможность связывания с другими патогенными компонентами плазмы.
Использование описанных выше систем для терапевтического афереза (DALI®) позволяет, помимо атерогенных липопротеидов, также неспецифично удалять СРБ, однако эффективность этого процесса невысока [20].
Таким образом, разработка сорбента, не содержащего продуктов животного происхождения и способного эффективно и селективно удалять несколько компонентов плазмы крови одновременно, представляется актуальной задачей.
Задачей данного изобретения является создание сорбента, способного с достаточной эффективностью и селективностью одновременно удалять из плазмы крови человека атерогенные липопротеиды и СРБ.
Технический результат изобретения заключается в повышение эффективности удаления из плазмы крови человека атерогенных липопротеидов и СРБ
Это достигается тем, что в заявляемом сорбенте для сочетанного удаления из плазмы человека атерогенных липопротеидов и С-реактивного белка, стабильном в условиях автоклавирования, представляющем собой инертную, биосовместимую агарозную матрицу, ковалентно связанную через спейсер с синтетическим лигандом, согласно изобретению, в качестве спейсера используют диаминоэтан, а в качестве лиганда используют бензойный альдегид с промежуточным получением оснований Шиффа при соединении спейсера с матрицей и спейсера с лигандом. Основания Шиффа восстанавливливаются затем боргидридом натрия с получением стабильных ковалентных связей.
В заявляемом сорбенте в качестве матрицы используется аналогичная прототипу агарозная матрица, в качестве лиганда - химический лиганд, связанный с матрицей через спейсер. Особенностью разработанного сорбента является то, что его группы имитируют молекулярные структуры сайта связывания СРБ-рецептора лейкоцитов, который распознает аминокислотную последовательность TKPLKAFTVCLH, имеющуюся на каждой субъединице пентамера, при этом для эффективного связывания достаточно пептидного фрагмента KAFTVC [23]. Кроме того, известно, что СРБ связывается с разной степенью эффективности с полимерными веществами, имеющими множество аминогрупп на поверхности полимера, например, с полилизином [24].
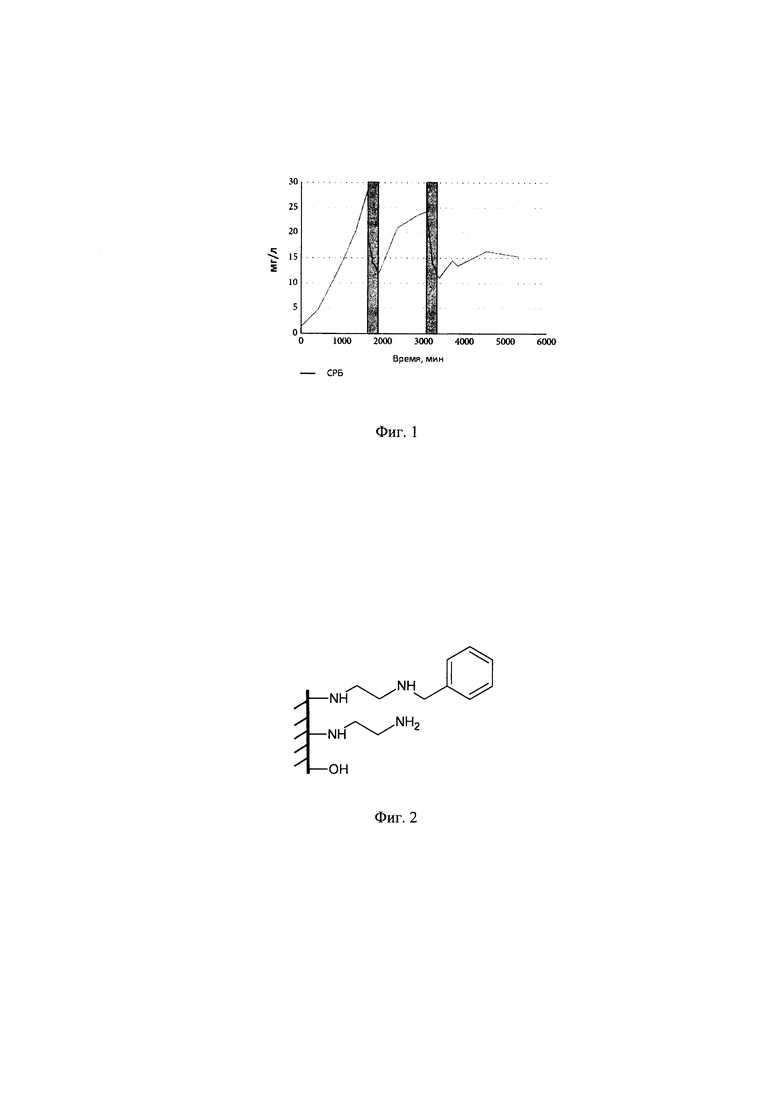
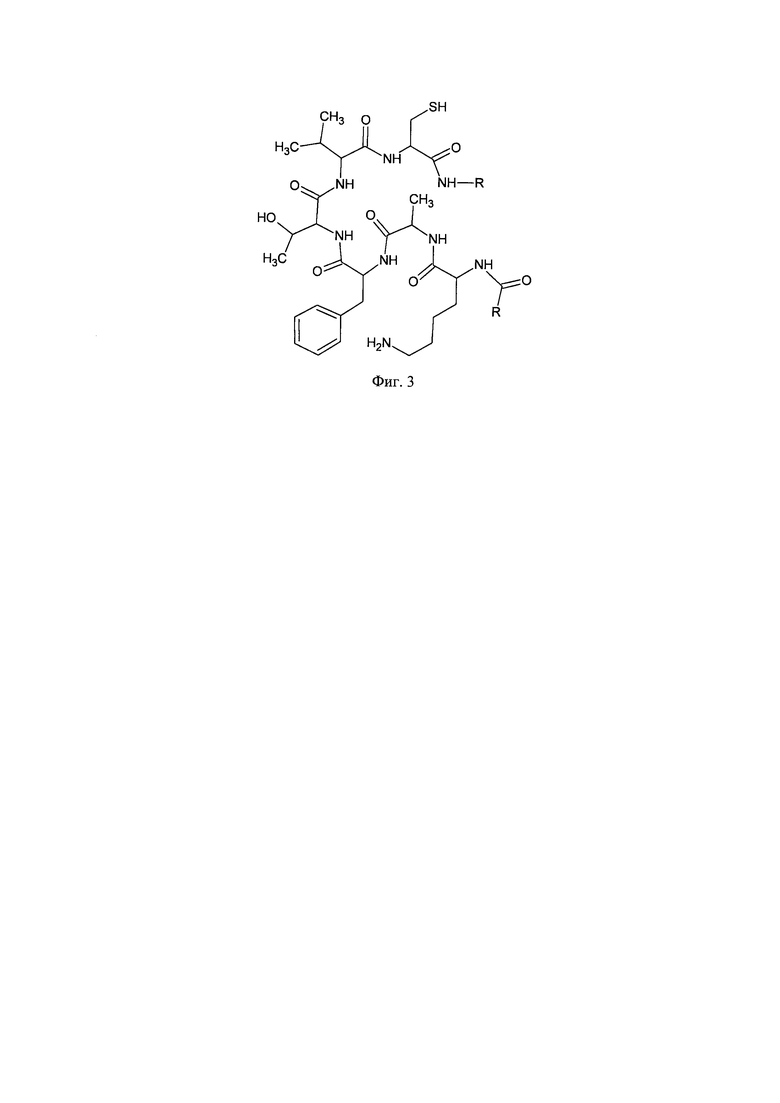
В структуре разрабатываемого сорбента на поверхности матрицы присутствуют группы ОН- (моносахаридных остатков), не подвергшиеся аминированию, также имеются первичные и вторичные аминогруппы, полученные после присоединения диаминоэтана, а также есть ароматические бензольные кольца, полученные при присоединении бензальдегида. На Фиг. 2 показаны структурные компоненты разрабатываемого сорбента, что имитирует большинство экспонированных на поверхности белка молекулярных групп фрагмента KAFTVC - основного эпитопа связывания СРБ-рецептора. На Фиг. 3 показаны структурные компоненты природного эпитопа KAFTVC.. Обилие аминогрупп на поверхности сорбента дает основание считать, что в сорбционных характеристиках будет также некоторое сходство с полилизином. Сульфгидрильная групп, которая присутствует в природном белке (остаток цистеина), исключена из рассмотрения ввиду ее химической нестабильности из-за окисления.
Пример 1.
Агарозную матрицу инкубировали на шейкере с 2 объемами 2% водного раствора NaIO4 в течение 2 часов при температуре 20°С и перемешивании. Активированную матрицу инкубировали на шейкере с 1 объемом 2 М водного раствора диаминоэтана в течение 2 часов при температуре 20°С. Аминированную матрицу инкубировали с 2 объемами 2% раствора NaBH4 в течение 30 минут при температуре 20°С и перемешивании. Процедуру блокировки с помощью NaBH4 проводили дважды. Полученную этиламин сефарозу промывали на стеклянном фильтре 10 объемами воды.
Иммобилизацию бензойного альдегида осуществляли следующим образом. Готовили раствор А - 0,02 М Na2CO3, растворенный в смеси 90% воды и 10% ДМСО. Готовили суспензию этиламин сефарозы в растворе А, содержащую 0,5 объема осевшего геля от объема суспензии. Добавляли бензойный альдегид в раствор А до концентрации 1 мг/мл. Добавляли к суспензии геля раствор альдегида в расчете 40 мкмоль лиганда на 1 мл геля. Инкубировали смесь на шейкере при температуре 37°С в течение 2 часов. По окончании инкубации к смеси добавили 2 объема 2% раствора NaBH4 и, помешивая, выдержали в течение 30 минут при температуре 20°С. Затем сорбент промыва 10 объемами дистиллированной воды, 3 объемами 0,2 М глицинового буфера рН 2,5 и 3 объемами 0,1 М Na2CO3. Готовили повторно суспензию сорбента в растворе А и повторяли все процедуры, описанные ранее касательно иммобилизации бензойного альдегида. После блокировки раствором NaBH4 проводили повторную блокировку 2 объемами 2% раствора NaBH4 в течение 30 минут, помешивая, при температуре 20°С. Полученный сорбент промыли 5 объемами дистиллированной воды, 5 объемами 0,2 М глицинового буфера рН 2,5 и 5 объемами 0,1 М Na2CO3 и 10 объемами дистиллированной воды. Хранение сорбента в 20% этаноле при температуре 4°С.
Пример 2.
Эффективность удаления атерогенных липопротеидов и СРБ изучали методом аффинной хроматографии плазмы крови человека на образцах разработанного сорбента и его прототипах. Поскольку сравнение сорбционных характеристик разрабатываемого сорбента и референсных сорбентов целесообразно проводить в одинаковых условиях, для изучения сорбционной емкости по СРБ в качестве прототипа нами был синтезирован иммуносорбент с иммобилизованной сульфатной фракцией антител к СРБ. Для изучения сорбционной емкости по липопротеидам в качестве прототипов использовали иммуносорбенты «ЛНП-Липопак®» и «Лп(а)-Липопак®».
Хроматографию проводили на 100 мкл сорбента, время контакта сорбента с плазмой составляло 1 час, объем плазмы - 1 мл при изучении сорбции липопротеидов, 4 мл - при изучении сорбции СРБ. Сорбционную емкость рассчитывали дифференциальным методом по разнице между количеством компонента плазмы крови исходно и после проведения хроматографии.
Значения сорбционной емкости и эффективности удаления компонентов плазмы крови предлагаемым сорбентом и соответствующими иммуносорбентами представлены в таблице 2 - Характеристика предлагаемого сорбента относительно удаляемых атерогенных и провоспалительных компонентов плазмы крови человека.
Эффективность сорбции таких провоспалительных компонентов плазмы как ОХС, ТГ, Лп(а) и СРБ, при проведении хроматографии на разработанном сорбенте не уступает соответствующим иммуносорбентам-прототипам. Для иммуносорбентов характерна сорбция преимущественно тех молекул и частиц, к которым были получены иммобилизованные на сорбент антитела, т.е. каждый из прототипов способен сорбировать либо атерогенные липопротеиды, либо СРБ. Разработанный сорбент селективно взаимодействует с ЛНП, Лп(а) и СРБ, с эффективностью, сравнимой с референсными иммуносорбентами.
Пример 3.
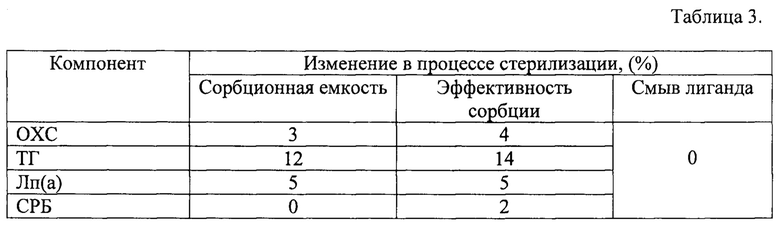
Стабильность сорбента в условиях стерилизации исследовали автоклавированием в течение 40 минут при температуре 121°С и давлении 1,1 бар в автоклаве Tuttnauer® (Израиль). Изучение сорбционных характеристик в образцах сорбента до и после стерилизации проводили методом аффинной хроматографии 100 мкл сорбента с 1 мл плазмы крови человека, время контакта сорбента с плазмой составляло 1 час. Сорбционную емкость рассчитывали дифференциальным методом по разнице между количеством компонента плазмы крови исходно и после проведения хроматографии. В результате эксперимента было установлено, что автоклавирование сорбента в течение 60 минут при температуре 121°С не приводит к изменению сорбционных характеристик в пределах погрешности эксперимента. В Таблице 3 показаны характеристики предлагаемого сорбента до и после стерилизации.
Таким образом, заявляемый сорбент с синтетическим лигандом, способен одновременно удалять несколько компонентов плазмы крови человека с эффективностью, аналогичной для специфичных иммуносорбентов, предназначенных для удаления индивидуальных компонентов. Сорбент в дальнейшем может использоваться для комплексного селективного удаления наиболее атерогенных липопротеидов плазмы крови человека.
Список использованных источников
1. Hoogeveen RC, Gaubatz JW, Sun W et al. Small dense low-density lipoprotein-cholesterol concentrations predict risk for coronary heart disease: the Atherosclerosis Risk In Communities (ARIC) study. Arterioscler Thromb Vase Biol. 2014; 34(5): 1069-77.
2. Julius U. Current Role of Lipoprotein Apheresis in the Treatment of High-Risk Patients. J Cardiovasc Dev Dis. 2018; 5(2). pii: E27.
3. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации VI пересмотр. Москва, 2017
4. Stefanutti С, Morozzi С, Petta A. Lipid and low-density-lipoprotein apheresis. Effects on plasma inflammatory profile and on cytokine pattern in patients with severe dyslipidemia. Cytokine. 2011; 56: 842-849.
5. Stefanutti C, Morozzi C, Perrone G, et al. The lipid- and lipoprotein- [LDL-Lp(a)] apheresis techniques. Updating. G Chir. 2012; 33:444-449.
6. Thompson GR, Barbir M, Davies D, et al. Recommendations for the use of LDL apheresis. Atherosclerosis. 2008; 198:247-55.
7. Pokrovsky SN, Sussekov AV, Afanasieva OI, et al Extracorporeal immunoadsorbtion for the specific removal of lipoprotein(a) [Lp(a) apheresis]: preliminary clinical data. Chem. Phys. Lipids. 1994; 67/68:323-30.
8. Keller C. Apheresis in coronary heart disease with elevated Lp (a): a review of Lp (a) as a risk factor and its management. Ther Apher Dial. 2007; 11(1):2-8.
9. Bambauer R, Bambauer C, Lehmann B, et al "LDL-Apheresis: Technical and Clinical Aspects," The Scientific World Journal, vol. 2012, Article ID 314283, 19 pages, 2012. doi: 10.1100/2012/314283
10. Ballantyne CM, ed. Clinical lipidology: a companion to Braunwald's heart disease. Philadelphia: Saunders Elsevier; 2009; p. 363-75.
11. Stoffel W, Borberg, Grevev: Application of specifi с extracorporeal removal of low-density lipoprotein in familial hypercholesterolaemia. Lancet. 1981; 2(8254): 1005-7.
12. Mabuchi H, Michishita I, Takeda M, et al: A new low-density lipoprotein apheresis system using two dextran sulfate cellulose columns in an automated column regenerating unit (LDL continuous apheresis). Atherosclerosis. 1987; 68(1-2): 19-25.
13. Otto C, Geiss HC, Laubach E, et al. Effects of direct adsorption of lipoproteins apheresis on lipoproteins, low-density lipoprotein subtypes, and hemorheology in hypercholesterolemic patients with coronary artery disease. Ther Apher. 2002; 6(2): 130-5
14. Bosch T, Schmidt В, Blumenstein M, et al. Lipid apheresis by hemoperfusion: in vitro efficacy and ex vivo biocompatibility of a new low-density lipoprotein adsorber compatible with human whole blood. Artif Organs. 1993;17(7): 640-52.
15. Алтынова Е.В., Афанасьева ОИ, Болдырев А.Г., соавт. Гемосорбенты для удаления атерогенных липопротеидов (in vitro сравнение). Эфферентная терапия. 2006; 12: 3-14.
16. Сафарова М.С., Афанасьева О.И., Применение афереза липопротеидов при атеросклерозе и его осложнениях. Атеросклероз и дислипидемии. 2014; 2: 5-16.
17. Libby Р, Loscalzo J, Ridker РМ et al. Inflammation, Immunity, and Infection in Atherothrombosis: JACC Review Topic of the Week. J Am Coll Cardiol. 2018; 72(17): 2071-2081
18. JoAnn Triaf, Lawrence A. Potempa, Mark L. Entman: The role of C-reactive protein in innate acquired inflammation: new perspectives. Inflamm Cell Signal. 2016; 3(2). pii: e1409.
19. Prins BP, Abbasi A, Wong A, et al. Investigating the Causal Relationship of C-Reactive Protein with 32 Complex Somatic and Psychiatric Outcomes: A Large-Scale Cross-Consortium Mendelian Randomization Study. PLoS Med. 2016; 13(6): e1001976. doi: 10.1371/journal.pmed.l001976.
20. Stefanutti C, Mazza F, Steiner M, Watts G.F., et al. Relationship between Sustained Reductions in Plasma Lipid and Lipoprotein Concentrations with Apheresis and Plasma Levels and mRNA Expression of PTX3 and Plasma Levels of hsCRP in Patients with HyperLp(a)lipoproteinemia. Mediators Inflamm. 2016; 2016: 4739512. Published online 2016 Jan 19. doi: 10.1155/2016/4739512
21. Sheriff A, Schindler R, Vogt В et al. Selective apheresis of C-reactive protein: a new therapeutic option in myocardial infarction? J Clin Apher. 2015; 30(1): 15-21.
22. Ries W, Sheriff A, Heigl F, Zimmermann O, Garlichs CD, Torzewski J. "First in Man": Case Report of Selective C-Reactive Protein Apheresis in a Patient with Acute ST Segment Elevation Myocardial Infarction. Case Rep Cardiol. 2018; 2018:4767105. doi: 10.1155/2018/4767105.
23. Zen Q, Zhong W, Mortensen RF. Binding site on human C-reactive protein (CRP) recognized by the leukocyte CRP-receptor. J Cell Biochem. 1997; 64(1): 140-51.
24. Lee RT, Takagahara I, Lee YC. Mapping the binding areas of human C-reactive protein for phosphorylcholine and polycationic compounds. Relationship between the two types of binding sites. J Biol Chem. 2002. 277(1): 225-32.
* Данные представлены как минимальный и максимальный процент удаления согласно опубликованным в различных клинических исследованиях данным
** корригированное значение
ОХС - общий холестерин, ХС-ЛНП - холестерин липопротеидов низкой плотности, Лп(а) - липопротеид(а), ТГ-триглицериды
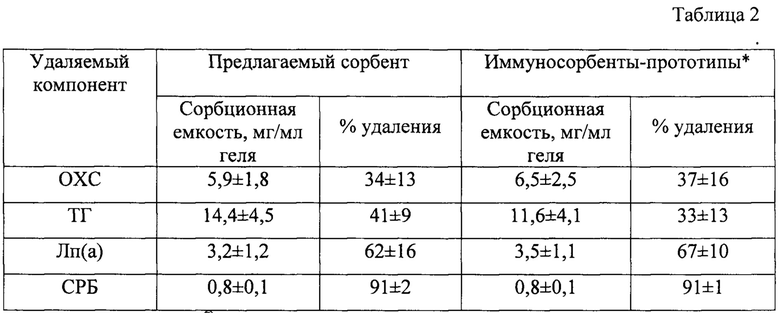
* ЛНП-Липопак® для ОХС, ТГ
* Лп(а)-Липопак® для Лп(а)
*сорбент с иммобилизованной сульфатной фракцией антител к СРБ для СРБ
Данные представлены как среднее ± ст. отклонение по 4 плазмам
| название | год | авторы | номер документа |
|---|---|---|---|
| СОРБЕНТ ДЛЯ УДАЛЕНИЯ ИММУНОГЛОБУЛИНОВ | 2006 |
|
RU2325172C2 |
| СОРБЕНТ ДЛЯ УДАЛЕНИЯ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2389022C2 |
| СПОСОБ ИЗМЕРЕНИЯ КОНЦЕНТРАЦИИ ЦИРКУЛИРУЮЩИХ МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИДОВ НИЗКОЙ ПЛОТНОСТИ В СЫВОРОТКЕ КРОВИ ЧЕЛОВЕКА | 2016 |
|
RU2659211C2 |
| СОРБЕНТ ДЛЯ УДАЛЕНИЯ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2558107C1 |
| СИНТЕТИЧЕСКИЙ АНТИГЕН, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬ АУТОАНТИТЕЛА К β-АДРЕНОРЕЦЕПТОРУ | 2007 |
|
RU2356576C1 |
| МЕТОД ВЫДЕЛЕНИЯ И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ | 2015 |
|
RU2592238C1 |
| СПОСОБ ОЦЕНКИ СОДЕРЖАНИЯ ЦИРКУЛИРУЮЩИХ ДЕСИАЛИРОВАННЫХ ЛИПОПРОТЕИДОВ НИЗКОЙ ПЛОТНОСТИ | 2015 |
|
RU2623879C2 |
| ПРИМЕНЕНИЕ СЕЛЕКТИВНОГО ИММУНОСОРБЕНТА ДЛЯ УДАЛЕНИЯ АНТИТЕЛ К ДЕСМОГЛЕИНУ 3 ТИПА ИЗ СЫВОРОТКИ КРОВИ У БОЛЬНЫХ ПУЗЫРЧАТКОЙ | 2016 |
|
RU2627652C1 |
| СПОСОБ ЛЕЧЕНИЯ АТЕРОСКЛЕРОЗА | 2006 |
|
RU2310478C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛИТИЧЕСКОЙ АКТИВНОСТИ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ | 2015 |
|
RU2577719C1 |
Изобретение относится к сорбентам для удаления атерогенных липопротеидов и С-реактивного белка из плазмы крови. Сорбент содержит полимерную матрицу, к которой ковалентно присоединен лиганд через молекулярный спейсер. Для присоединения молекулярного спейсера матрицу активируют с получением альдегидных групп с последующим присоединением диаминоэтана с получением основания Шиффа, восстанавливаемого затем боргидридом натрия. В качестве лиганда используют бензальдегид, который за счет альдегидной группы присоединяется к первичным аминогруппам на матрице, предварительно полученным при присоединении диаминоэтана. Основание Шиффа восстанавливается с помощью боргидрида натрия. Техническим результатом изобретения является получение сорбента, который эффективно удаляет атерогенные липопротеиды и С-реактивный белок из плазмы крови. Полученный сорбент может быть стерилизован автоклавированием без потери сорбционных характеристик. 3 ил., 3 табл., 3 пр.
Сорбент для сочетанного удаления из плазмы крови человека атерогенных липопротеидов и С-реактивного белка, содержащий инертную, биосовместимую агарозную матрицу, ковалентно связанную через спейсер с синтетическим лигандом, отличающийся тем, что в качестве спейсера использован диаминоэтан, а в качестве лиганда использован бензойный альдегид, иммобилизованный с промежуточным получением оснований Шиффа при соединении спейсера с матрицей и спейсера с лигандом, при этом основания Шиффа восстановлены боргидридом натрия с образованием стабильных ковалентных связей.
| Е.А | |||
| Алтынова и др | |||
| Гемосорбенты для удаления атерогенных липопротеидов, Эфферентная терапия, т | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| А.С | |||
| Морозов и др | |||
| Сорбенты для экстрапорального удаления токсических веществ и молекул с нежелательной биологической активностью (обзор), Общая реаниматология, 2016, 12, 6, с.82-107 | |||
| П.А | |||
| Левашов и др | |||
| Синтез аффинных сорбентов с иммобилизованными синтетическими лигандами для процедур терапевтического афереза, Биомедицинская химия, 2010, т | |||
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| УСТРОЙСТВО ДЛЯ ОБВЯЗКИ ОБСАДНЫХ КОЛОНН НА УСТЬЕ СКВАЖИНЫ | 1995 |
|
RU2118441C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОРБЕНТА ДЛЯ УДАЛЕНИЯ АТЕРОГЕННЫХ ЛИПОПРОТЕИДОВ ИЗ КРОВИ (ВАРИАНТЫ) | 2000 |
|
RU2200586C2 |
| RU 2071058 C1, 27.12.1996. | |||
Авторы
Даты
2019-09-18—Публикация
2019-03-25—Подача