Изобретение относится к экспериментальной медицине, конкретно к способам одновременной диагностики и терапии (тераностики) онкологических заболеваний, и может быть использовано в онкологии для диагностики опухолей и их лечения.
Известен способ диагностики онкологических заболеваний радиоизотопным методом с использованием радиоактивных изотопов: 32Р, 85Sr, 99Тс, после внутривенных инъекций которых млекопитающее сканируют и определяют остаточную дозу излучения. Максимальное излучение соответствует месту расположения опухоли [1, 2]. Существенным недостатком способа является опасность для здоровья радиоактивных изотопов, а также отсутствие возможности одновременной терапии.
В последние годы для диагностики онкологических заболеваний в эксперименте широко применяются наночастицы оксидов металлов.
Многочисленные экспериментальные и теоретические исследования показывают, что переход размеров исследуемых частиц в нанометровый диапазон приводит к качественному изменению свойств объекта. При этом структурные элементы могут приобретать физические, физико-химические и химические свойства, существенно отличающиеся от свойств объемного аналога. Применение наночастиц в медицине объясняется, во-первых, прекрасным транспортом внутри живых организмов даже по самым тонким капиллярам и способностью проникать в клетки путем эндоцитоза, а во-вторых, возможностью модификации наночастиц молекулами различных веществ.
Известны способы диагностики онкологических заболеваний с использованием наночастиц на основе оксидов железа с возможным сочетанием с другими соединениями и оксидами [3, 4]. Недостатками данных способов являются токсичность используемых частиц, очень медленное выведение их из организма, а также отсутствие возможности одновременной терапии.
Известен способ диагностики онкологических заболеваний с использованием оксидов алюминия. Цитотоксическое действие структур определяли при помощи МТТ-теста на культурах базальных клеток HeLa, А549, MDA и РуМТ [5]. Недостатком этого способа является то, что наночастицы оксида алюминия плоской формы обладают ярко выраженным токсическим действием по отношению к исследованным линиям клеток, а также отсутствие возможности одновременной терапии.
Известен способ диагностики онкологических заболеваний с использованием наночастиц диоксида титана [6]. Недостатком этого способа является то, что диоксид титана приводят к разрыву одно- и двухцепочечных ДНК, а также приводят к повреждению хромосом. Попадая в организм, титановые наночастицы накапливаются в различных органах, поскольку в организме нет механизмов их выведения. Вследствие своих малых размеров они легко проникают в клетки и начинают влиять на их элементы. В частности, наночастицы вызывают так называемый оксидативный стресс - физиологический стресс или повреждение организма, вследствие протекания нехарактерных для собственного метаболизма окислительных реакций.
Таким образом, общим недостатком выше указанных способов является то, что наночастицы практически всех оксидов металлов по результатам медицинских и биомедицинских исследований обнаруживают разную степень токсичности, накапливаясь в тканях внутренних органов. Кроме того, в этих известных способах отсутствует возможность одновременной диагностики и терапии онкологических заболеваний.
Перечисленных выше недостатков лишены наноразмерные частицы кремния и диоксида кремния, проявляющие высокие биосовместимые и биодеградируемые свойства [7, 8]. Кроме того, кремниевые наночастицы нетоксичны при распаде в теле: продукт их метаболизма - кремниевая кислота - содержится в человеческом организме и полезна для образования костной и соединительной тканей.
Известно использование кремниевых наночастиц в косметических средствах, ослабляющих ультрафиолетовое излучение [9, 10], и в онкологии в качестве усилителя ультразвукового воздействия для сонодинамической терапии опухолей - для данного применения водную суспензию наночастиц получали механическим измельчением пленок мезопористого кремния в планетарной мельнице FRITSCH "Pulverisette 7", пленки мезопористого кремния, в свою очередь, формировались с помощью стандартного метода электрохимического травления пластин кристаллического кремния [11].
Задачей настоящего изобретения является создание эффективного и безопасного способа одновременной диагностики и терапии (тераностики) онкологических заболеваний в эксперименте с использованием биосовместимых и биорезорбируемых в организме кремниевых наночастиц, позволяющих применять метод магнитно-резонансной томографии (МРТ).
Решение поставленной задачи достигается предлагаемым способом одновременной диагностики и терапии (тераностики) онкологических заболеваний в эксперименте, заключающимся в том, что в организм животного осуществляют трансплантацию клеток опухоли, после чего интратуморально или внутривенно вводят суспензию кремниевых наночастиц размера 25±5 нм, состоящих из ядра кристаллического кремния, покрытого аморфной оболочкой из диоксида кремния, полученных плазмохимическим методом и имеющих до 1019 Pb-центров, при концентрации наночастиц кремния в суспензии 0,3-0,5 мг/мл, с последующим проведением магнитно-резонансной томографии тела животного на частоте атомов водорода в режиме измерения Т2 взвешенной последовательности импульсов, и на основании результатов визуального анализа полученных изображений диагностируют наличие опухоли и затем наблюдают ингибирование роста опухоли.
Для приготовления суспензии наночастиц кремния можно использовать дистиллированную воду или физиологический раствор.
Концентрация наночастиц кремния в суспензии может составлять 0,3-0,5 мг/мл.
Кремниевые наночастицы, состоящие из ядра кристаллического кремния, покрытого аморфной оболочкой из диоксида кремния, имеют до 1019 Рb-центров.
Плазмохимический синтез используемых в предлагаемом способе наночастиц кремния осуществлялся в замкнутом газовом цикле: в инертном газе в присутствии кислорода. Заполнение системы инертным высокоочищенным газом (Аr) проводилось из магистрали. Глубокую очистку технологического газа от примесей влаги и кислорода производили при помощи расплавленного алюминия или специальных финишных очистителей, необратимо поглощающих примеси до уровня нескольких ppb. Концентрация кислорода в подаваемом газе составляла 1,5-3,0 об. %. Толщина поверхностного оксидного слоя на ядре кристаллического кремния (степень окисления кремния) контролировалась по концентрации кислорода в отходящем газе. В качестве реактора использовался плазменный испаритель-конденсатор, работающий в дуговом низкочастотном разряде. Исходное сырье - порошок кремния (99,99%) подавался в реактор инертным газовым потоком из соответствующего дозатора. В реакторе порошок испарялся при температуре ~10000°С. На выходе из низкотемпературной плазменной зоны полученная парогазовая смесь подвергалась резкому охлаждению газовыми струями, то есть создавались условия для конденсации нанокремния. Далее полученный аэрозоль с температурой 100-200°С поступал в холодильник, где охлаждался до температуры 60-80°С. Крупные частицы, в том числе и не переработанная фракция, отделялись от кондиционного ультрадисперсного порошка в классификаторе инерционного типа [12].
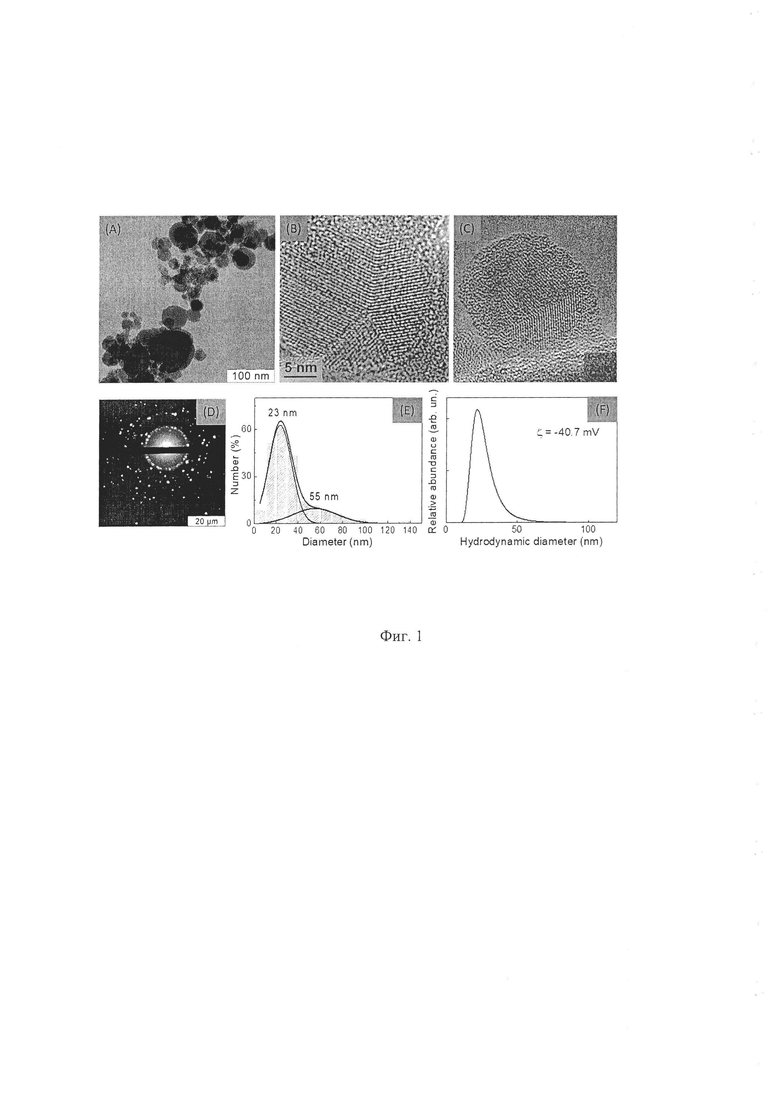
Полученные кремниевые наночастицы были исследованы взаимодополняющим набором методов: просвечивающей электронной микроскопии высокого разрешения (HRTEM, Jeol-JEM 2100 F/Cs, 200 keV), рентгеновской дифракции (Guinier camera Huber G670), спектроскопии комбинационного рассеяния (Т-64000, Jobin Yvon), люминесцентной спектроскопии (QE65000, Ocean Optics, USA), спектроскопии электронного парамагнитного резонанса (CMS 8400 ADANI), РФЭС (Kratos AXIS Ultra DLD, Kratos Analytical, UK). В результате было установлено, что исследуемые частицы имеют размер 25±5 нм.
На микрофотографии, приведенной на фиг. 1А (ПЭМ изображение), отчетливо видны структурные элементы размером 20-30 нм, образующие разветвленные агрегаты. Механизм агрегирования может быть разным, в данном случае слипание возможно за счет электростатического взаимодействия частиц нанокремния, которое возникает в микроскопе при действии электронного пучка на частицы. Фиг. 1В и 1С (ПЭМ изображения) получены при высоком разрешении; фиг. 1D - картина электронной дифракции.
На фиг. 1Е и 1F приведены результаты исследования распределения наночастиц по размерам (на фиг. 1F - методом динамического светорассеяния).
Для получения информации о структуре отдельной частицы были приготовлены 0,1% по массе золи нанокремния в воде. Данный способ пробоподготовки в сочетании с ультразвуковой обработкой позволил избежать слипания отдельных наночастиц. Сочетание рентгенофазового анализа и просвечивающей электронной микроскопии позволило установить, что полученные ультрадисперсные частицы кремния размера 25±5 нм, состоят из кристаллического кремниевого ядра и аморфной оксидной оболочки. Количественное содержание оксида кремния в полученных наночастицах, контролируемое в процессе их синтеза по количеству поглощенного кислорода, составляло 65-80 мас. %.
Такая структура полученных плазмохимических наноразмерных кремниевых частиц имеет большое число - до 1019 Рb-центров (ЭПР-спектрометр высокого разрешения CMS 8400 ADANI), связанных с дефектами, локализованными на поверхности наночастиц и поверхности раздела "кремниевое ядро - оксидная оболочка", что обеспечивает возможность их использования для неинвазивной визуализации методом МРТ распределения и локализации введенных наночастиц в органах и тканях живых организмов, мониторинга ингибирования роста опухоли и замедления процесса метастазирования, а также контроля их биодеградации в организме.
При разработке предлагаемого способа одновременной диагностики и терапии (тераностики) онкологических заболеваний in vivo нами предварительно были проведены исследования цитотоксичности полученных плазмохимических частиц нанокремния in vitro.
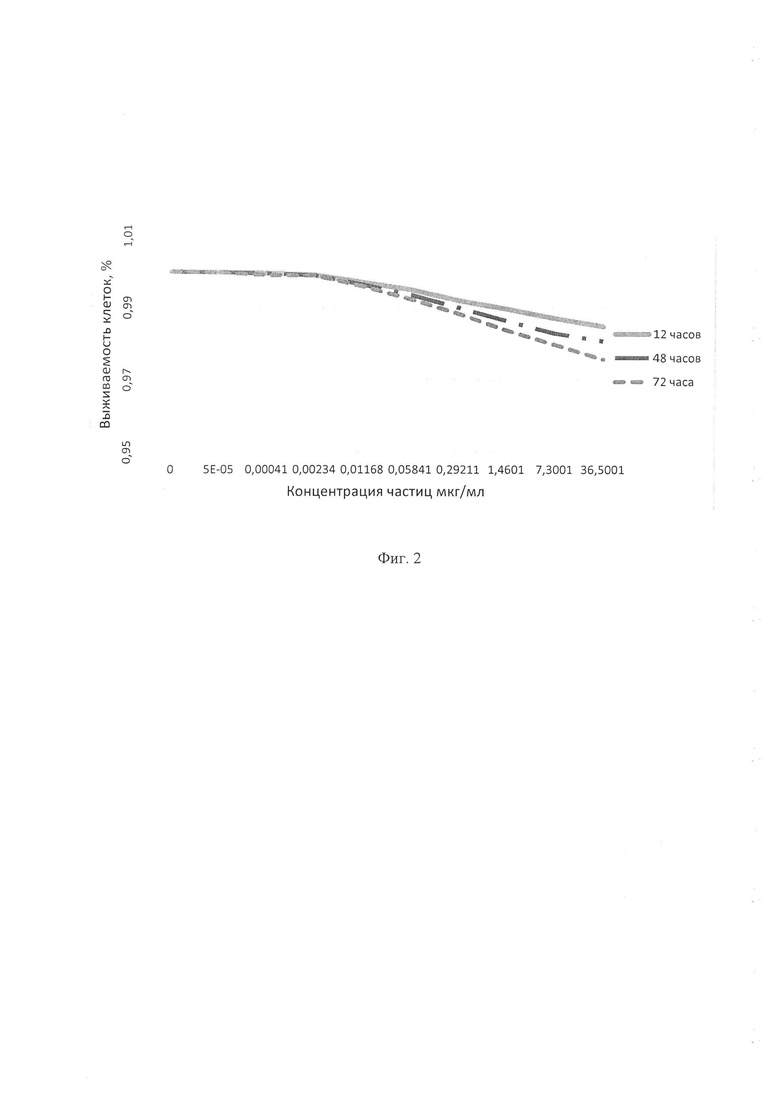
Для анализа цитотоксичности использовали моноклональные клеточные линии эритролейкоза человека К562. Анализ проводили с помощью стандартного колориметрического МТТ-теста [13, 14], позволяющего количественно определять выживаемость клеток относительно контроля. Клетки эритролейкоза К562 высевали в 96-луночный планшет в объеме 100 мкл. Исходную водную суспензию частиц нанокремния разводили в PBS 1:100, получая концентрацию 730 мкг/мл, и обрабатывали ультразвуком для предотвращения слипания частиц. Далее приготавливали серию 5х разведений из первого разведения 1:100. 5 мкл полученных разведенных суспензий добавляли к клеткам в 4 повторах для каждой точки. Оставляли 4 лунки с клетками, в которые не добавляли нанокремний (контрольные лунки). Планшет помещали в СО2-инкубатор. Через 12, 48 и 72 часа во все лунки добавляли по 5 мкл раствора МТТ-реагента и помещали планшет в СO2-инкубатор на 3 часа. После инкубации во все лунки добавляли по 100 мкл лизирующего буфера, помещали планшет в герметично закрытый пакет и оставляли на ночь при комнатной температуре, чтобы обеспечить лизис клеток и растворение образовавшихся кристаллов формазана. На следующий день на планшетном спектрофотометре измеряли поглощение при 540 нм (формазан) и 690 нм (фон) для вычисления коэффициента оптического поглощения (OD), который пропорционален количеству живых клеток в лунке.
Проведенный анализ показал, что плазмохимические частицы нанокремния в исследованной концентрации не обладают токсичностью in vitro на клеточные линии К562 независимо от времени воздействия (см. фиг. 2).
В экспериментах in vivo клетки карциномы легкого Льюис (CLL) трансплантировали внутримышечно в левую заднюю лапу самцов мышей линии C57BL. После достижения опухолью объема 210±30 мм3 на 8 сутки после прививки проводилось введение суспензии кремниевых наночастиц в 0,9% растворе NaCl (концентрация 0,5 мг/мл) интратуморально или внутривенно в хвостовую вену по 0,5 мл.
В случае интратуморального введения наблюдали биологические эффекты терапевтической значимости, оцененные как по критерию увеличения продолжительности жизни, так и по критерию торможения роста опухоли. Средняя продолжительность жизни лабораторных животных в опытной группе была на 16±5% больше, чем в группе интактного контроля (мыши с привитой опухолью LLC не подвергавшиеся никаким воздействиям), а максимальная продолжительность жизни увеличилась почти на 30%, как это видно из данных, приведенных на фиг. 3, кривая 3. Для сравнения в этих экспериментах in vivo нами были испытаны кремниевые наночастицы, полученные механическим измельчением пленок мезопористого кремния, как описано в работе [11] (аналог). В контрольной партии лабораторных мышей последние полностью погибали к 34 дню развития опухолей - кривая 1. При введении наночастиц кремния аналога [11] полная гибель животных наступала на 35 сутки - кривая 2. При введении плазмохимических частиц нанокремния, используемых в предлагаемом способе, гибель животных наступала на 42 сутки развития опухоли - кривая 3 на фиг. 3.
Исследования кинетики роста опухоли (по изменению объема опухоли у контрольных и опытных животных) при интратуморальном введении плазмохимических наночастиц показали, что у мышей опытной группы первичный узел опухоли рос медленнее, чем в контрольной группе на протяжении всего периода наблюдения. Разница по проценту торможения роста опухолей доходила до 26±5% к 27 дню от начала развития опухолей. Полученные результаты указывают на заметное ингибирование роста опухоли и замедление процесса метастазирования после введения плазмохимических наночастиц кремния.
При внутривенном введении в организм здоровых лабораторных животных плазмохимических наночастиц кремния каких-либо непосредственных или отдаленных токсических эффектов не наблюдалось. Исследованная биологическая эффективность терапевтической значимости как по критерию увеличения продолжительности жизни, так и по критерию торможения роста опухоли была выражена слабее, чем в случае интратуморального введения.
Как видно из приведенных результатов, несмотря на отсутствие цитотоксичности плазмохимических наночастиц кремния в исследованиях in vitro, эти частицы эффективно подавляют рост опухоли LLC при введении in vivo.
Имплантация кусочков ткани, взятых из привитых опухолей LLC, здоровым мышам приводит к росту у них соответствующих опухолей.
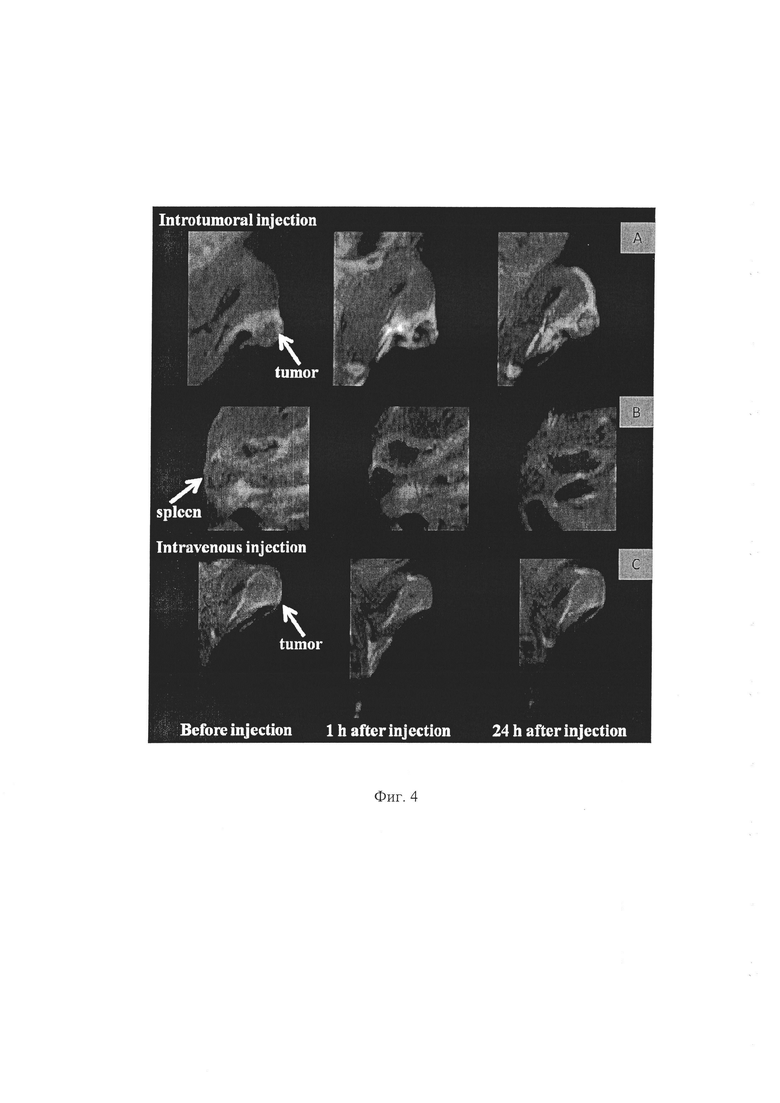
Были проведены эксперименты по наблюдению накопления плазмохимических кремниевых наночастиц в опухоли и торможения роста последней на модели малых лабораторных животных (мышей) методом магниторезонансной томографии (МРТ), которые проводились на МРТ биоспектротомографе BIOSPEC ВС 70/30 USR. (Bruker) с использованием импульсных последовательностей RARE (5500/16 [время повторения, мс/время эхо, мс]) и MSME (800/14 [время повторения, мс/время эхо, мс]) на частоте атомов водорода (H1). Визуальный анализ изображений на томограммах позволил определить структуры опухоли карциномы легких Льюис и внутренних органов (кости, легкие, почки, селезенка, мочевой пузырь и печень). Эксперименты проводили на 2-х группах мышей вида BDF1 при интратуморальном или внутривенном введении.
Пример 1: кремниевые наночастицы суспензировались в физиологическом растворе (0,9% растворе NaCl в воде) и интратуморально вводились в объеме 0,5 мл с концентрацией 0,5 мг/мл на каждое животное.
Пример 2: кремниевые наночастицы суспензировались в физиологическом растворе (0,9% растворе NaCl в воде) и внутривенно вводились в объеме 0,5 мл с концентрацией 0,5 мг/мл на каждое животное.
Установлено, что как при интратуморальном, так и при внутривенном введении плазмохимических кремниевых наночастиц уже через 1 час наблюдается потемнение центральной части опухоли, обусловленное контрастными свойствами наночастиц, вызывающих укорочение поперечных времен релаксации протонов [15], что делает видимыми структуры опухолевой ткани и позволяет осуществлять надежную диагностику опухоли. Через 24 часа после введения наночастиц потемнение области опухоли заметно уменьшалось, фиксировались признаки уменьшения скорости роста опухоли, и наблюдалось появление светлого ореола вокруг опухоли, что можно связать с проявлениями диффузии наночастиц кремния из области опухоли, которые стимулировали накопление лимфоцитов и межклеточной воды.
На фиг. 4А в качестве примера приведены МРТ Т2-взвешенные изображения опухоли опытной мыши последовательно: до интратуморального введения суспензии плазмохимических наночастиц кремния, через 1 час после введения наночастиц и через 24 часа после введения; на фиг. 4В - МРТ Т2-взвешенные изображения селезенки этой мыши; 4С - МРТ Т2-взвешенные изображения опухоли опытной мыши до внутривенного введения, через 1 час после введения и через 24 часа после введения суспензии наночастиц кремния.
Таким образом, предлагаемый способ одновременной диагностики и терапии (тераностики) онкологических заболеваний обеспечивает высокую надежность диагностики и позволяет эффективно подавлять рост опухоли. Благодаря использованию безвредных для живых организмов биосовместимых и биодеградируемых плазмохимических кремниевых наночастиц и возможности применения метода МРТ способ безопасен.
Очевидная дешевизна наночастиц кремния, синтезированных плазмохимическим методом, возможность их получения в массовых количествах, контрастное проявление в МРТ диагностике и уникальные терапевтические свойства открывают возможность широкого применения их в лабораторных и медицинских целях.
Источники информации
1. Долгушин Б.И. Методы лучевой диагностики в онкологии. Энциклопедия клинической онкологии. Главный ред. Давыдов М.И. Москва, РЛС-2004, с. 30-33.
2. Ширяев С.В. Ядерная медицина в онкологии. Энциклопедия клинической онкологии. Главный ред. Давыдов М.И. Москва, РЛС-2004, с. 117-125.
3. Брусенцов Н.А. и др. Способ диагностики онкологических заболеваний в эксперименте. RU 2343828, А61В 15/055, А61K 49/06, опубл. 21.01.2009.
4. N. Shahabadi et all. Improving antiproliferative effect of the anticancer drug cytarabine on human promyelocytic leukemia cells by coating on Fe3O4-SiO2 nanoparticles // Colloids and Surfaces, B. 2016. V. 141. P. 213-222.
5. E. Radziun et all. Assessment of the cytotoxicity of aluminium oxide nanoparticles on selected mammalian cells // Toxicology In Vitro, 2011. V. 25. P. 1694-1700.
6. S. Singh et all. Endocytosis, oxidative stress and IL-8 expression in human lung epithelial cells upon treatment with fine and ultrafme ТiO2: role of the specific surface area and of surface methylation of the particles // Toxicology and Applied Pharmacology. 2007. V. 222. 141-151.
7. Дурнев А.Д., Соломина A.C. и др. Исследование генотоксичности и репродуктивной токсичности нанокристаллов кремния // Бюл. экспер. биол. 2010, Т. 149, №4, С. 429-433.
8. Low S.P., Voelcker N.H. // Handbook of Porous Silicon / Ed. L. Canham. Cham, 2014, P. 381-393.
9. Бэкман Джеймс и др. Косметическое средство для защиты от ультрафиолетового излучения. RU 2227015, А61K 7/40, А61K 7/42, опубл. 20.04.2004.
10. Beckman J., Ischenko А.А. Ultra-violet radiation absorbing silicon particle nanoclusters. US 8,394,412 B1. Date of Patent: Mar. 12, 2013.
11. Осминкина Л.А. и др. Кремниевые наночастицы как усилители ультразвукового воздействия для сонодинамической терапии // Бюллетень экспериментальной биологии и медицины. 2016. Т. 161. №2. С. 261-265.
12. Ищенко А.А., Фетисов Г.В., Асланов Л.А. Нанокремний: свойства, получение, применение, методы исследования и контроля. М.: ФИЗМАТЛИТ, 2013, 648 с.
13. Berridge M.V., Herst P.M., and Tan A.S. Tetrazolium dyes as tools in cell biology: new insights into their cellular reduction. Biotechnology Annual Review, 11: p. 127-152 (2005).
14. Mosmann, Tim (December 1983). «Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays». Journal of Immunological Methods. 65 (1-2): 55-63
15. Gongalsky M.B., Kargina Yu.V. и др. "Porous silicon nanoparticles as biocompatible contrast agents for magnetic resonance imaging", Applied Physics Letters, v. 107, 233702(2015).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ УСИЛЕНИЯ ДЕЙСТВИЯ УЛЬТРАЗВУКА ПРИ ЛЕЧЕНИИ ГИПЕРТЕРМИЕЙ ОПУХОЛЕВЫХ ТКАНЕЙ ПУТЕМ ИСПОЛЬЗОВАНИЯ НАНОКЛАСТЕРОВ КРЕМНИЯ | 2010 |
|
RU2447915C1 |
| СПОСОБ ИЗУЧЕНИЯ ДИНАМИКИ BLV-ИНФЕКЦИИ IN VIVO | 2022 |
|
RU2819755C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФЛУОРЕСЦЕНТНЫХ МЕТОК НА ОСНОВЕ БИОДЕГРАДИРУЕМЫХ НАНОЧАСТИЦ КРЕМНИЯ ДЛЯ IN VIVO ПРИМЕНЕНИЯ | 2012 |
|
RU2491227C1 |
| СПОСОБ ТЕРАПИИ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2597414C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОКОНТЕЙНЕРОВ ДЛЯ ХИМИОТЕРАПЕВТИЧЕСКИХ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ | 2018 |
|
RU2722745C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНОЙ СУСПЕНЗИИ БИОСОВМЕСТИМЫХ ПОРИСТЫХ КРЕМНИЕВЫХ НАНОЧАСТИЦ | 2012 |
|
RU2504403C1 |
| Способ лечения онкологических заболеваний с помощью инъекций лекарственного препарата | 2018 |
|
RU2706427C1 |
| СПОСОБ ПОВЫШЕНИЯ БЕССОБЫТИЙНОЙ ПРОДОЛЖИТЕЛЬНОСТИ ЖИЗНИ ОПУХОЛЕНОСИТЕЛЕЙ В ЭКСПЕРИМЕНТЕ | 2009 |
|
RU2417942C1 |
| СПОСОБ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В ЭКСПЕРИМЕНТЕ | 2007 |
|
RU2343828C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОКРИСТАЛЛИЧЕСКОГО КРЕМНИЯ, ОБЛАДАЮЩЕГО ЯРКОЙ УСТОЙЧИВОЙ ФОТОЛЮМИНЕСЦЕНЦИЕЙ | 2009 |
|
RU2411613C1 |

Изобретение относится к экспериментальной медицине и может быть использовано при одновременной диагностике и терапии онкологических заболеваний. Для этого в организм животного осуществляют трансплантацию клеток опухоли, после чего интратуморально или внутривенно вводят суспензию кремниевых наночастиц размера 25±5 нм, состоящих из ядра кристаллического кремния, покрытого аморфной оболочкой из диоксида кремния, полученных плазмохимическим методом и имеющих до 1019 Pb-центров. Концентрация наночастиц кремния в суспензии 0,3-0,5 мг/мл. При этом для приготовления суспензии наночастиц кремния используют дистиллированную воду или физиологический раствор. Затем проводят магнитно-резонансную томографию тела животного на частоте атомов водорода в режиме измерения Т2 взвешенной последовательности импульсов. На основании результатов визуального анализа полученных изображений диагностируют наличие опухоли и затем наблюдают ингибирование роста опухоли. Способ обеспечивает высокую надежность диагностики и позволяет эффективно подавлять рост опухоли посредством использования наночастиц кремния, которые не являются цитотоксичными. 1 з.п. ф-лы, 4 ил., 2 пр.
1. Способ одновременной диагностики и терапии онкологических заболеваний в эксперименте, заключающийся в том, что в организм животного осуществляют трансплантацию клеток опухоли, после чего интратуморально или внутривенно вводят суспензию кремниевых наночастиц размера 25±5 нм, состоящих из ядра кристаллического кремния, покрытого аморфной оболочкой из диоксида кремния, полученных плазмохимическим методом и имеющих до 1019 Pb-центров, при концентрации наночастиц кремния в суспензии 0,3-0,5 мг/мл, с последующим проведением магнитно-резонансной томографии тела животного на частоте атомов водорода в режиме измерения Т2 взвешенной последовательности импульсов, и на основании результатов визуального анализа полученных изображений диагностируют наличие опухоли и затем наблюдают ингибирование роста опухоли.
2. Способ по п. 1, отличающийся тем, что для приготовления суспензии наночастиц кремния используют дистиллированную воду или физиологический раствор.
| СПОСОБ УСИЛЕНИЯ ДЕЙСТВИЯ УЛЬТРАЗВУКА ПРИ ЛЕЧЕНИИ ГИПЕРТЕРМИЕЙ ОПУХОЛЕВЫХ ТКАНЕЙ ПУТЕМ ИСПОЛЬЗОВАНИЯ НАНОКЛАСТЕРОВ КРЕМНИЯ | 2010 |
|
RU2447915C1 |
| СПОСОБ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В ЭКСПЕРИМЕНТЕ | 2007 |
|
RU2343828C2 |
| WO 2009013630 A2, 29.01.2009 | |||
| КОТКОВСКИЙ Г.Е | |||
| и др | |||
| Фотофизические свойства пористого кремния и его применение в технике и биомедицине | |||
| Ядерная физика и инжиниринг | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| ОСМИНКИНА Л.А | |||
| и др | |||
| Кремниевые наночастицы как усилители ультразвукового воздействия для сонодинамической терапии | |||
| Бюллетень экспериментальной биологии и медицины | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| JORDAN A | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Hyperthermia, 1997, Nov-Dec, 6, p.587-605. | |||
Авторы
Даты
2019-09-24—Публикация
2018-04-26—Подача