Изобретение относится к области медицины, экспериментальной онкологии, и может быть использовано для анализа динамики BLV-инфекции в организме лабораторных крыс, в том числе при изучении вопросов предотвращения и ингибирования злокачественных процессов.
Вирусы могут являться провоцирующим фактором в возникновении неоплазии как у людей, так и у животных. Роль вирусов при онкогенезе обычно заключается в инициировании клеточной трансформации через повреждение клеточной ДНК. Особый научный и практический интерес с точки зрения медицины представляют онкогенные вирусы, обладающие свойством полигостальности. К таковым относят вирус энзоотического лейкоза крупного рогатого скота (BLV).
BLV способен преодолевать межвидовой барьер и, как было показано, инфицирует различные виды диких животных [1]. По данным М.И. Гулюкина и соавт. (2015) экспериментально BLV-инфекцию удается воспроизвести на нескольких видах, как домашних, так и лабораторных животных [2]. Склонность вируса к полигостальности способствует увеличению резервуара BLV и, в конечном итоге, вероятности заражения человека. В последние годы было проведено много исследований по индикации BLV в тканях молочной железы у женщин по всему миру [3]. При этом BLV детектировался в молочной железе, что свидетельствует о его способности инфицировать человека, избирая эту ткань мишенью для инфекции [4]. Показано, что выявление вируса лейкоза крупного рогатого скота у здоровых и онкологически неблагополучных женщин коррелирует с инфицированностью стад BLV [5], а связь между раком груди и присутствием в ее ткани вируса была подтверждена как фактор риска [6].
В своих предварительных исследованиях мы показали высокую восприимчивость белых лабораторных крыс линии Wistar к заражению BLV с последующим развитием у них характерных для лейкозного процесса изменений [7, 8].
Маркерами динамики инфекционного процесса при вирусном лейкозе являются такие факторы, как динамика антителообразования и динамика провирусной нагрузки в организме экспериментальных животных. А онкогенный потенциал вируса оценивается по его способности провоцировать образование в организме атипичных склонных к злокачественной пролиферации клеток. Принимая во внимание выше сказанное, возникает необходимость создания научно обоснованной модели для исследования динамики BLV-инфекции in vivo с целью изучения вопросов предотвращения и ингибирования злокачественных процессов.
Известен способ одновременной диагностики и терапии онкологических заболеваний в эксперименте, при котором в организм животного осуществляют трансплантацию клеток опухоли, после чего интратуморально или внутривенно вводят суспензию кремниевых наночастиц размера 25±5 нм, состоящих из ядра кристаллического кремния, покрытого аморфной оболочкой из диоксида кремния, полученных плазмохимическим методом и имеющих до 1019 Pb-центров. Концентрация наночастиц кремния в суспензии 0,3-0,5 мг/мл. При этом для приготовления суспензии наночастиц кремния используют дистиллированную воду или физиологический раствор. Затем проводят магнитно-резонансную томографию тела животного на частоте атомов водорода в режиме измерения Т2 взвешенной последовательности импульсов. На основании результатов визуального анализа полученных изображений диагностируют наличие опухоли и затем наблюдают ингибирование роста опухоли (заявка №2018115651, опубликовано 24.09.2019 г., бюл. №27).
Данный способ не может быть использован для изучения динамики BLV-инфекции, так как в большинстве случаев вирус провоцирут возникновение не локального, а диссеминированного злокачественного процесса.
Известен способ диагностики злокачественной опухоли проводимый путем исследования скорости оседания эритроцитов под действием двух агентов: антииднотинической антиэмбриональной сыворотки и контрольной сыворотки отличающийся тем, что в качестве первого агента используют крысиную сыворотку, а второго - сыворотку крыс, которым предварительно вводят лимфоциты интактных сингенных животных, находят минимальный и максимальный градиент СОЭ, по полученным значениям определяют коэффициент злокачественности роста и при его значении от 1,55 до 7,00 определяют злокачественную опухоль (Заявка №95120436/14 от 15.12.1995).
Данный способ не может быть использован для оценки онкогенного потенциала BLV, так как показатель СОЭ не является специфическим при изучении динамики инфекции BLV.
Известен способ создания экспериментальных опухолей при котором водят крысе в ретрогастральную клетчатку 0,15 миллиметра взвеси штамма крысиной саркомы 45 на глубину 2-3 миллиметра, вводят крысе в паранефральную клетчатку по 0,2 миллиметра взвеси штамма крысиной саркомы 45 на глубину 3-4 миллиметра с обеих сторон, позволяющий создать опухоль в эксперименте для разработки и оценки противоопухолевой эффективности методов химиотерапии (патент №2257619 от 27.07.2005 Бюл. №21).
Данный способ не может быть использовать для изучения BLV-инфекции, так как вирус является лимфотропным и требует введения непосредственно в кровяное русло для достижения максимального эффекта при провоцируемой им неоплазии.
Наиболее близким к заявляемому изобретению является способ использования биогенеза микрорнк в экзосомах для диагностики и лечения, заключающийся в выявлении ракового биомаркера у субъекта in vitro, включающий получение от субъекта биологического образца, измерение уровня: RISC-белка во фракции экзосом образца, предшественника микроРНК, одной или нескольких микроРНК, первичной микроРНК или активности процессинга предшественника микроРНК во фракции экзосом образца и идентификацию того, обладает субъект или не обладает раковым биомаркером. При этом измерение уровней RISC-белка включает проведение вестерн-блоттинга, ИФА или анализа связывания на матрице с множеством антител, измерение уровней микроРНК включает проведение ОТ- ПЦР/ПЦР-РВ, нозерн-блоттинга или гибридизацию на матрице, а визуализация представляет собой рентгеновскую, КТ-, МРТ- или ПЭТ-визуализацию. Для лечения используется композиция, содержащая рекомбинантную или синтетическую ингибирующую РНК в ассоциации с комплексом RISC-белка, причем указанный комплекс заключен в липосому, наночастицу или микрокапсулу (патент №2015144212 от 21.04.2017, бюл. №12).
Недостатками данного способа являются:
- необходимость освобождения образцов от клеток;
- необходимость дополнительной очистки образца;
- необходимость визуализации результатов с помощью КТ-, МРТ- или ПЭТ-визуализации;
- необходимость предоставления информации в виде подготовки письменного или электронного отчета;
- необходимость использования материального машиночитаемого носителя, дополнительно содержащего машиночитаемый код, который при выполнении компьютером, обуславливает выполнение компьютером одной или нескольких дополнительных операций;
- необходимость применения ингибирующей РНК, которая представляет собой микроРНК человека, при этом ингибирующая РНК и комплекс RISC-белка заключены в липосому, наночастицу или микрокапсулу, содержащие липидный бислой.
Технической задачей является создание быстрого, технически легко исполнимого и высоко достоверного способа изучения динамики BLV-инфекции на лабораторной модели in vivo с целью последующего изучения вопросов предотвращения и ингибирования злокачественных процессов.
Технический результат предлагаемого изобретения заключается в разработке способа изучения динамики антителообразования и динамики провирусной нагрузки в организме BLV-инфицированных лабораторных крыс.
Техническая задача решается, а технический результат достигается тем, что на лабораторных крысах линии Wistar воспроизводят BLV-инфекцию по способу, описанному в патенте № RU №2019110652 от 10.04.2019, после чего кровь экспериментальных животных через каждые три месяца исследуют методом Real-Time PCR (ПЦР) на динамику провирусной нагрузки и методом ELISA (ИФА) на динамику антителообразования в течение года, при этом оценка динамики BLV-инфекции осуществляется по динамике провирусной нагрузки и антителообразования в крови крыс.
Предлагаемый способ изучения динамики BLV-инфекции in vivo обеспечивает возможность с высокой достоверностью отслеживать интенсивность иммунного ответа инфицированного организма на фоне провирусной экспансии и отличается тем, что:
- не требует освобождения образцов от клеток, так как для ПЦР используется цельная стабилизированная кровь, а для ИФА - сыворотка крови, образующаяся самопроизвольно после ретракции кровяного сгустка;
- нет необходимости дополнительной очистки образца, так как ПЦР и ИФА являются высоко специфичными методами исследования образцов;
- не требуется визуализации результатов с помощью КТ-, МРТ- или ПЭТ-визуализации;
- нет необходимости предоставления информации в виде подготовки письменного или электронного отчета;
- не требуется использование материального машиночитаемого носителя, дополнительно содержащего машиночитаемый код, который при выполнении компьютером, обуславливает выполнение компьютером одной или нескольких дополнительных операций;
- нет необходимости применения ингибирующей РНК, которая представляет собой микроРНК человека, при этом ингибирующая РНК и комплекс RISC-белка заключены в липосому, наночастицу или микрокапсулу, содержащие липидный бислой.
Пример. Изучение динамики BLV-инфекции у экспериментальных крыс.
Исследования проводились в 2020/21 гг. Были сформированы контрольная и экспериментальная группы животных по принципу аналогов. Крыс содержали в стандартных клетках группами по 3 самки на 1 самца, на полноценном рационе. В экспериментальной группе (n=12) воспроизводили BLV-инфекцию с последующим подтверждением. В контрольной группе животных вместо инфицирующего материала использовали стерильный физиологический раствор. Кровь у экспериментальных крыс отбирали из латеральной хвостовой вены через каждые 3 месяца в течение 1 года. Динамику провирусной нагрузки у крыс исследовали методом Real-Time PCR с использованием тест-системы «ЛЕЙКОЗ» (ИЛС, Россия) для выявления провируса BLV на амплификаторе CFX 96 (BioRad, США). Динамику антителообразования в сыворотке крови крыс изучали с помощью набора для выявления антител к BLV (ООО «Ветбтохим», Россия) методом ИФА на автоматическом биохимическом и ИФА анализаторе Chem Well 2910 (Awareness Technology, США).
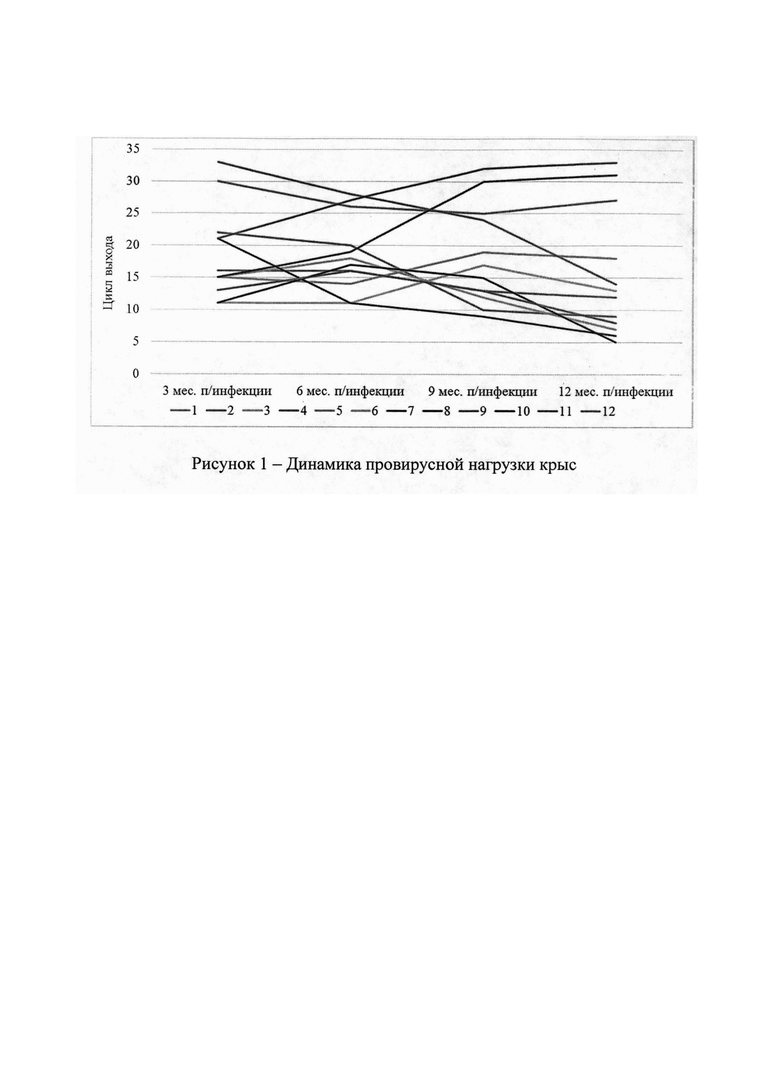
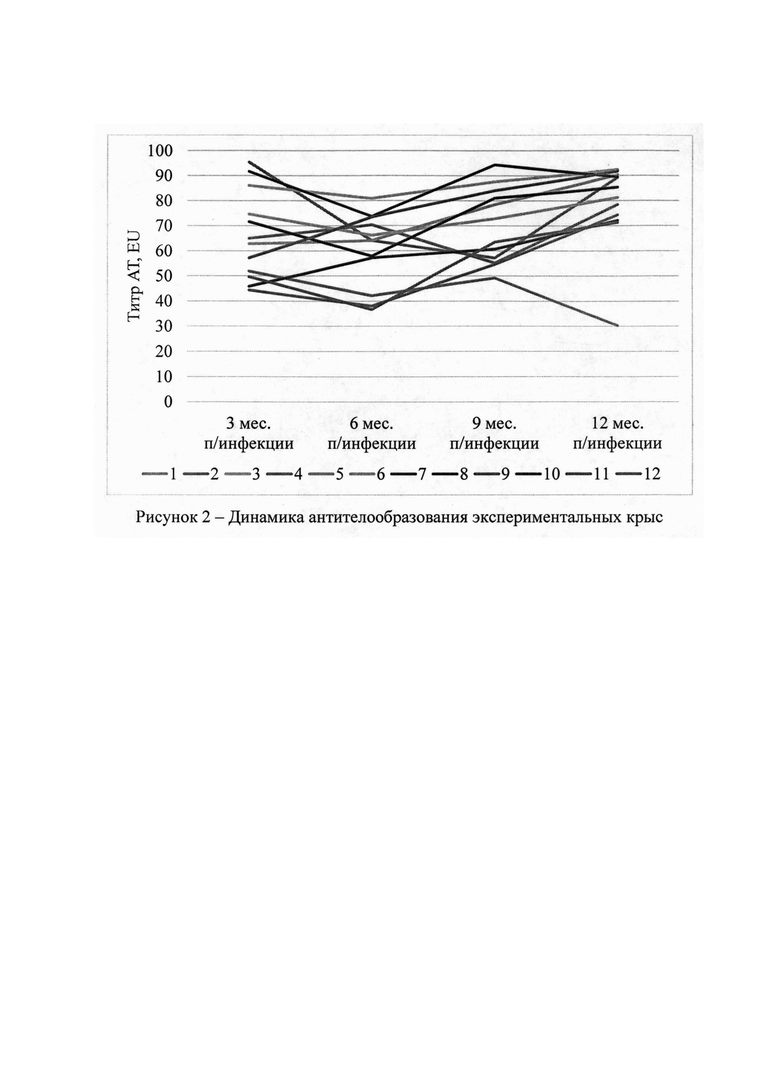
Полученные результаты в числовых значениях представлены в таблицах 1 и 2, динамика показателей проиллюстрирована на рисунках 1 и 2.

Как следует из данных, представленных в таблице 2 и проиллюстрировано на рисунке 1, через 3 месяца после инфицирования по оригинальной авторской методике все крысы, в той или иной степени, были носителями провируса BLV. Крысы №7 и 11 показали отрицательную динамику провирусной нагрузки, однако на окончание эксперимента полной элиминации возбудителя у них не было отмечено. У крысы №1 провирусная нагрузка была не высокой и в динамике эксперимента не имела выраженной положительной тенденции. Остальные 9 экспериментальных животных проявили выраженную положительную тенденцию провирусной нагрузке в динамике эксперимента, сто свидетельствует о развитии у них продуктивной BLV-инфекции.

Как следует из данных, представленных в таблице 1 и проиллюстрированных на рисунке 2, титр AT в сыворотке крови экспериментальных крыс варьировал в значительных пределах. При этом у большинства животных была отмечена волнообразная тенденция: на 6 месяц после заражения титр AT несколько снижался, затем отмечалась положительная динамика антителообразования. Отрицательная динамика антителообразования была отмечена только у крысы №1, что, вероятно, обусловлено невысокой провирусной нагрузкой у данной особи в течение эксперимента.
Таким образом, заявленное изобретение является доступным в исполнении, отличающимся высокой информативностью и эффективностью способом изучения динамики BLV-инфекции на лабораторных животных, что позволяет рекомендовать разрабатываемый способ для изучения вопросов предотвращения и ингибирования злокачественных процессов.
Предложенный способ апробирован с положительными результатами и стабильной воспроизводимостью этих результатов в 2020/21 гг. на крысах линии Wistar.
Список литературы:
1. Sciencedirect [(accessed on 9 October 2019)]; Available online: com/topics/agricultural-and-biological-sciences/bovine-leukemia-virus.].
2. Межвидовая передача вируса лейкоза крупного рогатого скота в эксперименте / М.И. Гулюкин [и др.] // Вопросы вирусологии. - 2015. - Vol. 60(5) - С. 32-37.
3. Exposure to Bovine Leukemia Virus Is Associated with Breast Cancer: A Case-Control Study / GC Buehring [et al.] // PLoS One. - 2015. - Vol. 10(9). - P. e0134304.
4. Buehring G.C., Sans H.M. Breast Cancer Gone Viral? Review of Possible Role of Bovine Leukemia Virus in Breast Cancer, and Related Opportunities for Cancer Prevention // Int J Environ Res Public Health. - 2020. - Vol. 17(1) - P. 209.
5. High positivity values for bovine leukemia virus in human breast cancer cases from Minas Gerais, Brazil / E. Delarmelina [et al.] // PLoS One. - 2020. - Vol. 15(10). - P. e0239745.
6. Risk factor for breast cancer development under exposure to bovine leukemia virus in Colombian women: A case-control study / N.N. Olaya-Galan [et al.] // PLoS One. - 2021. Vol. 16(9). - P. e0257492.
7. Красников A.B., Красникова E.C., Рыхлов A.C. Цитоморфологическая характеристика клеточных элементов селезенки лабораторных крыс при экспериментальной BLV-инфекции // Вестник Алтайского государственного аграрного университета. - 2021. - №2 (196). - С. 84-91.
8. The hematobiochemical status of Wistar rat line under the bovine leukemia virus experimental infection / E.S. Krasnikova [et al.] // Veterinary World. - 2019. - Vol. 12., №3. - P. 382-388.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ BLV-ИНФЕКЦИИ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 2020 |
|
RU2740470C1 |
| Способ диагностики лейкоза крупного рогатого скота методом полимеразной цепной реакции | 2018 |
|
RU2694617C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ВИРУСА ЛЕЙКОЗА КРС ПО НУКЛЕОТИДНЫМ ПОСЛЕДОВАТЕЛЬНОСТЯМ КОНСЕРВАТИВНЫХ ОБЛАСТЕЙ ВИРУСНОГО ГЕНОМА | 2012 |
|
RU2521330C2 |
| Способ моделирования лейкозной инфекции у животных | 2022 |
|
RU2802150C1 |
| ДИАГНОСТИЧЕСКАЯ СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ ДНК ПРОВИРУСОВ ЛЕЙКОЗА И ИММУНОДЕФИЦИТА КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2015 |
|
RU2615465C2 |
| Способ геноидентификации Bovine leukemia virus | 2020 |
|
RU2770412C1 |
| СПОСОБ ПОДГОТОВКИ БИОМАТЕРИАЛА ДЛЯ ПЦР ДИАГНОСТИКИ ВИРУСА ЛЕЙКОЗА КРУПНОГО РОГАТОГО СКОТА (ВЛ КРС) | 2013 |
|
RU2566071C2 |
| Способ диагностики вируса лейкоза крупного рогатого скота | 2018 |
|
RU2694966C1 |
| Способ постановки реакции иммунофлюоресценции для диагностики лейкоза крупного рогатого скота | 2023 |
|
RU2810589C1 |
| Способ диагностики лейкоза крупного рогатого скота с использованием ПЦР в режиме реального времени | 2018 |
|
RU2722137C1 |
Изобретение относится к области биотехнологии и может быть использовано для анализа динамики BLV-инфекции в организме лабораторных крыс, в том числе при изучении вопросов предотвращения и ингибирования злокачественных процессов. Изобретение представляет собой способ изучения динамики BLV-инфекции in vivo, включающий воспроизведение BLV-инфекции у лабораторных крыс по способу, описанному в патенте RU №2019110652 от 10.04.2019, с последующим исследованием крови экспериментальных животных через каждые три месяца методом Real-Time PCR (ПЦР) на динамику провирусной нагрузки и методом ELISA (ИФА) на динамику антителообразования четырехкратно в течение года, при этом положительная динамика провирусной нагрузки и/или антителообразования свидетельствует о развитии у животных продуктивной BLV-инфекции, а отрицательная динамика провирусной нагрузки и антителообразования расценивается как ингибирование провоцируемого BLV злокачественного процесса. Предлагаемый способ изучения динамики BLV-иифекцки in vivo обеспечивает возможность с высокой достоверностью отслеживать интенсивность иммунного ответа инфицированного организма на фоне провирусной экспансии и является доступным в исполнении, отличающимся высокой информативностью и эффективностью способом изучения динамики BL F-инфекции на лабораторных крысах, что позволяет рекомендовать разрабатываемый способ для изучения вопросов предотвращения и ингибирования злокачественных процессов. 2 ил., 2 табл.
Способ изучения динамики BLV-инфекции in vivo, включающий воспроизведение BLV-инфекции у лабораторных крыс с последующим исследованием крови экспериментальных животных, исследуют через каждые три месяца методом Real-Time PCR (ПЦР) на динамику провирусной нагрузки и методом ELISA (ИФА) на динамику антителообразования четырехкратно в течение года, при этом положительная динамика провирусной нагрузки и/или антителообразования свидетельствует о развитии у животных продуктивной BLV-инфекции, а отрицательная динамика провирусной нагрузки и антителообразования расценивается как ингибирование провоцируемого BLV злокачественного процесса.
| БЕЛЯКОВА А.С | |||
| Иммуноморфологический статус лабораторных крыс при экспериментальной blv-инфекции, автореферат диссертации, Саратов 2020, 21 с. | |||
| КРАСНИКОВА Е.С | |||
| и др.,Изучение динамики массы тела и внутренних органов лабораторных крыс при экспериментальной инфекциивирусом лейкоза крупного рогатого скота, Ветеринария сегодня, июнь N 2 (37) 2021, с |
Авторы
Даты
2024-05-23—Публикация
2022-10-18—Подача