Предложенный способ относится к области биотехнологии, молекулярной биологии и генетике, и может быть использован для определения генотипа человека по мутации с.496A>G (p.M166V, rs2297595) в 6 экзоне гена DPYD (ENST00000370192.7, RefSeq NM_000110) с отнесением исследуемого образца к гомозиготе по «дикому типу», гомозиготе или гетерозиготе по диагностируемому аллельному варианту.
Фармакогенетическое тестирование с целью прогноза развития токсических и побочных эффектов при проведении лекарственного лечения является одним из активно развивающихся направлений в ДНК-тестировании и постепенно занимает свое место во многих клинических рекомендациях по лечению злокачественных новообразований. Разработка и внедрение способа тестирования полиморфных вариантов в гене DPYD, одобренного FDA (Food and Drug Administration) и включенного в рекомендации ESMO (European Society of Clinical Oncology) для прогнозирования токсичности химиотерапии при лечении ряда злокачественных новообразований, является одним из приоритетных направлений в фармакогенетическом тестировании.
Ген DPYD кодирует фермент дигидропиримидиндегидрогеназу, функциональная недостаточность которой, приводит к развитию 5-фторурацил-ассоциированной токсичности (OMIM 274270) при назначении 5-фторурацила и капецитабина («Кселода»). ДНК-диагностика, основанная на определении генотипа человека по мутациям и полиморфизмам в гене DPYD, необходима для прогнозирования развития осложнений, ассоциированных с приемом данных лекарственных препаратов, коррекции дозы и схемы проводимого лечения.
Широко распространен способ определения полиморфных вариантов и мутаций в гене DPYD с помощью секвенирования по Сэнгеру всей кодирующей последовательности гена DPYD (Kuilenburg, A. Analysis of severely affected patients with dihydropyrimidine dehydrogenase defeciency reveals large intragenic rearrangements of DPYD and a de novo interstitial deletion del(1)(p13.3p21.3) / Kuilenburg A., Meijer J., Mul A. et al. // Hum.Genet. - 2009. - V.125. - P. 589-590).
Недостатки: трудоемкость, высокая стоимость проведения исследования.
Известен способ генотипирования полиморфных вариантов в гене DPYD, основанный на применении метода ПЦР c детекцией результатов в режиме реального времени (Real-time PCR) (Deenen, M. Relationship between Single Nucleotide Polymorphisms and Haplotypes in DPYD and Toxicity and Efficacy of Capecitabine in Advanced Colorectal Cancer / Deenen, M., Tol J., Burylo A. et al. // Clin. Cancer Res. - V. 17. - P. 3455-3468).
Недостатки: высокая стоимость проведения исследования.
Известен способ определения полиморфных вариантов в гене DPYD, основанный на гибридизации на чипах с применением аллель-специфичных зондов (т.н. SNP-array) (Rosmarin, D. Genetic Markers of Toxicity From Capecitabine and Other Fluorouracil-Based Regimens: Investigation in the QUASAR2 Study, Systematic Review and Meta-Analysis / Dan R., Palles C., Church D. et al. // Journal of clinical oncology. - 2014. - V. 32).
Недостатки: трудоемкость, высокая стоимость проведения исследования, потребность совместимого оборудования.
Известен способ ДНК-тестирования мутаций в гене DPYD с помощью ПЦР с последующим анализом длины рестрикционных фрагментов, т.н. ПДРФ-анализ (Restriction Fragment Length Polymorphism - RFLP analysis) (Uzunkoy, A. Investigation of IVS14+1G>A polymorphism of DPYD gene in a group of Turkish patients with colorectal cancer / Uzunkoy, A., Dilmec F., Ozgonul A. et al. // Anticancer Res. - 2007. - V. 27. - P. 3899-3902).
Недостатки: трудоемкость, времязатратность.
Одним из способов диагностики мутаций в гене DPYD является высокоэффективная жидкостная хроматография (Ezzeldin, H. Denaturing high performance liquid chromatography analysis of the DPYD gene in patients with lethal 5-fluorouracil toxicity / Ezzeldin, H., Johnson MR, Okamoto, Y. et al. // Clin. Cancer Res. - 2003. - V. 1. - P. 3021-3028).
Недостатки: трудоемкость, высокая стоимость проведения исследования, потребность совместимого оборудования.
Задачей заявляемого изобретения является разработка оптимального способа определения генотипа человека по мутации с.496A>G в 6 экзоне гена DPYD, ответственного за развитие токсических побочных эффектов при назначении 5-фторурацила и его аналогов.
Задача решается путем подбора специфичных оригинальных последовательностей олигонуклеотидов, образующих короткий фрагмент ДНК, который включает фрагмент гена DPYD с искомым вариантом, и оптимизации ПЦР с помощью адаптированного оригинального буфера для Taq-полимеразы. Высокая специфичность заявляемого способа диагностики мутации с.496A>G достигается за счет оригинального дизайна олигонуклеотидов, позволяющих получить короткий целевой фрагмент гена.
Техническим результатом заявляемого изобретения является широкая доступность, высокая чувствительность и специфичность при низкой стоимости исследования. Реакционные смеси включают специфичные оригинальные последовательности олигонуклеотидов, а также адаптированный буфер для Taq-полимеразы, позволяющий повысить чувствительность метода. Изобретение позволяет снизить затраты на молекулярно-генетическое исследование, повысить его доступность и точность тестирования за счет применения специфичных оригинальных олигонуклеотидных последовательностей и оптимизированных реакционных смесей.
Технический результат достигается путем подбора специфичных оригинальных последовательностей олигонуклеотидов, оптимизации условий проведения ПЦР с использованием оригинального состава буфера для Taq-полимеразы, отработки технических условий для проведения HRM-анализа.
Последовательность специфичных оригинальных олигонуклеотидов приведена в Перечне последовательностей олигонуклеотидов.
Копия перечня последовательностей олигонуклеотидов, представленная на машиночитаемом носителе, идентична перечню последовательностей в печатной форме.
Используются последовательности олигонуклеотидов:
SEQ ID NO 1; SEQ ID NO 2.
Подбор последовательностей олигонуклеотидов включает: дизайн олинуклеотидов, строго комплементарных целевой последовательности ДНК. Длина образуемого фрагмента ДНК составляет 106 пар нуклеотидов.
Состав буфера для Taq-полимеразы: Трис-HCl 67 mM, (NH4)2SO4 166 mM, tween-20 0,1%, глицерин 1%, рН 8,7;
- Режим проведения ПЦР:
1 этап: денатурация при t=95°С в течение 5 мин
2 этап: 50 циклов ПЦР
- денатурация при t=95°С в течение 15 сек
- отжиг олигонуклеотидов при t=58°С в течение 15 сек
- элонгация при t=72°С в течение 40 сек
3 этап: элонгация при t=72° в течение 2 мин.
4 этап: плавление продуктов ПЦР при t=72°-95°C
5 этап: охлаждение и хранение при t=95°-12°C.
Детекция флуоресцентного сигнала осуществляется как во время отжига олигонуклеотидов на каждом цикле ПЦР, так и при плавлении продуктов ПЦР с частотой 45 на 1°C.
Изобретение иллюстрируется фигурой, на которой представлено графическое изображение образцов ДНК с различными генотипами по мутации с.496A>G.
Изобретение иллюстрируется примерами 1, 2 и 3.
Пример 1.
Ф.И.О.: Пациент М.
Возраст: 1964 г.р.
Диагноз: Cr. сигмовидной кишки.
Выполнено молекулярно-генетическое исследование по заявляемому способу - анализ последовательности кодирующей части гена дигидропиримидиндегидрогеназы (DPYD) на предмет наличия герминальной мутации с.496A>G (p.M166V (rs2297595)), ассоциированной с повышенной токсичностью при назначении 5-фторурацила и капецитабина («Кселода») в процессе ПХТ.
Результат: При исследовании ДНК, выделенной из лимфоцитов периферической крови, герминальных мутаций в 6 экзоне гена DPYD не выявлено.
Пример 2.
Ф.И.О.: Пациент М.
Возраст: 1963 г.р.
Диагноз: Cr. толстой кишки.
Выполнено молекулярно-генетическое исследование по заявляемому способу - анализ последовательности кодирующей части гена дигидропиримидиндегидрогеназы (DPYD) на предмет наличия герминальной мутации с.496A>G (p.M166V (rs2297595)), ассоциированной с повышенной токсичностью при назначении 5-фторурацила и капецитабина («Кселода») в процессе ПХТ.
Результат: При исследовании ДНК, выделенной из лимфоцитов периферической крови, в 6 экзоне гена DPYD выявлена герминальная мутация с.496A>G (p.M166V (rs2297595)) в гетерозиготном состоянии.
Выявленная герминальная мутация с.496A>G в гене DPYD зарегистрирована в международных базах данных dbSNP и Ensembl.genome как высоко-патогенный клинически значимый вариант, ассоциированный с высоким риском развития токсичности при использовании 5-фторурацила и капецитабина («Кселода»).
Пример 3.
Ф.И.О.: Пациент Р.
Возраст: 1955 г.р.
Диагноз: Cr. толстой кишки.
Выполнено молекулярно-генетическое исследование по заявляемому способу - анализ последовательности кодирующей части гена дигидропиримидиндегидрогеназы (DPYD) на предмет наличия герминальной мутации с.496A>G (p.M166V (rs2297595)), ассоциированной с повышенной токсичностью при назначении 5-фторурацила и капецитабина («Кселода») в процессе ПХТ.
Результат: При исследовании ДНК, выделенной из лимфоцитов периферической крови, в 6 экзоне гена DPYD выявлена герминальная мутация с.496A>G (p.M166V (rs2297595)) в гомозиготном состоянии.
Выявленная герминальная мутация с.496A>G в гене DPYD зарегистрирована в международных базах данных dbSNP и Ensembl.genome как высоко-патогенный клинически значимый вариант, ассоциированный с высоким риском развития токсичности при использовании 5-фторурацила и капецитабина («Кселода»).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО МУТАЦИИ с.1236GA В 11 ЭКЗОНЕ ГЕНА DPYD | 2019 |
|
RU2709645C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО МУТАЦИИ IVS14+1GA B 14 ИНТРОНЕ ГЕНА DPYD | 2019 |
|
RU2709710C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ UGT1A1*6/*28 В ПРОМОТЕРНОЙ ОБЛАСТИ ГЕНА UGT1A1 | 2019 |
|
RU2703805C1 |
| НАБОР ПОСЛЕДОВАТЕЛЬНОСТЕЙ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ДИАГНОСТИКИ ГЕРМИНАЛЬНЫХ МУТАЦИЙ В ГЕНЕ RET, АССОЦИИРОВАННЫХ С НАСЛЕДСТВЕННОЙ ПРЕДРАСПОЛОЖЕННОСТЬЮ К РАКУ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2524433C1 |
| Способ определения мутаций в гене CALR методом анализа кривых плавления у больных хроническими миелопролиферативными заболеваниями | 2019 |
|
RU2722077C1 |
| Способ анализа терминальных мутаций в генах BRCA1, BRCA2, ATM и PALB2 с использованием мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2020 |
|
RU2729360C1 |
| Способ анализа соматических мутаций в генах GNAQ и GNA11 с использованием LNA-блокирующей мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2017 |
|
RU2674687C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ ОПУХОЛИ ЛЕГКОГО К ТЕРАПИИ ИНГИБИТОРАМИ ТИРОЗИНКИНАЗ | 2012 |
|
RU2499994C1 |
| Способ выявления химерного транскрипта DNAJB1-PRKACA в клинических образцах ткани пациентов с фиброламеллярной карциномой печени методом полимеразной цепной реакции в реальном времени | 2023 |
|
RU2807306C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ В ПОЗИЦИИ 2579 ГЕНА BRCA1 (rs4986850) | 2010 |
|
RU2445371C1 |

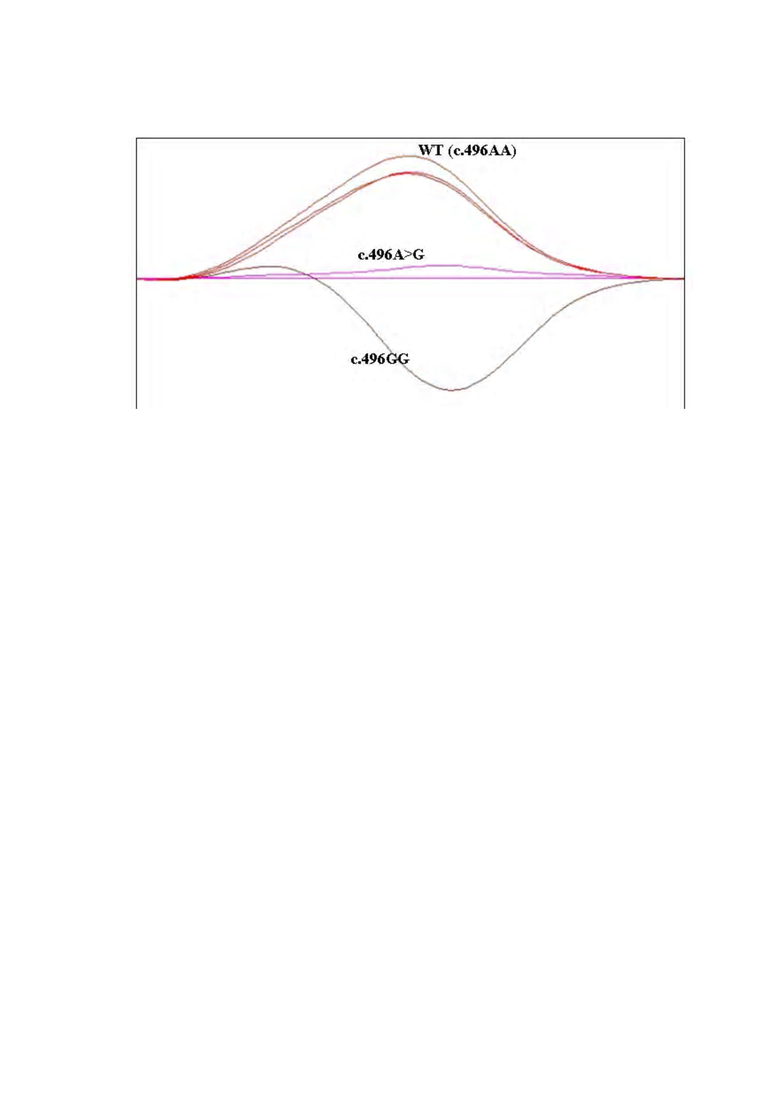
Изобретение относится к области биотехнологии, молекулярной биологии и генетики. Предложен способ определения генотипа человека по мутации с.496A>G в 6 экзоне гена DPYD, включающий проведение ПЦР в режиме реального времени с детекцией результатов с помощью метода анализа кривых плавления (HRM) и оптимизацией ПЦР с помощью применения адаптированного буфера для Taq-полимеразы состава Трис-HCl 67 mM, (NH4)2SO4 166 mM, tween-20 0,1%, глицерин 1%, рН 8,7. Изобретение обеспечивает высокую чувствительность и специфичность способа определения генотипа человека по мутации с.496A>G в 6 экзоне гена DPYD. 1 ил., 3 пр.
Способ определения генотипа человека по мутации с.496A>G в 6 экзоне гена DPYD, включающий проведение ПЦР в режиме реального времени с детекцией результатов с помощью метода анализа кривых плавления (HRM), отличающийся использованием специфичных оригинальных последовательностей олигонуклеотидов SEQ ID NO 1 и SEQ ID 2 и оптимизацией ПЦР с помощью применения адаптированного буфера для Taq-полимеразы состава: Трис-HCl 67 mM, (NH4)2SO4 166 mM, tween-20 0,1%, глицерин 1%, рН 8,7.
| WO 2010067208 A2, 17.06.2010 | |||
| US 2011311972 A1, 22.12.2011 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ МУТАЦИЙ ГЕНА MTRNR1 ПРИ ОСТРОЙ НЕЙРОСЕНСОРНОЙ ТУГОУХОСТИ, ВЫЗВАННОЙ ПРИМЕНЕНИЕМ АНТИБИОТИКОВ ИЗ ГРУППЫ АМИНОГЛИКОЗИДОВ | 2007 |
|
RU2335541C1 |
Авторы
Даты
2019-09-26—Публикация
2019-03-26—Подача