Изобретение относится к сельскохозяйственной микробиологии и биотехнологии, касается биологических средств для защиты растений от фитопатогенных микроорганизмов и стимуляции их роста, а также для улучшения биодеградации пожнивных остатков, и представляет собой штамм микроскопического гриба Trichoderma asperellum OPF-19.
В настоящее время при разработке биологических препаратов для растениеводства исследователи отдают предпочтение тем штаммам микроорганизмов, которые обладают выраженной комплексной биологической активностью. У многих видов микроорганизмов выявлены множественные пути для улучшения жизни растений, например продукция стимулирующих фитогормонов, оптимизация минерального питания за счет фиксации молекулярного азота или повышения доступности труднорастворимых соединений макро- и микроэлементов, индукция у растений системной устойчивости к неблагоприятным биотическим и абиотическим факторам окружающей среды, непосредственное подавление развития фитопатогенов и фитофагов, биодеградация токсичных соединений и т.д. Среди бактерий наибольшим биотехнологическим потенциалом в качестве основы биопрепаратов для растениеводства обладают представители родов Bacillus и Pseudomonas; среди грибов - представители рода Trichoderma. Среди преимуществ последних, которые в некоторых случаях могут сыграть решающую роль при выборе биопрепарата на основе того или иного микроорганизма, нужно отметить следующие: способность к образованию конидий, которые могут длительное время сохранять жизнеспособность при неблагоприятных условиях среды; высокая скорость роста; низкая инерционность, которая проявляется в быстрой активации спор и «взрывном» характере роста на богатых субстратах; невысокая требовательность к условиям окружающей среды; тяготение к кислым значениям pH и, соответственно, способность проявлять свою биологическую активность в кислых почвах; способность к гиперпаразитизму на фитопатогенных грибах, что вместе с продукцией антибиотических веществ позволяет эффективно защищать растения. Однако практический потенциал представителей этого рода раскрыт, на наш взгляд, недостаточно.
Известны штаммы Trichoderma viride Pers. ex. S. F. Gray под номерами F-3271Д (патент РФ №2013054, опубл. 30.05.1994), F-3269Д (патент РФ №2010528, опубл. 15.04.1994), F-3273Д (патент РФ №2013055, опубл. 30.05.1994), а также Trichoderma harzianum Rifai под номерами F-3270Д (патент РФ №2010527, опубл. 15.04.1994) и F-3272Д (патент РФ №2010526, опубл. 15.04.1994) для получения препаратов против возбудителей серой гнили винограда, в первую очередь для борьбы с Botrytis cinerea, а также некоторыми видами Penicillium spp., Aureobasidium pullulans. Указанные штаммы позволяют снизить потери от гниения во время хранения и повысить выход пригодного для хранения винограда, а также сократить количество химических обработок.
Известен штамм Trichoderma sp. МГ-97 (патент РФ №2171580, опубл. 10.08.2001), используемый для защиты сеянцев хвойных от фузариозов. Штамм проявляет выраженную антагонистическую активность в отношении Fusarium avenacem, F. sporotrichiella v. poae, F. moniliforme v. lactis, F. nivale, F. gibbosum.
Недостатком этих изобретений является недостаточная биологическая активность, проявляющаяся только в защите отдельных видов растений лишь от некоторых фитопатогенов. При этом их влияние на рост и урожайность растений остается неизвестным.
Известен способ защиты растений огурца и томата от фитопатогенов (патент РФ №2094991, опубл. 10.11.1997), предполагающий обработку пораженных растений пастообразным препаратом на основе штамма Trichoderma harzianum ВКМ F-2477Д с добавлением карбоксиметилцеллюлозы. Это обеспечивает полное оздоровление пораженных аскохитозом, белой и черной гнилями стеблей огурца и томата (при слабой степени поражения 0,1-1 балл) и повышение урожайности.
Известен штамм Trichoderma lignorum НИИ ККМ ГНЦ ВВ «Вектор» F5 (патент РФ №2121793, опубл. 20.11.1998), обладающий антагонистической активностью против фитопатогенных грибов Fusarium sp., Botrytis cinerea и бактерии Pseudomonas corrugata, снижающий заболеваемость огурцов и томатов фузариозом, серой гнилью и пустостебельностью, вызываемыми этими патогенами, и повышающий урожайность. При внесении жидкого препарата на основе штамма в почву происходит снижение фитопатогенного потенциала в прикорневой зоне растений.
К недостаткам этих штаммов следует отнести ограниченность сферы их применения закрытым грунтом и двумя культурами, а также узким кругом заболеваний, в борьбе с которыми штаммы оказались эффективными.
Известен штамм Trichoderma viride 23, обладающий фунгицидными свойствами (патент РФ №2186847, опубл. 10.08.2002). Штамм проявляет антагонистическую активность в отношении Botrytis cinerea, Fusarium lini, Fusarium solani, Fusarium oxysporum, Penicillium verrucosum, Pythium debaryanum, защищает растения от болезней в полевых условиях и способствует повышению урожайности. Недостатком штамма является узкий спектр подавляемых фитопатогенов. Кроме того, ничего не известно о влиянии штамма на рост растений.
Известен штамм гриба Gliocladium catenulatum Gilmann et Abbott D-553 (патент РФ №2307156, опубл. 27.09.2007) для получения биопрепарата против грибных возбудителей сосудистых болезней и корневых гнилей растений. Штамм антагонистичен по отношению к Fusarium solani, F. culmorum, Verticillium dahliae; хорошо приживается и активно развивается в различных типах почв, где при этом происходит снижение количества пропагул Verticillium dahliae; стимулирует прорастание и рост проростков огурца. Недостатком этого изобретения является направленная только на борьбу с фитопатогенами биологическая активность штамма, узкий спектр подавляемых фитопатогенов. Практически отсутствуют сведения о влиянии штамма на ростовые показатели и урожайность растений.
В качестве прототипа заявляемого изобретения можно рассматривать штамм Trichoderma viride Pers. ex. S. F. Gray 16 ЦКМ F-59M 80-90 (патент РФ №2170511, опубл. 20.07.2001). Штамм обладает высокой гиперпаразитической активностью против широкого спектра возбудителей болезней растений, относящихся к родам Fusarium, Helminthosporium, Rhizoctonia, Pythium, Sclerotinia, Alternaria, Verticillium и др., устойчив к ряду химических инсектицидов и фунгицидов; снижает заболеваемость и повышает урожайность растений (на примере двух сортов ярового ячменя). Основным недостатком прототипа можно считать то, что биологическая активность штамма ограничивается его использованием в качестве основы для биофунгицида для предпосевной обработки семян. При этом неизвестно, способен ли этот микромицет после уборки урожая осуществлять биодеградацию стерни и способствовать снижению инфекционного фона в почвах агроценозов.
Задачей заявленного изобретения является выделение нового природного штамма, обладающего антагонистической активностью по отношению к фитопатогенным микроорганизмам, защищающего растения от болезней, стимулирующего их рост и повышающего урожайность, устойчивого к химическим средствам защиты растений и не угнетающего полезную почвенную микрофлору.
Эта задача решается благодаря выделению и использованию штамма Trichoderma asperellum OPF-19, депонированного во Всероссийской Коллекции Промышленных Микроорганизмов под номером F-1323. Штамм был выделен с поверхности корней томатов, выращенных в условиях открытого грунта в Высокогорском районе республики Татарстан. Видовая принадлежность культуры была определена на основании результатов секвенирования гена 16S рРНК в ГНУ ВНИИ сельскохозяйственной микробиологии Россельхозакадемии. Заявленный штамм имеет следующие характеристики.
Культурально-морфологические и физиолого-биохимические признаки
После 72 часов роста на картофельно-глюкозном агаре (КГА) при 30°C колония штамма Т. asperellum OPF-19 имеет диаметр 55-65 мм, при 40°C - 2 мм. Колонии, выращенные на КГА, образуют несколько концентрических колец, на поверхности которых заметно интенсивное спороношение. В центральной части колония более темная, раньше приобретает зеленую окраску, по мере удаления от центра формируется воздушный мицелий. При культивировании при 25°C в отсутствие света, конидии формируются через 35-45 часов. Диффузии пигмента в агар не происходит, у старых колоний присутствует слабый специфический запах.
При росте на агаризованной среде Сабуро в течение 5 суток и 25°C подушечки образуются по всей поверхности колонии, обильно. Спороносящие удлинения на конидиеносцах отсутствуют. Стерильные отростки не формируются. Конидиеносцы чаще формируются в подушечках и редко на воздушном мицелии, конидиеносцы симметричные, завершаются четырьмя фиалидами. Парные ответвления формируются ниже верхушки конидиеносца и располагаются под углом около 90° по отношению к основной оси. Первичные ветки, по мере удаления от верхушки, удлиняются, парные ответвления имеют одинаковую длину, на боковых ветвях первого порядка формируются неветвящиеся боковые ветви второго порядка. Ширина конидиеносца 2,1-5,0 мкм. Фиалиды образуются на концах ветвей первого и второго порядка, образуются скопления из 2-4 фиалид. Фиалиды прямые, колбовидные, немного расширенные в середине, длина - 5-10 мкм, ширина - 2,2-5,7 мкм. Интеркалярные фиалиды не формируются. Конидии имеют темно-зеленый цвет, форма - немного яйцевидная, часто ближе к шаровидной, диаметр - 3,5-4 мкм.
Хламидоспоры образуются при глубинном культивировании, бледно-зеленые или коричневые.
Физиолого-биохимические признаки
Штамм является строгим аэробом, сапротрофом.
Для роста оптимальной является температура 27°C, при этом штамм может расти в диапазоне температур от +10 до +37°C. Оптимальные значения pH среды находятся в пределах 6,5-7,2, рост отмечается при значениях pH среды от 3,0 до 8,0.
В качестве источника углерода и энергии утилизирует глюкозу, галактозу, фруктозу, маннозу, арабинозу, мальтозу, сахарозу, целлобиозу, амигдалин, арбутин, эскулин, салицин, трегалозу, гликоген, гентиобиозу, крахмал, целлюлозу, фукозу.
В качестве источника азота Т. asperellum OPF-19 может использовать нитраты, соли аммония, органический азот в виде аминокислот и пептидов.
Размножение микроорганизма может осуществляться несколькими способами. При поверхностном способе конидии и мицелий штамма Т. asperellum OPF-19 вносят на поверхность питательной среды в чашках Петри, микробиологических матрацах или в любой микробиологической посуде с большой площадью рабочей поверхности, далее биомасса распределяется по поверхности среды шпателем Дригальского, и сосуды инкубируются в термостате при 27°C.
При глубинном способе культивирования, конидии штамма прорастают и образуют мицелий в жидкой питательной среде в конических колбах Эрленмейера (либо в качалочных колбах) или в ферментере. При культивировании конидий и мицелия штамма в колбах Эрленмейера используют шейкеры инкубаторы. Колбы, наполненные питательной средой на 1/4-1/3 от своего объема, инокулируются аликвотами биомассы штамма с плотной питательной средой, устанавливаются на шейкер-инкубатор и качаются при 27°C в течение 3 суток. При культивировании в ферментере питательная среда в культуральном сосуде инокулируется суточным мицелием штамма, полученным в колбах описанным выше способом. В качестве питательной среды для глубинного культивирования лучше всего подходит картофельно-глюкозный или картофельно-сахарозный бульон. Состав: картофель - 200 г/л, глюкоза или сахароза - 20 г/л, вода водопроводная - до 1 л. Картофель измельчают, вываривают в водопроводной воде в течение 30 минут, отфильтровывают, объем фильтрата доводят до 1 л водопроводной водой, добавляют глюкозу или сахарозу.
Штамм подавляет рост и развитие многих фитопатогенных грибов, таких как Ascochyta pisi, Cercospora beticola, Claviceps purpurea, Sclerotinia sclerotiorum, Alternaria alternata, Botrytis cinerea, Fusarium graminearum, Passalora fulva, Verticillum dahliae. Этот тип биологической активности штамма реализуется как за счет продукции антифунгальных метаболитов, так и за счет способности к гиперпаразитизму.
Конидии штамма Т. asperellum OPF-19 сохраняют жизнеспособность при воздействии таких химических фунгицидов, как Колосаль, Колосаль Про, Скальпель, Феразим, Раек, Беномил 500, Альто Турбо, Стингер, Иншур Перформ, а также гербицидам Ларен Про, Кортес СП, Торнадо.
Т. asperellum OPF-19 проявляет ростостимулирующую активность по отношению к растениям, одним из механизмов реализации которой является продукция веществ, обладающих ауксин-подобной активностью.
Кроме того, заявляемый штамм обладает способностью к биологической деструкции стерни, важным последействием чего является снижение инфекционного фона на полях, проявляющееся в снижении заболеваемости посевов последующей культуры.
Изобретение иллюстрируется следующими примерами.
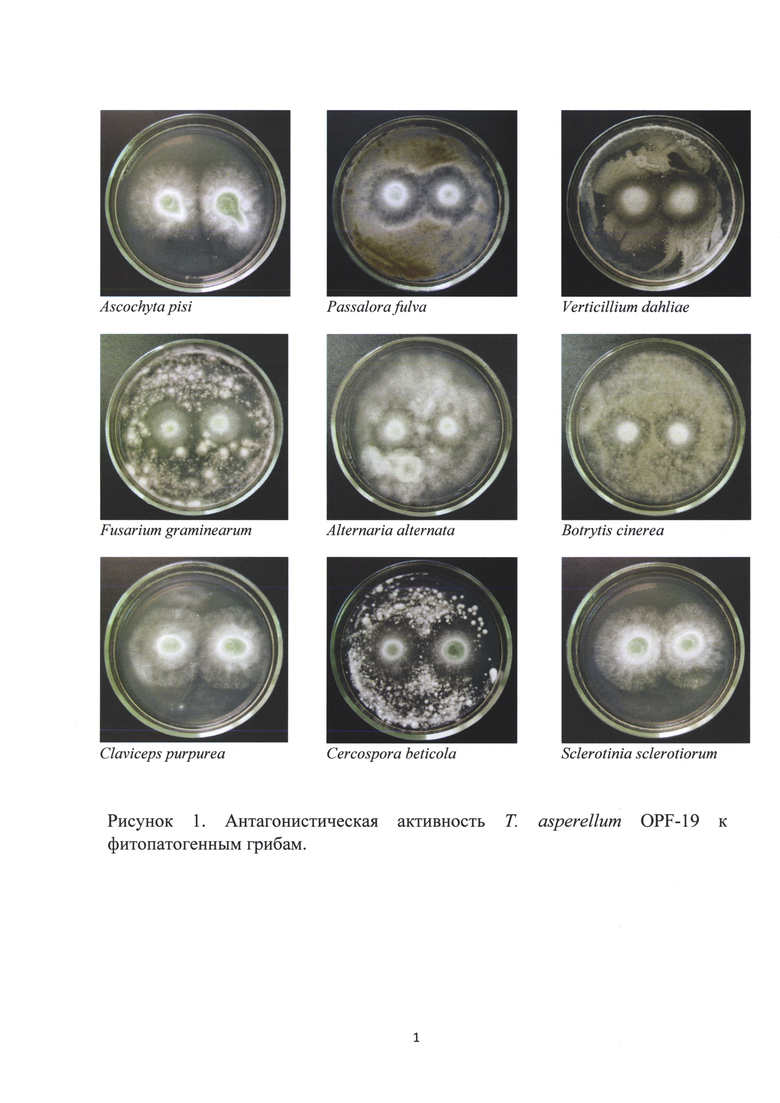
Пример 1. Исследование антагонистической активности штамма Trichoderma asperellum OPF-19
Для выявления антагонизма изучаемого штамма к фитопатогенным микроорганизмам использовали метод агаровых блоков. На чашки Петри с КГА высевали сплошным газоном суспензию спор и фрагментов мицелия фитопатогенов. Одновременно в отдельную чашку Петри с той же средой сеяли газоном Т. asperellum OPF-19. Все микроорганизмы помещали на 3-5 часов в термостаты при температуре 27°C для того, чтобы конидии и споры проросли. По прошествии указанного времени из среды, на которую была посеяна культура Т. asperellum OPF-19, стерильным пробочным сверлом вырезали агаровые блоки и посредством микробиологической иглы помещали их в чашки Петри с фитопатогенами так, чтобы та сторона блока, на которой находилась культура Т. asperellum OPF-19, оказалась непосредственно прилегающей к поверхности среды с развивающейся культурой фитопатогена. Контролем служили газоны фитопатогенов, посеянные одновременно с экспериментальными, но к которым не помещали агаровые блоки с триходермой. Контрольные и опытные чашки с культурами помещали в термостат при 27°C. Наблюдения проводили на 2-5 сутки в зависимости от скорости роста фитопатогена.
Результаты определения антагонистической активности штамма Т. asperellum OPF-19 представлены в виде фотографий на рисунке 1.
Согласно представленной информации штамм Т. asperellum OPF-19 является достаточно сильным антагонистом и обладает широким спектром активности; все использованные в исследовании тест-объекты проявили чувствительность к антагонистичному штамму, при этом рост фитопатогенов Ascochyta pisi, Claviceps purpurea, Sclerotinia sclerotiorum в условиях in vitro был подавлен полностью.
Пример 2. Лабораторные испытания эффективности штамма Т. asperellum OPF-19
В качестве объекта исследования использовали семена озимой пшеницы сорта Айвина. Семена обрабатывали полусухим способом жидкой культурой штамма Т. asperellum OPF- 19 с титром 1×108 конидий/мл, полученной на среде для глубинного культивирования. Контрольные семена обрабатывали водой, а в качестве стандарта использовали биофунгицид Бактофит, Ж (на основе бактерии Bacillus subtilis, штамм ИПМ 215) с нормой расхода 3 л/т, рекомендованной производителем. Расход рабочего раствора - 10 л/т. Через сутки после обработки семена помещали во влажную камеру и выдерживали при 25°C. Учет развития гриба на семенах проводили через 3 суток, а измерение длины корня и ростка - через 6 суток после размещения во влажной камере. Результаты представлены в таблице 1.
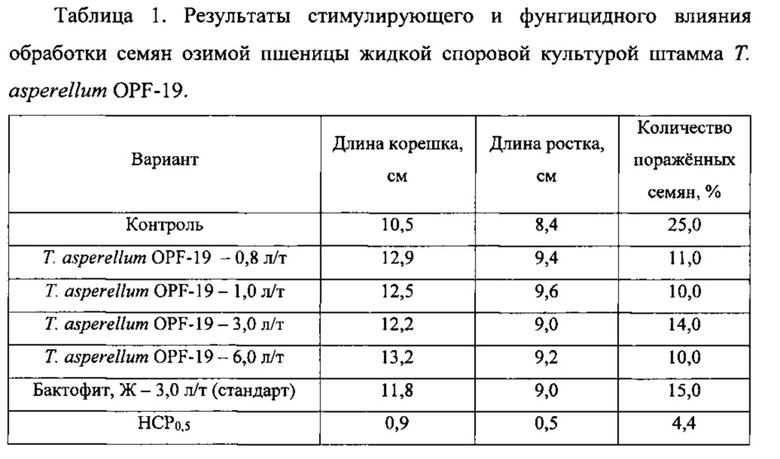
Согласно приведенным данным оптимальной нормой расхода жидкой культуры Т. asperellum OPF-19 с титром 1×108 КОЕ/мл была 0,8 л/т. Более высокие нормы расхода не приводили к существенному усилению роста или снижению зараженности проростков. Стимулирующее и фунгицидное действие обработки семян во всех случаях достоверно превышало показатели в контроле. Также стимуляция роста проростков и фунгицидная активность проявлялись в случае использования штамма Т. asperellum OPF-19 сильнее, чем при воздействии Бактофита, Ж.
Пример 3. Испытания эффективности штамма Т. asperellum OPF-19 в вегетационном опыте на горохе
Вегетационный опыт по выявлению физиологической активности Т. asperellum OPF-19 проводили на горохе сорта Ватан в пластиковых сосудах емкостью 1,5 л, наполненных почвой.
Семена гороха предварительно промывали в проточной водопроводной воде с помощью марлевого фильтра, 6-7 раз, после чего помещали на стерильную фильтровальную бумагу и просушивали в течение нескольких часов. После этого проводили обработку семян гороха полусухим методом суспензией конидий Т. asperellum OPF-19, которую готовили следующим образом. Первоначально смывали конидии с питательной среды (КГА) стерильным физиологическим раствором и получали суспензию с титром 1×108 конидий/мл, который определяли с помощью подсчета в камере Горяева. Далее из исходной суспензии готовили рабочий раствор для предпосевной обработки семян растений из расчета 1 л суспензии на 10 л рабочего раствора; расход рабочего раствора 10 л/т. Контролем служили растения, обработанные водой. Посев семян осуществляли через двое суток после обработки; глубина заделки семян 5 см. Почву увлажняли водопроводной водой до 60% полной влагоемкости.
Закрытые кюветы с посеянными семенами помещались в климатические камеры при температуре 23°C и режиме освещенности день - 18 часов, ночь - 6 часов. С появлением всходов крышки с кювет снимались. Полив осуществляли по мере подсыхания почвы водопроводной водой.
Учет всхожести, ростовых показателей и степени пораженности болезнями проводили через 14 дней после посева, предварительно отмыв растения от почвенной массы.
Выявлено, что заявленный штамм в значительной степени подавлял развитие фитопатогенов, которыми были заражены семена. На рисунке 2 заметно, что у контрольных растений главный корень тонкий с редкими боковыми корнями, семядоли поражены черными пятнами, на стеблях заметны бурые следы поражения растений фитопатогенами. Напротив, у растений, обработанных суспензией конидий Т. asperellum OPF-19, не наблюдалось таких проявлений. Корневая система имела более здоровый вид, лучше развитые боковые корни, что говорит о большей поглощающей способности корней данных растений, что сказывается на развитости всего растения в целом.
Более детально данные о воздействии Т. asperellum OPF-19 на рост растений гороха представлены в таблице 2.
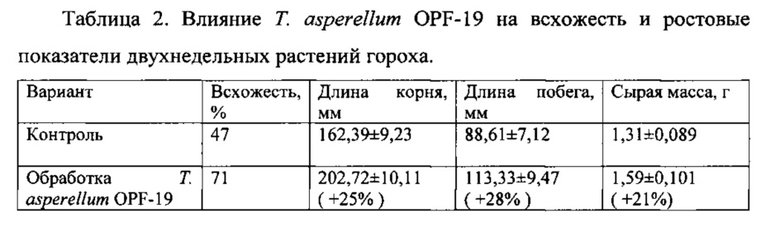
Таким образом, Т. asperellum OPF-19 способствует существенному повышению всхожести гороха и лучшему росту его вегетативных органов, в том числе за счет подавления развития семенной инфекции.
Пример 4. Испытания эффективности штамма Т. asperellum OPF-19 в вегетационном опыте на сое сорта Дуэт
Постановка эксперимента, подготовка суспензии конидий Т. asperellum OPF-19 осуществлялись так же, как описано в примере 3. В качестве стандарта в эксперимент был включен препарат Фитоспорин М, Ж (ООО НВП «Башинком»), обработка семян которым производилась в соответствии с рекомендациями производителя. Результаты представлены в таблице 3.

Растения сои сорта Дуэт в целом оказались маловосприимчивыми к обработке биопрепаратами. Но если в случае использования для предпосевной обработки семян Фитоспорина М их ростовые показатели не отличались от контрольных, то при использовании суспензии конидий Т. asperellum OPF-19 наблюдалось усиление роста растений: длина корней превышала контроль на 15%, побегов - на 7%, сырая масса - на 10%.
Пример 5. Выявление ауксин-подобной активности штамма Т. asperellum OPF-19
В основу биотеста положена стимуляция ауксинами растяжения колеоптилей злаков, в частности пшеницы. Семена пшеницы замачивали в течение 18 ч в водопроводной воде, после чего высаживали в кюветы и помещали в темноту в термостат при 25°C на 2 суток. Для биотеста отбирали проростки с длиной колеоптиля 18-20 мм. Колеоптили отделяли, удаляли первый лист и помещали на «гильотину» по 10 штук так, чтобы отсекаемая зона (5 мм) была ниже апекса на 4 мм, после чего вырезали нужные участки острым лезвием. Получившиеся полые цилиндрики временно помещали в чашку Петри с дистиллированной водой (не более чем на 3 ч). После этого 10 отрезков колеоптилей помещали в чашки Петри диаметром 3 см с 3 мл исследуемых растворов. В качестве контроля использовали дистиллированную воду, а в качестве положительного контроля - раствор индолил-3-уксусной кислоты (ИУК) в концентрации 1 мг/л. Чашки Петри помещали в темноту в термостат при 25°C на 18-20 часов, после чего измеряли длину колеоптилей. В случае наличия у исследуемых растворов ауксин-подобной активности, длина опытных колеоптилей превышала длину колеоптилей в контроле за счет стимуляции роста клеток растяжением.
Опытные растворы готовили посредством разведения жидкой культуры штамма Т. asperellum OPF-19 с титром 1×108 конидий/мл, полученной на среде для глубинного культивирования, в 10 раз и в 100 раз. Результаты представлены в таблице 4.

Таким образом, штамм Т. asperellum OPF-19 продуцирует метаболиты (возможно, ауксины, но не обязательно), которые стимулируют рост клеток растяжением, так же, как и ИУК, т.е. можно заключить, что штамм проявляет ауксин-подобную активность.
Пример 6. Оценка эффективности обработки растений штаммом Т. asperellum OPF-19 в полевых условиях
Для проведения эксперимента использовали жидкую культуру Т. asperellum OPF-19, выращенную на среде для глубинного культивирования, с титром 1×108 КОЕ/мл. Оценку проводили в полевых мелкоделяночных экспериментах на растениях яровой пшеницы сорта Экада 66 в 2014 и 2015 годах. В 2014 году в качестве способов обработки использовали предпосевную протравку конидиальной суспензией триходермы в различных дозировках и опрыскивание вегетирующих растений с нормой расхода 2 л/га. В 2015 году предпосевная обработка проводилась из расчета 1 л конидиальной суспензии на 1 т зерна, опрыскивание по вегетации - 2 л/га. Результаты приведены в таблицах 5-10.
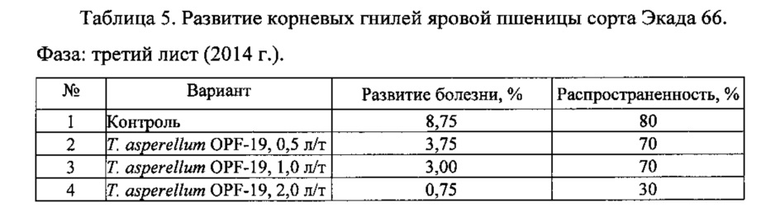
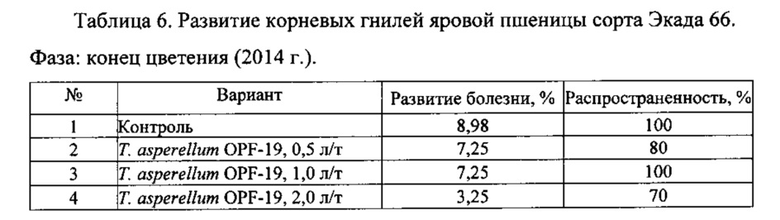
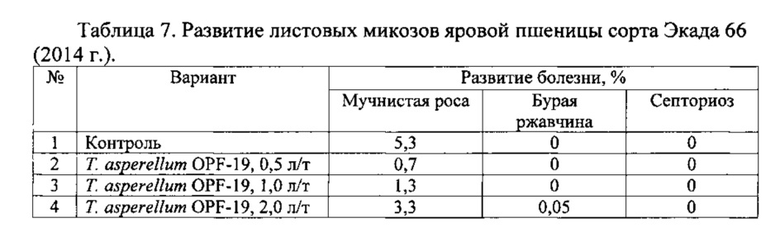
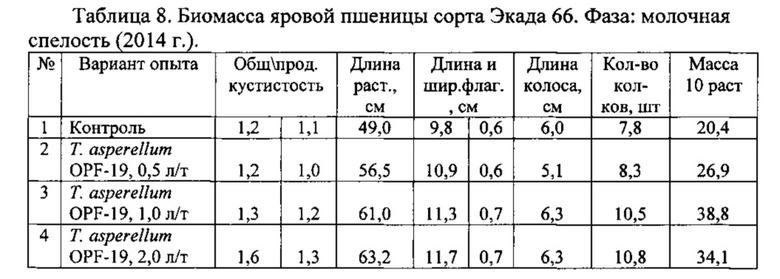
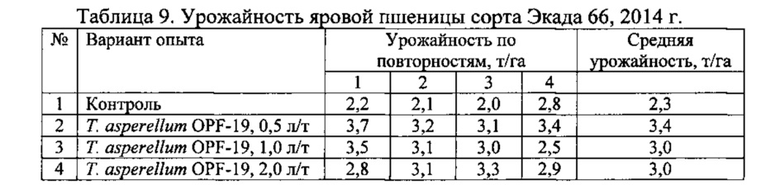
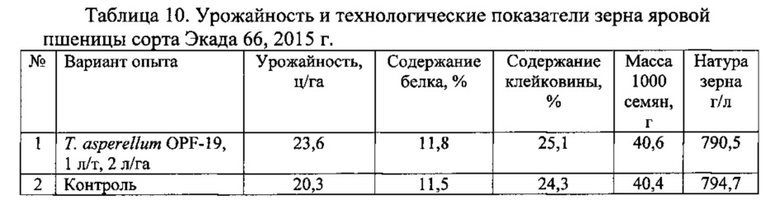
Данные экспериментов свидетельствуют о достоверной биологической эффективности штамма Т. asperellum OPF-19, выражающейся в снижении заболеваемости и повышении урожайности яровой пшеницы.
Пример 7. Оценка совместимости штамма Т. asperellum OPF-19 с химическими средствами защиты растений
Эксперимент проводили следующим образом.
Готовили рабочие растворы пестицидов согласно инструкциям производителей, в которые добавляли жидкую культуру штамма Т. asperellum OPF-19. В контрольном варианте ту же культуру штамма добавляли в стерильную водопроводную воду. Оценку жизнеспособности штамма проводили через 3 часа и через 24 часа после внесения культуры гриба в рабочие растворы пестицидов. Результаты представлены в таблице 11.
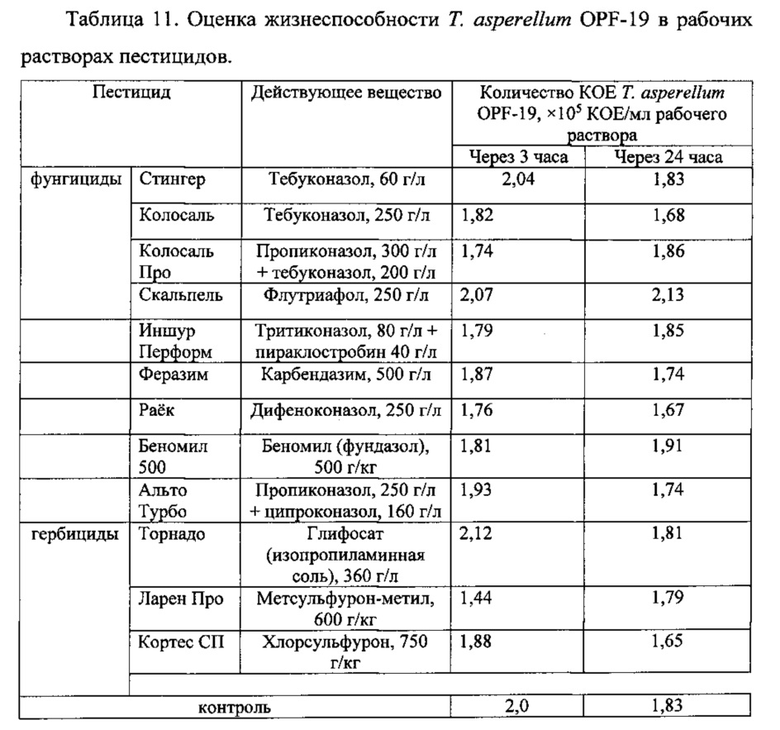
Согласно приведенным данным, в рабочих растворах исследованных пестицидов штамм сохраняет жизнеспособность не хуже, чем в воде даже после 24 часов инкубации, что позволяет говорить о его совместимости со многими химическими средствами защиты растений.
Пример 8. Исследование способности штамма Т. asperellum OPF-19 осуществлять деструкцию пожнивных остатков в лабораторных условиях
В эксперименте оценивалась убыль массы соломы при воздействии Т. asperellum OPF-19. Солома была собрана в начале сентября 2015 года с поля после уборки яровой пшеницы. В лаборатории она была высушена до воздушно-сухого состояния, после чего из случайно взятого пучка были отобраны участки бывших стеблей пшеницы (листовые части из эксперимента намеренно исключались), имеющие не сильно или совсем не поврежденный другими микроорганизмами внешний вид. Из них получали отрезки длиной 6 см, которые по отдельности взвешивали и так же по отдельности стерилизовали автоклавированием при 1,1 атм, после чего стерильным пинцетом раскладывали по 2 в чашки Петри на агаризованную среду, в качестве которой использовали водопроводную воду с 0,1% лактозой, являющуюся, согласно данным литературы, стимулятором целлюлозолитической активности. После этого перпендикулярно отрезкам на среду сеяли культуру штамма Т. asperellum OPF-19. Чашки инкубировали в течение 18 суток в темноте при комнатной температуре (не выше 22°C). По истечении этого времени проводили визуальную оценку роста штамма на среде и отрезках соломы, а также промывку и высушивание до воздушно-сухого состояния отрезков соломы с целью определения их массы. Результаты представлены в таблице 12.

Согласно полученным результатам, штамм Т. asperellum OPF-19 показал высокую эффективность. Культура штамма хорошо развивалась на отрезках соломы, что свидетельствует о способности гриба использовать растительные остатки в качестве источника питательных веществ. Также штамм продемонстрировал достоверную способность снижать массу соломы в условиях in vitro; учитывая небольшую продолжительность эксперимента можно предположить, что при более длительном воздействии Т. asperellum OPF-19 способна эффективно разрушать трудноразлагаемые растительные остатки.
Пример 9. Оценка последействия обработки стерни штаммом Т. asperellum OPF-19 на последующей культуре
Эксперимент проводили на участке, где стерня осталась после уборки озимой пшеницы. Участок был разбит на полосы площадью 30 м2, на каждой полосе закладывали один вариант опыта по обработке стерни: 1) контроль 1 (без обработки); 2) контроль 2 (раствор аммиачной селитры 10 кг/га); 3) препарат Стернифаг, СП (ООО «АгроБиоТехнология», Россия), 80 г/га - в качестве стандарта; 4) жидкая культура Т. asperellum OPF-19 - 0,3 л/га; 5) жидкая культура Т. asperellum OPF-19 - 0,8 л/га; 6) жидкая культура Т. asperellum OPF-19 - 1,5 л/га. Во всех вариантах (кроме контроля 1) в рабочие растворы для обработки стерни, приготовленные из расчета 200 л/га, была добавлена аммиачная селитра из расчета 10 кг/га. После обработки препаратами пожнивные остатки заделывали в почву не позднее, чем через 4 часа. После обработки на весь участок был произведен посев озимой пшеницы сорта Калым.
Весной после перезимовки при достижении пшеницей фазы развития «конец кущения» отбирали растения для учета. Было установлено, что растения поражены церкоспореллезной и ризоктониозной прикорневыми гнилями. Данные учета приведены в таблице 13.
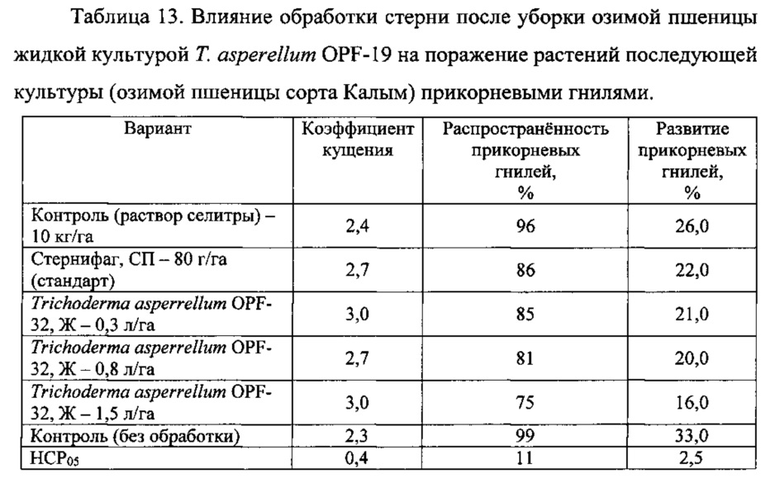
Достоверные отличия по коэффициенту кущения растений, распространенности прикорневых гнилей относительно обоих контролей было в варианте с Т. asperrellum OPF-19 - 1,5 л/га. Что же касается развития болезни, то этот вариант достоверно отличался не только от обоих контролей, но и других вариантов, в том числе стандарта.
Таким образом, технический результат заявляемого изобретения - снижение зараженности фитопатогенами вегетирующих растений и пожнивных остатков, стимуляция роста сельскохозяйственных растений, следствием чего является повышение их урожайности. Он достигается тем, что в качестве средства для обработки растений используется штамм микромицета Trichoderma asperrellum OPF-19, обладающий комплексом полезных свойств, таких как способность подавлять рост фитопатогенных грибов и защищать растения от болезней, стимулировать рост проростков, в том числе благодаря ауксин-подобной активности, повышать урожайность, осуществлять биологическую деструкцию пожнивных остатков и снижать инфекционный фон в почве, и при этом устойчивый к химическим пестицидам.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Trichoderma asperellum F-1395 - продуцент гидролитического комплекса | 2020 |
|
RU2740318C1 |
| Способ получения биопрепарата для обработки растений | 2016 |
|
RU2658430C1 |
| Средство на основе продуктов метаболизма Trichoderma veride с минеральной компонентой основой | 2024 |
|
RU2837159C1 |
| БИОПРЕПАРАТ ДЛЯ СТИМУЛЯЦИИ РОСТА РАСТЕНИЙ И ИХ ЗАЩИТЫ ОТ ФИТОПАТОГЕНОВ НА ОСНОВЕ ШТАММОВ TRICHODERMA, ШТАММЫ TRICHODERMA ДЛЯ ЕГО ПРОИЗВОДСТВА (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ БИОПРЕПАРАТА НА ОСНОВЕ ТАКИХ ШТАММОВ | 2015 |
|
RU2607785C2 |
| Штамм Trichothecium roseum HPL21/2.2 - гиперпаразит возбудителя парши яблони | 2023 |
|
RU2817835C1 |
| Штамм микроорганизма Clonostachys rosea f. catenulata в качестве биофунгицида, стимулятора роста растений и продуцента метаболитов для сельскохозяйственного применения | 2017 |
|
RU2644338C1 |
| ПРЕПАРАТ ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ БОЛЕЗНЕЙ | 1999 |
|
RU2170511C2 |
| Штамм Trichoderma viride - продуцент соясапонина с противогрибной и ростстимулирующей активностью к растениям и дождевым червям | 2020 |
|
RU2750957C2 |
| ШТАММ БАКТЕРИЙ BACILLUS MOJAVENSIS PS17 ДЛЯ ПОВЫШЕНИЯ УРОЖАЙНОСТИ И ЗАЩИТЫ СЕЛЬСКОХОЗЯЙСТВЕННЫХ РАСТЕНИЙ ОТ ФИТОПАТОГЕННЫХ ГРИБОВ | 2019 |
|
RU2737208C1 |
| ШТАММ ГРИБА TRICHODERMA SP. МГ-97, ИСПОЛЬЗУЕМЫЙ ДЛЯ ЗАЩИТЫ СЕЯНЦЕВ ХВОЙНЫХ ОТ ФУЗАРИОЗОВ | 1999 |
|
RU2171580C1 |



Изобретение относится к биотехнологии. Штамм микроскопического гриба Trichoderma asperellum OPF-19, обладающий антагонистической активностью по отношению к фитопатогенным микроорганизмам, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов под регистрационным номером ВКПМ F-1323 и может быть использован для создания биопрепарата комплексного действия для использования в растениеводстве, в том числе при ведении органического земледелия. Изобретение позволяет повысить урожайность сельскохозяйственных растений. 4 ил., 13 табл., 9 пр.
Штамм микроскопического гриба Trichoderma asperellum, депонированный во Всероссийской Коллекции Промышленных Микроорганизмов под номером F-1323, для получения биопрепарата комплексного действия для защиты сельскохозяйственных растений от болезней, вызываемых фитопатогенными грибами, стимуляции их роста и повышения урожайности, а также биодеградации пожнивных остатков и улучшения фитосанитарного состояния почв, совместимого с химическими пестицидами.
| ПРЕПАРАТ ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ БОЛЕЗНЕЙ | 1999 |
|
RU2170511C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКОГО СРЕДСТВА ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ФИТОПАТОГЕНОВ И НЕМАТОД НА ОСНОВЕ ШТАММА ГРИБА РОДА TRICHODERMA И БИОЛОГИЧЕСКОЕ СРЕДСТВО, ПОЛУЧЕННОЕ СПОСОБОМ | 2012 |
|
RU2534213C2 |
| СПОСОБ ЗАЩИТЫ РАСТЕНИЙ ОГУРЦА И ТОМАТА ОТ ФИТОПАТОГЕНОВ | 1993 |
|
RU2094991C1 |
| ШТАММ МИКРОМИЦЕТА ТRICHODERMA VIRIDE, ШТ.23, ОБЛАДАЮЩИЙ ФУНГИЦИДНЫМИ СВОЙСТВАМИ ДЛЯ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО БИОПРЕПАРАТА СО СВОЙСТВАМИ ФУНГИЦИДА И БАКТЕРИАЛЬНОГО УДОБРЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО БИОПРЕПАРАТА, КОМПЛЕКСНЫЙ БИОПРЕПАРАТ СО СВОЙСТВАМИ ФУНГИЦИДА И БАКТЕРИАЛЬНОГО УДОБРЕНИЯ | 1999 |
|
RU2186847C2 |
| ШТАММ ГРИБА TRICHODERMA SP. МГ-97, ИСПОЛЬЗУЕМЫЙ ДЛЯ ЗАЩИТЫ СЕЯНЦЕВ ХВОЙНЫХ ОТ ФУЗАРИОЗОВ | 1999 |
|
RU2171580C1 |
Авторы
Даты
2017-10-26—Публикация
2016-08-02—Подача