Область техники
В данном описании раскрыто устройство для пульмонального введения, содержащее узел распылительного сопла и картридж, включающий водный раствор, содержащий от 70 до 400 мг А/мл сульфометилированного полимиксина, и его применение в терапии для пульмонального введения пациенту, нуждающемуся в этом.
Предшествующий уровень техники
Бактериальная инфекция легких является серьезной проблемой и может стать угрожающей жизни для пациентов, страдающих от хронических заболеваний легких, таких как астма, муковисцидоз (МВ), бронхоэктаз, не связанный с муковисцидозом, и хроническая обструктивная болезнь легких.
Колистин - это многокомпонентный полимиксиновый антибиотик, продуцируемый Bacillus polymyxa var. colistinus, который полезен для лечения серьезных бактериальных легочных инфекций, вызванных грамотрицательными бактериями, такими как, например, Pseudomonas Aeruginosa или Klebsiella pneumoniae. Полимиксин Е1 и Полимиксин Е2 являются основными компонентами колистина.
Когда колистин является сульфометилированным, можно получить колистиметат натрия (CMS, от англ. colistimethate sodium). Чтобы он стал эффективным противомикробным агентом, необходимо гидролизовать сульфометильные группы CMS, тем самым высвобождая свободные аминогруппы. Таким образом, CMS считается пролекарством колистина. Принятый консенсус состоит в том, что в водных растворах CMS самопроизвольно гидролизуется и образует сложную смесь сульфометилированных производных колистина и, возможно, колистина. Широко признано, что лекарственный продукт CMS не должен содержать количество колистина, которое считается эффективным in vivo, потому что введение колистина приводит к заметной токсичности.
Парентеральный Coly-Mycin® M является препаратом, содержащим CMS, одобренным для инъекций. В инструкции по применению указано, что «парентеральные лекарственные средства перед введением должны проверяться визуально на предмет наличия твердых частиц и обесцвечивания, когда растворы и контейнеры позволяют это сделать. Если наблюдаются эти явления, продукт не должен использоваться. […] Любой конечный раствор для внутривенного вливания, содержащий колистиметат натрия, должен быть свежеприготовлен и использован в течение не более 24 часов».
Промиксин - это препарат, содержащий CMS, одобренный для ингаляции. В инструкции по применению указано, что «растворы следует использовать сразу после восстановления (см. раздел 4.2). Любой неиспользованный раствор, остающийся в распылителе, должен быть удален после обработки».
Предупреждение FDA, опубликованное в 2007 году после смерти пациента с МВ, связанной с вдыханием старого раствора CMS, гласит: «Предварительное смешивание колистиметата в водный раствор и его хранение более 24 часов приводит к увеличению концентрации колистина в растворе, что увеличивает потенциал для легочной токсичности. […] В водном растворе колистиметат подвергается спонтанному гидролизу с образованием колистина».
Сейчас было обнаружено, что водный раствор, содержащий высокую концентрацию сульфометилированного полимиксина, проявляет физико-химические свойства, пригодные для долгосрочной стабильности даже при комнатной температуре. Таким образом, его можно использовать в устройстве для пульмонального введения, которое можно использовать у людей по вышеупомянутому терапевтическому назначению.
Сущность изобретения
В данном описании раскрыто устройство для пульмонального введения, содержащее узел распылительного сопла и картридж, включающий водный раствор, содержащий от 70 до 400 мг А/мл сульфометилированного полимиксина, и его применение в терапевтическом или профилактическом лечении бактериальных инфекций легочной системы путем пульмонального введения.
Подробное описание изобретения
Краткое описание графических материалов
Фиг. 1. Изображение интервала масс-медианного аэродинамического диаметра (MMAD, от англ. mass median aerodynamic diameter) (мкм) для композиции Примера 4.
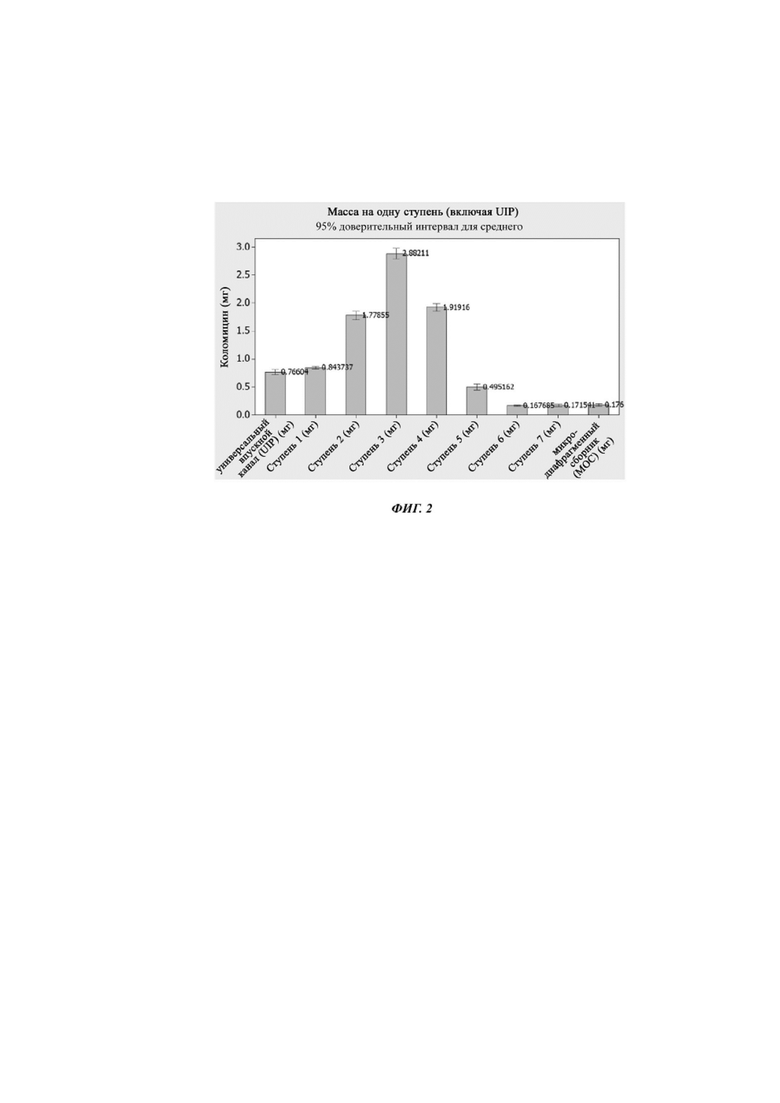
Фиг. 2. Массовое количество композиции Примера 4, доставленное за одну ступень, включая универсальный впускной канал («UIP», от англ. universal induction port).
Фиг. 3. График зависимости суммарной массы (%) от аэродинамического диаметра для композиции Примера 4.
Фиг. 4. Изображение интервала масс-медианного аэродинамического диаметра (мкм) для композиции Примера 5 при двух различных давлениях.
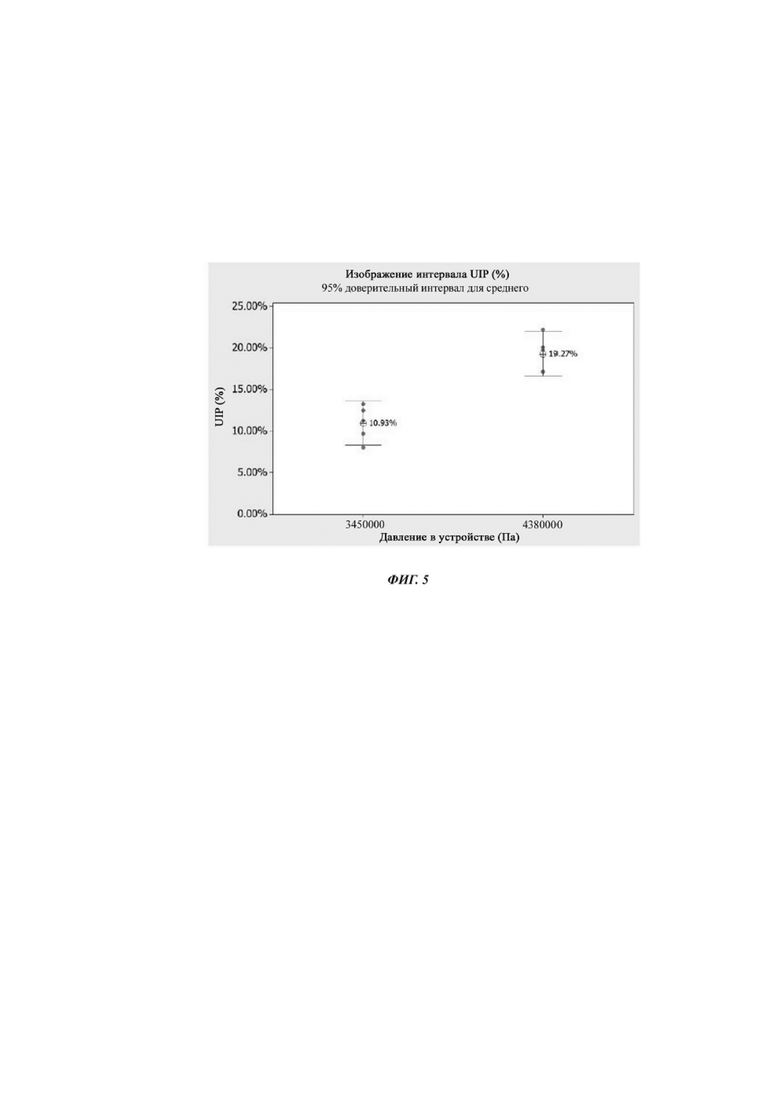
Фиг. 5. Изображение интервала UIP (%) для двух различных давлений для композиции примера 5 при двух различных давлениях.
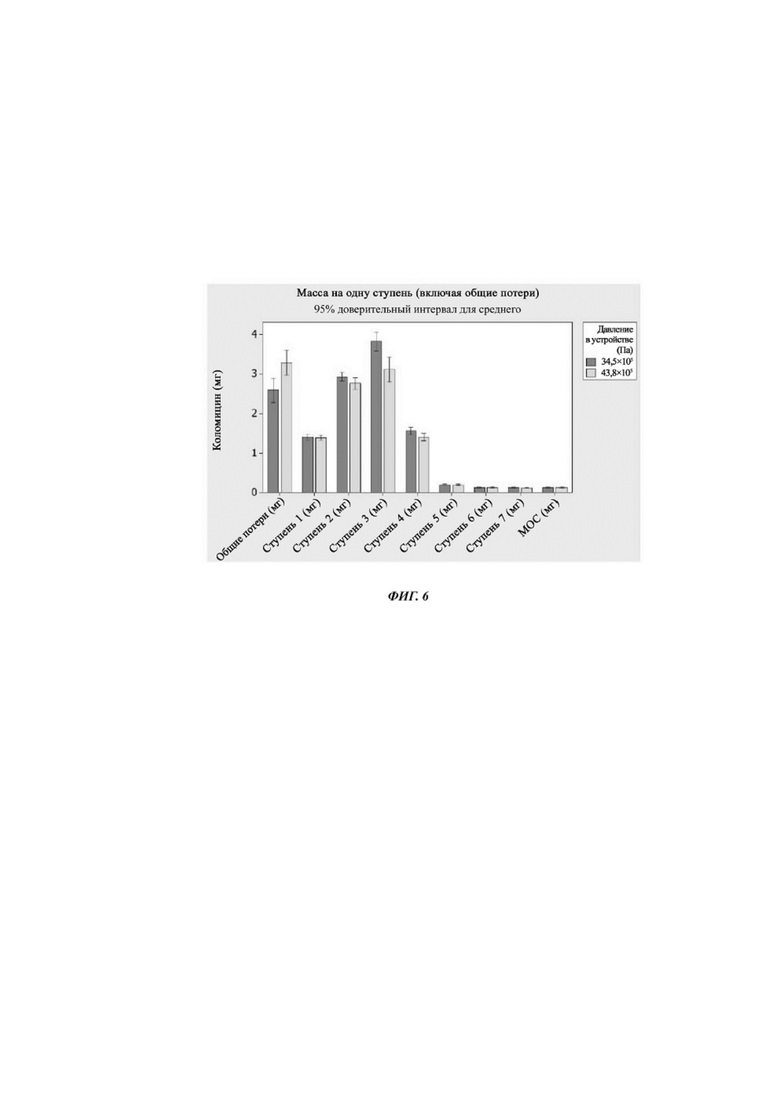
Фиг. 6. График зависимости суммарной массы (%) от аэродинамического диаметра для композиции Примера 5 при двух различных давлениях.
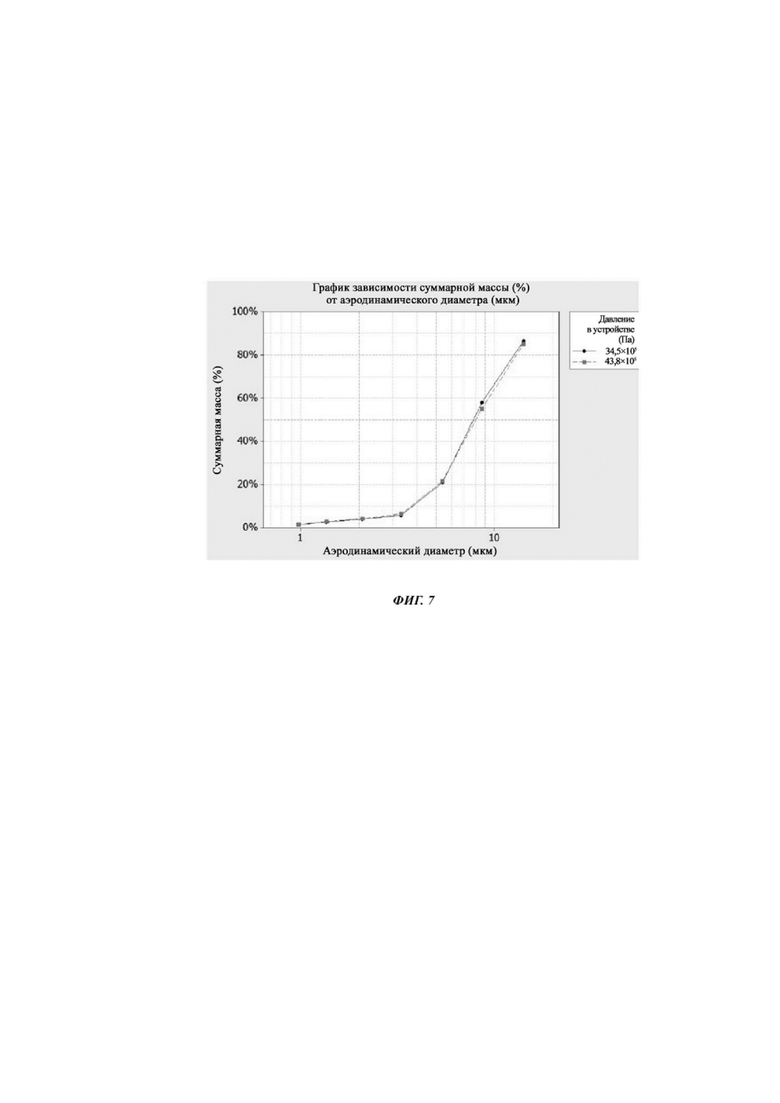
Фиг. 7. График зависимости суммарной массы (%) от аэродинамического диаметра для композиции Примера 5 при двух различных давлениях.
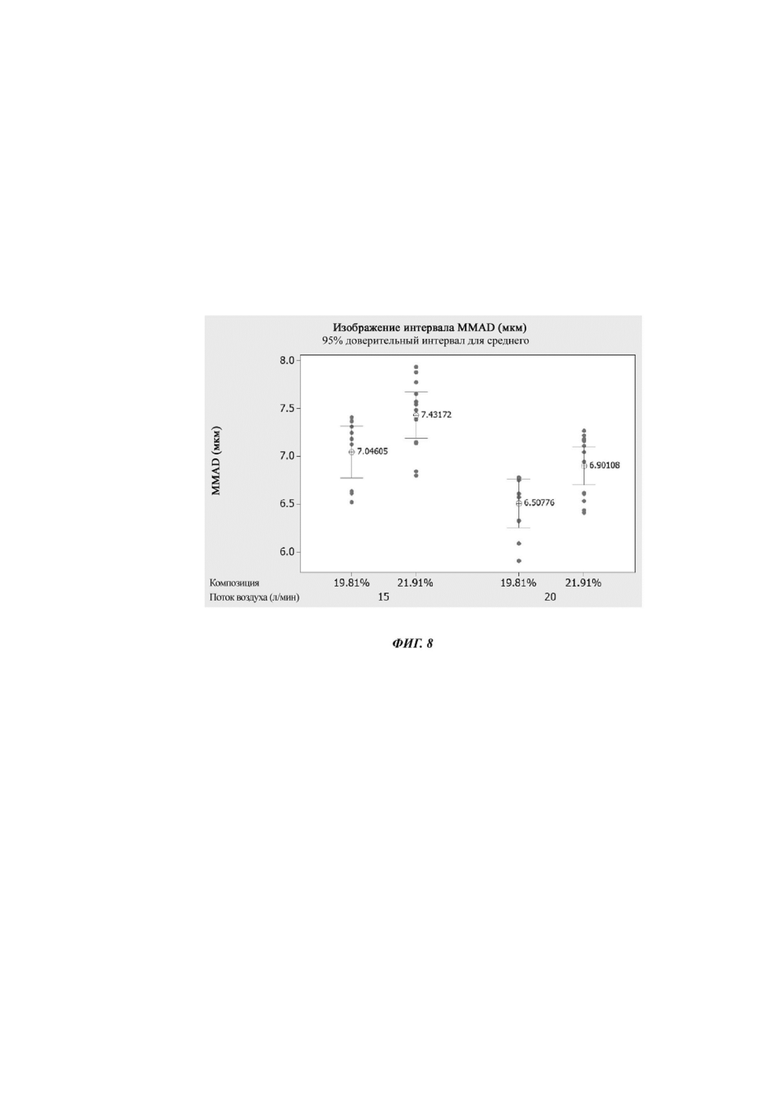
Фиг. 8. Изображение интервала масс-медианного аэродинамического диаметра (мкм) для композиции Примера 6 при двух различных давлениях.
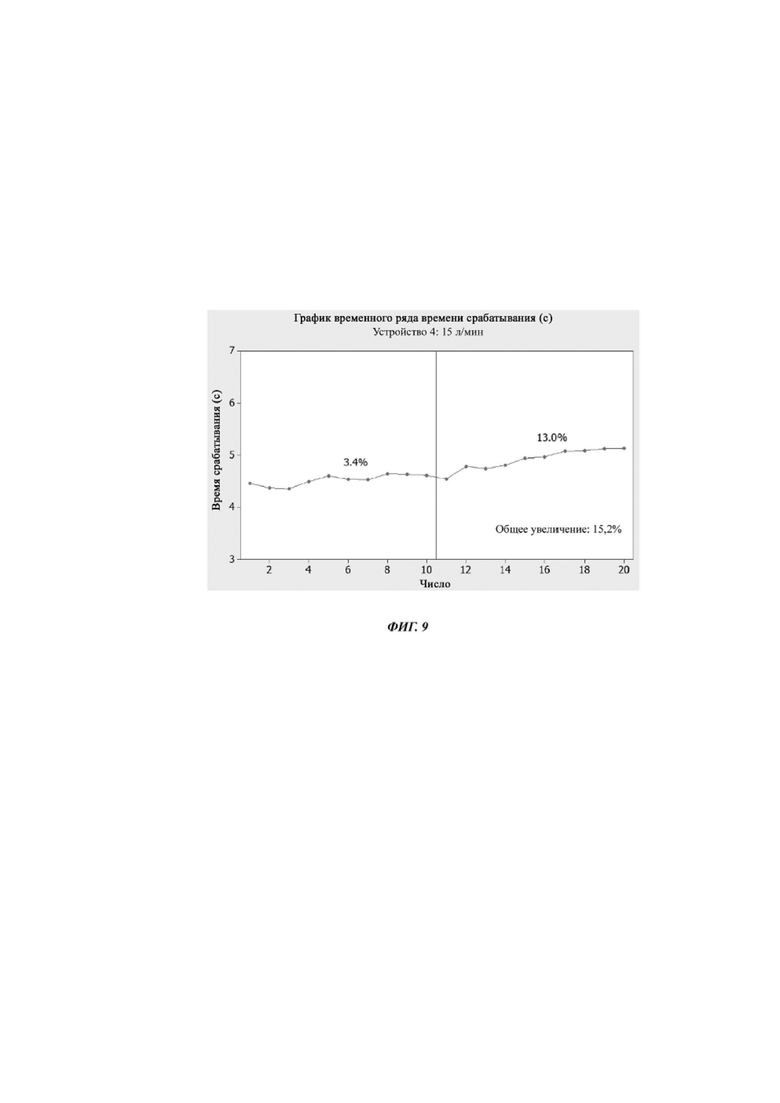
Фиг. 9. График временного ряда времени срабатывания для устройства № 4 в течение 10 срабатываний с последующим хранением в течение 17 часов при комнатной температуре, а затем еще 10 срабатываний. Данные собирали в эксперименте, раскрытом в Примере 7.
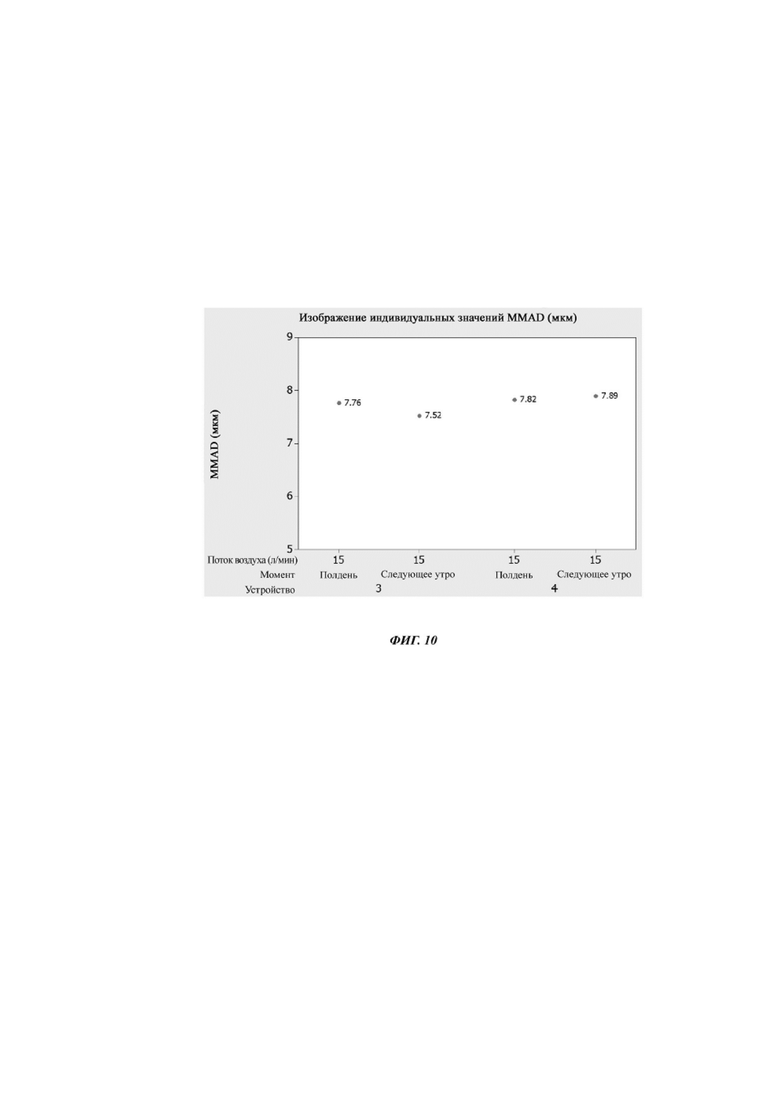
Фиг. 10 Изображение индивидуальных значений MMAD для устройства № 3 и устройства № 4 до и после хранения в течение 17 часов при комнатной температуре. Данные собирали в эксперименте, описанном в примере 7.
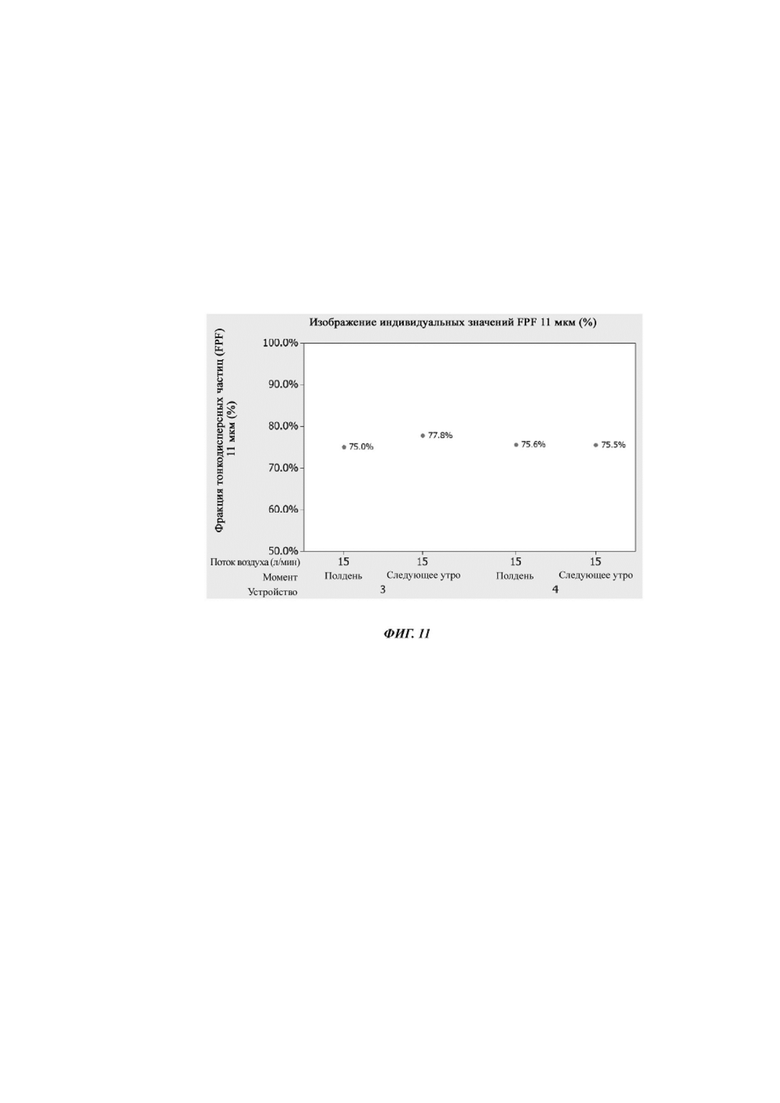
Фиг. 11. Изображение индивидуальных значений фракции тонкодисперсных частиц (FPF, от англ. fine particle fraction) 11 микрон для устройства № 3 и устройства № 4 до и после хранения в течение 17 часов при комнатной температуре. Данные собирали в эксперименте, описанном в примере 7.
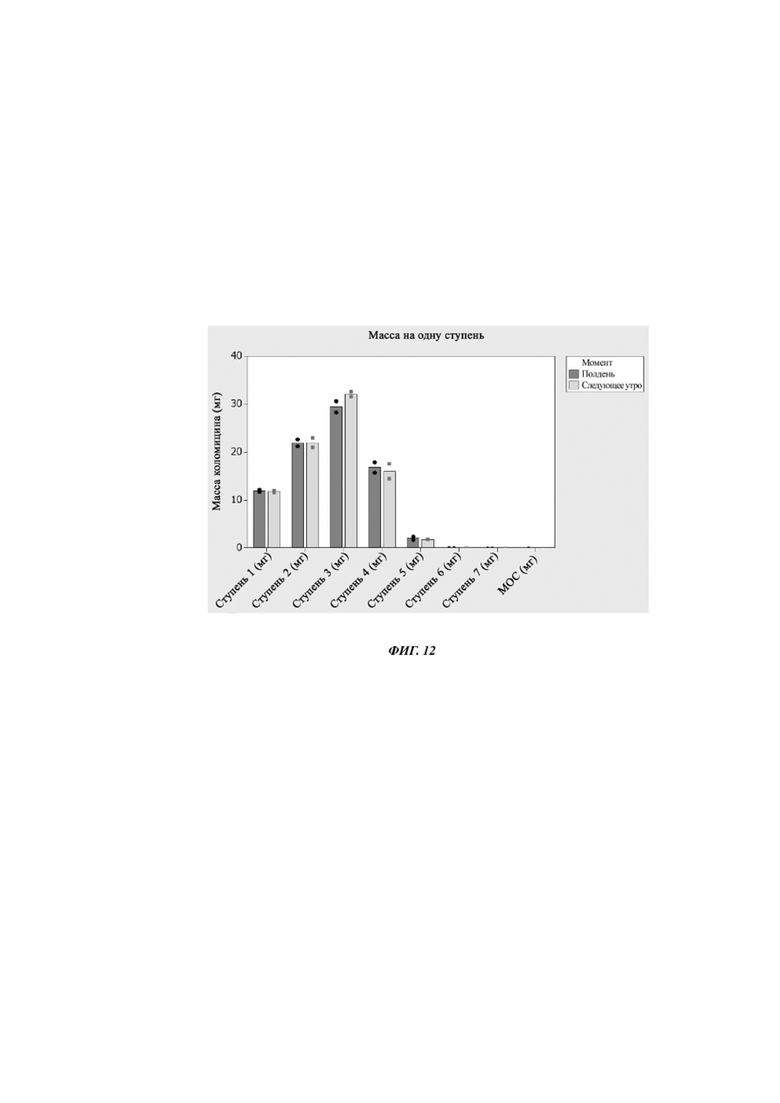
Фиг. 12. Масса на одну ступень распределения для устройства № 3 и устройства № 4 до и после хранения в течение 17 часов при комнатной температуре. Данные собирали в эксперименте, описанном в примере 7.
Определения
Используемые в данном описании формы единственного числа относятся к одному или нескольким объектам; например, «соединение» относится к одному или более соединений, или по меньшей мере к одному соединению.
Как таковые формы единственного числа, термины «один или более» и «по меньшей мере один» могут быть использованы здесь взаимозаменяемо.
Подразумевают, что числа, используемые здесь в отношении физико-химических свойств, времени, температуры, концентрации, размера частиц и тому подобного, представляют измеренные значения, и, как таковые, не должны строго истолковываться как абсолютные, а скорее они должны толковаться таким образом, чтобы учесть экспериментальные погрешности и округления. Например, следует понимать, что значение температуры 2°C имеет определенную степень дисперсии, обусловленную инструментом, используемым для измерения температуры, например, стеклянным термометром, цифровым термометром и т.д. Кроме того, измеренная температура 1,6°C при округлении в большую сторону будет эквивалентна значению температуры 2°C.
Термин «хроматографический профиль», используемый в данном описании, означает хроматограмму ВЭЖХ, полученную с помощью способа, способного разделить или отобразить по меньшей мере 50 пиков, присутствующих в CMS. Такой способ можно найти в WO 2014/195405.
Термин «никаких существенных изменений в хроматографическом профиле» включает хроматограммы, в которых относительная интенсивность пика является относительно стабильной, например, изменяется менее чем на 5%, или более предпочтительно, менее чем на 2%.
Термин «физико-химическое свойство», как он использован здесь, означает параметр, который является мерой физико-химических свойств, таких как, например, частицы, невидимые невооружённым глазом, количество видимых частиц, цвет, прозрачность, рН, осмоляльность, мутность или вязкость.
Приблизительное соотношение между базовой активностью колистина на единицу объема и полученной антибактериальной активностью раствора, как измерено в международных единицах на мл (МЕ/мл), показано в таблице 1 ниже. Активность CMS зависит от измеренной активности и содержания воды.
Таблица 1.
Термин «базовая активность колистина» альтернативно упоминается здесь как «A».
В соответствии с инструкцией, утвержденной FDA с января 2013 года, Coly-Mycin М, колистиметат натрия, поставляется во флаконах, содержащих 150 мг базовой активности колистина. Флаконы следует восстанавливать с помощью 2 мл стерильной воды для инъекций для получения колистиметата натрия в концентрации, эквивалентной 75 мг/мл базовой активности колистина. В настоящем описании мы считаем, что такие растворы содержат 75 мг A/мл CMS. Растворение 3,0 ММЕ CMS в 1,0 мл воды обеспечит 100 мг А/мл CMS. Растворение 2,8 ММЕ CMS в 1,0 мл воды обеспечит 94 мг А/мл CMS.
Термин «водный раствор», используемый в данном описании, означает раствор, в котором вода является основным (или главным) растворителем. Подходящие водные растворы для сульфометилированных полимиксинов включают в себя, но не ограничиваются ими, воду для инъекций (ВДИ), сверхчистую воду, 0,9% физиологический раствор и 0,45% физиологический раствор.
Термин «CMS», как описано в данном описании, относится к композиции, содержащей сульфометилированный полимиксин E1 и сульфометилированный полимиксин E2. В Реестре Химических рефератов (Chemical Abstracts) (CAS) этой композиции присвоен номер 8068-28-8 для CMS. В общем, CMS считается смесью сульфометилированных колистинов.
Термин «колистин», как описано в данном описании, относится к композиции, содержащей полимиксин E1 и полимиксин E2. В Реестре Chemical Abstracts колистину присвоен номер 1066-17-7. В соответствии с Европейской Фармакопеей колистин должен содержать более 77% полимиксина E1, E2, E3, E1i и E1-7MOA, но менее 10% каждого из второстепенных компонентов полимиксина E3, E1i и E1-7MOA. Термин «полимиксин Е», как описано в настоящем описании используется взаимозаменяемо с термином «колистин».
Термин «полимиксин Е1», как описано в настоящем описании, относится к соединению, имеющему CAS № 7722-44-3. Полимиксин Е1 используется взаимозаменяемо с колистином А.
Термин «полимиксин Е2», как описано в настоящем описании, относится к соединению, имеющему CAS № 7239-48-7. Полимиксин Е2 используется взаимозаменяемо с колистином В.
Термин «полимиксин В», используемый в настоящем описании, относится к соединению, имеющему CAS № 1405-20-5.
Термин «сульфометилированный полимиксин», используемый в данном описании, относится к полимиксину, содержащему по меньшей мере одну сульфометильную группу (-CH2S(O)2OR3), присоединенную к γ-аминогруппе на остатке L-DAB (или L-DBU), где радикал R3 может представлять собой Н или М, где М представляет собой одновалентный катион, который относится к катионным частицам, содержащим один положительный заряд, примеры которых включают, но не ограничиваются ими, Li+, Na+, K+, HmN(C1-4 алкил)n+, где m равно 0-4 и n равно 0-4, при условии, что m+n = 4.
Термин «DAB», как описано в настоящем описании, относится к радикалу, полученному из 2,4- диаминобутановой кислоты, где атом углерода, смежный с карбонильным атомом углерода, (то есть, α-углерод) имеет стереохимию, обозначенную как L-конфигурация. L-DAB альтернативно называют в литературе L-DBU.
Наиболее распространенный сульфометилированный полимиксин называется CMS, но существуют и другие сульфометилированные полимиксины, например, сульфометилированный полимиксин В, сульфометилированный полимиксин E1, сульфометилированный полимиксин E2 и т.д. Сульфометилированные полимиксины также раскрыты в опубликованной заявке РСТ WO 2014/108469 (Xellia), предмет которой включен в данное описание посредством ссылки в полном объеме. Дополнительные полимиксины описаны в опубликованной заявке РСТ WO 2012/168820, которая соответствует US 2012/0316105, предмет которой включен в данное описание посредством ссылки в полном объеме.
Термин «картридж», используемый здесь, означает сосуд, пригодный для хранения водных растворов, содержащих сульфометилированные полимиксины.
Термин «мОсм/ кг», относящийся к осмоляльности, как он использован здесь, означает миллиосмоль на кг.
Термин «НЕМ», относящийся к мутности, как он использован здесь, означает нефелометрические единицы мутности.
Термин «USP <номер>», как используется здесь, относится к специально пронумерованной статье, как описано в Фармакопее США (USP 35, 1 мая 2012).
Термин «Ph. Eur.» с последующим назначенным цифровым кодом, как он используется здесь, относится к Европейской Фармакопее, восьмое издание, том 1, 2013.
Термин «номинальный объем», как используется здесь, относится к объему, указанному производителем картриджа.
“pH’’ является обычной единицей измерения активности ионов водорода в растворе при 25°C, если не указана другая температура. Подходящий диапазон рН для водных растворов CMS в картриджах согласно настоящему изобретению составляет 6-9, например 6,5-8,5. Наиболее предпочтительный диапазон рН для водных растворов CMS в картриджах в соответствии с настоящим изобретением составляет 6,0-7,0.
Первый вариант осуществления изобретения относится к устройству для пульмонального введения, содержащему узел распылительного сопла и картридж, включающий водный раствор, содержащий от 70 до 400 мг А/мл сульфометилированного полимиксина.
В первом аспекте первого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 80 до 150 мг А/мл.
Во втором аспекте первого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 85 до 150 мг А/мл.
В третьем аспекте первого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 90 до 150 мг А/мл.
В четвертом аспекте первого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 100 до 120 мг А/мл.
В пятом аспекте первого варианта осуществления изобретения водный раствор содержит от 90 до 120 мг А/мл колистиметата натрия, и все концентрации, включенные в указанный диапазон, например, 90 мг А/мл, 94 мг А/мл, 95 мг А/мл, 100 мг А/мл, 110 мг А/мл, 112,5 мг А/мл, 115 мг А/мл и 120 мг А/мл.
В шестом аспекте первого варианта осуществления изобретения водный раствор содержит приемлемое количество посторонних веществ, как определено в соответствии с USP <1>.
В седьмом аспекте первого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>.
В восьмом аспекте первого варианта осуществления изобретения водный раствор имеет приемлемую прозрачность, как определено в соответствии с USP <1>.
В девятом аспекте первого варианта осуществления изобретения водный раствор имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В десятом аспекте первого варианта осуществления изобретения водный раствор имеет приемлемое количество посторонних веществ, как определено в соответствии с USP <1>; приемлемую прозрачность, как определено в соответствии с USP <1>; и мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 11 аспекте первого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>, имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 12 аспекте первого варианта осуществления изобретения водный раствор имеет pH от 6 до 8.
В 13 аспекте первого варианта осуществления изобретения картридж имеет номинальный объем 1,0 или 0,5 мл.
В 14 аспекте первого варианта осуществления изобретения водный раствор имеет осмоляльность от 500 мОсм/кг до 1300 мОсм/кг.
В 15 аспекте первого варианта осуществления изобретения водный раствор имеет осмоляльность от 700 мОсм/кг до 1200 мОсм/кг.
В 16 аспекте первого варианта осуществления изобретения водный раствор имеет осмоляльность от 900 мОсм/кг до 1200 мОсм/кг.
В 17 аспекте первого варианта осуществления изобретения устройство дополнительно содержит контейнер под давлением.
Второй вариант осуществления изобретения относится к устройству для пульмонального введения, содержащему узел распылительного сопла и картридж, включающий водный раствор, содержащий от 70 до 400 мг А/мл колистиметата натрия.
В первом аспекте второго варианта осуществления изобретения концентрация колистиметата натрия составляет от 80 до 200 мг А/мл.
Во втором аспекте второго варианта осуществления изобретения концентрация колистиметата натрия составляет от 80 до 120 мг А/мл.
В третьем аспекте второго варианта осуществления изобретения концентрация колистиметата натрия составляет от 85 до 113 мг А/мл.
В четвертом аспекте второго варианта осуществления изобретения концентрация колистиметата натрия составляет от 100 до 120 мг А/мл.
В пятом аспекте второго варианта осуществления изобретения водный раствор содержит от 90 до 120 мг А/мл колистиметата натрия, и все концентрации, включенные в указанный диапазон, например, 90 мг А/мл, 94 мг А/мл, 95 мг А/мл, 100 мг А/мл, 110 мг А/мл, 112,5 мг А/мл, 115 мг А/мл и 120 мг А/мл. .
В шестом аспекте второго варианта осуществления изобретения водный раствор содержит приемлемое количество посторонних веществ, как определено в соответствии с USP <1>.
В седьмом аспекте второго варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>.
В восьмом аспекте второго варианта осуществления изобретения водный раствор имеет приемлемую прозрачность, как определено в соответствии с USP <1>.
В девятом аспекте второго варианта осуществления изобретения водный раствор имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 10 аспекте второго варианта осуществления изобретения водный раствор имеет приемлемое количество посторонних веществ, как определено в соответствии с USP <1>; имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 11 аспекте второго варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>, имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 12 аспекте второго варианта осуществления изобретения водный раствор имеет pH от 6 до 8.
В 13 аспекте второго варианта осуществления изобретения картридж имеет номинальный объем 1,0 или 0,5 мл.
В 14 аспекте второго варианта осуществления изобретения водный раствор имеет осмоляльность от 500 мОсм/кг до 1300 мОсм/кг.
В 15 аспекте второго варианта осуществления изобретения водный раствор имеет осмоляльность от 700 мОсм/кг до 1200 мОсм/кг.
В 16 аспекте второго варианта осуществления изобретения водный раствор имеет осмоляльность от 900 мОсм/кг до 1200 мОсм/кг.
В 17 аспекте второго варианта осуществления изобретения устройство дополнительно содержит контейнер под давлением.
Водный дозирующий ингалятор (MDI) представляет собой устройство, которое доставляет определенное количество лекарственного средства в легкие в виде короткого выброса капель лекарственного средства, которые вдыхаются пациентом.
Дозирующие ингаляторы (MDI), подходящие в соответствии с вариантами осуществления, раскрытыми в данном документе, координируются с приведением в действие (срабатыванием) ингалятора. Таким образом, введение включает одну ингаляцию для каждого срабатывания устройства. Срабатывание устройства может быть вызвано различными способами, известными в данной области, например, вручную или с помощью «сенсоров дыхания». Когда дозирующий ингалятор приводят в действие за счет использования сенсоров дыхания и, таким образом, только путем вдыхания, композицию вводят с помощью «ингаляции, приводимой в действие дыханием».
Когда дозирующий ингалятор приводят в действие вручную, во время, когда пациенты выполняют одно вдыхание, композицию вводят путем «скоординированной ингаляции».
Типичное время введения для одной ингаляции с помощью MDI составляет несколько секунд. Эту операцию можно повторить несколько раз, чтобы получить требуемую дозу. Наиболее предпочтительные MDI для использования в настоящем изобретении производят монодисперсные частицы с масс-медианным аэродинамическим диаметром (MMAD) от 4 до 8 мкм или в среднем 6 мкм.
MDI, подходящий для введения композиции в соответствии с настоящим изобретением, способен формировать отдельные и однородные капли аэрозоля со средним диаметром от 4 до 8 микрон из водного раствора, содержащего сульфометилированные полимиксины. Опубликованная заявка РСТ WO 95/13860 (соответствующая US 5,753,014, включено посредством ссылки) описывает мембранные фильтры, снабженные порами, имеющими размер, как правило, в диапазоне от 5 нм до 50 мкм. Мембраны, описанные в ней, имеющие поры с размером, обеспечивающим аэрозоли, имеющие масс-медианный аэродинамический диаметр 4-8 мкм, предпочтительно могут быть использованы в узле распылительного сопла, помещенном в дозирующий ингалятор, такой как, например, дозирующий ингалятор, раскрытый в WO 2011/043712 (что соответствует US 2012/0216805, включено посредством ссылки), для введения высококонцентрированной композиции CMS в соответствии с настоящим изобретением.
Третий вариант осуществления изобретения относится к водной композиции и/или водному раствору, содержащему от 70 до 400 мг А/мл сульфометилированного полимиксина, для применения в терапевтическом или профилактическом лечении бактериальной инфекции легочной системы, где раствор предназначен для пульмонального введения.
Также предложен способ пульмонального введения путем аэрозолизации водной композиции согласно первому варианту осуществления или второму варианту осуществления.
Все варианты осуществления и аспекты, касающиеся способа пульмонального введения согласно настоящему изобретению, аналогичным образом применимы для композиции и/или водного раствора для медицинского применения в соответствии с третьим вариантом осуществления изобретения.
Четвертый вариант осуществления изобретения относится к способу пульмонального введения пациенту, нуждающемуся в этом, который включает: приведение в действие ингалятора, содержащего узел распылительного сопла и картридж, включающий водный раствор, содержащий от 70 до 400 мг/мл сульфометилированного полимиксина; и введение этого водного раствора пациенту в виде капель, имеющих масс-медианный аэродинамический диаметр от 4 до 8 мкм.
В первом аспекте третьего и четвертого варианта осуществления концентрация сульфометилированного полимиксина составляет от 80 до 200 мг А/мл.
Во втором аспекте третьего и четвертого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 80 до 120 мг А/мл.
В третьем аспекте третьего и четвертого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 85 до 113 мг А/мл.
В четвертом аспекте третьего и четвертого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 100 до 120 мг А/мл.
В пятом аспекте третьего и четвертого варианта осуществления изобретения водный раствор содержит от 90 до 120 мг А/мл колистиметата натрия, и все концентрации, включенные в указанный диапазон, например, 90 мг А/мл, 94 мг А/мл, 95 мг А/мл, 100 мг А/мл, 110 мг А/мл, 112,5 мг А/мл, 115 мг А/мл.
В шестом аспекте третьего и четвертого варианта осуществления изобретения водный раствор содержит приемлемое количество посторонних веществ, как определено в соответствии с USP <1>.
В седьмом аспекте третьего и четвертого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>.
В восьмом аспекте третьего и четвертого варианта осуществления изобретения водный раствор имеет приемлемую прозрачность, как определено в соответствии с USP <1>.
В девятом аспекте третьего и четвертого варианта осуществления изобретения водный раствор имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 10 аспекте третьего и четвертого варианта осуществления изобретения водный раствор имеет приемлемое количество посторонних веществ, как определено в соответствии с USP <1>; имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 11 аспекте третьего и четвертого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>, имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 12 аспекте третьего и четвертого варианта осуществления изобретения водный раствор имеет pH от 6 до 8.
В 13 аспекте третьего и четвертого варианта осуществления изобретения картридж имеет номинальный объем 1,0 или 0,5 мл.
В 14 аспекте третьего и четвертого варианта осуществления изобретения водный раствор имеет осмоляльность от 500 мОсм/кг до 1300 мОсм/кг.
В 15 аспекте третьего и четвертого варианта осуществления изобретения водный раствор имеет осмоляльность от 700 мОсм/кг до 1200 мОсм/кг.
В 16 аспекте третьего и четвертого варианта осуществления изобретения водный раствор имеет осмоляльность от 900 мОсм/кг до 1200 мОсм/кг.
В 17 аспекте третьего и четвертого варианта осуществления изобретения сульфометилированный полимиксин представляет собой колистиметат натрия.
В 18 аспекте третьего и четвертого варианта осуществления изобретения узел распылительного сопла обеспечивает капли посредством рассеяния Релея.
В 19 аспекте третьего и четвертого варианта осуществления изобретения узел распылительного сопла имеет отверстия с диаметром от 1,5 до 2,2 мкм.
Все варианты осуществления и аспекты, касающиеся способа пульмонального введения конкретному пациенту, также относятся к группе пациентов в вариантах осуществления и аспектах, связанных с композицией и/или водным раствором для медицинского применения.
В 20 аспекте третьего и четвертого варианта осуществления изобретения пациент инфицирован грамотрицательными бактериями.
В 21 аспекте третьего и четвертого варианта осуществления изобретения пациент инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 22 аспекте третьего и четвертого варианта осуществления изобретения пациент страдает от хронического легочного расстройства и инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 23 аспекте третьего и четвертого варианта осуществления изобретения пациент страдает от хронического легочного расстройства, выбранного из астмы, муковисцидоза (МВ), бронхоэктаза, не связанного с муковисцидозом, и хронической обструктивной болезни легких или их комбинации, и инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 24 аспекте третьего и четвертого варианта осуществления изобретения устройство дополнительно содержит контейнер под давлением.
Пятый вариант осуществления изобретения относится к способу пульмонального введения пациенту, нуждающемуся в этом, который включает: приведение в действие ингалятора, содержащего узел распылительного сопла и картридж, включающий водный раствор, содержащий от 70 до 400 мг/мл колистиметата натрия; и введение этого водного раствора пациенту в виде капель, имеющих масс-медианный аэродинамический диаметр от 4 до 8 мкм.
В первом аспекте пятого варианта осуществления изобретения концентрация колистиметата натрия составляет от 80 до 200 мг А/мл.
Во втором аспекте пятого варианта осуществления изобретения концентрация колистиметата натрия составляет от 80 до 120 мг А/мл.
В третьем аспекте пятого варианта осуществления изобретения концентрация колистиметата натрия составляет от 85 до 113 мг А/мл.
В четвертом аспекте пятого варианта осуществления изобретения концентрация колистиметата натрия составляет от 100 до 120 мг А/мл.
В пятом аспекте пятого варианта осуществления изобретения водный раствор содержит от 90 до 120 мг А/мл колистиметата натрия, и все концентрации, включенные в указанный диапазон, например, 90 мг А/мл, 94 мг А/мл, 95 мг А/мл, 100 мг А/мл, 110 мг А/мл, 112,5 мг А/мл, 115 мг А/мл и 120 мг А/мл.
В шестом аспекте пятого варианта осуществления изобретения водный раствор содержит приемлемое количество посторонних веществ, как определено в соответствии с USP <1>.
В седьмом аспекте пятого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>.
В восьмом аспекте пятого варианта осуществления изобретения водный раствор имеет приемлемую прозрачность, как определено в соответствии с USP <1>.
В девятом аспекте пятого варианта осуществления изобретения водный раствор имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 10 аспекте пятого варианта осуществления изобретения водный раствор имеет приемлемое количество посторонних веществ, как определено в соответствии с USP <1>; имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 11 аспекте пятого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>, имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 12 аспекте пятого варианта осуществления изобретения водный раствор имеет pH от 6 до 8.
В 13 аспекте пятого варианта осуществления изобретения картридж имеет номинальный объем 1,0 или 0,5 мл.
В 14 аспекте пятого варианта осуществления изобретения водный раствор имеет осмоляльность от 500 мОсм/кг до 1300 мОсм/кг.
В 15 аспекте пятого варианта осуществления изобретения водный раствор имеет осмоляльность от 700 мОсм/кг до 1200 мОсм/кг.
В 16 аспекте пятого варианта осуществления изобретения водный раствор имеет осмоляльность от 900 мОсм/кг до 1200 мОсм/кг.
В 17 аспекте пятого варианта осуществления изобретения узел распылительного сопла обеспечивает капли посредством рассеяния Релея.
В 18 аспекте пятого варианта осуществления изобретения узел распылительного сопла имеет отверстия с диаметром от 1,5 до 2,2 мкм.
В 19 аспекте пятого варианта осуществления изобретения пациент инфицирован грамотрицательными бактериями.
В 20 аспекте пятого варианта осуществления изобретения пациент инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 21 аспекте пятого варианта осуществления изобретения пациент страдает от хронического легочного расстройства и инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 22 аспекте пятого варианта осуществления изобретения пациент страдает от хронического легочного расстройства, выбранного из астмы, муковисцидоза (МВ), бронхоэктаза, не связанного с муковисцидозом, и хронической обструктивной болезни легких или их комбинации, и инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 23 аспекте пятого варианта осуществления изобретения устройство дополнительно содержит контейнер под давлением.
Шестой вариант осуществления изобретения относится к способу пульмонального введения пациенту, нуждающемуся в этом, который включает: приведение в действие ингалятора, содержащего узел распылительного сопла и картридж, включающий водный раствор, содержащий от 70 до 400 мг/мл сульфометилированного полимиксина; и введение этого водного раствора пациенту в виде капель, имеющих масс-медианный аэродинамический диаметр от 5,5 до 7,5 мкм.
В первом аспекте шестого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 80 до 150 мг А/мл.
Во втором аспекте шестого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 85 до 150 мг А/мл.
В третьем аспекте шестого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 90 до 150 мг А/мл.
В четвертом аспекте шестого варианта осуществления изобретения концентрация сульфометилированного полимиксина составляет от 100 до 120 мг А/мл.
В пятом аспекте шестого варианта осуществления изобретения водный раствор содержит от 90 до 120 мг А/мл колистиметата натрия, и все концентрации, включенные в указанный диапазон, например, 90 мг А/мл, 94 мг А/мл, 95 мг А/мл, 100 мг А/мл, 110 мг А/мл, 112,5 мг А/мл, 115 мг А/мл и 120 мг А/мл.
В шестом аспекте шестого варианта осуществления изобретения водный раствор содержит приемлемое количество посторонних веществ, как определено в соответствии с USP <1>.
В седьмом аспекте шестого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>.
В восьмом аспекте шестого варианта осуществления изобретения водный раствор имеет приемлемую прозрачность, как определено в соответствии с USP <1>.
В девятом аспекте шестого варианта осуществления изобретения водный раствор имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 10 аспекте шестого варианта осуществления изобретения водный раствор имеет приемлемое количество посторонних веществ, как определено в соответствии с USP <1>; имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 11 аспекте шестого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>, имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 12 аспекте шестого варианта осуществления изобретения водный раствор имеет pH от 6 до 8.
В 13 аспекте шестого варианта осуществления изобретения картридж имеет номинальный объем 1,0 или 0,5 мл.
В 14 аспекте шестого варианта осуществления изобретения водный раствор имеет осмоляльность от 500 мОсм/кг до 1300 мОсм/кг.
В 15 аспекте шестого варианта осуществления изобретения водный раствор имеет осмоляльность от 700 мОсм/кг до 1200 мОсм/кг.
В 16 аспекте шестого варианта осуществления изобретения водный раствор имеет осмоляльность от 900 мОсм/кг до 1200 мОсм/кг.
В 17 аспекте шестого варианта осуществления изобретения сульфометилированный полимиксин представляет собой колистиметат натрия.
В 18 аспекте шестого варианта осуществления изобретения узел распылительного сопла обеспечивает капли посредством рассеяния Релея.
В 19 аспекте шестого варианта осуществления изобретения узел распылительного сопла имеет отверстие с диаметром от 1,5 до 2,2 мкм.
В 20 аспекте шестого варианта осуществления изобретения пациент инфицирован грамотрицательными бактериями.
В 21 аспекте шестого варианта осуществления изобретения пациент инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 22 аспекте шестого варианта осуществления изобретения пациент страдает от хронического легочного расстройства и инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 23 аспекте шестого варианта осуществления изобретения пациент страдает от хронического легочного расстройства, выбранного из астмы, муковисцидоза (МВ), бронхоэктаза, не связанного с муковисцидозом, и хронической обструктивной болезни легких или их комбинации, и инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию .
В 24 аспекте шестого варианта осуществления изобретения устройство дополнительно содержит контейнер под давлением.
Седьмой вариант осуществления изобретения относится к способу пульмонального введения пациенту, нуждающемуся в этом, который включает: приведение в действие ингалятора, содержащего узел распылительного сопла и картридж, включающий водный раствор, содержащий от 70 до 400 мг/мл колистиметата натрия; и введение этого водного раствора пациенту в виде капель, имеющих масс-медианный аэродинамический диаметр от 5,5 до 7,5 мкм.
В первом аспекте седьмого варианта осуществления изобретения концентрация колистиметата натрия составляет от 80 до 200 мг А/мл.
Во втором аспекте седьмого варианта осуществления изобретения концентрация колистиметата натрия составляет от 80 до 120 мг А/мл.
В третьем аспекте седьмого варианта осуществления изобретения концентрация колистиметата натрия составляет от 85 до 113 мг А/мл.
В четвертом аспекте седьмого варианта осуществления изобретения концентрация колистиметата натрия составляет от 100 до 120 мг А/мл.
В пятом аспекте седьмого варианта осуществления изобретения водный раствор содержит от 90 до 120 мг А/мл колистиметата натрия, и все концентрации, включенные в указанный диапазон, например, 90 мг А/мл, 94 мг А/мл, 95 мг А/мл, 100 мг А/мл, 110 мг А/мл, 112,5 мг А/мл, 115 мг А/мл и 120 мг А/мл.
В шестом аспекте седьмого варианта осуществления изобретения водный раствор содержит приемлемое количество посторонних веществ, как определено в соответствии с USP <1>.
В седьмом аспекте седьмого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>.
В восьмом аспекте седьмого варианта осуществления изобретения водный раствор имеет приемлемую прозрачность, как определено в соответствии с USP <1>.
В девятом аспекте седьмого варианта осуществления изобретения водный раствор имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 10 аспекте седьмого варианта осуществления изобретения водный раствор имеет приемлемое количество посторонних веществ, как определено в соответствии с USP <1>; имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 11 аспекте седьмого варианта осуществления изобретения водный раствор не содержит видимых частиц, как определено в соответствии с USP <1>, имеет приемлемую прозрачность, как определено в соответствии с USP <1>; и имеет мутность не более 3 НЕМ, как определено в соответствии с Ph. Eur. 2.2.1.
В 12 аспекте седьмого варианта осуществления изобретения водный раствор имеет pH от 6 до 8.
В 13 аспекте седьмого варианта осуществления изобретения картридж имеет номинальный объем 1,0 или 0,5 мл.
В 14 аспекте седьмого варианта осуществления изобретения водный раствор имеет осмоляльность от 500 мОсм/кг до 1300 мОсм/кг.
В 15 аспекте седьмого варианта осуществления изобретения водный раствор имеет осмоляльность от 700 мОсм/кг до 1200 мОсм/кг.
В 16 аспекте седьмого варианта осуществления изобретения водный раствор имеет осмоляльность от 900 мОсм/кг до 1200 мОсм/кг.
В 17 аспекте седьмого варианта осуществления изобретения узел распылительного сопла обеспечивает капли посредством рассеяния Релея.
В 18 аспекте седьмого варианта осуществления изобретения узел распылительного сопла имеет отверстие с диаметром от 1,5 до 2,2 мкм.
В 19 аспекте седьмого варианта осуществления изобретения пациент инфицирован грамотрицательными бактериями.
В 20 аспекте седьмого варианта осуществления изобретения пациент инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 21 аспекте седьмого варианта осуществления изобретения пациент страдает от хронического легочного расстройства и инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 22 аспекте седьмого варианта осуществления изобретения пациент страдает от хронического легочного расстройства, выбранного из астмы, муковисцидоза (МВ), бронхоэктаза, не связанного с муковисцидозом, и хронической обструктивной болезни легких или их комбинации, и инфицирован грамотрицательными бактериями, и грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинацию.
В 23 аспекте седьмого варианта осуществления изобретения устройство дополнительно содержит контейнер под давлением.
В отношении четвертого, пятого, шестого и седьмого вариантов осуществления изобретения, и по меньшей мере одного из аспектов этих вариантов осуществления изобретения приведение в действие может быть выполнено либо (i) путем использования сенсоров дыхания, таким образом, путем «ингаляции, приводимой в действие дыханием»; либо (ii) вручную, во время, когда пациенты выполняют одно вдыхание, таким образом, путем «скоординированной ингаляции».
Для облегчения или предотвращения засорения сопла можно установить сито. Например, сито на 1 мкм будет удерживать частицы, присутствующие либо в водном растворе сульфометилированного полимиксина, либо в растворе колистиметата натрия, для предотвращения снижения производительности ингалятора с течением времени. Снижение температуры может также уменьшить засорение во время использования. Если устройство в соответствии с первым или вторым вариантом осуществления хранится между введением доз, например, между утренней дозой и вечерней дозой, температура хранения будет предпочтительно ниже 20°С. Что касается проблем засорения, температура хранения 2-8°С может быть более предпочтительной.
Отдельное техническое решение проблемы разрушения CMS в водном растворе направлено на устройство пульмонального введения, содержащее узел распылительного сопла и двухкамерный картридж, включающий порошок колистиметата натрия и водный разбавитель, который при смешивании обеспечивает водный раствор, содержащий от 20 до 75 мг А/мл колистиметата натрия. Такие двухкамерные картриджи могут быть выполнены, как описано в US5549561 или US2011/0094188.
Примеры
Следующие примеры служат для облегчения лучшего понимания предмета, раскрытого в данном документе, без ограничения этими примерами.
Пример 1
Три водных раствора, содержащих колистиметат натрия (CMS) в трех различных концентрациях (37,5 мг А/мл, 75 мг А/мл и 112,5 мг А/мл) хранили в герметичных контейнерах в течение 1-недельного периода времени.
ВЭЖХ-хроматографический профиль (данные не показаны) продемонстрировал разрушение в водном растворе, содержащем 37,5 мг А/мл CMS, но никакого существенного разрушения в водном растворе, содержащем 75 мг А/мл CMS или 112,5 мг А/мл CMS.
Проверяли несколько параметров вышеуказанных композиций в течение указанного периода времени при температурах (5°С (данные не показаны), 25°С, 30°С и 40°С), которые включают в себя, но не ограничиваются ими: внешний вид, посторонние вещества (USP <1>, наличие видимых частиц («VP») является неудовлетворительным), прозрачность раствора (USP <1>, отсутствие прозрачности приводит к неудовлетворительному качеству), количество частиц, невидимых невооружённым глазом (как ≤ 10 мкм, так и ≤ 25 мкм, USP <788>), рН (USP <791>), осмоляльность (USP <785>) и мутность (Ph. Eur. 2.2.1). Результаты этих наблюдений представлены в таблице 2.
Таблица 2.
Описание и условные обозначения
a Раствор от бесцветного до слегка желтого, b Не содержит видимых частиц, с Раствор не является существенно менее прозрачным, чем равный объем очищенной воды, содержащейся в аналогичном сосуде и исследуемой аналогичным образом, d Количество частиц, невидимых невооружённым глазом (PN), e Не более, чем ("NMT") 3000/мл, f Не более, чем 300/мл, g Не более, чем 3 НЕМ, h Слегка желтый раствор (SYS), i Видимые частицы (VP), j Соответствует (C), k Непрозрачный (NC).
Исходя из этих данных, можно видеть, что водный раствор, имеющий концентрацию менее 80 мг A/мл CMS, содержит недопустимое количество посторонних веществ, недопустимую прозрачность и/или мутность, и, таким образом, не может быть пригоден для длительного хранения в виде готовой к применению композиции, например, в виде парентерального, назального и ингаляционного раствора. Его следует сопоставить с водным раствором, имеющим концентрацию больше или равную 80 мг А/мл CMS, который показал приемлемое количество посторонних веществ, прозрачность и мутность. Исследования стабильности были расширены на период до 3-х месяцев. Результаты этих исследований (25°C) приведены в таблице 3.
Таблица 3
ностьc
ность (Осм/кг)
Описание и условные обозначения
a Раствор от бесцветного до слегка желтого, b Не содержит видимых частиц, с Раствор не является существенно менее прозрачным, чем равный объем очищенной воды, содержащейся в аналогичном сосуде и исследуемой аналогичным образом, d Количество частиц, невидимых невооружённым глазом (PN), меньше или равно указанному значению, e Не более, чем ("NMT") 3000/мл, f Не более, чем 300/мл, g Не более, чем 3 НЕМ, h Слегка желтый раствор (SYS), i Видимые частицы (VP), j Соответствует (C), k Непрозрачный (NC), l 3 из 5 флаконов показали отсутствие частиц, а в 2 флаконах наблюдалось то, что является ростом микробов.
Результаты, приведенные в этой таблице, подтверждают, что водный раствор, имеющий концентрацию менее 75 мг А/мл CMS, не может быть пригодным для длительного хранения в качестве готовой к применению композиции, а водный раствор, имеющий концентрацию более 80 мг А/мл CMS, может подходить для длительного хранения в виде готовой к применению композиции, и, таким образом, может быть использован в картридже, подходящем для парентерального, назального, ингаляционного применения.
Как было указано выше, инструкция для применения парентерального лекарственного продукта Coly-Mycin® M утверждает, что «[парентеральные препараты должны проверяться визуально на предмет твердых частиц и обесцвечивания перед введением, когда раствор и контейнер позволяют это сделать», и что «если наблюдаются эти явления, продукт не должен использоваться".
Соответственно, неожиданный и удивительный результат вариантов осуществления изобретения, описанных в настоящем документе, заключается в том, что водный раствор не содержит видимых частиц, как определено согласно USP <1>, имеет приемлемую прозрачность, как определено согласно USP <1>; и имеет мутность не более 3 НЕМ, как определено согласно Ph. Eur. 2.2.1.
Пример 2
Водные растворы, содержащие 94 мг A/мл колистиметата натрия (CMS), хранили в герметичных контейнерах в течение 1 месяца при различных температурах (5°C, 25°C, 30°C и 40°C). ВЭЖХ-хроматографический профиль (данные не показаны) не показал никаких существенных изменений. Проверяли несколько параметров описанной выше композиции в течение 1-месячного периода времени, результаты приведены в таблице 4.
Таблица 4.
Описание и условные обозначения
a Раствор от бесцветного до слегка желтого, b Не содержит видимых частиц, с Раствор не является существенно менее прозрачным, чем равный объем очищенной воды, содержащейся в аналогичном сосуде и исследуемой аналогичным образом, d Количество частиц, невидимых невооружённым глазом (PN), e Не более, чем ("NMT") 3000/мл, f Не более, чем 300/мл, g Не более, чем 3 НЕМ, h Слегка желтый раствор (SYS), i Видимые частицы (VP), j Соответствует (C), k Непрозрачный (NC).
Результаты, приведенные в этой таблице, подтверждают, что композиция, имеющая концентрацию, большую или равную 80 мг A/мл CMS, может быть пригодной для длительного хранения в виде готовой к применению композиции. Проверка водных растворов, содержащих 112 мг А/мл колистиметата натрия (CMS) (данные не показаны), подтверждает, что композиция, имеющая концентрацию более 80 мг А/мл CMS, может быть пригодна для долгосрочного хранения в виде композиции, готовой к применению.
Пример 3
Значения вязкости для композиций, содержащих CMS в различных композициях, измеряли при 25°С, и полученные результаты приведены в таблице 5.
Таблица 5
(мг А/мл)
(сСт)
Зависимость значений вязкости (η) от значений концентрации (с) показала, что квадратичное соотношение (η = Ac2 + Be + C) имеет хорошее соответствие (R2 равно 0,9901), где А равно 0,0002, В равно 0,0003 и С равно 0,9642.
С учетом функциональной зависимости, представленной выше, дополнительный аспект первого и второго вариантов осуществления изобретения относится к композиции, содержащей сульфометилированный полимиксин, имеющей значение вязкости, как определенно в вышеупомянутом квадратичном выражении.
Примеры 4 и 5 демонстрируют, как испытывали две композиции CMS на импакторе нового поколения (NGI). Одна из них содержала 20% масс./об. CMS (85 мг A/мл), а другая - 26,4 масс./об. CMS (112,5 мг A/мл). Обе давали хорошие аэрозоли и были бы полезны в ингаляционной терапии инфекций легких. Поток воздуха, используемый в испытании, составлял 15 л/мин. MMAD варьировал приблизительно от 60,5 до 8 мкм, а масса тонкодисперсных частиц (FPM) составляла приблизительно от 4 до 6 мг CMS на одну ингаляцию (50 микролитров). Считают, что FPM является частью аэрозоля, которая потенциально может достигать легких. Она является фракцией, способной депонироваться в легких; обычно 2-7 ступеней.
Лечение может состоять из 1-10 ингаляций 1-2 раза в день.
Анализ на NGI ясно показывает, что водный дозирующий ингалятор является предпочтительным ингаляционным устройством и единственным типом устройства, способным использовать предпочтительный контейнер для высококонцентрированных растворов CMS. Потенциальной выгодой от использования раствора является лучшая переносимость вдыхаемого раствора по сравнению с вдыханием сухих порошков, которые обычно провоцируют кашель.
Выполняли заводские приемочные испытания (FAT) с использованием универсального индукционного порта (UPI), который имитирует горло в стандарте при измерениях NGI.
NGI имеет семь ступеней и микродиафрагменный сборник (МОС, от англ. micro-orifice collector). При объемной скорости потока 60 л/мин точками отсечки для ступеней 1-7 являются 8,06, 4,46, 2,82, 1,66, 0,94, 0,55 и 0,34 мкм соответственно. При скорости потока 15 литров в минуту они немного отличаются.
Пример 4
Водный раствор, содержащий 20% масс./об. (85 мг А/мл) колистиметата натрия (CMS), превращали в аэрозоль с помощью водного дозирующего ингалятора, содержащего узел распылительного сопла, имеющего диаметр отверстия 1,8 мкм и источник питания на 35 бар (3500000 Па). Поток воздуха составлял 15 л/мин.
Изображение интервала для композиции Примера 4 представлено на фиг. 1. Там можно видеть, что MMAD для композиции составляет 6,6 мкм с соответствующим разбросом эксперимента. Массовое количество композиции Примера 4, доставленное за одну ступень, включая универсальный индукционный порт ("UIP"), представлено на фиг. 2. Количество, доставленное в течение каждой ступени, представлено в следующей таблице.
Из этих данных можно заметить, что максимальное количество CMS доставляется на третьей ступени. График зависимости суммарной массы (%) от аэродинамического диаметра (в мкм) для композиции Примера представлен на фиг. 3.
Пример 5
Водный раствор, содержащий 26% масс./об. (112,5 мг А/мл) колистиметата натрия (CMS), превращали в аэрозоль с помощью двух различных водных дозирующих ингаляторов, содержащих узел распылительного сопла, имеющего диаметр отверстия примерно 1,9 мкм и источники питания на 43,8 бара (4380000 Па) и 34,5 бара (3450000 Па) соответственно. Поток воздуха составлял 15 л/мин.
Изображение интервалов масс-медианного аэродинамического диаметра (мкм) композиции Примера 5 при двух различных давлениях представлено на фиг. 4.
Изображение интервала UIP (%) для двух различных давлений для композиции Примера 5 представлено на фиг. 5.
Массовое количество композиции Примера 5 на одну ступень для двух давлений представлено на фиг. 6.
График зависимости суммарной массы (%) от аэродинамического диаметра для композиции Примера 5 при двух различных давлениях представлен на фиг. 7.
Пример 6
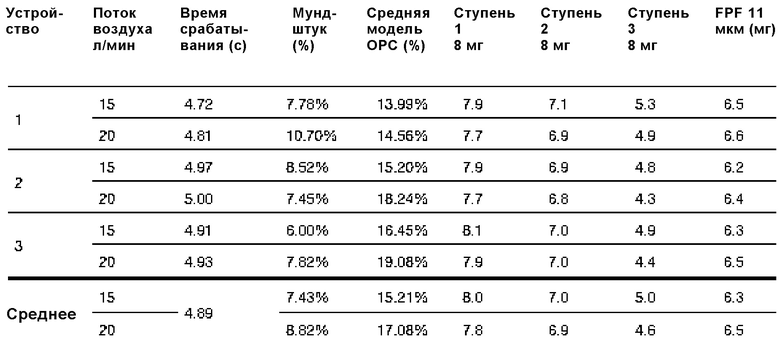
Два водных раствора, содержащих 85 мг А/мл и 94 мг А/мл колистиметата натрия (CMS), превращали в аэрозоль с помощью водного дозирующего ингалятора, содержащего узел распылительного сопла, имеющего диаметр отверстия примерно 1,8 мкм, источник питания на 38 бар (3800000 Па) и сито на 2 мкм.
Время срабатывания, осаждение на мундштуке, фракцию тонкодисперсных частиц и т.д. измеряли, как показано в следующих таблицах.
85 мг A/мл CMS:
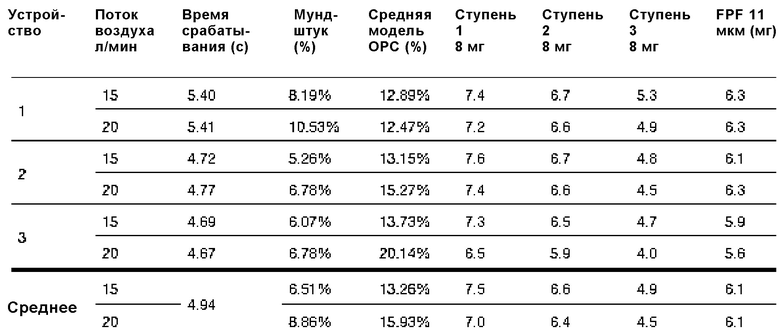
94 мг A/мл CMS:
На фиг. 8 представлено изображение интервала масс-медианного аэродинамического диаметра (мкм) для композиций Примера 6 при двух различных давлениях.
Пример 7
Водный раствор, содержащий 94 мг А/мл колистиметата натрия (CMS), превращали в аэрозоль с помощью водного дозирующего ингалятора, содержащего узел распылительного сопла, имеющего диаметр отверстия примерно 1,9 мкм, источник питания примерно на 38 бар (3800000 Па) и сито на 2 мкм.
Время срабатывания, осаждение на мундштуке, фракцию тонкодисперсных частиц и т.д. измеряли после 10 срабатываний с последующим хранением в течение приблизительно 17 часов перед следующими 10 срабатываниями, как показано в следующей таблице.
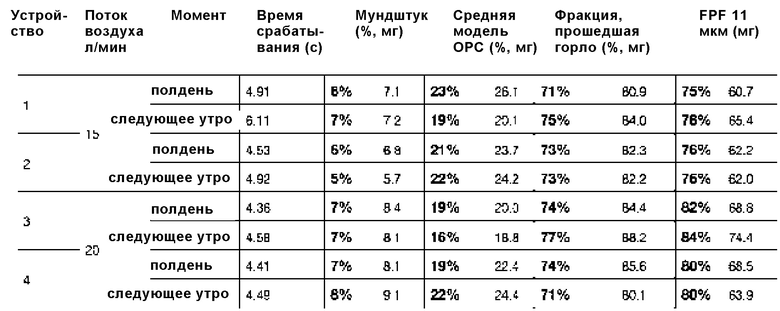
На фиг. 9 показано, как увеличивается время срабатывания при использовании и через 17 часов хранения при комнатной температуре для устройства 4. На фиг. 10 показаны MMAD при использовании устройств 3 и 4. На фиг. 11 показаны FPF при использовании.
Хотя считают, что в настоящем документе представлено полное и детальное описание, некоторые патентные и непатентные ссылки, в том числе упомянутые выше статьи USP и Ph. Eur., могут включать в себя некоторый существенный предмет обсуждения. В той степени, в какой эти патентные и непатентные ссылки описывают существенный предмет обсуждения, эти ссылки включены в данное описание посредством ссылки во всей их полноте. Следует понимать, что содержание включенного предмета обсуждения подчинено содержанию предмета обсуждения, раскрытого в данном документе.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ | 2015 |
|
RU2712276C2 |
| ПРОИЗВОДНЫЕ ПОЛИМИКСИНА С КОРОТКОЦЕПОЧЕЧНЫМ ЖИРНОКИСЛОТНЫМ ХВОСТОМ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2492179C2 |
| МИКРОНИЗИРОВАННЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2014 |
|
RU2659385C2 |
| ПРОИЗВОДНЫЕ ПОЛИМИКСИНА И ИХ ПРИМЕНЕНИЕ В КОМБИНИРОВАННОЙ ТЕРАПИИ СОВМЕСТНО С РАЗЛИЧНЫМИ АНТИБИОТИКАМИ | 2014 |
|
RU2730012C2 |
| КОНЦЕНТРИРОВАННЫЕ БЕЛКОВЫЕ ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2626512C2 |
| ПЕПТИДНЫЕ АНТИБИОТИКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2428429C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНАКИНРУ | 2016 |
|
RU2728795C2 |
| ПРОИЗВОДНЫЕ ПОЛИМИКСИНА И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2675819C1 |
| ПРОИЗВОДНЫЕ ПОЛИМИКСИНА И ИХ ПРИМЕНЕНИЕ В КОМБИНИРОВАННОЙ ТЕРАПИИ СОВМЕСТНО С РАЗЛИЧНЫМИ АНТИБИОТИКАМИ | 2015 |
|
RU2740190C2 |
| Композиция, содержащая высококонцентрированный ингибитор альфа-1-протеиназы, и способ ее приготовления | 2019 |
|
RU2813136C1 |



Группа изобретений относится к области фармацевтики и может быть использована в терапии бактериальной инфекции легких. Для этого используют устройство для пульмонального введения, содержащее узел распылительного сопла и картридж, включающий водный раствор, содержащий от 80 до 400 мг А/мл сульфометилированного полимиксина. Группа изобретений относится также к водному раствору, содержащему от 80 до 400 мг А/мл сульфометилированного полимиксина, и способам пульмонального введения указанного раствора пациенту, нуждающемуся в этом, для лечения бактериальной инфекции легочной системы. Группа изобретений обеспечивает получение раствора с высокой концентрацией сульфометилированного полимиксина, сохраняющего стабильность при комнатной температуре в течение длительного времени. 5 н. и 25 з.п. ф-лы, 12 ил., 8 табл., 7 пр.
1. Устройство для пульмонального введения, содержащее узел распылительного сопла и картридж, включающий водный раствор, содержащий от 80 до 400 мг А/мл сульфометилированного полимиксина.
2. Устройство по п. 1, где сульфометилированный полимиксин представляет собой колистиметат натрия.
3. Устройство по п. 1 или 2, где концентрация сульфометилированного полимиксина составляет от 80 до 200 мг А/мл.
4. Устройство по п. 2, где концентрация колистиметата натрия составляет от 80 до 120 мг А/мл.
5. Устройство по п. 2, где концентрация колистиметата натрия составляет от 85 до 113 мг А/мл.
6. Устройство по любому из пп. 2-5, где водный раствор имеет рН от 6 до 8.
7. Устройство по любому из пп. 2-5, где водный раствор имеет осмоляльность от 500 до 1300 мОсм/кг.
8. Устройство по любому из пп. 2-5, где водный раствор имеет осмоляльность от 700 до 1200 мОсм/кг.
9. Устройство по любому из пп. 2-5, где водный раствор имеет осмоляльность от 900 до 1200 мОсм/кг.
10. Водный раствор, содержащий от 80 до 400 мг А/мл сульфометилированного полимиксина, для лечения бактериальной инфекции легочной системы, где раствор предназначен для пульмонального введения.
11. Раствор для применения по п. 10, где сульфометилированный полимиксин представляет собой колистиметат натрия.
12. Раствор для применения по п. 10 или 11, где концентрация сульфометилированного полимиксина составляет от 90 до 150 мг А/мл.
13. Раствор для применения по п. 11, где концентрация колистиметата натрия составляет от 90 до 110 мг А/мл.
14. Раствор для применения по п. 11, где концентрация колистиметата натрия составляет от 90 до 100 мг А/мл.
15. Раствор для применения по п. 11, где водный раствор имеет рН от 6 до 8.
16. Раствор для применения по любому из пп. 11-15, где водный раствор имеет осмоляльность от 500 до 1300 мОсм/кг.
17. Раствор для применения по любому из пп. 11-15, где водный раствор имеет осмоляльность от 700 мОсм/кг до 1200 мОсм/кг.
18. Раствор для применения по любому из пп. 11-15, где водный раствор имеет осмоляльность от 900 до 1200 мОсм/кг.
19. Способ пульмонального введения сульфометилированного полимиксина пациенту, нуждающемуся в этом, включающий:
приведение в действие ингалятора, содержащего узел распылительного сопла и картридж, включающий водный раствор, содержащий от 80 до 400 мг А/мл сульфометилированного полимиксина; и
введение этого водного раствора пациенту в виде капель, имеющих масс-медианный аэродинамический диаметр от 4 до 8 мкм.
20. Способ пульмонального введения сульфометилированного полимиксина пациенту, нуждающемуся в этом, включающий:
приведение в действие ингалятора, содержащего узел распылительного сопла и картридж, включающий водный раствор, содержащий от 80 до 400 мг А/мл сульфометилированного полимиксина; и
введение этого водного раствора пациенту в виде капель, имеющих масс-медианный аэродинамический диаметр от 5,5 до 7,5 мкм.
21. Способ по п. 19 или 20, где сульфометилированный полимиксин представляет собой колистиметат натрия.
22. Способ по п. 19 или 20, где узел распылительного сопла имеет отверстия с диаметром от 1,5 до 2,2 мкм.
23. Способ по п. 19 или 20, где пациент инфицирован грамотрицательными бактериями.
24. Способ по п. 21, где водный раствор содержит от 80 до 120 мг А/мл колистиметата натрия.
25. Способ по п. 24, где водный раствор содержит от 85 до 113 мг А/мл колистиметата натрия.
26. Способ по п. 23, где грамотрицательные бактерии представляют собой Enterobacter aerogenes, Escherichia coli, Klebsiella pneumonaiae, Pseudomonas aeruginosa или их комбинации.
27. Способ по п. 24, где пациент страдает от хронического легочного расстройства.
28. Способ по п. 27, где хроническое легочное расстройство выбирают из астмы, муковисцидоза (MB), бронхоэктаза, не связанного с муковисцидозом, хронической обструктивной болезни легких или их комбинации.
29. Способ по п. 19, где устройство хранят при температуре 2-8°С, когда оно не используется.
30. Способ пульмонального введения сульфометилированного полимиксина пациенту, нуждающемуся в этом, включающий:
приведение в действие ингалятора, содержащего узел распылительного сопла, имеющего отверстие диаметром 1,7-2,0 мкм, и картридж, включающий водный раствор, содержащий от 90 до 100 мг А/мл колистиметата натрия; и
введение этого водного раствора пациенту в виде капель, имеющих масс-медианный аэродинамический диаметр от 4 до 8 мкм, со скоростью воздушного потока 15-20 л/мин.
| WO 2008025560 A1, 06.03.2008 | |||
| WO 1998020836 A2, 22.05.1998 | |||
| KAMIN WOLFGANG et al | |||
| Inhalation solutions: Which one are allowed to be mixed? Physico-chemical compatibility of drug solutions in nebulizers, Journal of Cystic Fibrosis, vol.5, 2006, pp.205-213. |
Авторы
Даты
2019-10-08—Публикация
2015-10-01—Подача