РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет и преимущества заявки на патент Великобритании GB 1309248.1, поданной 22 мая 2013 (22/05/2013) и заявки GB 1404301.2, поданной 11 марта 2014 (11/03/2014), содержание каждой из которых полностью включено в настоящий документ посредством ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым соединениям, комбинациям соединений согласно настоящему изобретению, фармацевтическим композициям, содержащим соединения и к применению соединений, фармацевтических композиций и комбинаций для лечения, например, лечения микробных инфекций, в частности, вызванных грамотрицательными бактериями.
УРОВЕНЬ ТЕХНИКИ
У восприимчивых индивидуумов некоторые грамотрицательные бактерии, такие как Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa и Acinetobacter baumanii могут вызвать тяжелые инфекции, такие как пневмония, инфекции мочеполовых путей, инфекции кожи и подкожных структур, такие как раневые инфекции, инфекции уха, инфекции глаз, интраабдоминальные инфекции, избыточный рост бактерий в желудочно-кишечном тракте и бактериемия/сепсис. Лечение тяжелых бактериальных инфекций в клинической практике может затрудняться резистентностью к антибиотикам. В последние годы увеличилось число инфекций, вызванных грамотрицательными бактериями, резистентными ко многим типам противомикробных средств, включая антибиотики широкого спектра действия, такие как аминогликозиды, цефалоспорины и даже карбапенемы. Соответственно, существует потребность в идентификации новых противомикробных средств, эффективных в отношении грамотрицательных бактерий, в частности, против мультирезистентных грамотрицательных бактерий.
Полимиксины представляют собой класс антибиотиков, продуцируемых грамположительной бактерией Bacillus polymyxa. Обнаруженные впервые в 1940х годах, полимиксины, в частности полимиксин В и полимиксин Е (колистин, обычно в форме пролекарства колистин метансульфоната), применяли в лечении грамотрицательных инфекций. Однако у этих антибиотиков наблюдались побочные эффекты, такие как нейротоксичность и нефротоксичность. Тем не менее, в настоящее время полимиксины играют важную роль в лечении мультирезистентных грамотрицательных инфекций ввиду отсутствия реальных альтернатив. Однако их применение ограничено применением в качестве крайней меры лечения (терапии отчаяния).
Публикация WO 2008/017734 посвящена попытке решить указанную проблему токсичности за счет новых производных полимиксина, несущих по меньшей мере два, но не более трех положительных зарядов. Говорится, что эти соединения являются эффективными противомикробными агентами с пониженной токсичностью. В описании высказано предположение, что уменьшенное число положительных зарядов снижает сродство соединения к такни изолированной почки крысы, что, в свою очередь, может приводить к снижению нефротоксичности.
Также раскрыто несколько производных полимиксина, лишенных ацильной цепи жирной кислоты, характеризующихся сниженной токсичностью у мышей, в то же время сохранявших хорошую активность против псевдомонад (Katsuma et al. Chem. Pharm. Bull. 2009; 57, 332-336; Sato et al. Chem. Pharm. Bull. 2011; 59, 597-602). Активность этих соединений в отношении Е. coli и К. pneumoniae была значительно ниже, чем активность полимиксина В.
В публикации WO 2010/075416 декапептиды полимиксина с присоединенным через мочевину арилом, включая СВ182,804, о котором сообщается, что он обладает активностью, сравнимой с полимиксином В, но более низкой токсичностью для почек. Фенилциклопропановые производные полимиксина описаны также в патенте США US 8,415,307. Показано, что эти соединения обладают активностью, сравнимой с полимиксином В, или более низкой активностью.
В публикации WO 2012/168820 предложен другой ряд производных полимиксина, о которых сообщается, что они обладают более низкой токсичностью и в некоторых случаях более высокой активностью, по сравнению с полимиксином В; в этих производных диаминобутиратная группа в положении 3 в трипептидной боковой цепи заменена на диаминопротионатную группировку.
Антибиотики часто применяют в комбинации для лечения инфекций по ряду причин:
- Для расширения спектра патогенов в эмпирической терапии или при лечении смешанных инфекций;
- Для повышения эффективности в тех случаях, когда активность комбинации выше, чем у одного из антибиотиков по отдельности (аддитивный эффект) или выше, чем можно было бы ожидать на основании простого суммирования активностей двух антибиотиков (синергетический эффект)
- для подавления развития резистентности
На практике в клинике полимиксины иногда применяют в комбинации с другими антибиотиками (такими как рифампицин, карбапенемы, аминогликозиды или хинолоны) для лечения тяжелых инфекций по всем указанным причинам. Были проведены многочисленные исследования эффективности комбинаций полимиксинов с антибиотиками на микроорганизмах и животных (Petrosillo et al. Clin. Microbiol. Infect. 2008; 14, 816-827). Также доступны комбинации полимиксинов, например, с неомицином и бацитрацином для топического применения. Полимиксины воздействуют на внешнюю мембрану грамотрицательных бактерий и, как считается, облегчают проникновение внутрь антибиотиков с более низкой способностью к переходу через барьер внешней мембраны, и, за счет этого повышают их активность.
Помимо применения полимиксинов как таковых в комбинации, сообщалось, что производные полимиксина, лишенные ацилирования жирными кислотами, такие как нонапептидный полимиксин В (PMBN), хотя и не обладают очень высокой антибактериальной активностью, все же способны повышать активность антибиотиков, поступление которых в клетку затрудняется внешней мембраной (Vaara et al. Microbiol. Rev. 1992; 56, 395-411). PMBN обладает пониженной острой токсичностью по сравнению с самим полимиксином, хотя остается неясным, снижается ли почечная токсичность.
Можно было предположить, что применение менее токсичных «пермеабилизаторов» в комбинации со вторым антибиотиком обеспечит возможность получения терапевтических препаратов, обладающих более высокой активностью и сниженной токсичностью.
Несмотря на то, что этот подход исследовался в течение нескольких лет, такие препараты не были внедрены в медицинскую практику, поскольку они не дают достаточных преимуществ по сравнению с доступными терапевтическими средствами. Следует отметить, что их активность часто не достигает уровня аналогичных комбинаций полимиксин-антибиотик.
Соединения, описанные в WO 2008/017734, были протестированы в комбинации с рифампицином, кларитромицин и другими антибиотиками и продемонстрировали некоторую синергетическую активность.
В публикации WO 2009/098357 предложены производные полимиксина, имеющие не более трех положительных зарядов, подобно соединениям, описанным в WO2008/017734, но с короткими ацильными цепями. Эти производные обладают слабой собственной противомикробной активностью, но способны потенцировать активность других агентов.
СВ-182,804 в присутствии рифампицина демонстрирует значения МЮ8оВ отношении штаммов Е. coli и К. pneumoniae, эквивалентные этому показателю для полимиксина В с рифампицином, но это соединение не настолько эффективно в отношении штаммов А. baumanii или P. aeruginosa (Quale et al. Microb. Drug Resist. 2012; 18, 132-136).
Сообщения об активности лишенных ацилирования жирной кислотой производных, описанных Katsuma с соавт. и Sato с соавт., отсутствуют, как и для соединений, описанных в документах WO 2012/168820 и US 8,415,307.
Сохраняется потребность в менее токсичных производных полимиксина, обладающих высокой потенцирующей активностью в отношении других антибиотиков, и в комбинациях таких агентов с антибиотиками-партнерами, которые обеспечили бы терапевтические препараты со стабильно высокой активностью против спектра патогенов-мишеней. Такие соединения должны дополнительно характеризоваться приемлемой токсичностью.
Авторы настоящего изобретения ранее описали в заявках PCT/GB 2012/052844, TW 101142961 и GCC 2012/22819, содержание каждой из которых полностью включено в настоящий документ, полимиксины для применения в лечении микробных инфекций.
Авторы настоящего изобретения неожиданно обнаружили несколько производных полимиксина, которые обладают пониженной токсичностью по сравнению с полимиксином и колистином и особенно эффективны в потенцировании активности антибиотиков, таких как рифампицин, и в некоторых случаях обеспечивают повышение эффективности in vitro по сравнению с комбинацией полимиксин: антибиотик. Соответственно, комбинации, содержащие эти агенты, обеспечивают терапевтические альтернативы со стабильно высокой активностью, и при этом более низкой, чем у доступных в настоящее время терапевтических средств, токсичностью.
Сущность изобретения
В общем аспекте настоящего изобретения предложен полимиксин Формулы (I), описанный в настоящем документе, и его применение в способе лечения или профилактики, в комбинации со вторым агентом (который может называться активным агентом). Соединения Формулы (I) могут применяться для лечения микробной инфекции, такой как инфекция, вызванная грамотрицательными бактериями.
В первом аспекте настоящего изобретения предложен полимиксин Формулы (I) для применения в способе лечения или профилактики, в комбинации с активным агентом, причем активный агент выбран из группы, состоящей из:
рифампицина, рифабутина, рифалазила, рифапентина и рифаксимина;
оксациллина, метициллина, ампициллина, клоксациллина, карбенициллина, пиперациллина, трикарциллина, флюклоксациллина нафциллина;
азитромицина, клэритромицина, эритромицина, телитромицина, цетромицина и солитромицина;
азтреонама и BAL30072;
меропенема, дорипенема, имипенема, эртапенема, биапенема, томопенема и панипенема;
тигециклина, омадациклина, эравациклина, доксициклина и миноциклина;
ципрофлоксацина, левофлоксацина, моксифлоксацина и делофлоксацина; фузидовой кислоты;
новобиоцина;
тейхопланина, телаванцина, далбаванцина и оритаванцина, и их фармацевтически приемлемых солей и сольватов;
Во втором аспекте предложен активный агент, определенный в первом аспекте, для применения в способе лечения или профилактики, в комбинации с полимиксином Формулы (I).
В третьем аспекте предложена комбинация полимиксина Формулы (I) и активного агента, определенного в первом аспекте, для применения в способе лечения или профилактики.
В четвертом аспекте предложен полимиксин Формулы (I) для применения в способе лечения или профилактики микробной инфекции, в комбинации с активным агентом, определенном в первом аспекте.
В пятом аспекте предложен активный агент, определенный в первом аспекте, для применения в способе лечения или профилактики микробной инфекции, в комбинации с полимиксином Формулы (I).
В шестом аспекте предложен способ лечения или профилактики, включающий этап введения нуждающемуся в этом субъекту полимиксина Формулы (I) и активного агента, определенного в первом аспекте.
В седьмом аспекте предложен способ лечения или профилактики микробной инфекции, включающий этап введения нуждающемуся в этом субъекту полимиксина Формулы (I) и активного агента, определенного в первом аспекте.
В восьмом аспекте предложено применение полимиксина Формулы (I) в изготовлении лекарственного средства для применения в лечении микробной инфекции в комбинации с активным агентом, определенном в первом аспекте.
В девятом аспекте предложено применение активного агента, определенного в первом аспекте, в изготовлении лекарственного средства для применения в лечении микробной инфекции в комбинации с полимиксином Формулы (I).
В дальнейшем аспекте предложена фармацевтическая композиция, содержащая соединение Формулы (I) вместе со вторым активным агентом, определенном в первом аспекте, и биологически приемлемое вспомогательное вещество. Далее, также предложен набор, содержащий соединение Формулы (I) и содержащий второй активный агент, определенный в первом аспекте. Соединение Формулы (I) и второй активный агент могут быть представлены в наборе раздельно.
В другом аспекте изобретения предложено соединение Формулы (II). Соединения Формулы (II) представляют собой подмножество полимиксинов Формулы (I). Соответственно, соединения Формулы (II) предусмотрены в аспектах, описанных выше для соединения Формулы (I).
Согласно настоящему изобретению также предложена фармацевтическая композиция, содержащая соединение Формулы (II) и биологически приемлемое вспомогательное вещество, необязательно вместе со вторым активным агентом.
В другом аспекте предложено соединение Формулы (II) или фармацевтическая композиция, содержащая соединения Формулы (II) для применения в способе лечения.
Согласно настоящему изобретению дополнительно предложено соединение Формулы (II) или фармацевтическая композиция, содержащая соединение Формулы (II), для применения в способе лечения микробной инфекции, такой как инфекция, вызванная грамотрицательными бактериями.
Согласно настоящему изобретению также предложен способ идентификации полезных для терапии комбинаций, включающий исследование комбинации соединения Формулы (I) или (II) с биологически активным соединением и определение биологической активности этой комбинации, по сравнению с указанным биологически активным соединением отдельно и/или с соединением Формулы (I) или (II) отдельно.
В альтернативном аспекте соединения Формулы (I) и (II) подходят для применения в лечении грибковых инфекций, например, в комбинации с противогрибковым агентом.
В другом аспекте изобретения предложено соединение Формулы (I).
Другие аспекты настоящего изобретения подробно обсуждаются ниже.
Описание фигур
На Фигуре 1 показана концентрация N-ацетил-бета-D-глюкозаминидазы (NAG) (нг/24 ч) в дни 0, 4 и 7 для соединений 1, 4 и 10 и колистина. На левом графике показаны слева направо колистин (2 мг/кг/день, дважды в день), колистин (8 мг/кг/день, дважды в день), соединение 1 (8 мг/кг/день, дважды в день) и 4 (8 мг/кг/день, дважды в день). На правом графике показаны колистин (2 мг/кг/день, дважды в день), колистин (8 мг/кг/день, дважды в день) и соединение 10 (8 мг/кг/день, дважды в день).
На Фигуре 2 показана концентрация альбумина (нг/24 ч) в дни 0, 4 и 7 для соединений 1, 4 и 10 и колистин. На левом графике показаны слева направо колистин (2 мг/кг/день, дважды в день), колистин (8 мг/кг/день, дважды в день), соединение 1 (8 мг/кг/день, дважды в день) и 4 (8 мг/кг/день, дважды в день). На правом графике показаны колистин (2 мг/кг/день, дважды в день), колистин (8 мг/кг/день, дважды в день) и соединение 10 (8 мг/кг/день, дважды в день).
На Фигуре 3 показана концентрация цистатина С (нг/24 ч) в дни 0, 4 и 7 для соединений 1, 4 и 10 и колистин. На левом графике показаны слева направо колистин (2 мг/кг/день, дважды в день), колистин (8 мг/кг/день, дважды в день), соединение 1 (8 мг/кг/день, дважды в день) и 4 (8 мг/кг/день, дважды в день). На правом графике показаны колистин (2 мг/кг/день, дважды в день), колистин (8 мг/кг/день, дважды в день) и соединение 10 (8 мг/кг/день, дважды в день).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложены соединения Формулы (I) и (II) для применения в медицинском лечении, в частности, в комбинации со вторым агентом. Согласно настоящему изобретению предложены соединения Формулы (II), причем такие соединения являются подмножеством соединений Формулы (I).
В целом, соединения Формулы (I) и (II) представляют собой полимиксины, в которых N-концевая группа содержит одну, две или три гидроксильные группы и/или одну, две или три аминогруппы. Дополнительно или в качестве альтернативы согласно настоящему изобретению предусмотрено, что N-концевая группа содержит азотосодержащую гетероциклильную (гетероциклиленовую) группу и/или азотосодержащую гетероалкиленовую группу. N-концевая группа может представлять собой алкильную группу или может представлять собой или включать арильную, циклоалкильную или гетероциклильную группу. Присутствие гидроксильной группы или основной аминогруппы в концевой группе связано с отдельными преимуществами, обсуждаемыми ниже.
Соединения Формулы (I) и (II) обладают подходящей антиобактериальной активностью и в то же время явно демонстрируют более низкую токсичность, в частности, нефротоксичность. Соединения могут обладать активностью, сравнимой с активностью полимиксина В или колистина, или более высокой активностью в отношении одного или более бактериальных штаммов Е. coli, P. aeruginosa, K. pneumonia или A. baumannii.
Такие соединения являются полезными альтернативами соединениям полимиксинового типа, описанным ранее в данной области.
В данной области известно или предполагается, что некоторые полимиксины или производные полимиксинов обладают плохими профилями токсичности. Например, применение соединений согласно настоящему изобретению, содержащих ацильную цепь жирной кислоты на N-конце, таких как полимиксин В и колистин, ассоциировано с нефротоксичностью.
Vaara с савт. (Antimicrob. Agents Chemother. 2008, 52, 3229) предположили, что фармакологические и токсические свойства полимиксина могут быть изменены путем внесения изменений в полипептидную последовательность полимиксина. В частности, Vaara с соавт. получили полимиксин, имеющий лишь три положительных заряда, в то время как нонапептидный полимиксин В несет пять положительных зарядов.
В отличие от этого, авторы настоящего изобретения показали, что модификации N-конца полимиксина могут снижать нефротоксичность. Как описано в настоящем документе, N-конец несет заместитель, содержащий гидроксильную группу или аминогруппу (которая может иметь форму азотосодержащего гетероцикла).
Кроме того, соединения Формулы (I) и (II) обладают способностью повышать противомикробную активность второго противомикробного агента, такого как рифампицин. Такие комбинации обладают активностью, сравнимой с активностью комбинации второго агента с полимиксином В или колистином, например, в отношении одного или более штаммов Е. coli, P. aeruginosa, K. pneumonia или A. baumannii, или более высокой. Фактически авторы изобретения обнаружили, что комбинация соединения Формулы (I) или (II) со вторым активным агентом, таким как противомикробный агент, обеспечивает неожиданное повышение биологической активности. Например, соединения Формулы (I) или (II) могут обладать активностью, сравнимой с активностью полимиксина В или колистина в отношении одного или большего числа штаммов Е. coli, P. aeruginosa, K. pneumonia или A. baumannii. Однако в случае применения таких соединений в комбинации со вторым активным агентом эта комбинация обладает неожиданно более высокой активностью, чем комбинация полимиксина В или колистин с тем же активным агентом. Как отмечалось выше, соединения Формулы (I) и (II) также могут обладать собственной противомикробной активностью.
Кроме того, авторы настоящего изобретения обнаружили, что каждое соединение Формулы (I) и (II) обладает активностью в отношении широкого спектра бактерий, и каждое соединение способно усиливать активность второго активного агента, например, в отношении штаммов Е. coli, P. aeruginosa, K. pneumonia или A. baumannii. В отличие от этого, описанные ранее в данной области соединения и комбинации имеют вариабельные профили биологической активности, и сложно предсказать степень, в которой конкретный полимиксин будет усиливать активность второго агента. В частности, биологическая активность многих известных производных полимиксина при применении в комбинации со вторым агентом ниже, чем у комбинации полимиксина В или колистина с тем же активным агентом.
Например, в публикации WO 2008/017734 описаны комбинации производных полимиксина с рифампицином, кларитромицином и другими антибиотиками. По-видимому комбинации NAB7061 и NAB739 с рифампицином обладают слабой активностью в отношении P. aeruginosa по сравнению с комбинацией нонапептидным полимиксином В с рифампицином. В отношении A. baumanii комбинация NAB739 с рифампицином обладает большей активностью, чем комбинация нонапептидного полимиксина В n с рифампицином. Однако комбинация NAB7061 с рифампицином обладает более низкой активностью. Также видно, что комбинации NAB7061 и NAB739 с рифампицином обладают более высокой активностью в отношении Е. coli, чем комбинации, содержащие нонапептидный полимиксин В. Однако эта повышенная активность непредсказуема и в целом не является единой для исследованных производных и различных штаммов, использованных для скрининга.
Комбинации согласно настоящему изобретению также обладают заметно более низкой токсичностью, чем комбинация второго агента с полимиксином В или колистином, например, например, согласно измерениям с использованием клеток HK-2. В частности, эти соединения обладают более низкой нефротоксичностью.
Активный агент
Каждое из соединений Формулы (I) и (II) может применяться совместно со вторым агентом. Авторы настоящего изобретения обнаружили, что такие комбинации обладают большей биологической активностью, чем можно было бы ожидать, исходя из активности обоих соединений по отдельности. Соединения Формулы (I) и (II) можно применять для повышения активности второго агента. В частности, соединения Формулы (I) и (II) можно применять совместно со вторым агентом для повышения противомикробной активности этого агента, например, в отношении грамотрицательных бактерий.
Без намерения ограничиваться теорией, считают, что соединения Формулы (I) и (II) воздействуют на клеточную мембрану клетки, например, клетки грамотрицательной бактерии, облегчая попадание второго агента в эту клетку. Соответственно, это позволяет агентам, которые в других случаях не способны проходить через клеточную мембрану или плохо проходят через клеточную мембрану, проникать в клетку-мишень под действие соединений Формулы (I) и (II).
В одном варианте реализации комбинация соединения Формулы (I) или (II) со вторым агентом обладает активностью против грамотрицательных бактерий. При этом соединение Формулы (I) или (II) или второй агент по отдельности могут не обладать активностью в отношении грамотрицательных бактерий.
В одном варианте реализации второй агент представляет собой агент, обладающий измеренным значением MIC (минимальной ингибирующей концентрации) в отношении конкретного микроорганизма, такого как бактерия, которое меньше 10, меньше 5 или меньше 1 микрограмм/мл. Этот микроорганизм представлять собой грамотрицательные бактерии, такие как грамотрицательные бактерии, выбранные из группы, состоящей из E. coli, S. enterica, K. pneumoniae, K. oxitoca; Е. cloacae, Е. aerogenes, Е. agglomerans, A. calcoaceticus, A. baumannii; Pseudomonas aeruginosa, Stenotrophomonas maltophila, Providencia stuartii, P. mirabilis и P. vulgaris.
Примеры вторых агентов, которые обладают активностью в отношении грамотрицательных бактерий включают бета-лактамы, тетрациклины, аминогликозиды и хинолоны.
В одном варианте реализации второй агент представляет собой агент, обладающий измеренным значением MIC (минимальной ингибирующей концентрации) в отношении конкретного микроорганизма, такого как грамотрицательная бактерия, которое больше 4, больше 8, больше 16 или больше 32 микрограмм/мл. В этом варианте реализации второй агент может обладать активностью, направленной против грамотрицательных бактерий. Например, второй агент представляет собой агент, имеющий измеренное значение MIC (минимальной ингибирующей концентрации) в отношении конкретной грамположительной бактерии, которое меньше 10, меньше 5 или меньше 1 микрограмм/мл. В данном случае соединение Формулы (I) или (II) облегчает поступление второго агента в клетку грамотрицательной бактерии. Соответственно, второй агент обладает способностью к нацеливанию в клетку грамотрицательной бактерии, причем его мишень может совпадать с мишенью второго агента в клетки грамотрицательной бактерии.
Грамположительные бактерии могут быть выбраны из группы, состоящей из стафилококковых и стрептококковых бактерий, таких как S. aureus (включая Метициллин-резистентный золотистый стафилококк (MRSA)), S. epidermis, Е. faecalis и Е. faecium.
Примеры вторых агентов, которые обладают активностью против грамположительных бактерий (например, при значениях MIC, указанных выше), и умеренной активностью в отношении грамотрицательных бактерий включают рифампицин, новобиоцин, макролиды, плевромутилины. В одном варианте реализации соединение, обладающее умеренной активностью в отношении грамотрицательных бактерий может иметь измеренное значение MIC в отношении грамотрицательной бактерии, которое меньше 32, меньше 64 или меньше 128 микрограмм/мл.
Также для применения подходят агенты, обладающие активностью в отношении грамположительных бактерий, которые не обладают существенной активностью в отношении грамотрицательных бактерий. Примеры включают фузидовую кислоту, оксазолидиноны (например, линезолид), гликопептиды (например, ванкомицин), даптомицин и лантибиотики. В одном варианте реализации измеренное значение MIC (минимальной ингибирующей концентрации) в отношении грамотрицательных бактерии соединения, не обладающего существенной активностью в отношении грамотрицательных бактерий, больше 32, больше 64, больше 128, больше 256 микрограмм/мл.
Значения MIC для конкретного агента могут быть определены с использованием методик, примеры которых приведены в настоящей заявке.
В обычных обстоятельствах такие агенты могут не подходить для применения против грамотрицательных бактерий из-за их относительно слабой способности проходить через наружную мембрану клеток грамотрицательных бактерий. Как указано выше, при применении совместно с соединением Формулы (I) или (II), такие агенты пригодны для применения.
В одном варианте реализации активный агент может быть выбран из группы, состоящей из рифампицин (рифампина), рифабутина, рифалазила, рифапентина, рифаксимина, азтреонама, оксациллина, новобиоцина, фузидовой кислоты, азитромицина, ципрофлоксацина, меропенема, тигециклина, эритромицина, кларитромицина и мупироцина и их фармацевтически приемлемых солей, сольватов и пролекарственных форм.
В одном варианте реализации активный агент может быть выбран из группы, состоящей из рифампицина, фузидовой кислоты, новобиоцина, оксациллина, азитромицина, азтреонама, меропенема, тигециклина, ципрофлоксацина и ванкомицина.
В одном варианте реализации активный агент может быть выбран из группы, состоящей из рифампицина, фузидовой кислоты, новобиоцина, оксациллина, азитромицина, азтреонама, меропенема, тигециклина и ципрофлоксацина.
В одном варианте реализации второй агент выбран из следующих классов агентов:
семейство рифампицина, включая рифампицин, рифабутин, рифалазил, рифапентин и рифаксимин;
семейстов оксациллина, включая оксациллин, метициллин, ампициллин, клоксациллин, карбенициллин, пиперациллин, трикарциллин, флюклоксациллин и нафциллин;
семейство азитромицина, включая азитромицин, кларитромицин, эритромицин, телитромицин, цетромицин и солитромицин;
семейство азтреонама, включая азтреонам и BAL30072
семейство меропенема, включая меропенем, дорипенем, имипенем, эртапенем, биапенем, томопенем и панипенем;
семейство тигециклина, включая тигециклин, омадациклин, эравациклин, доксициклин и миноциклин;
семейство ципрофлоксацина, включая ципрофлоксацин, левофлоксацин, моксифлоксацин и делофлоксацин;
фузидовая кислота;
новобиоцин;
семейство ванкомицина, включая ванкомицин, тейхопланин, телаванцин, далбаванцин, оритаванцин, например, включая тейхопланин, телаванцин, далбаванцин и оритаванцин,
и их фармацевтически приемлемые соли и сольваты.
В дополнение ко второму агенту, указанному выше, или в качестве альтернативы ему, второй агент может быть выбран из следующих классов агентов:
хлорамфеникол;
клиндамицин;
семейство оксазолидинона, включая линезолид, торезолид и радезолид;
семейстов аминогликозидов, включая амикацин, арбекацин, гентамицин, канамицин, неомицин, нетилмицин, паромомицин, стрептомицин, тобрамицин, апрамицин, этимицин и плазомицин;
даптомицин;
синерцид;
семейство плевромутилинов, включая ретапамулин и ВС-3781;
семейство лантабиотиков, включая низин, мерсацидин, актагардин, дезокси актагардин В, NVB302, NVB333, Mu1140 и микробиспорицин;
семейство цефалоспоринов, включая цевтаролин, цефтобипрол, цефтриаксон, цефтолозон, цефепим, цефуроксим, цефподоксим, цефдинир, цефиксим, цефотаксим и цефтазидим;
сульбактам; и
сулопенем,
и их фармацевтически приемлемые соли и сольваты
Авторы настоящего изобретения обнаружили, что полимиксины Формулы (I) и (II) можно применять совместно с некоторыми соединениями семейства рифамицина для лечения микробных инфекций. Семейство рифамицина включает выделяемые из природных источников рифамицины А, В, С, D, Е, S и SV и дериватизированные синтетическим путем варианты этих соединений, такие как рифампицин (рифампин), рифабутин, рифалазил, рифапентин и рифаксимин, и их фармацевтически приемлемые соли и сольваты.
В одном варианте реализации активный агент представляет собой рифампицин (рифампин) и его фармацевтически приемлемые соли, сольваты и пролекарства.
Авторы настоящего изобретения обнаружили, что полимиксины Формулы (I) и (II) можно применять совместно с некоторыми соединениями семейства меропенема для лечения микробных инфекций.
В одном варианте реализации семейство меропенема включает меропенем, дорипенем, имипенем, эртапенем, биапенем, томопенем, и панипенем и их фармацевтически приемлемые соли и сольваты.
Соединения Формулы (II) также можно применять совместно со вторыми агентами, указанными выше. Соединения Формулы (II) также можно применять совместно с такими вторыми агентами как ванкомицин, фосфомицин, рифамицин, бета-лактам (такой как цефалоспорин или карбапенем аминогликозид, макролид, тетрацилин, липопептид и/или оксазолидинон.
В одном варианте реализации соединения Формулы (II) можно дополнительно применыть совместно с ванкомицином или фосфомицином.
В альтернативном варианте второй агент не является ванкомицином, фосфомицином, рифамицином, бета-лактамом (таким как цефалоспорин или карбапенем), аминогликозидом, макролидом, тетрацилином, липопептидом, оксазолидиноном и/или противовоспалительным средством, таким как стероид.
Второй агент может применяться совместно с дополнительным агентом, например, агентом, который ограничивает или предотвращает разрушение второго агента in vivo. Например, в случае, когда второй агент обладает функциональностью β-лактама, со вторым агентом можно применять ингибитор фермента для ингибирования действия β-лактамазы. Во втором примере β-лактамный антибиотик, такой как имипенем, можно применять совместно с ингибитором дегидропептидазы, таким как калистатин, для предотвращения разрушения β-лактамного антибиотика в почках.
Второй агент может необязательно применяться совместно с противовоспалительным средством, таким как стероид.
Полимиксины Формул (I) и (II)
Соединения согласно настоящему изобретению Формул (I) и (II) являются N-концевыми производными соединений полимиксиновому ряду согласно настоящему изобретению. Остов соединения согласно настоящему изобретению представляет собой деацетилированный вариант полимиксина или нонапептидный вариант полимиксина, такой как деацилированный нонапептидный полимиксин В (PMBN) или деацилированный колистин.
Соединение Формулы (I) представлено следующим образом:
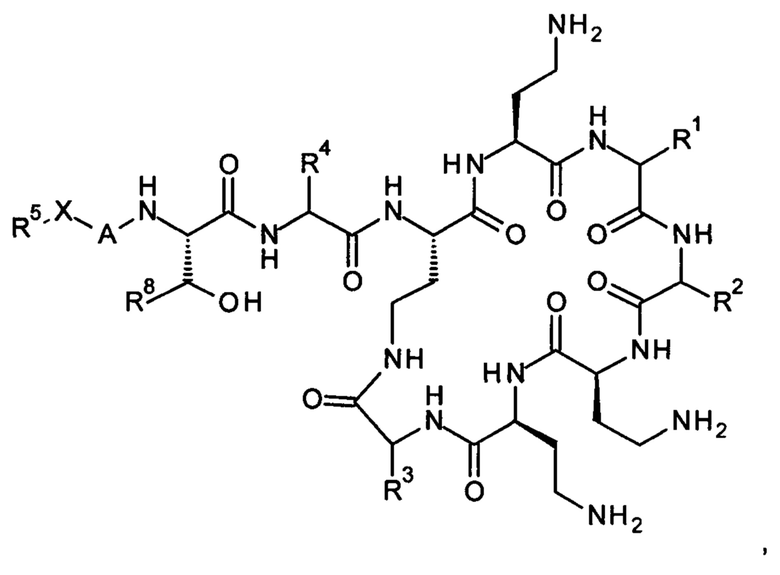
где:
-Х- представляет -C(O)-, -NHC(O)-, -OC(O)-, -CH2- или -SO2-; и
-R1 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток фенилаланина, лейцина или валина;
-R2 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток лейцина, изолейцина, фенилаланина, треонина, валина или норвалина;
-R3 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток треонина или лейцина;
-R4 представляет собой С1-6 алкил, содержащий в качестве заместителя одну гидроксильную группу или одну аминогруппу;
-А- представляет собой ковалентную связь или аминокислоту, такую как α-аминокислота;
-R5 представляет собой G-L2-L1-,
-G выбран из:
С3-10 циклоалкила,
С2-12 алкила,
С5-12 арила,
-L1- представляет собой ковалентную связь, С1-12 алкилен или С2-12 гетероалкилен,
-L2- представляет собой ковалентную связь или С4-10 гетероциклилен,
при условии, что -L1- не является C1-12 алкиленом, если -G представляет собой С2-12 алкил,
и G-L2-L1- содержит в качестве заместителей:
(i) одну, две или три гидроксильные группы, или
(ii) одну, две или три группы -NR6R7, или
(iii) одну или две группы -NR6R7, и одну, две или три гидроксильные группы,
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае, когда -L1- представляет собой азотосодержащий С2-12 гетероалкилен и/или -L2-представляет собой азотосодержащий С4-10 гетероциклилен,
или -R5 представляет собой D-L1-, где -D представляет собой С4-10 гетероциклил, и -L1-имеет определенное выше значение, и D-L1- содержит в качестве заместителей:
(i) одну, две или три гидроксильные группы, или
(ii) одну, две или три группы -NR6R7, или
(iii) одну или две группы -NR6R7 и одну, две или три гидроксильные группы,
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае, когда -L1- представляет собой азотосодержащий С2-12 гетероалкилен и/или -D представляет собой азотосодержащий С4-10 гетероциклил,
каждый -R6 независимо представляет собой водород или C1-4 алкил;
каждый -R7 независимо представляет собой водород или C1-4 алкил;
мом -NR6R7 представляет собой гуанидиновую группу; или
если -G представляет собой С3-10 циклоалкил или С5-12 арил, -R6 и -R7 вместе а атомом азота образуют С4-10 гетероцикл; и
и в тех случаях, когда арильная группа присутствует в -R5, она независимо может необязательно содержать один или больше заместителей, выбранных из -С1-10 алкила, такого как -С1-4 алкил, галогена, -CN, -NO2, -CF3, необязательно -C(O)R10,-NR10C(O)R10, -OCF3, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -С1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-10 алкил, такой как -С1-4 алкил;
и необязательно в тех случаях, когда алкильная, циклоалкильная или гетероциклильная группа присутствует в -R5, она независимо необязательно содержит один или больше заместителей, выбранных из -С1-10 алкила, такого как -С1-4 алкил, галогена, -CN, -NO2, -CF3, -C(O)R10, -NR10C(O)R10, -OCF3, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -С1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-10 алкил, такой как -С1-4 алкил, за тем исключением, что алкил не содержит в качестве заместителя алкил;
-R8 представляет собой водород или метил.
Как описано в настоящем документе, в одном варианте реализации соединения Формулы (I) не включают деацилированные полимиксины и не включают производные полимиксина, описанные Katsuma с соавт. (Chem. Pharm. Bull. 2009, 57, 332).
Соединения Формулы (II) представляют собой соединения, включающие соединения Формулы (IIa), (IIb), (IIc) и (IId), необязательно с соединением Формулы (IIe), (IIf) и (IIg). В одном варианте реализации соединения Формулы (II) представляют собой соединения Формулы (IIa).
Соединения Формулы (IIa) представляют собой соединения, в которых -R5 представляет собой G-L2-L1-, и
-G представляет собой С5-12 арил,
-L1- представляет собой ковалентную связь, С1-12 алкилен или С2-12 гетероалкилен,
-L2- представляет собой ковалентную связь или С4-10 гетероциклилен,
-R5 содержит в качестве заместителей:
(i) одну, две или три гидроксильные группы, или
(ii) одну, две или три группы -NR6R7, или
(iii) одну или две группы -NR6R7 и одну, две или три гидроксильные группы,
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае, когда -L1- представляет собой азотосодержащий С2-12 гетероалкилен и/или -L2-представляет собой азотосодержащий С4-10 гетероциклилен,
и арильная группа независимо и необязательно содержит один или более заместителей, выбранных из -С1-4 алкила, галогена, -CN, -NO2, -CF3, -NR10C(O)R10, -OCF3, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -С1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-10 алкил, такой как -С1-4 алкил;
R1, R2, R3, R4, R6, R7, R8 имеют те же значения, что и в соединениях Формулы (I), описанных выше. Дополнительно -А- и -Х- имеют те же значения, что и в соединениях Формулы (I), описанных выше. Необязательно, -R5-X- вместе не составляют Phe, His, Trp или Tyr, такие как L-Phe, L-His, L-Trp и L-Tyr, например, если -А- представляет собой ковалентную связь. Необязательно -R5-X- вместе не составляют Phe, и Trp, такие как L-Phe и L-Trp, например, если -А- представляет собой ковалентную связь.
Соединения Формулы (IIb) представляют собой соединения, в которых -R5 представляет собой G-L2-L1-, и -G представляет собой С3-10 циклоалкил,
-L1- представляет собой ковалентную связь, С1-12 алкилен или С2-10 гетероалкилен,
-L2- представляет собой ковалентную связь или С4-12 гетероциклилен,
при условии, что -L2- представляет собой ковалентную связь только если -L1-представляет собой С2-10 гетероалкилен,
-R5 содержит в качестве заместителей:
(i) одну, две или три гидроксильные группы, или
(ii) одну, две или три группы -NR6R7, или
(iii) одну или две группы -NR6R7, и одну, две или три гидроксильные группы,
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае, если -L1- представляет собой азотосодержащий С2-12 гетероалкилен и/или -L2-представляет собой азотосодержащий С4-10 гетероциклилен,
и необязательно циклоалкильная группа независимо и необязательно содержит один или больше заместителей, выбранных из -С1-10 алкила, такого как -C1-4 алкил, галогена, -CN, -NO2, -CF3, -C(O)R10, -NR10C(O)R10, -OCF3, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -C1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-10 алкил, такой как -C1-4 алкил, за тем исключением, что алкил не содержит в качестве заместителя алкил,
и R1, R2, R3, R4, R6, R7, R8 имеют те же значения, что и в соединениях Формулы (I) above. Дополнительно, -А- и -Х- имеют те же значения, что и в соединениях Формулы (I), описанных выше.
Соединения Формулы (IIc) представляют собой соединения, в которых -R5 представляет собой G-L2-L1-, где -G представляет собой С3-10 циклоалкил или С2-12 алкил,
-L1- представляет собой ковалентную связь или С1-12 алкилен,
-L2- представляет собой ковалентную связь,
при условии, что -L1- не является C1-12 алкилен, где -G представляет собой С2-12 алкил,
-R5 содержит в качестве заместителей:
(i) две или три группы -NR6R7, или
(ii) две группы -NR6R7, и одну, две или три гидроксильные группы;
и необязательно алкильная группа и циклоалкильная группа независимо и необязательно содержит один или больше заместителей, выбранных из -С1-10 алкила, такого как -С1-4 алкил, галогена, -CN, -NO2, -CF3, -C(O)R10, -NR10C(O)R10, -OCF3, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -С1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-10 алкил, такой как -С1-4 алкил, за тем исключением, что алкил не содержит в качестве заместителя алкил,
и R1, R2, R3, R4, R6, R7, R8 имеют те же значения, что и в соединениях Формулы (I), описанных выше. Дополнительно, -А- и -Х- имеют те же значения, что и в соединениях Формулы (I), приведенных выше. Необязательно -R5-X- вместе не составляют Lys, Dap, Arg, Dab, и Drg, например L-Lys, L-Dap, L-Arg, L-Dab, и L-Drg, например, в случае, когда -А- представляет собой ковалентную связь.
Соединения Формулы (IId) представляют собой соединения, в которых -R5 представляет собой D-L1-, причем D-L1- содержит в качестве заместителей:
(i) одну, две или три гидроксильные группы, или
(ii) одну, две или три группы -NR6R7, или
(iii) одну или две группы -NR6R7, и одну, две или три гидроксильные группы;
-L1- представляет собой ковалентную связь, С1-12 алкилен или С2-12 гетероалкилен,
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае, когда -L1- представляет собой азотосодержащий С2-12 гетероалкилен,
и необязательно гетероциклильная группа независимо и необязательно содержит один или больше заместителей, выбранных из -С1-10 алкила, такого как -С1-4 алкил, галогена, -CN, -NO2, -CF3, -C(O)R10, -NR10C(O)R10, -OCF3, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -С1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-10 алкил, такой как -С1-4 алкил, за тем исключением, что алкил не содержит в качестве заместителя алкил,
и R1, R2, R3, R4, R6, R7, R8 имеют те же значения, что и в соединениях Формулы (I), приведенных выше. Дополнительно -А-, -D, и -Х- имеют те же значения, что и в соединениях Формулы (I), приведенных выше.
Соединения Формулы (IIe) представляют собой соединения, в которых -А- представляет собой аминокислоту, такую как α-аминокислота, и R1, R2, R3, R4, R5, R6, R7, R8, и -X-имеют те же значения, что и в соединениях Формулы (I), описанной выше. Следует отметить, что соединения описанные Katsuma с соавт. (Chem. Pharm. Bull. 2009, 57, 332) представляют собой декапептиды полимиксина В. Однако эти соединения не имеют N-концевых модификаций, присутствующих в соединениях Формулы (IIe).
Соединения Формулы (IIf) представляют собой соединения, в которых -А- представляет собой ковалентную связь, и R1, R2, R3, R4, R5, R6, R7, R8, и -Х- имеют те же значения, что и в соединениях Формулы (I) выше, при условии, что -Х- и -R5 вместе не являются остатком L-α-аминокислоты. В одном варианте реализации -Х- и -R5 вместе не составляют L-Lys, L-Arg, L-Dap (L-α,β-диаминопропионовую кислоту), L-Ser, L-Dab (L-α,γ-диаминомасляную кислоту, L-Dgp (L-α,β-дигуанидинопропаноил) и L-Abu.
В одном варианте реализации, в котором -Х- и -R5 вместе составляют α-аминокислоту, причем эта α-аминокислота представляет собой остаток D-α-аминокислоты.
Следует отметить, что соединения, описанные Katsuma с соавт. (Chem. Pharm. Bull. 2009, 57, 332) декапептидные полимиксины В без жирной кислоты. Аминокислота в положении 1 в декапептида представляет собой L-α-аминокислоту, например, L-Lys, L-Arg, L-Dap (L-α,β-диаминопропионовая кислота) или L-Ser. Соединения Формулы (IIf) не охватывают соединения, описанные Katsuma et al., поскольку такие аминокислоты исключены из определений Х- и -R5 (в случае, если -А- представляет собой ковалентную связь).
Соединения, описанные авторами Sato et al. (Peptide Science 2007, 307) представляют собой декапептиды полимиксина В без жирной кислоты. Аминокислота в положении 1 в декапептида представляет собой L-α-аминокислоту, например, L-Dab, L-Dap, L-Dgp и L-Ser. Соединения Формулы (IIf) не охватывают соединения, описанные Sato et al., поскольку такие аминокислоты исключены из определений Х- и -R5 (в случае, если -А-представляет собой ковалентную связь).
В публикации WO 2009/098357 описано контрольное соединение NAB 705, которое представляет собой декапептид, содержащий нонапептидный полимиксин В, содержащий остаток L-Abu на N-конце. Соединения Формулы (IIf) не включают соединения, описанные в WO 2009/098357, поскольку эта аминокислоты исключены из определения -Х- и -R5 (в случае, если А- представляет собой ковалентную связь). NAB 705 также описано в WO 2008/017734.
Не описано применение соединений, описанных Katsuma с соавт. и Sato с соавт., в комбинации с активным агентом.
Соединения Формулы (IIg) представляют собой соединения, в которых -R4, вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, не является Dab, например, не является (S)-Dab.
Соответственно, -R4 не является -CH2CH2NH2 в (S)-конфигурации относительно атома углерода, с которым он связан. В этом варианте реализации -А-, R1, R2, R3, R5, R6, R7, R8, и -Х- имеют те же значения, что и в соединениях Формулы (I), описанных выше.
В одном варианте реализации -R4 представляет собой С1 алкил или С3-6 алкил, содержащий в качестве заместителя одну гидроксильную группу или одну аминогруппу.
В одном варианте реализации -R4 представляет собой C1 алкил, содержащий в качестве заместителя одну гидроксильную группу или одну аминогруппу.
В одном варианте реализации -R4, вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой Dap (α,β-диаминопропионовую кислоту), такую как (S)-Dap.
Соединения Формулы (IIg) представляют собой соединения, не имеющие общего с полимиксином В остатка в положении 3. Работа Sato с соавт и Katsuma соавт., например, ограничивается описанием соединений полимиксин В и колистин, у которых в положении 3 находится остаток (S)-Dab.
В публикации WO 2012/168820 описаны полиммиксины, в которых боковая цепь аминокислоты в положении 3 изменена по сравнению с полимиксином В. В WO 2012/168820 не описаны соединения с N-концевыми группами (т.е. группой -X-R5), которые описаны в настоящем документе.
В случае, когда А представляет собой ковалентную связь, R1 (вместе со связанными группами) представляет собой D-фенилаланин, R2 (вместе со связанными группами) представляет собой L-лейцин, R3 (вместе со связанными группами) представляет собой L-треонин, R4 (вместе со связанными группами) представляет собой L-α,γ-диаминомасляную кислоту; и R8 представляет собой метил (и вместе со связанными группами представляет собой L-треонин), соединение представляет собой производное нонапептидного полимиксина, содержащее аминокислоты 2-10 полимиксина В (нонапептидный полимиксин В), кроме того, в случае, когда А представляет собой L-α,γ-диаминомасляную кислоту, соединение представляет собой производное полимиксина, содержащее аминокислоты 1-10 полимиксина В.
Аналогично, в случае, когда А представляет собой ковалентную связь, R1 (вместе со связанными группами) представляет собой D-лейцин, R2 (вместе со связанными группами) представляет собой L-лейцин, R3 (вместе со связанными группами) представляет собой L-треонин, R4 (вместе со связанными группами) представляет собой L-α,γ-диаминомасляную кислоту; и R8 представляет собой метил (и вместе со связанными группами представляет собой L-треонин), соединение представляет собой нонапептидный полимиксин, содержащий аминокислоты 2-10 полимиксина Е (нонапептидеый колистин). Дополнительно, в тех случаях, когда А представляет собой L-α,γ-диаминомасляную кислоту, соединение представляет собой производное полимиксина, содержащее аминокислоты 1-10 полимиксина Е (колистин).
Полимиксин В
Нонапептидный полимиксин В имеет структуру, показанную ниже:
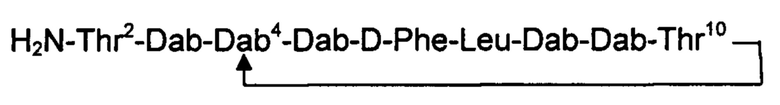
в которой указаны положения 2, 4 и 10 (в соответствии с нумерацией, применяемой для декапептида полимиксина В), и аминокислотные остатки находятся в L-конфигурации, если не указано иное.
Соединения согласно настоящему изобретению представляют собой производные нонапептидного полимиксина В, в которых (i) N-концевая аминогруппа, -NH2, заменена на группу -NH-A-X-R5 или -NH-X-R15, описанную в настоящем документе, и необязательно (ii) остатки аминокислот в положениях 2, 3, 6, 7 и 10 заменены другим аминокислотным остатком.
Для удобства соединения согласно настоящему изобретению представлены формулой (I) или (II), в которой аминокислоты в положениях 2, 3, 6, 7 или 10 определяются природой групп R8, R4, R1, R2 и R3, соответственно. Соединения согласно настоящему изобретению, которые включают описанные выше варианты, обладают биологической активностью.
Один из вариантов соединения представляет собой соединение, в котором одна или больше, например, от 1 до 5, например 1, 2, 3 или 4 аминокислот заменены другими аминокислотами. Аминокислота может находиться в положении, выбранном из положений 2, 3, 6, 7 или 10 (в соответствии с нумерацией остатков, используемой в полимиксине В). Замена может представлять собой замену на другую аминокислоту или стереоизомер.
-R1
Положение -R1 соответствует положению аминокислоты 6 в полимиксинах.
В одном варианте реализации -R1 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток фенилаланина, например, D-фенилаланин, или остаток лейцина, такой как остаток D-лейцина.
-R2
Положение -R2 соответствует положению аминокислоты 7 в полимиксинах.
В одном варианте реализации -R2 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток лейцина или треонина, такой как L-лейцин или L-треонин.
-R3
Положение -R3 соответствует положению аминокислоты 10 в полимиксинах.
В одном варианте реализации -R3 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток треонина, такой как L-треонин.
-R4
Положение -R4 соответствует боковой цепи аминокислоты в положении 3 в полимиксинах.
Группа -R4 вместе с карбонильной группой и азотом в альфа-положении относительно углерода, к которому она присоединена, представляет собой остаток аминокислоты с аминосодержащей или гидроксилсодержащей боковой цепью.
В одном варианте реализации -R4 представляет собой C1-4 алкил, имеющий один амино-заместитель и один заместитель-гидроксил.
В одном варианте реализации -R4 содержит один амино-заместитель.
В одном варианте реализации -R4 содержит один заместитель-гидроксил.
Аминогруппа может представлять собой -NH2, -NHMe или -NHEt. В одном варианте реализации аминогруппа представляет собой -NH2.
В одном варианте реализации -R4 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой α,γ-диаминомасляную кислоту (Dab), остаток серина, остаток треонина, остаток лизина, остаток орнитина или α,β-диаминопропионовую кислоту (Dap).
В одном варианте реализации -R4 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой α,γ-диаминомасляную кислоту (Dab), остаток серина, остаток лизина или α,β-диаминопропионовую кислоту (Dap).
В одном варианте реализации -R4 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой α,γ-диаминомасляную кислоту (Dab) или α,β-диаминопропионовую кислоту (Dap), например, L-Dab или L-Dap.
В одном варианте реализации -R4 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой α,γ-диаминомасляную кислоту (Dab) или α,β-диаминопропионовую кислоту (Dap), например, L-Dab или L-Dap.
В одном варианте реализации -R4 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток лизина, такой как L-Lys.
В одном варианте реализации -R4 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой Dab, такой как L-Dab.
Соединения согласно настоящему изобретению, в которых -R4 представляет собой боковую цепь Dab, можно получить из таких соединений как полимиксин В. Соединения, в которых -R4 представляет собой боковую цепь Dap могут быть получены с применением способов, описанных в WO 2012/168820. Соединения, в которых -R4 представляет собой боковую цепь серина, могут быть получены с применением способов, описанных Vaara с соавт. (см., например, Antimicrob. Agents Chemother. 2008, 52, 3229).
-R8
Остаток аминокислоты, включающий группу -R8, соответствует положению 2 в полимиксинах.
В одном варианте реализации -R8 представляет собой метил. Соответственно, образующаяся в результате аминокислота представляет собой Thr.
В одном варианте реализации -R8 представляет собой Н. Соответственно, образующаяся в результате аминокислота представляет собой Ser.
-X-
Группа -Х- может быть выбран из -С(О)-, -NHC(O)-, -ОС(О)-, -СН2- и -SO2-.
В одном варианте реализации -Х- выбран из -С(О)-, -SO2- и -СН2-.
В одном варианте реализации -Х- представляет собой -С(О)-.
В одном варианте реализации -Х- представляет собой -SO2-.
В одном варианте реализации -Х- представляет собой -СН2-.
Правая сторона группы-Х- представляет собой точку присоединения к NH, амино-концу аминокислоты в положении 2 или -А-, если он присутствует. Левая сторона группы -X-представляет собой точку присоединения к -R5.
-А-
В одном варианте реализации -А- представляет собой ковалентную связь. Такие соединения называются нонапептидами и их основой являются, например, нонапептидные формы полимиксина В, Е и М (например, имеющие структуру, показанную выше для полимиксина В). Нонапептидные формы полимиксина В и Е хорошо известны в данной области. Соединения согласно настоящему изобретению, в которых -А- представляет собой ковалентную связь, могут быть получены из нонапептидных форм путем соответствующей дериватизации N-конца.
В одном варианте реализации -А- представляет собой аминокислоту. Эта аминокислоты может представлять собой α-аминокислоту. Такие соединения называются декапептидами и их основой являются декапептидные формы полимиксина В, Е и М. Деацилированные формы полимиксина В, Е и М хорошо известны в данной области. Альтернативные декапептиды могут быть получены из нонапептида или гептапептида путем соответствующего присоединения аминокислоты или аминокислот к N-концу нонапептида или гептапептида. Следует отметить, что деацилированная форма полимиксин М по-видимому идентичны описанным для полимиксина А у Cubist (см. публикацию WO 2010/075416 и патент США US 8,415,307).
В одном варианте реализации -А- представляет собой α-аминокислоту. α-аминокислота включает протеиногенные ("природные") α-аминокислоты, необязательно вместе с другими α-аминокислотами.
В одном варианте реализации -А- представляет собой аминокислоту, выбранную из группы, состоящей из лизина (Lys), аргинина (Arg), диаминопропионовой кислоты (Dap), серина (Ser), треонина (Thr), изолейцина (Ile), тирозина (Tyr), гистидина (His), фенилаланина (Phe), пролина (Pro), триптофана (Trp), лейцина (Leu), аланина (Ala), Dab (α,γ-диаминомасляной кислоты), Dap (α,β-диаминопропионовой кислоты), Dgp (α,β-дигуанидинопропаноила), орнитина и норвалина, включая их L- и D-формы.
В одном варианте реализации -А- представляет собой аминокислоту, выбранную из группы, состоящей из Dab, Pro, Dap, Gly, Ser, His, Phe, Arg, Tyr и Leu, включая их L- и D-формы.
В одном варианте реализации -А- представляет собой D α-аминокислоту.
В одном варианте реализации -А- представляет собой L α-аминокислоту.
Примеры α-аминокислот, не являющихся протеиногенными, являются аминокислоты, образующиеся в результате посттрансляционных модификаций или других процессов.
Примеры включают Dab, Dap, Dgp (α,β-дигуанидинопропаноил), орнитин и норвалин. Также включены такие аминокислоты как аминокислоты, представленные в соединении-примере А28. Эта аминокислота имеет пиперидин в боковой цепи, который представляет собой двухвалентный заместитель, присоединенный к одному и тому же α-углероду. Соответственно, α-углерод представляет собой атом кольца в кольце пиперидина. Это является циклическим аналогом Dab.
В одном варианте реализации -А- представляет собой β-аминокислоту.
Соединения согласно настоящему изобретению, в которых -А- представляет собой аминокислоту, могут быть получены из деацилированного нонапептида, такого как PMBN (нонапептидный полимиксин В). Аминокислотная группа может быть присоединена с использованием простых методик связывания аминокислот. N-конец полученного соединения может быть дериватизирован (после удаления всех защитных групп с N-конца, в соответствующих случаях) с образованием необходимого конца R5-X-I. В альтернативном варианте N-конец аминокислотной группы может быть предварительно дериватизирован перед этапом присоединения аминокислоты. Соответственно, присоединение дериватизированной аминокислоты к деацилированному нонапептиду напрямую дает необходимую N-концевую группу. В одном варианте реализации -А- выбран из Lys, Arg, Dap, Ser, Phe, Trp, Leu, Ala, Dab, Dap, орнитина или норвалина, включая их L- и D-формы.
В одном варианте реализации -А- выбран из Thr, Ser, Lys, Dab или Dap, например, L-Thr, L-Ser, L-Lys, L-Dab или L-Dap.
В одном варианте реализации -А- представляет собой Dab, такой как L-Dab. в одном из альтернативных вариантов реализации, в котором -А- представляет собой аминокислоту, она не является Dab, например, она не является L-Dab.
-Х- и -R5
Соединения Формулы (I) не включают деацилированные варианты полимиксина В (деацилполимиксин В - DAPB), D, Е (деацилколистин - DAC) или М, или циркулин А. Соединения Формулы (I) не включают нонапептидные варианты полимиксина В (PMBN), D, Е или М или циркулин А.
В одном варианте реализации -Х- и -R5 вместе не являются α-аминокислотным остатком, например, если -А- представляет собой ковалентную связь. Остаток α-аминокислоты представляет собой группу, в которой -Х- представляет собой -С(О)-, и -R5 включает группу -NR6R7 (такую как -NH2) в качестве заместителя на атоме углерода, который находится в α- положении по отношению к группе -Х-.
В одном варианте реализации -Х- и -R5 вместе не составляют остатки Thr, Ser, α,γ-диаминомасляной кислоту (Dab) или α,β-диаминопропионовой кислоты (Dap).
В одном варианте реализации например, в котором ядро соединения Формулы (I) представляет собой полимиксин В, X и R5 вместе не составляют остатки Lys, Arg, Dap, Ser, Phe, Trp, Leu или Ala.
В одном варианте реализации -Х- и -R5 вместе не составляют остатки Lys, Arg, Dap, Ser, Phe, Trp, Leu, Ala α,γ-диаминомасляной кислоты (Dab) или α,β-диаминопропионовой кислоты (Dap).
В одном варианте реализации -Х- и -R5 вместе не составляют остатки Ala, Ser, Thr, Val, Leu, Ile, Pro, Phe, Tyr, Trp, His, Lys или Arg.
В одном варианте реализации -Х- и -R5 вместе не составляют остатки Ala, Ser, Thr, Val, Leu, Ile, Pro, Phe, Tyr, Trp, His, Lys, Arg, α,γ-диаминомасляной кислоты (Dab) или α,β-диаминопропионовой кислоты (Dap).
В одном варианте реализации -Х- и -R5 вместе не являются α-аминокислотой, например, D или L α-аминокислотой, например, L α-аминокислотой.
В одном варианте реализации -R5 не является диаминофенилом, таким как 3,5-диаминофенил, например, если -Х- представляет собой -С(О)-.
-R5
В одном варианте реализации -R5 представляет собой G-L2-L1-.
-R5 может представлять собой G-L1-, например, в случае, когда -L2- представляет собой ковалентную связь.
-R5 может представлять собой G-L2-, например, в случае, когда -L1- представляет собой ковалентную связь.
-R5 может представлять собой -G, например, в случае, когда -L1- и -L2- представляют собой ковалентные связи.
В одном варианте реализации -R5 представляет собой D-L1-.
-R5 может представлять собой -D, например, в случае, когда -L1- представляет собой ковалентную связь.
В одном варианте реализации -R5 содержит одну, две или три гидроксильных группы и/или группы -NR6R7. Эти группы могут быть расположены на любой группе в -R5, включая -G, -D, -L1- и -L2-. В одном варианте реализации эти группы представляют собой заместители -G, -D, и -L1-.
Следует отметить, что гидроксильные группы и группы -NR6R7 не обязательно являются заместителями группы D-L1-.
При обсуждении ниже заместители - гидроксилы и -NR6R7 могут называться заместителями -R5.
В одном варианте реализации одна, две или три гидроксильные группы и/или группы -NR6R7 необязательно являются заместителями на -R5. Это может быть в случае, когда -L1- представляет собой азотосодержащий С2-12 гетероалкилен, и/или -L2- представляет собой азотосодержащий С4-10 гетероциклилен, и/или -D представляет собой азотосодержащий С4-10 гетероциклил.
В одном варианте реализации -R5 содержит по меньшей мере 5, по меньшей мере 6, по меньшей мере 7 или по меньшей мере 8 атомов углерода.
В одном варианте реализации -R5 содержит 1, 2, или 3 атома азота. В одном варианте реализации атом азота представляет собой основной атом азота. Атом азота может быть представлен в виде NH.
В одном варианте реализации -R5 содержит 1, 2, или 3 атома кислорода.
В одном варианте реализации -R5 не является аминоциклогексилом например, если -А-представляет собой ковалентную связь, -Х- представляет собой -С(О)-, и -R1, -R2 и -R3 являются аминокислотными остатками полимиксина В.
Okimura с соавт. описывают нонапептиды полимиксина В, содержащие аминоциклогексильные группы на N-конце. Применение этих соединений в комбинации с активным агентом не описано.
В одном варианте реализации -R5 не является аминоциклогексильной группой, выбранной из группы, состоящей из цис-2-аминоциклогексила, транс-2-аминоциклогексила, цис-3-аминоциклогексила, цис-4-аминоциклогексила и транс-4-аминоциклогексила. В качестве дополнения или альтернативы, -R5 не является транс-3-аминоциклогексилом.
Линкер: -L2-L1- и -L1-
В группах G-L2-L1- и D-L1-, -L2-L1- и -L1- могут рассматриваться как линкеры, связывающие группу -Х- с -G или -D. Линкер может отсутствовать, например, в случае, когда -L1- и -L2-представляют собой ковалентные связи.
-L2-L1- в G-L2-L1-
В одном варианте реализации -L1- и -L2- оба представляют собой ковалентные связи. Соответственно, группа -G связана напрямую с -Х-. В этом случае на -G должны присутствовать гидроксильные или аминогруппы (такие как одна, две или три гидроксильные группы или группы и/или -NR6R7).
В случае, когда-L1- представляет собой азотосодержащий С2-12 гетероалкилен и/или -L2-представляет собой азотосодержащий С4-10 гетероциклилен, G-L2-L1- может необязательно содержать в качестве заместителей одну, две или три гидроксильные группы и/или группы -NR6R7.
-L1- в D-L1-
В одном варианте реализации -L1- представляет собой ковалентную связь. Соответственно, группа -D связана напрямую с -Х-. В случае, когда группа D-L1- содержит в качестве заместителя гидроксильную группу или аминогруппу (например, одну, две или три гидроксильные группы и/или группы -NR6R7), эти группы должны находиться на -D.
В случае, когда-L1- представляет собой азотосодержащий С2-12 гетероалкилен и/или -D представляет собой азотосодержащий С4-10 гетероциклил D-L1- необязательно может содержать в качестве заместителей одну, две или три гидроксильные группы и/или группы -NR6R7.
-L1-
В одном варианте реализации -L1- представляет собой ковалентную связь или а С1-12 алкиленовую группу.
В одном варианте реализации -L1- представляет собой ковалентную связь.
В одном варианте реализации -L1- представляет собой С1-12 алкиленовую группу или С2-12 гетероалкиленовую группу.
В одном варианте реализации -L1- представляет собой С1-12 алкиленовую группу.
В одном варианте реализации -L1- представляет собой C1-12 алкилен, например, C1-6, С1-4 или C1-2 алкилен.
В одном варианте реализации -L1- представляет собой -СН2- или -СН2СН2-.
В одном варианте реализации -L1- представляет собой С2-12 алкилен, например, С2-6 или С2-4 алкилен.
В одном варианте реализации -L1- представляет собой С3-12 алкилен, например, С3-6, С4-12, С5-12 или С6-12 алкилен.
Алкиленовая группа представляет собой насыщенную, алифатическую алкиленовую группу.
Алкиленовая группа группу может представлять собой линейную или разветвленную алкиленовую группу. В одном варианте реализации алкиленовая группа является линейной.
В случае, когда-L1- представляет собой алкиленовую группу и R5 содержит в качестве заместителей одну, две или три гидроксильные группы и/или группы -NR6R7, причем один или более заместителей могут быть заместителями на алкиленовой группе.
В одном варианте реализации алкиленовая группа содержит один, два или три заместителя.
В одном варианте реализации алкиленовая группа содержит один или два заместителя, в частности, один заместитель.
В одном варианте реализации число заместителей на алкиленовой группе не превышает число атомов углерода в этой алкиленовой группе. Соответственно, в случае, когда -L1- представляет собой С2 алкиленовую группу, она может содержать в качестве заместителя не более двух заместителей.
Дополнительные заместители, в случае их присутствия, могут быть расположены на -G или -D, в соответствующих случаях.
В одном варианте реализации алкиленовая группа не имеет заместителей.
В случае, когда-L1- представляет собой алкиленовую группу, она может содержать в качестве заместителя циклоалкильную группу. Один из атомов углерода в алкиленовой группе может образовывать ковалентную связь с атомом углерода в кольце циклоалкильной группы -G. Эта структура показана в соединениях-примерах 10 и А28. В альтернативном варианте циклоалкильная группа может представлять собой двухвалентный заместитель, связанный с одним атомом в алкиленовлй группе. Соответственно, атом углерода в алкиленовой группе также представляет собой атом углерода в кольце циклоалкильной группы. Эта структура показана в соединениях-примерах А30 и А34.
В альтернативном варианте эту последнюю структуру можно видеть в таких соединениях как А30 и А34 в виде циклоалкильной группы, содержащей необязательный алкильный заместитель, где одна, две или три гидроксильные группы и/или группы -NR6R7 расположены на этом необязательном алкильном заместителе.
В одном варианте реализации -L1- представляет собой С2-12 гетероалкилен. Гетероалкиленовая группа представляет собой алкиленовую группу, в которой один, два или больше, например, два, три или больше атомов углерода заменены гетероатомом, выбранным из N, О и S. Нижний индекс, например, 4 в С4 относится к общему числу атомов углерода и гетероатомов. Предполагается, что гетероатом гетероалкиленовой группы не является боковой амино-, гидроксильной или тиоловой группой.
В одном варианте реализации гетероалкиленовая группа содержит один или два гетероатома, например, один или два атома азота, такие как один или два -NH-. В одном варианте реализации гетероалкиленовая группа представляет собой азотосодержащий гетероалкиленовую группу.
Гетероатом может располагаться в алкиленовой цепи, например, -CH2-NH-CH2-.
Гетероатом может представлять собой концевую группу для соединения с -Х-, -L2-, -G или -D, например, -CH2-CH2-NH- или -NH-CH2-CH2-. В этих вариантах реализации гетероатом связан с атомом углерода в -Х-, -L2-, -G или -D.
В одном варианте реализации гетероатом гетероалкиленовой группы не является ковалентно связанным с группой -Х-.
В одном варианте реализации гетероатом гетероалкиленовой группы не является ковалентно связанным с группой -L2-, -G или -D, если таковая присутствует. В одном из альтернативных вариантов реализации гетероатом гетероалкиленовой группы, такой как -NH-, ковалентно связан с группой -L2-, -G или -D, если таковая присутствует.
В одном варианте реализации -L1- представляет собой С2-12 гетероалкилен, например, С2-6, С2-4, С3-6, С3-12, С4-6 или С4-12 гетероалкилен.
Гетероалкиленовая группа представляет собой замещенную алифатическую гетероалкиленовую группу.
Гетероалкиленовая группа может представлять собой линейную или разветвленную гетероалкиленовую группу. В одном варианте реализации гетероалкиленовая группа является линейной.
В одном варианте реализации -L1- представляет собой -NH-CH2CH2-NH-CH2-.
В одном варианте реализации -L1- представляет собой -CH2-NH-CH2CH2-.
В одном варианте реализации гетероалкиленовая группа не имеет заместителей.
В одном варианте реализации гетероалкиленовая группа содержит в качестве заместителей, например, одну или две гидроксильные группы и/или группы -NR6R7, например, одну гидроксильную группу или группу -NR6R7. Заместители расположены на атомах углерода в гетероалкиленовой группе.
В одном варианте реализации число заместителей на гетероалкиленовой группе не превышает число атомов углерода в гетероалкиленовой группе.
В случае, когда гетероалкиленовая группа содержит заместители, эти заместители в предпочтительном случае не располагаются на атоме углерода, который ковалентно связан с гетероатомом гетероалкиленовой группы. В случае, когда гетероалкиленовая группа содержит заместители, заместители могут располагаться на атоме углерода, который не связан с гетероатомом.
-L2-
В одном варианте реализации -L2- представляет собой ковалентную связь.
В одном варианте реализации -L2- представляет собой С4-10 гетероциклиленовую группу, например, если -L1- представляет собой С1-12 алкиленовую группу.
В одном варианте реализации -L2- представляет собой С4-7 гетероциклиленовую группу, например, а С5-7 или С5-6 гетероциклиленовую группу.
В одном варианте реализации С4-10 гетероциклилен содержит один или два гетероатома, выбранные из N, S и О. В случае, когда присутствует атом S, он может иметь форму S, S(O) или S(O)2. В случае, когда присутствует атом N, он может иметь форму NH или NR, где -R представляет собой С1-4 алкил, такой как метил или этил. В одном варианте реализации гетероциклиленовая группа представляет собой азотосодержащий гетероциклилен. Гетероциклиленовая группа может содержать один или два атома азота. Каждый атом азота может необязательно нести в качестве заместителя С1-4 алкил, в соответствующих случаях. В одном варианте реализации гетероциклиленовая группа содержит только гетероатомы азота.
Термин «гетероциклилен» применительно к группе -L2- относится к группе (1), которая содержит один или больше гетероатомов (например, N, О, S), составляющих часть системы колец, причем система колец включает одно кольцо или два или больше конденсированных колец, причем по меньшей мере одно кольцо в этой системе колец представляет собой неароматическое кольцо, и (2) которая присоединена к остальной молекуле (включая группы -G и -L1- в соответствующих случаях) через атомы неароматического кольца (т.е. каждый атом кольца является частью неароматического кольца, являющегося частью системы колец). В неороматическом кольце присутствует по меньшей мере один гетероатом.
Соответственно, гетероциклилен может представлять собой бициклическую систему колец, в которой одно кольцо представляет собой ароматическое кольцо. Ароматическое не является кольцом, которое связано с остальной молекулой, как отмечалось выше. Примеры конденсированных гетероциклильных систем обсуждаются ниже в связи с группой D.
В одном варианте реализации, в котором гетероциклиленовая группа содержит два или больше конденсированных колец, каждое кольцо является неароматическим. В одном варианте реализации гетероциклиленовая группа содержит одно кольцо.
В одном варианте реализации гетероциклиленовая группа не имеет заместителей. Соответственно, гидроксильная группа и/или группа -NR6R7 содержатся в других местах, по необходимости, например, на -L1-, в случаях его присутствия, или на -G или -D. В альтернативном варианте, в случае, когда гетероциклиленовая группа содержит основную азотсодержащую группу, такую как NH, гидроксильная группа и/или группа -NR6R7 являются необязательными, в случае отсутствия основной азотсодержащей группы, такой как NH, гетероциклиленовая группа может содержать гидроксильную группу и/или группу -NR6R7.
В одном варианте реализации гетероциклилен связан с -L1- или -Х- через атом углерода или атом азота, в случае его присутствия, гетероциклиленового кольца.
В одном варианте реализации гетероциклилен связан с -G через атом углерода или атом азота, в случае его присутствия, гетероциклиленового кольца.
В одном варианте реализации -L2- выбран из пиперидинилена, пиперазинилена и пирролидинилена.
В одном варианте реализации -L2- выбран из пиперидинил-1,4-ена, пиперазинил-1,4-ена и пирролидинил-1,3-ена.
Следует отметить, что гетероциклиленовая группа не включает двухвалентный радикал пиридана, такой как двухвалентный 2-пиридон. Такие соединения считаются ароматическими с учетом лактимной таутомерной формы. Соответственно, во избежание сомнений, -L2- может представлять гетероциклиленовую группу, при условии, что -L2- не является двухвалентным радикалом пиридона. Соответственно, соединение 5х, описанное Magee с соавт., J. Med. Chem., 2013, 56, 5079) не входит в формулу (I) в настоящей заявке.
Положение гидроксильного заместителя и заместителя -NR6R7
В одном варианте реализации группа -R5, такая как G-L2-L1- или D-L1-, может содержать в качестве заместителя одну, две или три гидроксильные группы.
В одном варианте реализации -R5 содержит в качестве заместителя одну гидроксильную группу.
В одном варианте реализации группа -R5 может содержать в качестве заместителя одну, две или три группы -NR6R7.
В одном варианте реализации -R5 содержит в качестве заместителя одну группу -NR6R7.
В одном варианте реализации -R5 содержит в качестве заместителей две или три группы -NR6R7.
В одном варианте реализации группа -R5 может содержать в качестве заместителя одну или две группы -NR6R7, и одну, две или три гидроксильные группы.
В одном варианте реализации -R5 содержит в качестве заместителей одну группу -NR6R7 и одну гидроксильную группу.
В одном варианте реализации гидроксильная группа, например, одна, две или три гидроксильные группы, являются заместителями в -G.
В одном варианте реализации гидроксильная группа, например, одна, две или три гидроксильные группы, являются заместителями в -D.
В одном варианте реализации гидроксильная группа, например, одна, две или три гидроксильные группы, являются заместителями в -L1-, в соответствующих случаях, например, в случае, когда -L1- представляет собой алкилен или гетероалкилен.
В одном варианте реализации гидроксильная группа, например, одна, две или три гидроксильные группы, являются заместителями в -L2-, в соответствующих случаях, например, в случае, когда -L2- представляет собой гетероциклилен.
В одном варианте реализации группа -NR6R7, например, одна, две или три группы -NR6R7, являются заместителями в -G.
В одном варианте реализации группа -NR6R7, например, одна, две или три группы -NR6R7, являются заместителями в -D.
В одном варианте реализации группа -NR6R7, например, одна, две или три группы -NR6R7, являются заместителями в -L1-, в соответствующих случаях, например, в случае, когда -L1- представляет собой алкилен или гетероалкилен.
В одном варианте реализации группа -NR6R7, например, одна, две или три группы -NR6R7, являются заместителями в -L2-, в соответствующих случаях, например, в случае, когда -L2- представляет собой гетероциклилен.
В одном варианте реализации G-L2-L1- содержит в качестве заместителей:
(i) одну или две гидроксильные группы, или
(ii) одну или две группы -NR6R7, или
(iii) одну группу -NR6R7 и одну гидроксильную группу,
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае, когда -L1- представляет собой азотосодержащий С2-12 гетероалкилен и/или -L2-представляет собой азотосодержащий С4-10 гетероциклилен.
В одном варианте реализации G-L2-L1- необязательно содержит заместители (i), (ii) и (iii), например, в случае, когда L1- представляет собой азотосодержащий С2-12 гетероалкилен, и/или -L2- представляет собой азотосодержащий С4-10 гетероциклилен.
В одном варианте реализации это условие не применимо, т.е. (i), (ii) и (iii) не являются необязательными заместителями.
Во избежание сомнений, в случае, когда указано, что группа -R5 содержит в качестве заместителя одну гидроксильную группу (-ОН), -R5 не содержит других гидроксильных групп. Аналогично, в случае, когда указано, что группа -R5 содержит в качестве заместителя одну группу -NR6R7, -R5 не содержит других групп -NR6R7. Аналогичным образом, в случае, когда -R5 содержит две или три гидроксильных группы или группы -NR6R7, общее число гидроксильных групп или групп -NR6R7 составляет две или три.
Как будет подробно описано ниже, в случае, когда присутствует гидроксильная группа, она может представлять собой заместитель на атоме углерода в α-положении по отношению к группе -Х-.
В одном варианте реализации, когда -R5 содержит больше одного заместителя, эти заместители расположены не на одном атоме углерода.
В данном случае карбоксильная группа (-СООН) не рассматривается в качестве гидроксильной группы.
В случае, когда-L1- содержит два или больше атомов углерода (например, С2-12 алкилен или С3-12 гетероалкилен), заместитель, в случае его присутствия, может находиться на атоме углерода, который находится в положении α по отношению к группе -Х-.
Аналогичным образом, в случае, когда -L1- и -L2- оба представляют собой ковалентные связи, и -G представляет собой С2-12 алкил, С2-12 алкильная группа может содержать заместитель на атоме углерода, который находится в положении α по отношению к группе -Х-.
В одном варианте реализации -L1- содержит в качестве заместителя гидроксильную группу (например, одну, две или три гидроксильные группы), причем гидроксильная группа находится на атоме углерода, который находится в положении α по отношению к группе -Х-. Авторы настоящего изобретения обнаружили, что соединения, содержащие гидроксильную группу на углероде α, обладают особенно улучшенной активностью потенцирования, по сравнению с теми соединениями, в которых гидроксильная группа связана, например, с атомом углерода, который не является α по отношению к группе -Х-, например, находится в положении β или γ по отношению к группе -Х-, как в соединении-примере 25.
Аналогичным образом, в случае, когда -L1- и -L2- оба представляют собой ковалентные связи, и -G представляет собой С2-12 алкил, С2-12 алкильная группа может содержать гидроксильную группу на атоме углерода, который находится в α-положении относительно группы -Х-.
В случае, когда-L1- содержит больше двух атомов углерода (например, С2-12 алкилен или С3-12 гетероалкилен), заместитель, в случае его присутствия, может находиться на атоме углерода, который расположен не в положении α относительно группы X. Например, заместитель может находиться на атоме углерода, который находится в положении β или γ по отношению к группе -Х-. В одном варианте реализации атом углерода в положении α по отношению к группе -Х- не несет ни одного заместителя.
Аналогичным образом, в случае, когда -L1- и -L2- оба представляют собой ковалентные связи, и -G представляет собой С2-12 алкил, С2-12 алкильная группа может содержать заместитель, который не находится на атоме углерода, который находится в положении α относительно группы -Х-. Например, этот заместитель может находиться на атоме углерода, который находится в положении the β или γ по отношению к группе -Х-.
В одном варианте реализации -L1- содержит в качестве заместителя аминогруппу (например, одну или две аминогруппы), причем эта аминогруппа (т.е. -NR6R7) находится на атоме углерода, который не является α по отношению к группе X. Примеры соединений согласно настоящему изобретению, замещенные таким образом, включают Соединение-пример 10, описанное в настоящей заявке. Авторы настоящего изобретения обнаружили, что соединения, содержащие аминогруппу на α-атоме углерода, такие как соединение-пример 40, могут иметь более низкую активность потенцирования, чем те соединения, в которых аминогруппа связана, например, с атомом углерода, который находится в β- или γ- положении относительно группы -Х-.
Кроме того, авторы изобретения установили, что изменение активности потенцирования связано со стереохимией углерода α в случае, когда он несет замещающую аминогруппу. Соединения-примеры А25 и А26 представляют собой диастереоизомеры, отличающиеся только стереохимией атом углерода α. Соединение А26 обладает более высокой активностью, чем соединение А25 в исследовании с использованием различных штаммов Е. coli, K. pneumoniae, P. aeruginosa и A. baumannii (см. Таблицу 6А).
Соответственно, в одном варианте реализации аминогруппа расположена на атоме углерода, который находится в положении α относительно группы X.
Аналогичным образом, в случае, когда -L1- и -L2- оба представляют собой ковалентные связи, и -G представляет собой С2-12 алкил, С2-12 алкильная группа может содержать аминогруппу, расположенную при атоме углерода, который не находится в положении α по отношению к группе -Х-, например, является β или γ по отношению к группе -Х-.
В одном варианте реализации амино- или гидроксильный заместитель расположен на концевом атоме углерода группы -L1- (например, С2-12 алкилен или С2-12 гетероалкилен) или концевом атоме углерода -С2-12 алкила, если он присутствует.
В одном варианте реализации группа -L1- в D-L1- представляет собой ковалентную связь. Соответственно, -D, который представляет собой С4-10 гетероциклил, связан напрямую с группой -Х-.
В одном варианте реализации группа -L2- представляет собой С4-10 гетероциклил. В случае, когда-L1- представляет собой ковалентную связь, -L2- связан напрямую с группой -Х-.
Связь каждой из этих гетероциклильных групп с -Х- обсуждается ниже.
В одном варианте реализации атом, находящийся в положении α по отношению к группе -Х-, может представлять собой атом углерода в кольце гетероциклильной группы. Гетероатом кольца гетероциклильной группы может быть ковалентно связан с атомом углерода в кольце, который находится в положении α по отношению к группе -X-, т.е. гетероатом кольца находится в положении β по отношению к группе -Х-. В одном варианте реализации гетероатом кольца в положении β по отношению к группе X представляет собой О или S, в частности, О. В одном варианте реализации гетероатом кольца в положении β по отношению к группе -Х- не является N.
В одном варианте реализации гетероатом кольца в положении γ по отношению к группе X представляет собой О, S или N.
В одном варианте реализации, в котором -L1- и -L2- оба представляют собой ковалентные связи, и -G представляет собой С5-12 гетероарил, этот гетероарил может быть связан с группой -Х- через атом углерода в кольце, который находится в положении α по отношению к группе -Х-. В одном варианте реализации гетероатом кольца, такой как N, не связан с атомом углерода, который находится в положении α по отношению к группе -Х-. В альтернативном варианте гетероатом кольца, такой как О или S, связан с атомом углерода, который находится в положении α по отношению к группе -Х-.
В одном варианте реализации группа G-L2-L1- содержит одну, два или три заместителя, представляющих собой гидроксильные группы и/или группы -NR6R7. Эти заместители могут располагаться на одной или большем числе групп -G-, -L2- или -L1-, в соответствующих случаях. В одном варианте реализации заместители расположены на -G- и/или -L1-. В случае, когда-L1- представляет собой С2-12 гетероалкилен, указанные один, два или три заместителя, представляющих собой гидроксильные группы и/или - группы NR6R7, являются необязательными.
Группа D-L1- необязательно содержит один, два или три заместителя, представляющих собой гидроксильные группы и/или группы -NR6R7. В случае, когда заместители присутствуют, они могут быть расположены на -D или -L1-, в соответствующих случаях.
В одном варианте реализации -R5 представляет собой G-L2-L1-, где -G представляет собой С5-12 арил.
В одном варианте реализации -R5 представляет собой G-L2-L1-, где -G представляет собой С3-10 циклоалкил или -С2-12 алкил, или -R5 представляет собой D-L1-, где D представляет собой С4-10 гетероциклил.
В одном варианте реализации G-L2-L1- содержит в качестве заместителей (i) одну, две или три гидроксильные группы, (ii) одну, две или три группы -NR6R7, или (iii) одну или две группы -NR6R7, и одну, две или три гидроксильные группы. В случае, когда арильная группа присутствует в G-L2-L1-, она независимо может необязательно содержать один или больше заместителей, выбранных из -С1-10 алкила, такого как -С1-4 алкил, галогена, -CN, -NO2, -CF3, -NR10C(O)R10, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -OCF3, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -С1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -C1-10 алкил, такой как -С1-4 алкил.
В одном варианте реализации D-L1- необязательно содержит в качестве заместителей (i) одну, две или три гидроксильные группы, (ii) одну, две или три группы -NR6R7 или (iii) одну, две или три группы -NR6R7, и одну, две или три гидроксильные группы.
В одном варианте реализации D-L1- содержит в качестве заместителей (i) одну, две или три гидроксильные группы, (ii) одну, две или три группы -NR6R7 или (iii) одну, две или три группы -NR6R7 и одну, две или три гидроксильные группы.
Группы С3-10 циклоалкил С2-12 алкил и С4-10 гетероциклил могут содержать в качестве заместителей гидроксильные группы и/или группы -NR6R7. В случае, когда циклоалкильная или гетероциклильная группа включает конденсированное ароматическое кольцо, это ароматическое кольцо может необязательно содержать необязательные заместители, описанные в настоящем документе. Дополнительные необязательные заместители не включают гидроксильные группы и/или группы -NR6R7.
Группа С5-12 арил содержит в качестве заместителей гидроксильную группу и/или группу-NR6R7, и the С5-12 арил может необязательно содержать дополнительные заместители. Дополнительные необязательные заместители не включают гидроксильные группы и/или группы -NR6R7.
С3-10 циклоалкильная, С2-12 алкильная, С5-12 арильная и С4-10 гетероциклильная группы в -G и -D не должны обязательно содержать в качестве заместителей гидроксильные группы и/или -NR6R7 группы. В одном варианте реализации гидроксильная группа и/или группа -NR6R7 может быть расположена на линкерных элементах группы -R5 например, -L1- и/или -L2-, если таковые присутствуют.
В случае, когда-R5 содержит а азотосодержащий гетероциклил (или азотосодержащий гетероциклилен) или азотосодержащий гетероалкиленовую группу, например, в виде части -L1-, -L2- или -D, гидроксильная группа и/или группа -NR6R7 могут быть необязательными.
В частности, гидроксильная группа и/или группа -NR6R7 являются необязательными только в тех случаях, когда группы гетероциклил, гетероциклилен или гетероалкилен содержат основную азотную группу, такую как NH.
Соответственно, в одном варианте реализации G-L2-L1- содержит в качестве заместителей:
(i) одну, две или три гидроксильные группы, или
(ii) одну, две или три группы -NR6R7, или
(iii) одну или две группы -NR6R7 и одну, две или три гидроксильные группы, азотосодержащий С2-12 гетероалкилен и/или а азотосодержащий С4-10 гетероциклилен, в случае его присутствия, содержит основную азотную группу, такую как NH.
В одном варианте реализации G-L2-L1- содержит в качестве заместителей:
(i) одну, две или три гидроксильные группы, или
(ii) одну, две или три группы -NR6R7, или
(iii) одну или две группы -NR6R7, и одну, две или три гидроксильные группы,
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае, когда -L1- представляет собой азотосодержащий С2-12 гетероалкилен и/или -L2-представляет собой азотосодержащий С4-10 гетероциклил.
В одном варианте реализации G-L2-L1- содержит в качестве заместителей:
(i) одну, две или три гидроксильные группы, или
(ii) одну, две или три группы -NR6R7, или
(iii) одну или две группы -NR6R7 и одну, две или три гидроксильные группы.
В одном варианте реализации D-L1- содержит в качестве заместителей:
(i) одну, две или три гидроксильные группы, или
(ii) одну, две или три группы -NR6R7, или
(iii) одну или две группы -NR6R7, и одну, две или три гидроксильные группы или азотосодержащий C2-12 гетероалкилен, в случае его присутствия, и/или -D содержит основную азотную группу, такую как NH.
-D
N-концевой заместитель полимиксина может включать а С4-10 гетероциклильную группу ("гетероциклильную группу"). Соответственно, в одном варианте реализации -R5 включает группу -D, которая представляет собой С4-10 гетероциклил.
В одном варианте реализации -D представляет собой азотосодержащую гетероциклильную группу. В таких вариантах реализации гидроксильная группа и группа -NR6R7 являются необязательными.
В случае, когда гетероциклильная группа не содержит атом азота в кольце, любая или обе группы из гетероциклильной группы и -L1- должны содержать в качестве заместителей одну, две или три гидроксильные группы и/или группы -NR6R7, или -L1-должен представлять собой азотосодержащий C2-12 гетероалкилен.
А гетероциклильная группа необязательно может содержать заместители, как описано ниже.
В одном варианте реализации С4-10 гетероциклил представляет собой С4-6 или С5-6 гетероциклил, такой как С5 гетероциклил или С6 гетероциклил.
В одном варианте реализации С4-10 гетероциклил содержит один или два гетероатома, выбранные из N, S и О. В случае, когда присутствует атом S, он может иметь форму S, S(O) или S(O)2. В случае, когда присутствует атом N, он может иметь форму NH или NR, где R представляет собой С1-4 алкил, такой как метил или этил.
В одном варианте реализации гетероциклильная группа представляет собой азотосодержащую гетероциклильную группу.
В одном варианте реализации С4-10 гетероциклил представляет собой пиперидинил, пиперазинил, морфолинил, диоксанил, тиоморфолинил (включая окисленный тиоморфолинил) или пирролидинил.
В одном варианте реализации С4-10 гетероциклил представляет собой пиперидинил, пиперазинил, тиоморфолинил (включая окисленный тиоморфолинил), пирролидинил или морфолинил.
В одном варианте реализации С4-10 гетероциклил представляет собой пиперидинил, пиперазинил или пирролидинил.
В случае, когда гетероциклил присутствует, он связан с -L1- или -Х- через атом углерода в кольце или атом N в кольце, если таковой присутствует. В одном варианте реализации гетероциклил связан через атом углерода в кольце. В другом варианте реализации гетероциклил связан через атом азота в кольце, если таковой присутствует.
В случае, когда гетероциклил содержит в качестве заместителей одну, две или три гидроксильные группы и/или группы -NR6R7, эти группы являются заместителями на атомах углерода в гетероциклильном кольце.
В одном варианте реализации гидроксильная группа или группа -NR6R7, в случае их присутствия, представляет собой заместитель на атоме углерода в кольце, который находится в положении β относительно гетероатома кольца.
В одном варианте реализации гетероциклила, если он содержит заместители, несет максимум один или два заместителя, которые могут быть одинаковыми или разными.
В одном варианте реализации общее число атомов углерода в гетероциклильной группе, вместе с общим числом атомов углерода, присутствующих в -R6 и -R7 (если они присутствуют) составляет по меньшей мере 5, по меньшей мере 6, по меньшей мере 7 или по меньшей мере 8.
Во избежание сомнений, индекс "Сх-у" в таких терминах как "С4-7 гетероциклил" и т.п. относится к числу атомов кольца, которые могут представлять собой атомы углерода или гетероатомы (например, N, О, S). Например, пиперидинил представляет собой пример С6 гетероциклильной группы.
Термин «гетероциклил» применительно к группе -D относится к группе (1), которая содержит один или больше гетероатомов (например, N, О, S), составляющих часть системы колец, причем указанная систем колец включает одно кольцо или два или больше конденсированных колец, причем по меньшей мере одно кольцо в системе колец представляет собой неароматическое кольцо, и (2) которая присоединена к остальной молекуле атомом неароматического кольца (т.е., атомом кольца, который является частью неароматического кольца, которое является частью системы колец). Например: пиперидино(пиперидин-1-ил) и пиперидин-4-ил оба являются примерами С6 гетероциклильной группы; 2,3-дигидро-1Н-индол-1-ил (индолин-1-ил) представляет собой пример С9 гетероциклильной группы; и декагидрохинолин-5-ил и 1,2,3,4-тетрагидрохинолин-4-ил оба являются примерами С10 гетероциклильной группы.
Гетероциклильная группа может необязательно содержать заместители.
Необязательные заместители представляют собой заместители, описанные ниже.
В одном варианте реализации, где гетероциклильная группа содержит два или больше конденсированных колец, каждое кольцо является неароматическим.
В одном варианте реализации гетероциклильная группа содержит одно кольцо.
В неароматическом кольце расположен по меньшей мере один гетероатом.
-G
Группа -G выбрана из С3-10 циклоалкила, С2-12 алкила и С5-12 арила. Каждый из этих вариантов описан ниже. Описанные ниже группы в соответствующих случаях могут применяться с любым -L1- и -L2-.
С3-10 циклоалкил
N-концевой заместитель полимиксина может включать а С3-10 циклоалкильную группу ("циклоалкильную группу"). Соответственно, -G может представлять собой С3-10 циклоалкил.
Если -G представляет собой С3-10 циклоалкил, -L1- может представлять собой ковалентную связь, С1-12 алкилен или С2-10 гетероалкилен, например, ковалентную связь или С1-12 алкилен.
В случае, когда -G представляет собой С3-10 циклоалкил, -L2- может представлять собой ковалентную связь или С4-12 гетероциклил, например, ковалентную связь.
В одном варианте реализации С3-10 циклоалкил представляет собой С3-8 или С3-6 циклоалкил.
В одном варианте реализации С3-10 циклоалкил представляет собой циклопентил или циклогексил.
В одном варианте реализации циклоалкил, если он содержит заместители, содержит максимум один или два заместителя, которые могут быть одинаковыми или разными.
В одном варианте реализации число заместителей циклоалкильной группе не превышает число атомов углерода в этой циклоалкильной группе. Соответственно, в тех случаях, когда алкильная группа представляет собой С6 алкильную группу, она может содержать не более шести заместителей.
В одном варианте реализации общее число атомов углерода в циклоалкильной группе, вместе с общим числом атомов углерода, присутствующих в -R6 и -R7 (если таковые присутствуют), составляет по меньшей мере 5, по меньшей мере 6, по меньшей мере 7 или по меньшей мере 8.
В одном варианте реализации циклоалкил представляет собой циклогексил, содержащий единственную гидроксильную группу или группу -NR6R7, например 4-замещенную циклогексильную группу. В одном варианте реализации циклоалкил представляет собой циклопентил, содержащий единственную гидроксильную группу или группу или -NR6R7, такой как 2- или 3-замещенная циклопентильная группа.
В одном варианте реализации циклоалкил не имеет заместителей. В этом варианте реализации заместители расположены на линкере -L2-L1-, который, соответственно, не может быть ковалентной связью.
В одном варианте реализации например, в случае, когда ядро соединения Формулы (I) представляет собой нонапептидный полимиксин В, группа G-L2-L1- не является 2-аминоциклогексилом, 3-аминоциклогексилом или 4-аминоциклогексилом.
Во избежание сомнений "циклоалкил" относится к группе, которая (1) содержит систему колец, которая содержит одно кольцо или два или больше конденсированных колец, причем одно кольцо из конденсированной системы колец может представлять собой ароматическое кольцо, и которая (2) присоединена к остальной молекуле атомом неароматического кольца (т.е., атомом кольца, который является частью неароматического кольца, которое является частью системы колец). Например: циклоалкил представляет собой пример С6 циклоалкильной группы; и тетралин-2-ил представляет собой пример С10 циклоалкильной группы.
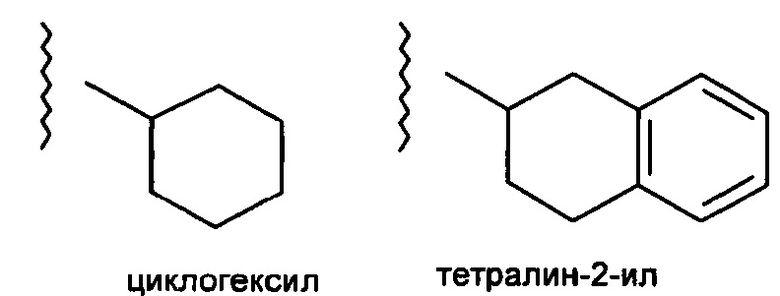
В случае, когда присутствует ароматическое кольцо, оно может необязательно содержать заместители. Необязательные заместители представляют собой заместители, описанные в качестве необязательных заместителей для С5-12 арильной группы.
В одном варианте реализации, где циклоалкил включает два или больше конденсированных колец, каждое кольцо является неароматическим.
В одном варианте реализации циклоалкильная группа содержит одно кольцо.
С2-12 алкил
N-концевой заместитель полимиксина может представлять собой С2-12 алкильную группу ("алкильную группу"). Соответственно, -G может представлять собой С2-12 алкил. В случае, когда -G представляет собой С2-12 алкил, -L1- может представлять собой ковалентную связь или С2-10 гетероалкилен, в частности, ковалентную связь. В случае, когда -G представляет собой С2-12 алкил, -L2- может представлять собой ковалентную связь или С4-12 гетероциклил, например, ковалентную связь. В одном варианте реализации, где -G представляет собой С2-12 алкил, и -L2- и -L1- представляют собой ковалентные связи. Соответственно, -G связан напрямую с -Х-.
В одном варианте реализации С2-12 алкил представляет собой С3-12 алкил, например, С4-12 или С6-12 алкил.
В одном варианте реализации С2-12 алкил представляет собой С2-6 алкил, например, С2-4 алкил.
Алкильная группа является насыщенной, алифатической алкильной группой. Алкильная группа может являться линейной или разветвленной алкильной группой.
В одном варианте реализации алкильная групп является разветвленной, причем боковая цепь не расположена на атоме углерода, который находится в положении а по отношению к группе -L2-, -L1- или -Х-.
В одном варианте реализации число заместителей на алкильной группе не превышает число атомов углерода в алкильной группе. Соответственно, в случае, когда алкильная группа представляет собой С2 алкильную группу, она может содержать в качестве заместителя не более двух заместителей.
В одном варианте реализации общее число атомов углерода в алкильной группе, вместе с общим числом атомов углерода, присутствующих в -R6 и -R7 (если таковые присутствуют) составляет по меньшей мере 5, по меньшей мере 6, по меньшей мере 7 или по меньшей мере 8.
В одном варианте реализации алкильная группа содержит заместитель на концевом углероде. Концевой углерод относится к атому углерода, который в отсутствие заместителей представлял бы собой -СН3. В разветвленной алкильной группе этот углерод может представлять собой атом углерода, который находится на конце самой длинной линейной части алкильной группы.
В одном варианте реализации алкильная группа содержит заместитель, который расположен при атоме углерода, который находится в положении β или γ относительно концевого атома углерода.
Как отмечалось выше, в одном варианте реализации группа -NR6R7, в тех случаях, когда она присутствует в качестве заместителя на алкильной группе, представляет собой заместитель на атоме углерода, который не является а по отношению к группе -L2-, -L1-или -Х-.
Как отмечалось выше, в одном варианте реализации гидроксильная группа, в тех случаях, когда она присутствует в качестве заместителя алкильной группы, представляет собой заместитель на атоме углерода, расположенном в положении а по отношению к группе -L2-, -L1- или -Х-.
В одном варианте реализации алкильная группа не содержит заместителей на атоме углерода, расположенном в положении α по отношению к группе -L2-, -L1- или -Х-.
В одном варианте реализации алкил, если он содержит заместители, содержит максимум один или два заместителя, которые могут быть одинаковыми или разными.
В альтернативных аспектах настоящего изобретения группа -G представляет собой C1-12 алкильную группу, а не С2-12 алкильную группу, и эта алкильная группа содержит в качестве заместителей гидроксильные группы и/или группы -NR6R7, в соответствующих случаях. В одном варианте реализации -R5 представляет собой С1-12 алкильную группу, такую как C1 алкил. В случае, когда -R5 представляет собой C1 алкил, присутствует один заместитель, такой как одна группа -NR6R7.
Алкильная группа может необязательно содержать дополнительные заместители, как подробно описано ниже. В одном варианте реализации алкильная группа, если она содержит заместители, содержит в качестве заместителей только гидроксильные группы или -NR6R7, в соответствующих случаях.
С5-12 арил
N-концевой заместитель полимиксина может включать или представлять собой С5-12 арильную группу ("группа"). Соответственно, -G может представлять собой С5-12 арил.
В случае, когда -G представляет собой С5-12 арил, -L1- может представлять собой ковалентную связь, C1-12 алкилен или С2-10 гетероалкилен, например, ковалентную связь или C1-12 алкилен.
В случае, когда -G представляет собой С5-12 арил, -L2- может представлять собой ковалентную связь или С4-12 гетероциклил, например, ковалентную связь.
Арильная группа необязательно содержит заместители, дополнительно к любым гидроксильным группам или группа -NR6R7.
В одном варианте реализации С5-12 арил представляет собой С5-7 арил
В одном варианте реализации С5-12 арил представляет собой С6-10 карбоарил или С5-12 гетероарил.
В одном варианте реализации С5-12 арил представляет собой С6-10 карбоарил.
В одном варианте реализации С6-10 карбоарил представляет собой фенил или нафтил.
В одном варианте реализации С6-10 карбоарил представляет собой фенил.
В одном варианте реализации С5-12 арил представляет собой С5-12 гетероарил, например, С5-10, С5-6, С5 или С6 гетероарил. Гетероарил может содержать один или два атома азота и, в качестве доплолнения или альтернативы, в случае, когда гетероарил представляет собой С5 гетероарил, он может содержать атом кислорода или серы. В одном варианте реализации С5-12 гетероарил независимо представляет собой фуранил, тиенил, пирролил, имдазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридил, пиримидинил, пиразинил, пиридазинил, хинолинил, изохинолинил или индол. В качестве дополнения или альтернативы С5-12 гетероарил независимо представляет собой пиридон.
В случае, когда гетероарил присутствует в группе -G, он связан с -L1-, -L2- или -Х- через атом углерода в кольце или атом N в кольце, если таковой присутствует.В одном варианте реализации гетероарил связан через атом углерода в кольце. В другом варианте реализации гетероарил связан через атом азота в кольце, если таковой присутствует.
В одном варианте реализации С5-12 арил представляет собой фенил или пиридин.
Во избежание сомнений, "гетероарил" относится к группе, которая (1) содержит один или больше гетероатомов (например, N, О, S), образующих часть системы колец, причем система колец содержит одно кольцо или два или больше конденсированных колец, причем по меньшей мере одно кольцо в этой системе колец представляет собой ароматическое кольцо, и (2) которая присоединена к остальной молекуле атомом ароматического кольца (т.е., атомом кольца, которое является частью ароматического кольца, которое является частью системы колец). Например: пиридил представляет собой пример С6 гетероарильной группы; изохинолил представляет собой пример С10 гетероарильной группы; и 1,2,3,4-тетрагидро-изохинолинил-7-ил представляет собой пример С10 гетероарильной группы.
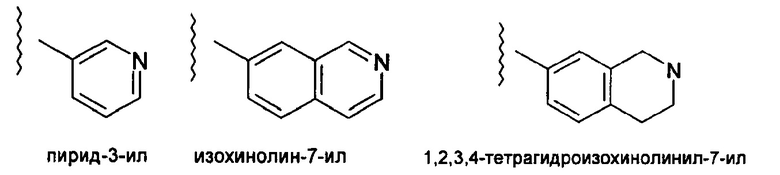
В одном варианте реализации атом ароматического кольца содержит гетероатом кольца.
В одном варианте реализации, где присутствует неароматическое кольцо, оно не содержит необязательных заместителей (хотя оно может содержать одну или больше гидроксильных групп или групп -NR6R7).
В другом варианте реализации, где присутствует неароматическое кольцо, оно необязательно содержит заместители. Подходящие необязательные заместители для неароматических колец обсуждаются ниже в связи с циклоалкильными группами (в которых неароматическое кольцо содержит в кольце только атомы углерода) и гетероциклильными группами (в которых неароматическое кольцо содержит один или больше гетероатомов в кольце).
В одном варианте реализации, где гетероарил содержит два или больше конденсированных колец, каждое кольцо представляет собой ароматическое кольцо. В одном варианте реализации гетероарильная группа содержит одно ароматическое кольцо.
Аналогичным образом, "карбоарил" относится к группе, которая (1) содержит систему колец, включающую одно кольцо или два или больше конденсированных колец, причем по меньшей мере одно кольцо в этой системе колец представляет собой ароматическое кольцо, и которая (2) присоединена к остальной молекуле атомом ароматического кольца (т.е., атомом кольца, которое является частью ароматического кольца, которое является частью системы колец). Например: фенил представляет собой пример С6 карбоарильной группы; и тетралин-6-ил представляет собой пример С10 карбоарильной группы.
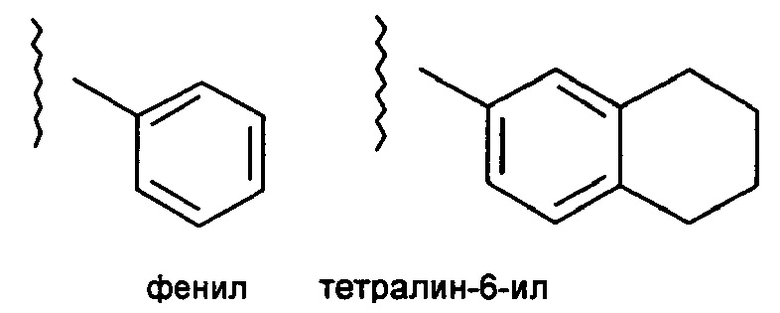
В одном варианте реализации, где карбоарил содержит два или больше конденсированных колец, каждое кольцо представляет собой ароматическое кольцо.
В одном варианте реализации С5-12 арил не является диаминофенилом, таким как 3,5-диаминофенил, например, если -Х- представляет собой -С(О)- и если -L1- и -L2- оба представляют собой ковалентные связи.
В одном варианте реализации С5-12 арил не является тригидроксифенилом, таким как 3,4,5-тригидроксифенил, например, если -Х- представляет собой -С(О)-.
Следует отметить, что Sandow с соавт. (US 5,565,423) описывают октапептиды полимиксина с модифицированным N-концом. N-концевая группа содержит фенильную группу, которая необязательно содержит в качестве заместителей 1, 2 или 3 идентичных или разных групп, выбранных из гидроксила, алкокси, амино, карбоксила, алкиламино и галогена. Фенильная группа может быть связана с N-концом алкиленовым спейсером и/или имино-оксимной группой. В альтернативном варианте N-концевая группа содержит группу 2-аминотиазо-4-ила.
Рабочие примеры, описанные Sandow с соавт., ограничены окстапептидами, содержащими группу 2-аминотиазол-4-ила, бензильную группу или 3,4,5-тригидроксифенильную группу. Примеры, в которых применяется нонапептид или декапептид, отсутствуют, и также отсутствуют примеры, в которых N-концевая группа содержит функциональную аминогруппу.
Следует отметить, что в WO 2012/168820 описаны декапептидные полимиксины с модифицированным N-концом. В публикации указано на то, что N-концевая группа может включать арильную, аралкильную, гетероарильную и гетероаралкильную функциональные группы, среди других вариантов. Арильная и гетероарильная группы могут быть связаны с другими арильными или гетероарильными группами, среди других вариантов. Линкер может представлять собой связь, -(СН2)n-, -(СН2)n-O-(СН2)р-, -(СН2)n-S-(CH2)p- или -(CH2)n-NR3-(CH2)p-, где n равен 0, 1, 2 или 3; и p равен 0, 1, 2 или 3; и R3 представляет собой Н или СН3.
Реальные примеры в WO 2012/168820 ограничены соединениями в которых одна арильная или гетероарильная группа связана непосредственно с другой арильной или гетероарильной группой. Примеры, в которых присутствует линкер, отсутствуют.
Соединения согласно настоящему изобретению отличаются от соединений, описанных в WO 2012/168820 по меньшей мере тем, что соединения, описанные в настоящем документе, не включают производные в которых арильная группа связана с N-концом производного нонапептидного полимиксина через другую алкильную группу. В настоящем случае арильная группа -G представляет собой связана с N-концом напрямую или через линкерную группу -L2-L1-. Линкерная группа -L2-L1- не включает арилен.
Кроме того, в соединениях, описанных в настоящем документе, N-концевая группа -R5 должна содержать заместители -гидроксил и/или -NR6R7, или содержать азотосодержащую гетероалкиленовую, гетероциклиленовую или гетероциклильную группу. Такие группы отсутствуют в соединениях, приведенных в качестве примеров в WO 2012/168820. Реальные примеры и примеры сравнения, приведенные в настоящем документе, демонстрируют, что соединения, которые не содержат указанных необходимых функциональных групп, имеют более низкую активность. Соединение-пример 37, содержащее группу пиперидина на N-конце, можно сравнить с приведенным в качестве сравнительного примера соединением С5, которое содержит на N-конце группу пиридина. Соединение 37 обладает более высокой активностью в отношении различных штаммов K. pneumoniae и P. aeruginosa, чем С5 (см. Таблицу 5А).
Следует отметить, что в настоящем документе гетероциклил и гетероциклилен относятся к группами, содержащим по меньшей мере одно неароматическое кольцо. Следует отметить, что гетероарил в настоящем документе обозначает группу, содержащую кольцо, содержащее по меньшей мере один гетероатом, такую как содержащее по меньшей мере один гетероатом ароматическое кольцо.
Соединения, содержащие арильные группы на N-конце, описаны также Magee с соавт., J. Med. Chem., 2013, 56, 5079. Примером является соединение 5х, в котором ариьная группа связана с N-концом производного нонапептидного полимиксина через группу пиридона. Такие соединения не подпадают под определения, приседенные в настоящем документие. Как объясняется выше, пиридоновая группа не рассматривается как гетероцикленовая группа в значении этого термина применительно к линкеру -L2-. Следует отметить, что было обнаружено, что соединение 5х менее активно, чем РМВ, против штаммов P. aeruginosa в модели нейтропении бедра у мышей.
Заместители арильной группы
Группа -R5 может включать арильную группу, например, в которой -G представляет собой С5-12 арил, или С3-10 циклоалкил содержит конденсированное ароматическое кольцо, или где -D представляет собой С4-10 гетероциклил, содержащий конденсированное ароматическое кольцо.
Каждая арильная группа необязательно содержит в один или больше заместителей. В случае, когда арильная группа необязательно замещена, могут присутствовать один, два или три необязательных заместителя.
В случае, когда гетероарильная группа содержит заместители, заместители могут располагаться на атоме углерода в кольце, например на атоме углерода в ароматическом кольце.
Каждый необязательный заместитель выбран из списка, состоящего из -С1-4 алкила, галогена, -CN, -NO2, -CF3, -NR10C(O)R10, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -OCF3, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-4 алкил.
В одном из альтернативных вариантов реализации, каждый необязательный заместитель выбран из списка, состоящего из -C1-8 алкила, такого как -С1-4 алкил, галоген, -CN, -NO2, -CF3, -C(O)R10, -NR10C(O)R10, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -OCF3, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -C1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-10 алкил, такой как -С1-4 алкил.
В одном варианте реализации каждый необязательный заместитель независимо выбран из -С1-8 алкила, такого как -С1-4 алкил, галогена, -NR10C(O)R10, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -OCF3, -NR10CON(R10)2, -OR9 и -SR9, причем каждый -R9 независимо представляет собой -С1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-10 алкил, такой как -С1-4 алкил. В одном варианте реализации каждый необязательный заместитель независимо выбран из -C1-8 алкил, такой как -С1-4 алкил и галогена.
В одном варианте реализации галогенсодержащая группа представляет собой -F, -Cl или -Br.
В одном варианте реализации а заместитель представляет собой -C1-8 алкил, такой как -С1-4 алкил.
В одном варианте реализации, где в ароматическом кольце присутствует атом азота, он может необязательно нести заместители -R9 или -R10, в соответствующих случаях. Обычно, атом азота ароматического кольца не имеет заместителей или необязательно несет в качестве заместителя -С1-8 алкил, такой как -С1-4 алкил, -C(O)R10, -CON(R10)2, -COOR9, SO2N(R10)2 и -SO2R10. Указание замещения при атоме азота в ароматическом кольце относится к замене водородного радикала в группе NH группой-заместителем, например, в случае, когда NH находится в ароматических группах, таких как пиррол, пиразол и имидазол. В одном варианте реализации замещение не относится к кватеринизированным атомам азота в кольце.
Необязательные заместители могут включать -С1-8 алкильную группу, такую как С1-4 алкильная группа, например, -R9 или -R10, самостоятельная или являющуюся частью более крупной группы-заместителя. Следует отметить, что каждая присутствующая C1-8 алкильная группа, такая как С1-4 алкильная группа, может содержать в качестве заместителя одну, две или три гидроксильные группы и/или группа -NR6R7.
В одном варианте реализации -R9 или -R10 не содержат в качестве заместителей гидроксильные группы или группы -NR6R7.
Алкильная, циклоалкильная и гетероциклильная группы-заместители
В одном варианте реализации, где алкильная, циклоалкильная или гетероциклильная группа присутствует в -R5, эта группа независимо и необязательно содержит один или больше заместителей, выбранных из -С1-10 алкила, такого как -С1-4 алкил, галогена, -CN, -NO2, -CF3, -C(O)R10, -NR10C(O)R10, -OCF3, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 независимо представляет собой -С1-10 алкил, такой как -С1-4 алкил, и каждый -R10 независимо представляет собой -Н или -С1-10 алкил, такой как -С1-4 алкил, за тем исключением, что алкил не содержит в качестве заместителя алкил.
В одном варианте реализации необязательные заместители выбраны из -С1-10 алкила, такого как -С1-4 алкил, -CN, -NO2, -C(O)R10, -NR10C(O)R10, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 и -R10 имеет определенное выше значение.
В одном варианте реализации необязательные заместители выбраны из -С1-10 алкила, такого как -С1-4 алкил, -C(O)R10, -NR10C(O)R10, -CON(R10)2, -COOR9, -OCOR10, -NR10COOR10, -OCON(R10)2, -NR10CON(R10)2, -OR9, -SR9, -NR10SO2R10, -SO2N(R10)2 и -SO2R10, причем каждый -R9 и -R10 имеет определенное выше значение.
В одном варианте реализации алкильная, циклоалкильная или гетероциклильная группа не содержит необязательных заместителей.
В одном варианте реализации каждый необязательный заместитель независимо выбран из -С1-8 алкила, такого как -С1-4 алкил.
В одном варианте реализации каждый необязательный заместитель независимо выбран из -С1-8 алкила, такого как -C(O)R10.
Гетероциклическая группа может содержать заместитель на атоме углерода в кольце или атоме азота в кольце. В случае, когда гетероциклильная группа содержит заместитель на атоме азота, заместители для этого атома выбраны соответствующим образом. Например, атом азота в кольце может нести в качестве заместителя группу, выбранную из -С1-4 алкила, -CF3, -C(O)R10, -CON(R10)2, -COOR9, -SO2N(R10)2 и -SO2R10. В другом примере атом азота в кольце может нести в качестве заместителя -С1-4 алкил, -C(O)R10, и -COOR9.
Необязательные заместители могут включать -C1-8 алкильную группу, такую как С1-4 алкильная группа, например, -R9 или -R10, отдельно, или в качестве части более крупной группы-заместителя. Следует отметить, что каждая присутствующая C1-8 алкильная группа, в частности, каждая С1-4 алкильная группа, может содержать в качестве заместителя однк, две или три гидроксильные группы и/или группы -NR6R7. В одном варианте реализации -R9 или -R10 не содержат в качестве заместителя гидроксильную группу и группу -NR6R7.
-R6 и -R7
В одном варианте реализации каждый -R6 и -R7, в случаях его присутствия, представляет собой Н.
В одном варианте реализации -R6 представляет собой Н, и -R7 представляет собой алкил, такой как метил или этил, например, метил.
В одном варианте реализации -R6 представляет собой метил или этил, например, метил.
В случае, когда -G представляет собой арильную или циклоалкильную группу, -R6 и -R7 могут вместе с атомом азота образовывать гетероцикл, например, С4-10 гетероциклил.
В одном варианте реализации С4-10 гетероциклил содержит один или два гетероатома, выбранные из N, S и О. В случае, когда присутствует атом S, он может иметь форму S, S(O) или S(O)2. В случае, когда присутствует атом N, он может иметь форму NH или NR, где R представляет собой С1-4 алкил, такой как метил или этил.
В одном варианте реализации С4-10 гетероциклил представляет собой пиперидинил, пиперазинил, морфолинил, диоксанил, тиоморфолинил (включая окисленный тиоморфолинил), или пирролидинил.
В одном варианте реализации С4-10 гетероциклил представляет собой пиперидинил, пиперазинил, тиоморфолинил (включая окисленный тиоморфолинил), пирролидинил или морфолинил.
В одном варианте реализации С4-10 гетероциклил представляет собой пиперидинил, пиперазинил или пирролидинил.
В одном варианте реализации одна группа -NR7R8, в случае ее присутствия, представляет собой гуанидиновую группу, такую как -NHC(NH)NH2.
-R9
В одном варианте реализации -R9 представляет собой метил или этил.
В одном варианте реализации -R9 представляет собой метил.
-R10
В одном варианте реализации -R10 представляет собой -Н.
В одном варианте реализации -R10 представляет собой метил или этил.
В одном варианте реализации -R10 представляет собой метил.
Соли, сольваты и другие формы
Примеры солей соединения Формулы (I) и (II) включают все фармацевтически приемлемые соли, такие как, но не ограничиваясь перечисленными: соли присоединения кислоты с сильными минеральными кислотами, такими как соли HCl и HBr, и соли присоединения с сильными органическими кислотами, такими как соль метансульфоновой кислоты. Дополнительные примеры солей включают сульфаты и ацетаты, такие как трифторацетат или трихлорацетат.
В одном варианте реализации соединения согласно настоящему изобретению предложены в форме сульфата или соли трифторуксусной кислоты (TFA, ТФУК). В одном варианте реализации соединения согласно настоящему описанию предложены в форме солей-ацетатов.
Соединение Формулы (I) или (II) также может быть представлено в форме пролекарства. Пролекарства могут включать антибактериальное соединение, описанное в настоящем документе, в котором одна или больше аминогрупп защищены группой, которая может быть отщеплена in vivo с высвобождением биологически активного соединения. В одном варианте реализации пролекарство представляет собой "аминное прорлекарство". Примеры аминных пролекарств включают сульфометил, описанный, например, Bergen с соавт., в Antimicrob. Agents and Chemotherapy, 2006, 50, 1953, или HSO3-FMOC, описанный, например, в Schechter et al, J. Med Chem 2002, 45(19) 4264, и их соли. Другие примеры аминных пролекарств приводят Krise и Oliyai в Biotechnology: Pharmaceutical Aspects, 2007, 5(2), 101-131.
В одном варианте реализации соединение Формулы (I) или (II) представлено в форме пролекарства.
Указание соединения Формулы (I) или (II) также относится к сольватам этого соединения. Примеры сольватов включают гидраты.
Соединение Формулы (I) или (II) включает соединение, в котором один из атомов заменен на природный или не встречающийся в природе изотоп. В одном варианте реализации изотоп представляет собой стабильный изотоп. Так, описанное в настоящем документе соединение включает, например, соединения, содержащие дейтерий, и т.п.. Например, Н может иметь форму любого изотопа, включая 1Н, 2Н (D) и 3Н (Т); С может иметь форму любого изотопа, включая 12С, 13С, и 14С; О может иметь форму любого изотопа, включая 16O и 18O; и т.п.
Некоторые соединения Формулы (I) или (II) могут существовать в одной или более конкретных геометрических, оптических, энантиомерных, диастериомерных, эпимерных, атроповых, стереоизомерных, таутомерных, конформационных или аномерных формах, включая, но не ограничиваясь следующими: цис- и транс-формы; Е- и Z-формы; с-, t-, и r- формы; эндо- и экзо-формы; R-, S- и мехо-формы; D- и L-формы; d- и I-формы; (+) и (-) формы; кето-, енольные и енолатныеформы; син- и анти-формы; синклинальные и антиклинальные формы; α- и β-формы; касиальные и экваториальные формы; формы ванны, кресла, твист-форма и полукресло; и их комбинации, которые далее в настоящем документе обозначаются общим термином "изомеры" (или "изомерные формы").
Следует отметить, что за исключением приведенного ниже обсуждения таутомерных форм, в настоящем документе из термина «изомеры» специально исключены структурные изомеры (изомеры структуры) (т.е., изомеры, которые различаются связями между атомами, а не просто положением атомов в пространстве). Например, указание метокси-группы, -ОСН3, не ограничивается только ее структурным изомером, гидроксиметильной группой, -СН2ОН. Аналогичным образом, указание орто-хлорфенила не ограничивается только его структурным изомером, мета-хлорфенилом. Однако указание класса структур может также включать структурные изомерные формы, входящие в этот класс (например, алкил включает н-пропил и изо-пропил; бутил включает н-, изо-, сек-, и трет-бутил; метоксифенил включает орто-, мета- и параметоксифенил).
Если не указано иное, указание конкретного соединения включает все такие изомерные формы, включая их смеси (например, рацемические смеси). Способы получения (например, асимметричный синтез) и разделения (например, фракционная кристаллизация и хроматографические средства) таких изомерных форм либо известны в данной области, либо могут быть легко получены путем адаптации способов, описанных в настоящем документе, или известных способов, известным образом.
Один из аспектов настоящего изобретения относится к соединениям в по существу очищенной форме и/или в форме, по существу свободной от примесей.
В одном варианте реализации по существу очищенная форма соответствует по меньшей мере 50% по массе, например, по меньшей мере 60% по массе, например, по меньшей мере 70% по массе, например, по меньшей мере 80% по массе, например, по меньшей мере 90% по массе, например, по меньшей мере 95% по массе, например, по меньшей мере 97% по массе, например, по меньшей мере 98% по массе, например, по меньшей мере 99% по массе.
В отсутствие других указаний по существу очищенная форма относится к соединению с любой стереоизомерной или энантиомерной форме. Например, в одном варианте реализации по существу очищенная форма относится к смеси стереоизомеров, т.е. очищена относительно других соединений. В одном варианте реализации по существу очищенная форма относится к одному стереоизомеру, например, оптически чистому стереоизомеру. В одном варианте реализации по существу очищенная форма относится к смеси энантиомеров. В одном варианте реализации по существу очищенная форма относится к эквимолярной смеси энантиомеров (т.е. рацемической смеси, рацемату). В одном варианте реализации по существу очищенная форма относится к одному энантиомеру, например, оптически чистому энантиомеру.
В одном варианте реализации примеси составляют не более 50% по массе, например, не более 40% по массе, например, не более 30% по массе, например, не более 20% по массе, например, не более 10% по массе, например, не более 5% по массе, например, не более 3% по массе, например, не более 2% по массе, например, не более 1% по массе.
Если не указано иное, примеси относятся к другим соединениям, т.е. отличным от стереоизомеров или энантиомеров. В одном варианте реализации примеси относятся к другим соединениям и другим стереоизомерам. В одном варианте реализации примеси относятся к другим соединениям и другому энантиомеру.
В одном варианте реализации по существу очищенная форма характеризуется по меньшей мере 60% оптической чистотой (т.е., 60% соединения, в молярном отношении, составляет целевой стереоизомер или энантиомер, и 40% составляет нецелевой стереоизомер или энантиомер), например, по меньшей мере 70% оптической чистотой, например, по меньшей мере 80% оптической чистотой, например, по меньшей мере 90% оптической чистотой, например, по меньшей мере 95% оптической чистотой, например, по меньшей мере 97% оптической чистотой, например, по меньшей мере 98% оптической чистотой, например, по меньшей мере 99% оптической чистотой.
Предпочтительные соединения
В одном варианте реализации соединение Формулы (I) или (II) выбрано из групп, состоящих из примеров соединений, описанных в настоящем документе.
В одном аспекте настоящего изобретения предложено соединение Формулы (I). В одном варианте реализации указанное соединение представляет собой соединение Формулы (I) при условии, что, R5-X- вместе не составляют группу, выбранную из списка, состоящего из Lys, Arg, Dap, Ser, Dab, Dgp (α,β-дигуанидинопропаноил), Thr и Abu. Это условие может применяться в случаях, когда -А- представляет собой ковалентную связь. Каждая из аминокислот может представлять собой L-аминокислоту. В одном варианте реализации соединение представляет собой соединение Формулы (I) при условии, что R5-X- вместе не является группой, выбранной из списка, состоящего из 2-аминоциклогексила, 3-аминоциклогексила и 4-аминоциклогексила. Это условие может применяться в случаях, когда -А- представляет собой ковалентную связь. Каждое из условий может применяться только в тех случаях, когда ядро соединения представляет собой Нонапептидный полимиксин В, т.е., когда -R1 - -R4 и -R8 имеют заместители, присутствующие в нонапептидном полимиксине В.
Способы лечения
Соединения Формулы (I) и (II) или фармацевтические составы, содержащие эти соединения, подходят для применения в способах лечения и профилактики. Соединения можно вводить нуждающемуся в этом субъекту. Соединения подходят для применения совместно с активным агентом ("вторым активным агентом"), например, вторым активным агентом, который представляет собой противомикробный агент. Соединения Формулы (I) и (II) предназначены для применения в способе терапевтического лечения организма человека или животного. В некоторых аспектах настоящего изобретения соединение Формулы (I) и (II) может вводиться субъекту - млекопитающему, такому как человек, для лечения микробной инфекции.
Другой аспект настоящего изобретения относится к применению соединения Формулы (I) и (II) в изготовлении лекарственного средства для применения в лечении. В одном варианте реализации лекарственное средство содержит соединение Формулы (I) и (II). В одном варианте реализации лекарственное средство предназначено для применения в лечении микробной инфекции.
Термин «микробная инфекция» относится к инвазии животного-хозяина патогенными микробами. Она включает избыточный рост микробов, которые присутствуют на теле животного или внутри него в норме. В более общем смысле, микробная инфекция может представлять собой любую ситуацию, в которой присутствие микробной популяции или популяций наносит вред животному-хозяину. Соответственно, животное "страдает" от микробной инфекции, когда на теле животного или внутри него присутствуют избыточные количества микробной популяции, или когда присутствие микробной популяции (популяций) наносит вред клеткам или другим тканям животного.
Соединения можно применять для лечения субъекта с микробной инфекцией, или с риском инфицирования микроорганизмом, таким как бактерия.
Микробная инфекция может представлять собой бактериальную инфекцию, такую как инфекция, вызванная грамотрицательными бактериями (грамотрицательная бактериальная инфекция).
Примеры грамотрицательных бактерий включают следующие, но не ограничиваются ими: Escherichia spp., Klebsiella spp., Enterobacter spp., Salmonella spp., Shigella spp., Citrobacter spp., Morganella morganii, Yersinia pseudotuberculosis и other Enterobacteriaceae, Pseudomonas spp., Acinetobacter spp., Moraxella, Helicobacter, Stenotrophomonas, Bdellovibrio, уксуснокислые бактерии, Legionella и альфа-протеобактерии, такие как Wolbachia и многие другие.
Имеющие медицинское значение грамотрицательные кокки включают три организма, которые вызвают заболевание, передающееся половым путем (Neisseria gonorrhoeae), менигнит (Neisseria meningitidis) и респираторные симптомы (Moraxella catarrhalis).
Имеющие медицинское значение грамотрицательные бациллы включают множество видов. Некоторые из них вызвают в основном респираторные проблемы (Hemophilus influenzae, Klebsiella pneumoniae, Legionella pneumophila, Pseudomonas aeruginosa), в основном проблемы с мочевыводящими путями (Escherichia coli, Enterobacter cloacae) и в первую очередь проблемы с желудочно-кишечным трактом (Helicobacter pylori, Salmonella enterica).
Грамотрицательные бактерии, связанные с внутрибольничными инфекциями, включают Acinetobacter baumannii, которая вызвает бактериемию, вторичный менингит и ИВЛ-ассоциированную пневмонию в реанимационных отделениях лечебных заведений.
В одном варианте реализации вид грамотрицательных бактерий выбран из группы, состоящей из Е. coli, S. enterica, K. pneumoniae, K. oxitoca; Е. cloacae, Е. aerogenes, Е. agglomerans, A. calcoaceticus, A. baumannii; Pseudomonas aeruginosa, Stenotrophomonas maltophila, Providencia stuartii, P. mirabilis и P. vulgaris.
В одном варианте реализации вид грамотрицательных бактерий выбран из группы, состоящей из E. coli, K. pneumoniae, Pseudomonas aeruginosa и A. baumannii.
Соединения Формулы (I) или (II) или композиции, содержащие такие соединения, можно применять для лечения инфекций кожи и мягких тканей, желудочно-кишечных инфекций, инфекций мочевыводящих путей, пневмонии, сепсиса, интраабдоминальных инфекций и акушерско-гинекологических инфекций. Инфекции могут представлять собой грамположительные или грамотрицательные инфекции.
Соединения Формулы (I) или (II) или композиции, содержащие такие соединения, можно применять для лечения инфекций, вызванных Pseudomonas, включая инфекции, вызванные P. aeruginosa,, например, инфекции кожи и мягких тканей, желудочно-кишечные инфекции, инфекции мочевыводящих путей, пневмонию и сепсис.
Соединения Формулы (I) или (II) или композиции, содержащие такие соединения, можно применять для лечения инфекций, вызванных акинетобактериями, включая инфекции, вызванные A. baumanii, связанных с пневмонией, инфекцией мочевыводящих путей и сепсисом.
Соединения Формулы (I) или (II) или композиции, содержащие такие соединения, можно применять для лечения инфекций, вызванных Klebsiella, включая инфекции, вызванные K. pneumoniae, в случае пневмонии, инфекции мочевыводящих путей, менингита и сепсиса.
Соединения Формулы (I) или (II) или композиции, содержащие такие соединения, можно применять для лечения инфекций, вызванных Е. coli, включая инфекции Е. coli, в случае бактериемии, холецистита, инфекций мочевыводящих путей, менингита у новорожденных и пневмонии.
Активный агент может представлять собой агент, обладающий активностью в отношении микроорганизма. Активный агент может обладать активностью в отношении грамотрицательных бактерий. Активный агент может обладать активностью в отношении микроорганизма, выбранного из приведенного выше списка.
В одном варианте реализации второй активный агент имеет значение MIC, равное 10 микрограмм/мл или меньше, в отношении такого микроорганизма как Е. coli, в отсутствие соединения Формулы (I) или (II). Микроорганизм может представлять собой микроорганизм из приведенной выше группы.
Конкретные соединения для применения в качестве вторых активных агентов описаны в настоящем документе и включают:
рифампицин, рифабутин, рифалазил, рифапентин и рифаксимин;
оксациллин, метициллин, ампициллин, клоксациллин, карбенициллин, пиперациллин, трикарциллин, флюклоксациллин и нафциллин;
азитромицин, кларитромицин, эритромицин, телитромицин, цетромицин и солитромицин;
азтреонам и BAL30072;
меропенем, дорипенем, имипенем, эртапенем, биапенем, томопенем и панипенем;
тигециклин, омадациклин, эравациклин, доксициклин и миноциклин;
ципрофлоксацин, левофлоксацин, моксифлоксацин и делофлоксацин;
фузидовую кислоту;
новобиоцин;
тейхопланин, телаванцин, далбаванцин и оритаванцин,
и их фармацевтически приемлемые соли и сольваты;
В одном варианте реализации конкретные соединения для применения в качестве вторых активных агентов описаны в настоящем документе и включают рифампицин (рифампин), рифабутин, рифалазил, рифапентин, рифаксимин, азтреонам, оксациллин, новобиоцин, фузидовая кислота, азитромицин, ципрофлоксацин, меропенем, тигециклин, эритромицин, кларитромицин и мупироцин, и их фармацевтически приемлемые соли и сольваты.
В альтернативном аспекте соединения Формулы (I) и (II) подходят для применения в лечении грибковых инфекций, например, в комбинации с противогрибковым агентом. Противогрибковый агент может быть выбран из полиеновых противогрибковых средств, например, амфотерцина В, имидазола, триазола, или тиазоловых противогрибковых средств, например, миконазола, флюконазола или абафунгина, аллиламина, эхинокандина или других агентов, например, циклопирокса.
Лечение
Термин «лечение» в контексте лечения состояния, относится в целом к лечению и терапии человека или животного (например, в ветеринарных приложениях), при которых достигается некоторый желаемый терапевтический эффект, например, подавление прогрессирования состояния, и включает снижение скорости прогрессирования, торможение скорости прогрессирования, облегчение симптомов состояния, облегчение состояния и излечивание состояния. Лечение в качестве профилактической меры (т.е., профилактика) также предусмотрено. Например, применение у пациентов, у которых еще не развилось состояние, но у которых есть риск развития состояния, включено в термин «лечение».
Термин «терапевтически эффективное количество» в настоящем тексте относится к количеству соединения, или материала, композиции или лекарственной формы, содержащих соединение, которое эффективно для достижения некоторого желательного терапевтического эффекта, связано с разумным соотношением польза/риск при введении с целевым режимом лечения.
Термин «лечение» включает комбинированные способы лечения и средства терапии, описанные в настоящем документе, объединяющие два или больше способов лечения или средств терапии, например, последовательно или одновременно
Комбинированная терапия
Соединение Формулы (I) или (II) может вводиться совместно с активным агентом. Введение может быть одновременным, раздельным или последовательным.
Способы и путь введения зависят от фармакокинетики соединения Формулы (I) или (II) и второго агента.
Под "одновременным" введением подразумевают, что соединение Формулы (I) или (II) и второй агент вводят субъекту в одной дозе одним и тем же путем введения.
Под "раздельным" введением подразумевают, что соединение Формулы (I) или (II) и второй агент вводят субъекту двумя различными путями введения в одно и то же время. Это может иметь место, например, в случае, когда один агент вводят путем инфузии, а другой дают перорально в течение инфузии.
Под "последовательным" подразумевают, что два агента вводят в различные моменты времени, при условии, что активность первого активного агента проявляется и сохраняется у субъекта в момент введения второго агента.
В целом, последовательное введение осуществляют таким образом, что второй из двух агентов вводят в течение 48 часов, предпочтительно в течение 24 часов, в частности, в течение 12, 6, 4, 2 часов или 1 часа после первого агента. В альтернативном варианте вначале могут вводить активный агент а затем соединение Формулы (I) или (II).
В конечном счете порядок и время введения соединения и второго агента в комбинированном лечении зависит от фрамакокинетических свойств каждого из них.
Количество соединения Формулы (I) или (II) для введения субъекту в конечном итоге зависит от природы субъекта и заболевания, которые лечат. Аналогичным образом, количество активного агента в конечном итоге зависит от природы субъекта и заболевания, которые лечат.
Составы
В одном аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение Формулы (I) или (II) вместе с фармацевтически приемлемым носителем. Фармацевтическая композиция может дополнительно содержать второй активный агент. В одном из альтернативных вариантов реализации, где присутствует второй агент для применения в терапии, второй агент может быть представлен отдельно от соединения Формулы (I) или (II). Соответственно, приведенные ниже комментарии, относящиеся к соединению Формулы (I) или (II), также применимы ко второму агенту, представленному отдельно.
Хотя соединение Формулы (I) или (II) может быть введено отдельно или совместно со вторым агентом, в предпочтительном случае оно представлено в виде фармацевтического состава (например, композиции, препарата, лекарственного средства), содержащего по меньшей мере одно соединение Формулы (I) или (II), описанных в настоящем документе, совместно с одним или большим числом других фармацевтически приемлемых ингредиентов, хорошо известных специалистам в данной области, включая следующие, но не ограничиваясь ими: фармацевтически приемлемые носители, разбавители, вспомогательные вещества, адъюванты, наполнители, буферы, консерванты, антиоксиданты, смазывающие вещества, стабилизаторы, солюбилизаторы, поверхностно-активные вещества (например, смачивающие вещества), маскирующие агенты, красители, вкусоароматические вещества и подсластители. Состав может дополнительно включать другие активные агенты, например, другие терапевтические или профилактические средства.
Соответственно, согласно настоящему изобретению также предложены фармацевтические композиции, определенные выше, и способы получения фармацевтической композиции, включающие смешивание по меньшей мере одного соединения Формулы (I) или (II), описанных выше, с одним или большим числом других фармацевтически приемлемых ингредиентов, хорошо известных специалистам в данной области, например, носителей, разбавителей, вспомогательных веществ и т.д. В случае изготовления в виде дискретных единиц (например, таблеток и т.д.), каждая единица содержит заранее определенное количество (дозировку) соединения. Композиции могут дополнительно необязательно содержать второй активный агент в заранее определенном количестве.
Термин «фармацевтически приемлемый» в настоящем документе относится к соединениям, ингредиентам, материалам, композициям, лекарственным формам и т.д., которые, в рамках обоснованного медицинского суждения, подходят для применения в контакте с тканями рассматриваемого субъекта (например, человека) без излишней токсичности, раздражения, аллергической реакции или других проблем или осложнений, при разумном соотношении польза/риск. Каждый носитель, разбавитель, вспомогательное соединение и т.д. также должен быть "приемлемым" в смысле совместимости с другими ингредиентами состава.
Подходящие носители, разбавители, вспомогательные вещества и т.д. могут быть найдены в стандартных фармацевтических текстах, например, Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Company, Easton, Pa., 1990; и Handbook of Pharmaceutical Excipients, 5th edition, 2005.
Составы могут быть получены любыми способами, известными в области фармацевтики. Такие способы включают этап приведения в контакт соединения Формулы (I) или (II) с носителем, который составляют один или больше вспомогательных ингредиентов. В целом, составы, получают путем равномерного и тщательного объединения соединения с носителями (например, жидкими носителями, тонкоизмельченным жидким носителем и т.д.) с последующим приданием формы продукту, если это необходимо.
Состав может быть приготовлен для обеспечения быстрого или медленного высвобождения, немедленного, отложенного высвобождения, высвобождения в выбранное время или замедленного высвобождения или их комбинации.
Составы могут, соответственно, быть представлены в форме жидкостей, растворов (например, водных, неводных), суспензий (например, водных, неводных), эмульсий (например, масло-в-воде, вода-в-масле), эликсиров, сиропов, электуариев, ополаскиваний для рта, капель, таблеток (включая, например, таблетки с покрытием), гранул, порошков, таблеток для рассасывания, пастилок, капсул (включая, например, твердые и мягкие из трагакантовой камеди), саше, пилюлей, ампул, болюсов, суппозиториев, пессариев, микстур, гелей, паст, мазей, кремов, лосьонов, масел, пенок, пенок, водных аэрозолей или аэрозолей.
Соответственно, составы могут быть представлены в форме пластыря, лейкопластыря, повязки, перевязочных материалов и т.п., которые содержат одно или больше соединений и необязательно одним или больше других фармацевтически приемлемых ингредиентов, включая, например, вещества, усиливающие проникновение, проницаемость и всасывание. Соответственно, составы могут также быть представлены в форме депо или резервуара.
Соединение может быть растворено в, суспендировано в или смешано с одним или большим числом фармацевтически приемлемых ингредиентов. Соединение может быть представлено в липосоме или других микрочастицах, которые предназначены для нацеливания соединения, например, на компоненты крови или один или больше органов. Следует отметить, что в случае, когда применяется липосома, липосома может содержать, и соединение Формулы (I) или (II), и второй агент.
Составы, подходящие для перорального введения (например, путем проглатывания) включают жидкости, растворы (например, водные, неводные), суспензии (например, водные, неводные), эмульсии (например, масло-в-воде, вода-в-масле), эликсиры, сиропы, электуарии, таблетки, гранулы, порошки, капсулы, саше, пилюли, ампулы, болюсы.
Составы, подходящие для буккального введения включают ополаскивания для рта, таблетки для рассасывания, пастилки, а также пластыри, лейкопластыри, депо и резервуары. Таблетки для рассасывания обычно содержат соединение во вкусовой основе, обычно сахарозе и гуммиарабике или трагаканте. Пастилки обычно содержат соединение в инертном матриксе, таком как трагакантовая камедь и глицерин, или сахароза и гуммиарабик. Ополаскивания для рта обычно содержат соединение в подходящем жидком носителе.
Составы, подходящие для подъязычного введения включают таблетки, таблетки для рассасывания, пастилки, капсулы и пилюли.
Составы, подходящие для введения через слизистые оболочки пероральным путем включают жидкости, растворы (например, водные, неводные), суспензии (например, водные, неводные), эмульсии (например, масло-в-воде, вода-в-масле), ополаскивания для рта, таблетки для рассасывания, пастилки, а также пластыри, лейкопластыри, депо и резервуары.
Составы, подходящие для введения через слизистые оболочки не пероральным путем включают жидкости, растворы (например, водные, неводные), суспензии (например, водные, неводные), эмульсии (например, масло-в-воде, вода-в-масле), суппозитории, пессарии, гели, пасты, мази, кремы, лосьоны, масла, а также пластыри, лейкопластыри, депо и резервуары.
Составы, подходящие для трансдермального введения включают гели, пасты, мази, кремы, лосьоны и масла, а также пластыри, лейкопластыри, повязки, перевязочные материалы, депо и резервуары.
Таблетки могут быть получены обычными средствами, например, прессованием или формованием, необязательно с применением одного или больше вспомогательных ингредиентов. Прессованные таблетки могут быть получены путем прессования в подходящем устройстве соединения в сыпучей форме, такой как порошок или гранулы, необязательно в смеси с одним или большим числом связующих (например, повидон, трагакантовая камедь, гуммиарабик, сорбит, трагакант, гидроксипропилметилцеллюлоза); наполнителей или разбавителей (например, лактозы, микрокристаллическая целлюлоза, двузамещенный фосфорнокислый кальций), смазывающими веществами (например, стеаратом магния, тальком, оксидом кремния), разрыхлителей (например, натрия крахмал гликолятом, поперечносшитым повидоном, поперечносшитой карбоксиметилцеллюлозой натрия), поверхностно-активными, диспергирующими или смачивающими веществами (например, лаурилсульфатом натрия), консервантами (например, метил п-гидроксибензоатом, пропил п-гидроксибензоатом, сорбиновой кислотаой, вкусоароматическими веществами, усилителями вкуса и подсластителями. Формованные таблетки могут быть изготовлены путем формования в подходящем устройстве, где смесь соединения в порошке смачивается инертным жидким разбавителем. Таблетки могут быть снабжены покрытием и могут быть изготовлены таким образом, чтобы обеспечить замедленное или контролируемое высвобождение соединения из них, с применением, например, гидроксипропилметилцеллюлозы в различных пропорциях для обеспечения желаемого профиля высвобождения. Таблетки могут быть (необязательно) снабжены покрытием, например, для изменения высвобождения, например, покрытием, растворяющемся в кишечнике, которое обеспечивает высвобождение в частях кишечника, отличных от желудка.
Мази обычно готовят из соединения и парафиновой или смешивающейся с водой основы для мази.
Кремы обычно готовят из соединения и основы крема типа масло-в-воде. При желании, водная фаза основы для крема может включать, например, по меньшей мере приблизительно 30% масс./масс. многоатомного спирта, т.е., спирта, содержащего два или больше гидроксильных групп, такие как, бутан-1,3-диол, маннитол, сорбит, глицерин и полиэтиленгликоль и их смеси. Может быть желательно, чтобы составы для топического применения включали соединение, которое усиливают всасывание или проникание соединения через кожу или другие пораженные области. Примеры таких веществ, улучшающих проникновение через кожу, включают диметилсульфоксид и родственные аналоги.
Эмульсии обычно готовят из соединения и масляной фазы, которая может содержать только эмульгатор (также известный как эмульгент), или может содержать смесь по меньшей мере одного эмульгатора с жиром или маслом или и с жиром, и с маслом. В предпочтительном варианте в них включают гидрофильный эмульгатор совместно с липофильным эмульгатором, который действует как стабилизатор. Также в предпочтительно включать и масло, и жир. Совместно, эмульгатор(ы) со стабилизатором(стабилиаторами) или без него образуют так называемый эмульсионный воск, и этот воск совместно с маслом и/или жиром составляют так называемую эмульсионную основу мази, которая составляет масляную диспергированную фазу препаратов в форме крема.
Подходящие эмульгаторы и стабилизаторы эмульсий включают Tween 60, Sp80, цетостеариловый спирт, миристиловый спирт, глицерил моностеарат и лаурилсульфат натрия. Выбор подходящих масел или жиров для состава основывается желаемых косметических свойствах, которые необходимо обеспечить, поскольку растворимость соединения в большинстве масел, которые вероятно будут применяться в фармацевтических эмульсионных составах, может быть очень низкой. Соответственно, крем в предпочтительном варианте будет представлять собой нежирный, не оставляющий пятен и смываемый продукт, имеющий консистенцию, позволяющую предотвращать вытекание из туб и других контейнеров. Можно применять одно- или двухосновные сложные эфиры линейных или разветвленных алкилов, такие как такие диизоадипат, изоцетилстеарат, пропиленгликолевый диэфир жирных кислот из кокосового масла, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известная под названием Crodamol САР, причем последние три соединения являются предпочтительными сложными эфирами. В зависимости от требуемых свойств указанные компоненты могут быть использованы в отдельности или в комбинации. В других случаях используют высокоплавкие липиды, такие как мягкий бесцветный парафин и/или вазелиновое масло или другие минеральные масла.
Составы, подходящие для интраназального введения, в которых носитель является жидким, включают, например, назальный спрей, назальные капли, или формы для введения в форме аэрозоля при помощи небулайзера, включают водные или масляные растворы соединения. В качестве альтернативного способа введения можно применять доставку в форме сухого порошка как альтернативу распыляемым аэрозолям.
Составы, подходящие для интраназального введения, в которых носитель является твердым, включают, например, представленные в форме крупного порошка с размером частиц, например, в диапазоне от приблизительно 20 до приблизительно 500 микрон, который вводят таким же образом, каким нюхают табак, т.е., путем быстрого вдыхания через носовые ходы из контейнера, содержащего порошок, который держат вблизи носа.
Составы, подходящие для введения в легкие (например, посредством ингаляционной или инсуффляционной терапии) включают составы, представленные в форме аэрозольного спрея в упаковке под давлением, с применением подходящего пропеллента, такого как дихлордифторметан, трихлорфторметан, дихлорртетрафторэтан, диоксид углерода или другие подходящие газы. Дополнительно или в качестве альтернативы, состав для легочного введения может быть представлен в форме для введения из небулайзера или ингалятора сухого порошка. Например, состав может быть дополнен носителями или липосомами для обеспечения размера частиц, подходящего для доставки в соответствующие части легкого, для облегчения доставки соответствующей дозы и/или для улучшения удержания в ткани легкого.
Составы, подходящие для глазного введения включают глазные капли, в которых соединение растворено или суспендировано в подходящем носителе, в частности, в водном растворителе для данного соединения.
Составы, подходящие для ректального введения, могут быть представлены в форме суппозитория с подходящей основой, включающей, например, природные или гидрогенезированные масла, воски, жиры, полутвердые или жидкие многоатомные спирты, например, масло какао или салицилат, или суспензии для лечения с применением клизмы.
Составы, подходящие для вагинального введения могут быть представлены в формах пессариев, тампонов, кремов, гелей, паст, пенок или спрея, содержащих, в дополнение к соединению, соответствующие носители, известные специалистам в данной области.
Составы, подходящие для парентерального введения (например, путем инъекции), включают водные или неводные, изотонические, апирогенные, стерильные жидкости (например, растворы, суспензии), в которых соединение растворено, суспендировано или содержится в другом виде (например, в липосомах или других микрокапсульных формах). Такие жидкости могут дополнительно содержать другие фармацевтически приемлемые ингредиенты, такие как антиоксиданты, буферы, консерванты, стабилизаторы, бактериостатики, суспендирующие вещества, загустители и растворяемые вещества, которые делают состав изотоничным крови (или другой соответствующей физиологической жидкости) предполагаемого реципиента. Примеры вспомогательных веществ включают, например, воду, спирты, многоатомные спирты, глицерин, растительные масла и т.п. Примеры подходящих изотонических носителей для применения в таких составах включают Хлорид натрия для инъекций, раствор Рингера или раствор Рингера лактатный для инъекций. Обычно концентрация соединения в жидкости составляет от приблизительно 1 нг/мл до приблизительно 100 мкг/мл, например, от приблизительно 10 нг/мл до приблизительно 10 мкг/мл, например, от приблизительно 10 нг/мл до приблизительно 1 мкг/мл. Составы могут быть представлены в закрытых контейнерах, содержащих одну дозу или множество доз, например, ампулах и флаконах, и могут храниться в сублимированном (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Экстемпоральные инъекционные растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток.
Дозировка
В целом, способы согласно настоящему изобретению могут включать введение субъекту эффективного количества соединения Формулы (I) или (II), что обеспечивает противомикробный эффект. Соединение Формулы (I) или (II) можно вводить в количестве, достаточном для потенцирования активности второго активного агента. Второй активный агент вводят субъекту в количестве, эффективном для обеспечения противомикробного действия.
Для специалиста в данной области понятно, что соответствующие дозировки соединения Формулы (I) или (II) или активного агента, и композиций, содержащих соединения Формулы (I) или (II) или активный агент, могут быть различными для разных пациентов. Определение оптимальной дозировки обычно включает уравновешивание уровня терапевтической пользы относительно любого риска или нежелательных побочных эффектов. Выбранный уровень дозировки будет зависеть от различных факторов, включая следующие, но не ограничиваясь ими: активность конкретного соединения Формулы (I) или (II) или активного агента, путь введения, время введения, скорость выведения соединение, продолжительность введения, другие лекарственные средства, соединения, и/или материалы, применяемые в комбинации, тяжесть состояния, и вид, пол, возраст, масса, состояние, общее состояние здоровья и предыдущая медицинская история пациента. Количество соединения Формулы (I) или (II) или активный агент и путь введения в конечном счете определяются суждением врача, ветеринара или клинициста, хотя в целом дозировку выбирают таким образом чтобы обеспечивать местную концентрацию с месте действия, которая обеспечивала желаемый эффект, не вызывая значительных вредных или разрушительных побочных эффектов.
Введение можно осуществлять одной дозой, непрерывно или с перерывами (например, дробными дозами с соответствующими интервалами) на протяжении курса лечения. Методы определения наиболее эффективных средств и дозировок для введения хорошо известны специалистам в соответствующей области, и варьируют в зависимости от составов, применяемых для терапии, цели терапии, клетки (клеток) - мишени лечения и субъекта лечения. Однократное или многократные введения могут осуществляться с применением уровня дозировки и схемы введения, выбранных лечащим врачом, ветеринаром или клиническим врачом.
В целом, подходящая доза соединения Формулы (I) или (II) или активного агента лежит в диапазоне от приблизительно 10 мкг до приблизительно 250 мг (в более типичном случае: от приблизительно 100 мкг до приблизительно 25 мг) на килограмм массы тела субъекта день. В случае, когда соединение Формулы (I) или (II) или активный агент представляет собой соль, эфир, амид, пролекарство и т.п., вводимое количество рассчитывают по исходному соединению таким образом, чтобы пропорционально увеличить фактически применяемую массу.
Наборы
Один аспект настоящего изобретения относится к набору, включающему (а) соединение Формулы (I) или (II), или композицию, содержащую соединение, определенное в любой из описанных выше Формул (I) или (II), например, в предпочтительном варианте, содержащемуся в подходящем контейнере с подходящей упаковкой; и (b) инструкции по применению, например, письменные инструкции относительно того, как вводить соединение или композицию.
Письменные инструкции могут также включать список показаний, для которых соединение Формулы (I) или (II) является подходящим средством лечения.
В одном варианте реализации набор дополнительно включает (с) второй активный агент или композицию, содержащую второй активный агент. В данном случае письменные инструкции могут также включать список показаний, для которых второй активный агент, вместе с соединением Формулы (I) или (II), является подходящим средством лечения.
Пути введения
Соединение Формулы (I) или (II), второй агент или фармацевтическую композицию, содержащую соединения Формулы (I) или (II) или второй агент, можно вводить субъекту с использованием любого удобного пути введения системного/периферического, либо топического (т.е., в участок желаемого действия).
Прим введения включают следующие, но не ограничиваются ими: пероральное (например, путем проглатывания), буккальное, подъязычное, трансдермальное (включая, например, посредством пластыря, накладки и т.д.), введение через слизистые оболочки (включая, например, посредством пластыря, накладки и т.д.), интраназальное (например, с применением назального спрея), глазное (например, в форме глазных капель), через легкие (например, путем ингаляции или инсуффляции с применением, например, аэрозоля, например, через рот или нос), ректальное (например, с применением суппозитория или клизмы), вагинальное (например, с применением пессария), парентеральное, например, путем инъекции, включая подкожную, внутрикожную, внутримышечную, внутривенную, внутриартериальную, внутрисердечную, интратекальную, интраспинальную, внутрикапсульную, субкапсулярную, интраорбитальную, внутрибрюшинную, интратрахеальную, подэпидермисную, внутрисуставную, субарахноидальную и чрезскожную; посредством имплантирования депо или резервуара, например,подкожно или внутримышечно.
Субъект/пациент
Субъект/пациент может представлять собой хордовое, позвоночное, млекопитающее, плацентарное млекопитающее, сумчатое (например, кенгуру, вомбат), грызуна (например, морскую свинку, хомяка, крысу, мышь), представителя семейства мышиных (например, мышь), зайцеобразное (например, кролика), птицу (например, птицу), представителя семейства собачьих (например, собаку), представителя семейства кошачьих (например, кошку), представителя семейства лошадиных (например, лошадь), представителя семейства свиней (например, свинью), представителя рода баранов (например, овцу), жвачное животное (например, корову), примата, представителя рода обезьян (например, мартышку или человекообразную обезьяну), обезьяну (например, игрунку, бабуина), человекообразную обезьяну (например, гориллу, шимпанзе, орангутанга, гиббона) или человека. Кроме того, субъект/пациент может находиться на любой стадии развития, например, представлять собой плод.
В одном предпочтительном варианте реализации субъект/пациент представляет собой человека.
Также предусмотрено, что настоящее изобретение может применяться для животного, не являющегося человеком, с микробной инфекцией. Не являющееся человеком млекопитающее может представлять собой грызуна. Грызуны включают крыс, мышей, морских свинок, шиншилл и других близких по размеру мелких грызунов, применяющихся в лабораторных исследованиях.
Способы получения
Соединения Формулы (I) и (II) могут быть получены путем обычного синтеза пептидов с использованием методов, известных специалистам в соответствующей области. Подходящие методы включают синтез в растворе, такой как описан Yamada с соавт., J. Peptide Res. 64, 2004, 43-50, или твердофазный синтез, такой как описан de Visser с соавт., J. Peptide Res, 61, 2003, 298-306, и Vaara с соавт., Antimicrob. Agents and Chemotherapy, 52, 2008. 3229-3236. Эти методы включают подходящие стратегии защиты и методы для этапа циклизации. В альтернативном варианте соединения могут быть получены из легкодоступных полимиксинов, например, путем удаления N-концевой аминокислоты полимиксина (остаток 1). Такие методы описаны в настоящем документе для получения соединений согласно настоящему изобретению на основе остатков 2-10 полимиксинов В и Е.
Как показано в настоящем документе, возможно дериватизировать N-концевую группу деацилированного полимиксина, такого как деацилированный полимиксин В и деацилированный нонапептидный полимиксин В, без дериватизации аминогрупп, которые присутствуют в боковых цепях этого полимиксина. Как описано в настоящем документе, боковые цепи полимиксина можно защищать селективно, не защищая N-концевую группу. Затем можно осуществить реакцию N-концевой группы с получением соответствующего N-концевого заместителя. Впоследствии защита с н-концевой группы может быть удалена.
Защищенный полимиксин также может быть расщеплен до соответствующего гептапептида путем отщепления аминокислот 1-3. Методы этого расщепления описаны в публикациях WO 2012/168820 и WO 1988/00950. Как показано в настоящем документе, дериватизацию можно осуществить путем связывания с содержащими соответствующие заместители дипептидами или трипептидами, что обеспечивает получение новых производных полимиксина.
Другие предпочтения
Каждая и все возможные комбинации вариантов реализации, описанные выше, в явном виде раскрыты в настоящем документе так как если бы каждая и все комбинации были указаны отдельно и в явном виде.
Различные дополнительные аспекты и варианты реализации настоящего изобретения станут ясны для специалиста в данной области на основании настоящего описания.
"И/или" в настоящем тексте следует понимать как конкретное описание каждого из двух указанных признаков или компонентов совместно друг с другом или друг без друга. Например, "А и/или В" следует понимать как раскрытие конкретно каждого из следующих вариантов: (i) A, (ii) В и (iii) А и В, так как если бы каждый из этих вариантов был приведен в настоящем документе отдельно.
Если контекст не указывает на иное, описания и определения приведенных выше признаков не ограничиваются каким-либо отдельным аспектом или вариантом реализации настоящего изобретения, и в равной степени применимы ко всем описанным аспектам и вариантам реализации. В случае, когда возможно объединение технически приемлемых вариантов реализации, соответственно, описание распространяется на все перестановки и комбинации описанных в настоящем документе вариантов реализации.
Некоторые аспекты и варианты реализации проиллюстрированы ниже с использованием примеров и со ссылкой на описанные выше фигуры.
Сокращения


Примеры
Нижеследующие примеры приведены исключительно для того, чтобы проиллюстрировать настоящее изобретение, и не предназначены для ограничения объема изобретения, описанного в настоящем документе. Номенклатура - названия соединений основаны на ядре природного полимиксина, из которого они получены синтетическим путем.
Примеры синтеза
Промежуточное соединение 1 - нонапептидный полимиксин В
Смесь ЭДТА (1,4 г), хлорида калия (1,1 г) и L-цистеина (0,12 г) растворяли в воде (475 мл) и калий-фосфатном буфере (рН 7, 25 мл). Реакционную смесь перемешивали при 37°С в течение 10 мин, затем добавляли полимиксин В (10,3 г). После перемешивания в течение 2 ч при 37°С добавляли папаин (3,36 U/мг) и перемешивали в течение еще 18 ч при 37°С. Прохождение реакции отслеживали методом ЖХ-МС с использованием условий, приведенных в Таблице 1. Сырой материал отделяли в фракциях объемом 87 мл и очищали с использованием 10 г картриджа для катионообменной хроматографии (SCX) (×6), используя для элюирования сначала метанол (100 мл), а затем 20% аммиак (вод., уд. пл. 880) в метаноле (100 мл). Фракции в аммиаке выделяли и упаривали, в результате чего получали продукт в виде твердого вещества бежевого цвета, выход 4,95 г, 60% m/z 482, [М+2Н]2+.


Промежуточное соединение 2 - Тетра-(Boc)нонапептидный полимиксин В
Селективную защиту группой ВОС свобоных γ-аминогрупп на остатках Dab нонапептиного полимиксина В осуществляли в соответствии с процедурой, описанной Н. O'Dowd et al, Tempahedron Lett, 2007, 48, 2003-2005. Нонапептидный полимиксин В (Промежуточное соединение 1, 1,00 г, 1,0 ммоль) растворяли в воде (4,4 мл), диоксане (4,4 мл), триэтиламине (4,4 мл) и перемешивали эту смесь в течение 10 мин, после чего добавляли 1-(Вос-оксиимино)-2-фенилацетонитрил(Вос-ON) (0,77 г; 3,11 ммоль). После перемешивания в течение 18 добавляли еще Boc-ON (0,1 г, 0,4 ммоль) добавляли и перемешивали смесь в течение еще 3 ч. Прохождение реакции отслеживали методом ЖХ-МС, после завершения реакции смесь нейтрализовали путем добавления 20% аммиака в метаноле (50 мл). Смесь после этого упаривали до сухости и повторно растворяли в метаноле, который после этого загружали на силикагель. Сырой материал очищали с использованием хроматографии (элюент: 0-20% метанол в дихлорметане) на силикагеле (40 г), в результате чего получали тетра-(Вос) нонапептидный полимиксин В в форме белого твердого вещества (0,5 г, 36%). ТСХ, Rf 0,2 (10% метанол в дихлорметане). m/z 1362,8 [МН]+.
Промежуточное соединение 3 - нонапептидный колистин (полимиксин Е)
Колистин (полимиксин Е, 5 г) обрабатывали иммобилизованным папаином (185 иммуноферментных единиц (ELU)/г), калий-фосфатным буфером (25 мМ; рН 7, 1,25 л), хлоридом калия (30 мМ), ЭДТА (10 мМ) и цистеином (1 мМ) при 37°С в течение 32 ч при аккуратном встряхивании, в результате чего получали нонапептид колистин (полимиксин Е). Прохождение реакции отслеживали методом ЖХ-МС с использованием условий, указанных для Промежуточного соединения 1, в Таблице 1. Иммобилизованный папаин удаляли путем фильтрации и концентрировали фильтрат под вакуумом, после чего оставался твердый остаток, который ресуспендировали в 10% метанола в воде и оставляли при комнатной температуре на ночь. Надосадочную жидкость сливали и концентрировали под вакуумом. Нонапептидный колистин (полимиксин Е) выделяли из остатка путем твердофазной экстракции на силикагеле С18 silica (10 г), используя для элюирования 0-25% метанол в воде. После упаривания соответствующих фракций получали продукт в форме белого твердого вещества, m/z 465,32 [М+2Н]2+.
Промежуточное соединение 4 - тетра-(Вос) нонапептидный колистин (полимиксин Е)
Нонапептидный колистин (полимиксин Е) (2,5 г, 2,69 ммоль) суспендировали в воде (35 мл) под действием ультразвука. Добавляли диоксан (35 мл) и триэтиламин (35 мл) и охлаждали смесь во льду в течение 10 мин, после чего добавляли 1-(Вос-оксиимино)-2-фенил ацетонитриле (Boc-ON) (2,65 г; 10,76 ммоль). Прохождение реакции отслеживали методом ЖХ-МС, реакция завершалась через 10 минут, после чего смесь нейтрализовали путем добавления 20% маммиака в метаноле (25 мл). Жидкую фазу сливали, а твердый остаток повторно растворяли в воде и экстрагировали последовательно дихлорметаном и изобутанолом. На основании анализа методом ЖХ-МС слитую жидкость и экстракты в дихлорметане и изобутаноле объединяли друг с другом, после чего концентрировали под вакуумом, в результате чего получали желтую смолу, которую подвергали флэш-хроматографии (Si 60А- 35-70). Колонку элюировали 0-20% метанолом (содержащим 2% аммиака) в дихлорметане. Фракции с колонки элюировали 7-10% метанолом (содержащим 2% аммиака) в дихлорметане, в результате чего получали тетра-(Вос) нонапептидный колистин (полимиксин Е) в форме белого твердого вещества (1,18 г, 33%). m/z 1329,7 [М+Н]+.
Промежуточное соединение 5 - три-(Вос) нонапептидный полимиксин В
РМВ сульфат (2 г) растворяли в воде (20 мл), после чего добавляли 1,4 диоксан (40 мл) и оставляли перемешиваться в течение 10 минут при комнатной температуре. К реакционной смеси добавляли твердый Вос-ангидрид (4,42 г) и перемешивали реакционную смесь при комнатной температуре, осуществляя мониторинг методом ЖХВД. Затем рН реакционной смеси доводили до 6 при помощи 1 М HCl, образующийся осадок фильтровали и промывали водой (50 мл) и гептаном (50 мл), после чего оставался Вос5РМВ в форме белого твердого вещества (2,4 г, 85%). Этот материал (1 г) растворяли в 1,4-бутандиоле (112,5 мл) и перемешивали смесь при 40°С в течение ночи. К раствору добавляли фосфат калия (75 мл, 0,12 5М рН 8,0 в течение одной минуты, в результате чего образовывалась белая суспензия. Реакционную смесь разбавляли добавлением 112,5 мл бутандиола и 75 мл фосфата калия (0,125 М рН 8,0), но белая эмульсия сохранялась. Температуру реакционной смеси снижали до 37°С, и затем добавляли савиназу 16L (250 мкл) и перемешивали реакционную смесь при комнатной температуре в течение ночи. По мере протекания реакции белая эмульсия превращалась в прозрачный раствор в результате образования более растворимого РМВН-Вос3. Реакционную смесь разбавляли водой (50 мл), а затем экстрагировали дихлорметаном (100 мл) Слой в ДХМ собирали и упаривали под вакуумом, в результате чего получали бесцветное масло. Полученное масло разбавляли в 50% метаноле (вод.) и загружали на четыре кондиционированных 10 г картриджа VariBond Elut SCX, и собирали элюат, прошедший через картриджи. Картриджи промывали двумя объемами колонки 50% метанола (вод.), после чего элюировали из колонки РМВН-Вос3 с использованием двух объемов колонки 20% аммиака в метаноле. Полученный элюент упаривали до сухости под вакуумом, в результате чего получали очищенный РМВН-Вос3 (610 мг). m/z 1062,6 [М+Н]+.
Промежуточное соединение 6 - пента-(Вос) декапептид полимиксин В
РМВ сульфат (2 г) растворяли в 100 мМ фосфата калия с рН 8,0 (приблизительно 500 мл). К раствору добавляли неочищенную полимиксинацилазу (выделенную из Pseudomonas sp. M-6-3W) в отношении 0,0125 г фермента: 1 г РМВ. Реакционную смесь перемешивали при 37°С в течение 16 часов. Затем реакционную смесь загружали на смолу VariBond Elut SCX (картриджи предварительно кондиционировании в соответствии с инструкциями изготовителя), затем картриджи промывали водой. Деацилированный полимиксин-декапептид (РМВ) элюировали с катионообменной колонки (SCX) с использованием 20% аммиака в метаноле, полученные фракции упаривали до сухости, (b) PMBD (2,2 г) растворяли в воде (10 мл), после чего добавляли 1,4-диоксан (10 мл) и триэтиламин (10 мл) при перемешивании при комнатной температуре. К реакционной смеси добавляли твердый Boc-ON (5 экв.) и перемешивали реакционную смесь при комнатной температуре, осуществляя мониторинг методом ЖХВД. PMBD-Boc5 очищали флэш-хроматографией с загрузкой в ДХМ и последующим проявлением колонки с использованием ступенчатого градиента ДХМ:MeOH:NH3: 100:0:0, 91:7:2, 88:10:2, 83:15:2 и 78:20:2. Фракции, содержащие PMBD-Boc5, упаривали до сухости, в результате чего получали белый порошок (0,48 г, 15%). m/z 1563,8 [М+Н]+.
Промежуточное соединение 7 - Thr(O-tBu) темпа-(N-Вос) нонапептидный полимиксин В
Этап 1 - (S)-2-((S)-2-Бензилоксикарбониламино-3-трет-бутокси-бутириламино)-4-трет-бутоксикарбониламино-масляной кислоты метиловый эфир
К перемешиваемой суспензии соли транс-3,4-дигидроксикоричной кислоты (DHCA) с (S)-2-бензилоксикарбониламино-3-трет-бутокси-масляной кислотой (3,65 г, 7,4 ммоль) и (S)-соли HCl с 2-амино-4-трет-бутоксикарбониламино-масляной кислоты метиловым эфиром (2,0 г, 7,4 ммоль) в смеси ДХМ (60 мл) и ДМФ (120 мл) добавляли N,N-диизопропилэтиламин (3,85 мл, 22,1 ммоль). К этой перемешиваемой смеси добавляли 1-гидрокси-7-азабензотриазол (1,0 г, 7,3 ммоль), а затем N-(3-диметиламинопропил)-N'-этилкарбодиимид в виде соли HCl (1,42 г, 7,4 ммоль). Смесь перемешивали в течение 17 ч при температуре окружающей среды, затем фильтровали под вакуумом для удаления нерастворимого побочного продукта, который не использовали. Фильтрат концентрировали с получением желтого масла, которое разделяли между смесь растворителей EtOAc/Et2O (1:1) (250 мл) и 0,5 М соляной кислоты (200 мл). Водную фазу еще раз экстрагировали свежей смесью растворителей (100 мл) и объединенные органические экстракты промывали последовательно водой (150 мл) и насыщ. раствором NaHCO3 (150 мл), сушили (Na2SO4) и концентрировали с получением бесцветного масла (3,72 г). Это масло очищали хроматографией на силикагеле с использованием 100 г картриджа SepPak, используя для элюирования градиент растворителей EtOAc/изогексан (0-70%). Фракции, содержащие продукт (Rf 0,26 в смеси EtOAc/изогексан 3:7, визуализирование распылением KMnO4), объединяли и концентрировали, в результате чего получали указанные в заголовке соединения в виде бесцветной пены (3,58 г, 6,8 ммоль, 92% выход), m/z 524 (МН+, 100%).
Этап 2 - (S)-2-((S)-2-бензилоксикарбониламино-3-трет-бутокси-бутириламино)-4-трет-бутоксикарбониламино-масляная кислота
Раствор моногидрата гидроксида лития (0,861 г, 20,5 ммоль) в воде (16 мл) добавляли к перемешиваемому раствору (S)-2-((S)-2-бензилоксикарбониламино-3-трет-бутокси-бутириламино)-4-трет-бутоксикарбониламино-масляной кислоты метилового эфира (3,58 г, 6,8 ммоль) в метаноле(64 мл) при температуре окружающей среды и перемешивали в течение 19 ч. К этому раствору добавляли 1М HCl (24 мл), в результате чего получали мутную смесь (рН 1), которую быстро экстрагировали дихлорметаном (3×135 мл). Объединенный органический экстракт сушили (Na2SO4) и концентрировали, в результате чего получали указанное в заголовке соединение в виде бесцветной пены (3,27 г, 6,4 ммоль, 94% выход). M/z 532 [MNa]+, 1041 [2M+Na]+.
Этап 3 - CbzHNPMBN(OBu)(Boc)4
(S)-2-((S)-2-Бензилоксикарбониламино-3-трет-бутокси-бутириламино)-4-трет-бутоксикарбониламино-масляную кислоту (1,73 г, 3,39 ммоль) и Промежуточное соединение 5 (3,0 г, 2,8 ммоль) помещали в колбу, в которую при перемешивании добавляли сухой ДХМ (85 мл) и сухой ДМФ (17 мл). К перемешиваемому раствору добавляли N,N-диизопропилэтиламин (1,46 мл, 8,4 ммоль) и после перемешивания в течение 5 мин. добавляли одной порцией O-(7-азабензотриазол-1-ил)-N,N,N'N'-тетраметилурония гексафторфосфат (1,29 г, 3,39 ммоль). Смесь обрабатывали ультразвуком в течение 2 минут, затем оставляли перемешиваться при температуре окружающей среды в течение 18 ч. Реакционную смесь после этого упаривали, а остаток еще раз выпаривали из толуола (3×100 мл). Остаток сушили под вакуумом в течение 3 ч чтобы гарантировать удаление толуола. К этому материалу добавляли воду (50 мл) и перемешивали смесь с высокой скоростью в течение 3 ч, обрабатывая периодически ультразвуком. Указанное в заголовке соединение собирали путем фильтрации под вакуумом в виде мелкодисперсного белого твердого вещества и промывали водой (2×25 мл), затем сушили под вакуумом в течение 15 ч (4,6 г, 3,0 ммоль, 100% выход), m/z 1554[МН+].
Этап 4 - Указанное в заголовке соединение
Продукт этапа 3 (5,41 г, 3,48 ммоль), формиат аммония (6,6 г, 104,4 ммоль) и 10% Pd-C (2,0 г) помещали в колбу в атмосфере N2. Добавляли МеОН (270 мл) и перемешивали смесь в атмосфере N2 в течение 4,5 ч. ЖХМС показала МН+ для продукта и исчезновение исходного материала. Смесь фильтровали под вакуумом через слой целита с использованием для продавливания через фильтр МеОН (50 мл). Фильтрат и смывы упаривали с получением бесцветного масла, которое разделяли между смесью растворителей EtOAc/MeOH (4:1) (250 мл) и водой (250 мл). Водную фазу затем экстрагировали такой же, но свежей, смесью растворителей (2×100 мл). Объединенные органические экстракты сушили (Na2SO4) и упаривали с получением бесцветного масла (~6 г). Этот материал очищали хроматографией на силикагеле (100 колонка SepPak) используя для элюирования градиент МеОН/EtOAc (0-4%). Фракции, содержащие продукт (Rf 0,30 в EtOAc/MeOH/NH4OH880 95:5:1, визуализация спреем KMnO4) объединяли и упаривали, в результате чего получали указанное в заголовке соединение в виде хрустящей пены (4,0 г, 2,8 ммоль, 81% выход), m/z 1420 [МН+].
Промежуточное соединение 8 - Thr(О-tBu) пента-(N-Вос) декапептид полимиксин В
Получали из промежуточного соединения 7 и N-α-Z-N-γ-BOC-L-Dab с применением Способа 2В с последующим удалением защитной группы CBZ-после этапа 4 синтеза Промежуточного соединения 7, в результате чего получали указанное в заголовке соединение в форме белой пены с 83% выходом. m/z 1620 [МН+].
Способ 1 - Общий способ получения амидных производных нонапептида
Этап 1. Соответствующую карбоновую кислоту (5 экв. в расчете на полимиксиновый субстрат) растворяли в дихлорметане (2 мл/ммоль). Затем к реакционной смеси добавляли N,N-диизопропилэтиламин (5,0 эквив.) и 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметил урония гексафторфосфат(HATU) (5,0 эквив.). После перемешивания в течение 30 мин при комнатной температуре добавляли Промежуточное соединение 2 или Промежуточное соединение 4 (1,0 эквив.). Через 16 ч ЖХМС подтверждала завершение реакции, и реакционную смесь упаривали до сухости и очищали при помощи колоночной хроматографии на силикагеле (элюент 0-10% метанол в дихлорметане). Соответствующие фракции концентрировали, в результате чего получали продукт в виде бесцветного масла (обычный выход 58%).
Этап 2. Продукт Этапа 1 растворяли в дихлорметане (20 мл/ммоль). Добавляли трифторуксусную кислоту (60 эквив.) добавляли и перемешивали смесь при комнатной температуре в течение 16 ч, после чего ЖХ-МА подтверждала завершение реакции. Реакционную смесь концентрировали под вакуумом, в результате чего оставалась соль трифторуксусной кислоты в виде бесцветного масла. К нему добавляли воду (10 мл/ммоль) и обрабатывали смесь ультразвуком в течение 5 мин. К полученной суспензии добавляли 1 М NaHCO3 до тех пор пока рН смеси не достигало 9. Затем смесь пропускали через 10 г колонку С18 SPE, с использованием для элюирования последовательно 0, 40, 50, 60, 70, 80 и 100% метанола в воде. Содержащие продукт фракции объединяли и упаривали. Остаток суспендировали в воде и добавляли 0,1 М H2SO4 до достижения рН 7. Раствор лиофилизировали в течение ночи, в результате чего получали сульфатную соль в форме белого твердого вещества. Чистоту соединения оценивали методом ЖХВД с использованием условий, приведенных в Таблице 2.

Способ 2 - Общий способ получения нонапептиднх амидов
Этап 1 - Защищенный группой ВОС нонапептид получали с использованием условий, описанных для Способа 1. После завершения реакции неочищенную реакционную смесь адсорбировали на силикагеле и подвергали хроматографии на картридже с силикагелем, используя для элюирования 0-20% метанол в дихлорметане. Содержащие продукт фракции объединяли и упаривали до получения белой пены. Полученный таким образом продукт повторно очищали хроматографией на силикагеле, в результате чего получали продукт в форме белой пены.
Этап 2 - Очищенный продукт Этапа 2 растворяли в дихлорметане (2 мл), обрабатывали трифторуксусной кислотой (1 мл) и перемешивали смесь при комнатной температуре в течение 1 часа. Растворитель выпаривали, а остаток азеотропировали с толуолом, в результате чего оставалось белое твердое вещество. Его растворяли в воде (10 мл) и промывали дихлорметаном (5 мл). Водную фазу упаривали до небольшого объема и лиофилизировали в течение ночи, в результате чего получали трифторацетат продукта в форме белого твердого вещества.
Способ 2А - Дополнительный общий способ получения амидов нонапептидов
Этап 1 - Защищенный полимиксин - субстрат (0,07 ммоль) растворяли в дихлорметане (4 мл), и обрабатывали соответствующей карбоновой кислотой (1,5 эквив. относительно олимиксина - субстрата), N,N-диизопропилэтиламином (3,0 эквив.), а затем HATU (2,0 эквивалента). Через 16 ч завершение реакции было подтверждено ЖХ-МС и реакционную смесь упаривали до сухости. Добавляли воду (~10 мл) добавляли, растирали смесь, а затем интенсивно перемешивали в течение 1 ч. Полученный осадок собирали путем фильтрации и сушили под вакуумом в течение ночи.
Этап 2 - Защищенное группой Вос производное, полученное на Этапе 1, растворяли в дихлорметане (3 мл) и обрабатывали трифторуксусной кислотой (1 мл). Реакционную смесь перемешивали при комнатной температуре, до тех пор пока полное удаление защиты не было подтверждено ЖХМС. Растворитель выпаривали, а остаток подвергали препаративной ЖХВД с использованием условий, описанных для Этапа 6 Способа. Содержащие продукт фракции объединяли, упаривали до небольшого объема и лиофилизировали, в результате чего получали продукт в форме соли с ТФУК.
Способ 3 - Общий способ получение дипипдидныных амидных производных гептапептидного полимиксина В
Этап 1 - Сочетание карбоновых кислот с метиловыми эфирами аминокислоты 1
Соответствующую карбоновую кислоту (1,1 эквив.), гидрохлорид метилового эфира соответствующей аминокислоты (N-Boc или OBut) (1 эквив.), ЭДХ гидрохлорид (1,1 equivs.) и HOAt (1,1 эквив.) помещали в колбу. Добавляли ДХМ (8 мл/ммоль в расчете на метиловый эфир аминокислоты) и к перемешиваемой смеси в атмосфере азота добавляли DIPEA (3 эквив.), в результате чего получали желтый раствор. Раствор перемешивали в течение 18 ч, разбавляли равным объемом ДХМ и промывали раствор последовательно водой (16 мл/ммоль в расчете на аминокислоту) и раствором гидрокарбоната натрия (16 мл/ммоль). Раствор сушили (Na2SO4) и упаривали, в результате чего получали остаток. Остаток очищали хроматографией на силикагеле (Элюирование градиентов этилацетатом/изогексан). Соответствующие фракции объединяли и упаривали, в результате чего получали целевой продукт - метиловый эфир (m/z [М+Н]+ детектируется в спектре ЖХМС). В случае, когда применяли рацемическую аминокислот, продукт получали в виде смеси диастереоизомеров.
Этап 2 - Гидролиз продукта этапа ! - метилового эфира
К перемешиваемому раствору продукта этапа 1 (1 эквив.) в метаноле(5 мл/ммоль относительно метилового эфира) добавляли раствор моногидрата гидроксида лития (3 эквив.) в воде (0,5 мл/ммоль реагента). Полученный раствор перемешивали при температуре окружающей среды в течение 24 ч, затем вливали в воду (25 мл/ммоль относительно метилового эфира). Этот раствор доводили до рН 1 путем добавления 1 М соляной кислоты (3 эквив.) и экстрагировали смесь дихлорметаном (3 ×). Объединенные органические экстракты сушили (Na2SO4) и упаривали, в результате чего получали целевую карбоновую кислоту (m/z [М+Н]+, детектируется в спектре ЖХМС). В случае, когда на этапе 1 используют рацемическую аминокислоту, продукт получают в виде смеси диастереоизомеров.
Этап 3 - Реакция сочетания карбоновой кислоты - продукт этапа 2 с метиловым эфиром аминокислоты 2
Этот этап осуществляли в соответствии с описанием этапа 1, используя карбоновую кислоту из этапа 2 и с соответствующий гидрохлорид метилового эфира аминокислоты (N-Boc или OBut). Продукт метиловый эфир (m/z [М+Н]+, детектируется в спектре ЖХМС) выделяли как описано для этапа 1. В случае, когда на этапе 1 используют рацемическую аминокислоту, продукт получают в виде смеси диастереоизомеров.
Этап 4 Гидролиз метилового эфира - продукта этапа 3
Этот этап осуществляли в соответствии с описанием для этапа 2, с использованием метилового эфира из этапа 3. Продукт - карбоновую кислоту (m/z [М+Н]+, детектируется в спектре ЖХМС) выделяли в виде смеси диастереоизомеров.
Этап 5 - Сочетание карбоновой кислоты - продукта этапа 4 с три-(Вос) гептапептидным полимиксин В полимиксином (промежуточное соединение 5)
РуВоР (2 эквив.) добавляли к перемешиваемому раствору карбоновой кислоты из этапа 4 (2 эквив.) в сухом ДХМ (15 мл/ммоль относительно кислоты). Затем добавляли DIPEA (2 эквив.) и перемешивали раствор в течение 30 мин. Затем к этому раствору добавляли раствор Промежуточного соединения 5 (1 эквив.) в сухом ДХМ (12 мл/ммоль относительно кислоты) и сухом ДМФ (1,5 мл/ммоль относительно кислоты) и перемешивали полученную смесь в течение 16 ч. Смесь после этого упаривали с получением густого масла, которое разделяли между EtOAc и водой. Органическую фазу промывали насыщенным раствором гидрокарбоната натрия, затем солевым раствором, сушили (Na2SO4) и упаривали с получением пены. Этот материал очищали хроматографией на силикагеле (с использованием для элюирования градиента MeOH/EtOAc), в результате чего получали полипептидный продукт (m/z [М+Н]+, детектируется в спектре ЖХМС). В случае, когда на этапе 1 используют рацемическую аминокислоту, продукт получают в виде смеси диастереоизомеров.
Этап 6 - Удаление защити гептапептидного полимиксина В, полученного на этапе 5
TFA (30 мл/ммоль относительно полипептида) добавляли к перемешиваемому раствору полипептида, полученного на этапе 5, в ДХМ (60 мл/ммоль). Раствор перемешивали в течение 3,5 ч, затем упаривали и сушили под вакуумом в течение 1 ч. Остаток очищали высокоэффективной жидкостной хроматографией (условия приведены ниже) и лиофилизировали, в результате чего получали продукт в форме соли ТФУК в виде белого твердого вещества. В случае, когда на этапе 1 используют рацемическую аминокислоты, продукт получают в виде смеси диастереоизомеров. (примеры приведены в Таблице 4).

Способ 3А
Сочетание осуществляли как описано в Способе 3, с использованием защищенной группой CBZ - аминокислоты на Этапе 3. Дополнительный этап удаления защитной группы CBZ (Этап 5А) вводили перед этапом 6.
Этап 5А - Удаление защитной группы CBZ:
Смесь защищенного промежуточного соединения, полученного на Этапе 5 (0,0573 ммоль) и пасты 10% Pd/C (10 мг) в этаноле (4 мл) перемешивали в атмосфере водорода в течение 18 h. Добавляли еще пасту 10% Pd/C (10 мг) и продолжали перемешивание в течение еще 24 ч. Реакционную смесь фильтровали через слой целита, осадок на фильтре промывали этанолом (2 ×). Объединенные органические вещества упаривали, в результате чего получали неочищенное масло. Его очищали препаративной обращенно-фазовой ЖХВД с применением условий Этапа 6 Способа 3 6, в результате чего получали целевой продукт в виде бесцветного прозрачного вещества (20%). (m/z [М+Н]+ детектировалось в спектре ЖХМС).
Способ 3В
Способ 3В состоит из Этапов 1-2 Способа 3А, за которыми следует сочетание с защищенным группой ВОС PMBN (Промежуточное соединение 2), в результате чего получали защищенный декапептид. Удаление защиты в соответствии с Этапом 5А Способа 3А для удаления защитной группы CBZ и Этапом 6 для удаления защитной группы Вос дает целевое соединение, подробности даны в Таблице 4.
Соединения выделяли в виде сульфатных солей, если не указано иное.
Общая схема получения ацетатных солей
Ацетатные соли могут быть при необходимости получены в соответствии со следующим протоколом.
Соль ТФУК (50 мг) можно растворить в воде и довести до рН 9 1М раствором NaHCO3. Смесь затем можно пропустить через 1 г колонку С18 SPE, используя для элюирования воду (20 мл), а затем 80% метанол/вода. Содержащие продукт фракции могут быть совместно обработаны 0,1 М уксусной кислотой (10 эквив). Этот раствор может быть концентрирован при пониженном давлении, затем лиофилизирован в течение ночи, в с получением ацетатной соли, обычно в форме белого твердого вещества. Чистоту соединения можно оценить методом ЖХВД с использованием условий, приведенных в Таблице 2.
Синтез карбоновых кислот
Карбоновые кислоты, применяемые для сборки производных полимиксина получали из коммерческих источников, или получали с использованием хорошо известных специалистам способов. Алкил-замещенные пиперидинкарбоновые кислоты, такие как цис-4-октилпиперидин 2-карбоновую кислоту, применяемую для примера А43, получали в соответствии с описанным ниже общим способом:
Общий способ синтеза алкилзамещенных пиридинкарбоновых кислот:
Этап 1. К раствору этилового эфира соответствующей бромпиридинкарбоновой кислоты 5,0 (ммоль) в этилацетате (20 мл) в атмосфере азота добавляли триэтиламин (1,1 мл, 7,5 ммоль), 1-октин (1,1 мл, 7,5 ммоль), бис(трифенилфосфин)палладий (II) дихлорид (176 мг, 0,25 ммоль) и йодид меди (10 мг, 0,05 ммоль). Реакционную смесь перемешивали при 50 градусах C в течение 16 часов, затем фильтровали под вакуумом через целит, используя для продавливания через фильтр этилацетат. Фильтрат упаривали при пониженном давлении. Остаток очищали хроматографией на силикагеле используя для элюирования 0-50% этилацетат в изогексане, в результате чего получали этиловый эфир соответствующей окт-1-инилпиридинарбоновойэтиловый эфир.
Этап 2. К раствору окт-1-инилпиридин карбоновой кислоты этилового эфира (4,60 ммоль) в уксусной кислоте (100 мл) добавляли оксид платины (100 мг). Реакционную смесь гидрогенировали в течение 16 ч, затем фильтровали под вакуумом через целит, промывая этилацетатом. Фильтрат упаривали при пониженном давлении, после чего остаток разделяли между этилацетатом и водой. pH водного слоя доводили до рН10 путем добавления 0,880 аммиака. После разделения слоев водную фазу еще раз экстрагировали этилацетатов, после чего объединенные органические слои продавливали через гидрофобный спеченный фильтр. Растворитель выпаривали при пониженном давлении, а остаток очищали хроматографией на силикагеле, используя для элюирования 0-100% (80:20:2 этилацетат:метанол:0,880 аммиак) в этилацетате, в результате чего получали восстановленный продукт.
Этап 3. К раствору октилпиперидинкарбоновой кислоты этилового эфира (3,20 ммоль) в дихлорметане (50 мл) добавляли триэтиламин (680 мкл, 4,8 ммоль), а затем ди-трет-бутилбикарбонат (1,06 г, 4,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, а затем концентрировали при пониженном давлении. Остаток растворяли в диэтиловом эфире и промывали раствором хлорида аммония. После разделения на слои водную фазу повторно экстрагировали диэтиловым эфиром, объединенные органические фазы сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Продукты очищали хроматографией на силикагеле используя для элюирования 0-30% диэтиловый эфир в изогексане. Стереохимическую структуру определяли путем сравнения с литературными данными, например, Syn. Comm., 2008, 38, 2799.
Этап 4. К раствору защищенного группой ВОС материала (0,89 ммоль) в диоксане (5 мл) и воде (2 мл) добавляли моногидрат гидроксида лития (76 мг, 1,80 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, а затем обрабатывали дополнительным количеством моногидрата гидроксида лития (100 мг) в течение 2 дней. Реакционную смесь концентрировали при пониженном давлении, остаток разделяли между этилацетатом и водой. Водную фазу подкисляли путем добавления 1М соляной кислоты, продукт экстрагировали в этилацетат. Органическую фазу пропускали через гидрофобный спеченный фильтр и выпаривали растворитель при пониженном давлении, в результате чего получали соответствующую октилпиперидинкарбоновую кислоту.
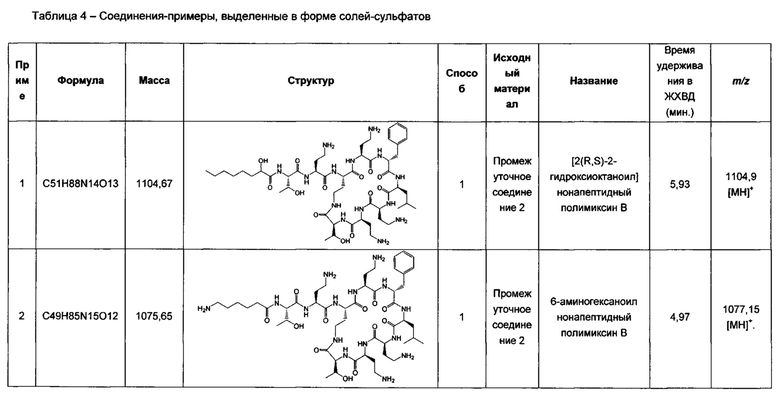
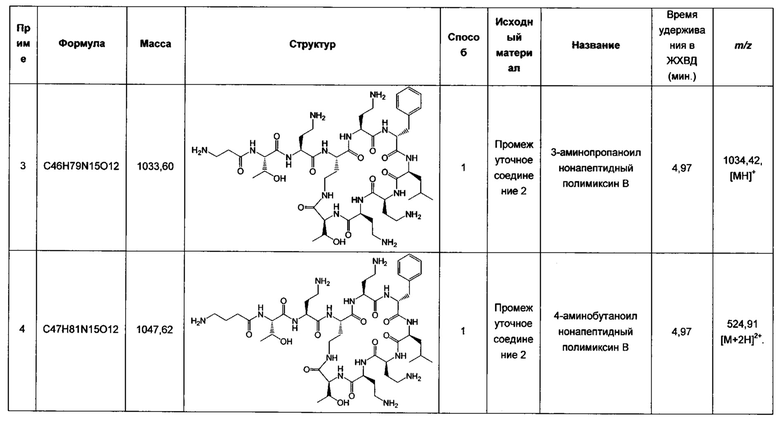
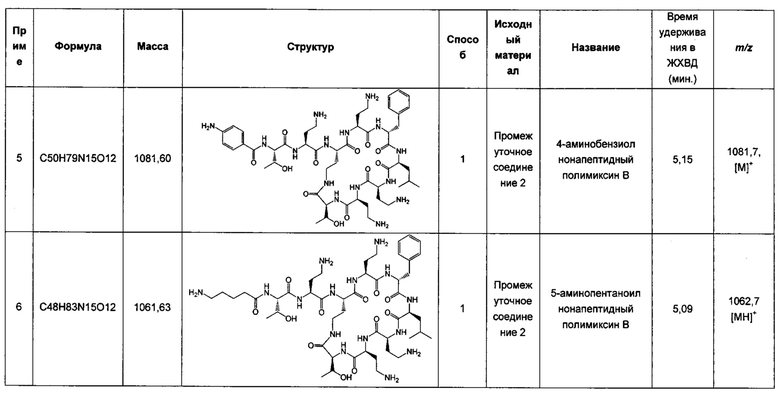
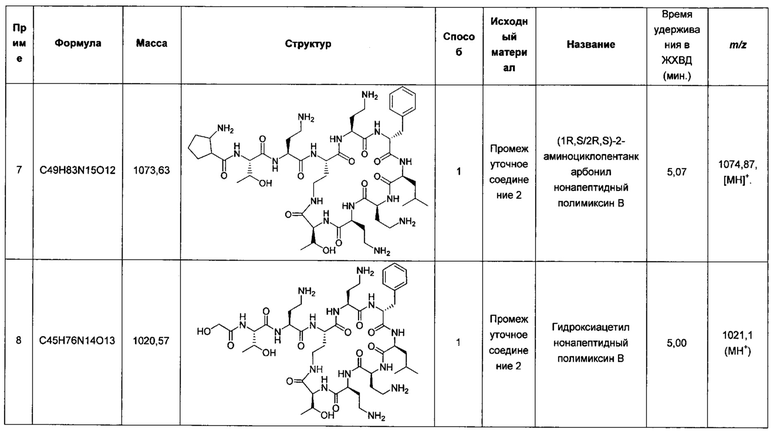

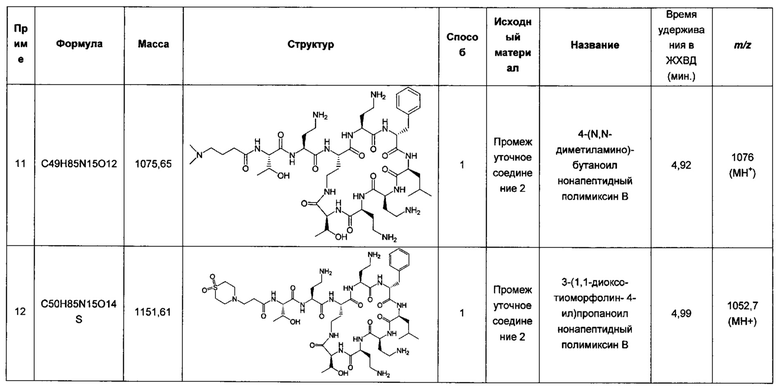
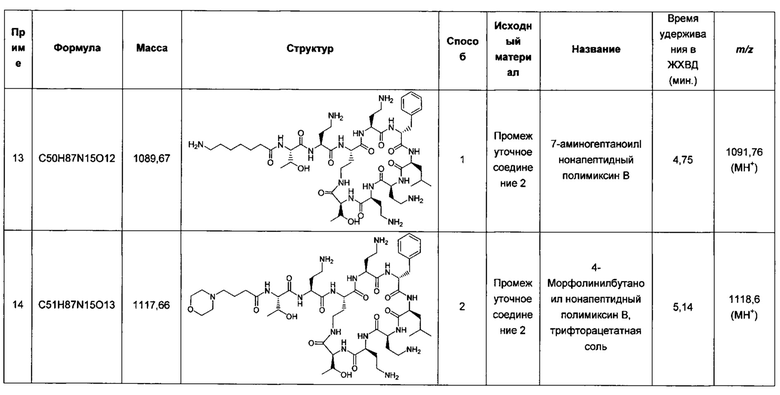
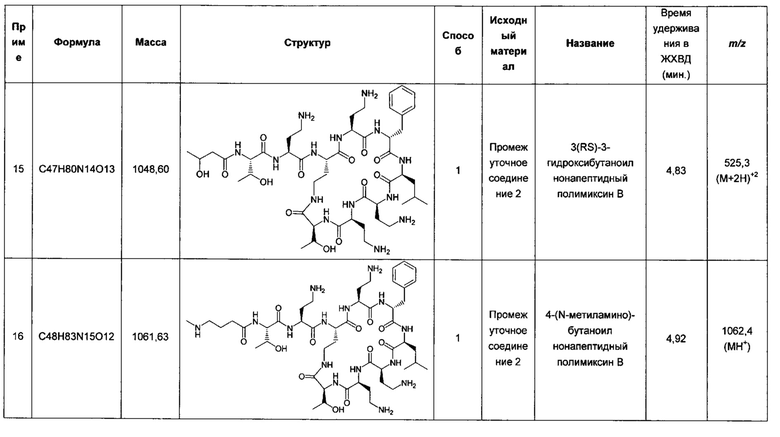
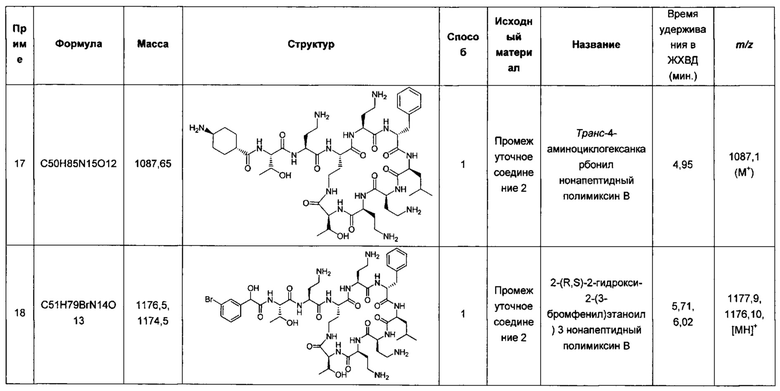
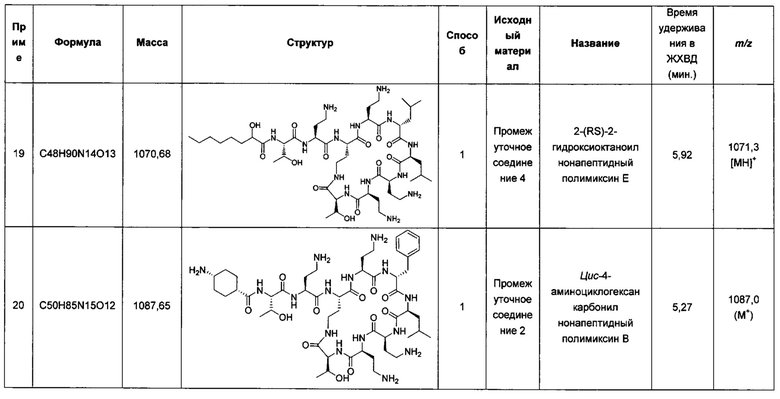
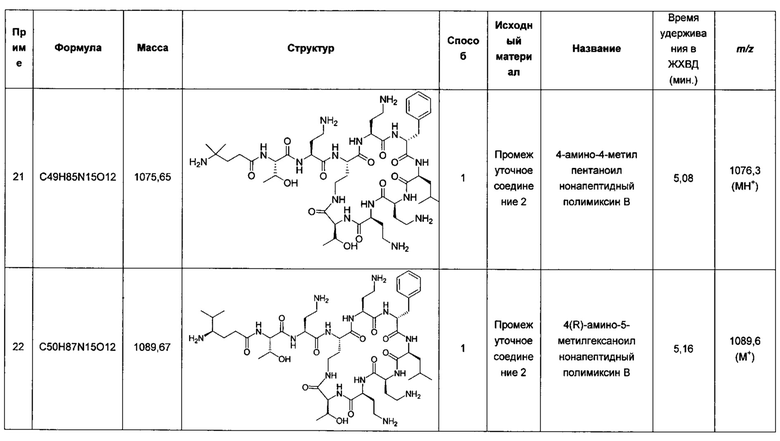
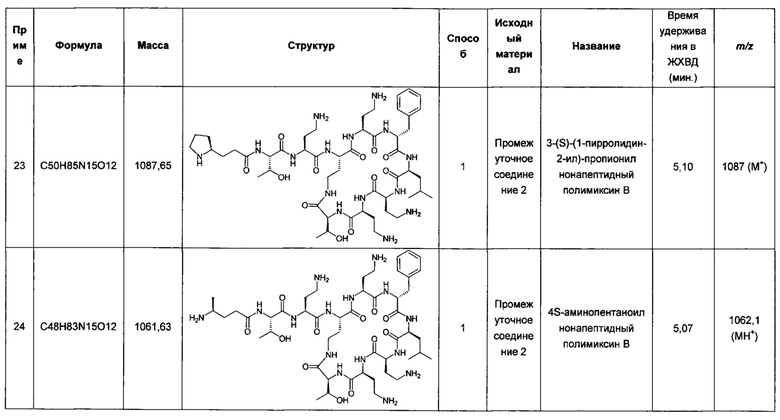
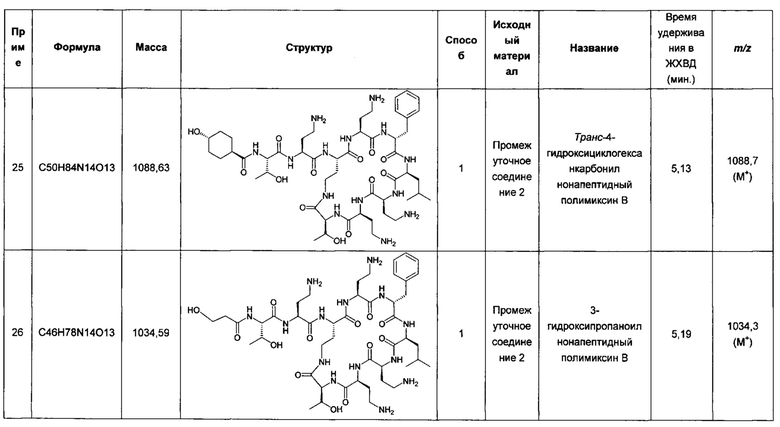
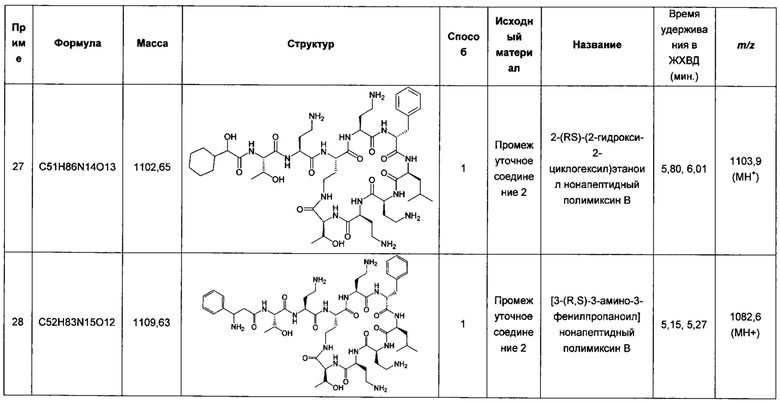
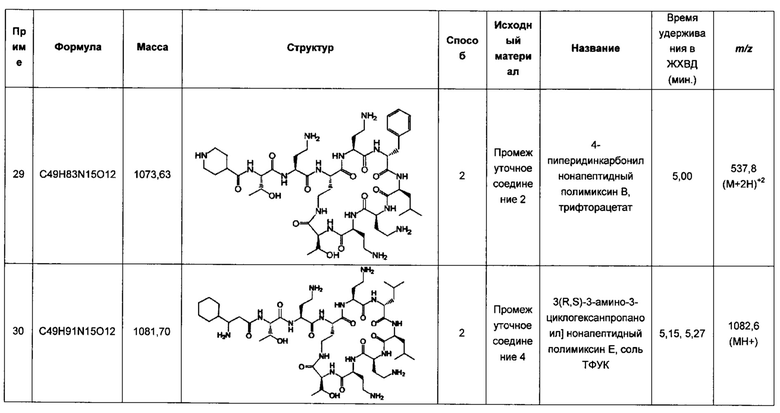
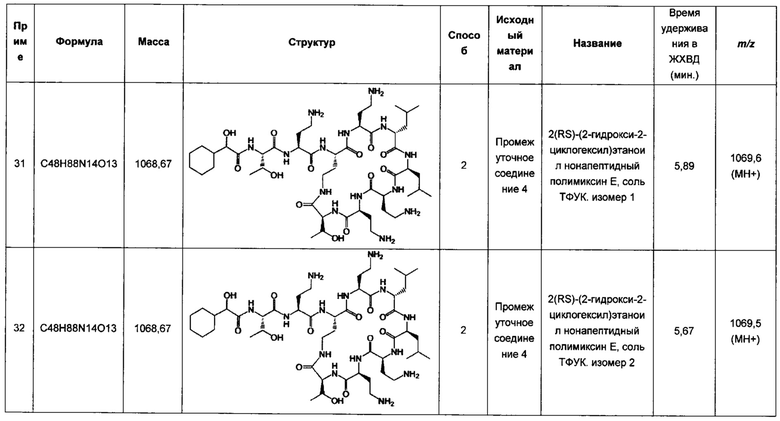
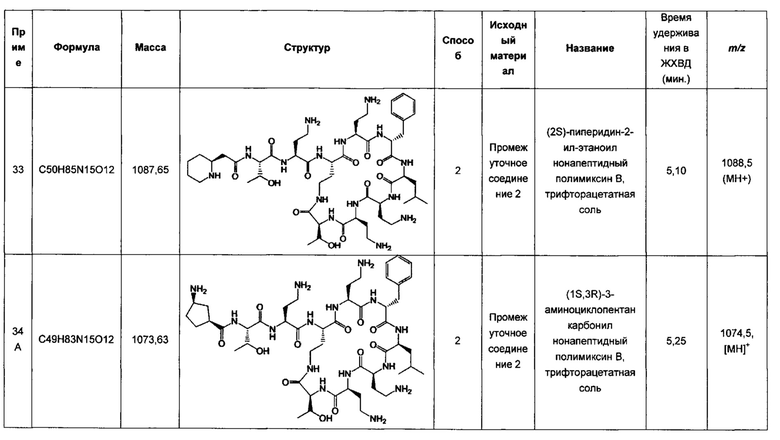
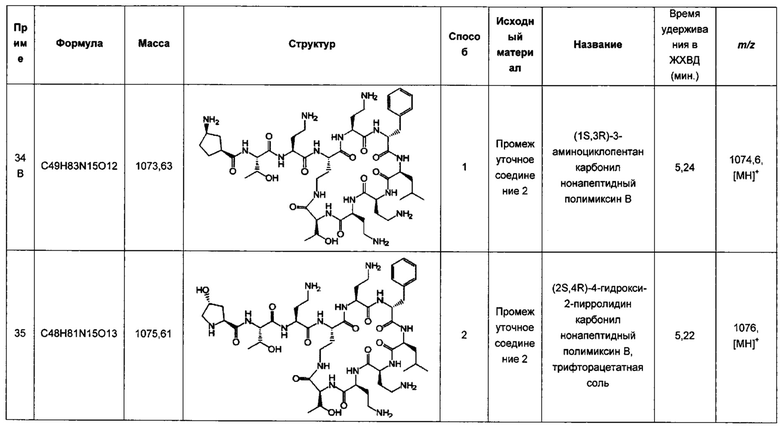



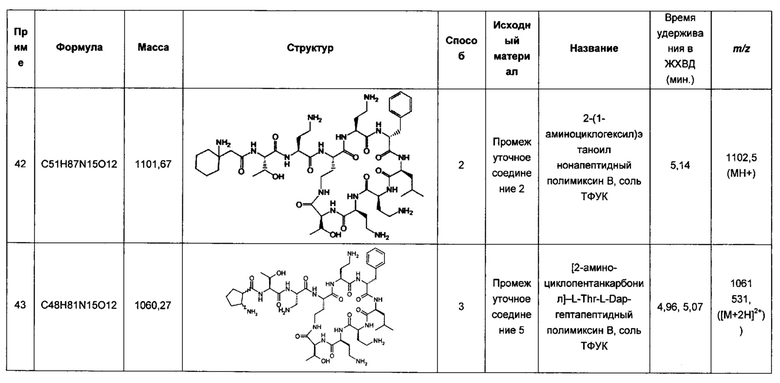
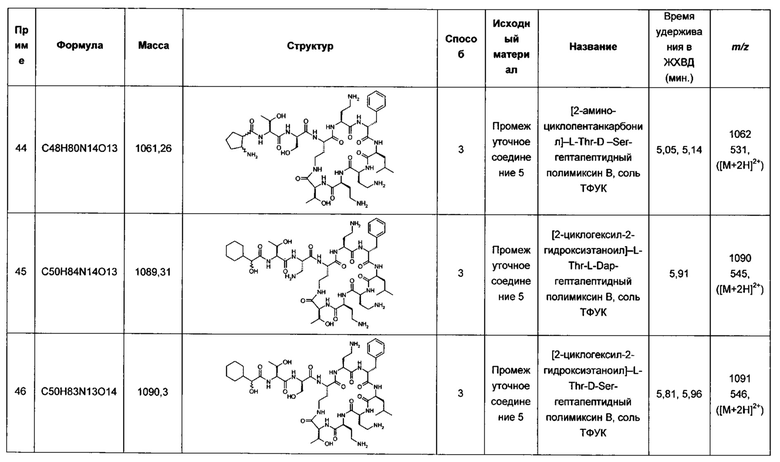
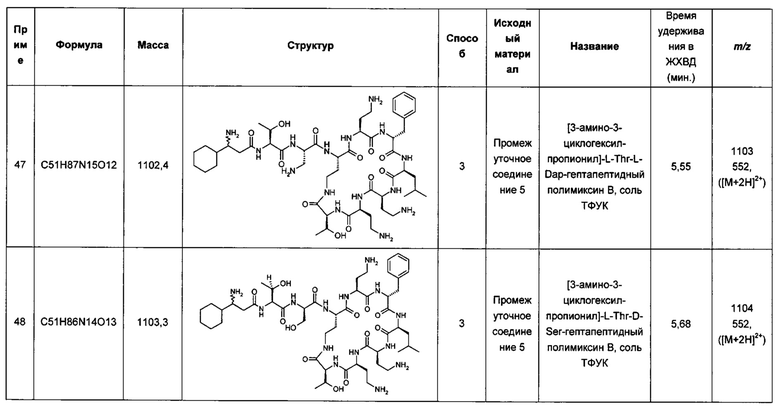
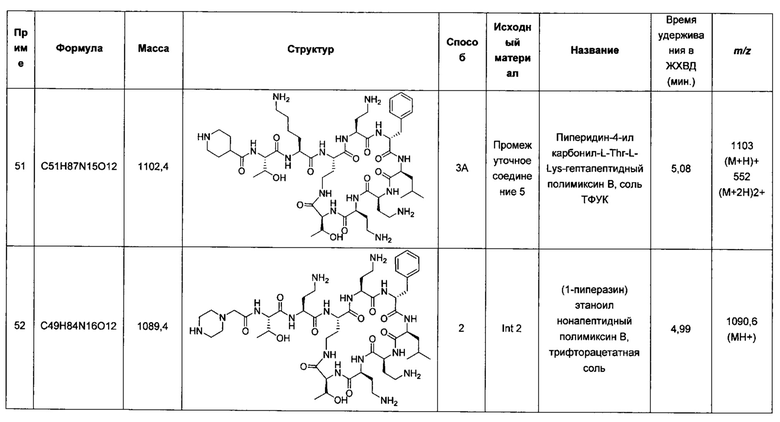
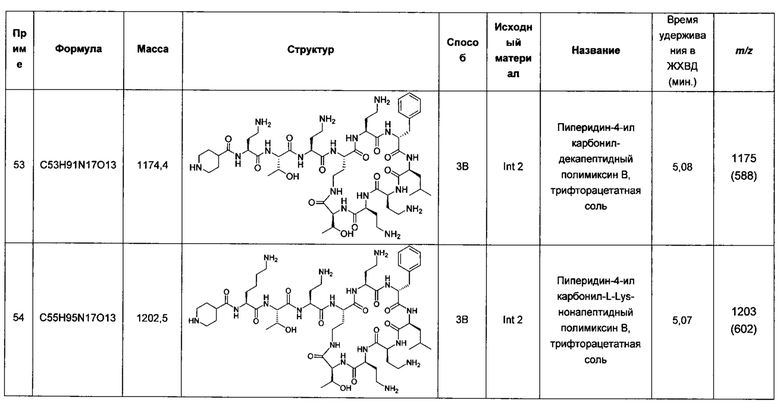
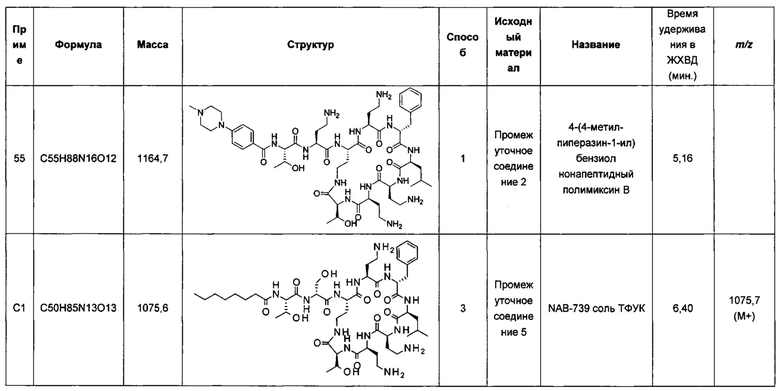
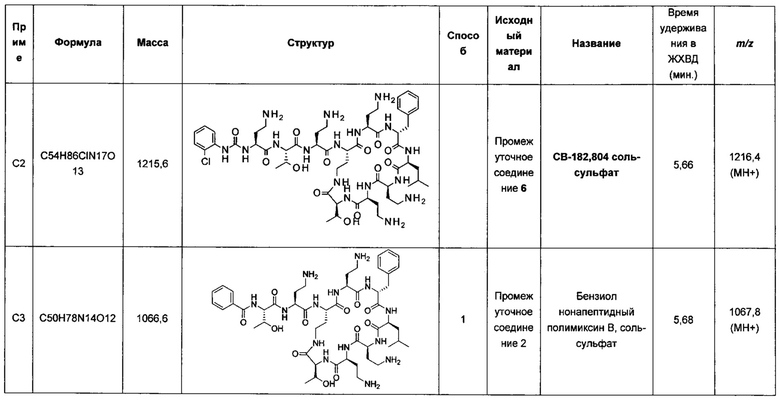
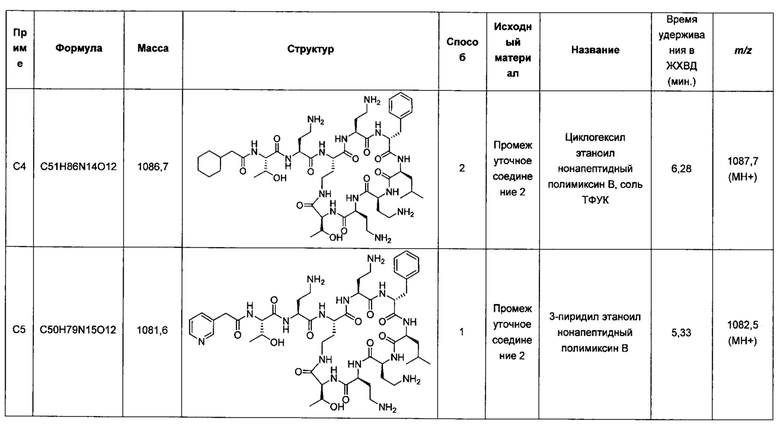
Пример 49 - N-[2-(1-аминоциклогексил)этил] нонапептидный полимиксин В
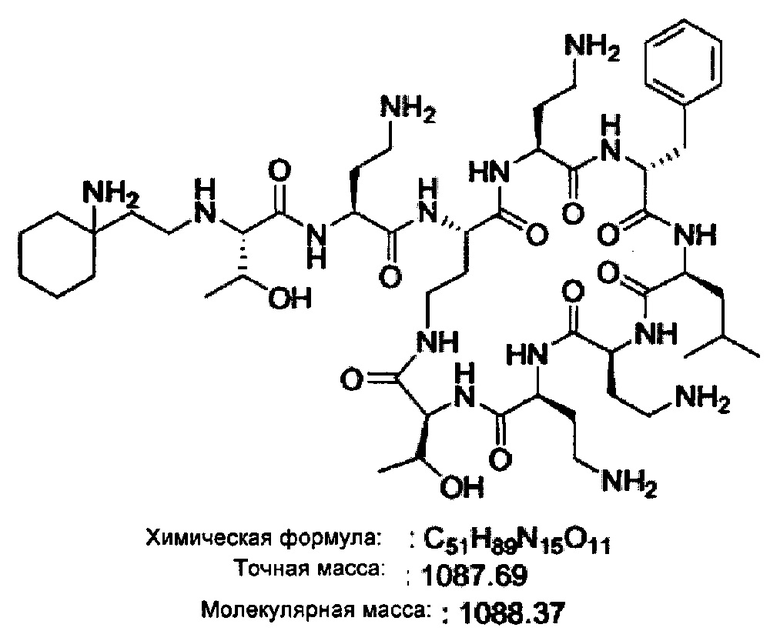
Этап 1 - К раствору промежуточного соединения 2 (100 мг, 0,073 ммоль) в метаноле(1,5 мл) и ДХМ (1,5 мл) добавляли N-Boc-1-аминоциклогексил ацетальдегид (Squarix GmbH) (21 мг, 1,2 эквив.) и кристаллическую уксусную кислоту (0,15 мл). Смесь перемешивали при комнатной температуре в течение 30 минут, добавляли (полистирилметил)триметиламмония цианоборогидрид (4,0 ммоль/г, 100 мг, Novabiochem) и перемешивали при комнатной температуре в течение ночи. Смолу удаляли путем фильтрации и упаривали фильтрат до сухости. Остаток подвергали хроматографии на силикагеле, используя для элюирования 0-20% (10% 880 аммиак в метаноле) в ДХМ. Наименее полярный компонент из колонки соответствовал ВОС-замещенному биалкилированному продукту, который получали в форме белого твердого вещества (30 мг, 23%). m/z 1814 (МН+). Наиболее полярный компонент соответствовал ВОС-замещенному указанному в заголовке соединению, (85 мг, 74%). m/z 1589 (МН+).
Этап 2 - Наиболее полярный компонент из этапа 1 (31 мг, 0,019 ммоль) растворяли в ДХМ (2 мл) и обрабатывали ТФУК (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали и остаток азеотропировали с толуолом, в результате чего получали белое твердое вещество. Его растворяли в воде (5 мл) и перемешивали с дихлорметаном (3 мл) в течение 5 мин. Фазы разделяли и водную фазу фильтровали через фильтр с отверстиями 0,22 мкм, затем упаривали до маленького объема. Раствор лиофилизировали в течение ночи, в результате чего получали указанное в заголовке соединение в виде рыхлой твердой соли ТФУК (20 мг, 62%). Время удерживания (ЖХВД), m/z 1088,6, МН+).
Пример 50 - 3-амино-3-циклогексилпропаноил-Thr-Dab-(цикло)Dab*-Dab-DLeu-Thr-Dab-Dab-Thr* [где * указывает на циклизацию]
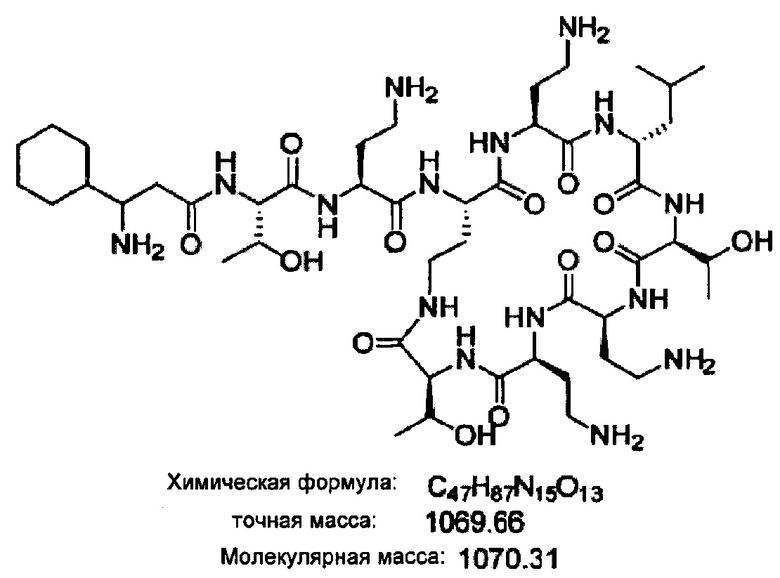
Указанное в заголовке соединение получали с использованием стандартных твердофазных реагентов с использованием стандартной стратегии защиты FMOC, используя для начала смолу Fmoc-Thr(tBu)-PEG-PS, и с использованием защищенных соответствующим образом аминокислот. Конечный пептид частично освобождали от защиты в сайте циклизации и отщепляли от смолы с использованием ТФУК/ТIS/Н2O (96/2/2об./об.) в течение 2 ч. Этот материал циклизуют с использованием PyBop/HoBt/NMM в ДХМ. Бензильные группы, которые сохраняют для предотвращения циклизации во многих сайтах, затем удаляют с использованием Pd/C в смеси уксусная кислота/МеОН/вода (5/4/1 об./об.). Конечный целевой пептид очищают с использованием обращенно-фазовой колонки С-18 (10×250 мм), в результате чего получали указанное в заголовке соединение в виде трифторацетатной соли, в форме лиофилизированного твердого вещества. Время удерживания (ЖХВД) 4,52 мин. m/z 1070,7 (МН+).
Соединения сравнения
В качестве соединений сравнения использовали колистин (полимиксин Е), полимиксин В (РМВ), С1 (NAB-739) и С2 (СВ-182,804).
СВ-182,804 (С2) представляет собой декапептидное производное с заместителем-арилмочевиной на N-конце, которое, как заявлялось, обладает более низкой токсичностью, чем полимиксин В (показано как соединение 5 в публикации WO 2010/075416), и которое было получено авторами настоящего изобретения. С1 также получали самостоятельно, оно соответствует NAB-739 (описанному Vaara в, например, WO 2008/01773.

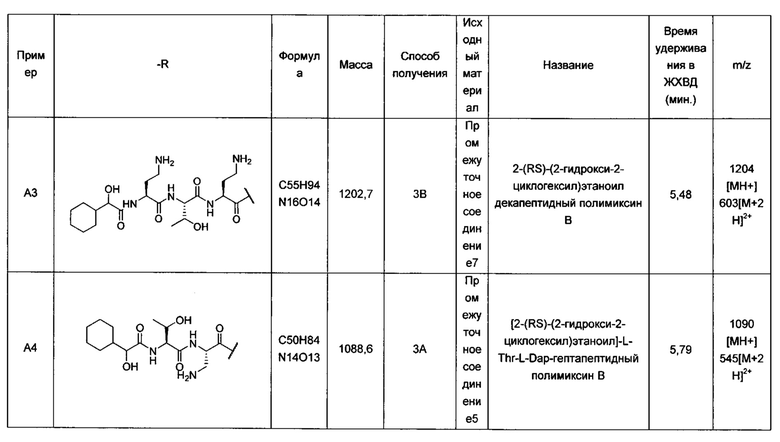
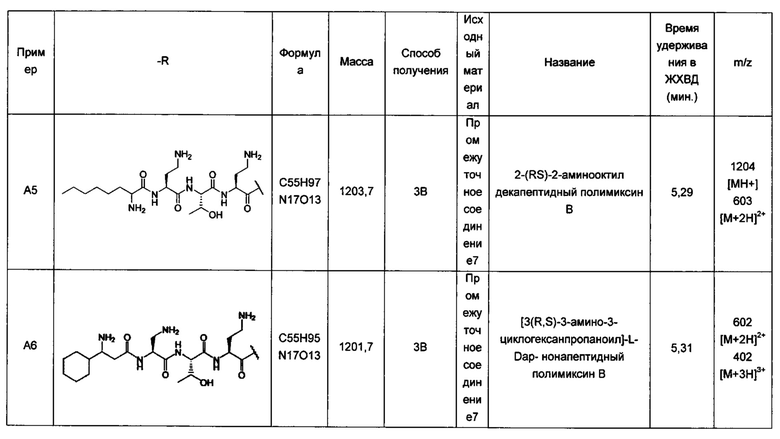
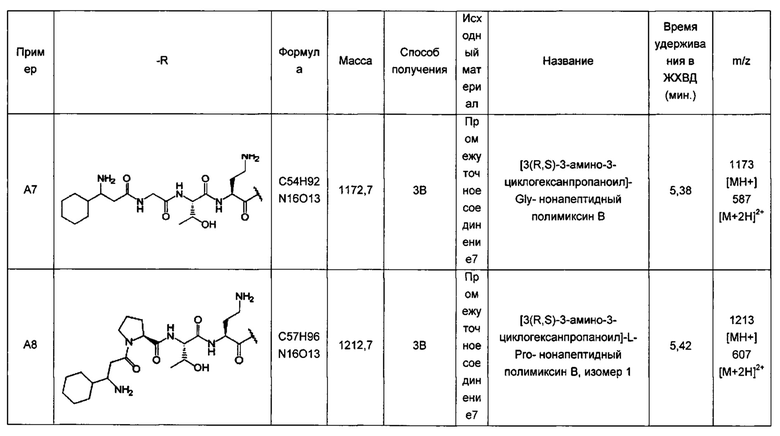

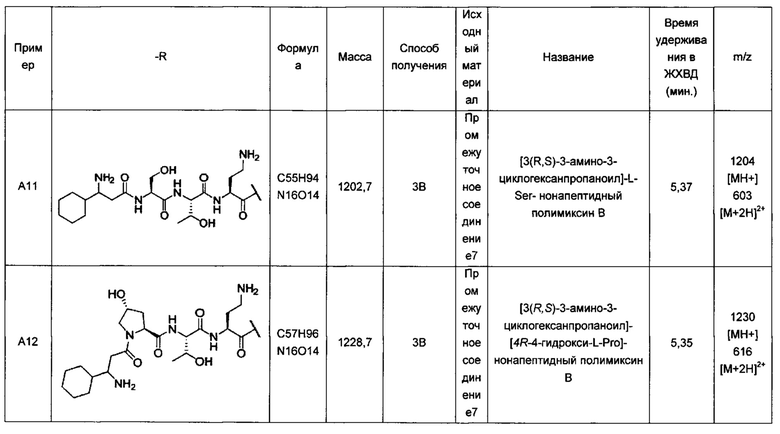
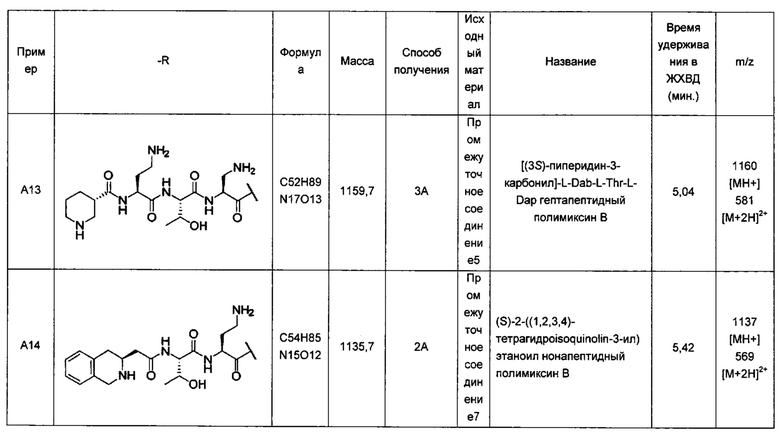
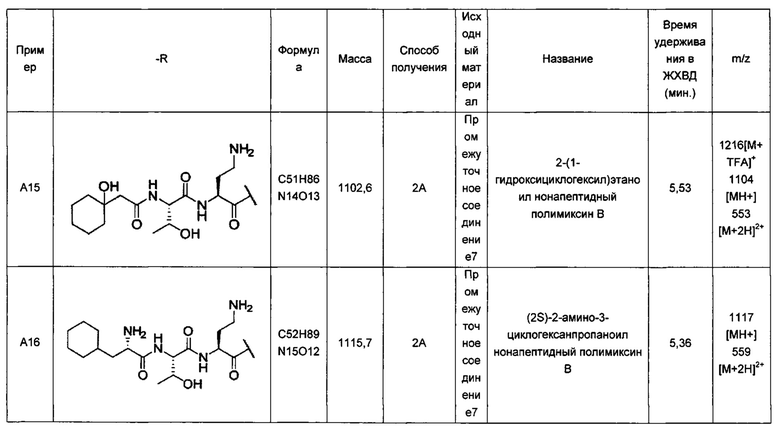
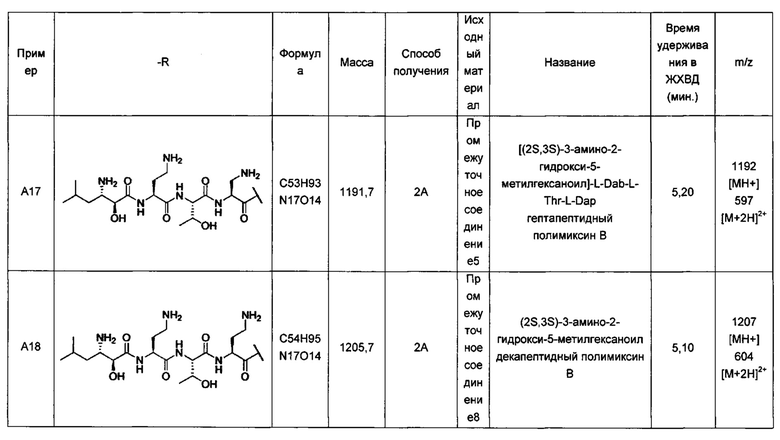

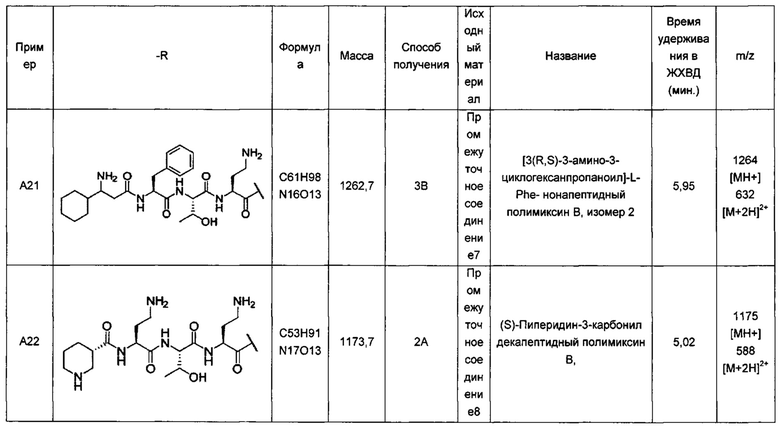
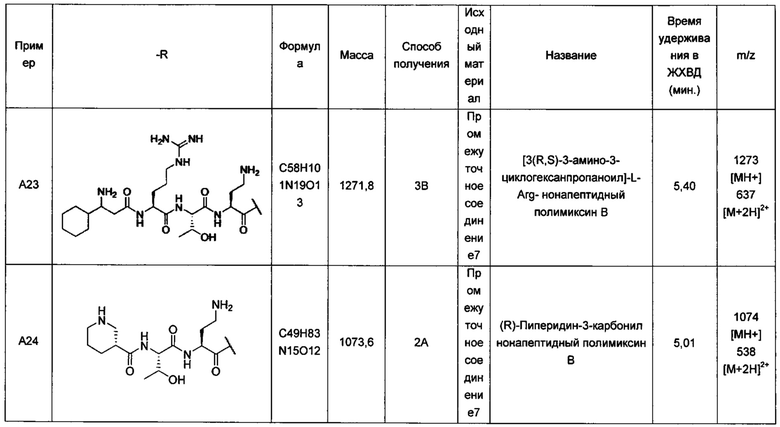



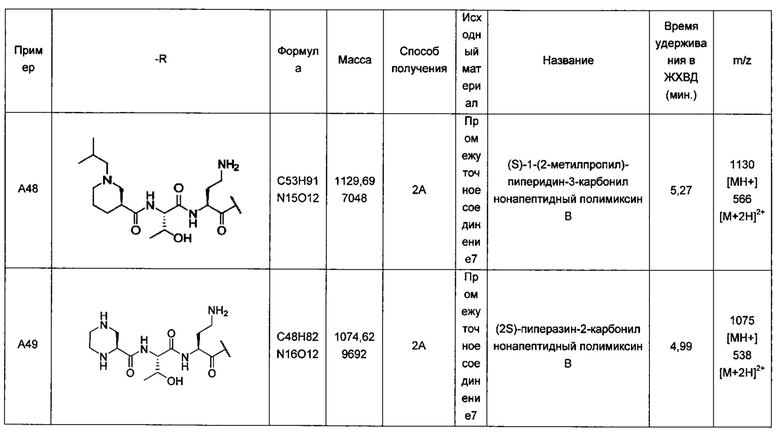
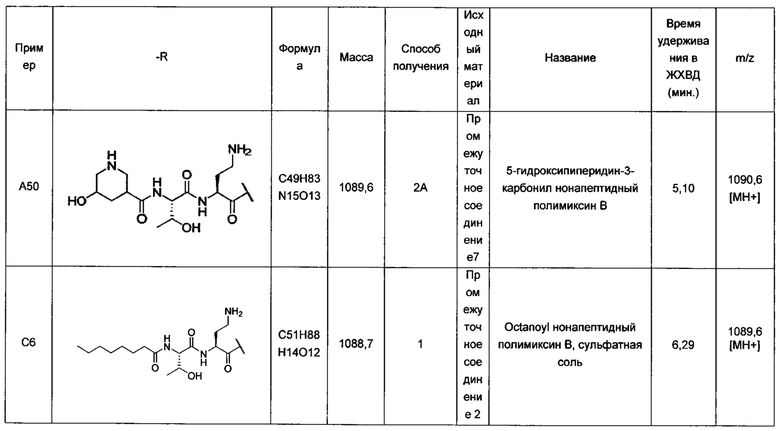
Биологическая активность
Для оценки эффективности и спектра действия соединения отдельно и в комбинации с другим агентом, проводили исследование на чувствительность с использованием четырех штаммов каждого из грамотрицательных патогенов: Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae и Acinetobacter baumannii.
Соотношения компонентов в комбинации, например 1:1, относится к относятся к масс-массовому соотношению.
Минимальная ингибирующая концентрация (MIC) относится к общей концентрации лекарственных средств (например, исследуемой соединение плюс второй агент, такой как рифампицин).
Активность в комбинации
Инокулят готовили путем получения суспензии непосредственно выделенных колоний (выбранных с 18-24 часовой чашки с агаром Мюллера-Хинтона), доведенной до мутности 0,5 по стандарту МакФаранда.
Проводили тестирование на MIC с использованием двукратных серийных разведений антибиотиков в бульоне Хинтон-Миллера, сбалансированного по катионам, в стерильных 96-луночных микротитрационных планшетах в общем объеме 170 мкл (150 мкл жидкой среды, содержащей противомикробный агент, 20 мкл инокулята). Тесты проводили в дупликатах. Планшеты инкубировали в аэробных условиях без встряхивания в течение 18-20 часов при 35°С, MIC определяли как самую низкую концентрацию лекарственного средства, которая предотвращала видимый рост. В тех случаях, когда значения в повторах различались меньше, чем в 2-раза, регистрировали меньшее из двух значений. Если наблюдали более чем 2-кратную разницу, тест признавали невалидным. Некоторые из соединений подвергали нескольким тестам, и в этих случаях MIC соответствует моде полученных значений.
В Таблице 5 показаны значения MIC (микрограмм/мл), зарегистрированные для соединений Примеров 1-55 в комбинации 1:1 (масс:масс) с рифампицином. Для сравнения использовали следующие соединения, каждое из которых исследовали в смеси 1:1 с рифампицином: колистин (полимиксин Е), полимиксин В (РМВ), нонапептидный полимиксин В (PMBN), С2 (СВ-182,804) и С1 (NAB-739).
СВ-182,804 представляет собой декапептидное производное полимиксина с заместителем - арилмочевиной на N-конце, которое, как было заявлено обладает более низкой токсичностью, чем полимиксин В (показано как соединение 5 в публикации WO 2010/075416), и было получено авторами настоящего изобретения. С1 также получали на месте, это соединение соответствует NAB-739 (как описано Vaara в, например, WO 2008/017734.
В Таблице 5А приведены значения MIC (микрограмм/мл) для некоторых соединений-примеров в сравнении с эталонными соединениями С3-С5, в комбинации 1:1 (масс:масс) с рифампицином. Результаты показывают, что соединения, содержащие гидроксильные и/или аминогруппы (такие как -NR6R7) обеспечивают более значительные потенцирующие эффекты, чем соединения, которые не содержат гидроксильных и/или аминогрупп.
Сравнение примера сравнения С3 (с бензоильной боковой цепью) с соответствующим анилиновым аналогом (соединение-пример 5) демонстрирует улучшение MIC в отношении штаммов Klebsiella и Pseudomonas для анилин-содержащего соединения по сравнению с С3, в случае комбинации обоих с рифампицином. Аналогично, введение пиперидина на бензоильной группе (Пример 55) аналогичным образом улучшает активность в отношении этих организмов.
Замена циклогексильного кольца в Примере С4 на пиперидин, как в Примере 33, также демонстрирует значительное улучшение активности в отношении штаммов всех исследованных организмов. Другие аналоги, содержащие пиперидин, также демонстрируют хорошие уровни активности (Соединения-примеры 29 и 37). Основность в этом положении имеет большое значение, поскольку аналогичное производное с пиридилом (Референсный пример С5) не демонстрирует повышенный уровень активности.
В Таблице 5В показано влияние изменения соотношения соединения к рифампицину в комбинации.
Минимальная ингибирующая концентрация относится к общей концентрации лекарственных средств (например, исследуемое соединение плюс рифампицин). Масса соединений в комбинации была одинаковой. Масса относится к массе применяемого соединения, например, соединений-примеров, используемых в форму соли ТФУК или сульфата.
Считали, что стехиометрия соединений-примеров в форме соли составляет приблизительно 1:5 для соединение:кислота в случае ТФУК 1:2,5 в случае сульфата, например, где соединение-пример содержит пять аминогрупп.
В качестве вторых агентов использовали следующие: Ванкомицин гидрохлорид, меропенем тригидрат, тигециклин гидрат, ципрофлоксацин в форме свободной кислоты, натриевая соль фузидовой кислоты, азитромицин дигидрат, в форме свободной кислоы, оксациллин, натриевая соль, и новобиоцин в форме натриевой соли.
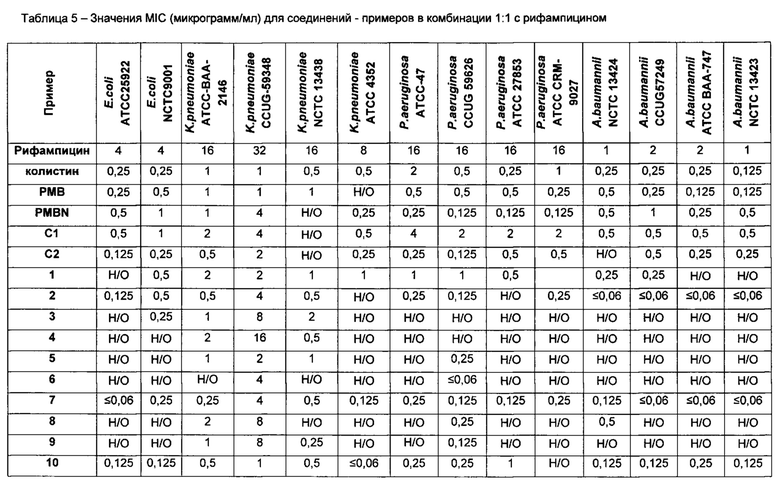
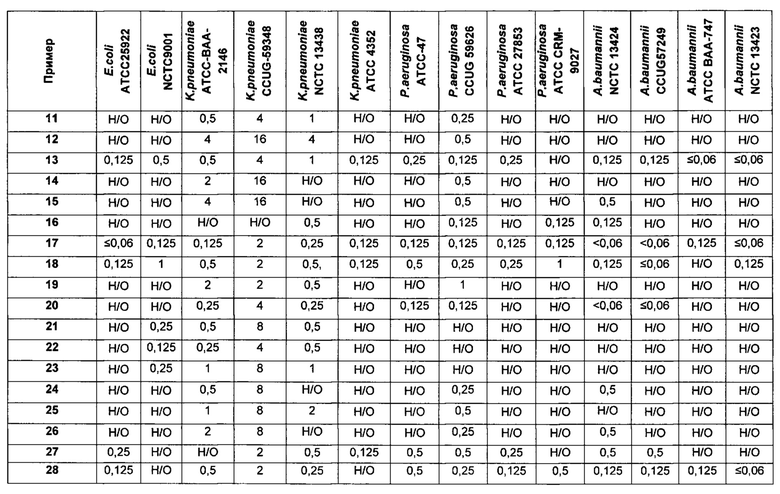
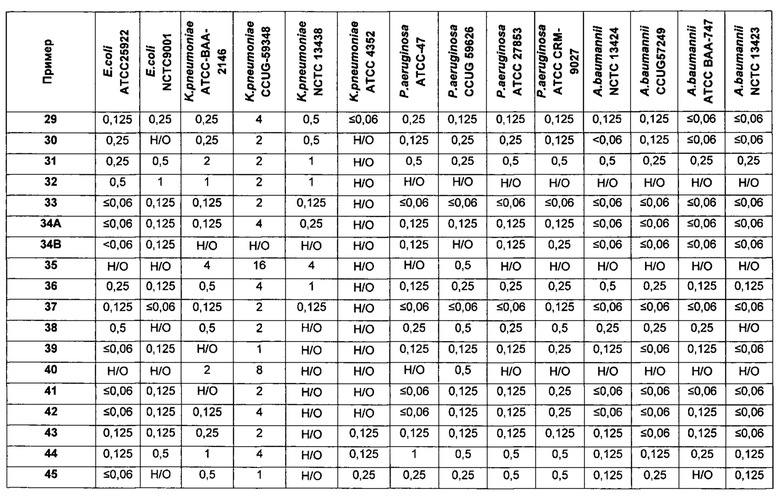
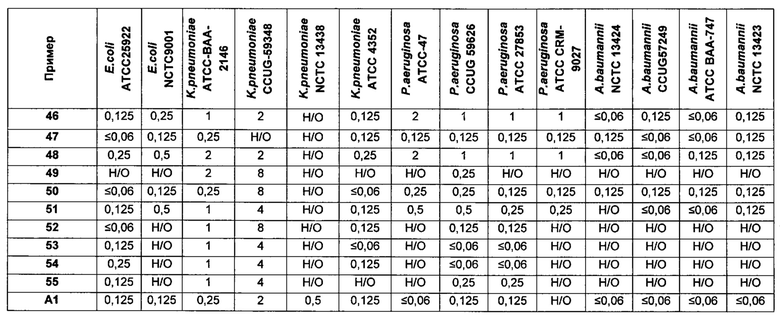
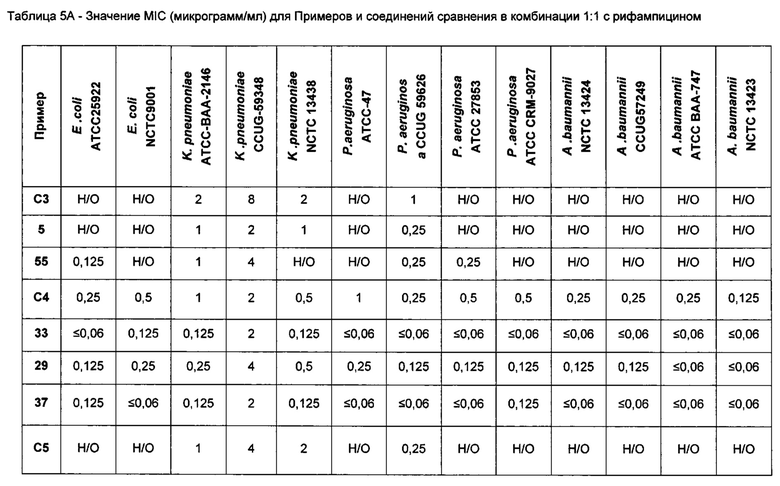
В Таблице 5В показано влияние изменение соотношения соединения к рифампицину в комбинации. Комбинации с рифампицином, колистином, нонапептидным полимиксином В и соединением-примером 10 исследовали в соотношениях 1:3, 1:1 и 3:1. Значение MIC (микрограмм/мл) относится к общей концентрации лекарственных средств (т.е. исследуемое вещество плюс рифампицин). Полученные значения были в пределах 2-кратного отклонения, наблюдаемого в тесте на MIC.
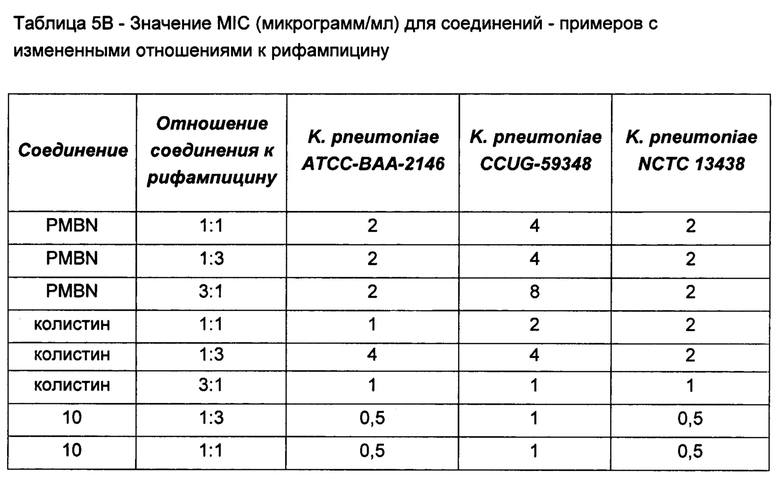
Самостоятельная активность
В Таблице 6 ниже показана активность, выраженная в знамениях MIC, соединений-примеров в отсутствие.
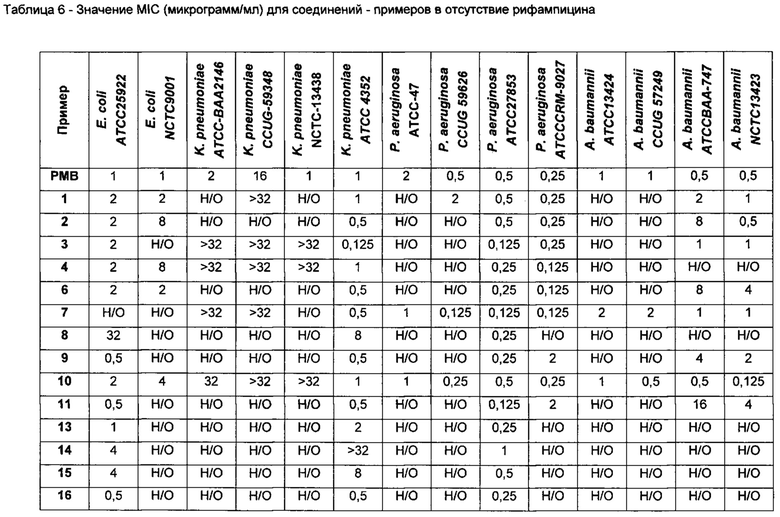
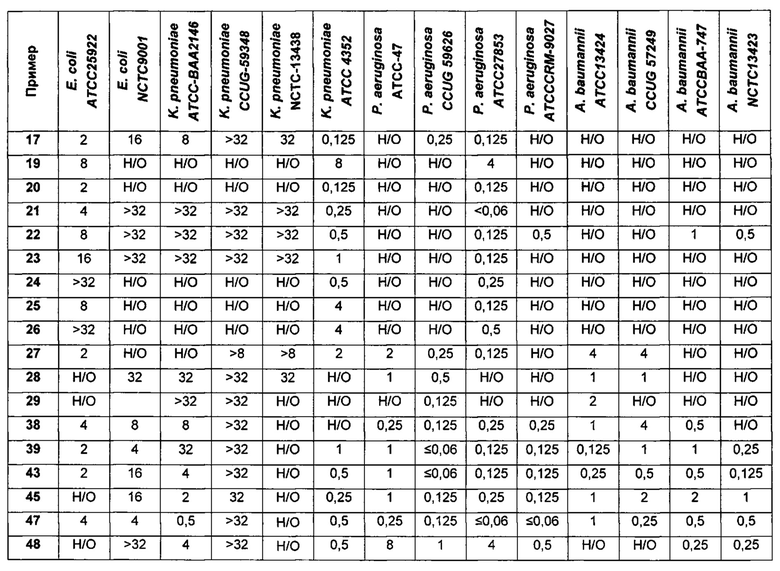
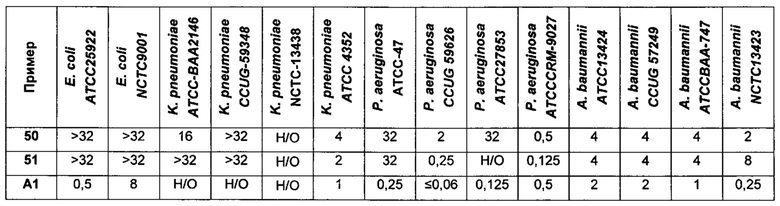
Активность в комбинации
В Таблицах 7А 7I показаны отобранные соединения в соотношении 1:1 с другими антибактериальными агентами. Значения MIC относятся к общей концентрации лекарственных средств. Соответственно, в случае применения комбинации 1:1, это количество исследуемого соединения и второго агента. Для сравнения, также приведено Значение MIC для второго агента отдельно.
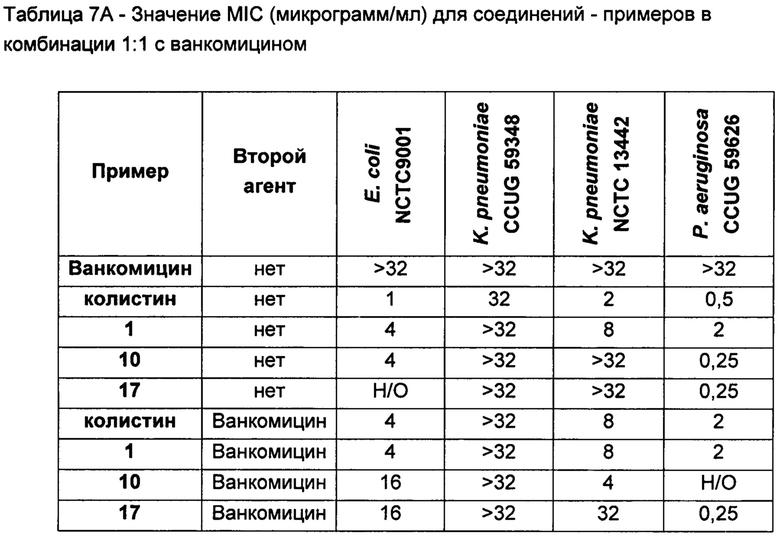
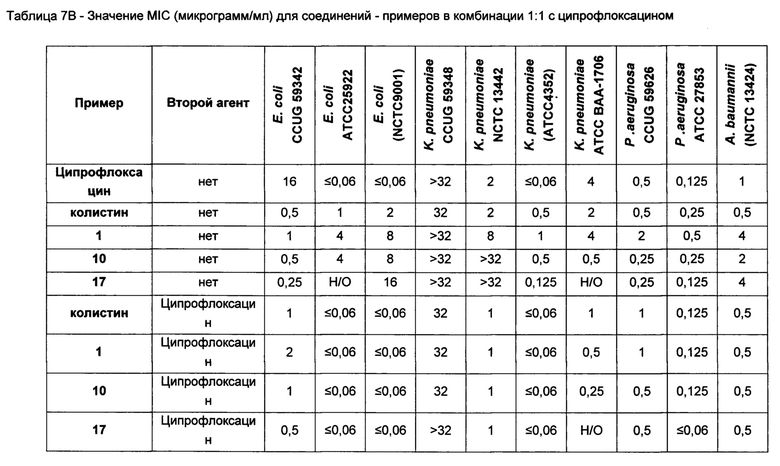
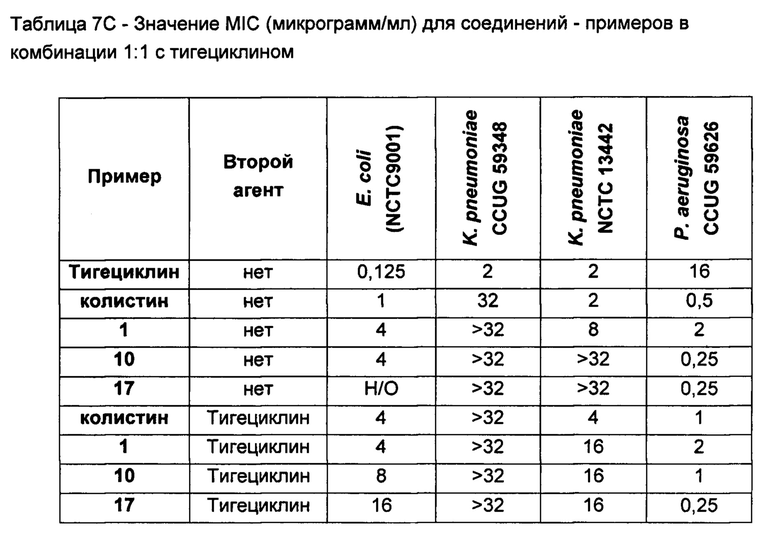
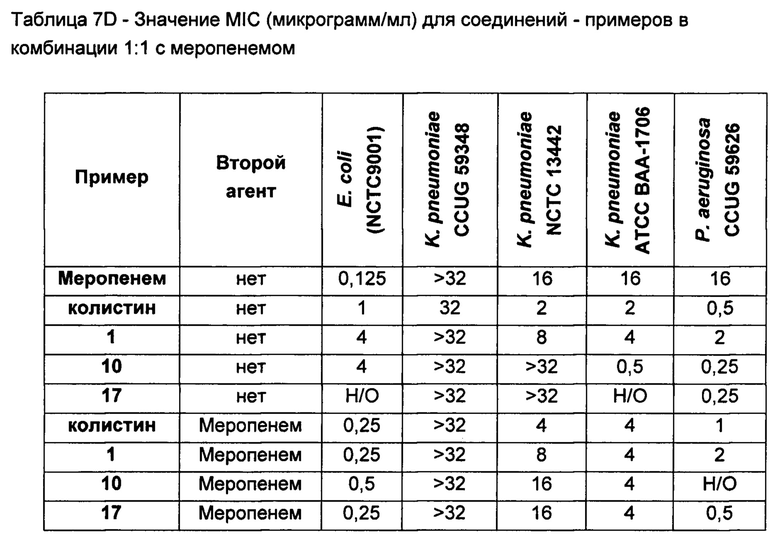
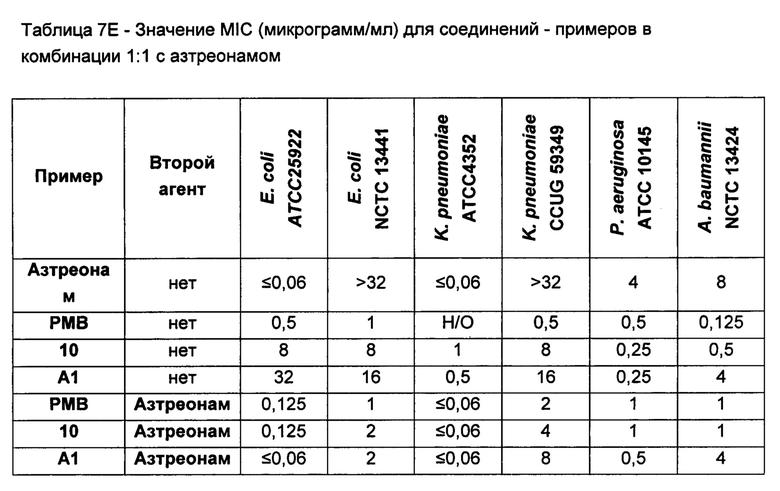
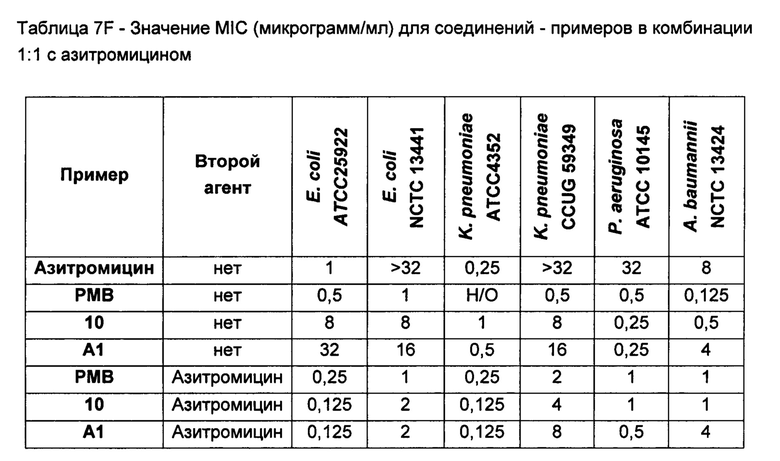
Получали значения MIC для других соединений-примеров и сравнивали с примерами сравнения PMB и оксациллином.
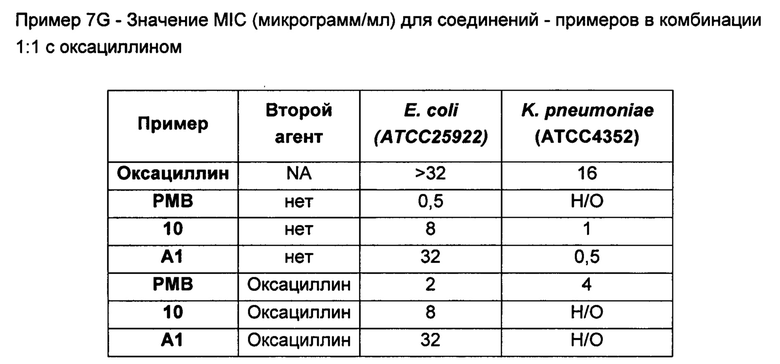
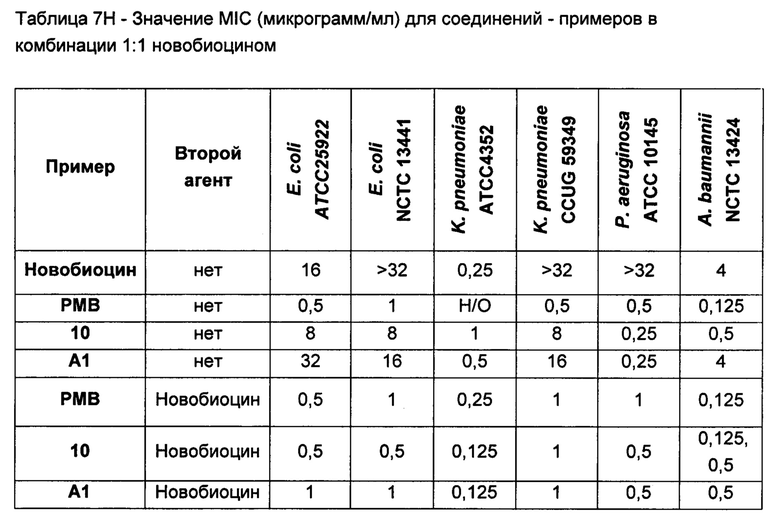
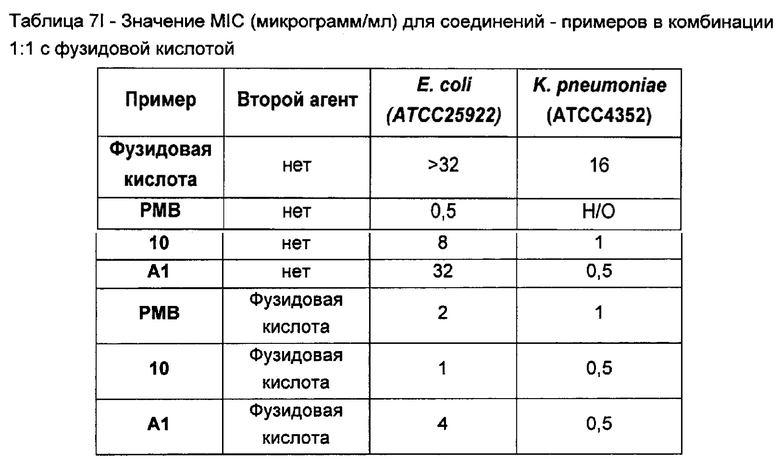
In Vitro анализ цитотоксичности в отношении клеток почек
Цитотоксичность соединения в отношении клеток почек оценивали в in vitro анализе с использованием клеточной линии HK-2, иммортализованной линии клеток проксимальных канальцев, выделенных из нормальной почки человека. Результатом для характеристики токсичности соединения было снижение уровня резазурина, коррелирующее с метабоолической активностью клеток. Клетки культивировали во флаконах площадью 150 см2 в 25 мл дополненной среду KSF (с 5 нг/мл эпидермального фактора роста и 50 мкг/мл экстракта гипофиза быка). Клетки поддерживали при 70% конфлюентности с макс. 25 пересевами.
День 1: Среду удаляли и клетки промывали 10 мл фосфатного буфера Дульбекко (DPBS). Затем во флакон добавляли шесть мл 0,25% раствора трипсина с ЭДТА и возвращали клетки в инкубатор. После инкубирование в течение 1-2 минут во флакон добавляли 14 мл среды добавляли для инактивации трипсина. Суспензию клеток переносили в центрифужную пробирку и осаждали клетки при 1000 об./мин в течение 6 минут. Затем клеточный осадок ресуспендировали в свежей среде, дополненной эпидермальным фактором роста и экстрактом гипофиза быка. Подсчитывали число клеток и разбавляли клетки до 46875 клеток/мл в свежей среде, дополненной эпидермальным фактором роста и экстрактом гипофиза быка. Распределяли по 7500 в каждую лунку в объеме 160 мкл и инкубировали при 37°С в течение 24 ч.
День 2: Готовили исследуемые соединения: либо непосредственно с среде, либо из маточных растворов, таким образом, чтобы получить не более 0,5% ДМСО или 5% воды в конечной аналитической среде. Готовили девять значений концентрации от 1000 мкг/мл до 1,95 мкг/мл путем двукратных разведений в свежей среде. Микротитрационные планшеты извлекали из инкубатора и заменяли среду на 100 мкл растворов с разбавлениями соединения. Каждую серию концентраций исследовали в трипликате, и в каждый планшет добавляли положительный и отрицательный контроли. Затем планшеты инкубировали в течение 24 ч при 37°С с 5% CO2 в.
День 3: Реагент, содержащий резазурин (CellTiter-Blue, Promega) разбавляли в ФБР (1:4) и добавляли в количестве 20% (об./об.) в каждую лунку. Затем планшеты инкубировали при 37°С в течение 2 ч, а затем определяли снижение уровня флуоресцентного продукта.
Вычитали известные из литературы значения, полученные со средами отдельно, а затем исследовали данные с использованием GraphPad Prism. Строили график концентрации соединения в виде логарифмических значений для аппроксимации кривой доза-ответ и определяли значения IC50 (Таблицы 8А и 8В).
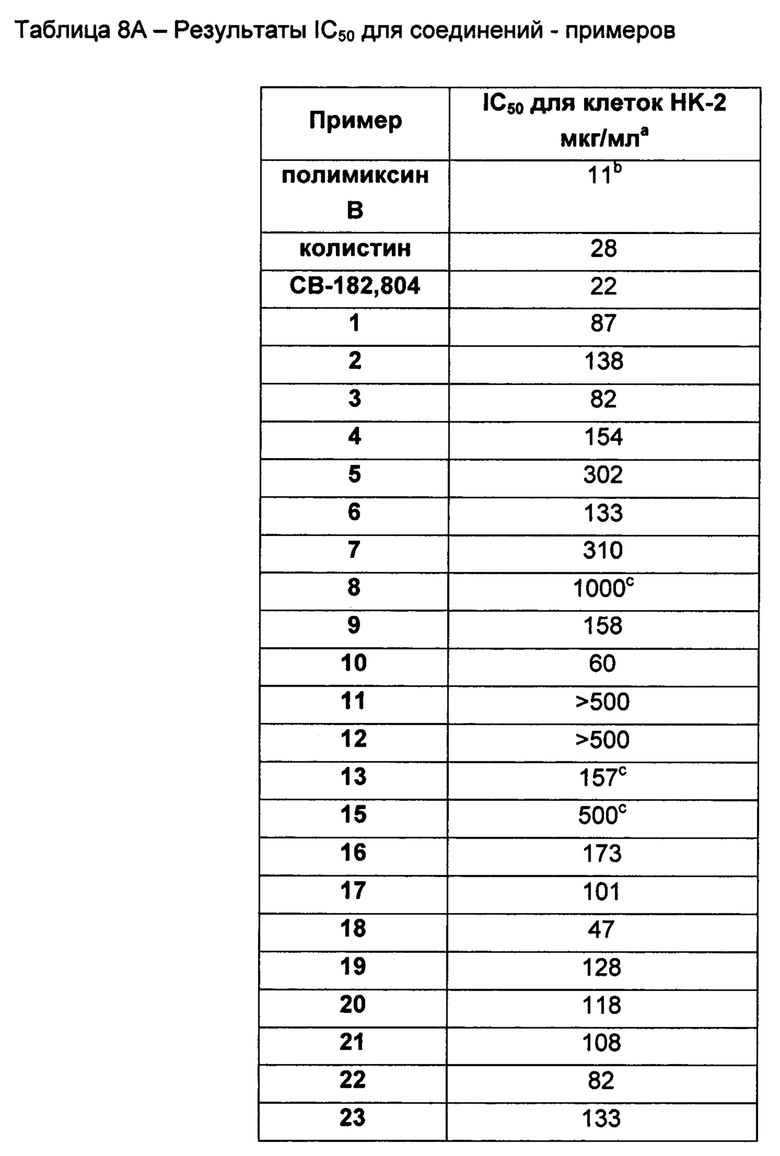
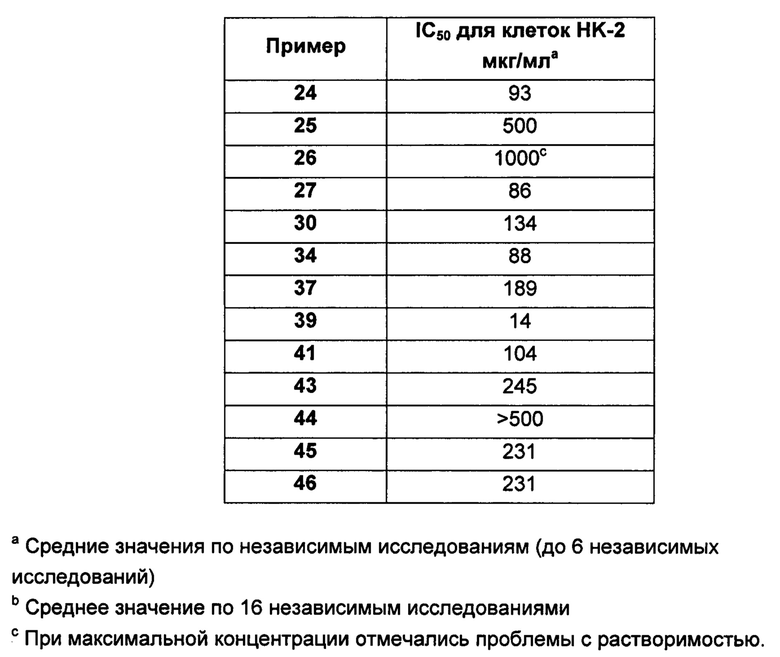
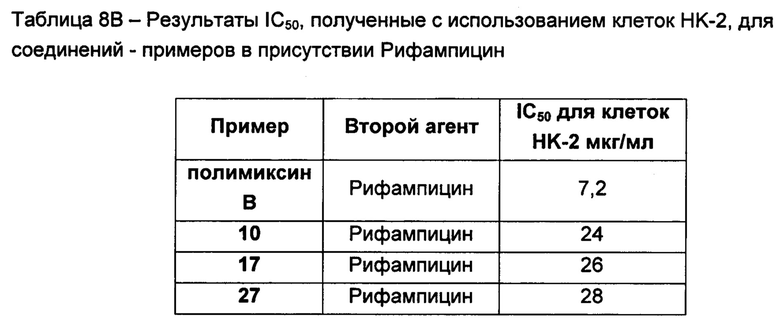
IC50 относится к общей концентрации лекартсвенных средств (исследуемое вещество плюс рифампицин). Соотношение соединения к рифампицину было 1:1 (масс:масс).
Самостоятельная активность - дополнительные данные
В Таблице 6А ниже показана активность, выраженная в значениях MIC, соединений-примеров в отсутствие второго агента, и токсичность в отношении линии клеток HK-2 (измеренная по отношению к значениями IC50 и выраженная относительно значений для полимиксина В)
Значения MIC определяли как описано в настоящем документе, за тем исключением, что использовали другой источник сбалансированной по катионам среды МНВ. Примеры 37 и 39 исследовали повторно для прямого сравнения. Значения IC50 для клеток HK-2 определяли как описано в настоящем документе. Значения приведены по отношению к полимиксину В.
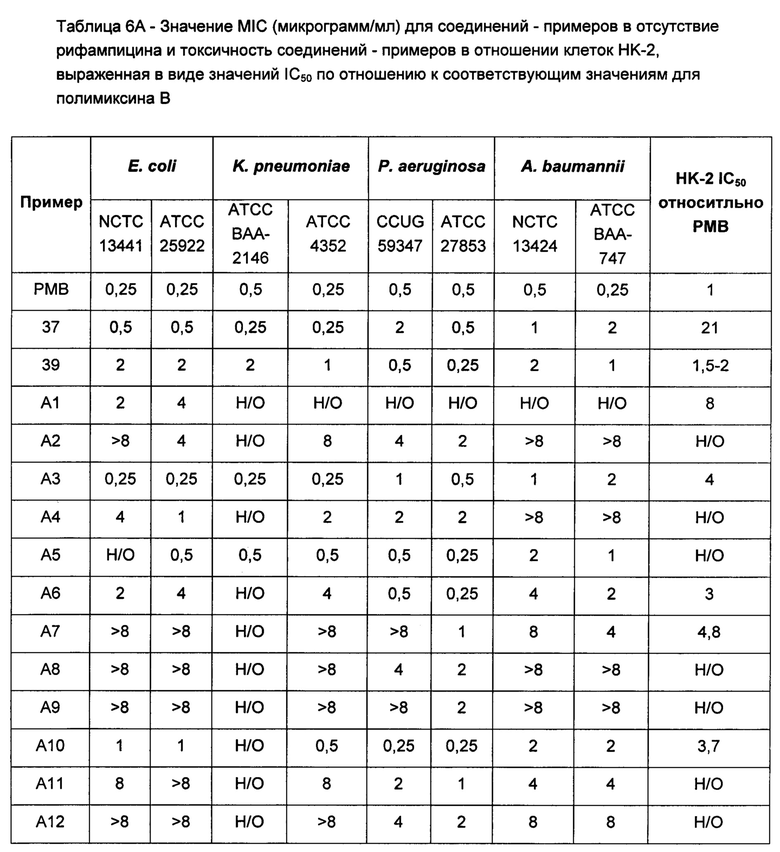
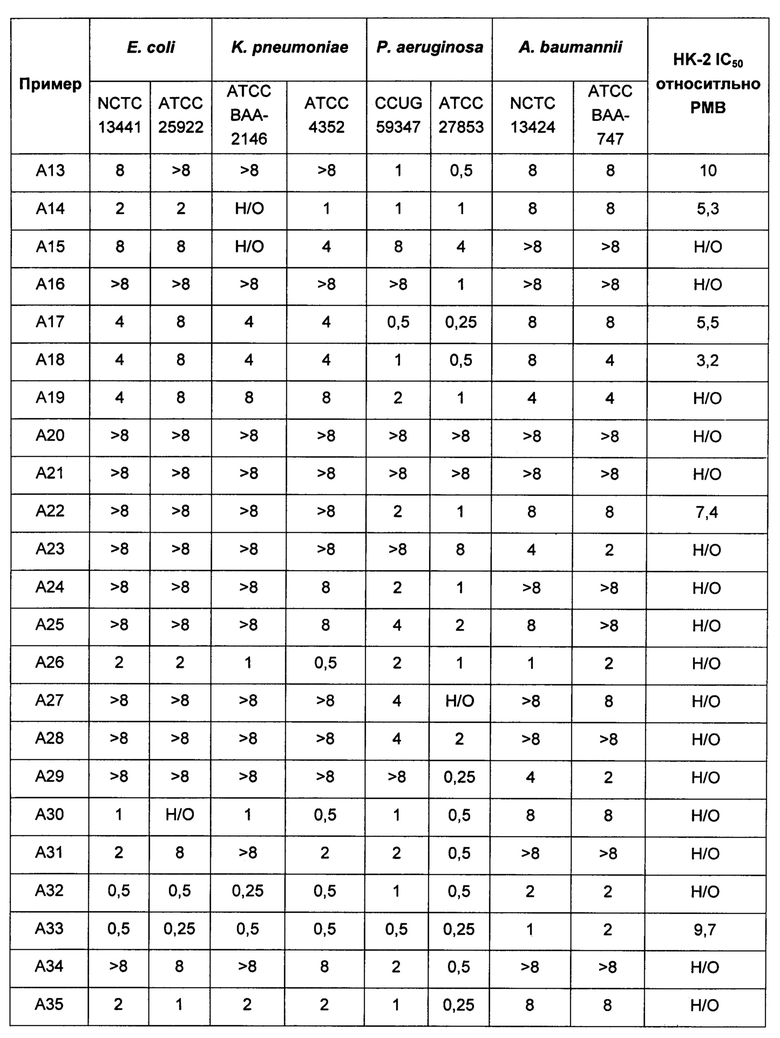
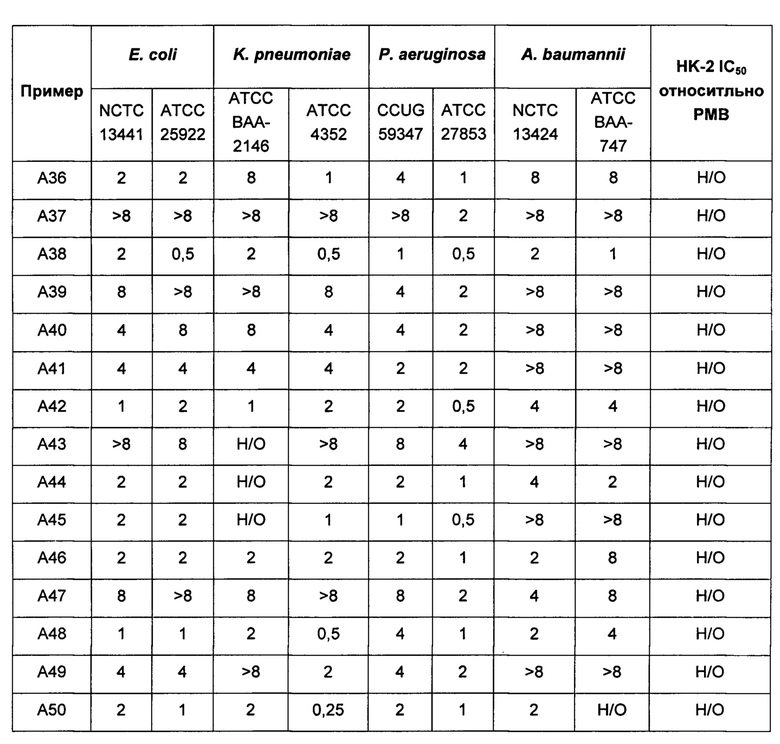
Значения MIC сравнивали с соединениями, известными из литературы. Данные приведены в Таблице 6В. С2 (СВ-182,804) представляет собой декапептидное производное полимиксина, описанное у Cubist (показано как соединение 5 в публикации WO 2010/075416), С1 представляет собой NAB-739 (описанный Vaara в, например, WO 2008/01773).
In vivo эффективность против инфекции бедра, вызванной Е. coli, у мышей - комбинация с рифампицином
In vivo эффективность двух соединений-примеров (Соединения-примеры 10 и А1) в комбинации 1:1 с рифампицином исследовали в модели инфекции бедра, вызванной Е. coli, на мышах. Результаты собраны в Таблице 9.
Использовали группы из 4 самцов мышей без конкретного патогена CD-1. У мешей вызвали временную нейтропению в результате иммуносуппрессии путем введения циклофосфамида в концентрации 150 мг/кг/день за 4 дня перед инфекцией и в концентрации 100 мг/кг/день за 1 перед инфекцией путем внутрибрюшинной инфекции. Через 24 часа после второго раунда иммуносупрессии мышей инфицировали путем введения штамма АТСС25922 Е. coli внутримышечно в боковые мышцы обоих бедер под газовой анестезией с использованием ~6,5×105 КОЕ/бедро мыши.
Исследуемые соединения и полимиксин В вводили в дозах 0,0625, 0,25 и 2,5 мг/кг/день совместно с рифампицином в эквивалентной дозе. Это обеспечивало уровни доз 0,125, 0,5 и 5 мг/кг/день для каждой комбинации (Таблица 9). Дополнительно согласно настоящему изобретению предложен полимиксин В вводили в качестве монотерапии в дозах 0,125, 0,5 и 5 мг/кг/день. Соединения вводили в растворе путем внутривенной (IV) инъекции в боковую вену хвоста. Это делали три раза через 1, 3,5 и 6 часа после инфицирования при объеме дозы 10 мл/кг (0,25 мл/25 г мышь). Контрольной группе вводили нейтральную основу (0,9% физраствора для инъекций) также в количестве 10 мл/кг внутривенно трижды через 1, 3,5 и 6 часов после инфицирования.
Через 1 час после инфицирования 4 животных подвергали гуманной эвтаназии с использованием передозировки пентабарбитоном, что давало группу контроля до лечения. Через 9 часов после инфицирования оценивали клиническое состояние всех животных, после чего их подвергали гуманной эвтаназии с использованием передозировки пентабарбитоном. Определяли массу животных, после чего извлекали оба бедра и взвешивали из отдельно. Отдельные образцы ткани бедра гомогенизировали в ледяном стерильном фосфатном буферном растворе. Гомогенаты культивировали для количественного анализа на агаре CLED и инкубировали при 37°С в течение 24 часов, после чего осуществляли подсчет колоний.
Соединения-примеры 10 и А1 в комбинации 1:1 с рифампицином в общей концентрации 5 мг/кг/день/дозы демонстрировали более высокую эффективность, чем только полимиксин В, и которая была сравнима с эффективностью комбинации 1:1 полимиксина В с рифампицином, снижение количества бактерии превосходило 4 log10.

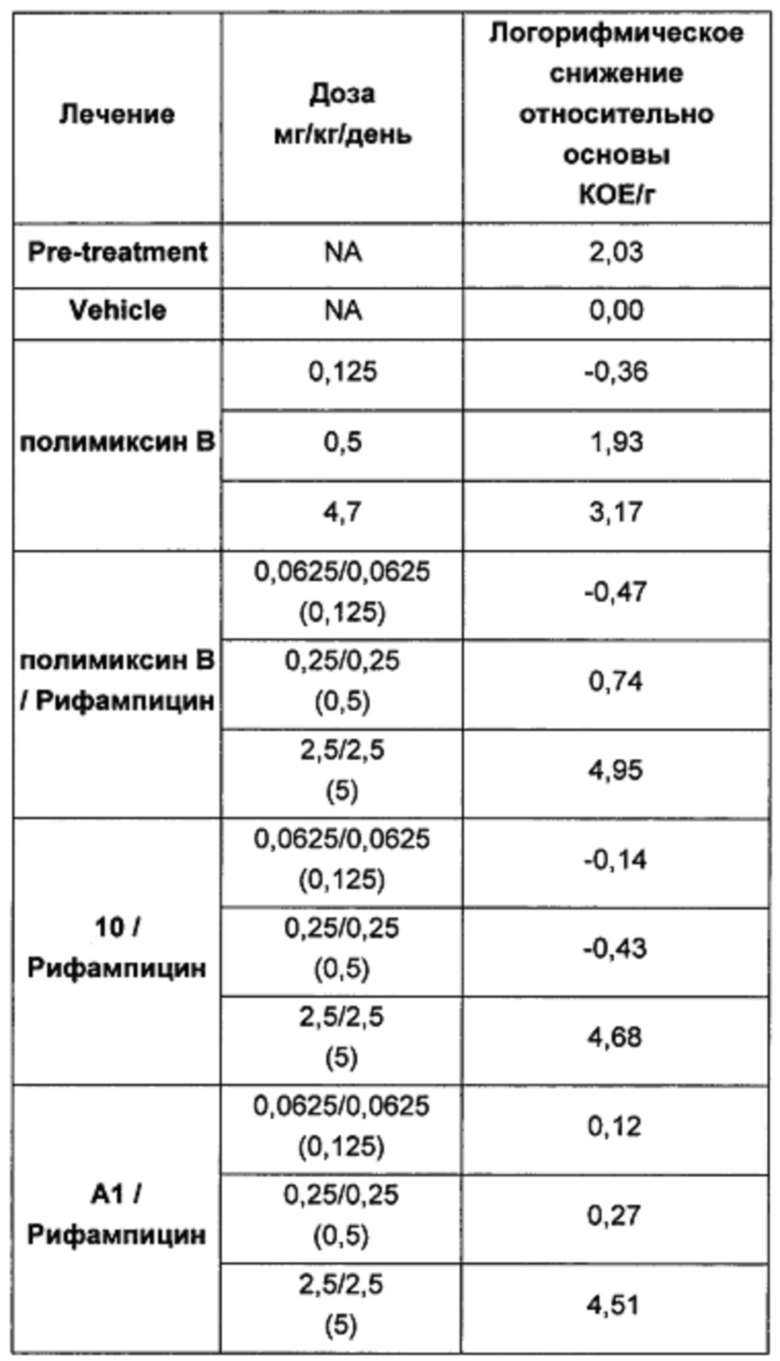
Нефротоксичность In vivo
Реализовывали нефротоксичности полимиксинов на крысах (адаптированная, на основе описанной у Yousef et al. Antimicrob. Agents Chemother. 2011, 55, 4044-4049). В этой модели исследовали соединения-примеры 1, 4, и 10 и сравнивали с колистином (в форме сульфата). После акклиматизации в течение одной недели самцов крыс Sprague-Dawley готовили путем хирургической установки канюли в яремную вену и содержали по отдельности соответствующим образом, либо в заранее выделенных клетках для содержания, либо в метаболических клетках. Колистин и соединения-примеры готовили в физиологическом растворе.
Соединения вводили через канюлю в яремной вене дважды день с интервалом 7 часов в течение семи дней. Каждую дозу постепенно увеличивали в течение трех дней до максимальной дозы, которую вводили до завершения исследования. Осуществляли суточный сбор мочи (на лед) в дни перед введением лекарственного средства и в дни 4 и 7. Режимы введения представлены в Таблице 10 ниже.
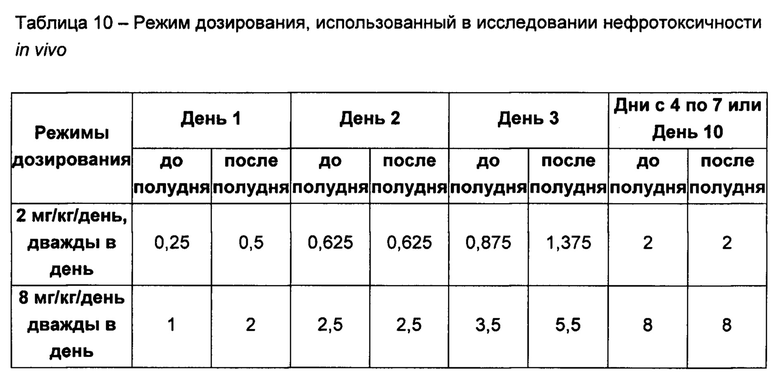
Дозы в таблице приведены в мг лекарственного средства в виде основания/кг (свободное основание).
Активность в моче N-ацетил-бета-D-глюкозаминдазы (NAG) определяли методом спектрофотометрии с использованием тест-набора на NAG производства Roche Applied Science. Биомаркеры повреждения почем определяли с использованием панели Kidney Injury Panel II производства Multi-Spot® Assay System (Meso Scale Discovery).
Соединения-примеры 1, 4, и 10, вводимые с использованием режима 8 мг/кг/день, продемонстрировали значительно сниженные уровни почечных биомаркеров NAG, альбумина и цистатина С по сравнению с колистином при том же режиме дозирования (см. Фигуры 1-3). Ответ был близким к ответу, вызваемому колистином в мкасимальной концентрации 2 мг/кг/день.
In vivo эффективность в отношении инфекции бедра, вызванной Е. coli, у мышей - Соединения-примеры in vivo эффективность 6 соединений согласно настоящему изобретению (Примеры 1, 2, 3, 4, 7 и 10) оценивали в модели инфекции бедра у мышей, вызванной Е. coli. Результаты собраны в Таблице 11 и 11А.
Использовали группы из 5 самок мышей без специфических патогенов CD-1 массой 22±2 г. У животных вызвали нейтропению путем внутрибрюшинного введения циклофосфамида в дни -4 (150 мг/кг/день) и -1 (100 мг/кг/день). В День 0 животным подкожно инокулировали 105 КОЕ/мышь изолята АТСС25922 Escherichia coli в правое бедро. Через 1 h определяли количество КОЕ у 5 мышей, а оставшимся мышам (по пяти на группу) делали подкожную инъекцию лекарственного средства: через 1 и 6 ч после инфицирования. В каждом исследования использовали две группы с разными дозами для каждого соединения: 1,5 и 5 мг/кг/день, дважды в день, соответственно.
Готовили соединения-примеры и полимиксин В в нормальном физрастворе в концентрации 2 мг/мл и доводили рН раствора до 6-7 путем добавления 0,1М H2SO4 или 4,2% NaHCO3, по необходимости. Через двадцать четыре часа после инфицирования мышей подвергали гуманной эвтаназии. Собирали мышцу правого бедра каждого животного, гомогенизировали, готовили серийные разведения и высевали на агар с сердечно-мозговой вытяжкой + 0,5% древесного угля (масс./об.) для определения КОЕ. Для каждой группы определяли снижение общего количества КОЕ правого бедра по сравнению с контрольными значениями через 24 ч.
Соединения 1 и 4 в дозе 10 мг/кг/день демонстрировали эффективность, сравнимую с эффективностью полимиксина В со снижением количества бактерий выше 3 log10.
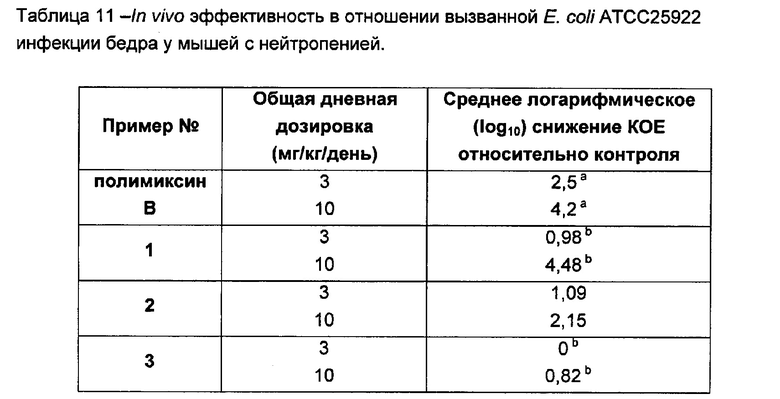
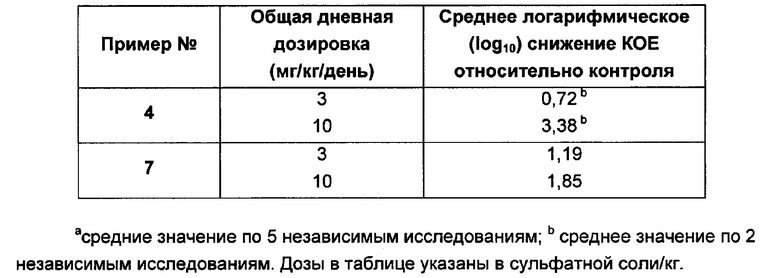
In vivo эффективность соединения из Примера 10 оценивали отдельно в модели инфекции бедра у мышей, вызванной Е. coli с использованием способов, описанных в примерах выше. Результаты приведены в Таблице 11А в сравнении с полимиксином В.
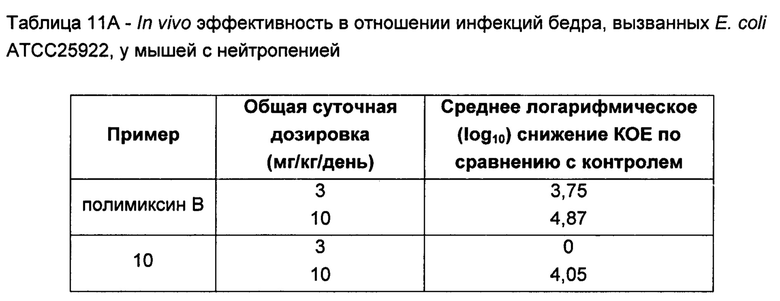
Соединение 10 в дозе 10 мг/кг/день демонстрировало эффективность, сравнимую с эффективностью полимиксина В, со снижением количества бактерий выше 3 log10.
С использованием той же процедуры, которая описана выше, оценивали in vivo эффективность трех соединений согласно настоящему изобретению (Примеры 1, 4 и 10) в модели инфекции бедра, вызванной Klebsiella pneumoniae ATCC10031, у мышей с использованием колистина (полимиксин Е) в качестве соединения-сравнения. Результаты приведены в Таблице 11В. Соединения 1, 4 и 10 в количестве 10 мг/кг/день продемонстрировали эффективность, сравнимую с эффективностью колистина, со снижением количества бактерий, соответствующем приблизительно 2 log10.
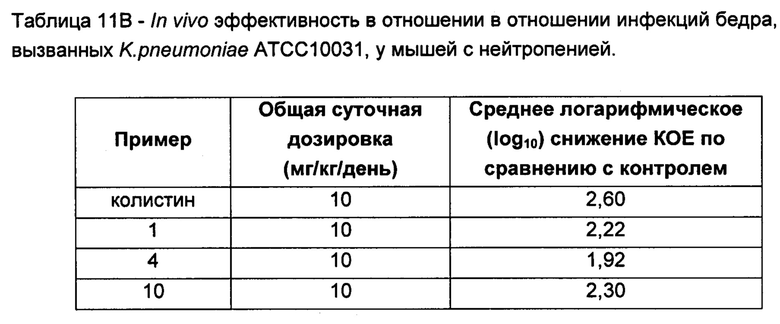
Дозы в таблицах указаны в мг сульфатной соли/кг.
Дополнительная биологическая активность
In vivo эффективность в отношении инфекции бедра, вызванной Е. coli АТСС25922, у мышей с нейтропенией - комбинация
In vivo эффективность А1 оценивали отдельно и в комбинации 1:1 (масс:масс) с рифампицином в модели инфекции бедра, вызванной Е. coli 25922, с использованием протокола, описанного для соединений 10 и 27 (Таблица 9) и с использованием уровней доз, указанных в Таблице 12. Результаты приведены в Таблице 12
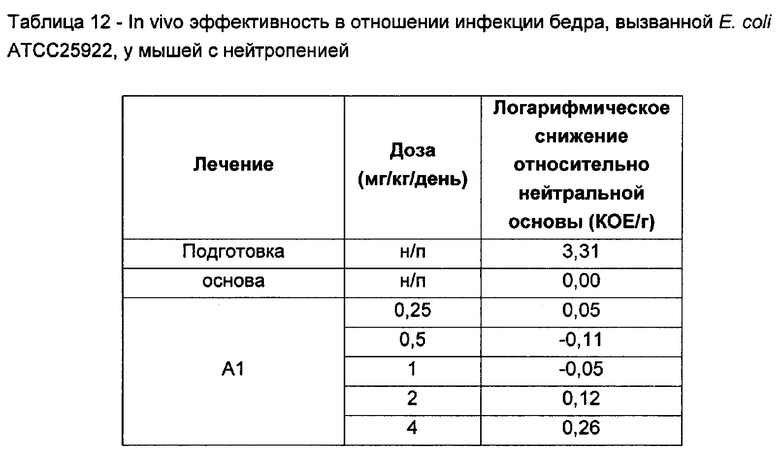
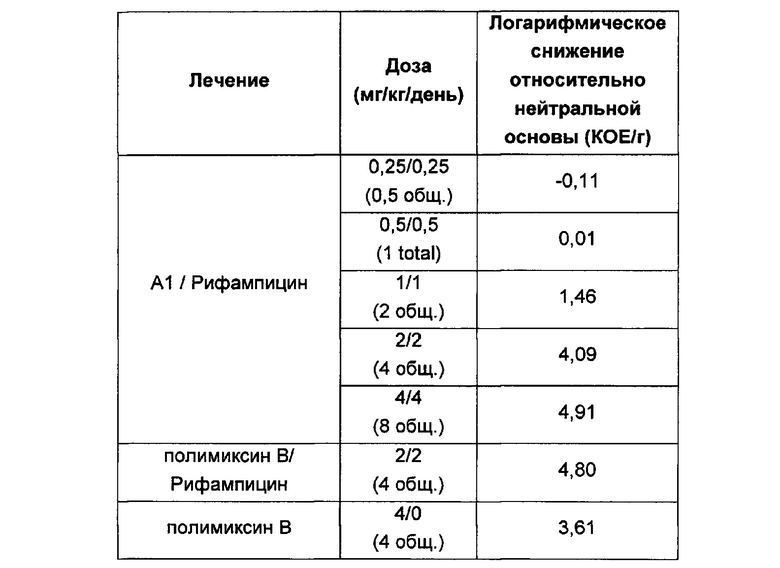
Дозы в таблицах указаны в мг сульфатной соли/кг.
А1 в комбинации 1:1 с рифампицином в общей дозе 4 мг/кг/день давало логарифмическое снижение количества бактерий, соответствующее 4,09 по сравнению с контролем без лечения. Полимиксин В в комбинации 1:1 с рифампицином в той же дозе давало логарифмическое снижение количества бактерий, соответствующее 4,8.
In vivo эффективность в отношении инфекции бедра, вызванной P. aeruginosa АТСС 27853, у мышей - Комбинация
Исследование эффективности in vivo, в котором сравнивали полимиксин В, Пример 37 и Пример 41 в комбинации 1:1 с рифампицином, осуществляли в модели 9-часовой нагрузки бедра с инфекцией, вызванной P. aeruginosa АТСС27853, у самцов мышей CD1. Основные результаты приведены в Таблице 13.
В этом исследовании использовали 4 самцов мышей в группе лечения для каждого соединения и 6 для контроля с введением нейтральной основы, у мышей вызвали временную нейтропению путем иммуносупрессии путем введения циклофосфамида в концентрации 150 мг/кг/день за 4 дня перед инфекцией и в концентрации 100 мг/кг/день за 1 перед инфекцией путем внутрибрюшинной инфекции. Через 24 часа после второго раунда иммуносупрессии мышей инфицировали путем введения штамма Р. aeruginosa ATCC27853 внутримышечно в боковые мышцы обоих бедер под газовой анестезией с использованием ~2,5 - 5×105 КОЕ/бедро мыши. Полимиксин В, Пример 37 и Полимиксин 41 вводили в количества 0,25, 1 и 2,5 мг/кг/день совместно с рифампицином в эквивалентной дозе. Это давало уровни антибактериальных средств, равных 0,5, 2 и 5 мг/кг/день, для каждой комбинации (Таблица 1). Соединения вводили в растворе путем внутривенной (в.в.) болюсной инфекции в боковую вену хвоста. Это делали три раза, через 1, 3,5 и 6 часов после инфицирования при объеме дозы 10 мл/кг (0,25 мл/25 г массы мыши). Группе контроля с нейтральной средой вводили 0,9% физраствора для инъекций также в дозе при 10 мл/кг внутривенно через 1, 3,5 и 6 часов после инфицирования.
Через 1 час после инфицирования 4 животных подвергали гуманной эвтаназии с использованием передозировки пентабарбитоном, что давало группу контроля до лечения. Через 9 часов после инфицирования оценивали клиническое состояние всех животных, после чего их подвергали гуманной эвтаназии с использованием передозировки пентабарбитоном. Определяли массу животных, после чего извлекали оба бедра и взвешивали из отдельно. Отдельные образцы ткани бедра гомогенизировали в ледяном стерильном фосфатном буферном растворе. Гомогенатыв юудер культивировали для количественного анализа на агаре CLED и инкубировали при 37°С в течение 24 часов, после чего осуществляли подсчет колоний.


Дозы в таблицах указаны в мг сульфатной соли/кг.
Пример 37, исследуемый в комбинации 1:1 с рифампицином в общей дозе 5 мг/кг/день давало логарифмическое снижение количества бактерий, равное 1,75, по сравнению с контролем без лечения, а комбинация Пример 41:рифампицин давала логарифмическое снижение, равное 2,73, а комбинация полимиксин В:рифампицин давала логарифмическое снижение, равное 5,37 при том же уровне дозы.
In vivo эффективность в отношении инфекции бедра, вызванной P. aeruginosa, у мышей - монотерапия
Исследование эффективности In vivo, в котором сравнивали два уровня дозы Примера 27, Примера 38, Примера 42, Примера 47, Примера 52 с полимиксином В при трех уровнях дозы осуществляли в модели 9-часовой нагрузки бедра с инфекцией, вызванной P. aeruginosa АТСС27853, у самцов мышей ICR с нейтропенией, с использованием протокола, описанного для Примеров 37 и 41. Результаты приведены в Таблице 14.
Пример 27, Пример 38, Пример 42, Пример 47 и Пример 52 вводили в двух дозах (2 и 4 мг/кг/день). Для сравнения использовали три дозы полимиксина В (1, 2 и 4 мг/кг/день). Соединения вводили в растворе путем внутривенной (IV) болюсной инъекции в боковую вену хвоста. Лекарственное средство вводили три раза через 1, 3,5 и 6 часов инфицирования при объеме дозы 10 мл/кг (0,25 мл/25 г мышь). Группе контроля с нейтральной средой вводили 0,9% физиологический раствор для инъекций также в дозе 10 мл/кг внутривенно трижды через 1, 3,5 и 6 часов после инфицирования.
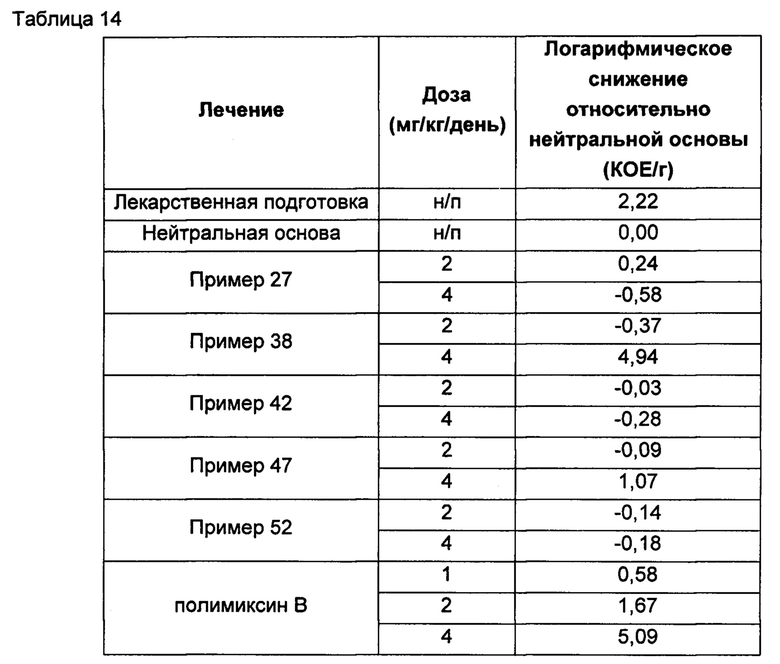
Дозы в таблицах указаны в мг сульфатной соли/кг.
Пример 27, Пример 42 и Пример 52 в количестве 2 или 4 мг/кг/день не обеспечивала значительного снижения нагрузок инфекции бедра. Пример 38, Пример 47 не оказывали значительного влияния на нагрузки инфекции бедра при введении в дозе 2 мг/кг/день, но снижали нагрузки на 4,9 и 1,1 Log10 КОЕ/г, соответственно, в дозе 4 мг/кг/день.
Дополнительное исследование эффективности in vivo, в котором сравнивали две дозы с использованием Примера 28, Примера 39 и A3, и полимиксина В при трех уровнях дозы, проводили на 9-часовой модели нагрузки бедра при инфекции бедра, вызванной P. aeruginosa АТСС 27853, у самцов мышей ICR с нейтропенией, с использование протокола, описанного для Примеров 37 и 41. Результаты приведены в Таблице 15.

Дозы в таблицах указаны в мг сульфатной соли/кг.
Исследование эффективности in vivo, в котором сравнивали А33 в дозе 1,7 мг/кг/день и 3,4 мг/кг/день эквивалентного свободного основания с полимиксин сульфатом в дозе 0,85, 1,7 и 3,4 мг/кг/день эквивалентного свободного основания проводили на 9-часовой модели нагрузки бедра при инфекции бедра, вызванной P. aeruginosa АТСС 27853. Использовали протокол, описанный для Примеров 37 и 41, за тем 10 исключением, что для инфицирования использовали уровни ~1×104 КОЕ/бедро мыши. Результаты приведены в Таблице 16.

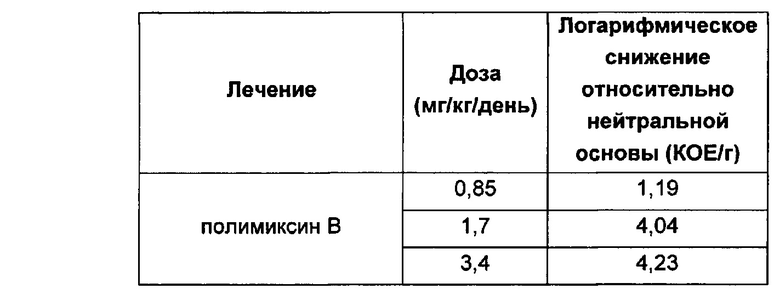
Доза в приведенной выше таблице к эквивалентному соединению в виде свободного основания.
Пример А33 давала логарифмическое снижение количества бактерий >3 по отношению к контролю без лечения, при обоих уровнях дозы.
Влияние гидроксильной группы в качестве заместителей на токсичность в отношении клеток HK-2
Соединения-примеры сравнивали с примером сравнения - соединением С6, для демонстрации преимуществ функциональных гидроксильной и амино-групп в снижении токсичности в отношении HK-2. Соединения-примеры 1, 13 и А33 обладали значительно повышенными определенными значениями IC50 в отношении HK-2 по сравнению с РМВ. Хотя соединение сравнения С6 обладает более низкой токсичностью в отношении HK-2, чем РМВ, это снижение не является таким значительным, как определенное для соединений 1, 13 и А33.
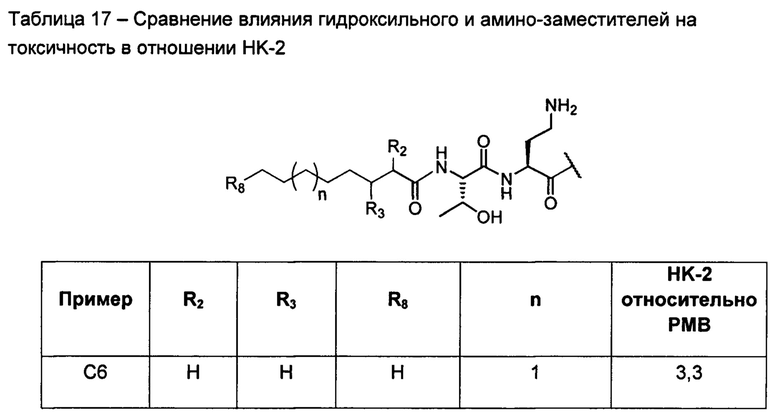
Дополнительная активность в комбинации
Дальнейшие тесты на MIC проводили с соединениями-примерами 40 и 41 в присутствии рифампицина против панели штаммов с повышенной репрезентативностью по резистентности к колистину или полимиксину В. Значения MIC определяли со стандартом исследования чувствительности CLSI, в сбалансированной по катионам жидкой среде Мюллера-Хинтона II (Becton Dickinson). Данные представлены в Таблице 18.
Значения MIC (мкг/мл) приведены в виде общей концентрации лекарственного средства для комбинации 1:1 (масс:масс) соединения-примера с рифампицином. Например, лунка с 2 мкг/мл содержит 1 мкг/мл исследуемого соединения и 1 мкг/мл рифампицина.
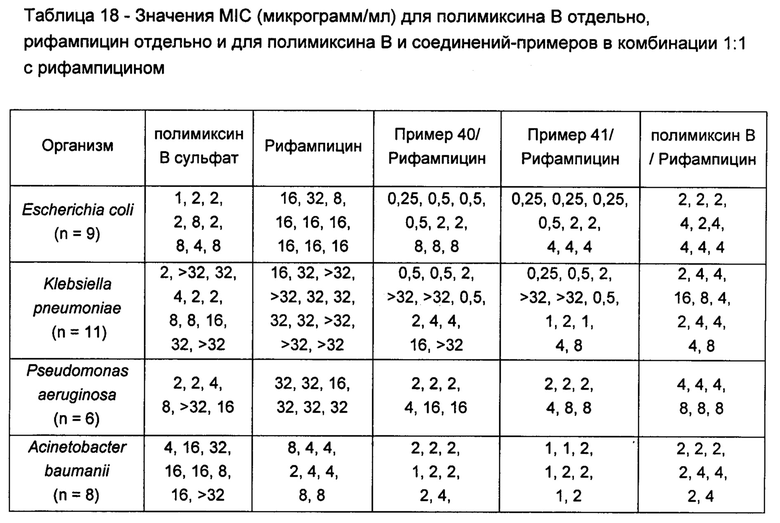
где n соответствует числу штаммов в панели для конкретного организма.
В комбинации с рифампицином соединения-примеры обладают улучшенной по сравнению с полимиксином В активностью в отношении штаммов Е. coli, P. aeruginosa, K. pneumoniae и A. baumannii. Панель организмов включала резистентные штаммы.
Цитируемые источники
Все документы, упоминаемые в данном описании, полностью включены в него посредством ссылки
de Visser et al, J. Peptide Res, 61, 2003, 298-306
Diaz et al. Syn Сомм, 2008, 38, 2799
GCC 2012/22819
Handbook of Pharmaceutical Excipients, 5th edition, 2005
Katsuma et al. Chem. Pharm. Bull. 2009; 57, 332-336
Magee at al, J. Med. Chem., 2013, 56, 5079
PCT/GB2012/052844
Petrosillo et al. Clin. Microbiol. Infect. 2008; 14, 816-827
Quale et al. Microb. Drug Resist. 2012; 18, 132-136
Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Company, Easton, Pa., 1990
Sato et al. Chem. Pharm. Bull. 2011; 59, 597-602
TW 101142961
US 5,565,423
US 8,415,307
Vaara et al, Antimicrob. Agents и Chemotherapy, 52, 2008. 3229-3236
Vaara et al. Microbiol. Rev. 1992; 56, 395-411
WO 1988/00950
WO 2008/017734
WO 2010/075416
WO 2012/168820
Yamada et al, J. Peptide Res. 64, 2004, 43-50
Yousef et al., Antimicrob. Agents Chemother. 2011, 55, 4044-4049
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПОЛИМИКСИНА С КОРОТКОЦЕПОЧЕЧНЫМ ЖИРНОКИСЛОТНЫМ ХВОСТОМ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2492179C2 |
| ПРОИЗВОДНЫЕ ПОЛИМИКСИНА И ИХ ПРИМЕНЕНИЕ В КОМБИНИРОВАННОЙ ТЕРАПИИ СОВМЕСТНО С РАЗЛИЧНЫМИ АНТИБИОТИКАМИ | 2015 |
|
RU2740190C2 |
| СПОСОБ ПОЛУЧЕНИЯ МАКРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ | 2006 |
|
RU2456296C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ МОДУЛИРОВАНИЯ КИНАЗЫ И ПОКАЗАНИЯ К ИХ ПРИМЕНЕНИЮ | 2013 |
|
RU2666146C2 |
| ПРОИЗВОДНОЕ ПИРАЗОЛО-ГЕТЕРОАРИЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2748833C2 |
| ДИАГНОСТИКА, ПРОФИЛАКТИКА И ЛЕЧЕНИЕ БОЛЕЗНЕЙ СУСТАВОВ | 2013 |
|
RU2682676C2 |
| КОМБИНАЦИИ АКТИВАТОРА (АКТИВАТОРОВ) РЕЦЕПТОРА, АКТИВИРУЕМОГО ПРОЛИФЕРАТОРОМ ПЕРОКСИСОМ (РАПП), И ИНГИБИТОРА (ИНГИБИТОРОВ) ВСАСЫВАНИЯ СТЕРИНА И ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ СОСУДОВ | 2008 |
|
RU2483724C2 |
| ПРОЛЕКАРСТВА PTH | 2017 |
|
RU2747316C2 |
| КАТАЛИТИЧЕСКАЯ СИСТЕМА | 2003 |
|
RU2326123C2 |
| ПЕПТИДНЫЕ АНТИБИОТИКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2428429C2 |
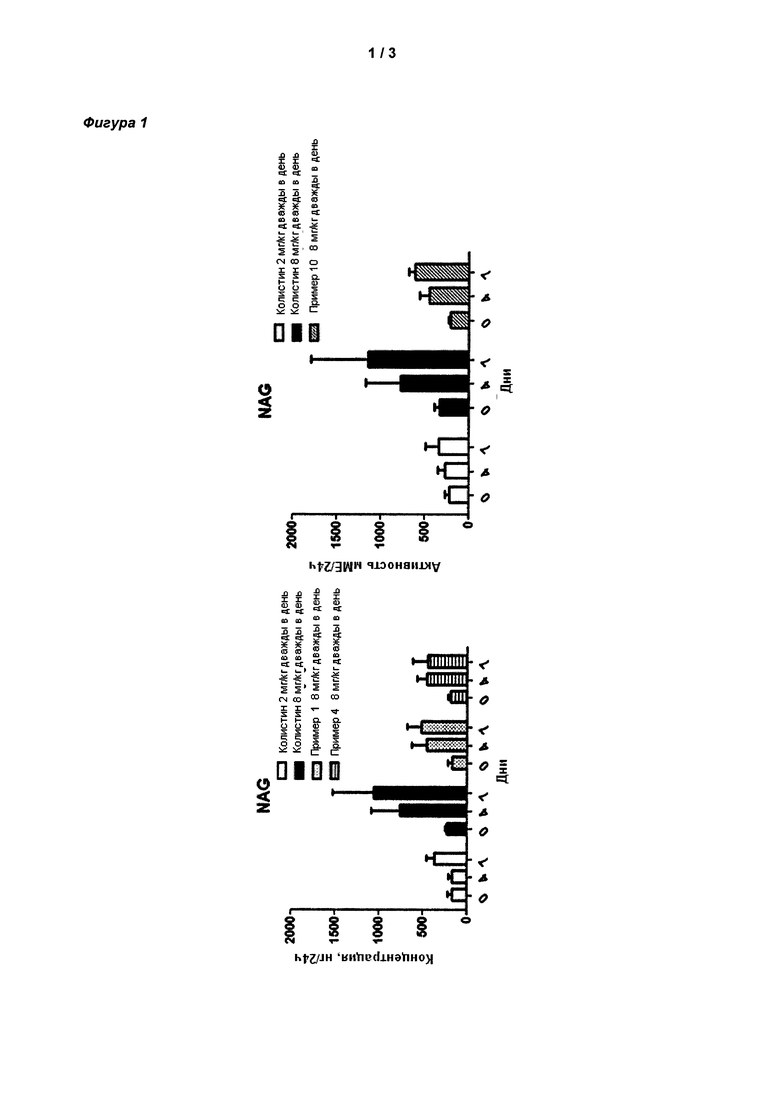
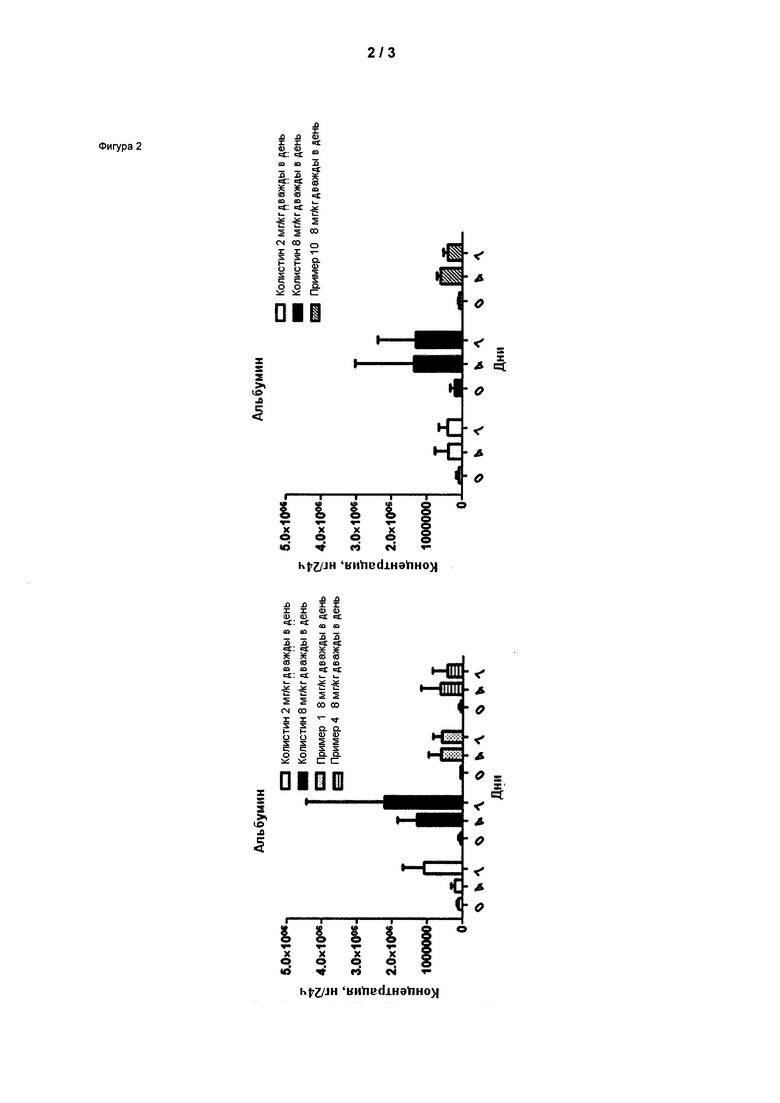
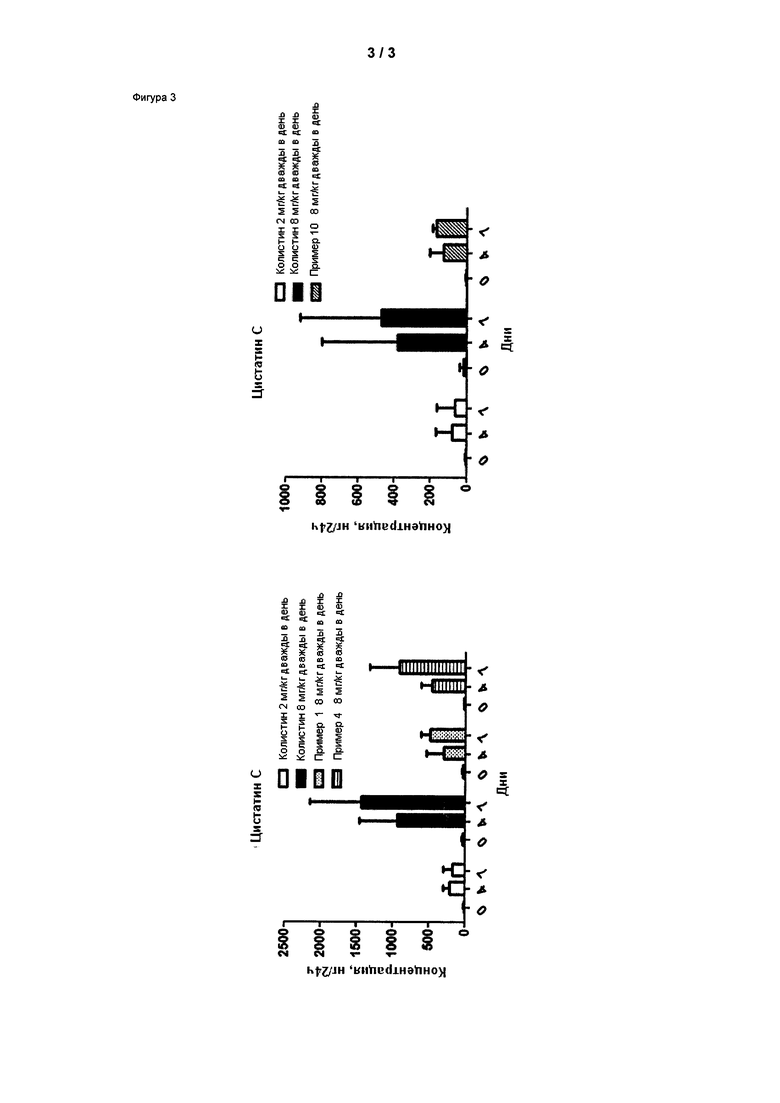
Изобретение относится к производным полимиксина формулы (I), где группы -А-, -R1, -R2, -R3, -R4, -R5, -R6, -R7, -R8 и -Х- указаны в формуле изобретения, которые предназначены для лечения бактериальной инфекции. 2 н. и 14 з.п. ф-лы, 3 ил., 18 табл., 50 пр.
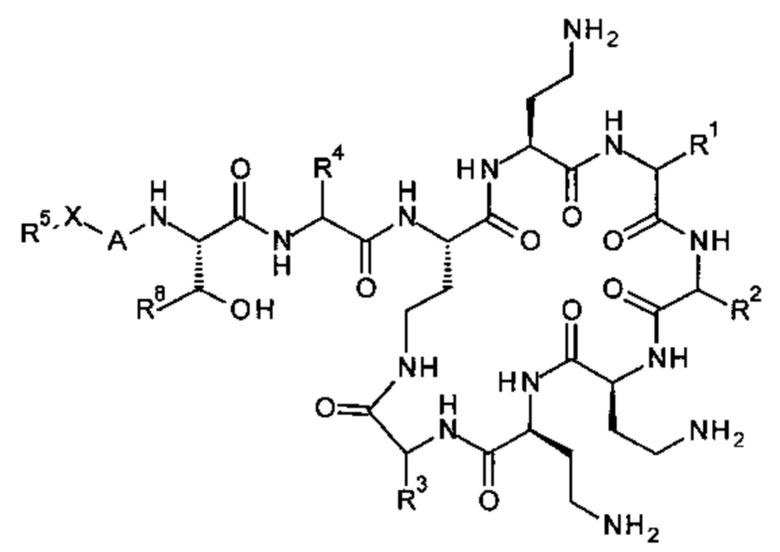
1. Полимиксин формулы (II), представленный формулой:
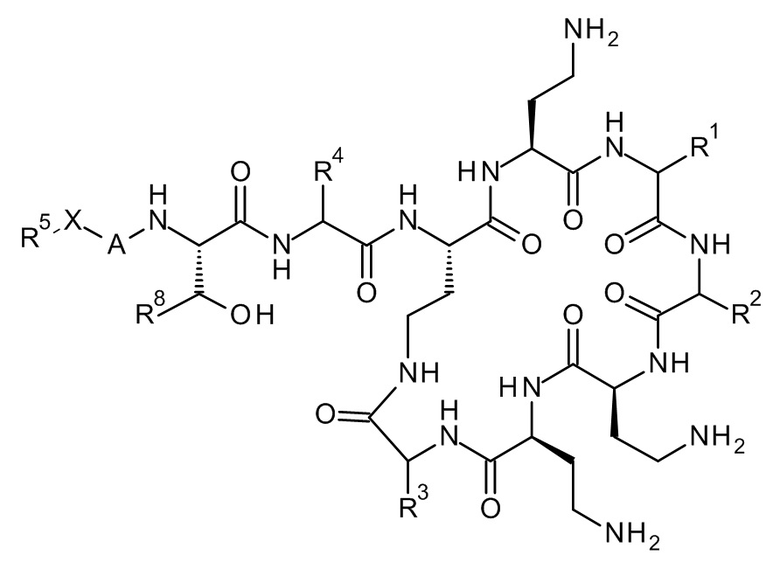
и его фармацевтически приемлемые соли,
где -X-, -R1, -R2, -R3, -R4, -R6, -R7, -R8 являются такими, как определено ниже:
-X- представляет собой -C(O)-, -NHC(O)-, -OC(O)-, -CH2- или -SO2-; и
-R1 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток фенилаланина, лейцина или валина;
-R2 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток лейцина, треонина, изолейцина, фенилаланина, валина или норвалина;
-R3 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток треонина или лейцина;
-R4 представляет собой C1-6 алкил, содержащий в качестве заместителя одну гидроксильную группу или одну аминогруппу;
-R8 представляет собой метил или водород,
каждый -R6 независимо представляет собой водород или C1-4 алкил;
каждый -R7 независимо представляет собой водород или C1-4 алкил;
или
если -G представляет собой C3-10 циклоалкил или C5-12 арил, -R6 и -R7 вместе с атомом азота образуют C4-10 гетероцикл; и
-A- представляет собой ковалентную связь или аминокислоту, такую как α-аминокислота;
и соединение выбрано из (IIа) или (IIg), указанных ниже:
(IIg) представляет собой соединение формулы (II), где:
-R4 представляет собой C1 алкил, замещенный одной аминогруппой, или C3-5 алкил, замещенный одной аминогруппой; и
-R5 представляет собой G-L2-L1-,
-G выбран из:
C5-12 арила при условии, что, когда -А- представляет собой аминокислоту, указанная аминокислота не является L-Dab;
C2-12 алкила,
C3-10 циклоалкила,
-L1- представляет собой ковалентную связь, C1-12 алкилен или линейный C2-12 гетероалкилен,
-L2- представляет собой ковалентную связь или C4-10 гетероциклилен
при условии, что -L1- не является C1-12 алкиленом, если -G представляет собой C2-12 алкил,
и G-L2-L1- содержит в качестве заместителей:
(i) одну гидроксильную группу, или
(ii) одну группу -NR6R7, или
(iii) одну группу -NR6R7 и одну гидроксильную группу
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае когда -L1- представляет собой азотосодержащий линейный C2-12 гетероалкилен и/или -L2- представляет собой азотосодержащий C4-10 гетероциклилен,
или -R5 представляет собой D-L1-, где
-D представляет собой C4-10 гетероциклил и
-L1- представляет собой ковалентную связь, C1-12 алкилен или C2-12 гетероалкилен, и
D-L1- содержит в качестве заместителей:
(i) одну гидроксильную группу, или
(ii) одну группу -NR6R7, или
(iii) одну группу -NR6R7 и одну гидроксильную группу
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае когда -L1- представляет собой азотосодержащий C2-12 гетероалкилен и/или -D представляет собой азотосодержащий C4-10 гетероциклил, и
(IIa) представляет собой соединение формулы (II), где:
-R5 представляет собой G-L2-L1-, где -G представляет собой C5-12 арил,
-L1- представляет собой ковалентную связь, C1-12 алкилен или линейный C2-12 гетероалкилен,
-L2- представляет собой ковалентную связь или C4-10 гетероциклилен,
-R5 содержит в качестве заместителей:
(i) одну гидроксильную группу, или
(ii) одну группу -NR6R7, или
(iii) одну группу -NR6R7 и одну гидроксильную группу
при условии, что (i), (ii) и (iii) являются необязательными заместителями, в случае когда -L1- представляет собой азотосодержащий линейный C2-12 гетероалкилен и/или -L2- представляет собой азотосодержащий C4-10 гетероциклилен,
при условии, что, когда -А- представляет собой аминокислоту, указанная аминокислота не является L-Dab;
и необязательно когда арильная, алкильная, циклоалкильная или гетероциклильная группа присутствует в -R5, она независимо необязательно замещена одним или более заместителем, выбранным из C1-10 алкила, такого как -C1-4 алкил, галогена, -CF3, -C(O)R10, -NR10C(O)R10, -CON(R10)2, -OCOR10, -OR9, -NR10SO2R10 и -SO2N(R10)2, причем каждый -R9 независимо представляет собой C1-10 алкил, такой как -C1-4 алкил, и каждый -R10 независимо представляет собой -H или C1-10 алкил, такой как -C1-4 алкил, за исключением того, что алкил не является замещенным алкилом.
2. Соединение по п. 1, отличающееся тем, что
-X- представляет собой -C(O)-, -NHC(O)-, -CH2- или -SO2-;
-R1 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток фенилаланина или лейцина;
-R2 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток лейцина или треонина;
-R3 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток треонина;
-R4 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой α,γ-диаминомасляную кислоту (Dab), остаток серина, остаток треонина, остаток лизина, остаток орнитина или α,β-диаминопропионовую кислоту (Dap);
-R8 представляет собой метил,
-A- представляет собой ковалентную связь.
3. Соединение по п. 1 или 2, отличающееся тем, что
-X- представляет собой -C(O)-; и
-R1 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток D-фенилаланина или D-лейцина;
-R2 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток L-лейцина или L-треонина;
-R3 вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой остаток L-треонина.
4. Соединение по любому из пп. 1-3, отличающееся тем, что указанное соединение представляет собой соединение формулы (IIg).
5. Соединение по п. 4, отличающееся тем, что -R4, вместе с карбонильной группой и азотом в альфа-положении по отношению к атому углерода, к которому он присоединен, представляет собой Dap, например L-Dap.
6. Соединение по п. 4 или 5, отличающееся тем, что -R5 представляет собой G-L2-L1-, и G- представляет собой C2-12 алкил.
7. Соединение по любому из пп. 1-3, отличающееся тем, что указанное соединение представляет собой соединение формулы (IIa).
8. Соединение по п. 7, отличающееся тем, что -L1- представляет собой C1-12 алкилен или линейный C2-12 гетероалкилен.
9. Соединение по п. 8, отличающееся тем, что -L1- представляет собой C1-12 алкилен, например -L1- представляет собой C3-12 алкилен, такой как L1- представляет собой C3-6 алкилен.
10. Соединение по любому из пп. 1-9, отличающееся тем, что -G представляет собой C5-12 арил и C5-12 арил необязательно замещен одним или более заместителями, выбранными из C1-10 алкила и галогена.
11. Соединение по п. 10, отличающееся тем, что C5-12 арил замещен одним или более заместителями, выбранными из C1-4 алкила, -F, -Cl и -Br.
12. Соединение по любому из пп. 7-11, отличающееся тем, что -G представляет собой фенил.
13. Соединение по любому из предшествующих пунктов, отличающееся тем, что -R5 замещен одной группой -NR6R7.
14. Соединение по п. 13, отличающееся тем, что -R5 замещен одной группой -NR6R7, где группа -NR6R7 выступает в качестве заместителя для -L1-.
15. Фармацевтическая композиция для лечения бактериальной инфекции, содержащая терапевтически эффективное количество соединения по любому из пп. 1-14 и биологически приемлемое вспомогательное вещество.
16. Соединение по любому из пп. 1-14 или фармацевтическая композиция по п. 15 для применения в способе лечения или профилактики бактериальной инфекции.
| WO 2012168820 A1, 13.12.2012 | |||
| WO 2008017734 A1, 14.02.2008 | |||
| WO 2009098357 A1, 08.2009 | |||
| Сигнальное приспособление при вращательном бурении | 1930 |
|
SU24792A1 |
| K OKIMURA ET AL., "Antimicrobial acttivity of various aminocyclohexylcarbonyl-polymyxin B (2-10) derivatives", PEPTIDE SCIENCE, PROTEIN RESEARCH FOUNDATION, MINOO, 2008, vol | |||
| Железобетонный фасонный камень для кладки стен | 1920 |
|
SU45A1 |
Авторы
Даты
2020-08-14—Публикация
2014-05-21—Подача