Для данной заявки на международный патент испрашивается приоритет заявки на Европейский патент 13002268.4, поданной 29 апреля 2014, включенной путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к антителам, фармацевтическим композициям и способам лечения и/или диагностики злокачественных новообразований, содержащих опухолевые стволовые клетки (ОСК).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Опухолевые стволовые клетки
Успехи последних десятилетий в области медицинских исследований позволили значительно улучшить существующие подходы к лечению злокачественных новообразований. Помимо того, что непрерывно ведутся научные исследования и усовершенствуются традиционные терапевтические подходы, включающие химиотерапию, лучевую терапию, гормональную терапию и хирургическое вмешательство, были разработаны новые подходы к лечению злокачественных новообразований, именуемые «таргетной противоопухолевой терапией», показавшие свою эффективность и вызвавшие интерес в мире медицины. Такая таргетная терапия включает моноклональные антитела, направленные против опухолевых антигенов, такие как трастузумаб (анти-Her2Neu), ритуксимаб (анти-CD20) или бевацизумаб (анти-VEGF), а также ингибиторы тирозин-киназы (например, иматиниб, эрлотиниб, гефитиниб), ингибиторы CDK и т.д. По сравнению с более традиционным подходами к лечению злокачественных новообразований, такие новые подходы позволили значительно улучшить жизнь пациентов за счет увеличения выживаемости и уменьшения побочных эффектов. Однако, возможности такого таргетного терапевтического подхода зачастую ограничены, в особенности из-за резистентности к указанной терапии, а также по той причине, что специфичная таргетная терапия не эффективна при всех видах злокачественных новообразований и у всех пациентов. Следствием резистентности является неэффективность лечения, развитие метастазов, рецидивы и повторные проявления заболевания.
Исследования показали, что причиной резистентности может быть присутствие опухолевых стволовых клеток, небольшой субпопуляции опухолевых клеток, способных к самообновлению и дифференцировке, играющих ключевую роль в рецидивировании и повторном проявлении злокачественных новообразований и развитии метастазов. Эти опухолевые стволовые клетки демонстрируют относительную резистентность к противоопухолевой терапии, в том числе к лучевой терапии и химиотерапии. Кроме того, для возникновения новой опухоли и, следовательно, метастазов, достаточно только небольшого количества этих опухолевых стволовых клеток. Следовательно, использование этих опухолевых стволовых клеток в качестве мишени может повысить эффективность существующих подходов к лечению злокачественных новообразований.
Опухолевые стволовые клетки и связанные с ними механизмы были предметом многочисленных исследований. Разработаны способы идентификации таких опухолевых стволовых клеток и обнаружено несколько новых маркеров ОСК. К сожалению, до сих пор не удалось найти маркер ОСК, который можно бы было применять при многих типах опухолей. Примеры используемых в настоящее время маркеров ОСК включают ALDH, CD133, CD44, CD24, CD166. При различных типах злокачественных новообразований ОСК имеют различные фенотипы. В частности, CD133, широко используемый в настоящее время в качестве маркера опухолевых стволовых клеток, оказался хорошим маркером ОСК при глиоме.
На сегодняшний день фенотип CD133+ связывают с опухолевыми стволовыми клетками при глиоме, фенотип CD44+CD24-/low связывают с опухолевыми стволовыми клетками при раке молочной железы; фенотип CD34+ связывают с опухолевыми стволовыми клетками при лейкозе, в частности, фенотип CD34+/CD38 связывают с опухолевыми стволовыми клетками при миелоидном лейкозе, а фенотип CD34+/CD19+ связывают с опухолевыми стволовыми клетками при лимфоидном лейкозе.
К сожалению, большинство известных маркеров ОСК также экспрессируются и некоторыми нормальными тканями. Поэтому большой интерес представляет выявление специфических опухолевых маркеров, которые можно использовать в качестве диагностических и терапевтических маркеров ОСК: их можно использовать для диагностики и для лечения злокачественных новообразований, содержащих опухолевые стволовые клетки, обозначаемых в данном документе злокачественными новообразованиями, содержащими ОСК, при отсутствии серьезных побочных эффектов, связанных с токсичностью в отношении здоровых клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения показали, что опухоли нейроэктодермального происхождения специфически экспрессируют О-ацетилированный GD2-ганглиозид, и что введение терапевтически активных антител, направленых против О-ацетилированного GD2-ганглиозида, оказывает благоприятное действие при отсутствии нейротоксичности, в особенности благодаря отсутствию экспрессии данного опухолевого антигена на здоровых клетках, в частности, на клетках периферических нервов.
Авторы изобретения неожиданно обнаружили, что экспрессия О-ацетилированного GD2-ганглиозида повышена на опухолевых стволовых клетках и может служить мишенью при терапии злокачественных новообразований, содержащих ОСК.
Так, для использования О-ацетилированного GD2-ганглиозида в качестве мишени при лечении злокачественных новообразований, содержащих ОСК, авторы изобретения предложили использовать антитело 8В6 (и его производные), специфическое в отношении О-ацетилированного GD2-ганглиозида.
В своих исследованиях они показали, что данному антителу присуща выраженная цитотоксическая активность в отношении опухолевых клеток, и помимо помимо иммунно-опосредованных механизмов, включая CDC и ADCC, оно в том числе оказывает на опухолевые стволовые клетки прямое цитотоксическое действие, вызывая апоптоз или другие варианты клеточной гибели.
Таким образом, данное изобретение относится к антителу, распознающему О-ацетилированный GD2-ганглиозид, или к его функциональному фрагменту, для лечения злокачественных новообразований, содержащих опухолевые стволовые клетки (ОСК), указанное антитело содержит:
a) Легкую цепь, по меньшей мере содержащую каркасный участок, вариабельного домена легкой цепи иммуноглобулина и три участка, определяющих комплементарность, характеризующихся последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3 и/или
b) Тяжелую цепь, по меньшей мере содержащую каркасный участок вариабельного домена тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность, характеризующихся последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3.
Изобретение также относится к фармацевтической композиции для лечения злокачественных новообразований, содержащих ОСК, указанная фармацевтическая композиция содержит антитело по изобретению.
Данное изобретение также относится к способу диагностики злокачественных новообразований, содержащих ОСК, у индивидуума, при этом указанный способ включает определение экспрессии О-ацетилированного GD2-ганглиозида, при этом экспрессия О-ацетилированного GD2-ганглиозида указывает на наличие злокачественных новообразований, содержащих ОСК.
Изобретение также относится к применению О-ацетилированного GD2 ганглиозида в качестве биомаркера злокачественных новообразований, содержащих ОСК.
Наконец, изобретение относится к способу прогнозирования ответа индивидуума, имеющего злокачественные новообразования, содержащие ОСК, на лечение антителом или композицией по изобретению, при этом указанный способ включает определение присутствия клеток, экспрессирующих О-ацетилированный GD2 ганглиозид в биологическом образце указанного индивидуума.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Репрезентативные фотографии срезов опухоли глиобластомы, окрашенных контрольным IgG3 антителом, служившим отрицательным контролем (A); срезы опухоли нейробластомы, окрашенные моноклональным антителом 8В6 (B). Образцы опухоли глиобластомы, которые оценивали на 1+ (С), 2+ (D), 3+ (Е) и 4+ (F), в зависимости от интенсивности специфической окраски моноклональным антителом 8В6.
Фиг. 2. O-Ac-GD2 позволяет обнаружить стволовые клетки с фенотипом CD133+ среди опухолевых клеток глиобластомы человека. UL, верхний левый квадрант, O-Ac-GD2+ клетки глиобластомы человека U87MG; UR, верхний правый квадрант, CD133+ O-Ac-GD2+ клетки глиобластомы человека U87MG; LL, нижний левый квадрант, CD133- O-Ac-GD2- клетки глиобластомы человека U87MG; LR, нижний правый квадрант, CD133+ клетки глиобластомы человека U87MG.
Фиг. 3. Фазово-контрастная микроскопия клеток глиобластомы человека U87MG, инкубировавшихся с контрольным антителом или моноклональным антителом 8В6 в концентрации 50 мкг/мл
После инкубации в течение 24 ч проводили фазово-контрастную микроскопию (увеличение ×200) для выявления апоптотических клеток по морфологическим изменениям. Стрелки указывают на апоптотические клетки.
Фиг. 4. Моноклональное антитело к O-Ac-GD2 ингибирует рост опухолевых клеток глиобластомы человека у мышей.
Фиг. 5. Цитотоксичность антител к GD2 и к O-Ac-GD2 в отношении клеток опухоли молочной железы. Прямую цитотоксичность оценивали с помощью теста МТТ при увеличении концентраций мышиных антител к GD2 (10В8) и к O-Ac-GD2 (8В6).
Фиг. 6. Экспрессия O-Ac-GD2 в опухолевых стволовых клетках при мелкоклеточном раке легкого. Профили экспрессии оценивали при помощи проточной цитометрии, используя клеточную линию Н196 опухолевых стволовых клеток, экспрессирующих CD133, при одновременном окрашивании O-Ac-GD2 (8В6) или GD2 (10B8).
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Терапевтические подходы согласно изобретению
Первым объектом изобретения является антитело, распознающее О-ацетилированный GD2-ганглиозид, или его функциональный фрагмент, для лечения опухолей, содержащих опухолевые стволовые клетки, указанное антитело содержит:
a) Легкую цепь, по меньшей мере содержащую каркасный участок вариабельного домена легкой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR, от англ. complementary determining regions), характеризующихся последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3 и/или
b) Тяжелую цепь, по меньшей мере содержащую каркасный участок вариабельного домена тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), характеризующихся последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3.

Указанные CDR обозначены в соответствии с номенклатурой IMGT, хорошо известной в области техники (The International Immunogenetics Information System®, LEFRANC et al., Nucleic Acids Research, vol. 27, p: 209-212, 1999).
Термин «антитело» используют в его обычном значении, для обозначения молекулы иммуноглобулина, соответствующей тетрамеру, содержащему четыре полипептидные цепи, две идентичные тяжелые (Н) цепи (полноразмерные цепи имеют молекулярную массу около 50-70 кДа) и две идентичные легкие (L) цепи (полноразмерные цепи имеют молекулярную массу около 25 кДа), соединенные между собой дисульфидными связями. Легкие цепи классифицируют как каппа и лямбда. Тяжелые цепи, которые классифицируют как гамма, мю, альфа, дельта и эпсилон, определяют изотип антитела, например, IgG, IgM, IgA, IgD и IgE, соответственно. Каждая тяжелая цепь содержит N-концевой вариабельный участок тяжелой цепи (сокращенно обозначаемый в данном документе HCVR, от англ. heavy chain variable region) и константный участок тяжелой цепи. Константный участок тяжелой цепи содержит три домена (СН1, СН2 и СН3) и шарнирный участок в случае IgG, IgD и IgA; или 4 домена (СН1, СН2, СН3 и СН4) в случае IgM и IgE. Каждая легкая цепь содержит N-концевой вариабельный участок легкой цепи (сокращенно обозначаемый в данном документе LCVR, от англ. light chain variable region) и константный участок легкой цепи. Константный участок тяжелой цепи содержит один домен, CL. Участки HCVR и LCVR далее подразделяются на гипервариабельные участки, обозначаемые участками, определяющими комплементарность (CDR), перемежающиеся с более консервативными участками, обозначаемыми каркасными участками (FR, от англ. framework regions). Каждый HCVR и LCVR содержит три CDR и четыре FR, расположенные в следующем порядке в направлении от амино-конца к карбокси-концу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Принадлежность аминокислот к каждому домену определяют в соответствии с известными правилами. Функциональная способность антител связываться с конкретным антигеном определяется вариабельными участками каждой пары легкая/тяжелая цепь и в большой степени определяется CDR.
В конкретном воплощении антитело по изобретению содержит:
a) Легкую цепь, содержащую каркасный участок легкой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), характеризующихся последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3 и/или
b) Тяжелую цепь, содержащую каркасный участок тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), характеризующихся последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3.
В более конкретном воплощении антитело по изобретению содержит вариабельный домен легкой цепи (LCVR), содержащий аминокислотную последовательность SEQ ID NO: 7 и вариабельный домен тяжелой цепи (HCVR), содержащий аминокислотную последовательность SEQ ID NO: 8. Указанное антитело представляет собой антитело 8В6.

Термин «антитело», используемый в данном документе, обозначает само моноклональное антитело. Моноклональное антитело может представлять собой человеческое антитело, химерное антитело и/или гуманизированное антитело.
Термин «функциональный фрагмент», используемый в данном документе, обозначает фрагмент антитела, способный распознавать О-ацетилированный GD2 ганглиозид. Указанные фрагменты могут быть идентифицированы или получены специалистом и включают, например, Fab фрагмент (который можно получить расщеплением папаином), Fab' фрагмент (который можно получить расщеплением пепсином и частичным восстановлением), F(ab')2 фрагмент (который можно получить расщеплением пепсином, частичным восстановлением и повторной агрегацией), а также scFv фрагмент (одноцепочечный Fv, полученный с использованием методов молекулярной биологии), диатела и монотела.
Термин «диатела» обозначает небольшие фрагменты антител, содержащие два антиген-связывающих сайта, указанные фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в составе одной полипептидной цепи (VH-VL). Предпочтительно, домены принудительно спаривают с комплементарными доменами другой цепи при помощи линкера, длина которого недостаточна для спаривания двух доменов одной и той же цепи, и создают два антиген-связывающих сайта.
Термин «монотела», используемый в данном документе, обозначает антиген-связывающие молекулы, содержащие вариабельный домен тяжелой цепи и не содержащие вариабельного домена легкой цепи. Монотело может связываться с антигеном в отсутствие легкой цепи и обычно имеет три CDR участка, обозначаемые CDRH1, CDRH2 и CDRH3. Монотела включают «верблюжьи монотела», такие как фрагменты VHH, полученные из организма животного семейства верблюдовых, включающего животных с двупалыми ступнями и кожистыми подошвами. Семейство верблюдовых объединяет верблюдов, лам и альпак. При исследовании сыворотки верблюдов (Camelus dromedaries и Camelus bactrianus) было обнаружено, что у них часто отсутствуют вариабельные домены легких цепей, что позволяет предположить, что для получения антител с достаточной специфичностью и аффинностью достаточно VH доменов (три CDR петли). Монотела также включают модифицированные VH из различных организмов животных, в частности, млекопитающих (например, мыши, крысы, кролика, лошади, осла, быка или человека), которые способны связываться с антигеном в отсутствие VL. Предпочтительно, VH модифицируют в позициях, находящихся на границе с VL, для связывания VH с антигеном в отсутствие VL. Специалист в данной области техники может оптимизировать VH человека путем замещения некоторых важных остатков, имитируя тяжелые цепи антитела верблюда, лишенные «партнеров» в виде легких цепей (произвести «оверблюживание»). Это позволяет получить функциональные фрагменты антител, стабильность и уровень экспрессии которых сравнимы с VHH верблюдовых, при этом сохранив способность фрагментов антител к распознаванию, в том числе высокую аффинность и высокую специфичность, и понизив иммуногенность.
Такие фрагменты можно получить путем ферментативного расщепления, синтеза, рекомбинантных методов, известных в области техники и/или описанных в данном документе. Антитела также можно получать в различных укороченных формах, используя гены антител, в которые введены один или несколько стоп-кодонов, предшествующих естественному сайту терминации трансляции. Например, можно создать комбинированный ген, кодирующий часть тяжелой цепи F(ab')2, включающий последовательность ДНК, кодирующую домен CH1 и/или шарнирный участок тяжелой цепи. Различные части антител можно объединять, используя стандартные химические методы, или получать в виде единого белка, используя методы генной инженерии.
В одном частном воплощении изобретение относится к функциональному фрагменту антитела по изобретению, когда указанный фрагмент выбран из группы, содержащей или состоящей из Fab, Fab', F(ab')2, Facb, Fd, scFv, диател и монотел, включая фрагменты VHH и фрагменты VH человеческого происхождения.
Согласно изобретению, указанные функциональные фрагменты способны распознавать О-ацетилированный GD2 ганглиозид.
Предпочтительно, функциональный фрагмент антитела по изобретению сохраняет активность, в частности, цитотоксическую активность, аналогичную антителу по изобретению.
Выражение «распознавать О-ацетилированный GD2 ганглиозид» означает, что антитело по изобретению способно связывать О-ацетилированный GD2 ганглиозид с аффинностью менее чем 10-7 М, предпочтительно менее чем 5×10-8 М и более предпочтительно, менее чем 10-8 М.
Предпочтительно, но не обязательно, антитела, используемые в изобретении, получают рекомбинантными способами, поскольку для гуманизации обычных мышиных или других антител, не являющимися человеческими, имеющих необходимую специфичность, требуются определенные манипуляции. Антитела могут быть гликозилированными или негликозилированными, однако предпочтительны гликозилированные антитела. Как известно, антитела имеют поперечные сшивки в виде дисульфидных связей.
Как хорошо известно в области техники, моноклональные антитела с соответствующей специфичностью можно легко получить при помощи стандартных методов иммунизации животных, вырабатывающих антитела. Затем можно провести манипуляции с данными нуклеотидными последовательностями для получения их гуманизированной формы.
Под «химерным антителом» понимают антитело, состоящее из вариабельных областей мышиного иммуноглобулина и константных областей человеческого иммуноглобулина. Такая замена представляет собой замещение константной области человеческого антитела мышиной константной областью с получением человеческого/мышиного химерного белка, обладающего достаточно низкой иммуногенностью для возможного фармацевтического применения.
Предложен ряд способов получения таких химерных антител, известных специалисту в данной области (см., например, патент США US 5,225,539).
Под «гуманизированным антителом» понимают антитело, частично или полностью состоящее из аминокислотных последовательностей, полученных на основе зародышевой последовательности антитела человека и измененной последовательности антитела, имеющего участки, определяющие комплементарность (CDR), отличные от человеческих. Такую гуманизацию вариабельного участка антитела и, следовательно, CDR осуществляют способами, хорошо известными в области техники.
Например, в заявке на патент GB 2188638А и в патенте US 5,585,089 описан способ получения рекомбинантных антител, у которых единственными замещенными частями антитела являются участки, определяющие комплементарность, или "CDR". Методику пересаживания CDR применяют для создания антител, состоящих из мышиных CDR и каркасных участков вариабельных областей и константных областей человеческих антител (см., например, Riechmann et al., Nature, vol. 332, с. 323-327, 1988). Такие антитела сохраняют константные области человеческого происхождения, необходимые для осуществления Fc-опосредованной эффекторной функции, но с гораздо меньшей вероятностью вызывают иммунный ответ против антитела.
Например, каркасные участки вариабельных областей замещают соответствующими каркасными участками человеческого происхождения, оставляя по существу интактными CDR, не являющиеся человеческими, или замещая CDR последовательностями, полученными на основе человеческих генов (см., например, заявку на патент US 2006/0258852). Полностью человеческие антитела способны вырабатывать генетически модифицированные мыши, чья иммунная система изменена таким образом, что соответствует иммунной системе человека. Как упоминалось выше, в способах по изобретению достаточно использовать иммунологически специфичный фрагмент антитела, включая фрагменты, представленные одноцепочечными формами.
Гуманизированное антитело обозначает антитело, содержащее человеческие каркасные участки, по меньшей мере один CDR антитела, не являющегося человеческим, в котором любой константный участок по существу идентичен константному участку иммуноглобулина человека, т.е. идентичен по меньшей мере на 85 или 90%, предпочтительно на 95%. Следовательно, все части гуманизированного антитела, возможно, за исключением CDR, по существу идентичны соответствующим частям одной или нескольких нативных последовательностей иммуноглобулинов человека. Например, к гуманизированным иммуноглобулинам обычно не относятся химерные антитела, содержащие мышиные вариабельные участки и человеческие константные участки.
При применении в терапии человека гуманизированные антитела имеют по меньшей мере три возможных преимущества по сравнению с антителами, не являющимися человеческими, и химерными антителами.
1) Поскольку эффекторная часть имеет человеческое происхождение, она может лучше взаимодействовать с другими компонентами иммунной системы человека (например, более эффективно разрушать клетки-мишени опосредованно через комплемент-зависимую цитотоксичность (CDC, от англ. complement-dependent cytotoxicity) или антитело-зависимую клеточную цитотоксичность (ADCC, от англ. antibody-dependent cellular cytotoxicity).
2) Иммунная система человека не должна распознавать каркасный участок или константную область гуманизированного антитела как чужеродные, и следовательно, гуморальный ответ на инъекцию антитела будет менее выраженным, чем на абсолютно чужеродное антитело, не являющееся человеческим, или на частично чужеродное химерное антитело.
3) Показано, что при введении антител, не являющихся человеческими, время их полужизни в сосудистом русле человека значительно меньше, чем время полужизни человеческих антител. Введенные гуманизированные антитела будут иметь время полужизни по существу идентичное с человеческими антителами естественного происхождения, что позволит уменьшить дозировку и сократить частоту введения.
Например, гуманизированные иммуноглобулины можно создавать следующим образом: Если аминокислота подпадает под следующую категорию, аминокислоту каркасной области иммуноглобулина человека, предназначенного для использования (иммуноглобулина-акцептора), замещают аминокислотой каркасной области иммуноглобулина, не являющегося человеческим, являющегося источником CDR (иммуноглобулина-донора): (а) аминокислота в составе каркасной области человеческого иммуноглобулина-акцептора нетипична для человеческого иммуноглобулина в указанной позиции, тогда как соответствующая аминокислота иммуноглобулина-донора типична для человеческого иммуноглобулина в указанной позиции; (б) аминокислота находится в позиции, непосредственно примыкающей к одному из CDR; или (в) любой атом боковой цепи аминокислоты каркасной области находится на расстоянии приблизительно 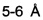 (от центра до центра) от любого атома аминокислоты CDR в трехмерной модели иммуноглобулина (QUEEN et al., Proc. Natl. Acad. Sci. USA, vol. 88, p: 2869, 1991). Если каждая аминокислота в составе каркасной области человеческого иммуноглобулина-акцептора и соответствующая аминокислота иммуноглобулина-донора нетипична для человеческого иммуноглобулина в указанной позиции, данную аминокислоту замещают аминокислотой, типичной для человеческого иммуноглобулина в указанной позиции.
(от центра до центра) от любого атома аминокислоты CDR в трехмерной модели иммуноглобулина (QUEEN et al., Proc. Natl. Acad. Sci. USA, vol. 88, p: 2869, 1991). Если каждая аминокислота в составе каркасной области человеческого иммуноглобулина-акцептора и соответствующая аминокислота иммуноглобулина-донора нетипична для человеческого иммуноглобулина в указанной позиции, данную аминокислоту замещают аминокислотой, типичной для человеческого иммуноглобулина в указанной позиции.
В конкретном воплощении антитело по изобретению представляет собой химерное антитело.
В предпочтительном воплощении указанное антитело представляет собой химерное антитело, а последовательности каркасных участков легкой и тяжелой цепей происходят из легкой и тяжелой цепей иммуноглобулина мыши, соответственно.
Предпочтительно, указанное химерное антитело дополнительно содержит константные области легкой и тяжелой цепей иммуноглобулина человека.
Согласно изобретению, химерное антитело по изобретению способно распознавать О-ацетилированный GD2 ганглиозид.
Предпочтительно, химерное антитело по изобретению сохраняет активность, в частности, цитотоксическую активность, аналогичную антителу по изобретению.
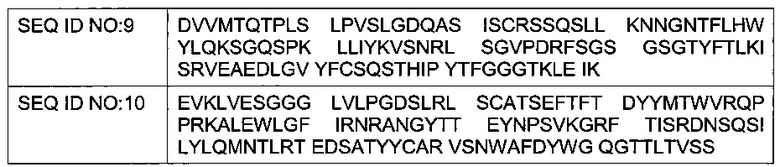
Предпочтительно, указанное антитело содержит вариабельный домен легкой цепи (LCVR), содержащий аминокислотную последовательность SEQ ID NO: 9.
Также предпочтительно, указанное антитело содержит вариабельный домен тяжелой цепи (HCVR), содержащий аминокислотную последовательность SEQ ID NO: 10.
В более предпочтительном воплощении указанное антитело содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 9, и вариабельный домен тяжелой цепи (HCVR), содержащий аминокислотную последовательность SEQ ID NO: 10.
В другом конкретном воплощении антитело по изобретению представляет собой гуманизированное антитело.
В следующем предпочтительном воплощении указанное антитело представляет собой гуманизированное антитело, а последовательности каркасных участков легкой и тяжелой цепей происходят из легкой и тяжелой цепей гуманизированного иммуноглобулина, соответственно.
Предпочтительно, гуманизированное антитело по изобретению дополнительно содержат константные области легкой и тяжелой цепей иммуноглобулина человека.
Согласно изобретению, гуманизированное антитело по изобретению способно распознавать О-ацетилированный GD2 ганглиозид.
Предпочтительно, гуманизированное антитело по изобретению сохраняет активность, в частности, цитотоксическую активность, аналогичную антителу по изобретению.
Гуманизированные антитела по данному изобретению могут иметь иные последовательности легкой и тяжелой цепей. Иммуноглобулины могут иметь две пары комплексов легкая/тяжелая цепь, по меньшей мере одна цепь содержит один или несколько определяющих комплементарность участков мышиного происхождения, функционально связанных с сегментами каркасных областей человеческого происхождения.
Антитела по изобретению включают иммуноконъюгаты.
В данном документе термин «иммуноконъюгат» обозначает молекулу конъюгата, содержащую по меньшей мере одно антитело или его функциональный фрагмент, связанные со второй молекулой, предпочтительно с цитотоксическим агентом или радиоактивным изотопом. Предпочтительно, указанное антитело или его функциональный фрагмент связано со второй молекулой при помощи ковалентной связи.
В одном воплощении антитело по изобретению представляет собой иммуноконъюгат.
В конкретном воплощении антитело по изобретению представляет собой иммуноконъюгат, при этом указанный иммуноконъюгат содержит антитело по изобретению или его функциональный фрагмент и цитотоксический агент.
В другом конкретном воплощении антитело по изобретению представляет собой иммуноконъюгат, при этом указанный иммуноконъюгат содержит антитело по изобретению или его функциональный фрагмент и радиоактивный изотоп.
Термин «злокачественные новообразования с опухолевыми стволовыми клетками», или «злокачественные новообразования, содержащие ОСК» обозначает злокачественные новообразования, в которых присутствуют определенные клетки, известные как опухолевые стволовые клетки.
В одном воплощении злокачественные новообразования, содержащие ОСК, содержат по меньшей мере 0,1% опухолевых стволовых клеток; предпочтительно, злокачественные новообразования, содержащие ОСК, содержат от 1% до 95% опухолевых стволовых клеток, наиболее предпочтительно, злокачественные новообразования, содержащие ОСК, содержат от 1% до 50% опухолевых стволовых клеток.
Термин «опухолевые стволовые клетки» используется в своем обычном значении в данной области техники и обозначает субпопуляцию опухолевых клеток (которые обнаруживаются как в солидных опухолях, так и при гемобластозах), обладающих характеристиками, присущими нормальным стволовым клеткам, в частности, способностью давать начало всем типам клеток, обнаруживаемым в образце конкретной опухоли. Они обладают способностью к самообновлению, дифференцировке в опухолевые клетки различных ростков и интенсивной пролиферации. Для того, чтобы давать начало новой опухоли достаточно лишь небольшого количества опухолевых стволовых клеток, и они склонны быть резистентными к стандартной терапии, включая химиотерапию и лучевую терапию.
Таким образом, направленно взаимодействуя с ОСК, антитело к O-Ac-GD2 позволяет предупреждать и/или лечить метастазы, появление которых вызвано данными ОСК.
Указанные опухолевые стволовые клетки можно выделить из опухолей, используя такие поверхностные маркеры как CD133, CD44, CD34, CD24, ALDH1; эти маркеры позволяют отличить опухолевые стволовые клетки от множества клеток опухоли. В настоящее время известно несколько способов специфического выделения опухолевых стволовых клеток in vitro, включая широко используемые подходы с применением специфических маркеров или с окрашиванием Hoechst, а также выделение, основанное на хеморезистентности, сортировка, основанная на различиях в инвазивности, а в случае клеток метастатического рака молочной железы - выделение, основанное на воздействии повторяющихся циклов гипоксии и реоксигенации.
Опухолевые стволовые клетки обнаружены при самых разных злокачественных новообразованиях, включая лейкоз, в том числе острый миелоидный лейкоз и острый лимфоидный лейкоз, рак молочной железы, глиому, в том числе глиобластому, колоректальный рак, рак поджелудочной железы, рак предстательной железы, рак легких, рак печени, рак мочевого пузыря или рак желудка, но не ограничиваясь ими.
Так, в одном воплощении изобретения злокачественные новообразования, содержащие ОСК, согласно изобретению выбраны из группы, содержащей или включающей лейкоз, в том числе острый миелоидный лейкоз и острый лимфоидный лейкоз, рак молочной железы, глиому, в том числе глиобластому, колоректальный рак, рак поджелудочной железы, рак предстательной железы, рак легких, рак печени, рак мочевого пузыря или рак желудка, но не ограничиваясь ими.
В предпочтительном воплощении указанные злокачественные новообразования, содержащие ОСК, представляют собой глиому, рак молочной железы, острый лимфоидный лейкоз или острый миелоидный лейкоз.
Идентифицировать опухолевые стволовые клетки среди множества клеток опухоли позволяют различные маркеры, эти маркеры варьируются в зависимости от типа злокачественного новообразования.
Примеры маркеров, которые можно применять для идентификации злокачественных новообразований, содержащих ОСК, включают CD34, CD38, CD19, интерлейкин-3-рецептор α (CD123), CD33, CD44, CD44v6, CD47, CD24, ЕрСАМ (ESA), Lin, CD133, A2B5, SSEA-1, CD166, CD26, CD200, α2β1, Sca, CD45, Pecam, ALDH, ALDH1, Oct4, ABCG2, CXCR4, AFP, EMA, IGF-IR, но не ограничиваются ими.
При этом отмечено, что для выявления злокачественных новообразований, содержащих ОСК, можно применять известные маркеры опухолевых стволовых клеток, однако они не подходят в качестве антигена-мишени для лечения указанного злокачественного новообразования, поскольку они почти всегда экспрессируются здоровыми тканями.
В Таблице 1 приведены некоторые примеры фенотипов опухолевых стволовых клеток.

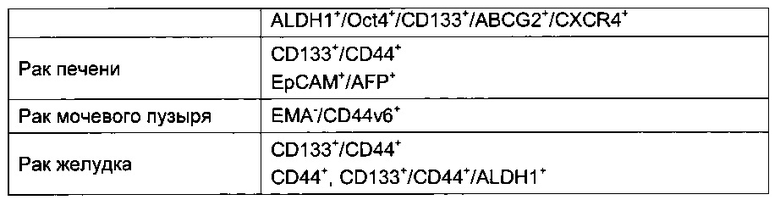
Так, в одном воплощении указанные злокачественные новообразования, содержащие ОСК, содержат клетки, имеющие по меньшей мере один фенотип, выбранный из группы, содержащей или состоящей из: CD34+/CD38-, CD34+/CD19-, CD34+/CD19+, CD34+/CD38+/CD19+, CD34+/CD38-/CD19+, CD133+/CD38-, CD133+/CD19-, интерлейкин-3-рецептор α+, CD33+, CD44+/CD24-/low, CD44+/CD24-/ESA+, CD44+/CD24low/-lin-/ALDH+, CD133+, A2B5+, SSEA-1+, CD133+/ESAhigh/CD44+, CD166+, CD26+, CD44+/CD133+/α2β1+, CD44+, Sca+/CD45-/Pecam-/CD34+, ALDH1+/Oct4+/CD133+/ABCG2+/CXCR4+, CD133+/CD44+, EpCAM+/AFP+, EMA-/CD44v6+, CD133+/CD44+/ALDH1+.
В одном воплощении изобретения злокачественные новообразования, содержащие ОСК, согласно изобретению содержат CD133+ клетки.
В другом воплощении злокачественные новообразования, содержащие ОСК, согласно изобретению содержат CD44+ клетки. В более конкретном воплощении злокачественные новообразования, содержащие ОСК, согласно изобретению содержат CD44+/CD24-/low клетки.
В следующем воплощении злокачественные новообразования, содержащие ОСК, согласно изобретению содержат CD34+ клетки.
В более конкретном воплощении злокачественные новообразования, содержащие ОСК, согласно по изобретению содержат CD34+/CD38- клетки.
В другом более конкретном воплощении злокачественные новообразования, содержащие ОСК, согласно изобретению содержат CD34+/CD19+ клетки, предпочтительно CD34+/CD38+/CD19+ или CD34+/CD38-/CD19+ клетки.
В предпочтительном воплощении изобретения злокачественное новообразование, содержащее ОСК, согласно изобретению характеризуется наличием субпопуляции опухолевых стволовых клеток, в которой по меньшей мере 10% опухолевых стволовых клеток экспрессируют на своей поверхности О-ацетилированный GD2 ганглиозид, предпочтительно по меньшей мере 30% опухолевых стволовых клеток, и наиболее предпочтительно по меньшей мере 50% опухолевых стволовых клеток экспрессируют на своей поверхности О-ацетилированный GD2 ганглиозид.
В конкретном воплощении изобретения указанное злокачественное новообразование, содержащее ОСК, представляет собой рак молочной железы.
В более конкретном воплощении указанное злокачественное новообразование, содержащее ОСК, представляет собой рак молочной железы, при этом опухолевые стволовые клетки характеризуются фенотипом CD44+/CD24-/low.
В другом конкретном воплощении изобретения указанное злокачественное новообразование, содержащее ОСК, представляет собой глиому.
В более конкретном воплощении указанное злокачественное новообразование, содержащее ОСК, представляет собой глиому, при этом опухолевые стволовые клетки характеризуются фенотипом CD133+.
В другом конкретном воплощении изобретения указанное злокачественное новообразование, содержащее ОСК, представляет собой лейкоз, более конкретно, острый миелоидный лейкоз или острый лимфоидный лейкоз.
В более конкретном воплощении указанное злокачественное новообразование, содержащее ОСК, представляет собой лейкоз, при котором опухолевые стволовые клетки характеризуются фенотипом CD34+, более конкретно указанное злокачественное новообразование, содержащее ОСК, представляет собой острый миелоидный лейкоз, при котором опухолевые стволовые клетки характеризуются фенотипом CD34+/CD38-, или острый лимфоидный лейкоз, при котором опухолевые стволовые клетки характеризуются фенотипом CD34+/CD19+, предпочтительно фенотипом CD34+/CD19+/CD38- или CD34+/CD19+/CD38+.
В контексте изобретения термин «лечение злокачественного новообразования, содержащего ОСК» означает обратное развитие, облегчение, подавление прогрессирования или распространения злокачественного новообразования, содержащего ОСК, и/или метастазирования. Термин также охватывает предупреждение злокачественного новообразования, содержащего ОСК, метастазирования или повторного проявления злокачественного новообразования, содержащего ОСК. Предпочтительно, данное лечение также вызывает регрессию опухолевого роста, т.е. уменьшение размера измеряемой опухоли. Как правило, указанное лечение приводит к увеличению выживаемости без прогрессирования злокачественного новообразования, содержащего ОСК, повторного его проявления или к увеличению общей выживаемости пациентов.
В одном воплощении изобретение относится к антителу по изобретению для лечения метастазов злокачественного новообразования, содержащего ОСК.
В контексте изобретения термин «лечение метастазов» означает предупреждение метастазирования злокачественного новообразования, содержащего ОСК.
В другом воплощении изобретение относится к антителу по изобретению для предупреждения рецидивов или повторных проявлений злокачественного новообразования, содержащего ОСК.
Антитело по изобретению для лечения злокачественного новообразования, содержащего ОСК, применяют для улучшения выживаемости (в частности, 5-летней выживаемости) пациентов, имеющих злокачественное новообразование, содержащее ОСК.
Так, в одном конкретном воплощении изобретение относится к антителу по изобретению для лечения злокачественного новообразования, содержащего ОСК, указанное злокачественное новообразование, содержащее ОСК, представляет собой злокачественное новообразование, имеющее неблагоприятный прогноз.
В данном документе злокачественное новообразование, имеющее неблагоприятный прогноз, соответствует злокачественному новообразованию, при котором медиана ожидаемой продолжительности жизни составляет менее 5 лет, предпочтительно менее 2 лет и еще более предпочтительно менее 1 года.
В данном контексте антитело по изобретению предпочтительно применяют в комбинации по меньшей мере с еще одним противоопухолевым соединением или еще одной противоопухолевой терапией для лечения злокачественного новообразования, содержащего ОСК. Данная комбинация может потенцировать эффекты противоопухолевой терапии и понижать риск распространения, рецидивирования или повторного проявления указанного злокачественного новообразования, содержащего ОСК.
В области техники известны различные противоопухолевые соединения и виды терапии. Они включают стандартные виды противоопухолевой терапии широкого профиля, например, химиотерапию, лучевую терапию, хирургическое вмешательство, а также гормональную терапию. Они также включают более специфические виды терапии, включая таргетную терапию, включая моноклональные антитела, направленные против опухолевых антигенов и тирозинкиназы, а также ингибиторы циклин-зависимой киназы, ингибиторы ангиогенеза…
В одном воплощении изобретение относится к антителу по изобретению и по меньшей мере еще одному противоопухолевому соединению в виде комбинированного препарата для раздельного, одновременного или последовательного применения в лечении злокачественного новообразования, содержащего ОСК.
В другом воплощении изобретение относится к антителу по изобретению в комбинации с хирургическим вмешательством, химиотерапией, гормональной терапией, таргетной терапией и/или лучевой терапией для раздельного, одновременного или последовательного применения в лечении злокачественного новообразования, содержащего ОСК.
Комбинация антитела по изобретению с другой противоопухолевой терапией может вызвать полную регрессию опухоли.
Второй объект изобретения относится к фармацевтической композиции для лечения злокачественного новообразования, содержащего ОСК, указанная фармацевтическая композиция содержит антитело по изобретению или его функциональный фрагмент.
Антитела по изобретению описаны выше.
Согласно изобретению, указанное антитело содержит:
a) Легкую цепь, по меньшей мере содержащую каркасный участок вариабельного домена легкой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR, от англ. complementary determining regions), характеризующихся последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3 и/или
b) Тяжелую цепь, по меньшей мере содержащую каркасный участок вариабельного домена тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), характеризующихся последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3.
В конкретном воплощении антитело по изобретению содержит:
a) Легкую цепь, содержащую каркасный участок легкой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), характеризующихся последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3 и/или
b) Тяжелую цепь, содержащую каркасный участок тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), характеризующихся последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3.
В другом воплощении указанная композиция содержит функциональный фрагмент антитела по изобретению, при этом указанный фрагмент выбран из группы, содержащей или состоящей из Fab, Fab', F(ab')2, Facb, Fd, scFv, диатела и монотела, включая фрагменты VHH и фрагменты VH человеческого происхождения.
Согласно изобретению, указанный фрагмент содержит CDR антитела по изобретению и способен распознавать О-ацетилированный GD2 ганглиозид.
В другом воплощении указанная композиция содержит антитело по изобретению, при этом указанное антитело представляет собой химерное антитело.
В предпочтительном воплощении указанное антитело содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 7, и вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 8.
В другом воплощении указанная композиция содержит антитело по изобретению, при этом указанное антитело представляет собой гуманизированное антитело.
В другом воплощении антитело по изобретению представляет собой иммуноконъюгат.
В конкретном воплощении антитело по изобретению представляет собой иммуноконъюгат, при этом указанный иммуноконъюгат содержит антитело по изобретению или его функциональный фрагмент и цитотоксический агент.
В другом конкретном воплощении антитело по изобретению представляет собой иммуноконъюгат, при этом указанный иммуноконъюгат содержит антитело по изобретению или его функциональный фрагмент и радиоактивный изотоп.
Злокачественные новообразования, содержащие ОСК, согласно изобретению также описаны выше.
В одном воплощении композиция по изобретению предназначена для лечения злокачественного новообразования, содержащего ОСК, выбранного из группы, содержащей или включающей лейкоз, в том числе острый миелоидный лейкоз и острый лимфоидный лейкоз, рак молочной железы, глиому, в том числе глиобластому, колоректальный рак, рак поджелудочной железы, рак предстательной железы, рак легких, рак печени, рак мочевого пузыря или рак желудка.
В предпочтительном воплощении указанные злокачественные новообразования, содержащие ОСК, представляют собой глиому, рак молочной железы, острый лимфоидный лейкоз или острый миелоидный лейкоз.
В другом воплощении указанное злокачественное новообразование, содержащее ОСК, содержит клетки, имеющие по меньшей мере один фенотип, выбранный из группы, содержащей или состоящей из: CD34+/CD38-, CD34+/CD19-, CD34+/CD19+, CD34+/CD38+/CD19+, CD34+/CD38-/CD19+, CD133+/CD38-, CD133+/CD19-, интерлейкин-3-рецептор α+, CD33+, CD44+/CD24-/low, CD44+/CD24-/ESA+, CD44+/CD24low/-lin-/ALDH+, CD133+, A2B5+, SSEA-1+, CD133+/ESAhigh/CD44+, CD166+, CD26+, CD44+/CD133+/α2β1+, CD44+, Sca+/CD45-/Pecam-/CD34+, ALDH1+/Oct4+/CD133+/ABCG2+/CXCR4+, CD133+/CD44+, EpCAM+/AFP+, EMA-/CD44v6+, CD133+/CD44+/ALDH1+.
В более конкретном воплощении изобретения злокачественное новообразование, содержащее ОСК, согласно изобретению содержит CD133+ клетки, CD44+ клетки, более конкретно CD44+/CD24-/low клетки или CD34+ клетки, более конкретно CD34+/CD38- или CD34+/CD19+ клетки, еще более конкретно CD34+/CD19+/CD38- или CD34+/CD19+/CD38+ клетки.
В предпочтительном воплощении изобретения злокачественное новообразование, содержащее ОСК, согласно изобретению характеризуется наличием субпопуляции опухолевых стволовых клеток, в которой по меньшей мере 10% опухолевых стволовых клеток экспрессируют О-ацетилированный GD2 ганглиозид, предпочтительно по меньшей мере 30% опухолевых стволовых клеток, и наиболее предпочтительно по меньшей мере 50% опухолевых стволовых клеток экспрессируют О-ацетилированный GD2 ганглиозид.
В конкретном воплощении изобретения указанное злокачественное новообразование, содержащее ОСК, представляет собой рак молочной железы. В более конкретном воплощении указанное злокачественное новообразование, содержащее ОСК, представляет собой рак молочной железы, при этом опухолевые стволовые клетки характеризуются фенотипом CD44+/CD24-/low.
В другом конкретном воплощении изобретения указанное злокачественное новообразование, содержащее ОСК, представляет собой глиому. В более конкретном воплощении указанное злокачественное новообразование, содержащее ОСК, представляет собой глиому, при этом опухолевые стволовые клетки характеризуются фенотипом CD133+.
В другом конкретном воплощении изобретения указанное злокачественное новообразование, содержащее ОСК, представляет собой лейкоз, при котором опухолевые стволовые клетки характеризуются фенотипом CD34+, более конкретно указанное злокачественное новообразование, содержащее ОСК, представляет собой острый миелоидный лейкоз, при котором опухолевые стволовые клетки характеризуются фенотипом CD34+/CD38- или острый лимфоидный лейкоз, при котором опухолевые стволовые клетки характеризуются фенотипом CD34+/CD19+, предпочтительно фенотипом CD34+/CD19+/CD38- или CD34+/CD19+/CD38+.
В одном воплощении изобретение относится к композиции по изобретению для лечения метастазирования или метастазов злокачественного новообразования, содержащего ОСК.
В другом воплощении изобретение относится к композиции по изобретению для предупреждения рецидивов или повторных проявлений злокачественного новообразования, содержащего ОСК.
Так, в одном конкретном воплощении изобретение относится к композиции по изобретению для лечения злокачественного новообразования, содержащего ОСК, где злокачественное новообразование, содержащее ОСК, имеет неблагоприятный прогноз.
В одном воплощении изобретение относится к композиции по изобретению и по меньшей мере еще одному противоопухолевому соединению в виде комбинированного препарата для раздельного, одновременного или последовательного применения в лечении злокачественного новообразования, содержащего ОСК.
В другом воплощении изобретение относится к композиции по изобретению в комбинации с хирургическим вмешательством, химиотерапией, гормональной терапией, таргетной терапией и/или лучевой терапией для раздельного, одновременного или последовательного применения в лечении злокачественного новообразования, содержащего ОСК.
Фармацевтическая композиция по изобретению дополнительно содержит фармацевтически приемлемый носитель.
Выражение «фармацевтически приемлемый» означает химические соединения и композиции, которые допустимы с физиологической точки зрения и при введении человеку обычно не вызывают аллергических или аналогичных нежелательных реакций, таких как расстройство желудка, головокружение и т.п. Предпочтительно, в данном документе выражение ««фармацевтически приемлемый» означает одобренный федеральными или региональными органами регулирования или включенный в фармокопею США или другую общепризнанную фармакопею для применения у животных, и в частности, у людей.
Термин «носитель» обозначает растворитель, адъювант, эксципиент или наполнитель, с которым вводят соединение. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода или масла, включая минеральное, животное, растительное или синтетическое масло, такое как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п.
Путь введения композиции по изобретению предпочтительно парентеральный; в данном документе термин «парентеральный» включает внутриопухолевое, внутривенное, внутримышечное, подкожное, ректальное, вагинальное или внутрибрюшинное введение. Таким образом, фармацевтическая композиция содержит наполнители, которые являются фармацевтически приемлемыми для составов, предназначенных для инъекций. В частности, они могут быть изотоническими, стерильными, солевыми растворами (гидрофосфат или дигидрофосфат натрия, хлорид натрия, калия, кальция или магния и т.п. или смеси данных солей) или сухими, особенно лиофильно высушенными композициями, которые при добавлении стерильной воды или физиологического раствора, в зависимости от ситуации, позволяют получить инъекционный раствор. Подходящие фармачевтические носители описаны в издании "Remington's Pharmaceutical Sciences" под редакцией E.W. Martin. При этом наиболее предпочтительным является внутривенное или внутриопухолевое введение.
Антитело можно растворять в буферном растворе или воде или включать в эмульсии, микроэмульсии, гидрогели (например, гидрогели на основе триблок-сополимеров полилактид-ко-гликолид - полиэтиленгликоль - полилактид-ко-гликолид), в микросферы, наносферы, микрочастицы, наночастицы (например, микрочастицы поли(молочной-ко-гликолевой кислоты) (например, полимолочной кислоты); поли(лактид-ко-гликолид)); микросферы, наносферы, микрочастицы или наночастицы полиглутамата), в липосомы или другие галеновые препараты. В любом случае, препарат должен быть стерильным и текучим до такой степени, чтобы подходить для инъекционного применения. Он должен быть стабилен в условиях изготовления и хранения и должен быть защищен от контаминации микроорганизмами, такими как бактерии и грибы.
Для приготовления дисперсий можно также использовать глицерин, жидкие полиэтиленгликоли, их смеси, а также масла. В обычных условиях хранения и применения данные препараты содержат консервант, предотвращащий рост микроорганизмов.
Антитело может входить в состав композиции в нейтральной форме или в форме соли. Фармацевтически приемлемые соли включают соли присоединения кислоты (образуемые при участии свободных аминогрупп белка), которые образуются с неорганическими кислотами, например, такими как соляная или фосфорная кислоты, или с органическими кислотами, такими как уксусная, щавелевая, винная, миндальная и т.п. Соли, образованные при участии свободных карбоксильных групп, также могут образовываться с неорганическими основаниями, например, такими как гидроксиды натрия, калия, аммония, кальция или железа, и с такими органическими основаниями, как изопропиламин, триметиламин, гистидин, прокаин и т.п.
Носитель также может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропилен гликоль, жидкий полиэтилен гликоль и т.п.), их подходящие смеси, а также растительные масла. Для повышения биодоступности конъюгаты по изобретению можно модифицировать, например, путем пегилирования.
Для поддержания надлежащей текучести можно, например, использовать покрытия, такие как лецитин, поддерживать необходимый размер частиц в случае диперсий, а также применять поверхностно-активные вещества. Предотвратить воздействие микроорганизмов можно при помощи различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п. Во многих случаях предпочтительно включать изотонические агенты, например, углеводы или хлорид натрия.
Пролонгированная абсорбция инъекционных композиций может быть достигнута благодаря включению в композиции агентов, замедляющих абсорбцию, например, моностеарата алюминия, желатина, полиолов, увеличивающих время полужизни составов, содержащих ковалентные и нековалентные связи.
Существует множество причин нестабильности или деградации пептидов, в их число входят гидролиз и денатурация. Гидрофобное взаимодействие может вызвать группирование молекул друг с другом (агрегацию). Для уменьшения или предотвращения таких недостатков можно добавлять стабилизаторы.
Стабилизаторы включают циклодекстрин и его производные (см. патент US 5,730,969). Кроме того, для стабилизации конечного препарата можно добавлять подходящие консерванты, такие как сахароза, маннитол, сорбитол, трегалоза, декстран и глицерин. В препарат можно добавлять стабилизатор, выбранный из ионных и неионных поверхностно-активных веществ, D-глюкозы, D-галактозы, D-ксилозы, D-галактуроновой кислоты, трегалозы, декстранов, гидорксиэтилкрахмала и их смесей. Стабилизировать пептид может добавление солей щелочных металлов или хлорида магния. Пептид можно также стабилизировать приведением его в контакт с сахаридом, выбранным из группы, состоящей из декстрана, хондроитинсерной кислоты, крахмала, гликогена, декстрина и солей альгиновой кислоты. Можно добавлять другие углеводы, включая моносахариды, дисахариды, сахарные спирты и их смеси (например, глюкозу, маннозу, галактозу, фруктозу, сахарозу, мальтозу, лактозу, маннитол, ксилитол). Полиолы могут стабилизировать пептид и быть смешивающимися с водой или водорастворимыми. Подходящие полиолы могут представлять собой полигидроксиспирты, моносахариды и дисахариды, включая маннитол, глицерин, этиленгликоль, пропиленгликоль, триметилгликоль, винилпирролидон, глюкозу, фруктозу, арабинозу, маннозу, мальтозу, сахарозу и их полимеры. Стабилизировать пептиды могут различные эксципиенты, включая сывороточный альбумин, аминокислоты, гепарин, жирные кислоты и фосфолипиды, поверхностно-активные вещества, металлы, полиолы, восстанавливающие агенты, хелаторы металлов, поливинилпирролидон, гидролизованный желатин и сульфат аммония.
В одном воплощении изобретения фармацевтическая композиция по изобретению также содержит дополнительное активное вещество в разделенных на дозы или дозированных лекарственных формах для раздельного, одновременного или последовательного применения или введения.
Третий объект изобретения относится к способу лечения злокачественного новообразования, содержащего ОСК, у индивидуума, который включает введение указанному индивидууму, нуждающемуся в этом, эффективного количества антитела или композиции по изобретению.
В данном документе термин «индивидуум» относится к млекопитающему, например, представителю отряда грызунов, семейства кошачьих, собачьих или отряда приматов, и наиболее предпочтительно, к человеку.
Композиции и антитела по изобретению подробно описаны выше.
В одном воплощении изобретение относится к указанному способу лечения злокачественного новообразования, содержащего ОСК, выбранного из группы, содержащей или включающей лейкоз, в том числе острый миелоидный лейкоз и острый лимфоидный лейкоз, рак молочной железы, глиому, в том числе глиобластому, колоректальный рак, рак поджелудочной железы, рак предстательной железы, рак легких, рак печени, рак мочевого пузыря или рак желудка.
В предпочтительном воплощении указанные злокачественные новообразования, содержащие ОСК, представляют собой глиому, рак молочной железы, острый лимфоидный лейкоз или острый миелоидный лейкоз.
В другом воплощении указанное злокачественное новообразование, содержащее ОСК, содержит клетки, имеющие по меньшей мере один фенотип, выбранный из группы, содержащей или состоящей из: CD34+/CD38-, CD34+/CD19-, CD34+/CD19+, CD34+/CD38+/CD19+, CD34+/CD38-/CD19+, CD133+/CD38-, CD133+/CD19-, интерлейкин-3-рецептор α+, CD33+, CD44+/CD24-/low, CD44+/CD24-/ESA+, CD44+/CD24low/-lin-/ALDH+, CD133+, A2B5+, SSEA-1+, CD133+/ESAhigh/CD44+, CD166+, CD26+, CD44+/CD133+/α2β1+, CD44+, Sca+/CD45-/Pecam-/CD34+, ALDH1+/Oct4+/CD133+/ABCG2+/CXCR4+, CD133+/CD44+, EpCAM+/AFP+, EMA-/CD44v6+, CD133+/CD44+/ALDH1+.
В более конкретном воплощении изобретения злокачественное новообразование, содержащее ОСК, согласно изобретению содержит CD133+ клетки, CD44+ клетки, более конкретно CD44+/CD24-/low клетки или CD34+ клетки, более конкретно CD34+/CD38- или CD34+/CD19+ клетки, еще более конкретно CD34+/CD19+/CD38- или CD34+/CD19+/CD38+ клетки.
В предпочтительном воплощении изобретения злокачественное новообразование, содержащее ОСК, согласно изобретению характеризуется наличием субпопуляции опухолевых стволовых клеток, в которой по меньшей мере 10% опухолевых стволовых клеток экспрессируют на своей поверхности О-ацетилированный GD2 ганглиозид, предпочтительно по меньшей мере 30% опухолевых стволовых клеток, и наиболее предпочтительно по меньшей мере 50% опухолевых стволовых клеток экспрессируют на своей поверхности О-ацетилированный GD2 ганглиозид.
В конкретном воплощении изобретения указанное злокачественное новообразование, содержащее ОСК, представляет собой рак молочной железы. В более конкретном воплощении указанное злокачественное новообразование, содержащее ОСК, представляет собой рак молочной железы, при этом опухолевые стволовые клетки характеризуются фенотипом CD44+/CD24-/low.
В другом конкретном воплощении изобретения указанное злокачественное новообразование, содержащее ОСК, представляет собой глиому. В более конкретном воплощении указанное злокачественное новообразование, содержащее ОСК, представляет собой глиому, при этом опухолевые стволовые клетки характеризуются фенотипом CD133+.
В другом конкретном воплощении изобретения указанное злокачественное новообразование, содержащее ОСК, представляет собой лейкоз, при котором опухолевые стволовые клетки характеризуются фенотипом CD34+, более конкретно указанное злокачественное новообразование, содержащее ОСК, представляет собой острый миелоидный лейкоз, при котором опухолевые стволовые клетки характеризуются фенотипом CD34+/CD38- или острый лимфоидный лейкоз, при котором опухолевые стволовые клетки характеризуются фенотипом CD34+/CD19+, предпочтительно фенотипом CD34+/CD19+/CD38- или CD34+/CD19+/CD38+.
В одном воплощении изобретение относится к способу лечения метастазов или метастазирования злокачественного новообразования, содержащего ОСК.
В другом воплощении изобретение относится к указанному способу для предупреждения рецидивов или повторных проявлений злокачественного новообразования, содержащего ОСК.
В конкретном воплощении изобретение относится к способу лечения злокачественного новообразования, содержащего ОСК, согласно изобретению, где указанное злокачественное новообразование, содержащее ОСК, представляет собой злокачественное новообразование, имеющее неблагоприятный прогноз.
В одном воплощении изобретение относится к способу лечения злокачественного новообразования, содержащего ОСК, у индивидуума, включающему введение указанному индивидууму, нуждающемуся в этом, эффективного количества антитела или композиции по изобретению и по меньшей мере еще одного противоопухолевого соединения в виде комбинированного препарата для раздельного, одновременного или последовательного применения в лечении злокачественного новообразования, содержащего ОСК.
В другом воплощении изобретение относится к способу лечения злокачественного новообразования, содержащего ОСК, согласно изобретению в комбинации с хирургическим вмешательством, химиотерапией, гормональной терапией, таргетной терапией и/или лучевой терапией для раздельного, одновременного или последовательного применения в лечении злокачественного новообразования, содержащего ОСК.
«Эффективное количество» композиции представляет собой количество, достаточное для того, чтобы вызывать регрессию роста опухоли. Вводимые дозы можно адаптировать в зависимости от различных параметров, в частности в зависимости от используемого способа введения, соответствующей патологии, или в альтернативном случае, в зависимости от желаемой продолжительности лечения. Форма фармацевтической композиции, путь введения, доза и режим естественным образом зависят от состояния, подлежащего лечению, тяжести заболевания, возраста, веса и пола индивидуума и т.д. Диапазон эффективных доз, приведенный ниже, не предназначен для ограничения изобретения, но представляет предпочтительный диапазон доз. При этом очевидно, что специалисты в данной области без излишних усилий могут подобрать предпочтительные дозы отдельным индивидуумам.
В качестве иллюстрации, эффективное количество по меньшей мере одного конъюгата составляет приблизительно от 50 до приблизительно 1000 мг/м2, более предпочтительно приблизительно от 100 до приблизительно 750 мг/м2 и наиболее предпочтительно приблизительно от 250 до приблизительно 500 мг/м2. Возможны и другие дозы, поскольку они могут зависеть от молекулярного веса конъюгата. Специалист в данной области техники сумеет легко определить подходящую дозу, находящуюся в диапазоне, или, при необходимости, за пределами диапазона.
Диагностические подходы согласно изобретению
Четвертый объект изобретения относится к способу диагностики злокачественного новообразования, содержащего ОСК, у индивидуума, при этом указанный способ включает определение экспрессии О-ацетилированного GD2 ганглиозида, при этом экспрессия О-ацетилированного GD2 ганглиозида указывает на наличие злокачественного новообразования, содержащего ОСК.
Изобретение охватывает способы in vivo и in vitro.
В одном воплощении изобретение относится к способу in vitro диагностики злокачественного новообразования, содержащего ОСК, у индивидуума, при этом указанный способ включает этап исследования биологического образца, полученного у указанного индивидуума путем (i) определения экспрессии О-ацетилированного GD2 ганглиозида, при этом экспрессия О-ацетилированного GD2 ганглиозида в указанном биологическом образце указывает на наличие злокачественного новообразования, содержащего ОСК.
Предпочтительно, на этапе (i) определения используют антитело или его функциональный фрагмент, как описано ранее. Указанное антитело или его фрагмент могут быть меченными (например, радиоактивно меченным, меченным хромофором, меченным флуорофором или ферментативно-меченным антителом) или производными (например, конъюгатом антитела с субстратом или с белком или лигандом белка в паре белок/лиганд (например, биотин-стрептавидин)).
Указанный анализ можно проводить различными способами, хорошо известными специалистам в данной области, включающими иммуноферментный анализ (ИФА), радиоиммунный анализ (РИА), вестерн-блоттинг и твердофазный иммуноферментный анализ, тонкослойную иммунохроматографию, визуализирующие методы, в частности, ПЭТ-сканирование (позитронно-эмиссионную томографию).
В способах in vivo по изобретению используют антитело по изобретению или его функциональный фрагмент, подходящие для введения in vivo. Предпочтительно, в указанных способах in vivo используют визуализирующие методы, такие как ПЭТ-сканирование. Данные способы хорошо известны в области техники.
В данном документе термин «биологический образец» означает любой биологический образец, полученный у пациента, предпочтительно указанный биологический образец обозначает биопсийный образец, выделенный из организма индивидуума перед осуществлением способа по изобретению.
В одном воплощении указанное злокачественное новообразование, содержащее ОСК, выбрано из группы, содержащей или включающей лейкоз, в том числе острый миелоидный лейкоз и острый лимфоидный лейкоз, рак молочной железы, глиому, в том числе глиобластому, колоректальный рак, рак поджелудочной железы, рак предстательной железы, рак легких, рак печени, рак мочевого пузыря или рак желудка.
В предпочтительном воплощении указанное злокачественное новообразование, содержащее ОСК, представляет собой глиому, рак молочной железы, острый лимфоидный лейкоз или острый миелоидный лейкоз.
Пятый объект изобретения относится к применению О-ацетилированного GD2 ганглиозида в качестве биомаркера злокачественного новообразования, содержащего ОСК.
Термин «О-ацетилированный GD2 ганглиозид» относится к ганглиозиду, который представляет собой производное GD2 ганглиозида и соответствует 9(7)-O-ацетил-GD2.
Шестым объектом изобретения является способ прогнозирования ответа индивидуума, имеющего злокачественное новообразование, содержащее ОСК, на лечение антителом или композицией по изобретению, при этом указанный способ включает определение присутствия клеток, экспрессирующих О-ацетилированный GD2 ганглиозид, в биологическом образце указанного индивидуума.
В одном воплощении изобретение относится к указанному способу прогнозирования ответа индивидуума, имеющего злокачественное новообразование, содержащее ОСК, на лечение антителом или композицией по изобретению, при котором присутствие клеток, экспрессирующих О-ацетилированный GD2 ганглиозид, в биологическом образце указанного индивидуума коррелирует с большой вероятностью того, что у указанного индивидуума будет достигнут лечебный эффект от применения указанной терапии.
В более конкретном воплощении изобретение относится к указанному способу, в котором указанный способ включает определение уровня опухолевых стволовых клеток, экспрессирующих О-ацетилированный GD2 ганглиозид, среди всех опухолевых стволовых клеток в биологическом образце указанного индивидуума.
В предпочтительном воплощении уровень опухолевых стволовых клеток, экспрессирующих на своей поверхности О-ацетилированный GD2 ганглиозид, составляющий по меньшей мере 10%, в частности по меньшей мере 30%, предпочтительно по меньшей мере 50% от всех опухолевых стволовых клеток в биологическом образце указанного индивидуума коррелирует с высокой вероятностью того, что у указанного индивидуума будет достигнут лечебный эффект от применения указанной терапии.
В одном воплощении указанный биологический образец представляет собой образец злокачественного новообразования, предпочтительно злокачественного новообразования, содержащего ОСК.
В одном воплощении указанное злокачественное новообразование, содержащее ОСК, выбрано из группы, содержащей или включающей лейкоз, в том числе острый миелоидный лейкоз и острый лимфоидный лейкоз, рак молочной железы, глиому, в том числе глиобластому, колоректальный рак, рак поджелудочной железы, рак предстательной железы, рак легких, рак печени, рак мочевого пузыря или рак желудка.
В предпочтительном воплощении указанное злокачественное новообразование, содержащее ОСК, представляет собой глиому, рак молочной железы, острый лимфоидный лейкоз или острый миелоидный лейкоз.
В одном воплощении изобретения указанный способ включает определение у пациентов присутствия клеток, экспрессирующих О-ацетилированный GD2 ганглиозид, неинвазивными способами, такими как визуализирующие методы, с применением визуализирующего средства in vivo. Данные способы хорошо известны в области техники.
ОПИСАНИЕ ПРИМЕРОВ ИЗОБРЕТЕНИЯ
Далее следует более подробное описание изобретения, где указаны ссылки на аминокислотные последовательности, нуклеотидные последовательности и приведены примеры. Однако, приведенные примеры не ограничивают изобретение. Скорее, изобретение относится к любому воплощению, включающему в себя детали, которые не указаны явным образом в приведенных примерах, но которые специалист в данной области подберет без особых усилий.
• Глиомы
Оценка экспрессии O-Ac-GD2 ганглиозида при глиоме
 Экспрессия O-Ac-GD2 в биоптате глиобластомы
Экспрессия O-Ac-GD2 в биоптате глиобластомы
Авторы изобретения оценивали экспрессию О-ацетилированного GD2 ганглиозида (O-Ac-GD2) в 22 образцах глиобластомы с использованием иммуногистохимии. Пример иммунохимического окрашивания в целях диагностики приведен на Фиг. 1, при этом ткани окрашивали на антиген O-Ac-GD2.
Образцы опухолей (глиобластомы) получали при хирургическом вмешательстве. Выделяли образец ткани (объемом ≤0,5 см3) и замораживали в изопентане, охлажденном до температуры жидкого азота. Через 60 секунд образец вынимали, переносили и хранили при -70°С. Срезы 10 мкм получали при помощи криостата. Срезы помещали на стеклянные слайды Superfrost Gold + (VWR) и высушивали на воздухе в течение 3 минут. Затем их фиксировали в ацетоне (-20°С) в течение 10 минут и снова высушивали на воздухе. Затем срезы хранили при -20°С до использования.
Иммунореактивность антитела 8В6 определяли при поэтапной инкубации с биотинилированным козьим антителом, распознающим иммуноглобулины мыши с последующим добавлением комплекса стрептавидин-биотин-пероксидаза и диаминобензидина в качестве субстрата. Исследование образцов с применением светового микроскопа проводил патолог и классифицировал результаты как отрицательные, 1+, 2+ или 3+ при сравнении с замороженными срезами нейробластомы человека, служившими положительным контролем и с тканью, которую инкубировали с нерелевантными IgG3 антителами, служившими отрицательным контролем. Результаты представлены в Таблице 2.
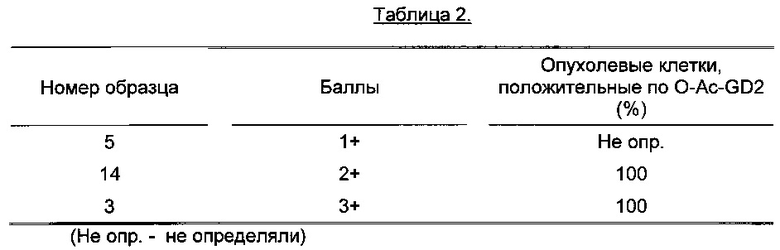
Обнаружено, что все образцы положительно окрашивались моноклональным антителом 8В6, направленным против O-Ac-GD2, при этом оценка результатов иммуногистохимической реакции варьировала от 1+ до 3+. В 16 из 22 образцов положительно окрашивались 100% опухолевых клеток в составе опухоли.
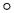 Экспрессия O-Ac-GD2 в линии клеток глиомы и в первичных клетках
Экспрессия O-Ac-GD2 в линии клеток глиомы и в первичных клетках
Профили экспрессии CD133 и O-Ac-GD2 в клетках глиобластомы человека U87MG определяли при помощи цитофлуориметрического исследования. Клетки окрашивали родительским моноклональным антителом 8В6, специфическим к О-Ас-GD2 и антителом к CD133, конъюгированным с FITC. Клетки трижды отмывали в ледяном ФСБ, инкубировали с моноклональным антителом 8В6 (10 мкг/мл в ФСБ-БСА 1%) в течение 30 минут при 4°С. После 3 отмывок ледяным ФСБ проводили инкубацию с F(ab)'2 фрагментом вторичного козьего антитела к иммуноглобулинам мыши, конъюгированным с FITC, в течение 30 минут для детекции связанного первичного антитела. После отмывки клетки инкубировали с антителом к CD133, конъюгированным с АРС, в течение 30 минут при 4°С. После 3-кратной отмывки клеток ледяным ФСБ клетки анализировали на цитометре FACS Calibur (BD) с программным обеспечением Cell Quest Pro (BD). В качестве отрицательного контроля использовали антитело того же изотипа. Для клеточных линий анализировали по меньшей мере 1×104 событий.
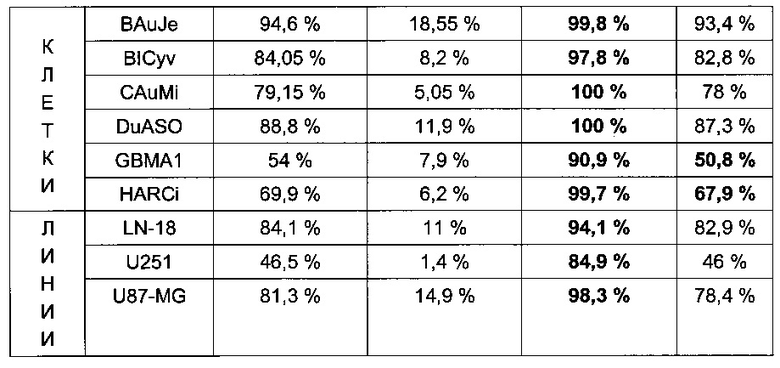
С помощью проточной цитометрии авторы изобретения также определяли поверхностную экспрессию антигена O-Ac-GD2, используя линию клеток глиомы человека (3/3) и первичные клетки глиомы человека (12/12). Для линии клеток глиомы доля O-Ас-GD2-положительных клеток варьировала от 61 до 85% (Фиг. 2, Таблица 3).
В данной линии клеток глиомы также наблюдалось присутствие CD133+O-Ac-GD2+ ОСК, а среди CD133-положительных клеток доля клеток, положительных по О-Ac-GD2, составляла приблизительно от 85 до 98%.
Доля O-Ас-GD2-положительных клеток среди первичных клеток глиомы варьировала от 32 до 94%. Среди первичных клеток глиомы также наблюдалось присутствие CD133+O-Ac-GD2+ ОСК, а среди CD133-положительных клеток доля клеток, положительных по O-Ac-GD2, составляла приблизительно от 62 до 100% (Таблица 3).
Выраженная экспрессия O-Ac-GD2 у первичных клеток глиомы и клеточной линии глиомы подтверждает результаты, полученные для биоптата глиобластомы. Кроме того, в ходе поиска (CD133+) ОСК среди указанных первичных клеток глиомы, а также клеточной линии глиомы было обнаружено, что процентное содержание таких (CD133+) ОСК различается. Неожиданно результаты показали, что экспрессия O-Ac-GD2 повышена в указанных ОСК по сравнению с клетками, которые не являются ОСК. Например, процентное содержание O-Ас-GD2-положительных клеток среди ОСК в два раза выше, чем среди клеток, не являющихся ОСК (данные не приведены).
Наконец, результаты показали, что O-Ac-GD2 повышен у ОСК глиомы, что можно использовать для адресного взаимодействия сданными клетками.
Влияние моноклонального антитела 8В6 на клетки глиомы, экспрессирующие O-Ac-GD2.
Опухолевые клетки U87-MG (5×105 клеток) высаживали в плоскодонные 12-луночные планшеты и инкубировали с моноклональным антителом 8В6 или с контрольным IgG3 антителом в течение 24 часов при 37°С, 5% CO2. Клеточные культуры фотографировали на цифровую камеру LEICA DFC295, установленную на микроскопе LEICA 164.
После инкубации в течение 24 ч проводили фазово-контрастную микроскопию (увеличение ×200) для выявления апоптотических клеток по морфологическим изменениям. Стрелками отмечены апоптотические клетки.
Моноклональное антитело 8В6 вызывало изменение морфологии клеток U87MG. Клетки, которые инкубировали с моноклональным антителом 8В6, имели сферическую форму и образовывали пузырьки, которые были неплотно присоединены ко дну культурального сосуда или плавали в культуральной среде. Клетки распадались на несколько фрагментов, что является характерным для апоптоза (Фиг. 3). Можно предположить, что ОСК, демонстрирующие наиболее высокую экспрессию O-Ac-GD2 среди клеток U87-MG, погибают вследствие апоптоза.
Влияние моноклонального антитела 8В6 на клетки глиобластомы в модели in vivo.
Самок бестимусных мышей, лишенных волосяного покрова (nu/nu) (Harlan Laboratories) содержали в виварии университета Нанта, аккредитованного департаментом сельского хозяйства Франции, в соответствии с Европейскими требованиями к содержанию животных согласно утвержденному протоколу по уходу за животным и их использованию.
Аликвоты суспензии клеток U251 (3×106 клеток/100 мкл, содержащие RPMI и матригель в равных объемах) имплантировали под кожу левого бока мыши. Через неделю опухолевая масса обнаруживалась у всех мышей, получивших инъекции, которых затем случайным образом делили на три равные группы и начинали терапию с применением антитела. Моноклональное антитело 8В6, направленное против O-Ac-GD2, находящееся в фосфатно-солевом буфере, вводили внутривенно. Одна группа получала одну инъекцию 500 мкг моноклонального антитела 8В6, тогда как контрольная группа получала равный объем ФСБ в качестве плацебо. Третья группа получала изотипически сходное моноклональное антитело, служившее отрицательным контролем. Опухоли измеряли с помощью циркуля, объем опухоли рассчитывали по формуле: длина × ширина2 × π/6.
Авторы изобретения также обнаружили, что моноклональное антитело к О-Ac-GD2 ингибирует опухолевый рост глиобластомы у мышей (Фиг. 4). При достижении объема опухоли 100 мм3, мышам вводили 500 мкг моноклонального антитела 8В6 или контрольного моноклонального IgG3 антитела и наблюдали за опухолевым ростом. Антитело 8В6 подавляло опухолевый рост глиобластомы человека U251 у мышей, при сравнении с плацебо и с контрольным антителом IgG3. Через 68 дней после инъекции антитела средний объем опухоли составлял 423±236 мм3 и 405±176 мм3 в группах, получавших плацебо и контрольное IgG3-антитело, соответственно. Напротив, терапия моноклональным антителом 8В6 подавляла рост опухолевых клеток U251, при этом средний объем опухоли составлял 254±142 мм3. Была показана специфичность терапии, поскольку терапия с использованием аналогичного количества неспецифического антитела IgG3 оказалась неэффективной. Наконец, было продемонстрировано, что в отличие от мышей, получавших IgG3, у мышей, получавших 8В6, ОСК не обнаруживались (данные не приведены).
В заключение, результаты показали, что антитело к O-Ac-GD2 позволило элиминировать ОСК in vivo, что сопровождалось отчетливым и выраженным подавлением роста опухоли.
• Злокачественные новообразования молочной железы
Оценка экспрессии O-Ac-GD2 ганглиозида при злокачественных новообразованиях молочной железы
 Экспрессия O-Ac-GD2 в ткани опухоли молочной железы
Экспрессия O-Ac-GD2 в ткани опухоли молочной железы
Авторы изобретения провели первичную иммуногистохимическую оценку экспрессии O-Ac-GD2 в фиксированных в формалине заключенных в парафин опухолевых тканях с использованием моноклонального антитела 8В6.
Установлено, что из 25 окрашенных образцов биопсийного материала новообразований молочной железы, 18 окрашивались положительно, при этом 1 образец был слабо окрашен (1+), 9 образцов окрашивались умеренно (2+) и 8 образцов были сильно окрашены (3+).
Выраженная корреляция, которая прослеживалась между тканями новообразований молочной железы и наличием O-Ac-GD2, была подтверждена в других иммуногистохимических исследованиях, которые были выполнены на 28 замороженных срезах других образцов злокачественных новообразований молочной железы. В данной серии экспериментов все образцы положительно окрашивались на O-Ac-GD2.
Таким образом, O-Ac-GD2 можно применять в качестве маркера злокачественных новообразований молочной железы.
 Экспрессия O-Ac-GD2 в линии клеток опухоли молочной железы
Экспрессия O-Ac-GD2 в линии клеток опухоли молочной железы
Исследовали экспрессию O-Ac-GD2 в линии клеток опухоли молочной железы SUM159. Профиль экспрессии O-Ac-GD2 в опухолевых стволовых клетках молочной железы человека анализировали при помощи проточной цитометрии после тройного флуоресцентного окрашивания. Клетки инкубировали с первичными антителами 8В6, 14G2a и 7Н2 (в концентрации 10 мкг/мл) в ФСБ-БСА 1% в течение 45 мин на льду. После 3 отмывок ледяным ФСБ проводили инкубацию с козьим антителом к IgG мыши (H+L), конъюгированным с Alexa Fluor® 568 (Life Technologies), в течение 45 минут на льду для детекции связанного первичного антитела. Затем клетки фиксировали 4% параформальдегидом в течение 10 минут и инкубировали в течение 25 минут с антителом к CD24, конъюгированным с FITC, и антителом к CD44, конъюгированным с АРС (BD). После отмывки клетки анализировали на проточном цитометре LSRII (BD) с программным обеспечением FlowJo (BD). Для клеточных линий анализировали по меньшей мере 1×104 событий.
Обнаружено, что приблизительно 35% клеток экспрессировали O-Ac-GD2 (антитело 8В6), тогда как только приблизительно 15% экспрессировали GD2 ганглиозид (антитело 14G2a). Такие различия в экспрессии были подтверждены на другой линии клеток опухоли молочной железы (HMLE, данные не приведены). Затем исследовали долю клеток CD44+CD24-/low среди клеток линии SUM159 и обнаружили, что 94% клеток обладают фенотипом ОСК. Если для линии SUM159 процентное содержание ОСК, положительных по O-Ac-GD2, в сравнении с клетками, не являющимися ОСК, не определяли, то в другой линии клеток опухоли молочной железы (HMLE) данное процентное содержание оказалось в 5 раз выше (данные не приведены). Таким образом, как и в случае результатов, полученных для глиомы, О-Ac-GD2 повышен у ОСК опухоли молочной железы, что можно использовать для адресного взаимодействия с данными клетками. Кроме того, данные результаты представляют большой интерес, поскольку они позволяют предположить терапевтическую эффективность лечения, мишенью которого является O-Ac-GD2, по сравнению с лечением, мишенью которого является GD2. Действительно, выбор в качестве мишени небольшой доли клеток, экспрессирующих GD2, не позволяет ограничить распространение злокачественного новообразования.
Подавление жизнеспособности клеток опухоли молочной железы с применением антитела 8В6
Авторы изобретения исследовали клеточную пролиферацию с применением антител к O-Ac-GD2 и GD2 на линии клеток опухоли молочной железы SUM159.
104 клеток SUM159 (100 мкл) инкубировали в 96-луночном планшете в течение 24 ч при 37°С. Антитела добавляли в концентрации 80-1,25 мкг/мл в 50 мкл среды и инкубировали в течение 24 ч при 37°С. В каждую лунку добавляли 50 мкг МТТ и инкубировали по меньшей мере в течение 4 ч при 37°С, после чего клетки солюбилизировали в 10% растворе додецил сульфата натрия, чтобы остановить восстановление красителя МТТ в клетках, и инкубировали в течение ночи при 37°С. Затем измеряли оптическую плотность при 570 и 650 нм. Для расчета общего количества восстановленного красителя оптическую плотность продукта при 650 нм вычитали из оптической плотности при 570 нм (Abs570-Abs650). Оптическая плотность в четырех контрольных лунках с клетками, обработанными 20 мкг этопозида, которые служили холостой пробой, соответствовала жизнеспособности 0%. Жизнеспособность (%) рассчитывали как процентное отношение к необработанным клеткам, каждое значение выражали как среднее арифметическое из четырех повторностей ± стандартная ошибка среднего.
Антитело 8В6 оказывало прямое цитотоксическое действие в отношении данной клеточной линии, при этом жизнеспособность клеток снижалась почти на 30% (Фиг. 5).
• Злокачественные новообразования легких
Оценка экспрессии O-Ac-GD2 ганглиозида при мелкоклеточном раке легкого
 Экспрессия O-Ac-GD2 в линии опухолевых клеток легкого
Экспрессия O-Ac-GD2 в линии опухолевых клеток легкого
Исследовали экспрессию O-Ac-GD2 в линии опухолевых клеток легкого Н196. Профиль экспрессии O-Ac-GD2 в опухолевых стволовых клетках легкого человека анализировали при помощи проточной цитометрии после двойного флуоресцентного окрашивания. Клетки инкубировали с первичными антителами 8В6, 10В8 и 7Н2 (в концентрации 10 мкг/мл) в ФСБ-БСА 1% в течение 45 мин на льду. После 3 отмывок ледяным ФСБ проводили инкубацию с козьим антителом к IgG мыши (H+L), конъюгированным с FITC (JacksonResearch), в течение 45 минут на льду для детекции связанного первичного антитела. Затем клетки фиксировали 4% параформальдегидом в течение 10 минут, после чего инкубировали в течение 25 минут с антителом к CD133, конъюгированным с АРС (Miltenyi Biotec). После отмывки клетки анализировали на проточном цитометре FACS Calibur (BD) с программным обеспечением CellQuest (BD). Для клеточных линий анализировали по меньшей мере 1×104 событий.
Результаты представлены на Фиг. 6.
Результаты вновь показали, что экспрессия O-Ac-GD2 и CD133 коррелировала более чем у 50% ОСК, экспрессирующих O-Ac-GD2. Экспрессия GD2 в этих клетках была незначительно выше, чем в отрицательном контроле (т.е. 7%).
O-Ac-GD2 также оказался повышен у ОСК при мелкоклеточном раке легкого, что можно использовать для адресного взаимодействия с данными клетками.
• Лейкозы
Авторы изобретения провели первичную иммуногистохимическую оценку экспрессии O-Ac-GD2 при остром лимфоидном лейкозе (ОЛЛ) и остром миелоидном лейкозе (ОМЛ) с использованием моноклонального антитела 8В6.
Две из протестированных клеточных линий ОЛЛ продемонстрировали положительные результаты. Один образец, полученный у пациента с ОМЛ, также оказался положительным.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО К GD2-O-АЦЕТИЛИРОВАННОМУ ГАНГЛИОЗИДУ С ПРОАПОПТОЗНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2679715C1 |
| ПРИМЕНЕНИЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К О-АЦЕТИЛИРОВАННОЙ ФОРМЕ ГАНГЛИОЗИДА GD2, ДЛЯ ЛЕЧЕНИЯ НЕКОТОРЫХ ФОРМ РАКА | 2007 |
|
RU2462476C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ О-АЦЕТИЛИРОВАННОГО ГАНГЛИОЗИДА GD2 ДЛЯ УЛУЧШЕНИЯ ТЕРАПЕВТИЧЕСКОГО ПОТЕНЦИАЛА ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2017 |
|
RU2771173C2 |
| Антитела к CD43 и их применение для лечения рака | 2016 |
|
RU2694903C1 |
| СЕЛЕКТИВНЫЙ БИФУНКЦИОНАЛЬНЫЙ ПРЕПАРАТ НА ОСНОВЕ ФРАГМЕНТОВ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ ВЕРБЛЮЖЬИХ, НАЦЕЛЕННЫЙ НА ОПУХОЛЕВЫЕ РЕЦЕПТОРЫ CD47/CD44, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2016 |
|
RU2658764C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАДИОЧУВСТВИТЕЛЬНОСТИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2020 |
|
RU2735982C2 |
| СЕЛЕКТИВНЫЙ БИФУНКЦИОНАЛЬНЫЙ ПРЕПАРАТ НА ОСНОВЕ ФРАГМЕНТОВ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ ВЕРБЛЮЖЬИХ, НАЦЕЛЕННЫЙ НА ОПУХОЛЕВЫЕ РЕЦЕПТОРЫ CD47/ERBB2, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2016 |
|
RU2648164C1 |
| СПОСОБ ИНГИБИРОВАНИЯ РАДИАЦИОННО-ИНДУЦИРОВАННОГО УВЕЛИЧЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2800366C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИТЕЛА К CD38 И ЛЕНАЛИДОМИД | 2013 |
|
RU2698911C2 |
| СПОСОБ СНИЖЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2018 |
|
RU2702910C2 |






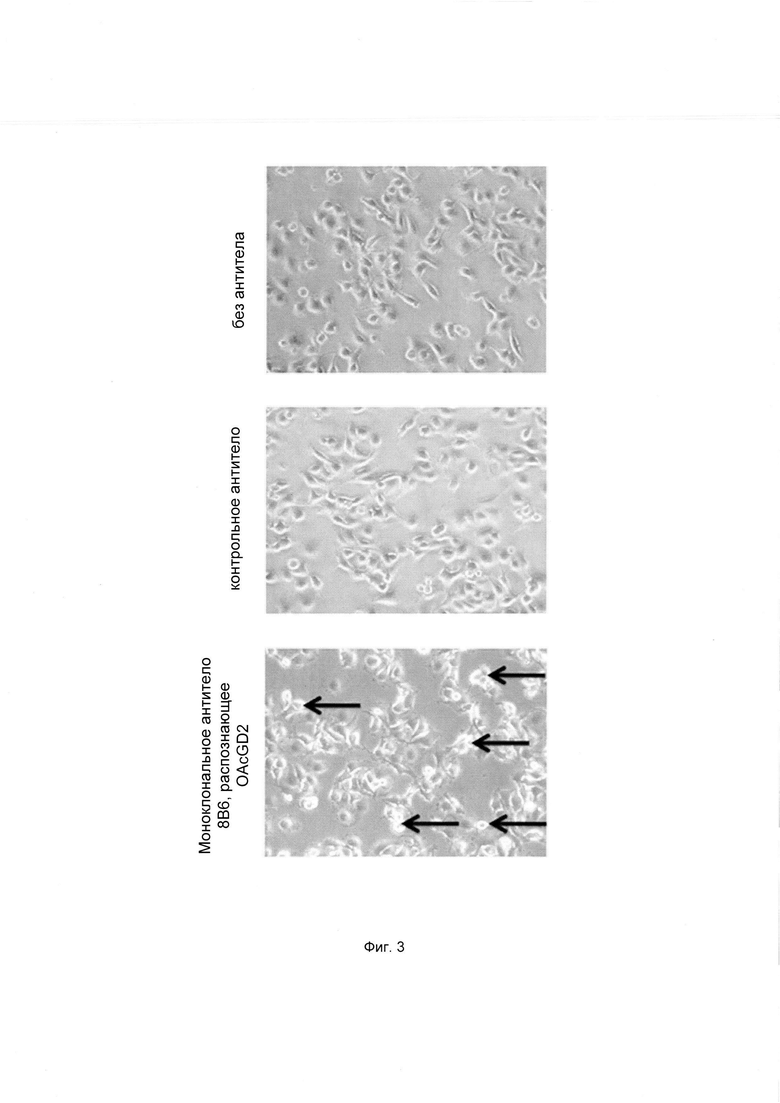
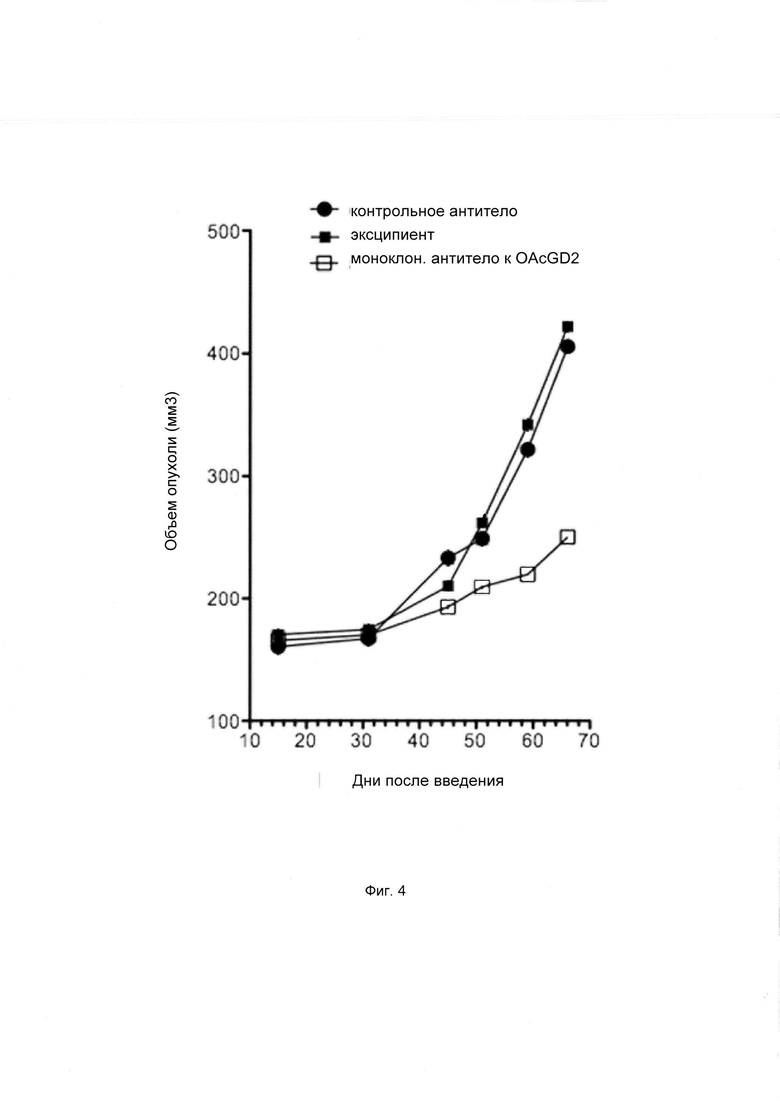
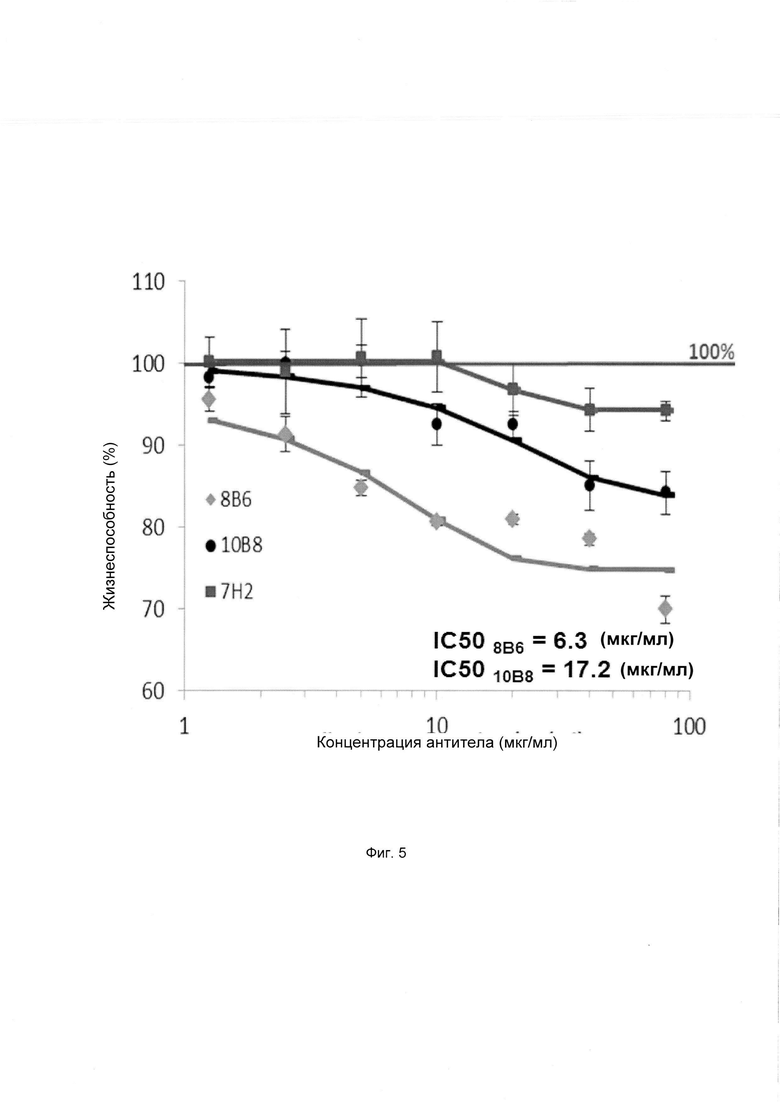

Изобретение относится к области биотехнологии. Описана группа изобретений, включающая способ лечения злокачественных новообразований, содержащих опухолевые стволовые клетки (ОСК), где указанный способ включает введение пациенту эффективного количества антитела или его антиген-связывающего фрагмента, специфически связывающегося с О-ацетилированным GD2 ганглиозидом, фармацевтическую композицию для лечения злокачественных новообразований, способ in vitro диагностики злокачественного новообразования, применение О-ацетилированного GD2 ганглиозида в качестве биомаркера злокачественного новообразования, способ прогнозирования ответа пациента, имеющего злокачественное новообразование. В одном из вариантов реализации злокачественное заболевание выбрано из лейкоза, рака молочной железы, глиомы, колоректального рака, рака поджелудочной железы, рака предстательной железы, рака легкого. Изобретение расширяет арсенал средств для лечения и диагностики злокачественных новообразований. 5 н. и 20 з.п. ф-лы, 6 ил., 3 табл., 4 пр.
1. Способ лечения злокачественных новообразований, содержащих опухолевые стволовые клетки (ОСК), имеющие по меньшей мере один фенотип, выбранный из группы, состоящей из: CD34+/CD38-, CD34+/CD19-, CD34+/CD19+, CD34+/CD38+/CD19+, CD34+/CD38-/CD19+, CD133+/CD38-, CD133+/CD19-, интерлейкин-3-рецептор α+, CD33+, CD44+/CD24-/low, CD44+/CD24-/low/ESA+, CD44+/CD24-/low/lin-/ALDH+, CD133+, A2B5+, SSEA-1+, CD133+/ESAhigh/CD44+, CD166+, CD26+, CD44+/CD24+/ESA+, CD44+/CD133+/α2β1+, CD44+, Sca+/CD45-/Pecam-/CD34+, ALDH1+/Oct4+/CD133+/ABCG2+/CXCR4+, CD133+/CD44+, EpCAM+/AFP+, EMA-/CD44v6+ и CD133+/CD44+/ALDH1+, где
указанный способ включает введение пациенту эффективного количества антитела или его антиген-связывающего фрагмента, специфически связывающегося с О-ацетилированным GD2 ганглиозидом, где указанное антитело содержит:
а) легкую цепь, по меньшей мере содержащую каркасный участок вариабельного домена легкой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3, и
б) тяжелую цепь, по меньшей мере содержащую каркасный участок вариабельного домена тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3.
2. Способ по п. 1, где указанный антиген-связывающий фрагмент, специфически связывающийся с О-ацетилированным GD2 ганглиозидом, выбран из группы, содержащей или состоящей из Fab, Fab', F(ab')2, Facb, scFv, диател и монотел, включающих фрагменты VHH и фрагменты VH человеческого происхождения.
3. Способ по п. 1, где указанное антитело представляет собой химерное или гуманизированное антитело.
4. Способ по п. 1, где указанное антитело содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 7, и вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 8.
5. Способ по п. 1, где указанное злокачественное новообразование, содержащее ОСК, выбрано из группы, содержащей или включающей лейкоз, в том числе острый миелоидный лейкоз и острый лимфоидный лейкоз, рак молочной железы, глиому, в том числе глиобластому, колоректальный рак, рак поджелудочной железы, рак легкого.
6. Способ по п. 1, где указанное злокачественное новообразование, содержащее ОСК, содержит клетки, имеющие по меньшей мере фенотип CD133+, CD44+/CD24-/low, CD34+/CD38- или CD34+/CD19+.
7. Способ по п. 1, где указанное злокачественное новообразование, содержащее ОСК, представляет собой рак молочной железы, глиому, острый миелоидный лейкоз или острый лимфоидный лейкоз.
8. Способ по п. 1, где указанное злокачественное новообразование, содержащее ОСК, характеризуется наличием субпопуляции опухолевых стволовых клеток, в которой по меньшей мере 10% опухолевых стволовых клеток экспрессируют О-ацетилированный GD2 ганглиозид.
9. Способ по п. 1, где указанное антитело предназначено для лечения метастазирования или метастазов злокачественного новообразования, содержащего ОСК, и/или для предупреждения повторного проявления или рецидива злокачественного новообразования, содержащего ОСК.
10. Способ по п. 1, где способ дополнительно включает раздельное, одновременное или последовательное введение пациенту по меньшей мере еще одного противоопухолевого соединения.
11. Способ по п. 1, где введенное антитело или его антиген-связывающий фрагмент раздельно, одновременно или последовательно комбинируют с хирургическим вмешательством, химиотерапией, гормональной терапией, таргетной терапией и/или лучевой терапией.
12. Фармацевтическая композиция для лечения злокачественного новообразования, содержащего опухолевые стволовые клетки (ОСК), имеющие по меньшей мере один фенотип, выбранный из группы, состоящей из: CD34+/CD38-, CD34+/CD19-, CD34+/CD19+, CD34+/CD38+/CD19+, CD34+/CD38-/CD19+, CD133+/CD38-, CD133+/CD19-, интерлейкин-3-рецептор α+, CD33+, CD44+/CD24-/low, CD44+/CD24-/low/ESA+, CD44+/CD24-/low/lin-/ALDH+, CD133+, A2B5+, SSEA-1+, CD133+/ESAhigh/CD44+, CD166+, CD26+, CD44+/CD24+/ESA+, CD44+/CD133+/α2β1+, CD44+, Sca+/CD45-/Pecam-/CD34+, ALDH1+/Oct4+/CD133+/ABCG2+/CXCR4+, CD133+/CD44+, EpCAM+/AFP+, EMA-/CD44v6+ и CD133+/CD44+/ALDH1+, где указанная фармацевтическая композиция содержит эффективное количество антитела или его антиген-связывающего фрагмента, специфически связывающегося с О-ацетилированным GD2 ганглиозидом, и фармацевтически приемлемый носитель, где указанное антитело содержит:
а) легкую цепь, по меньшей мере содержащую каркасный участок вариабельного домена легкой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3, и
б) тяжелую цепь, по меньшей мере содержащую каркасный участок вариабельного домена тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3.
13. Фармацевтическая композиция по п. 12, где указанное злокачественное новообразование, содержащее ОСК, выбрано из группы, состоящей из лейкоза, в том числе острого миелоидного лейкоза и острого лимфоидного лейкоза, рака молочной железы, глиомы, в том числе глиобластомы, колоректального рака, рака поджелудочной железы, рака легкого.
14. Фармацевтическая композиция по п. 12, где указанное злокачественное новообразование содержит клетки ОСК, имеющие по меньшей мере фенотип CD133+, CD44+/CD24-/low, CD34+/CD38- или CD34+/CD19+.
15. Фармацевтическая композиция по п. 12, где указанное злокачественное новообразование, содержащее ОСК, представляет собой рак молочной железы, глиому, острый миелоидный лейкоз или острый лимфоидный лейкоз.
16. Фармацевтическая композиция по п. 12, где указанное злокачественное новообразование, содержащее ОСК, характеризуется наличием субпопуляции опухолевых стволовых клеток, в которой по меньшей мере 10% опухолевых стволовых клеток экспрессируют О-ацетилированный GD2 ганглиозид.
17. Фармацевтическая композиция по п. 12, где указанная фармацевтическая композиция предназначена для лечения метастазирования или метастазов злокачественного новообразования, содержащего ОСК, и/или для предупреждения повторного проявления или рецидива злокачественного новообразования, содержащего ОСК.
18. Фармацевтическая композиция по п. 12 и по меньшей мере еще одно противоопухолевое соединение в виде комбинированного препарата для раздельного, одновременного или последовательного применения в лечении злокачественного новообразования, содержащего ОСК.
19. Фармацевтическая композиция по п. 12 в комбинации с хирургическим вмешательством, химиотерапией, гормональной терапией, таргетной терапией и/или лучевой терапией для раздельного, одновременного или последовательного применения в лечении злокачественного новообразования, содержащего ОСК.
20. Способ in vitro диагностики злокачественного новообразования, содержащего ОСК, имеющие по меньшей мере один фенотип, выбранный из группы, состоящей из: CD34+/CD38-, CD34+/CD19-, CD34+/CD19+, CD34+/CD38+/CD19+, CD34+/CD38-/CD19+, CD133+/CD38-, CD133+/CD19-, интерлейкин-3-рецептор α+, CD33+, CD44+/CD24-/low, CD44+/CD24-/low/ESA+, CD44+/CD24-/low/lin-/ALDH+, CD133+, A2B5+, SSEA-1+, CD133+/ESAhigh/CD44+, CD166+, CD26+, CD44+/CD24+/ESA+, CD44+/CD133+/α2β1+, CD44+, Sca+/CD45-/Pecam-/CD34+, ALDH1+/Oct4+/CD133+/ABCG2+/CXCR4+, CD133+/CD44+, EpCAM+/AFP+, EMA-/CD44v6+ и CD133+/CD44+/ALDH1+,
у пациента, при этом указанный способ включает этап исследования биологического образца, полученного у указанного пациента путем (i) определения экспрессии О-ацетилированного GD2 ганглиозида, при этом экспрессия О-ацетилированного GD2 ганглиозида в указанном биологическом образце указывает на наличие злокачественного новообразования, содержащего ОСК, где О-ацетилированный GD2 ганглиозид определяется антителом, содержащим:
а) легкую цепь, по меньшей мере содержащую каркасный участок вариабельного домена легкой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3, и
б) тяжелую цепь, по меньшей мере содержащую каркасный участок вариабельного домена тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3.
21. Способ по п. 20, где указанное злокачественное новообразование, содержащее ОСК, выбрано из группы, состоящей из лейкоза, в том числе острого миелоидного лейкоза и острого лимфоидного лейкоза, рака молочной железы, глиомы, в том числе глиобластомы, колоректального рака, рака поджелудочной железы, рака легкого.
22. Применение О-ацетилированного GD2 ганглиозида в качестве биомаркера злокачественного новообразования, содержащего ОСК, имеющие по меньшей мере один фенотип, выбранный из группы, состоящей из: CD34+/CD38-, CD34+/CD19-, CD34+/CD19+, CD34+/CD38+/CD19+, CD34+/CD38-/CD19+, CD133+/CD38-, CD133+/CD19-, интерлейкин-3-рецептор α+, CD33+, CD44+/CD24-/low, CD44+/CD24-/low/ESA+, CD44+/CD24-/low/lin-/ALDH+, CD133+, A2B5+, SSEA-1+, CD133+/ESAhigh/CD44+, CD166+, CD26+, CD44+/CD24+/ESA+, CD44+/CD133+/α2β1+, CD44+, Sca+/CD45-/Pecam-/CD34+, ALDH1+/Oct4+/CD133+/ABCG2+/CXCR4+, CD133+/CD44+, EpCAM+/AFP+, EMA-/CD44v6+ и CD133+/CD44+/ALDH1+, где O-ацетилированный GD2 ганглиозид определяется антителом, содержащим:
а) легкую цепь, по меньшей мере содержащую каркасный участок вариабельного домена легкой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3, и
б) тяжелую цепь, по меньшей мере содержащую каркасный участок вариабельного домена тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3.
23. Применение по п. 22, где указанное злокачественное новообразование, содержащее ОСК, выбрано из группы, состоящей из лейкоза, в том числе острого миелоидного лейкоза и острого лимфоидного лейкоза, рака молочной железы, глиомы, в том числе глиобластомы, колоректального рака, рака поджелудочной железы, рака предстательной железы, рака легкого.
24. Способ прогнозирования ответа пациента, имеющего злокачественное новообразование, содержащее ОСК, имеющие по меньшей мере один фенотип, выбранный из группы, состоящей из: CD34+/CD38-, CD34+/CD19-, CD34+/CD19+, CD34+/CD38+/CD19+, CD34+/CD38+/CD19+, CD133+/CD38-, CD133+/CD19-, интерлейкин-3-рецептор α+, CD33+, CD44+/CD24-/low, CD44+/CD24-/low/ESA+, CD44+/CD24-/low/lin-/ALDH+, CD133+, А2В5+, SSEA-1+, CD133+/ESAhigh/CD44+, CD166+, CD26+, CD44+/CD24+/ESA+, CD44+/CD133+/α2β1+, CD44+, Sca+/CD45-/Pecam-/CD34+, ALDH1+/Oct4+/CD133+/ABCG2+/CXCR4+, CD133+/CD44+, EpCAM+/AFP+, EMA-/CD44v6+ и CD133+/CD44+/ALDH1+,
на лечение антителом или его антиген-связывающим фрагментом, специфически связывающимся с О-ацетилированным GD2 ганглиозидом, где указанное антитело содержит:
а) легкую цепь, по меньшей мере содержащую каркасный участок вариабельного домена легкой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3, и
б) тяжелую цепь, по меньшей мере содержащую каркасный участок вариабельного домена тяжелой цепи иммуноглобулина и три участка, определяющих комплементарность (CDR), где CDR характеризуются последовательностями SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2, SEQ ID NO: 6 для CDR-H3,
или композицией по любому из пп. 12-19, при этом указанный способ включает определение присутствия клеток, экспрессирующих О-ацетилированный GD2 ганглиозид, в биологическом образце указанного пациента.
25. Способ по п. 24, где указанное злокачественное новообразование, содержащее ОСК, выбрано из группы, состоящей из лейкоза, в том числе острого миелоидного лейкоза и острого лимфоидного лейкоза, рака молочной железы, глиомы, в том числе глиобластомы, колоректального рака, рака поджелудочной железы, рака предстательной железы, рака легкого.
| FR2906808 A1 11.04.2008 | |||
| JYOTI NAUTIYAL et al | |||
| Combination of dasatinib and curcumin eliminates chemo-resistant colon cancer cells, Journal of Molecular Signaling 2011, Vol.6, No.7, pp.1-11 | |||
| Складная кровать с брезентовой палубой | 1921 |
|
SU987A1 |
| ДОРОНИН И.И., ХОЛОДЕНКО И.В., МОЛОТКОВСКАЯ И.М., ХОЛОДЕНКО Р.В | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ приготовления кирпичей для футеровки печей, служащих для получения сернистого натрия из серно-натриевой соли | 1921 |
|
SU154A1 |
| ПРИБОР ДЛЯ ОТБИРАНИЯ ПРОБ ЖИДКОСТИ | 1922 |
|
SU616A1 |
Авторы
Даты
2019-10-08—Публикация
2014-04-29—Подача