Изобретение относится к медицине, в частности к онкологии и радиологии, и может быть использовано для прогнозирования индивидуальной радиочувствительности злокачественных новообразований (ЗНО) верхних дыхательных путей (ВДП) на начальных этапах лучевой и химиолучевой терапии.
В индустриально развитых странах около 70% онкологических больных получают лучевую терапию в виде основного, адъювантного, неоадъювантного и паллиативного лечения (Андреев В.Г. и др. Терапевтическая радиология . Руководство для врачей / Под редакцией А.Ф. Цыба, Ю.С. Мардынского. М.: Медкнига, 2010. 552 с.). Тенденция к возрастанию роли ионизирующих излучений в лечении злокачественных новообразований обусловлена высокой эффективностью и органосохраняющей направленностью его воздействия на пораженный орган, позволяющей добиться выздоровления на фоне хорошей социальной и семейной реабилитации (Терновой C.К. и др. Лучевая диагностика и терапия: Учебник для студентов медицинских вузов в 3-х томах. М.: Медицина, 2008).
Вместе с тем известно, что радиочувствительность рака ВДП (как и других локализаций) сильно различается на индивидуальном уровне при одних и тех же клинико-морфологических показателях опухолевого процесса (анатомическая область, стадия, гистологический тип, степень дифференцировки опухолевых клеток). Этот факт делает неэффективным использование радиотерапии у части больных и определяет необходимость выявления таких пациентов ещё до начала или на первых этапах лечения с целью его оптимизации.
Среди причин широкой индивидуальной вариабельности радиочувствительности ЗНО следует указать такие хорошо известные биологические факторы как различия в оксигенации опухолей и пролиферативной активности опухолевых клеток (Деденков А.Н. и др. Прогнозирование реакции опухолей на лучевую и лекарственную терапию// М.: Медицина, 1987, 159 с.; Diehn M. et al. Association of Reactive Oxygen Species Levels and Radioresistance in Cancer Stem Cells// Nature. 2009. V. 458. N7239. P. 780–783; Быченков О.А. и др. Способ определения радиочувствительности опухоли слизистых оболочек полости рта, RU2387472). В последние годы интенсивно исследуются молекулярно-биологические показатели (профиль генной экспрессии, различные мутации, наличие папиломовирусной инфекции), также влияющие на радиочувствительность опухолей (Rieckmann T. et al. HNSCC cell lines positive for HPV and p16 possess higher cellular radiosensitivity due to an impaired DSB repair capacity// Radiotherapy and Oncology. 2013. V.107, N2. P. 242-246; Beck T.N. et al. Head and neck squamous cell carcinoma: Ambiguous human papillomavirus status, elevated p16, and deleted retinoblastoma 1// Head Neck. 2017. V.39. N3:E34-E39; Foy J.P. et al. A 13-gene expression-based radioresistance score highlights the heterogeneity in the response to radiation therapy across HPV-negative HNSCC molecular subtypes// BMC Med. 2017. V. 15. N1:165).
Известны биомаркеры и методы прогнозирования клинического исхода рака головы и шеи, включающего рак ВДП, на основе таких характеристик опухоли как профиль генной экспрессии (Pradhan S. et al. A chip and a method for head & neck cancer prognosis, WO/2019/220459), экспрессия ряда микроРНК (Ko Y-H. Biomarker microRNA for prediction of prognosis of head and neck cancer, WO/2017/073862), уровень экспрессии p16ink4a и ССND1 (Hayes D. et al. Method for head & neck cancer prognosis, WO/2013/192089), гиперметилирование промоторов ряда генов (Guerrero-Preston R. et al. Hypermethylation biomarkers associated with poor survival outcomes for head & neck squamous cell cancer, WO/2015/066170), мутации гена ТР53 (Lichtarge O. Biological action of missense genotype perturbations on phenotype, WO/2014/007863), белковая экспрессия цитокератина 17 (Shroyer K. et al. Keratin 17 as a biomarker for head & neck cancers, WO/2015/175858). Все указанные методы позволяют прогнозировать общую и (или) безрецидивную выживаемость больных, но в этих источниках нет сведений о возможности прогнозирования степени регрессии ЗНО, которая является непосредственным показателем радиочувствительности опухоли.
Известен способ оценки радиочувствительности рака верхних дыхательных путей (Замулаева И.А. и др. RU 2505817), основанный на определении частоты гемопоэтических стволовых клеток с иммунофенотипом CD34+CD45low в периферической крови больных до лечения.
Однако все вышеупомянутые методы прогнозирования не учитывают наличие в ЗНО фракции опухолевых стволовых клеток (ОСК), которые резистентны к воздействию многих противоопухолевых агентов, включая ионизирующее излучение (Zhu P. et al. Cancer stem cells and tumorigenesis// Biophysics Reports. 2018. V 4. №4. P. 178-188; Lytle N.K. et al. Stem cells fate in cancer growth, progression and therapy resistance// Nature Reviews. 2018. V.18. P. 669-680; Battle E., Clevers H. Cancer stem cells revisited// Nature Medicine. 2017. V.23. N.8. P. 1124-1134; Матчук О.Н. и др. Чувствительность клеток SP линии меланомы B16 к действию редко- и плотноионизирующего излучения// Радиационная биология. Радиоэкология. 2012. Т.52. №3. С. 261-267; Матчук О.Н., Замулаева И.А. Количественные изменения популяции стволовых клеток рака шейки матки линии Hela под влиянием фракционированного γ-облучения in vitro// Радиация и риск. 2019. Т.28. №2. C.112-123). Принимая во внимание резистентность ОСК к противоопухолевой терапии, полагают, что именно ОСК обеспечивают репопуляцию опухолевых клеток в ходе лечения, и именно эти клетки, сохранившие жизнеспособность и пролиферативный потенциал в ходе лучевой и химиотерапии, могут являться причиной развития рецидивов и метастазов после окончания лечения.
Известны различные методы выявления ОСК, которые включают использование лектинов различного происхождения (Carre V., Lacroix A. Method for isolating and detecting cancer stem cells, WO/2018/224761), (Carre V, Lacroix A. Method for isolating and detecting cancer stem cells, WO/2019/171010), (Lacroix A. et al. Method for detecting cancer stem cells, WO/2017/093696), микро РНК (Renaud S. et al. MiRNA as biomarkers and regulators of cancer stem cells, WO/2017/207623), CD133-связывающих аптамеров РНК (Duan W. CD133 aptamers for detection of cancer stem cells, WO/2014/019024), флуоресцентных аналогов глюкозы (Satake N., Nitin N. Methods of selecting and isolating cancer stem cells, WO/2016/073737), маркеров CD 133, CD13, SSA, ST6 GALNAC 1, GCNT3, MGAT 5 (Miyoshi E et al. Method for isolating cancer stem cells, WO/2012/039430), SEMA3C, LOX, GPM6A, HGF/SF, ALDH1 (Dekel B. et al. Identification of cancer stem cell markers and use of same for diagnosis and treatment, WO/2015/198334), Lgr5 или Lgr6 (Clevers J. et al. A Method for identifying, expanding, and removing adult stem cells and cancer stem cells, WO/2009/022907), CD20, CD24, CD34, CD38, CD44, CD45, Cod105, CD133, CD166, EpCAM, ESA, SCA1, Pecam, Stro1 (Gupta P.et al. Methods for identification and use of agents targeting cancer stem cells, WO/2009/126310). В том числе для выявления стволовых клеток рака ВДП используют антитела к поверхностным маркерам СD44 и CD24, при этом детекцию иммунореактивности проводят с помощью методов иммуногистохимии или проточной цитометрии. Известно, что ОСК ВДП характеризуются:
- высокой экспрессией CD44 (CD44+) (Okamoto A. et al. Expansion and characterization of cancer stem-like cells in squamous cell carcinoma of the head and neck//Oral Oncol. 2009. V.45. N7. P.633-639; Prince M.E. et al. Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma//Proc Natl Acad Sci USA. 2007. V.104. N3. P. 973-978; Kokko L.L. et al. Significance of site-specific prognosis of cancer stem cell marker CD44 in head and neck squamous-cell carcinoma//Oral Oncol. 2011. V.47. N6. P. 510-516; Chen J. et al. Significance of CD44 expression in head and neck cancer: a systemic review and meta-analysis// BMC Cancer. 2014. V.14: 15; Chai L. et al. CD44 expression is predictive of poor prognosis in pharyngolaryngeal cancer: systematic review and meta-analysis// Tohoku J Exp Med. 2014. V.232. N1. P. 9-19);
- отсутствием или низкой экспрессией CD24 (CD24-/low) (Chen C. et al. Evidence for epithelial-mesenchymal transition in cancer stem cells of head and neck squamous cell carcinoma//PLoS One. 2011. V. 6. N1:e16466; Chen Y.C. et al. Aldehyde dehydrogenase 1 is a putative marker for cancer stem cells in head and neck squamous cancer//Biochem Biophys Res Commun. 2009. V. 385. N3. P. 307-313; Facompre N. et al. Stem-like cells and therapy resistance in squamous cell carcinomas// Adv Pharmacol. 2012. V. 65. P.235-265; Han J. et al. Identification and characterization of cancer stem cells in human head and neck squamous cell carcinoma// BMC Cancer. 2014. V. 14:173; Modur V. et al. CD24 Expression May Play a Role as a Predictive Indicator and a Modulator of Cisplatin Treatment Response in Head and Neck Squamous Cellular Carcinoma//PLoS One. 2016. V. 11. N6: e0156651; Okamoto A. et al. Expansion and characterization of cancer stem-like cells in squamous cell carcinoma of the head and neck//Oral Oncol. 2009. V.45. N7. P.633-639; Albers A.A. Stem cells in squamous head and neck cancer// Crit Rev Oncol Hematol. 2012. V. 81. N3. P. 224-240).
Поэтому OСК ВДП могут быть выявлены по иммунофенотипу CD44+CD24-/low.
Известны многочисленные данные об ассоциации высокого количества ОСК или высокой экспрессии маркеров, связанных с ОСК, до лечения с низкой выживаемостью больных раком ВДП, что является основой для создания методов прогнозирования агрессивности ЗНО и эффективности лечения таких больных (Chen J. et al. Significance of CD44 expression in head and neck cancer: a systemic review and meta-analysis// BMC Cancer. 2014. V.14:15; Kokko L.L. et al. Significance of site-specific prognosis of cancer stem cell marker CD44 in head and neck squamous-cell carcinoma//Oral Oncol. 2011. V.47. N6. P. 510-516; Chai L. et al. CD44 expression is predictive of poor prognosis in pharyngolaryngeal cancer: systematic review and meta-analysis//Tohoku J Exp Med. 2014. V.232. N1. P. 9-19; van der Heijden M. et al. Biological Determinants of Chemo-Radiotherapy Response in HPV-Negative Head and Neck Cancer: A Multicentric External Validation// Front Oncol. 2020. V.9:1470; Qian X. et al. Prognostic significance of ALDH1A1-positive cancer stem cells in patients with locally advanced, metastasized head and neck squamous cell carcinoma// J Cancer Res Clin Oncol. 2014. V. 140. N7. P.1151-1158; Szafarowski T. et al. Assessment of cancer stem cell marker expression in primary head and neck squamous cell carcinoma shows prognostic value for aldehyde dehydrogenase (ALDH1A1)//Eur J Pharmacol. 2020. V. 867:172837; Athanassiou-Papaefthymiou M. et al. Evaluation of CD44 variant expression in oral, head and neck squamous cell carcinomas using a triple approach and its clinical significance//Int J Immunopathol Pharmacol. 2014. V. 27. N3. P. 337-349; Linge A. et al. HPV status, cancer stem cell marker expression, hypoxia gene signatures and tumour volume identify good prognosis subgroups in patients with HNSCC after primary radiochemotherapy: A multicentre retrospective study of the German Cancer Consortium Radiation Oncology Group (DKTK-ROG)// Radiother Oncol. 2016. V.121. N3. P. 364-373).
Однако, цитированные выше методы, основанные на количественной оценке ОСК в ЗНО ВДП до лечения, позволяют прогнозировать общую и (или) безрецидивную выживаемость больных, но не степень регрессии ЗНО, которая является непосредственным показателем радиочувствительности опухоли. Кроме того, эти методы не учитывают реакцию пула ОСК на лечебное воздействие.
Прототипом предлагаемого технического решения является способ прогнозирования результатов радиохимиотерапии местнораспространенного рака головы и шеи, включая рак гортани, гортаноглотки, носоглотки, ротоглотки, околоушной железы, по экспрессии маркера CD44 до лечения (Koukourakis M.I. et al. Cancer stem cell phenotype relates to radio-chemotherapy outcome in locally advanced squamous cell head–neck cancer// British Journal of Cancer. 2012. V. 106. P. 846-853). Группу исследования составляли больные с неоперабельными опухолями или с рецидивами заболевания, которым проводили платиносодержащую химиотерапию и радиотерапию в режиме гипофракционирования дозы (2,7 Гр х 20-22 фракции в течение 4-5 недель) с ежедневным введением цитопротекторного средства Амифостин. В биопсином материале 74 больных до лечения оценивали экспрессию ряда мембранных и цитоплазматических маркеров стволового состояния клеток (СD44, CD24, ALDH1, Oct4 и др.) с помощью метода иммуногистохимии. Через 2-4 месяца после завершения радиохимиотерапии оценивали ответ опухоли (первичного очага и лимфатических узлов) на лечение, разделяя больных на 2 группы с полным или неполным ответом по данным компьютерной томографии. Высокая доля CD44+ клеток до лечения и стадия N+ были статистически значимо ассоциированы с неполным ответом (р=0,04), причем оба параметра имели независимое прогностическое значение. Кроме того, экспрессия CD44 и ряд других биологических и клинико-морфологических параметров имели прогностическое значение в отношении безрецидивной выживаемости. Экспрессия СD24 не имела прогностического значения ни в отношении ближайших, ни в отношении отдаленных результатов лечения.
Однако в работе не проводилось одновременного определения экспрессии CD44 и CD24 на одних и тех же клетках, поэтому прогностическое значение количества клеток с иммунофенотипом CD44+CD24-/low до лечения не изучалось, как не изучалось и прогностическое значение ответа этих клеток в ходе лечения. В работе также не приводится сведений о чувствительности и специфичности методов прогнозирования ответа опухоли на лечение или безрецидивной выживаемости ни по одному из изученных показателей, в том числе по экспрессии CD44. Важно, что все оценки прогностического значения CD44+ клеток относятся к гипофракционированному облучению неоперабельных или рецидивных опухолей. Прогностическое значение этих клеток при использовании стандартных режимов фракционирования дозы (по 2,0Гр на фракцию) для лечения первичных операбельных опухолей не выяснялось.
Техническим результатом заявленного изобретения является прогнозирование радиочувствительности ЗНО ВДП на основе радиационного ответа популяции ОСК после первых сеансов лучевой терапии и формировании группы больных с неблагоприятным прогнозом результатов лечения по критерию низкой степени регрессии опухоли.
Указанный технический результат достигается тем, что также как и в известном способе получают биопсийные образцы опухолевой ткани до лечения и оценку экспрессии CD44 и CD24 с использованием моноклональных антител.
Особенностью заявляемого способа является то, что относительное количество опухолевых стволовых клеток определяют после облучения в суммарной очаговой дозе 10Гр и сравнивают с таковым до лечения, затем по изменению этого показателя прогнозируют степень регрессии новообразования под действием ионизирующего излучения, и если:
- относительное количество опухолевых стволовых клеток увеличивается более чем на 1% по сравнению с их исходным количеством до лечения, то прогнозируют низкую радиочувствительность опухоли;
- относительное количество опухолевых стволовых клеток увеличивается не более чем на 1% включительно, сохраняется на одинаковом уровне или уменьшается по сравнению с исходным количеством этих клеток до лечения, то прогнозируют высокую радиочувствительность опухоли.
Сущность изобретения заключается в том, что у больного раком ВДП берут биопсийный материал опухолевой ткани до лечения и после первых пяти сеансов лучевой терапии в режиме стандартного фракционирования дозы, т.е. после облучения в суммарной очаговой дозе (СОД) 10 Гр, определяют относительное количество CD44+CD24-/low ОСК и оценивают его изменение, по которому прогнозируют характер реакции ЗНО на лучевую или химиолучевую терапию. Так, если в биопсийном материале больного после облучения в СОД 10Гр наблюдается сильное увеличение относительного количества ОСК (выше 1,0 %) по сравнению с исходным уровнем до лечения, то прогнозируют низкую радиочувствительность опухоли (т.е. низкую степень её регрессии - менее 50% - по завершении первого этапа лучевой терапии в СОД 45-50 Гр). Если наблюдается уменьшение, сохранение на исходном уровне или слабое увеличение (до 1% включительно) относительного количества ОСК, то прогнозируют высокую радиочувствительность опухоли (т.е. высокую степень её регрессии - 50% и более).
Изобретение поясняется подробным описанием, примерами выполнения и иллюстрациями, на которых изображено:
Фиг. 1 - Точечный график распределения клеток биопсийного материала рака ВДП по интенсивности окрашивания антителами к CD45, меченными конъюгатом фикоэритрина c цианином-5 (ФЭ-Сy5), и ДНК-связывающим красителем Хёхст33342 (R1 – регион ядросодержащих клеток, не связывающих антитела к CD45).
Фиг. 2 – Точечные графики распределения клеток, взятых из региона R1 (фиг. 1), по интенсивности связывания антител к CD44 и CD24, меченных флуоресцеинизотиоцианатом (ФИТЦ) и ФЭ, соответственно. Представлены образцы двух опухолей с низким (А) и высоким (Б) относительным количеством искомых CD44+CD24-/low клеток.
R2- регион клеток с иммунофенотипом CD44+CD24low, R3- регион CD44+CD24- клеток.
Фиг. 3 – Распределение биопсийных образцов рака ВДП до лечения по относительному количеству CD44+CD24-/low ОСК.
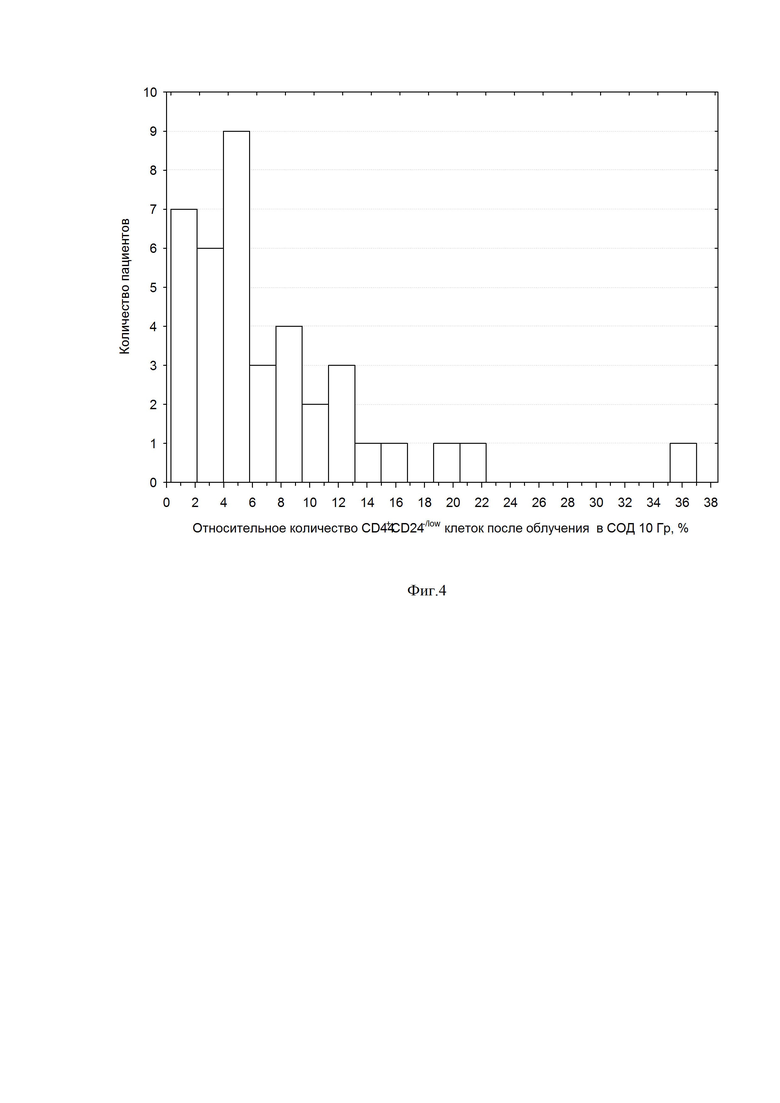
Фиг. 4 – Распределение биопсийных образцов рака ВДП после облучения в СОД 10Гр по относительному количеству CD44+CD24-/low ОСК.
Фиг. 5 – Распределение биопсийных образцов рака ВДП по изменению относительного количества CD44+CD24-/low ОСК после облучения в СОД 10Гр. По оси абсцисс показана разность: (относительное количество ОСК после лечения, %) – (относительное количество ОСК до лечения, %). Таким образом, положительные величины указывают на повышение относительного количества ОСК после облучения, отрицательные – на уменьшение этого показателя.
Способ осуществляют в несколько этапов.
I этап.
Сбор образцов и окрашивание клеток биопсийного материала больных раком ВДП с помощью моноклональных антител (МКАТ), меченных флуорохромами, и ДНК-связывающего красителя выполняют следующим образом:
- после местной аппликационной анестезии 10% раствором лидокаина в форме спрея, с использованием биопсийных щипцов Блексли, под видео-эндоскопическим контролем берут наиболее выраженные фрагменты опухолевой ткани объёмом не менее 1мм3;
- биопсийный материал помещают во флакон с полной питательной средой RPMI, содержащей 10% эмбриональной телячьей сыворотки. С помощью механического измельчения биопсийного материала получают суспензию опухолевых клеток, в которую добавляют 0,5 мл 0,01М фосфатного солевого буфера (ФСБ), рН 7,2, содержащего 0,15 М NаCl, тщательно перемешивают и фильтруют через нейлоновый фильтр с диаметром пор 40 мкм;
- определяют концентрацию ядросодержащих клеток в суспензии с помощью камеры Горяева по стандартной методике. Из каждого образца полученной суспензии отбирают 2 аликвоты по 105 клеток;
- в маркированную пробирку вносят аликвоту клеток и МКАТ к CD44, меченные ФИТЦ, к CD24, меченные ФЭ, и к CD45, меченные фикоэритрином-Cy5 (Becton Dickinson - BD, США) из расчета по 20 мкл МКАТ на 1 млн. ядросодержащих клеток. Вторую аликвоту клеток используют для контроля неспецифического связывания с МКАТ к гемоцианину Fissurella того же изотипа и меченные теми же флуорохромами, что и специфические антитела к указанным выше поверхностным маркерам. Контрольные МКАТ добавляют также из расчета по 20 мкл на 1 млн. ядросодержащих клеток. Обе пробы инкубируют при комнатной температуре в темноте в течение 30 минут;
- производят двукратное отмывание клеток суспензии от не связавшихся антител в 1 мл ФСБ, с помощью центрифугирования (300хg в течение 5 минут);
- в пробирку с осадком вносят 200 мкл ФСБ и ДНК-связывающий краситель Хехст 33342 в конечной концентрации 6,25 мкг/мл. Смесь перемешивают и инкубируют в темноте в течение 15 минут;
- суспензию окрашенных клеток фильтруют через нейлоновый фильтр с диаметром пор 40 мкм.
II этап.
Получение данных с помощью проточной цитометрии выполняют следующим образом:
- образец, подготовленный как описано на I этапе, анализируют на проточном цитофлуориметре FACS Vantage (BD, США), оснащенном лазерами с длиной волны 364 и 488 нм, или на других проточных цитофлуориметрах с указанными характеристиками;
- для измерения флуоресценции ФИТЦа используют узкополосные фильтры 530/30 нм, для ФЭ – 575/30 нм, для Хехста 33342 – 424/20 нм;
- в каждом образце анализируют до 100 тысяч клеток. Данные об интенсивности прямого и бокового светорассеяния, флуоресценции ФИТЦа, ФЭ, ФЭ-Cy5 и Хехста 33342 сохраняют файл. Полученные результаты записывают в цифровом виде;
- сохраненные файлы обрабатывают с помощью программы CellQuestPro (BD, USA) или другого программного обеспечения с необходимыми характеристиками.
III этап.
Обработка данных, собранных с помощью проточной цитометрии, в соответствии с алгоритмом идентификации ОСК по следующим критериям:
- сильная экспрессия маркера CD44 (СD44+);
- отсутствие или слабая экспрессия маркера CD24 (СD24-/low);
- отсутствие экспрессии общелейкоцитарного маркера СD45 (СD45-), что позволяет провести отрицательную селекцию лейкоцитов и повысить точность количественного анализа ОСК;
- интенсивное окрашивание Хёхстом33342 (Хёхст+), что позволяет дифференцировать ядросодержащие клетки от дебриса, эритроцитов, конгломератов тромбоцитов и др. неспецифических событий, что в конечном итоге обеспечивает высокую точность количественного анализа ОСК.
В частности, анализ проточноцитометрических данных с целью выявления и определения относительного количества ОСК в биопсии включает:
- построение точечного графика распределения клеток по интенсивности флуоресценции МКАТ к CD45 и интенсивности флуоресценции Хёхста 33342 (Фиг. 1). На графике выделяют регион ядросодержащих клеток (R1), характеризующихся отсутствием флуоресценции маркера CD45;
- построение точечного графика распределения клеток по интенсивности флуоресценции МКАТ к CD44 и CD24 (Фиг. 2). График строят только для клеток, удовлетворяющих условиям R1. На графике выделяют регионы клеток (R2 и R3) c иммунофенотипами CD44+CD24- и CD44+CD24low, соответственно, учитывая флуоресценцию клеток в контроле неспецифического связывания. Далее определяют количество клеток в регионах R2 и R3;
- расчет относительного количества ОСК, выражаемого в процентах, путем деления суммарного количества клеток в R2 и R3 на число клеток в R1.
Таким образом, определяют относительное количество CD44+CD24-/low ОСК среди CD45-Хёхст+ ядросодержащих клеток.
IV этап.
Прогнозирование радиочувствительности опухоли осуществляют следующим образом:
- сравнивают относительное количество ОСК, вычисленное на III этапе до лечения и после облучения в СОД 10Гр;
- если относительное количество ОСК в биопсии больного после облучения в СОД
10Гр более чем на 1% выше по сравнению с таковым до лечения (т.е. под влиянием радиационного воздействия происходит достаточно сильное увеличение относительного количества ОСК), прогнозируют низкую радиочувствительность опухоли, поскольку сильное увеличение количества ОСК происходит у 91% больных с низкой регрессией опухоли (<50%) после завершения первого этапа лучевой терапии в СОД 45-50Гр;
- если относительное количество ОСК в биопсии больного после облучения в СОД
10Гр увеличивается относительно слабо (на 1% и менее), остается без изменений или уменьшается по сравнению с таковым до лечения, вероятность высокой регрессии опухоли (≥50%) после завершения первого этапа лучевой терапии в СОД 45-50Гр составляет 92%, поэтому прогнозируется высокая радиочувствительность опухоли.
Способ иллюстрируется следующими примерами выполнения.
Пример №1 - Относительное количество ОСК в биопсийном материале рака ВДП до лечения в общей группе больных, а также в подгруппах больных с разными клинико-морфологическими показателями опухолевого процесса и степенью регрессии опухоли.
Относительное количество ОСК определено у 123 больных раком ВДП до лечения. Больные были госпитализированы в отделение лучевого и хирургического лечения заболеваний верхних дыхательных путей (отдел лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им.А.Ф. Цыба - филиал ФГБУ НМИЦ радиологии Минздрава России) в 2010-2014 годах. Средний возраст (±SE) больных составил 57,2±0,8 лет. Плоскоклеточный рак был верифицирован гистологически у всех больных, при этом у 36% больных диагностирован неороговевающий рак, у 43% - ороговевающий, у 18%- другие гистотипы плоскоклеточного рака. Стадия Т1 наблюдалась у 7, Т2- у 41,Т3- у 51 и Т4-у 24 больных. Регионарные лимфатические узлы были вовлечены в опухолевый процесс у 63 больных (N+), у остальных больных признаков поражения лимфатических узлов не отмечено (N0). Все больные, кроме одного, находились в стадии М0.
У всех больных лечение начинали с проведения одновременной химиолучевой терапии (схема PF). В схеме полихимиотерапии применялись два препарата – цисплатин и 5-фторурацил. В первый день лечения, до начала лучевой терапии, на фоне гипергидратации внутривенно вводили цисплатин из расчета 100 мг/м2 площади поверхности тела. Затем больному начинали внутривенное введение 5-фторурацила в дозе 3000 мг непрерывно в течение 72 часов при помощи инфузионного шприцевого насоса. Лучевую терапию начинали одновременно с непрерывным введением 5-фторурацила. Цикл химиотерапии повторяли на 22-й день лечения. Пациентам с неполной регрессий регионарных метастазов выполнялось плановое иссечение лимфоузлов через 4-6 недель после завершения химиолучевой терапии. В случае выявления остаточной опухоли либо локального рецидива больным выполнялось хирургическое вмешательство, объем которого определялся распространенностью новообразования.
Облучение осуществлялось на гамма-терапевтических установках. Для проведения дистанционной лучевой терапии на область первичной опухоли была применена методика облучения по 2 Гр пять раз в неделю.
После облучения в СОД 45-50 Гр определяли степень регрессии опухоли. При низкой степени регрессии опухоли (менее 50%) радиочувствительность опухоли расценивали как низкую, лучевую терапию прерывали и осуществляли хирургическое лечение. При выраженной регрессии опухоли (более 50%), лучевую терапию продолжали до СОД 60-62 Гр. При развитии лучевых эпителиитов делали вынужденный перерыв на 10-12 дней. Всего за курс лечения проводили 2 цикла полихимиотерапии.
На Фиг. 3 видно распределение относительного количества ОСК в общей группе больных до лечения. Этот показатель широко варьировал от 0,1 до 26,8 %. Данные об относительном количестве ОСК не подчинялись нормальному распределению (по критерию Шапиро-Уилка), поэтому в дальнейшем для описательной статистики этого показателя использовались значения медианы и размах квартилей (Q1-Q3), а сравнение этого показателя в подгруппах больных проводилось по непараметрическому критерию Манна-Уитни. Различия считали статистически значимыми при р<0,05.
В таблице 1 указано относительное количество ОСК в подгруппах больных с различными клинико-морфологическими показателями опухолевого процесса. Не обнаружено значимых различий относительного количества CD44+CD24-/low клеток у больных до лечения при разных стадиях заболевания, гистологических типах опухоли, поражении регионарных лимфатических узлов (таблица 1). Относительное количество ОСК до лечения статистически значимо не отличалось при разной степени регрессии (радиочувствительности) опухолей, составляя по медиане 4,1% в случаях высокой степени регрессии опухоли (≥50%) и 2,6% в случаях низкой регрессии (р=0,07).
Таблица 1.
Сравнение относительного количества CD44+CD24-/low клеток в биоптатах больных ВДП до лечения в подгруппах с различными клинико-морфологическими показателями опухолевого процесса
CD44+CD24-/low клеток, %
Медиана (Q1÷Q3)
Пример №2 - Относительное количество ОСК в биопсийном материале рака ВДП после облучения в СОД 10Гр на фоне полихимиотерапии в общей группе больных, а также в подгруппах больных с различными клинико-морфологическими показателями опухолевого процесса и степенью регрессии опухоли.
Относительное количество ОСК определено у 39 больных после облучения в СОД 10Гр. Больные были госпитализированы в то же отделение лучевого и хирургического лечения заболеваний верхних дыхательных путей (как в примере 1) в 2010-2014 годах.
Средний возраст (±SE) больных составил 59,4±1,1% лет. Плоскоклеточный рак был верифицирован гистологически у всех больных, при этом у 28,2% больных диагностирован неороговевающий рак, у 35,9% - ороговевающий. Стадия Т1 наблюдалась у 5, Т2 - у 13, Т3 - у 10, Т4 -у 11 больных. Регионарные лимфатические узлы были вовлечены в опухолевый процесс у 22 больных, у остальных больных признаков поражения лимфатических узлов не отмечено. Все больные находились в стадии М0.
Лечение больных и оценку радиочувствительности опухоли по степени её регрессии в ответ на лечение выполняли, аналогично примеру 1.
Распределение относительного количества ОСК в общей группе больных после облучения в СОД 10Гр иллюстрируется на Фиг. 4. Этот показатель широко варьировал от 0,3 до 37%. Как и до лечения, данные об относительном количестве ОСК после облучения не подчинялись нормальному распределению (по критерию Шапиро-Уилка), поэтому для описательной статистики этого показателя также использовались значения медианы и размах квартилей (Q1-Q3), а сравнение этого показателя в подгруппах больных проводилось по непараметрическому критерию Манна-Уитни.
Не обнаружено значимых различий пострадиационного количества ОСК при разных стадиях заболевания, гистологических типах опухоли, поражении регионарных лимфатических узлов (таблица 2). Важно, что относительное количество ОСК после облучения не отличалось при разной степени регрессии (радиочувствительности) опухолей: медиана этого показателя составляла 5,4% в случаях высокой степени (≥50%) регрессии опухоли и 5,0% в случаях низкой (< 50% ) регрессии (р=0,46).
Таблица 2.
Сравнение относительного количества CD44+CD24-/low клеток в биоптатах больных ВДП после облучения в СОД 10 Гр в подгруппах с различными
клинико-морфологическими показателями опухолевого процесса
Показатели
Mедиана (Q1÷Q3)
Пример №3 - Изменение относительного количества ОСК в биопсийном материале рака ВДП после облучения в СОД 10Гр в общей группе больных, а также в подгруппах больных с различными клинико-морфологическими показателями опухолевого процесса и степенью регрессии опухоли.
Относительное количество ОСК до лечения и после облучения в СОД 10 Гр сравнивали в группе 39 больных, подробно описанной в примере 2. Лечение больных и оценку радиочувствительности опухоли по степени её регрессии в ответ на лечение выполняли аналогично по примеру 1.
Изменение относительного количества ОСК в общей группе больных после облучения в СОД 10Гр иллюстрируется Фиг. 5. Данные о пострадиационном изменении относительного количества ОСК характеризовались нормальным распределением (по критерию Шапиро-Уилка), поэтому для описательной статистики этого показателя использовались средние значения и стандартные ошибки (±SE), а сравнение изменений пула ОСК в подгруппах больных проводилось по критерию Стьюдента. Установлена высокая индивидуальная вариабельность изменений относительного количества ОСК в биопсийном материале больных после облучения в СОД 10Гр: от уменьшения на 23,7% до увеличения на 36,1%, в среднем этот показатель увеличивался на 2,7±1,3%. У 76,9% больных (30/39) отмечено увеличение относительного количества ОСК после указанного воздействия по сравнению с исходным уровнем. Причем у 66,7% больных (26/39) относительное количество ОСК увеличивалось более чем на 1,0%. Величина изменений этого показателя после облучения в СОД 10 Гр не коррелировала с клинико-морфологическими показателями (таблица 3).
При сравнении изменений пула ОСК в подгруппах больных c разной степенью регрессии (радиочувствительностью) опухоли показано:
- в подгруппе 28 больных с высокой степенью регрессией опухоли (более 50%) среднее
количество ОСК статистически значимо не изменялось после облучения, составляя 5,0±1,1% до лечения и 6,2±0,8% после радиационного воздействия в дозе 10Гр (р=0,37);
- в подгруппе 11 больных с низкой регрессией опухоли среднее количество ОСК
статистически значимо увеличивалось после облучения на 6,6±3,4%, составляя 3,8±1,5% до лечения и 10,4±3,3% после него (р=0,007).
Таким образом, в результате проведенного проспективного исследования был обнаружен разный ответ пула ОСК на первые сеансы облучения в СОД 10Гр в опухолях с высокой и низкой степенью регрессии, оцениваемой после облучения в СОД 45-50Гр. При высокой степени регрессии опухолей относительное количество ОСК в среднем не изменялось статистически значимо, свидетельствуя о примерно одинаковой радиочувствительности опухолевых стволовых и не стволовых клеток. В то же время в опухолях с низкой радиочувствительностью ОСК демонстрировали более высокую радиорезистентность по сравнению с остальными клетками, поскольку относительное количество ОСК в среднем увеличивалось.
Таблица 3.
Изменение относительного количества CD44+CD24-/low клеток в биоптатах больных раком ВДП после облучения в СОД 10 Гр в подгруппах с различными клинико-морфологическими показателями опухолевого процесса
Среднее ±SE
0,29**
* При сравнении подгрупп больных с ороговевающим и неороговевающим раком.
**При сравнении подгрупп больных с ороговевающим раком и другими гистологическими типами.
Пример 4 - ROC-анализ эффективности (специфичности и чувствительности) способа прогнозирования радиочувствительности ЗНО ВДП по критерию изменения относительного количества ОСК после облучения в СОД 10Гр.
В группе 39 больных, описанной в примерах 2 и 3, методом ROC-анализа установлен оптимальный дискриминатор (для показателя «Изменение относительного количества ОСК после облучения в СОД 10Гр»), разделяющий пациентов на группы с относительно высокой и низкой вероятностью неблагоприятного результата лечения (низкой радиочувствительностью опухоли). Оказалось, что при уменьшении, сохранении на одном уровне или слабом увеличении (до 1% включительно) исходного количества ОСК низкая радиочувствительность опухоли отмечается только у 1/13 (7,7%) больных, в то время как при сильном увеличении этого показателя более чем на 1% - у 10/26 (38,5%) больных, т.е. в 5 раз чаще (р=0,046 по критерию Фишера) (таблица 4).
Чувствительность такого способа прогнозирования низкой радиочувствительности опухоли составляет 0,91 (95% доверительный интервал 0,62-0,98), специфичность – 0,43 (95% доверительный интервал 0,28-0,58), положительная прогностическая значимость – 0,38, отрицательная прогностическая значимость – 0,92. Величина AUC (area under curve), характеризующая прогностическую эффективность показателя, равна 0,67, что позволяет расценивать изменение количества ОСК после облучения в СОД 10Гр как средний по мощности классификатор.
Таблица 4.
Сопоставление характера изменений относительного количества ОСК после облучения в СОД 10 Гр (по сравнению с исходным значением до лечения) у больных раком ВДП с высокой и низкой радиочувствительностью опухоли, определенной по степени её регрессии (в таблице указано число больных)
Пример 5 - Множественный регрессионный анализ радиочувствительности ЗНО ВДП с помощью программы Статистика 6.0 (Stat Soft, Inc., США).
В группе 39 больных, описанной в примерах 2-4, выполнен множественный регрессионный анализ зависимости радиочувствительности опухоли (степени регрессии первичного опухолевого очага) от ряда возможных предикторов, включающих возраст больного, стадию заболевания Т1-4, поражение регионарных лимфатических узлов (N+/N0), гистологический тип (ороговевающий/неороговевающий/другие типы плоскоклеточного рака), а также относительное количество ОСК до лечения, относительное количество ОСК после облучения в СОД 10Гр, изменение относительного количества ОСК после облучения в СОД 10Гр (сильное увеличение/ слабое увеличение, сохранение на исходном уровне или уменьшение в соответствии с таблицей 4). Три показателя, продемонстрировавшие наиболее сильную взаимосвязь с регрессией опухоли, были выбраны для построения модели множественной регрессии: изменение относительного количества ОСК после облучения в СОД 10Гр, стадия Т и гистологический тип опухоли. Как показано в таблице 5, модель в целом характеризовалась статистической значимостью при р=0,03, причем только один показатель (изменение относительного количества ОСК после облучения в СОД 10Гр) имел независимое прогностическое значение для радиочувствительности опухоли.
Таблица 5.
Результаты множественного регрессионного анализа зависимости радиочувствительности опухоли от изменения относительного количества ОСК после облучения в СОД 10Гр, стадии заболевания и гистологического типа опухоли
Примечание: Beta - стандартизированный угловой коэффициент регрессии (в единицах SD), R - коэффициент множественной корреляции.
Доказательство достижения технического результата.
Как показывают примеры 1-3, существует высокая индивидуальная вариабельность относительного количества CD44+CD24-/low ОСК до лечения, после облучения в СОД 10 Гр и, как следствие, изменений этого показателя под влиянием первых сеансов лучевой терапии, что лежит в основе данного способа прогнозирования радиочувствительности опухолей. Причем все 3 показателя не ассоциированы с клинико-морфологическими характеристиками опухолевого процесса.
Пример 4 доказывает, что при повышении относительного количества ОСК более чем на 1% после облучения в дозе 10 Гр в 5 раз чаще отмечается низкая радиочувствительность опухоли (которая регистрируется по низкой степени её регрессии после завершения первого этапа химиолучевой терапии), чем при уменьшении количества ОСК, сохранении на исходном уровне или слабом увеличении (до 1% включительно) (р=0,046). Интегральный показатель (AUC) чувствительности и специфичности такого способа прогнозирования радиочувствительности опухоли составляет 0,67.
Пример 5 подтверждает прогностическое значение показателя «Изменение относительного количества ОСК после облучения в СОД 10Гр» с помощью множественного регрессионного анализа. Более того, именно этот показатель имеет независимое и большее прогностическое значение, чем стадия заболевания и гистологический тип опухоли.
Предложенный способ повышает точность оценки показаний к проведению лучевой терапии больных раком ВДП и, таким образом, улучшает планирование лечения. Кроме того, выявление пациентов с ЗНО, резистентными к стандартным вариантам радиационного воздействия, способствует разработке оптимальной стратегии их лечения, включая использование особых режимов фракционирования дозы редкоионизирующего излучения, использование адронной терапии, комбинированных методов лечения и т.д.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ РАДИОЧУВСТВИТЕЛЬНОСТИ РАКА ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2012 |
|
RU2505817C1 |
| Способ подавления индуцирующего действия высокомолекулярной гиалуроновой кислоты на стволовые клетки рака молочной железы | 2021 |
|
RU2774031C1 |
| СПОСОБ ИНГИБИРОВАНИЯ РАДИАЦИОННО-ИНДУЦИРОВАННОГО УВЕЛИЧЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2800366C2 |
| СПОСОБ СНИЖЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК АДЕНОКАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2798550C2 |
| СПОСОБ СНИЖЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2018 |
|
RU2702910C2 |
| СПОСОБ СНИЖЕНИЯ КЛОНОГЕННОЙ АКТИВНОСТИ СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2019 |
|
RU2700695C2 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ДЕЙСТВИЯ ПРОТОННОЙ ТЕРАПИИ НА СТВОЛОВЫЕ КЛЕТКИ МЕЛАНОМЫ | 2022 |
|
RU2798733C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ МЕСТНО-РАСПРОСТРАНЕННЫМ РАКОМ ГЛОТКИ | 2005 |
|
RU2289364C1 |
| Способ лечения местно-распространенного рака ротоглотки | 2020 |
|
RU2739294C1 |
| Способ прогнозирования эффективности таргетной терапии цетуксимабом у больных плоскоклеточным раком языка и слизистой дна полости рта | 2019 |
|
RU2713453C1 |



Изобретение относится к медицине, в частности к онкологии и радиологии, и раскрывает способ прогнозирования радиочувствительности рака верхних дыхательных путей. Способ включает окрашивание суспензии биопсийных клеток с использованием моноклональных антител к CD44, CD24, CD45 и ДНК-связывающего красителя Хёхст33342, с помощью проточной цитометрии выявляют опухолевые стволовые клетки с иммунофенотипом CD44+CD24-/low и определяют их относительное количество среди ядросодержащих СD45-Хёхст33342+ клеток, затем сравнивают относительное количество опухолевых стволовых клеток до лечения и после облучения в дозе 10 Гр, далее по изменению этого показателя прогнозируют степень регрессии новообразования под действием ионизирующего излучения. Предложенный способ повышает точность оценки показаний к проведению лучевой терапии больных раком ВДП и может быть использовано для прогнозирования индивидуальной радиочувствительности злокачественных новообразований верхних дыхательных путей на начальных этапах лучевой и химиолучевой терапии. 5 пр., 5 табл., 5 ил.
Способ прогнозирования радиочувствительности рака верхних дыхательных путей, включающий получение биопсийных образцов опухолевой ткани до лечения и оценку экспрессии CD44 и CD24 с использованием моноклональных антител, отличающийся тем, что биопсийный материал до лечения и после облучения в суммарной очаговой дозе 10 Гр дезагрегируют, полученную суспензию клеток окрашивают с использованием моноклональных антител к CD44, CD24, CD45 и ДНК-связывающего красителя Хёхст33342, с помощью проточной цитометрии выявляют опухолевые стволовые клетки с иммунофенотипом CD44+CD24-/low и определяют их относительное количество среди ядросодержащих СD45-Хёхст33342+ клеток, затем сравнивают относительное количество опухолевых стволовых клеток до лечения и после облучения в дозе 10 Гр, далее по изменению этого показателя прогнозируют степень регрессии новообразования под действием ионизирующего излучения, и если:
- относительное количество опухолевых стволовых клеток увеличивается более чем на 1% по сравнению с их исходным количеством до лечения, то прогнозируют низкую радиочувствительность опухоли;
- относительное количество опухолевых стволовых клеток увеличивается не более чем на 1% включительно, сохраняется на одинаковом уровне или уменьшается по сравнению с исходным количеством этих клеток до лечения, то прогнозируют высокую радиочувствительность опухоли.
| Koukourakis M.I | |||
| et al | |||
| Cancer stem cell phenotype relates to radio-chemotherapy outcome in locally advanced squamous cell head-neck cancer// British Journal of Cancer | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| V | |||
| Светоэлектрический измеритель длин и площадей | 1919 |
|
SU106A1 |
| P | |||
| Способ осахаривания древесных опилок | 1922 |
|
SU846A1 |
| СПОСОБ ОЦЕНКИ РАДИОЧУВСТВИТЕЛЬНОСТИ РАКА ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2012 |
|
RU2505817C1 |
| JP 5352037 B2, 27.11.2013 | |||
| СПОСОБ ДИАГНОСТИКИ РЕАКЦИИ ОПУХОЛИ ПРИ ЛЕЧЕНИИ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ | 1996 |
|
RU2107297C1 |
Авторы
Даты
2020-11-11—Публикация
2020-06-02—Подача