Уровень техники
[0001] Перфузия центральной полости (например, грудной клетки) и изменения такой перфузии в пациенте являются чрезвычайно полезной информацией при оценке состояния сердечно-сосудистой системы пациента. Предпринимались многочисленные попытки выполнения количественной оценки перфузии центральной полости. Однако существующие системы и способы количественной оценки перфузии центральной полости являются неэффективными, трудоемкими и/или инвазивными. Например, способ торакального импеданса требует установки на теле пациента дополнительных датчиков с полосками лейкопластыря/проводами. Для выполнения количественной оценки перфузии центральной полости можно также использовать допплеровскую флоуметрию, но она не позволяет проводить непрерывное измерение, поскольку соответствующее оборудование является габаритным, дорогим и требует оперативного управления врача. Для расчета перфузии и получения данных об объемной скорости кровотока сердца можно также использовать измерения центрального венозного давления (ЦВД), но для этого необходимо применять инвазивный катетер.
В US 5,178,154 А раскрыто, что показатели сердечной деятельности пациента можно получить из обнаруженных изменений его торакального импеданса. Возбуждающий сигнал прикладывается через первую пару электродов, установленных на лбу и на туловище пациента. Напряжение, приложенное к другой паре электродов, расположенных между первой парой электродов, измеряется для получения первого сигнала, представляющего собой импеданс. Производная первого сигнала дает второй сигнал. Образцы второго сигнала, взятые на протяжении нескольких циклов сердечной деятельности, представляют собой множество, усредненное для минимизации артефактов дыхательных движений. Для получения сегментов второго сигнала, которые появляются во время разных циклов сердечной деятельности, используются различные критерии, например, соотношение между электрокардиографическим сигналом и вторым сигналом. Образцы полученных сегментов второго сигнала для нескольких циклов сердечной деятельности усредняются по множеству для минимизации артефактов дыхательных движений. Данные такого усредненного множества используются для расчета систолического объема сердца и объемной скорости кровотока.
В US 2012/0172730 А1 утверждается, что существующие мониторы апноэ пропускают большое количество серьезных событий, поскольку не могут надлежащим образом отличить сигнал сердца в импедансе грудной клетки от дыхательного сигнала. При этом в US 2012/0172730 А1 раскрывается система и способ дыхательного мониторинга для улучшения выявления и реагирования на апноэ, в частности, в отделении интенсивной терапии новорожденных. Согласно способу выполняют отфильтровывание из импеданса грудной клетки части, которая дает биение сердца человека, и затем в отфильтрованном сигнале импеданса грудной клетки в режиме реального времени выявляют значительные периоды замирания дыхания и определяет вероятность апноэ. Если вероятность апноэ превышает пороговое значение, может быть выполнена стимуляция страдающего апноэ воздействием в автоматическом режиме, например, с помощью виброматраса или вентилятора.
Краткое описание чертежей
[0002] Фиг. 1 показывает блок-схему системы в соответствии с типовым вариантом реализации настоящего изобретения.
[0003] Фиг. 2 показывает блок-схему способа в соответствии с типовым вариантом реализации настоящего изобретения.
[0004] Фиг. 3 показывает график типового волнового сигнала частоты дыхательных движений пациента на основе импеданса.
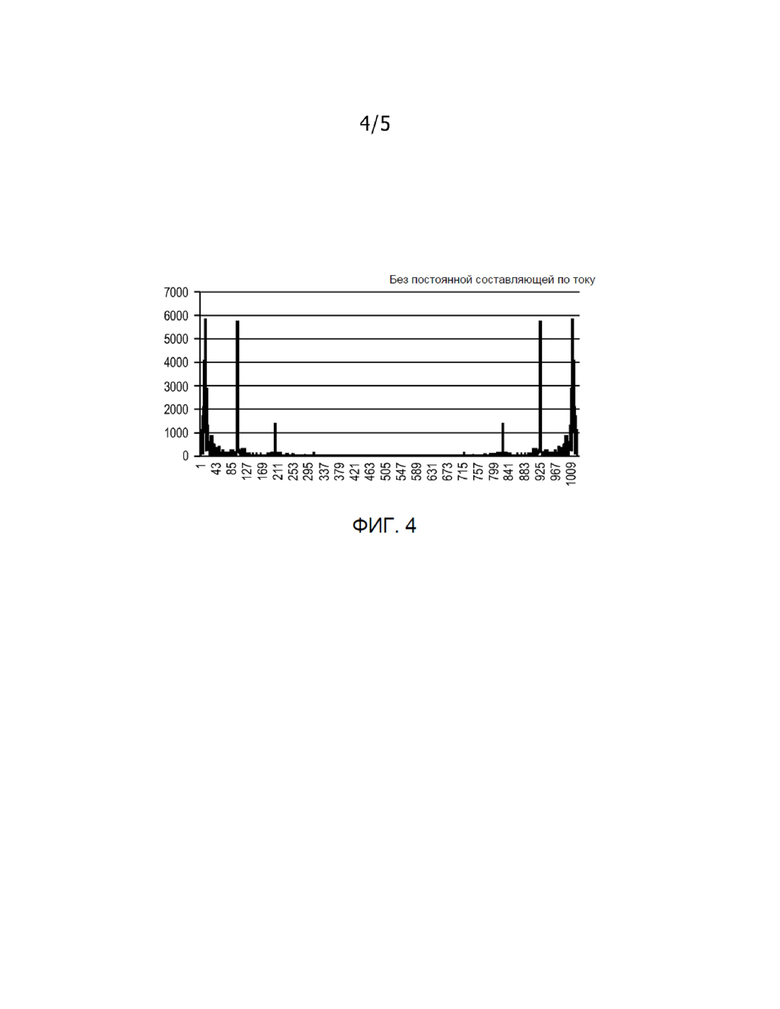
[0005] Фиг. 4 показывает типовое преобразование Фурье волнового сигнала частоты дыхательных движений, показанного на Фиг. 3.
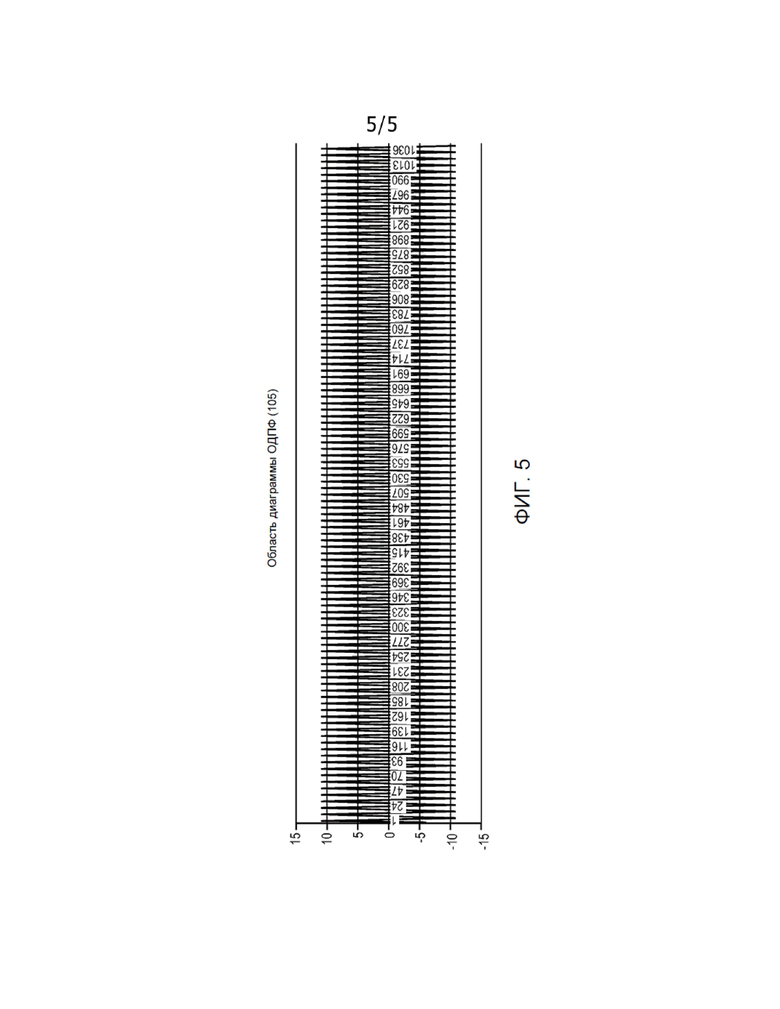
[0006] Фиг. 5 показывает график типового волнового сигнала перфузии на основе артефактов сердечной деятельности, выявленных с помощью преобразования Фурье, показанного на Фиг. 4.
Осуществление изобретения
[0007] Типовые варианты реализации настоящего изобретения включают способ мониторинга перфузии у пациента. Данный способ включает прием показателя напряжения, приложенного к грудной клетке пациента через первый электрод, прием данных измерения тока вторым электродом через грудную клетку пациента, возникающего вследствие действия приложенного напряжения, генерирование волнового сигнала частоты дыхательных движений на основе импеданса, исходя из приложенного напряжения и измеренного тока, выполнение преобразования Фурье волнового сигнала частоты дыхательных движений относительно ударов сердца пациента, выделение артефактов сердечной деятельности из преобразования Фурье и генерирование волнового сигнала перфузии, указывающего на перфузию грудной полости пациента, на основе выделенных артефактов сердечной деятельности.
[0008] Типовые варианты реализации настоящего изобретения также включают систему мониторинга перфузии у пациента. Система содержит первый электрод, прикладывающий напряжение к грудной клетке пациента, второй электрод, измеряющий ток через грудную клетку пациента, возникающий вследствие действия приложенного напряжения, и процессор, генерирующий волновой сигнал частоты дыхательных движений на основе импеданса, исходя из приложенного напряжения и измеренного тока, выполняющий преобразование Фурье волнового сигнала частоты дыхательных движений относительно ударов сердца пациента, выделяющий артефакты сердечной деятельности из преобразования Фурье и генерирующий волновой сигнал перфузии, указывающий на перфузию грудной полости пациента, на основе выделенных артефактов сердечной деятельности.
[0009] Типовые варианты реализации настоящего изобретения также включают энергонезависимый (non-transitory) машиночитаемый носитель данных, содержащий набор команд, которые могут быть выполнены процессором. Набор команд при выполнении процессором вызывает выполнение процессором операций, включая прием показателя напряжения, приложенного к грудной клетке пациента с помощью первого электрода, прием данных измерения тока вторым электродом через грудную клетку пациента, возникающего вследствие действия приложенного напряжения, генерирование волнового сигнала частоты дыхательных движений на основе импеданса, исходя из приложенного напряжения и измеренного тока, выполнение преобразования Фурье волнового сигнала частоты дыхательных движений относительно ударов сердца пациента, выделение артефактов сердечной деятельности из преобразования Фурье; и генерирование волнового сигнала перфузии, указывающего на перфузию грудной полости пациента, на основе выделенных артефактов сердечной деятельности.
Выполнение преобразования Фурье предпочтительно включает удаление постоянной составляющей по току (DC component). Генерирование волнового сигнала перфузии также предпочтительно включает выполнение обратного преобразования Фурье выделенных артефактов сердечной деятельности. Также предпочтительным является то, что система содержит память, в которой хранятся волновой сигнал частоты дыхательных движений и волновой сигнал перфузии. И еще предпочтительным является то, что система содержит дисплей, отображающий волновой сигнал перфузии, при этом также предпочтительным является то, что система содержит пользовательский интерфейс, позволяющий пользователю выбирать часть отображенного волнового сигнала перфузии для анализа части волнового сигнала перфузии в пределах заданного окна времени.
[0010] Типовые варианты реализации можно будет лучше понять со ссылкой на представленное ниже описание и приложенные чертежи, на которых одни и те же элементы имеют одинаковые позиционные обозначения. Типовые варианты реализации относятся к системе и способу оценки состояния сердечно-сосудистой системы пациента. В частности, в типовых вариантах реализации описана количественная оценка перфузии центральной полости пациента для определения состояния сердечно-сосудистой системы пациента. Хотя в типовых вариантах реализации показано и описано использование электродов для определения частоты дыхательных движений пациента, специалистам в данной области техники будет понятно, что система и способ по настоящему изобретению могут использовать другие устройства для определения частоты дыхательных движений.
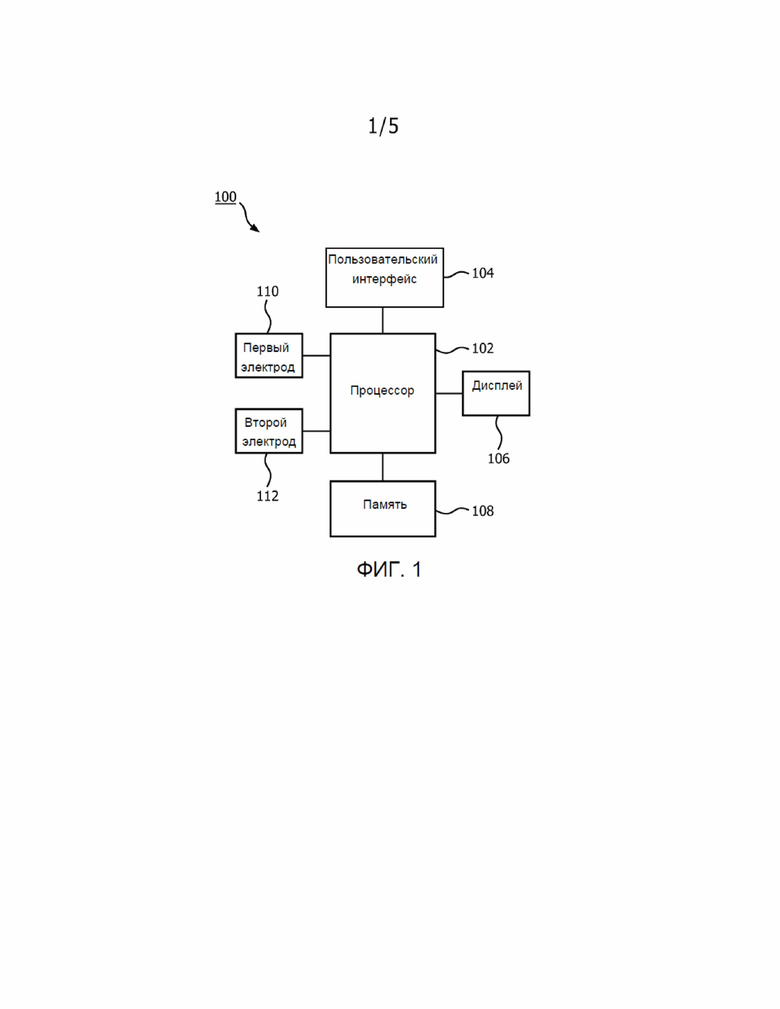
[0011] На Фиг. 1 показана система 100 в соответствии с типовым вариантом реализации настоящего изобретения, которая измеряет перфузию центральной полости пациента. Система 100 содержит процессор 102, пользовательский интерфейс 104, дисплей 106 и память 108. Система 100 также содержит первый электрод 110 и второй электрод 112, соединенные (непосредственно или опосредованно) с процессором 102 таким образом, что процессор 102 может обнаруживать и выполнять мониторинг напряжения, приложенного первым электродом 110, и тока, измеренного вторым электродом 112. Можно прикреплять первый и второй электроды 110, 112 к грудной клетке пациента и управлять ими через пользовательский интерфейс 104, который может включать, например, устройства ввода данных, такие как клавиатура, мышь и/или сенсорный экран на дисплее 106. Первый электрод 110 может быть ЭКГ-электродом, который прикладывает небольшое высокочастотное напряжение к грудной клетке, а второй электрод 112 может быть вторым ЭКГ-электродом, измеряющим ток, протекающий через грудную клетку после подачи указанного напряжения. Измерение частоты дыхательных движений на основе импеданса основано на том факте, что импеданс грудной клетки изменяется при вдыхании и выдыхании воздуха. Поскольку воздух является плохим проводником, проводимость грудной клетки уменьшается при попадании воздуха в легкие. Это видно по повышению импеданса грудной клетки по мере вдыхания воздуха. После подачи напряжения и измерения результирующего тока через грудную клетку процессор 102 вычисляет импеданс путем деления напряжения, приложенного к грудной клетке, на результирующий ток. Первый и второй электроды 110, 112 могут, соответственно, постоянно прикладывать напряжение и измерять результирующий ток, чтобы процессор 102 непрерывно измерял частоту дыхательных движений пациента. Основной импеданс, который является относительно постоянным, составляет порядка нескольких сотен Ом, а импеданс дыхательных движений составляет, например, приблизительно 2 Ома. Регистрируется, однако, и другой переменный импеданс, который вызван тем, что сердце постоянно закачивает кровь в грудную клетку и откачивает кровь из нее. Изменение импеданса вследствие этого процесса составляет около половины Ома. Этот импеданс особенно хорошо измеряется, когда легкие освобождаются от воздуха после выдоха. Указанную информацию можно использовать для оценки объема крови, поступающей в центральную полость.
[0012] В частности, процессор 102 принимает непрерывный волновой сигнал дыхательных движений и устанавливает для него новый интервал времени выборки, для которого сердце является хронометром и для которого длительность времени между любыми двумя ударами сердца одинакова. Информация об ударах сердца собирается подсоединенным ЭКГ. Затем сигнал дыхательных движений интерполируется по этому новому интервалу времени на основе ударов сердца. В этом месте процессор 102 выполняет преобразование Фурье волнового сигнала частоты дыхательных движений пациента, в котором по оси x отложено 1/удар сердца, а не 1/с.Результатом является преобразование, которое выделяет артефакт сердечной деятельности, измеренный по импедансу – например, по разнице импедансов грудной клетки, когда кровь закачивается в грудную клетку и выкачивается из нее. Далее процессор 102 выбирает артефакты сердечной деятельности и выполняет обратное преобразование Фурье артефактов сердечной деятельности для создания волнового сигнала, указывающего на объем крови, который закачивается в грудную клетку и выкачивается из нее. Для этого нового сигнала с помощью интерполяции восстанавливается начальный интервал времени. Изменения амплитуды результирующего сигнала могут быть проанализированы для определения перфузии грудной полости, что даст врачам представление о гемодинамическом состоянии пациента. Результирующий волновой сигнал перфузии может быть показан на дисплее 106. Понятно, что результирующий волновой сигнал перфузии и все связанные с ним данные, такие как частота постоянных дыхательных движений и преобразования Фурье, могут храниться в памяти 108.
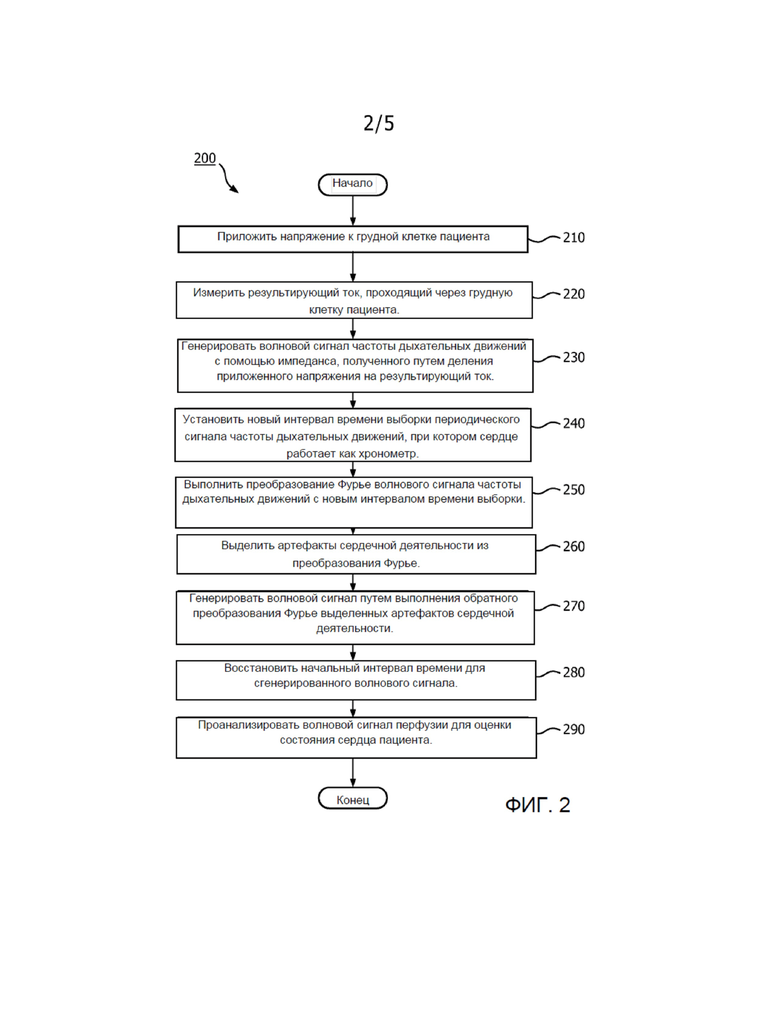
[0013] Фиг. 2 показывает типовой способ, в соответствии с которым система 100 генерирует волновой сигнал для анализа, отображающий перфузию пациента. Как было отмечено выше для системы 100, первый и второй электроды 110, 112 прикрепляются к грудной клетке пациента. Первый и второй электроды 110, 112 могут устанавливаться по всей поверхности грудной клетки и прикрепляться к ней способом, известным специалистам в данной области техники. На этапе 210 первый электрод 110 прикладывает к грудной клетке пациента непрерывное небольшое высокочастотное напряжение. На этапе 220 второй электрод 210 измеряет ток, проходящий через грудную клетку пациента вследствие действия приложенного напряжения. Процессор 102 может выполнять мониторинг приложенного напряжения и измеренного тока таким образом, что на этапе 230 процессор 102 будет генерировать волновой сигнал частоты дыхательных движений на основе импеданса, полученный путем деления приложенного напряжения на результирующий ток, как показано, например, на Фиг. 3. Такой волновой сигнал частоты дыхательных движений может сохраняться в памяти 108 и/или отображаться дисплеем 106. На этапе 240 процессор 102 принимает волновой сигнал частоты дыхательных движений и устанавливает для него новый интервал времени выборки, при котором сердце работает как хронометр. Интервал между двумя ударами сердца может быть одинаковым. Затем сигнал дыхательных движений интерполируется по этому новому интервалу времени на основе ударов сердца. Далее на этапе 250 процессор 102 выполняет преобразование Фурье волнового сигнала частоты дыхательных движений с новым интервалом времени выборки, где по оси x отложено 1/удар сердца, а не 1/с, что в качестве примера показано на Фиг. 4. В частности, преобразование Фурье можно будет растягивать и/или сжимать по времени таким образом, что все удары сердца пациента будут находиться на одинаковом расстоянии друг от друга. Специалистам в данной области техники будет понятно, что для нормировки сигнала, показанного на преобразовании Фурье, можно удалить постоянную составляющую по току. Артефакты сердечной деятельности могут быть показаны на преобразовании Фурье как узкие пики с частотой один удар сердца.
[0014] На этапе 260 артефакты сердечной деятельности могут быть выделены путем удаления других, несущественных в данном случае сигналов, возникающих, например, вследствие движения и дыхания пациента. На этапе 270 процессор 102 может выполнять обратное преобразование Фурье таких выделенных артефактов сердечной деятельности для генерирования волнового сигнала, указывающего на объем крови, который закачивается в грудную полость и выкачивается из нее, как показано, например, на Фиг. 5. На этапе 280 для генерирования волнового сигнала перфузии восстанавливается начальный интервал времени с помощью интерполяции для обратного преобразования Фурье. Указанный волновой сигнал перфузии может храниться в памяти 108 и/или отображаться дисплеем 106. Волновой сигнал перфузии может быть проанализирован на этапе 290 для определения состояния сердца пациента. Изменения амплитуды волнового сигнала перфузии отображают изменения объема крови, циркулирующей в грудной полости, и являются хорошим индикатором того, как тело пациента обеспечивает кровоснабжение и насколько хорошо выполняется перфузия в теле пациента. Например, уменьшение амплитуды во времени может указывать на то, что тело пациента перфузируется плохо, и у пациента может быть пониженное артериальное давление. Таким образом, анализ волнового сигнала перфузии может включать определение изменения амплитуды волнового сигнала перфузии. Когда, например, уменьшение амплитуды превысит заданное пороговое значение или выйдет за пределы заданного диапазона значений, процессор 102 может сгенерировать сигнал тревоги для пользователя (например, для врача), предупреждающий о том, перфузия пациента выполняется плохо, и у него может быть пониженное артериальное давление. Такой сигнал тревоги может быть звуковым и/или отображаться на дисплее 106. Специалистам в данной области техники будет понятно, что указанные заданные пороговые значения и заданный диапазон значений могут изменяться или обновляться пользователем системы с помощью пользовательского интерфейса 104. Специалистам в данной области техники будет также понятно, что для лучшего понимания гемодинамического состояния тела пациента волновой сигнал перфузии может анализироваться наряду с другой доступной информацией, такой как, например, объем крови на периферических участках тела пациента, который измеряется методом фотоплетизмографии.
[0015] Специалистам в данной области техники будет понятно, что волновой сигнал перфузии может быть генерирован для заданного интервала времени или может быть непрерывным волновом сигналом, генерируемым на протяжении всего периода времени, когда первый и второй электроды 110, 112, соответственно, прикладывают напряжение и измеряют ток. Каждый удар сердца может включать несколько амплитуд, так что это может позволить изучать волновой сигнал перфузии на меньших интервалах времени. Например, пользователь с помощью пользовательского интерфейса 104 будет иметь возможность выбирать окно или рамку времени, которые он будет передвигать на участки волнового сигнала перфузии для более внимательного изучения изменения амплитуды в меньшем окне времени.
[0016] Следует отметить, что пункты формулы изобретения могут включать ссылочные позиции/номера позиций в соответствии с Правилом 6.2(b) Договора о патентной кооперации. Однако, настоящая формула изобретения не должна рассматриваться как ограниченная типовыми вариантами реализации, относящимися к ссылочным позициям/номерам позиций.
[0017] Специалистам в данной области техники будет понятно, что описанные выше типовые варианты реализации могут быть реализованы множеством различных способов, включая отдельный модуль программного обеспечения, сочетание программного обеспечения и аппаратных средств и т.д. Например, генерирование волнового сигнала перфузии может быть реализовано с помощью программ, содержащих строки программного кода, которые после компилирования могут быть выполнены процессором.
[0018] Для специалистов в данной области техники будет очевидно, что в раскрытые типовые варианты реализации и способы и их альтернативные варианты могут быть внесены изменения без отступления от существа и объема настоящего изобретения. Таким образом, предполагается, что настоящее изобретение будет охватывать изменения и усовершенствования при условии, что они не будут выходить за рамки формулы настоящего изобретения и ее эквивалентов.

Группа изобретений относится к медицинской технике, а именно к системе и способу мониторинга перфузии у пациента. При этом с помощью первого электрода прикладывают напряжение к грудной клетке пациента. Измеряют с помощью второго электрода возникающий вследствие действия приложенного напряжения ток через грудную клетку пациента. Собирают информацию об ударах сердца с помощью подсоединенного ЭКГ. С помощью процессора генерируют волновой сигнал частоты дыхательных движений на основе импеданса, полученного путем деления приложенного напряжения на измеренный ток. Выполняют преобразование Фурье волнового сигнала частоты дыхательных движений относительно ударов сердца пациента. Выделяют артефакты сердечной деятельности из преобразования Фурье. Удаляют несущественные сигналы, возникающие вследствие движения и дыхания пациента. Выполняют обратное преобразование Фурье выделенных артефактов сердечной деятельности для генерирования волнового сигнала, указывающего на объем крови, который закачивается в грудную полость и выкачивается из нее. Восстанавливают начальный интервал времени с помощью интерполяции для обратного преобразования Фурье. Генерируют волновой сигнал перфузии, указывающий на перфузию грудной полости пациента, на основе выделенных артефактов сердечной деятельности. Обеспечивается мониторинг перфузии грудной полости пациента на основе выделенных артефактов сердечной деятельности. 3 н. и 12 з.п. ф-лы, 5 ил.
1. Способ мониторинга перфузии у пациента, включающий:
приложение напряжения к грудной клетке пациента;
измерение тока через грудную клетку пациента, возникающего вследствие действия приложенного напряжения;
сбор информации об ударах сердца,
генерирование волнового сигнала частоты дыхательных движений на основе импеданса, полученного путем деления приложенного напряжения на измеренный ток;
выполнение преобразования Фурье волнового сигнала частоты дыхательных движений относительно ударов сердца пациента;
выделение артефактов сердечной деятельности из преобразования Фурье и
удаление несущественных сигналов, возникающих вследствие движения и дыхания пациента,
обратное преобразование Фурье таких выделенных артефактов сердечной деятельности для генерирования волнового сигнала, указывающего на объем крови, который закачивается в грудную полость и выкачивается из нее,
восстановление начального интервала времени с помощью интерполяции для обратного преобразования Фурье,
генерирование волнового сигнала перфузии, указывающего на перфузию грудной полости пациента, на основе выделенных артефактов сердечной деятельности.
2. Способ по п. 1, дополнительно включающий:
анализ волнового сигнала перфузии путем выявления изменений амплитуды для оценки состояния сердца пациента.
3. Способ по п. 2, в котором анализ волнового сигнала перфузии включает выявление уменьшения амплитуды.
4. Способ по п. 3, дополнительно включающий:
инициирование выдачи сигнала тревоги для пользователя, когда уменьшение амплитуды превышает заданное пороговое значение.
5. Способ по п. 4, в котором сигнал тревоги является звуковым сигналом или визуальным сигналом.
6. Способ по п. 1, в котором выполнение преобразования Фурье включает удаление постоянной составляющей по току.
7. Способ по п. 1, в котором генерирование волнового сигнала перфузии включает выполнение обратного преобразования Фурье выделенных артефактов сердечной деятельности.
8. Способ по п. 1, дополнительно включающий:
сохранение волнового сигнала частоты дыхательных движений или волнового сигнала перфузии в память.
9. Способ по п. 1, дополнительно включающий:
отображение волнового сигнала перфузии на дисплее.
10. Способ по п. 9, дополнительно включающий:
выбор части отображенного волнового сигнала перфузии для анализа части волнового сигнала перфузии в пределах заданного окна времени.
11. Система мониторинга перфузии у пациента, содержащая:
первый электрод, выполненный с возможностью приложения напряжения к грудной клетке пациента;
второй электрод, выполненный с возможностью измерения тока через грудную клетку пациента, возникающего вследствие действия приложенного напряжения;
процессор, выполненный с возможностью:
генерирования волнового сигнала частоты дыхательных движений на основе импеданса, полученного путем деления приложенного напряжения на измеренный ток,
сбора информации об ударах сердца с использованием подсоединенного ЭКГ,
выполнения преобразования Фурье волнового сигнала частоты дыхательных движений относительно ударов сердца пациента, выделения артефактов сердечной деятельности из преобразования Фурье и
удаления несущественных сигналов, возникающих вследствие движения и дыхания пациента;
обратного преобразования Фурье таких выделенных артефактов сердечной деятельности для генерирования волнового сигнала, указывающего на объем крови, который закачивается в грудную полость и выкачивается из нее;
восстановления начального интервала времени с помощью интерполяции для обратного преобразования Фурье,
генерирования волнового сигнала перфузии, указывающего на перфузию грудной полости пациента, на основе выделенных артефактов сердечной деятельности.
12. Система по п. 11, в которой процессор выполнен с возможностью анализа волнового сигнала перфузии путем выявления изменения амплитуды для оценки состояния сердца пациента.
13. Система по п. 12, в которой процессор выполнен с возможностью анализа волнового сигнала перфузии путем выявления уменьшения амплитуды.
14. Система по п. 13, в которой процессор выполнен с возможностью инициирования выдачи сигнала тревоги для пользователя, когда уменьшение амплитуды превышает заданное пороговое значение.
15. Энергонезависимый машиночитаемый носитель, содержащий компьютерную программу со средствами программного кода, сконфигурированный для выполнения процессором этапов способа по п. 1 при выполнении указанной компьютерной программы на процессоре.
| АППАРАТУРА И СПОСОБ КОНТРОЛЯ ХАРАКТЕРИСТИК СЕРДЕЧНОЙ ДЕЯТЕЛЬНОСТИ | 1997 |
|
RU2195168C2 |
| US 5178154 A, 12.01.1993 | |||
| US 2012172730 A1, 05.07.2012 | |||
| US 2005065554 A1, 24.03.2005 | |||
| US 6348038 B1, 19.02.2002. | |||
Авторы
Даты
2019-10-08—Публикация
2015-03-27—Подача