Изобретение относится к ветеринарной микробиологии, в частности к лабораторной диагностике возбудителей инфекционных заболеваний, а именно к средствам диагностики инфекции у животных.
В настоящее время бордетеллез является широко распространенным заболеванием животных во многих странах мира. Bordetella bronchiseptica является возбудителем хронических и, довольно часто, асимптоматических инфекций респираторного тракта (трахеобронхита) животных. Возбудитель поражает животных всех возрастных групп, но наиболее тяжелые последствия развиваются у молодых особей. Тяжесть заболевания связана с присутствием у В. bronchiseptica факторов патогенности: адгезинов (филаментозного гемагглюти-нина, пертактина и фимбрий) и токсинов (дермонекротического, аденилатцик-лазы-гемолизина и липополисахарида). Инфекционный агент долго сохраняется в окружающей среде, поэтому чаще всего его обнаруживают в местах скученности животных (питомники, фермы, частные хозяйства).. Возможность трансмиссии возбудителя из природных эпизоотических очагов к животным, содержащимся в фермерских хозяйствах, и, как следствие, значительных экономических потерь в малом и среднем сельскохозяйственном бизнесе вследствие гибели или снижения продуктивности животных, обусловливают необходимость выявления В. bronchiseptica и проведение противоэпидемических мероприятий.
Известен способ ускоренной лабораторной диагностики коклюшной инфекции (Bordetella pertussis), предусматривающий взятие клинического материала из ротоглотки больного, выделение ДНК, проведение электрофореза, до выделения ДНК проводится пробоподготовка клинического материала, при которой тампоны с клиническим материалом суспендируют в физиологическом растворе на микроцентрифуге-вортексе в течение 5 минут для удаления тампонов, центрифугируют при 12000 об/мин в течение 3 минут, удаляют супернантант и ресуспендируют осадок, выделяют ДНК с помощью коммерческого набора, проводят изотермальную амплификацию с использованием смеси №1, состоящей из 10х реакционного ПЦР-Bst буфера, 2 mМ смеси нуклеотидов (dNTP s), 25 mM MgCl 2, раствора Betaine и трех пар праймеров и смеси №2, содержащей рабочее разведение Bst полимеразы, при 65°С в течение 60 минут и 80°С в течение 2 минут; после электрофореза в 2% агарозном геле при 160 V в течение 1 часа продукты амплификации подвергают дифференциации путем сравнения электрофоретической подвижности полученных фрагментов ДНК с подвижностью контрольного образца ДНК штамма В. pertussis и при наличии специфического светящегося профиля, аналогичного контрольному образцу ДНК штамма В. pertussis, диагностируют заболевание коклюшем (Патент РФ №2542396, 2014 г.).
Также известен способ выявления инфекций в клинических образцах методом мультиплексной ПНР с детекцией в режиме реального времени (патент РФ №2506317, C12Q 1/68, 2014 г.), включающий выделение ДНК из биологического материала от инфицированных особей сорбционным методом, постановку одноэтапной с добавлением внутреннего положительного контроля мультиплексной реакции обратной транскрипции и полимеразной цепной реакции - с проведением 45 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома олиго-нуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов, измерение накопления флуоресцентного сигнала по каналам соответствующих флуоресцентных красителей и интерпретацию результатов на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией (Threshold).
Наиболее близким является способ молекулярно-генетической идентификации Bordetella bronchiseptica с помощью полимеразной цепной реакции (Мастиленко А. В, Автореферат диссертации на соискание ученой степени кандидата биологических наук «Разработка идентификации bordetella bronchiseptica на основе иммунохимических и молекулярно-генетических методов»,Саратов - 2011, http://rykovodstvo.ru/exspl/58953/index.html?page=3), включающий выделение ДНК из биологического материала от инфицированных животных сорбционным методом, постановку одноэтапной полимеразной цепной реакции - с одновременным проведением циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома Bordetella bronchiseptica олигонуклеотидных праймеров, зондов, красителей и контрольных образцов в виде внутреннего и положительного, измерение специфического сигнала и сигнала контроля по каналам соответствующих красителей и интерпретацию результатов
Однако в известном способе последовательность непосредственно читается по электрофореграмме. Длина фрагмента, который может быть расшифрован этим методом, ограничивается разрешающей способностью метода гель-электрофореза.
Общим недостатком известных технических решений является отсутствие возможности получения достоверной диагностики выявления генома возбудителя ДНК Bordetella bronchiseptica инфекции у сельскохозяйственных животных.
Техническим результатом является получение достоверной диагностики возбудителя ДНК Bordetella bronchiseptica.
Технический результат достигается тем, что в способе выявления ДНК генома возбудителя Bordetella bronchiseptica у сельскохозяйственных животных, включающем выделение ДНК из биологического материала от инфицированных животных сорбционным методом, постановку одноэтапной полимеразной цепной реакции - с одновременным проведением не более 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома Bordetella bronchiseptica олигонуклеотидных праймеров, зондов, красителей и контрольных образцов в виде внутреннего и положительного, измерение специфического сигнала и сигнала контроля по каналам соответствующих красителей и интерпретацию результатов согласно изобретению проводят флуоресцентную детекцию, измеряют по каналу JOE(HEX)/Yellow накопление флуоресцентного сигнала для специфического сигнала ДНК генома возбудителя Bordetella bronchiseptica, а по каналу FAM/Green сигнал внутреннего контроля, интерпретацию результатов проводят на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный, при этом для внутреннего контроль-ного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК Bordetella bronchiseptica и фрагмент генома бактериофага Т4 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
BBrFl GAAACCCAGGCCGCAAATTC - прямой праймер
BBrR1 CCCAGGCGCTCGAACAATA - обратный праймер
BBRP1 [R6G]TAT AGC CGC CGC AAA CCAC[BHQ1] - зонд
T4F TACATATAAATCACGCAAAGC - прямой праймер
T4R TAGTATGGCTAATCTTATTGG - обратный праймер
Т4Р FAM ACATTGGCACTGACCGAGTTC - зонд.
Новизна заявляемого технического решения заключается в том, что для получения достоверной диагностики возбудителя ДНК Bordetella bronchiseptica инфекции животных проводят реакцию в одной ПЦР-пробирке (one-tube) с использованием специфичных для участка генома Bordetella bronchiseptica олигонуклеотидных праймеров флуоресцентно-меченного зонда и разных видов контроля для которых используют различные формы материала бактериофага Т4: суспензия и фрагмент генома со специфическими к нему праймерами и зондом. Такая постановка ПНР в реальном времени сокращает и упрощает процедуру анализа, снижает риск контаминации. Кроме того, флуоресцентная детекция продуктов амплификации осуществляется с использованием принципа выщепления флуоресцентной метки на 5' конце олигонуклеотидного зонда.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ рекомендовано использовать в ветеринарной вирусологии, так как относится к средствам диагностики Bordetella bronchiseptica инфекции у животных, что соответствует критерию «промышленная применимость».
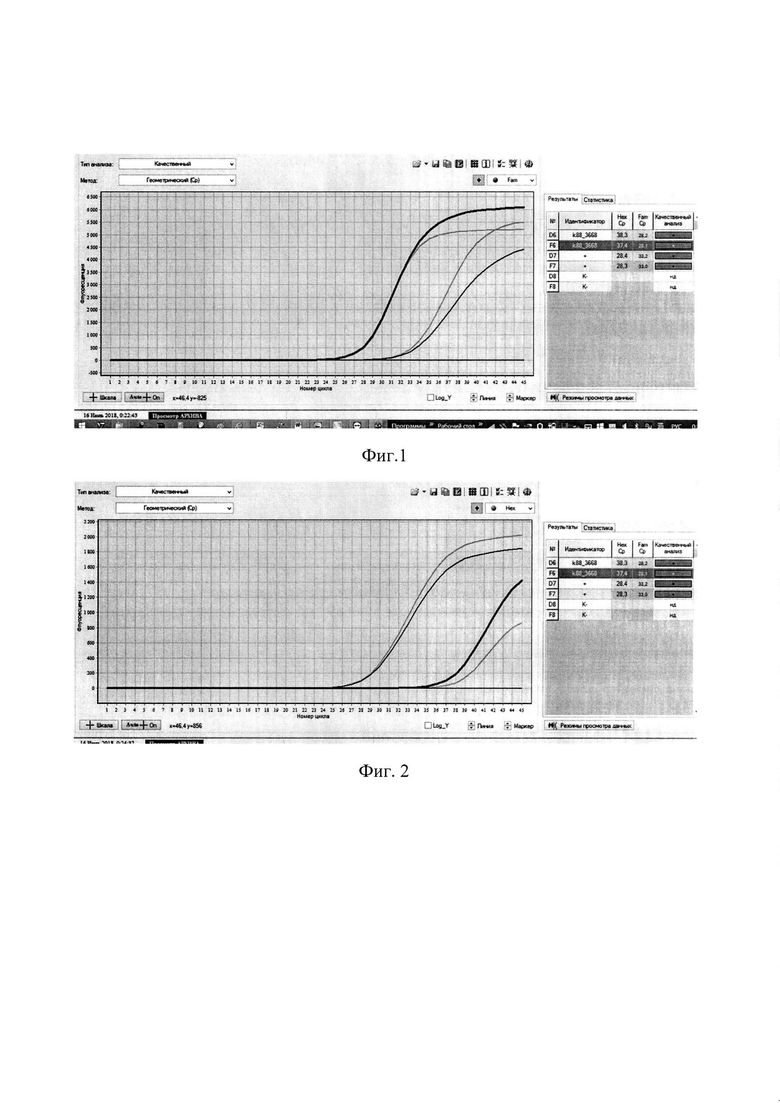
Сущность изобретения поясняется чертежом, где представлены скриншоты графиков, на фиг. 1 - представлен канал FAM - для тестирования сигнала от внутреннего контрольного образца - ВКО; на фиг. 2 Канал HEX - для тестирования наличия ДНК Bordetella bronchiseptica.
Способ выявления генома возбудителя Bordetella bronchiseptica инфекции у сельскохозяйственных животных осуществляется следующим образом
Предварительно выделяют ДНК генома возбудителя Bordetella bronchiseptica из биологического материала, взятый от инфицированных животных по выбору: ротоглоточные мазки, трансназальные или бронхоальвеолярные смывы, фрагменты легких, бронхов, трахеииз сорбционным методом. Затем проводят постановку одноэтапной полимеразной цепной реакции с добавлением внутреннего положительного контроля, в качестве которого используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл и проводят 45 циклов амплификации с флуоресцентной детекцией в реальном времени с использованием специфичных для участка генома возбудителя олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов. Для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК Bordetella bronchiseptica и фрагмент генома бактериофага Т4 взятых в соотношении 1:1, со следующими нуклео-тидными последовательностями:

Далее накопление флуоресцентного сигнала измеряют по каналам: JOE(HEX)/Yellow для специфического сигнала; FAM/Green для сигнала внутреннего контроля, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Использование для разных видов контроля различные формы материала бактериофага Т4: суспензии и фрагмента генома со специфическими к нему праймерами и зондом обусловлено тем, что это позволяет контролировать корректное прохождение реакции в каждой пробирки, а также контролируется этап выделения ДНК из образцов.
Выбор последовательности и расчет первичной структуры олигонуклеотидных праймеров и зондов.
Праймеры, специфичные для Bordetella bronchiseptica были отобраны на основе митохондриальной последовательности ДНК генома Bordetella bronchiseptica (Bordetella bronchiseptica strain D755 chromosome, complete genome, CP020651.1, участок между 4945015 и 4945092). Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Bio-systems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность. Для детекции продуктов амплификации был подобран оли-гонуклеотидный флуоресцентно-меченный зонд BBrPl (комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров BBrFl и BBrRl). Зонд был помечен красителем HEX. Для гашения самопроизвольной флуоресценции на 3'-конце олигонуклеотидного зонда прикреплен гаситель BHQ-1. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПНР.
В качестве внутреннего контроля использовался бактериофаг Т4, имеющий геномную ДНК порядка 169-170 тысяч пар нуклеотидов (Enterobacteria phage Т4Т, complete genome GenBank: HM137666.1). В результате анализа был выбран участок между 400 и 500 нуклеотидами, содержащий уникальные нуклеотидные последовательности, рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность.
Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд Т4Р, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров T4F и T4R. Зонд был помечен красителем Fam. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПНР.
Пример конкретного осуществления способа выявления генома возбудителя Bordetella bronchiseptica инфекции у с.-х животных. Для исследования используют от инфицированных животных В. bronchiseptica (далее В. Bronchiseptica по выбору следующий материал:
ротоглоточные мазки
 трансназальные или бронхоальвеолярные смывы
трансназальные или бронхоальвеолярные смывы
 фрагменты легких, бронхов, трахеи
фрагменты легких, бронхов, трахеи
 клеточные культуры.
клеточные культуры.
Затем проводят подготовку проб. Мазки и смывы исследуют без предварительной подготовки. Культуры в жидких средах исследуют без предварительной подготовки, бактериальные колонии, ресуспендируют в 0,5 мл физиологического раствора.
Исследуемые пробы фрагментов легких, бронхов и трахеи (небольшие кусочки до 1 г весом) гомогенизируют с использованием стерильных фарфоровых ступок и пестиков или автоматических гомогенизаторов. Затем готовят 10% суспензию на стерильном физиологическом растворе или фосфатном буфере. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 600-1600 g (3000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 2 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции ДНК.
Далее осуществляют анализ, состоящий из трех этапов:
 экстракция нуклеиновых кислот (НК);
экстракция нуклеиновых кислот (НК);
 проведение реакции ПНР РВ с флуоресцентной детекцией в режиме реального времени;
проведение реакции ПНР РВ с флуоресцентной детекцией в режиме реального времени;
 учет результатов анализа.
учет результатов анализа.
Проводят одноэтапную ПЦР РВ в одной пробирке.
Для экстракции (выделение) НК из исследуемых проб отбирают необходимое-количество одноразовых пробирок объемом - 1,5 мл, включая отрицательный контроль выделения. Вносят во все пробирки с исследуемыми образцами, включая пробирку для отрицательного контрольного образца (ОКО), по 10 мкл внутреннего контрольного образца (ВКО) В. Bronchiseptica в качестве которого используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, если концентрация копий нуклеотидных последовательностей отклоняется в большую или меньшую сторону, то наблюдаются повторности сомнительных образцов.
Для проведения анализа используют набор, который состоит из комплекта реагентов для проведения мультиплексной ПНР (комплект №1) и комплекта контрольных образцов (комплект №2). Набор выпускается в двух вариантах:
1) Для анализа 55 образцов (включая контрольные образцы);
2) Для анализа 110 образцов (включая контрольные образцы). Состав наборов приведены в Таблицах 1 и 2.
Наборы используют в соответствии с инструкцией по применению набора реагентов «ПЦР-БОРДЕТЕЛЛЕЗ-ФАКТОР» для выявления ДНК вируса (Bordetella bronchiseptica) в биологическом материале методом полимеразной цепной реакции (ПНР) с флуоресцентной детекцией в режиме реального времени ТУ 21.10.60-156-51062356-2018 http://www.vetfaktor.ru/.


Вносят исследуемые пробы в объеме согласно инструкции к набору для выделения НК, в пробирку отрицательного контроля выделения вместо исследуемой пробы вносят ОКО (пробирку обозначают как ВК-).
Выделяют ДНК из анализируемых и контрольных образцов согласно протоколу инструкции производителя набора для выделения НК.
Выделенную ДНК можно хранить в течение одной недели при температуре от 2°С до 8°С или в течение года при температуре не выше минус 16°С. Подготавливают образцы к проведению ПНР следующим образом Общий объем реакционной смеси - 25 мкл, объем ДНК-пробы -10 мкл. Успешное прохождение реакции контролируют используя ПКО В. Bronchiseptica, ВКО В. Bronchiseptica и ДНК БУФЕР, где для внутреннего контрольного образца (ВКО) используют суспензию бактериофага Т4 с кон-центрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца (ПКО) используют смесь рекомби-нантных плазмидных ДНК, содержащих фрагмент генома ДНК В. bronchiseptica и фрагмент генома бактериофага Т4, взятых в соотношении 1:1, взятых по 5000 копий специфического фрагмента в 10 мкл (в соотношении 1:1).
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
5 мкл ПЦР смесь В. bronchiseptica
10 мкл смеси ПЦР БУФЕР В. Bronchiseptica
0,5 мкл TAQ POLYMERASE
Затем перемешивают смесь на вортексе и сбрасывают капли кратковременным центрифугированием. Отбирают необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб. Вносят по 15 мкл приготовленной реакционной смеси. Используя наконечники с фильтром в подготовленные пробирки вносят:
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл ДНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую вносят по 10 мкл
ДНК соответствующей пробы;
в) в пробирку положительный контроль ПЦР (К+) - 10 мкл ПКО В. Bronchiseptica.
Проводят реакцию ПЦР РВ с флуоресцентной детекцией.
Для проведения амплификации был использован прибор «Rotor-Gene Q»

Помещают подготовленные для проведения ПЦР пробирки в ячейки ампли-фикатора. Программируют прибор согласно инструкции производителя.
Далее проводят интерпретацию результатов анализа. Во всех пробах за исключением пробы - отрицательный образец - (К-) наблюдается кривая роста флуоресценции (фигура 1). В четырех пробах, включая клинический образец к88_3668 и положительный контрольный образец (+) в двух повторах, наблюдается кривая роста флуоресценции. В пробирке - отрицательный образец - (К-) - кривая роста флуоресценции отсутствует (фигура 2).
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции ДНК в соответствии с таблицей 4, фиг. 1, 2)

Полученные данные - кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в режиме «реального времени» в соответствии с инструкцией производителя к прибору. Учет результатов ПЦР-анализа проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца).
Образец считается положительным (ДНК возбудителя (Bordetella bronchiseptica) присутствует) если наблюдается экспоненциальный рост сигнала на канале JOE(HEX)/Yellow (фиг. 2), при этом значения Ct контрольных образцов находятся в пределах нормы (табл. 4). Если для исследуемого образца по каналу JOE(HEX)/Yellow значение Ct определяется позднее 32 цикла при корректном прохождении положительных и отрицательных контролей - он считается спорным и исследуется повторно с этапа выделения НК. Если при повторной постановке наблюдается схожий результат (Ct на канале JOE(HEX)/Yellow более 32), требуется повторное взятие материала от того же животного для проведения ПНР-исследования и (или) использование альтернативных методов диагностики.
В случае получения значения Ct на канале JOE(HEX)/Yellow менее 32 при исследовании повторно взятого от животного материала - образец считать положительным.
Образец считается отрицательным (ДНК возбудителя (Bordetella bronchiseptica) отсутствует) если не наблюдается рост сигнала флуоресценции на канале JOE(HEX)/Yellow, при этом значения Ct по каналу FAM/Green и Ct контрольных образцов находятся в пределах нормы (Табл. 4, фиг. 1, 2).
Для доказательства эффективности использования ПЦР с флуоресцентной детекцией в режиме реального времени проводился сравнительный анализ чувствительности заявляемого технического решения с прототипом, в котором использовался метод ПЦР с электрофоретической детекцией. Оказалось чувствительность ПЦР с флуоресцентной детекцией при выявлении генома возбудителя генома возбудителя Bordetella bronchiseptica на 3,7-4,3% выше, чем ПЦР с электрофоретической детекцией.
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для обнаружения генома возбудителя ДНК Bordetella bronchiseptica инфекции у сельскохозяйственных животных | 2018 |
|
RU2700477C1 |
| Способ выявления ДНК возбудителя криптоспоридиоза (Cryptosporidiosis) в биологическом материале животных и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2021 |
|
RU2782427C1 |
| Тест-система для выявления ДНК возбудителя криптоспоридиоза (Cryptosporidiosis) в биологическом материале животных и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2021 |
|
RU2785381C1 |
| Способ выявления ДНК хламидий у сельскохозяйственных животных и птиц | 2018 |
|
RU2700381C1 |
| Способ выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных | 2018 |
|
RU2700478C1 |
| Способ выявления генома возбудителя бруцеллезной инфекции (Brucella spp.) у сельскохозяйственных животных | 2018 |
|
RU2703400C1 |
| Способ выявления ДНК провируса лейкоза крупного рогатого скота (Bovine leukosis virus, BLV) | 2018 |
|
RU2700245C1 |
| Тест-система для выявления ДНК хламидий у сельскохозяйственных животных и птиц | 2018 |
|
RU2701332C1 |
| Способ выявления ДНК вируса ринотрахеита (bovine herpes virus 1, BoHV-1) у крупного рогатого скота | 2018 |
|
RU2700449C1 |
| Способ выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале животных, продуктах питания и кормах животного и растительного происхождения | 2018 |
|
RU2700476C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой способ выявления ДНК генома возбудителя Bordetella bronchiseptica у сельскохозяйственных животных, включающий выделение ДНК из биологического материала сорбционным методом, постановку одноэтапной полимеразной цепной реакции - с одновременным проведением не более 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома Bordetella bronchiseptica олигонуклеотидных праймеров, зондов, красителей и контрольных образцов в виде внутреннего и положительного, измерение специфического сигнала и сигнала контроля по каналам соответствующих красителей и интерпретацию результатов, согласно изобретению проводят флуоресцентную детекцию, измеряют по каналу JOE(HEX)/Yellow накопление флуоресцентного сигнала для специфического сигнала ДНК генома возбудителя Bordetella bronchiseptica, а по каналу FAM/Green сигнал внутреннего контроля, интерпретацию результатов проводят на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный, при этом для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК Bordetella bronchiseptica и фрагмент генома бактериофага Т4, взятых в соотношении 1:1. Изобретение позволяет достоверно диагностировать ДНК возбудителя Bordetella bronchiseptica. 2 ил., 4 табл.
Способ выявления ДНК генома возбудителя Bordetella bronchiseptica у сельскохозяйственных животных, включающий выделение ДНК из биологического материала животных сорбционным методом, постановку одноэтапной полимеразной цепной реакции - с одновременным проведением не более 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома Bordetella bronchiseptica олигонуклеотидных праймеров, зондов, красителей и контрольных образцов в виде внутреннего и положительного, измерение специфического сигнала и сигнала контроля по каналам соответствующих красителей и интерпретацию результатов, отличающийся тем, что проводят флуоресцентную детекцию, измеряют по каналу JOE(HEX)/Yellow накопление флуоресцентного сигнала для специфического сигнала ДНК генома возбудителя Bordetella bronchiseptica, а по каналу FAM/Green сигнал внутреннего контроля, интерпретацию результатов проводят на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный, при этом для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК Bordetella bronchiseptica и фрагмент генома бактериофага Т4, взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
BBrF1 GAAACCCAGGCCGCAAATTC - прямой праймер;
BBrR1 CCCAGGCGCTCGAACAATA - обратный праймер;
BBRP1 [R6G]TATAGCCGCCGCAAACCAC[BHQ1] - зонд;
T4F TACATATAAATCACGCAAAGC - прямой праймер;
T4R TAGTATGGCTAATCTTATTGG - обратный праймер;
Т4Р FAMACATTGGCACTGACCGAGTTC - зонд.
| МАСТИЛЕНКО А.В | |||
| Разработка идентификации Bordetella Bronchiseptica на основе иммунохимических и молекулярно-генетических методов, автореферат, Саратов, 2011 | |||
| СПОСОБ И НАБОР ДЛЯ УСКОРЕННОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ КОКЛЮШНОЙ ИНФЕКЦИИ | 2013 |
|
RU2542396C1 |
Авторы
Даты
2019-10-16—Публикация
2018-10-01—Подача