Изобретение относится к ветеринарной микробиологии, в частности к лабораторной диагностике возбудителей инфекционных заболеваний а именно к средствам диагностики инфекции у животных, как в практике ветеринарной службы, так и для научных исследований.
Известен способ выявления инфекций в клинических образцах методом мультиплексной ПНР с детекцией в режиме реального времени (патент РФ №2506317, C12Q 1/68, 2014 г.), включающий выделение ДНК из биологического материала от инфицированных особей сорбционным методом, постановку одноэтапной с добавлением внутреннего положительного контроля мультиплексной реакции обратной транскрипции и полимеразной цепной реакции - с проведением 45 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов, измерение накопления флуоресцентного сигнала по каналам соответствующих флуоресцентных красителей и интерпретацию результатов на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией (Threshold).
Также известен способ выделения возбудителя сибирской язвы, бруцеллеза от других близкородственных видов рода Bacillus, предусматривающий пробоподготовку, выделение ДНК, постановку ПЦР в которой, применяют олигонуклеотидные праймеры, амплификацию с последующим электрофоретическим анализом продуктов амплификации (патент РФ 2514663, кл. C12Q 1/68, 2014 г.)
Наиболее близким является способ молекулярно-генетической идентификации Brucella spp. с помощью полимеразной цепной реакции (патент РФ №2621864), включающий выделение ДНК из биологического материала от инфицированных животных сорбционным методом, постановку одноэтапной полимеразной цепной реакции - с одновременным проведением не более 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома Brucella spp.олигонуклеотидных праймеров, зондов, красителей и контрольных образцов в виде внутреннего и положительного, измерение специфического сигнала и сигнала контроля по каналам соответствующих красителей и интерпретацию результатов
Однако в известном способе последовательность непосредственно читается по электрофореграмме. Длина фрагмента, который может быть расшифрован этим методом, ограничивается разрешающей способностью метода гель-электрофореза.
Общим недостатком известных технических решений является отсутствие возможности получения достоверной диагностики выявления генома возбудителя ДНК Brucella spp.инфекции у сельскохозяйственных животных.
Техническим результатом является получение достоверной диагностики возбудителя ДНК Brucella spp..
Технический результат достигается тем, что в способе выявления генома возбудителя бруцеллезной инфекции (Brucella spp.) у сельскохозяйственных животных, включающем выделение ДНК из биологического материала от инфицированных животных сорбционным методом, постановку одноэтапной полимеразной цепной реакции - с одновременным проведением не более 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома (Brucella spp). олигонуклеотидных праймеров, зондов, красителей и контрольных образцов в виде внутреннего и положительного, измерение специфического сигнала и сигнала контроля по каналам соответствующих красителей и интерпретацию результатов, согласно изобретению проводят флуоресцентную детекцию, измеряют по каналу JOE(HEX)/Yellow накопление флуоресцентного сигнала для специфического сигнала тестирования наличия генома возбудителя бруцеллезной инфекции (Brucella spp.), а по каналу FAM/Green - сигнал внутреннего контрольного образца, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный, а интерпретацию результатов проводят на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией, при этом для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК Brucella spp. и фрагмент генома бактериофага Т4 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
 прямой праймер
прямой праймер
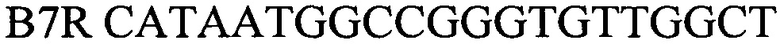 обратный праймер
обратный праймер
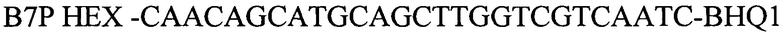 зонд
зонд
 - прямой праймер
- прямой праймер
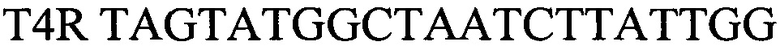 - обратный праймер
- обратный праймер
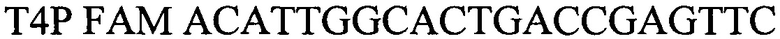 - зонд.
- зонд.
Новизна заявляемого технического решения заключается в том, что для получения достоверной диагностики возбудителя ДНК Brucella spp. инфекции животных проводят реакцию в одной ПЦР-пробирке (one-tube) с использованием специфичных для участка генома Brucella spp.олигонуклеотидных праймеров флуоресцентно-меченного зонда и разных видов контроля для которых используют различные формы материала бактериофага Т4: суспензия и фрагмент генома со специфическими к нему праймерами и зондом. Такая постановка ПЦР в реальном времени сокращает и упрощает процедуру анализа, снижает риск контаминации. Кроме того, флуоресцентная детекция продуктов амплификации осуществляется с использованием принципа выщепления флуоресцентной метки на 5' конце олигонуклеотидного зонда.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ рекомендовано использовать в ветеринарной вирусологии, а именно к средствам диагностики Brucella spp. инфекции у животных, как в практике ветеринарной службы, так и для научных исследований, что соответствует критерию «промышленная применимость».
Сущность изобретения поясняется чертежами, где представлены скриншоты графиков, на фиг. 1 - представлен канал FAM - для тестирования сигнала от внутреннего контрольного образца - ВКО; на фиг. 2 Канал JOE(HEX)/Yellow накопление флуоресцентного сигнала для специфического сигнала тестирования наличия генома возбудителя бруцеллезной инфекции (Brucella spp.), на фиг. 3 - таблица количественных данных для Cycling A. Yellow (Brucella spp) и A. Green (ВКО).
Способ выявления генома возбудителя Brucella spp. инфекции у сельскохозяйственных животных осуществляется следующим образом.
Предварительно сорбционным методом выделяют ДНК генома возбудителя Brucella spp. из биологического материала, взятый от инфицированных животных по выбору:
1. Цельная кровь, плазма крови, сыворотка крови. Кровь забирается в пробирку с 6% ЭДТА из расчета 50 мкл раствора ЭДТА на 1 мл крови, закрытую пробирку с кровью несколько раз переворачивают. Для получения сыворотки забирают кровь в пробирку без антикоагулянта;
2. Молоко, отбирают в объеме 10-30 мл в стерильную посуду;
3. Содержимое брюшной полости и желудка, селезенка, печень абортированного плода;
4. Плацента и плодовые оболочки от абортировавших животных;
5. Содержимое бурс, гигром;
6. Кусочки паренхиматозных органов (печень, селезенка);
7. Парные лимфатические узлы парааортальные, надвыменные, паховые, тазовые) отбирают целиком с обеих сторон;
8. Семенники с придатками от самцов с признаками орхита или эпидидимита.
Культуры микроорганизмов:
- культуры в жидких средах, без предварительной подготовки;
- бактериальные колонии, ресуспендировать в 0,5 мл физиологического раствора.
Затем проводят постановку одноэтапной полимеразной цепной реакции с добавлением внутреннего положительного контроля, в качестве которого используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, если концентрация копий нуклеотидных последовательностей отклоняется в большую или меньшую сторону, то наблюдаются повторности сомнительных образцов. 45 циклов амплификации с флуоресцентной детекцией в реальном времени проводят с использованием специфичных для участка генома возбудителя олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов. Для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК Brucella spp и фрагмент генома бактериофага Т4 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
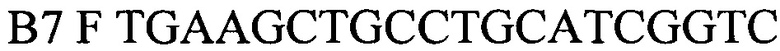 прямой праймер
прямой праймер
 обратный праймер
обратный праймер
 зонд
зонд
 - прямой праймер
- прямой праймер
 - обратный праймер
- обратный праймер
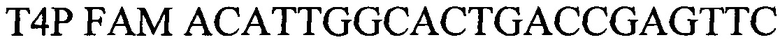 - зонд
- зонд
Далее накопление флуоресцентного сигнала измеряют по каналам: JOE(HEX)/Yellow для специфического сигнала генома возбудителя бруцеллезной инфекции (Brucella spp.); FAM/Green для сигнала внутреннего контроля, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не Пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Использование для разных видов контроля различные формы материала бактериофага Т4: суспензии и фрагмента генома со специфическими к нему праймерами и зондом обусловлено тем, что это позволяет контролировать корректное прохождение реакции в каждой пробирки, а также контролируется этап выделения ДНК из образцов.
Выбор последовательности и расчет первичной структуры олигонуклеотидных праймеров и зондов.
Праймеры, специфичные для Brucella spp.были отобраны на основе митохондриальной последовательности ДНК генома Brucella (Brucella canis strain GB1 chromosome II, complete sequence, CP027642.1, участок между 251426 и 251535). Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность. Для детекции продуктов амплификации был подобран олигонуклеотидный флуоресцентно-меченный зонд В7Р (комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров B7F и B7R). Зонд был помечен красителем HEX. Для гашения самопроизвольной флуоресценции на 3'-конце олигонуклеотидного зонда прикреплен гаситель BHQ-1. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
В качестве внутреннего контрольного образца использовался бактериофаг Т4, имеющий геномную ДНК порядка 169-170 тысяч пар нуклеотидов (Enterobacteria phage Т4Т, complete genome GenBank: HM137666.1). В результате анализа был выбран участок между 400 и 500 нуклеотидами, содержащий уникальные нуклеотидные последовательности, рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность
Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд Т4Р, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров T4F и T4R. Зонд был помечен красителем Fam. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
Пример конкретного осуществления способа выявления генома возбудителя Brucella spp.инфекции у с.-х животных.
Пробы цельной крови, консервированной ЭДТА, синовиальной жидкости, пунктаты из лимфоузлов, содержимое бурс и гигром, культуры микроорганизмов используют для выделения ДНК без предварительной подготовки.
Для получения сыворотки пробирки с кровью (без антикоагулянта) отстаивают при комнатной температуре в течение 30 минут до полного образования сгустка. Затем центрифугируют при 600-1600 g (3000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 10 минут при комнатной температуре. Сыворотку переносят отдельными наконечниками с фильтром в стерильные пробирки объемом 1,5 мл.
Для получения плазмы пробирку с цельной кровью центрифугируют в течение 10 мин при 1000 g (если кровь стояла при температуре от 2°С до 8°С более 1 ч после ее взятия, то пробирку следует аккуратно несколько раз перевернуть для равномерного перемешивания крови). Переносят плазму в количестве не менее 1 мл одноразовыми наконечниками с фильтром в стерильные пробирки объемом 1,5 мл.
Пробы паренхиматозных органов, семенников, плодовых оболочек, плаценты размером 1 см3, лимфатические узлы целиком, гомогенизируют с использованием стерильных фарфоровых ступок и пестиков, затем готовят 10% суспензию на стерильном физиологическом растворе или фосфатном буфере. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 600-1600 g (3000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 2 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции ДНК.
Молоко в объеме до 10 мл обеззараживают и центрифугируют при 3 тыс об/мин в течение 10-15 мин. Надосадочную жидкость осторожно отбирают, оставив над осадком примерно 0,2 мл жидкости. Осадок ресуспендируют в оставшейся надосадочной жидкости и 0,1 мл суспензии используют для выделения ДНК.
Проведение анализа
Анализ с помощью набора реагентов «ПЦР-БРУЦЕЛЛЕЗ-ФАКТОР» состоит из трех этапов:
 экстракция НК (на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»);
экстракция НК (на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»);
 проведение ПЦР с флуоресцентной детекцией в режиме реального времени;
проведение ПЦР с флуоресцентной детекцией в режиме реального времени;
 учет результатов анализа.
учет результатов анализа.
Далее осуществляют анализ, состоящий из трех этапов:
 экстракция нуклеотидных кислот (НК);
экстракция нуклеотидных кислот (НК);
 проведение реакции ПЦР РВ с флуоресцентной детекцией в режиме реального времени;
проведение реакции ПЦР РВ с флуоресцентной детекцией в режиме реального времени;
 учет результатов анализа.
учет результатов анализа.
Проводят одноэтапную ПЦР РВ в одной пробирке.
Для экстракции (выделение) НК из исследуемых проб отбирают необходимое-количество одноразовых пробирок объемом - 1,5 мл, включая отрицательный контроль выделения. Вносят во все пробирки с исследуемыми образцами, включая пробирку для отрицательного контрольного образца (ОКО), по 10 мкл внутреннего контрольного образца (ВКО) Brucella spp.B качестве которого используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл.
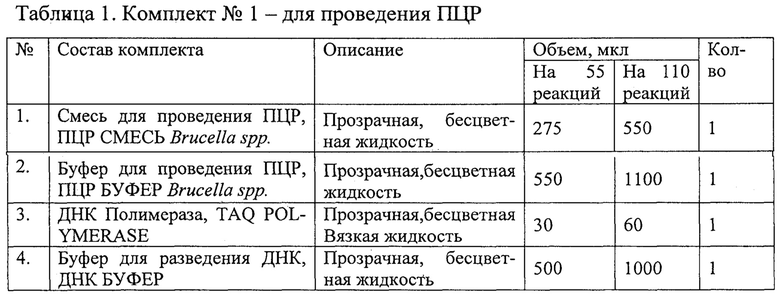
Набор состоит из комплекта реагентов для проведения мультиплексной ПНР (комплект №1) и комплекта контрольных образцов (комплект №2).
Набор выпускается в двух вариантах:
1) Для анализа 55 образцов (включая контрольные образцы);
2) Для анализа 110 образцов (включая контрольные образцы).
Состав наборов приведены в Таблицах 1 и 2.
Наборы используют в соответствии с инструкцией по применению набора реагентов «ПЦР-БРУЦЕЛЛЕЗ-ФАКТОР» для выявления ДНК вируса (Brucella spp.) в биологическом материале методом полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени ТУ 21.10.60-103-51062356-2015 (http://www.vetfaktor.ru/.).

Вносят исследуемые пробы в объеме согласно инструкции к набору для выделения НК, в пробирку отрицательного контроля выделения вместо исследуемой пробы вносят ОКО (пробирку обозначают как ВК-).
Выделяют ДНК из анализируемых и контрольных образцов согласно протоколу инструкции производителя набора для выделения НК.
Выделенную ДНК можно хранить в течение одной недели при температуре от 2°С до 8°С или в течение года при температуре не выше минус 16°С.
Подготавливают образцы к проведению ПЦР следующим образом.
Общий объем реакционной смеси - 25 мкл, объем ДНК-пробы - 10 мкл.
Успешное прохождение реакции контролируют,, используя ПКО Brucella spp., ВКО Brucella spp. и ДНК БУФЕР, где для внутреннего контрольного образца (ВКО) используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца (ПКО) используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК Brucella spp.n фрагмент генома бактериофага Т4, взятых в соотношении 1:1, взятых по 5000 копий специфического фрагмента в 10 мкл (в соотношении 1:1).
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
5 мкл ПЦР смесь Brucella spp.
10 мкл смеси ПНР БУФЕР Brucella spp.
0,5 мкл TAQ POLYMERASE
Затем перемешивают смесь на вортексе. и сбрасывают капли кратковременным центрифугированием. Отбирают необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб. Вносят по 15 мкл приготовленной реакционной смеси. Используя наконечники с фильтром в подготовленные пробирки вносят:
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл ДНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую вносят по 10 мкл ДНК соответствующей пробы;
в) в пробирку положительный контроль ПЦР (К+) - 10 мкл ПКО Brucella spp.
Проводят реакцию ПЦР РВ с флуоресцентной детекцией. Для проведения амплификации был использован прибор «Rotor Gene Q».
Параметры температурно-временного режима амплификации на приборе «Rotor-Gene Q» представлены в таблице 3.

Помещают подготовленные для проведения ПЦР пробирки в ячейки амплификатора. Программируют прибор согласно инструкции производителя.
Далее проводят интерпретацию результатов анализа. Во всех пробах за исключением пробы - отрицательный образец - (К-) наблюдается кривая роста флуоресценции (фигура 1). В четырех пробах, включая клинический образец k88_3668 и положительный контрольный образец (+) в двух повторах, наблюдается кривая роста флуоресценции. В пробирке - отрицательный образец - (К-) - кривая роста флуоресценции отсутствует (фигура 2).
Полученные данные - кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в режиме «реального времени» в соответствии с инструкцией производителя к прибору.
Учет результатов ПЦР-анализа проводился по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца).

Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции ДНК в соответствии с таблицей 4.
Для доказательства эффективности использования ПЦР с флуоресцентной детекцией в режиме реального времени проводился сравнительный анализ чувствительности заявляемого технического решения с прототипом, в котором использовался метод ПЦР с электрофоретической детекцией. Оказалось чувствительность ПЦР с флуоресцентной детекцией при выявлении генома возбудителя бруцеллезной инфекции (Brucella spp.) на 3,0-3,3% выше, чем ПЦР с электрофоретической детекцией.
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для выявления генома возбудителя бруцеллезной инфекции (Brucella spp.) у сельскохозяйственных животных | 2018 |
|
RU2700255C1 |
| Тест-система для обнаружения генома возбудителя ДНК Bordetella bronchiseptica инфекции у сельскохозяйственных животных | 2018 |
|
RU2700477C1 |
| Способ выявления ДНК хламидий у сельскохозяйственных животных и птиц | 2018 |
|
RU2700381C1 |
| Способ выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале животных, продуктах питания и кормах животного и растительного происхождения | 2018 |
|
RU2700476C1 |
| Способ выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных | 2018 |
|
RU2700478C1 |
| Способ выявления ДНК возбудителя криптоспоридиоза (Cryptosporidiosis) в биологическом материале животных и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2021 |
|
RU2782427C1 |
| Тест-система для выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале животных, продуктах питания и кормах животного и растительного происхождения | 2018 |
|
RU2700247C1 |
| Тест-система для выявления ДНК возбудителя криптоспоридиоза (Cryptosporidiosis) в биологическом материале животных и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2021 |
|
RU2785381C1 |
| Тест-система для выявления ДНК возбудителя лептоспироза (Leptospira spp.) у сельскохозяйственных животных | 2018 |
|
RU2680094C1 |
| Способ обнаружения ДНК генома возбудителя бордетеллеза (Bordetella bronchiseptica) у сельскохозяйственных животных | 2018 |
|
RU2703405C1 |

Изобретение относится к области биотехнологии. Изобретение представляет собой способ выявления генома возбудителя бруцеллезной инфекции (Brucella spp.) у сельскохозяйственных животных, включающий выделение ДНК из биологического материала от инфицированных животных сорбционным методом, постановку одноэтапной полимеразной цепной реакции - с одновременным проведением циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома (Brucella spp.) олигонуклеотидных праймеров, зондов, красителей и контрольных образцов в виде внутреннего и положительного, измерение специфического сигнала и сигнала контроля по каналам соответствующих красителей и интерпретацию результатов, где проводят флуоресцентную детекцию, измеряют по каналу JOE(HEX)/Yellow накопление флуоресцентного сигнала для специфического сигнала тестирования наличия генома возбудителя бруцеллезной инфекции (Brucella spp.), а по каналу FAM/Green - сигнал внутреннего контрольного образца, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный, а интерпретацию результатов проводят на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией, при этом для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК Brucella spp. и фрагмент генома бактериофага Т4, взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
B7F TGAAGCTGCCTGCATCGGTC - прямой праймер,
B7R CATAATGGCCGGGTGTTGGCT - обратный праймер,
В7Р HEX-CAACAGCATGCAGCTTGGTCGTCAATC-BHQ1 – зонд,
T4F TACATATAAATCACGCAAAGC - прямой праймер,
T4R TAGTATGGCTAATCTTATTGG - обратный праймер,
Т4Р FAM ACATTGGCACTGACCGAGTTC – зонд. Изобретение позволяет достоверно диагностировать возбудителя ДНК Brucella spp. 3 ил., 4 табл.
Способ выявления генома возбудителя бруцеллезной инфекции (Brucella spp.) у сельскохозяйственных животных, включающий выделение ДНК из биологического материала от инфицированных животных сорбционным методом, постановку одноэтапной полимеразной цепной реакции - с одновременным проведением циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома (Brucella spp.) олигонуклеотидных праймеров, зондов, красителей и контрольных образцов в виде внутреннего и положительного, измерение специфического сигнала и сигнала контроля по каналам соответствующих красителей и интерпретацию результатов, отличающийся тем, что проводят флуоресцентную детекцию, измеряют по каналу JOE(HEX)/Yellow накопление флуоресцентного сигнала для специфического сигнала тестирования наличия генома возбудителя бруцеллезной инфекции (Brucella spp.), а по каналу FAM/Green - сигнал внутреннего контрольного образца, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный, а интерпретацию результатов проводят на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией, при этом для внутреннего контрольного образца используют суспензию бактериофага Т4 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома ДНК Brucella spp. и фрагмент генома бактериофага Т4, взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
B7F TGAAGCTGCCTGCATCGGTC - прямой праймер,
B7R CATAATGGCCGGGTGTTGGCT - обратный праймер,
В7Р HEX-CAACAGCATGCAGCTTGGTCGTCAATC-BHQ1 – зонд,
T4F TACATATAAATCACGCAAAGC - прямой праймер,
T4R TAGTATGGCTAATCTTATTGG - обратный праймер,
Т4Р FAM ACATTGGCACTGACCGAGTTC - зонд.
| СПОСОБ ОПРЕДЕЛЕНИЯ ВИДОВОЙ ПРИНАДЛЕЖНОСТИ ВОЗБУДИТЕЛЯ БРУЦЕЛЛЕЗА МЕТОДОМ ПЦР С ГИБРИДИЗАЦИОННО-ФЛУОРЕСЦЕНТНЫМ УЧЕТОМ РЕЗУЛЬТАТОВ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2016 |
|
RU2621864C1 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ВОЗБУДИТЕЛЯ СИБИРСКОЙ ЯЗВЫ ОТ ДРУГИХ БЛИЗКОРОДСТВЕННЫХ ВИДОВ РОДА BACILLUS НА ОСНОВЕ ОПРЕДЕЛЕНИЯ РАЗЛИЧИЙ В СТРУКТУРЕ ХРОМОСОМНЫХ ГЕНОВ | 2013 |
|
RU2514663C2 |
Авторы
Даты
2019-10-16—Публикация
2018-10-01—Подача