Область техники
Способ получения органомодифицированного гидроксиапатита относится к способам модификации гидроксиапатита путем прививки молочной кислоты. Полученные модификаты могут быть использованы при создании композитов, в том числе биоразлагаемых, с улучшенными характеристиками.
Уровень техники.
Существует множество способов модификации гидроксиапатита и получения композитов различного назначения на основе полученных модификатов.
Известно, что распространенным методом модификации наполнителя является полимеризация лактида с раскрытием цикла в присутствии гидроксиапатита (Qiu, X., Chen, L., Ни, J., Sun, J., Hong, Z., Liu, A., Chen, X. and Jing, X. (2005). Surface-modified hydroxyapatite linked by L-lactic acid oligomer in the absence of catalyst. J. Polym. Sci., Part A: Polym. Chem., 5177-5185). Исходным материалом служил PLLA 179 кДа, частицы ГАП длиной 100-200 нм и шириной 20-30 нм. Модификацию ГАП осуществляли реакцией переэтерификации олигомеров молочной кислоты; максимальная прочность на растяжение 68,7 МПа и модуль Юнга на разрыв 2,1 ГПа при содержании наполнителя 15%.
Недостатком данного метода модификации гидроксиапатита является его длительность, использование катализатора, который необходимо удалять из композита при применении в медицине.
Известен метод поверхностной модификации наночастиц гидроксиапатита с помощью прививки на них L-молочной кислоты и L-лактида (Поверхностно модифицированный L-молочной кислотой гидроксиапатит и его последующая полимеризационная прививка L-лактидом. X. Qiu, Z. Hong, J. Ни, L. Chen, X. Chen, X. Jing. Biomacromolecules, 2005, 6, 1193-1199).
На первой стадии молочная кислота прививается на гидроксиапатит в растворе тетрагидрофурана (заменяемым далее на толуол) при 60°С с образованием кальций карбоксилатных и гидроксильных связей на поверхности. На второй стадии прививается лактид с образованием гидроксильных связей путем расплавной полимеризации полученных привитых фосфатов под действием октоата олова. Полученные композиты характеризуются степенью модификации 15%, прочность на разрыв повышается с 45 Мпа до 67 МПа и модуль с 1,7 ГПа до 2,1 ГПа. Недостатком способа является применение двух промежуточных растворителей и связанной с этим многостадийностью процесса, применением катализатора на стадии полимеризации, необходимостью удаления каталитических остатков из композита для применения его в медицинских целях.
Известен метод предварительной модификации поверхности дисперсного гидроксиапатита с помощью молочной кислоты и последующей полимеризации L-лактида в присутствии полученного модификата синтезированы образцы композитов с содержанием гидроксиапатита 5, 10 и 20 вес % (J. Li, X.L. Lu, Y.F. Zheng. Effect of surface modified hydroxyapatite on the tensile property improvement of HA/PLA composite. Applied Surface Science, 255, (2008), 494-497). Модификацию проводили в растворе тетрагидрофурана с последующей добавкой толуола и выдерживанием системы 6-8 часов при температуре 85°С, после чего наполнитель промывали этилацетатом. Полимеризацию осуществляли при температуре 130°С в течение 24 часов. Готовый композит промывали хлороформом и сушили в вакууме. Оптимальная степень наполнения, повышающая прочность на разрыв до 55 МПа, составила 10%. Констатировано и повышение термостабильности композита по сравнению с ненаполненными образцами. Недостатком метода является его длительность и наличие большого количества растворителей.
Известен способ получения биоразлагаемого композита на основе алифатических сложных полиэфиров и гидроксиапатита (Патент RU №2664432, 17.08.2018 Бюл. №23), включающий взаимную прививку полимера и наполнителя, в котором синтез композита осуществляют в отсутствие органического растворителя одно- или двухстадийным способом, методом совместной механохимической обработки компонентов, проводящейся при комнатной температуре в интервале 3000-7000 об/мин диспергатором при исходном соотношении гидроксиапатит / полилактид 10-90/90-10%.
Недостатком данного способа является более высокая технологическая сложность получения модификата, а также большой размер получающихся частиц модификата, что затрудняет его дальнейшее использование.
Известно техническое решение описанное в китайском патенте CN №102940908 (В) (Absorbable interference screw for repairing anterior and posterior cruciate ligaments and preparation method of screw) от 2013-02-27. В данном патенте предложен способ получения биоразлагаемого композита и крепежных винтов на его основе. Гидроксиапатит модифицировали путем смешения его водного золя и раствора олигомера молочной кислоты в ацетоне. Соотношение олигомера молочной кислоты и ацетона в интервале 1:3(10), олигомера молочной кислоты и ГАП - 1(10):1. После этого полученный раствор при перемешивании разбавляли водой до соотношения вода: ацетон в пределах 1,5(3): 1, фильтровали выпавший осадок и сушили. Для улучшения фильтруемости смесь выдерживали 4-24 часа. Далее материал обрабатывался смесью ксилола и ацетона (объемное соотношение 1:1(5)), в интервале температур 130-140°С, на протяжении 24-36 часов, затем удаляли ксилол центрифугированием с последующей обработкой хлороформом несколько раз.
Полученный органомодифицированный гидроксиапатит смешивали в экстру дере при температуре 120-230°С с биополимерами (молекулярная масса 40000-200000 Да), изготавливали пруток диаметром 9-14 мм и получали из него винты 7-12 мм.
В данном способе использовали золь-гель переход системы, позволяющий регулировать размер возникающих частиц, что возможно при применении комбинированных растворителей определенного состава. При этом возникающая степень прививки не достаточна и вводится дополнительная операция со сменой комбинированного растворителя (ксилол-ацетон) и длительным временем выдерживания системы (24-36 часов) при высокой температуре 130-140°С. В качестве недостатков способа можно выделить применение смеси органических растворителей, которые необходимо в дальнейшем удалять и разделять, длительность процесса модификации и повышенных температур.
Таким образом, высокая межфазная адгезия между неорганическими наполнителями и органической матрицей приводит к получению композитов с необходимыми механическими свойствами. Диспергируемость частиц гидроксиапатита и коллоидная стабильность является еще одним важным фактором для создания композиционных материалов на основе полилактида и гидроксиапатита.
Раскрытие изобретения
Технической проблемой, на решение которой направлено заявляемое изобретение, является быстрое получение органомодифицированного гидроксиапатита с улучшенными характеристиками в более простых условиях осуществления.
Технический результат заявленного изобретения заключается в получении органомодифицированного гидроксиапатита с пониженной склонностью к образованию агрегатов, при невысоких температурах более быстрым способом при отсутствии катализатора.
Технический результат заявленного изобретения достигается тем, что способ получения заключается в стадии модификации гидроксиапатита в растворе этилового спирта и молочной кислоты с использованием ультразвуковой диспергации, стадии, по меньшей мере 6 кратного центрифугирования и разбавления в этиловом спирте, стадии высушивания при массовом соотношении гидроксиапатит: молочная кислота: этиловый спирт (95%) 1:1-5:5-10
Совокупность приведенных выше существенных признаков приводит к тому, что:
- Процесс получения протекает без катализатора - от которого в следствии необходимо избавляться;
- Процесс модификации протекает в присутствии только 1 растворителя.
Перечисленные выше аспекты значительно сокращают стадийности способа и время получения конечного продукта.
Краткое описание чертежей
Способ получения органомодифицированного гидроксиапатита иллюстрируется следующими фигурами:
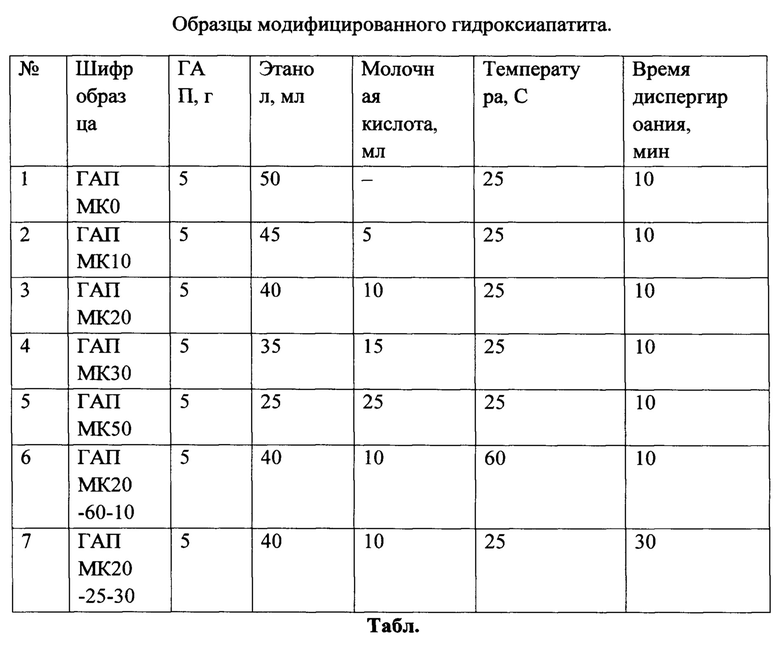
- на фиг. 1 приведены ИК-спектры 1% раствора молочной кислоты в спирте и спектры супернатантов образца ГА-МК20, модифицированного 20% раствором молочной кислоты.;
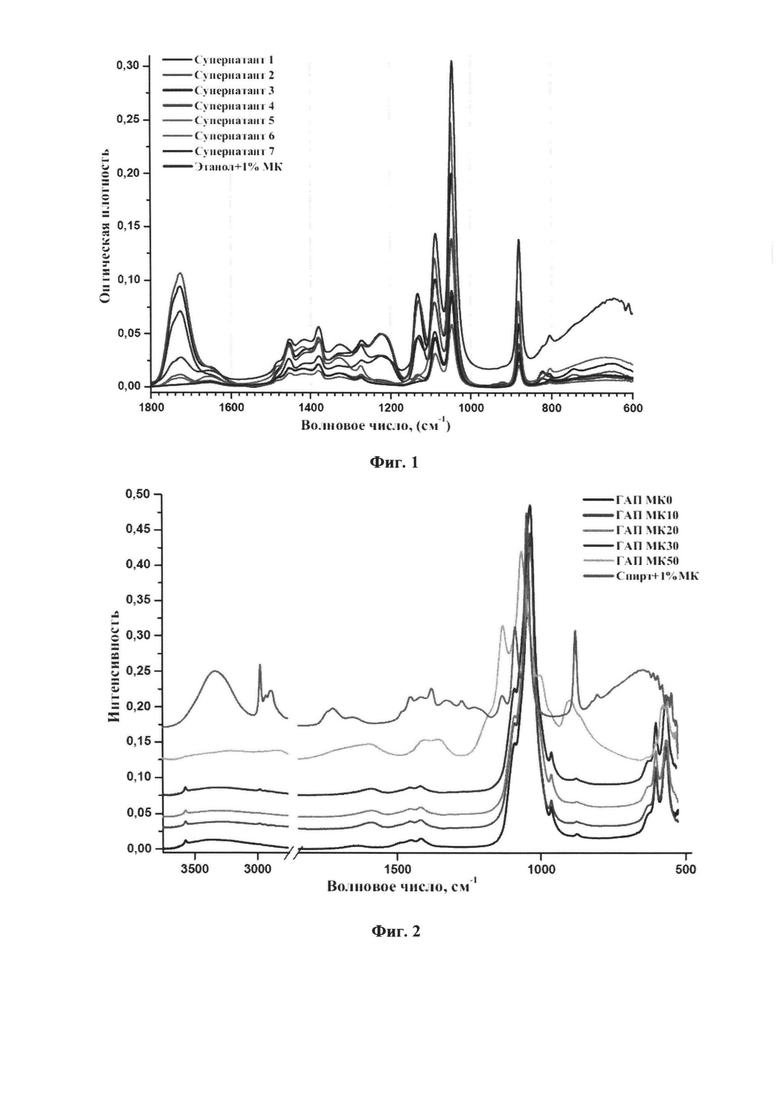
- на фиг. 2 приведен ИК-спектр модифицированного порошка гидроксиапатита после вакуумной сушки;
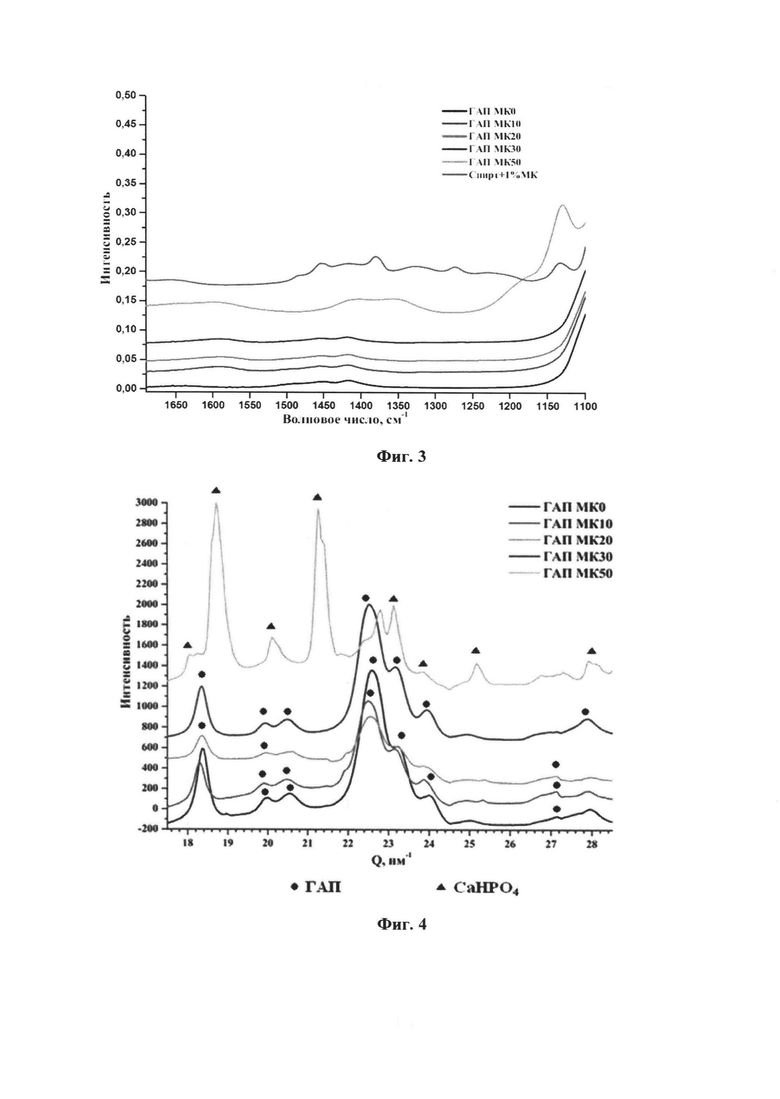
- на фиг. 3 показан приближенный ИК-спектр модифицированных молочной кислотой порошков гидроксиапатита где видно угасание колебаний в диапазоне 1450-1400 см-1, которые относятся к группе -ОН гидроксиапатита;
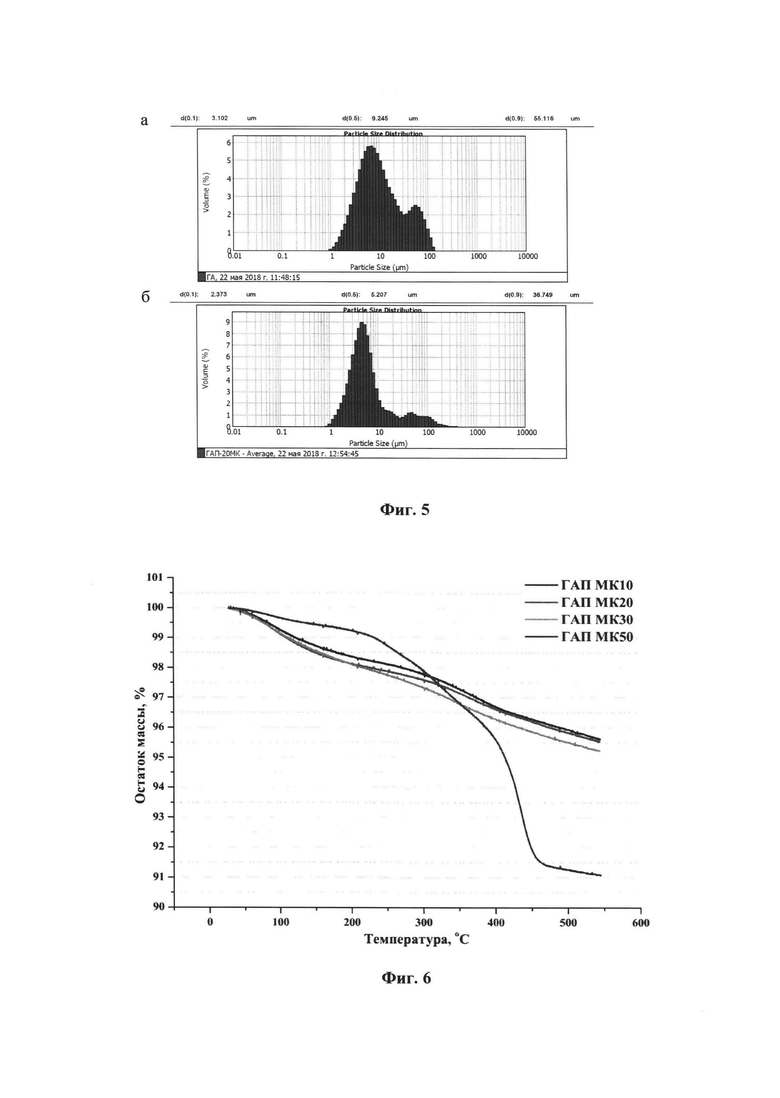
- на фиг. 4 приведены кривые распределения интенсивности рентгеновского рассеяния, подтверждающие структуру гидроксиапатита;
- на фиг. 5 показаны размеры частиц порошков исходного ГАП и модифицированного 20% раствором молочной кислоты и видно уменьшение размера частицы полученного ГАПа по сравнению с исходным;
- на фиг. 6 показана зависимость остатка массы ГАП МК (%) от температуры результатами термогравиметрического анализа количества привитой молочной кислоты.
Осуществление и примеры реализации изобретения
Заявляемый способ получения гидроксиапатита путем прививки молочной кислоты состоит в том, что модификацию гидроксиапатита проводят в спиртовом растворе молочной кислоты с использованием ультразвуковой диспергации при массовом соотношении гидроксиапатит : молочная кислота: этиловый спирт (95%)=1:1-5:5-10.
Модификацию гидроксиапатита молочной кислотой проводят при комнатной температуре в спиртовых растворах, где гидроксиапатит образует стабильную суспензию. При температуре выше либо ниже комнатной также возможно провести модификацию гидроксиапатита, однако требует дополнительных затрат на нагревание или охлаждение раствора.
Модификацию проводят путем приливания к гидроксиапатиту раствора молочной кислоты в этаноле. Растворы обрабатываются с помощью ультразвукового щупа UP400S (Heilscher) с амплитудой 80% в течение 10 минут, для предотвращения агломерации частиц модификата.
Для того чтобы исключить из смеси непрореагировавшую молочную кислоту, полученный гидроксиапатит многократно центрифугировают в течение 15 мин в ультрацентрифуге Optima МАХ-ХР (Beckman Coulter) при перегрузке 80000 g. После каждого центрифугирования удаляют супернатант и добавляют равное количество этанола. Процесс повторяют 6-8 раз, добиваясь степени разбавления не менее 6000 раз для полного удаления молочной кислоты. После этого полученный порошок высушивается.
Выбор соотношения компонентов осуществляли экспериментальным путем в диапазоне: гидроксиапатит: модификатор: этиловый спирт = 1:1-5:5-10. Перемешивание системы в процессе модификации осуществляется за счет ультразвуковой обработки.
Конкретные варианты осуществлений предполагаемого изобретения подтверждаются следующими примерами.
Пример 1 (№3 в таблице).
К гидроксиапатиту (ГАП) массой 5 г приливали 20% раствор молочной кислоты (МК) в этаноле. Агломераты частиц разбивали с помощью ультразвукового щупа с амплитудой 80% в течение 10 минут. Для того чтобы исключить из смеси непрореагировавшую молочную кислоту, полученную взвесь центрифугировали в течение 15 мин в ультрацентрифуге при перегрузке 80000 g. После центрифугирования удаляли супернатант дозатором и добавляли равное количество этанола. Процесс повторяли 7 раз, добиваясь степени разбавления более 6000 раз. Отсутствие молочной кислоты в супернатанте подтверждали методом ИК-спектроскопии с использованием ИК-Фурье спектрометра Thermo Scientific Nicolet iS5 фиг. 1.
На ИК-спектрах хорошо видно уменьшение количества молочной кислоты в растворе по уменьшению интенсивности полос, соответствующих колебаниям карбонильных групп молочной кислоты, которые располагаются в области 1740-1720 см-1, а также по полосам, относящимся к группе -ОН, в области 1140-1120 см-1.
На ИК-спектре модифицированного порошка гидроксиапатита после вакуумной сушки фиг. 2 наблюдаются полосы, характерные для фосфатов кальция, такие как деформационные колебания (550-605 см-1) и валентные (960-1200 см-1) колебания фосфатных групп. Слабые полосы в области 1550-1600 см-1 характерны колебаниям группы карбоксилат-ионов -СОО-.
Увеличение концентрации молочной кислоты в растворе для модификации фиг. 3 свидетельствует о том, что поверхностное взаимодействие ГАПа с молочной кислотой происходит по гидроксильной группе. Полосы в диапазоне 1550-1600 см-1 свидетельствуют о присутствии карбоксилат-ионов в образце. Поскольку вся несвязанная молочная кислота была отмыта, то можно сделать заключение о наличии привитой молочной кислоты. Данные рентгеноструктурного анализа фиг. 4, полученные на станции БиоМУР Курчатовского синхротрона, подтверждали структуру гидроксиапатита.
Порошковое светорассеяние фиг. 5 исходного гидроксиапатита и ГАПа, модифицированного 20% раствором молочной кислоты в этаноле, показало, что частицы последнего имеют меньший размер по сравнению с частицами исходного ГАПа. Среднеобъемный диаметр 50% частиц уменьшился при этом с 9,2 мкм до 5,2 мкм.
Количество привитой молочной кислоты определяли с помощью термогравиметрического анализа на приборе Perkin Elmer Pyris 1 в диапазоне температур 20-550 С фиг. 6. Измерения проводили в алюминиевых тиглях для предотвращения изменения массы навески в процессе обдувки. Степень прививки, при модификации 20%-ным раствором молочной кислоты (МК20) в образце ГАП МК20, равнялась 2,5 вес. % (за вычетом 2% сорбированной воды).
Остальные примеры №1-2, 4-7 в табл.аналогичны примеру №
1. В табл.1 сведены значения соотношений исходных компонентов при модификации наполнителя, температур модификации, время диспергирования, при которых осуществлялись испытания в примерах №1-7.
Концентрация молочной кислоты 50% (пример №5) является критической, так как при ней происходит структурное изменение гидроксиапатита. На фиг. 2 в образце ГАП МК50, модифицированном 50% раствором молочной кислоты, отмечены полосы в области 2750-2900 см-1, относящиеся к валентным колебаниям метальных групп (С-Н), а также полоса при 800-900 см-1, относящаяся к PO43-. Полосы в диапазоне 3500-3000 см-1 относятся к гидроксильной группе, содержащейся в молочной кислоте. Кривая распределения интенсивности рентгеновского рассеяния фиг. 4 соответствуют гидрофосфату кальция. На основании полученных данных можно сделать вывод о структурном изменении гидроксиапатита с образованием лактата кальция и гидрофосфата кальция в процессе модификации образца ГАП МК50. На рентгенограмме не наблюдается пик, относящийся к лактату кальция, поскольку он находится в области 15 нм-1. При термогравиметрическом анализе (фиг. 6) в образце ГАП МК50 наблюдается потеря 0,5% сорбированной воды при нагревании до 200°С. Дальнейшее уменьшение массы на 8% происходит из-за деструкции лактата кальция.
Повышение температуры модификации пример 6 в таблице, как и увеличение времени диспергирования пример 7 в табл.приводит к получению модификата, аналогичного по свойствам модификату, полученному при комнатной температуре и времени диспергирования 10 мин пример 3 в табл.
Таким образом, заявляемый способ позволяет получить продукт с улучшенными физико-механическими свойствами и высоким уровнем диспергирования наполнителя в полимерной матрице более быстрым, способом при отсутствии катализаторов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИОРАЗЛАГАЕМОГО КОМПОЗИТА НА ОСНОВЕ АЛИФАТИЧЕСКИХ СЛОЖНЫХ ПОЛИЭФИРОВ И ГИДРОКСИАПАТИТА | 2016 |
|
RU2664432C1 |
| Способ получения органомодифицированного монтмориллонита (ММТ) | 2018 |
|
RU2704190C1 |
| Способ получения мелкодисперсной суспензии гидроксилапатита | 2021 |
|
RU2780217C1 |
| СПОСОБ НАНЕСЕНИЯ БИОАКТИВНОГО ПОКРЫТИЯ НА ОСНОВЕ ХИТОЗАНА НА ПОЛИМЕРНЫЕ ПОРИСТЫЕ КОНСТРУКЦИИ | 2015 |
|
RU2600652C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОАКТИВНОГО ГИДРОКСИАПАТИТА | 2015 |
|
RU2604411C1 |
| Высокопрочный антифрикционный композит на основе полиэфирэфиркетона для медицины и способ его изготовления | 2020 |
|
RU2729653C1 |
| Способ получения композиционного материала на основе гидроксиапатита, содержащего наночастицы сульфида кадмия | 2024 |
|
RU2838999C1 |
| Способ получения гидроксиапатит-коллагенового композита | 2016 |
|
RU2631594C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАРОДОНТИТА И ПЕРИИМПЛАНТИТА | 2023 |
|
RU2830655C1 |
| Композиционный материал на основе гидроксиапатита для костных имплантатов и способ его получения | 2021 |
|
RU2771382C1 |
Изобретение может быть использовано при создании биоразлагаемых материалов. Способ получения органомодифицированного гидроксиапатита путем прививки молочной кислоты включает модификацию гидроксиапатита в растворе этилового спирта и молочной кислоты с использованием ультразвуковой диспергации. Проводят по меньшей мере 6-кратное центрифугирование и разбавление в этиловом спирте, затем высушивание. Массовое соотношение гидроксиапатит : молочная кислота : этиловый спирт (95%) составляет 1:1-5:5-10. Изобретение позволяет ускорить и упростить получение органомодифицированного гидроксиапатита. 6 ил., 1 табл., 7 пр.
Способ получения органомодифицированного гидроксиапатита путем прививки молочной кислоты, характеризующийся стадией модификации гидроксиапатита в растворе этилового спирта и молочной кислоты с использованием ультразвуковой диспергации, стадией по меньшей мере 6-кратного центрифугирования и разбавления в этиловом спирте, стадией высушивания при массовом соотношении гидроксиапатит : молочная кислота : этиловый спирт (95%) 1:1-5:5-10.
| CN 102940908 A, 27.02.2013 | |||
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОГО ГИДРОКСИАПАТИТА В МИКРОВОЛНОВОМ ПОЛЕ С ИСПОЛЬЗОВАНИЕМ ВЫГОРАЮЩЕЙ ДОБАВКИ | 2014 |
|
RU2574455C1 |
| БИОРЕЗОРБИРУЕМЫЙ МАТЕРИАЛ НА ОСНОВЕ АМОРФНОГО ГИДРОКСИАПАТИТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2510740C1 |
| КОМПОЗИТ ДЛЯ 3D-ПЕЧАТИ МЕДИЦИНСКИХ ИЗДЕЛИЙ | 2018 |
|
RU2679632C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОРАЗЛАГАЕМОГО КОМПОЗИТА НА ОСНОВЕ АЛИФАТИЧЕСКИХ СЛОЖНЫХ ПОЛИЭФИРОВ И ГИДРОКСИАПАТИТА | 2016 |
|
RU2664432C1 |
| CN 101693126 B, 28.11.2012. | |||
Авторы
Даты
2019-10-21—Публикация
2019-06-05—Подача