ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к офтальмологическому препарату пролонгированного действия, содержащему бензилбензоат и/или бензиловый спирт и полиэтиленгликоль и/или диметилсульфоксид, где объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду в офтальмологическом препарате пролонгированного действия составляет от 75:25 до 25:75, и общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 50% (масс./масс.) или более.
[0002] Настоящее изобретение относится к офтальмологическому препарату пролонгированного действия, дополнительно содержащему лекарственное средство, причем лекарственное средство содержится в форме соединения, представленного формулой (1):
[Химическая формула 1]
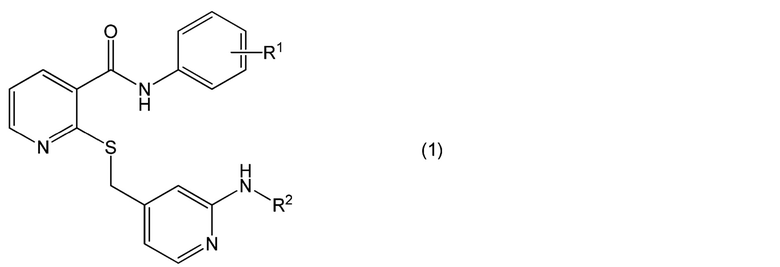
в которой
R1 представляет собой атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкильную группу, замещенную одним или несколькими атомами галогена, C1-6 алкоксигруппу или C1-6 алкоксигруппу, замещенную одним или несколькими атомами галогена, и
R2 представляет собой атом водорода, C1-6 алкильную группу, C1-6 алкилкарбонильную группу или C1-6 алкилкарбонильную группу, замещенную одной или несколькими гидроксильными группами,
или его соль.
УРОВЕНЬ ТЕХНИКИ
[0003] Например, инвазивный фармацевтический агент, такой как препарат для интравитреальных инъекций, предпочтительно представляет собой препарат, в котором лекарственное средство постепенно высвобождается из инъецированного участка после введения в организм и впоследствии демонстрирует фармакологический эффект в течение длительного периода времени с точки зрения снижения нагрузки на пациента в результате введения фармацевтического агента. Известным средством для реализации этого является препарат, в котором пролонгированное действие возникает на участке, где фармацевтический агент инъецирован, и лекарственное средство постепенно высвобождается из этого участка.
[0004] Непатентный документ 1 раскрывает образующийся in situ имплантат, который содержит сополимер молочной и гликолевой кислот (PLGA) и бензилбензоат, бензиловый спирт, ПЭГ400, ДМСО или их смесь в качестве растворителя и гранисетрона гидрохлорид в качестве лекарственного средства, и описывает исследование высвобождения гранисетрона гидрохлорида в фосфатном буфере. Однако непатентный документ 1 не описывает образующийся in situ имплантат, который не содержит сополимер молочной и гликолевой кислот (PLGA), и применение образующегося in situ имплантата, описанного в непатентном документе 1, в области офтальмологии также не описано.
[0005] Патентный документ 1 раскрывает препарат, который содержит PLGA и ацетат изобутират сахарозы (SAIB), и дополнительно бензилбензоат, бензиловый спирт, ДМСО или их смесь. Однако, хотя патентный документ 1 описывает препарат пролонгированного действия, он не препарат пролонгированного действия, который не содержит PLGA и SAIB, и применение препарата пролонгированного действия в области офтальмологии не описано или не рассмотрено.
[0006] Патентный документ 2 раскрывает препарат пролонгированного высвобождения для внутримышечного введения, который содержит ДМСО в качестве растворителя, каприловый/каприновый триглицерид (Myglyol 812) в виде маслянистой смеси, и бензилбензоат, бензиловый спирт или их смесь в качестве компонента для пролонгированного высвобождения, и фулвестрант в качестве лекарственного средства. Однако патентный документ 2 не описывает препарат пролонгированного высвобождения, который не содержит Myglycol 812, и применение этого препарата пролонгированного высвобождения в области офтальмологии также не описано.
[0007] Эти документы не описывают офтальмологический препарат пролонгированного действия, содержащий бензилбензоат и/или бензиловый спирт и полиэтиленгликоль и/или диметилсульфоксид, причем объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду в офтальмологическом препарате пролонгированного действия составляет от 75:25 до 25:75, и общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 50% (масс./масс.) или более. Кроме того, также не описано, что офтальмологический препарат пролонгированного действия демонстрирует фармакологический эффект в течение длительного периода времени посредством постепенного высвобождения лекарственного средства путем образования одинаковых депо независимо от участка введения или условий вокруг этого участка.
[Документы предшествующего уровня техники]
[Патентные документы]
[0008] [Патентный документ 1] Международная публикация № WO 2008/143992
[Патентный документ 2] Международная публикация № WO 2013/153559
[Непатентные документы]
[0009] [Непатентный документ 1] Turk. J. Pharm. Sci., 7(1), 2010, 49-56
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[ТЕХНИЧЕСКАЯ ЗАДАЧА]
[0010] Препарат пролонгированного действия представляет собой препарат, который после введения в организм образует депо, содержащее лекарственное средство, и непрерывно высвобождает лекарственное средство. В некоторых случаях образованное депо имеет произвольную неустойчивую форму. Даже в таком случае препарат можно применять для непрерывного высвобождения лекарственного средства. Однако для того, чтобы более стабильно достичь свойств пролонгированного высвобождения, предпочтительно, чтобы образованное депо обладало сферически стабильной формой. Кроме того, авторы настоящего изобретения обнаружили, что в препарате, в котором фармацевтический агент образует депо, форма депо образовывалась по-разному в зависимости от различия в участке введения или условий вокруг этого участка (например, в стекловидном теле и в передней камере, или от окружающих их условий), и что препарат может не иметь никаких свойств пролонгированного высвобождения при введении в определенный участок. Целью настоящего изобретения является предоставление офтальмологического препарата пролонгированного действия, который постепенно высвобождает лекарственное средство после введения в организм, причем офтальмологических препарат пролонгированного действия способен одинаково образовывать депо независимо от участка введения или условий вокруг этого участка и стабильно достигать пролонгированного высвобождения лекарственного средства.
[РЕШЕНИЕ ЗАДАЧИ]
[0011] В результате обширных исследований растворителей, которые растворяют лекарственные средства, для решения вышеупомянутых задач, авторы настоящего изобретения обнаружили, что офтальмологический препарат пролонгированного действия, содержащий бензилбензоат и/или бензиловый спирт и полиэтиленгликоль и/или диметилсульфоксид, где объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду в офтальмологическом препарате пролонгированного действия составляет от 75:25 до 25:75, и общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 50% (масс./масс.) или более, постепенно высвобождает лекарственное средство путем образования одинаковых депо независимо от участка введения или условий вокруг этого участка, что приводит к выполнению настоящего изобретения.
[0012] А именно, настоящее изобретение относится к указанному ниже.
[0013] (1) Офтальмологический препарат пролонгированного действия, содержащий бензилбензоат и/или бензиловый спирт и полиэтиленгликоль и/или диметилсульфоксид, в котором
объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду в офтальмологическом препарате пролонгированного действия составляет от 75:25 до 25:75, и
общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 50% (масс./масс.) или более.
[0014] (2) Офтальмологический препарат пролонгированного действия, описанный выше в (1), дополнительно содержащий лекарственное средство.
[0015] (3) Офтальмологический препарат пролонгированного действия, описанный выше в (2), в котором лекарственное средство представляет собой соединение, представленное формулой (1):
[Химическая формула 2]

в которой
R1 представляет собой атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкильную группу, замещенную одним или несколькими атомами галогена, C1-6 алкоксигруппу или C1-6 алкоксигруппу, замещенную одним или несколькими атомами галогена, и
R2 представляет собой атом водорода, C1-6 алкильную группу, C1-6 алкилкарбонильную группу или C1-6 алкилкарбонильную группу, замещенную одной или несколькими гидроксильными группами,
или его соль.
[0016] (4) Офтальмологический препарат пролонгированного действия, описанный выше в (3), в котором в формуле (1)
R1 представляет собой C1-6 алкоксигруппу или C1-6 алкоксигруппу, замещенную одним или несколькими атомами галогена, и
R2 представляет собой C1-6 алкилкарбонильную группу или C1-6 алкилкарбонильную группу, замещенную одной или несколькими гидроксильными группами.
[0017] (5) Офтальмологический препарат пролонгированного действия, описанный выше в (3), в котором в формуле (1)
R1 представляет собой C1-6 алкоксигруппу, замещенную одним или несколькими атомами галогена, и
R2 представляет собой C1-6 алкилкарбонильную группу, замещенную одной или несколькими гидроксильными группами.
[0018] (6) Офтальмологический препарат пролонгированного действия, описанный выше в (3), в котором соединение, представленное формулой (1), представляет собой 2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пиридинкарбоксамид или его соль.
[0019] (7) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(6), в котором средняя молекулярная масса полиэтиленгликоля находится в пределах от 90 до 2200.
[0020] (8) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(7), в котором полиэтиленгликоль представляет собой полиэтиленгликоль, выбранный из группы, состоящей из ПЭГ400, ПЭГ600, ПЭГ800 и ПЭГ1000.
[0021] (9) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(8), в котором объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду составляет от 60:40 до 35:65.
[0022] (10) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(8), в котором объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду составляет от 50:50 до 40:60.
[0023] (11) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(10), в котором общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 80% (масс./масс.) или более.
[0024] (12) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(11), в котором общее количество содержащегося бензилбензоата и/или бензилового спирта составляет от 25% (масс./масс.) до 60% (масс./масс.).
[0025] (13) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(12), в котором общее количество содержащегося полиэтиленгликоля и/или диметилсульфоксида составляет от 30% (масс./масс.) до 62% (масс./масс.).
[0026] (14) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (2)-(13), который дополнительно содержит токоферол или его производные.
[0027] (15) Офтальмологический препарат пролонгированного действия, описанный выше в (14), в котором количество токоферола или его производных составляет от 0,001% (масс./об.) до 10% (масс./об.).
[0028] (16) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(15), который предназначен для введения в стекловидное тело или переднюю камеру.
[0029] (17) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (2)-(16), в котором лекарственное средство содержится в количестве от 0,001% (масс./об.) до 30% (масс./об.).
[0030] (18) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (2)-(17), который предназначен для профилактики и/или лечения заболеваний глаз.
[0031] (19) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(18), который не содержит сополимер молочной и гликолевой кислот (PLGA).
[0032] (20) Офтальмологический препарат пролонгированного действия, описанный выше в (1)-(19), который не содержит среднецепочечный триглицерид.
[0033] (21) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(20), который не содержит ацетат изобутират сахарозы (SAIB).
[0034] (22) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (2)-(21), который по существу содержит только лекарственное средство, бензилбензоат, полиэтиленгликоль и токоферол или его производные.
[0035] (23) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (2)-(21), который по существу содержит только лекарственное средство, бензилбензоат, диметилсульфоксид и токоферол или его производные.
[0036] (24) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (2)-(21), который по существу содержит только лекарственное средство, бензилбензоат и полиэтиленгликоль.
[0037] (25) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (2)-(21), который по существу содержит только лекарственное средство, бензилбензоат и диметилсульфоксид.
[0038] (26) Офтальмологический препарат пролонгированного действия, описанный выше в (16), где заболевание глаз представляет собой возрастную макулярную дегенерацию, диабетическую ретинопатию, ретинопатию недоношенных, окклюзию вены сетчатки, окклюзию артерии сетчатки, полипоидную хориоидальную васкулопатию, ретинальную ангиоматозную пролиферацию, миопическую хориоидальную неоваскуляризацию, диабетический макулярный отек, окулярную опухоль, радиационную ретинопатию, рубеоз радужки, неоваскулярную глаукому или пролиферативную витреоретинопатию (PVR), первичную открытоугольную глаукому, вторичную открытоугольную глаукому, глаукому с нормальным давлением, гиперсекреторную глаукому, первичную закрытоугольную глаукому, вторичную закрытоугольную глаукому, глаукому с плоской радужкой, глаукому с комбинированным механизмом, развивающуюся глаукому, кортикостероидную глаукому, эксфолиативную глаукому, амилоидотическую глаукому, неоваскулярную глаукому, злокачественную глаукому, капсулярную глаукому, синдром плоской радужки или глаукому с высоким давлением.
[0039] (27) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(26), где за один раз вводят от 1 мкл до 1000 мкл.
[0040] (28) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(27), который вводят с интервалом от одного раза в неделю до одного раза в три года.
[0041] (29) Офтальмологический препарат пролонгированного действия, описанный выше в любом из (1)-(28), который предназначен для пролонгированного высвобождения лекарственного средства.
[0042] (30) Офтальмологический препарат пролонгированного действия по любому из вышеприведенных (1)-(29), который содержится в шприце, изготовленном из стекла, циклоолефинового полимера, полиолефина или поликарбоната.
[0043] (31) Офтальмологический препарат пролонгированного действия по любому из вышеприведенных (1)-(29), который содержится в шприце, изготовленном из стекла, циклоолефинового полимера или полипропилена.
[0044] (32) Способ, в котором лекарственное средство, содержащееся в офтальмологическом препарате пролонгированного действия, стабилизируют путем введения токоферола или его производных в указанный офтальмологический препарат пролонгированного действия,
указанный офтальмологический препарат пролонгированного действия содержит:
бензилбензоат и/или бензиловый спирт, и
полиэтиленгликоль и/или диметилсульфоксид, где
объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду в офтальмологическом препарате пролонгированного действия составляет от 75:25 до 25:75, и
общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 50% (масс./масс.) или более.
[0045] Кроме того, каждая из вышеприведенных конфигураций (1)-(32) может быть объединена путем произвольного выбора двух или более конфигураций.
[ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ]
[0046] Офтальмологический препарат пролонгированного действия по настоящему изобретению представляет собой офтальмологический препарат пролонгированного действия, который постепенно высвобождает лекарственное средство после введения в организм и демонстрирует фармакологический эффект в течение длительного периода времени посредством постепенного и стабильного высвобождения лекарственного средства путем образования одинаковых депо независимо от участка введения или условий вокруг этого участка. Кроме того, офтальмологический препарат пролонгированного действия по настоящему изобретению обладает достаточной безопасностью в качестве фармацевтического средства.
[КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ]
[0047] [Фиг. 1] Фотографии, демонстрирующие формы депо, образованных офтальмологическим препаратом пролонгированного действия по настоящему изобретению, введенным в стекловидное тело кролика.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0048] Ниже приводится подробное описание настоящего изобретения.
[0049] Что касается офтальмологического препарата пролонгированного действия по настоящему изобретению, препарат пролонгированного действия представляет собой препарат для непрерывного высвобождения лекарственного средства, причем препарат образует депо (массу) после введения в организм или тому подобное. Нет конкретного ограничения в отношении состояния препарата пролонгированного действия, и препарат может находиться в растворенном состоянии или в суспендированном состоянии, но предпочтительно, чтобы препарат находился в растворенном состоянии.
[0050] Нет конкретных ограничений в отношении лекарственного средства, содержащегося в офтальмологическом препарате пролонгированного действия по настоящему изобретению, и его конкретные примеры включают ингибиторы тирозинкиназы, такие как Тафетиниб, SIM-817378, ACTB-1003, Чиаураниб, CT-53608, Корица, chim4G8-SDIE, CEP-5214, IMC-1C11, CEP-7055, 3-[5-[2-[N-(2-метоксиэтил)-N-метиламино]этокси]-1H-индол-2-ил]хинолин-2(1H)-он, hF4-3C5, ZK-CDK, IMC-EB10, LS-104, CYC-116, OSI-930, PF-337210, JNJ-26483327, SSR-106462, R-1530, PRS-050, TG-02, SC-71710, SB-1578, AMG-191, AMG-820, Сульфатиниб, Луцитаниба гидрохлорид, JNJ-28312141, Илорасертиб, PLX-5622, ARRY-382, TAS-115, Танибирумаб, Хенатаниб, LY-2457546, PLX-7486, FPA-008, NVP-AEE-788, cgi-1842, RAF-265, MK-2461, SG-00529, Ребастиниб, Гольватиниб, Ронициклиб, BVT-II, X-82, XV-615, KD-020, Лестауртиниб, Дельфинидин, Семаксаниб, Ваталаниб, OSI-632, Телатиниб, Алацизумаб пеголь, ATN-224, Тивозаниб, XL-999, Икруцумаб, Форетиниб, Креноланиб безилат, R-406, Бриваниб, Пегдинетаниб, TG-100572, Оларатумаб, динатрия Фостаматиниб, BMS-690514, AT-9283, MGCD-265, Квизартиниб, ENMD-981693, Фамитиниб, Анлотиниб, Товетумаб, PLX-3397, Фруквинтиниб, (-)-Эпигаллокатехин, Мидостаурин, NSC-706456, Оратиниб, Цедираниб, Довитиниб, XL-647, Мотесаниб, Линифаниб, Бриваниб, Цедираниб, Апатиниб, Федратиниб, Пакритиниб, Рамуцирумаб, Интеданиб, Мазитиниб, Элемен, Дигидроартемизинин, WS-1442, Итраконазол, Лефлуномид, Дигидроартемизинин, Иматиниб, Сорафениб, Сунитиниб, Дазатиниб, Пазопаниб, Вандетаниб, Акситиниб, Регорафениб, Кабоазатиниб и Понатиниб, стероиды, такие как гидрокортизон, триамцинолон, флуоцинолон, дексаметазон и бетаметазон, производные простагландина, такие как изопропил унопростон, латанопрост, биматопрост и травопрост, иммуносупрессоры, такие как циклоспорин, сиролимус и FK506, антиаллергические лекарственные средства, такие как азеластин, нестероидные противовоспалительные лекарственные средства, такие как индометацин, бромфенак и диклофенак, ингибиторы ангиогенеза, такие как пазопаниб, SU5416, лапатиниб, ранибизумаб и бевацизумаб, средства, способствующие улучшению кровообращения, такие как никардипин и нитрендипин, антиоксиданты, такие как витамин Е, ингибиторы карбоангидразы, такие как ацетазоламид и бринзоламид, блокаторы β-рецепторов, такие как тимолол и картеолол, модуляторы зрительного цикла, такие как производные витамина A, нейротрофические факторы, такие как цилиарный нейротротрофический фактор (CNTF) и нейротрофический фактор мозга (BDNF), факторы роста, такие как фактор роста нервов (NGF) и фактор роста гепатоцитов (HGF), аптамеры, такие как пегаптиниб, фармацевтические препараты нуклеиновых кислот, такие как различные типы антисмысловых нуклеиновые кислоты и миРНК, антитела или пептидные препараты, такие как луцентис, антитело к эндоглину и IgG, ингибиторы VEGF, такие как те, которые описаны в не прошедшей экспертизу японской патентной публикации № 2006-96739, 2011-37844, 2005-232149, 2006-273851, 2006-306861 и 2008-266294, соединения, обладающие активностью связывания с глюкокортикоидным рецептором, такие как те, которые описаны в не прошедшей экспертизу японской патентной публикации № 2007-230993, 2008-074829, 2008-143889, 2008-143890, 2008-143891, 2009-007344 и 2009-084274, селективные антагонисты глюкокортикоидных рецепторов, такие как RU24858, противораковые агенты, такие как фторурацил, ингибиторы Янус-киназы, такие как тофацитиниб и ингибиторы протеинкиназы, такие как рубоксистаурин мезилат.
[0051] Предпочтительные конкретные примеры лекарственных средств, содержащихся в офтальмологическом препарате пролонгированного действия по настоящему изобретению, включают соединения, представленные вышеупомянутой формулой (1), и их соли.
[0052] "Атом галогена" относится к фтору, хлору, брому или иоду.
[0053] "С1-6 алкильная группа" относится к линейной или разветвленной алкильной группе, имеющей от 1 до 6 атомов углерода, и предпочтительно представляет собой линейную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода. Конкретные примеры включают метильную группу, этильную группу, н-пропильную группу, н-бутильную группу, н-пентильную группу, н-гексильную группу, изопропильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу и изопентильную группу.
[0054] "C1-6 алкоксигруппа" относится к группе, в которой атом водорода гидроксильной группы замещен вышеуказанной C1-6 алкильной группой. Конкретные примеры включают метоксигруппу, этоксигруппу, н-пропоксигруппу, н-бутоксигруппу, н-пентоксигруппу, н-гексилоксигруппу, изопропоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу и изопентилоксигруппу.
[0055] "C1-6 алкилкарбонильная группа" относится к группе, в которой атом водорода формильной группы замещен вышеуказанной C1-6 алкильной группой. Конкретные примеры включают метилкарбонильную группу (ацетильную группу), этилкарбонильную группу, н-пропилкарбонильную группу, н-бутилкарбонильную группу, н-пентилкарбонильную группу, н-гексилкарбонильную группу, изопропилкарбонильную группу, изобутилкарбонильную группу, втор-бутилкарбонильную группу, трет-бутилкарбонильную группу и изопентилкарбонильную группу.
[0056] Фраза, "замещенная одним или несколькими атомами галогена", как указано в настоящем изобретении, относится к вышеупомянутой C1-6 алкильной группе, замещенной от одного до максимального замещаемого числа атомов галогена. Каждый атом галогена может быть одинаковым или различным, случай, когда число атомов галогена составляет 2 или 3, является предпочтительным, и особенно предпочтительным является случай, когда число атомов галогена равно 3.
[0057] Фраза, "замещенная одной или несколькими гидроксильными группами", как указано в настоящем изобретении, относится к вышеупомянутой C1-6 алкильной группе, замещенной от одной до максимально возможного замещаемого числа гидроксильных групп. Случай, когда число гидроксильных групп составляет 1 или 2, является предпочтительным, и особенно предпочтительным является случай, когда число гидроксильных групп равно 1.
[0058] Кроме того, лекарственное средство в настоящем изобретении включает производные, такие как сложные эфиры и амиды. Конкретные примеры сложных эфиров включают сложные эфиры, в которых карбоновая кислота, такая как уксусная кислота, пропионовая кислота, изопропионовая кислота, масляная кислота, изомасляная кислота и пивалевая кислота, конденсирована с гидроксильной группой в лекарственном средстве. Конкретные примеры амидов включают амиды, в которых карбоксильная группа, такая как уксусная кислота, пропионовая кислота, изопропионовая кислота, масляная кислота, изомасляная кислота и пивалевая кислота, конденсирована с аминогруппой в лекарственном средстве.
[0059] Кроме того, содержащееся лекарственное средство может быть в форме гидрата или сольвата.
[0060] В случае, когда содержащееся лекарственное средство имеет геометрические изомеры, таутомеры или оптические изомеры, эти изомеры также включены в объем настоящего изобретения.
[0061] Кроме того, в случае, когда содержащееся лекарственное средство имеет кристаллический полиморфизм, кристаллические полиморфы также включены в объем настоящего изобретения.
[0062] (a) Предпочтительные примеры соединений, представленных формулой (1), включают соединения или их соли, в которых каждая группа представляет собой группу, указанную ниже:
[0063] (a1) R1 представляет собой C1-6 алкоксигруппу или C1-6 алкоксигруппу, замещенную одним или несколькими атомами галогена; и/или
(a2) R2 представляет собой C1-6 алкилкарбонильную группу или C1-6 алкилкарбонильную группу, замещенную одной или несколькими гидроксильными группами.
[0064] А именно, в соединениях, представленных формулой (1), их предпочтительные примеры включают соединения или их соли, состоящие из одной или двух, или более из каждой из комбинаций, выбранных из вышеупомянутых (а1) и (а2).
[0065] (b) Более предпочтительные примеры соединений, представленных формулой (1), включают соединения или их соли, в которых каждая группа представляет собой группу, указанную ниже:
[0066] (b1) R1 представляет собой C1-6 алкоксигруппу, замещенную одним или несколькими атомами галогена; и/или
(b2) R2 представляет собой C1-6 алкилкарбонильную группу, замещенную одной или несколькими гидроксильными группами.
[0067] А именно, в соединениях, представленных формулой (1), их предпочтительные примеры включают соединения или их соли, состоящие из одной или двух, или более из каждой из комбинаций, выбранных из вышеупомянутых (b1) и (b2). Кроме того, условия их отбора могут быть объединены с условиями (а).
[0068] (c) Наиболее предпочтительным примером соединений, представленных формулой (1), является соединение (2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пиридинкарбоксамид) или его соль, представленное формулой (2).
[0069] [Химическая формула 3]
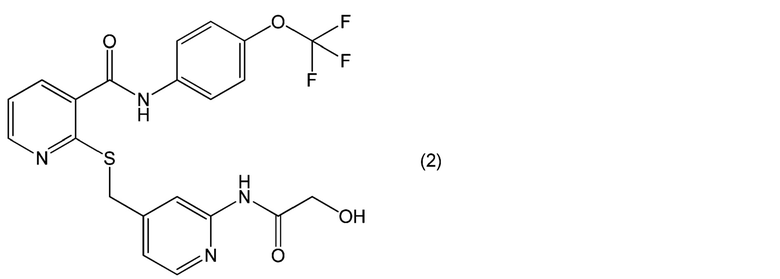
[0070] Соединение, представленное формулой (1), или его соль, содержащееся в офтальмологическом препарате пролонгированного действия по настоящему изобретению, может быть получено в соответствии с обычным способом в соответствующей технической области, таким как способ, описанный в публикации не прошедшей экспертизу заявки на патент США № 2007/0149574.
[0071] В офтальмологическом препарате пролонгированного действия по настоящему изобретению содержащееся лекарственное средство может представлять собой соль, и на нее нет конкретных ограничений при условии, что она разрешена в качестве фармацевтического средства. Примеры солей включают соли неорганических кислот, соли органических кислот, четвертичные аммонийные соли, соли с ионами галогена, соли со щелочными металлами, соли со щелочноземельными металлами, соли металлов и соли с органическими аминами. Примеры солей неорганических кислот включают соли с хлористоводородной кислотой, бромистоводородной кислотой, иодистоводородной кислотой, азотной кислотой, серной кислотой и фосфорной кислотой. Примеры солей органических кислот включают соли с уксусной кислотой, щавелевой кислотой, фумаровой кислотой, малеиновой кислотой, янтарной кислотой, яблочной кислотой, лимонной кислотой, винной кислотой, адипиновой кислотой, глюконовой кислотой, глюкогептоновой кислотой, глюкуроновой кислотой, терефталевой кислотой, метансульфоновой кислотой, аланином, молочной кислотой, гиппуровой кислотой, 1,2-этандисульфоновой кислотой, изэтионовой кислотой, лактобионовой кислотой, олеиновой кислотой, галловой кислотой, памовой кислотой, полигалактуроновой кислотой, стеариновой кислотой, дубильной кислотой, трифторметансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, лаурилсульфатом, метилсульфатом, нафталинсульфоновой кислотой и сульфосалициловой кислотой. Примеры четвертичных аммониевых солей включают соли с метилброматом и метилиодатом. Примеры солей с ионами галогена включают соли с хлорид-ионами, бромид-ионами и иодид-ионами, примеры солей со щелочными металлами включают соли лития, натрия и калия, примеры солей со щелочноземельными металлами включают соли кальция и магния, и примеры солей металлов включают соли железа и цинка. Примеры солей органических аминов включают соли с триэтилендиамином, 2-аминоэтанолом, 2,2-иминобис(этанол), 1-дезокси-1-(метиламино)-2-D-сорбитом, 2-амино-2-(гидроксиметил)-1,3-пропандиолом, прокаином и N,N-бис(фенилметил)-1,2-этандиамином.
[0072] В офтальмологическом препарате пролонгированного действия по настоящему изобретению, хотя нет никаких конкретных ограничений в отношении содержания содержащегося лекарственного средства, если оно является достаточным количеством для проявления желаемого фармакологического эффекта, оно составляет предпочтительно от 0,001% (масс./об.) до 30% (масс./об.), более предпочтительно от 0,01% (масс./об.) до 25% (масс./об.), еще более предпочтительно от 0,1% (масс./об.) до 20% (масс./об.), еще более предпочтительно от 0,5% (масс./об.) до 15% (масс./об.), особенно предпочтительно от 1% (масс./об.) до 12% (масс./об.) и наиболее предпочтительно 1% (масс./об.), 1,5% (масс./об.), 2% (масс./об.), 2,5% (масс./об.), 3% (масс./об.), 3,5% (масс./об.), 4% (масс./об.), 5% (масс./об.), 6% (масс./об.), 7% (масс./об.), 8% (масс./об.), 9% (масс./об.), 10% (масс./об.), 11% (масс./об.) или 12% (масс./об.). % (масс./об.) обозначает массу (г) компонента (то есть лекарственного средства в этом абзаце) в 100 мл офтальмологического препарата пролонгированного действия по настоящему изобретению. Это же самое применимо, если конкретно не указано иное.
[0073] Бензилбензоат, содержащийся в офтальмологическом препарате пролонгированного действия по настоящему изобретению, представляет собой соединение, представленное химической формулой: PhCO2CH2Ph.
[0074] Бензиловый спирт, содержащийся в офтальмологическом препарате пролонгированного действия по настоящему изобретению, представляет собой соединение, представленное химической формулой: PhCH2OH.
[0075] В офтальмологическом препарате пролонгированного действия по настоящему изобретению содержание бензилбензоата и/или бензилового спирта составляет предпочтительно от 15% (масс./масс.) до 75% (масс./масс.), более предпочтительно от 20% (масс./масс.) до 70% (масс./масс.), еще более предпочтительно от 25% (масс./масс.) до 60% (масс./масс.), еще более предпочтительно от 27% (масс./масс.) до 55% (масс./масс.), особенно предпочтительно от 30% (масс./масс.) до 50% (масс./масс.) и наиболее предпочтительно от 35% (масс./масс.) до 48% (масс./масс.). % (масс./масс.) обозначает массу (г) компонента (то есть бензилбензоата и/или бензилового спирта в этом абзаце) в 100 г офтальмологического препарата пролонгированного действия по настоящему изобретению. Это же самое применимо, если конкретно не указано иное.
[0076] Полиэтиленгликоль (ПЭГ), содержащийся в офтальмологическом препарате пролонгированного действия по настоящему изобретению, представляет собой полиэфир, полученный полимеризацией этиленгликоля, представленный общей формулой: HO(CH2CH2O)nH, и n представляет собой степень полимеризации. В случае полиэтиленгликоля (ПЭГ) можно использовать коммерчески доступный продукт или полученный в соответствии с обычным способом в соответствующей технической области.
[0077] В офтальмологическом препарате пролонгированного действия по настоящему изобретению средняя молекулярная масса полиэтиленгликоля составляет предпочтительно от 90 до 2200, более предпочтительно от 100 до 2000, еще более предпочтительно от 150 до 1500, еще более предпочтительно от 200 до 1300, особенно предпочтительно 300 до 1200, более конкретно от 360 до 1100 и наиболее предпочтительно от 400 до 1000. Конкретные примеры полиэтиленгликоля включают ПЭГ100, ПЭГ200, ПЭГ300, ПЭГ400, ПЭГ600, ПЭГ800 и ПЭГ1000.
[0078] В офтальмологическом препарате пролонгированного действия по настоящему изобретению содержание полиэтиленгликоля составляет предпочтительно от 15% (масс./масс.) до 75% (масс./масс.), более предпочтительно от 20% (масс./масс.) до 70% (масс./масс.), еще более предпочтительно от 30% (масс./масс.) до 62% (масс./масс.), особенно предпочтительно от 40% (масс./масс.) до 60% (масс./масс.) и наиболее предпочтительно 43% (масс./масс.) до 57% (масс./масс.).
[0079] Диметилсульфоксид (ДМСО), содержащийся в офтальмологическом препарате пролонгированного действия по настоящему изобретению, представляет собой соединение, представленное химической формулой: CH3SOCH3.
[0080] В офтальмологическом препарате пролонгированного действия по настоящему изобретению содержание диметилсульфоксида составляет предпочтительно от 15% (масс./масс.) до 75% (масс./масс.), более предпочтительно от 20% (масс./масс.) до 70% (масс./масс.), еще более предпочтительно от 30% (масс./масс.) до 62% (масс./масс.), особенно предпочтительно от 40% (масс./масс.) до 60% (масс./масс.) и наиболее предпочтительно от 43% (масс./масс.) до 57% (масс./масс.).
[0081] Общая масса бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида, содержащихся в офтальмологическом препарате пролонгированного действия по настоящему изобретению, составляет 50% (масс./масс.) или более и предпочтительно 80% (масс./масс.) или более от общей массы офтальмологического препарата пролонгированного действия. Кроме того, общая масса бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида, содержащихся в офтальмологическом препарате пролонгированного действия по настоящему изобретению, составляет предпочтительно от 60% (масс./масс.) до 99,99% (масс./масс.), более предпочтительно от 70% (масс./масс.) до 99,99% (масс./масс.), еще более предпочтительно от 80% (масс./масс.) до 99,5% (масс./масс.), особенно предпочтительно от 85% (масс./масс.) до 99,3% (масс./масс.) и наиболее предпочтительно от 90% (масс./масс.) до 99% (масс./масс.).
[0082] Объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду, содержащихся в офтальмологическом препарате пролонгированного действия по настоящему изобретению, составляет от 75:25 до 25:75, предпочтительно от 60:40 до 35:65, более предпочтительно от 50:50 до 40:60 и наиболее предпочтительно от 45:55 до 40:60. Кроме того, объем рассчитывают на основе объема бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида при 25°C и 1 атм.
[0083] По мере необходимости в офтальмологическом препарате пролонгированного действия по настоящему изобретению может быть использована добавка.
[0084] Когда в офтальмологический препарат пролонгированного действия по настоящему изобретению включают добавки, количество добавок может быть соответствующим образом скорректировано в зависимости от типов добавок или тому подобного, и общее количество добавок составляет предпочтительно от 0,0001% (масс./об.) до 30% (масс./об.), более предпочтительно от 0,001% (масс./об.) до 25% (масс./об.), еще более предпочтительно от 0,01% (масс./об.) до 20% (масс./об.), особенно предпочтительно от 0,1% (масс./об.) до 15% (масс./об.) и наиболее предпочтительно от 1% (масс./об.) до 10% (масс./об.).
[0085] К офтальмологическому препарату пролонгированного действия по настоящему изобретению в качестве добавок, которые могут быть использованы для фармацевтических препаратов, при необходимости могут быть добавлены, например, поверхностно-активные вещества, буферные агенты, средства, регулирующие тоничность, стабилизаторы, консерванты, антиоксиданты, высокомолекулярные полимеры и растворители.
[0086] Примеры поверхностно-активных веществ, пригодных для использования в качестве фармацевтических добавок, которые могут быть включены в офтальмологический препарат пролонгированного действия по настоящему изобретению, включают катионные поверхностно-активные вещества, анионные поверхностно-активные вещества и неионные поверхностно-активные вещества. Примеры анионных поверхностно-активных веществ включают фосфолипиды, а примеры фосфолипидов включают лецитин. Примеры катионных поверхностно-активных веществ включают соли алкиламина, аддукты алкиламина и полиоксиэтилена, соли сложных моноэфиров триэтаноламина и жирных кислот, соли ациламиноэтилдиэтиламина, конденсаты полиаминов и жирных кислот, алкилтриметиламмониевые соли, диалкилдиметиламмониевые соли, алкилдиметилбензиламмониевые соли, алкилпиридиниевые соли, ациламиноалкиламмониевые соли, ациламиноалкилпиридиниевые соли, диацилоксиэтиламмониевые соли, алкилимидазолины, 1-ациламиноэтил-2-алкилимидазолины и 1-гидроксиэтил-2-алкилимидазолины. Примеры алкилдиметилбензиламмониевых солей включают бензалкония хлорид и цеталкония хлорид. Примеры неионогенных поверхностно-активных веществ включают сложные эфиры полиоксиэтилена и жирных кислот, сложные эфиры полиоксиэтиленсорбита и жирных кислот, полиоксиэтилен гидрогенизированное касторовое масло, полиоксиэтиленовое касторовое масло, полиоксиэтиленполиоксипропиленгликоль, сложные эфиры сахарозы и жирных кислот и витамин Е-ТПГС.
[0087] Примеры сложных эфиров полиоксиэтилена и жирных кислот включают Полиоксил 40 стеарат.
[0088] Примеры сложных эфиров полиоксиэтиленсорбита и жирных кислот включают Полисорбат 80, Полисорбат 60, Полисорбат 40, полиоксиэтиленсорбита монолаурат, полиоксиэтиленсорбита триолеат и Полисорбат 65.
[0089] В случае полиоксиэтилен гидрогенизированного касторового масла могут быть использованы различные полиоксиэтилен гидрогенизированные касторовые масла, имеющие различную степень полимеризации этиленоксида, и степень полимеризации этиленоксида составляет предпочтительно от 10 до 100, более предпочтительно от 20 до 80, особенно предпочтительно 40 до 70 и наиболее предпочтительно 60. Конкретные примеры полиоксиэтилен гидрогенизированных касторовых масел включают полиоксиэтилен (10) гидрогенизированное касторовое масло, полиоксиэтилен (40) гидрогенизированное касторовое масло, полиоксиэтилен (50) гидрогенизированное касторовое масло и полиоксиэтилен (60) гидрогенизированное касторовое масло.
[0090] В случае полиоксиэтиленового касторового масла могут быть использованы различные полиоксиэтиленовые касторовые масла с различной степенью полимеризации этиленоксида, и степень полимеризации этиленоксида составляет предпочтительно от 5 до 100, более предпочтительно от 20 до 50, особенно предпочтительно от 30 до 40 и наиболее предпочтительно 35. Конкретные примеры полиоксиэтиленовых касторовых масел включают Полиоксил 5 касторовое масло, Полиоксил 9 касторовое масло, Полиоксил 15 касторовое масло, Полиоксил 35 касторовое масло и Полиоксил 40 касторовое масло.
[0091] Примеры полиоксиэтиленполиоксипропиленгликолей включают полиоксиэтилен (160) полиоксипропилен (30) гликоль, полиоксиэтилен (42) полиоксипропилен (67) гликоль, полиоксиэтилен (54) полиоксипропилен (39) гликоль, полиоксиэтилен (196) полиоксипропилен (67) гликоль и полиоксиэтилен (20) полиоксипропилен (20) гликоль.
[0092] Примеры эфиров сахарозы и жирных кислот включают стеарат сахарозы.
[0093] Витамин Е-ТПГС также называют токоферол полиэтиленгликоль 1000 сукцинатом.
[0094] Когда в офтальмологический препарат пролонгированного действия по настоящему изобретению включают поверхностно-активное вещество, количество поверхностно-активного вещества может быть соответствующим образом скорректировано в зависимости от типа поверхностно-активного вещества или тому подобного, и количество поверхностно-активного вещества составляет предпочтительно от 0,001% (масс./об.) до 10% (масс./об.), более предпочтительно от 0,01% (масс./об.) до 5% (масс./об.), еще более предпочтительно от 0,05% (масс./об.) до 3% (масс./об.) и наиболее предпочтительно 0,1% (масс./об.) до 2% (масс./об.).
[0095] Буфер, пригодный для использования в качестве фармацевтической добавки, может быть включен в офтальмологический препарат пролонгированного действия по настоящему изобретению. Примеры буферов включают фосфорную кислоту или ее соли, борную кислоту или ее соли, лимонную кислоту или ее соли, уксусную кислоту или ее соли, угольную кислоту или ее соли, винную кислоту или ее соли, ε-аминокапроновую кислоту или ее соли и трометамол. Примеры фосфатов включают фосфат натрия, дигидрофосфат натрия, гидрофосфат динатрия, фосфат калия, дигидрофосфат калия и гидрофосфат дикалия, примеры боратов включают буру, борат натрия и борат калия, примеры цитратов включают цитрат натрия и цитрат динатрия, примеры ацетатов включают ацетат натрия и ацетат калия, примеры карбонатов включают карбонат натрия и бикарбонат натрия, и примеры тартратов включают тартрат натрия и тартрат калия.
[0096] Когда в офтальмологический препарат пролонгированного действия по настоящему изобретению включают буферный агент, количество буферного агента может быть соответствующим образом скорректировано в зависимости от типа буферного агента или тому подобного, и количество буферного агента составляет предпочтительно от 0,001% (масс./об.) до 10% (масс./об.), более предпочтительно от 0,01% (масс./об.) до 5% (масс./об.), еще более предпочтительно от 0,05% (масс./об.) до 3% (масс./об.) и наиболее предпочтительно от 0,1% (масс./об.) до 2% (масс./об.).
[0097] Средство, регулирующее тоничность, пригодное для использования в качестве фармацевтической добавки, может быть соответствующим образом включено в офтальмологический препарат пролонгированного действия по настоящему изобретению. Примеры средств, регулирующих тоничность, включают ионные средства, регулирующие тоничность, и неионные средства, регулирующие тоничность. Примеры ионных средств, регулирующих тоничность, включают хлорид натрия, хлорид калия, хлорид кальция и хлорид магния, и примеры неионных средств, регулирующих тоничность, включают глицерин, пропиленгликоль, сорбит и маннит.
[0098] Когда в офтальмологический препарат пролонгированного действия по настоящему изобретению включают средство, регулирующее тоничность, количество средства, регулирующего тоничность, может быть соответствующим образом скорректировано в зависимости от типа средства, регулирующего тоничность, или тому подобного, и количество средства, регулирующего тоничность, составляет предпочтительно от 0,001% (масс./об.) до 10% (масс./об.), более предпочтительно от 0,01% (масс./об.) до 5% (масс./об.), еще более предпочтительно от 0,05% (масс./об.) до 3% (масс./об.) и наиболее предпочтительно от 0,1% (масс./об.) до 2% (масс./об.).
[0099] Стабилизатор, пригодный для использования в качестве фармацевтической добавки, может быть соответствующим образом включен в офтальмологический препарат пролонгированного действия по настоящему изобретению. Примеры стабилизаторов включают эдетиновую кислоту, эдетат натрия и цитрат натрия.
[0100] Когда в офтальмологический препарат пролонгированного действия по настоящему изобретению включают стабилизатор, количество стабилизатора может быть соответствующим образом скорректировано в зависимости от типа стабилизатора или тому подобного, и количество стабилизатора составляет предпочтительно от 0,001% (масс./об.) до 10% (масс./об.), более предпочтительно от 0,01% (масс./об.) до 5% (масс./об.), еще более предпочтительно от 0,05% (масс./об.) до 3% (масс./об.) и наиболее предпочтительно от 0,1% (масс./об.) до 2% (масс./об.).
[0101] Консервант, пригодный для использования в качестве фармацевтической добавки, может быть соответствующим образом включен в офтальмологический препарат пролонгированного действия по настоящему изобретению. Примеры консервантов включают бензалкония хлорид, бензалкония бромид, бензетония хлорид, сорбиновую кислоту, сорбат калия, метилпараоксибензоат, пропилпараоксибензоат и хлорбутанол.
[0102] Когда в офтальмологический препарат пролонгированного действия по настоящему изобретению включают консервант, количество консерванта может быть соответствующим образом скорректировано в зависимости от типа консерванта или тому подобного, и количество консерванта составляет предпочтительно от 0,0001% (масс./об.) до 10% (масс./об.), более предпочтительно от 0,001% (масс./об.) до 5% (масс./об.), еще более предпочтительно от 0,005% (масс./об.) до 3% (масс./об.) и наиболее предпочтительно от 0,01% (масс./об.) до 2% (масс./об.).
[0103] Антиоксидант, пригодный для использования в качестве фармацевтической добавки, может быть соответствующим образом включен в офтальмологический препарат пролонгированного действия по настоящему изобретению. Примеры антиоксидантов включают аскорбиновую кислоту, токоферол, дибутилгидрокситолуол, бутилгидроксианизол, эриторбат натрия, пропилгаллат и сульфит натрия или их производные, с точки зрения более высокой степени стабилизации лекарственного средства (например, (2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пиридинкарбоксамид) или его соль), токоферол или его производные являются особенно предпочтительными. Примеры токоферола и его производных включают витамин Е, α-токоферол, β-токоферол, γ-токоферол, δ-токоферол и их сложные эфиры с уксусной кислотой, сложные эфиры с янтарной кислотой и их d-изомер, l-изомер, dl-изомеры.
[0104] Когда в офтальмологический препарат пролонгированного действия по настоящему изобретению включают антиоксидант, количество антиоксиданта может быть соответствующим образом скорректировано в зависимости от типа антиоксиданта или тому подобного, и количество антиоксиданта составляет предпочтительно от 0,001% (масс./об.) до 10% (масс./об.), более предпочтительно от 0,01% (масс./об.) до 5% (масс./об.), еще более предпочтительно от 0,05% (масс./об.) до 3% (масс./об.) и наиболее предпочтительно от 0,1% (масс./об.) до 2% (масс./об.).
[0105] Высокомолекулярный полимер, пригодный для использования в качестве фармацевтической добавки, может быть соответствующим образом включен в офтальмологический препарат пролонгированного действия по настоящему изобретению. Примеры высокомолекулярных полимеров включают метилцеллюлозу, этилцеллюлозу, гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилметилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу натрия, сукцинат ацетат гидроксипропилметилцеллюлозы, фталат гидроксипропилметилцеллюлозы, карбоксиметилэтилцеллюлозу, фталат ацетат целлюлозы, поливинилпирролидон, поливиниловый спирт, карбоксивиниловый полимер и полиэтиленгликоль.
[0106] Когда в офтальмологический препарат пролонгированного действия по настоящему изобретению включают высокомолекулярный полимер, количество высокомолекулярного полимера может быть соответствующим образом скорректировано в зависимости от типа высокомолекулярного полимера или тому подобного, и количество высокомолекулярного полимера составляет предпочтительно от 0,001% (масс./об.) до 10% (масс./об.), более предпочтительно от 0,01% (масс./об.) до 5% (масс./об.), еще более предпочтительно от 0,05% (масс./об.) до 3% (масс./об.) и наиболее предпочтительно от 0,1% (масс./об.) до 2% (масс./об.).
[0107] Растворитель, пригодный для использования в качестве фармацевтической добавки, может быть соответствующим образом включен в офтальмологический препарат пролонгированного действия по настоящему изобретению. Примеры растворителей включают N-метилпирролидон, N,N-диметилацетоамид и этанол.
[0108] Когда в офтальмологический препарат пролонгированного действия по настоящему изобретению включают растворитель, количество растворителя может быть соответствующим образом скорректировано в зависимости от типа растворителя или тому подобного, и количество растворителя составляет предпочтительно от 0,1% (масс./об.) до 20% (масс./об.), более предпочтительно от 0,5% (масс./об.) до 15% (масс./об.), еще более предпочтительно от 1% (масс./об.) до 10% (масс./об.) и наиболее предпочтительно от 2% (масс./об.) до 5% (масс./об.).
[0109] Конкретным вариантом офтальмологического препарата пролонгированного действия по настоящему изобретению является офтальмологический препарат пролонгированного действия, по существу содержащий только соединение, представленное формулой (1), или его соль, бензилбензоат и полиэтиленгликоль.
[0110] Другим конкретным вариантом офтальмологического препарата пролонгированного действия по настоящему изобретению является офтальмологический препарат пролонгированного действия, по существу содержащий только соединение, представленное формулой (1), или его соль, бензилбензоат и диметилсульфоксид.
[0111] Другим конкретным вариантом офтальмологического препарата пролонгированного действия по настоящему изобретению является офтальмологический препарат пролонгированного действия, по существу содержащий только соединение, представленное формулой (1), или его соль, бензилбензоат, полиэтиленгликоль и токоферол или его производные.
[0112] Другим конкретным вариантом офтальмологического препарата пролонгированного действия по настоящему изобретению является офтальмологический препарат пролонгированного действия, по существу содержащий только соединение, представленное формулой (1), или его соль, бензилбензоат, диметилсульфоксид и токоферол или его производные.
[0113] Другим конкретным вариантом офтальмологического препарата пролонгированного действия по настоящему изобретению является офтальмологический препарат пролонгированного действия, по существу содержащий только соединение, представленное формулой (2), или его соль, бензилбензоат и полиэтиленгликоль.
[0114] Другим конкретным вариантом офтальмологического препарата пролонгированного действия по настоящему изобретению является офтальмологический препарат пролонгированного действия, по существу содержащий только соединение, представленное формулой (2), или его соль, бензилбензоат и диметилсульфоксид.
[0115] Другим конкретным вариантом офтальмологического препарата пролонгированного действия по настоящему изобретению является офтальмологический препарат пролонгированного действия, по существу содержащий только соединение, представленное формулой (2), или его соль, бензилбензоат, полиэтиленгликоль и токоферол или его производные.
[0116] Другим конкретным вариантом офтальмологического препарата пролонгированного действия по настоящему изобретению является офтальмологический препарат пролонгированного действия, по существу содержащий только соединение, представленное формулой (2), или его соль, бензилбензоат, диметилсульфоксид и токоферол или его производные.
[0117] Офтальмологический препарат пролонгированного действия по настоящему изобретению может быть введен перорально или парентерально. Нет никаких конкретных ограничений в отношении дозированной формы офтальмического препарата пролонгированного действия по настоящему изобретению, если она пригодна для использования в качестве фармацевтического средства. Примеры дозированных форм включают пероральные препараты, такие как жидкости и суспензии, и парентеральные формы, такие как инъекции, трансфузионные жидкости, капли для носа, капли для ушей и глазные капли. Примеры предпочтительно включают офтальмологические инъекции и глазные капли, более предпочтительно офтальмологические инъекции и наиболее предпочтительно инъекции для введения в стекловидное тело, переднюю камеру или для субконъюнктивального введения. Эти дозированные формы могут быть получены в соответствии с обычными способами в соответствующей технической области.
[0118] Офтальмологический препарат пролонгированного действия по настоящему изобретению может быть соответствующим образом введен в соответствии с его дозированной формой. Например, в случае офтальмологической инъекции офтальмологический препарат пролонгированного действия по настоящему изобретению может быть введен в стекловидное тело, вблизи задней склеры, вокруг орбиты или между склерой и конъюнктивой. Например, в случае введения офтальмологической инъекции в стекловидное тело или переднюю камеру, хотя нет никаких конкретных ограничений в отношении дозы, если она представляет собой количество, достаточное для проявления желаемого фармакологического эффекта, доза составляет предпочтительно от 1 мкл до 100 мкл, более предпочтительно от 5 мкл до 70 мкл, еще более предпочтительно от 10 мкл до 60 мкл, особенно предпочтительно от 20 мкл до 50 мкл и наиболее предпочтительно 20 мкл, 25 мкл, 30 мкл, 35 мкл, 40 мкл, 45 мкл или 50 мкл на одно введение. В случае введения офтальмологической инъекции субконъюнктивно, хотя нет конкретных ограничений в отношении дозы, если она представляет собой количество, достаточное для демонстрации желаемого фармакологического эффекта, доза составляет предпочтительно от 10 мкл до 1000 мкл, более предпочтительно от 20 мкл до 800 мкл, еще более предпочтительно от 50 мкл до 700 мкл, особенно предпочтительно от 100 мкл до 500 мкл и наиболее предпочтительно 100 мкл, 200 мкл, 300 мкл, 400 мкл или 500 мкл на одно введение. Доза препарата составляет предпочтительно от 0,001 мг/глаз до 30 мг/глаз, более предпочтительно от 0,01 мг/глаз до 10 мг/глаз, еще более предпочтительно от 0,1 мг/глаз до 5 мг/глаз, особенно предпочтительно от 0,2 мг/глаз до 1,6 мг/глаз и наиболее предпочтительно 0,2 мг/глаз, 0,3 мг/глаз, 0,4 мг/глаз, 0,5 мг/глаз, 0,6 мг/глаз, 0,7 мг/глаз, 0,8 мг/глаз, 1 мг/глаз, 1,2 мг/глаз, 1,4 мг/глаз или 1,6 мг/глаз.
[0119] В случае последовательного введения офтальмологического препарата пролонгированного действия по настоящему изобретению в стекловидное тело или переднюю камеру, хотя нет конкретных ограничений в отношении интервала введения, если он представляет собой количество, достаточное для демонстрации желаемого фармакологического эффекта, офтальмологический препарат пролонгированного действия по настоящему изобретению предпочтительно вводят с интервалом от одного раза в неделю до одного раза в три года, более предпочтительно вводят с интервалом один раз в неделю, один раз в две недели, один раз в месяц, один раз в два месяца, один раз в три месяца, один раз в четыре месяца, один раз в пять месяцев, один раз в шесть месяцев, один раз в год, один раз в два года или один раз в три года и, наиболее предпочтительно, с интервалом один раз в два месяца, один раз в три месяца, один раз в четыре месяца, один раз в пять месяцев, один раз в шесть месяцев или один раз в год. Кроме того, интервал введения может быть соответствующим образом изменен.
[0120] Офтальмологический препарат пролонгированного действия по настоящему изобретению полезен в качестве фармацевтического средства и может использоваться в качестве профилактического или терапевтического средства для заболеваний глаз, таких как возрастная макулярня дегенерация, диабетическая ретинопатия, ретинопатия недоношенных, окклюзия вены сетчатки, окклюзия артерии сетчатки, полипоидная хориоидальная васкулопатия, ретинальная ангиоматозня пролиферация, миопическая хориоидальная неоваскуляризация, диабетический макулярный отек, окулярная опухоль, радиационная ретинопатия, рубеоз радужки, неоваскулярная глаукома, пролиферативная витреоретинопатия (PVR), первичная открытоугольная глаукома, вторичная открытоугольная глаукома, глаукома с нормальным давлением, гиперсекреторная глаукома, первичная закрытоугольная глаукома, вторичная закрытоугольная глаукома, глаукома с плоской радужкой, глаукома с комбинированным механизмом, развивающаяся глаукома, стероидная глаукома, эксфолиативная глаукома, амилоидотическая глаукома, неоваскулярная глаукома, злокачественная глаукома, капсулярная глаукома, синдром плоской радужки и глаукома с высоким давлением. Офтальмологический препарат пролонгированного действия по настоящему изобретению более предпочтительно можно использовать в качестве профилактического или терапевтического средства для заболеваний глаз, таких как возрастная макулярня дегенерация, диабетическая ретинопатия, первичная открытоугольная глаукома, глаукома с нормальным давлением, первичная закрытоугольная глаукома и глаукома с высоким давлением.
[0121] Офтальмологический препарат пролонгированного действия по настоящему изобретению может содержаться в контейнере, используемом для фармацевтических препаратов, например, герметичном контейнере, особенно в ампуле, флаконе, шприце или тому подобном. Нет конкретных ограничений в отношении контейнера, в котором содержится офтальмологический препарат пролонгированного действия по настоящему изобретению. Примеры таких контейнеров включают те, которые сделаны из циклоолефинового полимера, стекла, полиолефина, такого как полиэтилен и полипропилен, поликарбоната или тому подобного. С точки зрения влияния офтальмологического препарата пролонгированного действия на стабильность контейнера предпочтительным является использование шприца из циклоолефинового полимера, полипропилена или стекла.
[0122] Офтальмологический препарат пролонгированного действия по настоящему изобретению можно хранить при температуре от -10 до 30°C, предпочтительно от -5 до 30°C, более предпочтительно от 0 до 30°C, в течение длительного времени, более 6 месяцев, предпочтительно более 1 года, более предпочтительно 2 года, наиболее предпочтительно 3 года. Оставшееся соотношение лекарственного средства в офтальмологическом препарате пролонгированного действия по настоящему изобретению при длительном хранении составляет предпочтительно от 90 до 100%, более предпочтительно от 95 до 100% и наиболее предпочтительно от 98 до 100%.
[0123] Вышеописанное описание офтальмологического препарата пролонгированного действия по настоящему изобретению применимо к способу по настоящему изобретению для стабилизации лекарственного средства в офтальмологическом препарате пролонгированного действия.
[0124] Способ по настоящему изобретению для стабилизации лекарственного средства в офтальмологическом препарате пролонгированного действия представляет собой способ, в котором лекарственное средство, содержащееся в офтальмологическом препарате пролонгированного действия, стабилизируется путем включения токоферола или его производных в препарат,
при этом препарат содержит:
бензилбензоат и/или бензиловый спирт, и
полиэтиленгликоль и/или диметилсульфоксид, где,
объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду в офтальмологическом препарате пролонгированного действия составляет от 75:25 до 25:75, и
общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 50% (масс./масс.) или более.
[0125] Хотя ниже приведены примеры препаратов и примеры испытаний, они предназначены для облегчения лучшего понимания настоящего изобретения и не ограничивают объем настоящего изобретения.
[0126] Примеры препаратов
Ниже приведены типичные примеры препаратов по настоящему изобретению.
[0127] Пример препарата 1
[0128] Пример препарата 2
[0129] Пример препарата 3
[0130] Пример препарата 4
[0131] Пример препарата 5
[0132] Пример препарата 6
[0133] Пример препарата 7
[0134] Пример препарата 8
[0135] Пример препарата 9
[0136] Пример препарата 10
[0137] Пример препарата 11
[0138] Пример препарата 12
[0139] Пример препарата 13
[0140] Кроме того, включенные количества лекарственного средства, бензилбензоата, бензилового спирта, полиэтиленгликоля и диметилсульфоксида в вышеупомянутых примерах препаратов 1-13 могут быть соответствующим образом скорректированы для получения желаемой композиции.
[Примеры]
[0141] 1. Тест для оценки образования депо (1)
Оценивали образование депо офтальмологического препарата пролонгированного действия по настоящему изобретению, не содержащего лекарственное средство.
[0142] 1-1. Получение испытуемых препаратов
300 мкл полиэтиленгликоля 400 (Croda) и 700 мкл бензилбензоата (Sigma-Aldrich) смешивали и перемешивали с получением препарата согласно примеру 1.
[0143] Препараты согласно примеру 2, примеру 3 и сравнительному примеру 1, показанные в таблице 1, получали с использованием того же способа, что и способ получения примера 1.
[0144] 1-2. Способ испытания
5 мл физиологического раствора помещали в стеклянный флакон. 50 мкл испытуемого препарата вводили в физиологический раствор с использованием инъекционной иглы 30G и шприца Гамильтон. После инъекции визуально подтверждали наличие или отсутствие образования депо испытуемым препаратом. Кроме того, аналогичные испытания проводили с использованием 1% и 2% водных растворов гипромеллозы вместо физиологического раствора.
[0145] 1-3. Результаты испытаний и обсуждение
Результаты испытаний показаны в таблице 1.
[0146] [Таблица 1]
ПГ400
300 мкл
500 мкл
700 мкл
900 мкл
ο: Образовывалось сферическое депо
×: Депо не образовывалось
[0147] [Таблица 2]
ПЭГ200
300 мкл
500 мкл
700 мкл
900 мкл
ο: Образовывалось сферическое депо
×: Депо не образовывалось
[0148] [Таблица 3]
ПЭГ1000
300 мкл
500 мкл
700 мкл
900 мкл
ο: Образовывалось сферическое депо
-: Препарат после получения затвердевал
[0149] [Таблица 4]
ДМСО
500 мкл
700 мкл
900 мкл
ο: Образовывалось сферическое депо
×: Депо не образовывалось
[0150] Как указано в таблицах 1-4, препараты согласно примерам 1-11 образовывали одинаковые депо сферических форм даже после того, как их инъецировали в растворы с различной вязкостью. С другой стороны, хотя препараты согласно сравнительным примерам 1, 2 и 4 образовывали сферические депо в 2% водном растворе гипромеллозы, они не образовывали депо в физиологическом растворе и 1% водном растворе гипромеллозы. Кроме того, поскольку препарат согласно сравнительному примеру 3 затвердевал после получения, он не мог быть введен с помощью шприца. Исходя из вышесказанного, было подтверждено, что офтальмологический препарат пролонгированного действия по настоящему изобретению образует одинаковые депо сферических форм независимо от участка введения или условий вокруг этого участка.
[0151] 2. Тест для оценки образования депо (2)
Оценивали образование депо офтальмологического препарата пролонгированного действия по настоящему изобретению, который содержал лекарственное средство.
[0152] 2-1. Получение испытуемых препаратов
Соединение, представленное формулой (2) (2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пиридинкарбоксамид, далее также именуемое как соединение A), получали в соответствии со способом, описанным в публикации не прошедшей экспертизу заявки на патент США № 2007/0149574. 2,75 мл полиэтиленгликоля 400 (Croda) добавляли к 0,16 г соединения A и перемешивали, и после того как соединение A растворилось, добавляли 2,25 мл бензилбензоата (Sigma-Aldrich) и перемешивали с получением препарата согласно примеру 12.
[0153] Препараты согласно примеру 13, примеру 14 и сравнительному примеру 5, показанные в таблице 5, получали с использованием того же способа, что и способ получения примера 12.
[0154] 2-2. Способ испытания
5 мл физиологического раствора помещали в стеклянный флакон. 50 мкл испытуемого препарата вводили в физиологический раствор с использованием инъекционной иглы 30G и шприца Гамильтон. После инъекции визуально подтверждали наличие или отсутствие образования депо испытуемым препаратом. Кроме того, аналогичные испытания проводили с использованием 1% и 2% водных растворов гипромеллозы вместо физиологического раствора.
[0155] 2-3. Результаты испытаний и обсуждение
Результаты испытаний показаны в таблице 5.
[0156] [Таблица 5]
Бензилбензоат
Бензиловый спирт
ПЭГ400
Диметилсульфоксид
2,75 мл
-
-
2,75 мл
-
0,25 мл
0,25 мл
-
-
5 мл
-
ο: Образовывалось сферическое депо
×: Депо не образовывалось
[0157] Как показано в таблице 5, препараты согласно примерам 12-14 образовывали одинаковые депо сферических форм даже после того, как их инъецировали в растворы с различной вязкостью. С другой стороны, хотя препарат согласно сравнительному примеру 5 образовывал сферическое депо в 2% водном растворе гипромеллозы, он не образовывал депо в физиологическом растворе и 1% водном растворе гипромеллозы. Исходя из вышесказанного, было подтверждено, что офтальмологический препарат пролонгированного действия по настоящему изобретению образует одинаковые депо сферических форм независимо от участка введения или условий вокруг этого участка.
[0158] 3. Тест для оценки образования депо (3)
Оценивали образование депо офтальмологического препарата пролонгированного действия по настоящему изобретению, который содержал лекарственное средство.
[0159] 3-1. Получение испытуемых препаратов
Препараты согласно примерам 15-21, показанные в таблице 6, получали с использованием того же способа, что и способ получения примера 12.
[0160] 3-2. Способ испытания
5 мл физиологического раствора помещали в стеклянный флакон. 50 мкл испытуемого препарата вводили в физиологический раствор с использованием инъекционной иглы 30G и шприца Гамильтон. После инъекции визуально подтверждали наличие или отсутствие образования депо испытуемым препаратом.
[0161] 3-3. Результаты испытаний и обсуждение
Результаты испытаний показаны в таблице 6.
[0162] [Таблица 6]
Бензилбензоат
ПЭГ400
Диметилсульфоксид
214 мкл
500 мкл
-
333 мкл
500 мкл
-
500 мкл
500 мкл
-
750 мкл
500 мкл
-
1167 мкл
500 мкл
-
600 мкл
-
400 мкл
700 мкл
-
300 мкл
ο: Образовывалось сферическое депо
[0163] Как показано в таблице 6, отличающиеся от описанного выше препарата согласно сравнительному примеру 5, препараты согласно примерам 15-21 образовывали одинаковые депо сферических форм после инъецирования в физиологический раствор. Исходя из вышесказанного, было подтверждено, что офтальмологический препарат пролонгированного действия по настоящему изобретению образует одинаковые депо сферических форм независимо от участка введения или условий вокруг этого участка.
[0164] 4. Тест на устойчивое высвобождение лекарственного средства
Проверяли уровни удержания лекарственного средства в депо, образованных офтальмологическим препаратом пролонгированного действия по настоящему изобретению, который содержал лекарственное средство.
[0165] 4-1. Получение испытуемых препаратов
Препараты согласно примерам 22-25 и сравнительному примеру 6, имеющие соотношения компонентов, показанные в таблице 7, получали с использованием того же способа, что и способ получения примера 12.
[0166] 4-2. Способ испытания
5 мл физиологического раствора помещали в стеклянный флакон. 20 мкл или 50 мкл испытуемого препарата вводили в физиологический раствор с использованием инъекционной иглы 30G и шприца Гамильтон. Примерно через 1 час депо, образованное после инъекции, выделяли, и количество соединения А в депо и в остаточной жидкости определяли с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) для расчета уровня удержания (%) соединения A в депо. Кроме того, аналогичные эксперименты проводили для примера 23 и сравнительного примера 6 с использованием 1% и 2% водных растворов гипромеллозы вместо физиологического раствора.
[0167] 4-3. Результаты испытаний и обсуждение
Результаты испытаний, состоящих из инъекций в физиологический раствор, показаны в таблице 7, результаты испытаний, состоящих из инъекций в 1% водный раствор гипромеллозы, показаны в таблице 8, и результаты испытания, состоящего из инъекций в 2% водный раствор гипромеллозы, показаны в таблице 9.
[0168] [Таблица 7]
Бензилбензоат
ПЭГ400
Диметилсульфоксид
dl-α-Токоферол
30 мл
-
-
45 мл
-
-
-
30 мл
-
40 мл
-
5 мл
100 мл
-
-
(мг/мл)
(мг/мл)
ο: Образовывалось сферическое депо
×: Депо не образовывалось
н.д.: Нет данных
[0169] [Таблица 8]
23
Бензилбензоат
ПЭГ400
45 мл
100 мл
ο: Образовывалось сферическое депо
×: Депо не образовывалось
[0170] [Таблица 9]
Бензилбензоат
ПЭГ400
45 мл
100 мл
ο: Образовывалось сферическое депо
[0171] Как показано в таблицах 7, 8 и 9, препараты согласно примерам 22-25 образовывали одинаковые депо сферических форм при инъецировании в физиологический раствор, и уровень удержания соединения A в депо составлял 90% или более. Кроме того, препарат согласно примеру 23 образовывал такое же депо сферической формы даже после инъецирования в 1% водный раствор гипромеллозы и 2% водный раствор гипромеллозы, и уровень удержания соединения A в депо составлял 70% или более. С другой стороны, препарат согласно сравнительному примеру 6 не образовывал депо даже при инъецировании в физиологический раствор и 1% водный раствор гипромеллозы, а соединение A высвобождалось в остаточную жидкость без сохранения в депо. В частности, в случае 1% водного раствора гипромеллозы, когда шприц вынимали из 1% водного раствора гипромеллозы, препарат согласно сравнительному примеру 6 был "тягучим" (проявлял тягучесть). Этот факт рассматривали как одну из причин неспособности образовывать сферическое депо. Такая тягучесть не была выявлена у препарата согласно примеру 23, который образовывал сферическое депо. Исходя из вышесказанного, было подтверждено, что офтальмологический препарат пролонгированного действия по настоящему изобретению образует одинаковые депо сферических форм и постепенно высвобождает лекарственное средство независимо от участка введения или условий вокруг этого участка.
[0172] 5. Тест на оценку интенсивности растворения лекарственного средства
Изучали интенсивность растворения лекарственного средства офтальмологического препарата пролонгированного действия по настоящему изобретению.
[0173] 5-1. Получение испытуемых препаратов
400 мкл диметилсульфоксида (Gaylord Chemical) добавляли к 0,08 г соединения A и после перемешивания и растворения добавляли 600 мкл бензилбензоата (Sigma-Aldrich), перемешивали и растворяли с получением препарата согласно примеру 26.
[0174] Препараты согласно примеру 27 и сравнительным примерам 7 и 8, имеющие соотношения компонентов, показанные в таблице 10, получали с использованием того же способа, что и способ получения примера 26.
[0175] 5-2. Способ испытания
Растворение испытуемых препаратов подтверждали визуально.
[0176] 5-3. Результаты испытаний и обсуждение
Результаты испытаний показаны в таблице 10.
[0177] [Таблица 10]
Бензилбензоат
Диметилсульфоксид
400 мкл
300 мкл
200 мкл
0 мкл
ο: Полностью растворялось
×: Полностью не растворялось
[0178] Как показано в таблице 10, в препаратах согласно примерам 26 и 27 соединение A полностью растворялось. С другой стороны, в препаратах согласно сравнительным примерам 7 и 8 соединение A полностью не растворялось. Исходя из вышесказанного, было подтверждено, что офтальмологический препарат пролонгированного действия по настоящему изобретению способен в достаточной мере растворять лекарственное средство.
[0179] 6. Тест для оценки образования депо у животного
Офтальмологический препарат пролонгированного действия по настоящему изобретению, содержащий лекарственное средство, вводили в стекловидное тело животного, и образование депо оценивали in vivo.
[0180] 6-1. Получение испытуемых препаратов
55 мл полиэтиленгликоля 400 (Croda) добавляли к 5 г соединению A для растворения соединения A при перемешивании. Препарат согласно примеру 28 получали дополнительно путем добавления 0,1 мл токоферола (Merck), и затем путем добавления бензилбензоата (Merck) до общего объема 100 мл. Препарат согласно сравнительному примеру 9, как показано в таблице 11, получали с использованием того же способа, что и способ получения примера 28.
[0181] [Таблица 11]
[0182] 6-2. Способ испытания
Испытуемые препараты интравитреально вводили белым кроликам (20 мкл/глаз) с использованием иглы 30 калибра, и через 4 часа после введения глаза энуклеировали. Что касается каждого из энуклеированных глаз, делали разрез в плоской части ресничного тела для удаления тканей переднего сегмента (таких как линза, роговица и тому подобное), и изображение состояния депо, образованного в глазу, получали с помощью камеры.
[0183] 6-3. Результаты испытаний и обсуждение
Результаты испытаний показаны на фиг. 1.
[0184] Как показано на фиг.1, препарат согласно примеру 28 образовывал сферическое депо с резко определенной границей между стекловидным телом и депо. С другой стороны, препарат согласно сравнительному примеру 9 образовывал депо с плохо определенной поверхностью раздела между стекловидным телом и депо и произвольной неустойчивой формой. Исходя из вышесказанного, было подтверждено, что офтальмологический препарат пролонгированного действия по настоящему изобретению образует сферическое депо даже при введении в стекловидное тело.
[0185] 7. Тест на совместимость со шприцем
Оценивали совместимость офтальмологического препарата пролонгированного действия по настоящему изобретению с различными шприцами.
[0186] 7-1. Получение испытуемого препарата
Препарат согласно примеру 29, как показано в таблице 12, получали с использованием того же способа, что и способ получения примера 28.
[0187] [Таблица 12]
[0188] 7-2. Способ испытания
Инъекционную иглу 23G прикрепляли к шприцам, показанным в таблице 13, и шприц заполняли приблизительно на 90% объема шприца препаратом согласно примеру 29. Инъекционную иглу заменяли инъекционной иглой 30G, и объем полости, образованной в инъекционной игле, заполняли препаратом. Шприц хранили при 25°C или 60°C в течение 6 часов. Через 6 часов визуально изучали состояние шприца.
[0189] 7-3. Результаты испытаний и обсуждение
Результаты испытаний показаны в таблице 13.
[0190] [Таблица 13]
Как показано в таблице 13, когда препарат согласно примеру 29 использовали в шприце, изготовленном из циклоолефинового полимера, полипропилена или стекла, в шприце не было обнаружено никаких изменений. С другой стороны, когда этот препарат использовали в шприце из поликарбоната, в шприце образовывались трещины. Предположили, что когда офтальмологический препарат пролонгированного действия по настоящему изобретению хранили в течение длительного периода времени в предварительно заполненном шприце, шприц, изготовленный из циклоолефинового полимера, полипропилена или стекла, являлся более подходящим, чем шприц из поликарбоната.
[0191] 8. Тест на устойчивость лекарственного средства
Оценивали стабильность лекарственного средства (соединение А) в офтальмологическом препарате пролонгированного действия по настоящему изобретению.
[0192] 8-1. Получение испытуемого препарата
К 1,25 г соединению A добавляли 30,8 г полиэтиленгликоля 400 (NOF CORPORATION) для растворения соединения A при перемешивании. Фармацевтическую композицию D получали дополнительно путем добавления 0,5 мл dl-α-токоферола (BASF), и затем путем добавления бензилбензоата (Sigma-Aldrich) до общего объема 50 мл. Стеклянный флакон объемом 2 мл (Wheaton, внутреннее содержимое 2,92 мл) заполняли 1,59 мл фармацевтической композиции и затем герметизировали резиновой пробкой с получением препарата согласно примеру 30.
[0193] Препараты согласно примерам 31-36, как показано в таблицах 14 и 15, получали, используя тот же способ, что и способ получения примера 30. Степень заполнения рассчитывали по объему фармацевтической композиции в контейнере/внутренний объем контейнера.
[0194] 8-2. Способ испытания
Что касается каждого из препаратов согласно примерам 30-36, количество соединения A, содержащегося в препарате после хранения в течение 4 недель при температуре 40°C и относительной влажности 20%, определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) и рассчитывали оставшееся содержание соединения A.
[0195] 8-3. Результаты испытаний и обсуждение
Результаты испытаний показаны в таблицах 14 и 15.
[0196] [Таблица 14]
30
31
32
33
34
(40°C/4 недели)
[0197] [Таблица 15]
(40°C/4 недели)
[0198] Как показано в таблицах 14 и 15, в препарате согласно примеру 36, не содержащем dl- α-токоферол, оставшееся содержание соединения A составляло 95% или более, и в каждом из препаратов согласно примерам 30-35, каждый из которых содержал dl-α-токоферол, оставшееся содержание соединения A составляло 97% или более, что было выше, чем первое. Исходя из вышесказанного, было предположено, что соединение A дополнительно стабилизировалось, когда токоферол или его производные содержались в офтальмологическом препарате пролонгированного действия по настоящему изобретению.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ПОЛИПЕПТИД | 2016 |
|
RU2726625C2 |
| ДЕПО-ПРЕПАРАТ, СОДЕРЖАЩИЙ СЛОЖНЫЙ ЭФИР ЛИМОННОЙ КИСЛОТЫ | 2016 |
|
RU2749952C2 |
| КОМПОЗИЦИИ ФУЛВЕСТРАНТА | 2018 |
|
RU2684330C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПАРЕНТЕРАЛЬНОЙ ДОСТАВКИ В ФОРМЕ ЛИОФИЛИЗАТА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2007 |
|
RU2370258C2 |
| МИКРОЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ СОЛИ ПЕПТИДОВ С ПОЛИЭФИРАМИ, ИМЕЮЩИМИ КОНЦЕВЫЕ КАРБОКСИГРУППЫ, И СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ | 1993 |
|
RU2152225C1 |
| ПРИМЕНЕНИЕ ПО НОВОМУ НАЗНАЧЕНИЮ БЕНЗИЛБЕНЗОАТА В КАЧЕСТВЕ АНТИГРИБКОВОГО СРЕДСТВА, ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АНТИМИКОЗНЫХ ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ | 2008 |
|
RU2573976C2 |
| ПРОЛЕКАРСТВА АБИРАТЕРОНА | 2020 |
|
RU2822219C2 |
| КОМПОЗИЦИИ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ | 2003 |
|
RU2355385C2 |
| ОФТАЛЬМИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЦВИТТЕРИОННЫХ МЯГКИХ КОНТАКТНЫХ ЛИНЗ | 2014 |
|
RU2670100C2 |
| ПРЕПАРАТЫ БУПРЕНОРФИНА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ | 2017 |
|
RU2747306C2 |

Группа изобретений относится к области медицины, а именно к офтальмологии, и предназначена для непрерывного высвобождения офтальмологического лекарственного средства. Офтальмологический депо-препарат содержит лекарственное средство, бензилбензоат и/или бензиловый спирт и полиэтиленгликоль и/или диметилсульфоксид. Объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду составляет от 75:25 до 25:75. Общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 50% (масс./масс.) или более. Указанный депо-препарат не содержит сополимер молочной и гликолевой кислот. Другим воплощением является контейнер, изготовленный из стекла, циклоолефинового полимера, полиолефина или поликарбоната и заполненный указанным депо-препаратом. Также раскрыт способ стабилизации 2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пиридинкарбоксамида или его соли, содержащегося в указанном офтальмологическом депо-препарате, путем введения токоферола или его производных в указанный депо-препарат. Использование группы изобретений обеспечивает постепенное непрерывное высвобождение лекарственного средства после его введения, причем указанный офтальмологический препарат способен одинаково образовывать депо независимо от участка введения или условий вокруг этого участка и стабильно достигать пролонгированного высвобождения лекарственного средства. 3 н. и 16 з.п. ф-лы, 1 ил., 15 табл., 36 пр.
1. Офтальмологический депо-препарат, содержащий:
лекарственное средство,
бензилбензоат и/или бензиловый спирт и
полиэтиленгликоль и/или диметилсульфоксид; в котором
объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду в офтальмологическом препарате пролонгированного действия составляет от 75:25 до 25:75 и
общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 50% (масс./масс.) или более и
который не содержит сополимер молочной и гликолевой кислот.
2. Офтальмологический депо-препарат по п.1, в котором лекарственное средство представляет собой соединение, представленное формулой (1):
[Химическая формула 4]

в которой
R1 представляет собой атом водорода, атом галогена, гидроксильную группу, C1-6 алкильную группу, C1-6 алкильную группу, замещенную одним или несколькими атомами галогена, C1-6 алкоксигруппу или C1-6 алкоксигруппу, замещенную одним или несколькими атомами галогена, и
R2 представляет собой атом водорода, C1-6 алкильную группу, C1-6 алкилкарбонильную группу или C1-6 алкилкарбонильную группу, замещенную одной или несколькими гидроксильными группами,
или его соль.
3. Офтальмологический депо-препарат по п.2, в котором в формуле (1)
R1 представляет собой C1-6 алкоксигруппу или C1-6 алкоксигруппу, замещенную одним или несколькими атомами галогена, и
R2 представляет собой C1-6 алкилкарбонильную группу или C1-6 алкилкарбонильную группу, замещенную одной или более гидроксильными группами.
4. Офтальмологический депо-препарат по п.2, в котором в формуле (1)
R1 представляет собой C1-6 алкоксигруппу, замещенную одним или более атомами галогена, и
R2 представляет собой C1-6 алкилкарбонильную группу, замещенную одной или более гидроксильными группами.
5. Офтальмологический депо-препарат по п.2, в котором соединение, представленное формулой (1), представляет собой 2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пиридинкарбоксамид или его соль.
6. Офтальмологический депо-препарат по любому из пп.1-5, в котором средняя молекулярная масса полиэтиленгликоля находится в пределах от 90 до 2200.
7. Офтальмологический депо-препарат по любому из пп.1-6, где полиэтиленгликоль представляет собой полиэтиленгликоль, выбранный из группы, состоящей из ПЭГ400, ПЭГ600, ПЭГ800 и ПЭГ1000.
8. Офтальмологический депо-препарат по любому из пп.1-7, в котором объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду составляет от 60:40 до 35:65.
9. Офтальмологический депо-препарат по любому из пп.1-7, в котором объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду составляет от 50:50 до 40:60.
10. Офтальмологический депо-препарат по любому из пп.1-9, в котором общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 80% (масс./масс.) или более.
11. Офтальмологический депо-препарат по любому из пп.1-10, в котором общее количество содержащегося бензилбензоата и/или бензилового спирта составляет от 25% (масс./масс.) до 60% (масс./масс.).
12. Офтальмологический депо-препарат по любому из пп.1-11, в котором общее количество содержащегося полиэтиленгликоля и/или диметилсульфоксида составляет от 30% (масс./масс.) до 62% (масс./масс.).
13. Офтальмологический депо-препарат по любому из пп.1-12, который дополнительно содержит токоферол или его производные.
14. Офтальмологический депо-препарат по п.13, в котором количество токоферола или его производных составляет от 0,001% (масс./об.) до 10% (масс./об.).
15. Офтальмологический депо-препарат по любому из пп.1-14, который предназначен для введения в стекловидное тело или переднюю камеру.
16. Офтальмологический депо-препарат по любому из пп.1-15, в котором лекарственное средство содержится в количестве от 0,001% (масс./об.) до 30% (масс./об.).
17. Офтальмологический депо-препарат по любому из пп.1-16, который предназначен для предупреждения и/или лечения болезни глаз.
18. Контейнер, изготовленный из стекла, циклоолефинового полимера, полиолефина или поликарбоната, заполненный офтальмологическим депо-препаратом по любому из пп.1-17.
19. Способ стабилизации 2-[[[2-[(гидроксиацетил)амино]-4-пиридинил]метил]тио]-N-[4-(трифторметокси)фенил]-3-пиридинкарбоксамида или его соли, содержащегося в офтальмологическом депо-препарате, путем введения токоферола или его производных в указанный офтальмологический депо-препарат,
указанный офтальмологический депо-препарат содержит:
бензилбензоат и/или бензиловый спирт и
полиэтиленгликоль и/или диметилсульфоксид, где
объемное отношение бензилбензоата и/или бензилового спирта к полиэтиленгликолю и/или диметилсульфоксиду в офтальмологическом депо-препарате составляет от 75:25 до 25:75 и
общее количество содержащихся бензилбензоата и/или бензилового спирта и полиэтиленгликоля и/или диметилсульфоксида составляет 50% (масс./масс.) или более.
| WO 2013036309 A2, 14.03.2013 | |||
| US 5980945 A, 09.11.1999 | |||
| Способ регулирования помола цементной шихты в мельнице | 1990 |
|
SU1717229A1 |
| WO 2009023877 A2, 19.02.2009 | |||
| WO 2006039336 A2, 13.04.2006. | |||
Авторы
Даты
2019-10-31—Публикация
2016-03-17—Подача