Изобретение относится к области медицины, а именно к способам выявления опухолевых клеток, находящихся в стадии эпителиально-мезенхимального перехода в асцитических жидкостях и солидных опухолях больных раком яичников.
Процесс эпителиально-мезенхимального перехода является одной из стадий канцерогенеза и метастазирования (Kalluri R. ЕМТ: When epithelial cells decide to become mesenchymal-like cells. // J Clin Invest., 2009, V. 119. №6, P. 1417-1419, Kalluri R. and Weinberg R.A. The basics of epithelial-mesenchymal transition. // J Clin Invest., 2009, V. 119, №6, P. 1420-1428). Он заключается в потере клетками опухоли свойств эпителия и приобретении свойств клеток мезенхимы. Это сопровождается откреплением клеток от базальной мембраны, потерей межклеточных контактов, изменением в экспрессии промежуточных филаментов и приобретением клетками подвижности. Обычно при исследовании эпителиально-мезенхимального перехода основное внимание уделяют замене белка межклеточных контактов Е-кадгерина на N-кадгерин и потере белка, связывающего их с актиновым цитоскелетом - бета-катепина (Vergara D., Merlot В., Lucot J.-P., Collinet P., Vinatier D., Fournier I., Salzet M. Epithelial-mesenchymal transition in ovarian cancer. // Cancer Letters, 2010, V. 291, P. 59-66). Менее изучена еще одна молекулярная особенность эпителиально-мезенхимального перехода - перестройка системы промежуточных филаментов: белки цитокератины частично замещаются белком виментином.
Цитокератины - белки промежуточных филаментов, которые специфически экспрессируются в эпителиальных клетках, нормальных и опухолевых. Виментии -специфический белок промежуточных филаментов. характерный для клеток мезенхимального происхождения, как нормальных, так и опухолевых (Rahmani А.Н., Babiker A.Y., Al Wanian W.M., Elsiddig S.A., Faragalla H.E., Aly S.M. Association of cytokeratin and vimentin protein in the genesis of transitional cell carcinoma of urinary bladder patients. // Dis Markers, 2015, Article ID 204759; Raymond W.A., Leong A.S. Co-expression of cytokeratin and vimentin intermediate filament proteins in benign and neoplastic breast epithelium. // J Pathol., 1989, V. 157, №4, P. 299-306).
Рак яичников представляет собой гетерогенную структуру, содержащую как опухолевые, так и нетрансформированные клетки: эпителиальные (экспрессирующие цитокератины) и соединительнотканные (экспрессирующие виментин). Для изучения эпителиально-мезенхимального перехода в такой системе необходимо выделить из общей популяции фракцию опухолевых клеток, находящихся в состоянии эпителиально-мезенхимального перехода. Данная фракция представляет собой совокупность клеток, экспрессирующих одновременно цитокератины и виментин.
Для выявления таких клеток памп был разработан метод двойного последовательного иммунофлуоресцентного окрашивания асцитных и солидных образцов с последующим анализом проб на проточном цитофлуориметре.
Известен иммуногистохимический метод детекции коэкспрессии виментина и цитокератина (Raymond W.A., Leong A.S. Co-expression of cytokeratin and vimentin intermediate filament proteins in benign and neoplastic breast epithelium. // J Pathol., 1989, Vol. 157, №4, P. 299-306). Недостатком метода является то, что он полуколичественный, т.е. отсутствует возможность точно оценить процент клеток, экспрессирующих как виментин, так и цитокератин.
Также существует способ иммунофлуоресцентного окрашивания клеток на виментин и цитокератин с последующим анализом флуоресценции на конфокальном флуоресцентном микроскопе, который принят нами за прототип (Lecharpentier A., Vielh Р., Perez-Moreno P., Planchard D., Soria J.С., Farace F. Detection of circulating tumour cells with a hybrid (epithelial/mesenchymal) phenotype in patients with metastatic non-small cell lung cancer. // British Journal of Cancer, 2011, 105, 1338-1341). Авторы использовали следующую методику:
Фильтры с иммобилизованными клетками инкубировали с:
1) антителами к виментину, конъюгированными с Alexa Fluor 488 (Santa Cruz Biotechnology, Heidelberg, Germany);
2) антителами к панцитокератину, конъюгированными с Alexa Fluor 647 (Cell Signalling. Danvers, MA, USA);
3) красителем SYTOX orange (Molecular Probes, Leiden, The Netherlands)
в течение ночи при +4 С. После отмывки ТБС (TBS, Tris-buffered saline) фильтры монтировали с помощью среды Ultramount (53001; Dako) и исследовали на конфокальном микроскопе.
К недостаткам описанного выше способа можно отнести использование только первичных антител, конъюгированных с флуоресцентным красителем, что увеличивает неспецифическую флуоресценцию. Также метод является полуколичественным и не позволяет точно определить размер популяции клеток, одновременно экспрессирующих цитокератин и виментин.
Задачей изобретения является создание нового более точного способа количественной оценки доли клеток в эпителиально-мезенхимальном переходе в асцитической жидкости и солидных опухолях больных раком яичников с помощью непрямого иммунофлуоресцентного окрашивания и проточной цитофлуориметрии.
Технический результат заключается в получении результатов проточной цитофлуориметрии в виде двухпараметрических гистограмм интенсивности флуоресценции (дот-плотов) в двух каналах, соответствующих цитокератинам и виментину. В результате выявляются популяции клеток, экспрессирующих эпителиальный и мезенхимальный маркеры как по-отдельности, так и вместе.
Эти популяции могут быть охарактеризованы количественно по доле клеток, экспрессирующих маркер, в проценте к общему количеству клеток, а также по средней интенсивности флуоресценции (MFI - mean fluorescence intensity).
Задача решается тем, что:
Из фиксированного формальдегидом образца солидной ткани или асцитической жидкости готовят одноклеточную суспензию, которую окрашивают антителами методом «двойного сэндвича». Затем проводят детекцию флуоресценции па проточном цитофлуориметре, в программе WinMDI 2.9 расставляют квадранты и вычисляют процент клеток, содержащих одиночную и двойную флуоресцентную метки.
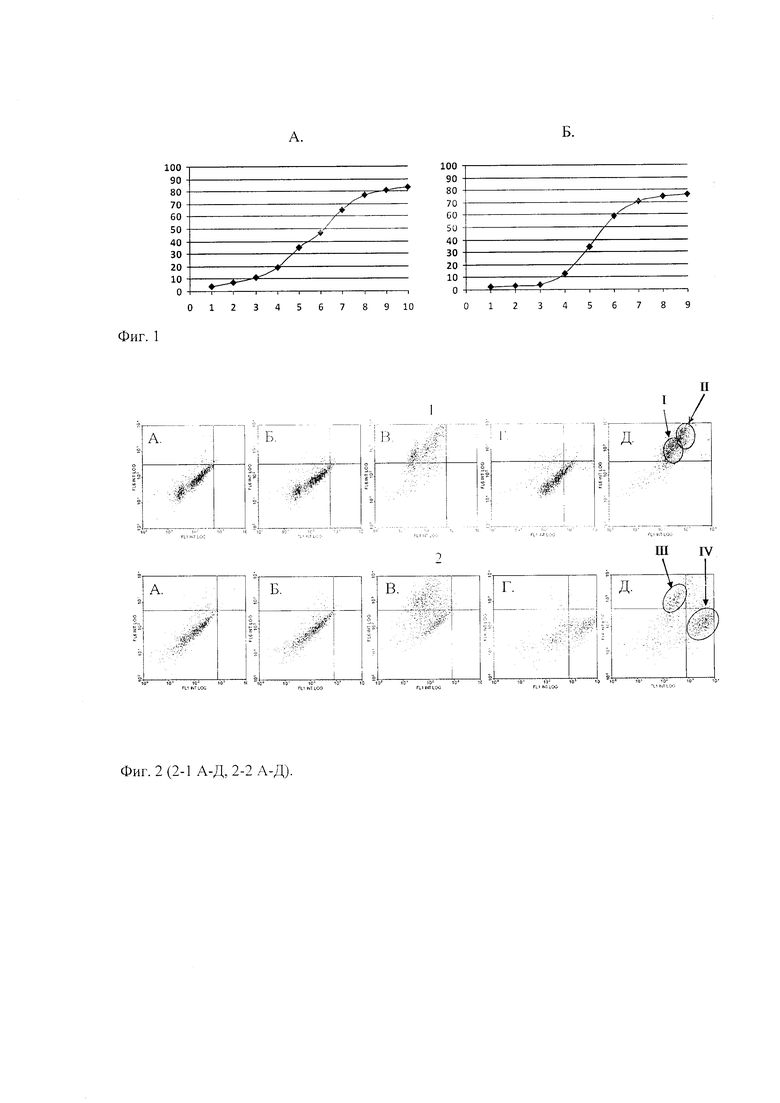
Изобретение иллюстрируется фигурами 1 и 2 (2-1 А-Д, 2-2 А-Д).
Способ осуществляется следующим образом.
Приготовление одноклеточной суспензии из солидных операционных образцов
Образец опухолевой ткани помещают в 4% раствор формальдегида в фосфатном буфере рН=7,4. Фиксированную опухолевую ткань разрезают ножницами на мелкие кусочки объемом менее 1 мм3 в чашке Петри, в полученную кашицу добавляют раствор Версена. Затем образцы инкубируют в течение 30 мин в термостате при t=+37°C. После инкубации содержимое чашки Петри гомогенизируют в цилиндрическом стеклянном гомогенизаторе и переносят в пробирку объемом 50 мл, объем жидкости доводят фосфатным буфером рН=7,4 до 40 мл. Далее суспензию пропускают через фильтр с диаметром пор 40 мкм, центрифугируют в течение 10 мин при 3 тыс. об/мин. Надосадочную жидкость удаляют пипеткой, а осадок ресуспендируют в 3-7 мл раствора фосфатного буфера рН=7,4. Количество клеток в полученной суспензии подсчитывают в камере Горяева. Для получения суспензии клеток из асцита асцитическую жидкость центрифугируют 5 мин при 3 тыс. об/мин, отбирают надосадочную жидкость, осадок растворяют в растворе фосфатно-солевого буфера рН=7,4.
Выбор оптимальных концентраций первичных антител
Для определения уровня экспрессии виментина используются первичные моноклональные кроличьи антитела клона SP20 (CRM312A, BIOCARE, США), для цитокератинов - первичные моноклональные мышиные антитела клона MNF116 (панцитокератин, М0821, Dako, США). Вторичные антитела подбирались с таким расчетом, чтобы их спектры испускания не пересекались: для виментина выбраны вторичные козьи поликлональные антикроличьи антитела, конъюгированные с красителем DyLight 650 (ab98510, Abeam, Великобритания), испускающим в красной области спектра. Для цитокератинов - вторичные козьи поликлональные антимышиные антитела, конъюгированные с красителем DyLight 488 (ab98726. Abeam, Великобритания), испускающим в зеленой области.
Для разработки метода в первую очередь выбирают оптимальные концентрации первичных антител к цитокератину и виментину для окрашивания всех клеток, экспрессирующих данные маркеры. Поскольку активность антител может различаться в зависимости от партии, необходимо проводить эту процедуру для каждой новой партии антител.
В начале исследования образцы асцитической жидкости пациентки с раком яичников окрашиваются по отдельности на цитокератин и виментин с использованием возрастающих концентраций первичных антител.
Пример полученных в результате калибровочных кривых приведен на фиг. 1: первичные антитела к виментину в разведении 1/1000 (10 мкг/мл), к цитокератинам - 1/200 (50 мкг/мл), вторичным антителам DyLight 650 1/1000 (10 мкг/мл) и вторичным антителам DyLight 488 1/250 (40 мкг/мл). Эти концентрации соответствуют точкам достижения плато на калибровочных кривых, т.е. максимальному насыщению антигенов антителами.
Окрашивание антителами по методу «двойного сэндвича»
1. К суспензии клеток, полученных из солидного узла или асцитической жидкости пациентки с раком яичников, добавляют первичные антитела к цитокератинам - моноклональные мышиные антитела клона MNF116 (панцитокератин. М0821, Dako, США) в разведении 1/200 (50 мкг/мл). Время инкубации составляет 15-20 ч, температура инкубации t=+4°C.
2. Для удаления несвязанных первичных антител пробу отмывают в растворе бычьего сывороточного альбумина (BSA, bovine serum albumin): в пробу добавляют 2 мл 0,5%-го раствора BSA в фосфатном буфере рН=7,4. центрифугируют в течение 5 минут при 3700 об/мин, отбирают супернатант, чтобы в пробирке оставалось 100 мкл жидкости.
3. В суспензию добавляют моноклональные кроличьи антитела клона SP20 (CRM312A, BIOCARE, США) к виментину в разведении 1/1000 (10 мкг/мл). Время инкубации составляет 1,5 ч, температура инкубации t=+4°C.
4. По завершении инкубации пробу отмывают 2 мл 0,5%-го раствора BSA в фосфатном буфере рН=7,4 аналогично пункту 2.
5. Далее добавляют вторичные антитела, конъюгированные с флуоресцентным красителем DyLight 488 (ab98510, Abeam, Великобритания). Время инкубации составляет 1,5 ч, температура инкубации t=+4°C.
6. По завершении инкубации пробу отмывают 2 мл 0,5%о-го раствора BSA в фосфатном буфере рН=7,4 аналогично пункту 2.
7. В суспензию добавляют вторичные антитела, конъюгированные с флуоресцентным красителем DyLight 650 (ab98729. Abeam, Великобритания). Время инкубации составляет 1,5 ч, температура инкубации t=+4°C.
8. Для выведения из анализа дебриса и эритроцитов после завершения второй инкубации с вторичными антителами инкубируют клетки в течение 15 мин со специфическим красителем ДНК Hoechst 33258 ("Sigma-Aldrich". США) в концентрации 1,2 мкг/мл.
9. Дважды проводят отмывку в 2 мл 0,5% раствора BSA в фосфатном буфере (рН=7,4) для удаления несвязанных антител и ДНК-красителя.
Анализ флуоресценции на проточном цитофлуориметре.
Окрашенные пробы анализируют на проточном цитофлуориметре.
Количество событий, выставленных в настройках цитофлуориметра, составляет 5000. Также для улучшения восприятия точечных гистограмм выставляется напряжение на проточном цитофлуориметре, чтобы все анализируемые события не выходили за границы дот-плота (см. далее).
В качестве контроля использовались следующие пробы:
1) Автофлуоресценция - проба, окрашенная только красителем Hoechst (все последующие пробы также окрашены данным красителем).
2) Проба, окрашенная только вторичными антителами.
3) Проба, окрашенная одиночной меткой на виментин, дополнительно окрашенная вторичными антителами DyLight 488.
4) Проба, окрашенная одиночной меткой на цитокератины, дополнительно окрашенная вторичными антителами DyLight 650.
Для оценки уровня двойной метки с помощью программы WinMDI 2.9 строят точечные гистограммы с распределением в красном и зеленом каналах и разбивают на квадранты таким образом, чтобы в пробе с только вторичными антителами сумма событий во всех квадрантах кроме левого нижнего (автофлуоресценция) не превышала 10% от числа событий, включенных в пробу.
Образец диаграммы представлен на фиг. 2. Точечные гистограммы двойного окрашивания. 2-1 - образец асцитической жидкости, 2-2 - образец солидного узла. На гистограммах типа А представлены данные для неокрашенных проб («автофлуоресценция»), Б - данные для проб, окрашенных только вторичными антителами, В - окрашенных только на виментин, Г - окрашенных только на цитокератины, Д - окрашенных на цитокератины и виментин («двойное окрашивание»). Представленные данные демонстрируют распределение клеток по интенсивности флуоресценции в разных каналах на проточном цитофлуориметре.
Анализ автофлуоресценции интактных клеток (фиг. 2, левый нижний квадрант) проводится для точной диспозиции областей размещения клеток, окрашенных виментином или цитокератином, а также при последовательном окрашивании одной и той же клеточной суспензии антителами к виментину и затем - к цитокератину. В правом верхнем квадранте (фиг. 2-1Д, двойное окрашивание) видна популяция клеток, выявляемая при таком окрашивании двумя антителами (II). Это клетки, несущие метку вторичных антител, конъюгированных с разными флуорохромами. специфичными по отношению к виментину или цитокератину. Часть клеток (левый верхний квадрант) при этом несет на себе метку только виментина (I), и незначительное количество клеток остаются неокрашенными (автофлуоресценция, левый нижний квадрант). Клетки, окрашенные только цитокератином (правый нижний квадрант), не определяются.
На фиг. 2-2Д при двойном окрашивании ситуация другая - в правом верхнем квадранте клетки практически не определяются, что говорит об отсутствии двойного окрашивания в солидном узле, однако четко разделяются фракции клеток, несущих только виментин (III) и клеток, несущих только цитокератины (IV). При заданном напряжении уровень экспрессии виментина в пробе, окрашенной только на виментин достигал 95%. В пробе, окрашенной двойной меткой на цитокератин и виментин - 93%. Уровень экспрессии цитокератинов в пробе, окрашенной только па цитокератин достигал 79%. В пробе, окрашенной двойной меткой па цитокератин и виментин - также 79%о. Таким образом, результаты, полученные методом двойного иммунофлуоресцентного окрашивания, практически полностью воспроизводят данные, полученные при окрашивании каждого маркера по отдельности.
Заявляемый способ двойного последовательного иммунофлуоресцентного окрашивания белков виментина и цитокератинов. ассоциированного с проточной цитофлуориметрией позволяет как качественно, так и количественно выделять в гетерогенной опухолевой структуре различные типы клеток - эпителиальные, мезенхимальные и находящиеся в состоянии эпителиально-мезенхимального перехода, что позволяет с высокой точностью определять уровень этого процесса в опухоли. Заявляемый метод подходит для анализа клеток, полученных как из солидных образцов, так и из асцитических жидкостей, что показывает его универсальность и широту практического применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ молекулярной количественной детекции локальной распространенности немелкоклеточного рака легкого методом двойного иммунофлуоресцентного окрашивания нормальной и опухолевой ткани органа | 2020 |
|
RU2732973C1 |
| СПОСОБ ИММУНОФЛУОРЕСЦЕНТНОГО АНАЛИЗА БЕЛКА ЭКСЦИЗИОННОЙ РЕПАРАЦИИ ERCC1 В СОЛИДНЫХ ОПУХОЛЯХ ЧЕЛОВЕКА | 2014 |
|
RU2563116C1 |
| СПОСОБ ИММУНОФЛУОРЕСЦЕНТНОГО АНАЛИЗА ЭСТРОГЕНОВЫХ РЕЦЕПТОРОВ β В СОЛИДНЫХ ОПУХОЛЯХ ЧЕЛОВЕКА | 2010 |
|
RU2429481C1 |
| СПОСОБ ИММУНОФЛУОРЕСЦЕНТНОГО АНАЛИЗА МАРКЕРОВ МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ В СОЛИДНЫХ ОПУХОЛЯХ ЧЕЛОВЕКА | 2009 |
|
RU2413948C1 |
| Способ оценки суммарного показателя анеуплоидии и пролиферативной активности опухолевых клеток немелкоклеточного рака легкого и рака яичников с использованием специфического красителя ДНК нового поколения DRAQ7 | 2016 |
|
RU2639251C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ЦИРКУЛИРУЮЩИХ В КРОВИ ОПУХОЛЕВЫХ КЛЕТОК МЕТОДОМ МНОГОПАРАМЕТРОВОЙ ПРОТОЧНОЙ ЦИТОМЕТРИИ | 2024 |
|
RU2825188C2 |
| Способ диагностики рака молочной железы с экспрессией рецептора Her2/neu на мембране опухолевых клеток | 2018 |
|
RU2701356C1 |
| МУЛЬТИПЛЕКСНАЯ ДЕТЕКЦИЯ ОПУХОЛЕВЫХ КЛЕТОК С ИСПОЛЬЗОВАНИЕМ ПАНЕЛИ АГЕНТОВ, СВЯЗЫВАЮЩИХСЯ С ВНЕКЛЕТОЧНЫМИ МАРКЕРАМИ | 2008 |
|
RU2489720C2 |
| Способ подавления индуцирующего действия высокомолекулярной гиалуроновой кислоты на стволовые клетки рака молочной железы | 2021 |
|
RU2774031C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ КЛЕТОК-ПРЕДШЕСТВЕННИКОВ (CD34+) В КРОВЕТВОРНОЙ ТКАНИ | 2012 |
|
RU2513511C1 |
Изобретение относится к области медицины, а именно к способам выявления опухолевых клеток, находящихся в стадии эпителиально-мезенхимального перехода в асцитических жидкостях. Может быть использовано в клинической лабораторной диагностике. Способ количественной оценки доли клеток в эпителиально-мезенхимальном переходе в асцитической жидкости рака яичников с помощью иммунофлуоресцентного окрашивания заключается в том, что из фиксированного формальдегидом образца асцитической жидкости готовят одноклеточную суспензию, которую окрашивают антителами по методу «двойного сэндвича», проводят детекцию флуоресценции на проточном цитофлуориметре, количественный анализ результатов, представленных в виде точечных диаграмм в программе WinMDI 2.9, вычисляют процент клеток, содержащих одиночную и двойную флуоресцентную метки. 2 ил.
Способ количественной оценки доли клеток в эпителиально-мезенхимальном переходе в асцитической жидкости рака яичников с помощью иммунофлуоресцентного окрашивания, отличающийся тем, что из фиксированного формальдегидом образца асцитической жидкости готовят одноклеточную суспензию, которую окрашивают антителами по методу «двойного сэндвича», проводят детекцию флуоресценции на проточном цитофлуориметре, количественный анализ результатов, представленных в виде точечных диаграмм в программе WinMDI 2.9, вычисляют процент клеток, содержащих одиночную и двойную флуоресцентную метки.
| Т.А | |||
| Богуш и др | |||
| Количественная оценка коэкспрессии цитокератинов и маркера мезенхимальных клеток виментина в ткани серозного рака яичников / РОССИЙСКИЙ БИОТЕРАПЕВТИЧЕСКИЙ ЖУРНАЛ, 2017, т | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Солесос | 1922 |
|
SU29A1 |
| Т.А.Богуш и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Держатель для поленьев при винтовом колуне | 1920 |
|
SU305A1 |
| L.Gao et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
Авторы
Даты
2019-10-31—Публикация
2018-11-07—Подача