Изобретение относится к области медицины, а именно к способам выявления локальной распространенности опухолевого процесса.
Степень локальной распространенности опухолевого процесса является одним из важнейших факторов, влияющих на выбор объема резекции немелкоклеточного рака легкого (НМРЛ), особенно на ранних стадиях этого заболевания. Традиционно для выявления этого показателя используют методы гистологического анализа и тонкослойную компьютерную томографию.
В последние годы помимо известных гемато- и лимфогенного путей распространения опухолевых клеток НМРЛ описан еще один - распространение через воздушные пространства (spread through air space, STAS). На гистологических препаратах таких опухолей видны папиллярные структуры, гнездовидные образования или одиночные клетки в воздушном пространстве паренхимы легкого вне границ первичного очага (Travis W.D., Brambilla Е., Nicholson A.G., et al. The 2015 World Health Organization Classification of lung tumors impact of genetic, clinical and radiologic advances since the 2004 Classification. Journal of Thoracic Oncology, 2015, V. 10, p. 1243-1260). При трехмерной реконструкции показано, что эти структуры прикреплены к альвеолярным стенкам вблизи кровеносных сосудов, но не на них, и замешают нормальные пневмоциты (Yagi Y, Aly R.G., Tabata К., Barlas A., Rekhtman N., Eguchi Т., Montecalvo J., HameedM., Manova-TodorovaK., Adusumilli P.S., Travis W.D. Three-dimensional histologic, immunohistochemical and multiple immunofluorescence analysis of dynamic vessel co-option of spread through airs paces (STAS) in lung adenocarcinoma // JournalofThoracicOncology, 2020, doi: https://doi.Org/10.1016/j.jtho.2019.12.112). Наличие STAS является неблагоприятным фактором общей выживаемости при аденокарциномах, особенно на ранних стадиях заболевания. К недостаткам гистологического метода детекции STAS можно отнести различную вероятность корректной идентификации и интерпретации этих образований патологами (Shih A.R. and Mino-Kenudson M. Updates on spread through air spaces (STAS) in lung cancer // Histopathology, 2020, Jan 14. doi: 10.1111/his.14062).
Кроме морфологических изменений в ткани легкого, распространение опухолевого процесса сопровождается молекулярными изменениями. Например, показано появление в опухоли белка TUBB3, экспрессирующегося в норме только в нейронах ЦНС и ПНС, клетках семенников, эндотелии. Этот белок является составляющей частью микротрубочек - каркаса цитоскелета. Его наличие в ткани является неблагоприятным прогностическим фактором и определяет устойчивость опухоли к таксанам (Ohashi Т., Yoshimasu Т., Oura S., et al. Class III beta-tubulin expression in non-small cell lung cancer: a predictive factor for paclitaxel response // Anticancer Res, 2015, V. 35, p. 2669-2674). Обычно для детекции экспрессии этого маркера в исследованиях используют метод иммуногистохимии. К его недостаткам можно отнести отсутствие строго количественных показателей, зависимость результатов от числа исследованных срезов и их локализации.
Экспрессия маркера в нормальной ткани легкого, окружающей опухолевый очаг, методом иммунофлуоресцентного анализа, сопряженного с проточной цитометрией, ранее была выявлена нами менее чем в половине случаев среди 77 пациентов. При этом отмечены значительные различия в уровне экспрессии TUBB3 как в опухолевой, так и в нормальной ткани легкого разных больных, однако во всех исследованных парах сравнения «опухоль-норма» при выявлении TUBB3 в обеих тканях уровень маркера в опухоли всегда был ниже показателя в опухолевом очаге (Мамичев, И.А. Бета-III тубулин как прогностический маркер немелкоклеточного рака легкого: диссертация кандидата биологических наук: 14.01.12 / [Место защиты: ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России]. - Москва, 2018. - 105 с.). Этот метод был принят нами за прототип.
В указанном способе одноклеточную суспензию клеток, приготовленную из опухолевой ткани НМРЛ, окрашивали методом «двойного сэндвича» с использованим первичных мышиных моноклональных антител (аb7751, клон TU-20, Abcam, Великобритания), специфичных к фрагменту а.к. 441-448 последовательности белка TUBB3. В качестве вторичных антител использовали козьи антимышиные поликлональные антитела, конъюгированные с красителем DyLight650 (ab98729, Abeam, Великобритания). Клетки инкубировали с первичными антителами в конечных концентрациях 0,04, 0,08 и 0,16 мкг/мл в течение ночи при температуре +4С. Затем несвязавшиеся антитела отмывали 0,05% раствором БСА в фосфатном буфере рН=7,4, добавляли вторичные антитела и инкубировали в течение 1,5 часов при температуре +4С. После этого для выведения из анализа дебриса и эритроцитов клетки инкубировали в течение 15 мин со специфическим красителем ДНК Hoechst 33258 (Sigma-Aldrich, США) в концентрации 1,2 мкг/мл. Затем суспензии окрашенных клеток дважды отмывали 0,05% раствором БСА в фосфатном буфере рН=7,4 и анализировали на проточном цитофлуориметре. Экспрессия TUBB3 в морфологически нормальной ткани легкого (взятой на максимальном удалении от первичного очага в доли легкого) варьирует в широких пределах. На каждый исследованный образец приходится от 0 до 57% клеток, экспрессирующих маркер, в 87% исследованных образцов обнаружены клетки, экспрессирующие TUBB3. При попарном сравнении выяснилось, что различия между опухолевой и отдаленной нормальной тканью, а также между опухолью и непосредственно прилежащей к ней тканью по уровню и интенсивности экспрессии TUBB3 статистически значимы, и уменьшаются по мере удаления от опухоли. Недостатком этого метода является невозможность определения отдельных популяций клеток, экспрессирующих TUBB3 (эндотелиоцитов, макрофагов и собственно опухолевых клеток). Т.е. при выбранном пороге уровня экспрессии в 15% экспрессия тубулина была отмечена в 97% исследованных опухолевых образцов со средним значением 43,1±14,9% клеток.
Задачей изобретения является создание способа более точной молекулярной количественной детекции локальной распространенности опухолевого процесса в ткани НМРЛ, за счет детекции белка TUBB3 только во фракции эпителиальных клеток опухоли.
Технический результат изобретения заключается в том, что заявляемый способ позволяет количественно оценить в эпителиальных клетках опухолевой ткани экспрессию белка TUBB3. Высокая точность, надежность и доступность определения маркеров делают пригодным заявляемый способ для рутинного использования в клинической практике.
Задача решается применением способа двойного иммунофлуоресцентного окрашивания методом «двойного сэндвича» и последующего анализа на проточном цитофлуориметре: готовят одноклеточную суспензию из опухолевой ткани, которую фиксируют в 4%-ном растворе формальдегида, отмывают фосфатным буфером рН=7,4, инкубируют с двумя типами первичных антител, затем с двумя типами вторичных антител и со специфическим красителем ДНК Hoechst 33258, измеряют уровень флуоресценции на проточном цитофлуориметре, рассчитывают уровень экспрессии белка с помощью статистического теста Колмогорова-Смирнова.
Способ осуществляется следующим образом.
Приготовление одноклеточной суспензии из операционных образцов
Образец опухолевой ткани помещали в 4% раствор формальдегида в фосфатном буфере рН=7,4. Фиксированную опухолевую ткань разрезали ножницами на мелкие кусочки объемом менее 1 мм3 в чашке Петри и добавляли в полученную кашицу раствор Версена. Затем инкубировали в течение 30 мин в термостате при t=+37°C. После инкубации содержимое чашки Петри гомогенизировали в цилиндрическом стеклянном гомогенизаторе и переносили в пробирку объемом 50 мл, доводя фосфатным буфером рН=7,4 объем жидкости до 40 мл. Далее проводили фильтрацию суспензии с помощью фильтра с диаметром пор 40 мкм, центрифугировали в течение 5 мин при 3 тыс. об/мин. Надосадочную жидкость удаляли пипеткой, а осадок ресуспендировали в 3-7 мл раствора фосфатного буфера рН=7,4. Количество клеток в полученной суспензии подсчитывали в камере Горяева.
Окрашивание антителами по методу «двойного сэндвича»
1. К суспензии клеток, полученных из солидного узла пациента с НМРЛ, добавляют первичные кроличьи антитела к TUBB3 (ab52623, Abeam) в конечном разведении 1/2500 и мышиные - к цитокератину (М0821, Dako), конечное разведение 1/1000.
2. Инкубировали в течение ночи при температуре +4С.
3. Добавляли 2 мл 0,05 р-ра БСАв фосфатном буфере рН=7,4, центрифугировали при 3700 тыс. об./мин в течение 5 минут и отбирали надосадочную жидкость.
4. Добавляли вторичные антикроличьи антитела в конечном разведении 1/5000, коньюгированные с красителем DyLight 650 (ab98570, Abcam) и антимышиные в конечном разведении 1/1200, коньюгированные с DyLight 488 (ab98726, Abcam).
5. Инкубировали в течение 1,5 часов в темноте при температуре +4С.
6. Добавляли краситель ДНК Hoechst 33258 до концентрации 1,2 мкг/мл для исключения из анализа клеточного дебриса и эритроцитов.
7. Инкубировали в темноте при температуре +4С в течение 15 минут.
8., Дважды отмывали от несвязавшихся антител и красителя центрифугированием в 2 мл 0,05 р-ра БСА в фосфатном буфере рН=7,4 при 3700 тыс. об/мин в течение 5 минут.
Выбор режима инкубации с первичными антителами
Для выбора оптимального режима инкубации суспензии с первичными антителами были использованы 3 режима:
1. Первичные антитела к TUBB3 и цитокератину добавляли одновременной инкубировали в течение ночи при температуре +4С.
2. Первичные антитела к цитокератину добавляли вечером и инкубировали в течение ночи при температуре +4С, затем добавляли антитела к TUBB3 и инкубировали 1 часпри температуре +4С.
3. Первичные антитела к TUBB3 добавляли вечером и инкубировали в течение ночипри температуре +4С, затем добавляли первичные антитела к цитокератину и инкубировали 1 час при температуре +4С.
Дальнейшее окрашивание проводили по указанной выше методике. Было показано, что оптимальным является первый описанный режим.
Анализ флуоресценции на проточном цитофлуориметре
Окрашенные пробы анализируют на проточном цитофлуориметре.
Количество событий, выставленных в настройках цитофлуориметра, составляет 5000.В качестве контроля использовались следующие пробы:
1) Автофлуоресценция - проба, окрашенная только красителем Hoechst.
2) Проба, окрашенная только вторичными антителами.
3) Проба, окрашенная одиночной меткой на TUBB3, дополнительно окрашенная вторичными антителами DyLight 650.
4) Проба, окрашенная одиночной меткой на цитокератины, дополнительно окрашенная вторичными антителами DyLight 488.
Для оценки уровня двойной метки с помощью программы WinMDI 2.9 строят точечные гистограммы с распределением внутриклеточной флуоресценции в красном и зеленом каналах. Установку квадрантов проводят по гистограмме, соответствующей окраске клеток только вторичными антителами. Линии устанавливают таким образом, чтобы сумма событий во всех квадрантах кроме левого нижнего (автофлуоресценция) не превышала 3% от числа событий, включенных в пробу. При этом в правом нижнем квадранте локализуются клетки, окрашенные только на цитокератины, в левом верхнем - клетки, окрашенные только на тубулин, а в правом верхнем - клетки, несущие одновременно метки на цитокератины и тубулин.
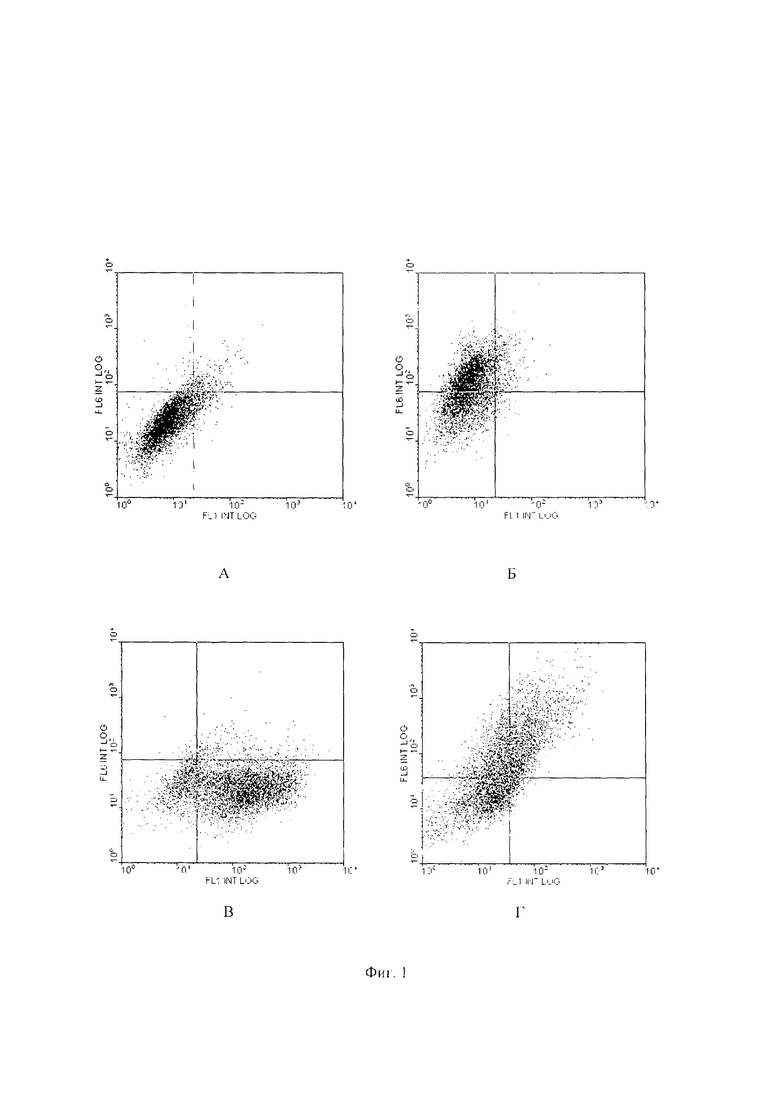
Изобретение иллюстрируется фиг. 1 (А - В) и фиг. 2 (А и Б).
На Фиг. 1 Точечные гистограммы окрашивания. Представленные данные демонстрируют распределение клеток по интенсивности флуоресценции в разных каналах на проточном цитофлуориметре.
По оси абсцисс отложена интенсивность флуоресценции в канале FL1, что соответствует эмиссии флуорохрома DyLight 488. По оси ординат отложена интенсивность флуоресценции в канале FL6, что соответствует эмиссии флуорохрома DyLight 650. На гистограмме А представлены данные для проб, инкубированных только со вторичными антителами, Б - данные для проб, окрашенных только антителами к TUBB3, окрашено 53,6% клеток, В - окрашенных только на цитокератин, окрашено 17% клеток, Г - окрашенных на цитокератины и тубулин 3 («двойное окрашивание»), окрашено на TUBB3 74% эпителиальных клеток. В верхнем правом квадранте видна субпопуляция клеток, несущих двойную метку. Уровень экспрессии TUBB3 в эпителиальных клетках оценивали как долю клеток (%), экспрессирующих как тубулин, так и цитокератины от доли клеток, экспрессирующих только цитокератины (количество клеток в правом верхнем квадранте деленное на сумму клеток в правом верхнем и правом нижнем квадрантах). Общее количество исследованных клеток во всех случаях составляло 5 тыс.
На Фиг. 2 представлены точечные гистограммы двойного окрашивания на TUBB3 и цитокератины образцов опухоли и морфологически нормальной ткани легкого одного пациента с НМРЛ. По оси абсцисс отложена интенсивность флуоресценции в канале FL1, что соответствует эмиссии флуорохрома DyLight 488. По оси ординат отложена интенсивность флуоресценции в канале FL6, что соответствует эмиссии флуорохрома DyLight 650. На гистограмме А представлено двойное окрашивание образца морфологически нормальной ткани легкого, окрашено на тубулин 27% эпителиальных клеток, на гистограмме типа Б - двойное окрашивание опухоли того же пациента, окрашено на тубулин 70% эпителиальных клеток.
Заявляемый способ двойного иммунофлуоресцентного окрашивания белков TUBB3 и цитокератинов, ассоциированного с проточной цитофлуориметрией, позволяет количественно оценивать локальную распространенность опухолевого процесса в ткани НМРЛ.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ количественной оценки доли клеток в эпителиально-мезенхимальном переходе в асцитической жидкости и солидных опухолях рака яичников | 2018 |
|
RU2704814C1 |
| СПОСОБ ИММУНОФЛУОРЕСЦЕНТНОГО АНАЛИЗА БЕЛКА ЭКСЦИЗИОННОЙ РЕПАРАЦИИ ERCC1 В СОЛИДНЫХ ОПУХОЛЯХ ЧЕЛОВЕКА | 2014 |
|
RU2563116C1 |
| СПОСОБ ИММУНОФЛУОРЕСЦЕНТНОГО АНАЛИЗА МАРКЕРОВ МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ В СОЛИДНЫХ ОПУХОЛЯХ ЧЕЛОВЕКА | 2009 |
|
RU2413948C1 |
| Способ оценки суммарного показателя анеуплоидии и пролиферативной активности опухолевых клеток немелкоклеточного рака легкого и рака яичников с использованием специфического красителя ДНК нового поколения DRAQ7 | 2016 |
|
RU2639251C1 |
| СПОСОБ ИММУНОФЛУОРЕСЦЕНТНОГО АНАЛИЗА ЭСТРОГЕНОВЫХ РЕЦЕПТОРОВ β В СОЛИДНЫХ ОПУХОЛЯХ ЧЕЛОВЕКА | 2010 |
|
RU2429481C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ЦИРКУЛИРУЮЩИХ В КРОВИ ОПУХОЛЕВЫХ КЛЕТОК МЕТОДОМ МНОГОПАРАМЕТРОВОЙ ПРОТОЧНОЙ ЦИТОМЕТРИИ | 2024 |
|
RU2825188C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ЦИРКУЛИРУЮЩИХ ОПУХОЛЕВЫХ КЛЕТОК, МИКРОЭМБОЛ И АПОПТОТИЧЕСКИХ ТЕЛЕЦ В КРОВИ БОЛЬНЫХ РАКОМ ЛЕГКОГО ЧЕЛОВЕКА | 2013 |
|
RU2571821C2 |
| Штамм гибридных культивируемых клеток животных mus musculus α - продуцент моноклональных антител, специфичных к раково-тестикулярному антигену человека GAGE | 2017 |
|
RU2652885C1 |
| Способ прогнозирования длительности безметастатического периода у больных инвазивной карциномой молочной железы неспецифического типа | 2024 |
|
RU2838685C1 |
| СПОСОБ СТИМУЛЯЦИИ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ ЦИТОТОКСИЧЕСКИХ ЭФФЕКТОРОВ ИММУННОЙ СИСТЕМЫ | 2010 |
|
RU2429005C1 |

Изобретение относится к области медицины. Способ иммунофлуоресцентной детекции локальной распространенности опухолевого процесса при немелкоклеточном раке легкого (НМРЛ) включает приготовление одноклеточной суспензии из образца ткани НМРЛ, фиксацию в 4% растворе формалина, отмывку с помощью фосфатного буфера рН=7,4, инкубацию с красителем ДНК Hoechst 33258, двойную отмывку от антител с помощью 0,05% раствора БСА в фосфатном буфере рН=7,4, проведение анализа флуоресценции на проточном цитофлуориметре, при этом инкубацию проводят одновременно с двумя типами первичных антител – кроличьи антитела к TUBB3 и мышиные антитела к цитокератинам, при этом первичные антитела к TUBB3 и цитокератину добавляют одновременно и инкубируют в течение ночи при температуре +4°С, и одновременно с двумя типами вторичных антител - антикроличьи антитела, конъюгированные с красителем DyLight 650, и антимышиные антитела, конъюгированные с DyLight 488, строят точечные гистограммы, сравнивают уровни экспрессии TUBB3 в эпителиальных клетках опухоли и окружающей нормальной ткани, где повышенная экспрессия TUBB3 характеризует локальную распространенность опухолевого процесса при НМРЛ. Изобретение позволяет количественно оценить в эпителиальных клетках опухолевой ткани экспрессию белка TUBB3. 2 ил.
Способ иммунофлуоресцентной детекции локальной распространенности опухолевого процесса при немелкоклеточном раке легкого (НМРЛ), включающий приготовление одноклеточной суспензии из образца ткани НМРЛ, фиксацию в 4% растворе формалина, отмывку с помощью фосфатного буфера рН=7,4, инкубацию с красителем ДНК Hoechst 33258, двойную отмывку от антител с помощью 0,05% раствора БСА в фосфатном буфере рН=7,4, проведение анализа флуоресценции на проточном цитофлуориметре, отличающийся тем, что инкубацию проводят одновременно с двумя типами первичных антител – кроличьи антитела к TUBB3 и мышиные антитела к цитокератинам, при этом первичные антитела к TUBB3 и цитокератину добавляют одновременно и инкубируют в течение ночи при температуре +4°С, и одновременно с двумя типами вторичных антител - антикроличьи антитела, конъюгированные с красителем DyLight 650, и антимышиные антитела, конъюгированные с DyLight 488, строят точечные гистограммы, сравнивают уровни экспрессии TUBB3 в эпителиальных клетках опухоли и окружающей нормальной ткани, где повышенная экспрессия TUBB3 характеризует локальную распространенность опухолевого процесса при НМРЛ.
| И.А | |||
| МАМИЧЕВ | |||
| Бета-III тубулин как прогностический маркер немелкоклеточного рака легкого / Автореферат на соиск | |||
| уч | |||
| степ | |||
| к.б.н., Москва 2018 (Ссылка помещена на сайт в Интернет 18.12.2019 http://www.dslib.net/onkologia/beta-iii-tubulin-kak-prognosticheskij-marker-nemelkokletochnogo-raka-legkogo.html; дата размещения подтверждена по адресу |
Авторы
Даты
2020-09-25—Публикация
2020-04-27—Подача