Область изобретения
Настоящее изобретение относится к применению моноклональных антител против эотаксина 2 (CCL24), которые обладают полиспецифическими связывающими свойствами с другими хемокинами, в лечении фиброзных, воспалительных, аутоиммунных и аллергических заболеваний.
Предшествующий уровень техники
Аутоиммунные расстройства возникают в результате сверхактивного иммунного ответа организма, направленного против собственных клеток (1). Почти все аутоиммунные заболевания являются хроническими и не характеризуются стойким выздоровлением. Свыше 300 миллионов пациентов по всему миру страдают этими расстройствами. Женщины составляют приблизительно 70%-75% от всех пациентов, страдающих аутоиммунными расстройствами.
Эотаксин 2 представляет собой хемокин, который способствует клеточной направленной миграции и регулирует воспалительные активности в комплексном сайте гена CCR3, в особенности вызывая хемотаксис эозинофилов (2-4), базофилов (4) и лимфоцитов типа Th2 (5).
К настоящему моменту эотаксин 2 хорошо известен в контексте аллергии. Хорошо известно, что имеет место значительное увеличение уровней эотаксина 2 во время аллергического ответа (6-8). Недавно авторы изобретения обнаружили, что эотаксин 2 также вовлечен в аутоиммунные и воспалительные заболевания (WO 2010/086854) Как описано Ablin et al. (9), ингибирование эотаксина 2 демонстрирует защитное действие в модели ревматоидного артрита у крыс. Дополнительно обнаружено, что блокирование эотаксина 2 уменьшало экспериментальный аутоиммунный энцефаломиелит, как опубликовано Mausner et al. (10).
Склеродермия или системный склероз (SSc) представляет собой редкое хроническое мультисистемное аутоиммунное заболевание, характеризующееся активацией иммунной системы, дисфункцией эндотелия и активным фиброзным процессом, вовлекающим фибробласты (11). Самая ранняя стадия в развитии склеродермальных поражений представляет собой активацию клеток эндотелия и повреждения сосудов. За ними следует миграция воспалительных клеток, прежде всего моноцитов, а затем лимфоцитов. В конечном счете, активируется популяция фибробластов. Активированные фибробласты продолжают продуцировать внеклеточный матрикс, который подчеркивает окончательную фиброзную патологию склеродермии (11). Исследования выявили, что человеческие фибробласты кожи конститутивно экспрессируют мРНК эотаксина 1, 2 и 3 (13). Дополнительно, повышенные уровни эотаксина обнаружены при легочном фиброзе и в модели вызванного блеомицином склероза у мышей (14). У нокаутированных по эотаксину и CCR3 мышей развивается значительно уменьшенный легочный фиброз (14, 15).
Провоспалительные связывающие CCR3 хемокины эотаксин 1, Rantes и МСР-3 относятся также к СС хемокиновому семейству и служат в качестве лигандов для рецептора CCR3. Они также вовлечены в миграцию иммунных клеток, представляя факт, который объясняет их эффективность в воспалительных доклинических моделях (16, 17).
Идиопатический легочный фиброз (IPF) представляет собой прогрессирующее фиброзное заболевание, ограниченное легкими, возникающее у более пожилых индивидов, чаще у мужчин, и характеризующееся неблагоприятным прогнозом с медианой выживаемости от 3 до 5 лет после постановки диагноза. Клинические признаки, характеризующие IPF, включают затруднение дыхания, рентгенографически выраженные диффузные легочные инфильтраты и различные степени воспаления, фиброза или обоих при биопсии. Полагают, что причина IPF остается неизвестной, тем не менее, механизмы, лежащие в основе рекрутинга и пролиферации фибробластов и иммунных клеток, а также их патологической дифференцировки являются критерием для прогрессирования заболевания. Кроме того, по-видимому существует большое количество медиаторов, вовлеченных в прогрессирование IPF, включающие цитокины, хемокины, фиброгенные факторы, белки системы свертывания, окислители и регуляторы апоптоза (18, 19). Кроме того, отложение компонентов внеклеточного матрикса, включающих коллаген, является неотъемлемым для этого фиброзного процесса (20).
Лечение этого заболевания, как правило, включает некоторую комбинацию симптоматической терапии, например, дополнительный кислород, легочную реабилитацию, рассмотрение возможности трансплантации легкого и идентификацию и лечение возможных сопутствующих заболеваний (21). Пирфенидон (эсбриет) и нинтеданиб представляют собой единственные одобренные FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов)/ЕМА (Европейское агентство по оценке лекарственных средств), средства лечения, в настоящее время доступные для индивидов, страдающих IPF (22-24). Пирфенидон обладает антифиброзными и противовоспалительными свойствами в различных in vitro системах и животных моделях фиброза.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Для понимания изобретения и для демонстрации того как оно может быть реализовано практически, воплощения будут описаны далее при помощи исключительно не ограничивающего объем изобретения примера со ссылкой на сопровождающие графические материалы, на которых:
Фиг. 1А-1С представляют собой графики, демонстрирующие уровни в системе кровообращения эотаксина 2 (Фиг. 1А), Rantes (регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками) (Фиг. 1В) и эотаксина 1 (Фиг. 1С) у пациентов с системным склерозом, измеренные при помощи ELISA (иммуноферментного анализа). Результаты представлены в пикограммах на миллилитр.
Фиг. 2А-2В представляют собой графики, демонстрирующие эффект обработки СМ101 в отношении различных параметров в превентивной модели у мышей, страдающих от вызванной блеомицином склеродермии. Фиг. 2А представляет собой график, демонстрирующий эффект обработки моноклональным антителом против эотаксина 2 (СМ101 в количестве 10, 20 или 50 мкг), IgG и PBS (физиологический раствор, забуференный фосфатом) на толщину кожи (± стандартная ошибка). Фиг. 2В представляет собой график, демонстрирующий действие обработки моноклональным антителом против эотаксина 2 (СМ101 в количестве 10, 20 или 50 мкг), IgG и PBS на концентрацию коллагена (± стандартная ошибка), * указывает на р≤0,05. (Разбавитель - отсутствие обработки (PBS); BLM - блеомицин)
Фиг. 3А-3В представляют собой графики, демонстрирующие действие обработки моноклональным антителом против эотаксина 2 (СМ101 в количестве 10 мкг или 50 мкг) на лимфоциты (Фиг. 3А) и эозинофилы (Фиг. 3В) в бронхоальвеолярной жидкости мышей в модели вызванной блеомицином склеродермии (превентивная модель) (± стандартная ошибка). * указывает на р≤0,05. (Разбавитель - отсутствие обработки (PBS); BLM - блеомицин)
Фиг. 4 представляет собой график, демонстрирующий действие обработки моноклональным антителом против эотаксина 2 (СМ 101, 50 мкг) и PBS (разбавитель) на концентрацию коллагена в коже у мышей в протоколе обработки (± стандартная ошибка), *р≤0,05 (Разбавитель - отсутствие обработки (PBS); BLM - блеомицин).
Фиг. 5А-5В представляют собой графики, демонстрирующие действие обработки моноклональным антителом против эотаксина 2 (СМ101, 50 мкг) и PBS (разбавитель) на инфильтрацию одноядерных клеток (Фиг. 5А) и лейкоцитов (WBC) (Фиг. 5В) в бронхоальвеолярной жидкости мышей в режиме обработки (± стандартная ошибка), *р≤0,05 (Разбавитель - отсутствие обработки (PBS); BLM - блеомицин). Фиг. 5C-5F представляют собой типичные результаты FACS (сортировка клеток с активацией флуоресценцией) (подсчет клеток в течение 30 сек в проточной цитометрии): 5С - PBS; 5D - BLM 8 суток; 5Е - BLM 21 сутки; 5F - BLM + СМ101.
Фиг. 6A-6D представляют собой фотографии, демонстрирующие типичный внешний вид кожи мышей (окрашивание гематоксилином и эозином (Н&Е)). Фиг. 6А - PBS; Фиг. 6В - BLM базовый уровень; Фиг. 6С - BLM завершение; Фиг. 6D мыши, обработанные СМ101 (обработка СМ 101, инициированная после установления заболевания). Фиг. 6Е-6Н представляют собой фотографии, демонстрирующие типичный внешний вид кожи мышей (окрашивание трихромом по Массону). Фиг. 6Е - PBS; Фиг. 6F - BLM базовый уровень; Фиг. 6G - BLM завершение; Фиг. 6Н мыши, обработанные СМ101 (обработка СМ 101, инициированная после экспериментального установления SSc).
Фиг.7А-7В представляют собой фотографии легочных поражений у пациентов, страдающих IPF, окрашенных hCM101.
Фиг. 8 представляет собой график, демонстрирующий действие обработки моноклональным антителом против эотаксина 2 (СМ101 в количестве 10, 100 мкг), IgG и PBS (разбавитель) на концентрацию коллагена у мышей в превентивной модели IPF (± стандартная ошибка). *pv≤0,05. ***pv≤0,01. (BLM - блеомицин).
Фиг. 9 представляет собой график, демонстрирующий действие обработки моноклональным антителом против эотаксина 2 (СМ101 в количестве 10, 100 мкг), IgG и PBS (разбавитель) на одноядерные клетки в бронхоальвеолярной жидкости у мышей в превентивном режиме модели IPF (± стандартная ошибка). *pv≤0,05. (BLM - блеомицин).
Фиг. 10 представляет собой график, демонстрирующий влияние СМ 101 (10, 100 мкг) на уровни эотаксина 2 в жидкости BAL в превентивной модели IPF (± стандартная ошибка). *pv≤0,05. (BLM - блеомицин, разбавитель - PBS).
Фиг. 11 представляет собой график, демонстрирующий действие обработки моноклональным антителом против эотаксина-2 (СМ101 в количестве 50 мкг), IgG и PBS (разбавитель) на концентрацию коллагена в легком у мышей в модели лечения IPF (± стандартная ошибка). *pv≤0,05.** pv≤0,01. (BLM - блеомицин).
Фиг. 12А-12В представляют собой графики, демонстрирующие действие обработки моноклональным антителом против эотаксина 2 (СМ101 в количестве 50 мкг), IgG и PBS (разбавитель) на одноядерные (Фиг. 12А) и полиморфноядерные (Фиг. 12В) клетки в бронхоальвеолярной жидкости мышей в модели лечения IPF (± стандартная ошибка). *pv≤0,05. (BLM - блеомицин).
Фиг. 13А-13Н представляют собой фотографии, демонстрирующие типичный внешний вид легочных поражений у мышей, обработанных СМ101 или PBS, окрашенных гематоксилином и эозином (Н&Е) (Фиг. 13D и Фиг. 13А, соответственно) или окрашенных трихромом по Массону (Фиг. 13Н и Фиг. 13Е, соответственно). Легочные поражения у мышей, обработанных блеомицином (BLM) в течение указанного количества суток, и окрашенных Н&Е представлены на Фиг. 13В и Фиг. 13С. Легочные поражения у мышей, обработанных блеомицином (BLM) в течение указанного количества суток и окрашенных трихромом по Массону, представлены на Фиг. 13F и Фиг. 13G.
Фиг. 14 представляет собой график, демонстрирующий действие СМ101 (100 мкг) по сравнению с пирфенидоном (100 мг/кг/сутки) на концентрацию коллагена в легком у мышей, страдающих IPF (± стандартная ошибка). *pv≤0,05. (BLM - блеомицин).
Фиг. 15А-15С представляют собой графики, демонстрирующие действие СМ101 (100 мкг) по сравнению с пирфенидоном (100 мг/кг/сутки) на одноядерные (Фиг. 15А), полиморфноядерные (Фиг. 15В) клетки и лейкоциты (Фиг. 15С) в бронхоальвеолярной жидкости мышей в модели IPF (± стандартная ошибка). *pv≤0,05. **pv≤0,01. (BLM - блеомицин).
Фиг. 16 представляет собой график, демонстрирующий связывание mAb против эотаксина 2 (hCM101) с эотаксином 2. Результаты представлены в виде измерений оптической плотности (OD) при 405 нм (± стандартная ошибка). pv≤0,05. (BSA - бычий сывороточный альбумин).
Фиг. 17 представляет собой график, демонстрирующий связывание mAb против эотаксина 2 (hCM101) с эотаксином 1. Результаты представлены в виде измерений оптической плотности (OD) при 405 нм (± стандартная ошибка). pv≤0,05. (BSA - бычий сывороточный альбумин).
Фиг. 18 представляет собой график, демонстрирующий связывание mAb против эотаксина 2 (hСМ101) с RANTES. Результаты представлены в виде измерений оптической плотности (OD) при 405 нм (± стандартная ошибка). pv≤0,05. (BSA - бычий сывороточный альбумин).
Фиг. 19 представляет собой график, демонстрирующий связывание mAb против эотаксина 2 (hCM101) с МСР-3. Результаты представлены в виде измерений оптической плотности (OD) при 405 нм (± стандартная ошибка). pv≤0,05. (BSA - бычий сывороточный альбумин).
Фиг. 20А представляет собой графическое представление сайта связывания hCM101 в N-петле эотаксина 1, эотаксина 2, Rantes и МСР-3 (структуры белков наложены друг на друга); Фиг. 20В демонстрирует сравнение аминокислотной последовательности предполагаемого связывающего эпитопа во всех четырех белках.
Фиг. 21А-21Н представляют собой графические представления белковой поверхности и ленточной диаграммы эпитопного картирования, представляющего похожий сайт связывания hCM101 с соответственно эотаксином 2 (Фиг. 21А и Фиг. 21Е), эотаксином 1 (Фиг. 21 В и Фиг. 21F), RANTES (Фиг. 21С и Фиг. 21G) и МСР3 (Фиг. 21D и Фиг. 21Н). Поверхность белка обведена в соответствии с зарядом; жирная линия представляет положительно заряженную область. Сайт поворота обозначен окружностью, а сайт N-петли обозначен овалом.
Фиг. 22А-22В представляют собой типичный гель (Фиг. 22А) и денситометрию падения уровней эотаксина 2 (Фиг. 22В) из сывороток крови при системном склерозе посредством использования hCM101 (5, 10 и 50 мкг). O.D. - оптическая плотность.
Фиг. 23 демонстрирует типичный анализ на геле с додецилсульфатом натрия (SDS) эотаксина 1, RANTES и МСР-3 (2, 1, 0,5 мкг), обнаруживаемых при помощи hCM101.
Фиг. 24 представляет собой график, демонстрирующий действие hCM101 (100, 50 и 10 нМ), IgG (50 нМ) или PBS ("0") на миграцию эозинофильной клеточной линии в направлении эотаксина 1 и эотаксина 2 (± стандартная ошибка). *pv≤0,05. **pv≤0,01.
Фиг. 25 представляет собой график, демонстрирующий действие hCM101 (100, 50 и 10 нМ), IgG (50 нМ) или PBS ("0") на миграцию моноцитарной клеточной линии в направлении МСР-3 и RANTES (± стандартная ошибка). *pv≤0,05.
Фиг. 26А представляет собой график, демонстрирующий действие hCM101 (100 и 10 нМ), IgG (50 нМ) или PBS ("0") на миграцию клеток CD14+ (выделенных у пациента, страдающего системным склерозом) в направлении МСР-3 и RANTES (± стандартная ошибка). *pv≤0,05.
Фиг. 26В представляет собой график, демонстрирующий действие hCM101 (100 и 10 нМ), IgG (50 нМ) или PBS ("0") на миграцию клеток CD14- (выделенных у пациента, страдающего системным склерозом) в направлении эотаксинов 1, 2 и RANTES (± стандартная ошибка). *pv≤0,05, ** pv≤0,01.
Фиг. 27А представляет собой график, демонстрирующий действие hCM101 (100 нМ) или PBS (ЕОХ-2) на миграцию фибробластной клеточной линии в направлении эотаксина 2 (± стандартная ошибка). **pv≤0,01. Фиг. 27В-27D представляют собой типичные картины контрольных (Фиг. 27В), обработанных PBS (Фиг. 27С) и обработанных hCM101 (Фиг. 27D) фибробластов, представленных на Фиг. 27А.
Фиг. 28А представляет собой график, демонстрирующий действие ИСМ101 (100 нМ) или PBS (ЕОХ-1) на миграцию фибробластной клеточной линии в направлении эотаксина 1 (± стандартная ошибка). *pv≤0,05. Фиг. 28В-28D представляют собой типичные картины контрольных (Фиг. 28В), обработанных PBS (Фиг. 28С) и обработанных hCM101 (Фиг. 28D) фибробластов, представленных на Фиг. 28А.
Фиг. 29А-29С представляют собой типичные изображения FACS, демонстрирующие действие hСМ101 на внутриклеточную экспрессию α-SMA в качестве показателя превращения миофибробластов. pv≤0,05. Фиг. 29А демонстрирует 44% SMA положительных клеток в сыворотке крови, полученной у пациента, страдающего склеродермией. Фиг. 29В демонстрирует 22% SMA положительных клеток в сыворотке крови, полученной у пациента, страдающего склеродермией, которого лечили hCM101 (10 мкг/мл), и Фиг. 29С демонстрирует 27% SMA положительных клеток в сыворотке крови, полученной у пациента, страдающего склеродермией, которого лечили hCM101 (5 мкг/мл).
Фиг. 30А-30В представляют собой графики, демонстрирующие кальциевый индекс активации с разрешением по времени под влиянием СМ101 (100, 50, 10, 5 или 0 нМ) (Фиг. 30А) и вариацию в вызванном эотаксином 2 кальциевом сигнале в зависимости от концентрации СМ 101 (Фиг. 30В) в эозинофилах. pv≤0,05
Фиг. 31 представляет собой график, демонстрирующий пролиферацию Т-клеток после инкубации с hCM101. Результаты представлены в виде индекса стимуляции.
Фиг. 32 представляет собой график, демонстрирующий корреляцию между клинической иммуногенностью (терапевтический ответ в виде антител против белка) и пролиферацией Т-клеток в Episcreen.
ОБЩЕЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящего изобретения предложено выделенное полиспецифическое антитело или любой его антигенсвязывающий фрагмент, который связывается с по меньшей мере двумя связывающими CCR3 хемокинами, для применения в лечении фиброзных заболеваний, аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, или аллергических атонических расстройств.
В некоторых воплощениях антитело в соответствии с изобретением представляет собой моноклональное антитело. В других воплощениях моноклональное антитело в соответствии с изобретением представляет собой химерное антитело, человеческое антитело, гуманизированное антитело или полностью гуманизированное антитело.
В дополнительных воплощениях выделенное полиспецифическое антитело для применения в соответствии с изобретением представляет собой антитело, в котором его антигенсвязывающий фрагмент выбран из группы, состоящей из Fv, одноцепочечного Fv (scFv), вариабельной области тяжелой цепи, способной связываться с антигеном, вариабельной области легкой цепи, способной связываться с антигеном, Fab, F(ab)2' и любой их комбинации.
В некоторых воплощениях определенное здесь фиброзное заболевание выбрано из группы, состоящей из склеродермии, идиопатического легочного фиброза (IPF), неалкогольного стеатогепатита (NASH), гломерулосклероза, цирроза и метаболических синдромов.
В других воплощениях определенное здесь аутоиммунное воспалительное расстройство выбрано из группы, состоящей из системной красной волчанки (SLE), ревматоидного артрита, псориаза, колита, увеита, рассеянного склероза и сахарного диабета I типа.
В дополнительных воплощениях расстройство, связанное с моноцитами, в соответствии с изобретением представляет собой атеросклероз.
В дополнительных воплощениях определенное здесь аллергическое атопическое заболевание выбрано из группы, состоящей из астмы, атопического дерматита, крапивницы и реакций гиперчувствительности.
В некоторых воплощениях выделенное полиспецифическое антитело для применения в соответствии с изобретением представляет собой антитело, в котором по меньшей мере два связывающих CCR3 хемокина выбраны из группы, состоящей из эотаксина 1, эотаксина 2, Rantes и МСР-3.
В других воплощениях выделенное полиспецифическое антитело для применения в соответствии с изобретением представляет собой антитело, которое связывается с эотаксином 1, эотаксином 2, Rantes и МСР-3.
В дополнительных воплощениях определенное здесь выделенное полиспецифическое антитело для применения представляет собой антитело, которое уменьшает миграционные свойства клеток, экспрессирующих CCR3, CCR1, CCR2 и CCR5.
В некоторых воплощениях определенное здесь антитело представляет собой полностью гуманизированное антитело, содержащее вариабельную область тяжелой цепи, включающую:
а) область, определяющую комплементарность, VH CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 5, или ее вариант;
б) область, определяющую комплементарность, VH CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 6, или ее вариант; и
в) область, определяющую комплементарность, VH CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 7, или ее вариант; и
вариабельную область легкой цепи, включающую
г) область, определяющую комплементарность, VK CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 8, или ее вариант;
д) область, определяющую комплементарность, VK CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 9, или ее вариант; и
е) область, определяющую комплементарность, VK CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 10, или ее вариант.
В других воплощениях антитело в соответствии с изобретением представляет собой полностью гуманизированное антитело, содержащее вариабельную область тяжелой цепи, обозначенную как SEQ ID NO:3, или ее вариант, и вариабельную область легкой цепи, обозначенную как SEQ ID NO: 4, или ее вариант.
В еще одном из своих аспектов в настоящем изобретении предложено выделенное антитело, которое связывается с конформационным эпитопом в N-петлевой области связывающего CCR3 хемокина, где указанный конформационный эпитоп характеризуется относительно высокой концентрацией положительно заряженных аминокислотных остатков, локализованных между положениями аминокислот 14 и 24 в аминокислотной последовательности указанного связывающего CCR3 хемокина.
В некоторых воплощениях определенный здесь конформационный эпитоп содержит по меньшей мере три положительно заряженных аминокислотных остатка между положениями аминокислот 14 и 24 в аминокислотной последовательности указанного связывающего CCR3 хемокина.
В других воплощениях определенные здесь положительно заряженные аминокислотные остатки выбраны из группы, состоящей из Arg, Lys и His.
В дополнительных воплощениях определенный здесь конформационный эпитоп содержит аминокислотные последовательности, выбранные из: аминокислотных последовательностей, обозначенных как SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 или SEQ ID NO: 19.
В еще одном из своих аспектов в настоящем изобретении предложено выделенное полиспецифическое антитело или любой его антигенсвязывающий фрагмент, который связывается с По меньшей мере двумя связывающими CCR3 хемокинами, где указанное антитело представляет собой полностью гуманизированное антитело и содержит вариабельную область тяжелой цепи, включающую:
а) область, определяющую комплементарность, VH CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 5, или ее вариант;
б) область, определяющую комплементарность, VH CDR2 содержащую аминокислотную последовательность обозначенную как SEQ ID NO: 6, или ее вариант; и
в) область, определяющую комплементарность, VH CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 7, или ее вариант; и
вариабельную область легкой цепи, включающую
г) область, определяющую комплементарность, VK CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 8, или ее вариант;
д) область, определяющую комплементарность, VK CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 9, или ее вариант; и
е) область, определяющую комплементарность, VK CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 10, или ее вариант.
В настоящем изобретении дополнительно предложена молекула нуклеиновой кислоты, кодирующая определенное здесь антитело.
В еще одном из своих аспектов в настоящем изобретении предложена молекула нуклеиновой кислоты, кодирующая гуманизированное антитело, которое связывается с по меньшей мере двумя связывающими CCR3 хемокинами, где указанная молекула нуклеиновой кислоты содержит последовательность, обозначенную как SEQ ID NO: 1 и SEQ ID NO: 2.
В настоящем изобретении дополнительно предложен экспрессионный вектор, содержащий молекулу нуклеиновой кислоты в соответствии с изобретением.
В еще одном из своих аспектов в настоящем изобретении предложена клетка-хозяин, содержащая молекулу нуклеиновой кислоты в соответствии с изобретением.
В настоящем изобретении дополнительно предложена фармацевтическая композиция, содержащая определенное здесь антитело и фармацевтически приемлемый носитель.
В некоторых воплощениях фармацевтическая композиция в соответствии с изобретением предназначена для применения в лечении фиброзных заболеваний, аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, или аллергических атопических расстройств.
В настоящем изобретении дополнительно предложен способ лечения фиброзных заболеваний, аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, или аллергических атопических расстройств, включающий введение пациенту, нуждающемуся в этом, терапевтически приемлемого количества определенных здесь антитела или фармацевтической композиции.
В еще одном из своих аспектов в настоящем изобретении предложен способ ослабления мигрирующих свойств клеток, экспрессирующих CCR3, CCR1, CCR2 и CCR5, при фиброзных заболеваниях, аутоиммунных воспалительных расстройствах, расстройствах, связанных с моноцитами, или аллергических атопических расстройствах, включающий введение пациенту, страдающему одним из указанных заболеваний, терапевтически приемлемого количества определенных здесь антитела или фармацевтической композиции.
В настоящем изобретении дополнительно предложен способ скрининга и идентификации антител, способных ослаблять мигрирующие свойства по меньшей мере одной из клеток, экспрессирующих CCR3, CCR1, CCR2 или CCR5, включающий:
а. получение антител против связывающего CCR3 хемокина; и
б. определение связывания указанных антител с конформационным эпитопом в N-петлевой области связывающего CCR3 хемокина, где указанный конформационный эпитоп характеризуется относительно высокой концентрацией положительно заряженных аминокислотных остатков, локализованных между положениями аминокислот 14 и 24 в аминокислотной последовательности указанного связывающего CCR3 хемокина;
в. отбор антител, которые связываются с указанным конформационным эпитопом;
где антитела, которые специфически связываются с указанным конформационным эпитопом, способны эффективно ослаблять мигрирующие свойства клеток, экспрессирующих CCR3, CCR1, CCR2 и CCR5.
В некоторых воплощениях способ скрининга и идентификации антител, способных ослаблять мигрирующие свойства по меньшей мере одной из клеток, экспрессирующих CCR3, CCR1, CCR2 или CCR5, представляет собой способ, при котором указанный конформационный эпитоп содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, обозначенных как SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19.
В еще одном аспекте в настоящем изобретении предложена выделенная N-петлевая область связывающего CCR3 хемокина, содержащая конформационный эпитоп, где указанный конформационный эпитоп характеризуется относительно высокой концентрацией положительно заряженных аминокислотных остатков, локализованных между положениями аминокислот 14 и 24 в аминокислотной последовательности указанного связывающего CCR3 хемокина, для образования антител против указанного связывающего CCR3 хемокина.
В некоторых воплощениях указанная выделенная N-петлевая область содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, обозначенных как SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на неожиданном обнаружении того, что антитело против конформационного эпитопа в полипептиде эотаксина 2 (CCL24) связывается и ингибирует активность эотаксина 2, а также дополнительных хемотаксических агентов, провоспалительных связывающих CCR3 хемокинов: эотаксина 1, Rantes и МСР-3. Таким образом, в настоящем изобретении предложено уникальное полностью гуманизированное моноклональное антитело (названное здесь hCM101), способное предупреждать миграцию иммунных клеток путем нейтрализации по меньшей мере одного из хемокинов, ответственных за их хемотаксис. Антитело hCM101 ингибирует связывание этих связывающих CCR3 хемокинов (некоторые из которых связываются с дополнительными рецепторами) с соответствующими их рецепторами и функционально ослабляет мигрирующие свойства клеток, экспрессирующих CCR3, CCR1, CCR2 и CCR5 (эозинофильные и моноцитарные клеточные линии, а также человеческие фибробласты).
Не желая быть связанными теорией, эти уникальные исключительные свойства антитела представляют собой полиспецифичность, а именно, нацеливание против нескольких хемокинов может объяснить их эффективность и их потенциальную способность преодолевать чрезмерные хемокиновые функции. Само по себе это антитело может быть полезно для лечения аутоиммунных заболеваний, ассоциированных с хроническим воспалением и характеризующихся миграцией и инфильтрацией иммунных клеток, включая аллергические и фиброзные заболевания.
Таким образом, в настоящем изобретении предложено выделенное полиспецифическое антитело или любой его антигенсвязывающий фрагмент, которые связываются с по меньшей с мере двумя связывающими CCR3 хемокинами, для применения в лечении фиброзных заболеваний, аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, или аллергических атопических расстройств.
Использованный здесь термин "полиспецифическое (или полиспецифичное) антитело" относится к полиреактивным антителам, которые способны распознавать несколько антигенов, в частности, изобретение охватывает полиспецифическое антитела, которые способны распознавать несколько разных провоспалительных связывающих CCR3 хемокинов. Антитело по изобретению образуется против эотаксина 2 и, как затем обнаружили, связывается и эффективно уменьшает активность дополнительных хемокинов (например эотаксина 1, Rantes и МСР-3). В некоторых воплощениях полиспецифическое антитело по изобретению связывается с различными хемокинами с похожими аффинностями. В других воплощениях антитело обладает отличающейся связывающейся аффинностью с различными хемокинами. В одном из конкретных воплощений антитело связывается с более высокой аффинностью с эотаксином 2, чем с другими протестированными хемокинами. По-видимому, полиспецифические антитела по изобретению распознают перекрестно-реактивный эпитоп в этих провоспалительных связывающих CCR3 хемокинах.
CCR3 (С-С хемокиновый рецептор тип 3) представляет собой белок, который у людей кодируется геном CCR3. CCR3 недавно обозначили как CD193 (кластер дифференцировки 193). Белок, кодируемый этим геном, представляет собой рецептор для хемокинов типа С-С. Он представляет собой 7-трансмембранный сопряженный с белком G рецептор, который экспрессируется эозинофилами, а также широким диапазоном типов клеток, включая макрофаги и эндотелиальные клетки. Этот рецептор связывается и отвечает на ряд хемокинов, включая эотаксин (также называемый эотаксин 1 или CCL11), эотаксин 2 (CCL24), эотаксин 3 (CCL26), МСР-3 (CCL7), МСР-4 (CCL13) и RANTES (CCL5).
Определенный здесь термин "связывающие CCR3 хемокины" относится к любому хемокину, который связывается с белком CCR3, и охватывает, например, эотаксин 1, эотаксин 2, эотаксин 3, Rantes, МСР-3 и МСР-4, но не ограничивается ими. Следует подчеркнуть то, что некоторые из связывающих CCR3 хемокинов, также связываются с дополнительными хемокиновыми рецепторами, например CCR1, CCR2 или CCR5.
Таким образом, в некоторых воплощениях выделенное полиспецифическое антитело для применения по изобретению представляет собой антитело, где по меньшей мере два связывающих CCR3 хемокина выбраны из группы, состоящей из эотаксина 1, эотаксина 2, Rantes и МСР-3.
Термины "эотаксин 2" (эозинофильный хемотаксический белок 2), "CCL24" (лиганд 24 хемокина (С-С мотив)) или "MPIF-2" (ингибирующий миелоидный предшественник фактор 2) используются взаимозаменяемо и относятся к цитокину, принадлежащему семейству хемокинов СС, который кодируется человеческим геном CCL24, расположенным на человеческой хромосоме 7. CCL24 взаимодействует с хемокиновым рецептором CCR3. Активность CCL24 включает индукцию хемотаксиса в эозинофилах, базофилах, Т-лимфоцитах и нейтрофилах, а также индукцию ангиогенных и миграционных ответов в эндотелиальных и гладкомышечных клетках. Аминокислотная последовательность эотаксина 2 (без N-концевого сигнального пептида) обозначена как SEQ ID NO: 11.
Как указано выше, дополнительные связывающие CCR3 хемокины, охватываемые настоящим изобретением, представляют собой эотаксин 1, эотаксин 3, Rantes, МСР-3 и МСР-4, но перечислены некоторые из них.
Определенный здесь термин "эотаксин 1" (также известный как хемокин 11 с мотивом С-С и эозинофильный хемотаксический белок) относится к белку, который у людей кодируется геном CCL11. Эотаксин 1 избирательно рекрутирует эозинофилы путем индукции их хемотаксиса и поэтому вовлечен в аллергические ответы. Действия эотаксина 1 опосредованы его связыванием с рецептором, сопряженным с G-белком, известным как хемокиновый рецептор, включающий CCR2, CCR3 и CCR5. Аминокислотная последовательность человеческого эотаксина 1 (без N-концевого сигнального пептида) обозначена, например, как SEQ ID NO: 12.
Определенный здесь термин "Rantes" (регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками), также называемый как хемокиновый (мотив С-С) лиганд 5 (CCL5), относится к белку, который у людей кодируется геном CCL5. Rantes представляет собой белок 8 кДа, классифицируемый как хемотаксический цитокин или хемокин для Т-клеток, эозинофилов и базофилов, и играет активную роль в рекрутинге лейкоцитов в сайты воспалений. При помощи конкретных цитокинов (т.е. IL-2 и IFN-гамма), высвобождаемых Т-клетками, Rantes также индуцирует пролиферацию и активацию некоторых клеток естественных киллеров (NK) для образования клеток CHAK (киллер, активируемый СС-хемокином). Rantes связывается также с рецептором CCR3. Аминокислотная последовательность человеческого Rantes (без N-концевого сигнального пептида) обозначена, например, как SEQ ID NO: 13.
Определенный здесь термин "МСР-3" (моноцит-специфический хемокин 3), также называемый хемокиновым (С-С мотив) лигандом 7 (CCL7), классифицируется среди подсемейства хемокинов, известных как СС хемокины. МСР-3 в частности привлекает моноциты и регулирует функцию макрофагов. Он продуцируется некоторыми опухолевыми клеточными линиями и макрофагами. Этот хемокин у людей локализован на хромосоме 17 в крупном кластере, содержащем множество других СС хемокинов. Rantes связывается также с рецептором CCR3. Аминокислотная последовательность человеческого МСР-3 (без N-концевого сигнального пептида) обозначена, например, как SEQ IDNO: 14.
В некоторых воплощениях выделенное полиспецифическое антитело для применения по изобретению представляет собой антитело, которое связывается с эотаксином 1, эотаксином 2, Rantes и МСР-3.
В других конкретных воплощениях выделенное полиспецифическое антитело для применения по изобретению ослабляет мигрирующие свойства клеток, экспрессирующих CCR3, CCR1, CCR2 и CCR5.
Под термином "ослабляет мигрирующие свойства" клеток, экспрессирующих CCR3, CCR1, CCR2 и CCR5, понимают, что антитело по изобретению уменьшает клеточную миграцию, которая может быть измерена в анализе хемотаксиса. Такие анализы хемотаксиса хорошо известны в области техники. Примеры анализов хемотаксиса представлены в приведенном ниже разделе примеров. Ослабление мигрирующих свойств означает любое статистически значимое уменьшение клеточной миграции по сравнению с необработанными клетками. Например, уменьшение по меньшей мере на 50% в количестве мигрирующих клеток.
Как приведено в разделе примеров ниже, антитело по изобретению способно связываться с несколькими провоспалительными хемокинами и ингибировать их различные активности, такие как ингибирование клеточного рекрутинга или хемотаксиса (например рекрутинга или хемотаксиса эозинофилов, или моноцитов, или фибробластов), ингибирование превращения фибробластов в миобласты, а также уменьшение клеточной активации. Сами по себе эти антитела могут быть полезны в лечении заболеваний, пагубные симптомы или действия которых опосредованы, по меньшей мере частично, провоспалительными хемокинами CCR3.
В частности, как представлено в примерах ниже, антитело по изобретению вызывало значительное уменьшение нескольких свойств в моделях идиопатического легочного фиброза (IPF) и склеродермии, которые классифицируются как фиброзные заболевания.
Фиброз представляет собой формирование избыточной фиброзной соединительной ткани в органе или ткани в репаративном или реактивном процессе. Это состояние может быть реактивным, доброкачественным или патологическим. Фиброз может использоваться для того, чтобы описать патологическое состояние избыточного отложения волокнистой ткани, а также процесс отложения соединительной ткани при заживлении. Таким образом, использованный здесь термин "фиброзное заболевание" относится к аномальному состоянию, при котором волокнистая соединительная ткань устилает или заменяет нормальную гладкую мышцу или другую нормальную ткань органа. Фиброз может охватывать сердце, легкое, брюшину, кожу или почку. Не ограничивающие примеры фиброзного заболевания включают склеродермию, идиопатический легочный фиброз (IPF), неалкогольный стеатогепатит (NASH), гломерулосклероз, цирроз и метаболические синдромы.
Таким образом, в некоторых воплощениях фиброзное заболевание выбрано из группы, состоящей из склеродермии, идиопатического легочного фиброза (IPF), неалкогольного стеатогепатита (NASH), гломерулосклероза, цирроза и метаболических синдромов.
Определенный здесь термин "склеродермия", также известный как системный склероз, относится к хроническому системному аутоиммунному заболеванию, характеризующемуся затвердеванием (склеро) кожи (дерма). В более тяжелой форме оно также поражает внутренние органы. Склеродермия может представлять собой ограниченную склеродермию и охватывать кожные проявления, которые в основном поражают руки, плечи и лицо, или диффузную склеродермию, которая быстро прогрессирует и поражает большую площадь поверхности кожи и один или более чем один внутренний орган, часто почки, пищевод, сердце и/или легкие. Эта форма склеродермии может приводить к значительной потере дееспособности. Отсутствует лечение самой склеродермии, но системные осложнения отдельных органов лечат.
Термин "идиопатический легочный фиброз" (IPF) относится к прогрессирующему фиброзу легочных альвеолярных стенок, с прогрессирующей одышкой и возможной смертельной нехваткой кислорода или недостаточностью правого желудочка. Острую форму называют синдромом Хаммена-Рича.
Использованный здесь термин "воспаление" относится к сложному биологическому ответу иммунной системы на опасные стимулы, такие как патогены, повреждения клеток (вызванные, например, ожогами, травмой, новообразованием) или раздражители, такие как химические раздражители, тепло или холод. Термин "воспалительное заболевание" или "воспалительное расстройство" относится к заболеваниям, ассоциированным с воспалением, включающим аутоиммунные воспалительные расстройства, но не ограничиваясь ими.
Использованный здесь термин аутоиммунное заболевание описывает патологическое состояние, возникающее в результате сверхактивного иммунного ответа организма на вещества и ткани, обычно присутствующие в организме. Иммунная система ошибочно воспринимает некоторую часть организма как патоген и атакует ее. Она может быть ограничена некоторыми органами или вовлекать конкретную ткань в различных местах, поражая базальную мембрану в легком и почках. Примеры аутоиммунных заболеваний включают ревматоидный артрит, рассеянный склероз, глютеновую болезнь, сахарный диабет I типа (IDDM), системную красную волчанку (SLE), синдром Шегрена, синдром Черджа-Строса, тиреоидит Хашимото, диффузный токсический зоб, псориаз, воспалительное заболевание кишечника (язвенный колит и болезнь Крона), склеродермию и пузырчатку.
Использованный здесь термин "аутоиммунные воспалительные расстройства" относится к расстройствам, возникающим в результате атаки иммунной системы на собственные ткани организма, которые также характеризуются увеличением воспаления. Не ограничивающие примеры аутоиммунного воспалительного расстройства включают системную красную волчанку (SLE), ревматоидный артрит, псориаз, колит, увеит, рассеянный склероз и сахарный диабет I типа.
Таким образом, в некоторых воплощениях определенное здесь аутоиммунное воспалительное расстройство выбрано из группы, состоящей из системной красной волчанки (SLE), ревматоидного артрита, псориаза, колита, увеита, рассеянного склероза и сахарного диабета I типа.
Использованный здесь термин "расстройство, связанное с моноцитами" относится к генетическим аномалиям, которые нарушают функцию моноцитов и макрофагов и вызывают образование дебриса в клетках, приводя в результате, например, к заболеваниям, обусловленным отложениями липидов (таким как болезнь Гоше и болезнь Ниманна-Пика), или к атеросклерозу. Увеличение моноцитов в крови (моноцитоз) возникает в ответ на хронические инфекции, при аутоиммунных расстройствах, при заболеваниях крови и при некоторых формах рака. Пролиферация макрофагов в тканях может возникать в ответ на инфекции, саркоидоз и лангергансоклеточный гистиоцитоз.
В дополнительных воплощениях расстройство, связанное с моноцитами, в соответствии с настоящим изобретением представляет собой атеросклероз.
Использованный здесь термин "атеросклероз" (также известный как атеросклеротическое заболевание сосудов или ASVD) представляет собой патологическое состояние, при котором стенка артерии утолщается в результате отложения жировых веществ, таких как холестерин. Этот процесс является результатом хронического воспалительного ответа в стенках артерий в значительной части вследствие аккумулирования макрофагов и чему способствуют липопротеины низкой плотности без надлежащего удаления жиров и холестерина из макрофагов за счет функции липопротеинов высокой плотности (HDL). Это отвердевание или обрастание артерий вызывается образованием множественных бляшек в артериях.
Использованный здесь термин "аллергическое атопическое расстройство" относится к форме аллергии, которая причиняет страдание лицам с генетической предрасположенностью к гиперчувствительности к некоторым аллергенам. Не ограничивающие примеры аллергического атопического расстройства включают астму, атопический дерматит, алллергический ринит, крапивницу и реакции гиперчувствительности.
Таким образом, в дополнительных воплощениях аллергическое атопическое расстройство в соответствии с изобретением выбрано из группы, состоящей из астмы, атопического дерматита, крапивницы и реакций гиперчувствительности.
Как указано выше, в настоящем изобретении предложены выделенные полиспецифические антитела, которые связываются с по меньшей мере двумя провоспалительными связывающими CCR3 хемокинами. Термин "антитело" относится к полипептиду, кодируемому геном иммуноглобулина, или его функциональным фрагментам, которые, в частности, связываются и распознают антиген, а именно провоспалительные связывающие CCR3 хемокины. В частности, антитело по изобретению связывается и распознает по меньшей мере эотаксин 2, эотаксин 1, RANTES и МСР-3.
В предпочтительном воплощении антитело по изобретению представляет собой моноклональное антитело. Определенный здесь термин "моноклональное антитело", "моноклональные антитела" или "mAb" относится к популяции по существу однородных антител, т.е. индивидуальные антитела, составляющие популяцию, идентичны за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела направлены против одного антигенного сайта.
Моноклональные антитела могут быть получены и очищены любым из способов, известных в данной области техники. Например, моноклональные антитела могут быть получены из В-клеток, взятых из селезенки или лимфатических узлов иммунизированных животных (например крыс или мышей), путем слияния с иммортализованными В-клетками в условиях, которые благоприятствуют росту гибридных клеток.
Иммунизация мышей может быть осуществлена, например, как описано в WO 2010/086854. Кратко, иммунизация мышей может быть осуществлена, например, путем первичной подкожной (s.c.) иммунизации желаемым антигенгом, а именно связывающим CCR3 хемокином, например эотаксином 2, или фрагментом связывающего CCR3 хемокина, содержащим конформационный эпитоп в N-петле (например, 50 мкг), эмульгированным с полным адъювантом Фрейнда. Две подкожные реиммунизирующие инъекции антигеном (например, 50 мкг), эмульгированным неполным адъювантом Фрейнда, затем вводят раз в 2 недели. Мыши с самым высоким титром нейтрализующего антитела получают дополнительно внутривенную (i.v.) реиммунизацию антигеном (например, 5 мкг) в PBS за четверо суток до удаления селезенки.
После окончательной реиммунизации (например, на четвертые сутки) селезенку у мыши с самым высоким титром нейтрализующего антитела удаляют и спленоциты подвергают слиянию с мышиными клетками миеломы (например клетками NS0) с использованием полиэтиленгликоля, как описано ранее ( , G. and Milstein, С. (1975) Nature 256: 495-497). После слияния клетки гибридомы отбирают путем выращивания клеток в среде HAT (гипоксантин-аминоптерин-тимидин). Клоны клеток затем отбирают для продуцирования специфического антитела, например, с использованием анализов ELISA, описанных ниже.
, G. and Milstein, С. (1975) Nature 256: 495-497). После слияния клетки гибридомы отбирают путем выращивания клеток в среде HAT (гипоксантин-аминоптерин-тимидин). Клоны клеток затем отбирают для продуцирования специфического антитела, например, с использованием анализов ELISA, описанных ниже.
Очистка моноклональных антител может быть основана, например, на аффинной хроматографии, а именно, с использованием аффинной колонки, с которой конъюгирован специфический эпитоп.
Пример структурной единицы антитела содержит тетрамер, как известно в данной области техники. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, где каждая пара имеет одну "легкую цепь" и одну "тяжелую цепь". N-конец каждой цепи определяет вариабельную область из приблизительно от 100 до 110 или большего количества аминокислот, прежде всего ответственных за распознавание антигена (или эпитопа).
Таким образом, термины "вариабельная область тяжелой цепи" (VH) и "вариабельная область легкой цепи" (VL) относятся, соответственно, к этим тяжелым и легким цепям. Более конкретно, вариабельная область разделяется на гипервариабельную и каркасную (FR) области. Гипервариабельные области имеют высокое отношение различных аминокислот в данном положении относительно наиболее распространенных аминокислот в этом положении. Четыре области FR, которые имеют более стабильные аминокислотные последовательности, разделяют гипервариабельные области. Гипервариабельные области непосредственно контактируют с определенным участком поверхности антигена. По этой причине гипервариабельные области здесь названы как "области, определяющие комплементарность" или "CDR".
От N-концу к С-концу как легкая, так и тяжелая цепи содержат домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR прежде всего ответственны за связывание с эпитопом антигена. CDR каждой цепи как правило называют CDR1, CDR2 и CDR3, нумеруя последовательно, начиная с N-конца, и также типично идентифицируют по цепи, в которой расположена конкретная CDR.
Таким образом, области, определяющие комплементарность, CDRH1, CDRH2 и CDRH3 относятся к трем областям, определяющим комплементарность, начиная с N-конца тяжелой цепи антитела, а области, определяющие комплементарность, CDRL1, CDRL2 и CDRL3, относятся к трем областям, определяющим комплементарность, начиная с N-конца легкой цепи антитела.
В некоторых воплощениях выделенное полиспецифическое моноклональное антитело в соответствии с изобретением представляет собой химерное антитело, человеческое антитело, гуманизированное антитело или полностью гуманизированное антитело.
Определенный здесь термин "химерные" антитела относится к антителам, в которых часть тяжелой и/или легкой цепи имеет происхождение от конкретных видов, тогда как оставшаяся часть цепи(ей) имеет происхождение от других видов, а также фрагментам таких антител, которые демонстрируют ту же самую биологическую активность.
Химерные антитела могут быть получены любым из способов, известных в данной области техники, например как описано ниже.
Мышиное-человеческое химерное антитело может быть получено путем амплификации и клонирования мышиных генов VH и VL, кодирующих вариабельные области антитела, с последующей экспрессией мышиного-человеческого химерного антитела. Для этого общую РНК выделяют из мышиных клеток гибридомы против эотаксина 2, которые, как продемонстрировано, секретируют антитела с желаемыми характеристиками, и кДНК синтезируют с использованием праймера олиго (dT)15, обратных транскриптаз M-MLV и AMV. Амплификация генов вариабельной области тяжелой и легкой цепей (VH и VL) может быть осуществлена с использованием панели праймеров, направленных к 5'-концу каркасной области 1 каждого гена, по существу как описано в Benhar и Reiter (Benhar, I. and Reiter, Y. (2002) Curr. Protoc. Immunol. Chapter 10: Unit 10 19В), и к константной области (СH1 или Сk, соответственно) по 3' концу.
Вариабельные гены затем повторно амплифицируют с использованием невырожденных праймеров, вводя сайты рестрикции с обоих концов для клонирования, например, в основанный на pCMV вектор экспрессии антитела.
Амплифицированные гены вариабельной области тяжелой и легкой цепей отдельно очищают, расщепляют и клонируют в соответствующие векторы млекопитающих для экспрессии полноразмерного lg, при условии, что каждая цепь с соответствующим сигнальным пептидом и константным геном приводит в результате к экспрессии lgG1/k мышиного-человеческого химерного антитела.
Для получения больших количеств антитела может быть получена стабильная клеточная линия, экспрессирующая антитело, путем трансфекции клеток (например, клеток СНО) вектором, экспрессирующим lg, содержащим как тяжелую, так и легкую цепи химерного антитела. Затем могут быть выбраны клоны с высокой степенью продуцирования антитела против эотаксина 2 (или любого другого связывающего CCR3 хемокина, используемого для продуцирования антител), и их уровень может быть увеличен на основе уровней антитела в супернатанте, как протестировано любым из способов, известных в данной области техники, например при помощи анализа ELISA, специфического в отношении связывающего CCR3 хемокина, как подробно представлено ниже.
Термин "гуманизированные" антитела традиционно относится к формам не являющихся человеческими (например, мышиных) антител, которые содержат каркасную область человеческого иммуноглобулина с минимальными последовательностями, имеющими происхождение от не являющегося человеческим иммуноглобулина по CDR и возможно по дополнительным релевантным положениям. По большей части гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены на остатки из гипервариабельной области видов, не являющихся человеческими (донорное антитело), таких как мышь, крыса, кролик или примат, не являющийся человеком, обладающие желаемыми специфичностью, аффинностью и активностью.
Использованный здесь термин "полностью гуманизированные" антитела относится к антителам, сконструированным таким образом, чтобы иметь только человеческие последовательности. Полностью гуманизированные антитела по настоящему изобретению получали с использованием технологии Composite Human Antibodies™, которая минимизирует иммуногенность антител у пациентов. В этой технологии гуманизации множественные сегменты последовательностей, происходящие из вариабельных (V) областей неродственных человеческих антител, используют в качестве акцепторов для областей, определяющих комплементарность (CDR), исходных антител. В процессе тщательного отбора сегментов человеческой последовательности и применения средств in silico удается избавиться от эпитопов CD4+ Т-клеток, таким образом, что риск иммуногенности уменьшается по сравнению со стандартными гуманизированными антителами при сохранении аффинности и специфичности антитела. Такие антитела содержат только человеческие последовательности и, таким образом, определяют как "полностью гуманизированные".
Используемый здесь термин "человеческое антитело" относится к антителу, которое содержит аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого у человека и/или полученного с использованием любого из способов получения человеческих антител, известных в данной области техники. Это определение специально исключает гуманизированное антитело, которое содержит не являющиеся человеческими антигенсвязывающие остатки.
Получение гуманизированных и человеческих антител хорошо известно в данной области техники. Антитела также могут быть получены с использованием фагового дисплея. Как известно в данной области техники, фаговый дисплей антитела (APD) основан на генетической инженерии бактериофагов и повторяющихся раундов управляемого антигеном отбора и воспроизводства фагов.
Процесс APD начинается с получения библиотеки антител путем приготовления качественной РНК из выбранного клеточного источника (например одноядерных клеток периферической крови). Эту РНК подвергают обратной транскрипции в кДНК, которую используют для ПЦР (полимеразной цепной реакции) цепей VH и VL кодируемых антител. За этой стадией следует лигрование продуктов ПЦР вариабельной тяжелой (VH) и вариабельной легкой (VL) цепей в вектор для фагового дисплея, завершая анализом клонов mAb.
В одном из воплощений в настоящем изобретении предложено выделенное полностью гуманизированное полиспецифическое моноклональное антитело, которое содержит вариабельную область тяжелой цепи, включающую CDRH1, содержащую аминокислотную последовательность NSGMN, обозначенную как SEQ ID NO: 5, или ее вариант, CDRH2, содержащую аминокислотную последовательность WINTYNGEPTYTDDFKG, обозначенную как SEQ ID NO: 6, или ее вариант, и CDRH3, содержащую аминокислотную последовательность HSYGSSYAMDN, обозначенную как SEQ ID NO: 7, или ее вариант; и вариабельную область легкой цепи, включающую: CDRL1, содержащую аминокислотную последовательность KASQSVDYDGDSYMN, обозначенную как SEQ ID NO: 8, или ее вариант; CDRL2, содержащую аминокислотную последовательность VASNLKS, обозначенную как SEQ ID NO: 9, или ее вариант; и CDRL3, содержащую аминокислотную последовательность QQSNEEPWT, обозначенную как SEQ ID NO: 10, или ее вариант.
Другими словами, в настоящем изобретении предложено выделенное полиспецифическое антитело или любой его антигенсвязывающий фрагмент, который связывается с по меньшей мере двумя связывающими CCR3 хемокинами, где антитело представляет собой полностью гуманизированное антитело и содержит вариабельную область тяжелой цепи, включающую:
а) область, определяющую комплементарность, VH CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 5, или ее вариант;
б) область, определяющую комплементарность, VH CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 6, или ее вариант; и
в) область, определяющую комплементарность, VH CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 7, или ее вариант; и
вариабельную область легкой цепи, включающую
г) область, определяющую комплементарность, VK CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 8, или ее вариант;
д) область, определяющую комплементарность, VK CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 9, или ее вариант; и
е) область, определяющую комплементарность, VK CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 10, или ее вариант.
В некоторых воплощениях в настоящем изобретении предложено выделенное полиспецифическое антитело или любой его антигенсвязывающий фрагмент, который связывается с по меньшей мере двумя провоспалительными связывающими CCR3 хемокинами, для применения в лечении фиброзных заболеваний, аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, или аллергических атопических расстройств, где указанное антитело представляет собой полностью гуманизированное антитело и содержит вариабельную область тяжелой цепи, включающую:
а) область, определяющую комплементарность, VH CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 5, или ее вариант;
б) область, определяющую комплементарность, VH CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 6, или ее вариант; и
в) область, определяющую комплементарность, VH CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 7, или ее вариант; и
вариабельную область легкой цепи, включающую
г) область, определяющую комплементарность, VK CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 8, или ее вариант;
д) область, определяющую комплементарность, VK CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 9, или ее вариант; и
е) область, определяющую комплементарность, VK CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 10, или ее вариант.
Вышеприведенные CDR последовательности CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3, обозначенные как SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10, соответственно, также представлены в контексте их соответствующих последовательностей тяжелой и легкой цепей:
Аминокислотная последовательность тяжелой цепи выделенного полностью гуманизированного полиспецифического моноклонального антитела, пример которой здесь приведен, обозначена как SEQ ID NO: 3 и представляет собой аминокислотную последовательность: QIQLVQSGPELKKPGASVKVSCRASGYPFTNSGMNWVKQAPGKGLKWMGWINTYNGEPTYTDDFKGRFAFSLETSASTAYLQINNLRNEDTATYFCASHSYGSSYAMDNWGQGTSVTVSS
Аминокислотная последовательность легкой цепи выделенного гуманизированного полиспецифического моноклонального антитела, пример которой здесь приведен, обозначена как SEQ ID NO: 4 и представляет собой аминокислотную последовательность:
DIVLTQSPDSLAVSLGERATINCKASQSVDYDGDSYMNWYQQKPGQPPKLLIYVASNLKSGIPARFSGSGSGTDFTLTISSLQPEDFATYYCQQSNEEPWTFGGGTKVEIK
Таким образом, в дополнительных воплощениях выделенное полиспецифическое антитело для применения в соответствии с изобретением представляет собой антитело, являющееся полностью гуманизированным антителом, содержащим вариабельную область тяжелой цепи, обозначенную как SEQ ID NO: 3, или ее вариант и вариабельную область легкой цепи, обозначенную как SEQ ID NO: 4, или ее вариант.
Настоящее изобретение также охватывает варианты вариабельных областей тяжелой и легкой цепей. Эти варианты могут включать мутации в областях, определяющих комплементарность, тяжелой и легкой цепей, которые не изменяют активность описанных здесь антител, или в каркасной области.
Под термином "вариант" понимают последовательности аминокислот или нуклеотидов, отличающиеся от последовательностей, конкретно идентифицированных здесь, в которых один или более чем один аминокислотный остаток или нуклеотид делетирован, замещен или вставлен.
Понятно, что под используемым здесь термином "вставлен" понимают любое добавление аминокислотных остатков к описанным здесь последовательностям.
Варианты охватывают различные аминокислотные замены. "Замена" аминокислоты представляет собой замену одной аминокислоты на другую аминокислоту, которая обладает сходными или отличающимися структурными и/или химическими свойствами. Аминокислотные замены могут быть осуществлены на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильноcти и/или амфипатической природе предусмотренных остатков.
Как правило, варианты охватывают консервативные аминокислотные замены. Таблицы с консервативными заменами, приводящими к функционально сходным аминокислотам, хорошо известны в данной области техники. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серии, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и отрицательно заряженные (кислотные) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту.
Каждая из следующих восьми групп содержит другие примеры аминокислот, которые представляют собой консервативные замены одна на другую:
1) аланин (А), глицин (G);
2) аспарагиновая кислота (D), глутаминовая кислота (Е);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (K);
5) изолейцин (I), лейцин (L), метионин (М), валин (V);
6) фенилаланин (F), тирозин (Y), триптофан (W);
7) серии (S), треонин (Т); и
8) цистеин (С), метионин (М).
Консервативные аминокислотные замены представляют собой замены нуклеиновых кислот, приводящие в результате к консервативным аминокислотным заменам, определенным выше.
Варианты в соответствии с изобретением также охватывают замены неполярных аминокислот на полярные и наоборот.
Используемый здесь термин "аминокислота" или "аминокислотный остаток" относится к встречающимся в природе и синтетическим аминокислотам, а также аминокислотным аналогам и аминокислотным миметикам, которые действуют по аналогии с встречающимися в природе аминокислотами.
Варианты последовательностей относятся к аминокислотным последовательностям или последовательностям нуклеиновых кислот, которые могут быть охарактеризованы процентной долей идентичности своих аминокислотных или нуклеотидных последовательностей с описанными здесь аминокислотными или нуклеотидными последовательностями (например аминокислотные или нуклеотидные последовательности тяжелой и легкой цепей описанных здесь антител).
В некоторых воплощениях определенные здесь варианты последовательностей относятся к последовательностям нуклеиновых кислот, которые кодируют вариабельные области тяжелой и легкой цепей, каждая из которых имеет последовательность нуклеотидов по меньшей мере с 70% или 75% идентичностью последовательности, приблизительно 80% или 85% идентичностью последовательности, приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности при сравнении с описанными здесь последовательностями вариабельных областей тяжелых и легких цепей.
В некоторых воплощениях выделенное полиспецифическое гуманизированное моноклональное антитело в соответствии с изобретением представляет собой антитело, в котором его вариабельная область тяжелой цепи кодируется последовательностью нуклеиновой кислоты, которая по меньшей мере на 70% идентична последовательности нуклеиновой кислоты вариабельного домена тяжелой цепи, обозначенной как SEQ ID NO: 1, и в котором его вариабельная область легкой цепи кодируется последовательностью нуклеиновой кислоты, которая по меньшей мере на 70% идентична последовательности вариабельного домена легкой цепи, обозначенной как SEQ ID NO: 2.
Под термином "активность антитела" понимают способность антитела связываться с по меньшей мере двумя связывающими CCR3 хемокинами и предпочтительно ингибировать биологическую функцию, опосредованную такими связывающими CCR3 хемокинами.
Не ограничивающие примеры таких биологических функций представляют собой: ингибирование клеточного рекрутинга или хемотаксиса (например рекрутинга или хемотаксиса эозинофилов, или моноцитов, или фибробластов), ингибирование превращения фибробластов в миобласты или уменьшение клеточной активации (например, измеряемой посредством поглощения Са+). Биологические функции могут быть измерены in vivo или in vitro с использованием способов, хорошо известных в данной области техники. Несколько таких анализов описаны в примерах ниже.
Дополнительные эксперименты in vitro для определения связывания антитела, полученного в соответствии с изобретением, со своим белком-мишенью включают, например, анализы ELISA.
Настоящее изобретение дополнительно охватывает любые антигенсвязывающие фрагменты выделенного полиспецифического моноклонального антитела по изобретению. Такие антигенсвязывающие фрагменты могут представлять собой, например, Fab и F(ab')2, которые способны связываться с антигеном. Такие фрагменты могут быть получены любым из способов, известных в данной области техники, например, путем протеолитического расщепления с использованием ферментов, таких как папаин (для получения фрагментов Fab) или пепсин (для получения фрагментов F(ab')2).
Таким образом, в некоторых воплощениях выделенное полиспецифическое моноклональное антитело в соответствии с изобретением представляет собой антитело, которое представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, одноцепочечного Fv (scFv), вариабельной области тяжелой цепи, способной связываться с антигеном, вариабельной области легкой цепи, способной связываться с антигеном, Fab, F(ab)2' и любой их комбинации.
Интерес представляет тот факт, что с использованием эпитопного картирования авторы изобретения идентифицировали специфический эпитоп в эотаксине 1, эотаксине 2, Rantes и МСР-3, с которым связывается антитело по изобретению (hСМ101).
Эпитоп в эотаксине 2, с которым связывается антитело по изобретению (hСМ101), содержит аминокислотную последовательность CMFFVSKRIP, обозначенную как SEQ ID NO: 15, в эотаксине 1 эпитоп содержит аминокислотную последовательность CFNLANRKIPLQRL, обозначенную как SEQ ID NO: 16, в Rantes эпитоп содержит аминокислотную последовательность AYIARPLPRAHIKEYFY, обозначенную как SEQ ID NO: 17, и в МСР3 эпитоп содержит аминокислотную последовательность CCYRFINKKI, обозначенную как SEQ ID NO: 18 ("первая часть N-петли"), и аминокислотную последовательность SYRRTTSSH, обозначенную как SEQ ID NO: 19 ("вторая часть N-петли").
Как следует из выравнивания последовательностей этих эпитопов, представленных на Фиг. 20В, аминокислотные последовательности данных эпитопов не являются идентичными. Тем не менее, как схематически продемонстрировано на Фиг. 21A-D, все эти эпитопы локализованы в одной и той же области в связывающем CCR3 хемокине, а именно в N-петлевой области, и явно образуют уникальную трехмерную структуру, которая распознается hCM101. Другими словами, существует общий конформационный эпитоп в N-петле эотаксина 1, эотаксина 2, Rantes и МСР-3, с которым связывается антитело по изобретению (hCM101).
Использованный здесь термин "конформационный эпитоп" относится к антигенной детерминанте, части антигена, которая распознается антителом, состоящей из непрерывных или прерывающихся фрагментов аминокислотной последовательности антигена. Конформационные эпитопы взаимодействуют со связывающим сайтом антитела, исходя из 3-D свойствах поверхности и формы или третичной структуры антигена. В некоторых случаях такие эпитопы могут быть идентифицированы частично по линейной последовательности и по их относительному положению в структуре полипептида и по характерным аминокислотам, которые обнаруживают в идентифицированном эпитопе.
Под термином "N-петлевая область" понимают N-петлю и поворот в направлении первого бета-тяжа, расположенного по N-концу связывающих CCR3 хемокинов. Например, как представлено на Фиг. 21А (где представлена белковая поверхность эотаксина 2) и на Фиг. 21Е (ленточная диаграмма эотаксина 2), в связывающем CCR3 хемокине эотаксине 2 N-петлевая область содержит аминокислотную последовательность CMFFVSKRIP, обозначенную SEQ ID NO: 15.
Таким образом, в некоторых воплощениях выделенное антитело по изобретению представляет собой антитело, в котором конформационный эпитоп содержит аминокислотные последовательности, выбранные из аминокислотных последовательностей, обозначенных как SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 или SEQ ID NO: 19.
Интерес представляет тот факт, что биоинформативный анализ конформационного эпитопа, обнаруженного в N-петлевой области эотаксина 1, эотаксина 2, Rantes и МСР-3, выявил несколько положительно заряженных аминокислотных остатков, расположенных либо во фрагменте идущих подряд аминокислотных последовательностей эпитопа, определенных выше, либо в его прилежащей области. Эпитопы схематически изображены на Фиг. 20 и 21. В соответствии с биоинформативным анализом, антитело связывается с областью внутри связывающего CCR3 хемокина, которая включает структуру, образованную в N-петлевой области, и включает аминокислотные остатки в положениях Lys-14 и Arg-15 (локализованные в эпитопе, обозначенном как SEQ ID NO: 15) и Arg-20 в эотаксине 2, положениях Arg-16 и Lys-17 (локализованные в эпитопе, обозначенном как SEQ ID NO: 16) и Arg-22 в эотаксине 1, положениях Arg-17 (локализованные в эпитопе, обозначенном как SEQ ID NO: 17), His-23 и Arg-21 в Rantes, и положениях Lys-18 и Lys-19 (локализованные в эпитопе, обозначенном как SEQ ID NO: 18) и Arg-24 в МСР3. Идентифицированные аминокислотные положения в каждой из хемокиновых последовательностей относятся к хемокиновой последовательности без N-концевого сигнального пептида, как представлено в SEQ ID NO: 11-14, соответствующих аминокислотной последовательности (без N-концевого сигнального пептида) эотаксина 2, эотаксина 1, Rantes и МСР3.
Под термином "положение" понимают локализацию в аминокислотной последовательности, где "положение 1" обозначает первый N-концевой аминокислотный остаток после сигнального пептида (а именно, аминокислотной последовательности зрелого полипептида), "положение 2" обозначает аминокислотный остаток, который расположен по ходу транскрипции последовательности относительно N-концевого аминокислотного остатка и так далее в направлении от N-конца к С-концу, как известно в данной области техники.
Под термином "относительно высокая концентрация" положительно заряженных аминокислотных остатков понимают по меньшей мере три положительно заряженных аминокислотных остатка, например три положительно заряженных аминокислотных остатка.
Таким образом, в еще одном из своих аспектов в настоящем изобретении предложено выделенное антитело, которое связывается с конформационным эпитопом в N-петлевой области связывающего CCR3 хемокина, где указанный конформационный эпитоп характеризуется относительно высокой концентрацией положительно заряженных аминокислотных остатков, локализованных между положениями аминокислот 14 и 24 в аминокислотной последовательности указанного связывающего CCR3 хемокина.
В некоторых конкретных воплощениях выделенное антитело по изобретению представляет собой антитело, в котором конформационный эпитоп содержит по меньшей мере три положительно заряженных аминокислотных остатка между положениями аминокислот 14 и 24 в аминокислотной последовательности указанного связывающего CCR3 хемокина.
В других конкретных воплощениях положительно заряженные аминокислотные остатки выбраны из группы, состоящей из Arg, Lys и His.
В некоторых конкретных воплощениях выделенное антитело по изобретению связывается с эпитопом, содержащим аминокислотные остатки в положениях Lys-14, Arg-15 и Arg-20 в эотаксине 2, положениях Arg-16, Lys-17 и Arg-22 в эотаксине 1, положениях Arg-17, His-23 и Arg-21 в Rantes и положениях Lys-18, Lys-19 и Arg-24 в МСР3.
Общий определенный выше эпитоп может также служить для скрининга и идентификации дополнительных антител, обладающих полиспецифическими связывающими способностями в отношении нескольких связывающих CCR3 хемокинов. Такие антитела могут обладать высокой вероятностью активности в отношении уменьшения клеточной миграции, опосредованной этими хемокинами.
Таким образом, в еще одном аспекте в настоящем изобретении предложен способ скрининга и идентификации антител, способных эффективно ослаблять мигрирующие свойства по меньшей мере одной из клеток, экспрессирующих CCR3, CCR1, CCR2 или CCR5.
В одном из воплощений указанный способ включает:
а. получение антитела против связывающего CCR3 хемокина; и
б. определение связывания указанных антител с конформационным эпитопом в N-петлевой области связывающего CCR3 хемокина, где указанный конформационный эпитоп характеризуется относительно высокой концентрацией положительно заряженных аминокислотных остатков, локализованных между положениями аминокислот 14 и 24 в аминокислотной последовательности указанного связывающего CCR3 хемокина;
в. отбор антител, которые связываются с указанным конформационным эпитопом;
где антитела, которые специфически связываются с указанным конформационным эпитопом, способны эффективно ослаблять мигрирующие свойства клеток, экспрессирующих CCR3, CCR1, CCR2 и CCR5.
В одном из воплощений указанный конформационный эпитоп содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, обозначенных как SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19.
В одном из конкретных воплощений стадию определения связывания осуществляют путем приведения антител в контакт с указанным конформационным эпитопом, например, путем инкубации антител с фрагментом хемокина, содержащим N-петлю, или путем инкубации антител с по меньшей мере одной из аминокислотных последовательностей, обозначенных как SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19. Инкубация может быть осуществлена любым из способов, известных в данной области техники для определения связывания антиген-антитело, например, при помощи ELISA или с использованием чипа, содержащего множество аминокислотных фрагментов. Инкубацию осуществляют в присутствии связывающего буфера и связывание антитела определяют, например, путем дополнительной инкубации с вторичным антителом, меченым детектируемой меткой.
Использованный здесь термин "скрининг и идентификация" относится к определению способности антитела или множества антител связываться с эпитопом по изобретению, определенным выше, и отбору антител, которые связываются с эпитопом и таким образом, как ожидается, уменьшают активность связывающего CCR хемокина при связывании с хемокином.
В некоторых конкретных воплощениях указанный конформационный эпитоп содержит аминокислотные остатки в следующих положениях: Lys-14, Arg-15 и Arg-20 в эотаксине 2 (аминокислотная последовательность которого обозначена как SEQ ID NO: 11), Arg-16, Lys-17 и Arg-22 в эотаксине 1 (аминокислотная последовательность которого обозначена как SEQ ID NO: 12), Arg-17, His-23 и Arg-21 в Rantes (аминокислотная последовательность которого обозначена как SEQ ID NO: 13) и Lys-18, Lys-19 и Arg-24 в МСР3 (аминокислотная последовательность которого обозначена как SEQ ID NO: 14).
Идентифицированный конформационный эпитоп по изобретению также может быть использован в качестве антигена для получения антител, способных эффективно ослаблять мигрирующие свойства по меньшей мере одной из клеток, экспрессирующих CCR3, CCR1, CCR2 или CCR5. Таким образом, в еще одном своем аспекте в настоящем изобретении предложена выделенная N-петлевая область связывающего CCR3 хемокина, содержащая конформационный эпитоп, где указанный конформационный эпитоп характеризуется относительно высокой концентрацией положительно заряженных аминокислотных остатков, локализованных между положениями аминокислот 14 и 24 в аминокислотной последовательности указанного связывающего CCR3 хемокина, для получения антител против указанного связывающего CCR3 хемокина. В конкретных воплощениях указанная выделенная N-петлевая область содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, обозначенных как SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19.
В некоторых воплощениях в настоящем изобретении предложена выделенная N-петлевая область связывающего CCR3 хемокина, содержащая конформационный эпитоп, где указанный конформационный эпитоп характеризуется относительно высокой концентрацией положительно заряженных аминокислотных остатков, локализованных между положениями аминокислот 14 и 24 в аминокислотной последовательности указанного связывающего CCR3 хемокина, для применения в способе получения антител против указанного связывающего CCR3 хемокина. В конкретных воплощениях указанная выделенная N-петлевая область содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, обозначенных как SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19.
Таким образом, в настоящем изобретении дополнительно предложен способ получения антител, способных эффективно ослаблять мигрирующие свойства по меньшей мере одной из клеток, экспрессирующих CCR3, CCR1, CCR2 или CCR5, включающий получение эпитопа по изобретению и продуцирование антитела к указанному эпитопу с использованием любого из способов, известных в данной области техники.
Способы вакцинации животных и получения поликлональных и моноклональных антител хорошо известны в данной области техники.
В еще одном из своих аспектов в настоящем изобретении предложена выделенная молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую антитело или любой его антигенсвязывающий фрагмент в соответствии с изобретением.
Определенный здесь термин "нуклеиновая кислота" или "молекула нуклеиновой кислоты" относится к полимеру из нуклеотидов, который может быть одно- или двухцепочечным, который представляет собой полинуклеотид, такой как дезоксирибонуклеиновая кислота (ДНК) и, где подходит, рибонуклеиновая кислота (РНК). Следует понимать, что эти термины включают в качестве эквивалентов аналоги ДНК или РНК, полученные из нуклеотидных аналогов, и, если применимо для описанного воплощения, одноцепочечные (такие как смысловые или антисмысловые) и двухцепочечные полинуклеотиды. Используемый здесь термин ДНК также включает кДНК, т.е. комплементарную ДНК или копию ДНК, полученную на матрице РНК под действием обратной транскриптазы (РНК-зависимая ДНК-полимераза).
Изобретение также относится к экспрессионному вектору, содержащему определенную здесь выделенную молекулу нуклеиновой кислоты.
Используемый здесь термин "экспрессионный вектор" иногда называемый как "экспрессионный носитель" или "экспрессионная конструкция", включает векторы, такие как плазмиды, вирусы, бактериофаги, интегрируемые фрагменты ДНК и другие носители, которые способны интегрировать фрагменты ДНК в геном хозяина. Экспрессионные векторы обычно представляют собой самореплицирующиеся конструкции ДНК или РНК, содержащие желаемый ген или его фрагменты, и функционально связанные генетические контрольные элементы, которые распознаются в подходящей клетке-хозяине и влияют на экспрессию желаемых генов. Эти контрольные элементы способны влиять на экспрессию в подходящем хозяине. Экспрессионный вектор в соответствии с изобретением может быть способным для экспрессии в бактериальной, дрожжевой клетке-хозяине или клетке-хозяине млекопитающего и так далее.
Еще в одном из аспектов настоящего изобретения предложена клетка-хозяин, трансфицированная выделенной молекулой нуклеиновой кислоты по изобретению или экспрессионным вектором по изобретению.
Используемый здесь термин "клетка-хозяин" относится к клеткам, которые восприимчивы к внедрению выделенной молекулы нуклеиновой кислоты по изобретению или экспрессионного вектора по изобретению. Предпочтительно, указанные клетки представляют собой клетки млекопитающих, например клетки СНО (клетки яичника китайского хомячка) или клетки NS0. Трансфекция выделенной молекулы нуклеиновой кислоты или экспрессионного вектора по изобретению в клетку-хозяин может быть осуществлена любым способом, известным в данной области техники.
Еще в одном из своих аспектов в настоящем изобретении предложен иммуноконъюгат, содержащий антитело или любой его антигенсвязывающий фрагмент в соответствии с изобретением и дополнительный терапевтический агент, например противовоспалительный агент.
Определенный здесь термин "иммуноконъюгат" относится к антителу или любому его антигенсвязывающему фрагменту в соответствии с изобретением, которое конъюгировано (связано или соединено) с дополнительным агентом. Иммуноконъюгаты могут быть получены любым способом, известным специалисту в данной области техники, например, путем перекрестного связывания дополнительного агента с антителом по изобретению или методиками рекомбинации ДНК.
Полиспецифическое антитело по изобретению может быть введено в комбинации с по меньшей мере одним дополнительным терапевтическим агентом.
Используемый здесь термин "дополнительный терапевтический агент" относится к любому агенту, который может быть использован для лечения фиброзного заболевания, аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, или аллергических атопических расстройств. В некоторых воплощениях дополнительный терапевтический агент представляет собой дополнительный противовоспалительный агент или антифиброзный агент. В соответствии с некоторыми воплощениями, по меньшей мере один дополнительный терапевтический агент выбран из группы, состоящей из химиотерапевтических средств, цитокинов, пептидов, антител и антибиотиков.
В некоторых воплощениях указанный дополнительный терапевтический агент включает метотрексат, стероид, циклоспорин, NSAID (нестероидное противовоспалительное лекарственное средство), стероиды, интерферон-бета, внутривенный иммуноглобулин (IVIG), пирфенидон, нинтеданиб, босентан или мацицетан, но не ограничиваются ими.
В некоторых воплощениях дополнительный терапевтический агент представляет собой дополнительные антитело. Определенный здесь термин "дополнительные антитело" относится к антителу, которое не является антителом по изобретению, которое может быть использовано в комбинации с антителом по изобретению. В качестве неограничивающего примера такое антитело может быть направлено против TNFα (фактора некроза опухоли альфа), рецептора TNF, рецептора IL6 или CD20.
В настоящем изобретении дополнительно предложена фармацевтическая композиция, содержащая в качестве активного ингредиента выделенное полиспецифическое антитело по изобретению или любой его антигенсвязывающий фрагмент или иммуноконъюгат, как определено здесь, и фармацевтически приемлемый носитель, эксципиент или разбавитель.
"Фармацевтическая композиция" по изобретению, как правило, содержит антитело или любой его антигенсвязывающий фрагмент, определенные здесь, и буферный агент, агент, регулирующий осмолярность композиции, и возможно один или более чем один фармацевтически приемлемый носитель, эксципиент и/или разбавитель, известный в данной области техники.
Использованный здесь термин "фармацевтически приемлемый носитель, эксципиент или разбавитель" включает любые возможные растворители, диспергирующие среды, оболочки, антибактериальные и противогрибковые агенты и тому подобное, как известно в данной области техники. Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное), их подходящие смеси и растительные масла. Каждый носитель должен быть фармацевтически и физиологически приемлемым с точки зрения совместимости с другими ингредиентами и не причинять вред субъекту. За исключением того, когда любые обычные среды или агенты несовместимы с активным ингредиентом, предусмотрено их использование в терапевтической композиции.
В других воплощениях фармацевтическая композиция по изобретению дополнительно содержит дополнительный терапевтический агент, например противовоспалительный агент.
В конкретном воплощении настоящее изобретение относится к фармацевтической композиции, содержащей выделенное полиспецифическое гуманизированное антитело или любой его антигенсвязывающий фрагмент, который связывается с по меньшей мере двумя провоспалительными связывающими CCR3 хемокинами, где антитело содержит аминокислотную последовательность вариабельной области тяжелой цепи, обозначенную как SEQ ID NO: 3, или ее вариант, и аминокислотную последовательность вариабельной области легкой цепи, обозначенную как SEQ ID NO: 4, или ее вариант.
Дополнительно предложен способ профилактики, лечения или уменьшения интенсивности симптомов аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, аллергических атопических расстройств или фиброзных заболеваний, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества выделенного полиспецифического антитела или любого его антигенсвязывающего фрагмента или фармацевтической композиции по изобретению.
В некоторых воплощениях изобретения предложен способ профилактики, лечения или уменьшения интенсивности симптомов аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, аллергических атопических расстройств или фиброзных заболеваний, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества выделенного полиспецифического гуманизированного антитела или любого его антигенсвязывающего фрагмента, который связывается с по меньшей мере двумя провоспалительными связывающими CCR3 хемокинами, где антитело содержит аминокислотную последовательность вариабельной области тяжелой цепи, обозначенную как SEQ ID NO: 3, или ее вариант, и аминокислотную последовательность вариабельной области легкой цепи, обозначенную как SEQ ID NO: 4, или ее вариант.
Термины "субъект" или "пациент" используются взаимозаменяемо и относятся к субъекту, который в соответствии с настоящим изобретением может представлять собой млекопитающее (например собаку, кошку, овцу, свинью, лошадь, быка или человека). В одном из конкретных воплощений пациент представляет собой человека.
Под определенным здесь термином "профилактика" понимают "превентивное лечение" или "профилактическое лечение", а именно действующее защитным образом, для защиты от или предупреждения аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, аллергических атопических расстройств или фиброзных заболеваний или эпизода такого заболевания.
Следует понимать, что термины "лечить", "процесс лечения", "лечение" или формы, определенные здесь, обозначают уменьшение, предотвращение, излечение, обращение симптомов, уменьшение интенсивности симптомов, ослабление, облегчение, минимизацию, подавление или прекращение вредных действий заболевания или состояния, или замедление возникновения одного или более чем одного из клинических симптомов заболевания, на которые влияют провоспалительные связывающие CCR3 хемокины. Такие заболевания включают аутоиммунные воспалительные расстройства, расстройства, связанные с моноцитами, аллергические атопические заболевания или фиброзные заболевания.
Использованный здесь термин "лечение" относится к уменьшению, предупреждению, излечению, обращению симптомов, ослаблению, уменьшению интенсивности симптомов, минимизации, подавлению или прекращению вредных действий заболевания или состояния, опосредованного эотаксином 2.
Введение в соответствии с настоящим изобретением может быть осуществлено любым из следующих способов: пероральное введение, внутривенная, внутримышечная, внутрибрюшинная, интратекальная или подкожная инъекция; внутриректальное введение; интраназальное введение, внутриглазное введение или местное введение.
В конкретном воплощении введение в соответствии с настоящим изобретением может быть осуществлено внутривенно. В другом конкретном воплощении введение может быть осуществлено внутрибрюшинно. В других конкретных воплощениях введение может быть осуществлено путем ингаляции.
Определенное здесь антитело или фрагменты антитела, любая фармацевтическая композиция, содержащая их, или любой из конъюгатов, содержащий их, может быть введен субъекту до или после возникновения заболевания.
Таким образом, в некоторых воплощениях способ профилактики, лечения или уменьшения интенсивности аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, аллергических атопических расстройств или фиброзных заболеваний в соответствии с изобретением представляет собой способ, при котором указанное выделенное гуманизированное полиспецифическое антитело или любой его антигенсвязывающий фрагмент в соответствии с изобретением или фармацевтическую композицию в соответствии с изобретением вводят указанному субъекту до или после возникновения заболевания.
"Терапевтически эффективное количество" выделенного моноклонального антитела или любого его антигенсвязывающего фрагмента в соответствии с изобретением или фармацевтической композиции в соответствии с изобретением, для определенных здесь целей, определяется такими факторами, которые известны в данной области техники для излечения, прекращения или по меньшей мере ослабления, или уменьшения интенсивности медицинского состояния. Для любого препарата, применяемого в способах по изобретению, доза или терапевтически эффективное количество может быть установлено изначально в исследованиях клеточных культур in vitro или на основании животных моделей, таких как подробно определенные здесь животные модели.
В некоторых воплощениях терапевтически эффективное количество в соответствии с изобретением находится в диапазоне от 0,01 до 100 мг/кг.
В других воплощениях терапевтически эффективное количество в соответствии с изобретением находится в диапазоне от 0,01 до 40 мг/кг, от 0,1 до 40 мг/кг или от 1 до 10 мг/кг.
В других воплощениях выделенное гуманизированное полиспецифическое антитело или любой его антигенсвязывающий фрагмент в соответствии с изобретением или фармацевтическая композиция в соответствии с изобретением вводят субъекту в виде однократной дозы или множественных доз.
Термин "субъект, нуждающийся в" в контексте настоящего изобретения означает теплокровных животных, таких как, например, крысы, мыши, собаки, кошки, морские свинки, приматы и люди, страдающих аутоиммунными воспалительными расстройствами, расстройствами, связанными с моноцитами, аллергическими атопическими расстройствами или фиброзными заболеваниями.
В настоящем изобретении дополнительно предложено выделенное гуманизированное полиспецифическое антитело или любой его антигенсвязывающий фрагмент в соответствии с изобретением или фармацевтическая композиция в соответствии с изобретением для использования в способе профилактики, лечения или уменьшения интенсивности аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, аллергических атопических расстройств или фиброзных заболеваний.
В конкретных воплощениях изобретения предложено выделенное гуманизированное полиспецифическое антитело или любой его антигенсвязывающий фрагмент, который связывается с по меньшей мере двумя провоспалительными связывающими CCR3 хемокинами, где антитело включает аминокислотную последовательность вариабельной области тяжелой цепи, обозначенную как SEQ ID NO: 3, или ее вариант, и аминокислотную последовательность вариабельной области легкой цепи, обозначенную как SEQ ID NO: 4, или ее вариант, для использования в способе профилактики, лечения или уменьшения интенсивности аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, аллергических атопических расстройств или фиброзных заболеваний.
Понятно, что термин "очищенное" или "выделенное" относится к молекулам, таким как последовательности аминокислоты или нуклеиновой кислоты, пептиды, полипептиды или антитела, которые извлечены из их природного окружения, выделены или разделены. Таким образом, "выделенное антитело" представляет собой очищенное антитело. Использованный здесь термин "очищенный" или "очищать" также относится к удалению примесей из образца.
Материалы и методы
ELISA для анализа специфичности
Специфичность СМ101 оценивали при помощи ELISA. Планшеты покрывали следующими антигенами: эотаксин1, эотаксин2, моноцитарный хемоаттрактантный белок-3 (CCL7) и RANTES (CCL5). Все из них покрывали в количестве 1 мкг/мл при 4°С в течение ночи. После промывания (PBS + 0,1% Tween 20) в планшеты добавляли hCM101 (5 мкг) в течение 1 ч. После повторного промывания проводили детектирование СМ101 при помощи конъюгата антитела против человеческого антитела с пероксидазой хрена (инкубация в течение 1 ч с разведением 1:5000 в PBS) и количественно оценивали с использованием 3,3',5,5'-тетраметилбензидина в качестве субстрата (Sigma Chemical, Gillingham, UK). Реакцию останавливали через 10 мин добавлением серной кислоты (50 мкл 2М) и оптическую плотность измеряли при 450 нМ.
Иммуногистохимия:
Иммуногистохимическое окрашивание на человеческий эотаксин 2/CCR3 осуществляли на замороженных срезах толщиной 5 мкм после биопсий кожи/легкого, взятых у пациентов, страдающих склеродермией. После фиксации метанолом и ацетоном срезы блокировали неиммунизированной кроличьей и козьей сывороткой крови с последующей инкубацией с блокирующим реагентом CAS. Затем первичное антитело (антитела против эотаксина 2 или против CCR3) добавляли в течение 1 часа при комнатной температуре. После промывки добавляли биотинилированные аффинно-очищенные козьи антитела против мышиных/кроличьих антител (Jackson). Слайды затем инкубировали с 0,3% Н2О2, а затем дополнительно промывали и инкубировали с конъюгатом стрептавидин-пероксидаза (Jackson) в течение 30 минут при комнатной температуре. Слайды проявляли при помощи 3-амино-9 этилкарбазола в качестве субстрата (Dako) в течение 15 минут и докрашивали гематоксилином. Окрашивания Н&Е и трихромом по Массону использовали для анализа легочного воспаления и фиброзных изменений в срезах кожи и легкого
Анализ ослабления
Анализ ослабления применяли с использованием протокола dynabeads (lifetechnology). СМ101 в увеличивающихся концентрациях инкубировали с магнитными частицами (1 мг) в течение 1,5 часов при комнатной температуре. Затем осуществляли разделение на магнитных частицах с последующей инкубацией в течение ночи с образцами человеческой сыворотки крови (пациента, страдающего системным склерозом). Осуществляли разделение на магнитных частицах и элюцию хемокина с частиц с последующим переносом на нитроцеллюлозную мембрану и обработкой имеющимся в продаже антителом против Еох2. Способность hCM101 связываться с эотаксином 1, Rantes и МСР-3 также определяли с использованием электрофореза в геле с додецилсульфатом натрия (SDS).
Анализ хемотаксиса
Aml 14.3D10, представляющую собой эозинофильную клеточную линию, которая стабильно экспрессирует CCR3, однократно промывали PBS и ресуспендировали в концентрации 107 клеток/мл в буфере для анализа (RPMI 1640, 1% BSA без эндотоксинов, 100 Е/мл пенициллина и 100 мкг/мл стрептомицина). hCM101 в различных концентрациях (10-7М-10-9М) инкубировали с комбинацией 5 нМ человеческого эотаксина 1 и эотаксина 2 или МСР-3 и RANTES (30 мин, 37°С) и помещали в нижние камеры 24-луночных планшетов Transwell с порами 5 мкм (Costar); 100 мкл клеток (1×106 клеток) помещали в верхнюю камеру каждого планшета Transwell и анализируемую среду инкубировали при 37°С в течение 4 ч (5% СО2). Живые клетки, мигрирующие в нижнюю камеру, подсчитывали с использованием проточного цитометра (FACSCalibur, BD Biosciences, Cowley, UK). Результаты выражены в виде процентной доли относительно миграции в контроле (т.е. индуцированной хемокином).
Эксперименты также проводили с моноцитарной клеточной линией U937, которая экспрессирует CCR1, CCR3 и CCR5. Для оценки способности hCM101 ингибировать миграцию клеток hCM101 инкубировали с 5 нМ смеси МСР-3 и RANTES и помещали в нижние камеры 24-луночных планшетов Transwell с порами 5 мкм (Costar). Анализ проводили как описано выше.
Для СD14-положительных клеток авторы изобретения использовали магнитные частицы для разделения MACS (Milteny) для РВМС в фиколле, выделенных из цельной крови пациентов, страдающих склеродермией. Миграцию клеток CD14+ в направлении МСР3 и RANTES определяли как описано выше. Дополнительно определяли миграцию клеток CD14- в направлении эотаксина 1, 2 и RANTES, обработанных hCM101.
Для определения хемотаксиса адгезивных клеток (фибробласты-NHDF) в ответ на эотаксин 2 авторы изобретения использовали камеры трансвелл с размером пор 8 мкм (Costar), покрытые фибронектином. После инкубации эотаксин 2 инкубировали с hCM101 в течение 30 минут, в верхнюю камеру добавляли клетки NHDF (5×104 клеток) и инкубировали при 37°С в течение 4 ч. Затем не мигрирующие клетки удаляли с вставленных мембран при помощи ватных тампонов. Мембрану фиксировали 4%-ным параформальдегидом и мигрирующие клетки затем окрашивали кумасси голубым. Количество мигрирующих клеток подсчитывали в трех произвольных полях с использованием инвертированного микроскопа и анализировали с использованием программного обеспечения image pro.
Анализ кальциевой активации:
Клетки (2×106 клеток/мл) инкубировали в PBS+/ + (кальций магний ++) с кальциевым индикатором (Flou4-AM, invitrogen) до конечной концентрации 4 мкМ в течение 30 мин при 37°С. Затем клетки промывали и инкубировали в течение еще 30 мин при 37°С в 500 мкл PBS+/+. Клетки анализировали с использованием проточного цитометра в течение 30 сек (лазер 488, фильтр 520), затем стимулировали 100 нг/мл эотаксина 2 (с преинкубацией с hCM101) и немедленно осуществляли считывание на проточном цитометре.
Окрашивание клеток для проточной цитометрии:
Фибробласты инкубировали в течение 24 ч с СМ101 (10 или 5 мкг/мл) и образцами человеческой сыворотки крови. Затем клетки трипсинизировали, фиксировали 70%-ным этанолом и инкубировали с Ab против α SMA с клетками (Biolegend) в течение 0,5 ч при комнатной температуре. Клетки затем промывали и подвергали инкубации с вторичными ослиными Ab с Cye3 против кроличьего IgG (1:300 в PBS) в течение 0,5 ч при комнатной температуре. Клетки анализировали при помощи проточного цитометра.
Модель склеродермии in vivo
Блеомицин (sigma) растворяли в физиологическом растворе, забуференном фосфатом (PBS), в концентрации 100 мкг/мл.
Превентивная модель:
Системный склероз вызывали ежесуточными подкожными инъекциями 50 мкг блеомицина самкам мышей С3Н в возрасте 6 недель в течение 21 суток. СМ-101 (в дозах 5 мкг, 10 мкг, 20 мкг или 50 мкг), иммуноглобулин G1 (IgG1) или PBS инъецировали через сутки (начиная с 1 суток) параллельно с началом инъекций блеомицина.
Модель лечения:
Самок мышей С3Н в возрасте 6 недель обрабатывали путем подкожных инъекций блеомицина (50 мкг в сутки) в течение 20 суток. Начиная с восьмых суток после начала ежесуточного введения блеомицина мышей ежесуточно обрабатывали внутрибрюшинными инъекциями СМ-101 или PBS 50 мкг/сутки в 100 мкл и умерщвляли на 21 сутки. Важно отметить то, что начало лечения СМ-101 происходило после появления симптомов заболевания.
Мышей затем умерщвляли и осуществляли штанцевую биопсию с использованием 6-мм щипцов на всю толщину кожи из места инъекции. Кожную ткань отбирали для парафиновых и замороженных блоков и для анализа коллагена. Кроме того, кровь отбирали из орбитальной пазухи. Наконец, отбор легких для гистологии и бронхоальвеолярного лаважа (BAL) осуществляли для исследования процентной доли лейкоцитов (в PBS, содержащем 0,1% BSA (бычий сывороточный альбумин) и 0,05 мМ EDTA (этилендиаминтетрауксусная кислота)).
Модель IPF in vivo:
Превентивная модель:
Самцов мышей C57BL в возрасте 7 недель обрабатывали разовой дозой BLM (60 мкг/мышь) путем внутритрахеальной инъекции под изофлурановой анестезией. BLM растворяли в PBS. После инъекции мышей помещали в вертикальное положение и вращали в течение 1 мин. СМ-101 (в дозах 10 мкг, 50 мкг или 100 мкг), иммуноглобулин G1 (lgG1) или PBS инъецировали через сутки (начиная с 1 суток) параллельно с началом инъекции блеомицина.
Модель лечения:
Самцов мышей C57BL в возрасте 7 недель обрабатывали разовой дозой BLM (60 мкг/мышь) путем внутритрахеальной инъекции под изофлурановой анестезией. BLM растворяли в PBS. После инъекции мышей помещали в вертикальное положение и вращали в течение 1 мин. Через девять суток после введения блеомицина мышей ежесуточно обрабатывали 10 или 50 мкг/сутки СМ-101, IgG или PBS в 100 мкл внутрибрюшинных инъекций и умерщвляли на 21 сутки. Важно отметить то, что начало лечения СМ-101 происходило после появления симптомов заболевания. Через девять суток после инъекций блеомицина группу, которой вводили PBS и блеомицин, умерщвляли для определения базового уровня фиброза и воспаления. На 21 сутки оставшиеся группы также умерщвляли.
Мышей умерщвляли и легкие собирали для гистологии и измерения коллагена (sircol). Бронхоальвеолярный лаваж (BAL) собирали для исследования процентной доли лейкоцитов (в PBS, содержащем 0,1% BSA и 0,05 мМ EDTA).
Измерение содержания коллагена
Растворенный коллаген количественно измеряли с использованием анализа для измерения растворенного коллагена Sircol (Biocolor, Belfast, UK). Образцы кожи получали у мышей, страдающих склеродермией, обработанных СМ101 (5, 20 или 100 мкг/мл), IgG или PBS. Образцы экстрагировали в кислотно-пепсиновом растворе. Образцы анализировали в отношении содержания коллагена в соответствии с протоколом производителя. Кратко, 100 мкл образца добавляли к 1 мл колориметрического реагента (краситель SR в пикриновой кислоте) и встряхивали в течение 30 мин с последующим центрифугированием при 10000 g в течение 10 мин. Краситель SR высвобождался из осадка при помощи щелочного реагента (1 н. NaOH), и спектрофотометрические считывания осуществляли при 555 нм на микропланшетном ридере.
Анализ BAL:
Анализ BAL осуществляли как описано ранее (Komai et al, 2010). В трахею вводили канюлю и легкое 4 раза промывали 0,5 мл PBS без кальция и магния, содержащего 0,1% BSA и 0,05 мМ EDTA-2Na. Эту процедуру повторяли трижды (общий объем: 1,3 мл, открываемость >85%). BAL для каждого животного объединяли в пластиковой пробирке, охлаждали на льду и центрифугировали (150×g) при 4°С в течение 10 мин. Клеточные осадки ресуспендировали в том же самом буфере (0,5 мл). Дифференциальный подсчет клеток осуществляли с использованием проточной цитометрии.
Уровни хемокинов
Уровни эотаксина 1, эотаксина 2 и Rantes определяли в образцах сыворотки крови пациентов, страдающих склеродермией, и здоровых доноров с использованием следующих наборов для Elisa: Quantikine human CCL11/Eotaxin, CCL24/Eotaxin-2 and CCL5/Rantes (R&D) в соответствии с протоколом производителя.
Эпитопное картирование
CHIP KMC блокировали 0,05% Tween-20, 0,05% Triton Х-100 в буфере TBS, рН 7,0, 4°С, в течение ночи. CHIP промывали 1 мл 1×TBS с 0,05% Tween-20 и 0,05% Triton Х-100 с рН 7,0 и сканировали при 635 нм и РМТ 700. Затем для обнаружения эпитопного связывания СМ101 CHIP промывали 1 мл связывающего буфера при 4°С в течение 20 мин и инкубировали с 1 мкг/мл hCM101 в связывающем буфере (рН 7,4) при 4°С в течение 2 часов; после инкубации CHIP промывали и инкубировали с 10 нг/мл конъюгата антитела против человеческого IgG с Alexa 647 в связывающем буфере (рН 7,4) при 4°С в течение 1 часа. CHIP вновь промывали и сканировали при 635 нм и РМТ 700.
Анализ Biacore
Константу аффинности hCM101 или мышиного СМ101 оценивали с использованием Biacore Т100. В этом способе используют электрооптическое явление поверхностного плазмонного резонанса (SPR) для измерения констант связывания и констант скорости ассоциации/диссоциации между партнерами связывания. Эотаксин 2 ковалентно иммобизировали на поверхности чипа СМ-5 и раствор СМ101 пропускали над поверхностью. Измеряли изменения угла SPR и получали возможность для определения KD.
Кинетический анализ Episcreen Т-клеточной пролиферации
РВМС для 20 здоровых доноров подвергали оттаиванию, подсчитывали и определяли жизнеспособность. Для каждого донора готовили смешанные культуры, в которых 1 мл концентрата пролиферирующих клеток добавляли в соответствующие лунки 24-луночного планшета. Культуральную среду, 0,5 мл, и 0,5 мл каждого разведения hCM101 добавляли к РВМС с получением конечной концентрации 50 мкг/мл в образце. Для каждого донора также включали контроль воспроизводимости (100 мкг/мл KLH) и только культуральную среду. Культуры инкубировали в течение в общей сложности 8 суток при 37°С с 5% СО2. На 5, 6, 7 и 8 сутки клетки в каждой лунке кратковременно обрабатывали 0,75 мКи [3Н]-тимидина (Perkin Elmer, UK) в 100 мкл культуральной среды AIM-V и инкубировали в течение 18 часов до сбора с использованием TomTec Mach III. Количество импульсов в минуту (cpm) определяли путем сцинтилляционного подсчета Meltilex (Perkin Elmer, UK).
Пример 1. Обработка mAb СМ101 против эотаксина 2 уменьшает признаки склеродермии в мышиной модели
Для исследования возможного вовлечения связывающих CCR3 хемокинов в склеродермию определяли уровни эотаксина 1, 2 и RANTES в сыворотке крови пациентов, страдающих склеродермией, по сравнению со здоровыми субъектами. Результаты указывали на значимое увеличение уровней эотаксина 2 и RANTES (pv≤0,05), как представлено на Фиг. 1А и 1В, соответственно. Кроме того, значимо увеличенная экспрессия эотаксина 2 и его рецептора CCR3 обнаружена в образцах биопсии кожи, взятых у пациентов, страдающих склеродермией (данные не показаны). Таким образом, возможно, что активация пути эотаксин-2/CCR3 может быть применимой при склеродермии.
Значимость эотаксина 2 для склеродермии дополнительно определяли с использованием СМ101. СМ101 представляет собой мышиное моноклональное антитело против эотаксина 2 (WO 2010/086854). Константу аффинности (Kd) для СМ-101 к мышиному эотаксину 2 определяли при помощи Biacore, и обнаружили, что она составляет 7 нМ. Для оценки эффекта лечения СМ101 в отношении склеродермии использовали мышиную модель вызванной блеомицином склеродермии. Склеродермию вызывали путем ежесуточной инъекции 50 мкг блеомицина мышам С3Н в течение 21 суток. СМ101 (10 мкг, 20 мкг или 50 мкг), IgG или PBS инъецировали внутрибрюшинно через сутки. Через двадцать одни сутки после начала инъекций блеомицина образцы кожи и жидкости BAL получали у всех групп. Мышей умерщвляли для определения фиброза и бронхоальвеолярного воспаления.
Значимое уменьшение симптомов, связанных с тяжестью склеродермии, обнаружено у мышей, которых лечили СМ-101, по сравнению с мышами, обработанными IgG1 или PBS. Как показано на Фиг. 2 и Фиг. 3, СМ-101 предупреждало увеличение всех тестируемых параметров (толщина кожи, содержание коллагена в коже и инфильтрация лейкоцитов в легкое). В тесте толщины кожи (Фиг. 2А) обнаружены статистически значимые различия (р<0,05) для каждой дозы СМ-101 по сравнению с обработкой PBS или контролем IgG1. Превентивный эффект СМ-101 также виден в значительном уменьшении концентрации коллагена в коже в зависимости от дозы (30%, 60% и 84% уменьшения при уровнях дозы 10 мкг, 20 мкг и 50 мкг СМ-101, соответственно, как показано на Фиг. 2В). Определение различных подгрупп лейкоцитов в мышином бронхоальвеолярном лаваже выявило значительное дозозависимое уменьшение процентных долей лимфоцитов и эозинофилов (Фиг. 3А и 3В, соответственно).
В модели лечения через восемь суток после инъекций блеомицина получали образцы кожи и жидкости BAL у первой (PBS) и второй (только блеомицин) групп. Через 21 сутки после начала инъекций блеомицина образцы кожи и жидкости BAL получали у третьей (блеомицин) и четвертой (блеомицин + СМ101) групп. Мышей умерщвляли для определения фиброза и бронхоальвеолярного воспаления.
Концентрация коллагена в коже значимо уменьшалась на 60% в группе лечения СМ-101 по сравнению с группой, обработанной блеомицином, в течение 21 суток (Фиг. 4).
Дополнительно жидкость BAL тестировали на присутствие лейкоцитов с использованием анализа проточной цитометрии. Инфильтрация одноядерных клеток и лейкоцитов значимо уменьшалась (на 55% и 30%, соответственно) в группе лечения СМ-101 по сравнению с группой, обработанной блеомицином, как показано на Фиг. 5А и 5В. Типичные картины проточной цитометрии представлены на Фиг. 5C-5F.
Для оценки толщины кожи осуществляли гистопатологическое окрашивание гематоксилином и эозином (Н&Е, Фиг. 6A-D) и трихромом по Массону (Фиг. 6Е-Н) на поврежденной коже. Во-первых, обнаружено значимое увеличение толщины кожи после обработки блеомицином в течение 21 суток, как видно на Фиг. 6С и 6G. Это увеличение не обнаружено в том случае, когда мышей лечили СМ-101 начиная с 8 суток. Дополнительно, окрашивание Н&Е и трихромом по Массону выявило значимое уменьшение воспаления и фиброза в кожных повреждениях у группы лечения СМ-101 (Фиг. 6D и 6Н) по сравнению с группой, обработанной BLM.
Пример 2. Обработка mAb СМ101 против эотаксина 2 уменьшает IPF в мышиной модели
Для исследования возможного вовлечения эотаксина 2 в идиопатический легочный фиброз (IPF) определяли уровни эотаксина 2 в образцах легочной биопсии у пациентов, страдающих IPF. Значимо увеличенная экспрессия эотаксина 2 обнаружена в образцах биопсии кожи, взятых у пациентов с IPF (показано на Фиг. 7). Эти данные подтверждают идею о том, что путь через эотаксин 2 может активироваться при IPF.
Общую модель вызванного блеомицином легочного фиброза использовали для оценки эффективности СМ101. Блеомицин (60 мкг на мышь) инъецировали внутритрахеально мышам C57/BI на 1 сутки. В протоколе профилактики СМ101 или IgG инъецировали I.P (внутрибрюшинно) с 1 по 14 сутки. Через 14 суток после инъекции блеомицина образцы легкого и жидкости BAL отбирали у всех групп. Мышей умерщвляли для определения фиброза и бронхоальвеолярного воспаления.
Значимое подавление связанных с IPF симптомов обнаружено у мышей, обработанных СМ-101, по сравнению с мышами, обработанными иммуноглобулином (IgG) или PBS. Как показано на Фиг. 8 и Фиг. 9, ингибирование при использовании СМ-101 выражено для всех протестированных параметров (концентрация коллагена и инфильтрация лейкоцитов в легкое). Ингибирующее действие СМ-101 выражено в значимом уменьшении концентрации коллагена в зависимости от дозы (уменьшения на 60% и 70% при уровнях дозы СМ-101 10 мкг и 100 мкг, соответственно, как показано на Фиг. 8). Измерение одноядерных клеток в мышином бронхоальвеолярном лаваже (BAL) выявило значимое уменьшение (Фиг. 9) после обработки СМ101. Измерение уровней эотаксина 2 в жидкости BAL выявило уменьшение эотаксина 2 в жидкости BAL в группе, обработанной СМ101 (Фиг. 10).
Для оценки эффективности СМ101 после возникновения заболевания осуществляли протокол лечения, при котором СМ101 вводили ежесуточно только в течение 10 суток после внутритрахеальной инъекции BLM на протяжении 2 недель. Оценка содержания коллагена в легком выявила значимое уменьшение (75%) после ежесуточных обработок 50 мкг СМ101 (Фиг. 11).
Дополнительно, жидкость BAL тестировали на присутствие лейкоцитов с использованием анализа проточной цитометрии. Инфильтрация одноядерных клеток и полиморфноядерных клеток значимо уменьшалась (55% и 65%, соответственно) в группе, обработанной СМ-101, по сравнению с группой, обработанной блеомицином, как показано на Фиг. 12А и 12В. Окрашивание на патологию осуществляли на легочных срезах для каждой группы, и оно продемонстрировало значимое уменьшение воспаления (окрашивание Н&Е) и отложения коллагена (окрашивание трихромом по Массону), как показано на Фиг. 13.
Третья модель in vivo, которую осуществляли, представляла собой сравнение между СМ101 с недавно одобренным лечением IPF пирфенидоном. Пирфенидон (5-метил-1-фенилпиридин-2[1Н]-он) представляет собой небольшую молекулу, обладающую антифиброзными свойствами и некоторыми свойствами акцептора гидроксила, одобренную FDA и ЕМА для лечения IPF, поскольку продемонстрировано, что он замедляет прогрессирование заболевания у пациентов, страдающих IPF.
IPF индуцировали как описано в предшествующем эксперименте. Перед инъекцией BLM мышам I.P. инъецировали 100 мкг СМ101 или ежесуточно давали 100 мг/кг/сутки пирфенидона. Инъекции антитела осуществляли трижды в неделю на протяжении двух недель, тогда как пероральное введение пирфенидона через зонд осуществляли ежесуточно в течение двух недель.
Как показано на Фиг. 14 и 15, СМ101 превосходит пирфенидон для всех протестированных параметров. Концентрация коллагена в легком более серьезно уменьшалась у мышей, которых лечили СМ101, по сравнению с мышами, которых лечили пирфенидоном. Дополнительно, измерение одноядерных клеток, лейкоцитов (WBC) и полиморфноядерных клеток в бронхоальвеолярном лаваже мышей (BAL) выявило значимое уменьшение в группе лечения СМ101, в противоположность группе лечения пирфенидоном (Фиг. 15). Гистологическое окрашивание подтверждает эти результаты, демонстрируя менее выраженные воспаление и фиброз в легочном повреждении, полученные в группе лечения СМ101 по сравнению с группой лечения пирфенидоном (данные не показаны).
Пример 3. Получение гуманизированного mAb hСМ101
Гены вариабельной области (V) из мышиного антитела СМ101 клонировали в векторы Antitope для получения химерного антитела, содержащего мышиные области V, комбинированные с человеческой константной областью тяжелой цепи IgG1 и константными областями легкой цепи κ. Последовательности VH и Vκ мышиного антитела СМ101 подвергали амплификации путем ПЦР с использованием праймеров, которые вводят фланкирующие сайты рестрикции ферментами для клонирования в векторы Antitope, экспрессирующие цепь VH и Vκ IgG1. Область VH клонировали с использованием сайтов MluI и HindIII, и область Vκ клонировали с использованием сайтов рестрикции BssHII и BamHI. Обе конструкции подтверждали путем секвенирования ДНК. Дополнительно, разработали и сконструировали серии из четырех гуманизированных областей VH для IgG1 и четырех гуманизированных областей Vκ с использованием технологии Composite Human Antibody™ (Antitope).
Химерное антитело и комбинации генов гуманизированной области V (в общей сложности 16 антител) экспрессировали в клетках NS0, очищали и тестировали в отношении связывания с человеческим эотаксином 2 в конкурентном анализе ELISA. Данные по связыванию использовали для ранжирования гуманизированных вариантов СМ101 по сравнению с химерным антителом СМ101. Никаких значимых отличий в качестве полос для тяжелой и легкой цепей не обнаружили посредством SDS PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) (данные не показаны).
На основе данных связывания гуманизированный вариант VH1/VK3 (hСМ101) выбран в качестве лидирующего соединения для тестирования в функциональных анализах.
последовательность VH1/VK3:

Нуклеотидные последовательности *CDR выделены жирным шрифтом и подчеркнуты.


Приведенная выше последовательность нуклеиновой кислоты VH вариант 1 (тяжелая цепь или VH) определена здесь как SEQ ID NO: 1.
Приведенная выше последовательность нуклеиновой кислоты VK вариант 3 (легкая цепь) определена здесь как SEQ ID NO: 2.
Приведенная выше аминокислотная последовательность VH вариант 1 (тяжелая цепь или VH, 113 аминокислот) определена здесь как SEQ ID NO: 3.
Приведенная выше аминокислотная последовательность VK вариант 3 (легкая цепь, 107 аминокислот) определена здесь как SEQ ID NO: 4.
VH вариант 1 (тяжелая цепь) включает три области, определяющие комплементарность (CDR):
VH CDR1 имеет аминокислотную последовательность NSGMN (SEQ ID NO: 5).
VH CDR2 имеет аминокислотную последовательность WINTYNGEPTYTDDFKG (SEQ ID NO: 6).
VH CDR3 имеет аминокислотную последовательность HSYGSSYAMDN (SEQ ID NO: 7).
VK вариант 3 (легкая цепь) включает три области, определяющие комплементарность (CDR):
VK CDR1 имеет аминокислотную последовательность KASQSVDYDGDSYMN (SEQ ID NO: 8).
VK CDR2 имеет аминокислотную последовательность VASNLKS (SEQ ID NO: 9).
VK CDR3 имеет аминокислотную последовательность QQSNEEPWT (SEQIDNO: 10).
Пример 4. Аффинность и специфичность связывания hСМ101
Для исследования аффинности связывания hCM101 с эотаксином 2, а также с другими родственными хемокинами использовали несколько разных способов: Elisa, Biacore и эпитопное картирование при помощи CHIP. Значительное связывание антитела с эотаксином 2 продемонстрировано при помощи Biacore (Фиг. 16) и при помощи Elisa, выявивших константу аффинности 3×10-9 М.
Неожиданно обнаружили, что hCM101 связывается с умеренной аффинностью также с другими родственными хемокинами. Как было обнаружено при помощи Elisa, hCM101 связывается с эотаксином 1 (Фиг. 17), RANTES (Фиг. 18) и МСР3 (Фиг. 19).
Анализ путем эпитопного картирования выявил общую особенность между этими четырьмя хемокинами. По-видимому, эотаксин 1, 2, Rantes и МСР-3 демонстрируют сайт эпитопа, который локализован внутри N-петли (Фиг. 20). Этот общий сайт связывания характеризуется высокой концентрацией положительно заряженных остатков приблизительно в одном и том же положении (Фиг. 21).
Эти результаты свидетельствуют о том, что hCM101 представляет собой полиспецифическое антитело, которое связывается с эотаксином 2 с высокой аффинностью и другими родственными хемокинами, как продемонстрировано Elisa. Без связи с теорией, это свойство может обеспечить возможность hCM101 для преодоления чрезмерного уровня хемокинов и для достижения эффекта.
Для оценки ex vivo связывающей специфичности hCM101 анализ ослабления эотаксина 2 в системе кровообращения осуществляли на типичном образце сыворотки крови пациента, страдающего системным склерозом, с использованием полностью гуманизированного антитела СМ101 (hCM101). Авторы изобретения обнаружили дозозависимое распознавание эотаксина 2 со стороны hCM101.
Этот результат свидетельствует о высокой специфчности hCM101 к эотаксину 2 в образцах сыворотки крови (Фиг. 22).
Дополнительно, с использованием анализа путем электрофореза на нитроцеллюлозной мембране эотаксин 1, Rantes и МСР-3 в увеличивающихся концентрациях подвергали воздействию hCM101. Обнаружено дозозависимое увеличение связывания hСМ101 с этими хемокинами (Фиг. 23).
Пример 5. Функциональные анализы с использованием hСМ101
Эотаксин 1 и эотаксин 2 представляют собой хемокины, вовлеченные в рекрутинг эозинофилов в ткани путем связывания и активации CCR3.
Для исследования возможной противомигрирующей функции антитела hCM101 его инкубировали с этими хемокинами в течение 30 минут при 37°С и исследовали хемотаксис эозинофилов. Результаты указывают на значимое дозозависимое ингибирующее действие hCM101 в отношении миграции эозинофилов. От 16% до 45% миграции клеток обнаружили при обработке антителом в концентрации от 10-7 до 10-8 М, соответственно (Фиг. 24), pv≤0,05.
Известно, что клетки моноцитарной линии представляют собой первичные мишени для RANTES и МСР-3 за счет их связывания с рецепторами CCR 1, 2, 3, 5. Таким образом, действие hCM101 на миграцию моноцитарной клеточной линии U937 исследовали путем инкубации антитела с МСР-3 и RANTES. Хемотаксис моноцитов значимо уменьшался, демонстрируя только 26% миграцию в концентрации hCM101 10-7 М (Фиг. 25).
Дополнительно анализы хемотаксиса моноцитов in vitro осуществляли с использованием выделенных человеческих моноцитов и их соответствующих хемоаттрактантов.
Для этой цели моноцитам CD14+, отсортированным от РВМС, полученным у пациентов, страдающих склеродермией, давали возможность мигрировать в направлении человеческих МСР-3 и RANTES в качестве аттрактантов с разными дозами hCM101 или без него. Обработка hCM101 значимо уменьшала хемотаксис моноцитов приблизительно на 55% в высокой дозе (Фиг. 26А).
Аналогичный эксперимент проводили в отношении миграции CD14-отрицательных клеток (в основном лимфоцитов) в направлении эотаксина 1, 2 и Rantes. Обнаружено, что hCM101 значимо уменьшался приблизительно на 90% при высокой дозе антитела (Фиг. 26В).
Склеродермия и IPF представляют собой фиброзные заболевания, которые хорошо характеризуются пролиферацией и миграцией фибробластов. Для исследования действия hCM101 на миграцию фибробластов осуществляли анализ хемотаксиса в направлении эотаксина 2 с или без hCM101. Значимое уменьшение миграции обнаруживали тогда, когда добавляли hCM101, поскольку только 9% клеток прилипали к камерам трансвелл по сравнению с контролем (Фиг. 27). В отношении действия hСМ101 на эотаксин 1 продемонстрировано ингибирование 60% миграции фибробластов (Фиг. 28).
Превращение фибробластов в миофибробласты отражается в повышенной экспрессии гладкомышечного актина.
Превращение фибробластов в миофибробласты вовлекает экспрессию гладкомышечного актина альфа (α-SMA) и представляет собой важный процесс при фиброзе. Их появление может быть вызвано присутствием цитокинов и хемокинов в сыворотке крови. Для оценки влияния hCM-101 на превращение фибробластов в миофибробласты hCM-101 инкубировали с образцами сыворотки крови пациентов, страдающих SSc, и затем эти образцы сывороток крови инкубировали с человеческими фибробластами для измерения их способности индуцировать α-SMA. Экспрессию α-SMA оценивали посредством проточной цитометрии. Как показано на Фиг. 30, увеличение α-SMA уменьшалось на 50% при инкубации образцов сыворотки крови с СМ-101 (10 мкг/мл). Эти результаты свидетельствуют о том, что СМ-101 уменьшает превращение фибробластов в миофибробласты, стимулированное образцами сыворотки крови пациентов, страдающих системным склерозом (SSc). Это превращение ответственно за избыточный синтез и ремоделирование внеклеточного матрикса (ЕСМ), характеризующих SSc.
Активирующую силу хемокинов как правило измеряют путем захвата кальция в цитозоль. Инкубация клеток, экспрессирующих CCR3, с эотаксином 2 и разными концентрациями hCM-101 продемонстрировала значимое уменьшение захвата кальция (демонстрируя клеточную активацию), как показано на Фиг. 30.
Пример 6. hСМ101 не является иммуногенным в соответствии с измерениями в тесте иммуногенности Episcreen
Основное полностью гуманизированное антитело против эотаксина 2 (hCM101) тестировали против группы из 20 здоровых доноров с использованием Т-клеточного анализа по времени EpiScreen™ для определения сравнительного риска иммуногенности. Образцы тестировали в конечной концентрации 50 мкг/мл hCM101 на основе предыдущих исследований, демонстрирующих то, что эта насыщающая концентрация достаточна для стимулирования детектируемых антителоспецифических Т-клеточных ответов. Для определения иммуногенного потенциала каждого образца использовали Т-клеточный анализ по времени EpiScreen™ с анализом пролиферации для измерения Т-клеточной активации.
Фиг. 31 иллюстрирует ответы SI донора на hCM101 в зависимости от времени. Полностью гуманизированное антитело против эотаксина 2 не вызывало положительные ответы при использовании SI≥2,0, пороговое значение р<0,05, в любом из доноров в анализе пролиферации.
Предыдущие Т-клеточные анализы по времени EpiScreen™ с рядом биологических агентов (Фиг. 32) продемонстрировали ясную корреляцию между процентной долей ответов донорных Т-клеток в анализе EpiScreen™ и уровнем иммуногенности (терапевтические ответы в виде антитела против белка), обнаруженным в клинике. Высокая частота донорных ответов обнаружена в анализах EpiScreen™ для иммуногенных антител, таких как Кэмпас (Campath), тогда как относительно низкая частота донорных ответов обнаружена для неиммуногенных антител, таких как Ксолар (Xolair) и Герцептин (Herceptin). В общем, белковые терапевтические средства, которые вызывают <10% положительных ответов в анализе EpiScreen™, ассоциированы с низком риском иммуногенности в клинике. Настоящее исследование продемонстрировало, что по сравнению с другими белковыми терапевтическими средствами, протестированными в анализах EpiScreen™ (Фиг. 32), полностью гуманизированное антитело против эотаксина 2 hCM101 попадает в тот же диапазон, что и Xolair, Herceptin и Avastin, и может рассматриваться как обладающее низким риском иммуногенности.
Литературные источники
1. Goodnow СС et al, Cellular and genetic mechanisms of self tolerance and autoimmunity. Nature 2005; 2; 435(7042):590-7.
2. Jose PJ, Griffiths-Johnson DA, Collins PD et al., Eotaxin: a potent eosinophil chemoattractant cytokine detected in a guinea pig model of allergic airways inflammation, J Exp Med 1994; 179: 881-887.
3. Kitaura M, Nakajima T, Imai T, et al., Molecular cloning of human eotaxin, an eosinophil-selective CC chemokine, and identification of a specific eosinophil eotaxin receptor, CC chemokine receptor 3, J Biol Chem 1996; 271: 7725-7730.
4. Ponath PD, Qin S, Ringler DJ, et al., Cloning of the human eosinophil chemoattractant, eotaxin. Expression, receptor binding, and functional properties suggest a mechanism for the selective recruitment of eosinophils. J Clin Invest 1996; 97: 604-612.
5. Bocchino V, Bertorelli G, Bertrand CP, et al., Eotaxin and CCR3 are up-regulated in exacerbations of chronic bronchitis, Allergy 2002; 57: 17-22.
6. Fulkerson PC et al, Targeting eosinophils in allergy, inflammation and beyond; Nat Rev Drug Discov. 2013 Feb; 12(2): 117-29.
7. Amerio.p et al, Eotaxins and CCR3 receptor in inflammatory and allergic skin diseases: therapeutical implications. Curr Drug Targets Inflamm Allergy. 2003; 2(1): 81-94.
8. Pope SM.et al, The eotaxin chemokines and CCR3 are fundamental regulators of allergen-induced pulmonary eosinophilia. J Immunol. 2005 15; 175(8): 5341-50.
9. Ablin, JN. Protective effect of eotaxin-2 inhibition in adjuvant-induced arthritis. Clin Exp Immunol. 2010; 161(2): 276-83.
10. Mausner et al, Eotaxin-2 blockade ameliorates experimental autoimmune encephalomyelitis World J Immunol 2013 27; 3(1): 7-14.
11. Gu YS et al, The immunobiology of systemic sclerosis. Semin Arthritis Rheum. 2008 Oct; 38(2): 132-60.
12. Bhattacharyya S, et al. Understanding fibrosis in systemic sclerosis: shifting paradigms, emerging opportunities Nat Rev Rheumatol. 2011 Oct 25; 8(1): 42-54.
13. Dulkys Y, et al. Detection of mRNA for eotaxin-2 and eotaxin-3 in human dermal fibroblasts and their distinct activation profile on human eosinophils. J Invest Dermatol. 2001.
14. Huaux et al. Role of Eotaxin-1 (CCL11) and CC chemokine receptor 3 (CCR3) in bleomycin-induced lung injury and fibrosis. Am J Pathol. 2005; 167(6): 1485-96.
15. Martin Kohan, Et al. Eotaxin-2/CCL24 and eotaxin-3/CCL26 exert differential profibrogenic effects on humanlung fibroblasts.
16. Baggiolini, M. et al Eotaxin: a VIC (very important chemokine) of allergic inflammation? 1996 J. Clin. Invest. 97:587.
17. Baggiolini, M., B. et al.. Human chemokines: an update. 1997, Annu. Rev. Immunol. 15:675-705.
18. Noble P.W., Barkauskas C.E., Jiang D., et al: Pulmonary fibrosis: patterns and perpetrators. J Clin Invest 2012; 122: 2756-2762.
19. Maher T.M.: Beyond the diagnosis of idiopathic pulmonary fibrosis: the growing role of systems biology and stratified medicine. Curr Opin Pulm Med 2013; 19: 460-465.
20. Shimbori C., Gauldie J., Kolb M., et al: Extracellular matrix microenvironment contributes actively to pulmonary fibrosis. Curr Opin Pulm Med 2013; 19: 446-452.
21. Raghu G, Collard HR, Egan JJ, Martinez FJ, Behr J, Brown KK, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med 2011; 183(6): 788-824.
22. Maher TM. Pirfenidone in idiopathic pulmonary fibrosis. Drugs Today 2010; 46(7): 473-482.
23. Bouros D. Pirfenidone for idiopathic pulmonary fibrosis. Lancet 2011; 377(9779): 1727-1729.
24. Taniguchi H, Ebina M, Kondoh Y, Ogura T, Azuma A, Suga M, et al. Pirfenidone in idiopathic pulmonary fibrosis. Eur Respir J 2010; 35(4): 821-829.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИКИНОВЫЕ АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С НЕСКОЛЬКИМИ СС-ХЕМОКИНАМИ | 2010 |
|
RU2574786C2 |
| АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ МСР-1 | 2001 |
|
RU2314316C2 |
| КОНСТРУКЦИИ АНТИТЕЛ И ХЕМОКИНОВ И ИХ ПРИМЕНЕНИЕ ПРИ ИММУНОЛОГИЧЕСКИХ НАРУШЕНИЯХ | 2001 |
|
RU2252786C2 |
| АНТАГОНИСТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2005 |
|
RU2401842C2 |
| АНТИТЕЛО ПРОТИВ CCR5 | 2003 |
|
RU2322454C2 |
| АНТИТЕЛА К ИНТЕРЛЕЙКИНУ 6 И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2656162C2 |
| НЕЙТРАЛИЗУЮЩИЕ МОНОКЛОНАЛЬНЫЕ ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА ПРОТИВ ИНТЕРЛЕЙКИНА-33 | 2014 |
|
RU2709722C1 |
| IL-17A-СВЯЗЫВАЮЩИЙ АГЕНТ И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2014 |
|
RU2682046C1 |
| НОВЫЕ МОДУЛЯТОРЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2627176C2 |
| АНТИТЕЛА ПРОТИВ NOTCH1 | 2011 |
|
RU2622083C2 |






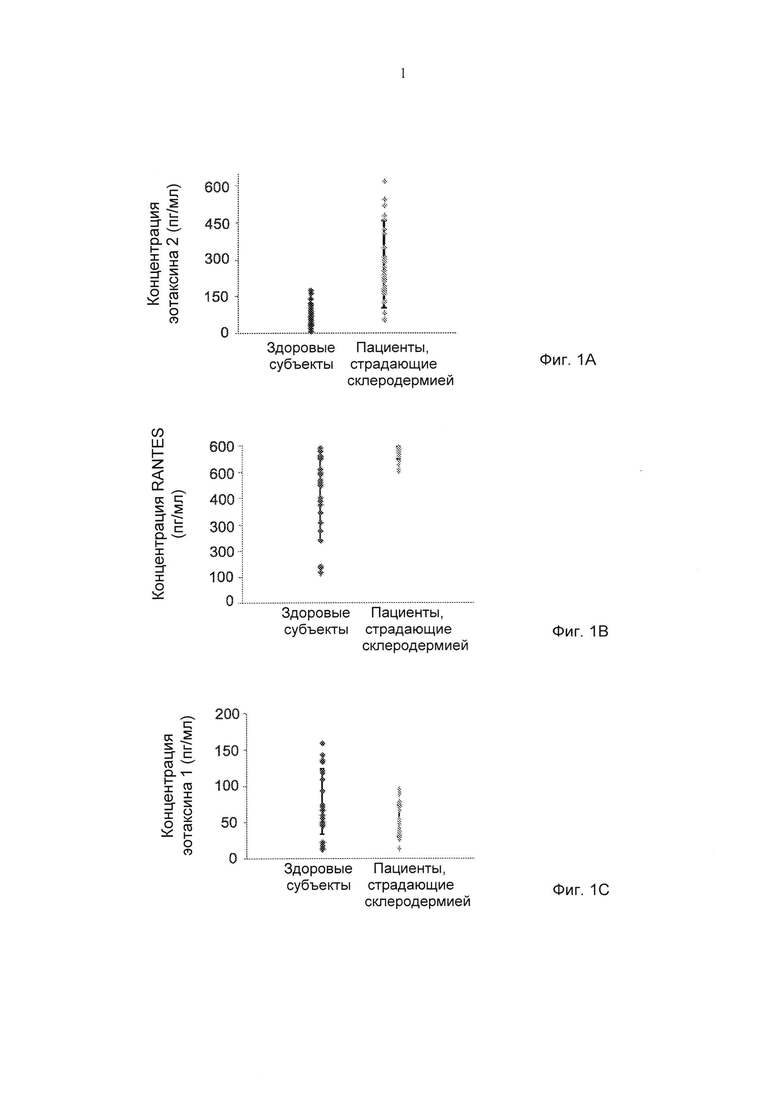
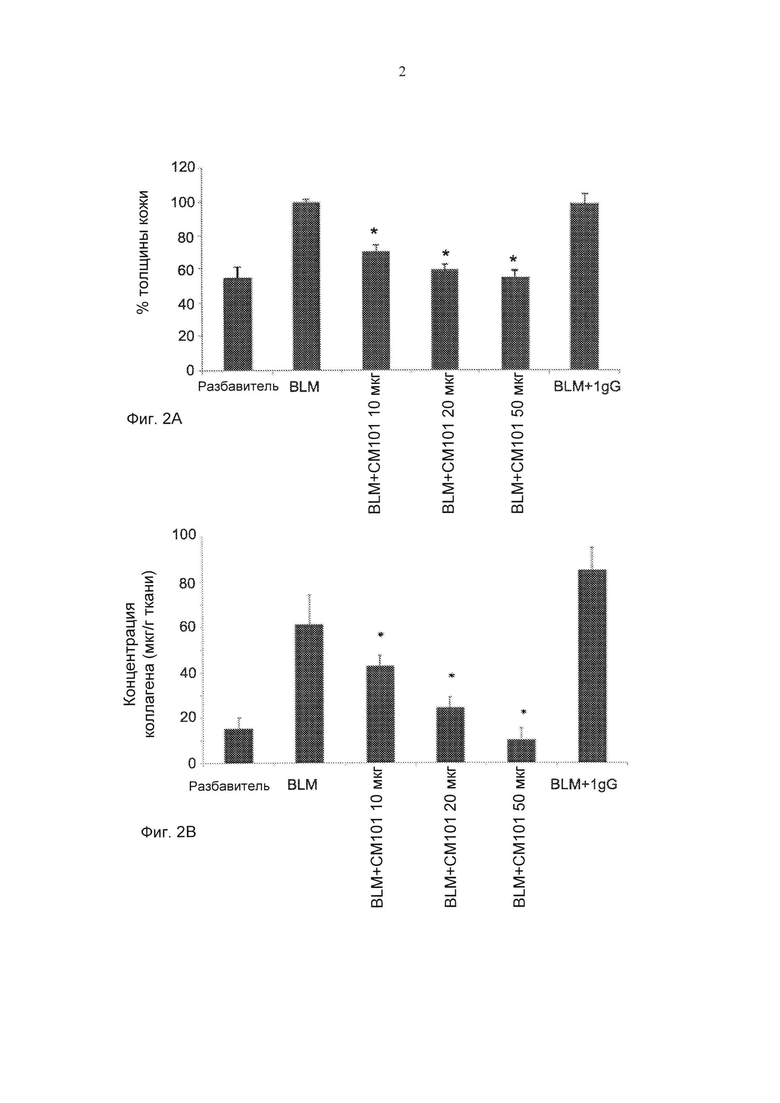
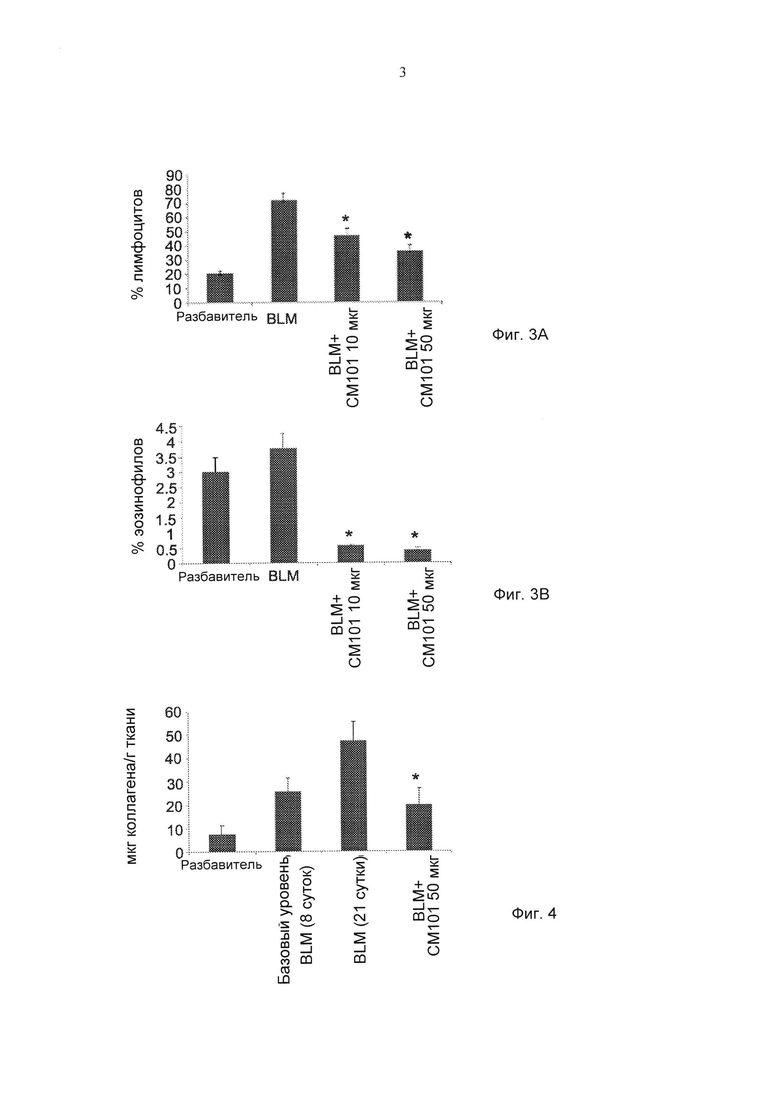
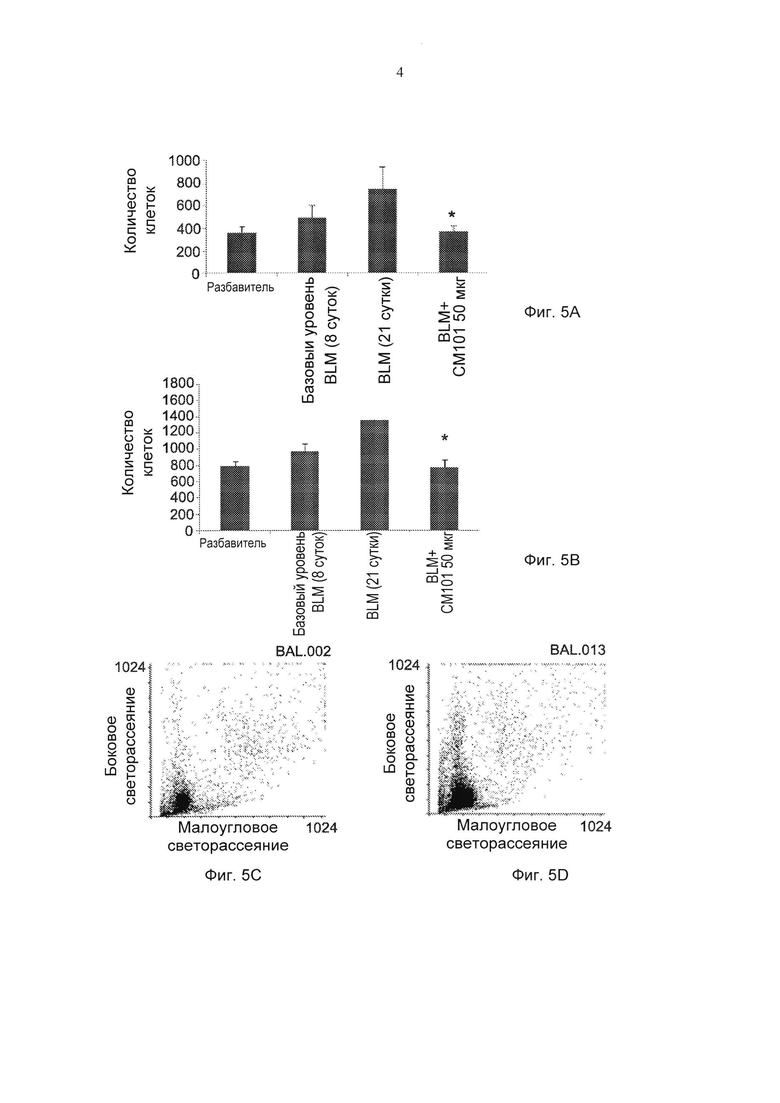
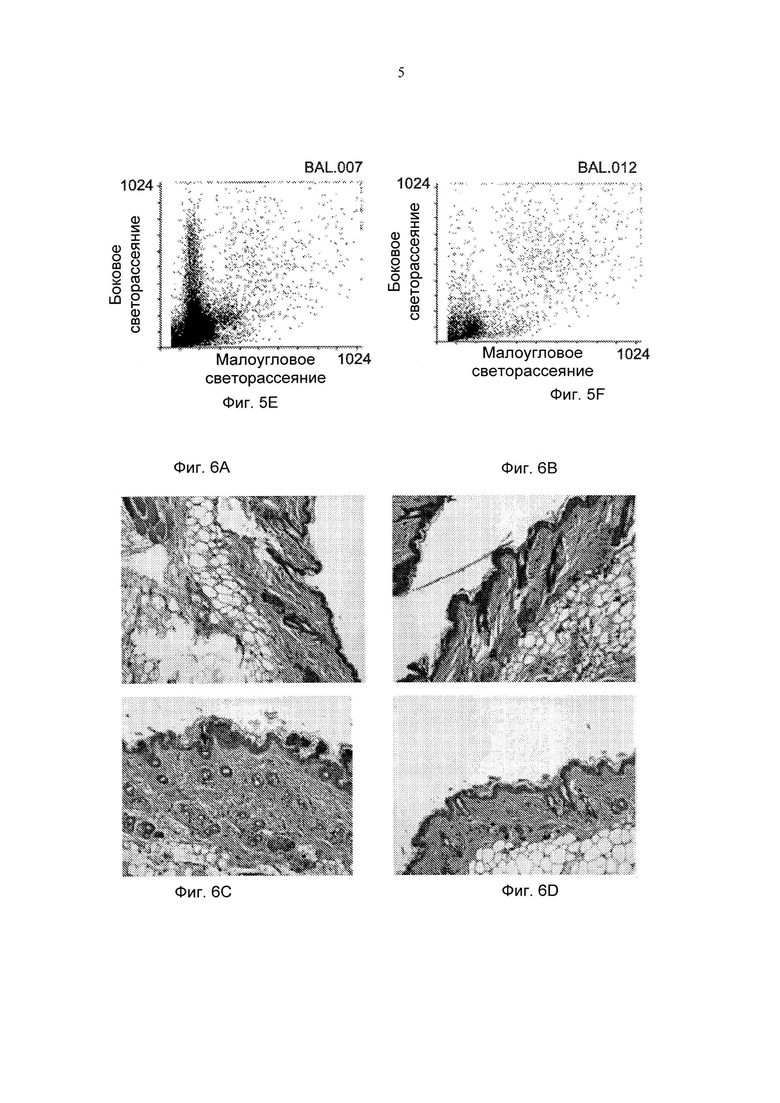
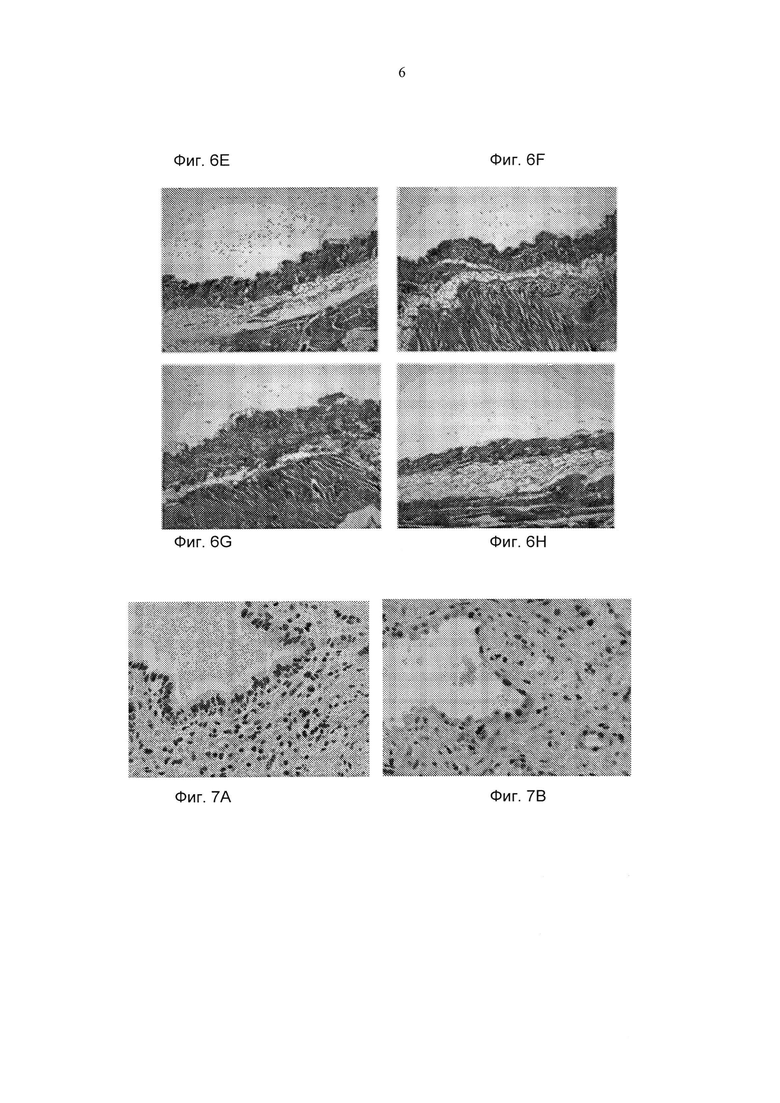
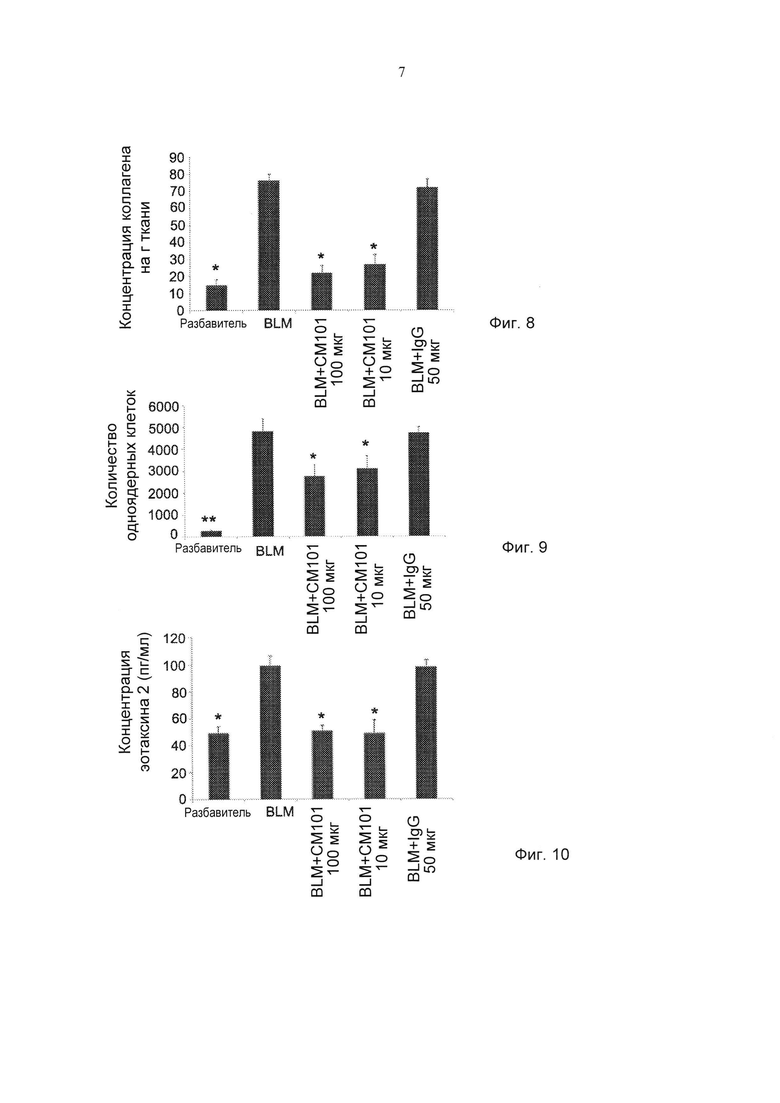
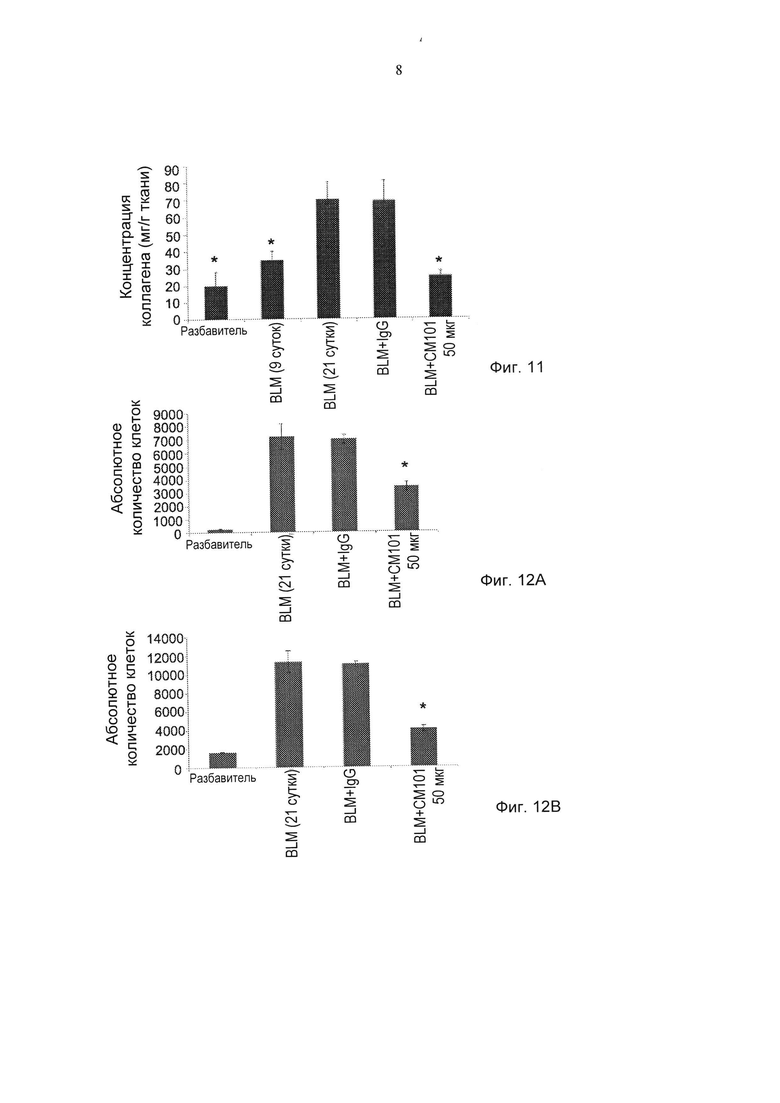
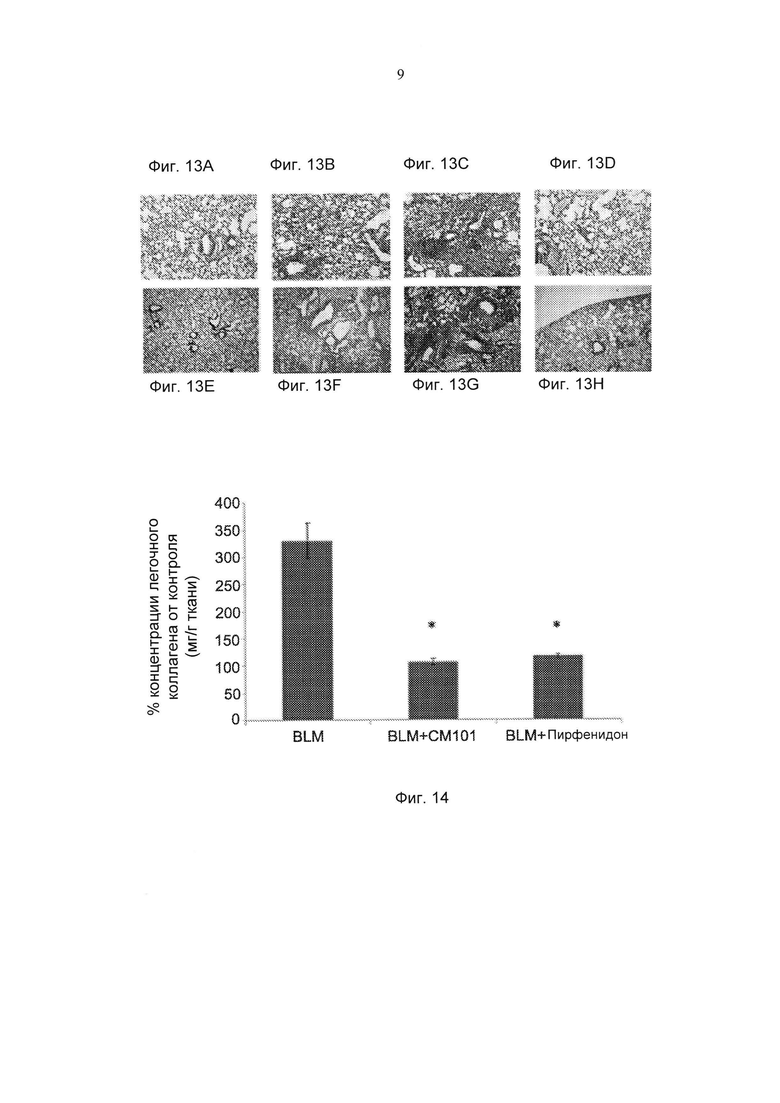
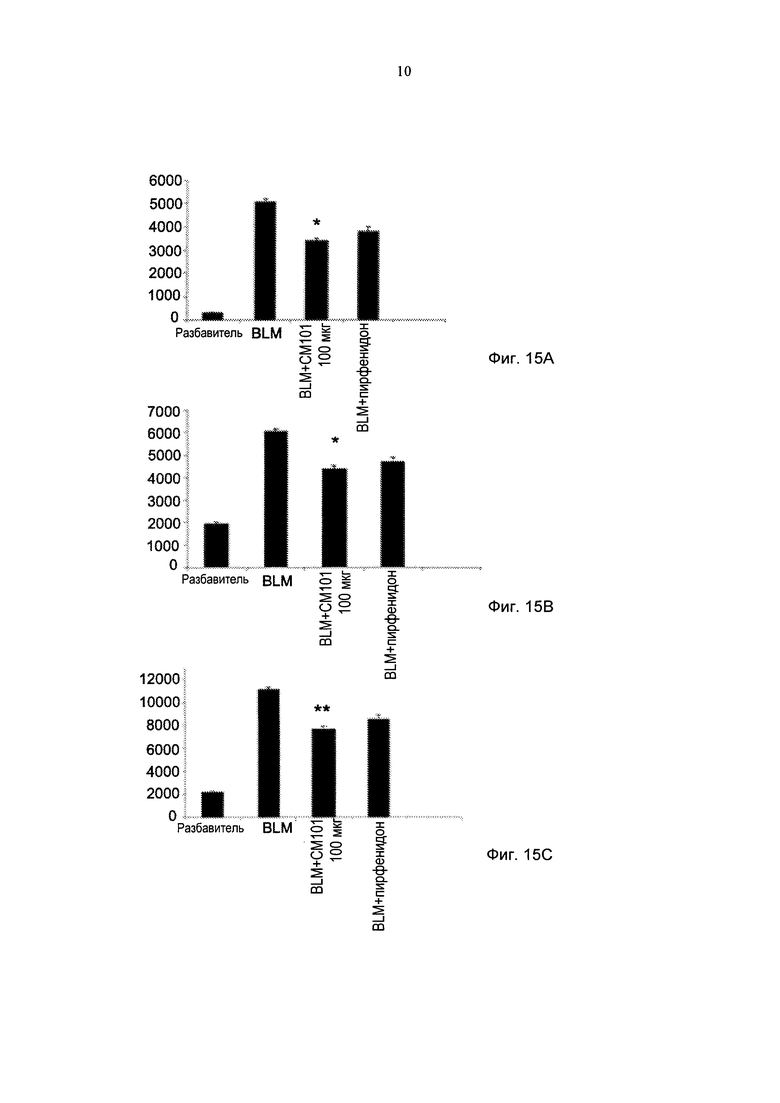
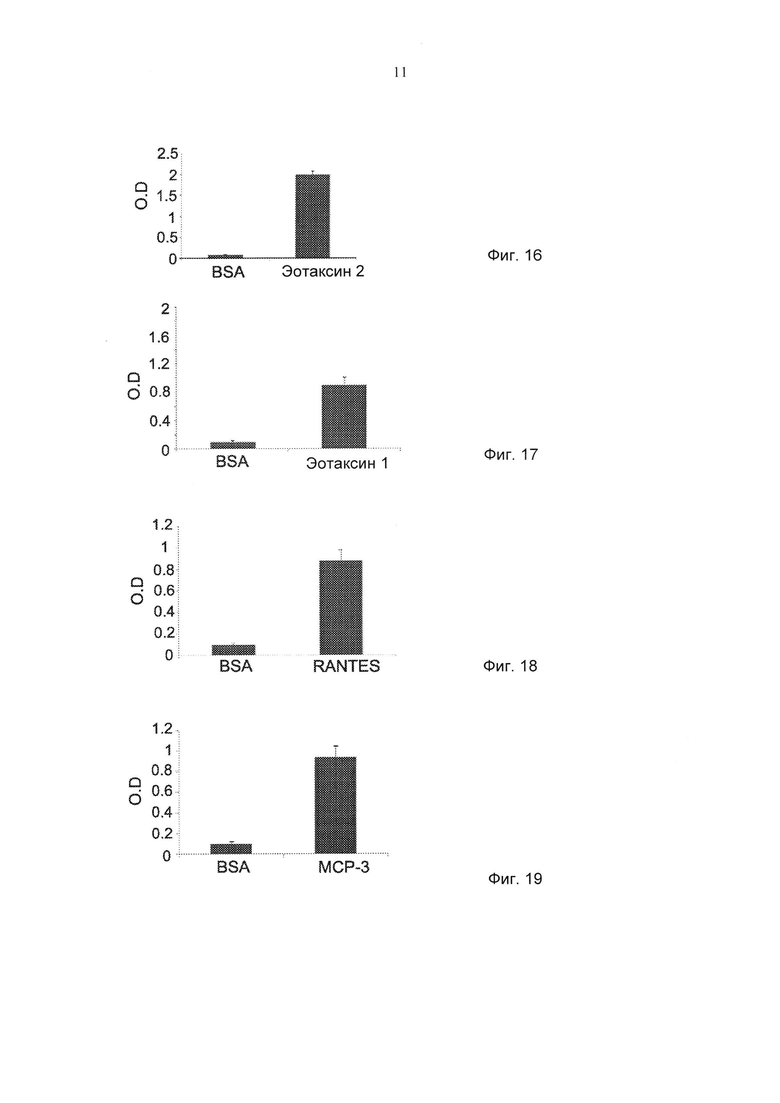
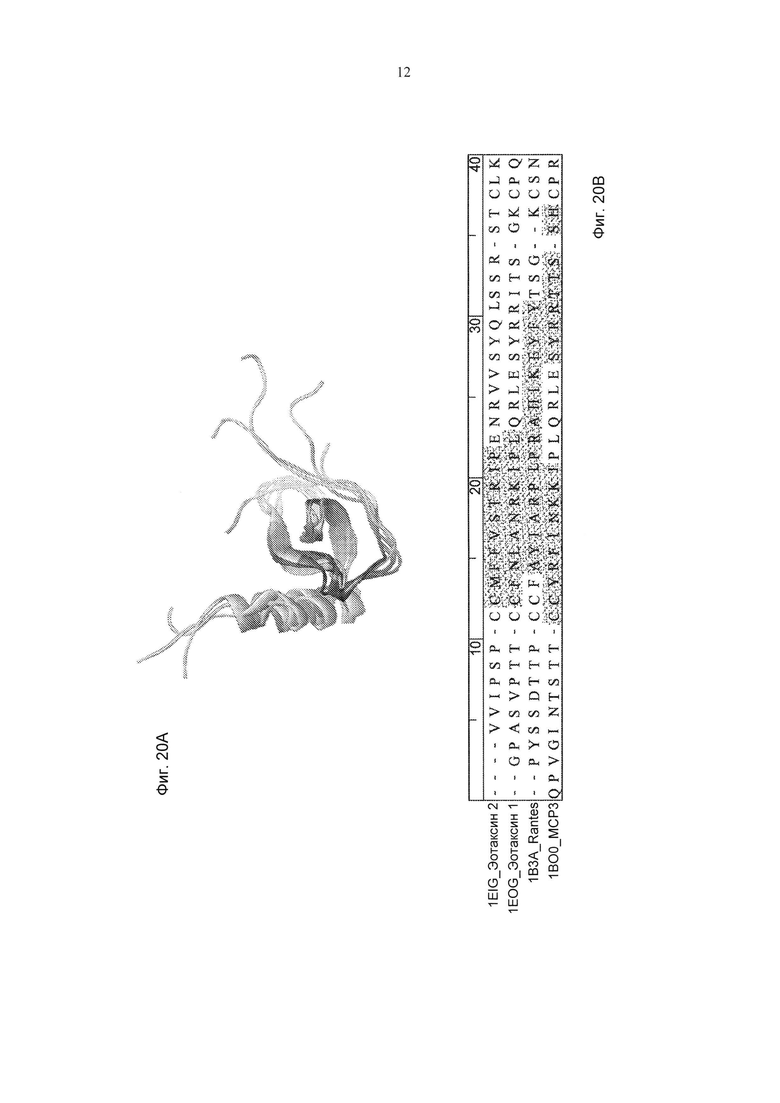
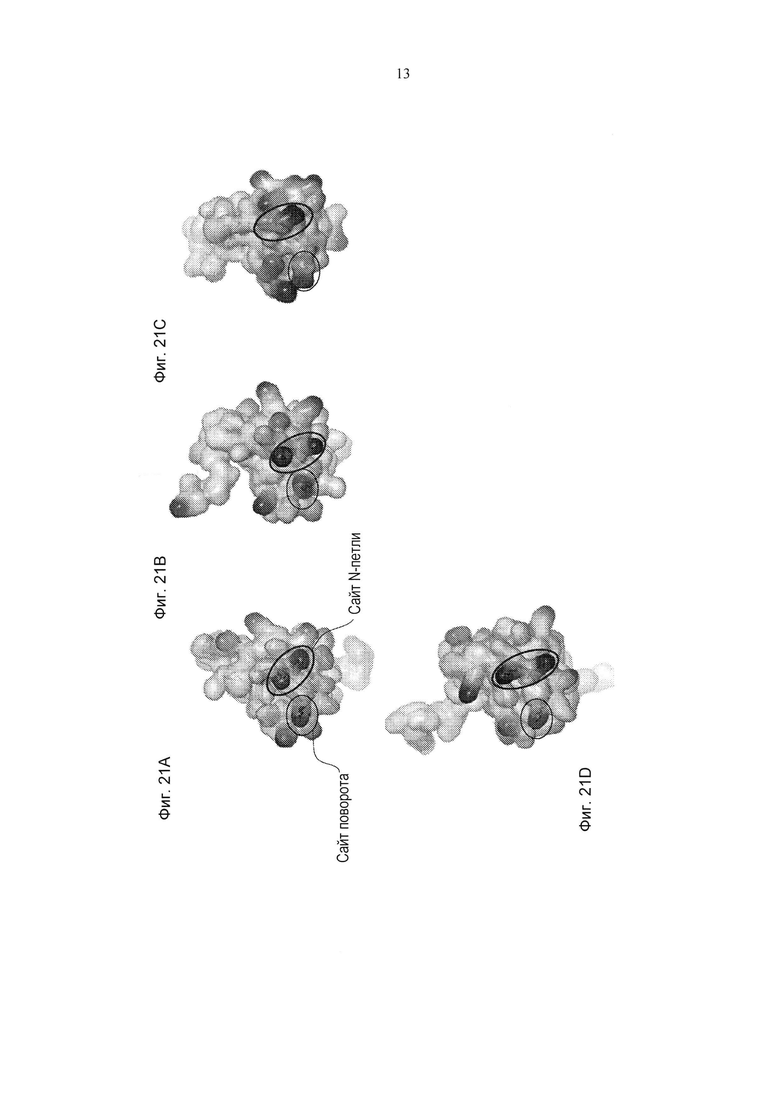
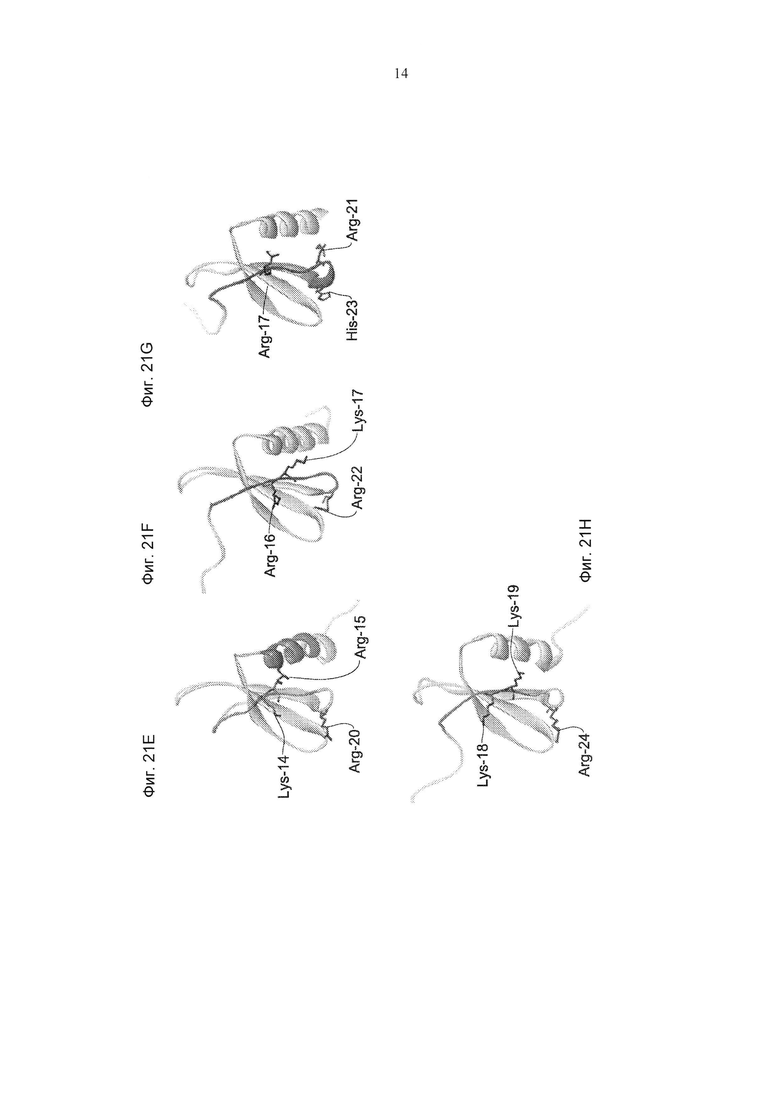
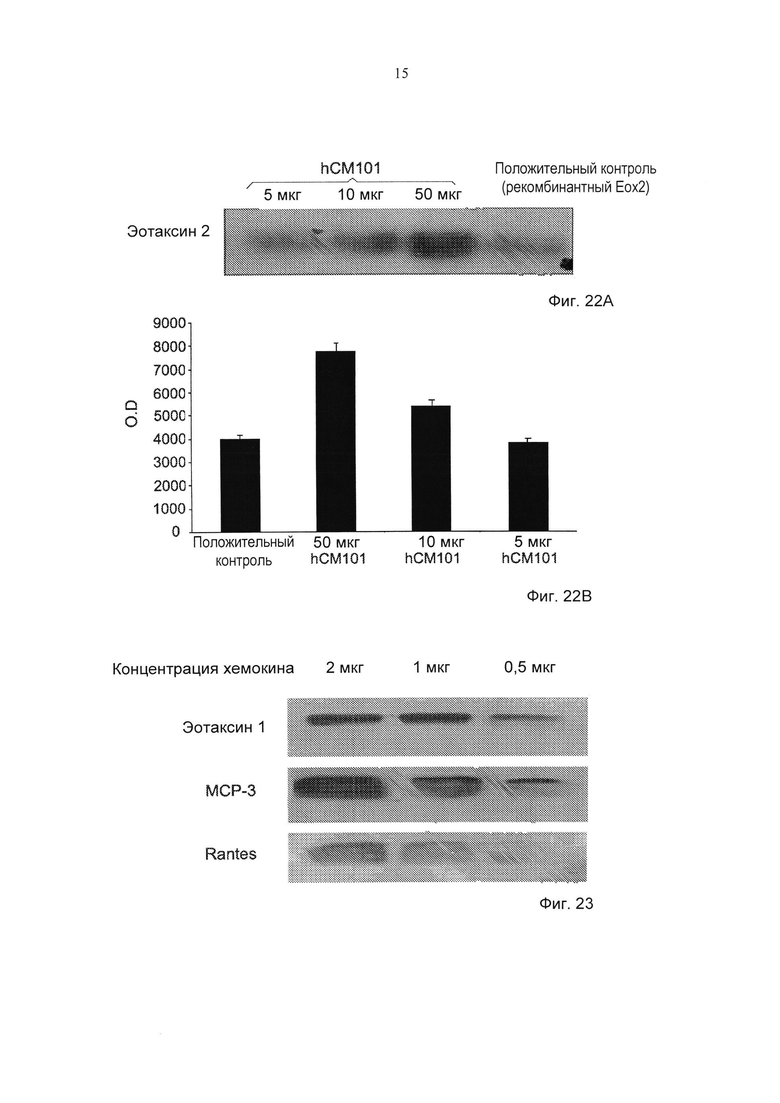
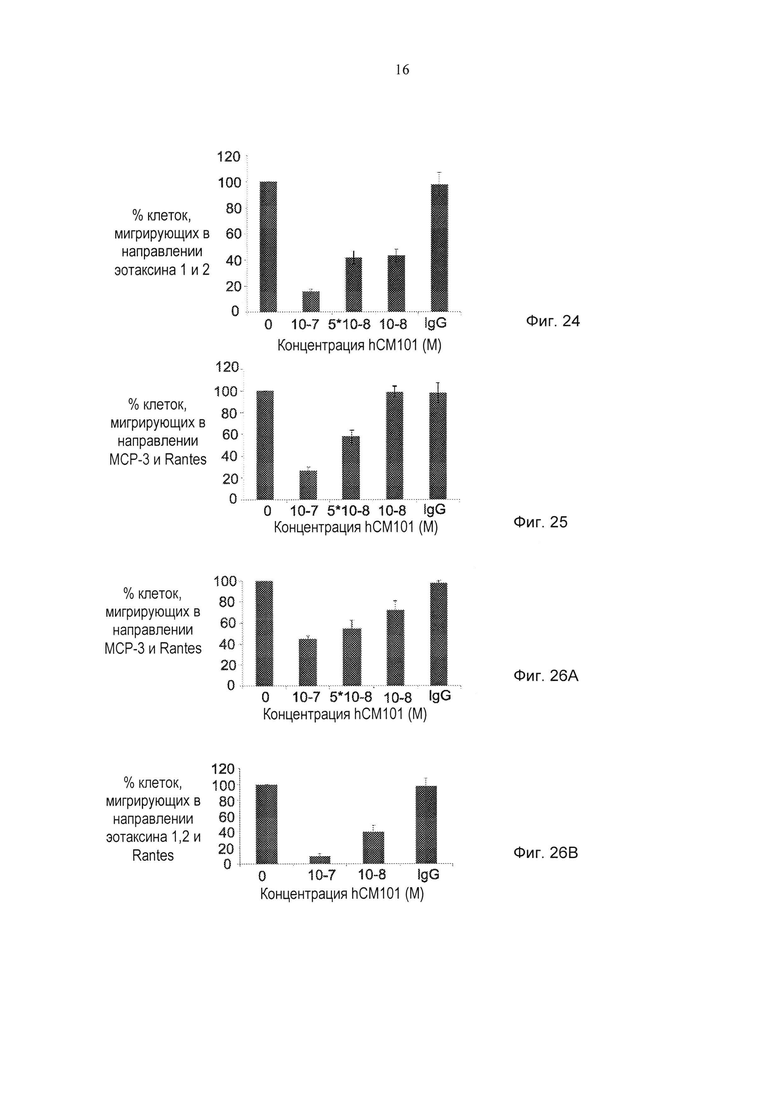
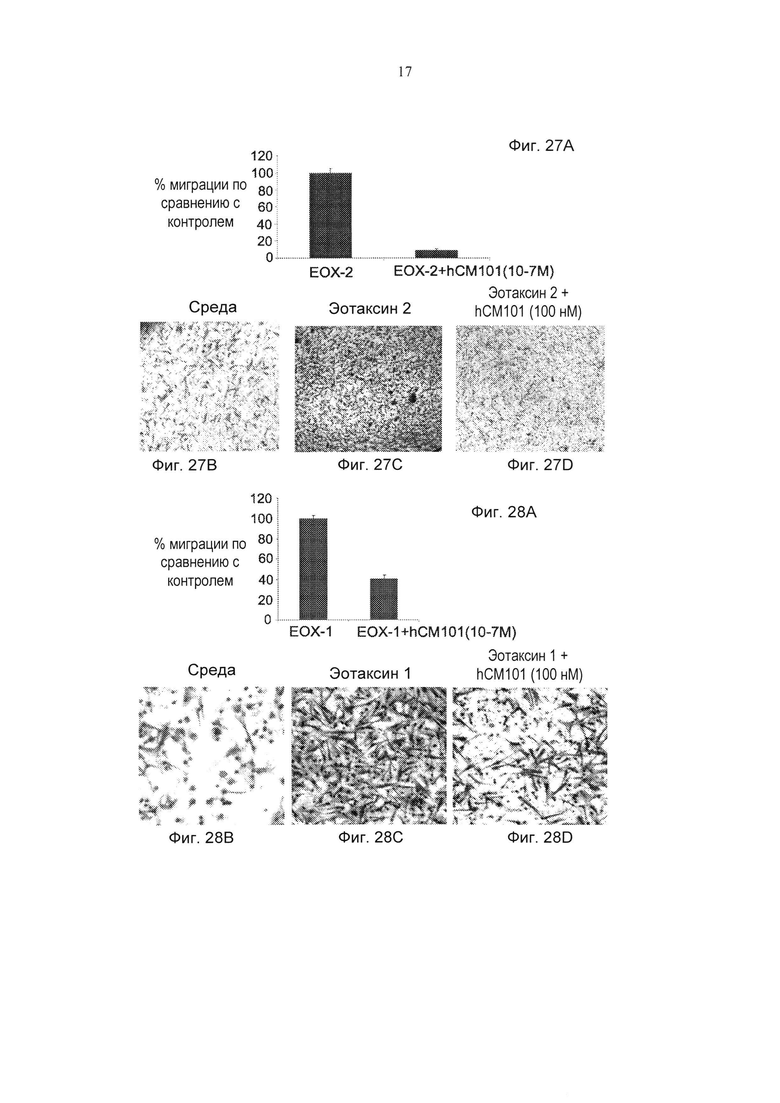
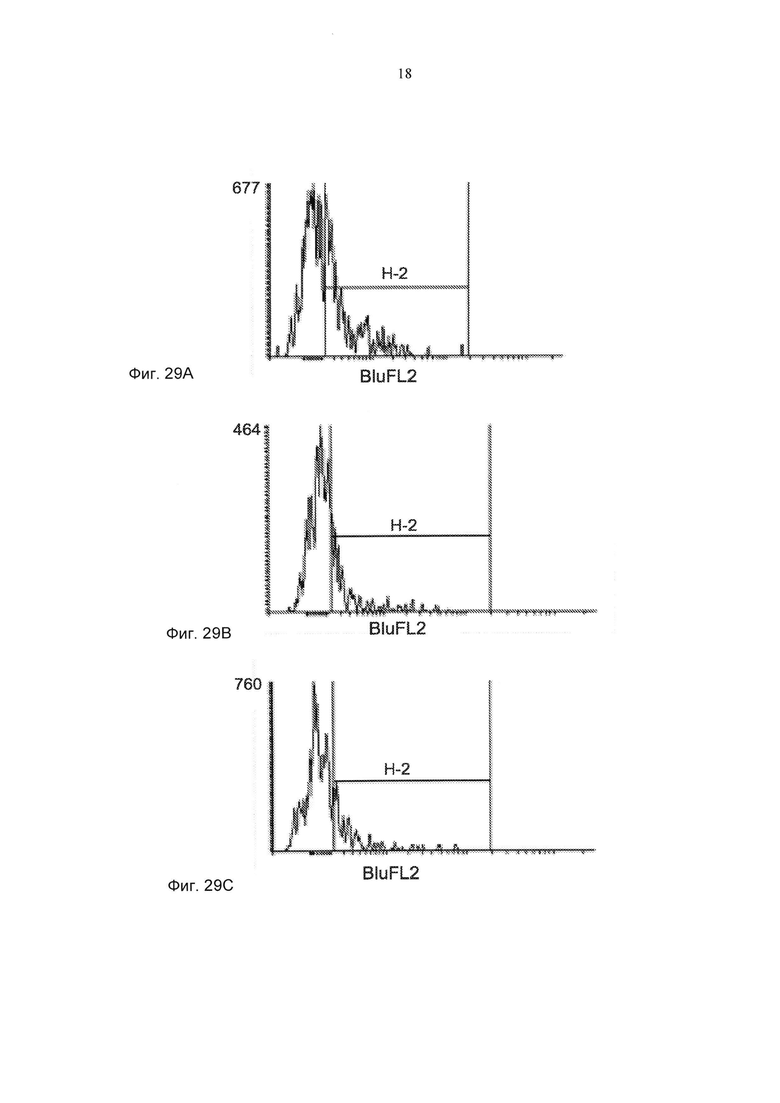
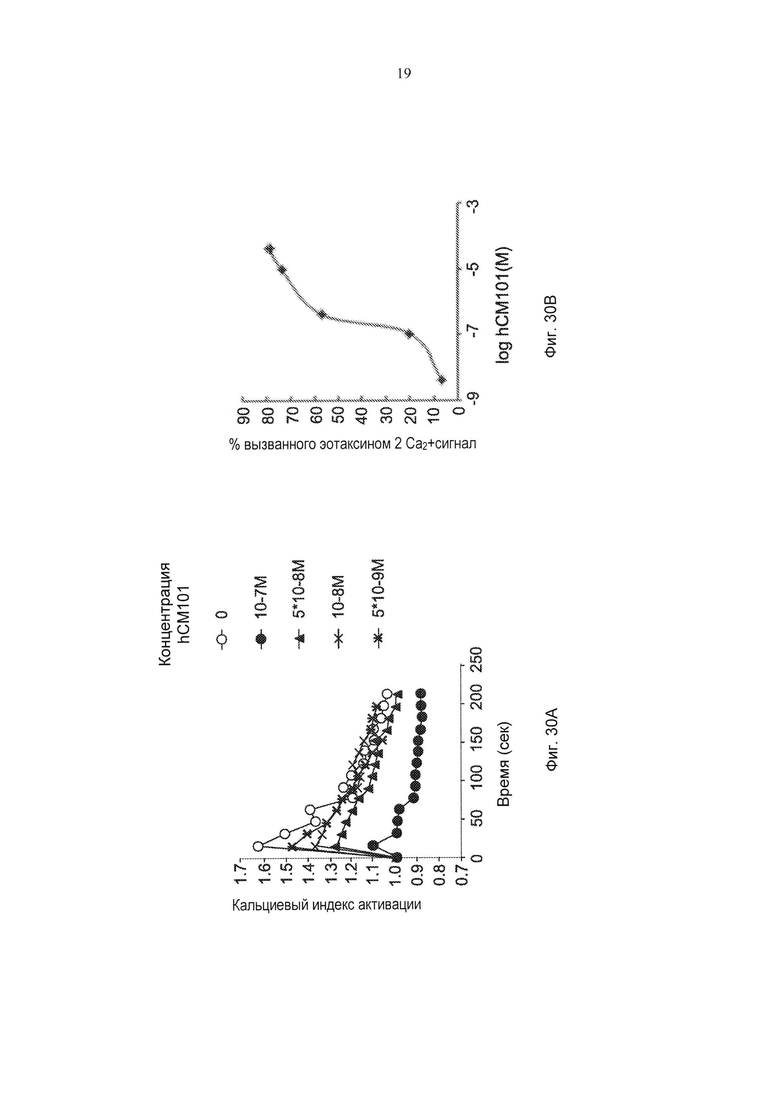
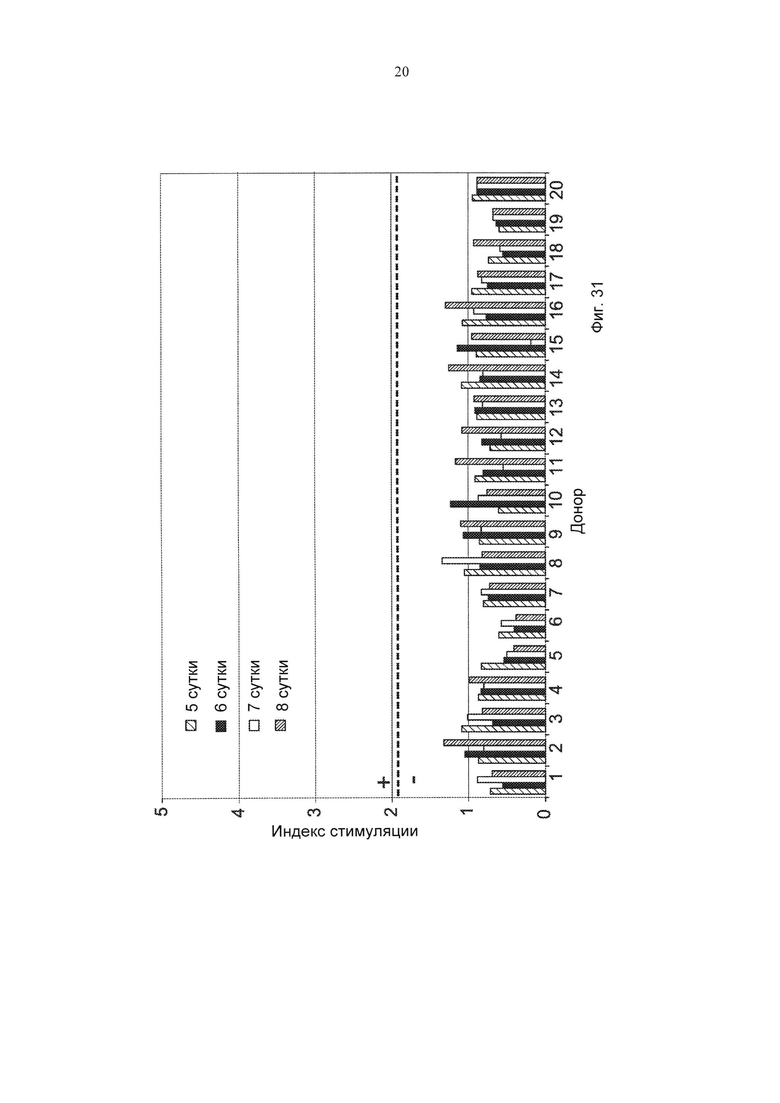
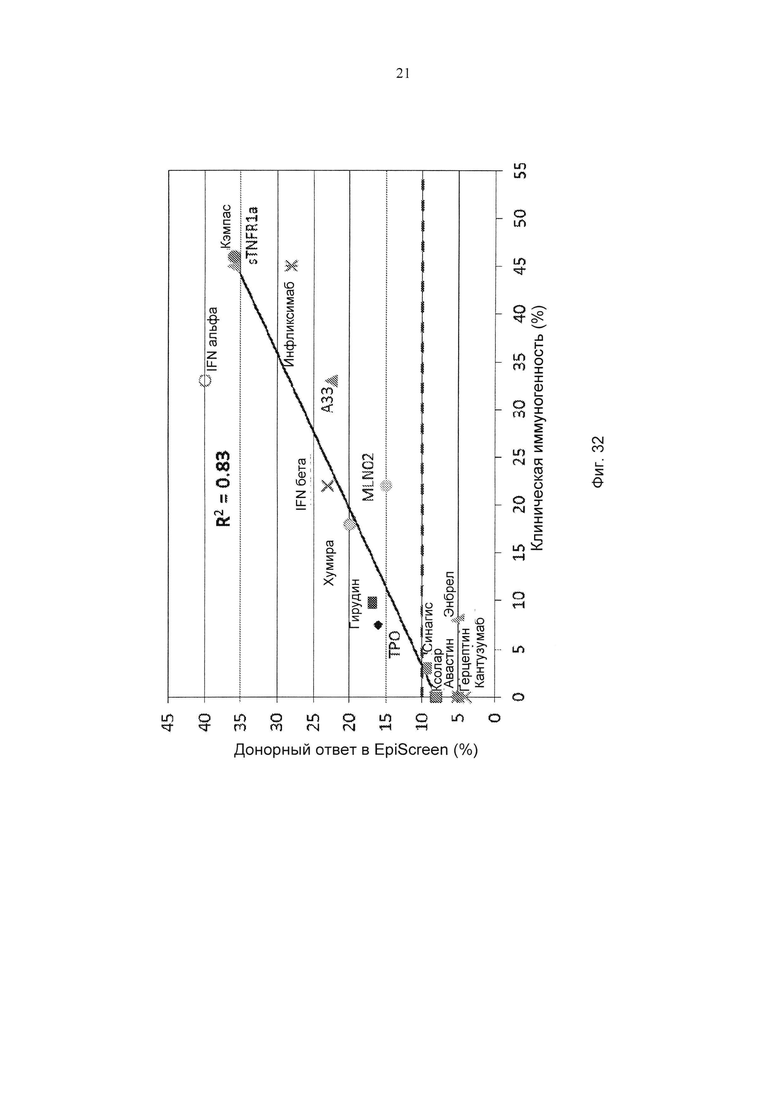
Изобретение относится к биотехнологии и представляет собой выделенные полиспецифические антитела против уникального эпитопа в хемокине эотаксине 2, посредством чего антитела связываются с дополнительными связывающими CCR3 хемокинами. Изобретение также относится к применению этих антител для ослабления миграции различных клеток и для лечения фиброзных заболеваний, аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, или аллергических атопических расстройств. Изобретение позволяет повысить эффективность лечения указанных заболеваний. 7 н. и 12 з.п. ф-лы, 32 ил.
1. Выделенное полиспецифическое антитело или любой его антигенсвязывающий фрагмент, которые специфически связываются с по меньшей мере двумя связывающими CCR3 хемокинами, для применения в лечении фиброзных заболеваний, аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, или аллергических атопических расстройств, где указанное антитело представляет собой полностью гуманизированное антитело, содержащее:
вариабельную область тяжелой цепи, включающую:
а) область, определяющую комплементарность, VH CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 5;
б) область, определяющую комплементарность, VH CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 6, и
в) область, определяющую комплементарность, VH CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 7, и
вариабельную область легкой цепи, включающую:
г) область, определяющую комплементарность, VK CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 8;
д) область, определяющую комплементарность, VK CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 9, и
е) область, определяющую комплементарность, VK CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 10.
2. Выделенное полиспецифическое антитело для применения по п. 1, где указанное антитело представляет собой моноклональное антитело.
3. Выделенное полиспецифическое антитело для применения по п. 2, где указанное моноклональное антитело представляет собой химерное антитело, человеческое антитело, гуманизированное антитело или полностью гуманизированное антитело.
4. Выделенное полиспецифическое антитело для применения по любому из пп. 1-3, где указанный его антигенсвязывающий фрагмент выбран из группы, состоящей из Fv, одноцепочечного Fv (scFv), вариабельной области тяжелой цепи, способной связываться с антигеном, вариабельной области легкой цепи, способной связываться с антигеном, Fab, F(ab)2′ и любой их комбинации.
5. Выделенное полиспецифическое антитело для применения по любому из пп. 1-4, где указанное фиброзное заболевание выбрано из группы, состоящей из склеродермии, идиопатического легочного фиброза (IPF), неалкогольного стеатогепатита (NASH), гломерулосклероза, цирроза и метаболических синдромов.
6. Выделенное полиспецифическое антитело для применения по любому из пп. 1-5, где указанное аутоиммунное воспалительное расстройство выбрано из группы, состоящей из системной красной волчанки (SLE), ревматоидного артрита, псориаза, колита, увеита, рассеянного склероза и сахарного диабета I типа.
7. Выделенное полиспецифическое антитело для применения по любому из пп. 1-4, где указанное расстройство, связанное с моноцитами, представляет собой атеросклероз.
8. Выделенное полиспецифическое антитело для применения по любому из пп. 1-4, где указанное аллергическое атопическое расстройство выбрано из группы, состоящей из астмы, атопического дерматита, крапивницы и реакций гиперчувствительности.
9. Выделенное полиспецифическое антитело для применения по любому из пп. 1-8, где указанные по меньшей мере два связывающие CCR3 хемокина выбраны из группы, состоящей из эотаксина 1, эотаксина 2, Rantes и MCP-3.
10. Выделенное полиспецифическое антитело для применения по п. 9, где указанное антитело связывается с эотаксином 1, эотаксином 2, Rantes и MCP-3.
11. Выделенное полиспецифическое антитело для применения по любому из пп. 1-10, где указанное антитело ослабляет мигрирующие свойства клеток, экспрессирующих CCR3, CCR1, CCR2 и CCR5.
12. Выделенное полиспецифическое антитело для применения по п. 1, где указанное антитело представляет собой полностью гуманизированное антитело, содержащее вариабельную область тяжелой цепи, обозначенную как SEQ ID NO: 3, или ее вариант и вариабельную область легкой цепи, обозначенную как SEQ ID NO: 4, или ее вариант.
13. Выделенное полиспецифическое антитело или любой его антигенсвязывающий фрагмент, которые специфически связываются с по меньшей мере двумя связывающими CCR3 хемокинами, где указанное антитело представляет собой полностью гуманизированное антитело и содержит вариабельную область тяжелой цепи, включающую:
а) область, определяющую комплементарность, VH CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 5;
б) область, определяющую комплементарность, VH CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 6, и
в) область, определяющую комплементарность, VH CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 7, и
вариабельную область легкой цепи, включающую:
г) область, определяющую комплементарность, VK CDR1, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 8;
д) область, определяющую комплементарность, VK CDR2, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 9, и
е) область, определяющую комплементарность, VK CDR3, содержащую аминокислотную последовательность, обозначенную как SEQ ID NO: 10.
14. Молекула нуклеиновой кислоты, кодирующая антитело по любому из пп. 1-13.
15. Молекула нуклеиновой кислоты, кодирующая гуманизированное антитело, которое связывается с по меньшей мере двумя связывающими CCR3 хемокинами, где указанная молекула нуклеиновой кислоты содержит последовательность, обозначенную как SEQ ID NO: 1 и SEQ ID NO: 2.
16. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по любому из пп. 14 или 15.
17. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты по любому из пп. 14 или 15, для продуцирования антитела, способного специфически связываться с по меньшей мере двумя связывающими CCR3 хемокинами.
18. Фармацевтическая композиция для использования в лечении заболеваний, ассоциированных с хроническим воспалением и характеризующихся миграцией и инфильтрацией иммунных клеток, содержащая антитело по любому из пп. 1-13 и фармацевтически приемлемый носитель.
19. Фармацевтическая композиция для использования по п. 18, где указанные заболевания выбраны из группы, состоящей из фиброзных заболеваний, аутоиммунных воспалительных расстройств, расстройств, связанных с моноцитами, или аллергических атопических расстройств.
| WO2011025962 A1, 03.03.2011 | |||
| WO2010086854 A1, 05.08.2010 | |||
| WO00/27880 A2, 18.05.2000 | |||
| RU 2009101297 А, 27.08.2010 | |||
| RU 2013140619 А, 20.04.2015. |
Авторы
Даты
2019-11-06—Публикация
2015-03-04—Подача