ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композиции пролекарства арипипразола и способам его применения. В частности, указанные композиции и способы включают пролекарство арипипразола, имеющее размер частиц менее примерно 1000 нм, и содержат стабилизатор поверхности частиц, где соотношение стабилизатора поверхности к пролекарству составляет от примерно 0,1:1 до примерно 40:1, наиболее предпочтительно приблизительно 17:1. Такое соотношение стабилизатора поверхности и пролекарства обеспечивает оптимальное количество свободного стабилизатора поверхности для получения состава предназначенного для начального этапа введения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Суспензия для инъекций ABILIFY MAINTENA® (арипипразол) с продолжительным высвобождением для внутримышечного применения не позволяет добиться устойчивых концентраций в плазме людей непосредственно после введения. На начальном этапе лечения с первой дозой Abilify Maintena® для достижения терапевтических концентраций требуется совместное введение в течение 14 дней подряд пероральной формы арипипразола (10 мг-20 мг) (Otsuka America Pharmaceutical, Inc., ʺAbilify Maintena Product Insert, 2013ʺ). Проблемой, на решение которой направлено настоящее изобретение, является соблюдение пациентом режима лечения во время этого 14-дневного начального периода.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к стабилизированным композициям пролекарства арипипразола, которым можно придать такие свойства, чтобы они имели желаемый начальный профиль высвобождения in vivo. В частности, настоящее изобретение относится к композициям и способам, которые уменьшают число «начальных» дней перорального введения арипипразола, которые необходимы для достижения равновесных концентраций в плазме.
Более конкретно, настоящее изобретение относится к композиции, содержащей: (a) совокупность частиц пролекарства арипипразола, имеющих объемный размер (Dv50) менее 1000 нм по данным методики, основанной на рассеянии света, (b) по меньшей мере один стабилизатор поверхности частиц, включающий адсорбированный компонент (т.е. определенное количество стабилизатора поверхности), который адсорбирован на поверхности частиц пролекарства арипипразола, и свободный компонент (т.е. вторую часть стабилизатора поверхности), который способен осуществлять солюбилизацию пролекарства арипипразола (т.е. свободный компонент стабилизатора не адсорбирован на поверхности пролекарства арипипразола). Отношение пролекарства арипипразола к стабилизатору поверхности составляет от примерно 0,1:1 до примерно 40:1. Пролекарство арипипразола имеет следующую формулу:
Формула 1
где n означает ноль или целое число, меньшее 20. В предпочтительном варианте осуществления, пролекарство арипипразола имеет указанную выше формулу, где n=4 (пролекарство арипипразола кавоксил) или n=10 (пролекарство арипипразола лауроксил). В описанной выше композиции значение Dv90 композиции может составлять менее примерно 1800 нм, предпочтительно, менее примерно 1500 нм, и значение Dv10 может быть менее примерно 600 нм. Другие типовые размеры частиц описаны в настоящей заявке. Предпочтительно, чтобы композиция характеризовалась стабильностью размеров частиц.
Упомянутый по меньшей мере один стабилизатор поверхности частиц можно выбрать из группы, состоящей из сложного эфира полиоксиэтиленсорбитана и жирной кислоты (например, полисорбата 80, полисорбата 40, полисорбата 20), повидонов низкой молекулярной массы, лецитина, d-альфа токоферил полиэтиленгликоль 1000 сукцината, диоктилсульфосукцината натрия (или докузата натрия), метил- и пропилпарабенов, монолаурата сорбитана, карбоксиметилцеллюлозы, гидроксипропилцеллюлозы, дезоксихолата натрия, алкилсахаридов, дифункциональных блок-сополимеров, d-альфа токоферил полиэтиленгликоль 1000 сукцината, желатина, альбумина, лизоцима, циклодекстринов, примером которых мог бы служить бетагидроксициклодекстрин, и гель-образующих полимеров. Перечисленные выше стабилизаторы считаются предпочтительными с точки зрения безопасности. Предпочтительно, по меньшей мере один стабилизатор поверхности выбран из группы, состоящей из карбоксиметилцеллюлозы и эфиров полиоксиэтиленсорбитана и жирных кислот. Было показано, что упомянутые стабилизаторы поверхности являются особенно эффективными для получения стабильных композиций по настоящему изобретению, поскольку было обнаружено, что степень прироста размера частиц в композиции, включающей упомянутые стабилизаторы поверхности, является особенно низкой. Более предпочтительно, стабилизатор поверхности является сложным эфиром полиоксиэтиленсорбитана и жирной кислоты, например, полисорбатом 20, поскольку это вещество одобрено FDA для применения в составах для инъекции и, как было обнаружено, является особенно эффективным для получения стабильных композиций.
Композиция по настоящему изобретению может включать только один стабилизатор поверхности, или один основной стабилизатор поверхности и по меньшей мере один дополнительный стабилизатор поверхности. Применение одного или нескольких дополнительных стабилизаторов поверхности может увеличить стабильность полученной композиции и/или изменить высвобождение in vivo пролекарства арипипразола, описанного в настоящей заявке.
Композиция, содержащая более одного стабилизатора поверхности, может, например, содержать основной стабилизатор поверхности, который представляет собой полисорбат 20, и дополнительный стабилизатор поверхности, который представляет собой плуроник F108 и/или его компоненты (индивидуальными компонентами являются полиоксиэтилен и полиоксипропиленгликоль). В такой композиции в формуле пролекарства арипипразола n равно 4 (т.е. арипипразола кавоксил), и объемное распределение размеров частиц (Dv50) арипипразола находится в пределах от 200 до 600 нм, предпочтительно от 500 нм до 600 нм. В такой композиции общее содержание свободного компонента (состоящего из основного и дополнительного стабилизаторов поверхности) составляет от 0,5% до 10%, предпочтительно от 0,5% до 3% (масса/масса) от массы композиции.
Количество стабилизатора поверхности, которое следует добавлять в композицию, можно выразить в виде отношения к количеству пролекарства арипипразола в композиции, путем вычисления процентного содержания (масса/масса) (от общей массы композиции, включающей любые эксципиенты) пролекарства арипипразола и суммарного процентного содержания (масса/масса) (от общей массы композиции, включающей любые эксципиенты) стабилизатора поверхности. Если в композиции присутствуют несколько стабилизаторов поверхности, указанное выше отношение учитывает все стабилизаторы поверхности, присутствующие в композиции. Отношение количества пролекарства арипипразола к количеству стабилизатора поверхности находится в пределах от примерно 0,1:1 до примерно 40:1. Отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, более конкретно, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1. В предпочтительном варианте осуществления, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, более конкретно находиться в диапазоне от примерно 15:1 до примерно 20:1. Было обнаружено, что этот диапазон обеспечивает оптимальное количество адсорбированного и свободного компонентов стабилизатора поверхности для цели получения состава для начального этапа введения. Еще более предпочтительно, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, составляет приблизительно 17:1.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 900 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 800 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) от примерно 50 до примерно 700 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 700 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 600 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 500 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 400 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) от примерно 175 до примерно 350 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 300 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) менее, чем примерно 200 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 100 нм, отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, может находиться в пределах от примерно 0,5:1 до примерно 38:1, от примерно 1:1 до примерно 36:1, от примерно 2:1 до примерно 34:1, от примерно 2:1 до примерно 25:1, от примерно 2:1 до примерно 20:1, от примерно 4:1 до примерно 32:1, от примерно 6:1 до примерно 30:1, от примерно 8:1 до примерно 28:1, от примерно 10:1 до примерно 26:1, от примерно 10:1 до примерно 25:1, от примерно 10:1 до примерно 20:1, от примерно 12:1 до примерно 24:1, от примерно 13:1 до примерно 23:1, от примерно 14:1 до примерно 22:1, от примерно 15:1 до примерно 21:1, от примерно 16:1 до примерно 20:1, или от примерно 17:1 до примерно 19:1.
Приведенное выше отношение действующего ингредиента к стабилизатору поверхности выбирают таким образом, чтобы обеспечить подходящий уровень свободного стабилизатора поверхности. Имеющийся уровень свободного стабилизатора поверхности должен быть достаточно высоким, чтобы достичь желаемого модулирования фармакокинетических свойств, в частности, времени до начала действия. Однако общее содержание стабилизатора поверхности в композиции предпочтительно является достаточно низким, чтобы избежать проблем с токсичностью или реакций в месте инъекции у пациентов. Предпочтительно, чтобы свободный компонент указанного по меньшей мере одного стабилизатора поверхности составлял более 0% (масс./масс.) и не более примерно 3% (масс./масс.) от массы композиции (т.е. от суммарной массы композиции, включающей действующее вещество, стабилизатор поверхности и любые другие эксципиенты, включенные в композицию), поскольку содержание свободного стабилизатора поверхности в указанном диапазоне обеспечивает оптимальное уменьшение времени до начала действия, и при этом остается на уровне, который является предпочтительным с точки зрения потенциальной токсичности. Содержание свободного стабилизатора поверхности может, например, находиться в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, от примерно 0,1 до примерно 0,4%. Более предпочтительно, количество свободного стабилизатора поверхности находится в диапазоне от примерно 0,1% до примерно 1,6%, поскольку было обнаружено что именно этот конкретный диапазон обеспечивает значительное сокращение времени до начала действия препарата и в то же время гарантирует, что содержание стабилизатора поверхности находится на заведомо переносимых уровнях.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 900 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 800 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) от 50 до 700 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 700 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 600 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 500 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 400 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) от примерно 175 до примерно 350 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 300 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 200 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
В композиции, имеющей объемный размер частиц (Dv50) менее чем примерно 100 нм, содержание свободного стабилизатора поверхности может находиться, например, в диапазоне от примерно 0,1 до примерно 2,9%, от примерно 0,1 до примерно 2,7%, от примерно 0,1 до примерно 2,6%, от примерно 0,1 до примерно 2,4%, от примерно 0,1 до примерно 2,2%, от примерно 0,1 до примерно 2%, от примерно 0,1 до примерно 1,8%, от примерно 0,1 до примерно 1,4%, от примерно 0,1 до примерно 1,2%, от примерно 0,1 до примерно 1%, от примерно 0,1 до примерно 0,8%, от примерно 0,1 до примерно 0,6%, и от примерно 0,1 до примерно 0,4% (масс./масс.) от массы композиции.
Объемный размер частиц (Dv50) может составлять менее чем примерно 1000 нм, менее чем примерно 950 нм, менее чем примерно 900 нм, менее чем примерно 850 нм, менее чем примерно 800 нм, менее чем примерно 750 нм, менее чем примерно 700 нм, менее, чем примерно 650 нм, менее чем примерно 600 нм, менее чем примерно 550 нм, менее чем примерно 500 нм, менее чем примерно 450 нм, менее чем примерно 400 нм, менее чем примерно 350 нм, менее чем примерно 300 нм, менее чем примерно 250 нм, менее чем примерно 200 нм, менее чем примерно 150 нм, менее чем примерно 100 нм или менее чем примерно 50 нм. В предпочтительном варианте осуществления объемный размер частиц (Dv50) пролекарства арипипразола находится в диапазоне примерно от 50 до 700 нм, более предпочтительно от примерно 175 до примерно 350 нм.
В любой из композиций, описанных в настоящем изобретении, если значение Dv50 составляет менее примерно 900 нм, значение Dv90 может составлять менее чем примерно 1700 нм, менее чем примерно 1600 нм, менее чем примерно 1500 нм, менее чем примерно 1400 нм, менее чем примерно 1300 нм, менее чем примерно 1200 нм, менее чем примерно 1100 нм и менее чем примерно 1000 нм. Значение Dv10 может быть менее чем примерно 850 нм, менее чем примерно 800 нм, менее чем примерно 700 нм, менее чем примерно 600 нм, менее чем примерно 500 нм, менее чем примерно 400 нм, менее чем примерно 300 нм, менее чем примерно 200 нм и менее чем примерно 100 нм.
Если значение Dv50 составляет менее примерно 800 нм, значение Dv90 может составлять менее чем примерно 1600 нм, менее, чем примерно 1500 нм, менее чем примерно 1400 нм, менее чем примерно 1300 нм, менее чем примерно 1200 нм, менее чем примерно 1100 нм, менее чем примерно 1000 нм и менее чем примерно 900 нм. Значение Dv10 может быть менее чем примерно 750 нм, менее чем примерно 700 нм, менее чем примерно 600 нм, менее чем примерно 500 нм, менее чем примерно 400 нм, менее чем примерно 300 нм, менее чем примерно 200 нм и менее чем примерно 100 нм.
Если значение Dv50 составляет менее примерно 700 нм, значение Dv90 может составлять менее чем примерно 1500 нм, менее чем примерно 1400 нм, менее чем примерно 1300 нм, менее чем примерно 1200 нм, менее чем примерно 1100 нм, менее чем примерно 1000 нм, менее чем примерно 900 нм и менее чем примерно 800 нм. Значение Dv10 может быть менее чем примерно 650 нм, менее чем примерно 600 нм, менее чем примерно 500 нм, менее чем примерно 400 нм, менее чем примерно 300 нм, менее чем примерно 200 нм и менее чем примерно 100 нм.
Если значение Dv50 составляет менее примерно 600 нм, значение Dv90 может составлять менее чем примерно 1500 нм, менее чем примерно 1400 нм, менее чем примерно 1300 нм, менее чем примерно 1200 нм, менее чем примерно 1100 нм, менее чем примерно 1000 нм, менее чем примерно 900 нм, менее чем примерно 800 нм и менее чем примерно 700 нм. Значение Dv10 может быть менее чем примерно 550 нм, менее чем примерно 500 нм, менее чем примерно 400 нм, менее чем примерно 300 нм, менее, чем примерно 200 нм и менее чем примерно 100 нм.
Если значение Dv50 составляет менее примерно 500 нм, значение Dv90 может составлять менее чем примерно 1500 нм, менее чем примерно 1400 нм, менее чем примерно 1300 нм, менее чем примерно 1200 нм, менее чем примерно 1100 нм, менее чем примерно 1000 нм, менее чем примерно 900 нм, менее чем примерно 800 нм, менее чем примерно 700 нм и менее чем примерно 600 нм. Значение Dv10 может быть менее чем примерно 450 нм, менее чем примерно 400 нм, менее чем примерно 300 нм, менее чем примерно 200 нм и менее чем примерно 100 нм.
Если значение Dv50 составляет менее примерно 400 нм, значение Dv90 может составлять менее чем примерно 1500 нм, менее чем примерно 1400 нм, мене, чем примерно 1300 нм, менее чем примерно 1200 нм, менее чем примерно 1100 нм, менее чем примерно 1000 нм, менее чем примерно 900 нм, менее чем примерно 800 нм, менее чем примерно 700 нм, менее чем примерно 600 нм и менее чем примерно 500 нм. Значение Dv10 может быть менее чем примерно 350 нм, менее чем примерно 300 нм, менее чем примерно 200 нм и менее чем примерно 100 нм.
Если значение Dv50 составляет менее примерно 300 нм, значение Dv90 может составлять менее чем примерно 1500 нм, менее чем примерно 1400 нм, менее чем примерно 1300 нм, менее чем примерно 1200 нм, менее чем примерно 1100 нм, менее чем примерно 1000 нм, менее чем примерно 900 нм, менее чем примерно 800 нм, менее чем примерно 700 нм, менее чем примерно 600 нм, менее чем примерно 500 нм и менее чем примерно 400 нм. Значение Dv10 может быть менее чем примерно 250 нм, менее чем примерно 200 нм и менее чем примерно 100 нм.
Если значение Dv50 составляет менее примерно 200 нм, значение Dv90 может составлять менее чем примерно 1500 нм, менее чем примерно 1400 нм, менее чем примерно 1300 нм, менее чем примерно 1200 нм, менее чем примерно 1100 нм, менее чем примерно 1000 нм, менее чем примерно 900 нм, менее чем примерно 800 нм, менее чем примерно 700 нм, менее чем примерно 600 нм, менее чем примерно 500 нм, менее чем примерно 400 нм и менее чем примерно 300 нм. Значение Dv10 может быть менее чем примерно 150 нм, менее чем примерно 100 нм и менее чем примерно 50 нм.
Если значение Dv50 составляет менее примерно 100 нм, значение Dv90 может составлять менее чем примерно 1000 нм, менее чем примерно 900 нм, менее чем примерно 800 нм, менее чем примерно 700 нм, менее чем примерно 600 нм, менее чем примерно 500 нм, менее чем примерно 400 нм, менее чем примерно 300 нм и менее чем примерно 200 нм. Значение Dv10 может быть менее чем примерно 50 нм.
Композицию по настоящему изобретению можно получать в форме состава-депо (состава с пролонгированным высвобождением) для инъекций. Это является предпочтительным путем введения для обеспечения долговременного высвобождения арипипразола. Некоторые композиции составов-депо предназначены для доставки лекарственного средства в течение нескольких недель или месяцев. Таким путем лекарственное средство можно доставлять в регулируемом режиме в течение продолжительного периода времени. Если композицию предполагается применять в качестве композиции, вводимой на начальном этапе лечения (в комбинации с отдельным препаратом продолжительного действия для инъекции), получение композиции в форме состава-депо для инъекции дает потенциальное преимущество над другими путями введения (например, пероральным путем на начальном этапе) из-за потенциального упрощения режима введения за счет уменьшения частоты введения доз. В одном из вариантов осуществления, композицию-депо по настоящему изобретению можно вводить один раз, что даст возможность охватить весь начальный период и будет способствовать приверженности пациента лечению, что является особенно полезным в контексте популяции пациентов, для которых предназначен арипипразол. Конкретно, арипипразол является атипичным антипсихотическим средством, предназначенным для лечения, например, субъектов с депрессией, шизофренией и биполярным расстройством. Такие субъекты с трудом соглашаются на многостадийные схемы введения препаратов; простейшая схема введения, вероятнее всего, получит приверженность наиболее высокой процентной доли пациентов.
Предпочтительно, состав-депо для инъекций поставляют в устройстве для инъекций, например, предварительно заполненном шприце или двухкамерном шприце. Это обеспечивает наиболее простое и быстрое средство введения композиции без необходимости дополнительных стадий, таких, как восстановление порошка в дисперсию и т.д.
Композицию по настоящему изобретению можно получать в форме порошка для восстановления в жидкой среде, где совокупность частиц пролекарства арипипразола повторно диспергируют в жидкой среде, так, чтобы диспергированные частицы пролекарства арипипразола имели объемный размер (Dv50) менее примерно 1000 нм.
Композиция по настоящему изобретению может включать вторую совокупность частиц пролекарства арипипразола, где эта вторая совокупность имеет объемный размер частиц (Dv50) примерно 5000 нм или более. Комбинация композиции по настоящему изобретению с композицией частиц более крупного размера, приводит к получению бимодальной или мультимодальной композиции, в которой могут сочетаться преимущества быстрого начала действия и долговременного терапевтического эффекта. Неожиданно было обнаружено, что бимодальная или мультимодальная композиция пролекарства арипипразола не вызывает проблемы нестабильности размера частиц, которая обычно возникает в мультимодальных композиций других действующих ингредиентов. Вторая совокупность частиц может иметь объемный размер частиц (Dv50) в диапазоне от примерно 15 мкм до примерно 25 мкм.
Композиция по настоящему изобретению может включать дополнительное атипичное антипсихотическое средство помимо пролекарства арипипразола, применяемого в настоящем изобретении.
Настоящая заявка относится также к способу лечения состояния у млекопитающего, выбранного из шизофрении, биполярного расстройства I типа, большого депрессивного расстройства (MDD), аутического расстройства (аутизма), возбуждения, связанного с шизофренией или биполярным расстройством I типа. Указанный способ включает введение млекопитающему, которому это необходимо, терапевтически эффективного количества композиции по настоящему изобретению. Указанный способ может включать введение композиции, которая способна обеспечивать терапевтические уровни арипипразола в течение по меньшей мере 30 дней (начальный этап введения препарата). В качестве альтернативы, начальный период может составлять не менее примерно 15 дней, не менее примерно 25 дней, не менее примерно 30 дней или любое количество времени между указанными значениями. Способ по настоящему изобретению упрощает схему введения композиции пациенту на начальном этапе и устраняет необходимость ежедневного перорального приема определенной дозы препарата. Способ может дополнительно включать введение композиции пролекарства арипипразола, имеющей объемный размер частиц (Dv50) более примерно 5000 нм, которое можно осуществить путем совместного введения композиций (соответствующие композиции вводят примерно в одно и то же время; в виде отдельных композиций) или путем введения соответствующих композиций совместно в форме единой композиции. В качестве альтернативы, способ по настоящему изобретению может включать введение композиции, которая способна поддерживать терапевтический уровень арипипразола в крови в течение не более примерно 13 дней, и затем повторное введение композиции в соответствующий момент времени.
Настоящее изобретение относится также к способам улучшения исходных профилей фармакокинетического высвобождения in vivo путем применения совокупности частиц пролекарства арипипразола, имеющих объемное распределение размера (Dv50) от примерно 350 до примерно 175 нм по данным методик, основанных на рассеянии света, где при соотношении указанных частиц к полисорбату (наиболее предпочтительно, полисорбату 20) 17:1, терапевтическая концентрация арипипразола достигается в течение менее чем семи дней. В предпочтительном варианте осуществления, совокупность частиц пролекарства арипипразола имеет объемное распределение размера (Dv50) менее чем примерно 400 нм, менее чем примерно 300 нм, менее чем примерно 200 нм и/или менее чем примерно 100 нм. В еще более предпочтительном варианте осуществления, отношение количества указанных частиц к количеству полисорбата 20 позволяет добиться терапевтических концентраций арипипразола в течение менее, чем примерно 72 часов, примерно 48 часов и/или примерно 24 часов.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
Фиг.1: представляет собой графическое отображение индукционного периода состава известного уровня техники, включающего 20 мкм частицы арипипразола лауроксила.
Фиг.2: представляет собой график средних концентраций в плазме и крови для составов 1, 2 (препарат сравнения), 3 (препарат сравнения) и 4, измеренных in vivo у грызунов через различные периоды времени, как обсуждается в примерах 1 и 2.
Фиг.3: представляет собой график средних концентраций в крови, измеренных in vivo у грызунов для составов 5 и 6, как обсуждается в примере 3.
Фиг.4: представляет собой график средних концентраций арипипразола, измеренных in vivo у грызунов, для составов 7, 8, 9 и 10 (препарат сравнения), как обсуждается в примере 4.
Фиг.5: представляет собой график средних концентраций арипипразола, измеренных in vivo у собак для составов 11, 12 и 13, в сравнении с составами, включающими частицы 20 000 нм, которые обсуждаются в примере 5.
Фиг.6: представляет собой график средних концентраций арипипразола, измеренных in vivo у собак для составов 14-17 примера 6.
Фиг.7: представляет собой график средних концентраций арипипразола, измеренных in vivo у собак для составов 18, 20 и 23 примера 7.
Фиг.8: представляет собой график средних концентраций арипипразола, измеренных in vivo у собак для составов 19, 20 и 21 примера 7.
Фиг.9: представляет собой график средних концентраций арипипразола, измеренных in vivo у собак для составов 25, 26 и 27 примера 8.
Фиг.10: представляет собой график средних концентраций арипипразола, измеренных in vivo у собак для составов 25-27 примера 8.
Фиг.11: представляет собой график средних концентраций арипипразола лауроксила, измеренных in vivo у собак для составов 25, 28 и 29, как обсуждается в примере 8.
Фиг.12: представляет собой график средних концентраций арипипразола, измеренных in vivo у собак для составов 25, 28 и 29 (иллюстрирующий влияние отношения действующего вещества к стабилизатору поверхности на измеренные уровни арипипразола), как обсуждается в примере 8.
Фиг.13: представляет собой график средних концентраций арипипразола, измеренных in vivo у собак для составов 27 и 30 (иллюстрирующий влияние отношения действующего вещества к стабилизатору поверхности на уровни арипипразола), как обсуждается в примере 8.
Фиг.14: представляет собой график средних концентраций арипипразола лауроксила, измеренных in vivo у собак для составов 25 и 30 (иллюстрирующий влияние отношения действующего вещества к стабилизатору поверхности на уровни арипипразола), как обсуждается в примере 8.
Фиг.15: представляет собой график средних концентраций арипипразола, измеренных in vivo у собачьих моделей для составов 25 и 30 примера 8 (иллюстрирующий влияние отношения действующего вещества к стабилизатору поверхности на уровни арипипразола).
Фиг.16: отображает AUC арипипразола лауроксила для составов 25, 28 и 29 (составы с фиксированной площадью поверхности и повышающейся концентрацией полисорбата 20) по данным исследований на собаках.
Фиг.17: отображает AUC арипипразола для составов 25, 28 и 29 (составы с фиксированной площадью поверхности и повышающейся концентрацией полисорбата 20) по данным исследований на собаках.
Фиг.18 (A и B): отображает количество свободного полисорбата 20 и растворенного арипипразола лауроксила для составов 25, 28 и 29 (составы с фиксированной площадью поверхности и повышающейся концентрацией полисорбата 20) по данным ВЭЖХ.
Фиг.19 (A и B): отображает AUC арипипразола лауроксила и арипипразола для составов 27 и 30 (составы с фиксированной площадью поверхности и повышающейся концентрацией полисорбата 20) по данным исследований на собаках.
Фиг.20 (A и B): отображает количество свободного полисорбата 20 и растворенного арипипразола лауроксила для составов 27 и 30 (составы с фиксированной площадью поверхности и повышающейся концентрацией полисорбата 20) по данным ВЭЖХ.
Фиг.21 (A и B): отображает количество свободного полисорбата 20 и растворенного арипипразола лауроксила для составов 25, 26 и 30 (составы с фиксированной площадью поверхности и повышающейся концентрацией полисорбата 20) по данным ВЭЖХ.
Фиг.22 (A и B): отображает AUC арипипразола лауроксила и арипипразола для составов 25, 26 и 30 (составы с фиксированной площадью поверхности и повышающейся концентрацией полисорбата 20) по данным исследований на собаках.
Фиг.23: представляет собой график зависимости вязкости от скорости сдвига для состава 31 примера 9.
Фиг.24: представляет собой график зависимости размера частиц от времени для состава 31 примера 9.
Фиг.25: отображает средние концентрации арипипразола, измеренные in vivo у грызунов для составов X и Y примера 12.
Фиг.26: отображает микроскопические изображения составов X и Y, разбавленных фосфатным солевым буфером, примера 12.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение описано в тексте заявки с использованием ряда терминов, определения которых приведены ниже и используются во всем тексте заявки.
В настоящей заявке термин «примерно» должен быть понятен рядовым специалистам в данной области техники и он будет в определенной степени меняться в зависимости от контекста, в котором он используется. Если имеются случаи использования этого термина, которые неясны рядовому специалисту, в том контексте, в котором они использованы, термин «примерно» будет означать вплоть до плюс или минус 10% от указанной величины.
Термины «состав для инъекции длительного действия» или «состав-депо» для инъекции относятся к композиции, подходящей для введения инъекцией (как правило подкожной или внутримышечной), которая после введения образует хранилище лекарственного вещества в организме субъекта, из которого это лекарственное вещество медленно поступает в системную циркуляцию. Таким путем лекарственное вещество может доставляться контролируемым образом в течение продолжительного периода времени. Как указано в тексте заявки, состав-депо для инъекции высвобождает пролекарство арипипразола в течение продолжительного периода времени, по меньшей мере примерно 24 часов и предпочтительно примерно 1 недели или более.
Термин «реакция в месте инъекции» в настоящей заявке относится к любой нежелательной физиологической реакции после инъекции вокруг места вхождения иглы в организм.
Термин «композиция начального этапа введения» в настоящем описании относится к составу действующего агента, который ослабляет или устраняет эффект «начального» периода введения, который описан ниже. Другими словами, действие композиции начального этапа введения направлено на повышение уровней действующего агента в начальном периоде, до значений, которые могли бы наблюдаться в отсутствии такой композиции. Эта композиция может именоваться также насыщающей дозой.
Термины «начальный период» или «начальный этап» в настоящем описании относятся к периоду времени после введения субъекту действующего агента и до того, как уровни действующего агента в системной циркуляции достигнут терапевтически эффективных значений для субъектов из числа млекопитающих, которым осуществляется введение.
Термины «размер частиц», «объемный размер частиц» или «распределение объемного размера частиц» в настоящем описании являются эквивалентными, могут также обозначаться Dv50 или D50, и означают, что по меньшей мере примерно 50% частиц пролекарства арипипразола имеют диаметр менее приведенного размера. Указанные выше термины в тексте настоящей заявки являются взаимозаменяемыми. Например, фраза «объемный размер частиц (Dv50) менее 1000 нм» означает, что 50% совокупности частиц имеет диаметр менее 1000 нм, при измерении по методике статического или динамического рассеяния света, известной специалисту в данной области техники. Поскольку частицы по настоящему изобретению обычно имеют неправильную форму, осуществляется аппроксимация размеров частиц на основе объемного размера частиц, который указывает на диаметр сферы, которая имеет такой же объем, как и у данной частицы. Если не указано иное, все размеры частиц указаны в терминах объемных размеров и эти размеры определены с помощью рассеяния/дифракции лазерного излучения. Затем определяют размеры частиц, исходя из теории рассеяния Ми. Более конкретно, если не указано иное, объемный размер частиц (Dv50) определяют с использованием стандартной модели лазерного анализатора размеров частиц Horiba LA-950. Если не указано иное, в качестве среды для определения размера частиц используют деионизированную воду или воду с небольшим содержанием (например, 0,1% масс./масс.) стабилизатора поверхности (например, полисорбата 20). Термины «D90» и «D10» означают, что, соответственно, 90% и 10% частиц пролекарства арипипразола имеют диаметр менее указанной величины. Указанные величины могут также обозначаться как «Dv90» и «Dv10», соответственно, и эти термины в тексте данной заявки являются взаимозаменяемыми.
Термин «средний размер частиц» в основном соответствует значению термина «средний объемный диаметр» и в настоящей заявке определяется аналогично определению, приведенному в брошюре Horiba Scientific ʺA guidebook to particle size analysisʺ (2012), которая доступна на вебсайте Horiba www.horiba.com. Вычисления осуществляются на основе таблицы, в которой отображаются верхние и нижние границы n размерных диапазонов, а также процентные доли частиц, попадающих в каждый из диапазонов. Значение Di для каждого диапазона представляет собой геометрическое среднее, т.е. квадратный корень из произведения верхняя граница диаметра × нижняя граница диаметра. В числителе находится сумма произведений геометрическая Di в четвертой степени × процентная доля частиц в данном диапазоне, для всех диапазонов. В знаменателе находится сумма произведений геометрическая Di в третьей степени × процентная доля частиц в данном диапазоне, для всех диапазонов. Средний объемный диаметр обозначается несколькими символами, в т.ч. D[4,3].

Специалист поймет, что размер частиц можно также определять любыми подходящими способами измерения, например, на основе объема, числа частиц и т.д. и можно измерять, например, с помощью осаждения, фракционирования в потоке, динамического рассеяния света, с использованием дисковой центрифуги и других методик, известных в технике. Полное описание методик динамического и статического рассеяния света приведено на стр.121-131 книги ʺNanoparticle technology for drug deliveryʺ авторы Ram B.Gupta и Uday B.Kompella, изданной Taylor & Franceis Group (ISBN 1-57444-857-9) и на стр.569-580 книги ʺPharmaceutical, the science of dosage form designʺ под.ред. Michael E. Aulton, изданной Churchill Livingstone (ISBN: 0-443-03643-8). Подразумевается, что определение размеров частиц, указанных в формуле изобретения, должно охватывать измерения, произведенные с использованием любых методик, применяемых в технике для определения размеров частиц.
Термин «пролекарство» относится к терапевтически неактивной молекуле, которая в результате биологического метаболизма превращается в активный фармацевтический ингредиент. Термины «лекарственное средство» или «действующий агент» при использовании в настоящей заявке, как правило, относятся к арипипразолу (метаболиту), но могут, если на это явно указывает контекст, относиться к другому лекарственному средству.
Композиция со «стабильным размером частиц» представляет собой композицию, в которой не наблюдается флоккуляции или агломерации частиц, видимой невооруженным глазом в течение по меньшей мере 15 минут и предпочтительно в течение примерно двух дней или более после ее получения. Предпочтительно, композиция со «стабильным размером частиц» представляет собой композицию, в которой объемный размер частиц (Dv50) и/или средний размер частиц не повышается на величину, превышающую примерно 400 нм, если композиция хранится при температуре примерно 20°C в течение примерно 24 часов. Более предпочтительно, композиция со «стабильным размером частиц» представляет собой композицию в которой объемный размер частиц (Dv50) и/или средний размер частиц не повышается на величину, превышающую примерно 400 нм, если композиция хранится при температуре примерно 40°C в течение примерно 6 месяцев. Наиболее предпочтительно, композиция со «стабильным размером частиц» представляет собой композицию в которой объемный размер частиц (Dv50) и/или средний размер частиц не повышается на величину, превышающую примерно 100 нм, если композиция хранится при температуре примерно 40°C в течение примерно 6 месяцев.
В настоящей заявке термин «субъект» предназначен для обозначения животного, предпочтительно, млекопитающего, в т.ч. человека или не человека. Термины «пациент» и «субъект» могут являться взаимозаменяемыми.
Термин «терапевтически эффективное количество» относится к минимальной концентрации арипипразола в крови, которая оказывает терапевтическое действие. Эта величина может меняться в зависимости от типа субъекта. В случае людей, в кратком обосновании решения о регистрации Управления по контролю за пищевыми продуктами и лекарственными средствами США (FDA) эта величина для Abilify Maintena определяется как 94 нг/мл. Если не указано иное, эта величина применительно к людям определяется в настоящей заявке на уровне, по меньшей мере, примерно 34 - примерно 50 нг/мл и предпочтительно 94 нг/мл.
Термины «лечение», «терапия», «терапевтический» и т.п. в настоящей заявке охватывают любой курс терапевтического вмешательства, направленный на патологическое состояние, и включает не только стойкое излечение заболевания, но и предотвращение заболевания, борьбу с заболеванием или даже шаги, предпринятые для ослабления заболевания или его симптомов.
Взаимосвязь между содержанием свободного стабилизатора поверхности и высвобождения in vivo на начальном этапе
Композиция по настоящему изобретению включает стабилизированные частицы арипипразола (частицы, включающие стабилизатор поверхности, который адсорбирован на их поверхности и ослабляет агрегацию частиц и/или рост кристаллов лекарственного средства), имеющие объемный размер (Dv50) менее чем примерно 1000 нм, а также свободный (несвязанный) компонент стабилизатора поверхности. Неожиданно было обнаружено, что комбинация этих параметров, т.е. определенного размера стабилизированных частиц арипипразола и отношения их количества к количеству свободного стабилизатора поверхности, приводит к существенному улучшению фармакокинетического профиля по сравнению с композициями арипипразола, которые не имеют указанных характеристик.
Путем надлежащего выбора размера стабилизированных частиц арипипразола и содержания свободного стабилизатора поверхности, можно добиться, чтобы композиция по настоящему изобретению имела профиль высвобождения in vivo, соответствующий применяемой дозировке. Например, надлежащий выбор размера стабилизированных частиц арипипразола и содержания свободного стабилизатора поверхности позволяет обеспечить значительное изменение фармакокинетического профиля, за счет сокращения времени до достижения Tmax и времени до начала действия (т.е. периода времени от момента введения и до достижения терапевтической концентрации действующего вещества в крови). Чтобы гарантировать присутствие в композиции по настоящему изобретению достаточного количества свободного компонента стабилизатора поверхности, в композицию следует вводить достаточное количество стабилизатора поверхности (избыток по сравнению с тем количеством, которое требуется для стабилизации частиц). Суммарное количество введенного в композицию стабилизатора поверхности должно зависеть от размера частиц пролекарства арипипразола. Именно комбинация характеристик, т.е. размера стабилизированных частиц арипипразола при определенном отношении к количеству свободного стабилизатора, позволяет регулировать желаемую скорость высвобождения арипипразола, как показано на фиг.16-22 и в таблице 13 примера 8.
Согласно настоящей заявке, фармакокинетический профиль на начальном этапе введения можно определить как любой фармакокинетический профиль высвобождения in vivo у субъекта из числа людей или млекопитающих, в котором терапевтическая концентрация в крови достигается менее чем примерно за 1 неделю, предпочтительно, менее чем примерно за 72 часа, более предпочтительно, менее чем примерно за 48 часов, и еще более предпочтительно, менее чем примерно за 24 часа, и в котором терапевтические уровни сохраняются в течение по меньшей мере примерно 1 недели, предпочтительно, примерно 2 недель и более предпочтительно примерно 3 недель.
Не ограничиваясь конкретными объяснениями, возможный механизм, посредством которого свободный стабилизатор поверхности модифицирует фармакокинетический профиль высвобождения композиции по настоящему изобретению in vivo, заключается в содействии или увеличении растворимости пролекарства арипипразола. Один из механизмов, позволяющих добиться подобного эффекта, заключается в формировании мицелл, содержащих солюбилизированное лекарственное средство. Это обеспечивает возможность солюбилизации большей доли имеющегося пролекарства за данный период времени. Другой возможный механизм действия заключается в том, что после введения композиции пролекарства (например, внутримышечной инъекции состава-депо), частицы имеют склонность к агрегации в мышечной ткани и присутствие свободного компонента стабилизатора поверхности уменьшает, замедляет или предотвращает протекание такой агрегации, тем самым увеличивая скорость распределения и окончательной абсорбции действующего вещества.
Особенно предпочтительно, чтобы объемный размер частиц (Dv50) композиции пролекарства арипипразола по настоящему изобретению находился в диапазоне от примерно 50 до примерно 750 нм, и чтобы отношение действующего вещества к стабилизатору поверхности в композиции находилось в диапазоне от примерно 17:1 до примерно 26:1. Предпочтительно, объемный размер частиц (Dv50) композиции пролекарства арипипразола по настоящему изобретению находится в диапазоне от примерно 350 нм до примерно 175 нм. Еще более предпочтительно, количество свободного стабилизатора поверхности в композиции находится в диапазоне от примерно 1% до примерно 1,6% (масс./масс.).
Композиция по настоящему изобретению может применяться в качестве композиции для начального этапа в дополнение к традиционному антипсихотическому составу длительного действия, с целью предотвращения отсрочки начала действия, которая может иметь место при применении такого состава. Композиция по настоящему изобретению может применяться в качестве композиции начального этапа в сочетании с любым атипичным антипсихотическим средством длительного действия (например, Abilify Maintena®) для решения проблемы замедленного начала действия, которая характерна для указанных препаратов. Предпочтительное применение композиции по настоящему изобретению представляет собой применение в качестве композиции начального этапа введения для пролекарств арипипразола, как описано в настоящей заявке.
Композиции по настоящему изобретению
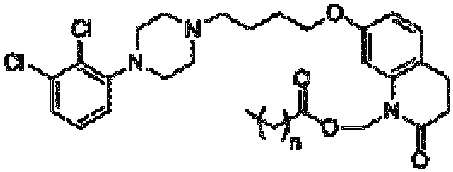
Композиция по настоящему изобретению включает определенные пролекарства арипипразола, которые описаны в патенте США 8 431 576, который конкретно включен в настоящую заявку посредством ссылки. В частности, пролекарство арипипразола согласно настоящему изобретению имеет общую формулу:

где n означает любое целое число, равное или большее 0 и меньшее 20. В предпочтительном варианте осуществления, который обсуждается ниже, n равно 4 или 10.
Одним из таких соединений является арипипразола гексаноат (в этом случае n=4), наименованием USAN для которого является арипипразола кавоксил. Арипипразола кавоксил представляет собой N-гексаноилметилзамещенное пролекарство арипипразола, которое имеет следующую структуру.
Приведенное выше соединение может быть описано химическим наименованием (7-(4-(4-(2,3-дихлорфенил)пиперазин-1-ил)бутокси)-2-оксо-3,4-дигидрохинолин-1(2H)ил)метил гексаноат и молекулярной формулой C30H39Cl2N3O4. Молекула имеет регистрационный номер CAS 1259305-26-4.
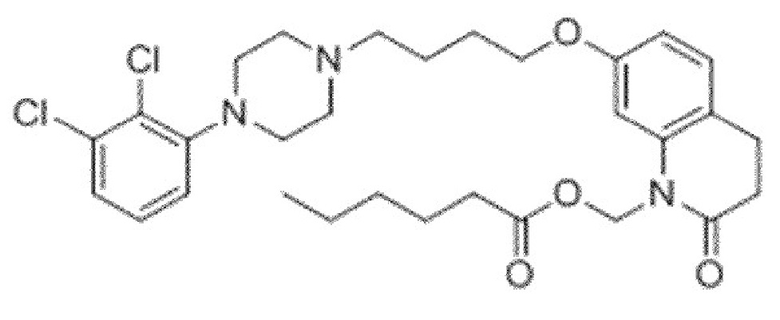
Другим подобным соединением является арипипразола лаурат (в этом случае n=10). Наименованием USAN для этого соединения является арипипразола лауроксил. Арипипразола лауроксил представляет собой N-лауроилоксиметилзамещенное пролекарство арипипразола и имеет следующую структуру:

Приведенное выше соединение может быть описано химическим наименованием [7-[4-[4-(2,3-дихлорфенил)-1-пиперазинил]бутокси]-3,4-дигидро-2-оксо-1(2H)-хинолинил]метиловый эфир додекановой кислоты и молекулярной формулой C36H51Cl2N3O4. Молекула имеет регистрационный номер CAS 1259305-29-7.
Арипипразола лауроксил представляет собой препарат для инъекций долговременного действия, показанный для лечения шизофрении и разработанный Alkermes Pharma Ireland Limited, в форме микрокристаллической суспензии, имеющей размер частиц порядка приблизительно 20 мкм.
Дозированные формы и введение согласно настоящему изобретению
Композиции по настоящему изобретению можно также получать в виде дозированных форм, предназначенных для введения примерно один раз в неделю. Схема введения один раз в неделю согласно настоящему изобретению может быть обеспечена введением состава в форме внутримышечной инъекции состава-депо, который можно получать в форме порошка, подходящего для восстановления, или помещать в устройства для инъекций, такие как предварительно заполненный шприц.
Дозированную форму для введения один раз в неделю можно определить, как препарат, который обеспечивает у людей или млекопитающих фармакокинетический профиль in vivo, характеризующийся достижением терапевтических концентраций в крови в течение менее примерно 72 часов и сохранением терапевтического уровня в течение по меньшей мере примерно 5 дней и как максимум примерно 13 дней. Предпочтительно дозированная форма для введения один раз в неделю при введении субъекту из числа млекопитающих позволяет достичь терапевтической концентрации в крови субъекта менее, чем примерно за 36 часов и сохранить терапевтический уровень в крови субъекта в течение по меньшей мере примерно 5 дней и как максимум в течение примерно 9 дней.
Композиция по настоящему изобретению может также подходить для введения один раз в две недели или один раз в три недели. Например, такая композиция могла бы обеспечить достижение терапевтической концентрации в крови субъекта в течение менее примерно 7 дней и могла бы сохранять концентрации арипипразола, превышающие терапевтическую концентрацию, в течение по меньшей мере примерно 14 дней, предпочтительно примерно 21 дня и как максимум примерно 28 дней. Такая композиция могла бы стать основой для альтернативной схемы введения, которая хотя и связана с регулярными визитами к профессиональным медикам, но является менее напряженной и неудобной для пациента, чем схема, включающая введение один раз в неделю.
Композиции по настоящему изобретению можно также придать свойства композиции длительного действия, которая способна поддерживать терапевтические уровни действующего вещества в крови в течение по меньшей мере примерно 1 недели и вплоть до примерно 1 месяца. Соответственно, композиция по настоящему изобретению сама по себе может иметь профиль высвобождения, позволяющий обеспечить как эффективность на начальном этапе, так и длительное действие.
Композиция по настоящему изобретению может также подходить для введения один раз в две недели или один раз в три недели. Например, такая композиция могла бы обеспечить достижение терапевтической концентрации в крови субъекта в течение менее примерно 7 дней и могла бы сохранять концентрации арипипразола, превышающие терапевтическую концентрацию, в течение по меньшей мере примерно 14 дней, предпочтительно примерно 21 дня и как максимум примерно 28 дней. Такая композиция могла бы стать основной альтернативной схемы введения, которая связана с регулярными визитами к профессиональным медикам, но является менее напряженной и неудобной для пациента, чем схема, включающая введение один раз в неделю.
Композиция по настоящему изобретению может также подходить для одновременного введения с пероральным атипическим антипсихотическим средством, предпочтительно арипипразолом. Арипипразол можно приобрести в Соединенных Штатах под торговым наименованием Abilify® (Abilify является зарегистрированной торговой маркой Otsuka Pharmaceutical Co., Ltd.) и это средство производится/поставляется компанией Bristol-Myers Squibb, Princeton, N.J. и продается компанией Otsuka America Pharmaceutical, Inc. Арипипразол доступен в форме таблеток, таблеток для рассасывания и в форме перорального раствора. В частности, дозировки перорального антипсихотического препарата составляют 10 мг, 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг и/или 100 мг. Преимущественно, пероральная дозировка антипсихотического средства составляет 30 мг.
Композиция по настоящему изобретению, помимо того, что она включает совокупность частиц с объемным размером (Dv50) менее 1000 нм, может также включать вторую совокупность более крупных частиц пролекарства арипипразола, имеющих объемный размер (Dv50) примерно 5000 нм или более. Например, в композицию по настоящему изобретению можно включать совокупность частиц пролекарства арипипразола, имеющих объемный размер (Dv50) 20 мкм, с целью придания одной композиции как свойств композиции начального этапа введения, которые описаны выше, так и свойств композиции долговременного действия.
Это позволяет добиться упрощения схемы введения препарата, благодаря присутствию компонента, действующего на начальном этапе, который обеспечивает быстрое начало действия, и затем терапевтические уровни арипипразола в крови в течение начального этапа, и компонента длительного действия, который достигает терапевтического уровня в крови после начального этапа и поддерживает этот терапевтический уровень в течение примерно 30 дней. Это гарантирует, что одна композиция обеспечит сохранение терапевтических концентраций в крови в течение по меньшей мере от примерно 1 до примерно 30 дней. Следовательно исчезнет необходимость в отдельном введении препарата начального этапа и осуществлении инъекции длительного действия, и прямым следствием этого станет упрощение схемы введения и повышение приверженности пациента лечению.
Тот факт, что смесь двух совокупностей частиц различных размеров можно получить в виде стабильной композиции, вообще говоря, является неожиданным. Для смесей частиц других действующих ингредиентов авторы настоящего изобретения наблюдали, что если одна из размерных групп имеет достаточно мелкий (менее примерно 2000 нм) объемный размер частиц (Dv50), обе размерные группы имеют тенденцию к изменению своих размеров благодаря эффекту созревания (переконденсации) Оствальда. Оствальдовское созревание представляет собой явление, наблюдающееся в совокупностях мелких частиц, где присутствуют частицы различных размеров. Как правило, частицы меньших размеров претерпевают растворение, и последующая кристаллизация приводит к росту более крупных частиц. Это явление встречается достаточно части для значительного числа действующих агентов, в особенности имеющих высокую растворимость. Неожиданно было установлено, что Оствальдовское созревание в смесях частиц пролекарства арипипразола различных размерных групп по настоящему изобретению является очень незначительным при наблюдении в течение периода примерно 1 месяца. Возможное объяснение этого заключается в том факте, что действующий агент по настоящему изобретению имеет исключительно низкую растворимость в воде, т.е. частицы действующего агента имеют слабую склонность к растворению и последующей кристаллизации. Это может являться отличительным свойством гидрофобных материалов: низкая свободная энергия поверхности препятствует увеличению размеров частиц.
В другом варианте осуществления композиция по настоящему изобретению, помимо совокупности частиц размером менее 1000 нм, может включать вторую совокупность частиц пролекарства арипипразола, имеющих объемный размер (Dv50) менее 1000 нм, и превышает значение Dv50 (первой) совокупности частиц пролекарства арипипразола не менее чем примерно на 100 нм, не менее чем примерно на 200 нм, не менее чем примерно на 300 нм, не менее чем примерно на 400 нм, не менее чем примерно на 500 нм, не менее чем примерно на 600 нм, не менее чем примерно на 700 нм, не менее чем примерно на 800 нм или не менее чем примерно на 900 нм.
В другом варианте осуществления, композиция по настоящему изобретению может поставляться в двухкамерном шприце, в котором одна из камер заполнена второй композицией пролекарства арипипразола, имеющей другой размер частиц. Например, вторая композиция арипипразола может иметь размер частиц также менее 1000 нм, от примерно 1000 до примерно 5000 км или более примерно 5000 нм. Обе композиции, таким образом, хранятся отдельно друг от друга.
Композиция по настоящему изобретению может иметь форму дисперсии частиц. Такая композиция включает дисперсионную среду, в которой диспергирована совокупность частиц пролекарства арипипразола, причем свободный компонент стабилизатора поверхности растворен или распределен другим образом.
Кроме того, композицию по настоящему изобретению можно получать в форме дисперсии (которая описана выше). Такая дисперсия, например, может быть помещена в устройство для инъекции, например, предварительно заполненный шприц. Однако следует понимать, что устройство для инъекции может включать любое устройство, способное осуществлять доставку состава для инъекции, которое можно применять согласно настоящему изобретению. Например, композиции по настоящему изобретению можно также вводить с применением автоматического устройства для инъекции. В качестве альтернативы, композиции по настоящему изобретению можно доставлять с применением шприца без иглы или двухкамерного шприца.
Композиция по настоящему изобретению может принимать форму порошка для восстановления в жидкой среде. В этой связи, значимая особенность настоящего изобретения заключается в том, что совокупность частиц пролекарства арипипразола редиспергируется при восстановлении в жидкой среде, так что редиспергированные частицы пролекарства арипипразола имеют объемный размер менее 1000 нм.
Рядовой специалист в данной области техники примет во внимание, что эффективные количества пролекарства арипипразола можно определить опытным путем. Реальные дозировки пролекарства арипипразола в композиции по настоящему изобретению можно менять, чтобы получить такое количество пролекарства арипипразола, которое эффективно для достижения желаемой терапевтической реакции в случае конкретной композиции и способа введения. Следовательно, выбранная дозировка зависит от желаемого терапевтического эффекта, пути введения, эффективности пролекарства арипипразола, желаемой продолжительности действия и других факторов. Композиции в форме дозированных единиц могут содержать такие количества действующего вещества, которые являются целыми долями дневной дозы, и их можно использовать для получения дневной дозы. Однако следует понимать, что дневная дозировка для любого конкретного пациента будет зависеть от целого ряда факторов: типа и степени клеточной или физиологической реакции, которой необходимо добиться; активности конкретного применяемого агента или композиции; конкретных применяемых агентов или композиций; возраста, массы тела, общего состояния здоровья, пола и рациона питания пациента; времени введения, пути введения и скорости выведения агента; продолжительности лечения; лекарственных средств, которые применяются в комбинации или одновременно с данным конкретным агентом; а также подобных факторов, хорошо известных в медицинской технике.
Стабилизаторы поверхности
Композиция по настоящему изобретению включает по меньшей мере один стабилизатор поверхности. Однако было обнаружено, что подходят и могут применяться в настоящем изобретении также и комбинации из более чем одного стабилизатора поверхности. Если применяется несколько стабилизаторов поверхности, может иметься основной стабилизатор поверхности, который присутствует в более высокой концентрации, чем остальные (дополнительные) стабилизаторы поверхности.
Не ограничиваясь конкретным объяснением, считается, что стабилизатор поверхности действует путем формирования пространственного или электростатического барьера вокруг частиц лекарственного средства, за счет чего возникает достаточное физическое разделение частиц, предотвращающее их агрегацию. Известно, что ряд соединений обладает способностью формировать такой пространственный или электростатический барьер при нанесении на частицы малого размера. Таким образом, представляется вероятным, что любое из этих веществ могло бы служить в качестве стабилизатора поверхности в рамках настоящего изобретения и, следовательно, входить в объем настоящего изобретения. Термин «стабилизатор поверхности» может применяться наряду с термином «модификатор поверхности».
Подходящие стабилизаторы поверхности, которые можно применять в настоящем изобретении, включают, не ограничиваясь перечисленными, известные органические и неорганические фармацевтические эксципиенты. Такие эксципиенты включают различные полимеры, олигомеры низкой молекулярной массы, природные продукты и ПАВ. Типовые стабилизаторы поверхности включают неионные и ионные (например, анионные, катионные и цвиттерионные) стабилизаторы поверхности. Не желая ограничиваться каким-либо конкретным объяснением, полагают, что полимерные материалы, прикрепляющиеся к поверхности частиц, могут создавать пространственный барьер, препятствующий агрегации частиц, тогда как в случае ионных стабилизаторов поверхности, стабилизирующее действие может быть отнесено на счет электростатических взаимодействий.
Особенно предпочтительными стабилизаторами поверхности для применения в настоящем изобретении являются полисорбатные ПАВ, именуемые также полисорбатами или сложными эфирами полиоксиэтилен сорбитана и жирных кислот. Примеры включают продукты, которые можно приобрести под торговым наименованием Tween® (зарегистрированная торговая марка Unigema бизнес-подразделения ICI Americas Inc.), такие как Tween® 20 (полиоксиэтилен 20 сорбитана монолаурат), именуемый в настоящей заявке также полисорбатом 20 или PS20, Tween® 40 (полиоксиэтилен 20 сорбитана пальмитат), именуемый в настоящей заявке также полисорбатом 40 или PS40 или Tween® 80 (полиоксиэтилен 20 сорбитана моноолеат), именуемый в настоящей заявке также полисорбатом 80 или PS80. Полисорбаты представляют собой амфифильные неионные ПАВ, состоящие из гидрофильной головной группы (сорбитан полиоксиэтилен), связанной эфирной связью с гидрофобной хвостовой группой. Различные марки полисорбатов различаются длиной этой хвостовой группы, например, PS20 (лаурат, C12), PS40 (пальмитат, C16), PS80 (олеат, C18).
Другие предпочтительные стабилизаторы поверхности для применения в настоящем изобретении, включают повидоны низкой молекулярной массы, лецитин, DSPG (1,2-дистеароил-sn-глицеро-3-фосфо-рац-(1-глицерин)), DOSS (диоктилсульфосукцинат натрия или докузат натрия), метил- и пропилпарабены, монолаурат сорбитана, именуемый также SML, который можно приобрести под торговым наименованием Span®20 (зарегистрированная торговая марка Croda International PLC), карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, именуемую также HPC, включая такие примеры, как HPC-SL низкой вязкости, которая имеет вязкость от 2,0 до 2,9 мПа⋅с в водном растворе 2% масса/объем при 20°C (можно приобрести у Nippon Soda Co Ltd, Japan), дезоксихолат натрия, алкилсахариды. Кроме того предпочтительными являются блок-сополимеры на основе этиленоксида и пропиленоксида, известные также, как полоксамеры и продаваемые, например, под торговыми наименованиями Pluronic® и Lutrol® (зарегистрированные торговые марки BASF Corporaton) и Synperonic (зарегистрированная торговая марка Croda International PLC). Примеры включают полоксамер 407 (Lutrol® F127), полоксамер 188 (Lutrol® F68/Pluronic® F68) или полоксамер 338 (Lutrol® F108/Pluronic® F108). Полоксамеры являются амфифильными, неионными триблок-сополимерами, состоящими из центрального гидрофобного блока поли(пропилен оксида) (PPO) с концевыми гидрофильными блоками поли(этиленоксида) (PEO). Различные марки отличаются длиной этих блоков и долей гидрофильных участков. Полоксамер 188 имеет мольную массу (18×100≈)1800 г/моль и (8×10≈) 80% суммарной массы составляет полиоксиэтилен; (PEO80-PPO27-PEO80). Полоксамер 338 имеет мольную массу (33×100≈)3300 г/моль и (8×10≈) 80% суммарной массы составляет полиоксиэтилен; (PEO132-PPO50-PEO132). Кроме того, предусматривается и применение индивидуальных компонентов, из которых состоят эти блок-сополимеры, например, в случае Pluronic F108, такими индивидуальными компонентами являются полиоксиэтилен и полиоксипропилен гликоль. Особенно предпочтительно применять упомянутые выше индивидуальные компоненты, принимая во внимание статус их одобрения. Другие предпочтительные стабилизаторы включают TPGS (d-альфа токоферил полиэтиленгликоля 1000 сукцинат), желатин и альбумин, лизоцим и циклодекстрины (например, бета-гидроксициклодекстрин). Также подходят гелеобразующие полимеры, такие как ReGel® (термоотверждаемый биоразрушаемый гель, разработанный British Technology Group) (ReGel является зарегистрированной торговой маркой Protheric Salt Lake City, Inc.). Особенно предпочтительными стабилизаторами поверхности для применения в рамках настоящего изобретения являются продукты, одобренные регулирующими органами для предпочтительного пути введения, т.е. внутримышечного применения.
Из перечисленных выше продуктов, особенно предпочтительными являются следующие, поскольку они в целом считаются наиболее приемлемыми для внутримышечного применения: полисорбатные ПАВ, такие как полисорбат 80, полисорбат 40 и полисорбат 20, повидоны низкой молекулярной массы, лецитин, DSPG и сорбитана монолаурат.
Другие подходящие стабилизаторы поверхности включают сополимеры винилпирролидона и винилацетата или коповидон (например, Plasdone® S630, который является стохастическим сополимером винилацетата и винилпирролидона, который можно приобрести у ISP Technologies, Inc. (USA)); гидроксипропилметилцеллюлозу (HPMC, например Pharmacoat® 603, которую можно приобрести у Shin-Etsu Chemical Co Ltd, Japan); поливинилпирролидон (PVP), например, продукт, который можно приобрести у ISP Corp (New Jersey, USA) под торговым наименованием Plasdone®, например Plasdone® C29/32 (который эквивалентен BASF PVP K29/32), Plasdone® C-30, Plasdone® C17 (эквивалентный BASF PVP K-17) и Plasdone® C12 (эквивалентный повидону K12); натриевую соль дезоксихолевой кислоты, лаурилсульфат натрия (SLS, известный также как додецилсульфат натрия или SDS), бензалкония хлорид (известный также, как алкилдиметилбензиламмония хлорид), лецитин, дистеарил пальмитат глицерил или их комбинации. Другие предпочтительные стабилизаторы поверхности включают альбумин, лизоцим, желатин, макрогол 15 гидроксистеарат (который можно приобрести, например, у BASF AG под торговым наименованием Solutol® 15), тилоксапол и полиэтоксилированное касторовое масло (которое можно приобрести, например, у BASF AG под торговым наименованием Cremophor® EL), ПЭГ-40 касторовое масло (Cremophor® RH 40, зарегистрированная торговая марка группы BASF), (2-гидроксипропил)-β-циклодекстрин, трет-октилфениловый эфир полиэтиленгликоля (Triton X-100TM, торговая марка Dow Chemical Company), полиэтиленгликоля(15) гидроксистеарат (Solutol® HS15, зарегистрированная торговая марка группы BASF), сульфобутиловый эфир β-циклодекстрина.
Стабилизаторы поверхности можно приобрести на рынке и/или можно получить по методикам, известным в технике. Большинство из этих стабилизаторов поверхности являются известными фармацевтическими эксципиентами и подробно описаны в Handbook of Pharmaceutical Excipients, совместно опубликованной American Pharmaceutical Association и Pharmaceutical Society of Great Britain (R.C.Rowe et al (ed.) 5th Edition, The Pharmaceutical Press, 2006, конкретно включенной в настоящую заявку посредством ссылки.
Эксципиенты
Композиция по настоящему изобретению может дополнительно включать один или несколько нетоксичных, физиологически приемлемых носителей, адъювантов или наполнителей, которые в совокупности именуются носителями. Композиция может быть предназначена для введения любыми фармацевтически приемлемыми средствами, включая, но не ограничиваясь этим, парентеральные инъекции (например, внутримышечные или подкожные). Небольшой размер частиц пролекарства арипипразола (т.е. менее 1000 нм) делает композицию по настоящему изобретению особенно подходящей для парентеральных составов.
Композиция по настоящему изобретению может включать хелатообразующий агент, например, цитрат натрия, дигидрат одноосновного фосфата натрия (NaH2PO4⋅2H2O) или безводный двухосновный фосфат натрия (NaH2PO4). Хелатообразующий агент связывается с примесями ионов металлов, которые попадают в композицию во время процесса измельчения и, тем самым, препятствует образованию альдегидов.
Композиции по настоящему изобретению могут также включать буфер для повышения pH дисперсионной среды. Некоторые стабилизаторы поверхности, в т.ч. полисорбат 20, могут быть склонны к окислению. Если после измельчения полисорбат 20 в композиции подвергается окислению, это может понизить итоговое значение pH дисперсионной среды. После этого лекарственное вещество может стать более растворимым в среде с более низким значением pH, что, вероятно, приведет к росту размера частиц из-за проявления такого процесса, как Оствальдовское созревание. Поэтому в композицию можно включить буфер для противодействия снижению pH и предотвращения возникновения указанного эффекта. Буферы, которые могут применяться в композициях по настоящему изобретению, включают цитрат натрия, дигидрат одноосновного фосфата натрия (NaH2PO4⋅2H2O) или безводный двухосновный фосфат натрия (NaH2PO4).
Композиция по настоящему изобретению может также включать антиоксидант для предотвращения окисления стабилизатора поверхности или любого другого компонента. В качестве эффективного антиоксиданта может применяться лимонная кислота.
Композиция по настоящему изобретению может также включать средство для регулирования тоничности, например, солевой раствор, сахара или полиолы.
Как указано выше, композиции по настоящему изобретению можно получать в форме дисперсий, в которых частицы по настоящему изобретению диспергированы в дисперсионной среде. Дисперсионная среда может состоять из воды и/или любого из эксципиентов, описанных выше по тексту. Могут применяться масла или другие неводные среды, если они совместимы с пролекарством арипипразола. Предпочтительно, дисперсионной средой является вода или среда на водной основе.
В качестве альтернативы, композиция по настоящему изобретению может представлять собой частицы в сухой форме, предназначенные для диспергирования в дисперсионной среде перед введением. В таких вариантах осуществления, композиция предпочтительно включает один или несколько из упомянутых выше эксципиентов, и перед введением ее восстанавливают водой.
Способы получения композиции пролекарства арипипразола по настоящему изобретению
Кроме того, настоящее изобретение относится к способу получения композиции пролекарства арипипразола по настоящему изобретению.
Этот способ включает стадию (a) вычисления количества по меньшей мере одного стабилизатора, который следует добавить в композицию, чтобы гарантировать присутствие в композиции как адсорбированного компонента, так и свободного компонента стабилизатора поверхности. Это вычисление можно осуществить, например, с помощью методик приблизительного вычисления количества свободного стабилизатора поверхности, описанных в настоящей заявке. Кроме того, описываемый способ включает (b) получение совокупности частиц пролекарства арипипразола с объемным размером частиц (Dv50) менее 1000 нм, который определяют по рассеянию света. Это получение можно осуществить с использованием любых описанных ниже способов получения частиц малого размера. Предпочтительным способом является измельчение с помощью мельницы. Далее способ включает (c) смешивание вычисленного количества стабилизатора поверхности с совокупностью частиц пролекарства арипипразола, так чтобы адсорбирующийся компонент стабилизатора поверхности адсорбировался на поверхность частиц пролекарства арипипразола. Адсорбция стабилизатора поверхности на частицы пролекарства арипипразола может быть достигнута приведением в контакт этих частиц с по меньшей мере одним стабилизатором поверхности на такое время и в таких условиях, которые достаточны для получения композиции, содержащей частицы пролекарства арипипразола, имеющие объемный размер (Dv50) менее 1000 нм. Стадию (b) и стадию (c) можно осуществлять одновременно путем измельчения пролекарства арипипразола в присутствии стабилизатора, как подробно описано ниже и в примерах. Кроме того, способ может включать стадию (d) сохранения образца композиции для определения количества свободного компонента стабилизатора поверхности, стадию (e) выделения частиц пролекарства арипипразола с адсорбированным на них стабилизатором поверхности из дисперсионной среды в образце с образованием супернатанта и стадию (f) измерения количества стабилизатора поверхности в супернатанте с использованием прибора для высокоэффективной жидкостной хроматографии (ВЭЖХ) для подтверждения, что свободный компонент стабилизатора действительно присутствует в композиции. Далее, способ по настоящему изобретению может включать стадию (g) смешивания частиц пролекарства арипипразола и стабилизатора поверхности с дисперсионной средой с получением композиции диспергированного пролекарства арипипразола. Другие возможные стадии включают стадию (h) смешивания частиц пролекарства арипипразола с дополнительной совокупностью частиц пролекарства арипипразола, имеющих объемный размер (Dv50) по меньшей мере на 100 нм больше и стадию (i) помещения композиции диспергированного пролекарства арипипразола в устройство для инъекций (например, заполненный шприц, автоматический медицинский шприц, шприц без иглы или двухкамерный шприц). При применении двухкамерного шприца, способ может включать дополнительную стадию j) помещения композиции пролекарства арипипразола в одну камеру двухкамерного шприца и помещения в другую камеру двухкамерного шприца второй композиции. Эта вторая композиция может являться второй композицией пролекарства арипипразола, имеющей другой объемный размер частиц (Dv50), или включать действующий ингредиент, не являющийся арипипразолом, например, атипичное антипсихотическое средство.
Композицию по настоящему изобретению можно получать, применяя, например, измельчение или растирание (включая, но не ограничиваясь этим, мокрое измельчение), гомогенизацию, осаждение, замораживание, методику матричной эмульсии, методику сверхкритического флюида, методику нано-электрораспыления или любые комбинации перечисленных способов. Типовые примеры способов получения композиций наночастиц описаны в патенте ʹ684. Способы получения композиций наночастиц описаны также в патенте США № 5 518 187 под названием «Способ измельчения фармацевтических веществ», патенте США № 5 718 388 под названием «Непрерывный способ измельчения фармацевтических веществ», патенте США № 5 862 999 под названием «Способ измельчения фармацевтических веществ», патенте США № 5 665 331 под наименованием «Совместное микроосаждение фармацевтических агентов с модификаторами роста кристаллов в форме наночастиц», патенте США № 5 662 883 под названием «Совместное микроосаждение фармацевтических агентов с модификаторами роста кристаллов в форме наночастиц», патенте США № 5 560 932 под названием «Микроосаждение фармацевтических агентов в форме наночастиц», патенте США № 5 543 133 под названием «Способ получения композиций для контрастирования рентгеновских изображений, содержащих наночастицы», патенте США № 5 534 270 под названием «Способ получения стабильных наночастиц лекарственных веществ», патенте США № 5 510 118 под названием «Способ получения терапевтических композиций, содержащих наночастицы», и патенте США № 5 470 583 под названием «Способ получения композиций наночастиц, содержащих заряженные фосфолипиды для ослабления агрегации», причем все перечисленные патенты конкретно включены в настоящую заявку посредством ссылки.
Измельчение для получения композиции пролекарства арипипразола
Измельчение пролекарства арипипразола для получения композиции пролекарства арипипразола по настоящему изобретению включает диспергирование частиц в жидкой дисперсионной среде, в которой пролекарство арипипразола плохо растворимо, с последующим применением механических средств в присутствии среды для измельчения с целью уменьшения размера частиц пролекарства арипипразола до желаемого объемного размера (Dv50). Дисперсионной средой может являться, например, вода, сафлоровое масло, этанол, т-бутанол, глицерин, полиэтиленгликоль (ПЭГ), гексан или гликоль. Предпочтительной дисперсионной средой является вода.
Размер частиц пролекарства арипипразола можно уменьшать в присутствии по меньшей мере одного стабилизатора поверхности. В качестве альтернативы, частицы пролекарства арипипразола можно привести в контакт с одним или несколькими стабилизаторами поверхности после растирания. В процессе уменьшения размеров частиц к композиции пролекарство арипипразола/стабилизатор поверхности можно добавлять другие соединения, например, разбавитель. Дисперсии можно получать в непрерывном или периодическом режиме.
Среда для измельчения может содержать частицы, которые предпочтительно имеют практически сферическую форму, как, например, керамические шарики или шарики, состоящие главным образом из полимерных или сополимерных материалов. В качестве альтернативы, среда для измельчения может содержать ядра, на которые нанесено полимерное или сополимерное покрытие.
Как правило, полимерные или сополимерные материалы являются химически и физически инертными, практически не содержат металлов, растворителей и мономеров, и характеризуются значительной твердостью и прочностью к истиранию, что позволяет избежать раскалывания или раскрашивания во время измельчения. Подходящие полимерные или сополимерные материалы включают поперечно-сшитые полистиролы, например, полистирол, сшитый дивинилбензолом; сополимеры стирола; поликарбонаты; полиацетали, например, Delrin™ (E.I. du Pont de Nemours and Co); полимеры и сополимеры винилхлорида; полиуретаны; полиамиды; поли(тетрафторэтилены), например, Teflon® (E.I. du Pont de Nemours and Co), и другие фторсодержащие полимеры; полиэтилены высокой плотности; полипропилены; простые и сложные эфиры целлюлозы, например, ацетат целлюлозы; полигидроксиметакрилат; полигидроксиэтилакрилат; а также кремнийсодержащие полимеры, такие как полисилоксаны и т.п. Полимер может являться биоразрушаемым. Типовые примеры биоразрушаемых полимеров или сополимеров включают поли(лактиды), поли(гликолиды), сополимеры лактидов и гликолидов, полиангидриды, поли(гидроксиэтил метакрилат), поли(имино карбонаты), сложные эфиры поли(N-акрилгидроксипролина), сополимеры этилен-винилацетат, поли(ортоэфиры), поли(капролактоны) и поли(фосфазены). В случае биоразрушаемых полимеров или сополимеров, положительным фактором является то, что примеси этих полимеров, могут разрушаться вследствие метаболизма in vivo до биологически приемлемых продуктов, которые могут удаляться из организма.
Частицы среды для измельчения предпочтительно имеют размеры в диапазоне от примерно 0,01 до примерно 3 мм. При необходимости тонкого измельчения, среда для измельчения предпочтительно имеет размеры от примерно 0,02 до примерно 2 мм, более предпочтительно от примерно 0,03 до примерно 1 мм. Полимерный или сополимерный материал может иметь плотность от примерно 0,8 до примерно 3,0 г/см3.
В предпочтительном способе измельчения частицы пролекарства арипипразола получают в непрерывном режиме. Такой способ включает непрерывную подачу композиции пролекарства арипипразола по настоящему изобретению в камеру для помола, введение в контакт композиции пролекарства арипипразола по настоящему изобретению со средой для измельчения, находящейся в камере, для уменьшения размера частиц пролекарства арипипразола композиции по настоящему изобретению и непрерывное удаление композиции пролекарства арипипразола из камеры для помола. Среду для измельчения отделяют от измельченной композиции пролекарства арипипразола по настоящему изобретению в ходе вторичного процесса с помощью известных методик разделения, например, простого фильтрования, просеивания через сетчатый фильтр или сито с определенным размером ячеек и т.п. Также могут применяться и другие методики разделения, например, центрифугирование.
Типовой способ измельчения с применением мельницы Nanomill® 01 включает следующие стадии:
1. Вычисление количества действующего фармацевтического ингредиента (API), стабилизатора поверхности и других эксципиентов, необходимых для изготовления композиции.
2. Получение непрерывной фазы или дисперсионной среды, которое включает стадии взвешивания эксципиента в чистом сосуде и перемешивания содержимого в течение нескольких секунд, после чего содержимому дают осесть в течение короткого времени. Для получения 10X носителя, например, хлорид натрия можно растворить в цитратном буфере. После фильтрования носитель можно перенести в стерильный контейнер и хранить в холодном помещении.
3. Взвешивание API и перенесение API в камеру для помола.
4. Добавление дисперсионной среды к API в камере.
5. Перемешивание содержимого для гарантированного смачивания поверхности.
6. Взвешивание среды для измельчения и добавление этой среды в камеру для помола.
7. Перемешивание содержимого камеры для обеспечения смачивания среды.
8. Установка камеры на мельницу NanoMill и присоединение охлаждающей бани.
9. Запуск мельницы на минимальной скорости в течение 5 минут.
10. Измельчение содержимого на желаемой круговой скорости в течение желаемого времени.
11. Извлечение измельченной композиции. При использовании мельницы Nanomill® 01 было отмечено, что композицию со средним размером частиц менее 200 нм лучше всего извлекать центрифугированием с использованием 10 мкм (мл?) пробирки или 10 мл сосуда из нержавеющей стали со стальным ситом, имеющим размер ячеек от 100 до 150 мкм. В случае композиций, имеющих средний размер частиц менее 250 нм лучше всего собирать большую часть NCD с помощью иглы 23G на первой стадии и затем осуществлять центрифугирование оставшейся суспензии с использованием 10 мкм пробирки с последующим объединением двух полученных порций.
Типовой состав, в котором в качестве стабилизатора поверхности применяется полисорбат 2,0 можно получить измельчением кристаллов арипипразола лауроксила с помощью NanoMill при загрузке 30% (масс./масс.) в 2% (масс./масс.) полисорбате 20. Требуемой для введения концентрации можно достичь в результате разбавления полученной дисперсии носителем. Активность (содержание действующего вещества) полученного препарата можно точно определить с помощью ВЭЖХ.
Мокрое измельчение можно проводить в водных носителях, содержащих модификаторы, стабилизирующие поверхность, с шариками из полистирола (среда для измельчения Polymill® 500) с использованием системы для измельчения NanoMill® 0,01. Скорость вращения рабочего органа, измельчаемый объем и время измельчения могут быть подобраны экспериментальным путем до достижения желаемого размера частиц. «Базовый» состав можно собрать откачиванием дисперсии через подходящий фильтр (полистирольный с отверстиями 10 мкм или металлический с отверстиями 100 мкм) при содержании API приблизительно 30% (масс./масс.). Содержание твердого вещества, концентрация стабилизатора поверхности температура измельчения, круговая скорость измельчения, объем измельчаемого вещества и время измельчения могут быть подобраны экспериментальным путем до достижения желаемого размера частиц.
Осаждение для получения композиции пролекарства арипипразола
Другим способом формирования композиции пролекарства арипипразола по настоящему изобретению является микроосаждение. Оно представляет собой способ получения стабильных дисперсий плохо растворимых действующих агентов в присутствии одного или нескольких стабилизаторов поверхности и одного или нескольких поверхностно-активных агентов повышающих стабильность коллоидов, свободных от любых следов токсичных растворителей или растворенных примесей тяжелых металлов. Этот способ включает, например: (1) растворение пролекарства арипипразола в подходящем растворителе; (2) добавление состава стадии (1) к раствору, содержащему по меньшей мере один стабилизатор поверхности; и (3) осаждение состава стадии (2) с помощью подходящего нерастворителя (осадителя). Способ может быть дополнен удалением любой образовавшейся соли, если она присутствует, путем диализа или диафильтрации, и концентрирование дисперсии известными способами.
Гомогенизация для получения композиции пролекарства арипипразола
Типовые способы гомогенизации для получения композиций действующего агента описаны в патенте США № 5 510 118 под названием «Способ получения терапевтических композиций, содержащих наночастицы». Эти способы включают диспергирование частиц пролекарства арипипразола в жидкой дисперсионной среде, с последующим осуществлением гомогенизации дисперсии для уменьшения размеров частиц пролекарства арипипразола до желаемого объемного размера (Dv50). Размер частиц пролекарства арипипразола можно уменьшать в присутствии по меньшей мере одного стабилизатора поверхности. В качестве альтернативы, частицы пролекарства арипипразола могут быть приведены в контакт с одним или несколькими стабилизаторами поверхности либо до, либо после измельчения. Другие соединения, например, разбавитель, могут быть добавлены к композиции пролекарство арипипразола/стабилизатор поверхности до, во время или после процесса уменьшения размера частиц пролекарства арипипразола. Дисперсии можно изготавливать либо в непрерывном, либо в периодическом режиме.
Криогенные методики получения композиций пролекарства арипипразола
Другим способом получения композиции пролекарства арипипразола по настоящему изобретению является замораживание распылением в жидкость (SFL). В этом способе применяется органический или водно-органический раствор пролекарства арипипразола со стабилизатором поверхности, который распыляют в криогенную жидкость, например, жидкий азот. Капельки раствора пролекарства арипипразола замерзают со скоростью, достаточной для минимизации кристаллизации и роста частиц, за счет чего образуются частички пролекарства арипипразола размером менее 1000 нм. В зависимости от выбора системы растворителей и условий обработки, частицы пролекарства арипипразола могут иметь различную морфологию. На стадии выделения продукта, азот и растворитель удаляют в условиях, которые позволяют избежать агломерации или созревания частиц арипипразола в продукте.
В качестве методики, дополняющей SFL, может также применяться ультрабыстрая заморозка (URF) для создания эквивалентных частиц пролекарства арипипразола со значительно увеличенной площадью поверхности. В URF применяется распыление органического или водно-органического растворителя пролекарства арипипразола на криогенный субстрат.
Эмульсионные методики получения композиций пролекарства арипипразола
Другим способом получения композиции пролекарства арипипразола по настоящему изобретению является формирование матричной эмульсии. Матричная эмульсия позволяет получить наноструктурированные частицы пролекарства арипипразола с регулируемым распределением размеров и хорошей скоростью растворения. В этом способе применяются эмульсии масло-в-воде, которые получают и затем подвергают набуханию в неводном растворе, включающем пролекарство арипипразола и стабилизаторы поверхности. Распределение размеров частиц пролекарства арипипразола непосредственно определяется размером капелек эмульсии перед загрузкой в них пролекарства арипипразола, т.е. свойством, которым можно управлять и которое можно оптимизировать в данном способе. Кроме того, за счет выбора растворителей и стабилизаторов, достигается стабильность эмульсии при отсутствии или значительном ослаблении Оствальдовского созревания. После получения желаемой эмульсии, растворитель и воду удаляют и выделяют стабилизированные частицы пролекарства арипипразола. Путем надлежащего регулирования условий процесса, можно получить частицы пролекарства арипипразола с различной морфологией.
Методики получения композиций пролекарств арипипразола с применением сверхкритического флюида
Композиции пролекарства арипипразола можно также получать способами, в которых применяются сверхкритические флюиды. В таких способах пролекарство арипипразола растворяют в растворе или носителе, который может также содержать по меньшей мере один стабилизатор поверхности. Затем раствор и сверхкритический флюид совместно вводят в сосуд для формирования частиц. Если в носитель предварительно не добавлен стабилизатор поверхности, его можно добавить в сосуд для формирования частиц. Температуру и давление регулируют таким образом, что диспергирование и экстракция носителя происходят практически одновременно под действием сверхкритического флюида. Химические вещества, которые могут применяться в качестве сверхкритических флюидов, включают диоксид углерода, закись азота, гексафторид серы, ксенон, этилен, хлортрифторметан, этан и трифторметан.
Примеры известных способов получения наночастиц, основанных на сверхкритических флюидах, включают Международную заявку на патент No WO 97/14407, поданную Pace и соавторами, опубликованную 24 апреля 1997, которая относится к частицам нерастворимых в воде биологически активных соединений со средним размером от 100 нм до 300 нм, полученные растворением соединения в растворе с последующим распылением раствора в сжатый газ, жидкость или сверхкритический флюид в присутствии подходящих стабилизаторов поверхности.
Аналогично, в патенте США No 6 406 718, выданном Cooper и соавторам, описан способ формирования продукта, состоящего из частиц флутиказона пропионата, включающий совместное введение сверхкритического флюида и носителя, содержащего по меньшей мере флутиказона пропионат в растворе или суспензии, в сосуд для формирования частиц, в котором температура и давление регулируются таким образом, что диспергирование и удаление носителя происходят практически одновременно под действием сверхкритического флюида. Указано, что соединения, которые подходят в качестве сверхкритического флюида, включают диоксид кремния, закись азота, гексафторид серы, ксенон, этилен, хлортрифторметан, этан и трифторметан. Сверхкритический флюид необязательно может содержать один или несколько модификаторов, например, метанол, этанол, этилацетат, ацетон, ацетонитрил или любую смесь этих веществ. Модификатор сверхкритического флюида (или сорастворитель) представляет собой химическое вещество, которое, будучи добавлено к сверхкритическому флюиду, меняет исходные свойства этого сверхкритического флюида около критической точки. Согласно Cooper и соавторам, частицы флутиказона пропионата, полученные с применением сверхкритического флюида, имеют диапазон размеров от 1 до 10 мкм, преимущественно от 1 до 5 мкм.
Методики нано-электрораспыления, применяемые для получения композиции пролекарства арипипразола
При ионизации электрораспылением, жидкость прокачивают через очень мелкий, обычно металлический капилляр, несущий заряд. Эта жидкость содержит желаемое вещество, например, пролекарство арипипразола, растворенное в значительном количестве растворителя, который, как правило, является значительно более летучим, чем само вещество. В этот раствор часто добавляют также летучие кислоты, основания или буферные соединения. Вещество находится в растворе в форме ионов, либо в протонированной форме, либо в виде анионов. Поскольку одноименные заряды отталкиваются, жидкость выбрасывается из капилляра и образует туман или аэрозоль из мелких капелек поперечником примерно 10 мкм. Эта струя аэрозольных капелек по меньшей мере частично образуется в результате процесса, включающего образование конуса Тейлора и выброс с кончика этого конуса. Для содействия распылению жидкости и для лучшего испарения нейтрального растворителя из мелких капелек иногда применяют нейтральный газообразный носитель, например, газообразный азот. По мере испарения мелких капелек, взвешенных в воздухе, заряженные молекулы вещества вынуждены сближаться друг с другом. Капельки становятся неустойчивыми по мере сближения одноименно заряженных молекул, и разрушаются далее. Это явление именуется Кулоновским распадом, поскольку движущей силой процесса является именно сила Кулоновского отталкивания между заряженными молекулами вещества. Этот процесс повторяется до тех пор, пока вещество не потеряет весь растворитель и не станет состоять только из ионов.
В нанотехнологии методика электрораспыления может применяться для осаждения отдельных частиц на поверхности, например, частиц пролекарства арипипразола. Это достигается распылением коллоидов и гарантирует, что в среднем на одну капельку не будет приходиться более одной частицы. Последующее испарение окружающего растворителя приводит к образованию потока аэрозоля, состоящего из отдельных частиц пролекарства арипипразола. Ионизация в данном способе не имеет решающего значения для реализации настоящего изобретения, но ее можно использовать в электростатическом осаждении частиц.
Определение размеров частиц
Размер частиц в композиции по настоящему изобретению можно измерять с помощью такой методики, как рассеяние света, либо в воде, либо в разбавленном растворе стабилизатора поверхности, используемых в качестве разбавителя. Результаты измерений можно подтверждать с применением микроскопии. Распределение размеров частиц можно определять с помощью анализатора размеров частиц Horiba 950 в виде мокрой суспензии. Объемное распределение размеров частиц (Dv50) выражено в настоящей заявке посредством объемного диаметра частиц. Измерение размеров частиц можно также проводить с использованием PCS (измерения динамического рассеяния света).
Помимо методик, основанных на рассеянии света, существуют другие способы определения размеров частиц, которые подробно описаны ниже.
Оптическую микроскопию можно проводить на микроскопе Leica DMR при увеличениях 100Х, используя оптику для фазового контраста. Анализ изображений можно осуществлять с помощью программы Axiovision.
Сканирующую электронную микроскопию (SEM) можно осуществлять с применением подходящего сканирующего электронного микроскопа, например, Phenom Pro G2. Образцы можно получать выливанием разбавленного состава с концентрацией примерно 0,5 мг/мл на 9 мм клейкие пластинки на углеродной основе Pelcon с последующим высушиванием на воздухе в течение ночи. Образцы можно покрыть напылением (2X) используя устройство для нанесения покрытий напылением Denton Vacuum Desk V.
Свободный стабилизатор поверхности
Для гарантии того, что в композиции по настоящему изобретению имеется достаточное количество свободного стабилизатора поверхности, можно прибегнуть к грубому приблизительному подсчету количества стабилизатора поверхности, которое требуется добавить в композицию, используя описанную ниже методику. Отметим, что используются следующие сокращения: SA=площадь поверхности, NP=наночастица, PS=размер частицы. Количество свободного стабилизатора поверхности может быть приблизительно предсказано с использованием формулы SAстабилизатор/SAдоступная. Если полученное значение равно 1, то система насыщена стабилизатором поверхности. Если полученное значение меньше 1, это может означать, что система не насыщена, и следовательно в ней вообще отсутствует доступный свободный стабилизатор поверхности. Если установлено, что значение превышает 1, то система является насыщенной, и в ней будет присутствовать свободный стабилизатор.
В приведенном выше выражении, SAдоступная представляет собой суммарную площадь поверхности лекарственного вещества, которая доступна для данной массы этого вещества, SAстабилизатор означает площадь поверхности головных групп стабилизатора, адсорбированного на поверхности частиц лекарственного средства. Эти величины можно вычислить путем расчета общей площади поверхности на основании измеренного радиуса частиц лекарственного средства. Радиус (r) вычисляют простым определением значения объемного размера частиц (Dv50) и делением его на 2, в предположении, что частицы лекарственного средства являются сферическими. Затем полученное значение умножают на количество частиц (N), которое определяют путем деления массы использованного лекарственного средства (M) на массу одной частицы лекарственного средства. Массу частицы можно вычислить, исходя из плотности лекарственного соединения (σ), путем умножения на объем одной частицы (Vnp), где Vnp=4πr3/3.
N=M/σ*Vnp
Площадь поверхности наночастицы=SAnp=4πr2
Общая площадь поверхности=SAобщая=N*SAnp
Из-за экранирования головными группами стабилизатора поверхности, не вся площадь поверхности является доступной. Это можно смоделировать, предполагая, что наночастицы являются сферами и что плотнейшая гексагональная упаковка (HCP) обеспечивает максимально плотное покрытие поверхности. HCP для двумерных кругов (которыми, как предполагается в данной модели, являются головные группы стабилизатора) составляет 0,9069 (т.е. покрыто 90,69% поверхности).
SAдоступная=SAобщая*0,9069
SAстабилизатор=Площадь поверхности головных групп стабилизатора, адсорбированного на поверхности лекарственного средства
Значение SAстабилизатор можно вычислить следующим образом. Во-первых, массу стабилизатора, который предполагается включить в композицию, преобразуют в количество молей стабилизатора. Затем полученную величину используют для вычисления числа молекул стабилизатора, присутствующих в композиции, которое представляет собой количество молей*NA (где NA означает число Авогадро 6,022*10-23 моль-1). После этого число молекул стабилизатора умножают на площадь поверхности головной группы. Площадь головной группы для полисорбата 20 принимают равной площади поверхности алифатической цепи C12. Значения площадей головных групп можно вычислить из литературных данных, и они будут зависеть от ориентации группы на поверхности (Tween surfactants: Adsorption, self-organization, and protein resistance: Lei Shen, Athena Guo, Xiaoyang Zhu; Surface Science 605 (2011)494-499).
Описанная выше методика способна дать приблизительный ориентир по количеству стабилизатора, которое следует добавлять в композицию.
Измерение содержания свободного стабилизатора поверхности
Количество свободного стабилизатора поверхности можно определить после получения композиции, используя такие методики, как термогравиметрический анализ (TGA) или высокоэффективную жидкостную хроматографию (ВЭЖХ).
Способ определения свободного компонента стабилизатора поверхности в композиции пролекарства арипипразола может включать следующие стадии: (i) отделение частиц вместе с адсорбированным на них стабилизатором поверхности от дисперсионной среды, которая образует супернатант, и (ii) определение количества стабилизатора поверхности в супернатанте, с использованием прибора для высокоэффективной жидкостной хроматографии (ВЭЖХ).
ВЭЖХ можно выполнять для определения количества свободного стабилизатора поверхности с использованием, например, ВЭЖХ-анализа на обращенной фазе с применением колонки C8. Типовая методика включает изократическую хроматографию с 35% 10мМ буферного раствора фосфата калия (pH 2,5) и 65% ацетонитрила в качестве подвижной фазы и УФ-детектирование при 240 нм. Лекарственный продукт ресуспендируют и центрифугируют/фильтруют для удаления лекарственного вещества и «связанного» полисорбата 20. Количество «свободного» полисорбата 20 определяют, используя в качестве эталона стандартные растворы полисорбата 20.
Способ лечения и применения композиции пролекарства арипипразола по настоящему изобретению
Кроме того, настоящее изобретение относится к способу лечения млекопитающего, которому это необходимо, включающему введение стабильной композиции пролекарства арипипразола, включающей: (a) частицы пролекарства арипипразола или его соли, имеющие объемный размер (Dv50) менее примерно 1000 нм; и (b) по меньшей мере один стабилизатор поверхности.
Композиция пролекарства арипипразола по настоящему изобретению может применяться в лечении заболеваний и расстройств ЦНС, например, психических заболеваний и расстройств, включая, но не ограничиваясь перечисленными, шизофрению, острые маниакальные и смешанные эпизоды, связанные с биполярным расстройством, и другие шизофреноформные заболевания, большое депрессивное расстройство (MDD), а также в лечении раздражительности, связанной с аутическим расстройством. Указанный способ может включать лечение млекопитающего, в т.ч. человека, от расстройств центральной нервной системы, например психических заболеваний и расстройств; упомянутое лечение может включать психиатрическое лечение. Лечение может включать введение млекопитающему композиции, содержащей пролекарство арипипразола по настоящему изобретению.
Композиция по настоящему изобретению можно вводить субъекту любым фармацевтически приемлемым путем, включая, но не ограничиваясь указанным, парентеральный путь (например, внутримышечное или подкожное введение).
Композиция, которая подходит для парентеральной инъекции, может включать физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки, предназначенные для восстановления до стерильных растворов или дисперсий для инъекций. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или носителей включают воду, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и т.п.), их подходящие смеси, растительные масла (например, оливковое масло) и подходящие для инъекций органические эфиры, такие как этилолеат. Надлежащую текучесть состава можно поддерживать, например, применением покрытий, таких как лецитин, сохранением необходимого размера частиц в случае дисперсий, а также применением ПАВ.
Композицию можно вводить в любой фармацевтически приемлемой форме; однако предпочтительными являются составы, подходящие для инъекций.
Состав для инъекций можно вводить, например, внутримышечной или подкожной инъекцией, так чтобы формировался болюс или депо; образовавшееся депо может обеспечивать продолжительный период действия, например, за счет медленного и равномерного поступления в организм субъекта. Так, например, составам для инъекций можно придать такие свойства, чтобы они обеспечивали регулируемое высвобождение пролекарства арипипразола после подкожной, внутримышечной, интраперитонеальной и т.д. инъекции. Например, размер частиц и концентрацию эксципиента можно отрегулировать таким образом, чтобы получить регулируемое высвобождение (например, уровни пролекарства арипипразола в организме субъекта будут находиться в окне терапевтически эффективных концентраций) в течение более примерно 24 часов, более примерно 3 дней, более примерно 5 дней, более примерно 7 дней, более примерно 10 дней, более примерно 14 дней, более примерно 20 дней, более примерно 30 дней, более примерно 2 месяцев, более примерно 3 месяцев, более примерно 4 месяцев или в течение любого периода времени, находящегося между указанными значениями. Композиция по настоящему изобретению может иметь такой состав, чтобы инъецированное в организм депо могло высвобождать пролекарство арипипразола в терапевтических количествах в течение периода от примерно двух до примерно двадцати четырех недель; от примерно двух до примерно шести недель; от примерно двух до примерно четырех недель; или от примерно одной до примерно четырех недель.
При лечении расстройств центральной нервной системы полезно иметь дозированную лекарственную форму, которая доставляет требуемое терапевтическое количество лекарственного средства in vivo и делает действующее вещество биодоступным быстрым и бесперебойным образом. Этой цели можно добиться путем применения составов для инъекций композиции пролекарства арипипразола по настоящему изобретению, за счет формирования депо (например, при внутримышечной инъекции) лекарственного вещества, как описано выше. В некоторых вариантах осуществления, действующее вещество высвобождается из депо в кровеносную систему с постоянной скоростью, что непрерывно обеспечивает пациенту необходимую дозу лекарственного вещества в течение продолжительного периода времени. Этот способ (например, инъекция состава-депо) позволяет также добиться повышенной приверженности пациента лечению. Однократная инъекция, например, раз в месяц, обеспечит пациенту необходимые терапевтические дозировки в течение месяца, по сравнению с ежедневной необходимостью помнить или принимать решение о приеме таблетки, капсулы и т.д.
Типовые составы пролекарства арипипразола, предназначенные для введения внутримышечной или подкожной инъекцией, могут включать частицы пролекарства арипипразола, имеющие объемный размер (Dv50) менее 1000 нм, наряду с одним или несколькими стабилизаторами поверхности, такими как, но не ограничиваясь перечисленными, эфиры полиоксиэтиленсорбитана и жирной кислоты (полисорбат 80, полисорбат 40, полисорбат 20), повидоны низкой молекулярной массы, лецитин, d-альфа токоферил полиэтиленгликоля 1000 сукцинат, диоктилсульфосукцинат натрия или докузат натрия, метил- и пропилпарабены, монолаурат сорбитана, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, дезоксихолат натрия, алкилсахариды, дифункциональные блок-сополимеры, d-альфа токоферил полиэтиленгликоля 1000 сукцинат, желатин, альбумин, лизоцим, циклодекстрин (например, бетагидроксициклодекстрин) и гель-образующие полимеры, адсорбированными на поверхности упомянутых частиц пролекарств, в количестве, достаточном для сохранения объемного размера частиц (Dv50) в течение желательной продолжительности эффективности. Такая композиция пролекарства арипипразола, предназначенная для парентерального введения, может улучшать эффективность пролекарства арипипразола при лечении заболеваний или расстройств ЦНС различных типов, например, психических заболеваний и расстройств.
Композиция, подходящая для парентеральной инъекции, может включать физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления до стерильных растворов или дисперсий для инъекций. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или носителей включают воду, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и т.п.), их подходящие смеси, растительные масла (например, оливковое масло) и подходящие для инъекций органические эфиры, такие как этилолеат. Надлежащую текучесть состава можно поддерживать, например, применением покрытий, таких как лецитин, сохранением необходимого размера частиц в случае дисперсий, а также применением ПАВ.
Композиция пролекарства арипипразола может также включать адъюванты, например консервирующие, смачивающие, эмульгирующие агенты и средства, способствующие распределению препарата. Предотвращение роста микроорганизмов можно обеспечить различными антибактериальными и противогрибковыми агентами, такими как парабены, хлорбутанол, фенол, сорбиновая кислота и т.п. Также может быть желательно включать в состав изотонические агенты, такие как сахара, хлорид натрия и т.п. Продолжительной абсорбции фармацевтической формы для инъекций можно добиться применением агентов, замедляющих абсорбцию, например, моностеарата алюминия и желатина.
Кроме того, предусмотрено, что более высокие концентрации пролекарства арипипразола могут быть доставлены в инъекции меньшего размера (и следовательно меньшего объема) по сравнению со стандартными формами пролекарства арипипразола. Это гарантирует сведение к минимуму дискомфорта пациента при введении препарата.
Композиция по настоящему изобретению может также включать адъюванты, например консервирующие, смачивающие, эмульгирующие агенты и средства, способствующие распределению препарата. Предотвращение роста микроорганизмов можно обеспечить различными антибактериальными и противогрибковыми агентами, такими как парабены, хлорбутанол, фенол, сорбиновая кислота и т.п. Также может быть желательно включать в состав изотонические агенты, такие как сахара, хлорид натрия и т.п. Продолжительной абсорбции фармацевтической формы для инъекций можно добиться применением агентов, замедляющих абсорбцию, например, моностеарата алюминия и желатина.
Все общедоступные документы, упомянутые в тексте заявки, включая, но не ограничиваясь этим, патенты США, конкретно включены в настоящую заявку посредством ссылки.
ПРИМЕРЫ
Приведенные ниже примеры включены в заявку для иллюстрации настоящего изобретения. Однако следует понимать, что настоящее изобретение не ограничено конкретными условиями и деталями, описанными в этих примерах.
Все величины, указанные в процентных долях (%), относятся в настоящей заявке к массовым процентам (% масса/масса), т.е. масса компонента выражена в процентах от общей массы полученного образца.
Термин ʺHoribaʺ относится к анализатору размеров частиц Horiba LA 910 или LA 950 (Horiba Instruments, Irvine, California, USA).
Во всех приведенных ниже примерах измельчение осуществляли на мельнице NanoMill® 0,01 (Alkermes Pharma Ireland Limited), которая имеет размер камеры 10 мл, 50 мл или 100 мл с применением измельчающей среды Polymill® 50 мкм или 100 мкм, которая поставляется Dow Chemical Co., Michigan, United States (PolyMill® является зарегистрированной торговой маркой Alkermes Pharma Ireland Limited).
Если не указано иное, материалы получали из следующих источников: поставка полисорбата 20, цитрата натрия и хлорида натрия осуществлялась AvantorTM Performance Materials под их брендом J.T.Baker®. Avantor Performance Materials, Inc., Philadelphia, USA. Фосфатный буферный солевой раствор подставлялся либо EMD Millipore в случае дигидрата одноосновного фосфата натрия (NaH2PO4⋅2H2O) или AvantorTM Performance Materials, J.T.Baker® в случае безводного двухосновного фосфата натрия (NaH2PO4). Аргинин⋅HCl поставлялся Sigma-Aldrich Co.LLC, St.Louis, MO, USA. Арипипразола лауроксил и арипипразола кавоксил можно получать, как описано в патенте США 8 431 576. Каждый из описанных ниже составов получали из твердых частиц, в случае арипипразола кавоксила размер частиц до измельчения (Dv50) превышал 8 микронов, и в случае арипипразола лауроксила размер частиц до измельчения (Dv50) превышал 10 микронов.
В некоторых случаях для обозначения отдельных компонентов композиции используются сокращения. Например, PS20 означает полисорбат 20, PBS означает фосфатный буферный солевой раствор, CBS означает цитратный буферный солевой раствор. Все печатные публикации, упомянутые в настоящей заявке, включая, но не ограничиваясь этим, патенты, конкретно включены в заявку посредством ссылки.
Пример 1: Исследование на грызунах
Цель настоящего исследования заключалась в сравнении фармакокинетических свойств дисперсии арипипразола кавоксила, имеющей объемный размер частиц (Dv50) менее 200 нм, со свойствами дисперсии арипипразола кавоксила с частицами более крупного размера.
Получали три образца по следующим методикам.
Состав 1 получали, выполняя следующие стадии. Вначале получали 4,66 г первичной суспензии, содержащей 13,6% (масс/масс) арипипразола кавоксила и 1,6% (масс/масс) полисорбата 20. Затем эту смесь разбавляли, добавляя 10 мМ буферный раствор, полученный из 0,8% (масс/масс) полисорбата 20 в фосфатном солевом буфере. Затем суспензию переносили в мельницу NanoMill 0,01, снабженную 10 мл камерой и прямым валом. Вначале суспензию перемешивали вручную с помощью шпателя. Композицию измельчали в течение 60 минут на скорости 2500 об/мин (оборотов в минуту). Температура при измельчении составляла 15°C. Полученную смесь собирали, используя пробирки Vectaspin в течение 10 минут при температуре 10°C и скорости 2500 об/мин. Конечная композиция по данным анализа активности включала 8,39% (масс/масс) арипипразола кавоксила, 1,6% (масс/масс) полисорбата 20, 10 мМ фосфатный буфер и 0,8% (масс/масс) хлорида натрия. Отношение количества лекарственного средства к количеству стабилизатора поверхности составляло примерно 5:1. Проводили анализ размеров частиц на приборе Horiba LA950, используя воду в качестве среды для наблюдения (DDH20 при 79%T; RI=1,57-0,01i), и определяли, что средний размер частиц в композиции составляет 127 нм, при значении Dv90 194 нм, Dv50 120 нм и Dv10 73 нм.
Состав 2 (препарат сравнения) получали для сравнения, причем он включал частицы большего размера, чем композиция по настоящему изобретению. Вначале готовили первичную суспензию 13,6% (масс/масс) кристаллов арипипразола кавоксила и 1,6% (масс/масс) полисорбата 20 и перемешивали в течение 1 часа. Затем ее разбавляли буферным солевым раствором, содержащим 1,6% (масс/масс) полисорбата 20 и фосфатный солевой буфер, до желаемой активности (содержания действующего вещества). Конечная композиция содержала примерно 8,8% (масс/масс) арипипразола кавоксила, 1,6% (масс/масс) полисорбата 20, 10 мМ фосфатный солевой буфер и 0,8% (масс/масс) хлорида натрия. Определяли, что конечная композиция имеет pH 6,9 при осмоляльности 279. Анализ размера частиц проводили на приборе Horiba LA910, причем средой для наблюдения служила вода с 0,1% (масс/масс) полисорбата 20. Перед этим анализом композицию обрабатывали ультразвуком в течение 1 минуты. Определяли, что композиция имеет средний размер частиц 28000 нм (28 мкм), при значении Dv90 52800 нм (52,8 мкм) и Dv10 3774 нм (3,8 мкм).
Состав 3 (препарат сравнения) представлял собой другую композицию, имеющую параметры, отличные от настоящего изобретения. Этот состав включал 8,3% (масс/масс) арипипразола кавоксила, 2% (масс/масс) карбоксиметилцеллюлозы, 0,2% (масс/масс) полисорбата 20, 10 мМ фосфатный буфер и 0,6% (масс/масс) хлорида натрия. Композицию обрабатывали ультразвуком в течение 1 минуты, после чего проводили анализ размеров частиц на приборе Horiba LA910, используя смесь воды и 0,1% (масс/масс) полисорбата 20 в качестве среды для определения размера частиц. Определяли, что средний размер частиц композиции составлял 26 200 нм (26,2 мкм), при Dv10 3616 нм (3,6 мкм) и Dv90 51260 нм (51,3 мкм).
Все три состава перед введением хранили при комнатной температуре. Для эксперимента использовали шесть особей крыс. Композиции вводили внутримышечно в суммарной дозировке примерно 20 мг, концентрации действующего вещества 65 мг/мл и объеме дозы 0,3 мл.
Фармакокинетические свойства, измеренные в виде концентрации арипипразола в плазме, показаны ниже в таблице 1.
Таблица 1: Средние концентрации арипипразола
Кривые средних концентраций арипипразола для составов 1, 2 (препарат сравнения) и 3 (препарат сравнения) показаны на фиг.2. Это исследование продемонстрировало, что состав арипипразола кавоксила по настоящему изобретению (состав 1) обеспечил значительное изменение Tmax, наблюдаемое in vivo. Для этого состава Tmax сократилось со 168 часов, что наблюдалось для состава сравнения с более крупным размером частиц, до 6 часов в случае композиции по настоящему изобретению с размером частиц менее 1000 нм (т.е. уменьшение Tmax в 28 раз или на 96%).
Пример 2: Исследование на грызунах (сравнительный пример)
Следующее исследование на грызунах было выполнено в качестве сравнительного примера для определения фармакокинетических свойств дисперсии арипипразола кавоксила, имеющей размер частиц, несколько превышающий 1000 нм.
Состав 4 (препарат сравнения) получали по следующей методике. Готовили первичную суспензию, состоящую из 30% (масс/масс) арипипразола кавоксила 1,6% (масс/масс) полисорбата 20 и воды. Полученный продукт перемешивали в течение 5-10 минут, после чего переносили в мельницу NanoMill 0,01, снабженную 10 мл камерой и прямым валом. Затем добавляли 500 мкм среду для измельчения PolyMill до содержания среды 69% (масс/масс) (4,21 г среды). Полученную смесь подвергали измельчению при 150 об/мин от 45 до 60 минут при 15°C. Концентрация арипипразола кавоксила в собранной композиции составляла 29% (масс/масс) в 1,6% (масс/масс) полисорбате 20. Затем полученный состав разбавляли до желаемой активности буферным раствором, содержащим 1,6% (масс/масс) полисорбата 20 и 10 мМ фосфатный солевой буфер. Итоговая композиция включала 7,9% (масс/масс) арипипразола кавоксила, 1,65 (масс/масс) полисорбата 20 в фосфатном солевом буфере и имела значение pH 7,03, и осмоляльность 253. Анализ размеров частиц проводили на приборе Horiba 950, используя воду в качестве разбавителя (RI=1,57-0,01i); причем было установлено, что средний размер частиц составлял 1080 нм, Dv90 был равен 1 740 нм и Dv50 был равен 1030 нм. Содержание свободного компонента стабилизатора поверхности было определено равным 21 мкг/мл.
Исследование было выполнено на четырех особях крыс. Композицию вводили внутримышечно, причем суммарная доза составляла 20 мг, и объем дозы равнялся 0,3 мл.
Значения средней концентрации арипипразола, измеренные в цельной крови, показаны в таблице 2 ниже по тексту. Эти значения отображены в виде кривой концентрации, приведенной на фиг.2, так, чтобы их можно было сравнивать с соответствующими кривыми концентрации, полученных для составов 1-3 примера 1.
Таблица 2: Средние концентрации арипипразола
Данные, полученные в этом исследовании, демонстрируют, что состав арипипразола кавоксила, имеющий размер частиц несколько превышающий 1 мкм, демонстрирует фармакокинетические свойства, которые очень сходны с наблюдавшимися in vivo для состава 2 (препарата сравнения) и состава 3 (препарата сравнения), где оба указанных состава имели размеры частиц на порядки величины превышающие размеры частиц по настоящему изобретению.
Пример 3: Исследование на грызунах
Цель настоящего исследования заключалась в сравнении фармакокинетических характеристик композиций арипипразола кавоксила, имеющих размер частиц от 200 до 1000 нм.
Составы 5 и 6 получали с помощью методик, которые подробно изложены ниже.
Для получения состава 5 готовили первичную суспензию (общей массой 5,86 г), содержащую 15% (масс/масс) арипипразола кавоксила, 1,6% (масс/масс) полисорбата 20 и воду. Добавляли среду для измельчения PolyMill 500 мкм, общее количество составляло 4,21 г (т.е. содержание среды 69%). Полученную смесь переносили в мельницу NanoMill 0,01, снабженную 10 мл камерой и прямым валом, и перемешивали вручную в течение 5-10 минут, используя шпатель. Композицию подвергали измельчению при 2500 об/мин в течение 55 минут при 15°C. Затем измельченную композицию собирали, используя пробирки Vectaspin. Концентрация компонентов в собранной композиции составляла 13,7% (масс/масс) арипипразола кавоксила, 1,6% (масс/масс) полисорбата, а остальную массу составляла вода. Затем полученный состав разбавляли до желаемой активности буферным раствором, состоящим из 1,6% (масс/масс) полисорбата 20 и 10 мМ фосфатного солевого буфера. Конечная композиция включала 8,4% (масс/масс) арипипразола кавоксила, 1,6% (масс/масс) полисорбата 20 и фосфатный солевой буфер; она имела значение pH 6,9 и осмоляльность 287 мОсм/кг. Анализ размеров частиц проводили на приборе Horiba 950, используя воду в качестве разбавителя (RI=1,57-0,01i); и определяли, что средний размер частиц в композиции составляет 245 нм, при Dv90 459 нм, Dv50 200 нм и Dv10 91 нм.
Для получения состава 6 готовили первичную суспензию (общей массой 5,86 г), включающую 15% (масс/масс) арипипразола кавоксила и 1,6% (масс/масс) полисорбата 20 в воде. Добавляли среду для измельчения PolyMill 500 мкм (т.е. количество среды 69% (масс/масс) или 4,21 г). Полученную суспензию помещали в мельницу NanoMill 0,01, снабженную 10 мл камерой и прямым валом, и перемешивали в течение 5-10 минут, используя шпатель. Затем композицию подвергали измельчению при 1500 об/мин в течение 45 минут и собирали, используя шприц. Определяли, что концентрация соответствующих компонентов в собранной композиции составляла 12,9% (масс/масс) арипипразола кавоксила, 1,6% (масс/масс) полисорбата, причем остальную массу составляла вода. Полученный состав разбавляли до желаемой активности буферным раствором, который также содержал 1,6% (масс/масс) полисорбата 20 и 10 мМ фосфатный солевой буфер. Конечная композиция включала 8,1% (масс/масс) арипипразола кавоксила и 1,65% (масс/масс) полисорбата 20 в фосфатном солевом буфере. Измеренное значение pH равнялось 7,0, и осмоляльность составляла 281 мОсм/кг. Анализ размеров частиц на приборе Horiba 950 с использованием воды в качестве среды для определения размера частиц (RI=1,57-0,01i) позволил определить, что средний размер частиц в композиции составляет 475 нм, при Dv90 942 нм, Dv50 363 нм и Dv10 143 нм.
Исследование проводили с использованием 4 особей крыс. Композиции вводили внутримышечно, причем суммарная доза составляла 20 мг, и объем дозы равнялся 0,3 мл. Средние концентрации арипипразола, измеренные in vivo в плазме в различные моменты времени, приведены в таблице 3 и построены в виде кривых концентрации арипипразола, показанных на фиг.3
Таблица 3: Средние концентрации арипипразола
Результаты этого исследования позволяют предположить, что частицы меньшего размера обеспечивают более высокие уровни арипипразола.
Пример 4: Исследование на грызунах
Исследование было посвящено поведению арипипразола лауроксила в моделях in vivo. Цель исследования заключалась в том, чтобы выяснить, можно ли в случае арипипразола лауроксила добиться изменения фармакокинетических свойств (например, уменьшения времени до начала действия или Tmax) путем уменьшения размера частиц до величины менее 1000 мкм. В исследовании сравнивали фармакокинетические свойства составов арипипразола лауроксила, размер частиц которых находился в диапазоне по настоящему изобретению, с составами арипипразола лауроксила, размеры частиц которых находились за пределами диапазона, установленного в настоящем изобретении.
Состав 7 включал арипипразола лауроксил, и его получали по следующей методике. Вначале получали 5,86 г первичной суспензии, содержащей 30% (масс/масс) арипипразола лауроксила, 2% (масс/масс) полисорбата 20 и воду. Полученную суспензию перемешивали в течение 5-10 минут, после чего измельчали на мельнице NanoMill 0,01, снабженной 10 мл емкостью и прямым валом. Использовали среду для измельчения PolyMill 500 мкм (добавляли 4,21 г, содержание среды 69% (масс/масс)). Композицию измельчали при 2500 об/мин в течение 35 минут при 15°C. После сбора продукта, измельченную композицию разбавляли до желаемой активности водой и 10 мМ цитратным солевым буфером. Готовая композиция включала 9,2% (масс/масс) арипипразола лауроксила, 0,67% (масс/масс) полисорбата 20 в 10 мМ цитратном солевом буфере. Определяли, что pH композиции составляет 6,6 и осмоляльность равна 281 мОсм/кг. Определение размера частиц проводили на приборе Horiba 950, используя воду в качестве разбавителя (RI: 1,62-0,01i), и установили, что средний размер частиц составляет 174 нм, при значении Dv90 286 нм, Dv50 157 нм и Dv10 82 нм.
Составы 8 и 9 получали из такой же первичной суспензии, и они отличались тем, что состав 9 получали без добавления каких-либо буферов, средств для регулирования тоничности или гипотонических веществ. Первичная суспензия для обоих составов 8 и 9 содержала 30% (масс/масс) арипипразола лауроксила, 2% (масс/масс) полисорбата 20 и воду. Суммарная масса первичной суспензии составляла 5,86 г. Суспензии перемешивали в течение 5-10 минут, после чего измельчали на мельнице NanoMill 0,01, снабженной 10 мл емкостью и прямым валом. Средой для измельчения являлась PolyMill 500 мкм (добавляли 4,21 г, содержание среды составляло 69% (масс/масс)). Композицию измельчали при 2500 об/мин в течение 30 минут при 15°C. После сбора продукта, в случае состава 8 измельченную композицию разбавляли до желаемой активности 10 мМ цитратным солевым буфером. Конечная композиция содержала 9,56% (масс/масс) арипипразола лауроксила и 0,67% (масс/масс) полисорбата 20 в 10 мМ цитратном солевом буфере. Значение pH составляло 6,3, и осмоляльность равнялась 229 мОсм/кг. Определение размера частиц проводили на приборе Horiba 950, используя воду в качестве разбавителя (RI: 1,62-0,01i), и установили, что средний размер частиц составляет 687 нм, при значении Dv50 649 нм, Dv90 1134 нм и Dv10 284 нм. Разбавление состава 9 осуществляли только водой. Конечная композиция содержала 9,41% (масс/масс) арипипразола лауроксила и 0,67% (масс/масс) полисорбата 20 в воде, и имела значение pH 6,4. Распределение размеров частиц было очень сходно с описанным выше составом 8 (средний размер частиц составлял 584 нм, при Dv50 549 нм, Dv90 961 нм и Dv10 261 нм).
Состав 10 представлял собой препарат сравнения, который не подвергали измельчению, и он включал 10% (масс/масс) арипипразола лауроксила +2% (масс/масс) полисорбата 20 (LSC12-226) в цитратном солевом буфере. Перед введением композицию получали и перемешивали в течение ночи. Значение pH готовой композиции составляло 6,2 при осмоляльности 264 мОсм/кг. Средний размер частиц по данным измерений составлял 17 000 нм, при Dv90 28 300 нм, Dv50 14 200 нм и Dv10 7 500 нм.
Составы вводили крысам, и подробности введения приведены ниже в таблице 4. В столбце, озаглавленном «доза ARI (мг)» приведены значения эквивалентных доз арипипразола в миллиграммах.
Таблица 4: Сводка деталей исследования на грызунах
2500 об/мин
Средние значения уровней арипипразола, измеренные in vivo в различные моменты времени, приведены ниже в таблице 5. Кроме того, эти значения отображены графически на фиг.4
Таблица 5: Средние концентрации арипипразола
Приведенные в таблице результаты показывают, что уменьшение размеров частиц арипипразола лауроксила до значений менее 1000 нм позволяет добиться более быстрого начала действия и уменьшения значения Tmax относительно препарата сравнения с частицами более крупного размера с Dv50 14200 нм (состав 10). Такие свойства полезны для получения составов начального этапа введения. Проведенное исследование обеспечивает основу для дальнейших исследований арипипразола лауроксила, в которых будет исследован эффект размера частиц в диапазоне до 1000 нм.
Пример 5: Исследование на собаках
Цель данного эксперимента заключалась в исследовании соответствующих фармакокинетических профилей, полученных для композиций арипипразола лауроксила, имеющих размер частиц примерно 350 нм, примерно 450 нм и смеси частиц различных размерных групп при введении собакам in vivo.
Состав 11: Получали первичную суспензию (в количестве 73 г), которая включала 30% (масс/масс) арипипразола лауроксила, 2% (масс/масс) полисорбата 20 и воду. Эту смесь измельчали на мельнице NanoMill® 0,01, снабженной контейнером 50 мл и валом со штифтами при 300 об/мин в течение 5 минут и при 1300 об/мин в течение 330 минут. Использовали 500 мкм среду для измельчения PolyMill, причем общее количество среды составляло 69% (масс/масс). Полученную смесь собирали вручную в вытяжном шкафу с ламинарным потоком, используя 5 мл шприц и иглу 23 калибра, определяли активность (содержание действующего вещества) и затем разбавляли. Итоговая композиция включала 14,3% (масс/масс) арипипразола лауроксила и 1% (масс/масс) полисорбата 20 в 10 мМ цитратом солевом буфере, имела значение pH 6,3 и осмоляльность 320 мОсм/кг. Анализ размеров частиц проводили на приборе Horiba 950 (средой служила вода), причем было установлено, что средний размер частиц составляет 395 нм, при Dv90 623 нм, Dv50 368 нм и Dv10 205 нм.
Состав 12: Получали первичную суспензию (в количестве 73 г), которая включала арипипразола лауроксил 30% (масс/масс), 2% (масс/масс) полисорбата 20 в качестве стабилизатора поверхности и воду. В качестве буфера добавляли 1,6% (масс/масс) аргинин⋅HCl. Эту композицию измельчали на мельнице NanoMill® 0,01, снабженной контейнером 50 мл и валом со штифтами, используя 500 мкм среду для измельчения PolyMill, причем общее количество среды составляло 69% (масс/масс). Температуру при измельчении поддерживали на уровне 15°C. Композицию измельчали при 300 об/мин в течение 5 минут и при 1300 об/мин в течение 335 минут. Измельченную композицию собирали вручную в вытяжном шкафу с ламинарным потоком, используя 5 мл шприц и иглу 23 калибра, определяли активность и затем разбавляли. Композицию разбавляли до желаемой активности раствором аргинин⋅HCl. Итоговая композиция включала 14,9% (масс/масс) арипипразола лауроксила, 1% (масс/масс) полисорбата 20 и 1,6% (масс/масс) гидрохлорида аргинина. Анализ размеров частиц проводили на приборе Horiba 950, используя воду в качестве среды, причем было установлено, что средний размер частиц составляет 465 нм, при Dv90 794 нм, Dv50 447 нм и Dv10 231 нм. Измеренное значение pH составляло 5,7, и осмоляльность равнялась 182 мОсм/кг.
Состав 13: Эту композицию получали для выяснения свойств композиции по настоящему изобретению, в которой композиция начального этапа введения смешана с компонентом, имеющим более крупный размер частиц. Смесь частиц различных размерных групп получали смешиванием частиц состава 11 с частицами размером 19000 нм. Частицы микронного размера получали смешиванием 30% (масс/масс) арипипразола лауроксила с 2% (масс/масс) полисорбатом и выдерживанием смеси в течение ночи.
Частицы состава 11 и частицы микронного размера смешивали в массовом отношении 1:1 и разбавляли до желаемой концентрации цитратным солевым буфером. Итоговая композиция включала 73,5 мг/мл состава 11, 73,5 мг/мл частиц микронного размера, 10 мМ CBS и воду. Вводимая композиция суммарно включала 10,3% (масс/масс) арипипразола лауроксила, 1% (масс/масс) полисорбата 20 в цитратном солевом буфере, имела значение pH 6,6 и осмоляльность 324 мОсм/кг.
Порции составов 11, 12 и 13 сохраняли для исследования стабильности. Данные тестов на стабильность приведены ниже в таблице 6. Приведенные данные указывают на стабильность композиции в течение трехмесячного периода исследования.
Таблица 6: Стабильность составов 11-13 в течение 3-месячного периода
Количество собак, которым вводили препараты в рамках данного исследования, составляло 4 особи на каждый состав. Препараты вводили животным внутримышечно. Образцы для фармакокинетического анализа отбирали регулярно с момента введения и вплоть до 672 часов (28 дней) после введения.
Измеряли концентрацию арипипразола в каждом образце. Средние фармакокинетические параметры (для всех собак в исследовании), измеренные в цельной крови, представлены ниже в таблице 7.
Таблица 7: Фармакокинетические параметры (Арипипразол)
Приведенные в таблице результаты показывают, что составы 11, 12 и 13 демонстрируют пониженное время достижения Tmax по сравнению с составами, имеющими размер частиц примерно 20 микронов. Для состава 11 наблюдается относительно быстрое появление высоких концентраций молекул пролекарства. Для состава 13 наблюдается быстрое повышение концентрации арипипразола с последующим продолжительным сохранением концентрации арипипразола с течением времени. На фиг.5 отображены средние концентрации арипипразола, измеренные in vivo.
Пример 6: Исследования на собаках
Основываясь на описанных данных предыдущего исследования, которые демонстрируют, что фармакокинетические свойства композиции по настоящему изобретению включают более быстрое начало действия и уменьшенное время Tmax, по сравнению с композициями, содержащими частицы пролекарства арипипразола более крупного размера, цель настоящего исследования заключалась в более конкретном исследовании влияния применения частиц пролекарства арипипразола различного размера в диапазоне до 1000 нм, которые характеризуют композиции по настоящему изобретению. Кроме того, это исследование направлено на определение фармакокинетического профиля, который можно получить при применении смеси состава с размером частиц, указанных в настоящем изобретении (менее 1000 нм), с составом, включающим частицы арипипразола лауроксила более крупного размера.
Состав 14: Получали первичную суспензию (в количестве 53 г), включающую 13% (масс/масс) арипипразола лауроксила и 1,3% (масс/масс) полисорбата 20, который использовался в качестве стабилизатора поверхности. Т.е. отношение арипипразола лауроксила к стабилизатору поверхности составляло примерно 10:1. В качестве буфера добавляли 10 мМ цитратный солевой буфер. Композицию измельчали на мельнице NanoMill 0,01, снабженной камерой объемом 100 мл, с использованием прямого вала (без штифтов) при скорости измельчения 973 об/мин в течение 240 минут при температуре 15°C. Использовали среду для измельчения PolyMill размером 500 мкм, и количество этой среды составляло 69%. Анализ размеров частиц в полученной композиции на приборе Horiba LA950 позволил определить, что средний размер частиц составлял 110 нм, при значении Dv90 164 нм, Dv50 103 нм и Dv10 67 нм.
Состав 15: Вначале получали первичную суспензию (в количестве 5,86 г), включающую 15% (масс/масс) арипипразола лауроксила и 1% (масс/масс) полисорбата 20, который использовался в качестве стабилизатора поверхности. Т.е. общее отношение арипипразола лауроксила к стабилизатору поверхности составляло примерно 15:1. В качестве буфера добавляли цитратный солевой буфер. Композицию измельчали на мельнице NanoMill 0,01, снабженной камерой объемом 10 мл, с использованием прямого вала при скорости измельчения 2500 об/мин в течение 105 минут при температуре 15°C. Использовали среду для измельчения PolyMill размером 500 мкм, и количество этой среды составляло 69%. Средний размер частиц полученной композиции согласно измерениям на приборе Horiba LA950, составлял 192 нм, при значении Dv90 347 нм, Dv50 153 нм и Dv10 77 нм.
Состав 16: представлял собой смесь 100 мг композиции, имеющей объемный размер частиц (Dv50) примерно 100 нм (состав 16 выше), со 100 мг композиции с более крупными частицами арипипразола лауроксила со средним размером (Dv50) примерно 20 мкм (20000 нм). В качестве буфера добавляли цитратный солевой буфер.
Состав 17: Получали первичную суспензию (53 г), включающую 13% (масс/масс) арипипразола лауроксила. В качестве стабилизатора поверхности добавляли полисорбат 1,3% (масс/масс) и декстрозу 2% (масс/масс). Суммарное отношение арипипразола лауроксила к стабилизатору поверхности составляло примерно 10:1. В качестве буфера добавляли аргинин. Измельчение композиции осуществляли с использованием мельницы NanoMill 0,01, снабженной камерой объемом 100 мл, с использованием прямого вала. Скорость работы мельницы составляла 973 об/мин и композицию измельчали в течение 240 минут при 15°C. Средой для измельчения являлась 500 мкм среда PolyMill. Количество этой среды составляло 69%. Средний размер частиц, измеренный на приборе Horiba LA950, составлял 105 нм, при значении Dv90 155 нм, Dv50 97 нм и Dv10 65 нм.
В исследованиях было задействовано в общей сложности по 4 собаки на каждый состав, и все препараты вводили внутримышечно. Состав 14 вводили в количестве, эквивалентном 100 мг арипипразола или 147 мг арипипразола лауроксила, и объем дозы составлял 1,1 мл на одно животное. Состав 15 вводили в количестве, эквивалентном 100 мг арипипразола или 147 мг арипипразола лауроксила, и объем дозы составлял 1 мл на одно животное. Состав 16 вводили в количестве, эквивалентном 200 мг арипипразола (по 100 мг частиц каждого типа в смеси) или 147 мг арипипразола лауроксила, и объем дозы составлял 2,1 мл на животное. Состав 17 вводили в количестве, эквивалентном 100 мг арипипразола или 147 мг арипипразола лауроксила, и объем дозы составлял 1,1 мл на одно животное. Образцы для фармакокинетического анализа регулярно отбирали после введения препаратов и вплоть до 672 часов (28 дней) после введения.
Отобранные образцы цельной крови подвергали анализу. Измеряли концентрацию арипипразола лауроксила и арипипразола. Средние значения концентраций арипипразола показаны ниже в таблице 8.
Таблица 8: Средние концентрации арипипразола для составов 14-17
Таблица 9: Фармакокинетические параметры для арипипразола
Таблица 10: Фармакокинетические параметры для арипипразола лауроксила (пролекарства)
На Фиг.6 приведены средние концентрации арипипразола, измеренные in vivo в организмах собачьих моделей для составов 14-17. Было отмечено, что все составы 14-17 характеризуются уменьшенным временем начала действия и Tmax по сравнению с составом арипипразола лауроксила с размером частиц приблизительно 20 микронов.
Пример 7: Исследование на собаках
Цель настоящего примера заключалась в определении фармакокинетических параметров различных композиций арипипразола в организмах животных моделей. Исследование было направлено, в том числе, на влияние дозировки и количество стабилизатора поверхности на уровни пролекарства арипипразола, измеренные in vivo у собак.
Состав 18: Вначале получали первичную суспензию (116 г) в которой в качестве стабилизатора поверхности применяли полисорбат 20 в количестве 2% (масс/масс). Цитратный буфер применяли в количестве 15:1. Измельчение композиции проводили с помощью мельницы NanoMill 0,01 с камерой объемом 100 мл и валом, снабженным штифтами. Измельчение на первом этапе проводили при скорости 3100 об/мин в течение 45 минут и затем 700 об/мин в течение 20 минут. Температура при измельчении составляла 15°C. Использовали среду для измельчения PolyMill 500 мкм. Количество среды составляло 89%. Общее количество действующего вещества в дозе было эквивалентно 100 мг арипипразола. При измерении распределения размеров частиц после получения состава было обнаружено, что значение Dv90 составляет 296,8 нм, значение Dv50 равно 166,1 нм, и значение Dv10 равно 84,0 нм.
Состав 19: Вначале получали неочищенную суспензию (58 г), в которой в качестве стабилизатора поверхности использовался полисорбат 20 при содержании 1% (масс/масс). Цитратный буфер применялся в количестве 28:1. Измельчение проводили на мельнице NanoMill 0,01 с камерой 50 мл и валом, снабженным штифтами. Скорость работы мельницы составляла 962 об/мин в течение 180 мин, после чего ее снизили до 450 об/ми и продолжали измельчение еще 60 минут. Измельчение проводили при температуре от 8 до 10°C. Использовали среду для измельчения PolyMill 500 мкм. Общее количество среды составляло 89%. Общее содержание действующего вещества в дозе было эквивалентно 300 мг арипипразола. По итогам измерения распределения размеров частиц, которое проводили после получения состава, было обнаружено, что значение Dv90 составляет 679,1 нм, значение Dv50 равно 242,6 нм, и значение Dv10 равно 88,1 нм.
Состав 20: Вначале получали первичную суспензию (116 г), в которой в качестве стабилизатора поверхности применяли полисорбат 20 в количестве 2% (масс/масс). Цитратный буфер применяли в количестве 15:1. Измельчение композиции проводили с помощью мельницы NanoMill 0,01 с камерой объемом 100 мл и валом, снабженным штифтами. Скорость работы мельницы составляла 3100 об/мин в течение 45 минут и затем 700 об/мин в течение 20 минут. Температура при измельчении составляла 15°C. Использовали среду для измельчения PolyMill 500 мкм. Количество среды составляло 89%. Общее количество действующего вещества в дозе было эквивалентно 300 мг арипипразола. При измерении распределения размеров частиц после получения состава было обнаружено, что значение Dv90 составляет 296,8 нм, значение Dv50 равно 166,1 нм, и значение Dv10 равно 84,0 нм.
Состав 21: Вначале получали первичную суспензию (116 г) в которой в качестве стабилизатора поверхности применяли полисорбат 20 в количестве 3% (масс/масс). Цитратный буфер применяли в количестве 10:1. Измельчение композиции проводили с помощью мельницы NanoMill 0,01 с камерой объемом 100 мл и валом, снабженным штифтами. Скорость работы мельницы составляла 3100 об/мин в течение 4 минут, затем ее снижали до 389 об/мин в течение 50 минут, затем повышали до 3100 об/мин в течение 40 минут и, наконец, снижали до 450 об/мин на 90 минут. Температура при измельчении составляла 8°C. Использовали среду для измельчения PolyMill 500 мкм. Суммарное количество среды составляло 89%. Общее количество действующего вещества в дозе было эквивалентно 300 мг арипипразола. При измерении распределения размеров частиц после получения состава было обнаружено, что значение Dv90 составляет 361,8 нм, значение Dv50 равно 151,8 нм, и значение Dv10 равно 76,4 нм.
Состав 22: Вначале получали первичную суспензию (116 г) в которой в качестве стабилизатора поверхности применяли полисорбат 20 в количестве 2% (масс/масс). Фосфатный и натрий цитратный буфер применяли в количестве 15:1. Измельчение композиции проводили с помощью мельницы NanoMill 0,01 с камерой объемом 100 мл и валом, снабженным штифтами. Скорость работы мельницы вначале составляла 3100 об/мин в течение 45 минут и затем ее понижали до 700 об/мин на 20 минут. Температура при измельчении составляла 15°C. Использовали среду для измельчения PolyMill 500 мкм. Количество среды составляло 89%. Общее количество действующего вещества в дозе было эквивалентно 300 мг арипипразола. При измерении распределения размеров частиц после получения состава было обнаружено, что значение Dv90 составляет 306 нм, значение Dv50 равно 171 нм, и значение Dv10 равно 86 нм.
Состав 23: Вначале получали первичную суспензию (116 г), включавшую полисорбат 20 в количестве 2% (масс/масс), которой применяли в качестве стабилизатора поверхности. Цитратный буфер применяли в количестве 15:1. Измельчение композиции проводили с помощью мельницы NanoMill 0,01 с камерой объемом 100 мл и валом, снабженным штифтами. Скорость работы мельницы вначале составляла 3100 об/мин в течение 45 минут и затем ее снижали до 700 об/мин на 20 минут. Температура при измельчении составляла 15°C. Использовали среду для измельчения PolyMill 500 мкм. Общее количество среды составляло 89%. Общее количество действующего вещества в дозе было эквивалентно 700 мг арипипразола. При измерении распределения размеров частиц после получения состава было обнаружено, что значение Dv90 составляет 296,8 нм, значение Dv50 равно 166,1 нм и значение Dv10 равно 84,0 нм.
Состав 24: Вначале получали первичную суспензию (в количестве 116 г), включавшую полисорбат 20 в количестве 2% (масс/масс), которой применяли в качестве стабилизатора поверхности. Буфер цитрат/сахароза применяли в количестве 15:1. Измельчение композиции проводили с помощью мельницы NanoMill 0,01 с камерой объемом 100 мл и валом, снабженным штифтами. Скорость работы мельницы вначале составляла 3100 об/мин в течение 45 минут и затем ее снижали до 700 об/мин в течение 20 минут. Температура при измельчении составляла 15°C. Использовали среду для измельчения PolyMill 500 мкм. Общее количество среды составляло 89%. Общее количество действующего вещества в дозе было эквивалентно 300 мг арипипразола. При измерении распределения размеров частиц после получения состава было обнаружено, что значение Dv90 составляет 301 нм, значение Dv50 равно 168 нм и значение Dv10 равно 84 нм.
При исследовании каждого состава было задействовано в общей сложности 4 собаки. Все составы вводили внутримышечно. Дозировка состава 18 составляла 147 мг арипипразола лауроксила (эквивалентна 100 мг арипипразола), и объем вводимой дозы равнялся 0,67 мл на одно животное. Составы 19, 20, 21, 22 и 24 вводили в количестве, соответствующем 441 мг арипипразола лауроксила (что эквивалентно 300 мг арипипразола), и объем дозы составлял 2 мл на животное. Состав 23 вводили в количестве, соответствующем 1029 мг арипипразола лауроксила (что эквивалентно 700 мг арипипразола), и объем дозы составлял 4,7 мл на животное.
Средние концентрации арипипразола, измеренные в цельной крови, показаны ниже в таблице 11. Эти также значения отображены на графиках фиг.7 и 8. На фиг.7 непосредственно сопоставлены средние концентрации арипипразола, измеренные in vivo для составов 18, 20 и 23. На фиг.9 показано непосредственное сравнение средних концентраций арипипразола, измеренных in vivo для составов 19, 20 и 21.
Таблица 11: Средние концентрации арипипразола
Средние фармакокинетические параметры для уровней арипипразола, вычисленные для каждой группы, показаны ниже в таблице 12:
Таблица 12: Фармакокинетические параметры для арипипразола
На основании полученных результатов можно сделать следующие выводы относительно влияния уровня дозировки на содержание препарата в крови. Состав 18 содержал 100 мг дозу арипипразола, состав 23 содержал 700 мг дозу, и составы 19-22 и 24 содержали 300 мг дозу. Следует отметить, что повышение дозы действительно приводит к увеличению уровней арипипразола лауроксила (пролекарства), которые обнаруживаются в крови. Во-вторых, следует отметить, что измеренные уровни арипипразола повышались по мере увеличения дозировок.
Что касается влияния процентного содержания полисорбата 20 на общее поступление пролекарства в кровь, были сделаны следующие наблюдения. Состав 19 включал наименьший уровень полисорбата 20, а именно 1% (масс/масс) от общей массы композиции. Составы 18, 20, 22, 23 и 24 содержали более высокие уровни, а именно 2% (масс/масс), и состав 21 характеризовался наиболее высоким уровнем, равным 3% (масс/масс). Было обнаружено, что повышение процентного содержания полисорбата 20 в композиции приводило к повышению содержания свободного компонента во вводимом препарате. Соответственно, было обнаружено, что уровни арипипразола в крови повышаются с увеличением процентного содержания имеющегося полисорбата 20.
Пример 8: Исследование на собаках
Цель этого финального исследования на собаках заключалась в определении влияния размера частиц и отношения активного стабилизатора поверхности на уровни арипипразола лауроксила и арипипразола, измеренные у собак в цельной крови после однократной внутримышечной инъекции. Готовили образцы в основном из одних и тех же компонентов, в которых меняли или размер частиц арипипразола лауроксила и/или общее количество присутствующего стабилизатора поверхности. Составы получали по следующим методикам:
Состав 25 получали из первичной суспензии (в количестве 136 г), включавшей 26% (масс/масс) арипипразола лауроксила и 1,53% (масс/масс) полисорбата 20 в качестве стабилизатора поверхности (т.е. отношение действующего вещества к стабилизатору поверхности составляло примерно 17:1). К этой суспензии добавляли 10 мМ фосфатный солевой буфер (pH 6,8) и 26 мМ цитрат натрия. Среду для измельчения PolyMill размером 250 мкм добавляли в таком количестве, чтобы ее суммарное содержание составляло 80%. Суспензию помещали в 100 мл камеру мельницы NanoMill® 0,01, снабженную валом со штифтами и измельчали при 1000 об/мин в течение в общей сложности 1860 минут при температуре 5°C. Полученная композиция перед введением имела средний размер частиц 113 нм, Dv90 166 нм, Dv50 107 нм и Dv10 69 нм.
Состав 26 получали из первичной суспензии (в количестве 136 г), включавшей 26% (масс/масс) арипипразола лауроксила и 1,53% (масс/масс) полисорбата 20 в качестве стабилизатора поверхности (т.е. отношение действующего вещества к стабилизатору поверхности составляло примерно 17:1). К этой суспензии добавляли 10 мМ фосфатный солевой буфер (pH 6,8) и 26 мМ цитрат натрия. Среду для измельчения PolyMill размером 500 мкм добавляли в таком количестве, чтобы ее суммарное содержание составляло 80%. Суспензию измельчали в мельнице NanoMill® 0,01, снабженной 100 мл камерой и валом со штифтами при 1000 об/мин в течение 723 минут при температуре 5°C. Полученная композиция имела средний размер частиц 202 нм, Dv90 366 нм, Dv50 167 нм и Dv10 82 нм.
Вязкость состава 26 определяли при различных скоростях сдвига при температуре 25°C. При скорости сдвига 1 с-1 измеренная вязкость составила 9 сП. Профиль вязкости продемонстрировал истончение сдвига (снижение вязкости при сдвиге), где ньютоновская область находилась между 100 и 1000 с-1 при вязкости в диапазоне примерно 2,5-4 сП. Это исследование продемонстрировало, что состав 26 имеет благоприятные характеристики вязкости для состава, предназначенного для инъекций, где скорость сдвига как правило увеличивается при введении композиции. На фиг.18 приведена кривая зависимости вязкости от сдвига для состава 26.
Состав 27 получали из первичной суспензии (в количестве 136 г), включавшей 26% (масс/масс) арипипразола лауроксила и 1,53% (масс/масс) полисорбата 20 в качестве стабилизатора поверхности (т.е. отношение действующего вещества к стабилизатору поверхности составляло примерно 17:1). К этой суспензии добавляли 10 мМ фосфатный солевой буфер (pH 6,8), а также 26 мМ цитрат натрия. Добавляли среду для измельчения PolyMill размером 500 мкм, причем ее суммарное содержание составляло 80%. Суспензию помещали в 100 мл камеру мельницы NanoMill® 0,01, снабженную валом со штифтами, и измельчали при 1000 об/мин в течение в общей сложности 538 минут при температуре 5°C. Полученная композиция имела средний размер частиц 445 нм, Dv90 769 нм, Dv50 398 нм и Dv10 180 нм.
Состав 28 получали из первичной суспензии (в количестве 136 г), включавшей 26% (масс/масс) арипипразола лауроксила и 1,73% (масс/масс) полисорбата 20 в качестве стабилизатора поверхности (т.е. отношение действующего вещества к стабилизатору поверхности составляло примерно 15:1). К этой суспензии добавляли 10 мМ фосфатный солевой буфер (pH 6,8), а также 26 мМ цитрат натрия. Добавляли среду для измельчения PolyMill размером 250 мкм, до достижения суммарного содержания среды 80%. Суспензию измельчали в мельнице NanoMill® 0,01, снабженной 100 мл камерой и валом со штифтами, при 1000 об/мин в течение в общей сложности 1200 минут при температуре 5°C. Было обнаружено, что полученная композиция имела средний размер частиц 109 нм, Dv90 161 нм, Dv50 102 нм и Dv10 68 нм.
Состав 29 получали из первичной суспензии (в количестве 136 г), включавшей 26% (масс/масс) арипипразола лауроксила и 2,6% (масс/масс) полисорбата 20 в качестве стабилизатора поверхности (т.е. отношение действующего вещества к стабилизатору поверхности составляло примерно 10:1). К этой суспензии добавляли 10 мМ фосфатный солевой буфер (pH 6,8), а также 26 мМ цитрат натрия. Добавляли среду для измельчения PolyMill размером 250 мкм, в таком количестве, чтобы ее суммарное содержание составляло 80%. Суспензию помещали в 100 мл камеру мельницы NanoMill® 0,01, снабженную валом со штифтами, и измельчали при 1000 об/мин в течение в общей сложности 1200 минут при температуре 5°C. Было обнаружено, что полученная композиция имела средний размер частиц 113 нм, Dv90 168 нм, Dv50 106 нм и Dv10 68 нм.
Состав 30 получали из первичной суспензии (в количестве 136 г), включавшей 26% (масс/масс) арипипразола лауроксила и 1% (масс/масс) полисорбата 20 в качестве стабилизатора поверхности (т.е. отношение действующего вещества к стабилизатору поверхности составляло примерно 26:1). К этой суспензии добавляли 10 мМ фосфатный солевой буфер (pH 6,8), а также 26 мМ цитрат натрия. Добавляли среду для измельчения PolyMill размером 500 мкм, в таком количестве, чтобы ее суммарное содержание составляло 80%. Суспензию помещали в 100 мл камеру мельницы NanoMill® 0,01, снабженную валом со штифтами, и измельчали при 1000 об/мин в течение в общей сложности 90 минут при температуре 5°C. Было обнаружено, что полученная композиция имела средний размер частиц 449 нм, Dv90 765 нм, Dv50 407 нм и Dv10 184 нм.
Для каждого из описанных выше составов 25-30 экспериментально определяли содержание свободного стабилизатора поверхности и растворенного арипипразола лауроксила, используя ВЭЖХ анализ, причем результаты показаны ниже в таблице 13. В некоторых из составов количество свободного стабилизатора поверхности или растворенного арипипразола лауроксила было ниже предела обнаружения, что обозначено в таблице <LOD.
Таблица 13: Результаты определения свободного стабилизатора поверхности в композиции
% масс/масс
% масс/масс
Каждый из описанных выше составов 25-30 вводили внутримышечно 4 самцам собак. Для каждого состава дозировка на одно животное была эквивалентна 300 мг арипипразола или 441 мг арипипразола лауроксила. Для каждого из введенных образцов, целевой объем дозы составлял 1,6 мл на одно животное. Образцы цельной крови отбирали в следующие моменты времени с момента введения (часы): 0,25, 0,5, 1, 2, 3, 6, 12, 24, 36, 48, 60, 72, 120, 168, 240, 336, 408, 504, 576 и 672. Уровни арипипразола и арипипразола лауроксила определяли в цельной крови в указанные выше моменты времени, средние значения приведены ниже, соответственно в таблице 14 и таблице 15.
Таблица 14: Средние значения концентрации арипипразола
100 нм
17:1
200 нм
17:1
450 нм
17:1
100 нм
15:1
100 нм
10:1
450 нм
26:1
Таблица 15: Средние значения концентрации арипипразола лауроксила
100 нм
17:1
200 нм
17:1
450 нм
17:1
100 нм
15:1
100 нм
10:1
450 нм
26:1
Приведенные данные показывают, что в случае одинакового распределения размеров частиц (например, 100 нм), при увеличении количества стабилизатора поверхности в составе, уровни арипипразола лауроксила в крови повышаются. На фиг.11 и 16 показаны площади под кривой (AUC) для арипипразола лауроксила, определенные после внутримышечного введения собакам составов 25, 28 и 29. Аналогично, уровни арипипразола в крови возрастают как функция стабилизатора поверхности (фиг.17 и 12). Это объясняется тем фактом, что при фиксированном размере частиц, т.е. фиксированной площади поверхности, стабилизатор поверхности будет адсорбироваться на поверхности частиц до покрытия всей поверхности, причем любой избыток стабилизатора, присутствующий в носителе состава, именуется свободным (несвязанным) стабилизатором. По мере роста содержания свободного стабилизатора, повышается растворимость арипипразола лауроксила. Это подтверждается данными in vitro, показанными в таблице 13, и проиллюстрировано фиг.18. С увеличением растворимости арипипразола лауроксила растет его уровень в крови собаки, и вследствие этого растет содержание в крови арипипразола.
Аналогичное поведение наблюдалось также для составов 27 и 30 с более крупным размером частиц; т.е. меньшей площадью поверхности (фиг.13, 19A и 20).
Несмотря на то, что составы 25 и 30 имеют различный размер частиц, равный 100 нм и 450 нм, соответственно, два этих состава не вызывают появления обнаружимых количеств свободного полисорбата 20 или растворенного арипипразола лауроксила (фиг.21). Причина этого заключается в том, что различным является отношение количества лекарственного препарата к количеству стабилизатора. Состав 26 имеет то же отношение лекарственного вещества к стабилизатору, но более крупный размер частиц (меньшую площадь поверхности), как и состав 25. В результате состав 26 содержит большее количество свободного полисорбата 20 и характеризуется большим количеством растворенного арипипразола лауроксила (фиг.21).
На фиг.22 приведено сравнение AUC арипипразола лауроксила и арипипразола для составов 25, 26 и 30. Хотя состав 26 имеет меньший размер частиц, чем состав 25, уровни арипипразола лауроксила и арипипразола в крови выше для состава 26. Это происходит благодаря изменению отношения лекарственного средства к стабилизатору, которое приводит к различию в количествах свободного полисорбата 20 и, следовательно, количествах растворенного арипипразола лауроксила в составах. Такие изменения действительно позволяют преодолеть влияние размера частиц (площади поверхности) на растворение, за счет которого более мелкие частицы растворяются быстрее.
Аналогичную закономерность можно выявить при сравнении составов 25 и 30. Хотя составы 25 и 30 имеют существенно различающийся размер частиц, профили высвобождения этих двух составов в организмах собак являются сходными (фиг. 14, 15 и 19B).
На фиг.9 и фиг.10 отображены средние концентрации арипипразола лауроксила, измеренные in vivo для составов 25-27, в который отношение API к стабилизатору поверхности является постоянным, и меняется размер частиц. Состав 26 демонстрирует, что частицы промежуточного размера (200 мг) по сравнению с составом 25 (100 нм) и 27 (450 нм) на начальном этапе обеспечивает более высокие уровни арипипразола и арипипразола лауроксила в крови.
Пример 9
Для демонстрации того, что композиция по настоящему изобретению имеет стабильный размер частиц, была проведена серия исследований, некоторые из которых описаны ниже.
Состав 31 получали для оценки стабильности композиции по настоящему изобретению. Проводили исследование стабильности продолжительностью четыре недели, используя состав, включающий 20% арипипразола лауроксила. Отношение арипипразола лауроксила к стабилизатору поверхности составляло 14:1. Кроме того, в состав в качестве буфера добавляли 10 мМ фосфатный солевой буфер и 26 мМ цитратный солевой буфер. На фиг.17 изображен график, отражающий результаты измерения размера частиц в различные моменты времени, демонстрирующий стабильность состава 31. Как видно из данных, приведенных на графике, было обнаружено, что за период исследования композиция продемонстрировала очень небольшой прирост размеров частиц.
Помимо получения композиций, проводили также исследования стабильности для ряда других составов, результаты которых приведены ниже в таблице 16.
Таблица 16: 6-месячное исследование стабильности альтернативных составов
30% (масс/масс) API+ 2%(масс/масс) PS20
Цитрат-Сахароза
27% API+1,8%PS20+ цитратный буфер сахароза
27% API+1,8%PS20+ цитратный солевой буфер
30% API+2%PS20
27% API+1,8%PS20+ цитратный буфер сахароза
27% API+1,8%PS20+ цитратный солевой буфер
Пример 10
Хотя полисорбат 20 является предпочтительным выбором в качестве стабилизатора поверхности, настоящее изобретение можно также реализовать с применением альтернативных стабилизаторов поверхности. Для демонстрации этого готовили состав 32, который включал частицы арипипразола кавоксила, которые были стабилизированы бета-гидрокси циклодекстрином. Полученная композиция включала 5% масс/масс арипипразола кавоксила и 10% бета-гидрокси циклодекстрина. Готовая композиция имела размер частиц примерно 250 нм и, как было продемонстрировано, характеризовалась очень незначительным приростом размеров частиц за четырехнедельный период, как показано ниже в таблице 17.
Таблица 17: Исследование стабильности состава 32 в течение 4-недельного периода
Пример 11
В момент написания заявки, составы 33-36, которые обсуждаются ниже, должны вводиться пациентам в качестве части исследования на людях. Составы 33, 34 и 35 очень сходны с составами 25, 26 и 30, полученными для исследования на собаках, которые обсуждались выше в примере 8.
Состав 33 будет получен из первичной суспензии, включающей 26% масс/масс арипипразола лауроксила и 1,53% масс/масс полисорбата 20 в качестве стабилизатора поверхности (т.е. отношение действующего вещества к стабилизатору поверхности составит примерно 17:1). К этой суспензии будет добавлен 10 мМ фосфатный буфер (pH 6,8), а также 26 мМ цитратный солевой буфер. Состав будет измельчен способом, аналогичным составу 30, как описано выше, с получением итогового объемного размера частиц перед введением примерно 100 нм (+/- 50 нм).
Состав 34 будет получен из первичной суспензии, включающей 26% масс/масс арипипразола лауроксила и 1,53% масс/масс полисорбата 20 в качестве стабилизатора поверхности (т.е. отношение действующего вещества к стабилизатору поверхности составит примерно 17:1). К этой суспензии будет добавлен 10 мМ фосфатный буфер (pH 6,8), а также 26 мМ цитратный солевой буфер. Состав будет измельчен способом, аналогичным составу 31, как описано выше, с получением итогового объемного размера частиц перед введением примерно 200 нм (+/- 50 нм).
Состав 35 будет получен из первичной суспензии, включающей 26% масс/масс арипипразола лауроксила и 1% масс/масс полисорбата 20 в качестве стабилизатора поверхности (т.е. отношение действующего вещества к стабилизатору поверхности составит примерно 26:1). К этой суспензии будет добавлен 10 мМ фосфатный буфер (pH 6,8), а также 26 мМ цитратный солевой буфер. Состав будет измельчен способом, аналогичным составу 35, как описано выше, с получением итогового объемного размера частиц перед введением примерно 450 нм (+/- 50 нм).
Состав 36 будет получен из первичной суспензии, включающей 26% масс/масс арипипразола лауроксила, 1% масс/масс полисорбата 20 (что соответствует отношению действующее вещество:стабилизатор поверхности 26:1) в 10 мМ фосфатном буфере, pH 6,8. В качестве буфера будет добавляться 26 мМ цитратный солевой буфер. Описанная выше композиция будет измельчена таким способом, чтобы конечный размер частиц составлял примерно 900 нм (+/- 50 нм). Компоненты составов 33-36 подробно описаны ниже в таблице 18.
Таблица 18: Подробные сведения о составе композиций для исследований на людях
Предполагается, что каждая из описанных выше композиций продемонстрирует такие фармакокинетические свойства, как более быстрое начало действия и снижение значения Tmax, при введении людям, и, в частности, что время начала действия будет значительно улучшено по сравнению с составами с более крупным размером частиц, в частности составами арипипразола с частицами 20 мкм, описанными выше в примерах настоящей заявки.
Пример 12: Влияние дополнительного стабилизатора на PK в моделях из числа грызунов
Состав X получали из первичной суспензии (в количестве 5,86 г), включающей 15% масс/масс арипипразола кавоксила и 1,6% масс/масс полисорбата 20 в качестве стабилизатора поверхности (т.е. соотношение действующего вещества к стабилизатору поверхности составляло 9:1). Добавляли среду для измельчения Polymill с размером частиц 500 мкм, причем общее количество среды составляло 69%. Суспензию помещали в 10 мл камеру мельницы NanoMill® 0,01, снабженной прямым валом, и измельчали при 1500 об/мин в течение в общей сложности 45 минут при температуре 15°C. Часть полученного состава разбавляли до содержания арипипразола кавоксила 8% 1,6% раствором полисорбата 20 в фосфатном солевом буфере (pH 6,8). Конечная композиция имела средний размер частиц 584 нм, Dv50 составлял 549 нм, Dv90 961 нм и Dv10 261 нм.
Состав Y получали разбавлением другой порции полученного выше состава до содержания арипипразола кавоксила 8% 1,6% раствором полисорбата 20 и 0,1% раствором плуроник F108, в качестве второго стабилизатора, в фосфатном солевом буфере (pH 6,8). Конечная композиция имела средний размер частиц 584 нм, Dv50 составлял 549 нм, Dv90 961 нм и Dv10 261 нм.
Составы X и Y хранили при комнатной температуре до момента введения. Для экспериментов использовали шесть особей крыс. Композиции вводили внутримышечно, в дозировке, соответствующей количеству действующего вещества примерно 20 мг, при концентрации действующего вещества 65 мг/мл и объеме дозы 0,3 мл.
Кривые средних концентраций арипипразола для составов X и Y показаны на фиг.25. Исследование продемонстрировало, что при добавлении дополнительного стабилизатора наблюдалось значительное изменение Cmax in vivo. Уровни арипипразола значительно возрастали (в 5 раз) для состава Y по сравнению с составом X.
Микроскопическое исследование капли состава X, разбавленного фосфатным солевым буфером, продемонстрировало образование агрегатов (фиг.26). С другой стороны, при разбавлении состава Y фосфатным солевым буфером микроскопическое исследование не выявило образования агрегатов. Это могло бы указывать на то, что при введении состава в объем мышцы, состав X мог бы формировать агрегаты, которые уменьшают площадь поверхности, находящуюся в контакте с мышцей. С другой стороны, состав Y после инъекции мог бы сформировать депо, распределенное между мышечными волокнами, которое увеличивает площадь поверхности контакта, что ведет к повышению уровней действующего вещества в крови.
Хотя некоторые из предпочтительных вариантов осуществления настоящего изобретения были описаны и конкретно проиллюстрированы выше, не предполагается, что настоящее изобретение ограничено этими вариантами осуществления. В эти варианты осуществления можно вносить различные модификации, не выходя за пределы объема и не отступая от сути настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ ПРОЛЕКАРСТВА АРИПИПРАЗОЛА | 2015 |
|
RU2817019C2 |
| ЖИДКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭНСИФЕНТРИН И ГЛИКОПИРРОЛАТ | 2021 |
|
RU2831388C1 |
| СОСТАВЫ ФУЛЬВЕСТРАНТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2775225C2 |
| Фармацевтическая композиция, содержащая энсифентрин | 2020 |
|
RU2825334C2 |
| Фармацевтические композиции, содержащие RPL554 в HFA-134A для введения посредством ингаляции | 2019 |
|
RU2813959C2 |
| СПОСОБ ОБРАБОТКИ ЧАСТИЦ АКТИВНЫХ ФАРМАЦЕВТИЧЕСКИХ ИНГРЕДИЕНТОВ | 2011 |
|
RU2597790C2 |
| ЖИДКАЯ ИНГАЛЯЦИОННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ RPL 554 | 2015 |
|
RU2699995C2 |
| ПРЕССОВАННАЯ ТВЕРДАЯ КОМПОЗИЦИЯ ДЛЯ НЕПИЩЕВОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2768832C2 |
| КОМПОЗИЦИЯ НА ОСНОВЕ ПОЛЫХ ПОЛИМЕРОВ | 2016 |
|
RU2732539C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ВОДОНЕРАСТВОРИМОЕ АНТИПСИХОТИЧЕСКОЕ СРЕДСТВО И СЛОЖНЫЕ ЭФИРЫ СОРБИТАНА | 2012 |
|
RU2757859C2 |
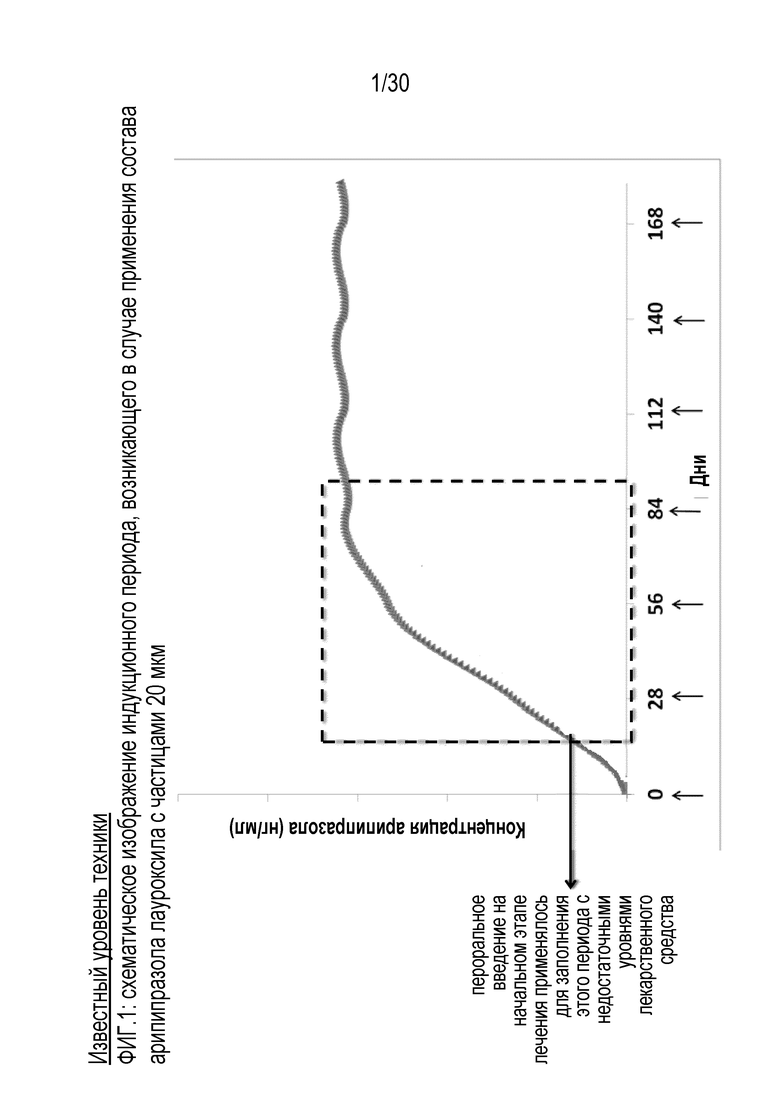

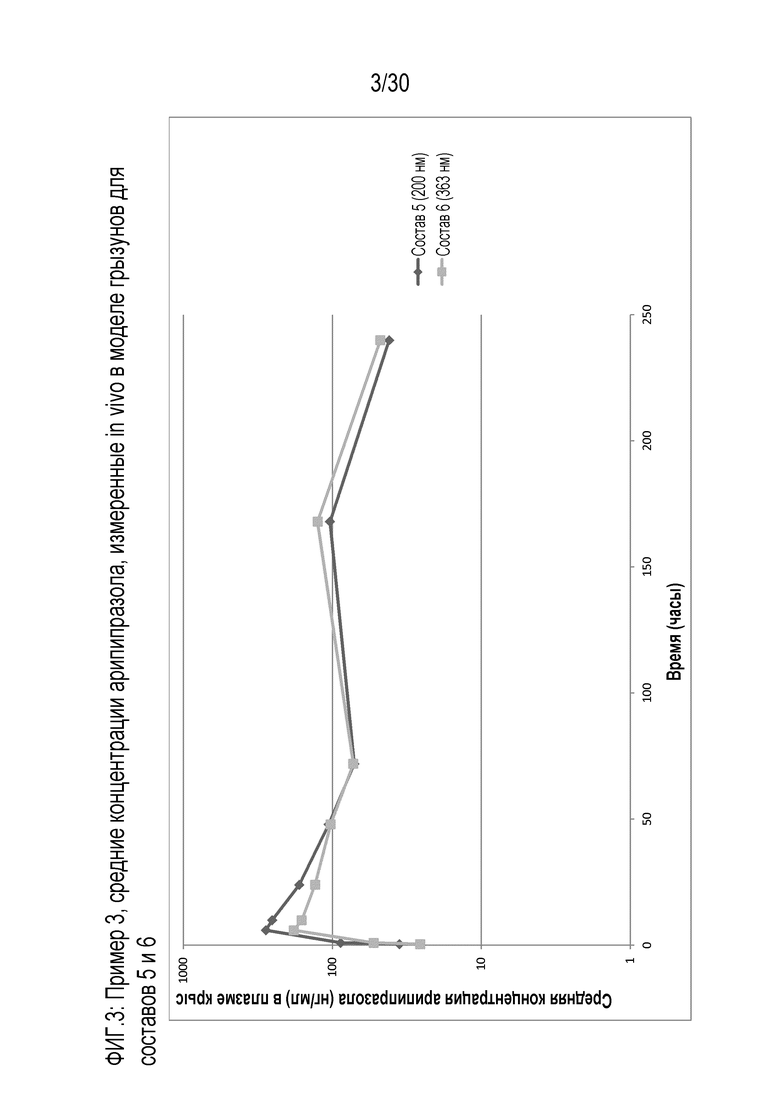
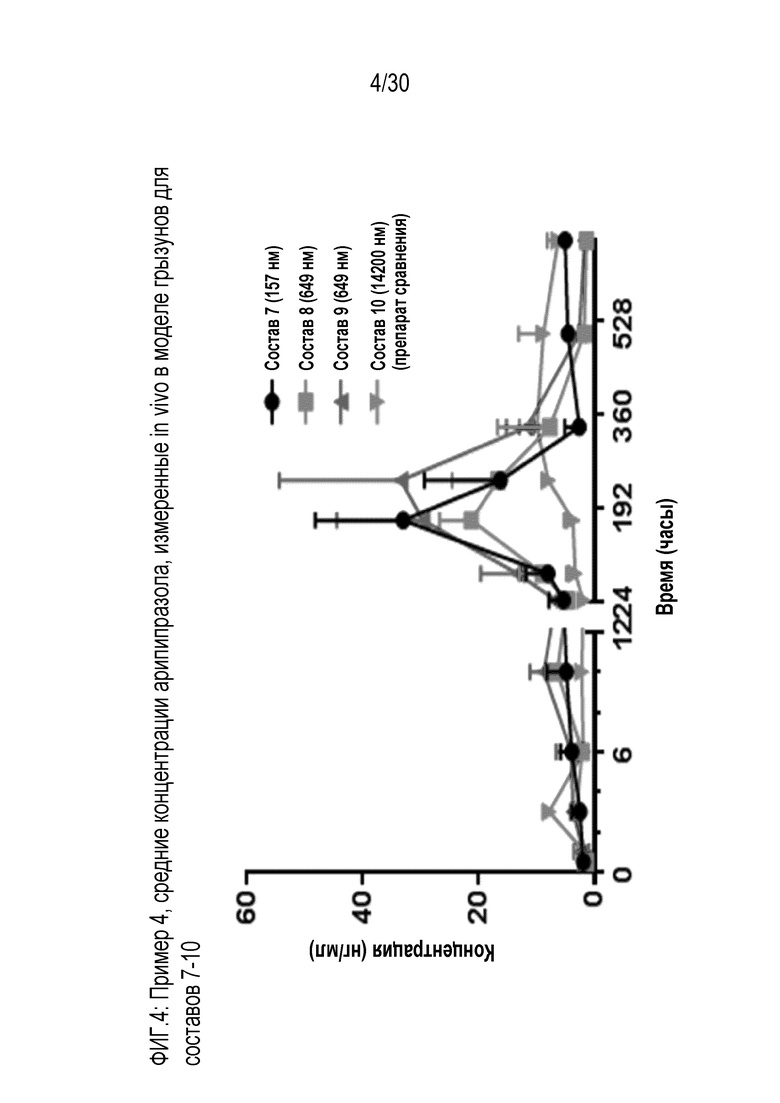

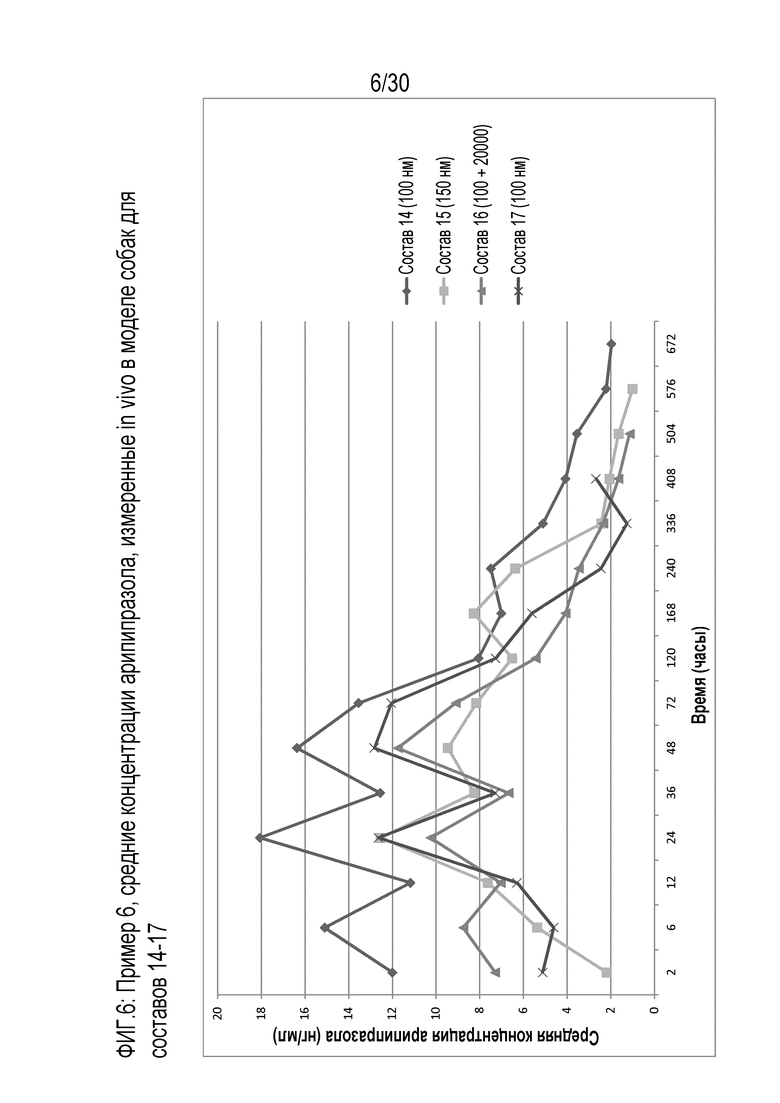










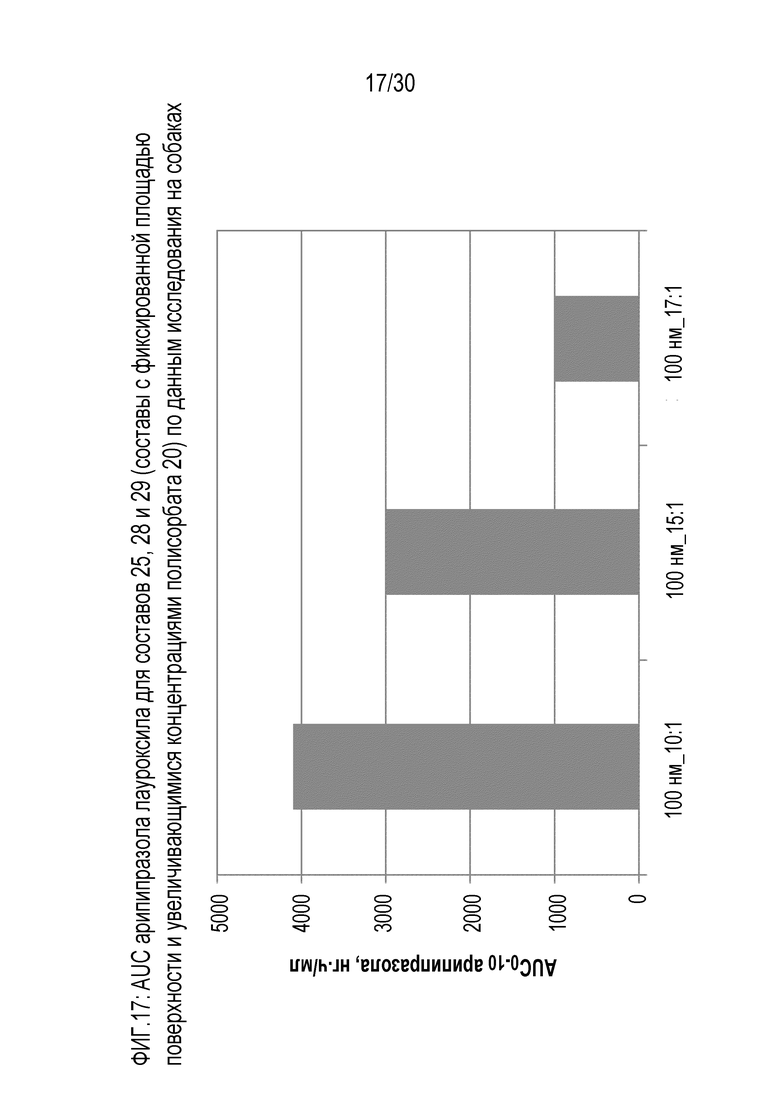
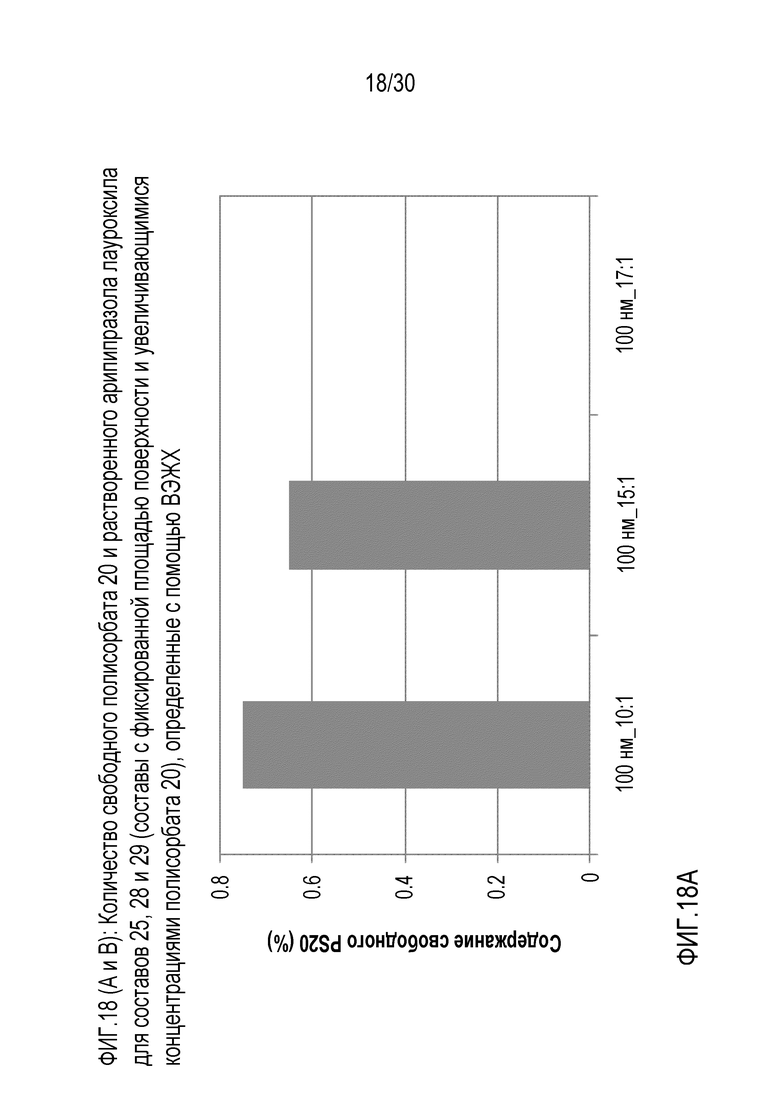






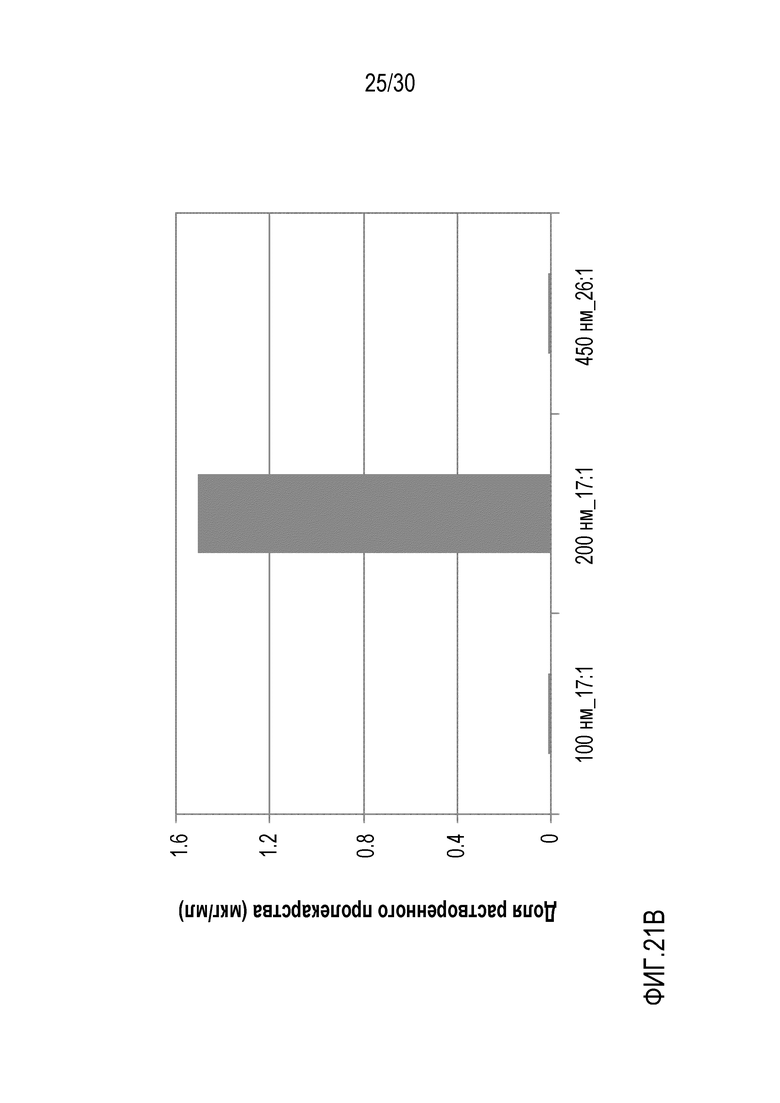
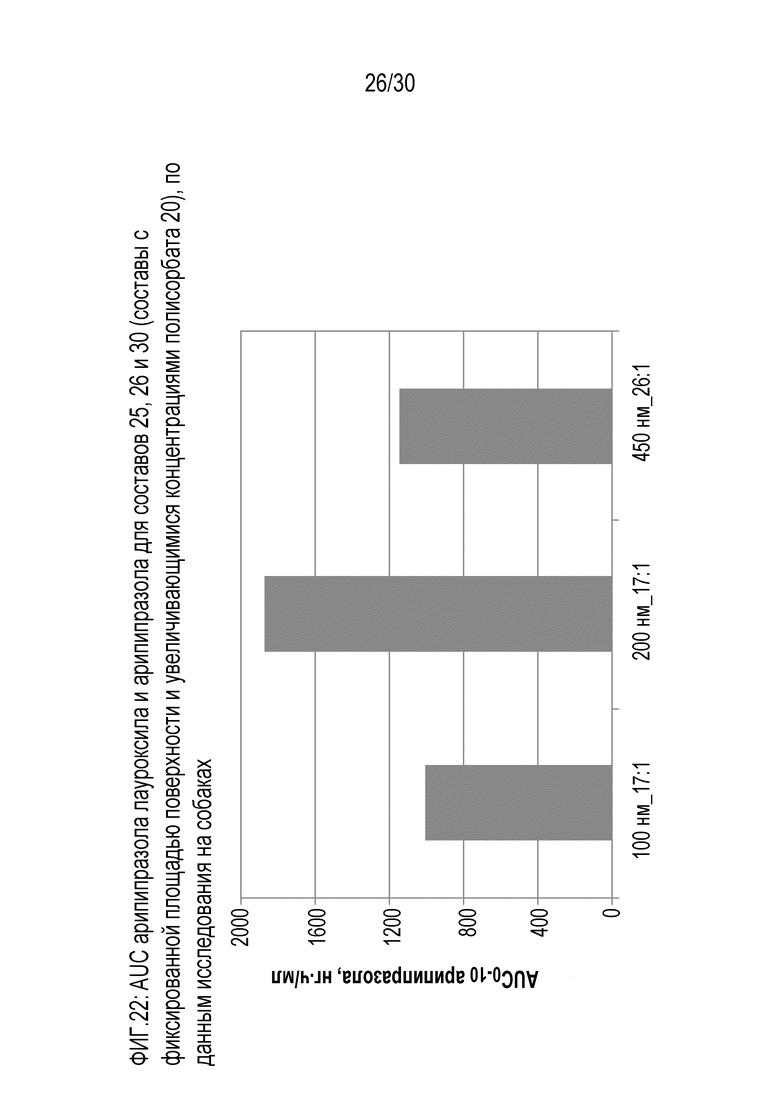




Описана композиции для доставки пролекарства арипипразола. Композиция содержит (a) совокупность частиц пролекарства арипипразола, имеющих объемный размер (Dv50) менее 1000 нм, и (b) по меньшей мере один стабилизатор поверхности, содержащий адсорбированный компонент, который адсорбирован на поверхности частиц пролекарства арипипразола, и свободный компонент, который способен солюбилизировать пролекарство арипипразола. Отношение пролекарства арипипразола к стабилизатору поверхности составляет от 0,1:1 до 40:1, предпочтительно 17:1. По меньшей мере один стабилизатор поверхности представляет собой карбоксиметилцеллюлозу или сложный эфир полиоксиэтиленсорбитана и жирных кислот. Предпочтительно стабилизатор поверхности представляет собой полисорбат 20. Композиции по изобретению обеспечивают улучшение in vivo фармакокинетического профиля высвобождения арипипразола на начальном этапе введения и позволяют достичь терапевтической концентрации арипипразола менее чем за семь дней. 7 н. и 32 з.п. ф-лы, 26 ил., 18 табл., 12 пр.
1. Композиция для доставки пролекарства арипипразола, включающая:
a) совокупность частиц пролекарства арипипразола, имеющих объемный размер (Dv50) менее 1000 нм, определенный по методикам, основанным на рассеянии света,
b) по меньшей мере один стабилизатор поверхности, содержащий адсорбированный компонент, который адсорбирован на поверхности частиц пролекарства арипипразола, и свободный компонент, который способен солюбилизировать пролекарство арипипразола,
где отношение пролекарства арипипразола к стабилизатору поверхности составляет от 0,1:1 до 40:1, и где пролекарство арипипразола имеет формулу
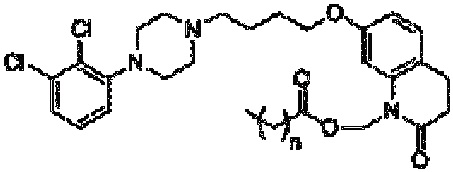
где n означает 0 или целое число меньше 20, и
где по меньшей мере один стабилизатор поверхности представляет собой карбоксиметилцеллюлозу или сложный эфир полиоксиэтиленсорбитана и жирных кислот.
2. Композиция по п.1, где в формуле пролекарства арипипразола n равно 4.
3. Композиция по п.1, где в формуле пролекарства арипипразола n равно 10.
4. Композиция по любому из пп.1-3, где количество свободного компонента стабилизатора поверхности составляет от более чем 0% (масс/масс) до не более чем 3% (масс/масс) композиции.
5. Композиция по любому из пп.1-4, где объемное распределение размеров частиц пролекарства арипипразола (Dv50) находится в пределах от 50 до 700 нм.
6. Композиция по п.5, где объемное распределение размеров частиц (Dv50) находится в пределах от 175 до 350 нм.
7. Композиция по любому из пп.1-6, где стабилизатор поверхности представляет собой сложный эфир полиоксиэтиленсорбитана и жирной кислоты.
8. Композиция по любому из пп.1-6, где стабилизатор поверхности представляет собой полисорбат 20.
9. Композиция по любому из пп.1-8, где отношение пролекарства арипипразола к стабилизатору поверхности, присутствующему в композиции, находится в пределах от 17:1 до 26:1.
10. Композиция по любому из пп.1-9, дополнительно содержащая дисперсионную среду, в которой диспергирована совокупность частиц пролекарства арипипразола, где свободный компонент стабилизатора поверхности растворен или диспергирован в дисперсионной среде.
11. Композиция по любому из пп.1-10, адаптированная для инъекции в качестве состава-депо.
12. Композиция по любому из пп.10 или 11, где композиция поставляется в устройстве для инъекции.
13. Композиция по п.12, где устройство для инъекции представляет собой предварительно заполненный шприц.
14. Композиция по п.12, где устройство для инъекции представляет собой автоматический медицинский шприц.
15. Композиция по п.12, где устройство для инъекции представляет собой безыгольный шприц.
16. Композиция по п.12, где устройство для инъекции представляет собой двухкамерный шприц.
17. Композиция по любому из пп.1-16, составленная в форме порошка для восстановления в жидкой среде, где совокупность частиц пролекарства арипипразола редиспергируют в жидкой среде, так что редиспергированные частицы пролекарства арипипразола имеют объемный размер (Dv50) менее 1000 нм.
18. Композиция по любому из пп.1-17, дополнительно содержащая вторую совокупность частиц пролекарства арипипразола, где указанная вторая совокупность имеет объемный размер частиц (Dv50) 5000 нм или более.
19. Композиция по п.18, где вторая совокупность имеет объемный размер частиц (Dv50) от 15 мкм до 25 мкм.
20. Композиция по любому из пп.1-19, дополнительно содержащая атипичное антипсихотическое средство, отличающееся от пролекарства арипипразола.
21. Композиция по любому из пп.1-16 и 18-20, где вязкость композиции менее 10 сП при скорости сдвига 100 с-1, при измерении при температуре 25°C.
22. Композиция по любому из пп.1-21, где композиция при введении млекопитающему субъекту демонстрирует Tmax в крови субъекта менее одной недели, и где концентрация арипипразола в крови сохраняется выше терапевтически эффективного количества в течение по меньшей мере двух недель с момента, когда концентрация арипипразола в крови впервые достигла терапевтически эффективного количества.
23. Композиция по любому из пп.1-21, где композиция при введении млекопитающему субъекту позволяет достичь терапевтической концентрации в крови субъекта менее чем за 36 часов и сохраняет терапевтический уровень в крови субъекта в течение минимум 5 дней и максимум 9 дней.
24. Композиция по любому из пп.1-21, где композиция при введении млекопитающему субъекту позволяет достичь терапевтической концентрации в крови субъекта менее чем за 72 часа и сохраняет терапевтический уровень в крови субъекта в течение минимум 5 дней и максимум 13 дней.
25. Композиция по любому из пп.1-21, где композиция при введении млекопитающему субъекту позволяет достичь терапевтической концентрации в крови субъекта менее чем за 7 дней и сохраняет концентрацию арипипразола в крови субъекта, которая превышает терапевтическую концентрацию, в течение минимум 14 дней.
26. Композиция для доставки пролекарства арипипразола, состоящая из:
совокупности частиц пролекарства арипипразола формулы

имеющая объемное распределение размеров частиц (Dv50) от 175 до 350 нм по данным методик, основанных на рассеянии света, где отношение указанных частиц к полисорбату 20 составляет 17:1.
27. Композиция для доставки пролекарства арипипразола, состоящая из:
совокупности частиц пролекарства арипипразола формулы

имеющая объемное распределение размеров частиц (Dv50) менее 400 нм по данным методик, основанных на рассеянии света, где отношение указанных частиц к полисорбату 20 составляет 17:1.
28. Композиция для доставки пролекарства арипипразола , состоящая из:
совокупности частиц пролекарства арипипразола формулы

имеющая объемное распределение размеров частиц (Dv50) менее 300 нм по данным методик, основанных на рассеянии света, где отношение указанных частиц к полисорбату 20 составляет 17:1.
29. Композиция для доставки пролекарства арипипразола , состоящая из:
совокупности частиц пролекарства арипипразола формулы

имеющая объемное распределение размеров частиц (Dv50) менее 200 нм по данным методик, основанных на рассеянии света, где отношение указанных частиц к полисорбату 20 составляет 17:1.
30. Композиция для доставки пролекарства арипипразола , состоящая из:
совокупности частиц пролекарства арипипразола формулы

имеющая объемное распределение размеров частиц (Dv50) менее 100 нм по данным методик, основанных на рассеянии света, где отношение указанных частиц к полисорбату 20 составляет 17:1.
31. Способ улучшения in vivo фармакокинетического профиля высвобождения на начальном этапе введения, заключающийся в предоставлении совокупности частиц пролекарства арипипразола формулы

имеющих объемное распределение размеров частиц (Dv50) менее 400 нм по данным методик, основанных на рассеянии света, где отношение указанных частиц к полисорбату 20, равное 17:1, позволяет достичь терапевтической концентрации арипипразола менее чем за семь дней.
32. Способ по п.31, где указанная терапевтическая концентрация арипипразола достигается менее чем за 72 часа.
33. Способ по п.31, где указанная терапевтическая концентрация арипипразола достигается менее чем за 48 часов.
34. Способ по п.31, где указанная терапевтическая концентрация арипипразола достигается менее чем за 24 часа.
35. Способ по п.31, где указанное объемное распределение размеров частиц (Dv50) находится в пределах от 175 до 350 нм.
36. Способ по п.31, где указанное объемное распределение размеров частиц (Dv50) составляет менее 300 нм.
37. Способ по п.31, где указанное объемное распределение размеров частиц (Dv50) составляет менее 200 нм.
38. Способ по п.31, где указанное объемное распределение размеров частиц (Dv50) составляет менее 100 нм.
39. Способ по п.31, где терапевтическая концентрация арипипразола достигается при совместном пероральном введении 30 мг дозы арипипразола.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| CA 2885196 A1, 19.09.2013 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| US 8338427 B2, 25.12.2012 | |||
| US 7807680 B2, 05.10.2010. | |||
Авторы
Даты
2019-11-07—Публикация
2015-08-17—Подача