ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к препарату рокурония с улучшенной стабильностью, и способу повышения стабильности препарата рокурония.
ПРЕДЩЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рокуроний (или бромид рокурония) известен в качестве активного ингредиента анестетического миорелаксанта или т.п. (непатентная литература 1).
Рокуроний является относительно, термически нестабильным в водном растворе, и таким образом, его хранение и/или транспортировка являются трудоемкими и затратными. Например, ESLAX, которые известен в качестве коммерчески доступного препарата рокурония, нуждается в охлаждении при температуре от 2 до 8°C (Непатентная литература 1).
По этой причине, были предприняты попытки улучшить стабильность рокурония в водном растворе. Например, в WO2008/065142 (Патентная литература 1) раскрыта техника стабилизации рокуроний-содержащего водного раствора посредством добавления к раствору производного простого сульфоалкильного эфира β-циклодекстрина или его фармацевтически приемлемой соли.
Однако способ по этому документу нуждается в добавлении производного простого сульфоалкильного эфира β-циклодекстрина или его фармацевтически приемлемой соли, применение которых, как сообщали, вызывает почечную дисфункцию и т.д. В документе описано, что pH должен находиться в диапазоне от 3,5 до 7,5, и предпочтительно от 5,5 до 7,5 для уменьшения боли при инъекции. Другими словами, в этом документе признается возникновение боли при инъекции в диапазоне pH от 3,5 до 7,5, и снижение pH до 3,5 или менее не рассматривают.
СПИСОК ЦИТИРОВАНИЙ
ПАТЕНТНАЯ ЛИТЕРАТУРА
Патентная литература 1: WO 2008/065142
НЕПАТЕНТНАЯ ЛИТЕРАТУРА
Непатентная литература 1: Форма опроса о лекарственных средствах для ESLAX внутривенно 25 мг/2,5 мл и ESLAX внутривенно 50 мг/5,0 мл, исправленная в октябре, 2010
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Целью настоящего изобретения является предоставить препарат рокурония с превосходной стабильностью.
Другой целью настоящего изобретения является предоставить препарат рокурония, pH которого сильно снижен.
Другой целью настоящего изобретени\ является предоставить препарат рокурония, который не вызывает раздражения кровеносных сосудов при введении.
Другой целью настоящего изобретения является предоставить препарат рокурония, не вызывающий или вызывающий меньшую боль при иъекции.
РЕШЕНИЕ ЗАДАЧИ
Для достижения описанных выше целей, авторы настоящего изобретения провели интенсивные исследования и обнаружили, что препарат рокурония, содержащий рокуроний и буферный раствор, и обладающий pH в пределах определенного диапазона, а также ниже чем pH коммерчески доступного продукта ESLAX (pH 4,0), к удивлению демонстрирует заметно увеличенную или улучшенную стабильность, и что несмотря на низкий pH, такой препарат рокурония не обладает физиологически неблагоприятными эффектами и, таким образом, может быть введен безопасным образом, в то время как стабильность препарата является улучшенной или повышенной. На основе этих данных, авторы настоящего изобретения завершили настоящее изобретение.
То есть препарат рокурония по настоящему изобретению содержит рокуроний и буферный раствор, и обладает pH в пределах предопределенного диапазона (например, 3,5 или менее). pH препарата рокурония может составлять, конкретно, приблизительно от 2,5 до 3,5 (например, от 2,8 до 3,2).
Буферный раствор конкретно не ограничен при условии, что его pH может достигать желаемого значения по настоящему изобретению, и может составлять, по меньшей мере, один вид, выбранный из формиатного буферного раствора, ацетатного буферного раствора, цитратного буферного раствора, тартратного буферного раствора, фталатного буферного раствора, фосфатного буферного раствора, лимоннокислотного-фосфатного буферного раствора и глицинового буферного раствора. Конкретно, буферный раствор может быть, по меньшей мере, одним видом, выбранным буферного раствора на основе лимонной кислоты и гидроксида натрия, буферного раствора на основе винной кислоты и гидроксида натрия, буферного раствора на основе калий гидрофталата и соляной кислоты и буферного раствора на основе глицина и соляной кислоты.
Типичные препараты рокурония включают препарат, имеющий pH от 2,5 до 3,5 и содержащий буферный раствор на основе глицина и соляной кислоты, концентрация которого составляет 0,01 M или выше (например, 0,015 M или выше).
Препарат рокурония по настоящему изобретению обладает превосходной стабильностью. Например, после 6-месячного хранения при 40oC, скорость образования сопутствующей примеси C (величина, полученная посредством вычитания исходной процентной площади сопутствующей примеси C из процентной площади сопутствующей примеси C в каждой точке измерения) может составлять 5% или менее.
Препарат рокурония по настоящему изобретению может быть инъекционным препаратом. Такой инъекционный препарат, в дополнение к стабильности, обладает эффектом предотвращать или снижать боль при инъекции и сосудистое раздражение (раздражение кровеносных сосудов). Таким образом, препарат рокурония (инъекционный препарат рокурония) по настоящему изобретению может быть препаратом рокурония, который обладает уровнем образования сопутствующей рокуронию примеси С равным 5% или менее после 6-месячного хранения при 40°C и который не вызывает (или не обладает возможностью вызывать) или вызывает меньшую боль при инъекции и/или сосудистое раздражение (в частности, и боль при инъекции, и сосудистое раздражение).
Таким образом, препарат рокурония по настоящему изобретению обладает превосходной термостабильностью, и таким образом, может быть препаратом, который хорошо храниться, в частности, при комнатной температуре.
По настоящему изобретению, стабильность препарата рокурония может быть увеличена или улучшена посредством корректировки pH препарата рокурония до предопределенного диапазона. В данном контексте, настоящее изобретение также относится к способу увеличения или улучшения стабильности препарата рокурония посредством корректировки рН препарата рокурония, содержащего рокуроний и буферный раствор, до 3,5 или менее (в частности, способ увеличения или улучшения стабильности препарата рокурония, так чтобы уровень образовавшейся сопутствующей рокуронию примеси С после 6-месячного хранения при 40°C составляет 5% или менее).
Кроме того, как описано выше, инъекционный препарат по настоящему изобретению обладает эффектом предотвращать боль при инъекции и сосудистое раздражение. В этом контексте, настоящее изобретение также относится к способу предотвращения или уменьшения как боли при инъекции, так и сосудистого раздражения, вызванных инъекционным препаратом рокурония и для увеличения или улучшения стабильности инъекционного препарата рокурония так, чтобы уровень образовавшейся сопутствующей рокуронию примеси С после 6-месячного хранения при 40°C составлял 5% или менее, посредством корректировки рН инъекционного препарата рокурония, содержащего рокуроний и буферный раствор, до 3,5 или менее.
По этим способам, можно получать препарат (препарат рокурония или инъекционный препарат рокурония) таким образом, чтобы он мог храниться при комнатной температуре.
БЛАГОПРИЯТНЫЕ ЭФФЕКТЫ ПО ИЗОБРЕТЕНИЮ
В настоящем изобретении, препарат рокурония с превосходной стабильностью (в частности, термостабильностью) можно получать посредством корректировки рН до определенного диапазона. Например, препарат рокурония по настоящему изобретению незначительно разлагается даже при хранении в неохлажденных условиях в течение длительного периода или в условиях высокой температуры и высокого давления. Кроме того, изменение pH можно четко контролировать, и таким образом, препарат рокурония является чрезвычайно стабильным. Таким образом, препарат рокурония можно хранить при нормальной температуре, и таким образом, он является чрезвычайно практичным.
Препарат рокурония по настоящему изобретению не имеет физиологически неблагоприятных эффектов (или обладает только несущественными неблагоприятными эффектами), и в отношении этого также является в высокой степени практичным. Например, препарат рокурония по настоящему изобретению не вызывает образование тромба, периваскулярное воспаление или т.п., и можно вводить без сосудистого раздражения. Кроме того, при введении, препарат не вызывает или вызывает гораздо меньшую боль при инъекции, чем та, которую вызывает коммерческий продукт (ESLAX). Таким образом, препарат рокурония по настоящему изобретению также является эффективным в качестве препарата, способного предотвращать или уменьшать боль при инъекции и/или сосудистом раздражении. Кроме того, препарат рокурония по настоящему изобретению достигает увеличенной или улучшенной стабильности без компонента, описанного в патентной литературе 1 (производное простого сульфоалкильного эфира β-циклодекстрина или его фармацевтически приемлемая соль).
Таким образом, препарат по настоящему изобретению является превосходным как в отношении стабильности, так и в отношении безопасности, и является чрезвычайно полезным препаратом.
Как описано выше, препарат по настоящему изобретению не обладает физиологически неблагоприятными эффектами, что является очень удивительным, учитывая тот факт, что pH коммерческого препарата рокурония (ESLAX), как было решено, должен иметь уровень pH (4,0) выше, чем диапазон pH по настоящему изобретению, принимая во внимание физиологически неблагоприятные эффекты (процитировано из отчета по анализу ESLAX).
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
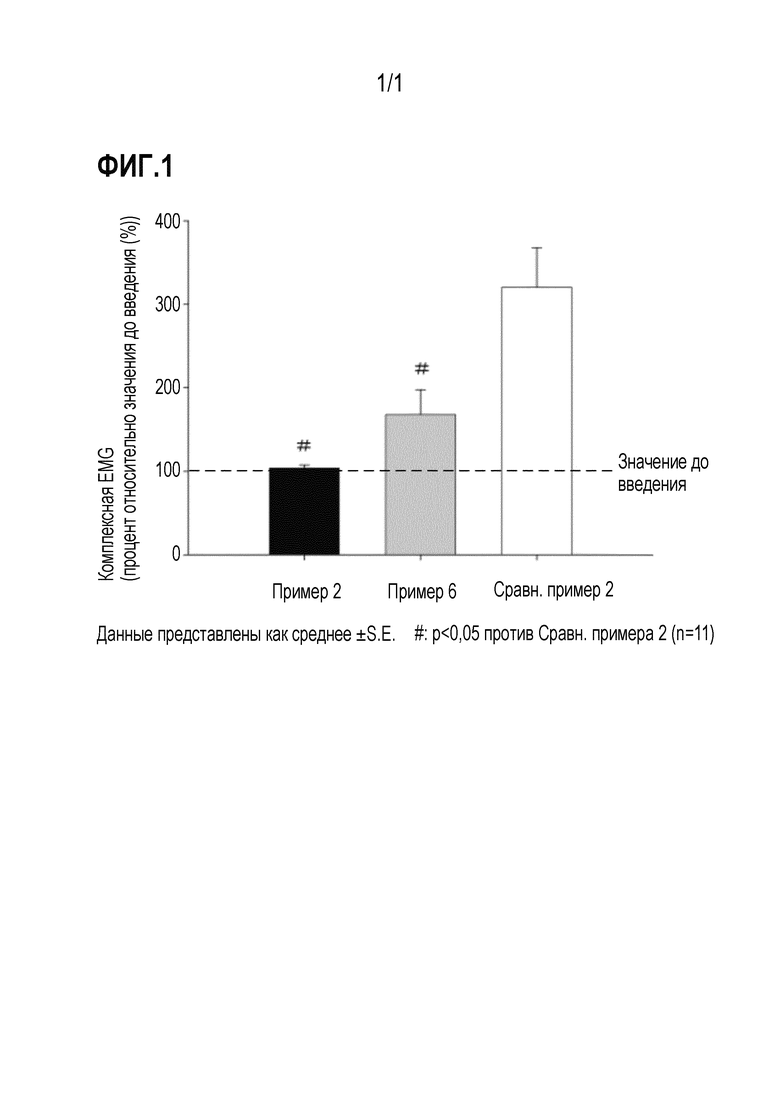
На фиг. 1 представлен график, демонстрирующий результаты оценки боли при инъекции препаратов из примера 2, примера 6, и сравнительного примера 2 на основе EMG.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
препарат рокурония по настоящему изобретению содержит рокуроний и буферный раствор и имеет pH в пределах предопределенного диапазона. Рокуроний является бромидом рокурония (химическое название): (+)-(17β-ацетокси-3α-гидрокси-2β-морфолино-5α-андростан-16β-ил)-1-аллил-1-пирролидиний бромид), представленный следующей формулой.
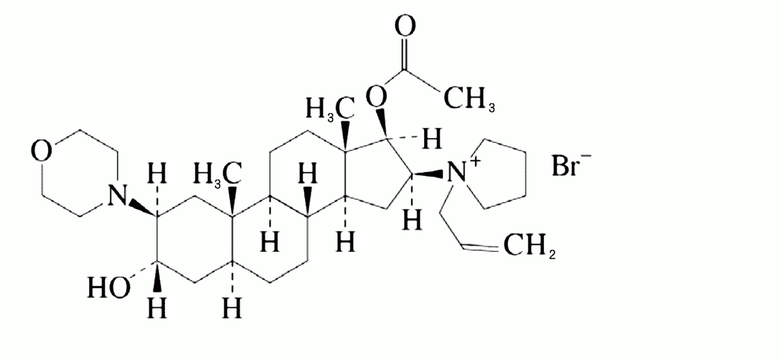
Процент рокурония в препарате конкретно не ограничен и соответствующим образом выбран в зависимости от состояния заболевания, лекарственной формы и т.д. Процент может составлять, например, приблизительно от 0,1 до 10% масс./об., предпочтительно приблизительно от 0,5 до 5% масс./об. и более предпочтительно приблизительно от 0,8 до 3% масс./об.
Буферный раствор конкретно не ограничен при условии, что он может достигать желаемый pH по настоящему изобретению, и его примеры включают буферные растворы на основе карбоновых кислот (например, формиатный буферный раствор, ацетатный буферный раствор, цитратный буферный раствор, тартратный буферный раствор, фталатный буферный раствор и т.д.), фосфатные буферные растворы (например, фосфатный буферный раствор, лимоннокислотный-фосфатный буферный раствор и т.д.), аминокислотные буферные растворы (например, глициновый буферный раствор и т.д.) и т.д. Чтобы достичь желаемый рH по настоящему изобретению, подходящими буферными растворами среди них могут быть цитратные буферные растворы (например, буферный раствор на основе лимонной кислоты и гидроксида натрия и т.д.), тартратные буферные растворы (например, буферный раствор на основе винной кислоты и гидроксида натрия и т.д.), фталатные буферные растворы (например, буферный раствор на основе калий гидрофталата и соляной кислоты и т.д.), и глициновые буферные растворы (например, буферный раствор на основе глицина и соляной кислоты и т.д.). В частности, можно использовать буферный раствор глицина и соляной кислоты. Эти буферные растворы можно использовать в отдельности или в комбинации двух или более. Эти буферные растворы можно готовить или приобретать в виде коммерчески доступных продуктов.
Концентрация буферного раствора в препарате конкретно не ограничена и может быть выбрана соответствующим образом в зависимости от типа буферного раствора, желаемого pH и т.д. Концентрацию можно выбирать из диапазона 0,001 M или выше (например, от 0,003 до 0,8 M), например, 0,005 M или выше (например, от 0,008 до 0,7 M), предпочтительно 0,01 M или выше (например, от 0,015 до 0,5 M), более предпочтительно 0,02 M или выше (например, от 0,03 до 0,4 M), и конкретно предпочтительно 0,04 M или выше (например, от 0,05 до 0,3 M).
В частности, когда буферным раствором является буферный раствор на основе глицина и соляной кислоты, концентрация в препарате может быть, например, 0,01 M или выше (например, от 0,015 до 0,8 M), предпочтительно 0,02 M или выше (например, от 0,025 до 0,6 M), более предпочтительно 0,03 M или выше (например, от 0,04 до 0,5 M), и в частности, приблизительно 0,05 M или выше (например, от 0,06 до 0,3 M).
Более высокая концентрация буферного раствора приводит к более эффективному контролю изменения или вариативности pH препарата.
Концентрация буферного раствора означает концентрацию компонента, демонстрирующего буферную способность (буферное действие), например, концентрация глицина в случае буферного раствора на основе глицина и соляной кислоты.
pH препарата рокурония по настоящему изобретению может составлять 3,5 или менее (например, от 1,8 до 3,5), предпочтительно 3,4 или менее (например, от 2 до 3,35), и более предпочтительно 3,3 или менее (например, от 2,2 до 3,3). В частности, pH препарата рокурония может составлять, например, от 2 до 3,5, предпочтительно от 2,5 до 3,5 (например, от 2,8 до 3,2), и, как правило, менее чем 3,5 (например, от 2 до 3,4). pH может быть значением при температуре от 20 до 30oC.
Препарат рокурония по настоящему изобретению может содержать другие компоненты (фармацевтический носитель и т.д.), примешанные туда по мере необходимости. Примеры других таких компонентов включают растворитель, солюбилизатор, суспендирующее средство, обеспечивающее изотоничность средство, успокаивающее средство и т.д. Кроме того, любые известные добавки и фармацевтически приемлемые добавки, как правило, применяемые в фармацевтической области, например, консервант, антиоксидант, стабилизатор и ингибитор окисления, можно использовать при необходимости. Эти добавки можно использовать в отдельности или в качестве смеси двух или более компонентов при необходимости для предполагаемой лекарственной формы и т.д. Эти добавки могут быть коммерчески доступными продуктами.
Растворитель конкретно не ограничен, и его примеры включают очищенную воду, этанол, пропиленгликоль, полиэтиленгликоль, макрогол, сезамовое масло, кукурузное масло, оливковое масло и т.д. Солюбилизатор конкретно не ограничен, и его примеры включают пропиленгликоль, D-маннит, бензил бензоат, этанол, триэтаноламин, карбонат натрия, цитрат натрия и т.д. Суспендирующее средство конкретно не ограничено, и его примеры включают хлорид бензалкония, кармеллозу, гидроксипропилцеллюлозу, пропиленгликоль, поливинилпирролидон, метилцеллюлозу, моностеарат глицерина, лаурилсульфат натрия, лецитин, поливиниловый спирт и т.д. Обеспечивающее изотоничность средство конкретно не ограничено, и его примеры включают глюкозу, D-сорбит, хлорид натрия, D-маннит, глицерин и т.д. Успокаивающее средство конкретно не ограничено, и его примеры включают бензиловый спирт и т.д.
Консервант конкретно не ограничен, и его примеры включают этил п-гидроксибензоат, хлорбутанол, бензиловый спирт, натрий дегидроацетат, сорбиновую кислоту и т.д. Антиоксидант конкретно не ограничен, и их примеры включают сульфит натрия, аскорбиновую кислоту и т.д. Стабилизатор конкретно не ограничен, и его примеры включают казеин, казеинат натрия и т.д. Примеры ингибитора окисления включают трет-бутилгидрохинон, бутилгидроксианизол, бутилгидрокситолуол, α-токоферол и их производные.
Препарат по настоящему изобретению может содержать конкретный компонент, описанный в патентной литературе 1, а именно производное простого сульфоалкильного эфира β-циклодекстрина или его фармацевтически приемлемую соль, но, как правило, не должен содержать примесь. Поскольку не существует необходимости в таком компоненте в настоящем изобретении, может быть предоставлен стабилизированный препарат рокурония, который является в высокой степени безопасным и свободным от риска вызвать почечную дисфункцию и т.д.
Осмотическое давление препарата рокурония по настоящему изобретению конкретно не ограничено, и может, например, составлять от 250 до 1000 мосмоль/кг или от 260 до 600 мосмоль/кг.
Препарат рокурония по настоящему изобретению можно получать посредством, например, смешивания рокурония с буферным раствором (и другими компонентами при необходимости), но способ получения конкретно этим не ограничен.
Лекарственная форма препарата рокурония по настоящему изобретению конкретно не ограничена, но, как правило, является раствором. Примеры раствора включают парентеральные препараты, такие как инъекционные препараты (для внутривенной инъекции, внутриартериальной инъекции, внутримышечной инъекции, подкожной инъекции, интрадермальной инъекции, интраперитонеальной инъекции, интраспинальной инъекции или эпидуральной инъекции), офтальмические препараты и интраназальные препараты.
Способ введения препарата рокурония по настоящему изобретению конкретно не ограничен, но в случаях парентерального введения с применением инъекционных препаратов, является предпочтительным соответствующим образом выбрать путь введения из предпочтительных путей введения, включая внутривенный, внутриартериальный, подкожный, интрадермальный, внутримышечный и интраперитонеальный пути введения в зависимости от возраста пациента, состояния заболевания и/или других условий.
Величина дозы (применение дозы) препарата рокурония по настоящему изобретению варьирует в зависимости от возраста, пола и массы пациента, тяжести заболевания и т.д., и таким образом конкретно не ограничена, но как правило, общая суточная доза активного ингредиента (а именно, рокурония) составляет, как правило, приблизительно от 0,01 до 100 мг, и предпочтительно приблизительно от 10 до 60 мг на взрослого. Кроме того, дозировка и способ введения варьируют в зависимости от возраста, пола и массы пациента, тяжести заболевания и т.д. и таким образом конкретно не ограничена, но как правило, является целесообразным, что общую суточную дозу вводят один раз в сутки или в качества множественных (например, от 2 до 4) дробных доз. В приведенном в качестве примера способе, рокуроний вводят внутривенно в дозе 0,6 мг/кг, и по мере необходимости, дополнительно вводят посредством непрерывных инфузий в дозе от 0,1 до 0,2 мг/кг во время операции.
Препарат рокурония по настоящему изобретению предпочтительно используют при анестезии, хотя это не является необходимым условием. Анестетик конкретно не ограничен, и предпочтительные его примеры включают ингаляционный анестетик и внутривенный анестетик. Ингаляционный анестетик конкретно не ограничен, и его примеры включают испаряющиеся ингаляционные анестетики, такие как галотан, изофлуран, энфлуран, метоксифлуран, севофлуран и десфлуран; и газообразные ингаляционные анестетики, такие как этилен, циклопропан, диэтиловый эфир, хлороформ, оксид азота и ксенон. Внутривенный анестетик конкретно не ограничен, и его примеры включают пропофол, мидазолам, кетамин, тилетамин, тиопентал, метогекситал и этомидат. Предпочтительными являются пропофол, мидазолам и т.д. Эти анестетики можно использовать в отдельности или в качестве смеси двух или более их типов. Эти анестетики могут быть коммерчески доступными продуктами.
Как описано выше, препарат рокурония по настоящему изобретению обладает высокой стабильностью. Например, после хранения препарата рокурония при 40°C в течение 3 месяцев уровень образовавшейся сопутствующей рокуронию примеси С является чрезвычайно низким и составляет 2,5% или менее (например, от 0 до 2,3%), предпочтительно 2% или менее (например, от 0,1 до 1,8%), более предпочтительно приблизительно 1,5% или менее (например, от 0,2 до 1,3%). Также возможно уменьшить уровень образования сопутствующей рокуронию примеси С до 1% или менее (например, от 0,1 до 0,8%).
Кроме того, после хранения препарата рокурония при 40°C в течение 6 месяцев, уровень образовавшейся сопутствующей рокуронию примеси С может составлять 5% или менее (например, от 0 до 4,9%), предпочтительно 4% или менее (например, от 0,01 до 3,9%), более предпочтительно приблизительно 3% или менее (например, от 0,1 до 2,9%).
Когда уровень образования сопутствующей рокуронию примеси С составляет 5% или менее, препарат рокурония оценивается как фармацевтический препарат, хранящийся при комнатной температуре. Здесь, комнатная температура означает от 1 до 30°C (японская фармакопея).
Таким образом, препарат рокурония по настоящему изобретению обладает превосходной стабильностью, и уровень образовавшейся сопутствующей рокуронию примеси С после 3-месячного хранения можно уменьшить до гораздо меньшего уровня чем 5%, что является пограничной величиной между хранящимися и не хранящимися при комнатной температуре. Даже после длительного (6-месячного) хранения уровень образования может все еще быть ниже чем 5%, демонстрируя, что препарат может храниться при комнатной температуре.
Сопутствующая примесь С является главным продуктом распада рокурония, и является примесью, описанной в фармакопее Соединенных Штатов Америки (USP) и в европейской фармакопее (EP).
После термического воздействия на препарат рокурония при 121°C в течение 20 минут, уровень образовавшейся сопутствующей рокуронию примеси С является чрезвычайно низким и составляет 0,7% или менее (например, от 0 до 0,6%), предпочтительно 0,5% или менее (например, от 0,01 до 0,45%), более предпочтительно приблизительно 0,4% или менее (например, от 0,05 до 0,35%). Также возможно уменьшить уровень образования сопутствующей рокуронию примеси С до 0,3% или менее (например, от 0,01 до 0,3%).
В настоящем изобретении, изменение pH препарата рокурония также можно минимизировать. Например, после хранения препарата рокурония при 40°C в течение 6 месяцев, отличие pH (или его абсолютное значение) до и после хранения является таким низким, как 0,25 или менее (например, от 0 до 0,22), предпочтительно 0,2 или менее (например, от 0 до 0,18), более предпочтительно приблизительно 0,15 или менее (например, от 0 до 0,12), и может также составлять 0,1 или менее (например, от 0 до 0,08, предпочтительно от 0 до 0,05, более предпочтительно от 0 до 0,03). Кроме того, в случаях, когда препарат рокурония обработан термически при 121°C в течение 20 минут, различие pH до и после термического воздействия можно выбирать из подобных диапазонов.
Таким образом, в настоящем изобретении, препарат рокурония с чрезвычайно высокой стабильностью можно получать посредством корректировки рН (а также выбора подходящего типа буферного раствора и корректировки концентрации буферного раствора). В этом контексте, настоящее изобретение также относится к способу увеличения или улучшения стабильности препарата рокурония посредством корректировки рН препарата рокурония, содержащего рокуроний и буферный раствор, до предопределенного диапазона (например, 3,5 или менее).
Препарат рокурония по настоящему изобретению обладает относительно низким pH, но не имеет или почти не имеет физиологически неблагоприятных эффектов. В частности, препарат рокурония по настоящему изобретению способен предотвращать или уменьшать боль при инъекции и/или сосудистом раздражении с высокой эффективностью. В этом контексте, настоящее изобретение также относится к способу предотвращения или уменьшения (облегчения) боли при инъекции и/или сосудистом раздражении (в частности, как боли при инъекции, так и сосудистом раздражении), вызванных рокуронием (в частности, вызванных введением препарата рокурония), посредством корректировки рН препарата рокурония (инъекционного препарата рокурония), содержащего рокуроний и буферный раствор до предопределенного диапазона (например, 3,5 или менее).
Настоящее изобретение относится к вариантам осуществления, в которых различные структуры, описанные выше, комбинируют в пределах технической области по настоящему изобретению таким образом, что вызывают эффект по настоящему изобретению.
ПРИМЕРЫ
Далее в настоящем документе, настоящее изобретение будет проиллюстрировано более подробно посредством примеров, но не является ограниченным ими. В пределах технической мысли специалистами в данной области могут быть сделаны различные модификации по настоящему изобретению.
В примерах, различные свойства определяли или оценивали следующим образом.
pH
Измерение проводили при от 20 до 30°C в соответствии с «определением pH» в японской фармакопее.
Уровень образования сопутствующей примеси (загрязнения) C
Измерение проводили в соответствии с USP способом для ВЭЖХ.
Сосудистое раздражение
Перед началом введения в месте введения у каждого из шести (трех для каждой группы) 14-недельных старых самцов кроликов JW удаляли волосы с помощью электрической машинки для волос. Почти из середины левой ушной задней вены выбирали 3-см участок, имеющий меньше ветвей маленьких сосудов (область накопления), и оба конца этого участка помечали нестираемым маркером, которым дали название центральной и периферической гемостатической области. В день введения при анестезии севофлураном (индукция: 5%, поддержание: 3%), точку в 5 мм в сторону периферической гемостатической области маркировали нестираемым маркером, для применения в качестве места вставки инъекционной иглы.
Во время введения зажим прикрепляли к части периферической по отношению к месту вставки инъекционной иглы, чтобы остановить кровоток, и инъекционную иглу вставляли из места вставки инъекционной иглы, в направлении от центральной области к периферической гемостатической области. Образец раствора инъецировали в количестве 0,025 мл, и подтверждали, что локальный кровеносный сосуд был заполнен образцом примеси. Затем центральный гемостатический участок перекрывали с помощью зажима, дополнительно инъецировали 0,025 мл образца раствора, и периферическую гемостатическую область перекрывали зажимом. Затем, 0,2 мл 2,5% масс./об. раствора сугаммадекса быстро вводили из правой ушной вены. После 3 минут накопления образца раствора зажимы удаляли, и после того, как было подтверждено спонтанное дыхание животного, анестезию удаляли. Для ежедневного введения образца раствора ту же самую область накопления и то же самое место вставки инъекционной иглы применяли по мере возможности.
Количество доз: один раз в сутки в течение 8 последующих суток
Вводимый объем: 0,05 мл/область/сутки
Способ введения, количество доз, период введения и объем введения выбирали в соответствии с способом Fukawa et al. (Nihon Yakurigaku Zasshi 71: 307-315, 1975).
Сосудистое раздражение оценивали один раз в сутки на основе критерия макроскопического осмотра, представленного ниже.
(Тромб)
-: отсутствие тромба (0 мм)
+: небольшой тромб (от 1 до 4 мм)
++: тромб среднего размера (от 5 до 14 мм)
+++: большой тромб (от 15 мм или более)
(Воспаление вокруг кровеносного сосуда (гиперемия, отек))
-: отсутствие изменения
+: легкое воспаление (ограниченное 3 см длины гемостатической области)
++: умеренное воспаление (1/3 центра уха вокруг гемостатической области)
+++: тяжелое воспаление (1/2 всего уха)
Боль при инъекции
Уретан инъецировали интраперитонеально крысам (8-недельным SD крысам-самцам, 11 животным в каждой группе) при дозе 1,1 г/кг, волоски вокруг обработанного участка удаляли, и кожу надрезали для того, чтобы обнажить кровеносные сосуды около бедренной артерии. PFA пробирку, имеющую наконечник, предварительно сделанный конусовидным, вводили приблизительно 2 см в хвостовую поверхностную эпигастральную артерию способом, осуществляющимся против естественного хода крови, до тех пор пока он не достигал области, из которой начинается бедренная артерия. Коаксиальный игольчатый электрод (26 G) вводили в левую заднюю полусухожильную мышцу. После операции крыс держали при температуре приблизительно 37oC. До начала введения исходное значение измеряли в течение 30 секунд. Каждый тестовый раствор в количестве 50 μL вводили через PFA пробирку на скорости 0,8 мл/мин, и проводили электромиографическое (EMG) измерение через 30 секунд после начала введения. Каждый тестовый раствор повторно вводили через каждый час 1 час или дольше. До введение и после заключительного введения, 1% пропофола «Maruishi» (название японского продукта) вводили крысам, и только таких индивидуумов, которые демонстрировали мышечное сокращение, использовали в тесте. Анализ полученной электромиограммы проводили с применением PowerLab (16sp, ADInstruments). Необработанные сигналы были очищены и интегрированы, чтобы обеспечить количественные данные (μV⋅s). Результаты представлены в качестве процентных величин относительно величины до введения, взятого за 100%.
Пример 1
В воде для инъекции растворяли 0,06 г глицина, 0,67 г хлорида натрия, 30 г 0,1 M HCl и 1,0 г бромида рокурония, и дополнительно добавляли воду для инъекции, чтобы довести объем до 100 мл.
pH полученного препарата составлял 2,0. После этого препарат хранили при 40°C в течение 3 месяцев и 6 месяцев, определяли pH и уровень образования сопутствующей рокуронию примеси С. pH составлял 2,0 в обоих случаях (после 3-месячного хранения и 6-месячного хранения), и уровень образования сопутствующей рокуронию примеси С составлял 1,24% (после 3-месячного хранения) и 2,52% (после 6-месячного хранения).
Пример 2
В воде для инъекций растворяли 0,55 г глицина, 0,50 г хлорида натрия, 30 г 0,1 M HCl и 1,0 г бромида рокурония, и затем добавляли воду для инъекции, чтобы довести объем до 100 мл.
pH полученного препарата составлял 3,0. После этого препарат хранили при 40°C в течение 3 месяцев и 6 месяцев, и определяли pH и уровень образования сопутствующей рокуронию примеси С. pH составлял 3,0 в обоих случаях (после 3-месяцев хранения и 6-месяцев хранения), и уровни образования сопутствующей рокуронию примеси С составляли 0,77% (после 3-месяц хранения) и 1,58% (после 6-месяцев хранения).
Справочный пример 1
В воде для инъекции растворяли 4,58 г глицина, 30 г 0,1 M HCl и 1,0 г бромида рокурония и дополнительно добавляли воду для инъекции, чтобы довести объем до 100 мл.
pH полученного препарата составлял 4,0. После этого препарат хранили в течение 3 месяцев и 6 месяцев таким же образом, как в примере 1, pH и определяли уровень образования сопутствующей рокуронию примеси С. pH составлял 4,0 в обоих случаях, и уровни образования сопутствующей рокуронию примеси С составляли 2,81% (после 3-месяцев хранения) и 5,36% (после 6-месяцев хранения).
Сравнительный пример 1
Препарат рокурония, композиция которого была идентичной композиции коммерческого препарата рокурония (ацетатный буферный раствор, 0,15 M в отношении ацетатных ионов, pH 4,0) получали таким же образом, как в примере 1. После этого препарат хранили в течение 3 месяцев и 6 месяцев таким же образом, как в примере 1, pH и определяли уровень образования сопутствующей рокуронию примеси С. pH составлял 4,0 в обоих случаях, и уровни образования сопутствующей рокуронию примеси С составляли 2,53% (после 3-месяц хранения) и 5,46% (после 6-месяцев хранения).
Результаты обобщены в таблице 1.
Таблица 1
(M)
(M)
Пример: Пример
Ref. Пример: Справочный пример
Comp. Пример: Сравнительный пример
Результаты в таблице 1 ясно демонстрируют, что посредством корректировки рН до предопределенного диапазона уровень образования сопутствующей рокуронию примеси С заметно снижается, и стабильность увеличена по сравнению с тем случаем, когда pH составляет 4,0.
В частности, сравнение примера 1, примера 2 и справочного примера 1 продемонстрировало удивительное поведение, со снижением pH, уровень образования сопутствующей рокуронию примеси С не просто снижался, а стал увеличиваться. Кроме того, в этих примерах, pH не изменился, что продемонстрировало, что препараты рокурония были чрезвычайно стабильными. Дополнительно, сравнение справочного примера 1 и сравнительного примера 1 продемонстрировало, что такая стабильность не зависела от типа буферного раствора.
Пример 3
В воде для инъекций растворяли 1,17 г глицина, 0,37 г хлорида натрия, 45 г 0,1 M HCl и 1,0 г бромида рокурония, и дополнительно добавляли воду для инъекции, чтобы довести объем до 100 мл.
pH полученного препарата составлял 3,0. После того, как препарат термически обрабатывали, при 121°C в течение 20 минут, и определяли pH и уровень образования сопутствующей рокуронию примеси С. pH составлял 3,0 и уровень образования сопутствующей рокуронию примеси С составлял 0,28%.
Пример 4
Препарат, полученный в примере 2 (pH 3,0), термически обрабатывали таким же образом, как в примере 3, а затем определяли pH и уровень образования сопутствующей рокуронию примеси С. РН составлял 3,0 и уровень образования сопутствующей рокуронию примеси С составлял 0,23%.
Пример 5
В воде для инъекций растворяли 0,18 г глицина, 0,64 г хлорида натрия, 20 г 0,1 M HCl и 1,0 г бромида рокурония, и дополнительно добавляли воду для инъекции, чтобы довести объем до 100 мл.
pH полученного препарата составлял 3,0. После того, как препарат термически обрабатывали, таким же образом, как в пример е3, и определяли pH и уровень образования сопутствующей рокуронию примеси С. рН составлял 3,1 и уровень образования сопутствующей рокуронию примеси С составлял 0,23%.
Сравнительный пример 1
Препарат, полученный в сравнительном примере 1 (pH 4,0), термически обрабатывали таким же образом, как в примере 3, а затем определяли pH и уровень образования сопутствующей рокуронию примеси С. рН составлял 4,0 и уровень образования сопутствующей рокуронию примеси С составлял 0,75%.
Результаты обобщены в таблице 2.
Таблица 2
(M)
(M)
Результаты в таблице 2 ясно демонстрируют, что в случаях, когда рН является фиксированной величиной, несмотря на отличие в концентрации буферного раствора уровень образования сопутствующей рокуронию примеси С заметно снижен. Даже после термической обработки рН ненамного изменялся.
Справочный пример 2
В воде для инъекций растворяли 0,90 г хлорида натрия, 15 г 0,1 M HCl и 1,0 г бромида рокурония и дополнительно добавляли воду для инъекции, чтобы довести объем до 100 мл.
pH полученного препарата составлял 3,0. После того, как препарат термически обрабатывали, таким же образом, как в примере 3, определяли рН. рН составлял 3,3.
Результаты справочного примера 2 и примера 5 обобщены в таблице 3.
Таблица 3
(M)
(M)
Результаты в таблице 3 ясно демонстрируют, что без буферного действия pH намного менялся посредством термической обработки.
Пример 6
В воде для инъекций растворяли 0,55 г глицина, 0,50 г хлорида натрия, 51 г 0,1 M HCl и 1,0 г бромида рокурония и дополнительно добавляли воду для инъекции, чтобы довести объем до 100 мл.
pH полученного препарата составлял 2,5. После того, как препарат термически обрабатывали, таким же образом, как в примере 3, определяли pH и уровень образования сопутствующей рокуронию примеси С. рН составлял 2,5 и уровень образования сопутствующей рокуронию примеси С составлял 0,10%.
Пример 7
В воде для инъекций растворяли 0,55 г глицина, 0,50 г хлорида натрия, 38 г 0,1 M HCl и 1,0 г бромида рокурония и дополнительно добавляли воду для инъекции, чтобы довести объем до 100 мл.
pH полученного препарата составлял 2,8. После того, как препарат термически обрабатывали, таким же образом, как в примере 3, определяли pH и уровень образования сопутствующей рокуронию примеси С. рН составлял 2,8 и уровень образования сопутствующей рокуронию примеси С составлял 0,14%.
Пример 8
В воде для инъекций растворяли 0,55 г глицина, 0,50 г хлорида натрия, 27 г 0,1 M HCl и 1,0 г бромида рокурония и дополнительно добавляли воду для инъекции, чтобы довести объем до 100 мл.
рH полученного препарата составлял 3,2. После того, как препарат термически обрабатывали, таким же образом, как в примере 3, определяли pH и уровень образования сопутствующей рокуронию примеси С. РН составлял 3,2 и уровень образования сопутствующей рокуронию примеси С составлял 0,27%.
Пример 9
В воде для инъекций растворяли 0,55 г глицина, 0,50 г хлорида натрия, 21 г 0,1 M HCl и 1,0 г бромида рокурония и дополнительно добавляли воду для инъекции, чтобы довести объем до 100 мл.
рH полученного препарата составлял 3,5. После того, как препарат термически обрабатывали, таким же образом, как в примере 3, определяли pH и уровень образования сопутствующей рокуронию примеси С. рН составлял 3,5 и уровень образования сопутствующей рокуронию примеси С составлял 0,31%.
Результаты обобщены в таблице 4. В таблице 4 результаты примера 4 и сравнительного примера 1, которые уже были продемонстрированы в таблице 2, представлены вместе для ссылки.
Таблица 4
(M)
(M)
Результаты в таблице 4 ясно демонстрируют, что в случаях, когда pH находится в предопределенном диапазоне, несмотря на различия в pH, уровень образования сопутствующей рокуронию примеси С заметно снижен. Кроме того, не наблюдали никакого значительного изменения рН, т.е. изменение pH заметно снижено.
Пример 10
В воде для инъекций растворяли 15 г 0,1 M соляной кислоты, 0,45 г хлорида натрия, 0,42 г калий водород фталата и 0,50 г бромида рокурония, и дополнительно добавляли воду для инъекций, чтобы довести объем до 50 мл.
рH полученного препарата составлял 3,0. После того, как препарат термически обрабатывали, таким же образом, как в примере 3, определяли pH и уровень образования сопутствующей рокуронию примеси С. рН составлял 3,0 и уровень образования сопутствующей рокуронию примеси С составлял 0,25%.
Пример 11
В воде для инъекций растворяли 0,45 г хлорида натрия, 0,34 г гидрата лимонной кислоты, 2,46 г 0,1 M раствора гидроксида натрия и 0,50 г бромида рокурония, и дополнительно добавляли воду для инъекций, чтобы довести объем до 50 мл.
рH полученного препарата составлял 3,0. После того, как препарат термически обрабатывали, таким же образом, как в примере 3, определяли pH и уровень образования сопутствующей рокуронию примеси С. рН составлял 3,0 и уровень образования сопутствующей рокуронию примеси С составлял 0,19%.
Пример 12
В воде для инъекций растворяли 0,45 г хлорида натрия, 0,23 г винной кислоты, 2,50 г 0,1 M раствора гидроксида натрия и 0,50 г бромида рокурония, и дополнительно добавляли воду для инъекций, чтобы довести объем до 50 мл.
рH полученного препарата составлял 3,0. После того, как препарат термически обрабатывали, таким же образом, как в примере 3, определяли pH и уровень образования сопутствующей рокуронию примеси С. рН составлял 3,0 и уровень образования сопутствующей рокуронию примеси С составлял 0,28%.
Результаты обобщены в таблице 5. В таблице 5, результаты сравнительного примера 1, которые уже были представлены в таблице 2, представлены вместе для ссылки.
Таблица 5
Результаты в таблице 5 ясно демонстрируют, что в случаях, когда pH находится в предопределенном диапазоне, несмотря на различия в типе буферного раствора уровень образовавшейся сопутствующей рокуронию примеси С после термической обработки заметно снижен, и изменение рН также является заметно сниженным.
Оценка сосудистого раздражения
Препарат рокурония, полученный в примере 6 (pH 2,5) и коммерческий препарат рокурония (торговое название: ESLAX (зарегистрированный товарный знак) внутривенно 50 мг/5,0 мл, ацетатный буферный раствор, 0,15 M в отношении ацетатных ионов, pH 4,0) (Сравнительный пример 2) были раздельно оценены в отношении сосудистого раздражения.
Результаты представлены в таблице 6.
Таблица 6
No.
Результаты в таблице 6 ясно демонстрируют, что несмотря на то, что pH ниже, чем рН в сравнительном примере 2 в качестве коммерческого продукта, сосудистого раздражения не наблюдали. Таким образом, в настоящем изобретении, стабильность препарата рокурония увеличена, не вызывая раздражения кровеносных сосудов.
Оценка боли при инъекции
Препарат рокурония, полученный в примере 2 (pH 3,0), препарат рокурония, полученный в примере 6 (pH 2,5) и сравнительном примере 2, были раздельно оценены в отношении боли при инъекции.
Результаты представлены в таблице 7 и на фиг. 1.
Таблица 7
(процент относительно величины до введения)
Результаты в таблице 7 ясно демонстрируют, что препараты рокурония из примеров 2 и 6, по сравнению с коммерческим продуктом, заметно снижали боль при инъекции до степени статистически значимого отличия. Как результат, было выявлено, что настоящее изобретение относится к препарату рокурония, которой обладает увеличенной стабильностью и не вызывает боль при инъекции.
ПРИМЕНИМОСТЬ В ПРОМЫШЛЕННОСТИ
Настоящее изобретение увеличивает стабильность (стабильность хранения и т.д.) препарата рокурония, пригодного как миорелаксант или т.п.
Группа изобретений относится к препарату рокурония. Инъекционный препарат рокурония в жидкой форме содержит рокуроний и буферный раствор и имеет pH 3,5 или менее, где буферный раствор содержится в концентрации от 0,015 до 0,5 M и представляет собой буферный раствор на основе глицина и соляной кислоты. Также раскрыты способ увеличения или улучшения стабильности инъекционного препарата рокурония и способ предотвращения или уменьшения боли при инъекции и сосудистого раздражения, вызванного инъекционным препаратом рокурония. Группа изобретений обеспечивает повышенную стабильность препарата рокурония и уменьшение боли при его инъекции. 3 н. и 5 з.п. ф-лы, 1 ил., 7 табл., 12 пр.
1. Инъекционный препарат рокурония в жидкой форме, содержащий рокуроний и буферный раствор и имеющий pH 3,5 или менее, где буферный раствор содержится в концентрации от 0,015 до 0,5 M и представляет собой буферный раствор на основе глицина и соляной кислоты.
2. Инъекционный препарат рокурония по п. 1, имеющий pH от 2,5 до 3,5.
3. Инъекционный препарат рокурония по п. 1 или 2, имеющий pH от 2,8 до 3,2.
4. Инъекционный препарат рокурония по любому из пп. от 1 до 3, уровень образовавшейся сопутствующей рокуронию примеси С в котором после 6-месячного хранения при 40°C составляет 5% или менее и который предотвращает или уменьшает как боль при инъекции, так и сосудистое раздражение, вызванное инъекционным препаратом рокурония.
5. Инъекционный препарат рокурония по любому из пп. от 1 до 4, который хранится при комнатной температуре.
6. Способ увеличения или улучшения стабильности инъекционного препарата рокурония посредством корректировки рН препарата рокурония в жидкой форме, содержащего рокуроний и буферный раствор, до 3,5 или менее, где буферный раствор содержится в концентрации от 0,015 до 0,5 M и представляет собой буферный раствор на основе глицина и соляной кислоты.
7. Способ предотвращения или уменьшения боли при инъекции и сосудистого раздражения, вызванного инъекционным препаратом рокурония, посредством корректировки рН инъекционного препарата рокурония в жидкой форме, содержащего рокуроний и буферный раствор, до 3,5 или менее, где буферный раствор содержится в концентрации от 0,015 до 0,5 M и представляет собой буферный раствор на основе глицина и соляной кислоты.
8.Способ по п. 6 или 7, где указанный препарат рокурония может храниться при комнатной температуре.
| CN 103462885 A, 25.12.2013 | |||
| CN 101843593 A, 29.09.2010 | |||
| US 20070258908 A1, 04.02.2009 | |||
| СПОСОБЫ И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КЛОНИДИН, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ | 2009 |
|
RU2510263C2 |
Авторы
Даты
2019-11-13—Публикация
2014-06-26—Подача