Настоящее изобретение относится к способам детектирования антител против членов семейства сердечных рецепторов, наборам для осуществления способов согласно изобретению, применению указанных способов согласно изобретению для диагностики, терапевтического лечения и/или профилактики одного или более заболеваний, связанных с одним или более членами семейства сердечных рецепторов, в частности, заболевания, выбранного из группы, состоящей из высокого кровяного давления, дилатационной кардиомиопатии, глаукомы, хронической усталости и деменции, а также применению указанных способов согласно изобретению для а) идентификации модуляторов свойств связывания антител против членов семейства сердечных рецепторов или b) идентификации терапевтических агентов для лечения одного или более из перечисленных выше заболеваний.
Сердечная недостаточность (СН) представляет собой патологическое поражение сердца, приводящее к недостаточному кровоснабжению тканей тела. Причинные факторы СН включают пониженную насосную функцию сердца (систолическую сердечную недостаточность) или неполноценное наполнение сердца (диастолическую сердечную недостаточность). СН является основной причиной смертности в западном мире и создает огромную финансовую и социальную проблему. Примерно 2% всех взрослых людей страдает СН, при этом повышение частоты встречаемости и распространенности заболевания коррелирует с возрастом (6-10% людей возрастом 65 лет и старше страдают СН).
Функция сердца контролируется вегетативной нервной системой. Передача сигнала запускается сердечными рецепторами, главным образом, адренергическими рецепторами (АР) и мускариновыми ацетилхолиновыми рецепторами (mAChR). Адренергические рецепторы (AR) принадлежат к суперсемейству сопряженных с G-белком рецепторов (GPCR), которые являются мишенью катехоламинов, в частности, адреналина и норадреналина. У человека было описано девять AR, которые делят на три семейства: α1-адренергические рецепторы (α1-AR), α2-адренергические рецепторы (α2-AR) и β-адренергические рецепторы (β-AR). Было описано три подтипа β-AR: β1-AR, β2-AR и β3-AR, все из которых экспрессируются в сердце человека. AR регулируют многие физиологические процессы, включая пейсмейкерную активность сердца, сокращение миокарда и тонус мускулатуры сосудистых стенок. Особую клиническую значимость имеют β1-AR и β2-AR, при этом β1-AR представляет собой основной подтип в сердце. В связи с этим β1-AR является основной мишенью для класса терапевтически активных соединений, которые называются «β-блокаторами» и широко применяются для лечения сердечно-сосудистых заболеваний.
Помимо AR важную роль играют также ацетилхолиновые рецепторы (AChR). Существует два типа AChR: никотиновые AChR (nAChR) и мускариновые AChR (mAChR). nAChR являются ионотропными и, соответственно, функционируют как самостоятельные ионные каналы. mAChR являются метаботропными рецепторами (сопряженными с белками) и принадлежат суперсемейству сопряженных с G-белком рецепторов (GPCR). mAChR инициируют, например, сердечные сокращения и сердечное давление. mAChR дополнительно делат на пять подтипов на основе их фармакологических свойств: M1 - М5. mAChR с нечетными номерами M1, М3 и М5 связаны с гетеротримерным G-белком Gq. mAChR с четными номерами М2 и М4 связаны с гетеротримерным G-белком Gi. Активация М2, например, приводит к снижению частоты сердечных сокращений.
Аутоантитела («аАb») играют важную роль в патогенезе аутоиммунных заболеваний. Результаты недавних исследований указывают на патогенное и диагностическое значение антител («Аb») против сердечных рецепторов. Например, высокая концентрация аАb против α1-AR связана с повышенным кровяным давлением. Клинические исследования показывают значительную корреляцию повышенного титра аутоантител («аАb») против β1-AR у пациентов с СН по сравнению с контрольными здоровыми субъектами. Присутствие аАb против mAChR М2 связано с повышенным риском развития кардиомиопатии. Кроме того, была выявлена высокая частота встречаемости аАb против mAChR у пациентов с фибрилляцией (Semin. Immunopathol. 2014 May, 36(3), 351-63). В связи с ограниченной доступностью высокоэффективных способов скрининга эпидемиологическое исследование патогенного значения Аb против членов семейства сердечных рецепторов до сих пор не проводилось, и имеется мало доступных данных для дифференциальной диагностики и лечения сердечной дисфункции. Таким образом, разработка быстрого, специфичного, чувствительного и надежного способа детектирования аутоантител против конкретных сердечных рецепторов (субъединиц) может играть важную роль, в особенности если такой способ позволяет определять перекрестную реактивность. Такие способы дали бы возможность ранней или дифференциальной диагностики и могли бы иметь особое значение для предотвращения, лечения или контроля аутоиммунных расстройств, связанных с одним или более членами семейства сердечных рецепторов. Более того, желательно обеспечить дешевый и эффективный способ, который дополнительно позволил бы идентифицировать взаимодействия с модуляторами (т.е. активаторами, ингибиторами или молекулами, которые другим образом влияют на взаимодействие между антигеном и антителом и, соответственно, связывание одного или более члена семейства сердечных рецепторов с аАb или терапевтическим агентом).
Доступные на сегодняшний день способы исследования не могут обеспечить желаемую специфичность, масштабируемость, контролируемость, чувствительность и/или требуют большого количества биологического образца. Таким образом, существует необходимость в улучшении аналитических способов и технологий. Настоящее изобретение, определенное в формуле изобретения, позволяет преодолеть указанные выше проблемы предшествующего уровня техники с помощью предложенных способов, обеспечивающих повышенную скорость, специфичность и/или чувствительность, которые подходят также для автоматизации или высокоэффективного скрининга. Способы согласно настоящему изобретению приближены к физиологическим условиям, поскольку они позволяют антигену образовывать правильную трехмерную структуру. Это одно из основных отличий настоящего изобретения от способов, использующих белки или пептидные фрагменты, экспрессируемые в бактериях. Способы согласно изобретению подходят для автоматизации и осуществления в исследовательских и/или клинических лабораториях. Более того, способы согласно изобретению обеспечивают возможность идентификации специфичной перекрестной реактивности между патологическими или терапевтическими антителами и членами семейства сердечных рецепторов. Примечательно, что способы согласно настоящему изобретению благодаря их повышенной чувствительности и/или специфичности дают возможность дифференциального исследования взаимодействий, а также разработки улучшенных подходов и агентов для профилактики, диагностики и терапевтического лечения заболеваний или расстройств, связанных с членами семейства сердечных рецепторов.
Таким образом, согласно первому варианту реализации настоящего изобретения предложен способ детектирования в исследуемом образце присутствия и/или свойств связывания анализируемых антител, способных реагировать с одной или более антигенными молекулами, где указанный способ включает следующие этапы:
(a) обеспечение одной или более первых антигенных молекул, с которыми могут взаимодействовать анализируемые антитела, если они присутствуют в указанном образце, причем указанная первая антигенная молекула выбрана из семейства сердечных рецепторов (CRF); и
(b) обеспечение одной или более вторых антигенных молекул, с которыми могут взаимодействовать анализируемые антитела, если они присутствуют в указанном образце, причем указанная вторая антигенная молекула выбрана из CRF; и
(с) одновременное или последовательное приведение указанных первых антигенных молекул, обеспеченных на этапе (а), и указанных вторых антигенных молекул, обеспеченных на этапе (b), в контакт с исследуемым образцом позволяющее анализируемым антителам, если они присутствуют в указанном образце, взаимодействовать с указанными антигенными молекулами с образованием комплексов, содержащих [первую антигенную молекулу]-[анализируемое антитело]-[вторую антигенную молекулу]; и
(d1) обеспечение до, или одновременно с, или после этапа (с) средства иммобилизации, позволяющее иммобилизировать указанную первую антигенную молекулу, присутствующую в указанных комплексах, образованных на этапе (с), соответственно, способную образовывать указанные комплексы на этапе (с), на твердой подложке до, или одновременно с, или после этапа (с); и/или
(d2) обеспечение до, или одновременно с, или после этапа (с) второго средства мечения, в результате чего происходит мечение указанной первой антигенной молекулы, присутствующей в указанных комплексах, образованных на этапе (с), соответственно, способной образовывать указанные комплексы на этапе (с), указанным вторым средством мечения до, или одновременно с, или после этапа (с); и (е) обеспечение до, или одновременно с, или после этапа (с) первого средства мечения, в результате чего происходит мечение указанной второй антигенной молекулы, присутствующей в указанных комплексах, образованных на этапе (с), соответственно, способной образовывать указанные комплексы на этапе (с) указанным первым средством мечения до, или одновременно с, или после этапа (с); и
(g) детектирование присутствия указанных комплексов, образованных во время или после этапа (с), с получением показателя присутствия анализируемых антител в указанном образце,
где указанные первое и второе средства мечения различаются, и где в указанном способе предпочтительно не используются средства радиоактивного мечения.
Другой вариант реализации способа согласно изобретению включает следующие этапы:
(a) обеспечение одной или более первых антигенных молекул, с которыми могут взаимодействовать анализируемые антитела, если они присутствуют в указанном образце, и где первая антигенная молекула выбрана из семейства сердечных рецепторов (CRF); и
(b) обеспечение одной или более вторых антигенных молекул, с которыми могут взаимодействовать анализируемые антитела, если они присутствуют в указанном образце, причем указанная вторая антигенная молекула выбрана из CRF; и
(с) одновременное или последовательное приведение указанных первых антигенных молекул, обеспеченных на этапе (а), и указанных вторых антигенных молекул, обеспеченных на этапе (b), в контакт с исследуемым образцом позволяющее анализируемым антителам, если они присутствуют в указанном образце взаимодействовать с указанными антигенными молекулами с образованием комплексов, содержащих [первую антигенную молекулу]-[анализируемое антитело]-[вторую антигенную молекулу]; и (d1) обеспечение до этапа (с) средства иммобилизации, позволяющее иммобилизировать указанную первую антигенную молекулу, присутствующую в указанных комплексах, образованных на этапе (с), соответственно, способную образовывать указанные комплексы на этапе (с), на твердой подложке до этапа (с); и/или
(d2) обеспечение второго средства мечения до этапа (с), позволяющее метить указанную первую антигенную молекулу, присутствующую в указанных комплексах, образованных на этапе (с), соответственно, способную образовывать указанные комплексы на этапе (с), указанным вторым средством мечения до этапа (с); и
(е) обеспечение первого средства мечения до этапа (с), позволяющее метить указанную вторую антигенную молекулу, присутствующую в указанных комплексах, образованных на этапе (с), соответственно, способную образовывать указанные комплексы на этапе (с), указанным первым средством мечения до этапа (с); и
(g) детектирование присутствия указанных комплексов, образованных во время или после этапа (с), с получением показателя присутствия анализируемых антител в указанном образце,
где указанные первое и второе средства мечения различаются и где указанный способ предпочтительно не включает применение средств радиоактивного мечения. Согласно другому варианту реализации способов согласно изобретению также исключено: а) применение средств радиоактивного мечения и любых этапов, включающих преципитацию, или b) применение средств радиоактивного мечения и любых этапов, включающих центрифугирование.
Согласно настоящему изобретению, первое и второе средства мечения выбраны таким образом, что они являются различным и обеспечивают различимые и, соответственно, раздельные сигналы, предпочтительно, сигналы, раздельно поддающиеся детектированию с помощью единственного измерения в ходе применимого способа детектирования. Согласно альтернативным вариантам реализации изобретения, антигенные фрагменты первых и вторых антигенных молекул являются идентичными или различными. Согласно другому варианту реализации изобретения первые и/или вторые антигенные молекулы заключают в мембраноподобное или мембранное окружение. Согласно другому варианту реализации настоящего изобретения анализируемые Аb из исследуемого образца представляют собой аАb конкретного субъекта или терапевтические Аb или диагностические Аb, при этом последние предпочтительно являются моноклональными. Согласно другому варианту реализации способов согласно изобретению один или более компонентов, выбранных из первого средства мечения, второго средства мечения, средства иммобилизации и модуляторов, обеспечивают до приведения указанных антигенов в контакт с указанными анализируемыми Аb, т.е. один или оба антигена являются меченными и, соответственно, иммобилизируются для получения первых и вторых антигенных молекул до образования указанных комплексов вместе с антителами.
Другой объект изобретения представляет собой применение in vitro способов согласно изобретению для диагностирования у субъекта заболевания или предрасположенности к заболеванию, связанному с функцией рецептора (или его части), являющегося членом семейства сердечных рецепторов («CRF»). Другой предмет изобретения представляет собой применение способов и/или наборов согласно изобретению для идентификации фармацевтически эффективного соединения для лечения и/или профилактики одного или более заболеваний, связанных с функцией рецептора (или его части), являющегося членом CRF, в частности, заболеваний, выбранных из высокого кровяного давления, дилатационной кардиомиопатии, глаукомы, хронической усталости и деменции, в частности, предпочтительное применение автоматизированного способа, в частности, высокоэффективного скринингового анализа («HTS»).
В предпочтительном варианте способы согласно настоящему изобретению представляют собой способы in vitro, которые помимо этапов, перечисленных выше, могут включать этапы, связанные с предварительной обработкой или исследованием образца, соответственно, дополнительной обработкой первичных или вторичных измерительных сигналов способа, в частности, связанных с детектированием присутствия указанных комплексов. Способы согласно изобретению могут частично или полностью осуществляться вручную или автоматически. Необязательно, один или более из этапов (а), (b), (с), (c1), (с2), (d), (d1), (d2), (е), (f) и (g), (h) и (i) способа согласно изобретению могут быть частично или полностью автоматизированными, включая подходящее роботизированное и сенсорное оборудование и/или компьютеризованную обработку и/или оценку первичных сигналов. Более того, специалисту в данной области техники известно, что для осуществления способов согласно изобретению предпочтительно требуется калибровка или стандартизация сигнала для того, чтобы обеспечить количественную оценку детектируемых сигналов и, соответственно, присутствия комплексов, подлежащих идентификации, например, с помощью внутреннего или внешнего стандарта, т.е. одного или более известных количеств референсных соединений (референсных Аb или комплексов).
Согласно альтернативным вариантам реализации настоящего изобретения первые антигены и вторые антигены идентичны или не идентичны (т.е. различны). Согласно дополнительным альтернативным вариантам реализации изобретения, первые и вторые антигены различаются и принадлежат к одному или разным членам CRF. Согласно другому варианту реализации изобретения первый и/или второй антиген заключают в мембраноподобное или мембранное окружение. Согласно предпочтительному варианту реализации изобретения способ дает возможность детектирования указанных Аb против члена CRF в концентрации от примерно 0,03 до 3 нг/мл, предпочтительно от 0,03 до 1 нг/мл и более предпочтительно от 0,03 до 0,1 нг/мл.
Согласно другому варианту реализации способов согласно изобретению одну или более первых антигенных молекул обеспечивают до этапа (с) в иммобилизированном виде (например, присоединенной к твердой подложке), предпочтительно, до контакта с исследуемым образцом. Необязательно твердая подложка может быть представлена в жидкой форме (например, в виде дисперсии, суспензии или коллоида), в качестве альтернативы, указанная подложка может быть предложена, например, в виде микротитрационного планшета или любого материала, подходящего для аффинной хроматографии. Указанные иммобилизированные одну или более первые антигенные молекулы затем приводят одновременно или последовательно в контакт с исследуемым образцом и одной или более вторыми антигенными молекулами.
Иммобилизированные одна или более первые антигенные молекулы при контакте с указанным образцом могут образовывать промежуточные комплексы, содержащие первую антигенную молекулу и анализируемое антитело, где указанные одна или более первые антигенные молекулы иммобилизированы на твердой подложке, и образованный таким образом иммобилизированный промежуточный комплекс затем приводят в контакт с одной или более вторыми антигенными молекулами, присутствующими в растворе, с образованием описанных выше комплексов, содержащих первую антигенную молекулу, анализируемое антитело и вторую антигенную молекулу, прямо или непрямо иммобилизированную на твердой подложке через первую антигенную молекулу. Согласно другому варианту реализации способов согласно изобретению одну или более первых антигенных молекул, меченных вторым средством мечения, обеспечивают до этапа (с).
Согласно другому варианту реализации способов согласно изобретению одну или более первых антигенных молекул иммобилизируют на твердой подложке и обеспечивают до этапа (с). Согласно другому варианту реализации способов согласно изобретению одну или более вторых антигенных молекул, меченных первым средством мечения, обеспечивают до этапа (с). Согласно другому варианту реализации способов согласно изобретению одну или более первых антигенных молекул, иммобилизированных на твердой подложке, и одну или более вторых антигенных молекул, меченных первым средством мечения, обеспечивают до этапа (с). Согласно другому варианту реализации способов согласно изобретению одну или более первых антигенных молекул, меченных вторым средством мечения, и одну или более вторых антигенных молекул, меченных первым средством мечения, обеспечивают до этапа (с). Согласно другому варианту реализации способов согласно изобретению одна или более первых антигенных молекул иммобилизированы на твердой подложке, и одна или более вторых антигенных молекул мечены первым средством мечения, где указанные вторые антигенные молекулы предложены в растворе. Согласно другому варианту реализации способов согласно изобретению одна или более первых антигенных молекул иммобилизированы на твердой подложке, и одна или более вторых антигенных молекул мечены первым средством мечения, где указанные первые и вторые антигенные молекулы предложены в растворе. Другой вариант реализации способов согласно настоящему изобретению позволяет непосредственно отслеживать взаимодействия между (i) указанными анализируемыми антителами, присутствующими в образце, и (ii) указанными одной или более первыми антигенными молекулами и (iii) указанными одной или более вторыми антигенными молекулами в определенном порядке путем применения аналитического метода детектирования, известного в данной области техники (например, неконкурентных или конкурентных анализов), например, анализов по типу «сэндвич» или по типу резонансного переноса энергии (resonance energy transfer, RET), при этом последний тип анализа не требует иммобилизации и/или отделения указанных первых антигенных молекул от жидкой фазы. Другой вариант реализации способов согласно настоящему изобретению позволяет идентифицировать модуляторы, которые способны взаимодействовать с комплексами, образующимися на этапе (с), и/или которые способны препятствовать образованию комплексов в соответствии с этапом (с), согласно определению способа детектирования анализируемых антител в соответствии с настоящим изобретением. Соответственно, другой вариант реализации способов согласно настоящему изобретению также включает этап (f) обеспечения до, или одновременно с, или после этапа (с) одного или более исследуемых соединений, способных взаимодействовать с комплексами, образующимися на этапе (с), и/или способных препятствовать образованию указанных комплексов в соответствии с этапом (с), и одновременное или последовательное приведение указанных исследуемых соединений в контакт с указанным образцом, указанными одной или более первыми антигенными молекулами и/или указанными одной или более вторыми антигенными молекулами до, или одновременно с, или после этапа (с) или приведение в контакт указанных исследуемых соединений одновременно или последовательно с указанными комплексами, образующимися во время или после этапа (с). Согласно другому варианту реализации способов в соответствии с настоящим изобретением один или более модуляторов (т.е. «исследуемых соединений на предмет их способности взаимодействовать с указанными комплексами или образовывать комплексы») обеспечивают до этапа (с) способа детектирования антитела согласно настоящему изобретению. Согласно другим вариантам реализации способов согласно настоящему изобретению одно или более из указанных средств, выбранных из группы, состоящей из указанных средств иммобилизации, указанного второго средства мечения и указанного первого средства мечения, обеспечивают до этапа (с) способа детектирования аутоантитела в соответствии с настоящим изобретением.
Согласно дополнительному варианту реализации настоящего изобретения предложен набор, применимый для осуществления любых способов в соответствии с настоящим изобретением, содержащий (а) одну или более первых антигенных молекул, выбранных из CRF, определенных в одном или более способах согласно изобретению; (b) одну или более вторых антигенных молекул, выбранных из CRF, определенных в одном или более способах согласно изобретению; (c1) средство иммобилизации, определенное в одном или более способах согласно изобретению и/или (с2) второе средство мечения, определенное в одном или более способах согласно изобретению; и (d) первое средство мечения, определенное в одном или более способах согласно изобретению, и необязательно одно или более анализируемых антител, способных реагировать с одной или более первыми и вторыми антигенными молекулами, определенным в одном или более способах согласно изобретению. Согласно другому варианту реализации изобретения набор в соответствии с настоящим изобретением содержит (а) указанные первые антигенные молекулы, меченные вторым средством мечения, или (а) указанные первые антигенные молекулы, иммобилизированные на твердой подложке; и (b) указанные вторые антигенные молекулы, меченные первым средством мечения.
Согласно другим вариантам реализации настоящего изобретения, предложено применение любых способов или наборов согласно изобретению для диагностики присутствия, возникновения или распространения заболевания или дисфункции, связанной с одним или более членами семейства сердечных рецепторов, и/или для идентификации фармацевтически эффективного соединения для лечения и/или профилактики заболевания или дисфункции, связанной с одним или более членами семейства сердечных рецепторов. Другой предмет изобретения представляет собой применение одного или более членов, выбранных из группы семейства сердечных рецепторов (CRF), меченных двумя или более различными средствами мечения, которые предпочтительно дифференциально поддаются детектированию, для осуществления способа идентификации одного или более антител против одного или более членов CRF, создания наборов для осуществления указанных способов и их диагностического или терапевтического применения и их применения для идентификации терапевтически эффективных агентов для лечения заболевания или дисфункции, связанной с одним или более членами CRF, в частности, для лечения заболевания, выбранного из группы, состоящей из высокого кровяного давления, дилатационной кардиомиопатии, глаукомы, хронической усталости и деменции.
В целом, все термины и фразы, употребляемые в настоящей заявке, имеют значение, соответствующее общим для специалиста в данной области техники. Однако приведенные ниже предпочтительные определения некоторых терминов и фраз могут дополнительно уточнять настоящее изобретение:
Термины «полипептид» и «белок» употребляются как синонимы.
Термин «образец» в соответствии с настоящим изобретением обозначает «образец, подлежащий анализу», который по существу включает жидкость, суспензию или дисперсию, предпочтительно, биологического и/или синтетического химического происхождения. Образец может быть получен с помощью хорошо известных методов и может состоять из выделенных биологических жидкостей, таких как кровь, плазма крови, сыворотка, спинномозговая жидкость, слюна, моча, семенная жидкость, слезная жидкость и другие. «Образец» может дополнительно включать волосы, ногтевые срезы, кал или другие экскременты, выделенные клетки, клеточные гомогенаты, тканевые гомогенаты или гомогенаты органов, полученные от животного (например, мыши, крысы, морской свинки, собаки, свиньи, приматов) или человека. Образцы тканей или образцы органов могут быть получены из любой ткани или органа путем, например, биопсии или мазка. Выделенные клетки могут быть получены из биологических жидкостей или тканей или органов с помощью методов разделения, таких как центрифугирование или сортировка клеток. В предпочтительном варианте клеточные образцы, образцы тканей или образцы органов получают из таких клеток, тканей или органов, которые экспрессируют, содержат, накапливают, концентрируют или продуцируют антигены, анализируемые антитела или модуляторы, указываемые в настоящей заявке. Образец может быть подвергнут обработке и/или модификации, известной специалисту в данной области техники, для обеспечения возможности хранения или дополнительной обработки в способе согласно изобретению. Например, специалисту в данной области техники известно, что образец можно разводить в подходящем буфере. Если образец получен из мочи, то любой биотин, содержащийся в образце, необходимо удалить, чтобы он не мешал точному детектированию биотина в случае его использования в качестве средства мечения способа согласно изобретению. В предпочтительном варианте образец может быть выбран из образца, полученного от субъекта с подозрением на заболевание или состояние, связанное с нарушением функции, или от субъекта с предполагаемым началом заболевания или состояния, связанного с нарушением функции, или от субъекта, страдающего указанным заболеванием или состоянием, связанным с нарушением функции (или от субъекта, у которого необходимо контролировать указанное состояние), которая связана с регуляцией сердечной функции или кровяного давления, или связанными заболеваниями (например, глаукомой, деменцией, хронической усталостью или сердечной аритмией). Согласно одному варианту реализации изобретения образец может представлять собой референсный образец и содержать анализируемые антитела и/или один или более модуляторов известного типа и в известном количестве, предпочтительно, и анализируемые антитела, и один или более модуляторов известного типа и в известном количестве. Это может иметь особую значение для идентификации модуляторов, описанных в настоящей заявке.
В целом, термин «антигенная молекула» в соответствии с настоящим изобретением обобозначает полученное синтетическим путем соединение, содержащее связанный (иммобилизированный и/или меченый) антиген, с которым может взаимодействовать анализируемое антитело и которое способно связываться с анализируемым антителом (одним или более) с образованием специфических комплексов, содержащих анализируемое антитело и антигенную молекулу.
Термин «антиген» в соответствии с настоящим изобретением обозначает любую молекулу из группы семейства сердечных рецепторов, их субъединиц, пептидов или фрагментов, с которыми анализируемое антитело может взаимодействовать и которые способны связываться с анализируемым антителом (одним или более) с образованием специфичных комплексов, содержащих анализируемое антитело и антигенную молекулу. Антиген может являться природным или синтетическим, и его модификации предпочтительно представляют собой такие модификации, которые не оказывают негативного влияния на связывающие свойства согласно способам в соответствии с настоящим изобретением.
Термин «анализируемое антитело» в соответствии с настоящим изобретением обозначает любое антитело, способное связываться с антигеном (одним или более), являющимся членом CRF, и, соответственно, способное связываться с одним или более рецепторов, выбранных из группы, состоящей из адренергических рецепторов (AR) и ацетилхолинергических рецепторов (AChR), присутствие которых оценивают путем количественного и/или качественного анализа с помощью способов согласно изобретению, как дополнительно изложено в настоящей заявке, таких как α1-AR, α2-AR, β-AR, никотиновые AChR, мускариновые AChR и их субъединицы, пептиды, фрагменты и/или варианты.
Конкретные примеры членов CRF представляют собой: α1A-AR, α1B-AR, α1D-AR, α2A-AR, α2B-AR, α2C-AR, β1-AR, β2-AR, β3-AR, никотиновые нейрональные AChR, никотиновые мышечные AChR, мускариновые M1-AChR, мускариновые M2-AChR, мускариновые М3-AChR, мускариновые M4-AChR, мускариновые M5-AChR М5. Согласно изобретению, ортологичные или паралогичные последовательности также могут являться подходящими. Термин «анализируемое антитело» также обозначает моноклональное антитело, поликлональное антитело, одноцепочечное антитело, биспецифичное антитело или диатело, бивалентное антитело, мультиспецифичное антитело, синтетическое антитело, аптамер, шпигельмер, человеческое или гуманизированное антитело, а также их фрагменты или варианты, такие как, например, Fab-, Fv- или scFv-фрагменты, или химически модифицированное производное любых из указанных вариантов, например, конъюгаты антитело-лекарственное средство, доменные антитела, наноантитела или миметики антител (дарпины, «сконструированные белки с анкириновым повтором»). Согласно конкретным вариантам реализации настоящего изобретения, термин «анализируемые антитела» обозначает эндогенные аутоантитела, терапевтические антитела и/или диагностические антитела.
Термин «член семейства сердечных рецепторов» и, соответственно, «семейство сердечных рецепторов» (CRF) в соответствии с настоящим изобретением обозначает любой полипептид, выбранный из группы, состоящей из адренергических рецепторов (AR) и ацетилхолинергических рецепторов (AChR), таких как α1-AR, α2-AR, β-AR, никотиновые AChR, мускариновые AChR, и их субъединиц, пептидов, фрагментов и/или вариантов, в частности, α1A-AR, α1B-AR, α1D-AR, α2A-AR, α2B-AR, α2C-AR, β1-AR, β2-AR, β3-AR, нейрональных никотиновых AChR, никотиновых мышечных AChR, мускариновых Ml-AChR, мускариновых M2-AChR, мускариновых M3-AChR, мускариновых M4-AChR, мускариновых M5-AChR, включая их субъединицы, варианты, аналоги, производные, фрагменты, ортологичные и паралогичные последовательности, которые содержат связывающий антитело домен, более предпочтительно, обозначает указанные молекулы, имеющие природное происхождение. В предпочтительном варианте CRF представляет собой CRF животного происхождения (например, CRF мыши, крысы, морской свинки, собаки, свиньи, примата) или человеческого происхождения, более предпочтительно, CRF человека.
Согласно дополнительным альтернативным вариантам реализации способов согласно изобретению термин «CRF» обозначает непосредственно: а) адренергический рецептор (AR); b) ацетилхолинергический рецептор (AChR); с) адренергический α1-рецептор; d) адренергический α2-рецептор; е) адренергический β-рецептор; f) никотиновый ацетилхолинергический рецептор; g) мускариновый ацетилхолинергический рецептор; или его субъединицу, вариант, аналог, производное или фрагмент (для каждого случая), который содержит связывающий антитело домен, более предпочтительно, обозначает указанные молекулы, имеющие природное происхождение. В предпочтительном варианте CRF представляет собой CRF животного происхождения (например, мыши, крысы, морской свинки, собаки, свиньи, приматов) или человеческого происхождения, более предпочтительно, CRF человека, тогда как согласно другим вариантам реализации изобретения, указанное выше определение относится только к первой антигенной молекуле.
Подходящие полипептиды и соответствующие гены, кодирующие члены семейства CRF, хорошо известны специалисту в данной области техники. Члены CRF, полученные рекомбинантным путем, являются коммерчески доступными (например, из компании R&D Systems, Inc., Миннеаполис, Миннесота 55413, США, OriGene Technologies, Inc., Роквилл, Мерилэнд 20850, США) и хорошо известны из баз данных последовательностей белков и нуклеиновых кислот, таких как, например, EMBL, Genbank и другие. Для членов CRF человека на сегодняшний день доступны коды доступа баз данных, приведенные для конкретных рецепторных белков, однако следует понимать, что настоящее изобретение не ограничивается указанными белками.
Термин «адренергический рецептор» («AR») в соответствии с настоящим изобретением обозначает любой выделенный полипептид, имеющий встречающуюся в природе аминокислотную последовательность или любой ее вариант. Аминокислотные последовательности и последовательности гена, кодирующие AR, хорошо известны специалисту в данной области техники, например, из баз данных последовательностей, таких как UniProtKB или http://www.rcsb.org. Следующие последовательности приведены в качестве примера:
a) α1-адренергические рецепторы (α1-AR):
Р35348 (ADA1A HUMAN); Р35368 (ADA1B HUMAN); P25100 (ADA1D HUMAN);
b) α2-адренергические рецепторы (α2-AR):
P08913 (ADA2A HUMAN); PI8089 (ADA2B HUMAN); PI8825 (ADA2C HUMAN);
с) β-адренергические рецепторы (P-AR):
Р08588 (ADRB1 HUMAN); Р07550 (ADRB2 HUMAN); Р13945 (ADRB3 HUMAN).
Согласно другому варианту реализации настоящего изобретения AR обозначает вариант AR, который отвечает за распространение патологии или дисфункции у животных (например, мыши, крысы, морской свинки, собаки, свиньи, примата) или человека. Согласно другому варианту реализации настоящего изобретения AR помещен в мембранное окружение.
Термин «ацетилхолинергический рецептор» («AChR») в соответствии с настоящим изобретением обозначает любой выделенный полипептид, имеющий встречающуюся в природе аминокислотную последовательность или любой вариант никотиновых (nAChR) или мускариновых (mAChR) AChR. На сегодняшний день идентифицировано 17 различных субъединиц nAChR, которые делят на субъединицы мышечного и нейронального типа (CHRNA1; CHRNA2; CHRNA3; CHRNA4; CHRNA5; CHRNA6; CHRNA7; CHRNA8; CHRNA9; CHRNA10; CHRNB1; CHRNB2; CHRNB3; CHRNB4; CHRND; CHRNE и CHRNG). Из указанных 17 субъединиц α2-α7 и β2-β4 были идентифицированы у людей. Никотиновые AChR представляют собой пентамеры указанных субъединиц, таким образом, существует широкий диапазон вариаций в пределах существующих биологических nAChR, которые можно разделить на мышечные и ганглиозные рецепторы и различные классы рецепторов ЦНС.
Аминокислотные последовательности и последовательности гена, кодирующего AChR, хорошо известны специалистам в данной области техники, например, из баз данных последовательностей, таких как UniProtKB или http://www.rcsb.org (следующие далее последовательности приведены в качестве примера: Мускариновые ацетилхолиновые рецепторы (mAChR):
PI 1229 (АСМ1 HUMAN); P08172 (ACM2 HUMAN); P20309 (ACM3 HUMAN); P08173 (ACM4 HUMAN); P08912 (ACM5 HUMAN)),
так же как для никотиновых ацетилхолиновых рецепторов (nAChR) и их субъединиц (UE), например, из UniProtKB: α1 (Р02708); α2 (Q15822); α3 (P32297); α4 (P43681); α5 (P30532); α6 (Q15825); α7 (P36544); β1 (PI 1230); β2 (P17787); β3 (Q05901); β4 (P30926); γ (P07510); δ (Q07001); ε (Q04844).
Согласно другому варианту реализации настоящего изобретения AChR обозначает вариант AChR, который отвечает за распространение патологии или дисфункции у животных (например, мыши, крысы, морской свинки, собаки, свиньи, примата) или человека. Согласно другому варианту реализации настоящего изобретения AChR помещен в мембранное окружение.
Термин «вариант» в соответствии с настоящим изобретением обозначает любой фрагмент, аналог, производное, гибридный белок, субъединицу или цепь субъединицы антигена, приведенного выше.
В предпочтительном варианте «вариант» может иметь по существу такие же биологические свойства, как соответствующие полипептиды или белки, указываемые выше, предпочтительно, с учетом их иммунологических свойств, и более предпочтительно, с учетом свойств, отвечающих за дисфункцию. Более того, следует понимать, что термин «вариант» в соответствии с настоящим изобретением обозначает любую аминокислотную последовательность, которая отличается в результате по меньшей мере одной аминокислотной замены, модификации, делеции и/или вставки, где указанная аминокислотная последовательность варианта предпочтительно остается по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичной аминокислотной последовательности исходной последовательности соответствующего перечисленного полипептида или белка, предпочтительно, по всей длине конкретного полипептида или белка. Варианты могут являться аллельными вариантами или любыми другими видоспецифичными гомологами, паралогами или ортологами. Более того, варианты, указываемые в настоящей заявке, включают фрагменты соответствующих полипептидов или белков, перечисленных ранее в настоящей заявке в качестве членов CRF, при условии что указанные фрагменты имеют по существу такие же биологические или патофизиологические свойства. Более того, варианты, изложенные в настоящей заявке, включают гибридные белки соответствующих полипептидов или белков, перечисленных выше в настоящей заявке в качестве членов CRF, с полипептидами, которые подходят в качестве средств иммобилизации, средств связывания или средств мечения, при условии что такой гибридный белок по существу сохраняет такие же биологические, предпочтительно, иммунологические свойства соответствующего исходного полипептида или белка, приведенного выше в настоящей заявке в качестве члена CRF. Варианты могут дополнительно включать модификации указанных полипептидов или белков путем гликозилирования или любой другой химической или ферментативной модификации, при условии, что указанные варианты имеют по существу такие же биологические, предпочтительно иммунологические свойства, как описано выше. Варианты согласно изобретению могут включать так называемые «молчащие» замены, вставки и делеции, которые не изменяют или по существу не изменяют биологическую активность. Более конкретно, варианты в соответствии с настоящим изобретением могут быть модифицированы по одному или более аминокислотным остаткам, которые замещаются на консервативный или неконсервативный аминокислотный остаток, предпочтительно, консервативный аминокислотный остаток, или имеют такие замены, при которых один или более из аминокислотных остатков может включать замещенный радикал. Предполагается, что такие варианты находятся в пределах объема настоящего изобретения. Более конкретно, «молчащие» варианты представляют собой такие варианты, которые различаются консервативными аминокислотными заменами. Такие замены представляют собой замены с замещением конкретной аминокислоты в полипептиде на другую аминокислоту, имеющую сходные химические характеристики. В этом отношении консервативными заменами следует считать замены между малыми алифатическими аминокислотами А, V, L и I; между гидроксильными остатками S и Т; между кислотными остатками D и Е; между амидными остатками N и Q; между основными остатками К и R и между ароматическими остатками F и Y (согласно однобуквенному коду аминокислот в соответствии с номенклатурой ИЮПАК). Согласно одному варианту реализации настоящего изобретения «вариант» имеет по существу такие же биологические свойства. Согласно другому варианту реализации настоящего изобретения используется «вариант» члена CRF, который отвечает за распространение патологии или дисфункции, т.е., связанный с заболеванием, связанным с семейством сердечных рецепторов у животного (например, мыши, крысы, морской свинки, собаки, свиньи, примата) или субъекта, представляющего собой человека.
Термин «биологические свойства» в соответствии с настоящим изобретением обозначает, в частности, связывающие свойства соответствующей перечисленной молекулы. В случае конкретного члена CRF указанный термин обозначает его способность образовывать комплекс с его биологическим, соответственно, (пато)физиологическим лигандом при подходящих условиях, в частности, с одной или более молекулами, выбранными из адреналина, норадреналина, ацетилхолина или других известных активных трансмиттеров. Необязательно термин «биологические свойства» может дополнительно включать конкретные специфические иммунологические свойства полипептидов, например, если они специфично поддаются детектированию с помощью одного и того же метода ИФА. В частности, член CRF проявляет по существу такие же «биологические свойства», как его вариант, если оба из них (а) могут взаимодействовать с анализируемыми антителами, (b) поддаются детектированию с помощью одного и того же метода ИФА и/или (с) поддаются детектированию с помощью способа детектирования в соответствии с настоящим изобретением.
Согласно другому предпочтительному варианту реализации изобретения одна или более первых антигенных молекул и одна или более вторых антигенных молекул представляют собой один или более полипептидов, выбранных из группы, состоящей из α1A-AR, α1B-AR, α1D-AR, α2A-AR, α2B-AR, α2C-AR, β1-AR, β2-AR, β3-AR, nAChR и mAChR или их вариантов, субъединиц и фрагментов.
Термин «обеспечение до этапа (с) способа детектирования аутоантитела» согласно изобретению обозначает обеспечение до приведения в контакт указанных антигенных молекул и указанных анализируемых антител.
Термин «детектирование (определение) присутствия и/или свойств связывания» согласно изобретению обозначает качественное и/или количественное детектирование относительного или абсолютного количества или концентрации анализируемого вещества, предпочтительно, количественное детектирование. Сигнал может быть получен путем прямого или непрямого измерения. Прямое измерение относится к измерению количества или концентрации одного или более выделяемых в реакции веществ и/или продуктов реакции на основе сигнала, который получен от самого/самих одного или более выделяемых в реакции веществ и/или продуктов реакции, и интенсивности, которая прямо коррелирует с количеством молекул одного или более выделяемых в реакции веществ реакции и/или продуктов реакции в реакционном объеме. Такой сигнал может быть получен, например, путем измерения интенсивности или значения специфических физических или химических свойств одного или более выделяемых в реакции веществ реакции и/или продуктов реакции. Непрямое измерение включает измерение сигнала, полученного от вторичного компонента (т.е. компонента, который сам по себе не является выделяемым в реакции соединением или продуктом реакции) или средства передачи биологических данных или амплификационных систем, называемых в настоящей заявке «средствами мечения», например, измеримых клеточных или трансмембранных ответов, лигандов или продуктов ферментативных реакций, например, с помощью флуорофоров, хромофоров, концентрации ионов, которое можно осуществлять с помощью оптического, электрического и/или электронного оборудования. Для измерения продуктов ферментативной реакции количество субстрата предпочтительно является насыщающим. Необязательно субстрат также может быть помечен с помощью поддающейся детектированию метки до проведения реакции. В предпочтительном варианте партнеров реакции приводят в контакт с субстратом в течение подходящего периода времени, которое соответствует времени, необходимому для достижения поддающегося детектированию количества одного или более продуктов реакции, которые предполагается получить, таких как поддающийся измерению сигнал. Вместо измерения количества или концентрации одного или более продуктов реакции можно измерять время, необходимое для достижения данного (например, поддающегося детектированию) количества или концентрации одного или более продуктов реакции.
Согласно изобретению, термин «детектирование (определение) присутствия и/или свойств связывания» включает все средства для определения количества выделяемого в реакции вещества и/или продукта реакции, известные специалисту в данной области техники. Указанные средства включают способы и устройства для осуществления иммунологических анализов, в которых могут использоваться меченные или иммобилизированные молекулы в аналитических реакциях различных форматов (например, реакциях по типу «сэндвич», конкурентных реакциях и т.д.). Указанные анализы подходят для генерации сигнала, показывающего присутствие или отсутствие выделяемых в реакции веществ и/или продуктов реакции. Более того, сигнал предпочтительно может прямо или не прямо коррелировать (например, быть пропорциональным или обратно пропорциональным) с количеством выделяемых в реакции веществ и/или продуктов реакции, присутствующих в реакционном объеме. Указанные способы предпочтительно включают биосенсоры, оптические устройства, сопряженные с иммунологическими анализами, биочипы и аналитические устройства, такие как спектрометры или устройства для хроматографии. Дополнительно способы включают способы на основе ИФА, в которых используются необязательно предварительно обработанные или предварительно покрытые микротитрационные планшеты, микрочипы, матрицы на основе пробирок или чипы, полностью автоматизированные или роботизированные иммунологические анализы (доступные, например, для проведения с помощью аналитических систем Roche-Elecsys™, Abbott-AxSYM™ или Brahms Kryptor™). В предпочтительном варианте «детектирование присутствия и/или свойств связывания» включает этапы, которые позволяют объединить партнеров реакции на подходящий период времени с получением поддающегося детектированию сигнала.
Термин «связывание» в соответствии с настоящим изобретением включает как ковалентное, так и нековалентное связывание. Термин «специфичное связывание» относится к аффинности связывания, превышающей по меньшей мере в 3 раза, предпочтительно, по меньшей мере в 10 раз, и более предпочтительно, по меньшей мере в 50 раз аффинность связывания с другими молекулами. Согласно другому варианту реализации настоящего изобретения термин «связывание» обозначает связывание партнеров связывания в анализе связывания in vitro при подходящих условиях, предпочтительно, в условиях, соответствующих инструкциям производителя аналитической системы или по существу соответствующих способам согласно определению, приведенному далее в настоящей заявке в разделе Примеры. В целом, «связывание» относится к аффинности связывания (Ко, которая обозначает отношение константы диссоциации к константе ассоциации), составляющей примерно от 10-14 М до 10-7 М, предпочтительно, примерно от 10-13 М до 10-9 М.
Термин «модулятор» согласно изобретению обозначает любое биологическое или химическое соединение, макромолекулу (например, имеющую массу более чем примерно 5 кДа), малую молекулу (например, имеющую массу менее чем примерно 5 кДа или даже менее чем примерно 800 Да), выделенное или очищенное соединение или их смесь, неочищенный экстракт или гомогенаты выбранных клеток, ткани или органа, природное соединение или синтетическое соединение, содержащее один или более пептидов, полипептидов (например, поликлональные или моноклональные антитела, включая одноцепочечные антитела, диатела, мультиспецифичные антитела, гуманизированные антитела, гибридные антитела или их фрагменты, такие как Fv, Fab и F(ab)2 фрагменты), аптамеры, шпигельмеры, нуклеиновые кислоты и/или малые молекулы.
Термин «антигенная молекула, помещенная в мембранное окружение», согласно изобретению обозначает, что указанная антигенная молекула, которая может происходить из трансмембранного белка, находится в модельной мембране другой амфифильной структуры, которая включает любое подходящее синтетическое, природное или искусственное окружение, например, клеточную, мембранную, везикулярную, мицеллярную или липосомальную структуру, в результате чего указанная антигенная молекула сохраняет свою функциональную и/или структурную целостность и способна взаимодействовать с перечисленными выше анализируемыми антителами и, таким образом, позволяет образование указанного комплекса.
Аналитические способы для белков, помещенных в мембранное окружение, хорошо известны специалисту в данной области техники, например, из технологий и способов, которые используют искусственные или биомиметические мембраны или липидные бислои (в настоящей заявке «модельные мембраны»). Модельные мембраны широко применяются для исследования свойств мембранных белков, и многие из них подходят для осуществления способов согласно настоящему изобретению, в частности, мембраны, предотвращающие денатурацию указанной антигенной молекулы.
Термин «модельная мембрана» согласно изобретению обозначает любую липосому или везикулу, например, созданные искусственным путем везикулы, содержащие один или более липидных слоев в сферической геометрии. Такие липосомы и везикулы также используются в качестве наполнителей для транспорта липидов, белков и малых молекул и могут использоваться для введения фармацевтических препаратов. Везикулы или липосомы можно получать путем разрыва биологических мембран выбранных клеточных культур, тканей, органов или субклечтоных структур (например, ядра, аппарата Гольджи, эндоплазматического ретикулума, митохондрий), например, путем обработки ультразвуком и/или экструзии и последующей повторной самосборки липидных структур, что обеспечивает возможность мечения, например, с помощью красителей, полипептидов или других средств мечения. «Модельные мембраны» также могут включать липидные бислои, собранные синтетическим путем in vitro. Указанные мембраны могут быть сделаны из одного или более синтетических и/или природных липидов.
Термин «модельные мембраны» может дополнительно включать, например, черные липидные мембраны (BLM), везикулы, липидные бислои, липосомы, мицеллы, бицеллы, гибридные бислои (включая гидрофобный монослой и липидный монослой) и нанодиски, которые могут быть заякорены, закреплены или привязаны к твердой фазе или твердому субстрату, и которые могут необязательно быть представлены вместе со спейсером или подложкой (например, полиэтиленгликолями, олигонуклеотидами, пептидами, полипептидами (например, стрептавидином) или гидрогелями), позволяющими поддерживать расстояние между мембраной и/или указанной выше антигенной молекулой и твердым субстратом. В предпочтительном варианте спейсер или подложка представляет собой гидрофильную молекулу. В отличие от везикулы или клеточной мембраны, указанный выше закрепленный бислой может иметь плоскую структуру, которая удерживается на твердой подложке. Таким образом, только верхняя поверхность бислоя подвергается воздействию раствора. Например, способ получения пртеолипосомы известен из заявки на европейский патент №1992688 А1, в которой получение липосомы описано в Примерах 1-20.
Термин «мицеллы» согласно изобретению обозначает другой тип модельных мембран без липидного бислоя. В водных растворах мицеллы представляют собой совокупность амфифильных молекул (например, детергентов), гидрофильные части которых контактируют с полярным растворителем, а гидрофобные части находятся в центре. Мицеллы способны солюбилизировать мембранные белки путем их частичного погружения и экранирования их гидрофобных поверхностей от полярного растворителя. Термин «бицеллы» обозначает еще один тип модельных мембран, которые, как правило, состоят из двух липидов, один из которых образует липидный бислой, тогда как другой является амфифильным, таким образом, образуется подобная мицеллам структура, в которой центральная часть бислоя экранирована от окружающих молекул растворителя. Термин «нанодиски» обозначает сегмент липидного бислоя, погруженный в амифифильное белковое, липидное покрытие или покрытие из слоя детергента. Мембранные белки также могут быть встроены и солюбилизированы с помощью нанодисков.
Термин «заболевание, связанное с семейством сердечных рецепторов» («DRCRF»), согласно изобретению обозначает любое расстройство или дисфункцию, которая связана с одним или более членами CRF, предпочтительно, полипептидом, который представляет собой AR или AChR согласно определению выше, более предпочтительно, относящимся к одному, двум или трем из указанных членов CRF.
Термин «DRCRF» согласно изобретению предпочтительно обозначает хроническое или периодическое расстройство, которое выбрано из группы, состоящей из гипертензивной дисфункции, высокого кровяного давления, дилатационной кардиомиопатии, глаукомы, хронической усталости, деменции и аутоиммунных расстройств, в частности, хронических указанных расстройств и более предпочтительно одного из указанных расстройств аутоиммунной природы.
Термин «средство иммобилизации» согласно изобретению обозначает любой реагент и/или способ, который подходит для иммобилизации указанных первых антигенных молекул на твердой подложке согласно знаниям специалистов в данной области техники, предпочтительно, с поддержанием их структурной и/или функциональной целостности. Тип твердой подложки и применимые условия в соответствии с настоящим изобретением не отличаются от обычно используемых материалов, способов и условий, используемых в известных методах иммунологического анализа. Твердая подложка для применения в соответствии с настоящим изобретением может включать планшеты для ИФА, используемые в известных современных методах ИФА, или же для применения согласно настоящему изобретению можно использовать любую другую подходящую подложку, такую как микротитрационные планшеты (содержащие 96, 384, 1536 или 3456 или более лунок) или их части, пробирки, частицы, магнитные гранулы, нитроцеллюлозу, устройства на основе чипов и т.д. Материалы, подходящие для применения в качестве твердой подложки, которые можно использовать в соответствии с идеей настоящего изобретения, хорошо известны в данной области техники и включают, например, коммерчески доступные материалы колонки, полистироловые гранулы и другие носители, латексные гранулы, магнитные гранулы, коллоидный металл, стеклянные поверхности, силанилированные поверхности, силиконизированные поверхности и чипы для применения в методах на основе белковых микрочипов, нитроцеллюлозные носители, целлюлозные носители, мембраны, модельные мембраны, стабилизированные липосомы или клетки (например, дурациты (Duracyte™)), лунки, соответственно, поверхности реакционных планшетов, сосудов или микротитрационных планшетов, пластиковых пробирок и т.д.
Указанные первые антигенные молекулы могут быть иммобилизированы на любом носителе, известном специалисту в данной области техники. Примеры таких носителей включают инертные материалы и представляют собой такие инертные материалы, как стекло, полистирол, поливинилхлорид, полипропилен, полиэтилен, поликарбонат, декстран, нейлон, амилоза, природная и модифицированная целлюлоза, полиакриламид, агароза, магнетит и золото. Носитель может быть растворимым или нерастворимым. В случае нерастворимого носителя указанный носитель представляет собой твердое вещество или коллоид и может необязательно быть представлен в виде суспензии.
Подходящие средства иммобилизации указанных антигенных молекул известны и включают, но не ограничиваются указанными, ионные, гидрофобные или ковалентные взаимодействия. Также может являться подходящим применение указанного средства иммобилизации в суспензии, например, полых микрогранул или микросфер, возможно различного типа, которые необязательно являются меченными, и каждая из которых необязательно содержит различные антигенные молекулы. Способы получения суспензий, например, на основе твердофазных химических реакций и фотомечения защитных групп, известны из патента США 5 744 305.
Термин «мечение» в соответствии с настоящим изобретением обозначает прямое или непрямое мечение. Прямое мечение включает прямое (ковалентное или нековалентное) присоединение метки («зонда») к молекуле, которую предполагается пометить. Непрямое мечение включает связывание (ковалентное или нековалентное) второго лиганда с молекулой, которую предполагается пометить. Такой второй лиганд специфично связывается с молекулой, которую предполагается пометить (например, с аффинностью, превышающей по меньшей мере в 3 раза, предпочтительно по меньшей мере в 10 раз и более предпочтительно по меньшей мере в 50 раз аффинность связывания с другими молекулами), в аналитических условиях. Указанный второй лиганд также может быть связан с подходящим средством мечения и/или может связываться с третьим лигандом, который связывается со вторым лигандом. Применение второго лиганда или лиганда более высокого порядка можно применять для увеличения или амплификации сигнала. Подходящие вторые лиганды и лиганды более высокого порядка могут включать антитела, вторичные антитела и хорошо известную систему стрептавидин-биотин (Vector Laboratories, Inc.). Более того, молекула, которую предполагается пометить, или субстрат также могут быть «помечены» одним или более зондами/метками, известными в данной области техники. Такие зонды затем могут служить мишенями для лигандов более высокого порядка. Подходящие зонды включают биотин, диоксигенин, гистидиновую метку, глутатион-8-трансферазу, FLAG-метку (N-DYKDDDDK-C), зеленый флуоресцентный белок (GFP), myc-метку, гемагглютинин вируса гриппа А (НА), мальтоза-связывающий белок и другие. В случае пептида или полипептида зонд в целом располагается на N- и/или С-конце или вблизи от N- и/или С-конца.
Более того, молекула, которую предполагается пометить, или субстрат также может быть предложен с подходящей «спейсерной» молекулой, известной в данной области техники, для предотвращения в случае объемных молекул любых стерических затруднений, связанных со свойствами связывания из-за пространственных ограничений. Термин «первое средство мечения» согласно изобретению обозначает средство прямого или непрямого детектируемого мечения, предпочтительно, выбранного из группы ферментов, радиоактивных веществ или изотопов, красителей или их предшественников, используемых для хемолюминесценции, биолюминесценции, флуоресценции и магнитного мечения (например «магнитных гранул», включая парамагнитные и суперпарамагнитные метки). «Первое средство мечения» поддается детектированию с помощью подходящего способа детектирования, известного в данной области техники. Подходящие метки могут дополнительно включать частицы золота, латексные гранулы, сложный эфир акридиния, люминол и рутений. Ферментативно активные метки включают, например, пероксидазу хрена, щелочную фосфатазу, β-галактозидазу, люциферазу и их производные. Подходящие субстраты для прямого или непрямого детектирования включают ди-амино-бензидин (DAB), 3, 3-5, 5'-тетраметилбензидин, NBT-BCIP (4-нитросиний тетразолий хлорид и 5-бром-4-хлор-3-индолилфосфат, CDP-StAR™ (Amersham Biosciences), ECL™ (Amersham Biosciences) и другие соединения, известные в данной области техники. Подходящая комбинация фермент-субстрат может обеспечивать повышение или снижение количества окрашенного продукта или выделяемого в реакции вещества (хромофора, флуоресценции, хемо- или биолюминесценции), который детектируется с помощью известных способов (например, с использованием фотометра, фотоумножителя и светочувствительной пленки или системы камер). Такие же методы применяются для количественной оценки при измерении конечного результата, производительности или скорости ферментативной реакции.
Известные флуоресцентные метки включают флуоресцентные красители и белки (такие как GFP и его производные), Су3, Су5, Texas Red, флуоресцеин и серию красителей Alexa (например Alexa 568) и квантовые точки. Многие подходящие флуоресцентные метки являются коммерчески доступными. Примеры флуоресцентных белков включают, но не ограничиваются указанными, зеленые, желтые, голубые, синие и красные флуоресцентные белки.
Подходящие хемолюминесцентные или биолюминесцентные метки могут включать прокариотические люцеферазы (например, бактериальные lux-кодируемые люциферазы) или эукариотические люцеферазы (например, кодируемые геном luc люцеферазы светлячка), а также варианты, обладающие отличными или измененными оптическими свойствами, такие как люциферазы, которые испускают свет различного цвета, например, люциферазы из огневки Photinus pyralis, из губки Suberities domuncula и гриба Mycena fungi. Более того, подходящими могут являться фотобелки, например, активируемые кальцием фотобелки, и их специфически сконструированные варианты, испускающие свет, как правило, в диапазоне от 200 до 1100 нм или в видимом спектре (т.е. от 350 до 800 нм), например, обелин из морского полипа Obelia longissima или экворин, например, из светящейся медузы Aequorea victoria или из других организмов, необязательно в мембранном окружении.
Подходящие радиоактивные метки включают S35, I125, Р32, Р33 и другие нуклиды. Радиоактивную метку можно выявить с помощью любого известного и подходящего способа, например, с помощью светочувствительной пленки или люминесцентного визуализатора.
Подходящие способы детектирования для осуществления настоящего изобретения также включают преципитацию (в частности, иммунопреципитацию), электрохемилюминесценцию (генерируемую электрическим путем хемилюминесценцию), биолюминесценцию, РИА (радиоиммунологический анализ), ИФА (иммуноферментный анализ), иммуноферментные «сэндвич»-тесты, иммунологические «сэндвич«-анализы (ECLIA), усиленный диссоциацией лантанидный флюоресцентный иммуноанализ (DELFIA™, PerkinElmer Inc., США), сцинтилляционный анализ сближения (SPA), турбидиметрию, нефелометрию, турбидиметрию или нефелометрию с латексным усилением, анализ латекс-агглютинации или твердофазные иммунные анализы, при этом указанный способ предпочтительно не включает преципитацию.
Дополнительно способы, известные в данной области техники (такие как электрофорез в геле, двумерный электрофорез в геле, электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ), Вестерн-блоттинг и масс-спектрометрия) могут необязательно использоваться в комбинации со способами мечения или другими способами детектирования, описанными выше.
Термин «второе средство мечения» согласно изобретению обозначает любое прямо или непрямо поддающееся детектированию средство мечения, выбранное из группы, включающей ферменты, радиоактивные вещества или изотопы, красители или их предшественники для хемолюминесцентного, биолюминесцентного, флуоресцентного и магнитного мечения (например, «магнитные гранулы», включая парамагнитные и суперпарамагнитные метки). В предпочтительном варианте «первое средство мечения» представляет собой нерадиоактивную метку, более предпочтительно, «первое средство мечения» и «второе средство мечения» являются нерадиоактивными. Употребление термина «второе средство мечения» обозначает, что указанное «второе средство мечения» не идентично «первому средству мечения». Специалисту в данной области техники известно, как выбрать первое и второе средство мечения таким образом, чтобы сигналы от первого и второго средства мечения поддавались дифференциальному детектированию в способе детектирования согласно изобретению. Подходящее второе средство мечения выявляется с помощью подходящего способа детектирования, известного в данной области техники, например, способа на основе резонансного переноса энергии (RET). В предпочтительном варианте «второе средство мечения» включает средство мечения, подходящее для резонансного переноса энергии флуоресценции (FRET), резонансного переноса энергии биолюминесценции (BRET) или резонансного переноса энергии хемолюминесценции (CRET), как известно специалисту в данной области техники. Специалист в данной области техник выбирает подходящее второе средство мечения с учетом типа первого средства мечения таким образом, чтобы сигнал RET поддавался детектированию и был различимым. Например, генерирование сигнала RET и выбор подходящего средства мечения может обеспечить дополнительную информацию о типе и кинетике образования комплекса и структурных признаках образованных комплексов. Последовательности:
Seq. ID No. 1 Последовательность ДНК LUC
Seq. ID No. 2 Последовательность белка LUC
Seq. ID No. 3 Праймер P1 Luc Fw
Seq. ID No. 4 Праймер P2 Luc Rv
Seq. ID No. 5 кДНК B1
Seq. IDNo. 6 AA B1
Seq. ID No. 7 Праймер Р3 В 1 Fw
Seq. ID No. 8 Праймер P4 B1 Rv
Seq. ID No. 9 кДНК B1-Luc
Seq. ID No. 10 AA B1-Luc
Seq. ID No. 11 кДНК В2
Seq. ID No. 12 AA B2
Seq. ID No. 13 Праймер P5 B2 Fw
Seq. ID No. 14 Праймер P6 B2 Rv
Seq. ID No. 15 кДНК B2 Luc
Seq. ID No. 16 AA B2 Luc
Seq. ID No. 17 кДНК М2
Seq. ID No. 18 AA M2
Seq. ID No. 19 Праймер P7 M2 Fw
Seq. ID No. 20 Праймер P8 M2 Rv
Seq. ID No. 21 кДНК M2 Luc
Seq. ID No. 22 AA M2 Luc
Seq. ID No. 23 Праймер P9 B2 2B5 Вас Fw
Seq. ID No. 24 Праймер P 10 B2 2B5 Вас Rv
Следующие далее примеры и сравнительные примеры иллюстрируют настоящее изобретение и не ограничивают его объем. Экспериментальное исследование:
Материалы:
ДНК-праймеры были получены из компании Life Technologies (Карлсбад, Калифорния, США); вектор pSP-luc+NF был получен из компании Promega GmbH (Мангейм, Германия); вектор pIRESneo был получен из компании Clontech (Пало-Альто, калифорния, США); вектор pFastBacl и клетки насекомых High Five™ были получены из компании Invitrogen (Карлсбад, Калифорния, США); пробирки из полистирола, покрытые антителами PGA14 (Selenotest LIA), были получены из ICI immunochemical intelligence GmbH (Берлин, Германия). Если иное не указано, другие реагенты и химические вещества были получены из Sigma-Aldrich Chemie GmbH (Мюнхен, Германия) или Merck KGaA (Дармштадт, Германия); ферменты были получены из компании Promega (Мэдисон, Висконсин, США) или New England Biolabs (Ипсвич, Массачесетс, США).
Пример 1: Конструирование гибридных белков
Пример 1А: Конструирование гибридного белка β1-адренергический рецептор-люцифераза ДНК (последовательность Seq. ID No. 1), кодирующую аминокислоты 2-551 люциферазы светлячка (Seq. ID No. 2 в плазмиде pSP-luc+NF), амплифицировали с помощью ПЦР (полимеразной цепной реакции) с использованием праймеров PI (Seq. ID No. 3) и Р2 (Seq. ID No. 4), содержащих сайты рестикции EcoRI и BamHI соответственно. Плазмиду pIRESneo переваривали с помощью рестрикционных эндонуклеаз EcoRI и BamHI; полученный фрагмент замещали на ДНК, кодирующую люциферазу светлячка, полученную в результате указанный выше ПЦР, с получением, таким образом, плазмиды pIRESneo-Luc. кДНК (Seq. ID No. 5), кодирующую аминокислоты 1-469 человеческого β1-адренергического рецептора (Seq. ID No. 6), амплифицировали с помощью ПЦР с использованием праймеров РЗ (Seq. ID No. 7) и Р4 (Seq. ID No. 8), содержащих сайты рестрикции EcoRV и EcoRI соответственно. pIRESneo-Luc переваривали с помощью рестрикционных эндонуклеаз EcoRV и EcoRI и полученный фрагмент замещали на последовательность ДНК, кодирующую человеческий β1-адренергический рецептор, полученный в результате предыдущей ПЦР, с получением вектора pIRESneo-B1-Luc, содержащего последовательность Seq. ID No. 9, кодирующую меченный гибридный белок Seq. ID No. 10.
Пример 1В: Конструирование гибридного белка β2-адренергический рецептор-люцифераза кДНК (Seq. ID No. 11), кодирующую аминокислоты 1-413 человеческого β2-адренергического рецептора (Seq. ID No. 12), амплифицировали с помощью ПЦР с использованием праймеров Р5 (Seq. ID No. 13) и Р6 (Seq. ID No. 14), содержащих сайты рестрикции NotI и EcoRI соответственно. pIRESneo-Luc переваривали с помощью рестрикционных эндонуклеаз NotI и EcoRI и полученный фрагмент замещали на последовательность ДНК, кодирующую β2-адренергический рецептор, полученный в результате предыдущей ПЦР, с получением вектора pIRESneo-B2-Luc, содержащего Seq. ID No. 15, кодирующую меченный гибридный белок Seq. ID No. 16.
Пример 1С: Конструирование гибридного белка мускариновый рецептор М2-люцифераза кДНК (Seq. ID No. 17), кодирующую аминокислоты 1-466 мускаринового рецептора М2 (Seq. ID No. 18), амплифицировали с помощью ПЦР с использованием праймеров Р7 (Seq. ID No. 19) и Р8 (Seq. ID No. 20), содержащих сайты рестрикции EcoRV и EcoRI соответственно. Плазмиду pIRESneo-Luc переваривали с помощью рестрикционных эндонуклеаз EcoRV и EcoRI и полученный фрагмент замещали на последовательность ДНК, кодирующую мускариновый рецептор М2, полученный в результате предыдущей ПЦР, с получением вектора pIRESneo-M2-Luc, содержащего Seq. ID No. 21, кодирующую меченый гибридный белок Seq. ID No. 22.
Пример ID: Конструирование гибридного белка β2-адренергический рецептор-эпитоп, распознаваемый антителами PGA14 кДНК (Seq. ID No. 11), кодирующую аминокислоты 1-413 β2-адренергического рецептора (Seq. ID No. 12), амплифицировали с помощью ПЦР с использованием праймеров Р9 (Seq. ID No. 23) и P10 (Seq. ID No. 24), содержащих сайты рестрикции BamHI и HindIII соответственно (Р10 содержит последовательность, кодирующую эпитоп, состоящий из 16 аминокислот и распознаваемый антителами PGA 14). Вектор pFastBacl переваривали с помощью рестрикционных эндонуклеаз BamHI и HindIII и полученный фрагмент замещали на последовательность ДНК, кодирующую гибридный белок β2-адренергический рецептор-эпитоп PGA 14, полученную в результате указанной выше ПЦР, с получением вектора pFastBacl-B2-PGA14tag.
Пример 2: Получение B1-Luc-, B2-Luc- и М2-Luc-продуцирующих клеток
Пример 2А: Получение B1-Luc-, B2-Luc- и М2-Luc-продуцирующих клеток НЕK 293
Клетки НЕK 293 растили в среде DMEM-F12 с добавлением 10% эмбриональной бычьей сыворотки при 5% СO2 и 37°С. Указанные клетки НЕK 293 трансфицировали с помощью одной из плазмид pIRESneo-B1-Luc, pIRESneo-B2-Luc или pIRESneo-M2-Luc с использованием реагента трансфекции FuGENE6 (полученного из Roche Deutschland Holding GmbH, Гренцах-Вилен, Германия) в соответствии с инструкциями изготовителя. Через 48 часов поле трансфекции начинали селекцию с помощью 0,8 мг/мл G418 (Gibco™ BRL, Invitrogen). Были выбраны стабильные клоны, экспрессирующие гибридный белок на высоком уровне.
Пример 2В: Получение клеточных экстрактов B1-Luc, B2-Luc и M2-Luc
Клетки НЕK293 (продуцирующие B1-LUC, B2-LUC или M2-LUC) растили в планшетах площадью 75 см2 до конфлюентного состояния, собирали и ресуспендировали в фосфатно-солевом буфере (ФСБ). Клетки промывали путем центрифугирования в ФСБ. Полученные клетки лизировали с помощью лизирующего буфера (50 мМ Tris-HCl рН 7,5; 100 мМ NaCl; 10% глицерин; 1% тритон Х-100). Суспензию центрифугировали, супернатант отделяли от клеточных остатков и хранили при -80°С.
Пример 2С: Создание рекомбинантного бакуловируса, экспрессирующего гибридный белок B2-PGA14tag
Последовательность B2-PGA14tag, полученную из Примера 1D, переносили в бакмидную ДНК путем сайт-специфической рекомбинации в бактериях. Бакмиду затем использовали для создания полностью рекомбинантнго бакуловируса в клетках насекомых Sf9 в соответствии с протоколами изготовителя (руководством для экспрессионной системы Вас-to-Bac, Invitrogen).
Пример 2D: Создание гибридного белка B2-PGA14tag
Клетки насекомых High Five™ растили в суспензии в бессывороточной среде Express Five™ до достижения плотности 2×106 клеток/мл. Затем клетки инфицировали (трансфецировали) рекомбинантным бакуловирусом B2-PGA14tag (множественность заражения (multiplicity of infection, MOI) составляла 1). Через 72 часа после инфицирования клетки собирали и экстракт выделяли и хранили при -80С°, как описано в Примере 2В.
Сравнительный Пример 3: Анализ иммунопреципитации β2-аутоантител (β2-аАb)
Клеточный экстракт B2-Luc, полученный из Примера 2В, разводили в 20 раз буфером, содержащим 50 мМ Tris-HCl рН 7,5,100 мМ NaCl, 1% Тритон Х-100,10% глицерин, 5 мг/мл БСА. 100 мкл разведенного экстракта (RLU примерно 107) смешивали с 10 мкл образца (проба сыворотки) и инкубировали в течение ночи при температуре 4°С. Иммунные комплексы затем преципитировали путем добавления 10 мкл 10% суспензии белка А-сефарозы (POROS™, Life Technologies) в том же буфере в течение 1 ч при комнатной температуре при перемешивании. Белок А-сефарозу преципитировали и промывали 3 раза 1 мл промывочного буфера (50 мМ Tris-HCl, рН 7,5, 100 мМ NaCl, 0,1% Тритон Х-100). В конце эксперимента измеряли люциферазную активность преципитированных иммунных комплексов на люминометре Berthold (AutoLumat Plus LB 953) в течение 10 с.Результаты выражали как RLU для связавшихся молекул. В Таблице 1 показана активность для образцов pVaAb-положительной сыворотки и β2-аАb-отрицательной сыворотки.
Пример 4: Перекрестные анализы
Пример 4А: Перекрестный анализ для детектирования β2-аАb
Полистироловые пробирки, покрытые антителами PGA 14 (ICI immunochemical), инкубировали в течение ночи при 4°С с 200 мкл среды от клеток насекомых SF6, содержащей B2-PGA14tag. После иммобилизации B2-PGA14tag пробирки промывали два раза 1 мл буфера, содержащего 20 мМ Tris-HCl рН 7,5, 50 мМ NaCl, 10% глицерин. Затем каждую пробирку инкубировали в течение ночи при температуре 4С° со смесью, содержавшей 100 мкл того же буфера, 10 мг/мл БСА и 100 мкл образца (пробы сыворотки). Пробирки промывали два раза 1 мл того же буфера и инкубировали в течение ночи при температуре 4С° с 200 мкл B2-Luc, полученного, как описано выше в Примере 2В, разведенного в том же буфере вместе с БСА (люциферазная активность примерно 40×106 RLU). После инкубирования пробирки промывали четыре раза и активность люциферазы измеряли в люминометре Berthold (AutoLumat Plus LB 953) в течение 10 с. Результаты, показанные в таблице 1, выражали как RLU (относительные световые единицы) для связанных молекул и сравнивали с результатами, полученными от стандартного анализа из Примера 3.

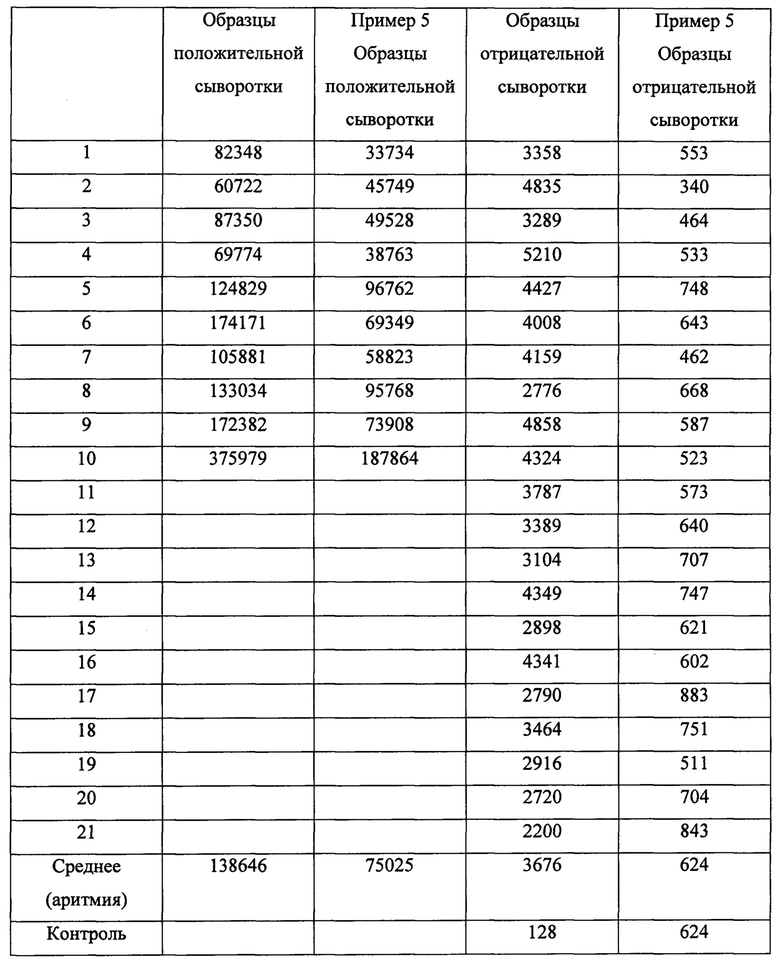
Пример 4В: Предел чувствительности анализа для детектирования β2-аАb в человеческой сыворотке
Каждые 3 образца β2-аАb-положительной и β2-аАb-отрицательной сыворотки разводили в смеси, содержащей 20 мМ Tris-HCl, рН7,5, 50 мМ NaCl, 10% глицерин, 10 мг/мл БСА.
Анализ проводили, как описано в Примере 4А. Фоновый сигнал получали с использованием только буфера.
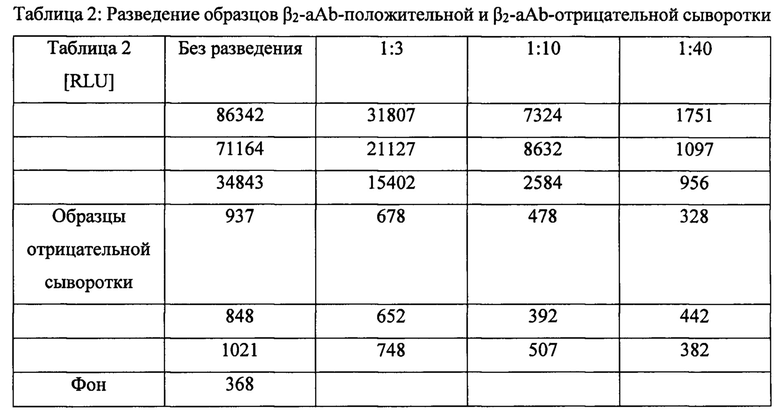
Пример 4С: Восстановление частоты сердечных сокращений по результатам оценки β2-аАb в человеческой сыворотке
Каждый из трех образцов человеческой β2-аАb-положительной сыворотки (Р1-Р3) смешивали в отношении 1:1 с образцами β2-аАb-отрицательной сыворотки (K1-K3) и анализировали, как описано в Примере 4А (Таблица 3).

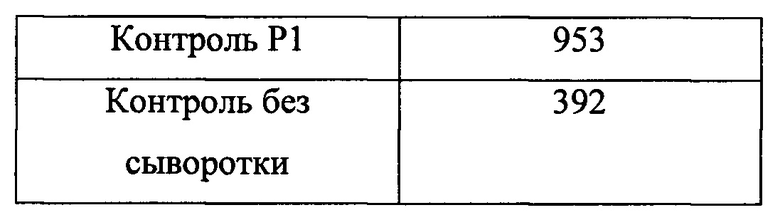
Пример 4D: Непосредственное нанесение антигена на пластиковую поверхность
Три образца человеческой β2-аАb-положительной сыворотки и три образца β2-аАb-отрицательной сыворотки анализировали так же, как описано в Примере 4А, за исключением того, что гибридный комплекс β2-PGA14tag из Примера 2D инкубировали с полистироловыми пробирками без непосредственного покрытия (ICI immunochemical intelligence GmbH, Берлин) до начала детектирования. Контроли анализировали точно так же, как описано в Примере 4А (Таблица 4).
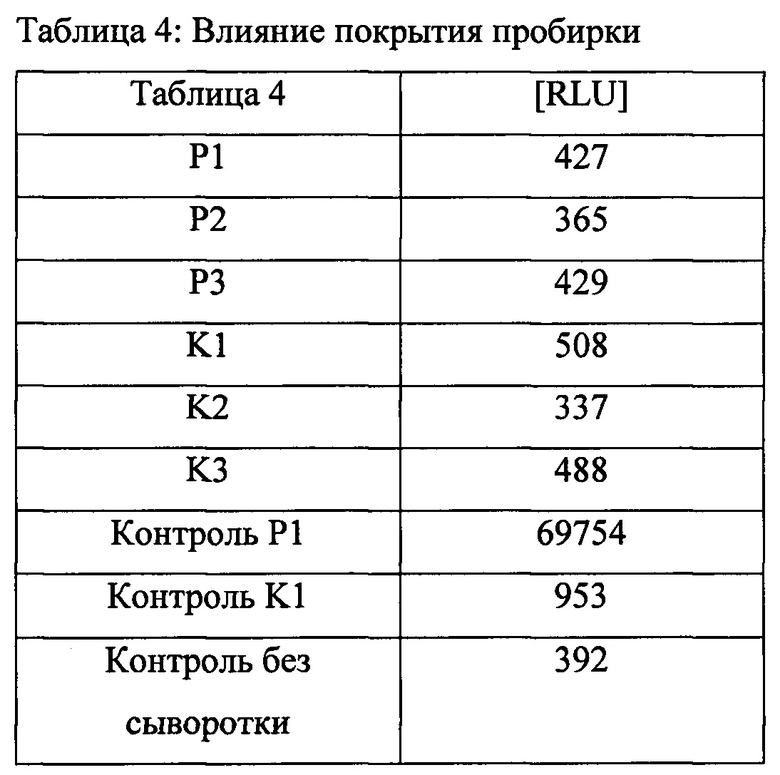
Пример 4Е: Специфичное детектирование
Три образца человеческой β2-аАb-положительной сыворотки и три образца β2-аАb-отрицательной сыворотки анализировали, как описано в Примере 4А, за исключением того, что вместо экстракта B2-Luc из Примера 2В в анализе использовали кроличьи античеловеческие антитела IgG в разведении 1:500, связанные с пероксидазой хрена (ПХ) (DIANOVA, Гамбург, Германия) (Таблица 5).

Пример 4F: Предел обнаружения антител против β2.
Известное количество антител против β2 (sc-569, Santa Cruz, Калифорния, США) разводили в буфере (20 мМ Tris-HCl, рН 7,5, 50 мМ NaCl, 10% глицерин, 10 мг/мл БСА), как показано в таблице, и анализировали, как описано в Примере 4А.
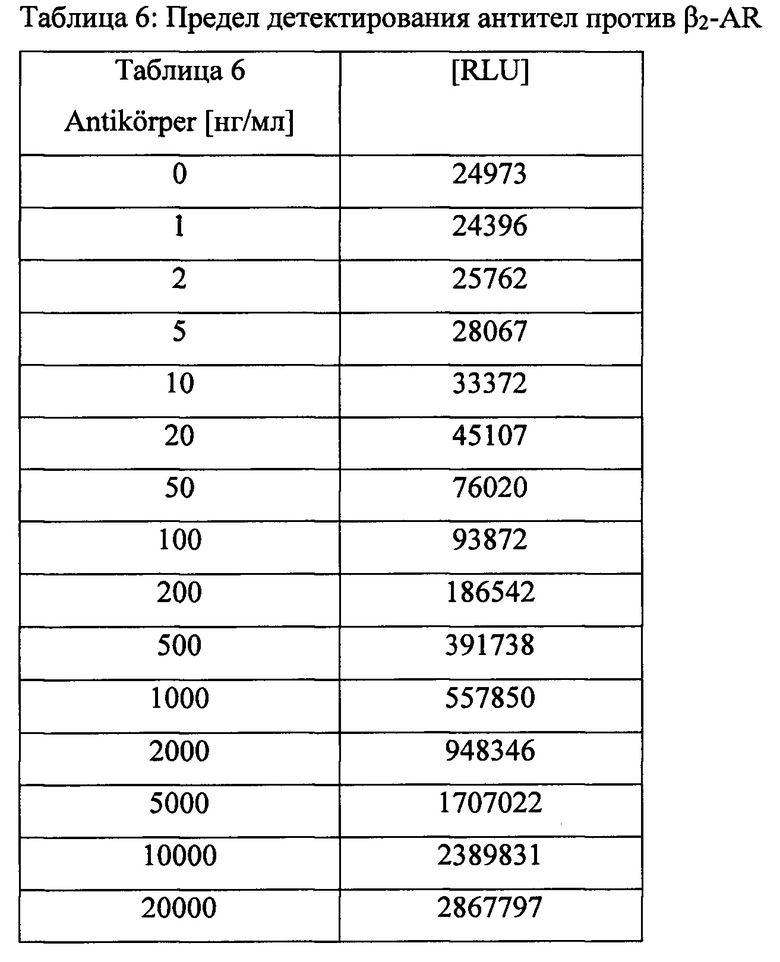
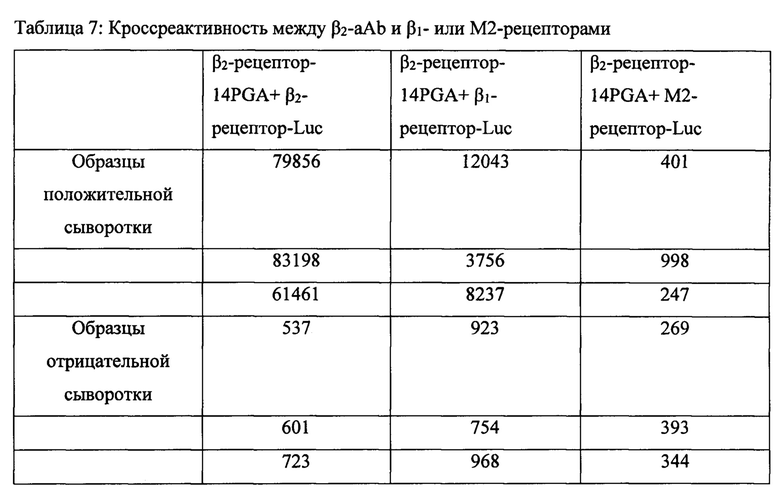
Пример 4G: Гетерореактивность
Три образца β2-аАb-положительной сыворотки анализировали, как описано в Примере 4А. β2-аАb-кроссреактивность выявляли путем инкубации с 200 мл разведенного экстракта β2-Luc, разведенного экстракта B1-Luc или разведенного экстракта M2-Luc из Примера 2В (люциферазная активность для β1 и β2 - 40×106 RLU (относительных световых единиц, люциферазная активность для М2 - 0,5×106 RLU) в буфере с БСА при температуре 4°С в течение ночи (Таблица 7).
Пример 5: Клиническая значимость уровня β2-аАb у людей
В Таблице 8 показаны средние значения (и стандартное отклонение) массы тела (ожирение и риск развития диабета) и возраста пациентов (людей), от которых была получена сыворотка, содержащая β2-аАb.

| название | год | авторы | номер документа |
|---|---|---|---|
| IL-1 АЛЬФА И БЕТА БИСПЕЦИФИЧЕСКИЕ ИММУНОГЛОБУЛИНЫ С ДВОЙНЫМИ ВАРИАБЕЛЬНЫМИ ДОМЕНАМИ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2627171C2 |
| КОМПЛЕМЕНТАРНЫЙ ПЕПТИД К ОСНОВНОМУ ИММУНОГЕННОМУ РАЙОНУ РЕЦЕПТОРА АЦЕТИЛХОЛИНА, ТЕРАПЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СПОСОБ ИЗГОТОВЛЕНИЯ ПЕПТИДА И ЕГО ПРИМЕНЕНИЕ | 2006 |
|
RU2422458C2 |
| СВЯЗЫВАЮЩИЕ IL-1 БЕЛКИ | 2011 |
|
RU2615173C2 |
| ПАРТНЕРЫ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ С NGF | 2006 |
|
RU2406728C2 |
| СПОСОБ ЛЕЧЕНИЯ БУЦИНДОЛОЛОМ, ОСНОВАННЫЙ НА ОПРЕДЕЛЕНИИ ГЕНОТИПА | 2005 |
|
RU2389798C2 |
| ИММУНОЛОГИЧЕСКИЕ ТЕСТЫ НА АКТИВНОСТЬ ЭНДОПЕПТИДАЗ С ИЗМЕНЕННОЙ НАЦЕЛЕННОСТЬЮ | 2010 |
|
RU2543650C2 |
| ОПРЕДЕЛЯЮЩИЕ КОМПЛЕМЕНТАРНОСТЬ УЧАСТКИ ДЛЯ СВЯЗЫВАНИЯ CD3 И СОДЕРЖАЩАЯ ИХ БИСПЕЦИФИЧЕСКАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА | 2019 |
|
RU2738802C1 |
| СПОСОБЫ ИДЕНТИФИКАЦИИ СОЕДИНЕНИЙ ДЛЯ РЕГУЛЯЦИИ МЫШЕЧНОЙ МАССЫ ИЛИ ФУНКЦИИ С ПРИМЕНЕНИЕМ РЕЦЕПТОРОВ РИЛИЗИНГ-ФАКТОРА КОРТИКОТРОПИНА | 2002 |
|
RU2260805C2 |
| GD2-СВЯЗЫВАЮЩАЯ МОЛЕКУЛА | 2020 |
|
RU2824670C2 |
| АНТИ-IL-17F АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2605318C2 |



























Группа изобретений относится к медицине и касается способа детектирования в исследуемом образце присутствия и/или свойств связывания анализируемых антител, способных реагировать с одной или более антигенными молекулами, включающего (a) обеспечение первой антигенной молекулы, выбранной из CRF; (b) обеспечение второй антигенной молекулы, выбранной из CRF; (c) приведение первых антигенных молекул и вторых антигенных молекул в контакт с образцом с образованием комплексов, содержащих [первую антигенную молекулу]-[анализируемое антитело]-[вторую антигенную молекулу]; (d1) обеспечение средства иммобилизации и/или (d2) обеспечение второго средства мечения; и (e) обеспечение первого средства мечения; и (g) детектирование присутствия комплексов, образованных во время или после этапа (c). Группа изобретений также касается набора, применимого для осуществления указанного способа; применения указанного способа для диагностики присутствия или начала заболевания, связанного с семейством сердечных рецепторов. Группа изобретений обеспечивает быстрый, надежный, специфичный и чувствительный способ, который позволяет исследовать низкие количества аналита. 6 н. и 7 з.п. ф-лы, 8 табл., 5 пр.
1. Способ детектирования в исследуемом образце присутствия и/или свойств связывания анализируемых антител, способных реагировать с одной или более антигенными молекулами, где указанный способ включает:
(a) обеспечение одной или более первых антигенных молекул, с которыми могут взаимодействовать анализируемые антитела, если они присутствуют в указанном образце, причем указанная первая антигенная молекула выбрана из семейства сердечных рецепторов (CRF); и
(b) обеспечение одной или более вторых антигенных молекул, с которыми могут взаимодействовать анализируемые антитела, если они присутствуют в указанном образце, причем указанная вторая антигенная молекула выбрана из CRF; и
(c) одновременное или последовательное приведение указанных первых антигенных молекул, обеспеченных на этапе (a), и указанных вторых антигенных молекул, обеспеченных на этапе (b), в контакт с исследуемым образцом, обеспечивающее возможность взаимодействия анализируемых антител, если они присутствуют в указанном образце, с указанными антигенными молекулами с образованием комплексов, содержащих [первую антигенную молекулу]-[анализируемое антитело]-[вторую антигенную молекулу]; и
(d1) обеспечение до, или одновременно с, или после этапа (c) средства иммобилизации, с помощью которого указанную первую антигенную молекулу, представленную в указанных комплексах, образованных на этапе (c), соответственно, способную образовывать указанные комплексы на этапе (c), можно иммобилизировать на твердой подложке до, или одновременно с, или после этапа (c); и/или
(d2) обеспечение до, или одновременно с, или после этапа (c) второго средства мечения, в результате чего происходит мечение указанной первой антигенной молекулы, присутствующей в указанных комплексах, образованных на этапе (c), соответственно, способной образовывать указанные комплексы на этапе (c), указанным вторым средством мечения до, или одновременно с, или после этапа (c); и
(e) обеспечение до, или одновременно с, или после этапа (c) первого средства мечения, в результате чего происходит мечение указанной второй антигенной молекулы, присутствующей в указанных комплексах, образованных на этапе (c), соответственно, способной образовывать указанные комплексы на этапе (c), указанным первым средством мечения до, или одновременно с, или после этапа (c); и
(g) детектирование присутствия комплексов, образованных во время или после этапа (c), с получением показателя присутствия анализируемых антител в указанном образце.
2. Способ по п. 1, дополнительно включающий:
(f) обеспечение до, или одновременно с, или после этапа (c) одного или более модуляторов, способных взаимодействовать с комплексами, образующимися на этапе (c), и/или способных препятствовать образованию указанных комплексов в соответствии с этапом (c), и до, или одновременно с, или после этапа (c) одновременное или последовательное приведение указанных одного или более модуляторов в контакт с указанным образцом, указанными одной или более первыми антигенными молекулами и/или указанными одной или более вторыми антигенными молекулами или одновременное или последовательное приведение указанных одного или более модуляторов в контакт с указанными комплексами, образующимися во время или после этапа (c).
3. Способ по п. 1, отличающийся тем, что указанные первые антигенные молекулы и указанные вторые антигенные молекулы идентичны.
4. Способ по одному или более из пп. 1-3, отличающийся тем, что указанные первые антигенные молекулы и/или указанные вторые антигенные молекулы заключают в мембранное окружение.
5. Способ по одному или более из пп. 1-4, где указанное анализируемое антитело, детектируемое в указанном образце, представляет собой эндогенное аутоантитело или моноклональное антитело.
6. Способ по одному или более из пп. 1-5, отличающийся тем, что одно или более из указанных средств, выбранных из группы, состоящей из указанного первого средства мечения, указанного второго средства мечения, указанного средства иммобилизации и указанных модуляторов, обеспечивают до приведения в контакт указанных антигенных молекул и указанных анализируемых антител.
7. Набор, применимый для осуществления способа по одному или более из пп. 1-6, содержащий
(a) одну или более первых антигенных молекул, выбранных из семейства сердечных рецепторов, определенных в одном или более из пп. 1-2;
(b) одну или более вторых антигенных молекул, выбранных из семейства сердечных рецепторов, определенных в одном или более из пп. 1-2;
(c1) средство иммобилизации, определенное в п. 1, и/или
(c2) второе средство мечения, определенное в п. 1, и
(d) первое средство мечения, определенное в п. 1.
8. Набор по п. 7, отличающийся тем, что
(a) указанные первые антигенные молекулы мечены вторым средством мечения; и
(b) указанные вторые антигенные молекулы мечены первым средством мечения.
9. Набор по п. 7, отличающийся тем, что
(a) указанные первые антигенные молекулы иммобилизированы на твердой подложке; и
(b) указанные вторые антигенные молекулы мечены первым средством мечения.
10. Применение способа по одному или более из пп. 1-6 для диагностики присутствия или начала заболевания, связанного с семейством сердечных рецепторов.
11. Применение способа по одному или более из пп. 1-6 для идентификации фармацевтически эффективного соединения для лечения и/или профилактики заболевания, связанного с семейством сердечных рецепторов.
12. Применение набора по одному или более из пп. 7-9 для диагностики присутствия или начала заболевания, связанного с семейством сердечных рецепторов.
13. Применение набора по одному или более из пп. 7-9 для идентификации фармацевтически эффективного соединения для лечения и/или профилактики заболевания, связанного с семейством сердечных рецепторов.
| WO 2011132077 A2, 27.10.2011 | |||
| ФУНКЦИОНАЛЬНЫЕ ПЛГ СОПОЛИМЕРЫ, ИХ НАНОЧАСТИЦЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ДЛЯ АДРЕСНОЙ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА И ПОЛУЧЕНИЯ ИЗОБРАЖЕНИЯ | 2013 |
|
RU2631653C2 |
| BUVALL L | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J Mol Cell Cardiol | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
Авторы
Даты
2019-11-22—Публикация
2015-12-21—Подача