Изобретение относится к органической и фармацевтической химии, конкретно к перфторированным полиэфирам общей формулы
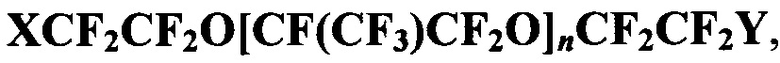
где X=CF3, Br; Y=Br, Cl; n=1-3,
обладающим газотранспортными свойствами и предназначенным для внутрисосудистого введения в виде высокостабильных водных эмульсий при возмещении кровопотерь, терапии заболеваний, характеризующихся гипоксическими или ишемическими поражениями, а также в качестве перфузионных сред и средств визуализации при лучевых исследованиях.
Известно, что насыщенные перфторорганические соединения (ПФОС) обладают аномально высокой растворяющей способностью по отношению к газам - в первую очередь к кислороду (40-53 об. %) и CO2 (120-350 об. %), при этом химически инертны и не подвергаются метаболизму в организме. Эти свойства ПФОС легли в основу многочисленных работ по созданию лекарственных форм на их основе, предназначенных, прежде всего, для замены донорской крови, что позволило бы решить такие острые проблемы трансфузиологии, как несовместимость и распространение инфекционных заболеваний - гепатита, ВИЧ и др. Поскольку ПФОС практически не растворяются в воде, их лекарственные формы представляют собой эмульсии в водных растворах (см. обзоры [Riess J.G. Chemical Reviews, 2001, 101 (9), 2797-2919; Yamanouchi K., Tanaka M., Tsuda Y., Yokoyama Т., Awazu S., Kobayashi Y. Chem. Pharm. Bull., 1985, 33 (3), 1221-1231; Remy В., Deby-Dupont G., Lamy M. Brit. Med. Bull., 1999, 55 (1), 277-298]).
В качестве фторорганической основы эмульсий наиболее широко исследовались смеси перфтордекалина с перфтортрипропиламином [препарат Fluosol DA производства Green Cross Corp.(Osaka, Japan) и Sanguine Corp. (Pasadena, CA, USA)], перфтороктилбромида (ПФОБ) с перфтордецилбромидом [препарат Oxygent производства Alliance Pharmaceutical Corp. (San Diego, CA, USA)], перфтордекалина (ПФД) с перфторметилциклогексилпиперидином (ПФМЦП) [препарат «Перфторан» производства НПФ «Перфторан» (г. Пущино, Московская обл., Россия)], перфторпентан [препарат S-9156 производства Sonus Corp. (Seattle, WA, USA)], перфтортрет-бутилциклогексан [препарат Oxycyte PFC производства Synthetic Blood International Inc. (Kettering, O., USA)], перфтордихлороктан [препарат Oxyfluor производства HemaGen (St. Louis, Mo., USA)], но также и многие другие фторуглероды (см. обзоры [Riess J.G. Chemical Reviews, 2001, 101 (9), 2797-2919; Yamanouchi K., Tanaka M., Tsuda Y., Yokoyama Т., Awazu S., Kobayashi Y. Chem. Pharm. Bull., 1985, 33 (3), 1221-1231]).
Из всего многообразия перечисленных композиций лишь препарат «Перфторан» прошел все клинические испытания и в настоящее время используется в медицинской практике [RU 2206319 (2003)]. К его недостаткам относятся необходимость тщательной очистки от водородсодержащих примесей, обусловленных получением фторорганических компонентов эмульсии из водородсодержащих предшественников, а также нестабильность эмульсии при стерилизации в автоклаве и хранении при температурах выше 0°С, что является следствием относительно низкой липофильности компонентов фторорганической основы.
Общепринятым критерием липофильности является критическая температура растворения в н-гексане (Ткр), при которой в смеси равных объемов фторуглерода и н-гексана исчезает граница разделения фаз: чем выше Ткр, тем ниже липофильность [Иваницкий Г.Р. Биофизические основы создания перфторуглеродных сред и газотранспортных кровезаменителей. - В сб. науч. тр.: Перфторорганические соединения в биологии и медицине. Пущино: ИТЭБ РАН, 2001, 4-48]. Критические температуры растворения ПФД и ПФМЦП в н-гексане (соответственно 22 и 40°С [Розенберг Г.Я., Макаров К.Н. ЖВХО им. Д.И. Менделеева, 1985, 30 (4), 387-394]) довольно высоки, следствием чего является слабое межмолекулярное взаимодействие с липофильными участками полоксамеров (блоксополимеров окисей пропилена и этилена) и фосфолипидов яичного желтка и сои, используемых в качестве стабилизирующих агентов (эмульгаторов), что приводит к относительно невысокой стабильности эмульсий.
Существенно большей липофильностью обладают первичные насыщенные фторалифатические бромиды. Так, Ткр перфтороктилбромида составляет -20°С. На основе ПФОБ был создан газотранспортный препарат Oxygent, эмульсии ПФОБ широко применялись и как рентгеноконтрастные агенты. Кроме того, в качестве рентгеноконтрастных соединений были предложены эфиры CmF2m+1O(CF2)nBr, где n и m=2-6 [US 4640833 (1987)], а в качестве фторорганической основы газотранспортных композиций - полиэфиры CF3CF2[OCF2CF(CF3)]nOCF2CF2Br, где n=2-5 [RU 2497801 (2013)].
Здесь следует отметить, что под действием кобаламина (витамина В12) перфтороктилбромид подвергается одноэлектронному восстановлению с генерацией перфтороктильного радикала, способного алкилировать соединения углеводородного ряда [Недоспасов А.А., Беда Н.В., Природа, 2005, №8, 33-39]. В равной мере это можно отнести и к эфирам общей формулы CmF2m+1O(CF2)nBr, где значения n больше 2. Неабсолютная химическая инертность перфтороктилбромида и эфиров общей формулы CmF2m+1O(CF2)nBr, где n>2, в значительной степени ограничивает безопасное использование этих соединений в газотранспортных лекарственных и перфузионных средствах.
Задачей настоящего изобретения является создание новых фторуглеродов, применимых для получения газотранспортных композиций медико-биологического назначения, характеризующихся, помимо высокой кислородной емкости, пониженной реакционной способностью и способностью образовывать в водно-солевых растворах нетоксичные стабильные тонкодисперсные эмульсии.
Задача решается галогенсодержащими перфторированными полиэфирами 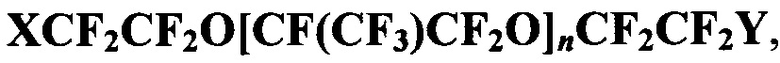 где X=CF3, Br; Y=Br, Cl; n=1-3, в качестве органической основы газотранспортных композиций медико-биологического назначения.
где X=CF3, Br; Y=Br, Cl; n=1-3, в качестве органической основы газотранспортных композиций медико-биологического назначения.
Заявляемые соединения получают по описанным методикам по следующей схеме:
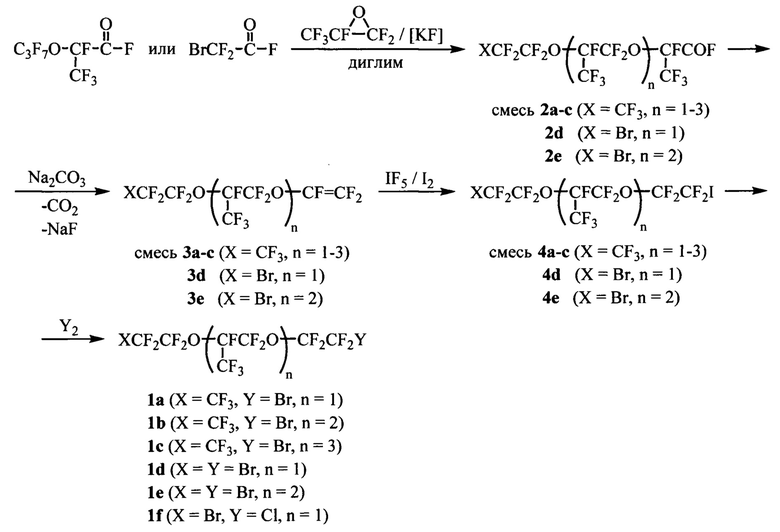
В качестве исходных соединений используют окись гексафторпропилена (ОГФП) - многотоннажный коммерческий продукт, ее димер и бромдифторацетилфторид. Под действием фторангидридов карбоновых кислот (димера ОГФП или бромдифторацетилфторида) в присутствии каталитических количеств фторида калия в диглиме ОГФП подвергается теломеризации с образованием фторангидридов 2а-е. Превращение их в натриевые соли и термическое декарбоксилирование приводит к терминальным перфторполиоксаалкенам 3а-е [US 3114778А (1963); US 3132123А (1964)]. Ключевой стадией синтеза является региоселективное йодфторирование полученной двойной связи с помощью системы IF5/I2 [Лурье Э.П., Дяткин Б.Л., Кнунянц И.Л. Журн. орг. хим., 1971, 7 (9), 1835-1840; Chambers R.D., Musgrave W.K.R., Savory J. J. Chem. Soc., 1961, 3779-3786]. Последующее тривиальное замещение йода бромом или хлором приводит к заявляемым α,ω-дибром- или α-бром-ω-хлорперфторполиэфирам 1а-е.
Структура полученных соединений доказана с помощью 19F ЯМР-спектроскопии, а чистота подтверждена данными элементного анализа. (Отметим, что соединение 1d [CAS # 1262415-94-0] приведено в каталогах ряда американских фирм, однако никак не охарактеризовано и способ его получения не раскрыт.)
Химическую инертность заявляемых соединений - первоочередное условие возможности применения эмульсий на их основе в качестве терапевтических и диагностических средств - определяет наличие в них атома кислорода в β-положении к атому галогена (брома и хлора), так как известно: реакционная способность перфтор(2-алкоксиэтил)галогенидов в реакциях радикального присоединения резко падает по сравнению с их перфторалкильными аналогами, что связано с дестабилизирующим влиянием атома кислорода на радикальный центр в β-положении [Киселева Л.Н., Достовалова В.Н., Величко Ф.К., Черстков В.Ф., Стерлин С.Р., Савичева Г.Н., Курыкин М.А., Герман Л.С., Изв. АН СССР, сер. хим., 1988, №9, 2132].
Главным основанием для использования фторуглеродов в биомедицинской практике являются их хорошая газовая емкость. Заявляемые соединения 1а-е характеризуются высокой растворяющей способностью по отношению к кислороду и диоксиду углерода: 52-53 и 360-380 об. % соответственно.
Другой важной характеристикой фторуглеродов, используемых для получения эмульсий медико-биологического назначения, является их липофильность, меняющаяся антибатно значениям температуры критического растворения в гексане. Это связано с тем, что с увеличением липофильности фторуглеродов возрастает скорость их выведения из организма и увеличивается стабильность эмульсий на их основе при длительном хранении и термической стерилизации. На высокую липофильность заявляемых α-бром-ω-галогенперфторполиэфиров 1а-е указывают относительно низкие значения их Ткр: 17°С (1b), 29°С (1c), -24°С (1d), -18°С (1e), -20°С (1f). Для сравнения укажем, что для близкого по строению к бромиду 1с полиэфира CF3CF2CF2O[CF(CF3)CF2O]3CF2CF3 Ткр составляет 56°С [RU 2206319 (2003)].
В соответствии с низкими значениями температуры критического растворения в гексане, заявляемые соединения при 15-кратной гомогенизации под давлением 600 кгс/см в присутствии полоксамера со средней молекулярной массой 10000 Да образуют стабильные (выдерживают термическую стерилизацию в автоклаве при 121°С в течение 30 мин практически без изменения дисперсности) эмульсии в воде и водно-солевых растворах, изотоничных плазме крови, с 10-20%-ным объемным содержанием фторуглеродной фазы со средним диаметром частиц 120-130 нм. (Отметим, что от размера эмульгированных частиц в значительной мере зависят переносимость и отсутствие побочного действия эмульсий ПФОС: их средний диаметр не должен превышать 200 нм [Иваницкий Г.Р. Биофизические основы создания перфторуглеродных сред и газотранспортных кровезаменителей. - В сб. науч. тр.: Перфторорганические соединения в биологии и медицине. Пущино: ИТЭБ РАН, 2001, 4-48].)
Эмульсии заявляемых соединений хорошо переносятся: при плеторическом внутривенном введении мышам и крысам от 25 до 50 мл на 1 кг массы не оказывают патогенного воздействия на их органы, ЛД50 (доза, при которой выживает 50% животных) при таком введении составляет 130-145 мл/кг.
Технический результат изобретения - расширение ассортимента перфторорганических соединений, применимых в качестве основы газотранспортных эмульсий медицинского и биотехнологического назначения, за счет создания новых химически инертных полиоксаперфторалкилгалогенидов, обладающих способностью хорошо растворять кислород и углекислый газ и образовывать нетоксичные наноэмульсии в водно-солевых растворах, не разрушающиеся при термической стерилизации в автоклаве при 121°С.
Все исходные соединения, реагенты, растворители и эмульгаторы, используемые в изобретении, коммерчески доступны, за исключением фторангидридов 2d и 2е. Их получают ректификацией смеси продуктов теломеризации ОГФП в присутствии бромдифторацетилфторида под действием каталитических количеств фторида калия [RU 2497801 (2013)].
Спектры 19F ЯМР сняты на приборе Bruker Avance 400 (382 МГц) в отсутствие растворителя с использованием трифторуксусной кислоты в качестве внешнего стандарта.
Изобретение проиллюстрировано описанием получения шести заявляемых бромсодержащих эфиров 1 (примеры 1-10), определения растворимости кислорода и углекислого газа в них (примеры 11 и 12), приготовления на их основе эмульсий (пример 13), определения токсичности полученных эмульсий (пример 14).
Пример 1. Получение перфторалкилвиниловых эфиров 3а-с [по аналогии с US 3114778 А (1963); US 3132123 А (1964)]
Смесь 1476 г (4,45 моль) димера ОГФП, 258 г (4,45 моль) безводного KF и 2,95 л сухого диглима перемешивают 2 ч, затем при -25…-28°С при интенсивном перемешивании вводят 1846 г (11,1 моль) ОГФП со скоростью 110-120 г/ч. Полученную реакционную массу перегоняют при 15-20 мм рт.ст., собирая дистиллят в приемник, охлаждаемый до -78°С. Дистиллят отогревают до 15-20°С, верхний слой (диглим) отделяют и переносят в реакционную колбу, содержащую 590 г (5,56 моль) безводного Na2CO3 и снабженную механической мешалкой, капельной воронкой и обратным холодильником. При перемешивании при 45-60°С по каплям прибавляют нижний слой дистиллята, представляющий собой смесь фторангидридов 2а-с, со скоростью, не допускающей бурного выделения CO2. По окончании прибавления реакционную массу постепенно нагревают сначала до 80°С и выдерживают при этой температуре до полного прекращения выделения CO2, затем до 110-115°С (начала дополнительного выделения CO2), после чего медленно повышают температуру до 135-140°С, регулируя скорость нагрева таким образом, чтобы не допустить бурного газовыделения. По окончании реакции летучие продукты реакции отгоняют в охлаждаемый приемник при 15-17 мм рт.ст., фторорганический слой дистиллята отделяют, промывают разбавленной соляной кислотой, сушат MgSO4 и перегоняют, собирая фракцию с т. кип. 50-110°С/15-18 мм рт.ст. Получают 2,1 кг смеси виниловых эфиров C3F7O[CF(CF3)CF2O]nCF=CF2 (3а-с), содержащей теломер гомологи с n=1-3, в основном с n=2, 3 (по данным 19F ЯМР-спектров).
Пример 2. Йодфторирование перфторалкилвиниловых эфиров 3а-с [по аналогии с Лурье Э.П., Дяткин Б.Л., Кнунянц И.Л. Журн. орг.хим., 1971, 7 (9), 1835-1840; Chambers R.D., Musgrave W.K.R., Savory J. J. Chem. Soc., 1961, 3779-3786]
Смесь 68 г (0,1 моль) эфиров 3а-с, 10 г (0,045 моль) IF5 и 22 г (0,087 моль) I2 нагревают в автоклаве из нержавеющей стали объемом 100 мл при 125°С в течение 24 ч. Жидкие продукты реакции промывают водным раствором Na2SO3, водой, сушат MgSO4, перегоняют при 40-80°С/1-2 мм рт.ст. и получают 68 г (91%) смеси йодидов 4а-с (по данным 19F ЯМР-спектров).
Пример 3. Бромирование йодидов 4а-с [по аналогии с Лурье Э.П., Дяткин Б.Л., Кнунянц И.Л. Журн. орг. хим., 1971, 7 (9), 1835-1840; Chambers R.D., Musgrave W.K.R., Savory J. J. Chem. Soc., 1961, 3779-3786] и выделение индивидуальных бромидов 1a, 1b, 1c
Смесь 513 г (0,62 моль) йодидов 4а-с и 118 г (0,74 моль) Br2 нагревают в полулитровом автоклаве из нержавеющей стали при 210°С в течение 9 ч, жидкие продукты реакции промывают водным раствором Na2SO3, водой, сушат над MgSO4, перегоняют при 60-110°С/17 мм рт.ст.и получают 440,3 г (91%) смеси бромидов 1а-с. Эту смесь подвергают ректификации и выделяют индивидуальные соединения.
Бромид 1а: т. кип. 126-128°С.
Найдено, %: С 18,09; F 60,99; Br 14,69. C8F17O2Br. Вычислено, %: С 18,10; F 60,83; Br 15,05.
19F ЯМР-спектр 1CF32CF23CF2O4CF(5CF3)6CF2O7CF28CF2Br, δ, м.д.: -81,66…-85,72 (группа сигналов 3F1+3F5+2F6+2F7); -88,78 (2F3); -147,64 (1F4); -72,25 (2F8); -132,36 (2F2).
Бромид 1b: т. кип. 167-168°С.
Найдено, %: С 19,09; F 62,46; Br 11,16. C11F23O3Br. Вычислено, %: С 18,94; F 62,69; Br 11,48.
19F ЯМР-спектр CF32CF23CF2O4CF(5CF3)6CF2O7CF8(CF3)9CF2O10CF211CF2Br δ, м.д.: -81,66…-85,72 (группа сигналов 3F1+3F5+2F6+3F8+2F9+2F10); -88,78 (2F3); -132,36 (2F2); -146,96…-147,80 (1F4+1F7); -72,25 (2F11).
Бромид 1 с: т. кип. 132°С/60 мм рт. ст.
Найдено, %: С 19,45; F 64,08; Br 9,25. C14F29O4Br. Вычислено, %: С 19,47; F 63,84; Br 9,27.
19F ЯМР-спектр
1CF32CF23CF2O4CF(5CF3)6CF2O7CF(8CF3)9CF2O10CF(11CF3)12CF2O13CF214CF2Br, 5, м.д.: -81,66…-85,72 (группа сигналов 3F1+3F5+2F6+3F8+2F9+3F11+2F12+2F13); -88,80 (2F3); -132,36 (2F2); -146,96…-147,80 (1F4+1F7+1F10); -72,29 (2F14).
Пример 4. Получение 11-бромперфтор-5,8-диметил-3,6,9-триоксаундец-1-ена (3е)
К суспензии 18,9 г (0,18 моль) безводного Na2CO3 в 80 мл сухого диглима при интенсивном перемешивании и нагревании до 55°С прибавляют по каплям 100 г (0,15 моль) фторангидрида 11-бромперфтор-2,5,8-триметил-3,6,9-триоксаундекановой кислоты (2е) [RU 2497801 (2013)], реакционную массу медленно нагревают до 78°С до прекращения газовыделения, затем температуру постепенно, за 3 ч, поднимают до 140°С. По окончании реакции летучие продукты отгоняют в охлаждаемый приемник при 50-60°С/10 мм рт.ст., дистиллят переносят в делительную воронку, нижний слой отделяют. Твердый остаток в реакционной колбе суспендируют в воде, раствор фильтруют, нижний слой фильтрата отделяют. Фторорганические продукты объединяют, промывают разбавленной соляной кислотой, сушат MgSO4, перегоняют и получают 68 г (73%) винилового эфира 3е, т. кип. 73°С/25 мм рт.ст.
Найдено, %: С 19,53; F 60,32; Br 11,30. C10F19BrO3. Вычислено, %: С 19,70; F 59,28; Br 14,14.
19ЯМР-спектр Br1CF22CF2O3CF(4CF3)5CF2O6CF(7CF3)8CF2O9CF=10CF2, δ, м.д.: -72,1 (2F1); группа сигналов -81,58…-87,62 (2F2+3F4+2F5+3F7+2F8); -147,09 уш. с. (1F3+1F6); -117,6 (1F9); -124,80 (цис-1F10); -138,7 (транс-1F11).
Пример 5. Получение 8-бромперфтор-5-метил-3,6-диоксаокт-1-ена (3d)
8-Бромперфтор-5-метил-3,6-диоксаокт-1-ен получают по методике, приведенной в примере 4, используя 101,8 г (0,2 моль) фторангидрида 8-бром-3,6-диоксаперфтор-2,5-диметилоктановой кислоты (2d) [RU 2497801 (2013)], 25,4 г (0,24 моль) безводного Na2CO3 и 80 мл сухого диглима. Выход винилового эфира 3d 66,5 г (75%), т. кип. 145-146°С.
Найдено, %: С 18,74; F 55,50; Br 17,77. C7F13BrO3. Вычислено, %: С 18,98; F 55,76; Br 18,04.
19F ЯМР-спектр Br1CF22CF2O3CF(4CF3)5CF2O6CF=7CF2, δ, м.д.: -71,60 (2F1); -82,6 (3F4); -86,09 и -87,14 (2F2+2F5); -117,5 (1F6); -125,0 (цис-1F7); -138,5 (транс-F8); -147,2 (1F3).
Пример 6. Получение 11-бромперфтор-5,8-диметил-3,6,9-триоксаундецилйодида (4е)
Смесь 63,5 г (0,104 моль) винилового эфира 3е, 10 г (0,045 моль) IF5 и 22,9 г (0,090 моль) I2 нагревают в стальном автоклаве в течение 2 дней при 125°С, жидкие продукты реакции промывают водным раствором Na2SO3, водой, сушат P2O5, перегоняют и получают 63 г (81%) 11-бромперфтор-5,8-диметил-3,6,9-триоксаундецилйодида (4е), т. кип. 103-109°С/30 мм рт.ст.
19F ЯМР-спектр Br1CF22CF2O3CF(4CF3)5CF2O6CF(7CF3)8CF2O9CF210CF2I, δ, м.д.: -72,26 (2F1); -81,66…-86,72 (группа сигналов 2F2+3F4+2F5+3F7+2F8+2F9); -67,76 (2F10); -146,93…-147,80 (1F3+1F6).
Пример 7. Получение 8-бромперфтор-5-метил-3,6-диоксаоктилйодида (4d)
8-Бромперфтор-5-метил-3,6-диоксаоктилйодид получают по методике, приведенной в примере 6, из 66 г (0,15 моль) винилового эфира 3d, 15 г (0,068 моль) IF5 и 33,6 г (0,132 моль) I2. Выход йодида 4d 73 г (83%), т. кип. 50-51°С/10 мм рт.ст.
19F ЯМР-спектр Br1CF22CF2O3CF(4CF3)5CF2O6CF27CF2I, δ м.д.: -66,54 (2F7); -71,17 (2F1); -82,4 (3F4); -82,55…-88,47 (группа сигналов 2F2+2F5+2F6); -147,37 (1F3).
Пример 8. Получение 1,11-дибромперфтор-4,7-диметил-3,6,9-триоксаундекана (1е)
Смесь 39 г (52 ммоль) йодида 4е и 10 г (0,063 моль) Br2 нагревают в стальном автоклаве при 210°С в течение 20 ч, жидкие продукты реакции промывают водным раствором Na2SO3, водой, перегоняют в вакууме и получают 32 г (87%) дибромида 1е, т. кип. 104,5-106,0°С/45 мм рт.ст., d23=1,97 г/см3.
Найдено, %: С 17,05; F 54,25; Br 22,21. C10F20Br2O3. Вычислено, %: С 16,95; F 53,67; Br 22,60.
19F ЯМР-спектр Br1CF22CF2O3CF(4CF3)5CF2O6CF(7CF3)8CF2O9CF210CF2Br, δ, м.д.: -72,32 и -71,78 (2F1+2F10); -81,66…-86,72 (группа сигналов 2F2+3F4+2F5+3F7+2F8+2F9); -146,93…-147,80 (1F3+1F6).
Пример 9. Получение 1,8-дибромперфтор-4-метил-3,6-диоксаоктана (1d)
1,8-Дибромперфтор-4-метил-3,6-диоксаоктан получают по методике, приведенной в примере 8, из 59 г йодида 4d и 19,5 г Br2. Выход дибромида 1d 47,7 г (88%), т. кип. 145-146°С.
Найдено, %: С 15,54; F 49,20; Br 29,51. C7Br2F14O2. Вычислено, %: С 15,52; F 49,09; Br 29,49.
19F ЯМР-спектр Br1CF22CF2O3CF(4CF3)5CF2O6CF27CF2Br, δ, м.д.: -71,35 и -71,83 (2F1+2F7); -82,27 (3F4); -82,25…-88,60 (группа сигналов 2F2+2F5+2F6);-147,42 (1F3).
Пример 10. Получение 8-хлорперфтор-4-метил-3,6-диоксаоктилбромида (1f)
8-Хлорперфтор-4-метил-3,6-диоксаоктилбромид получают по методике, приведенной в примере 3, используя 59 г (0,10 моль) йодида 4d и 9,2 г (0,13 моль) хлора вместо брома. Выход бромхлорида 1f 45,2 г (91%), т. кип. 125-127°С.
Найдено, %: С 16,96; F 53,11; Cl 6,83; Br 15,19. C7BrClF14O2. Вычислено, %: С 16,90; F 53,47; Cl 7,13; Br 16,06.
19F ЯМР-спектр Br1CF22CF2O3CF(4CF3)5CF2O6CF27CF2Cl, δ, м.д.: -71,48 (2F1); -76,13 (2F7); -82,53 (3F4); -85,4…-88,64 (группа сигналов 2F2+2F5+2F6);-147,49 (1F3).
Пример 11. Определение растворяющей способности 3,6,9-триоксаперфтор-5,8-диметилдодецилбромида (1b) по отношению к кислороду
В колбу, снабженную газовой бюреткой, заполненной кислородом, сухоледным обратным холодильником с краном, соединяющим систему с масляным насосом (общий объем системы 410 мл), и якорем магнитной мешалки, помещают 50 мл 3,6,9-триоксаперфтор-5,8-диметилдодецилбромида (1b). Систему вакуумируют при перемешивании, после чего кран, соединяющий колбу с масляным насосом, перекрывают, открывают кран, соединяющий колбу с газовой бюреткой, заполненной кислородом, и перемешивают содержимое до прекращения поглощения газа. Объем вошедшего в систему кислорода составляет 386 мл. Несложный расчет показывает, что растворимость кислорода в бромиде 1b при комнатной температуре составляет 52 об. %.
Пример 12. Определение растворяющей способности 3,6,9-триоксаперфтор-5,8-диметилдодецилбромида (1b) по отношению к диоксиду углерода
В колбу, соединенную через склянку Тищенко, заполненную серной кислотой, с камерой с углекислым газом и снабженную сухоледным холодильником с краном, соединяющим колбу с масляным насосом, и якорем магнитной мешалки, помещают 50 мл 3,6,9-триоксаперфтор-5,8-диметилдодецилбромида (1b). Кран, соединяющий колбу со склянкой Тищенко, перекрывают, систему вакуумируют при перемешивании, после чего кран, соединяющий колбу с масляным насосом, перекрывают и открывают краны, обеспечивающие поступление в колбу углекислого газа. Содержимое перемешивают до прекращения поглощения CO2. По данным 13С ЯМР-спектроскопии, полученный раствор содержит 48 ммоль CO2 (1186 мл) на 1 моль бромида 1b (615 г, объем 339,8 мл). Таким образом, растворимость CO2 в 3,6,9-триоксаперфтор-5,8-диметилдодецилбромиде (1b) при комнатной температуре составляет 380 об. %.
Пример 13. Получение эмульсии на основе 3,6,9-триоксаперфтор-5,8-диметилдодецилбромида (1b)
В 800 мл апирогенной воды растворяют 80 г полоксамера со средней молекулярной массой 10000 Да. Полученный раствор стерилизуют фильтрованием и смешивают с 200 мл 3,6,9-триоксаперфтор-5,8-диметилдодецилбромида (1b) на турбинной механической мешалке при частоте вращения 8000 об/мин. Образовавшуюся грубую дисперсию пропускают 15 раз через гомогенизатор модели «Донор» при давлении 600 кгс/см2 и получают в результате такой гомогенизации тонкодисперсную эмульсию со средним диаметром частиц 120 нм согласно показаниям лазерного наносайзера Coulter 15 фирмы Becman-Coulter (США). Один литр тонкодисперсной эмульсии, содержащей 20 об. % фторуглеродной фазы, смешивают с 1 л стерилизованной путем фильтрации водно-солевой композиции, содержащей, г/л: хлористый натрий 12; хлористый калий 0,8; хлористый магний 0,4; натрий гидрофосфат 0,4; натрий гидрокарбонат 1,3 и глюкозу 4,0. В результате получают совместимую с цельной кровью и пригодную для внутривенного введения наноэмульсию, содержащую 10 об. % 3,6,9-триоксаперфтор-5,8-диметилдодецилбромида (1b). Полученную наноэмульсию стерилизуют в автоклаве ВК-75 при 121°С в течение 30 мин. По показаниям наносайзера средний диаметр ее частиц после автоклавирования изменяется незначительно, составляя 130 нм.
Пример 14. Тестирование безопасности использования эмульсии на основе 3,6,9-триоксаперфтор-5,8-диметилдодецилбромида (1b) на лабораторных животных
Наноэмульсию, полученную в примере 13, вводили внутривенно наркотизированным мышам и крысам в дозе от 25 до 50 мл на 1 кг массы плеторически (без кровопускания, при неизмененном объеме крови) и после предварительного кровопускания в дозе 35 мл на 1 кг массы тела. Животных содержали первые двое суток в замкнутой камере при свободном доступе к воде и пище в атмосфере, обогащенной кислородом, - при парциальном давлении рО2 порядка 400 мм рт.ст. Затем животных помещали в стандартные клетки, где они дышали обычным атмосферным воздухом с pO2 на уровне 150 мм рт.ст. Гистологическое исследование органов лабораторных животных через 2 мес после введения эмульсии не выявило признаков ее патогенного воздействия. Полулетальная доза (ЛД50) для мышей и крыс при плеторическом введении (без кровопотери) составила 130-145 мл на 1 кг массы тела.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОКСА- И ПОЛИОКСАПЕРФТОРАЛКИЛБРОМИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2497801C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСАПЕРФТОРАЛКАНСУЛЬФОКИСЛОТ И ИХ СОЛЕЙ | 2012 |
|
RU2503659C1 |
| 1,20-Дибром-3,6,9,12,15,18-гексаоксаперфтор-4,7,10,11,14,17-гексаметилэйкозан в качестве исходного соединения для эмульсий медико-биологического назначения и способ его получения | 2016 |
|
RU2696874C2 |
| 2-БРОМТЕТРАФТОРЭТИЛПЕРФТОРАЛКИЛОВЫЕ ЭФИРЫ ДЛЯ ПОЛУЧЕНИЯ ЭМУЛЬСИЙ МЕДИКО-БИОЛОГИЧЕСКОГО НАЗНАЧЕНИЯ | 2017 |
|
RU2696871C2 |
| α,ω-ДИБРОМПОЛИОКСАПЕРФТОРАЛКАНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЭМУЛЬСИИ МЕДИКО-БИОЛОГИЧЕСКОГО НАЗНАЧЕНИЯ НА ИХ ОСНОВЕ | 2016 |
|
RU2707553C2 |
| СПОСОБ ПОЛУЧЕНИЯ α,β,β-ТРИФТОРСТИРОЛА | 2023 |
|
RU2811553C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-(ФТОРСУЛЬФОНИЛ)ПЕРФТОРПЕНТИЛВИНИЛОВОГО ЭФИРА | 2024 |
|
RU2840850C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРФТОРАЛКИЛЙОДИДОВ | 2020 |
|
RU2748928C1 |
| СПОСОБ ПОЛУЧЕНИЯ БРОМДИФТОРАЦЕТИЛФТОРИДА | 2024 |
|
RU2833217C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРФТОРАЛКИЛЙОДИДОВ И БРОМИДОВ | 2020 |
|
RU2739762C1 |
Настоящее изобретение относится к соединению общей формулы 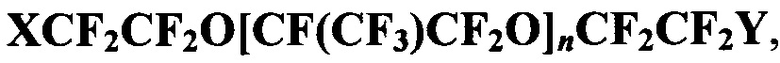 где X=CF3, Y=Вr, n=1, 2, 3; X=Y=Br, n=2; X=Br, Y=Cl, n=1, которое может быть использовано в качестве основы газотранспортных композиций медико-биологического назначения. 1 з.п. ф-лы, 14 пр.
где X=CF3, Y=Вr, n=1, 2, 3; X=Y=Br, n=2; X=Br, Y=Cl, n=1, которое может быть использовано в качестве основы газотранспортных композиций медико-биологического назначения. 1 з.п. ф-лы, 14 пр.
1. Соединения общей формулы 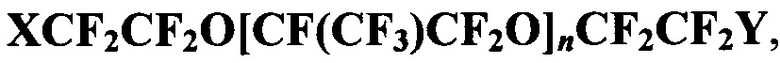 где X=CF3, Y=Вr, n=1, 2, 3; X=Y=Br, n=2; X=Br, Y=Cl, n=1.
где X=CF3, Y=Вr, n=1, 2, 3; X=Y=Br, n=2; X=Br, Y=Cl, n=1.
2. Соединения по п. 1 в качестве основы газотранспортных композиций медико-биологического назначения.
| Hung, Ming-H | |||
| et al | |||
| Synthesis of Perfluorovinyl Ether Monomers | |||
| Journal of Organic Chemistry, 1994, 59(15), 4332-4335 | |||
| Database CA [online], RN 1262415-94-0, Entered STN: 09 Feb 2011 | |||
| ОКСА- И ПОЛИОКСАПЕРФТОРАЛКИЛБРОМИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2497801C1 |
| US 4640833 A1, 03.02.1987. | |||
Авторы
Даты
2019-11-22—Публикация
2019-03-29—Подача