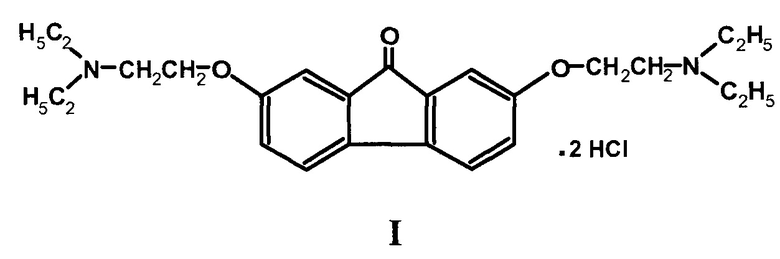
Изобретение относится к области органической химии, а именно: к усовершенствованному способу получения дигидрохлорида 2,7-бис-[2-(диэтиламино)этокси]-флуоренона-9 (I) - химической субстанции лекарственного средства тилорон, обладающего противовирусным действием и иммуностимулирующими свойствами [Николаева, И.С.Синтез и противовирусная активность тилорона и его аналогов / И.С. Николаева [и др.] // Хим.-фарм. журн. - 1988. - №7. - С. 977-979; Григорян, С.С. Интерфероноиндуцирующая активность амиксина и его влияние на интерфероновый статус / С.С. Григорян [и др.] // Вопросы вирусологии. - 1990. - №1 - С. 64-66; Krueger, R.F. Tilorone Hydrochloride: An Orally Active Antiviral Agent / R.F. Krueger and G.D. Mayer // Science. - 1970. - Vol. 169. - P. 1213-1214; Adamson, R.H. Antitumor Activity of Tilorone Hydrochloride against Some Rodent Tumors: Preliminary Report / R.H. Adamson // J. National Cancer Institute. - 1971. - Vol. 46. - P. 431-434].
В качестве исходного сырья при получении I, как правило, используют флуорен.
Описаны способы получения I через различные 2,7-производные флуорена: диацетильное производное [Burke, M.S. New synthetic pathways to tilorone hydrochloride / M.S. Burke and M.M. Joulie. // Synthetic Com. - 1976. - 6(5). - P. 371-376]; 2,7-дийодфлуоренон [Пат. РФ №2076097, 27.03.1997]; 2,7-динитро-флуоренон [Пат. №9031036 JP, 04.02.1997]; 2,7-дисульфофлуорен [Пат. РФ №2317974, 13.12.2006; Пат. РФ №2444512, 18.10.2010; Богатський, О.В. Про синтез  / О.В. Богатський, A.I. Грень, Л.О. Литвинова, Г.В. Лемпарт. //
/ О.В. Богатський, A.I. Грень, Л.О. Литвинова, Г.В. Лемпарт. //  РСР.
РСР.  Б. - 1976. - №7. - С. 610-612; Zhang, J. An Effective Synthesis Method for Tilorone Dihydrochloride with Obvious IFN-α Inducing Activity / J. Zhang, Q. Yao, and Z, Liu // Molecules. - 2015. - Vol. 20. - No. 12. - P. 21458-21463; Shaabani, A. Solvent free permanganate oxidation / A. Shaabani and D.G. Lee // Tetrahedron Lett. - 2001. - No. 42. - P. 5833-5836; Пат. РФ №2218327, 17.03.1999].
Б. - 1976. - №7. - С. 610-612; Zhang, J. An Effective Synthesis Method for Tilorone Dihydrochloride with Obvious IFN-α Inducing Activity / J. Zhang, Q. Yao, and Z, Liu // Molecules. - 2015. - Vol. 20. - No. 12. - P. 21458-21463; Shaabani, A. Solvent free permanganate oxidation / A. Shaabani and D.G. Lee // Tetrahedron Lett. - 2001. - No. 42. - P. 5833-5836; Пат. РФ №2218327, 17.03.1999].
Явными недостатками способа [Burke, M.S. New synthetic pathways to tilorone hydrochloride / M.S. Burke and M.M. Joulie. // Synthetic Com. - 1976. - 6(5). - P. 371-376] являются применение дорогостоящих реагентов, образование трудно утилизируемых хром содержащих отходов, а также низкий выход целевого продукта.
Несмотря на кажущуюся простоту способа [Пат. РФ №2076097, 27.03.1997], практическая его реализация связана с применением элементарного йода, дорогостоящего 18-краун-6-эфира и получением диэтиламиноэти-лата калия, что в немалой степени осложняют внедрение способа в промышленное производство.
Общим недостатком способов [Burke, M.S. New synthetic pathways to tilorone hydrochloride / M.S. Burke and M.M. Joulie. // Synthetic Com. - 1976. - 6(5). - P. 371-376] и [Пат. РФ №2076097, 27.03.1997], несомненно, является использование большого количества органических растворителей на всех стадиях синтеза.
Существенным недостатком способа [Пат. №9031036 JP, 04.02.1997], помимо низкого выхода целевого продукта, является наличие опасных производственных процессов нитрования, диазотирования и гидрирования с применением высокого давления, которые предполагают применение специального дорогостоящего оборудования и принятия повышенных мер технической безопасности производства. Эти факторы отрицательно сказываются на возможности внедрения данного способа в производство.
В последние годы разработаны синтетические способы получения I без использования флуорена.
Одним из таких путей является взаимодействие 3-метоксибензойного альдегида с 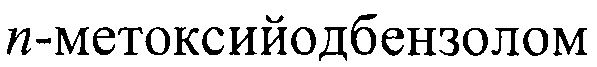 [Chen, X-Y. Synthesis of Fluorenones from Benzaldehydes and Aryl Iodides: Dual C-H Functionalizations Using a Transient Directing Group / X-Y. Chen, S. Ozturk, and E.J. Sorensen // Org. Lett. - 2017. - Vol. 19. - No. 5. - P. 1140-1143] в присутствии ацетата палладия, тетрафторацетата серебра и антраниловой кислоты. Синтез осуществляют в смеси уксусной кислоты с гексафторизопропанолом.
[Chen, X-Y. Synthesis of Fluorenones from Benzaldehydes and Aryl Iodides: Dual C-H Functionalizations Using a Transient Directing Group / X-Y. Chen, S. Ozturk, and E.J. Sorensen // Org. Lett. - 2017. - Vol. 19. - No. 5. - P. 1140-1143] в присутствии ацетата палладия, тетрафторацетата серебра и антраниловой кислоты. Синтез осуществляют в смеси уксусной кислоты с гексафторизопропанолом.
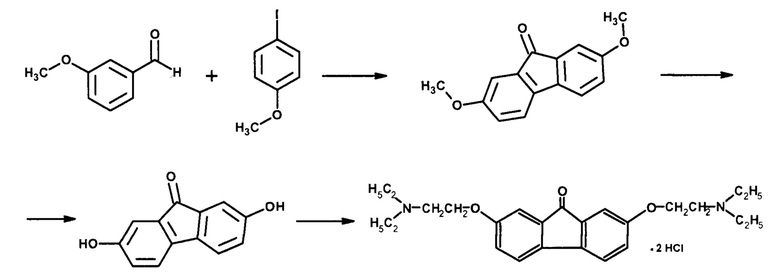
К получению I приводит также взаимодействие 3-гидроксибензойного альдегида с 3-йод-4-бромфенолом [Patel, A. Palladium catalyztivated domino С-Н activation strategy: An access to 9-fluornones / A. Patel, M. Shaikh, and K. Chikhalia // Tetrahedron. - 2019. - Vol. 75. - No. 2. - P. 236-245] в растворе трет-амилового спирта в атмосфере азота при 120°С в присутствии ацетата палладия, N-фенилпиколинамида и гидрокарбоната калия.
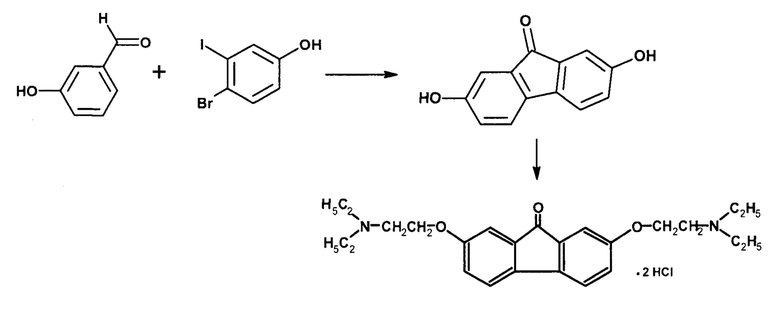
Тилорон (I) получают путем алкилирования полученного 2,7-дигидрок-сифлуоренона диэтиламиноэтилхлоридом с последующим выделением солянокислой соли.
Оба способа [Chen, X-Y. Synthesis of Fluorenones from Benzaldehydes and Aryl Iodides: Dual C-H Functionalizations Using a Transient Directing Group / X-Y. Chen, S. Ozturk, and E.J. Sorensen // Org. Lett. - 2017. - Vol. 19. - No. 5. - P. 1140-1143; Patel, A. Palladium catalyztivated domino C-H activation strategy: An access to 9-fluornones / A. Patel, M. Shaikh, and K. Chikhalia // Tetrahedron. -2019. - Vol. 75. - No. 2. - P. 236-245], несомненно представляя научный интерес, вряд ли являются привлекательными для промышленного применения по причине высокой стоимости получаемого I.
Наиболее технологичными и приемлемыми для практической реализации являются способы получения I через соли 2,7-флуорендисульфокислоты. На первой стадии синтеза флуорен сульфируют серной кислотой [Пат. РФ №2317974, 13.12.2006; Пат. РФ №2444512, 18.10.2010] или 10% олеумом [Богатський, О.В. Про синтез 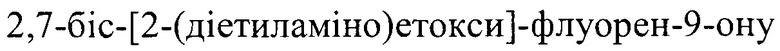 / О.В. Богатський, A.I. Грень, Л.О. Литвинова, Г.В. Лемпарт. //
/ О.В. Богатський, A.I. Грень, Л.О. Литвинова, Г.В. Лемпарт. //  РСР.
РСР.  Б. - 1976. - №7. - С. 610-612]. Дальнейший процесс включает окислительное гидроксилирование динатриевой соли 2,7-флуорендисульфокислоты, циклизацию 4,4'-дигидроксидифенил-2-карбоновой кислоты и алкилирование 2,7-дигидроксифлуоренона N,N-диэтиламиноэтилхлоридом.
Б. - 1976. - №7. - С. 610-612]. Дальнейший процесс включает окислительное гидроксилирование динатриевой соли 2,7-флуорендисульфокислоты, циклизацию 4,4'-дигидроксидифенил-2-карбоновой кислоты и алкилирование 2,7-дигидроксифлуоренона N,N-диэтиламиноэтилхлоридом.
В ряде способов окислительное гидроксилирование динатриевой соли 2,7-флуорендисульфокислоты заменяют двухступенчатым процессом получения 4,4'-дигидроксидифенил-2-карбоновой кислоты. Для этого динатриевую соль 2,7-флуорендисульфокислоты окисляют перманганатом калия до соли 2,7-флуоренондисульфокислоты, после чего последнюю подвергают щелочному плавлению без добавления нитратов [Zhang, J. An Effective Synthesis Method for Tilorone Dihydrochloride with Obvious IFN-a Inducing Activity / J. Zhang, Q. Yao, and Z, Liu // Molecules. - 2015. - Vol. 20. - No. 12. - P. 21458-21463; Shaabani, A. Solvent free permanganate oxidation / A. Shaabani and D.G. Lee // Tetrahedron Lett. - 2001. - No. 42. - P. 5833-5836].
Несомненным преимуществом способов синтеза I через 2,7-дисульфофлуорен является ограниченное применение органических растворителей (на последней стадии синтеза), что делает способы более безопасными и привлекательными для промышленной реализации.
Общими недостатками данных способов является довольно трудоемкий процесс выделения продукта первой стадии синтеза и образование большого количества отходов производства, связанное с применением большого избытка сульфирующего агента.
Наиболее близким техническим решением заявляемому изобретению является способ получения дигидрохлорида 2,7-бис[2-(диэтиламино)этокси]-флуоренона-9 [Пат. РФ №2218327, 17.03.1999], заключающийся в том, что флуорен сульфируют серной кислотой с плотностью 1,83-1,84 г/см3 при температуре 160±5°С в течение 20 мин, смесь образующихся сульфокислот разбавляют водой и нейтрализуют едким натром до рН 4-4,5; выпавший осадок смеси моно-(III) и ди-(II) натриевых солей сульфокислот флуорена перекристаллизовывают из воды с получением II, которую подвергают реакции щелочного плавления нагреванием в течение 2,5-3 ч при 220±10°C с едким натром в присутствии каталитических количеств аммиачной воды и смеси азотнокислого натрия и азотнокислого калия, взятых в весовом соотношении друг к другу 5:1. При этом после гашения щелочного плава, подкисления его 50%-ной серной кислотой с выходом 88% образуется 4,4'-дигидроксидифенил-2-карбоновая кислота, которая при нагревании с хлористым цинком в течение 30 мин при температуре 200±5°С превращается в 2,7-дигидроксифлуоренон с выходом 90%. Далее 2,7-дигидроксифлуоренон подвергают реакции алкилирования взаимодействием с 2,5-3,0 молями гидрохлорида 2-диэтиламиноэтилхлорида при кипячении в течение 20 ч в толуоле с 40%-ным раствором едкого кали. При этом образуется основание «тилорона» - 2,7-бис[2-(диэтиламино)этокси]-флуоренон-9. Полученное основание растворяют в ацетоне и превращают в I действием 35%-ной соляной кислоты, добавляемой в ацетоновый раствор основания «тилорона». При выходе I на стадии алкилирования 57% общий выход I, считая на исходный флуорен, составляет 32-34%.
Задачей заявляемого изобретения является получение I высокого качества при упрощении производства и сокращении количества отходов.
Поставленная задача решается следующим способом получения I, заключающимся в том, что флуорен сульфируют хлорсульфоновой кислотой (ХСК) в органическом растворителе, образующуюся смесь сульфокислот флуорена после фильтрации растворяют в воде и нейтрализуют раствором гидроксида натрия до значения рН 8,5-9. Выпавший осадок III отделяют фильтрацией, полученный фильтрат упаривают до состояния густой суспензии и выделяют II. Полученный продукт II подвергают дальнейшей переработке согласно способу, принятому за прототип. Получают I с выходом 36-38%, считая на исходный флуорен. Чистота полученного продукта составляет 99,75-99,80% (ВЭЖХ).
Уменьшение количества отходов производства по сравнению с прототипом и другими способами [Пат. РФ №2317974, 13.12.2006; Пат. РФ №2444512, 18.10.2010; Богатський, О.В. Про синтез 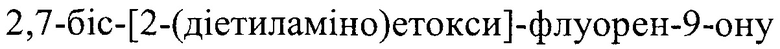 / О.В. Богатський, A.I. Грень, Л.О. Литвинова, Г.В. Лемпарт. //
/ О.В. Богатський, A.I. Грень, Л.О. Литвинова, Г.В. Лемпарт. //  РСР.
РСР.  Б. - 1976. - №7. - С. 610-612; Zhang, J. An Effective Synthesis Method for Tilorone Dihydrochlo-ride with Obvious IFN-α Inducing Activity / J. Zhang, Q. Yao, and Z, Liu // Molecules. - 2015. - Vol. 20. - No. 12. - P. 21458-21463; Shaabani, A. Solvent free permanganate oxidation / A. Shaabani and D.G. Lee // Tetrahedron Lett. - 2001. - No. 42. - P. 5833-5836; Пат. РФ №2218327, 17.03.1999] достигается за счет возвращения в технологический процесс как растворителя, используемого на операции сульфирования флуорена, так и отогнанной при упаривании раствора II воды.
Б. - 1976. - №7. - С. 610-612; Zhang, J. An Effective Synthesis Method for Tilorone Dihydrochlo-ride with Obvious IFN-α Inducing Activity / J. Zhang, Q. Yao, and Z, Liu // Molecules. - 2015. - Vol. 20. - No. 12. - P. 21458-21463; Shaabani, A. Solvent free permanganate oxidation / A. Shaabani and D.G. Lee // Tetrahedron Lett. - 2001. - No. 42. - P. 5833-5836; Пат. РФ №2218327, 17.03.1999] достигается за счет возвращения в технологический процесс как растворителя, используемого на операции сульфирования флуорена, так и отогнанной при упаривании раствора II воды.
Поскольку применение ХСК предполагает наличие безводной среды, процесс сульфирования осуществляют в среде органического растворителя. Для достижения лучших результатов сульфирования применяемые растворители должны удовлетворять следующим условиям:
- хорошо растворять исходные вещества;
- плохо растворять продукт реакции;
- не сульфироваться в условиях реакции;
- быть легко регенерируемыми;
- являться, по возможности, пожаробезопасными.
Перечисленным критериям соответствуют хлорированные углеводороды, из которых наиболее подходящим является хлороформ.
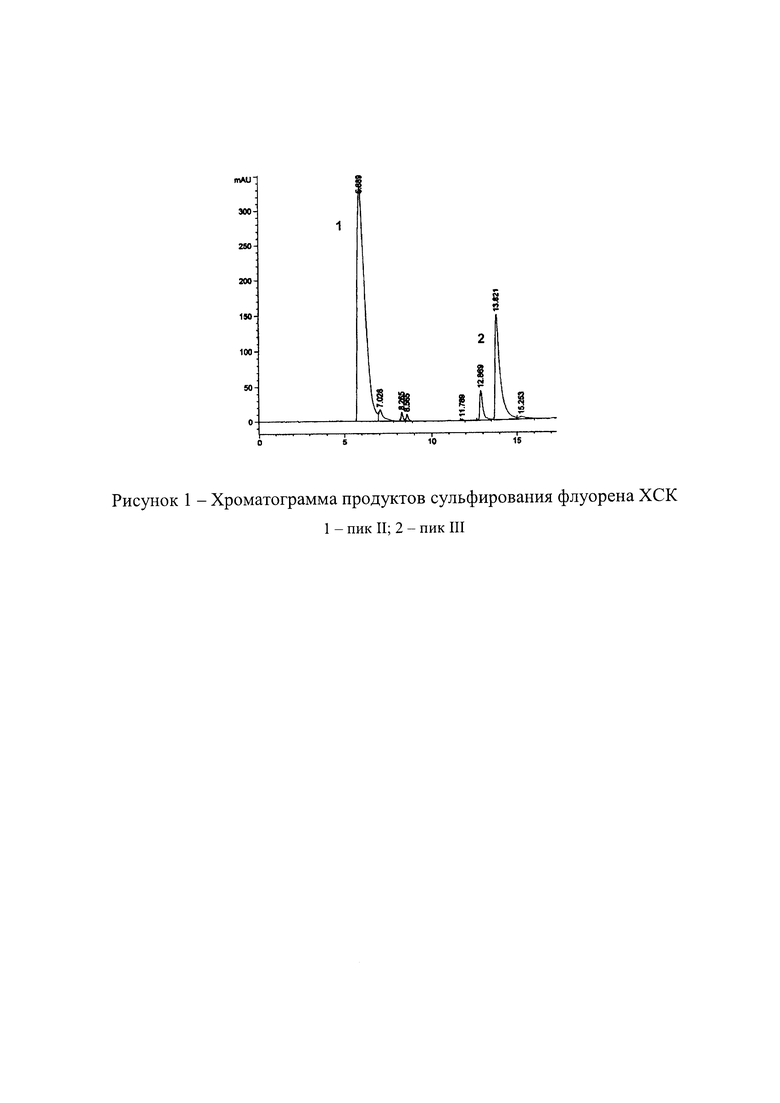
Независимо от характера сульфирующего агента при сульфировании флуорена, помимо 2,7-дисульфофлуорена (пик 1, рисунок 1), образуется ряд других сульфозамещенных, основное количество из которых приходится на монозамещенное производное (пик 2, рисунок 1).
Несомненным достоинством предлагаемого способа является возможность простым и эффективным способом отделить II от монозамещенной соли III, который основан на различной растворимости солей. При высокой растворимости в воде II (200 г/л) растворимость III составляет всего 8 г/л. В отсутствии высаливающего эффекта сульфата натрия при нейтрализации водного раствора продуктов сульфирования натриевой щелочью при рН 4-4,5 (в отличие от прототипа) наблюдается лишь частичное выпадение III из раствора. Полное же осаждение III достигается при значении рН 8,5-9. После отделения осадка в фильтрате остается И, который выделяют путем упаривания фильтрата.
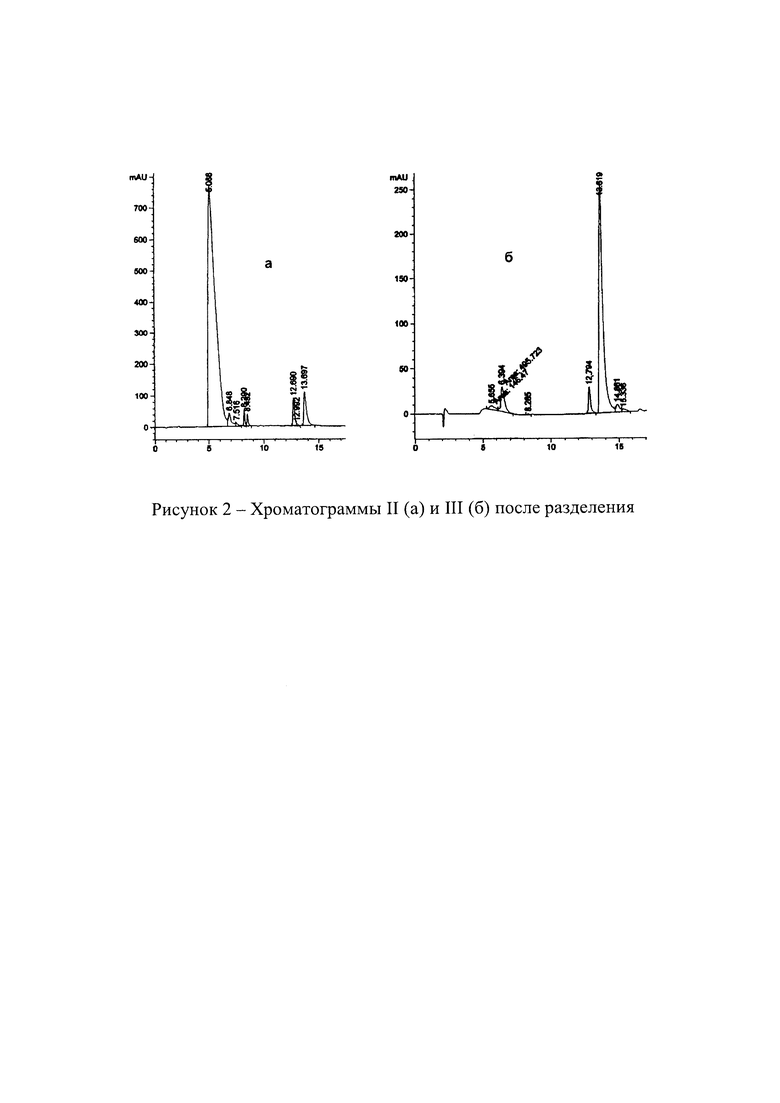
Эффективность разделения исходной смеси сульфокислот иллюстрируют приведенные на рисунке 2 хроматограммы продуктов разделения. После нейтрализации в водной фазе преимущественно присутствует II (а), а осадок в основном состоит из мононатриевой соли III (б).
Помимо этого, при сульфировании ХСК (в отличие от серной кислоты и олеума) в реакционной массе отсутствует сульфат натрия, осложняющий выделение и очистку II. Это в значительной степени упрощает процесс, положительно сказывается на снижении трудоемкости производства и сокращении количества отходов.
Сравнение результатов сульфирования флуорена различными способами показывает несомненные преимущества предлагаемого технического решения (таблица 1).
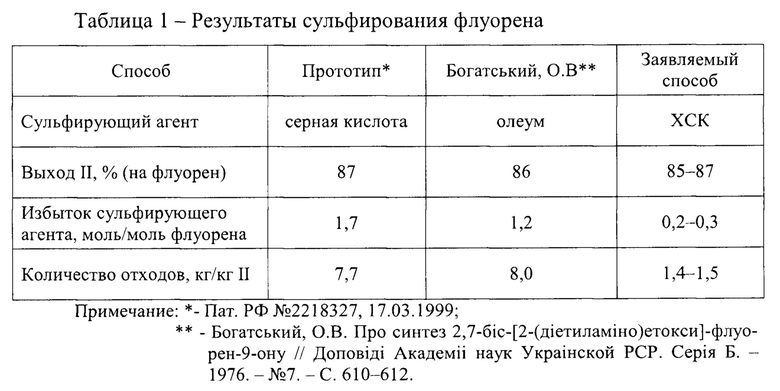
При сопоставимых значениях выхода II предлагаемый способ выгодно отличается низким расходом сульфирующего агента и меньшим количеством отходов.
Характерной особенностью ХСК является ее высокая сульфирующая способность, которая приводит к энергичному протеканию процесса сульфирования. Уже при 0°С наблюдается максимальный выход продукта. При этом как снижение температуры ниже 0°С, так и повышение ее выше 10°С приводит к уменьшению выхода II (таблица 2).

Несмотря на высокую реакционную способность ХСК стехиометрического количества сульфирующего агента явно не хватает для получения высокого выхода 2,7-дисульфофлуорена из-за расходования сульфирующего агента на образование 2-сульфофлуорена. Для получения максимального выхода продукта оказывается достаточно избытка ХСК, равного 0,2-0,3 моль на моль флуорена. Дальнейшее увеличение избытка ХСК нецелесообразно, (таблица 3).

Таким образом, оптимальным режимом сульфирования можно считать проведение процесса при температуре 0-10°С и небольшом избытке ХСК, равном 0,2-0,3 моль/моль флуорена.
Сравнение заявляемого способа получения I с прототипом и другими способами показывает, что техническое решение поставленной задачи, в котором бы имело место предложенное сочетание признаков, неизвестно.
В предложенном способе получения I процесс сульфирования флуорена проводится в органическом растворителе, в качестве сульфирующего агента применена хлорсульфоновая кислота, а очистка продукта первой стадии (II) от монозамещенной соли (III) впервые осуществлена без применения процесса перекристаллизации. По всем перечисленным признакам способ соответствует условию новизна.
Реализация заявленного способа позволяет практически в 5 раз сократить количество промышленных отходов и упростить технологический процесс, что в конечном итоге положительным образом сказывается на улучшении технико-экономических показателей производства I. По перечисленным признакам предложенное техническое решение соответствует условию промышленной применимости.
Сведения, подтверждающие возможность осуществления способа, приведены ниже.
Пример 1
В 50 мл дихлорэтана растворяют 4,2 г (0,025 моль) флуорена; в 30 мл дихлорэтана растворяют 6,4 г (0,055 моль) ХСК. Раствор флуорена охлаждают до 0°С. В охлажденный раствор медленно прикапывают охлажденный раствор ХСК, не допуская подъема температуры выше 10°С. После окончания дозировки реакционную массу выдерживают при перемешивании 2 ч.
Осадок отфильтровывают, промывают на фильтре небольшим количеством дихлорэтана, высушивают под вакуумом без нагрева. Получают 7,76 г (95,5%) серого осадка, содержащего смесь сульфокислот. Содержание 2,7-дисульфофлуорена в осадке продуктов сульфирования составляет 83,4% (ВЭЖХ). Высушенный осадок растворяют в небольшом количестве воды и нейтрализуют раствором NaOH до рН 8-9, при этом наблюдается практически полное выпадение моносульфопроизводного. Выпавший осадок отфильтровывают, фильтрат упаривают до 20-25% от исходного объема и получают 7,95 г (0,0215 моль) динатриевой соли 2,7-флуорендисульфокислоты с выходом 86%.
Дальнейший синтез I осуществляли согласно прототипу. Получили продукт с выходом 36% в расчете на исходный флуорен с содержанием основного вещества 99,8%.
Найдено (%): С, 63.08; Н, 7.72; N, 5.91; О, 10.24.
Вычислено (%): С, 62.04; Н, 7.44; N, 5.79; О, 9.93.
ИК-спектр ν, см-1: 1710 (С=O); 2978, 1475 (С-Наром); 2730, 1446 (С-Налиф.); 1065 (С-О-С).
ЯМР-спектр 1Н (DMSO-d6): 1,25-1,28 м.д. (12Н, м, СН3); 3,20-3,50 м.д. (8Н, м, СН2); 4,46 м.д. (4Н, с, СН2); 7,16-7,20 м.д. (4Н, м, СН2); 7,64-7,66 м.д. (2Н, д, СН); 10,72 м.д. (4Н, с, СН).
ЯМР-спектр 13С (DMSO-d6): 193,02 м.д. (С=O, Ar-1); 158,60 м.д. (С-О, Ar-7, Ar-11); 137,84 м.д. (С, Ar-3, Ar-4); 135,62 м.д. (С, Ar-2, Ar-5); 122,20 м.д. (С, Ar-9, Ar-13); 121,66 м.д. (С, Ar-8, Ar-12); 111,09 м.д. (С, Ar-6, Ar-10); 63,37 м.д. (С-О); 50,07 м.д. (С-О); 47,50 м.д. (C-N); 40,67 - 39,40 м.д. (C-N); 8,94 м.д. (СН).
Пример 2
В 100 литровый стеклянный реактор заливают 50 л хлороформа, растворяют 4,15 кг (25 моль) флуорена и охлаждают полученный раствор до 0°С. В охлажденный раствор флуорена медленно приливают из дозатора заранее приготовленный охлажденный раствор 6,7 кг (57,5 моль) ХСК в 30 л хлороформа, не допуская подъема температуры выше 10°С. После окончания дозировки реакционную массу выдерживают при перемешивании в течение 2 ч.
Выпавший осадок продуктов сульфирования отфильтровывают, промывают на фильтре 5 л хлороформа и высушивают под вакуумом без нагрева. Высушенный осадок растворяют в 5 л воды и нейтрализуют раствором NaOH до рН 8-9. Выпавший осадок моносульфопроизводного отфильтровывают, фильтрат упаривают до 20% от исходного объема и получают 8,05 кг (21,75 моль) динатриевой соли 2,7-флуорендисульфокислоты с выходом 87%.
Дальнейший синтез I осуществляли согласно прототипу. Получили продукт с выходом 38% в расчете на исходный флуорен с содержанием основного вещества 99,75%.
Найдено (%): С, 61.83; Н, 7.59; N, 5.85; О, 9.72.
Вычислено (%): С, 62.04; Н, 7.44; N, 5.79; О, 9.93.
ИК-спектр ν, см-1: 1710 (С=O); 2978, 1475 (С-Наром.); 2730, 1446 (С-Налиф.); 1065 (С-О-С).
ЯМР-спектр 1Н (DMSO-d6): 1,25-1,28 м.д. (12Н, м, СН3); 3,20-3,50 м.д. (8Н, м, СН2); 4,46 м.д. (4Н, с, СН2); 7,16-7,20 м.д. (4Н, м, СН2); 7,64-7,66 м.д. (2Н, д, СН); 10,72 м.д. (4Н, с, СН).
ЯМР-спектр 13С (DMSO-d6): 193,02 м.д. (С=O, Ar-1); 158,60 м.д. (С-О, Ar-7, Ar-11); 137,84 м.д. (С, Ar-3, Ar-4); 135,62 м.д. (С, Ar-2, Ar-5); 122,20 м.д. (С, Ar-9, Ar-13); 121,66 м.д. (С, Ar-8, Ar-12); 111,09 м.д. (С, Ar-6, Ar-10); 63,37 м.д. (С-О); 50,07 м.д. (С-О); 47,50 м.д. (C-N); 40,67-39,40 м.д. (C-N); 8,94 м.д. (СН).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРОХЛОРИДА 2,7-БИС-[2-(ДИЭТИЛАМИНО)ЭТОКСИ]-ФЛУОРЕНОНА-9 | 2010 |
|
RU2444512C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРОХЛОРИДА 2,7-БИС[2-(ДИЭТИЛАМИНО)ЭТОКСИ] ФЛУОРЕНОНА (АМИКСИНА) | 2006 |
|
RU2317974C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРОХЛОРИДА 2,7-БИС-[2-(ДИЭТИЛАМИНО)ЭТОКСИ]ФЛУОРЕНОНА-9-ПРОТИВОВИРУСНОГО И ИММУНОМОДУЛИРУЮЩЕГО ПРЕПАРАТА "АМИКСИН" | 1999 |
|
RU2218327C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,7-БИС[2-(ДИЭТИЛАМИНО)ЭТОКСИ]ФЛОУРЕНОНА ДИГИДРОХЛОРИДА | 1994 |
|
RU2076097C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,7-БИС[2-(ДИЭТИЛАМИНО)ЭТОКСИ]ФЛУОРЕН-9-ОНА ДИГИДРОХЛОРИДА (ТИЛОРОНА) | 2008 |
|
RU2375345C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОЗАМЕЩЕННЫХ ФТАЛОЦИАНИНОВ | 1999 |
|
RU2181736C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА IV ТИЛОРОНА ДИГИДРОХЛОРИДА И ПРОМЫШЛЕННЫЙ СПОСОБ ЕЕ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2012 |
|
RU2509074C2 |
| СПОСОБ ПЕРЕРАБОТКИ ОТХОДОВ ПРОИЗВОДСТВА КОНТАКТНОГО АНТРАХИНОНА | 1991 |
|
RU2072353C1 |
| Способ получения динатриевой соли дисульфокислоты фталоцианина кобальта | 1986 |
|
SU1395645A1 |
| Способ флуоресцентной идентификации амилоида | 2017 |
|
RU2673815C1 |
Изобретение относится к усовершенствованному способу получения дигидрохлорида 2,7-бис-[2-(ди-этиламино)этокси]-флуоренона-9, обладающего иммуномодулирующими свойствами и широким спектром противовирусного действия. Способ включает сульфирование флуорена, окислительное гидроксилирование динатриевой соли 2,7-флуорендисульфокислоты, циклизацию полученного 4,4'-дигидроксидифенил-2-карбоновой кислоты, алкилирование 2,7-дигидроксифлуоренона гидрохлоридом 2-диэтиламиноэтилхлоридом с получением основания, которое превращают в дигидрохлорид. Отличительной особенностью предлагаемого способа является то, что сульфирование флуорена осуществляют хлорсульфоновой кислотой в мольном соотношении флуорен:хлорсульфоновая кислота, равном 1:2,2-1:2,3, в интервале температур 0-10°C с последующим отделением натриевой соли моносульфофлуорена нейтрализацией водного раствора продуктов сульфирования гидроксидом натрия до рН 8-9 и выделением динатриевой соли 2,7-дисульфофлуорена упариванием полученного фильтрата. Способ позволяет повысить выход целевого продукта до 36-38% в расчете на исходный флуорен и содержание основного вещества более 99%. При этом снижается количество побочных продуктов. 2 ил., 2 пр.
Способ получения дигидрохлорида 2,7-бис-[2-(диэтиламино)этокси]-флуоренона-9, включающий сульфирование флуорена, окислительное гидроксилирование динатриевой соли 2,7-флуорендисульфокислоты, циклизацию 4,4'-дигидроксидифенил-2-карбоновой кислоты, алкилирование 2,7-дигидроксифлуоренона, отличающийся тем, что сульфирование флуорена осуществляют хлорсульфоновой кислотой в мольном соотношении флуорен : хлорсульфоновая кислота, равном 1:2,2-1:2,3, в интервале температур 0-10°C с последующим отделением натриевой соли моносульфофлуорена, нейтрализацией водного раствора продуктов сульфирования гидроксидом натрия до рН 8,5-9 и выделением динатриевой соли 2,7-дисульфофлуорена упариванием полученного фильтрата.
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРОХЛОРИДА 2,7-БИС[2-(ДИЭТИЛАМИНО)ЭТОКСИ] ФЛУОРЕНОНА (АМИКСИНА) | 2006 |
|
RU2317974C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,7-БИС[2-(ДИЭТИЛАМИНО)ЭТОКСИ]ФЛУОРЕН-9-ОНА ДИГИДРОХЛОРИДА (ТИЛОРОНА) | 2008 |
|
RU2375345C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРОХЛОРИДА 2,7-БИС-[2-(ДИЭТИЛАМИНО)ЭТОКСИ]ФЛУОРЕНОНА-9-ПРОТИВОВИРУСНОГО И ИММУНОМОДУЛИРУЮЩЕГО ПРЕПАРАТА "АМИКСИН" | 1999 |
|
RU2218327C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРОХЛОРИДА 2,7-БИС-[2-(ДИЭТИЛАМИНО)ЭТОКСИ]-ФЛУОРЕНОНА-9 | 2010 |
|
RU2444512C1 |
| Zhang, J., Yao, Q., & Liu, Z | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| An Effective Synthesis Method for Tilorone Dihydrochloride with Obvious IFN-α Inducing Activity | |||
| Molecules, 20(12), 21458-21463 | |||
| Burke, S | |||
| M., & Joullie, M | |||
| M., New Synthetic Pathways to Tilorone | |||
Авторы
Даты
2019-11-25—Публикация
2019-08-06—Подача