Перекрестная ссылка на родственные заявки
В настоящей заявке, согласно статье 35, 119(e) Кодекса законов США (USC) испрашивается приоритет предварительной заявки pег.# 61/975127, поданной 4 апреля 2014, полное описание которой вводится в настоящее описание посредством ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и фармацевтическим композициям, применяемым для доставки в легкие путем ингаляции, где указанные композиции содержат рапамицин для предотвращения старения и для профилактики и лечения возрастных заболеваний, состояний и расстройств.
Предпосылки создания изобретения
Рапамицин представляет собой макроциклический триеновый антибиотик, продуцируемый бактерией Streptomyces hygroscopicus, см., например, патент США No. 3929992. Рапамицин является ингибитором mTOR. Впервые было показано, что рапамицин, благодаря своим иммуносупрессорным и противовоспалительным свойствам, может быть использован при трансплантации и для лечения аутоиммуннных заболеваний. Так, например, было показано, что он может быть использован для предупреждения образования гуморальных (IgE-подобных) антител, вырабатываемых в ответ на стимуляцию альбуминовым аллергеном; для ингибирования активации мышиных Т-клеток и для увеличения продолжительности жизни трансплантированных органов у грызунов, обладающих совместимостью к гистоину. У грызунов с моделью аутоиммунного заболевания, рапамицин подавляет иммуноопосредуемые реакции, ассоциированные с системной красной волчанкой, коллаген-индуцируемым артритом, аутоимунным диабетом типа I, аутоиммунным миокардитом, экспериментальным аллергическим энцефаломиелитом, реакцией «трансплантат против хозяина» и аутоиммунным увеоретинитом.
Рапамицин также известен под своим общим названием «сиролимус» (см., например, ANDA #201578, Dr. Reddys Labs Ltd., апробированный 28 мая, 2013). Сиролимус был одобрен организацей FDA для его продажи в Соединенных Штатах, и этот препарат используется для профилактики отторжения трансплантированных органов и при трансплантации почек, где указанный препарат поставляется Wyeth (Pfizer) под торговым знаком RAPAMUNE. Этот препарт производится в форме перорального раствора (1 мг/мл) или таблетки (в различных концентрациях). Компания Wyeth (Pfizer) также выпускает производное указанного препарата под торговым знаком TORISEL (темсиролимус), которое вводят внутривенно для лечения прогрессирующей почечно-клеточной карциномы. Темсиролимус представляет собой водорастворимое пролекарство сиролимуса. Cordis, отделение компании Johnson & Johnson, выпускает сиролимус-выводящие коронарные стенты под торговым знаком CYPHER. В этой связи следует отметить, что антипролиферативное действие сиролимуса предупреждает рестеноз коронарной артерии после баллонной ангиопластики. В заявке США 2010/0305150, Berg et al. (Novartis), описаны производные рапамицина для лечения и предупреждения нервно-кожных расстройств, таких как TSC-опосредуемые расстройства, включая туберозный склероз, а также расстройства, опосредуемые нейрофиброматозом типа 1 (NF-1). Рапамицин и его производные также описаны в публикации Nishimura, T. et al. (2001) Am. J. Respir. Crit. Care Med. 163:498-502 и в патентах США NN 6384046 и 6258823.
Рапамицин, применяемый согласно его клинически одобренным показаниям, дает несколько известных побочных эффектов, включая токсическое действие на легкие (в инструкции по приему RAPAMUNE имеется предупреждение, что этот препарат не показан пациентам при трансплантации легких), повышенный риск развития рака и симптомы, напоминающие диабет. Рапамицин ассоциируется с легочной токсичностью, обычно проявляющийся в форме интерстициального пневмонита, но был также зарегистрирован случай альвеолярного протеиноза легких. См., например, Nocera et al., Sirolimus Therapy in Liver Transplant Patients: An Initial Experience at a Single Center, Transplantation Proceedings (2008), 40(6), 1950-1952; Perez et al., Interstitial Pneumonitis Associated With Sirolimus in Liver Transplantation: A Case Report, Transplantation Proceedings (2007), 39(10), 3498-3499; Hashemi-Sadraei et al., Sirolimus-associated diffuse alveolar hemorrhage in a renal transplant recipient on long-term anticoagulation, Clinical Nephrology (2007), 68(4), 238-244; Pedroso et al., Pulmonary alveolar proteinosis - a rare pulmonary toxicity of sirolimus, Transplant International (2007), 20(3), 291-296. Причина возникновения легочной токсичности, индуцированной рапамицином, пока неизвестна.
При применении сиролимуса в качестве противоракового терапевтического средства путем его непрерывного введения в кровоток в концентрациях, составляющих в пределах более, чем 1 нанограмм/мл, также наблюдались тяжелые респираторные побочные эффекты. Так, например, легочная токсичность после введения пролекарства сиролимуса, а именно, темсиролимуса, было зарегистрировано в 2009 году в отчете, где указано, что «интерстициальное заболевание легких представляет собой редкий побочный эффект, вызываемый введением темсиролимуса пациентам с раком почек». Aparicio et al., Clinical & Translational Oncology (2009), 11(8), 499-510; Vahid et al., Pulmonary complications of novel antineoplastic agents for solid tumors, Chest (2008) 133:528-538. Кроме того, мета-анализ, проведенный в 2012 году, показал, что у 10% раковых пациентов, которым вводили темсиролимус или эверолимус, могла наблюдаться слабая токсичность с ухудшением качества жизни, а в некоторых случаях, требовалось прерывание терапии. См. Iacovelli et al., Incidence and risk of pulmonary toxicity in patients treated with mTOR inhibitors for malignancy. A meta-analysis of published trials, Acta oncologica (2012), 51(7), 873-879. Кроме того, фармакологические исследования по оценке безопасности, проведенные на крысах, которым вводили темсиролимус (см. раздел, посвященный фармакологическим/токсическим свойствам (Pharm/Tox) темсиролимуса NDA), указывали на снижение скорости потока воздуха при дыханни, а также на снижение альвеолярной инфильтрации макрофагов и воспаления легких (см. Фармакологический Реестр для темсиролимуса NDA 22088, имеющийся на web-сайте FDA US). Эти побочные эффекты наблюдались в условиях системного введения в кровоток относительно высоких концентраций лекарственного средства.
В заявке на патент США, Lehrer, опубликованной в 2013 году, указано, что «рапамицин (сиролимус) не может быть безопасно введен путем ингаляции, поскольку его хорошо задокументированное токсическое действие на легкие вызывает интерстициальный пневмонит». См. патентную заявку США 20130004436, цитируемую Chhajed et al. (2006) 73:367-374. В патентной заявке Lehrer описаны композиции и способы, применяемые для лечения и предупреждения рака легких и лимфангиолейомиоматоза. Хотя в некоторых более ранних публикациях, таких как патент США No. 5080899, Sturm et al. (выданный в феврале 1991) и патент США No. 5635161 (выданный в июне 1995), имеются некоторые общие описания рапамицина, вводимого путем ингаляции, однако, такие общие описания не были подтверждены какими-либо доказательствами, поскольку впоследствии поступало множество сообщений о наличии индуцированной рапамицином легочной токсичности, которая наблюдалась после широкого применения препарата в качестве иммунодепрессанта при трансплантации и в качестве ингибитора пролиферации клеток при проведении противораковой терапии, на что указывают данные, обсуждаемые выше.
В WO 2011/163600 описан аэрозольный препарат такролимуса, который, подобно рапамицину, представляет собой лактон макролид. Однако, такролимус, по своей химической структуре, отличается от сиролимуса, а молекулярной мишенью такролимуса является кальцинейрин, а не mTOR, но в отличие от рапамицина, такролимус не вызывает легочной токсичности, а поэтому он может быть использован для предупреждения отторжения трансплантата после трансплантации легких.
Принимая во внимание широко распространенное мнение о возможной рапамицин-индуцированной легочной токсичности, следует отметить, что фармацевтическая композиция, содержащая рапамицин для доставки в легкие, уже не рассматривается как ценное терапевтическое средство для лечения человека.
Доставка лекарственных средств в легкие посредством ингаляции является важным фактором, позволяющим использовать эти средства для лечения ряда состояний, включая такие широко распространенные локальные состояния, как кистозный фиброз, пневмония, бронхиальная астма и хроническая обструктивная болезнь легких; некоторые системные состояния, включая состояния, требующие гормонзаместительной терапии и купирования боли, иммунодефицит, эритропоэз, диабет, рак легких и т.п. В общих чертах, см. Yi et al. J. Aerosol Med. Pulm. Drug Deliv. 23:181-7 (2010). Средствами, показанными для лечения рака легких путем ингаляции, являются цисплатин, карбоплатин, таксаны и антрациклины. См., например, патенты США NN. 6419900; 6419901; 6451784; 6793912 и публикации заявок на патент США NN 2003/0059375 и 2004/0039047. Кроме того, было высказано предположение, что доксорубицин и темозоломид, вводимые путем ингаляции, могут быть использованы для лечения метастазов в легкие. См., например, патент США No. 7288243 и публикацию заявки на патент США No. US 2008/0008662.
В US 20100260733 («в заявке ʹ733») описаны пути передачи сигнала киназы TOR (мишени для рапамицина) как комплекс различных клеточных сигналов, передаваемых такими агентами, как питательные вещества, митогенные факторы роста и энергетические агенты, а также сигналов, ассоциированных со стрессом и регулирующих катаболические и анаболические процессы в клетке. Путь передачи сигнала TOR также описан как путь, который может играть важную роль в увеличении продолжительности жизни, обеспечиваемом ограничением калорийности почкующихся дрожжей, Ceanorhabditis elegans и Drosophila. Митохондриальная функция описана как функция, играющая важную роль в замедлении старения, индуцированного теломерной дисфункцией и снижением калорий, что способствует предотвращению прогрессирования старения посредством пути передачи TOR/AMPK/митохондриального сигнала. Сообщалось, что такой механизм является консервативным в дрожжах и у животных с моделью человеческой теломерной дисфункции. Заявка ʹ733 относится к методам идентификации агентов, стимулирующих митохондриальную функцию и, тем самым, способствующих предупреждению прогрессирования старения или лечению заболевания, ассоциированного с прогрессированием старения. Поскольку, в соответствии с описанием заявки ʹ733, многие возрастные заболевания ассоциируются с митохондриальной дисфункцией и/или теломерной дисфункцией, то агенты, идентифицированные этим методом, могут быть использованы для предупреждения возрастных заболеваний или расстройств. Следует отметить, что это противоречит современным общепринятым антивозрастным стратегиям, которые, в основном, направлены на ингибированияе процесса старения, поскольку главным фактором в этих стратегиях считается сам процесс старения, а не замедление процесса старения. В заявке ʹ733 описан ряд in vitro экспериментов, проводимых с использованием клеток различных типов, где указанные эксперименты продемонстрировали, например, что низкие дозы рапамицина ингибируют индуцированную мутагеном трансформацию человеческих фибробластов и снижают уровень активного кислорода, а также увеличивают продолжительность жизни культивированных нейронов. В заявке ʹ733 описаны только два исследования на животных, которые продемонстрировали, что низкие дозы рапамицина снижают тяжесть инфаркта у крыс с моделью инсульта или инфаркта миокарда.
В патенте США No. 8492110 («патенте ʹ110»), выданном на заявку ʹ733, заявлены методы предупреждения старения клеток посредством удлинения фазы G0 у индивидуума, нуждающегося в этом, где указанные методы включают введение низкой дозы (определенной как доза, которая не ингибирует трансляцию белка и рост клеток на фазе G1 клеточного цикла) ингибитора TOR.
В заявке на патент США No. 20130102569 («заявке ʹ569») описаны методы лечения или предупреждения возрастного заболевания, состояния или расстройства, где указанные методы включают введение пациенту, нуждающемуся в этом, терапевтически эффективного количества ингибитора TOR. В заявке ʹ569 описана роль ингибитора TOR, которая до некоторой степени отличается от роли ингибитора TOR, описанной в заявке ʹ733, а именно, в заявке ʹ569 приводятся данные, указывающие на то, что рапамицин ингибирует начало старения клеток in vitro, но он не действует в последующем процессе старения путем предупреждения его прогрессирования. В заявке ʹ569 не представлено каких-либо данных, полученных в экспериментах на животных и подтверждающих, что описанные методы могут быть применены лечения или предупреждения возрастного заболевания, состояния или расстройства.
Таким образом, необходимо разработать фармацевтические препараты на основе рапамицина, его пролекарств, производных и аналогов, которые могли бы быть безопасно доставлены в легкие, предпочтительно, путем ингаляции, для того, чтобы получить более эффективную лекарственную форму для лечения и профилактики заболеваний и расстройств, вызываемых посредством пути передачи сигнала TOR, где такая лекарственная форма позволяет снизить или устранить токсичность и побочные эффекты, ассоциированные с введением пероральных лекарственных форм рапамицина.
Краткое описание чертежей
Фиг. 1: ЖХ-МС/МС-хроматограмма для 10,6 нг/мл рапамицина (вверху) и внутреннего стандарта (внизу) в мышиной крови.
Фиг. 2: Репрезентативные хроматограммы для 10,6 нг/мл рапамицина (вверху) и внутреннего стандарта (внизу) в гомогенате мышиных легких.
Фиг. 3: Калибровочная кривая для рапамицина в мышиной крови.
Фиг. 4: Калибровочная кривая для рапамицина в гомогенате мышиных легких.
Фиг. 5: Репрезентативные хроматограммы для рапамицина (вверху) и внутреннего стандарта (внизу) в крови мышей 2-07, которым был введен рапамицин путем ОФА.
Фиг. 6: Репрезентативные хроматограммы для рапамицина (вверху) и внутреннего стандарта (внизу) в гомогенате легких мышей 2-07, которым был введен рапамицин путем ОФА.
Фиг. 7: Рапамицин ингибирует жизнеспособность TSC2-мутантных клеток (внизу) и фосфорилирование S6 (вверху).
Фиг. 8A и B: Фосфорилирование S6 в мышиных легких после (A) ОФА и перорального введения рапамицина и (B) введения путем ингаляции.
Фиг. 9: Предсказанные концентрации рапамицина в крови, вводимого в легкие один раз в день.
Сущность изобретения
Настоящее изобретение частично основано на разработке безопасного и эффективного аэрозольного препарата, включающего рапамициновую композицию и способного доставлять эту рапамициновую композицию в ткани-мишени в количестве, достаточном для обеспечения в этих тканях-мишенях сильной биологической активности с минимальной токсичностью, ассоциированной с введением рапамицина. Кроме того, настоящее изобретение основано на неожиданном открытии фармакокинетических свойств рапамициновой композиции, приготовленной как описано в настоящей заявке. Как более подробно описано ниже, рапамициновая композиция, доставляемая непосредственно в легкие, обеспечивает значительно более высокие концентрации лекарственного средства в ткани легких. Количество лекарственного средства в ткани легких неожиданно оказалось выше, чем это было предсказано в ранее проведенных исследованиях по пероральному и внутривенному введению. Неожиданным также явился тот факт, что даже относительно высокие количества рапамицина, доставляемого непосредственно в легкие, не вызывают токсичности в ткани легких. Кроме того, было продемонстрировано, что количество лекарственного средства в ткани легких, достигаемое описанными здесь способами, является эффективным для сообщения сильной биологической активности, включая ингибирование роста и жизнеспособность клеток, а также ингибирование фосфорилирования S6 в ткани-мишени. Эти биологические активности показали, что доза рапамициновой композиции, доставляемая в соответствии с заявленными здесь способами, является достаточной для ингибирования передачи mTOR-сигнала в тканях-мишенях. Таким образом, полученные результаты показали, что описанные здесь аэрозольные препараты способны обеспечивать доставку низкой, но, при этом, терапевтически эффективной дозы рапамицина, и тем самым обеспечивать высокую эффективность при введении очень низкой системной дозы лекарственного средства. В результате этого был достигнут значительно более высокий терапевтический индекс рапамицина при его введении в соответствии с настоящим изобретением.
Настоящее изобретение относится к фармацевтическим аэрозольным препаратам на основе рапамициновой композиции, доставляемым непосредственно в легкие. В этом контексте, термин «аэрозольный препарат» может означать водную композицию, сухую порошковую композицию или композицию на основе пропеллента, как более подробно описано ниже. Аэрозольный препарат согласно изобретению может быть введен индивидууму различными способами, например, интраназально или перорально, например, путем ингаляции. Используемый здесь термин «рапамициновая композиция» может означать сам рапамицин, предпочтительно, в аморфной форме, называемой сиролимусом, или его пролекарство или производное. В одном из вариантов осуществления изобретения, рапамициновая композиция согласно изобретению содержит рапамицин в количестве, эффективном для ингибирования передачи mTOR-сигнала в ткани-мишени, но, при этом обладает низкой токсичностью или вообще не обладает токсичностью, и кроме того, уровни рапамицина в крови составляют приблизительно менее, чем 1 нг/мл.
В одном из вариантов осуществления изобретения, рапамициновая композиция согласно изобретению имеет улучшенный профиль безопасности, на что указывает более высокий терапевтический индекс, в частности, при длительном или пролонгированном введении по сравнению с профилем безопасности других лекарственных форм рапамицина, например, лекарственных форм, вводимых перорально или внутривенно.
В одном из своих вариантов, настоящее изобретение относится к композициям и способам, применяемым для лечения и профилактики возрастного заболевания или расстройства путем введения один раз в день человеку, нуждающемуся в этом, фармацевтического аэрозольного препарата, содержащего рапамициновую композицию в количестве, эффективном для достижения максимального уровня рапамициновой композиции в крови приблизительно от 0,25 до 0,75 нг/мл, и минимального уровня в крови приблизительно от 0,075 до 0,25 нг/мл. В одном из вариантов осуществления изобретения, максимальный уровень рапамицина в крови составляет приблизительно 0,5 нг/мл, минимальный уровень рапамицина в крови составляет приблизительно 0,1 нг/мл, а количество рапамициновой композиции в препарате, вводимом один раз в день, составляет приблизительно от 25 до 100 микрограммов или приблизительно 50 микрограммов.
В соответствии с настоящим изобретением могут быть приготовлены аэрозольные препараты, содержащие лишь одну рапамициновую композицию, либо ее комбинацию с одним или более дополнительными терапевтическими средствами в одной и той же лекарственной форме. Кроме того, аэрозольные препараты согласно изобретению могут быть введены отдельно или в комбинации с одним или более дополнительными терапевтическими средствами, каждое из которых может быть введено одним и тем же способом или различными способами, например, перорально, внутривенно и т.п. В одном из вариантов осуществления изобретения, аэрозольные препараты согласно изобретению могут быть введены в комбинации с одним или более курсами лечения возрастного заболевания или расстройства.
В одном из своих вариантов, настоящее изобретение относится к фармацевтическому аэрозольному препарату, содержащему рапамициновую композицию в количестве, эффективном для достижения нужного терапевтического уровня этой композиции в ткани-мишени. В одном из вариантов осуществления изобретения, ткань выбрана из группы, состоящей из ткани легких, сердца, почек, головного мозга, печени и глаза. В одном из вариантов осуществления изобретения, терапевтический уровень определяют через 12 или 24 часа после доставки, а предпочтительно, через 24 часа после доставки. В одном из вариантов осуществления изобретения, терапевтический уровень поддерживается по меньшей мере в течение 24 часов после доставки.
В одном из вариантов осуществления изобретения, тканью-мишенью являются легкие. В одном из вариантов осуществления изобретения, отношение концентрации композиции в легких к концентрации композиции в крови через 24 часа после доставки составляет по меньшей мере 100, по меньшей мере 250 или по меньшей мере 500. В одном из вариантов осуществления изобретения, отношение концентрации композиции в легких к концентрации композиции в крови через 24 часа после доставки составляет приблизительно 100-250, 250-500, 500-750 или 750-1000. В одном из вариантов осуществления изобретения, отношение концентрации композиции в легких к концентрации композиции в крови через 24 часа после доставки составляет по меньшей мере 5, по меньшей мере 10, по меньшей мере 20, по меньшей мере 30, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 80 или по меньшей мере 100.
В одном из вариантов осуществления изобретения, количество рапамициновой композиции в аэрозольном препарате составляет 5-500 микрограммов, 10-250 микрограммов, 15-150 микрограммов или 20-100 микрограммов. В одном из вариантов осуществления изобретения, количество рапамициновой композиции в аэрозольном препарате составляет 20, 40, 50, 100, 125 или 250 микрограммов.
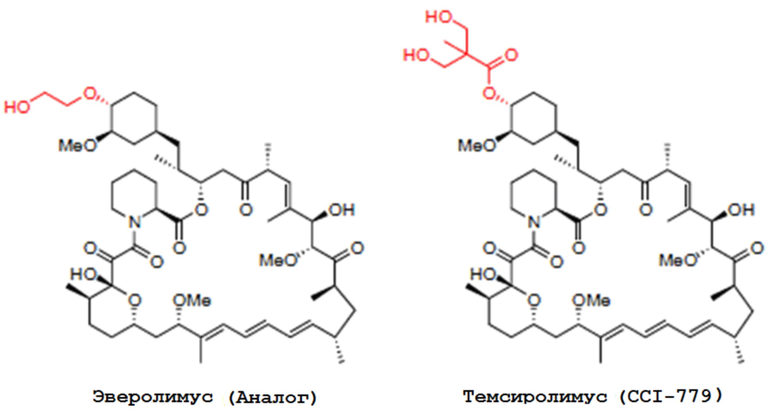
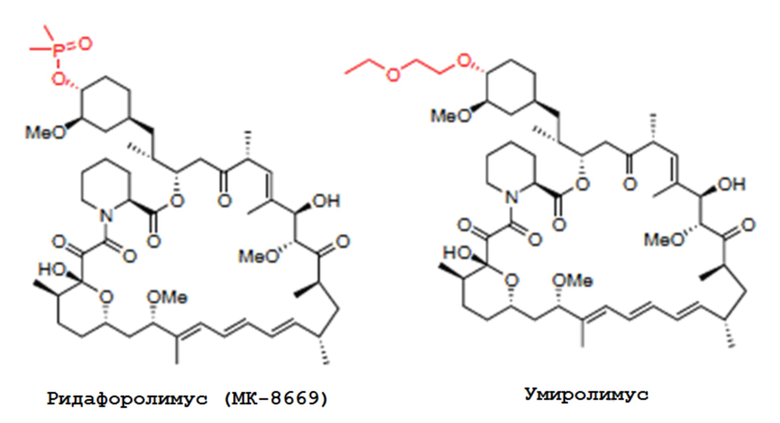
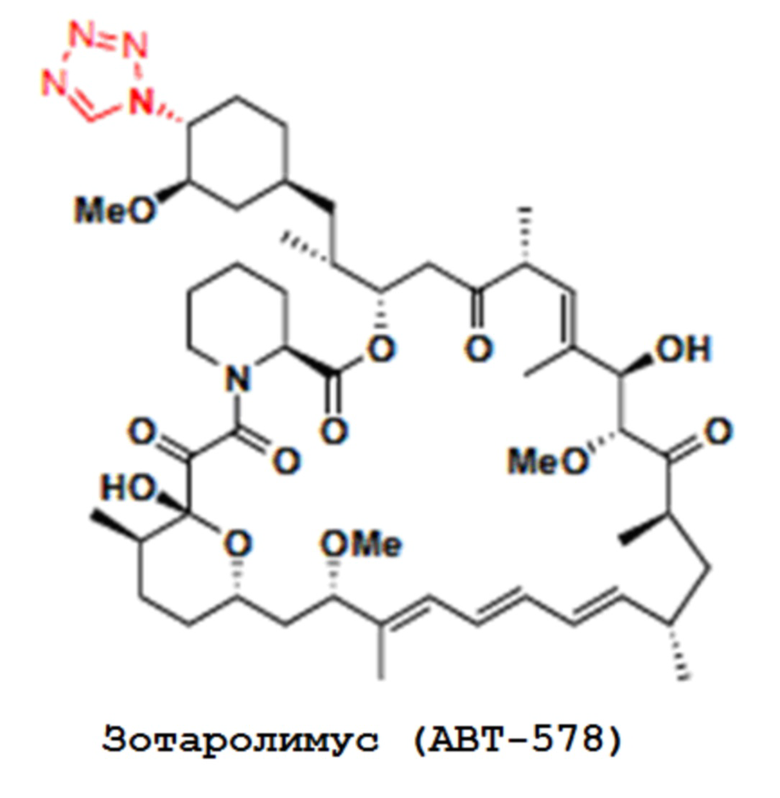
В одном из вариантов осуществления изобретения, рапамициновой композицией является сиролимус. В одном из вариантов осуществления изобретения, рапамициновая композиция выбрана из группы, состоящей из эверолимуса, темсиролимуса, ридафоролимуса, умиролимуса и зотаролимуса.
В одном из вариантов осуществления изобретения, рапамициновая композиция представляет собой сиролимус и имеет отношение изомеров B:C более, чем 30:1 или более, чем 35:1. В одном из вариантов осуществления изобретения, рапамициновая композиция имеет отношение изомеров B:C, составляющее 3,5%-10%.
В одном из вариантов осуществления изобретения, возрастное заболевание или расстройство выбрано из рака, гипертрофии предстательной железы, сердечно-сосудистых заболеваний, инсульта, атеросклероза, гипертензии, остеопороза, инсулинорезистентности и диабета типа II, болезни Альцгеймера, болезни Паркинсона, возрастной дегенерации желтого пятна, хронической сердечной недостаточности, печеночной недостаточности, хронического заболевания почек, почечной недостаточности и хронического заболевания легких. В одном из вариантов осуществления изобретения, возрастным заболеванием является рак.
В одном из вариантов осуществления изобретения, способом антивозрастной терапии является терапия, эффективная для предупреждения старения одного или более органов, выбранных из группы, состоящей из легких, сердца, почек, головного мозга, печени и глаз. В одном из вариантов осуществления изобретения, индивидуумом является пожилой человек, где способ лечения включает введение композиции в течение определенного периода времени, а эффективность такого способа определяют по улучшению сжимательной способности руки или по способности к передвижению после введения указанной композиции в течение определенного периода времени. В одном из вариантов осуществления изобретения, композицию вводят один или два раза в день в течение периода времени, выбранного из периодов времени от 1 до 3 недель, менее, чем одного месяца, от 1 до 2 месяцев, от 2 до 3 месяцев или от 3 дл 4 месяцев.
В одном из вариантов осуществления изобретения, в стадии введения композиции индивидууму продуцируются частицы, содержащие рапамицин и имеющие среднечисленный диаметр в пределах от 0,1 до 10 микрон. В одном из вариантов осуществления изобретения, в стадии введения композиции индивидууму продуцируются частицы, содержащие рапамицин и имеющие среднечисленный диаметр в пределах от 0,5 до 6 микрон.
В одном из вариантов осуществления изобретения, указанный способ также включает проведение одной или более дополнительных терапий или терапевтических курсов лечения.
В одном из вариантов осуществления изобретения, аэрозольный препарат согласно изобретению адаптирован для его введения один раз в день, и в соответствии с описанными здесь способами, такой аэрозольный препарат вводят один раз в день.
В одном из вариантов осуществления изобретения, аэрозольный препарат представляет собой сухую порошковую композицию, подходящую для ее доставки путем ингаляции. В одном из вариантов осуществления изобретения, сухой порошок включает рапамициновую композицию в форме микрочастиц (то есть, рапамицин в форме микрочастиц), частицы носителя и один или более необязательных наполнителей. В одном из вариантов осуществления изобретения, микрочастицы состоят из частиц лекарственного средства, имеющих средний диаметр приблизительно от 0,1 до 10 микрон или приблизительно от 1 до 5 микрон. В одном из вариантов осуществления изобретения, частицы имеют средний диаметр приблизительно от 1,5 до 4 микрон, приблизительно от 1,5 до 3,5 микрон или приблизительно от 2 до 3 микрон. Носитель может быть выбран из группы, состоящей из арабинозы, глюкозы, фруктозы, рибозы, маннозы, сахарозы, трегалозы, лактозы, мальтозы, крахмала, декстрана, маннита, лизина, лейцина, изолейцина, дипальмитилфосфатидилхолина, лецитина, полимолочной кислоты, сополимера молочной и глутаминовой кислоты, ксилита и смесей любых вышеупомянутых соединений. В одном из вариантов осуществления изобретения, носитель включает смесь двух различных носителей или состоит из этой смеси. Частицы носителя могут иметь диаметр в пределах до 200 микрон, от 30 до 100 микрон или менее, чем 10 микрон. Если носитель состоит из смеси двух различных носителей, то каждый носитель состоит из частиц различных размеров, измеренных как средний диаметр частиц. В одном из вариантов осуществления изобретения, носитель состоит из смеси двух различных носителей, а именно, первого носителя и второго носителя. Первый носитель состоит из частиц, имеющих диаметр в пределах приблизительно 30-100 микрон, а второй носитель состоит из частиц, имеющих диаметр менее, чем 10 микрон. Два различных носителя присутствуют в отношении в пределах от 3:97 до 97:3. В одном из вариантов осуществления изобретения, два различных носителя присутствуют в отношении в пределах 97:3 или 95-98:2-5. В одном из вариантов осуществления изобретения, носитель состоит из смеси двух различных лактозных носителей. Отношение лекарственного средства к носителю в порошке может составлять от 0,5% до 2% (по массе). В одном из вариантов осуществления изобретения, отношение лекарственного средства к носителю в порошке составляет 1% (по массе).
Количество рапамициновой композиции в аэрозольном препарате составляет приблизительно от 0,1 масс.% до 20 масс.% по общей массе композиции. В одном из вариантов осуществления изобретения, количество этой композиции составляет приблизительно от 0,25 масс.% до 2 масс.%.
В одном из вариантов осуществления изобретения, в композиции присутствуют один или более необязательных наполнителей, выбранных из фосфолипида, соли металла и жирной кислоты и их смесей. В одном из вариантов осуществления изобретения, фосфолипид выбран из дипальмитилфосфатидилхолина и лецитина. В одном из вариантов осуществления изобретения, солью металла и жирной кислоты является стеарат магния. В одном из вариантов осуществления изобретения, наполитель или наполнители наносят на частицы носителя в массовом отношении наполнителя к крупной частице носителя, составляющем от 0,01 до 0,5%.
В одном из вариантов осуществления изобретения, количеством рапамициновой композиции в аэрозольном препарате является количество, эффективное для ингибирования биологической активности mTORC1. В одном из вариантов осуществления изобретения, таким количеством является количество, эффективное для ингибирования фосфорилирования белка S6K.
В одном из вариантов осуществления изобретения, количеством рапамициновой композиции в аэрозольном препарате является количество, эффективное для достижения вдыхаемой дозы 5-500 микрограммов, доставляемых в легкие. В одном из вариантов осуществления изобретения, вдыхаемая доза составляет приблизительно 5, приблизительно 20, приблизительно 50, приблизительно 100 или приблизительно 250 микрограммов. В одном из вариантов осуществления изобретения, вдыхаемая доза составляет приблизительно 20 микрограммов, приблизительно 50 микрограммов или приблизительно 100 микрограммов. В одном из вариантов осуществления изобретения, таким количеством является количество, эффективное для обеспечения концентрации рапамициновой композиции в ткани легких в пределах от 1 нг/г до 1 микрограммов (мкг)/г. В одном из вариантов осуществления изобретения, концентрация рапамициновой композиции в ткани легких составляет приблизительно от 5 до 30 нг/г. В одном из вариантов осуществления изобретения, концентрация рапамициновой композиции в ткани легких составляет приблизительно 5 нг/г, приблизительно 10 нг/г, приблизительно 15 нг/г, приблизительно 20 нг/г, приблизительно 25 нг/г, приблизительно 30 нг/г, приблизительно 50 нг/г, приблизительно 60 нг/г, приблизительно 100 нг/г или приблизительно 200 нг/г. В соответствии с вышеуказанными вариантами осуществления изобретения, при этом минимальный уровень рапамициновой композиции в крови составляет менее, чем 5 нг/мл, менее, чем 2 нг/мл, менее, чем 1 нг/мл, менее, чем 0,5 нг/мл или менее, чем 0,25 нг/мл. В одном из вариантов осуществления изобретения, минимальный уровень в крови составляет менее, чем 1 нг/мл, менее, чем 0,5 нг/мл или менее, чем 0,25 нг/мл.
В одном из вариантов осуществления изобретения, рапамициновая композиция присутствует в легких на терапевтических уровнях приблизительно 1 нг/г, приблизительно 5 нг/г, приблизительно 10 нг/г, приблизительно 15 нг/г, приблизительно 20 нг/г, приблизительно 25 нг/г, приблизительно 50 нг/г или приблизительно 100 нг/г в течение определенного периода времени после введения композиции, предпочтительно, человеку, где указанный период времени выбран из периодов времени приблизительно 6-10 часов, приблизительно 6-14 часов, приблизительно 6-24 часов и приблизительно 6-72 часов. В одном из вариантов осуществления изобретения, указанный период времени выбран из периодов времени приблизительно 12 часов, приблизительно 14 часов, приблизительно 24 часа и приблизительно 72 часа.
В одном из вариантов осуществления изобретения, рапамициновая композиция присутствует в легких на терапевтических уровнях приблизительно 5-100 нг/г или приблизительно 5-30 нг/г в течение периода времени, составляющегог приблизительно 12 или 24 часа. В одном из вариантов осуществления изобретения, рапамициновая композиция присутствует в легких на терапевтических уровнях приблизительно 5 нг/г, приблизительно 10 нг/г, приблизительно 20 нг/г, приблизительно 30 нг/г, приблизительно 50 нг/г, приблизительно 60 нг/г, приблизительно 70 нг/г, приблизительно 80 нг/г, или приблизительно 90 нг/г. В одном из вариантов осуществления изобретения, рапамициновая композиция присутствует в легких на терапевтических уровнях по меньшей мере 5 нг/г, по меньшей мере 20 нг/г или по меньшей мере 30 нг/г. В одном из вариантов осуществления изобретения, рапамициновая композиция присутствует в легких на терапевтических уровнях приблизительно от 20 нг/г до приблизительно 30 нг/г или приблизительно от 50 нг/г до приблизительно 80 нг/г.
В одном из вариантов осуществления изобретения, препарат содержит более, чем 20% фракцию тонкодисперсных частиц (FPF), где соответствующая доза тонкодисперсных частиц (FPD) составляет от 5 микрограммов до 2 миллиграммов, а предпочтительно, менее, чем 0,5 миллиграмма, после хранения в течение 1-12 месяцев или 1-36 месяцев. В одном из вариантов осуществления изобретения, вдыхаемая доза, доставляемая в легкие, также называется доставляемой дозой (DD) или испускаемой дозой (ED), и составляет в пределах от 10 миллиграммов до 2,5 миллиграмма, предпочтительно, менее, чем 0,5 миллиграмма. В одном из вариантов осуществления изобретения, доставляемая доза составляет приблизительно от 20 до 100 микрограммов, приблизительно от 10 до 25 микрограммов или приблизительно от 30 до 60 микрограммов. В одном из вариантов осуществления изобретения, доставляемая доза составляет 20 или 50 микрограммов. В одном из вариантов осуществления изобретения, доставляемая доза составляет 100 микрограммов.
В одном из вариантов осуществления изобретения, вдыхаемая доза рапамициновой композиции составляет приблизительно 20 микрограммов; концентрация лекарственного средства в ткани легких составляет приблизительно от 5 до 25 нг/г; Cmax в крови составляет менее, чем 1,0 нг/мл, или приблизительно от 0,50 нг/мл до 1,0 нг/мл, или приблизительно от 0,50 нг/мл до 0,90 нг/мл; минимальная концентрация лекарственного средства в крови через 24 часа после введения дозы составляет приблизительно менее, чем 0,20 нг/мл, а постоянная концентрация лекарственного средства в крови через 14 дней после введения дозы составляет приблизительно менее, чем 0,90 нг/мл, или приблизительно менее, чем 0,80 нг/мл.
В одном из вариантов осуществления изобретения, вдыхаемая доза рапамициновой композиции составляет приблизительно 50 микрограммов; концентрация лекарственного средства в ткани легких составляет приблизительно от 2 до 15 нг/г; Cmax в крови составляет менее, чем 2,0 нг/мл, или приблизительно от 0,25 нг/мл до 0,1 нг/мл, или приблизительно от 0,10 нг/мл до 0,5 нг/мл; минимальная концентрация лекарственного средства в крови через 24 часа после введения разовой дозы составляет приблизительно менее, чем 0,10 нг/мл, а минимальная концентрация лекарственного средства в крови через 5 дней после повторного ежедневного введения дозы один раз в день составляет приблизительно менее, чем 1,0 нг/мл, или приблизительно менее, чем 0,50 нг/мл. В одном из вариантов осуществления изобретения, препарат адаптирован для его введения один раз в день.
В одном из вариантов осуществления изобретения, препарат также включает одно или более дополнительных терапевтических средств.
Настоящее изобретение также относится к применению композиции согласно изобретению для лечения и профилактики возрастных заболеваний и расстройств у человека, нуждающегося в таком лечении. В одном из своих вариантов, настоящее изобретение относится к способу лечения и профилактики возрастных заболеваний и расстройств у человека, нуждающегося в таком лечении или профилактике, где указанный способ включает введение индивидууму описанной здесь композиции или единичной лекарственной формы путем ингаляции.
Настоящее изобретение также относится к единичной лекарственной форме, включающей аэрозольный препарат, содержащий описанную здесь рапамициновую композицию, где количество рапамициновой композиции составляет приблизительно от 5 до 2500 микрограммов, от 20 до 500 микрограммов или от 50 до 250 микрограммов. В одном из вариантов осуществления изобретения, количество рапамициновой композиции составляет приблизительно от 50 до 125 микрограммов. В одном из вариантов осуществления изобретения, количество рапамициновой композиции составляет приблизительно 40, приблизительно 50, приблизительно 100, приблизительно 125 или приблизительно 250 микрограммов. В одном из вариантов осуществления изобретения, количество рапамициновой композиции составляет приблизительно 250 микрограммов.
В одном из вариантов осуществления изобретения, единичной лекарственной формой является капсула, подходящая для ее использования в устройстве для ингаляции сухих порошков. В одном из вариантов осуществления изобретения, такая капсула содержит от 1 мг до 100 мг порошка (общее количество, включающее рапамициновую композицию, носитель и любой и любые необязательные наполнители) или от 10 мг до 40 мг порошка. Такой капсулой может быть желатиновая, пластиковая или целлюлозная капсула, либо такая капсула может быть приготавлена в виде блистерной упаковки «фольга/фольга» или «фольга/пластик», подходящей для ее использования в устройстве DPI.
Настоящее изобретение также относится к фармацевтической упаковке или к фармацевтическому набору, содержащим описанную здесь композицию или единичную лекарственную форму, и инструкции по их применению.
В одном из вариантов осуществления изобретения, препарат получают методом мокрого формования, включающим стадии приготавления водной суспензии лекарственного средства, микрофлюидизации этой суспензии лекарственного средства и сушки полученных частиц распылением с получением сухого порошка.
В одном из вариантов осуществления изобретения, рапамициновой композицией является сиролимус; носитель состоит из смеси двух различных лактозных носителей, где первый носитель состоит из частиц, имеющих средний диаметр приблизительно 30-100 микрон, а второй носитель состоит из частиц, имеющих средний диаметр менее, чем 10 микрон; отношение двух различных носителей составляет приблизительно от 97:3 до 3:97; а количество рапамицина составляет от 25 до 1400 микрограммов.
Настоящее изобретение также относится к устройству для доставки сухих порошков, включающему резервуар, содержащий описанную здесь композицию или единичную лекарственную форму. Резурвуар может представлять собой камеру, встроенную в устройство, капсулу или блистерную упаковку. В одном из вариантов осуществления изобретения, устройство выбрано из Plastiape® RS01 Model 7, Plastiape® RS00 Model 8, XCaps®, Handihaler®, Flowcaps® TwinCaps® и Aerolizer®. В одном из вариантов осуществления изобретения, устройство выбрано из Plastiape® RS01 Model 7 или Plastiape® RS00 Model 8. В одном из вариантов осуществления изобретения, таким устройством является Plastiape® RS00 Model 8.
Подробное описание изобретения
Настоящее изобретение относится к способам и композициям, применяемым для лечения и профилактики возрастных заболеваний и расстройств у человека, нуждающегося в таком лечении. В одном из вариантов осуществления изобретения, такие способы включают введение индивидууму композиции для ингаляции, содержащей рапамицин в подходящем носителе и, необязательно, одну или более добавок. Термин «рапамицин», используемый в описании настоящего изобретения, означает сам рапамицин (также называемый «сиролимусом»), а также его пролекарства (такие как темсиролимус) и производные. Производные рапамицина включают соединения, которые по своей структуре аналогичны рапамицину, принадлежат к одному и тому же химическому классу, являются аналогами рапамицина или представляют собой фармацевтически приемлемые соли рапамицина или его производных. Подробное описание и примеры рапамицина, его пролекарств и производных приводится в нижеследующем разделе.
Описанные здесь композиции называются «аэрозольными препаратами», и этот термин определяют здесь как распыляемые композиции, подходящие для продуцирования вдыхаемых частиц или капелек, содержащих рапамициновую композицию, которая описана выше как собственно сам рапамицин, предпочтительно, в аморфной форме, называемой сиролимусом, или его пролекарство или производное. В одном из вариантов осуществления изобретения, рапамициновая композиция выбрана из сиролимуса, эверолимуса и темсиролимуса. В одном из вариантов осуществления изобретения, рапамициновой композицией является сиролимус. Описанные здесь аэрозольные препараты могут содержать рапамициновую композицию, носитель и, необязательно одну или более добавок. Аэрозольные препараты могут быть приготовлены в форме водного раствора, сухого порошка или смеси одного или более фармацевтически приемлемых пропеллентов и носителя, как более подробно описано ниже в разделе, озаглавленном «Композиции для ингаляции».
Настоящее изобретение также относится к способам лечения и профилактики возрастных заболеваний и расстройств у человека, нуждающегося в таком лечении, где указанные способы включают стадию введения в легкие индивидуума аэрозольного препарата согласно изобретению. В одном из вариантов осуществления изобретения, вводимая доза рапамициновой композиции является достаточной для достижения терапевтических уровней рапамицина в ткани легких с сохранением низкого уровня или минимального уровня рапамицина в крови у индивидуума. Так, например, терапевтические уровни рапамициновой композиции могут составлять 1 нг/г, приблизительно 5 нг/г, приблизительно 10 нг/г, приблизительно 15 нг/г, приблизительно 20 нг/г, приблизительно 25 нг/г, приблизительно 50 нг/г, а минимальные уровни этой композиции в крови составляют от 0,01 до 0,15 нг/мл, от 0,075 до 0,350 нг/мл, от 0,150 до 0,750 нг/мл, от 0,750 до 1,5 нг/мл, или от 1,5 до 5 нг/мл. В одном из вариантов осуществления изобретения, вводимая доза является достаточной для достижения терапевтических уровней лекарственного средства в легких приблизительно от 5 нг/г до 50 нг/г, или приблизительно от 5 нг/г до 20 нг/г, где минимальный уровень лекарственного средства в крови составляет менее, чем 5 нг/мл, менее, чем 2 нг/мл, менее, чем 1 нг/мл, или менее, чем 0,5 нг/мл. В одном из вариантов осуществления изобретения, отношение концентрации рапамициновой композиции в легких и в крови через 24 часа после доставки составляет по меньшей мере 100, по меньшей мере 250, или по меньшей мере 500. В одном из вариантов осуществления изобретения, отношение концентрации рапамициновой композиции в легких и в крови через 24 часа после доставки составляет приблизительно от 100 до 250, от 250 до 500, от 500 до 750 или от 750 до 1000.
Предпочтительно, вышеупомянутые терапевтические уровни достигаются путем введение описанного здесь аэрозольного препарата один раз в день. В одном из вариантов осуществления изобретения, общая суточная доза рапамициновой композиции составляет в пределах от 5 до 100 микрограммов, от 20 до 250 микрограммов, от 50 до 500 микрограммов (от 0,05 до 0,5 миллиграммов), от 250 до 1000 микрограммов (от 0,25 до 1 миллиграммов) или от 500 до 2000 микрограммов (от 0,5 до 2 миллиграммов). В одном из вариантов осуществления изобретения, общая суточная доза составляет менее, чем 500 микрограммов, менее, чем 100 микрограммов, менее, чем 50 микрограммов, менее, чем 20 микрограммов или менее, чем 10 микрограммов. В одном из вариантов осуществления изобретения, общая суточная доза составляет менее, чем 500 микрограммов, менее, чем 250 микрограммов, менее, чем 100 микрограммов, менее, чем 50 микрограммов или менее, чем 10 микрограммов. В одном из вариантов осуществления изобретения, общая суточная доза, вводимая индивидууму, составляет менее, чем 0,5 мг или менее, чем 0,25 мг в день. Другие варианты пульмональной доставки и доз, включая комбинированную терапию, описаны ниже в разделе, озаглавленном «Пульмональное введение и дозы».
В одном из вариантов осуществления изобретения, способы согласно изобретению включают пульмональное введение рапамицина в комбинации с одним или более дополнительными агентами, выбранными из других агентов против старения и антиоксидантов. В одном из вариантов осуществления изобретения, один или более дополнительных агентов выбраны из группы, состоящей из витамина C, витамина E, бета-каротина и других каротиноидов, селена, липоевой кислоты, ликопена, лютеина, ксантина кукурузы, кофермента Q10, глутатиона, N-ацетилцистеина, мелатонина, генистеина, эстрадиола, чайного экстракта, экстракта из семян винограда, AICAR, EGCG, экстракта грейпфрута, черничного экстракта, селенита, генистеина, диаллилтрисульфида, бензилизотиоцианата, фенилизотиоцианата, фенетилизотиоцианата, ресвератрола, ликопена и аллилизотиоцианата. Один или более дополнительных агентов и рапамицин могут быть введены одним и тем же способом или различными способами. Так, например, агент может быть введен путем ингаляции, внутривенно, перорально или интраназально.
Способы и композиции согласно изобретению являются эффективными для проведения антивозрастной терапии и для лечения и профилактики возрастных заболеваний и расстройств у индивидуума, а предпочтительно, у человека. Используемый здесь термин «эффективное количество композиции согласно изобретению» означает количество, достаточное для снижения или замедления прогрессирования заболевания или расстройства или ослабления одного или более его симптомов, для снижения или ослабления тяжести такого заболевания или расстройства и/или снижения его продолжительности; для предупреждения прогрессирования заболевания или расстройства; для индуцирования обратного развития заболевания или расстройства; для предупреждения развития или начала развития одного или более симптомов, ассоциированных с таким заболеванием или расстройством; для усиления или улучшения профилактического(их) или терапевтического(их) эффекта(ов) другой терапии (например, профилактического или терапевтического средства) в целях ослабления тяжести или замедления начала развития одного или более симптомов заболевания или расстройства или в целях замедления развития или прогрессирования такого заболевания или расстройства. Таким образом, что касается способов согласно изобретению, то термины «лечить», «лечение» и «терапия» относятся к снижению тяжести, замедлению течения или прогрессирования заболевания или расстройства или одного или более симптомов, ассоциированных с этим заболеванием или расстройством.
В некоторых вариантах осуществления изобретения, способы включают пульмональное введение композиции согласно изобретению в качестве первичной терапии. В других вариантах осуществления изобретения, введение композиции согласно изобретению представляет собой адъювантную терапию. В любом случае, способы согласно изобретению включают введение композиции согласно изобретению в комбинации с одним или более дополнительными терапевтическими средствами для лечения заболевания или расстройства. Термины «терапия» и «терапии» означают любой метод, протокол и/или агент, которые могут быть применены для предупреждения, лечения, терапии или замедления прогрессирования заболевания или расстройства или одного или более его симптомов.
Одна дополнительная терапия или более могут быть проведены до введения композиции согласно изобретению (например, за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часов, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель), одновременно с введением этой композиции или после ее введения (например, через 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часов, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель).
В некоторых вариантах осуществления изобретения, дополнительное терапевтическое средство приготавливают для совместного введения с композицией согласно изобретению в лекарственной форме, подходящей для пульмонального введения. В других вариантах осуществления изобретения, дополнительное терапевтическое средство вводят отдельно от лекарственной формы, содержащей рапамицин, где способы введения этого дополнительного средства и рапамицина являются одинаковыми или различными. Способы согласно изобретению также включают комбинированное введение одного или более дополнительных терапевтических средств, осуществляемое до, во время или после введения лекарственной формы, содержащей рапамицин.
В некоторых вариантах осуществления изобретения, способы согласно изобретению являются эффективными для лечения заболевания или расстройства у индивидуума, страдающего таким заболеванием или расстройством. В этом контексте, термины «лечить», «лечение» и «терапия» означают достижение благоприятных эффектов, наблюдаемых у индивидуума после проведения терапии, которые не наблюдались после ранее проводимых курсов лечения. В одном из вариантов осуществления изобретения, считается, что индивидуум восприимчив к лечению заболевания или расстройства, если у него наблюдается замедление прогрессирования или приостановка развития заболевания или расстройства во время лечения рапамицином с применением способов согласно изобретению. В другом варианте осуществления изобретения, считается, что индивидуум восприимчив к лечению заболевания или расстройства, если у него наблюдается ослабление или стабилизация одного или более симптомов, ассоциированных с таким заболеванием или расстройством (то есть, если эти симптомы не обостряются при проведении данного курса лечения).
В одном из вариантов осуществления изобретения, лечение способами согласно изобретению назначают индивидуумам, которые являются «не-восприимчивыми» к современным методам терапии заболевания или расстройства или «не поддаются» лечению указанными методами. В этом контексте, термины «не-восприимчивый» к лечению и «не поддающийся» лечению означают, что у данного индивидуума ответ на проведенную терапию не является клинически адекватным для ослабления одного или более симптомов, ассоциированных с указанным заболеванием или расстройством. Используемые здесь термины «индивидуум» и «пациент» являются синонимами. Эти термины относятся к животному, а предпочтительно, к млекопитающему, включая млекопитающих, не являющихся приматами (например, коров, свиней, лошадей, кошек, собак, крыс и мышей), и приматов (например, шимпанзе, обезьян, таких как собакоподобные обезьяны, и человек), а более предпочтительно, человека. В предпочтительном варианте осуществления изобретения, индивидуумом является человек.
Термины «предупреждать», «предупреждение» и «профилактика» относятся к предупреждению рецидивов, развития, прогрессирования или начала развития одного или более симптомов заболевания или расстройства после введения одного или более соединений, идентифицированных в соответствии со способами согласно изобретению, или введения комбинации такого соединения вместе с известной терапией такого заболевания или расстройства.
Предпочтительно, введение композиции способами согласно изобретению в комбинации с проведением одного или более дополнительных курсов лечения будет приводить к вырабатыванию синергического ответа у индивидуума, страдающего таким заболеванием или расстройством. В этом контексте, термин «синергический» означает, что эффективность комбинации превышает аддидитвные эффекты, наблюдаемые при проведенни любого одного из этих курсов лечения. В одном из вариантов осуществления изобретения, синергический эффект комбинированной терапии рапамицином согласно изобретению позволяет использовать более низкие дозы по меньшей мере одного терапевтического средства в данной комбинации и/или вводить их реже, чем дозы отдельно взятого терапевтического средства. В другом варианте осуществления изобретения, синергический эффект проявляется полным отсутствием или снижением побочных или нежелательных эффектов, ассоциированных с применением любой отдельно проводимой терапии, включенной в данную комбинированную терапию.
В контексте описания фармацевтических композиций согласно изобретению, термин «носитель» означает, например, жидкое или твердое вещество, такое как растворитель, разбавитель, стабилизатор, адъювант, наполнитель, вспомогательный агент, пропеллент или носитель, входящие в состав рапамицинового препарата для доставки. Примерами фармацевтически приемлемых носителей, используемых в композициях согласно изобретению, являются, но не ограничиваются ими, носители в виде сухих порошков, такие как лактоза, манноза, аминокислоты, циклодекстрин, дипальмитилфосфатидилхолин, пропелленты на основе углеводородов и фтористых углеводородов, сжиженные газы, стерильные жидкости, вода, забуференный физиологический раствор, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.), масла, детергенты, суспендирующие агенты, углеводы (например, глюкоза, лактоза, сахароза или декстран), антиоксиданты (например, аскорбиновая кислота или глутатион), хелатообразующие агенты, низкомолекулярные белки или их подходящие смеси. Предпочтительно, при использовании аэрозольных препаратов в виде сухих порошков, содержащих рапамицин, носитель, если он присутствует, выбран из группы, состоящей из сахарида и спирта ряда сахаров. В одном из вариантов осуществления изобретения, носителем, если он присутствует, является лактоза.
Термин «фармацевтически приемлемый» относится к лекарственному средству, одобренному Регуляторными органами Федерального правительства или штата и имеющемуся в списке Фармакопеи США или в другой общеизвестной Фармакопее, такой как Европейская Фармакопея, и этот термин означает, что данное средство может быть использовано для лечения животных, а более конкретно, человека. Одним из способов солюбилизации плохо растворимых или не растворимых в воде лекарственных средств является получение соли лекарственного средства или получение пролекарства, которое является более растворимым или может быть использовано для образования водорастворимой соли пролекарства. Методы получения солей и фармацевтически приемлемых солевых форм известны специалистам, и такими солями являются, но не ограничиваются ими, соли кислотных или основных групп, которые могут присутствовать в представляющем интерес лекарственном средстве или пролекарстве. Соединения, который являются основными по своей природе, обладают способностью образовывать широкий ряд солей различных неорганических и органических кислот. Кислотами, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений, являются кислоты, образующие нетоксичные кислотно-аддитивные соли, то есть, соли, содержащие фармакологически приемлемые анионы, включая, но не ограничиваются ими, соли серной кислоты, лимонной кислоты, малеиновой кислоты, уксусной кислоты, щавелевой кислоты, гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (то есть, 1,1ʹ-метилен-бис-(2-гидрокси-3-нафтоат)). Соединения, которые являются кислотными по своей природе, способны образовывать соли оснований с различными фармакологически приемлемыми катионами. Примерами таких солей являются соли щелочных или щелочноземельных металлов, а в частности, соли кальция, магния, натрия, лития, цинка, калия и железа.
В одном из вариантов осуществления изобретения, в способах и композициях согласно изобретению используется водорастворимое пролекарство или производное рапамицина, а предпочтительно, темсиролимуса или родственного соединения. В одном из вариантов осуществления изобретения, в способах и композициях согласно изобретению используется рапамицин (сиролимус).
Рапамицин
Рапамицин представляет собой макроциклический лактон, который продуцируется бактерией Streptomyces hygroscopicus. Он имеет нижеследующее химическое название (по номенклатуре ИЮПАК): (3S,6R,7E,9R,10R,12R,14S,15E,17E,19E,21S,23S,26R,27R,34aS)-9,10,12,13,14,21,22,23,24,25,26,27,32,33,34,34a-гексадекагидро-9,27-дигидрокси-3-[(1R)-2-[(1S,3R,4R)-4-гидрокси-3-метоксициклогексил]-1-метилэтил]-10,21-диметокси-6,8,12,14,20,26-гексаметил-23,27-эпокси-3H-пиридо[2,1-c][1,4]оксаазациклогентриаконтин-1,5,11,28,29(4H,6H,31H)-пентон.
Это соединение имеет молекулярную формулу C51H79NO13, а его молекулярная масса составляет 914,172 г/моль. Его структура представлена ниже. Известны также изомеры рапамицина, например, изомер В и изомер С, структуры которых описаны в патенте США No. 7384953. Обычно, рапамицин представляет собой смесь изомеров В и С. В растворе, изомеры В и С рапамицина являются взаимопревращающими, в результате чего достигается равновесие. В соответствии с общей практикой, в литературе обычно приводится структура рапамицина в форме изомера В, представленной ниже.

Рапамицин представляет собой белый или не совсем белый порошок, который, как считается, не растворяется в воде и имеет очень низкую растворимость, то есть, только при 2,6 мкг/мл. Рапамицин легко растворяется в бензиловом спирте, хлороформе, ацетоне и ацетонитриле. Нерастворимость рапамицина в воде создает определенные технические проблемы при получении его препарата. Что касается получения его препарата в виде пероральной лекарственной формы, то он может быть приготовлен в виде перорального раствора, имеющего форму твердой дисперсии (WO 97/03654), и в виде таблетки, содержащей наночастицы (менее, чем 400 нм) (патент США 5989591). Но при проведении этих процедур, часто наблюдаются значительные отклонения в растворении активного вещества, что влияет на его биологическую доступность. В другом методе получения препарата используется кристаллический порошок. В соответствии с хорошо известными методами, превращение кристаллической формы лекарственного средства с низкой растворимостью в аморфную форму может значительно повысить растворимость этого лекарственного средства. Хотя аморфная форма также характерна для рапамицина, однако, химически, она является крайне нестабильной. Фармацевтические лекарственные формы, содержащие аморфный рапамицин (сиролимус), описаны в WO 06/039237 и WO 06/094507 (препарат с модифицированным высвобождением, содержащий сиролимус и глицерилмоностеарат в концентрации 49,25%). Пероральная лекарственная форма рапамицина, обладающая повышенной стабильностью, описана в патенте США 8053444. Эта лекарственная форма включает сложный эфир жирной кислоты и полимер (например, поливинилпирролидон (PVP), гидроксипропилцеллюлозу (HPC) или гидроксипропилметилцеллюлозу (HPMC)), присутствующие в композиции, что способствует повышению стабильности сиролимуса, но при этом не оказывает негативного воздействия на скорость его высвобождения. Как описано в патенте США 8053444, сложный эфир жирной кислоты в концентрации, превышающей 10 масс.%, снижает скорость высвобождения сиролимуса из препарата, что является нежелательным, поскольку это может приводить к недостаточной абсорбции из желудочно-кишечного тракта. Предпочтительная концентрация сложного эфира жирной кислоты (сложного эфира глицерина) составляет от 1% до 5% или от 5% до 9%. В одном из вариантов осуществления изобретения, аэрозольные рапамициновые композиции согласно изобретению не содержат комбинации сложного эфира жирной кислоты и полимера. В одном из вариантов осуществления изобретения, аэрозольные рапамициновые композиции согласно изобретению содержат сложный эфир жирной кислоты в концентрации более, чем 10% или 12% по массе композиции.
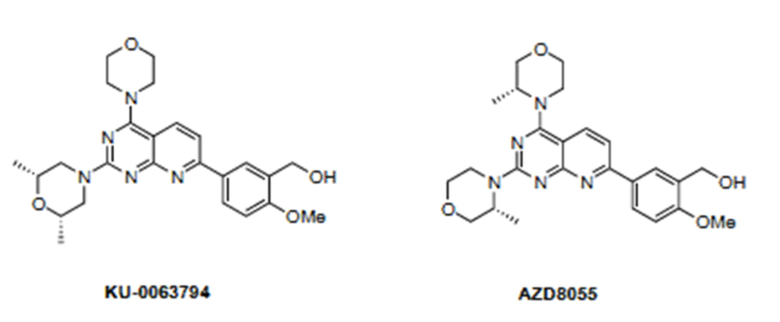
Рапамицин и его производные (включая аналоги) и пролекарства, подходящие для их использования в композициях и способах согласно изобретению, включают рапамицин (сиролимус) и его пролекарства или производные, которые являются ингибиторами пути передачи клеточного сигнала mTOR, а предпочтительно, ингибиторы самой mTOR. В одном из вариантов осуществления изобретения, производное или пролекарство рапамицина представляет собой ингибитор mTOR, выбранный из группы, состоящей из эверолимуса (Affinitor; RAD001), темсиролимуса (CCI-779), ридафоролимуса (ранее известного как дефоролимус; AP23573), умиролимуса (Biolimus A9), зотаролимуса (ABT-578), новолимуса, миолимуса, AP23841, KU-0063794, INK-128, EX2044, EX3855, EX7518, AZD08055 и OSI027. Специалистам известны и другие производные, которыми являются, например, O-замещенное производное, в котором гидроксильная группа на циклогексильном кольце сиролимуса заменена -OR1, где R1 представляет собой, но необязательно, замещенный алкил, ациламиноалкил или аминоалкил.
В одном из вариантов осуществления изобретения, соединением, используемым в аэрозольных препаратах и способах согласно изобретению, является производное рапамицина (аналог), выбранное из группы, состоящей из аналогов рапамицина, таких как эверолимус, темсиролимус, ридафоролимус, умиролимус и зотаролимус. Химические структуры аналогов рапамицина, таких как эверолимус, темсиролимус, ридафоролимус, умиролимус и зотаролимус, представлены ниже.
В одном из вариантов осуществления изобретения, соединением, используемым в аэрозольных препаратах и способах согласно изобретению, является ингибитор mTOR, выбранный из группы, состоящей из KU-0063794, AZD8055, INK128 и OSI-027. Химические структуры ингибиторов mTOR KU-0063794, AZD8055, INK128 и OSI-027 представлены ниже.
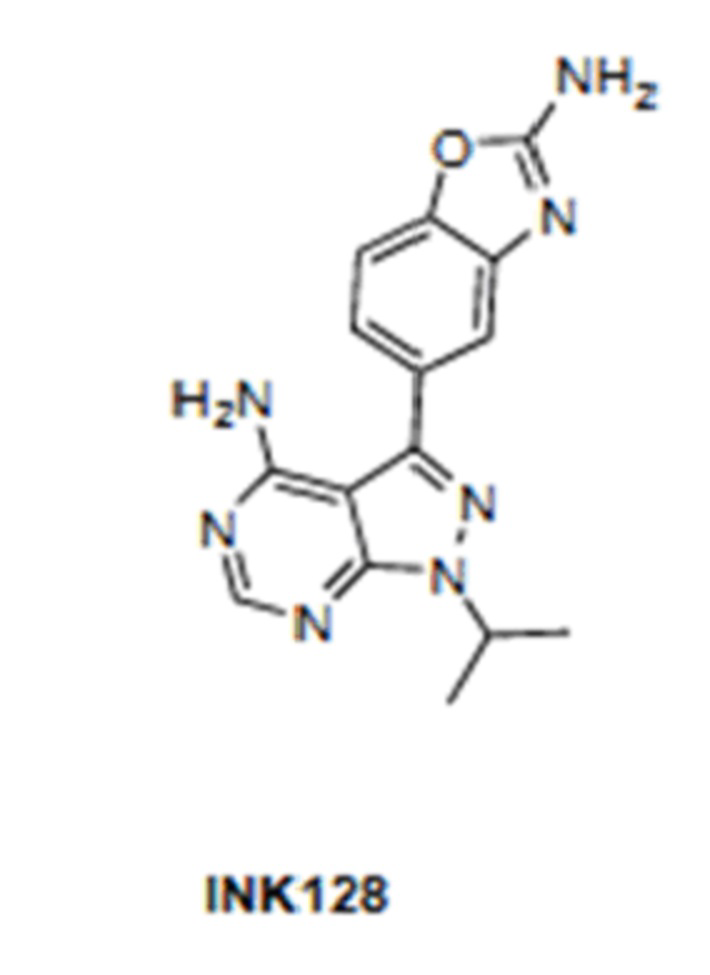

Соединениями, особенно предпочтительными для их использования в способах и композициях согласно изобретению, являются сиролимус, темсиролимус и эверолимус. В одном из вариантов осуществления изобретения, соединение, используемое в аэрозольных препаратах и способах согласно изобретению, выбрано из группы, состоящей из сиролимуса, темсиролимуса и эверолимуса. В одном из вариантов осуществления изобретения, соединением является сиролимус или эверолимус.
Композиции для ингаляции
Настоящее изобретение относится к фармацевтическим композициям, адаптированным для введения путем ингаляции и содержащим рапамицин или его пролекарство или производное в форме водного раствора, сухого порошка или смеси одного или более фармацевтически приемлемых пропеллентов и носителя. В одном из вариантов осуществления изобретения, рапамицин инкапсулирован в фармацевтически приемлемом соединении, веществе или матрице. В одном из вариантов осуществления изобретения, рапамицин инкапсулирован в липосомном препарате или в не-липосомном препарате.
Композиции согласно изобретению представляют собой распыляемые рапамициновые препараты, подходящие для пульмональной доставки лекарственного средства человеку путем ингаляции аэрозоля. В контексте настоящего описания, термин «аэрозоль» означает коллоидную систему, в которой дисперсная фаза состоит из твердых или жидких частиц, и в которой диспергируемой средой является газ. В одном из вариантов осуществления изобретения, газом является воздух, а препаратом является препарат в форме раствора, подходящего для введения с помощью аэрозольного ингалятора, или препарат в форме сухого порошка, подходящего для введения с помощью устройства для ингаляции сухих порошков. Вообще говоря, средний диаметр вдыхаемых частиц или капелек составляет в пределах от 0,10 до 10 микрон. Размер частиц или капелек выбирают так, чтобы он соответствовал максимальной направленной доставке этих частиц или капелек либо в сами легкие (то есть, если легкие представляют собой ткань-мишень), либо в кровоток (то есть, если введение в легкие служит альтернативным способом системного введения). Предпочтительный размер частиц составляет в пределах приблизительно от 0,5 до 5 микрон, в случае, если терапевтической мишенью являются сами легкие, или менее, чем 3 микрона в случае системной доставки через легкие. Размер определяют известными методами, описанными, например, в Фармакопее США, в главах 905 и 601. Так, например, размер частиц определяют как среднемассовый аэродинамический диаметр (MMAD). В одном из вариантов осуществления изобретения, усредненный или средний диаметр частиц, содержащих описанные здесь композиции, измеряют как MMAD.
В одном из вариантов осуществления изобретения, дисперсная фаза аэрозоля состоит из жидких частиц или капелек. В этом контексте, термины «жидкие частицы» и «капельки» являются синонимами. В этом варианте осуществления изобретения, препаратом согласно изобретению является препарат в виде раствора. В одном из вариантов осуществления изобретения, дисперсная фаза аэрозоля состоит из твердых частиц. В этом варианте осуществления изобретения, препаратом согласно изобретению является препарат в виде сухого порошка. Микронизированные частицы такого размера могут быть получены методами известными специалистам, например, путем механического измельчения (помола), осаждения из субкритических или надкритических растворов, сушки распылением, сушки вымораживанием или лиофилизации.
В общих чертах, вдыхаемые частицы осаждаются по одному из двух механизмов: соударение, которое обычно наблюдается в случае более крупных частиц, и седиментация, которая, в основном, наблюдается в случае более мелких частиц. Соударение наблюдается в том случае, когда импульс вдыхаемой частицы является достаточным для того, чтобы эта частица не попадала в воздушный поток и не сталкивалась с физиологической поверхностью. В противоположность этому, седиментация наблюдается, главным образом, в глубине легких, если очень мелкие частицы, которые проникают вместе с вдыхаемым потоком воздуха, сталкиваются с физиологическими поверхностями в результате рандомизированной диффузии в воздушном потоке. Аэрозольные композиции согласно изобретению, предпочтительно, адаптируют для максимизации их осаждения, либо посредством соударения (в верхних дыхательных путях), либо посредством седиментации (в альвеолах) в целях достижения нужной терапевтической эффективности.
Количество лекарственного средства, доставляемого пациенту из устройства для доставки, такого как аэрозольный ингалятор, устройство pMDI или DPI, называется доставляемой дозой. Это количество может быть оценено in vitro путем определения количества лекарственного средства, испускаемого из устройства для доставки в соответствии с процедурой, моделирующей ингаляцию. Такое количество называется «испускаемой дозой» (ED), измеряемой известным методом, например, методом, описанным в Фармакопее США или в Европейской Фармакопее, например, в главах 601 и 905 USP. В соответствии с этим, «испускаемая доза» рассматривается как доза, эквивалентная доставляемой дозе.
Количество лекарственного средства, доставляемого в легкие пациента из устройства для доставки, называется «вдыхаемой дозой». Она может быть оценена in vitro путем определения дозы тонкодисперсных частиц (FPD), измеренной с использованием каскадных импакторов, таких как Импактор Нового Поколения (NGI), с применением известных методов, например, описанных в Фармакопее США или в Европейской Фармакопее, например, в главах 601 и 905 USP.
Количество лекарственного средства, высвобождаемое в виде тонкодисперсных распыляемых частиц из устройства для доставки, называется фракцией тонкодисперсных частиц (FPF) препарата. FPF представляет собой фракцию лекарственного средства в доставляемой дозе, которая может вдыхаться. Таким образом, FPF представляет собой отношение FPD к ED (испускаемой дозы или доставляемой дозы). Эти характеристики препарата определяют известными методами, например, описанными в Фармакопее США или в Европейской Фармакопее, например, в главе 601 USP и в монографии 2.9.18 Европейской Фармакопеи.
В одном из вариантов осуществления изобретения, распыляемые рапамициновые препараты согласно изобретению имеют FPF более, чем 20%, причем, соответствующая доза FPD составляет в пределах от 10 микрограммов до 2 миллиграммов, а предпочтительно, менее, чем 0,5 миллиграмма, даже после длительного хранения, например, в течение 1-12 месяцев или 1-36 месяцев после хранения. В одном из вариантов осуществления изобретения, доза, доставляемая пациенту, то есть, доставляемая доза (DD) или испускаемая доза (ED) составляет в пределах от 25 микрограммов до 2,5 миллиграмма, а предпочтительно, менее, чем 0,5 миллиграмма.
В некоторых вариантах осуществления изобретения, рапамицин инкапсулирован в фармацевтически приемлемом соединении, веществе или матрице. В одном из вариантов осуществления изобретения, рапамицин инкапсулирован в липосомном препарате или в не-липосомном препарате.
Композиции в виде водного раствора
В одном из вариантов осуществления изобретения, распыляемой композицией согласно изобретению является рапамициновая композиция в виде водного раствора, адаптированного для пульмональной доставки с помощью аэрозольного ингалятора, включая струйный ингалятор, ингалятор с вибрирующей и статической сеткой или ингалятор с отверстием. Таким образом, композиция в виде раствора адаптирована так, чтобы она образовывала в дыхательных путях аэрозольные капельки диаметром приблизительно от 0,1 до 10 микрон, как описано выше. В одном из вариантов осуществления изобретения, композицией является распыляемый препарат в виде водного раствора, состоящий из рапамицина (сиролимуса) или его пролекарства или производного, растворенных в воде и этаноле; и низкомолекулярного полиола и, необязательно, поверхностно-активного вещества. В одном из вариантов осуществления изобретения, препарат в виде водного раствора имеет вязкость ниже 20 мПа•с, ниже 10 мПа•с, или ниже 5 мПа•с, и поверхностное натяжение по меньшей мере 45 дин/см, предпочтительно, более, чем 60 дин/см. Предпочтительно, препарат имеет вязкость ниже 5 мПа•с, и поверхностное натяжение выше 45 дин/см. В одном из вариантов осуществления изобретения, композиция имеет вязкость ниже 20 мПа•с, ниже 10 мПа•с, или ниже 5 мПа•с, и поверхностное натяжение по меньшей мере 45 дин/см, предпочтительно, более, чем 60 дин/см.
В одном из вариантов осуществления изобретения, препарат в виде водного раствора состоит из рапамицина, воды, этанола и низкомолекулярного полиола, выбранного из глицерина и пропиленгликоля. В одном из вариантов осуществления изобретения, препарат в виде водного раствора состоит из рапамицина, воды и низкомолекулярного полиола, выбранного из глицерина и пропиленгликоля, причем, этанол является необязательным. Этот препарат может также содержать, но необязательно, неионное поверхностно-активное вещество, а предпочтительно, ПЭГ 100, или полисорбат, предпочтительно, полисорбат 80 («PS80»), фосфолипид, а предпочтительно, природный фосфолипид, такой как лецитин, а предпочтительно, гидрогенизированный лецитин сои, и антиоксидант или стабилизатор, а предпочтительно, динатрий-EDTA. В одном из вариантов осуществления изобретения, неионное поверхностно-активное вещество выбрано из группы, состоящей из полиэтиленгликоля (ПЭГ) ПЭГ 100, ПЭГ 1000 и полисорбата 80 (также называемого твином (Tween™) 80, сорбитанмоноолеатом или полиоксиэтиленсорбитанолеатом) и их смесей.
Количество рапамицина в водном растворе составляет приблизительно от 0,001 до 0,01 процентов (масс.% или % масс/масс) по массе всего раствора. В одном из вариантов осуществления изобретения, рапамицин присутствует в растворе в концентрации приблизительно от 0,01 мг/мл до приблизительно 0,1 мг/мл. В одном из вариантов осуществления изобретения, количество рапамицина составляет от 0,001 до 0,01% по массе всего раствора.
В одном из вариантов осуществления изобретения, концентрация рапамицина в растворе составляет приблизительно от 0,01 до 0,1 мг/мл, количество низкомолекулярного полиола составляет от 5 до 35 масс.%, количество этанола составляет 5-20 масс.%, а количество неионного поверхностно-активного вещества составляет от 1 до 200 миллионных долей (м.д.) по массе. Предпочтительно, количество неионного поверхностно-активного вещества составляет менее, чем 100 м.д. (по массе). Количество необязательного антиоксиданта/стабилизатора составляет от нуля до менее, чем 0,01 масс.%.
В одном из вариантов осуществления изобретения, препарат в виде водного раствора не содержит одной или более добавок или одного или более наполнителей, выбранных из группы, состоящей из полиэтиленгликоля, лецитина, EDTA, блоксополимера и циклодекстрина.
Препарат в виде водного раствора представляет собой однофазный водный раствор, в котором рапамицин является полностью растворенным. Главными сорастворителями в данном препарате являются этанол и низкомолекулярный полиол, выбранный из глицерина и пропиленгликоля. Рапамицин не присутствует в суспензии или эмульсии, и его раствор не может быть описан как коллоидный раствор или дисперсия. Препарат в виде водного раствора согласно изобретению не содержит коллоидных структур, таких как мицеллы или липосомы. Количество фосфолипида, если он присутствует, слишком мало для образования липосом или для осаждения рапамицина. При этом, общее количество фосфолипида и неионного поверхностно-активного вещества также слишком мало для модификации поверхностного натяжения. В соответствии с этим, ни фосфолипид, ни неионное поверхностно-активное вещество не присутствуют в количестве, достаточном для их функционирования в качестве поверхностно-активного вещества в традиционном смысле. В этом контексте, термин «поверхностно-активное вещество» означает агент, снижающий поверхностное натяжение раствора или межфазное поверхностное натяжение между жидкими и любыми твердыми частицами лекарственного средства, а поэтому такое поверхностно-активное вещество действует как детергент, смачивающий агент, эмульгатор или диспергирующий агент. В отличие от этого, неионное поверхностно-активное вещество, присутствующее в препарате в виде раствора согласно изобретению, блокирует адсорбцию лекарственного средства в полиэтиленовом контейнере, в котором упакован конечный продукт, и тем самым, предупреждает потерю активности лекарственного средства посредством адсорбции в контейнере.
В соответствии с этим, в одном из вариантов осуществления изобретения, препарат в виде водного раствора представляет собой однофазный водный раствор, в котором рапамицин является полностью растворенным, и этот раствор также не содержит мицелл или липосом и не является эмульсией, дисперсией или суспензией.
В одном из вариантов осуществления изобретения, препарат в виде раствора является стерильным. В одном из вариантов осуществления изобретения, препарат в виде раствора подвергают стерильной фильтрации через фильтр 0,2 микрона. В одном из вариантов осуществления изобретения, препарат в виде раствора не стерилизуют путем нагревания, такого как автоклавирование, или путем облучения.
В одном из своих вариантов, настоящее изобретение относится к упаковке, содержащей один или более контейнеров или сосудов (эти термины являются синонимами), заполненных стерильным препаратом в виде водного раствора. Предпочтительно, контейнеры представляют собой контейнеры, содержащие единичную дозу. В одном из вариантов осуществления изобретения, контейнеры представляют собой полимерные сосуды, а предпочтительно, полиэтиленовые сосуды. В одном из вариантов осуществления изобретения, контейнер или сосуд, заполненный стерильным препаратом в виде водного раствора согласно изобретению, приготавливают способом, включающим стадии формования сосуда посредством выдувного формования с последующим непосредственным заполнением сосуда стерильно отфильтрованным препаратом согласно изобретению в асептических условиях, и термосваркой сосуда сразу после его заполнения.
В одном из вариантов осуществления изобретения, препарат в виде водного раствора согласно изобретению включает или состоит из них:
рапамицин (или его пролекарство или производное) в количестве приблизительно от 0,001% до 0,01 масс.%,
пропиленгликоль приблизительно от 5% до 35 масс.%,
этанол приблизительно от 5% до 20 масс.%,
полисорбат 80 приблизительно от 1 до 200 м.д. по массе,
лецитин приблизительно от 1 до 100 м.д. по массе, и
воду,
где количество воды является достаточным для достижения концентрации рапамицина от 0,01 до 0,1 миллиграммов/миллилитров. Может быть также добавлен, но необязательно, агент, повышающий стабильность, такой как динатрий-EDTA на уровне ниже 0,01 масс.%.
В случае использования водных и других несжиженных жидких систем, для распыления препаратов применяются различные аэрозольные ингаляторы (включая аэрозольные ингаляторы небольшого объема). Аэрозольные ингаляторы, управляемые компрессором, работают на основе струйной технологии, которая предусматривает использование сжатого воздуха для получения жидкого аэрозоля. Такие устройства являются коммерчески доступными и поставляются, например, компаниями Healthdyne Technologies, Inc.; Invacare, Inc.; Mountain Medical Equipment, Inc.; Pari Respiratory, Inc.; Mada Medical, Inc.; Puritan-Bennet; Schuco, Inc., DeVilbiss Health Care, Inc.; и Hospitak, Inc. Ультразвуковые аэрозольные ингаляторы работают на основе механической энергии вибрации пьезоэлектрического кристалла, генерирующего вдыхаемые жидкие капельки, и эти аэрозольные ингаляторы поставляются, например, компаниями Omron Healthcare, Inc. и DeVilbiss Health Care, Inc.
В одном из вариантов осуществления изобретения, водный аэрозольный препарат согласно изобретению вводится посредством вибрирующего аэрозольного ингалятора, поставляемого Aerogen, Pari, Philips или Omron. В одном из вариантов осуществления изобретения, водный аэрозольный препарат согласно изобретению упаковывают в контейнер, подходящий для его использования в вибрирующем ситовом аэрозольном ингаляторе, например, Aeroneb® Go (Aerogen, поставляемый Philips Respironics), I-Neb® (Philips) или E-Flow® (Pari), или в аналогичном аэрозольном ингаляторе. В одном из вариантов осуществления изобретения, водный аэрозольный препарат согласно изобретению вводится посредством аэрозольного ингалятора с отверстием, такого как Respimat® от Boeringher-Ingelheim.
Таким образом, в одном из своих вариантов, настоящее изобретение относится к фармацевтической композиции в форме распыляемого водного раствора, подходящего для его введения путем ингаляции человеку, где указанный водный раствор состоит из рапамицина или его пролекарства или производного, предпочтительно, выбранных из сиролимуса, эверолимуса и темсиролимуса, воды, этанола и низкомолекулярного полиола. В одном из вариантов осуществления изобретения, низкомолекулярным полиолом является глицерин или пропиленгликоль или их смесь. В одном из вариантов осуществления изобретения, указанная композиция также содержит неионное поверхностно-активное вещество, выбранное из группы, состоящей из ПЭГ 100, ПЭГ 1000, полисорбата 80 и их смесей. В одном из вариантов осуществления изобретения, количество неионного поверхностно-активного вещества в препарате составляет от 1 до 200 м.д., предпочтительно, менее, чем 100 м.д. по массе всего препарата. В одном из вариантов осуществления изобретения, композиция также включает фосфолипид, антиоксидант или химический стабилизатор. В одном из вариантов осуществления изобретения, количество антиоксиданта или химического стабилизатора в препарате составляет менее, чем 0,01% по массе препарата. В одном из вариантов осуществления изобретения, антиоксидантом или химическим стабилизатором является EDTA. В одном из вариантов осуществления изобретения, количество рапамицина в препарате составляет от 0,001 до 0,01% по массе препарата.
В одном из вариантов осуществления изобретения, композиция не содержит одной или более добавок или одного или более наполнителей, выбранных из группы, состоящей из полиэтиленгликоля, лецитина, EDTA, блоксополимера и циклодекстрина.
В одном из вариантов осуществления изобретения, композиция не содержит коллоидных структур, выбранных из мицелл и липосом.
В одном из вариантов осуществления изобретения, композиция является подходящей для ее введения с помощью одного из устройств, таких как струйный ингалятор, ингалятор с вибрирующей и статической сеткой и ингалятор с отверстием.
В одном из вариантов осуществления изобретения, композиция имеет вязкость ниже 20 мПа•с, предпочтительно, ниже 10 мПа•с, а наиболее предпочтительно, ниже 5 мПа•с, и поверхностное натяжение по меньшей мере 45 дин/см, а предпочтительно, по меньшей мере 50 дин/см.
Настоящее изобретение также относится к способу получения фармацевтической композиции согласно изобретению в форме распыляемого водного раствора, где указанный способ включает стерильную фильтрацию раствора через фильтр с размером пор 0,2 микрона или менее, и сбор стерильного фильтрата в сосуде для сбора в асептических условиях. В одном из вариантов осуществления изобретения, способ получения препарата также включает перенос стерильного фильтрата в контейнер, который закрывают в асептических условиях. В одном из вариантов осуществления изобретения, закрытым контейнером является полиэтиленовый сосуд, содержащий единичную дозу. В одном из вариантов осуществления изобретения, сосуд получают посредством выдувного формования с последующим непосредственным переносом стерильного фильтрата в сосуд. В одном из вариантов осуществления изобретения, указанный способ также включает стадию термосварки сосуда сразу после переноса стерильного фильтрата в сосуд.
Композиции в виде сухого порошка
В одном из вариантов осуществления изобретения, аэрозольной композицией согласно изобретению является сухой порошок, содержащий микронизированные частицы рапамицина или его пролекарства или производного, используемые в качестве терапевтического средства (также называемого «лекарственным средством»), где указанные частицы имеют диаметр от 0,1 до 10 микрон и средний диаметр приблизительно от 0,5 до 4,5 микрон, приблизительно от 1 до 4 микрон, приблизительно от 1 до 3,5 микрон, приблизительно от 1,5 до 3,5 микрон, или приблизительно от 2 до 3 микрон. Препарат в виде сухого порошка является подходящим для его использования в устройстве для ингаляции сухих порошков (DPI) или в ингаляторе с дозатором, работающем под давлением (pMDI). Количество рапамицина в сухом порошке составляет приблизительно от 0,5 до 20% по массе всего порошка. В одном из вариантов осуществления изобретения, количество рапамицина составляет приблизительно 1% или 2 масс.%.
В одном из вариантов осуществления изобретения, микронизированный рапамицин приготавливают методом мокрого фомования или помола на струйной мельнице, как описано ниже с получением частиц диаметром приблизительно от 0,5 до 4,5 микрон, приблизительно от 1 до 4 микрон, или приблизительно от 2 до 3 микрон, и полученные частицы рапамицин смешивают с частицами лактозного носителя в отношении лекарственное средство/носитель в пределах от 0,5 до 2 масс.%, а предпочтительным отношением является 1%.
В одном из вариантов осуществления изобретения, частицы лекарственного средства плотно упаковывают в тонкую матрицу, содержащуюся в устройстве для доставки (в ингаляторе сухих порошков). После запуска устройства для доставки, из матрицы высвобождается порция частиц лекарственного средства, в результате чего частицы лекарственного средства доставляются в дыхательные пути. Альтернативно, частицы лекарственного средства могут присутствовать в виде свободнотекучего порошка, содержащегося в резервуаре в устройстве для доставки (в ингаляторе сухих порошков). Резервуар может представлять собой камеру, встроенную в устройство, капсулу или блистерную упаковку, или подобный заранее приготовленный резервуар, который вставляют в устройство перед его запуском. После запуска устройства, часть частиц лекарственного средства высвобождается из резервуара, и диспергированная фракция, высвобождаемая из резервуара, попадает во вдыхаемый воздух, в результате чего лекарственное средство доставляется в дыхательные пути.
В одном из вариантов осуществления изобретения, композиция в виде сухого порошка состоит из частиц лекарственного средства и носителя, выбранного из группы, состоящей из арабинозы, глюкозы, фруктозы, рибозы, маннозы, сахарозы, трегалозы, лактозы, мальтозы, крахмала, декстрана, маннита, лизина, лейцина, изолейцина, дипальмитилфосфатидилхолина, лецитина, полимолочной кислоты, сополимера молочной и глутаминовой кислоты, ксилита или смесей любых вышеупомянутых соединений. В одном из вариантов осуществления изобретения, носителем является лактоза, в частности, в форме моногидрата. В одном из вариантов осуществления изобретения, композиция в виде сухого порошка содержит смесь из двух или более носителей.
В одном из вариантов осуществления изобретения, композиция в виде сухого порошка включает лекарственное средство и смесь по меньшей мере из двух различных носителей. В одном из вариантов осуществления изобретения, отношение лекарственного средства к носителю составляет в пределах приблизительно от 0,5 до 20 масс.%. В одном из вариантов осуществления изобретения, частица лекарственного средства имеют диаметр в пределах от 0,1 до 10 микрон и средний диаметр приблизительно от 1 до 4, от 1 до 3,5, или от 1,5 до 3,5, или от 2 до 3 микрон. Частицы носителя могут иметь диаметр в пределах от 2 до 200 микрон.
В одном из вариантов осуществления изобретения, композиция содержится в блистерной упаковке или в резервуаре устройства DPI. В одном из вариантов осуществления изобретения, композицию в виде сухого порошка предварительно загружают в желатиновую, крахмальную, целлюлозную или полимерную капсулу, либо в блистерную упаковку «фольга/фольга» или «фольга/пластик», подходящую для ее использования в устройстве DPI. Каждая капсула или блистерная упаковка может содержать от 1 до 100 миллиграммов композиции в виде сухого порошка. Капсулы или блистерные упаковки могут быть вставлены в устройство для ингаляции сухих порошков (DPI), такое как Aerolizer®, Plastiape® RS01 Model 7, и Plastiape® RS00 Model 8, XCaps®, FlowCaps®, Arcus®, Diskhaler® или Microdose®. После включения устройства DPI, капсулы или блистерные упаковки разрываются, и порошок диспергируется во вдыхаемом воздухе, в результате чего лекарственное средство доставляется в дыхательные пути.
В одном из вариантов осуществления изобретения, композиция в виде сухого порошка содержится в устройстве для ингаляции сухих порошков (DPI), выбранном из ингаляторов Accuhaler®, ConixTM, Rotahaler®, TwinCaps®, XCaps®, FlowCaps®, Turbuhaler®, NextHaler®, CycloHaler®, Revolizer TM, Diskhaler®, Diskus®, Spinhaler, Handihaler®, ингалятора для микродоз, и ингаляторов GyroHaler®, OmniHaler®, Clickhaler®, Duohaler® (Vectura) и ARCUS® (Civitas Therapeutics). В одном из своих вариантов, настоящее изобретение относится к устройству DPI, содержащему описанные здесь композиции в виде сухого порошка. В одном из вариантов осуществления изобретения, устройство выбрано из группы, состоящей из XCaps, FlowCaps, Handihaler, TwinCaps, Aerolizer®, Plastiape® RS01 Model 7 и Plastiape® RS00 Model 8. В одном из вариантов осуществления изобретения, устройство, содержащее композицию, выбрано из группы, состоящей из ингалятора GyroHaler®, OmniHaler®, Clickhaler®, Duohaler® и ARCUS®.
При этом, предпочтительно, чтобы частицы носителя были более крупного размера (более, чем 5 микрон) во избежание их попадания вглубь легких. В одном из вариантов осуществления изобретения, частицы носителя имеют диаметр в пределах от 1 до 200 микрон, от 30 до 100 микрон или менее, чем 10 микрон. В одном из вариантов осуществления изобретения, частицы носителя представляют собой смесь из двух носителей, где частицы одного из носителей имеют диаметр в пределах приблизительно 30-100 микрон, а частицы второго носителя имеют диаметр менее, чем 10 микрон. Отношение двух различных носителей составляет в пределах от 3:97 до 97:3. В одном из вариантов осуществления изобретения, композиция в виде сухого порошка имеет отношение лекарственного средства к носителю, составляющее 0,5-20 масс.%, где частицы лекарственного средства имеют диаметр от 0,1 до 10 микрон и средний диаметр менее, чем 3,5 микрон. В одном из вариантов осуществления изобретения, носителем является кристаллический носитель. Предпочтительно, чтобы такой носитель был по меньшей мере на 90%, а предпочтительно, более, чем на 95% кристаллическим носителем, и не содержал, или, по существу, не содержал воду, абсорбируемую носителем при относительной влажности 80% или менее при комнатной температуре. Примерами таких кристаллических носителей являются моногидрат лактозы и моногидрат глюкозы. Количество носителя в препарате составляет от 1 до 99,0%, а предпочтительно, от 5 до 99%, от 10 до 99%, от 20 до 99%, от 30 до 99%, от 40 до 99%, или от 50 до 99% или более из расчета сухой массы порошка.
В одном из вариантов осуществления изобретения, композиция в виде сухого порошка присутствует в резервуаре устройства для доставки (в ингаляторе для сухих порошков). Резервуар может представлять собой камеру, встроенную в устройство, капсулу или блистерную упаковку или подобный заранее приготовленный резервуар, который вставляют в устройство перед его запуском. После запуска устройства, часть частиц лекарственного средства высвобождается из резервуара, и диспергированная фракция, высвобождаемая из резервуара, попадает во вдыхаемый воздух, в результате чего лекарственное средство доставляется в дыхательные пути.
В одном из вариантов осуществления изобретения, лекарственное средство присутствует в виде тонкодисперсного порошка, содержащего фармацевтически приемлемый носитель. В этом контексте, термин «тонкодисперсный» относится к размеру вдыхаемых частиц как обсуждается выше. Предпочтительно, лекарственное средство микронизируют так, чтобы частицы имели средний диаметр в пределах 10 микрон или менее. В одном из вариантов осуществления изобретения, средний диаметр (MMAD или Dv50) частиц рапамицина (или его пролекарства или производного) в композиции в виде сухого порошка, описанной в настоящей заявке, составляет от 0,5 до 10 микрон, от 0,5 до 6 микрон, от 1 до 5 микрон, от 1 до 4 микрон, от 1 до 3 микрон или от 2 до 3 микрон. Величина MMAD или Dv50 представляет собой размер частиц, который имеет 50% из всего объема присутствующих частиц.
В одном из вариантов осуществления изобретения, рапамициновый препарат в виде сухого порошка также включает одну или более добавок, выбранных из добавок, описанных ниже. В одном из вариантов осуществления изобретения, одна или более добавок включают стеарат магния или состоят из него. В одном из аспектов этого варианта, стеарат магния присутствует в количестве от 0,001 до 10%, а предпочтительно, от 0,01 до 5% или от 0,01 до 2% по сухой массе порошка. В другом варианте осуществления изобретения, добавка включает фосфолипид или состоит из фосфолипида, такого как лецитин (который представляет собой смесь фосфатидилхолинов) в количестве от 0,1% до 1%, а предпочтительно, от 0,2 до 0,6% по сухой массе порошка. В одном из аспектов этого варианта, добавку наносят на носитель до или во время проведения стадии смешивания носителя с частицами рапамицина. Это может быть осуществлено, например, путем проведения стадии высокоэнергетического смешивания для нанесения добавки на носитель или длительного низкоэнергетического смешивания или комбинации стадий низкоэнергетического и высокоэнергетического смешивания до достижения нужного уровня покрытия носителя. Устройства для низкоэнергетического смешивания сухих порошков с получением смесей хорошо известны специалистам, и такими устройствами являются, например, V-смесители, смесители с двойным конусом, смесители со скошенным конусом, кубообразные смесители, смесители бункерного типа, смесители с горизонтальным или вертикальным барабаном, смесители статического непрерывного действия и смесители динамического непрерывного действия. Другими устройствами, работающими с более высоким энергетическим потенциалом, являются миксеры с большим сдвиговым усилием, известные специалистам.
В некоторых вариантах осуществления изобретения, сухой порошок содержится в капсуле. В одном из вариантов осуществления изобретения, такой капсулой является желатиновая капсула, пластиковая капсула или целлюлозная капсула, либо такая капсула может быть приготовлена в виде блистерных упаковок «фольга/фольга» или «фольга/пластик». В каждом случае, такая капсула или блистерная упаковка является подходящей для ее использования в устройстве DPI, а предпочтительно, в единичных лекарственных формах вместе с носителем, где количество этих форм в каждой капсуле составляет от 1 мг до 100 мг по общей массе порошка. Альтернативно, сухой порошок может содержаться в резервуаре устройства DPI для введения многократных доз.
Размер частиц рапамицина может быть уменьшен до нужного размера микрочастиц стандартными методами, например, путем помола в струйной воздушной мельнице, шаровой мельнице или вибрационной мельнице, путем мокрого формования, микропреципитации, сушки распылением, лиофилизации или перекристаллизации из субкритических или надкритических растворов. В этом контексте, струйный помол или измельчение означает микронизацию сухих частиц лекарственного средства механическим методом. Методы микронизации не требуют получения раствора, взвеси или суспензии лекарственного средства. Вместо этого, размер частиц лекарственного средства уменьшают механическим методом. Из-за относительно высокой энергии, затрачиваемой в процессе микронизации, в некоторых вариантах осуществления изобретения, желательно, чтобы совместно микронизируемая смесь рапамицина включала носитель. В этой связи следует отметить, что вещество носителя поглощает некоторое количество энергии микронизации, что может негативно влиять на структуру рапамицина. В одном из вариантов осуществления изобретения, рапамициновые частицы, имеющие размер в пределах от 1 до 4 или от 2 до 3 микрон, получают методом струйного помола.
Мокрое формование, как описано в заявке США US2013/0203717, включает формование с большими сдвиговыми усилиями для уменьшения размера частиц лекарственного средства в суспензии или во взвеси. Мокрому формованию могут быть подвергнуты лишь частицы лекарственного средства или дополнительные частицы, называемые средствами для помола. В одном из вариантов осуществления изобретения, размер частиц рапамицина может быть уменьшен до нужного уровня с применением метода мокрого формования, который включает мокрый помол, в частности, посредством кавитации при повышенном давлении, где рапамицин суспендируют в воде или в другом растворителе, в котором он не растворяется, а затем, суспензию подвергают сушке распылением с получением рапамицина в виде сухого порошка. В одном из вариантов осуществления изобретения, частицы рапамицина размером от 1 до 4 или от 2 до 3 микрон получают методом мокрого формования, который включает приготовление суспензии рапамицина, микрофлюидизацию этой суспензии и сушку полученных частиц распылением с образованием сухого порошка. Рапамицин может быть суспендирован в антирастворителе, выбранном из группы, состоящей из пропилового или бутилового спирта, воды и этилацетата. В одном из вариантов осуществления изобретения, суспензией является водная суспензия.
Сушка распылением обычно включает приготовление раствора, взвеси или суспензии лекарственного средства, измельчение раствора, взвеси или суспензии с образованием частиц и последующим выпариванием среды раствора, взвеси или суспензии с получением частиц. Раствор, взвеь или суспензия могут быть получены в субкритических или надкритических условиях. Стадия выпаривания может быть осуществлена путем повышения температуры окружающей среды, в которой осуществляют измельчение, или путем снижения давления или путем проведения комбинации этих процедур. В одном из вариантов осуществления изобретения, препарат в виде порошка, содержащий рапамицин, получают путем сушки водной дисперсии рапамицина распылением с образованием сухого порошка, состоящего из агрегированных частиц рапамицина, имеющих размер, подходящий для доставки в легкие, как описано выше. Размер агрегированных частиц может быть скорректирован (увеличен или уменьшен) для доставки либо вглубь легких, либо в верхние дыхательные пути, такие как верхняя бронхиальная область или слизистая носа. Это может быть осуществлено, например, путем повышения концентрации рапамицина в осущенной распылением дисперсии, или путем увеличения размера капелек, полученных путем сушки распылением.
Альтернативно, сухой порошок может быть получен путем сушки водного раствора, дисперсии или эмульсии лекарственного средства вымораживанием (лиофилизации) или путем комбинации сушки распылением и сушки вымораживанием.
В одном из вариантов осуществления изобретения, водная дисперсия рапамицина и одна или более необязательных добавок также включают растворенный разбавитель, такой как лактоза или маннит, в результате чего образуется осушенная вымораживанием дисперсия вдыхаемых частиц разбавителя, каждая из которых содержит по меньшей мере одну включенную в эту дисперсию частицу лекарственного средства и дополнительную частицу, если она присутствует.
В одном из вариантов осуществления изобретения, препарат в виде сухого порошка получают путем лиофилизации водной дисперции рапамицина и одной или более необязательных добавок. В одном из вариантов осуществления изобретения, порошки содаржат агрегаты рапамицина и добавку, если она присутствует, где агрегаты имеют размеры вдыхаемых частиц, описанные выше.
В одном из вариантов осуществления изобретения, сухой порошок включает липосомы, нагруженные рапамицином. Нагруженные лекарственным средством липосомы могут быть получены известными методами, например, методом, описанным для такролимуса в публикации M. Chougale, et al. Int. J. Nanomedicine 2:625-688 (2007). Вкратце, рапамицин, гидрированный фосфатидилхолин (HSPC) и холестерин растворяют в смеси метанола и хлороформа, а затем формуют с образованием сухой тонкой пленки, например, в роторном испарителе. Затем липосомы подвергают гидратации, и полученную липосомную дисперсию пропускают через гомогенизатор высокого давления для уменьшения расмера частиц. Полученные гранулы охарактеризовывают для оценки размера везикул и процента захваченного лекарственного средства и гранул, эквивалентных нужному количеству рапамицина, а затем, продукт диспергируют в подходящей смеси и подвергают сушке распылением с получением частиц, размер которых является подходящим для ингаляции. Осушенный распылением порошок может быть упакован в капсулы, канистры или блистерные упаковки для их последующего введения.
В одном из вариантов осуществления изобретения, частицы сухого порошка могут быть получены путем осаждения из надкритического или субкритического раствора.
Композиции в виде сухого порошка могут содержаться в подходящем устройстве для ингаляции сухих порошков, или в капсуле или в блистерной упаковке, используемой в таком устройстве. Примеры таких устройств описаны выше, и ими являются Accuhaler®, Aerolizer®, Plastiape® RS01 Model 7, Plastiape® RS00 Model 8, ConixTM, Rotahaler®, TwinCaps®, XCaps®, FlowCaps®, Turbuhaler®, NextHaler®, CycloHaler®, Revolizer TM, Diskhaler®, Diskus®, Spinhaler, Handihaler®, ингалятор для микродоз, GyroHaler®, OmniHaler®, Clickhaler®, или Duohaler® (Vectura), или ингалятор, подающий воздух для вдыхания ARCUS® (Civitas Therapeutics). В одном из своих вариантов, настоящее изобретение относится к устройству DPI, содержащему описанную здесь композицию в виде ссухого порошка. В одном из вариантов осуществления изобретения, устройство выбран из группы, состоящей из XCaps, FlowCaps, Handihaler, TwinCaps, Aerolizer®, Plastiape® RS01 Model 7 и Plastiape® RS00 Model 8.
Пропеллент-содержащие препараты
В другом варианте осуществления изобретения, рапамицин приготавливают в виде пропеллент-содержащего препарата, который также называется здесь общим термином «препарат pMDI». Препарат pMDI является подходящим для доставки с помощью такого устройства, как ингалятор с дозатором, работающий под давлением (pMDI). В одном из вариантов осуществления изобретения, композиция содержит рапамицин, пропеллент и растительное масло или фармацевтически приемлемое производное растительного масла. Пропеллент, предпочтительно, выбирают из 1,1,1,2-тетрафторэтана (HFA134a) и 1,1,1,2,3,3,3-гептафторпропана (HFA227) или их смесей. В одном из вариантов осуществления изобретения, растительное масло выбирают из оливкового масла, сафлорового масла и соевого масла. Рапамицин может присутствовать в пропелленте в виде раствора или суспензии. В этом контексте, словосочетание «в суспензии» означает, что рапамицин присутствует в форме частиц, диспергированных в пропелленте. В одном из вариантов осуществления изобретения, рапамицин является микронизированным и присутствует в пропелленте в виде суспензии. В одном из вариантов осуществления изобретения, препарат также содержит смачивающий агент или сорастворитель, такой как этанол. В одном из вариантов осуществления изобретения, препарат также содержит полигидроксиспирт, такой как пропиленгликоль.
Подходящие пропелленты известны специалистам, и ими являются, например, замещенные галогеном углеводороды, например, фтор-замещенные метаны, этаны, пропаны, бутаны, циклопропаны или циклобутаны, а в частности, 1,1,1,2-тетрафторэтан (HFA134a) и 1,1,1,2,3,3,3-гептафторпропан (HFA227) или их смеси.
В одном из вариантов осуществления изобретения, препарат содержит микронизированный рапамицин, этанол, подходящий пропеллент, такой как HFA 134a, HFA 227 или или смесь подходящих пропеллентов, и, необязательно, одно или более поверхностно-активных веществ. В одном из вариантов осуществления изобретения, препарат также содержит замасливатель.
В одном из вариантов осуществления изобретения, препарат содержит рапамицин, пропеллент и растительное масло. В одном из аспектов изобретения, препарат не содержит добавок или поверхностно-активных веществ. Так, например, препарат не содержит этанола, полигидроксиспирта (например, пропиленгликоля) или поверхностно-активного вещества (например, сорбитантриолеата, сорбитанмоноолеата или олеиновой кислоты).
В одном из вариантов осуществления изобретения, пропеллент-содержащий препарат включает сжатый воздух, диоксид углерода, азот или ожиженный пропеллент, выбранный из группы, состоящей из н-пропана, н-бутана, изобутана или их смесей, или 1,1,1,2-тетрафторэтана (HFA134a) и 1,1,1,2,3,3,3-гептафторпропана (HFA227) или их смесей, в присутствии или в отсутствии полярного сорастворителя, такого как спирт. Композиция может представлять собой раствор или суспензию. В случае суспензий, частицы лекарственного средства имеют диаметр от 0,1 до 10 микрон и средний диаметр менее, чем 3,5 микрон.
Пропеллент-содержащий препарат получают известными методами, например, путем мокрого помола крупнозернистого рапамицина и, необязательно, добавки, содержащейся в жидком пропелленте, под давлением окружающей среды или под высоким давлении. В некоторых вариантах осуществления изобретения, добавкой является поверхностно-активное вещество, которое служит для предотвращения агрегации (спекания или кристаллизации), и, тем самым, для обеспечения подачи равномерной дозы и (или альтернативно) нужной фракции тонкодисперсных частиц (FPF). В одном из аспектов изобретения, поверхностно-активное вещество выбирают из сорбитантриолеата, сорбитанмоноолеата или олеиновой кислоты. Альтернативно, сухие порошки, содержащие частицы лекарственного средства, получают путем сушки распылением или лиофилизации водных дисперсий частиц лекарственного средства, как обсуждается выше, и полученные порошки диспергируют в подходящие пропелленты. используемые в стандартных ингаляторах с дозатором, работающих под давлением (pMDI). В одном из вариантов осуществления изобретения, устройствм для ингаляции является Respimat™.
В одном из вариантов осуществления изобретения, пропеллент-содержащие аэрозольные рапамициновые препараты согласно изобретению являются стабильными, то есть, в них не наблюдается увеличение размера частиц или изменение кристаллической морфологии рапамицина в течение длительного периода времени.
Способ получения стерильных единичных лекарственных форм
В одном из вариантов осуществления изобретения, композициями согласно изобретению являются стерильные композиции. В одном из вариантов осуществления изобретения, стерильными композициями являются стерильные единичные лекарственные формы. В одном из вариантов осуществления изобретения, стерильной единичной лекарственной формой является капсула, подходящая для ее использования в аэрозольном ингаляторе.
В одном из вариантов осуществления изобретения, готовую композицию стерилизуют в закрытом контейнере путем нагревания, например, автоклавирования или облучения. В одном из вариантов осуществления изобретения, части компонентов композиции сначала стерилизуют подходящим способом, включая стерильную фильтрацию жидких компонентов и облучение или автоклавирование твердых веществ или жидкостей, где указанный способ также включает поддержание стерильности стерильных компонентов путем их упаковки в герметичные контейнеры, объединение компонентов в сосуде для смешивания в соответствующих пропорциях, и заполнение контейнера с крышкой полученным продуктом, где все эти процедуры проводят в асептических условиях. Этот способ имеет тот недостаток, что он является слишком дорогостоящим и требует проведения трудоемких процедур обработки в асептических условиях. В соответствии с этим, такой способ применяется, главным образом, для обработки крупнодисперсных суспензий или коллоидных дисперсий, липосомных препаратов или эмульсий, которые не могут быть пропущены через субмикронный фильтр для стерилизации. И наконец, в одном из вариантов осуществления изобретения, готовую композицию подвергают стерильной фильтрации через субмикронный фильтр, а предпочтительно, через фильтр 0,2 микрона. В одном из вариантов осуществления изобретения, композициями согласно изобретению являются однофазные водные растворы, стерилизованные методом стерилизации на фильтре. В противоположность этому, эмульсии и липосомные препараты обычно не являются достаточно стабильными при стерильной фильтарции с большими сдвиговыми усилиями, а поэтому они не являются предпочтительными для использования в данном способе.
В одном из вариантов осуществления изобретения, композициями согласно изобретению являются однофазные водные растворы, которыми заполняют контейнер с крышкой, например, сосуд, изготовленный из полимера, а предпочтительно, полиэтилена, или, альтернативно, в стеклянный сосуд. Автоклавирование и облучение не применяются в том случае, если сосудом является полимерный сосуд, поскольку в данном случае существует высокая вероятность химической нестабильности лекарственного средства и/или наполнителей, присутствующих в препарате, а также в контейнере, что обусловлено образованием нежелательных примесей. В одном из вариантов осуществления изобретения, композициями согласно изобретению стерилизуют методом, который не включает нагревание (автоклавирование) или облучения, а вместо этого включает стерилизацию на фильтре. В соответствии с этим вариантом осуществления изобретения, предпочтительно, чтобы однофазные водные растворы рапамицина были подвергнуты стерилизации на фильтре, имеющем размер пор 0,2 микрона или менее. В одном из вариантов осуществления изобретения, стерильный фильтрат собирают в сосуд для сбора в асептических условиях. В одном из вариантов осуществления изобретения, стерильный фильтрат переносят из сосуда для сбора в контейнер с крышкой в асептических условиях. Контейнером с крышкой, предпочтительно, является полимерный сосуд, предпочтительно, сосуд с единичными дозами, а наиболее предпочтительно, полиэтиленовый сосуд с единичными дозами. В одном из вариантов осуществления изобретения, полимерный сосуд изготавливают путем выдувного формования, а затем сразу, после его заполнния препаратом, подвергают термосварке. Эта технология может также называться технологией «формования-заполнения-сварки» или «формования-заполнения». Такая технология является особенно предпочтительной при использовании композиций согласно изобретению, которые представляют собой однофазные водные растворы рапамицина, поскольку эта технология не требует нагревания или облучения, которые могут приводить к разрушению либо самого лекарственного средства, либо наполнителей для данного препарата, либо самого контейнера с крышкой.
Пульмональное введение и дозы
Настоящее изобретение относится к композициям и способам, применяемым для лечения и профилактики возрастных заболеваний и расстройств у человека, где указанные способы включают введение рапамицина в дыхательные пути, предпочтительно, в легкие, путем ингаляции. Пульмональную доставку, предпочтительно, осуществляют путем ингаляции аэрозоля через ротовую полость и горло в легкие, однако, такая доставка может быть также осуществлена путем ингаляции аэрозоля через нос. Таким образом, в одном из вариантов осуществления изобретения, композицию доставляют интраназально. В другом варианте осуществления изобретения, аэрозоль доставляют перорально.
Композиции и способы согласно изобретению преимущественно применяются для нацеленной доставки терапевтически эффективного количества рапамицина в легкие, но, при этом количество рапамицина в крови и во всех других органах должно снижаться до очень низких или недетектируемых уровней. В одном из вариантов осуществления изобретения, количество рапамицина в разовой дозе описанной здесь композиции в виде сухого порошка составляет приблизительно от 5 до 500 микрограммов или приблизительно от 100 до 300 микрограммов, или приблизительно от 50 до 250 микрограммов. Нацеленная доставка низкой дозы рапамицина непосредственно в легкие с минимальной доставкой в другие органы будет обеспечивать увеличение терапевтического индекса по сравнению с терапевтическим индексом, наблюдаемым при введении пероральных лекарственных форм.
В одном из вариантов осуществления изобретения, введение рапамицина путем ингаляции способами согласно изобретению приводит к увеличению терапевтического индекса рапамицина. В этом контексте, для человека терапевтический индекс представляет собой отношение дозы, дающей терапевтический эффект (ED50), к дозе, продуцирующей токсичность (TD50) у 50% пациентов. Это отношение может быть выражено как TD50/ED50. В одном из вариантов осуществления изобретения, введение рапамицина путем ингаляции способами согласно изобретению приводит к снижению одного или более токсических эффектов, ассоциированных с перорально вводимым рапамицином, и тем самым, к увеличению терапевтического индекса рапамицина.
Настоящее изобретение включает аэрозольные препараты, приготовленные в форме растворов и порошков. В соответствии с этим, рапамицин может быть введен способами согласно изобретению в форме водного аэрозоля, аэрозоля в виде сухого порошка или пропеллент-содержащего аэрозоля.
В одном из вариантов осуществления изобретения, минимальные уровни вводимой дозы рапамицина в крови индивидуума составляют от 0,01 до 0,15 нг/мл, от 0,075 до 0,350 нг/мл, от 0,150 до 0,750 нг/мл, от 0,750 до 1,5 нг/мл или от 1,5 до 5 нг/мл. В одном из вариантов осуществления изобретения, минимальные уровни вводимой дозы рапамицина в крови индивидуума составляют менее, чем 5 нг/мл, менее, чем 2 нг/мл, менее, чем 1 нг/мл, или менее, чем 0,5 нг/мл.
В одном из вариантов осуществления изобретения, вводимая доза рапамицина является достаточной для достижения концентрации рапамицина в ткани легких в пределах от 1 нг/г до 1 мкг/г, а предпочтительно, приблизительно от 5 нг/г до 100 нг/г, приблизительно от 5 нг/г до приблизительно 20 нг/г или приблизительно от 5 нг/г до 30 нг/г.
В одном из вариантов осуществления изобретения, вводимая доза рапамицина составляет от 5 до 100 микрограммов, от 20 до 100 микрограммов, от 20 до 250 микрограммов, от 50 до 500 микрограммов (от 0,05 до 0,5 миллиграммов), от 250 до 1000 микрограммов (от 0,25 до 1 миллиграммов) или от 500 до 2000 микрограммов (от 0,5 до 2 миллиграммов). В одном из вариантов осуществления изобретения, количество вводимого рапамицина составляет менее, чем 500 микрограммов, менее, чем 100 микрограммов, менее, чем 50 микрограммов, менее, чем 20 микрограммов, или менее, чем 10 микрограммов. Предпочтительно, количество вводимого рапамицина составляет менее, чем 0,5 миллиграмма, или менее, чем 0,25 миллиграмма.
В одном из вариантов осуществления изобретения, рапамицин вводят один раз в день.
В одном из вариантов осуществления изобретения, общая суточная доза рапамицина составляет в пределах от 5 до 100 микрограммов, от 20 до 250 микрограммов, от 50 до 500 микрограммов (от 0,05 до 0,5 миллиграммов), от 250 до 1000 микрограммов (от 0,5 до 1 миллиграммов) или от 500 до 2000 микрограммов (от 0,5 до 2 миллиграммов). В одном из вариантов осуществления изобретения, общая суточная доза рапамицина составляет в пределах менее, чем 500 микрограммов, менее, чем 100 микрограммов, менее, чем 50 микрограммов, менее, чем 20 микрограммов, или менее, чем 10 микрограммов. В одном из вариантов осуществления изобретения, общая суточная доза рапамицина, вводимого индивидууму, составляет в пределах менее, чем 0,5 миллиграммов или менее, чем 0,25 миллиграмма в день.
В одном из вариантов осуществления изобретения, композицию согласно изобретению вводят индивидууму один раз в день. В одном из вариантов осуществления изобретения, композицию согласно изобретению вводят два или три раза в день. Предпочтительно, композицию вводят один или два раза в день или реже, чем один раз в день.
В одном из вариантов осуществления изобретения, способы согласно изобретению включают введение рапамицина в легкие в комбинации с одним или более дополнительными терапевтическими средствами. Один или более дополнительных агентов и рапамицин могут быть введены одним и тем же способом или различными способами. Так, например, агент может быть введен путем ингаляции, интраназально, перорально или внутривенно.
В одном из вариантов осуществления изобретения, способы согласно изобретению включают введение рапамицина в легкие в комбинации с одним или более дополнительными курсами терапии.
В некоторых вариантах осуществления изобретения, способы включают пульмональное введение композиции согласно изобретению в качестве первичной терапии. В других вариантах осуществления изобретения, введение композиции согласно изобретению представляет собой адъювантную терапию. В любом случае, способы согласно изобретению включают введение композиции согласно изобретению в комбинации с одним или более дополнительными курсами терапии, проводимыми для лечения заболевания или расстройства. Термины «терапия» и «терапии» означают любой метод, протокол и/или агент, которые могут быть применены для предупреждения, лечения, терапии или замедления прогрессирования заболевания или расстройства или одного или более его симптомов.
Предпочтительно, введение фармацевтической композиции, содержащей рапамицин или его пролекарство или производное, способами согласно изобретению в комбинации с проведением одного или более дополнительных курсов лечения будет приводить к вырабатыванию синергического ответа у индивидуума, страдающего таким заболеванием или расстройством. В этом контексте, термин «синергический» означает, что эффективность комбинации превышает аддитивные эффекты, наблюдаемые при проведенни любого одного из этих курсов лечения. В одном из вариантов осуществления изобретения, синергический эффект комбинированной терапии рапамицином согласно изобретению позволяет использовать более низкие дозы по меньшей мере одного терапевтического средства в данной комбинации и/или вводить их реже, чем дозы отдельно взятого терапевтического средства. В другом варианте осуществления изобретения, синергический эффект проявляется полным отсутствием или снижением побочных или нежелательных эффектов, ассоциированных с применением любой отдельно проводимой терапии, включенной в данную комбинированную терапию.
Доставка с помощью аэрозольного ингалятора
В одном из вариантов осуществления изобретения, рапамицин приготавливают в форме водного раствора, подходящего для его распыления с помощью аэрозольного ингалятора. В случае использования водных и других несжиженных жидких систем, для распыления препаратов применяются различные аэрозольные ингаляторы (включая аэрозольные ингаляторы небольшого объема). Аэрозольные ингаляторы, управляемые компрессором, работают на основе струйной технологии, которая предусматривает использование сжатого воздуха для получения жидкого аэрозоля. Такие устройства являются коммерчески доступными и поставляются, например, компаниями Healthdyne Technologies, Inc.; Invacare, Inc.; Mountain Medical Equipment, Inc.; Pari Respiratory, Inc.; Mada Medical, Inc.; Puritan-Bennet; Schuco, Inc., DeVilbiss Health Care, Inc.; и Hospitak, Inc. Ультразвуковые аэрозольные ингаляторы работают на основе механической энергии вибрации пьезоэлектрического кристалла, генерирующего вдыхаемые жидкие капельки, и эти аэрозольные ингаляторы поставляются, например, компаниями Omron Healthcare, Inc. и DeVilbiss Health Care, Inc. Аэрозольным ингалятором может быть, например, стандартный пневматический аэрозольный ингалятор, такой как воздушный струйный ингалятор или ультразвуковой аэрозольный ингалятор, который может содержать, например, от 1 до 50 мл, а обычно 1-10 мл препарата в виде раствора.
В одном из вариантов осуществления изобретения, препарат в виде водного раствора согласно изобретению адаптируют для его введения с помощью аэрозольного ингалятора, содержащего вибрирующую или стационарную сетку. Такими устройствами являются, например, устройства AERx® (Aradigm), RESPIMAT® (Boehringer Ingelheim), I-Neb® (Philips) или MicroAire® (Omron), в которых раствор лекарственного средства выталкивается поршнем или посредством пневматического давления или с помощью пьезоэлектрического кристалла через отверствие или сетку. Альтернативно, раствор может подаваться насосом через вибрационную сетку ингалятора, такого как E-Flow® (Pari) или Aeroneb® Go (Aerogen). Эти устройства обеспечивают доставку гораздо меньших распыляемых объемов, например, от 10 до 100 мкл, и с большей эффективностью, чем это может быть осуществлено с помощью стандартных аэрозольных ингаляторов.
Доставка сухого порошка
В одном из вариантов осуществления изобретения, композиции в виде сухого порошка согласно изобретению доставляют с помощью устройства для ингаляции сухих порошков (DPI) без пропеллента. В одном из вариантов осуществления изобретения, порошок содержится в желатиновых или в пластиковых капсулах или в блистерных упаковках, подходящих для использования в устройстве DPI. В одном из вариантов осуществления изобретения, порошок поставляется в форме единичной лекарственной форме с дозой от 5 мг до 100 мг порошка на капсулу. В другом варианте осуществления изобретения, сухой порошок содержится в резервуаре устройства для ингаляции сухих порошков с многократными дозами. В одном из вариантов осуществления изобретения, устройство для ингаляции включает аэрозольный сосуд, снабженный клапаном, адаптированным для доставки отмеренной дозы, такой как 10-100 мкл, например, 25-50 мкл композиции, то есть, устройство, известное как ингалятор с дозатором.
В одном из вариантов осуществления изобретения, устройство DPI представляет собой устройство, в котором используется блистерная упаковка, такое как GyroHaler® или OmniHaler® (оба от Vectura); устройство резервуарного типа, такое как Clickhaler® или Duohaler® (Vectura), и ингалятор ARCUS® (Civitas Therapeutics). В одном из вариантов осуществления изобретения, устройство DPI выбрано из Pulmatrix™, Hovione Twincaps и XCaps™. В одном из вариантов осуществления изобретения, устройство выбрано из группы, состоящей из XCaps, Plastiape® RS01 Model 7 и Plastiape® RS00 Model 8.
В одном из вариантов осуществления изобретения, устройство DPI выбрано из группы, состоящей из Accuhaler®, Aerolizer®, Plastiape® RS01 Model 7, Plastiape® RS00 Model 8, ConixTM, Rotahaler®, TwinCaps®, XCaps®, FlowCaps®, Turbuhaler®, NextHaler®, CycloHaler®, Revolizer TM, Diskhaler®, Diskus®, Spinhaler, Handihaler®, ингалятора для микродоз, GyroHaler®, OmniHaler®, Clickhaler®, или Duohaler® (Vectura), или ингалятора, подающего воздух для вдыхания ARCUS® (Civitas Therapeutics).
В одном из вариантов осуществления изобретения, устройство DPI выбрано из группы, состоящей из Arcus™, Aspirair™, Axahaler™, Breezhaler™, Clickhaler™, Conix Dry™, Cricket™, Dreamboat™, Genuair™, Gemini™, Inspiromatic™, iSPERSE™, MicroDose™, Next DPI™, Prohaler™, Pulmojet™, Pulvinal™, Solis™, Taifun™, Taper Dry™, Trivai™, Novolizer™, Podhaler™, Skyehaler™, Spiromax™, Twincaps/Flowcaps™ и Turbuhaler™. В одном из вариантов осуществления изобретения, устройство DPI адаптируют для доставки сухого порошка из капсулы или блистерной упаковки, содержащей единичную дозу сухого порошка, или устройство для ингаляции сухого порошка многократными дозами адаптируют для доставки, например, 5-25 мг сухого порошка за одно включение.
Устройство pMDI
В другом варианте осуществления изобретения, рапамицин доставляется в форме аэрозольных частиц из контейнера или дозатора, работающего под давлением и содержащего описанный выше подходящий пропеллент в комбинации с пропеллент-содержащими препаратами. В одном из вариантов осуществления изобретения, ингалятором является индуцируемый пропеллентом ингалятор, такой как устройство pMDI, которое высвобождает отмеренную дозу рапамицина после каждого включения этого устройства. Типичное устройство pMDI включает канистру, содержащую лекарственное средство, клапан, дозирующий лекарственное средство, и мундштук. В одном из аспектов этого варианта осуществления изобретения, рапамицин присутствует в пропелленте в виде суспензии. В контексте этого варианта осуществления изобретения, рапамицин приготавливают в виде тонкодисперсного порошка, суспендированного в ожиженном пропелленте или в смеси пропеллентов. Затем, суспензию хранят в герметично закрытой канистре под давлением, достаточным для поддержания пропеллента в жидкой форме. В другом варианте осуществления изобретения, рапамицин приготавливают в виде раствора. В контексте этого варианта осуществления изобретения, рапамицин солюбилизируют в ожиженном пропелленте или в смеси пропеллентов. В одном из вариантов осуществления изобретения, препарат также содержит стабилизатор в количестве, подходящем для предотвращения осаждения, загущения или флокулляции препарата в течение периода времени, достаточного для получения репродуцируемой дозы рапамицина после встряхивания этого препарата. Стабилизатор может присутствовать в избыточном количестве, составляющем приблизительно от 10 частей по массе и приблизительно до 5000 частей по массе из расчета одной миллионной доли на общую массу аэрозольного препарата. В одном из вариантов осуществления изобретения, жидким носителем является 1,1,1,2-тетрафторэтан, 1,1,1,2,3,3,3-гептафторпропан или их смесь. В другом варианте осуществления изобретения, жидким носителем является углеводород (например, н-бутан, пропан, изопентан или их смесь). Композиция может также содержать сорастворитель (например, этанол или другой подходящий сорастворитель).
В одном из вариантов способов согласно изобретению, аэрозольный препарат, содержащий рапамицин, также включает дополнительное лекарственное средство.
Добавки
Аэрозольные композиции согласно изобретению могут содержать, помимо любого носителя или разбавителя (такого как лактоза или маннит), присутствующего в препарате, одну или более добавок. В одном из вариантов осуществления изобретения, одна или более добавок включают одно или более поверхностно-активных веществ или состоят из них. Поверхностно-активные вещества обычно имеют одну или более длинных алифатических цепей, таких как жирные кислоты, что позволяет этим соединениям встраиваться непосредственно в липидные структуры клеток и, тем самым, усиливать пенетрацию и абсорбцию лекарственного средства. Эмпирическим параметром, обычно испольуемым для характеризации относительной гидрофильности и гидрофобности поверхностно-активных веществ, является гидрофильно-липофильный баланс (величина «ГЛБ»). Поверхностно-активные вещества с более низкими величинами ГЛБ являются более гидрофобными и имеют более высокую растворимость в маслах, а поверхностно-активные вещества с более высокими величинами ГЛБ являются более гидрофильными и имеют более высокую растворимость в водных растворах. Таким образом, гидрофильные поверхностно-активные вещества обычно рассматриваются как соединения, имеющие величину ГЛБ приблизительно более, чем 10, а гидрофобные поверхностно-активные вещества обычно рассматриваются как соединения, имеющие величину ГЛБ приблизительно менее, чем 10. Однако, эти величины ГЛБ рассматриваются просто в качестве примера, поскольку для многих поверхностно-активных веществ, величины ГЛБ могут отличаться приблизительно на 8 единиц, в зависимости от выбранного эмпирического метода, применяемого для определения величины ГЛБ.
Поверхностно-активными веществами, используемыми в аэрозольных композициях согласно изобретению, являются полиэтиленгликоль (ПЭГ)-жирные кислоты и сложные моно- и диэфиры ПЭГ-жирной кислоты, сложные эфиры ПЭГ-глицерина, продукты переэтерификации спиртов и масел, полиглицерилжирные кислоты, сложные эфиры пропиленгликоля и жирной кислоты, стирол и его производные, сложные эфиры пропиленгликоля, сорбитана и жирной кислоты, алкиловые эфиры полиэтиленгликоля, сахар и его производные, полиэтиленгликоль-алкилфенолы, блоксополимеры полиоксиэтилена и полиоксипропилена (POE-POP), сложные эфиры сорбитана и жирной кислоты, ионные поверхностно-активные вещества, жирорастворимые витамины и их соли, водорастворимые витамины и их амфифильные производные, аминокислоты и их соли и органические кислоты и их сложные эфиры и ангидриды. Каждое их этих соединений более подробно описано ниже.
Сложные эфиры ПЭГ и жирной кислоты
Хотя сам полиэтиленгликоль (ПЭГ) не обладает функцией поверхностно-активного вещества, однако, различные сложные эфиры ПЭГ-жирной кислоты обладают ценными свойствами поверхностно-активных веществ. В вариантах осуществления настоящего изобретения, наиболее подходящими являются моноэфиры ПЭГ-жирной кислоты, сложные эфиры лауриновой кислоты, олеиновой кислоты и стеариновой кислоты. Предпочтительными гидрофильными поверхностно-активными веществами являются лаурат ПЭГ-8, олеат ПЭГ-8, стеарат ПЭГ-8, олеат ПЭГ-9, лаурат ПЭГ-10, олеат ПЭГ-10, лаурат ПЭГ-12, олеат ПЭГ-12, олеат ПЭГ-15, лаурат ПЭГ-20 и олеат ПЭГ-20. Их величины ГЛБ составляют в пределах 4-20.
Поверхностно-активными веществами, также подходящими для использования в композициях вариантов осуществления изобретения, являются сложные диэфиры полиэтиленгликоля и жирной кислоты. Наиболее предпочтительными гидрофильными поверхностно-активными веществами являются дилаурат ПЭГ-20, диолеат ПЭГ-20, дистеарат ПЭГ-20, дилаурат ПЭГ-32 и диолеат ПЭГ-32. Их величины ГЛБ составляют в пределах 5-15.
В общих чертах, в вариантах осуществления настоящего изобретения также могут быть использованы смеси поверхностно-активных веществ, включая смеси двух или более коммерчески доступных поверхностно-активных веществ, а также смеси поверхностно-активных веществ и другой добавки или других добавок. Некоторые сложные эфиры ПЭГ-жирной кислоты имеются в продаже как их смеси и моно- и диэфиры.
Сложные эфиры полиэтиленгликоля, глицерина и жирной кислоты
Предпочтительными гидрофильными поверхностно-активными веществами являются глицериллаурат ПЭГ-20, глицериллаурат ПЭГ-30 глицериллаурат, глицериллаурат ПЭГ-40, глицерилолеат ПЭГ-20 и глицерилолеат ПЭГ-30.
Продукты переэтерификации спиртов и масел
Различные поверхностно-активные вещества, имеющие различные степени гидрофобности или гидрофильности, могут быть получены посредством реакции взаимодействия спиртов или многоатомных спиртов с различными природными и/или гидрогенизированными маслами. Наиболее часто используемыми маслами являются касторовое масло или гидрогенизированное касторовое масло, пищевое растительное масло, такое как кукурузное масло, оливковое масло, арахисовое масло, пальмовое масло, масло из косточек абрикоса или миндальное масло. Предпочтительными спиртами являются глицерин, пропиленгликоль, этиленгликоль, полиэтиленгликоль, сорбит и пентаэритрит. Среди этих поверхностно-активных веществ, которые представляют собой продукты переэтерификации спиртов и масел, предпочтительными гидрофильными поверхностно-активными веществами являются касторовое масло на основе ПЭГ-35 (Incrocas-35), гидрогенизированное касторовое масло на основе ПЭГ-40 (Cremophor RH 40), триолеат ПЭГ-25 (TAGAT.RTM. TO), глицериды ПЭГ-60 кукурузы (Crovol M70), миндальное масло на основе ПЭГ-60 (Crovol A70), пальмовое масло на основе ПЭГ-40 (Crovol PK70), касторовое масло на основе ПЭГ-50 (Emalex C-50), гидрогенизированное касторовое масло на основе ПЭГ-50 (Emalex HC-50), каприловые/каприновые глицериды ПЭГ-8 (Labrasol) и каприловые/каприновые глицериды ПЭГ-6 (Softigen 767). Предпочтительными гидрофобными поверхностно-активными веществами этого класса являются гидрогенизированное касторовое масло на основе ПЭГ-5, гидрогенизированное касторовое масло на основе ПЭГ-7, гидрогенизированное касторовое масло на основе ПЭГ-9, кукурузное масло на основе ПЭГ-6 (Labrafil.RTM. M 2125 CS), миндальное масло на основе ПЭГ-6 (Labrafil.RTM. M 1966 CS), масло из косточек абрикоса на основе ПЭГ-6 (Labrafil.RTM. M 1944 CS), оливковое масло на основе ПЭГ-6 (Labrafil.RTM. M 1980 CS), арахисовое масло на основе ПЭГ-6 (Labrafil.RTM. M 1969 CS), гидрогенизированное пальмовое масло на основе ПЭГ-6 (Labrafil.RTM. M 2130 BS), пальмовое масло на основе ПЭГ-6 (Labrafil.RTM. M 2130 CS), ПЭГ-6-триолеин (Labrafil.RTM.b M 2735 CS), кукурузное масло на основе ПЭГ-8 (Labrafil.RTM. WL 2609 BS), глицериды ПЭГ-20 кукурузы (Crovol M40) и глицериды ПЭГ-20 миндаля (Crovol A40).
Полиглицерилжирные кислоты
Подходящими поверхностно-активными веществами, используемыми в вариантах осуществления изобретения, также являются сложные эфиры полиглицерина и жирных кислот. Среди сложных эфиров полиглицерилжирных кислот, предпочтительными гидрофобными поверхностно-активными веществами являются полиглицерилолеат (Plurol Oleique), полиглицерил-2-диолеат (Nikkol DGDO), полиглицерил-10-триолеат, полиглицерилстеарат, полиглицериллаурат, полиглицерилмиристат, полиглицерилпальмитат и полиглицериллинолеат. Предпочтительными гидрофильными поверхностно-активными веществами являются полиглицерил-10-лаурат (Nikkol Decaglyn 1-L), полиглицерил-10-олеат (Nikkol Decaglyn 1-0), полиглицерил-10-моно,диолеат (Caprol.RTM. ПЭГ 860), полиглицерил-10-стеарат, полиглицерил-10-лаурат, полиглицерил-10-миристат, полиглицерил-10-пальмитат, полиглицерил-10-линолеат, полиглицерил-6-стеарат, полиглицерил-6-лаурат, полиглицерил-6-миристат, полиглицерил-6- пальмитат и полиглицерил-6-линолеат. Предпочтительными поверхностно-активными веществами также являются полиглицерилполирицинолеаты (Polymuls).
Сложные эфиры пропиленгликоля и жирной кислоты
Подходящими поверхностно-активными веществами, используемыми в вариантах осуществления изобретения, также являются сложные эфиры пропиленгликоля и жирных кислот. Предпочтительными гидрофобными поверхностно-активными веществами этого класса являются монолаурат пропиленгликоля (Lauroglycol FCC), рицинолеат пропиленгликоля (Propymuls), моноолеат пропиленгликоля (Myverol P-06), дикаприлат/дикапрат пропиленгликоля (Captex.RTM. 200) и диоктаноат пропиленгликоля (Captex.RTM. 800).
Стирол и его производные
Подходящими поверхностно-активными веществами, используемыми в вариантах осуществления изобретения, являются стиролы и производные стиролов. Предпочтительными производными являются производные полиэтиленгликоля. Предпочтительным поверхностно-активным веществом этого класса является эфир ПЭГ-24 и холестерина (Solulan C-24).
Сложные эфиры пропиленгликоля, сорбитана и жирной кислоты
Существует ряд сложных эфиров ПЭГ-сорбитана и жирной кислоты, и эти сложные эфиры являются подходящими для их использования в качестве поверхностно-активных веществ в вариантах осуществления изобретения. Среди сложных эфиров ПЭГ-сорбитана и жирной кислоты, предпочтительными поверхностно-активными веществами являются монолаурат ПЭГ-20-сорбитана (твин-20), монопальмитат ПЭГ-20-сорбитана (твин-40), моностеарат ПЭГ-20-сорбитана (твин-60) и моноолеат ПЭГ-20-сорбитана (твин-80).
Алкиловые эфиры полиэтиленгликоля
Подходящими поверхностно-активными веществами, используемыми в вариантах осуществления изобретения, являются эфиры полиэтиленгликоля и алкиловых спиртов. Предпочтительными эфирами являются олеиловый эфир ПЭГ-3 (Volpo 3) и лауриловый эфир ПЭГ-4 (Brij 30).
Сахар и его производные
Подходящими поверхностно-активными веществами, используемыми в вариантах осуществления изобретения, являются производные сахара. Предпочтительным поверхностно-активным веществом этого класса является монопальмитат сахарозы, монолаурат сахарозы, деканоил-N-метилглюкамид, н-децил-β-D-глюкопиранозид, н-децил-β-D-мальтопиранозид, н-додецил-β-D-глюкопиранозид, н-додецил-β-D-мальтозид, гептаноил-N-метилглюкамид, н-гептил-β-D-глюкопиранозид, н-гептил-β-D-тиоглюкозид, н-гексил-β-D-глюкопиранозид, нонаноил-N-метилглюкамид, н-нонил-β-D-глюкопиранозид, октаноил-N-метилглюкамид, н-октил-β-D-глюкопиранозид и октил-β-D-тиоглюкопиранозид.
Полиэтиленгликоль-алкилфенолы
Некоторыми ПЭГ-алкилфеноловыми поверхностно-активными веществами, используемыми в вариантах осуществления изобретения, являются эфир ПЭГ-10-100-нонилфенола и эфир ПЭГ-15-100-октилфенола, тилоксапол, октоксинол и ноноксинол.
Блоксополимеры полиоксиэтилена и полиоксипропилена (POE-POP)
Блоксополимеры полиоксиэтилена и полиоксипропилена (POE-POP) представляют собой уникальный класс полимерных поверхностно-активных веществ. Уникальная структура этих поверхностно-активных веществ, состоящая из гидрофильных групп POE и гидрофобных групп POP в хорошо определенных отношениях и положениях, образует широкий ряд поверхностно-активных веществ, подходящих для их использования в вариантах осуществления настоящего изобретения. Эти поверхностно-активные вещества имеются в продаже под различными торговыми знаками, включая поверхностно-активные вещества серии Synperonic PE (ICI); серии Pluronic.RTM. (BASF), Emkalyx, Lutrol (BASF), Supronic, Monolan, Pluracare и Plurodac. Эти полимеры известны под общим название «полоксамеры» (CAS 9003-11-6). Эти полимеры имеют формулы: HO(C2H4O)a(C3H6O)b(C2H4O)aH, где «a» и «b» означают число полиоксиэтиленовых и полиоксипропиленовых звеньев, соответственно.
Предпочтительными гидрофильными поверхностно-активными веществами этого класса являются полоксамеры 108, 188, 217, 238, 288, 338 и 407. Предпочтительными гидрофобными поверхностно-активными веществами этого класса являются полоксамеры 124, 182, 183, 212, 331 и 335.
Сложные эфиры сорбитана и жирных кислот
Сложные эфиры сорбитана и жирных кислот являются подходящими поверхностно-активными веществами, используемыми в вариантах осуществления настоящего изобретения. Среди этих эфиров, предпочтительными гидрофобными поверхностно-активными веществами являются монолаурат сорбитана (Arlacel 20), монопальмитат сорбитана (Span-40), моноолеат сорбитана (Span-80) и моностеарат сорбитана.
Монопальмитат сорбитана, то есть, амфифильное производное витамина С (которое обладает активностью витамина С), может выполнять две важных функции в системах солюбилизации. Во-первых, он имеет активные полярные группы, которые могут модулировать микроокружение. Эти полярные группы являются такми же, как и группы самого витамина С (аскорбиновой кислоты), то есть, одного из наиболее распространенных водорастворимых соединений органического твердого вещества: а именно, аскорбиновая кислота растворяется в воде приблизительно на 30 масс.% (то есть, ее растворимость является почти такой же, как растворимость, например, хлорида натрия). И во-вторых, по мере увеличения pH, фракция аскорбилпальмитата превращается в более растворимую соль, такую как аскорбилпальмитат натрия.
Ионные поверхностно-активные вещества
Ионные поверхностно-активные вещества, включая катионные, анионные и цвиттерионные поверхностно-активные вещества, являются подходящими гидрофильными поверхностно-активными веществами, используемыми в вариантах осуществления настоящего изобретения. Предпочтительными ионными поверхностно-активными веществами являются четвертичные соли аммония, соли жирных кислот и соли желчных кислот. В частности, предпочтительными ионными поверхностно-активными веществами являются хлорид бензалкония, хлорид бензэтония, хлорид цетилпиридиния, додецилбромид триметиламмония, додецилсульфаты натрия, диалкилхлорид метилбензиламмония, хлорид эдрофония, бромид домифена, диалкиловые сложные эфиры натрия и сульфонянтарной кислоты, диоктилсульфосукцинат натрия, холат натрия и таурохолат натрия. Эти четвертичные соли аммония являются предпочтительными добавками. Они могут быть растворены в органических растворителях (таких как этанол, ацетон и толуол) и в воде. Это свойство является особенно ценным для нанесения покрытий в медицинских устройствах, поскольку это упрощает процесс приготовления и нанесения покрытий и сообщает хорошие адгезивные свойства. Не растворимые в воде лекарственные средства обычно растворяются в органических растворителях.
Жирорастворимые витамины и их соли
Витамины A, D, E и K, существующие в различных формах и в формах провитаминов, рассматриваются как жирорастворимые витамины и, кроме того, существует ряд других витаминов и их источников или близкородственных соединений, которые также представляют собой жирорастворимые витамины, имеющие полярные группы и относительно высокие коэффициенты распределения октанола-воды. Давно известно, что соединения этого общего класса являются безопасными и имеют высокое отношение польза-риск, а поэтому они могут быть использованы в качестве добавок в вариантах осуществления настоящего изобретения.
Примерами жирорастворимых производных витаминов и/или их источников, которые могут быть использованы в качестве добавок, являются: альфа-токоферол, бета-токоферол, гамма-токоферол, дельта-токоферол, ацетат токоферола, эргостирол, 1-альфа-гидроксихолекальциферол, витамин D2, витамин D3, альфа-каротин, бета-каротин, гамма-каротин, витамин A, фурсултиамин, метилолрибофлавин, октотиамин, просултиамин, рибофлавин, винтиамол, дигидровитамин K1, диацетат менадиола, дибутират менадиола, дисульфат менадиола, менадиол, витамин K1, оксид витамина K1, витамины K2 и витамин K-S(II). К соединениям этого типа также принадлежит фолиевая кислота, и хотя она растворяется в воде при физиологическом pH, она может присутствовать в форме свободной кислоты. Другие производные жирорастворимых витаминов, используемых в вариантах осуществления настоящего изобретения, могут быть легко получены путем проведения хорошо известных химических реакций взаимодействия с гидрофидльными молекулами.
Водорастворимые витамины и их амфифильные производные
Витамины B, C, U, пантотеновая кислота, фолиевая кислота и некоторые витамины/провитамины, родственные менадиону, присутствуют во многих различных формах и рассматриваются как водорастворимые витамины. Эти соединения могут быть также конъюгированы или могут образовывать комплексы с гидрофобными группами или с поливалентными ионами с образованием амфифильных форм, которые имеют относительно высокие коэффициенты распределения октанола-воды и полярные группы. И в этом случае, такие соединения могут иметь низкую токсичность и высокое отношение польза-риск, а поэтому они могут быть использованы в качестве добавок в вариантах осуществления настоящего изобретения. В настоящем изобретении, в качестве добавок могут быть также использованы их соли. Примерами водорастворимых витаминов и их производных являются, но не ограничиваются ими, ацетиамин, бенфотиамин, пантотеновая кислота, цетотиамин, циклотиамин, декспантенол, ниацинамид, никотиновая кислота, 5-фосфат пиридоксаля, аскорбат никотинамида, рибофлавин, фосфат рибофлавина, тиамин, фолиевая кислота, дифосфат менадиола, бисульфит менадиона-натрия, менадоксим, витамин B12, витамин K5, витамин K6, витамин K6 и витамин U. Кроме того, как упоминалось выше, фолиевая кислота имеет широкий интервал pH, включая физиологический pH, растворяется в воде и может использоваться в качестве соли.
Соединения, в которых присутствует аминогруппа или другая основная группа, могут быть легко модифицированы путем проведения простой реакции взаимодействия кислоты с основанием, где указанная кислота содержит гидрофобную группу, например, жирная кислота (а в частности, лауриновая, олеиновая, миристиновая, пальмитиновая, стеариновая или 2-этилгексановая кислота), слаборастворимая аминокислота, бензойная кислота, салициловая кислота или кислотный жирорастворимый витамин (такой как рибофлавин). Другие соединения могут быть получены путем проведения реакции взаимодействия такой кислоты с другой группой на витамине, такой как гидрокисльная группа, с образованием связи, такой как сложноэфирная связь и т.п. Производные водорастворимого витамина, содержащего кислотную группу, могут быть получены путем реакции взаимодействия с реагентом, содержащим гидрофобную группу, таким как стеариламин или рибофлавин, с образованием, например, соединения, которое может быть использовано в вариантах осуществления настоящего изобретения. После проведения реакции связывания пальмитатной цепи с витамином С образуется аскорбилпальмитат.
Аминокислоты и их соли
Другими подходящими добавками, которые могут быть использованы в вариантах осуществления настоящего изобретения, являются аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, цистин, глутаминовая кислота, глутамин, глицин, гистидин, пролин, изолейцин, лейцин, лизин, метионин, фенилаланин, серин, треонин, триптофан, тирозин, валин и их производные.
Некоторые аминокислоты, присутствующие в цвиттерионной форме и/или в солевой форме с одновалентным или с поливалентным ионом, имеют полярные группы и относительно высокие коэффициенты распределения октанола-воды, и могут быть использованы в вариантах осуществления настоящего изобретения. В контексте настоящего описания, термин «слаборастворимая аминокислота» означает аминокислоту, растворимость которой в незабуференной воде составляет приблизительно менее 4% (40 мг/мл). Такими аминокислотами являются цистин, тирозин, триптофан, лейцин, изолейцин, фенилаланин, аспарагин, аспарагиновая кислота, глутаминовая кислота и метионин.
Органические кислоты и их сложные эфиры и ангидриды
В качестве примеров могут служить уксусная кислота и ее ангидрид, бензойная кислота и ее ангидрид, ацетилсалициловая кислота, дифлунизал, 2-гидроксиэтилсалицилат, диангидрид диэтилентриаминпентауксусной кислоты, диангидрид этилендиаминтетрауксусной кислоты, малеиновая кислота и ее ангидрид, янтарная кислота и ее ангидрид, ангидрид дигликолевой кислоты, ангидрид глутаровой кислоты, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, щавелевая кислота, аспарагиновая кислота, никотиновая кислота, 2-пирролидон-5-карбоновая кислота и 2-пирролидон.
Эти сложные эфиры и ангидриды растворяются в органических растворителях, таких как этанол, ацетон, метилэтилкетон, этилацетат. Не растворимые в воде лекарственные средства могут быть растворены в органическом растворителе вместе с этими сложными эфирами и ангидридами, а затем, они могут быть легко нанесены на медицинское устройство с последующим их гидролизом при высоких значениях рН. Гидролизованными ангидридами или сложными эфирами являются кислоты или спирты, которые растворяются в воде и могут эффективно доставлять лекарственные средства из данного устройства в стенки сосуда.
Примеры
Настоящее изобретение также описано в нижеследующих примерах, которые не должны рассматриваться как ограничение объема изобретения, сформулированного в формуле изобретения.
Пример 1: Водный аэрозольный препарат
Репрезентативный водный препарат рапамицина получали с использованием следующих компонентов.
Процедура смешивания: В 1000-миллилитровой волюметрической колбе из спеченного стекла смешивали 250 г пропиленгликоля с 250 г этанола до получения однородной смеси. Эту смесь растворяли сначала в 100 мг рапамицина, а затем в 20 мг полисорбата 80 в растворе пропиленгликоля и этанола. В 1000-миллилитровую волюметрическую колбу добавляли воду, и содержимое перемешивали или обрабатывали ультразвуком до тех пор, пока смесь не становилась однородной и пока не растворялся весь рапамицин. Затем смесь хранили в темноте при регулируемой температуре.
Пример 2: Препарат в виде сухого порошка
Партии 06RP68.HQ00008 и 06RP68.HQ00009. Каждый из этих двух препаратов представляет собой смесь микронизированных частиц лекарственного средства (рапамицина), диспергированных на поверхности частиц лактозного носителя. Конечная композиция каждой партии содержит 1% (масс/масс) частиц лекарственного средства, имеющих средний диаметр приблизительно 2,60 микрон и 3,00 микрон, соответственно. Частицы лекарственного средства, имеющие подходящий размер, получали путем мокрого формования (06RP68.HQ00008) или струйного помола (06RP68.HQ00009), как описано ниже. Хотя в этом примере используется 1% (масс/масс) рапамицин, однако, практически, рапамицин может быть использован в количестве от 0,5 до 20%. Частицы носителя состоят из смеси двух носителей, а именно, Respitose® SV003, присутствующего в количестве 95,5% (масс/масс) и имеющего частицы размером приблизительно от 30 до 100 микрон (эквивалентный сферический диаметр), и Respitose® LH300 (Lactohale 300), присутствующего в количестве 5,5% (масс/масс) и имеющего частицы размером менее, чем 10 микрон (эквивалентный сферический диаметр). После смешивания, смеси анализировали для подтверждения гомогенности и содержания лекарственного средства в количестве 1%.
Для снижения уровня агломерации частиц лекарственного средства и для облегчения распыления этих частиц могут быть включены, но необязательно, некоторые другие наполнители. Необязательными наполнителями являются фосфолипиды, такие как дипальмитилфосфатидилхолин (DPPC) и лецитин, и соли металла и жирной кислоты, такие как стеарат магния. Эти наполнители могут быть нанесены на частицы носителя в массовом отношении наполнителя к крупным частицам носителя, составляющим в пределах от 0,01 до 0,5%.
Заполнение капсулы: 20 миллиграммов порошкообразных смесей партии 06RP68.HQ00008 и партии 06RP68.HQ00009 загружали в HPMC-капсулы размером #3 с получением лекарственного продукта. Желательно, чтобы смеси, предназначенные для загрузки в капсулы размером #3, содержали от 5 до 35 миллиграммов лекарственного средства, и желательно, чтобы из капсулы высвобождалось более, 95% загруженной смеси после запуска устройств Plastiape® RS01 Model 7 или Plastiape® RS00 Model 8 при скорости потока от 60 до 100 литров в минуту.
Пример 3: Определение рапамицина в легких и в крови после его введения мышам C57BL6 путем орофарингеальной аспирации (ОФА) и через пероральный зонд
Это исследование проводили для оценки концентрации рапамицина у самцов мышей C57BL/6 после введения рапамицина в очень высокой конечной дозе, а именно, 1 мг/кг с помощью зонда и путем орофарингеальной аспирации (ОФА). Метод анализа на концентрацию рапамицина в гомогенате крови и легких мышей был разработан на основе жидкостной хроматографии с тандемным масс-спектрометрическим детектированием (ЖХ-МС/МС). Калибровочные кривые рапамицина, построенные с использованием концентраций с тремя повторностями, анализировали на участках кривой между 1 нг/мл и 2000 нг/мл в крови мышей и между 2 нг/мл и 20000 нг/мл в гомогенате мышиных легких. Точность, достоверность и линейность имели ожидаемые пределы.
В пилотных исследованиях, эффективность доставки носителя в легкие посредством орофарингеальной аспирации в объеме 50 мкл на мышь оценивали путем введения красителя голубого Эванса. Присутствие голубого красителя визуально подтверждали только в легких, а отсутствие голубого красителя в желудке указывало на отсутствие доставки рапамицина в желудок при проведении данной процедуры.
Рапамицин вводили самцам мышей C57BL/6 (N=6) через зонд в дозе 1,0 мг/кг либо перорально, либо посредством ОФА. Пероральная доза была приготовлена с использованием фармацевтического жидкого препарата для перорального введения, такого как Rapamune Oral® (Pfizer). Для ОФА, рапамицин получали путем растворения тест-образца в соответствующем объеме этанола с последующим добавлением соответствующего объема воды и получением 10% раствора этанола в концентрации 1 мг рапамицина/мл. Рапамицин вводили 2 группам, состоящим из 6 самцов мышей C57BL/6, посредством ОФА под анестезией изофлураном. Дополнительной группе из 6 мышей вводили только носитель (10% этанол в воде). Через 1 час после введения, группу из 6 мышей, которым вводили рапамицин перорально и посредством ОФА, подвергали эвтаназии, а затем брали кровь посредством сердечной пункции и извлекали легкие. Остальных мышей каждой группы, которой вводили рапамицин или носитель посредством ОФА, наблюдали еще 3 дня. Через 72 часа после аутопсии брали кровь посредством сердечной пункции и извлекали легкие. Через 72 часа после введения дозы, у мышей, обработанных рапамицином или носителем, каких-либо побочных эффектов не наблюдалось.
Концентрацию рапамицина определяли в собранной крови и в гомогенате легких с помощью ЖХ-МС/МС. Через 1 час после введения рапамицина посредством ОФА, концентрация рапамицина в ткани легких в ~6 раз превышала (3794 ± 1259 нг/г ткани) концентрацию рапамицина в крови (641 ± 220 нг/мл). После перорального введения аналогичной дозы рапамицина, концентрации рапамицина в легких и в крови через 1 час составляли 71 ± 43 нг/г и 23 ± 16 нг/мл, соответственно. Концентрации рапамицина в гомогенате легких после ОФА в 53 раза превышали концентрации, измеренные после перорального введения аналогичной высокой дозы (1 мг/кг) рапамицина. Эти данные позволяют предположить, что доставка более низких доз рапамицина в легкие (уровни доз, которые не обеспечивали системного насыщения) давала уровни рапамицина в легких, которые могли быть достигнуты при введении пероральной дозы, но со значительно меньшим уровнем рапамицина в крови, как это наблюдалось при пероральном введении дозы.
Материалы и методы
Тест-соединение: сиролимус (Rapamune, рапамицин) MW 914,172, C51N79NO12, CAS NUMBER: 53123-88-9. Источник (для введения с помощью перорального зонда): Rapamune Oral® (Pfizer) для перорального введения, партия No.: MWGT, объем выдоха: 07/16. Источник (для ОФА): рапамицин (сиролимус) твердый, LC Laboratories, Woburn MA, партия No.: ASW-127, объем выдоха: 12/2023.
Животные: самцы мышей C57BL/6, в возрасте приблизительно 8 недель, полученные из лаборатории Charles River Laboratories, Inc, Raleigh, NC. Животным давали сертифицированный корм для грызунов #5002 и водопроводную воду ad libitum. Алазиз каждой партии корма на уровни питательных веществ и возможные примеси осуществлялся поставщиком под наблюдением руководителя исследований и при постоянной регистации данных исследования. Корм хранили приблизительно при 60-70°F, и срок хранеия этого корма не должен превышать шесть месяцев после даты помола. Мыши содержались (по одной мыши в клетке) в поликарбонатных клетках, которые были снабжены решеткой из нержавеющей стали, поддерживающей бутыль с водой. Клетки для мышей имели размер приблизительно 11,5"×7,5"×5" (с полом в 70 кв. дюймов). Подстилка представляла собой древесную стружку Sani-Chips (P. J. Murphy Forest Products Co.; Montville, NJ). Перед проведением исследований, мышей оставляли для акклиматизации на 5 дней. Перед окончанием карантинного срока, животных осматривали ветеринары или квалифицированный персонал. При этом непрерывно следили за температурой и относительной влажностью в камерах для содержания животных RTI, и эту температуру и относительную влажность регулировали и регистировали с помощью автоматической системы (Siebe/Barber-Colman Network 8000 System with Revision 4.4.1 for Signal® software [Siebe Environmental Controls (SEC)/Barber-Colman Company; Loves Park, IL]). Эксперимент проводили в следующих условиях: при температуре 64-79°F (18°C-26°С) и относительной влажности 30-70%, с 12-часовой сменой для и ночи. В конце срока жизни, мышей подвергали эвтаназии путем введения избыточной дозы диоксида углерода.
Получение химических соединений для тестов: Голубой Эванс получали в концентрации 0,5% масс./об. в стерильной дистиллированной воде. Рапамицин Oral® вводили в пероральной дозе, рекомендованной поставщиком. Рапамицин (в твердом виде) растворяли в этаноле и разводили дистиллированной водой до конечной концентрации 0,5 мг/мл в 10% этаноле.
Дозы: Перед введением дозы, каждое животное взвешивали для определения количества вводимой дозы. Одну дозу вводили через зонд с помощью 100-микролитрового стеклянного шприца (Hamilton, Reno, NV), снабженного закругленной иглой из нержавеющей стали калибра 20-G (Popper & Sons Inc., New Hyde Park, NY). Дозу, вводимую каждому животному, определяли исходя из массы наполненного шприца за вычетом массы пустого шприца. Время введения дозы регистировали. Между введением доз животным делали соответствующие интервалы для забора крови. Лекарственные препараты вводили животным каждой группы в дозах, представленных ниже.
Каждой мыши в группе орофарингеальной аспирации вводили одну дозу рапамицина (50 мкл) под анестезией изофлураном с помощью 100-микролитрового стеклянного шприца (Hamilton, Reno, NV), снабженного закругленной иглой из нержавеющей стали калибра 24-G (Popper & Sons Inc., New Hyde Park, NY). Перед введением дозы, мышей взвешивали и определяли вводимую дозу рапамицина по массе. Каждую мышь анестезировали изофлураном, и ротовую полость оставляли открытой в неподвижном положении. Язык удерживали с одной стороны ротовой полости пинцетом, и дозу медленно вводили в дистальную часть этой ротовой полости. Ноздри прикрывали пальцем для двух вдохов для гарантии аспирации (Rao et al., 2003).
Таблица 1: Краткий протокол исследования
которой
вводили
дозу
животных
Сбор проб крови и образцов легких: По окончании исследования (через 1 или 72 часа после введения дозы), мышей анестезировали путем обработки CO2, и брали кровь посредством сердечной пункции с использованием дикалий-EDTA в качестве антикоагулянта. Ткани легких иссекали и разделяли на правое и левое легкое. Левое легкое использовали для анализа, а правое легкое сразу замораживали в жидком азоте и хранили при -70°C для последующего анализа.
Анализ образцов на рапамицин, проводимый с помощью ЖХ-МС/МС: Метод ЖХ-МС/МС для анализа рапамицина в легких и в крови был разработан на основе метода, опубликованного Wu et al. (2012). Объемы гомогената в крови и легких были, в основном, ниже, чем в опубликованном методе. В качестве внутреннего стандарта использовали триамцинолон.
Гомогенат легких был получен путем гомогенизации взвешенных образцов легких в гомогенизаторе с 2,8-миллиметровыми шарикоподшипниками и с тканью+деионизованной водой (1:3 масс/об) в мельнице SPEX SamplePrep 2010 Geno/Grinder.
Концентрации стандартов располагали так, чтобы каждый стандарт происходил от очередного исходного стандарта. Калибровочную кривую, построенную по шести точкам, каждую с тремя повторностями, использовали для количественной оценки аналита. Для построения кривой использовали модель простой линейной регресиии при взвешивании или без взвешивания. Концентрация, определенная в крови, составляла в пределах 1-2000 нг/мл, а концентрация, определенная в гомогенате легких составляла 2-2000 нг/мл.
Были рассмотрены нижеследующие приемлемые технологичесие параметры аналитического метода; коэффициент детерминации, r2, ≥0,98 для зависимости «концентрация-ответ»; точность ≤±15% (для концентрации выше LOQ) или ≤±20% (для концентрации в LOQ) номинальной величины. r2 составляет более, чем 0,999 во всех анализах.
Тридцать (30) мкл матрицы, 30 мкл заливочного раствора (метанола для контроля и образцов), 10 мкл раствора внутреннего стандарта (в MeOH) и 90 мкл MeOH пипетировали в микроцентрифужные пробирки, быстро перемешивали, а затем центрифугировали в течение 6 минут при 10000 об/мин при ~4°C. Аликвоты (90 мкл) супернатанта переносили в ЖХ-отделение сосуда, а затем анализировали с помощью ЖХ-МС/МС (Таблица 2).
Таблица 2: Метод ЖХ-МС/МС
Сбор данных и регистрация: данные исследования собирали и регистрировали в системе Debra™ версии 5.5.10.72 (Lablogic Systems Ltd., Sheffield, England). Эта система включает данные массы тела животного, вводимую дозу, время введения дозы и время сбора образцов. Вычисления вводимой дозы и определение времени сбора образцов регистрировали в системе Debra™.
Результаты
Анализ на рапамицин: Анализ на рапамицин осуществляли в объеме проб крови и образцов гомогената легких 30 мкл. Репрезентативные хроматограммы представлены для рапамицина и внутреннего стандарта в крови и в легких (фигуры 1 и 2). Перед приготовлением образцов для исследований, строили калибровочные кривые с тремя повторностями для легких и крови в целях подтверждения эффективности метода. Диапазон калибровки составлял от 1,0 до 2000 нг/мл для крови, и от 1 до 20000 нг/мл для гомогената легких. Гомогенат легких получали из 1 г ткани легких в 3 объемах воды с выходом гомогената 1:4. Калибровочные кривые представлены на фигурах 3 и 4 для крови, гомогената легких и растворителя.
Орофарингеальная аспирация: Перед введением рапамицина посредством орофарингеальной аспирации добавляли голубой Эванс для подтверждения того, что доза в легкие может быть введена посредством ОФА. Мышей анестезировали изофлураном и вводили голубой Эванс посредством ОФА с использованием шприца, снабженного затупленной иглой. Сразу после ОФА, мышей подвергали эвтаназии и визуально оценивали легкие и желудок для того, чтобы подтвержить, что краситель голубой Эванс доставлялся в легкие, но не в желудок. Четырем мышам успешно был введен голубой Эванс, где у всех этих мышей голубой Эванс доставлялся в легкие, но не в желудок.
Введение рапамицина: Массу вводмой дозы в растворе определяли путем взвешивания шприца с загруженной дозой в растворе до ее введения, и последующего взвешивания шприца после введения. Массу вводимой дозы в растворе использовали для вычисления количества вводимого рапамицина. Время введения дозы было принято за 0. Животных в группе 2 и 3 подвергали эвтаназии через 1 час после введения дозы. Животных в группе 4 и 5 наблюдали в течение 72 часов после введения дозы. У животных любой из этих групп, каких-либо значимых клинических признаков не наблюдалось.
Анализ на рапамицин в крови и в легких: Рапамицин анализировали в крови и гомогенате левого легкого мышей во всех собранных образцах (фигуры 5 и 6). Образцы правого легкого каждого животного хранили для последующего анализа. Систематизированные данные для образцов представлены в таблице 3.
Таблица 3: Концентрация рапамицина в крови и легких после перорального и орофарингеального (ОФА) введения рапамицина мышам (1 мг/кг)
Для всех серий образцов анализировали калибровочную кривую с тремя повторностями в следующей последовательности: стандартная серия, серия образцов в дубликате 1, стандартная серия, серия образцов в дубликате 2, стандартная серия. Через 1 час после введения рапамицина посредством ОФА, концентрация рапамицина в ткани легких в ~6 раз превышала (3794 ± 1259 нг/г ткани) концентрацию рапамицина в крови (641 ± 220 нг/мл). После перорального введения аналогичной дозы рапамицина, концентрации рапамицина в легких и в крови через 1 час составляли 71 ± 43 нг/г и 23 ± 16 нг/мл, соответственно. Концентрации рапамицина в гомогенате легких после ОФА в 53 раза превышали концентрации, измеренные после перорального введения аналогичной высокой дозы (1 мг/кг) рапамицина.
Обсуждение
В этом исследовании оценивали концентрацию рапамицина в крови и в ткани легких после введения рапамицина через зонд в виде коммерчески доступного перорального препарата и посредством орофарингеального введения (ОФА) в виде суспензии, приготавленной в 10% водном растворе этанола. У мышей, обработанных рапамицином или носителем через 72 часа после введения дозы посредством ОФА, каких-либо побочных эффектов не наблюдалось. В соответствии с заранее разработанным аналитическим методом, введение рапамицина подтверждали путем введения красителя в легкие посредством ОФА. Концентрации рапамицин в легких после его введения посредством ОФА в 6 раз превышали его концентрации в крови. Через 72 часа после ОФА, уровень рапамицина был ниже предела количественной оценки в крови, но детектировался в легких. Это исследование показало, что после пульмонального введения, рапамицин присутствовал в кровотоке, но, при этом, его концентрации в ткани легких значительно превышали концентрации в крови на ранней и поздней стадии после доставки в легкие.
Полученные результаты также продемонстрировали, что непосредственная доставка рапамицина в легкие давала неожиданно высокую локальную концентрацию лекарственного средства в ткани легких по сравнению с концентрацией в крови. Вообще говоря, этот результат был неожиданным с точки зрения фармакологии рапамицина, в соответствии с которой предполагалось, что концентрация лекарственного средства в ткани легких и в крови должна быть приблизительно равной, поскольку известно, что рапамицин одинаково распределяется по всем тканям организма и должен быстро подвергаться клиренсу из легких благодаря его высокой липофильности. В соответствии с этим, полученные результаты показали, что посредством прямого введения рапамицина в легкие могут быть достигнуты достаточно выскокие уровни терапевтической эффективности, и почти недетектируемые уровни в кровотоке, что позволяет предотвратить токсическое действие рапамицина, ассоциированное с пероральным введением и обусловленное системной доставкой лекарственного средства. Хотя токсичность этого лекарственного средства для самих легких также оценивалась в ранее проведенных исследованиях, однако, полученные результаты также неожиданно показали, что относительно высокие количества рапамицина не оказывают острого токсического действия на ткань легких.
Пример 4: Рапамицин ингибирует жизнеспособность TSC2-мутантных клеток и фосфорилирование S6
Антипролиферативную активность рапамицина тестировали на TSC2-дефицитной клеточной линии TRI-AML101, происходящей от ангиомиолипомы (АМЛ). Клеточная линия TRI-AML101 происходит от TSC2-дефицитной первичной человеческой АМЛ, предоставленной Dr. Elizabeth Henske (Fox Chase Cancer Center, Philadelphia, PA). Опухолевые клетки иммортализовали двухстадийным способом. Сначала клетки инфицировали амфотропным ретровирусом LXSN16E6E7, кодирующим открытые рамки считывания HPV16 E6 и E7 и кластер резистентности к неомицину. Затем клетки размножали и проводили отбор на резистентность к неомицину. Отдельные клоны выделяли и замораживали. Затем, человеческий ген теломеразы (hTERT) трансфецировали кластером резистентности к гигромицину (плазмидой pLXSN hTERT-hyg), и стабильную линию отбирали путем отбора на резистентность к гигромицину.
Активность рапамицина тестировали на жизнеспособность клеток TRI-AML101 путем проведения анализа кривой «доза-ответ», построенной по 10 точкам. 2000 клеток в 50 мкл культуральной среды (DMEM, 10% FBS и 1% пенициллина/стрептомицина) высевали в 96-луночный планшет. Через 24 часа после посева клеток, к этим клеткам добавляли еще 50 мкл культуральной среды, содержащей рапамицин (0,0005-5000 нM, 10-кратное разведение, 0,1% конечная концентрация ДМСО) или только ДМСО. Через 72 часа после добавления соединения определяли относительную жизнеспособность клеок с помощью люминесцентного анализа CellTiter-Glo® (Promega), и результаты выражали как процент по отношению к контрольным клеткам, обработанным носителем (ДМСО). Рапамицин ингибировал жизнеспособность клеток при концентрации по меньшей мере 0,05 нМ (фиг.7, внизу). Ингибирование mTOR-пути было также продемонстрировано посредством измерения уровней фосфорилированного S6 с помощью вестерн-блот-анализа. Клетки АМЛ инкубировали с 20 нМ рапамицина в течение 24 часов. Затем был проведен вестерн-блот-анализ, который продемонстрировал, что рапамицин в высокой степени ингибирует фосфорилирование S6 (фиг.7, вверху).
Пример 5: Фосфорилирование S6 в мышиных легких после перорального введения и ОФА-введения рапамицина
Как обсуждалось выше, проведенные авторами эксперименты по распределению рапамицина в ткани легких и в крови после перорального введения и ОФА показали, что посредством прямого введения рапамицина в легкие могут быть достигнуты достаточно выскокие уровни терапевтической эффективности и очень низкие уровни в кровотоке, что позволяет одновременно повысить терапевтическую эффективность и предотвратить значительное токсическое действие, ассоциированное с пероральным введением рапамицина. Для эффективности такого подхода, авторами был использован фосфорилированный белок S6, присутствующий в ткани мышиных легких, в качестве биомаркера активности mTOR. У мышей (C57bl/6), эпителиальные клетки дыхательных путей и альвеол имели конститутивно активный (фосфорилированный, «p») белок S6. Белок S6 обычно фосфорилируется под действием S6K, который действует после mTORC1 и активируется, например, после факторов роста, таких как эпидермальный фактор роста (EGF), AKT, ERK и RSK. mTORC1 стимулирует рост клеток и пролиферацию посредством стимуляции анаболических процессов, таких как биосинтез липидов, белков и органелл, и подавления катаболических процессов, таких как аутофагия. Путь mTORC1 ответственен за передачу и интеграцию внутриклеточных и внеклеточных сигналов, включая факторы роста, кислород, аминокислоты и энергетический статус, и тем самым регулирует процессы широкого ряда, такие как синтез белка и липида и аутофагию. mTORC1 является в высокой степени чувствительным к рапамицину.
В настоящем исследовании, ткань легких брали у мышей C57bl/6, обработанных как обсуждалось выше, либо носителем (n=6), либо 1 мг/кг рапамицина, вводимого посредством ОФА (n=6) или посредством перорального введения через зонд (n=6), в два периода времени после введения дозы, то есть, через 1 час и 72 часа. Как обсуждалось выше, через 1 час после введения посредством ОФА, рапамицин детектировался в концентрации 641 нг/мл в крови и в концентрации 3794 нг/г в ткани легких, и через 72 часа он еще детектировался в легких в концентрации 12,5 нг/г, но в это время, он уже не детектировался в крови. И наоборот, через 1 час после перорального введения (через зонд), рапамицин детектировался в концентрации 23 нг/мл в крови и 71 нг/г в ткани легких, а через 72 часа он вообще не детектировался ни в легких, ни в крови. Как указывают данные на фигуре 8A, уровень фосфорилированного S6 (pS6) значительно снижался через 1 час после введения рапамицина посредством ОФА и перорального введения, и оставался на этом уровне через 72 часа после ОФА. Уровень pS6 был самым высоким в носителе-контроле, поскольку у этих мышей наблюдалась передача сигнала конститутивно активной mTOR. Эти данные показали, что вводимая доза рапамицина является достаточной для достижения приблизительно 70 нг/г лекарственного средства в легких, и, по существу, для предотвращения передачи mTOR-сигнала в ткани легких, как было определено по присутствию белка S6, и что передача mTOR-сигнала ингибируется на уровне по меньшей мере 12,5 нг/г. Эти результаты подтвердили, что разаработанный авторами метод позволяет использовать рапамицин, вводимый путем ингаляции, для лечения заболеваний и расстройств, характеризующихся аномально высокой активностью mTOR-пути, и эти результаты также продемонстрировали, что вводимый путем ингаляции рапамицин может быть введен в гораздо более низких дозах, чем перорально вводимый рапамицин, и одновременно обеспечивать высокую терапевтическую эффективность и очень низкую токсичность.
Пример 6: Вводимый путем ингаляции рапамицин ингибирует фосфорилирование S6 в ткани легких
Нормальным крысам Sprague-Dawley вводили рапамицин путем ингаляции до достижения конечной дозы 0,354 мг/кг рапамицина (LAM-001) (N=36), и животных из подгрупп, состоящих из 6 животных, умерщвляли (1) перед введением доз, (2) в середине интервала между введением доз, (3) сразу после введения доз, (4) через 2 часа после введения доз, (5) через 4 часа после введения доз и (6) через 12 часов после введения доз на день 1 данного исследования. В лаборатории Charles River определяли концентрацию рапамицина в легких у каждого умерщвленного животного в вышеперечисленных подгруппах, где средняя концентрация рапамицина в нанограммах на грамм ткани (нг/г) для каждой группы представлена в нижеследующей таблице.
Таблица 4: Количество рапамицина в ткани легких после его введения путем ингаляции
Образцы легких брали у каждого животного и сразу замораживали. Отдельные замороженные образцы легких гомогенизировали (Qiagen TissueLyser LT, в соответствии с протоколами производителей) в 1× буфере RIPA, содержащем ингибиторы протеазы и фосфатазы. Гомогенаты легких анализировали с помощью вестерн-блот-анализа на мишень, действующую после mTOR, то есть, рибосомный белок фосфо-S6 (Ser240/244) (Cell Signaling Technology antibody, клон D68F8) по сравнению с общими уровнями белка S6, то есть, рибосомного белка S6 (Cell Signaling Technology antibody, клон 5G10). Изображения, полученные с помощью вестерн-блот-анализа, анализировали с использованием программы NIH imageJ v1.48, на реактивность/интенсивность соответствующего антитела, и определяли отношение интенсивности фосфорилированного S6 (S6-P) к интенсивности общего S6 для каждого образца легких. Была построена вертикальная диаграмма рассеяния, применяемая для выявления изменения переменных для различных групп данных, где представлена зависимость отношений «S6-P/общий S6» (ось y) в образцах от времени для групп животных, тестируемых в различные моменты времени (ось х) (GraphPad, version 4.0), где все образцы для этих групп представлены на графике черными точками (●), а средние величины показаны горизонтальной линией между точками для каждой соответствующей группы (фиг. 8B).
Пример 7: Введенный путем ингаляции рапамицин обнаруживал неожиданное биораспределение в легких
В литературе сообщалось, что рапамицин накапливается в легких после перорального или внутривенного введения высоких доз (Yanez, J. et. al., Pharmacometrics and Delivery of Novel Nanoformulated ПЭГ-b-poly(ε-caprolactone) Micelles of Rapamycin, Cancer Chemotherapy and Pharmacology, 61 (1), 133-144 2007). Исследование показало, что после введения одной дозы 10,0 миллиграммов/килограмм (мг/кг) крысам Sprague-Dawley (SD), количество рапамицина в легких через определенное время, необходимое для распределения в различных отделах ткани (через 24 часа), составляло 721 нанограммов/грамм (нг/г), что приблизительно в 19 раз превышало его концентрацию в крови (таблица 5).
Таблица 5. Биораспределение рапамицина в легких и в крови после i.v. введения как описано Yanez et al.
В отдельном исследовании, ранее проведенном Napoli (Napoli, K., et. al., Distribution of Sirolimus in Rat Tissue, Clinical Biochemistry, 30(2):135-142, 1997), крысам SD ежедневно вводили рапамицин в различных дозах перорально или внутривенно (i.v.). Через 14 дней после i.v. введения, концентрация рапамицина в ткани легких варьировалась пропорционально дозе от 200 до 900 нг/г, и приблизительно в 23-44 раза превышала концентрации рапамицина в крови. Но при пероральном введении тех же самых доз, в легких накапливались значительно более низкие уровни рапамицина, даже несмотря на то, что отношения концентраций рапамицина в легких и в крови были приблизительно одинаковыми (таблица 6).
Таблица 6: Биораспределение рапамицина через 24 часа после ежедневного i.v. введения в течение 14 дней как описано Napoli et al.
(нг/мл)
(нг/мл))
Оценка биораспределения рапамицина после его введения путем ингаляции показала, что рапамицин аккумулируется в легких на гораздо более высоком уровне, чем это было предсказано в публикациях Napoli и Yanez, даже несмотря на аналогичные отношения уровней в легких и крови.
В первом исследовании, рапамицин вводили крысам SD путем ингаляции в двух дозах (1) 1,0 мг/кг/день и (2) 0,0360 мг/кг/день, в течение одного дня. По истечении 12 часов, достаточных для распределения рапамицина в отделах ткани, минимальные концентрации рапамицина в легких при высоких дозах составляли приблизительно 14800 нг/г, а концентрация рапамицина в легких приблизительно в 23 раза превышала его концентрацию в крови (Таблица 7). Концентрация рапамицина в легких при низкой дозе в 24 раза превышала концентрацию рапамицина в крови (Таблица 7). В таблице 8 показана минимальная концентрация в легких, а также максимальные и минимальные концентрации в крови после повторного введения один раз в день в течение 5 дней в тех же самых двух дозах, которые были использованы в предыдущих экспериментах, то есть, 1,0 мг/кг/день и 0,0360 мг/кг/день.
Таблица 7: Биораспределение рапамицина через 12 часов после введения одной дозы путем ингаляции
(нг/мл)
Таблица 8: Биораспределение рапамицина, вводимого путем ингаляции один раз в день (как было измерено минимум на день 5)
(нг/мл)
Результаты этого предварительного исследования показали, что доставка рапамицина в легкие путем ингаляции приводит к значительному повышению концентраций лекарственного средства в ткани легких, которые могут быть достигнуты альтернативными способами введения, например, перорального или внутривенного введения, как описано ранее в работах Yanez and Napoli. Кроме того, высокие количества рапамицина в легких после его доставки путем ингаляции оказались неожиданно более высокими, чем это было предсказано в работах Yanez и Napoli. Поскольку внутривенное введение и введение путем ингаляции обеспечивают высокую биологическую доступность рапамицина, то было высказано предположение, что вводимая путем ингаляции доза будет обеспечивать концентрации рапамицина в легких, приблизительно в 2,5 раза превышающие концентрации, наблюдаемые при внутривенном введении дозы 0,4 мг/кг/день, как описано в работе Napoli. Вместо этого, уровни рапамицина в легких приблизительно в 17 раз превышали уровни, достигаемые при введении рапамицина путем ингаляции (ср. таблицу 7, где доза 1 мг/кг/день, вводимая путем ингаляции, давала 14831 нг/г лекарственного средства в легких, и таблицу 6 (Napoli), где доза 0,40 мг/кг/день, вводимая внутривенно, давала 868 нг/г в легких; 14831/868=17). Аналогичнным образом, было предсказано, что доза 10 мг/кг, вводимая внутривенно, как описано в работе Yanez, будет обеспечивать концентрацию рапамицина в легких, приблизительно в 10 раз превышающую концентрацию, наблюдаемую при введении дозы 1 мг/кг путем ингаляции. Вместо этого, внутривенная доза давала концентрации в легких приблизительно в 20 раз ниже, чем доза, вводимая путем ингаляции (ср. таблицу 7, где доза 1 мг/кг/день, вводимая путем ингаляции, давала концентрацию 14831 нг/г лекарственного средства в легких, и таблицу 5 (Yanez), где доза 10 мг/кг/день, вводимая внутривенно, давала концентрацию 721 нг/г в легких; 14,831/721=21). Это возможно обусловлено низкой метаболической активностью в легких и медленным пассивным или активным транспортом рапамицина из отдела ткани легких в кровоток. Независимо от конкретного механизма доставки, эти результаты показали, что доставка рапамицина в легкие обеспечивает стабильно высокие локальные концентрации, а концентрации в кровотоке остаются низкими.
Результаты этого предварительного исследования регистрировали и использовали в дополнительных исследованиях на крысах и собаках. Эти последующие исследования были проанализированы для определения токсичности и токсикинетики повторной дозы аэрозольного препарата в виде сухого порошка, содержащего 1% (масс/масс) рапамицина, смешанного с лактозой и вводимого путем ингаляции нормальным крысам Sprague-Dawley (SD) и собакам породы коротконогая гончая. В первом исследовании, для введения препарата в виде сухого порошка крысам SD использовали стандартные цилиндрические проточные камеры для ингаляции только в носовую полость. В течение пяти последующих дней, животных каждый день обрабатывали тест-соединением в течение 300 минут до достижения конечной дозы 0,354 мг/кг рапамицина. Для проведения токсикокинетических измерений в данном исследовании использовали животных двух групп. На день 1 исследования, животным первой серии вводили дозу в течение 300 минут, и у животных из подгрупп, состоящих из 6 животных, брали пробы крови (N=36) и образцы легких (N=36), причем этих животных умерщвляли (1) перед введением доз, (2) в середине интервала между введением доз, (3) сразу после введения доз, (4) через 2 часа после введения доз, (5) через 4 часа после введения доз, и (6) через 12 часов после введения доз. Животным второй серии вводили дозу в течение 300 минут в последующие 5 дней, и на день исследования 5, у животных из подгрупп, состоящих из 6 животных, брали пробы крови (N=36) и образцы легких (N=36), причем этих животных умерщвляли (1) перед введением доз, (2) в середине интервала между введением доз, (3) сразу после введения доз, (4) через 2 часа после введения доз, (5) через 4 часа после введения доз и (6) через 12 часов после введения доз. Определяли максимальную концентрацию рапамицина в пробах цельной крови (нг/мл) и в образцах ткани легких (нг/г), а также концентрацию рапамицина через 12 часов после введения доз.
Второе повторное исследование на действие прапарата проводили для оценки токсичности и токсикинетики повторной дозы препарата в виде сухого порошка, вводимого крысам SD и собакам породы коротконогая гончая в течение 28 дней.
Для исследования на крысах использовали стандартные цилиндрические проточные камеры для ингаляции только в носовую полость, как описано выше. В течение 28 последующих дней, животных каждый день обрабатывали тест-соединением в течение 300 минут до достижения конечной дозы 0,167, 4,75 и 9,50 мг/кг рапамицина, соответственно. Для групп, которым вводили каждую из этих трех доз, животным одной серии (N=36) вводили дозу в течение 300 минут каждый день в течение 28 последующих дней. На 1-й и 28-й дни исследования, у животных подгруппы, состоящей из 6 животных, брали пробы крови (1) перед введением доз, (2) в середине интервала между введением доз, (3) сразу после введения доз, (4) через 2 часа после введения доз, (5) через 4 часа после введения доз, (6) через 12 часов после введения доз и (7) через 24 часа после введения дозы.
В исследованиях на собаках использовали систему позитивной доставки путем ингаляции (PFDS), состоящую из центральной платформы и вспомогательных устройств для доставки. Центральная платформа состоит из модульной конструкции с отдельными портами, к которым подсоединены 5 боковых устройств для доставки, снабженных ороназальными ингаляторными масками, к которым подсоединены трубки для впуска и выпуска воздуха. Маску надевали на морду собаки так, чтобы ее нос находился внутри маски для обеспечения впуска и выпуска воздуха. Во время обработки, животных фиксировали ремнями и помещали на ограничительную платформу. Ремни привязывали к двум боковым стойкам на платформе для ограничения боковых перемещений собаки. Для предотвращения поворота головы животного, передняя часть ремней была слегка прикреплена крючком спереди платформы. Собак обрабатывали тест-соединением в течение 60 минут каждый день до достижения конечных доз 0,020 и 0,053 мг/кг рапамицина, соответственно. Для каждой группы, которой вводили дозу, животным одной серии (N=6) вводили дозу в течение 60 минут каждый день в течение 28 последующих дней. На 1-й и 28-й дни исследования, у животных подгруппы, состоящей из 6 животных, брали пробы крови (1) перед введением доз, (2) после введения доз (T=0), (3) через 1 час после введения доз, (4) через 4 часа после введения доз, (5) через 8 часов после введения доз, (6) через 12 часов после введения доз и (7) через 24 часа после введения доз. На 29-й день, собак умерщвляли, брали часть ткани легких и измельчали для проведения анализа на содержание рапамицина.
Максимальная концентрация и минимальная концентрация рапамицина в цельной крови (нг/мл) представлены ниже и экстраполированы для человеческих доз. В этой таблице также представлены минимальные уровни рапамицина в легких собак (нг/г) через 28 дней после повторного введения дозы.
Таблица 9: Данные по ингаляции рапамицина крысам и экстраполяция этих данных для человеческих доз
(мкг)
(нг/г)
* исследование 7300225 по введению крысам повторных суточных доз в течение 28 дней - усредненные данные для крови, D28
** исследование 7300227 по введению собакам повторных суточных доз в течение 28 дней - усредненные данные для крови и легких, D28
** данные для крови и легких, экстраполированные исходя из результатов исследований 7300225 и 7300227.
Таким образом, исходя из представленных здесь результатов был сделан вывод, что эффективная доза рапамицина в легких человека, составляющая в приблизительно 5 нг/г, может быть достигнута путем введения в легкие приблизительно менее, чем 100 микрограммов путем ингаляции. В противоположность этому, для достижения сравнимой концентрации в легких при пероральной доставке по Yanez потребуется 4-16 миллиграммов. Для достижения сравнимой концентрации в легких при внутривенной доставке по Napoli потребуется 60-600 микрограммов.
Кроме того, исходя из представленных здесь результатов был сделан вывод, что терапевтический эффективная доза приблизительно 5 нг/г в легких может быть достигнута при отношении распределения препарата в легких и крови 13:1, если рапамицин был доставлен путем ингаляции. Это означает, что хотя рапамицин присутствует в ткани легких в терапевтически эффективной дозе, однако, его максимальные концентрации в крови составляют лишь 650-1500 пикограммов/мл. Предполагается, что такая низкая концентрация рапамицина в крови будет приводить к снижению токсичности и побочных эффектов лекарственного средства, ассоциированных с гораздо более высокой концентрацией рапамицина в крови, вызываемой более высокими уровнями доз, вводимых перорально или внутривенно.
В целом, описанные здесь результаты продемонстрировали, что введение рапамицина в легкие путем ингаляции может оказаться предпочтительным для снижения дозы рапамицина, необходимой для достижения терапевтически эффективной дозы в легких в пределах приблизительно 5 нг/г и одновременно для снижения концентрации лекарственного средства в кровотоке, что будет приводить к заметному повышению терапевтического индекса для рапамицина.
Пример 8: Уменьшение размера частиц рапамицина в композициях для ингаляции
Размер частиц рапамицина был уменьшен до конечных значений 2,0 мкм < Dv50<3,0 мкм посредством мокрого формования или струйного помола. Для струйного помола использовали лабораторное устройство MCOne от Jetpharma со следующими техническими характеристиками: давление Вентури 2-4 бар, давление помола 3-5 бар, скорость потока 90 г/час. Для мокрого формования получали суспензию подаваемого продукта с использованием очищенной воды. Для проведения стадии уменьшения размера частиц использовали гомогенизатор высокого давления с псевдоожиженным слоем Microfluidics, и полученную суспензию сушили распылением. Подробное описание процесса мокрого формования приводится ниже.
Гомогенизатор высокого давления, используемый для проведения стадии уменьшения размера частиц при мокром формовании, представляет собой экспериментальный гомогенизатор высокого давления Microfluidics, снабженный вспомогательным технологическим модулем (200 микрон) и камерой для взаимодействия частиц 100 микрон. Это устройство работает при давлении ~455 бар (~30 бар при гидравлическом давлении, подаваемом на модуль усилителя). После микрофлюидизации, жидкость удаляли путем сушки распылением с получением сухого порошка. Лабораторный осушитель распылением SD45 (BÜCHI, последняя модель B-290) был снабжен двумя соплами для подачи жидкости (с крышкой и диаметром 1,4 и 0,7 мм, соответственно). Для сбора осушенного продукта были использованы два устройства серии «Циклон» (один из которых представляет собой стандартный, а второй - циклон Buchi с высоким разрешением). Устройство для сушки распылением работает в атмосфере азота в режиме одного пропускания, то есть, без рециркуляции осушающего азота. Аспиратор для продувки азотом был установлен на 100% мощность (скорость потока при максимальной мощности составляет приблизительно 40 кг/час). Скорость потока азота для распыления корректировали на величину ротаметра 40±5 мм. Перед подачей суспензии продукта, распылительную сушилку стабилизировали очищенной водой, и во время такой стабилизации, скорость потока корректировали до 6 мл/мин (20% в перистальтическом насосе). Температуру на входе корректировали для достижения нужной температуры на выходе (45°C). После стабилизации температуры, скорость подачи продукта в распылительную сушилку переключали с очищенной воды на суспензию продукта (поддерживая одну и ту же скорость потока во время стабилизации), и температуру на входе снова корректировали для достижения нужной температуры на выходе. По окончании подачи исходной суспензии, поток продукта снова переключали на очищенную воду для промывки поточной линии и автоматической остановки работы устройства. Сухой продукт в колбах-сборниках, находящихся под обоими циклонами, взвешивали, и выход вычисляли как процент сухого продукта по массе всех твердых веществ в суспензии, подаваемой в гомогенизатор высокого давления.
Распределение частиц по размеру анализировали методом лазерной дифракции. Анализ твердого состояния (для оценки полиморфной формы и чистоты) проводили с помощью жидкостной хроматографии высокого давления (ВЭЖХ), рентгеновской порошковой дифракции (XRPD) и дифференциальной сканирующей калориметрии (mDSC). Содержание воды определяли методом Карла Фишера.
В результате струйного помола был получен кристаллический рапамициновый порошок с монодисперсным распределением частиц по размеру, имеющих Dv10 1,5 микрон, Dv50 2,7 микрон и Dv 90 4,9 микрон, как показано ниже в таблице 10.
В результате мокрого помола был получен кристаллический рапамициновый порошок с монодисперсным распределением частиц по размеру, имеющих Dv10 1,0 микрон, a Dv50 2,4 микрон и Dv90 5,0 микрон (таблица 11).
С примененим обоих методов были получены частицы рапамицина нужного размера, и ни один из этих методов не влиял на полиморфную форму или чистоту рапамицина. В нижеследующих таблицах приводятся данные, полученные с помощью управляемого технологического процесса для струйного помола и мокрого формования. Эти данные показали, что оба этих способа позволяют получить частицы API нужного размера, но при этом не оказывают какого-либо воздействия на чистоту или полиморфную форму этих частиц.
Таблица 10: Данные для струйного помола
(% площади)
Таблица 11: Данные для мокрого формования
(% площади)
Пример 9: Анализ композиций в виде сухого порошка на аэрозольную эффективность
Капсулы, полученные как описано в предыдущем примере, помещали в устройство, указанное в нижеследующих таблицах, и это устройство включали. Эффективность доставки аэрозоля из устройств/капсул, содержащих смеси из партии 06RP68.HQ00008 и партии 06RP68.HQ00009, оценивали с использованием импактора нового поколения (NGI) с применением методов, описанных в главах 905 и 601 USP. Аэрозоли были протестированы при скорости потока 60 и 100 литров в минуту (LPM). Доза тонкодисперсных частиц (FPD) и фракция тонкодисперсных частиц (FPF) указаны в таблицах, приведенных ниже. Также указаны среднемассовые аэродинамические диаметры (MMAD) и геометрические стандартные отклонения (GSD).
Таблица 12: 06RP68.HQ00008 (мокрое формование)+Plasitape RS01 Model 7
Таблица 13: 06RP68.HQ00008 (мокрое формование)+Plastiape RS00 Model 8
Таблица 14: 06RP68.HQ00009 (струйный помол)+Plastiape RS01 Model 7
Таблица 15: 06RP68.HQ00009 (струйный помол)+Plastiape RS00 Model 8
Исходя из данных по эффективности доставки аэрозоля, был сделан вывод, что предпочтительными являются частицы лекарственного средства, полученные путем мокрого формования. Такой метод позволяет повысить дозу тонкодисперсных частиц, увеличить фракцию тонкодисперсных частиц и получить такое распределение частиц по размеру, которое обеспечивало бы пенетрацию этих частиц в центральные и периферические области легких и минимизацию их осаждения в ротовой полости.
Пример 10: Фармакокинетическое моделирование рапамицина
Исходя из данных по эффективности доставки аэрозоля 06RP68.HQ00008 (мокрое формование)+Plasitape RS01 Model, как показано выше, и исходя из результатов экспериментов на животных, проводимых как описано в примере 3, можно предположить, что доставка рапамицина непосредственно в легкие человека путем ингаляции даст аналогичные персистентные концентрации в легких, которые будут достаточно высокими для достижения терапевтической эффективности, но достаточно низкими для их попадания в кровоток (низкие концентрации в крови), что позволит эффективно минимизировать побочные эффекты, ассоциированные с присутствием этого препарата в кровотоке. Была разработана двухкамерная фармакокинетическая модель для предсказания концентраций рапамицина в крови и в легких человека после повторного ежедневного введения доз препарата с использованием ингалятора DPI, как показано в таблице 11. Для фармакокинетической модели были использованы ФК-параметры препарата Rapamune® (NDA 21-110 и NDA 21-083), вводимого человеку в соответствии с общими протоколами, одобренными Регуляторными Органами, где указанными параметрами являются: допустимый объем распределения 780 литров, скорость клиренса 0,0003/минуту, и время полужизни до элиминации 42,3 часа (предположительно эквивалентное времени полужизни рапамицина, вводимого внутривенно). Время полужизни рапамицина до его абсорбции из легких составляло, по оценке, приблизительно 0,5 часа, что аналогично времени полужизни других в высокой степени липофильных соединений, таких как пропионат флутиказона, для которого имеются данные по его абсорбции. Биологическая доступность рапамицина, осаждающегося в легких, составляет, предположительно, почти 100%. Биологическая доступность рапамицина, абсорбированного в желудочно-кишечном тракте посредством орофарингеального осаждения, или его удаление из верхних дыхательных путей посредством клиренса через мукоциллиальные пути составляет, предположительно, 14%, как указано в отчете по общему применению Rapamune®, одобренному Регуляторными Органами. Для типичной ингаляции препарата человеку при скорости потока 60 литров в минуту, как показано в таблице 11, доза тонкодисперсных частиц должна составлять 57 микрограммов, а фракция тонкодисперсных частиц должна составлять 40%.
Эта модель позволяет предсказать среднюю постоянную концентрацию через 11 дней, как показано на фигуре 9. Исходя из данных, представленных на этой фигуре, можно видеть, что ежедневная повторная доза 57 микрограммов, доставляемая в легкие, дает минимальные концентрации в крови, составляющие приблизительно 50 пикограммов/мл, и максимальные концентрации, составляющие ниже 200 пикограммов/мл, что значительно ниже концентраций 5-15 нг/мл, сообщаемых в работе McCormack et al. (2011), «Efficacy and safety of sirolimus in lymphangioleiomyomatosis», N Engl J Med 364:1595-1606. Если предположить, что масса ткани в легких составляет 850 граммов, и что метаболизм в легких отсутствует, а время полужизни до абсорбции в легких составляет 30 минут, то 57 микрограммов рапамицина, доставляемого в легкие, будут давать терапевтические уровни в ткани легких, причем, локальные концентрации рапамицина в легких будут составлять приблизительно до 14 нг/грамм.
Эквиваленты
Специалисту в данной области известно или очевидно, что путем всего лишь рутинного экспериментирования могут быть получены различные эквиваленты конкретным вариантам осуществления изобретения, описанным в настоящей заявке. Считается, что такие эквиваленты входят в объем формулы изобретения, прилагаемой ниже.
Все цитируемые здесь работы вводятся во всей своей полноте и во всех целях в описание настоящей заявки так, как если бы каждая конкретная публикация или каждый конкретный патент или каждая конкретная патентная заявка были отдельно и конкретно включены во всей своей полноте и во всех целях в описание настоящей заявки.
Объем настоящего изобретения не ограничивается описанными здесь конкретными вариантами его осуществления. Действительно, различные модификации, вводимые в настоящее изобретение, помимо описанных здесь модификаций, будут очевидны специалистам из представленного выше описания и прилагаемого графического материала. Считается, что такие модификации входят в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАПАМИЦИН ДЛЯ ЛЕЧЕНИЯ ЛИМФАНГИОЛЕЙОМИОМАТОЗА | 2014 |
|
RU2707285C2 |
| ИНГАЛЯЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА РАПАМИЦИНА ДЛЯ ЛЕЧЕНИЯ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ | 2015 |
|
RU2732908C2 |
| КОМПОЗИЦИИ ДЛЯ ИНГАЛЯЦИИ, СОДЕРЖАЩИЕ КИСЛОТУ МОНТЕЛУКАСТ И ИНГИБИТОР PDE-4 ИЛИ ИНГАЛЯЦИОННЫЙ КОРТИКОСТЕРОИД | 2008 |
|
RU2470639C2 |
| АЭРОЗОЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, БАЛЛОНЧИК ДЛЯ ХРАНЕНИЯ И ДОСТАВКИ ФАРМАЦЕВТИЧЕСКОЙ АЭРОЗОЛЬНОЙ КОМПОЗИЦИИ, СПОСОБ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ, СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ | 1993 |
|
RU2120285C1 |
| СПОСОБЫ ЛЕЧЕНИЯ ГРИБКОВЫХ ИНФЕКЦИЙ | 2019 |
|
RU2820457C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2008 |
|
RU2484823C2 |
| АЭРОЗОЛЬНЫЕ ФТОРХИНОЛОНЫ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2428986C2 |
| СИСТЕМЫ И СПОСОБЫ ДОСТАВКИ СУХИХ ПОРОШКОВЫХ ЛЕКАРСТВ | 2011 |
|
RU2531455C2 |
| СИСТЕМЫ И СПОСОБЫ ДОСТАВКИ СУХИХ ПОРОШКОВЫХ ЛЕКАРСТВ | 2013 |
|
RU2650035C2 |
| НАНОЧАСТИЦЫ, ЛЕГЧЕ ПРОНИКАЮЩИЕ В СЛИЗИСТУЮ ОБОЛОЧКУ ИЛИ ВЫЗЫВАЮЩИЕ МЕНЬШЕ ВОСПАЛЕНИЯ | 2012 |
|
RU2631599C2 |

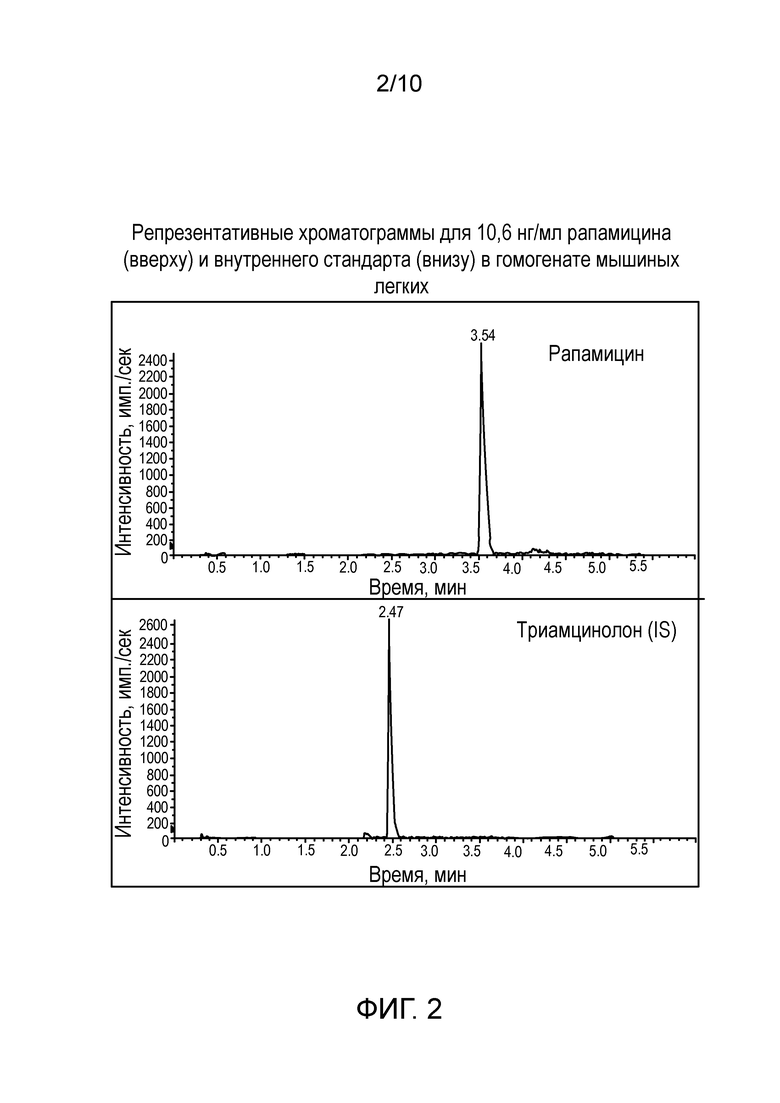
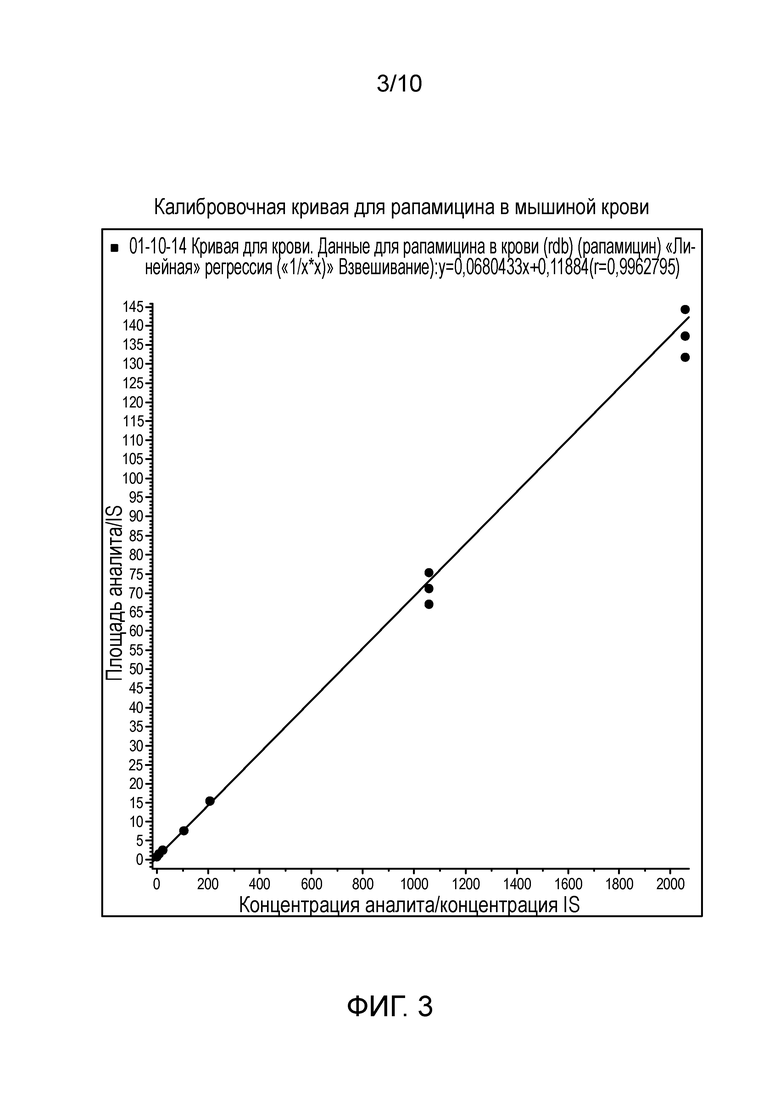
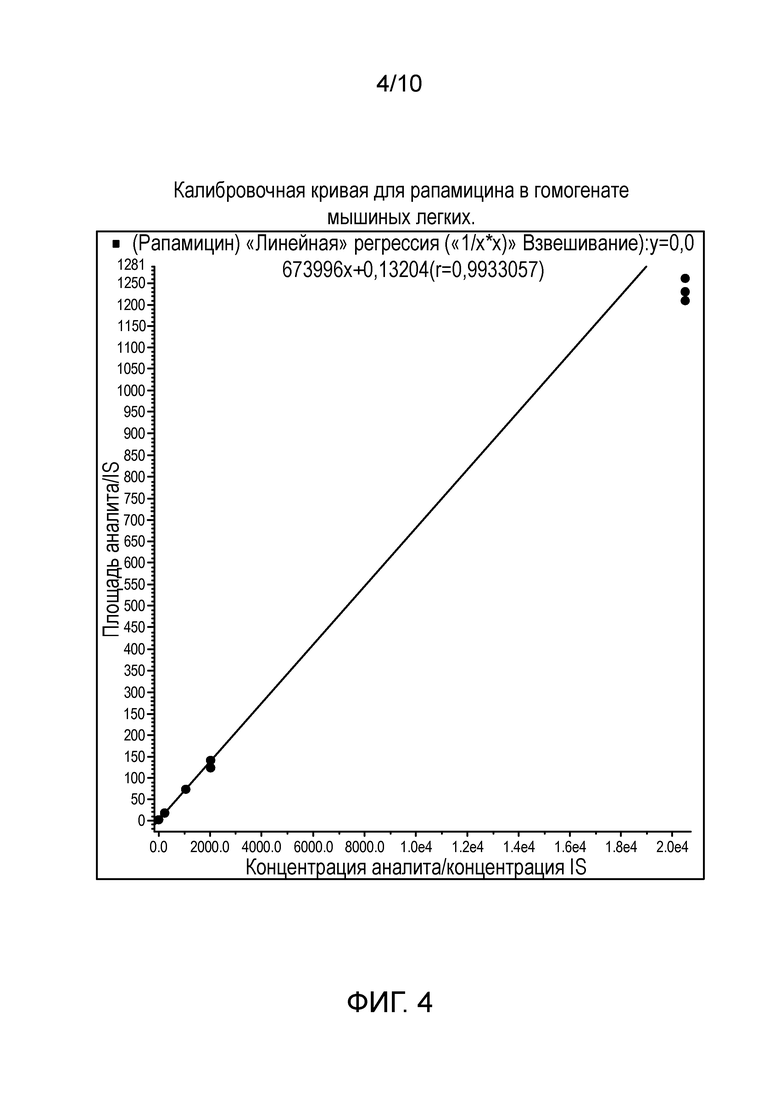
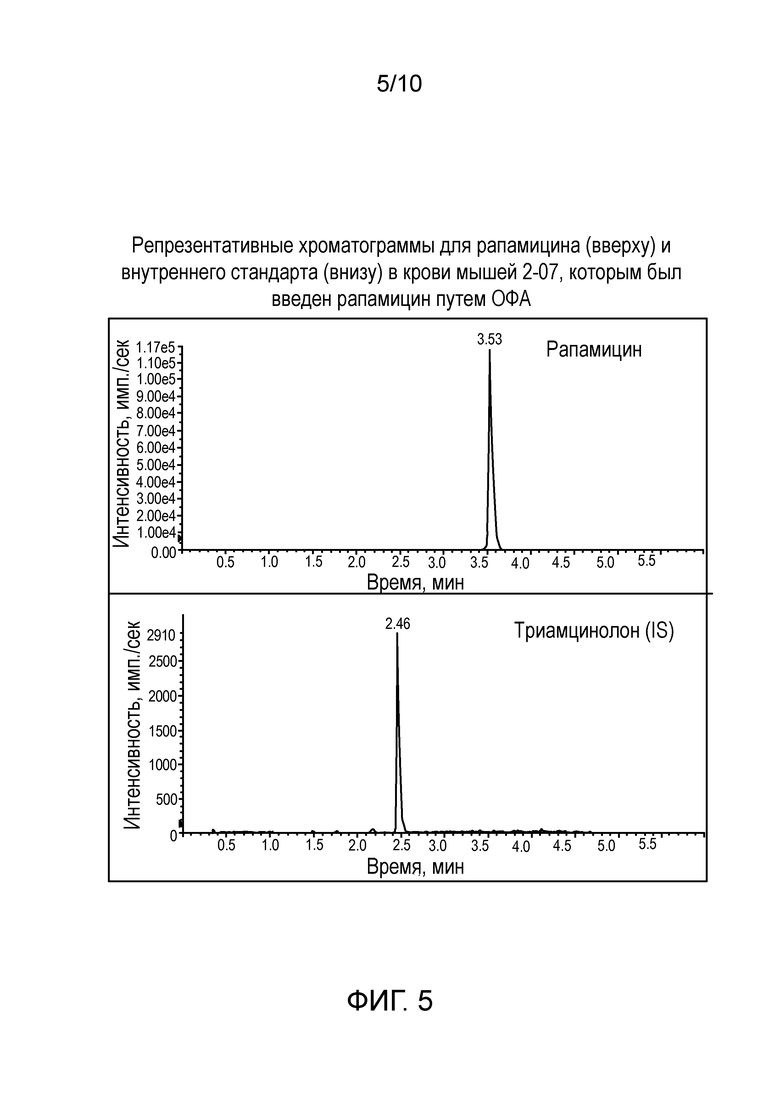
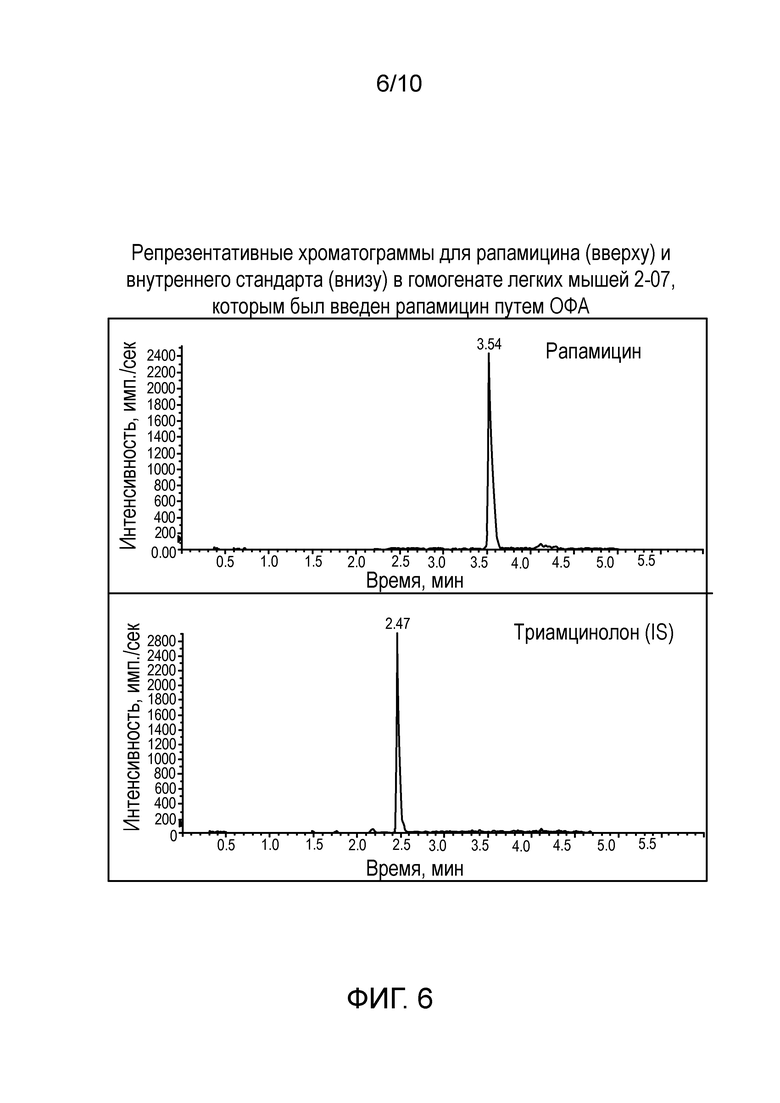
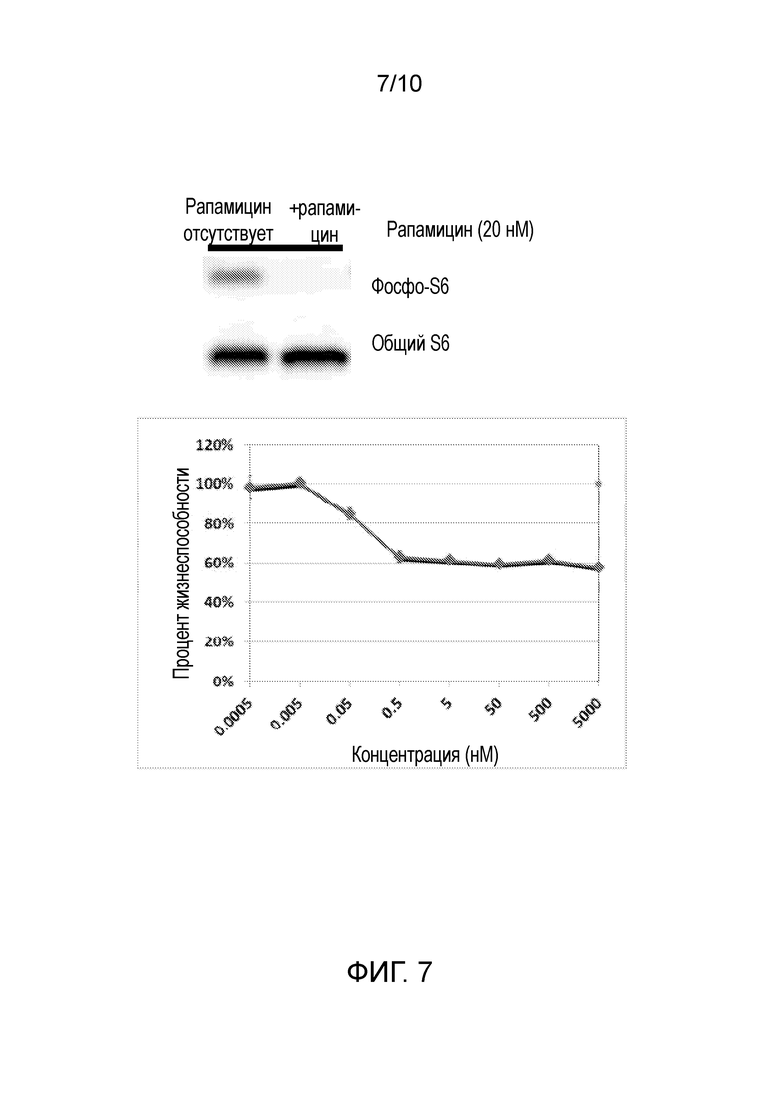
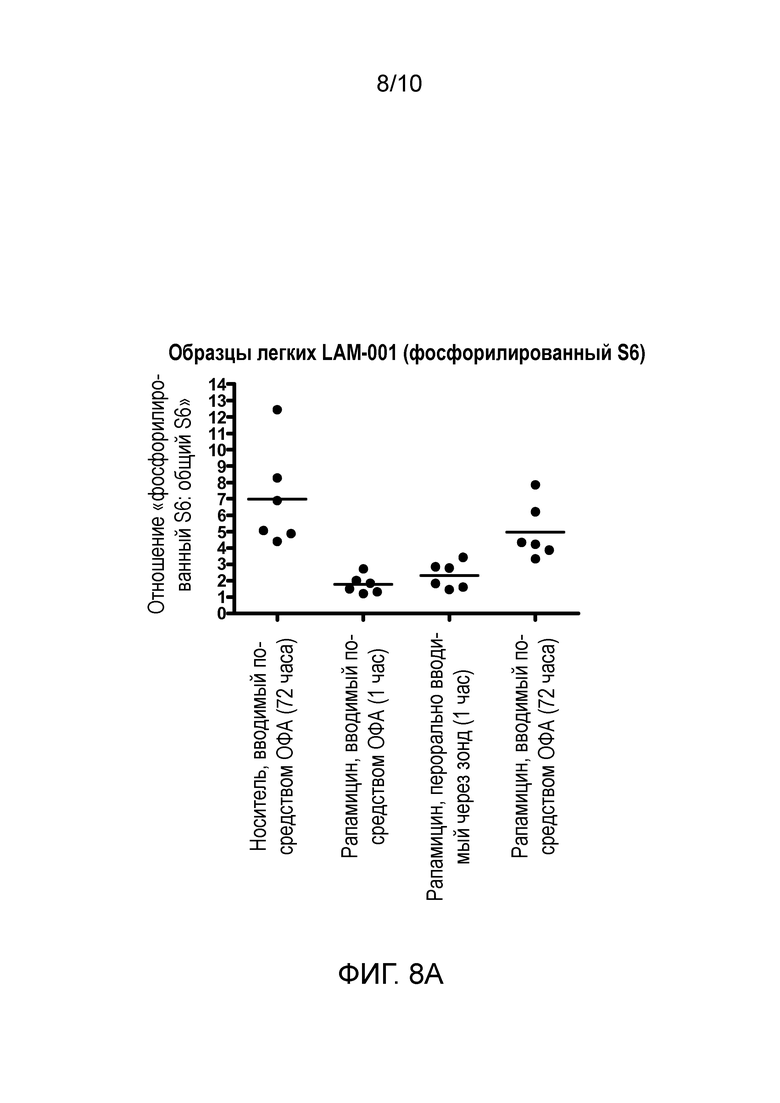
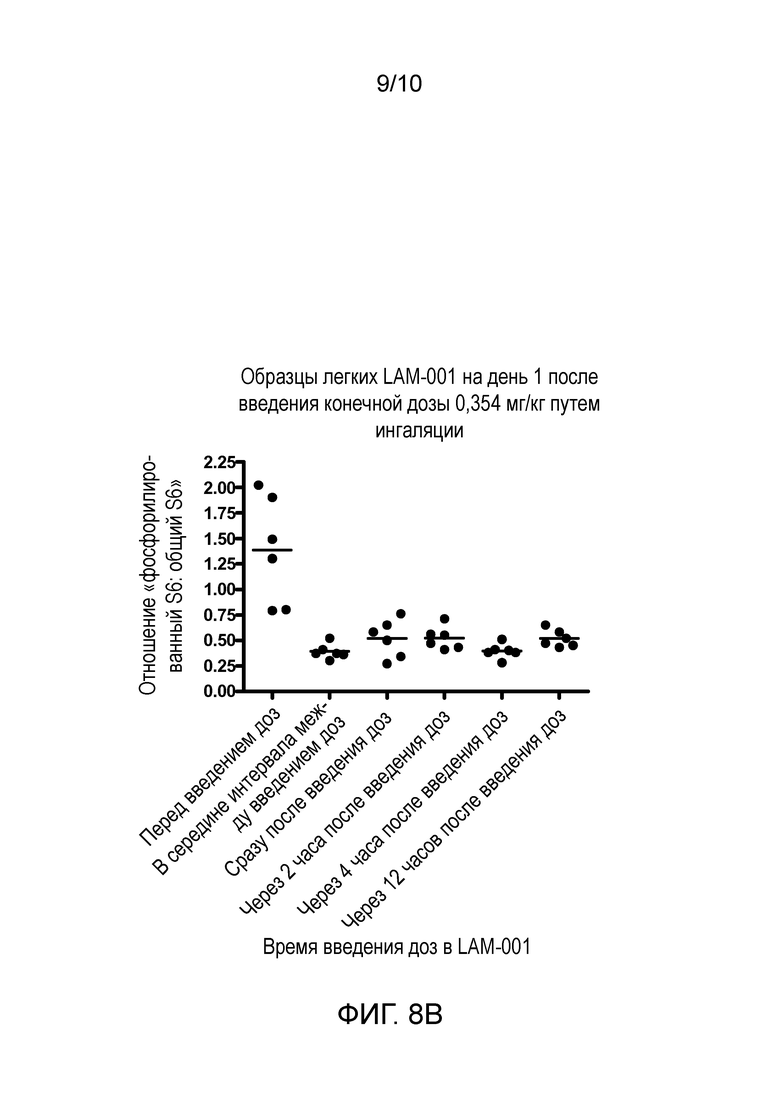
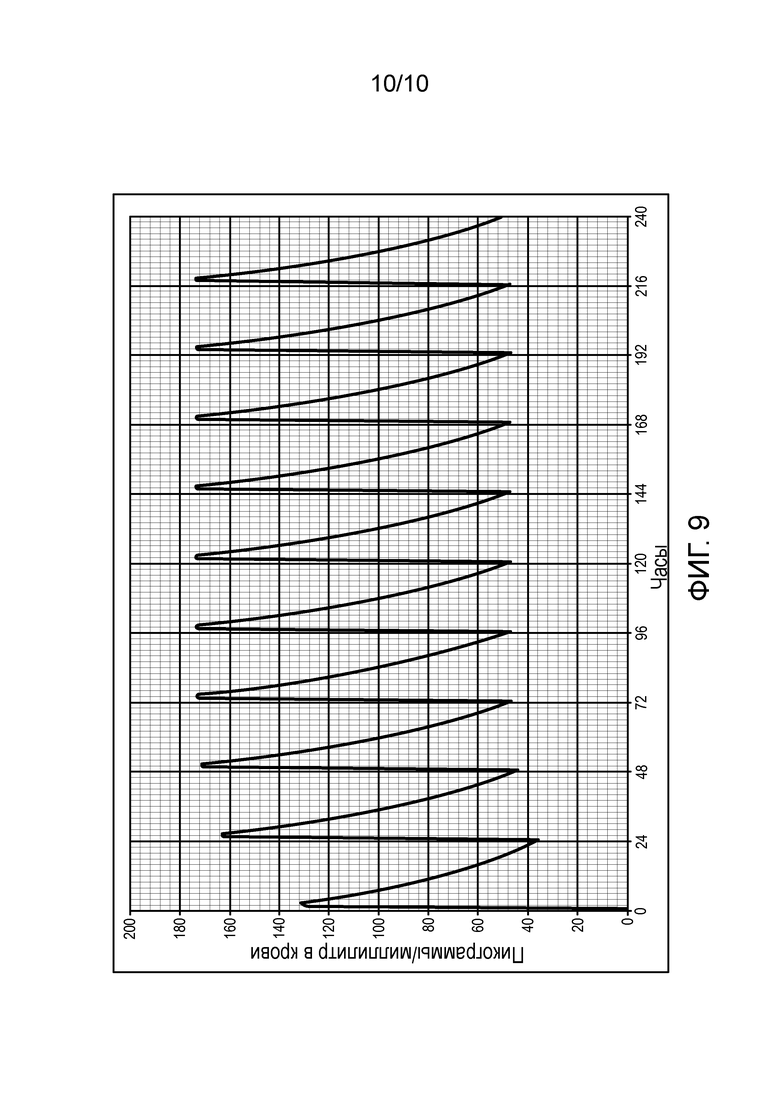
Настоящее изобретение относится к способу лечения рака легких или хронического заболевания легких у человека. Способ включает введение субъекту посредством ингаляции фармацевтической аэрозольной композиции в форме сухого порошка микронизированного рапамицина, частиц носителя и одного или более необязательных наполнителей. Микронизированный рапамицин состоит из частиц, имеющих массовый медианный аэродинамический диаметр (ММАD) от 1 до 5 мкм. Общая суточная доза рапамицина, вводимая субъекту один раз в день, составляет от 50 до 250 мкг. Предпочтительно носитель содержит смесь двух различных носителей, наиболее предпочтительно носитель состоит из смеси двух различных лактозных носителей. Способ по изобретению обеспечивает высокую локальную концентрацию рапамицина в ткани легких, которая достигается при относительно низкой концентрации рапамицина. 1 н. и 8 з.п. ф-лы, 9 ил., 15 табл., 10 пр.
1. Способ лечения рака легких или хронического заболевания легких у человека, включающий введение субъекту посредством ингаляции фармацевтической аэрозольной композиции в форме сухого порошка микронизированного рапамицина, частиц носителя и одного или более необязательных наполнителей, где общая суточная доза рапамицина вводимая субъекту один раз в день составляет от 50 до 250 мкг, и микронизированный рапамицин состоит из частиц, имеющих массовый медианный аэродинамический диаметр (MMAD) от 1 до 5 мкм.
2. Способ по п. 1, где количество рапамицина в композиции составляет от 0,1% до 20% (мас./мас.) или от 0,25% до 2% (мас./мас.) от общей массы композиции.
3. Способ по любому из пп. 1-2, где вводимая композиция продуцирует уровень рапамицина в крови субъекта, составляющий менее, чем 2 нг/мл, менее, чем 1 нг/мл, менее, чем 0,5 нг/мл, или менее, чем 0,25 нг/мл.
4. Способ по любому из пп. 1-3, где микронизированный рапамицин состоит из частиц, имеющих массовый медианный аэродинамический диаметр (MMAD) от 1,5 до 4 мкм, от 1,5 до 3,5 мкм или от 2 до 3 мкм.
5. Способ по любому из пп. 1-4, где носитель выбран из группы, состоящей из арабинозы, глюкозы, фруктозы, рибозы, маннозы, сахарозы, трегалозы, лактозы, мальтозы, крахмалов, декстрана и маннита.
6. Способ по любому из пп. 1-5, где частицы носителя имеют диаметр в пределах от 1 до 200 мкм, от 30 до 100 мкм или менее, чем 10 мкм.
7. Способ по любому из пп. 1-6, где носитель содержит смесь двух различных носителей, первого носителя и второго носителя, или состоит из этих различных носителей, где носитель необязательно состоит из смеси двух различных лактозных носителей.
8. Способ по п. 7, где первый носитель состоит из частиц, имеющих диаметр 30-100 мкм, а второй носитель состоит из частиц, имеющих диаметр менее, чем 10 мкм.
9. Способ по любому из пп. 1-8, где субъект является пожилым человеком.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2020-04-08—Публикация
2015-04-06—Подача