ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет на основании патентной заявки США с порядковым номером 61/896473, поданной 28 октября 2013 г.; патентной заявки США с порядковым номером 61/922586, поданной 31 декабря 2013 г., и патентной заявки США с порядковым номером 62/067273, поданной 22 октября 2014 г., содержание каждой из которых включено в настоящий документ посредством ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Изобретение, среди прочего, относится к моделям, полезным для определения того, проявляют ли вариантные полипептиды фактора роста фибробластов, обладающие снижающей уровень глюкозы активностью, также благоприятными с точки зрения онкологии свойствами, а также к способам и вариантам их применения. Также предложены способы противодействия онкогенной активности FGF19 у субъекта и, в конкретных вариантах осуществления, способы предотвращения или лечения заболевания, нарушения или состояния, такого как FGF19-зависимое заболевание, нарушение или состояние, либо его симптома.
УРОВЕНЬ ТЕХНИКИ
Сахарный диабет является изнурительным метаболическим заболеванием, возникающим в результате отсутствия продуцирования инсулина (1 тип), либо устойчивости к инсулину или недостаточного продуцирования инсулина (2 тип) панкреатическими β-клетками, эндокринными клетками, в которых производится и хранится инсулин для высвобождения после приема пищи. Высокие уровни глюкозы в крови стимулируют секрецию инсулина панкреатическими β-клетками. Инсулин, в свою очередь, стимулирует поступление глюкозы в мышцы и жировые клетки, что ведет к запасанию гликогена и триглицеридов и к синтезу белков. Активация инсулиновых рецепторов на клетках различного типа приводит к снижению уровней циркулирующей глюкозы за счет повышения поглощения и утилизации глюкозы, а также за счет снижения печеночного выброса глюкозы. Нарушения в этой регуляторной сети могут приводить к диабету и ассоциированным патологическим состояниям.
Индивидуум с нарушением метаболизма глюкозы может страдать гипергликемией, гиперинсулинемией и/или нарушением толерантности к глюкозе, наряду с множеством родственных заболеваний. Например, устойчивость к инсулину, заболевание, часто ассоциированное с аномальными уровнями глюкозы и/или инсулина, характеризуется потерей печеночными, жировыми и мышечными клетками их способности реагировать на нормальные уровни инсулина в крови. Такие нарушения метаболизма глюкозы отрицательно сказываются на здоровье большого и все увеличивающегося числа людей во всем мире.
Ожирение, которое чаще всего вызвано избыточным потреблением пищи в сочетании с ограниченным расходом энергии и/или недостатком физических упражнений, часто сопровождает различные нарушения метаболизма глюкозы. Ожирение увеличивает вероятность развития у индивидуума различных заболеваний, таких как сахарный диабет, гипертензия, атеросклероз, болезнь коронарных артерий, подагра, ревматизм и артрит. Более того, риск преждевременной смерти имеет прямую корреляцию с ожирением, так что, например, индекс массы тела, превышающий 40, приводит к снижению средней ожидаемой продолжительности жизни более чем на 10 лет.
Некоторые методы медикаментозного лечения продемонстрировали, в разной степени, эффективность как в отношении гомеостаза глюкозы, так и против ожирения. К сожалению, такие методы часто связаны с серьезными и зачастую изнурительными неблагоприятными эффектами.
Ввиду распространенности и тяжести диабета, ожирения и ассоциированных метаболических и не метаболических нарушений, наряду с недостатками современных методов лечения, существует потребность в альтернативных вариантах лечения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Бариатрическая хирургия бал предложена в качестве альтернативного не фармакологического лечения диабета. Было высказано предположение, что изменения в секреции гормонов кишечника после хирургической операции являются причиной разрешения диабетических состояний. Сывороточные уровни фактора роста фибробластов 19 (FGF19) у человека повышаются после операции шунтирования желудка. FGF19 экспрессируется на высоких уровнях в дистальном отделе тонкого кишечника, и избыточная экспрессия трансгена FGF19 приводит к улучшению гомеостаза глюкозы (Tomlinson, E. (2002) Endocrinology 143(5): 1741-47). Повышенная экспрессия и секреция FGF19 может, по меньшей мере частично, объяснить ремиссию диабета, наблюдаемую после операции.
Несмотря на желательные метаболические эффекты, связанные с FGF19 (например, снижение уровня глюкозы в крови), методы лечения, приводящие к повышению уровней FGF19 (за счет, например, повышения экспрессии FGF19 или введения экзогенного FGF19), связаны с индукцией гепатоцеллюлярной карциномы (HCC). Таким образом, продолжаются поиски средств, обладающих полезными характеристиками FGF19, но не вызывающих злокачественные опухоли, подобные HCC. Настоящее изобретение частично основано на животных моделях и соответствующих способах, помогающих точному и эффективному определению того, обладает ли потенциальное лечебное средство такими свойствами, а также того, является ли субъект подходящим кандидатом для такого лечения.
В следующих вариантах осуществления вариант применения или способ лечения субъекта должен приводить или приводит к снижению уровней глюкозы, повышению чувствительности к инсулину, снижению устойчивости к инсулину, уменьшению уровня глюкагона, улучшению толерантности к глюкозе или метаболизма или гомеостаза глюкозы, улучшению функционирования поджелудочной железы, либо снижению уровней триглицеридов, холестерина, липопротеинов промежуточной плотности (ЛПП), липопротеинов низкой плотности (ЛНП) или липопротеинов очень низкой плотности (ЛОНП), либо снижению кровяного давления, уменьшению интимального утолщения в кровеносных сосудах, либо снижению массы тела или меньшему увеличению массы тела.
В одном варианте осуществления настоящее изобретение относится к способу определения того, является ли тестируемый субъект, имеющий метаболическое нарушение, кандидатом на лечение вариантом FGF19, включающему: a) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, имеющему метаболическое нарушение, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и b) определение того, наблюдаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие квалифицирующих признаков онкологического заболевания указывает на то, что тестируемый субъект является кандидатом на лечение вариантом FGF19.
Используемый в настоящем документе термин «заменитель FGF19» включает любую молекулу (например, полипептид), способную вызывать такой же или сопоставимый эффект, что и FGF19, при этом эффект, как правило, имеет отношение к раку (например, индукция образования опухоли или любых других квалифицирующих признаков онкологического заболевания). Заменитель FGF19 часто представляет собой вариант FGF19, включая активные фрагменты, имеющие по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 93%, по меньшей мере примерно 95%, по меньшей мере примерно 96%, по меньшей мере примерно 97%, по меньшей мере примерно 98% или по меньшей мере примерно 99% идентичности аминокислотной последовательности с непрерывным участком длиной от примерно 150 аминокислот до примерно 160 аминокислот, от примерно 160 аминокислот до примерно 170 аминокислот, от примерно 170 аминокислот до примерно 180 аминокислот, от примерно 180 аминокислот до примерно 190 аминокислот, или примерно 194 аминокислоты или более, одной из аминокислотных последовательностей, описанных в настоящем документе.
В настоящем документе выражение «квалифицирующие признаки онкологического заболевания» в широком смысле означает любое свидетельство того, что онкологическое заболевание, нарушение или состояние развилось, развивается или, по всей вероятности, разовьется. Большинство форм рака первоначально распознают либо вследствие появления признаков или симптомов, либо в процессе скрининга. Для постановки окончательного диагноза, как правило, необходимо, в числе прочего, проводить одно или более патоморфологических исследований образцов ткани, анализы крови, рентгеноскопию, КТ сканирование и эндоскопию. Онкологические заболевания означают любой вид или форму рака, включая карциномы, саркомы, лимфомы и лейкозы, а также бластомы.
Симптомы рака, как правило, бывают вызваны эффектом, который оказывает раковая опухоль на ту часть тела, где опухоль образуется (например, необычные уплотнения в молочных железах или изменение родинок на коже), хотя онкологические заболевания, нарушения и/или состояния могут вызывать более общие симптомы, такие как потеря веса или утомляемость. В способах и моделях, описанных в настоящем документе, квалифицирующие признаки онкологического заболевания (или нарушения, или состояния) часто представляют собой опухоль (например, опухоль толстого кишечника или опухоль печени). Наблюдения и измерения уменьшения числа опухолей, размера опухоли или массы опухоли часто указывают на то, что метод лечения имеет положительный эффект.
В конкретных вариантах осуществления квалифицирующие признаки онкологического заболевания связаны с гепатоцеллюлярной карциномой (HCC, также называемой злокачественной гепатомой), наиболее распространенной формой рака печени. Признаками HCC могут быть желтуха, вздутие живота от асцита, легко возникающие кровоподтеки из-за аномалий свертывания крови, потеря аппетита, потеря веса, боли в животе, тошнота, рвота или утомляемость. HCC описана далее в настоящем документе.
В другом варианте осуществления настоящее изобретение относится к способу определения того, является ли тестируемый субъект, имеющий метаболическое нарушение, кандидатом на лечение вариантом FGF19, включающему: a) выявление тестируемого субъекта, имеющего квалифицирующие признаки онкологического заболевания, субъекта, имеющего метаболическое нарушение, b) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и c) определение того, усиливаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие усиления квалифицирующих признаков онкологического заболевания указывает на то, что тестируемый субъект является кандидатом на лечение вариантом FGF19.
В следующем варианте осуществления настоящее изобретение относится к способу определения того, является ли тестируемый субъект, имеющий метаболическое нарушение, кандидатом на лечение вариантом FGF19, включающему: a) выявление тестируемого субъекта, имеющего квалифицирующие признаки онкологического заболевания, тестируемого субъекта, имеющего метаболическое нарушение, b) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и c) определение того, уменьшаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом уменьшение квалифицирующих признаков онкологического заболевания указывает на то, что тестируемый субъект является кандидатом на лечение вариантом FGF19.
Настоящее изобретение также относится к способу определения того, является ли вариант FGF19 потенциальным лечебным средством для лечения тестируемого субъекта, имеющего метаболическое нарушение, включающему совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, имеющему метаболическое нарушение, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и определение того, наблюдаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие квалифицирующих признаков онкологического заболевания указывает на то, что вариант FGF19 является потенциальным лечебным средством для лечения тестируемого субъекта.
Другие варианты осуществления, предусмотренные в настоящем документе, относятся к способу определения того, является ли вариант FGF19 потенциальным лечебным средством для лечения тестируемого субъекта, имеющего метаболическое нарушение, включающему выявление тестируемого субъекта, имеющего метаболическое нарушение, тестируемого субъекта, имеющего квалифицирующие признаки онкологического заболевания, совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для усугубления онкологического заболевания в контрольной популяции, и определение того, усиливаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие усиления квалифицирующих признаков онкологического заболевания указывает на то, что вариант FGF19 является потенциальным лечебным средством для лечения тестируемого субъекта. В конкретных вариантах осуществления один или более квалифицирующих признаков онкологического заболевания уменьшаются у тестируемого субъекта.
В других вариантах осуществления настоящее изобретение относится к способу лечения (или предотвращения, в определенных обстоятельствах) для субъекта, имеющего метаболическое нарушение, включающему выявление субъекта, имеющего метаболическое нарушение, при этом субъект имеет квалифицирующие признаки FGF19-индуцированного онкологического заболевания, и введение субъекту терапевтически эффективного количества варианта FGF19, идентифицированного в группе вариантов-кандидатов полипептидов FGF19, описанных в настоящем документе; при этом имеет место уменьшение метаболического нарушения у субъекта.
Как упоминалось выше, по настоящему изобретению также предусмотрены различные модели. Один вариант осуществления относится к модели для определения того, является ли вариант FGF19 потенциальным лечебным средством для предотвращения онкологического заболевания, нарушения или состояния у субъекта, имеющего метаболическое нарушение, при этом модель включает субъекта, который i) не имеет квалифицирующих признаков онкологического заболевания до введения эффективного количества FGF19 или заменителя FGF19 и ii) имеет квалифицирующие признаки онкологического заболевания после введения FGF19 или заменителя FGF19; и при этом квалифицирующие признаки онкологического заболевания уменьшаются после введения эффективного количества полипептида, содержащего аминокислотную последовательность, приведенную в SEQ ID NO: 1. В конкретных вариантах осуществления полипептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 1.
Настоящее изобретение также относится к модели для определения того, является ли вариант FGF19 потенциальным лечебным средством для лечения онкологического заболевания, нарушения или состояния у субъекта, имеющего метаболическое нарушение, при этом модель включает субъекта, имеющего по меньшей мере один квалифицирующий признак рака, возникающего в результате введения FGF19 или заменителя FGF19, причем квалифицирующий признак рака уменьшается после введения эффективного количества полипептида, содержащего аминокислотную последовательность, приведенную в SEQ ID NO: 1. В конкретных вариантах осуществления полипептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 1.
Хотя и без ограничений, в конкретных вариантах осуществления в способах и моделях по настоящему изобретению вариант FGF19 представляет собой M70 (SEQ ID NO: 1). Вариант FGF19 может быть идентифицирован в группе кандидатов-вариантов полипептидов FGF19, при этом идентифицированный вариант FGF19 улучшает по меньшей мере одно состояние из, например, гипергликемического состояния (например, диабет), устойчивости к инсулину, гиперинсулинемии, нарушения толерантности к глюкозе, метаболического синдрома, ожирения или нежелательной массы тела. Дополнительные примеры метаболических нарушений, заболеваний и состояний описаны далее в настоящем документе.
В конкретных вариантах осуществления способов и моделей, описанных в настоящем документе, субъект (например, тестируемый субъект) является животным (например, грызуном или обезьяной), таким как мышь (например, мышь db/db). В зависимости от контекста, в котором используется термин, субъект также может быть человеком. В некоторых вариантах осуществления субъект имеет повышенный уровень зрелого FGF19 по сравнению с уровнем зрелого FGF19 в типовой популяции, при этом типовая популяция может быть любой группой из членов, используемых в качестве исходного материала, эталона и так далее. В некоторых вариантах осуществления повышенный уровень зрелого FGF19 возникает вследствие избыточной экспрессии.
В некоторых вариантах осуществления FGF19, заменитель FGF19 и/или вариант FGF19 является меченым, например, для облегчения обнаружения, очистки и тому подобного. В конкретных вариантах осуществления FGF19, заменитель FGF19 и/или вариант FGF19 является меченым за счет образования ковалентной связи. Квалифицированному специалисту известны разные виды меток и способов их использования. Мечение чаще всего выполняют на N-конце и/или C-конце полипептида, оно также может иметь место внутри полипептида. По настоящему изобретению предусмотрено использование любых методов прямого и непрямого мечения, которые можно применять in vivo, in vitro и так далее.
В способах и моделях по настоящему изобретению этапы, связанные с определением квалифицирующих признаков онкологического заболевания, нарушения или состояния, можно выполнять в любой момент времени, в который онкологическое заболевание, нарушение или состояние может проявляться и, таким образом, быть обнаружено. В качестве примера, определение может иметь место через более чем 3 месяца, более чем 20 недель, более чем 6 месяцев, более чем 9 месяцев или более чем 12 месяцев после вышеупомянутых этапов совместного введения. В конкретных вариантах осуществления FGF19 вводят совместно с вариантом FGF19.
Настоящее изобретение также относится к способу противодействия онкогенной активности FGF19. В конкретных вариантах осуществления настоящего изобретения предложен способ противодействия онкогенной активности FGF19 у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19 и тем самым противодействие онкогенной активности FGF19 у субъекта. В конкретных вариантах осуществления субъект имеет метаболическое нарушение и/или квалифицирующие признаки онкологического заболевания.
Настоящее изобретение также относится к способу предотвращения или лечения FGF19-зависимого заболевания, нарушения или состояния, либо его симптома, у субъекта, включающему введение субъекту терапевтически эффективного количества варианта FGF19, при этом заболевание, нарушение или состояние у субъекта предотвращается или подвергается лечению. В конкретных вариантах осуществления происходит ослабление заболевания, нарушения, состояния или его симптома у субъекта. В конкретных вариантах осуществления субъект имеет метаболическое нарушение и/или квалифицирующие признаки онкологического заболевания. В конкретном варианте осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль. В некоторых вариантах осуществления рак или опухоль представляет собой рак или опухоль печени. В конкретных вариантах осуществления рак или опухоль представляет собой рак или опухоль толстого кишечника. В других вариантах осуществления рак или опухоль представляет собой рак или опухоль предстательной железы. В других вариантах осуществления рак или опухоль представляет собой рак или опухоль легкого. В конкретных вариантах осуществления субъект является субъектом, который нуждается в их лечении или предотвращении. В конкретном варианте осуществления вариант FGF19 представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 1 (M70).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 приведены аминокислотные последовательности зрелого FGF19 человека. Аминокислотные остатки, соответствующие flag-эпитопу, подчеркнуты.
На фигуре 2 представлены концентрации FGF19 в плазме, определенные методом ELISA у мышей db/db через пять недель после опосредованной AAV генной доставки (GFP в качестве контроля; FGF19; и/или M70).
На фигуре 3 показано образование макроскопических опухолевых узлов в печени у мышей db/db после непрерывного воздействия GFP, FGF19-flag и/или M70 через двадцать четыре недели после опосредованной AAV генной доставки.
На фигуре 4 показан эффект на массу тела, измеренную до инъекции и через 3, 5 и 23 недель после инъекции, у мышей db/db вследствие непрерывного воздействия GFP, FGF19-flag и/или M70 после опосредованной AAV генной доставки.
На фигуре 5 показан эффект на концентрацию глюкозы, измеренную до инъекции и через 3, 5 и 23 недель после инъекции, у мышей db/db вследствие непрерывного воздействия GFP, FGF19-flag и/или M70 после опосредованной AAV генной доставки.
На фигурах 6A-6E представлена опосредованная AAV трансгенная система для изучения гепатоцеллюлярного онкогенеза. (A) Схема протокола эксперимента. Мыши в возрасте 6-12 недель получали одну инъекцию 3x1011 геномных копий AAV-FGF19 в хвостовую вену. Мышей умерщвляли через 24 или 52 недели для анализа опухолей в печени. ITR, инвертированный концевой повтор; EF1a, промотор фактора элонгации 1α. (B) Репрезентативные печени мышей db/db через 24 недели после введения AAV-FGF19. Множественные крупные выпуклые опухоли, выступающие над поверхностью печени, наблюдали у мышей db/db, экспрессирующих FGF19. Никаких опухолей в печени не наблюдали у животных, которым инъецировали контрольный вирус (AAV-GFP) в данном эксперименте. Масштабные полоски, 10 мм. (C) Сывороточные уровни FGF19 измеряли методом ELISA через 1, 4, 12 и 24 недели после введения AAV мышам db/db (n=5). Все величины представляют собой средние значения ± SEM. (D) Количество, размер и опухолевые показатели в баллах для опухолей в печени у мышей db/db, экспрессирующих трансген FGF19. Подсчитывали количество опухолей на печень и измеряли максимальные размеры опухолей. Среднее значение для каждой группы указано горизонтальными линиями (n=15 на группу, каждая точка соответствует отдельному животному). Все величины представляют собой средние значения ± SEM. ***p<0,001, *p<0,05 обозначают существенные различия по сравнению с контрольной группой при использовании двустороннего критерия Стьюдента. (E) Гистологическая и иммуногистохимическая характеристика FGF19-индуцированных опухолей печени у мышей db/db. Колонки соответствуют, сверху вниз: окрашивание гематоксилином и эозином (H & E) срезов печени; иммуногистохимическое обнаружение Ki-67, PCNA, глютамин-синтетазы и β-катенина. FGF19-индуцированные неопластические клетки в высокой степени положительны по глютамин-синтетезе. Опухоли (T) обведены пунктирными линиями. Масштабные полоски, 100 мкм.
На фигурах 7A-7H показано, что M70 является не вызывающим образование опухолей вариантом FGF19 после непрерывного воздействия на мышей db/db в течение 24 недель. (A) Выравнивание белковых последовательностей M70 и FGF19 в N-концевой области. Мутации, введенные в M70, подчеркнуты. (B)-(F) Количество опухолей на печень (B), масса печени (C) и отношение массы печени к массе тела (D) у мышей db/db, экспрессирующих FGF19 или M70 в течение 24 недель (n=5 на группу). Также определяли кривую роста (E) и сывороточные уровни экспрессированного трансгена (F). (G) Репрезентативные срезы печени мышей db/db через 24 недели экспрессии трансгена. Представляющие печень колонки соответствуют, сверху вниз: окрашивание гематоксилином и эозином (H & E) срезов печеночной ткани; иммуногистохимическое обнаружение Ki-67 и глютамин-синтетазы. Опухоли (T) обведены пунктирными линиями. Масштабные полоски, 100 мкм. (H) Сывороточные уровни печеночных ферментов (ALKP: щелочная фосфатаза; ALT, аланин-аминотрансфераза; AST, аспартат-аминотрансфераза; n=5 на группу) измеряли перед завершением исследования. Все величины представляют собой средние значения ± SEM. *p<0,05, **p<0,01, ***p<0,001 обозначают существенные различия по сравнению с контрольной группой при использовании однофакторного анализа ANOVA с последующим апостериорным критерием Даннета. Смотри также таблицы 3 и 4.
На фигурах 8A-8G показано отсутствие образования опухолей в печени у мышей rasH2, получавших M70 в течение 52 недель. (A)-(E) Кривая роста (A), количество опухолей на печень (B), масса печени (C), отношение массы печени к массе тела (D) и сывороточные уровни M70 или FGF19 (E) у мышей rasH2, экспрессирующих трансгены FGF19 или M70 (n=9 на группу) в течение 52 недель. (F) Печень собирали через 52 недели после введения AAV и окрашивали H & E или антителами против глютамин-синтетазы, маркера FGF19-индуцированных опухолей печени. Срезы, окрашенные на глютамин-синтетазу, взяты из области рядом с парным срезом, окрашенным H & E, и видны те же воротные (p) и центральные (c) вены. Опухоли (T) обведены пунктирными линиями. Масштабные полоски, 100 мкм. (G) кОТ-ПЦР анализ экспрессии Ki-67 и AFP в печени. Копийность мРНК нормировали к экспрессии GAPDH. Все величины представляют собой средние значения ± SEM. *p<0,05, **p<0,01, ***p<0,001 обозначают существенные различия по сравнению с контрольной группой при использовании однофакторного анализа ANOVA с последующим апостериорным критерием Даннета.
На фигурах 9A-9G показано связывание M70 и активация FGFR4 in vitro. (A) ППР анализ Biacore взаимодействия между FGF19 и химерными белками FGFR4-Fc, иммобилизованными на проточных ячейках. Колонка слева представляет кривые связывания, полученные в диапазоне концентраций FGF19 (15,62-2000 нМ в 2-кратных разведениях), а колонка справа представляет соответствующие равновесному состоянию данные для получения значений KD. (B) Связывание M70 с FGFR4 в анализе Biacore. Использованы методы, аналогичные (A). (C) Твердофазное связывание M70 или FGF19 с рецепторным комплексом FGFR4-KLB. Связанные лиганды обнаруживали с помощью биотинилированного специфического для FGF19 поликлонального антитела. (D) Относительная люциферазная активность после стимуляции M70 или FGF19 в клетках L6, временно трансфицированных FGFR4, в присутствии или в отсутствие KLB. (E) M70 индуцирует фосфорилирование ERK в клетках Hep3B. (F) M70 подавляет экспрессию Cyp7a1 в первичных гепатоцитах мыши, крысы и человека. Относительную экспрессию мРНК Cyp7a1 в гепатоцитах определяли методом кОТ-ПЦР и нормировали на уровни 18S РНК (мышь и крыса) или мРНК актина (человек). (G) Подавление экспрессии Cyp7a1 в печени мышей с помощью M70. Мышам db/db в возрасте 12 недель вводили внутрибрюшинной инъекцией рекомбинантный белок M70 или FGF19. Мышей подвергали эвтаназии через 4 часа после дозирования, экспрессию Cyp7a1 в печени оценивали методом кОТ-ПЦР и нормировали на экспрессию 18S РНК. Представлены кривые зависимости ответа от дозы для подавления экспрессии Cyp7a1 у мышей. Все величины представляют собой средние значения ± SEM.
На фигурах 10A-10C показана дифференциальная активация клеточных сигнальных путей с помощью M70 и FGF19 in vivo. (A) Печень собирали от мышей db/db (n=6 на группу), которым внутрибрюшинной инъекцией вводили солевой раствор, белки FGF19 в концентрации 1 мг/кг или M70 в концентрации 1 мг/кг, через 2 часа после инъекции. Лизаты печени изучали методом вестерн-блоттинга на экспрессию и фосфорилирование указанных белков. Каждая дорожка соответствует отдельной мыши. Rab11 служит в качестве контроля нагрузки. Примечательно, что STAT3 печени активируется FGF19, но не M70. (B) У мышей, получавших FGF19, наблюдали повышенную экспрессию IL-6 (индуктора STAT3). Печень собирали от мышей db/db как в случае (A). Количества мРНК IL-6 в печени измеряли методом кОТ-ПЦР и нормировали к экспрессии GAPDH. Результаты представлены в виде кратности экспрессии относительно получавших солевой раствор животных. Показаны результаты для 5 отдельных мышей на каждый вариант. Статус фосфорилирования STAT3, определенный методом иммуноблоттинга лизатов печени от тех же животных, показан на нижней панели. (C) Результаты кПЦР, демонстрирующие экспрессию мРНК для целевых генов STAT3 (сурвивин, Bcl-XL и циклин D1), у мышей rasH2 через 52 недели после введения векторов AAV, экспрессирующих трансгены FGF19 или M70. Все величины представляют собой средние значения ± SEM. **p<0,01, ***p<0,001 обозначают существенные различия по сравнению с контрольной группой при использовании однофакторного анализа ANOVA с последующим апостериорным критерием Даннета.
На фигурах 11A-11J показано, что M70 ингибирует FGF19-индуцированный рост опухолей у мышей db/db и в моделях ксенотрансплантатов. (A)-(D) Мышам db/db в возрасте 11 недель вводили инъекцией AAV-FGF19 (3×1010 геномных копий) в отсутствие или в присутствии M70 (3×1011 геномных копий). Опухолевые показатели в баллах (A), массу печени (B), отношение массы печени к массе тела (C) и сывороточные уровни экспрессированного трансгена (D) определяли через 24 недели. *p<0,05 обозначает существенные различия по сравнению с контрольной группой при использовании однофакторного анализа ANOVA с последующим апостериорным критерием Даннета; ##p<0,01 обозначает существенные различия по сравнению с контрольной группой при использовании двустороннего критерия Стьюдента. (E) Гистологический анализ печени мышей, экспрессирующих FGF19 или получавших сочетание с M70. Срезы печени окрашивали H & E или антителами против глютамин-синтетазы, маркера FGF19-индуцированных опухолей печени. Опухоли (T) обведены пунктирными линиями. Масштабные полоски, 100 мкм. (F) FGF19 продуцируется и секретируется линиями раковых клеток человека. Уровни FGF19 в культуральном супернатанте определяли методом ELISA. (G-J) M70 ингибирует рост ксенотрансплантата раковой опухоли человека in vivo. Бестимусным мышам nu/nu в возрасте 8 недель подкожно имплантировали 5×106 клеток Huh-7 (n=10) (G) или HCT-116 (n=5) (H-J). Мышей со сформировавшимися опухолями эквивалентных объемов (~ 100 мм3) рандомизировали в группы и лечили M70 путем AAV-опосредованной генной доставки. В исследование также включали контрольный вирус (GFP). Рост опухолей измеряли на протяжении 15-дневного периода лечения. Изображение демонстрирует солидные опухоли HCT-116, иссеченные в конце 15-дневного периода лечения (I). Также определяли увеличение массы тела мышей с ксенотрансплантатами опухоли HCT-116 (J). ***p<0,001 обозначает существенные различия по сравнению с контрольной группой при использовании двухфакторного анализа ANOVA с последующим апостериорным критерием Бонферрони. Все величины представляют собой средние значения ± SEM.
На фигурах 12A-12B показана модель разработки варианта FGF19 для лечения FGF19-зависимых опухолей. (A) Хроническое поражение печени (холестаз, цирроз и так далее) приводит к накоплению FGF19 в печени. Играя важную роль в регуляции синтеза желчных кислот, FGF19 в то же время активирует STAT3, ключевой фактор транскрипции в стимуляции печеночного канцерогенеза. Это вносит вклад в начало образования, стимуляцию и прогрессирование опухоли в HCC. (B) M70 представляет собой генно-инженерный вариант FGF19. В качестве избирательного модулятора M70 проявляет уклон в сторону определенных сигнальных путей FGFR4 (то есть pERK и Cyp7a1) при относительном исключении других (то есть связанных с опухолями). Более того, M70 может ингибировать рост опухолей, зависимых от FGF19.
На фигурах 13A-13B показано, что M70 замедляет рост опухолей в сингенной мышиной модели рака CT26 толстого кишечника. (A) M70 замедляет рост опухоли CT26 после введения доз 10 мг/кг. (B) M70 замедляет рост опухоли CT26 после введения доз 3 мг/кг. p-значения определяли с использованием двухфакторного анализа ANOVA в сравнении с мышами, получавшими растворитель. ***p<0,001; **p<0,01.
На фигурах 14A-14B показано, что M70 приводит к снижению массы тела в сингенной мышиной модели рака CT26 толстого кишечника. (A) M70 приводит к снижению массы тела после введения доз 10 мг/кг. (B) M70 приводит к снижению массы тела после введения доз 3 мг/кг. p-значения определяли с использованием двухфакторного анализа ANOVA в сравнении с мышами, получавшими растворитель. ***p<0,001; **p<0,01.
ПОДРОБНОЕ ОПИСАНИЕ
Прежде чем перейти к более подробному описанию настоящего изобретения, следует понимать, что изобретение не ограничено конкретными вариантами осуществления, приведенными в настоящем документе, и также следует понимать, что терминология, используемая в настоящем документе, служит исключительно для целей описания конкретных вариантов осуществления и не должна быть ограничивающей.
Обзор
Настоящее изобретение относится к идентификации средств, а также их композиций с использованием моделей и способов, описанных в настоящем документе. Модели и соответствующие способы предоставляют точную эффективную методологию идентификации средств, которые не вызывают онкологические заболевания (например, гепатоцеллюлярную карциному). В конкретных вариантах осуществления модели и способы, предложенные в настоящем документе, полезны для идентификации средств, которые противодействуют онкогенной активности FGF19. В конкретных вариантах осуществления такие средства имеют терапевтическое применение в лечении и/или предотвращении различных заболеваний, нарушений и состояний и/или их симптомов, имеющих отношение, например, к нарушениям метаболизма глюкозы и/или избыточной массе тела. В качестве примера, но без ограничения, средства и их композиции можно использовать для лечения и/или предотвращения диабета 2 типа, устойчивости к инсулину, а также заболеваний, нарушений и состояний, характеризующихся устойчивостью к инсулину, снижением продуцирования инсулина, гипергликемией, метаболическим синдромом или ожирением. Такие средства также полезны для предотвращения или лечения FGF19-зависимого заболевания, нарушения или состояния, либо его симптома.
Модели и соответствующие способы, описанные в настоящем документе, полезны для идентификации средств (например, полипептидов и антител), которые ни индуцируют, ни усиливают относящиеся к раку эффекты FGF19 (например, HCC). Как описано более подробно далее, конкретные варианты осуществления подразумевают использование моделей и способов для определения того, будет ли вариант полипептида FGF19, обладающий благоприятными метаболическими характеристиками, также обладать желательным «относящимся к раку» профилем. Также предложены способы противодействия онкогенной активности FGF19 у субъекта и, в конкретных вариантах осуществления, способы предотвращения или лечения FGF19-зависимого заболевания, нарушения или состояния, либо его симптома. В конкретных вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль, например, рак или опухоль печени, толстого кишечника, предстательной железы или легкого.
Определения
Термины «пациент» или «субъект» используются взаимозаменяемо для обозначения человека или животного, отличного от человека (например, млекопитающего).
Термины «лечить», «лечение», «терапия» и тому подобные относятся к способу действий (таких как введение полипептида или фармацевтической композиции, содержащей полипептид), начатых после того, как заболевание, нарушение или состояние, либо его симптом, были диагностированы, обнаружены и тому подобное, с тем, чтобы устранить, уменьшить, подавить, смягчить или ослабить, либо временно, либо постоянно, по меньшей мере одну из основополагающих причин заболевания, нарушения или состояния, от которого страдает субъект, или по меньшей мере один из симптомов, ассоциированных с заболеванием, нарушением, состоянием, от которого страдает субъект. Таким образом, лечение включает ингибирование (то есть прекращение развития или дальнейшего развития заболевания, нарушения или состояния, либо ассоциированных с ним клинических симптомов) активного заболевания (например, для того, чтобы снизить уровень инсулина и/или глюкозы в кровотоке, увеличить толерантность к глюкозе, чтобы свети к минимуму флуктуации уровней глюкозы, и/или чтобы защитить от заболеваний, вызываемых нарушением гомеостаза глюкозы).
Используемый в настоящем документе термин «нуждается в лечении» относится к решению, вынесенному врачом или другим медицинским работником, о том, что субъект нуждается или получит пользу от лечения.
Термины «предотвращать», «предотвращение», «профилактика» и тому подобные относятся к способу действий (таких как введение полипептида или фармацевтической композиции, содержащей полипептид), начатых некоторым образом заранее (например, до начала заболевания, нарушения, состояния или его симптома) с тем, чтобы предотвратить, подавить, ингибировать или уменьшить, либо временно, либо постоянно, риск развития у субъекта заболевания, нарушения, состояния или тому подобного (что определяют, например, по отсутствию клинических симптомов), либо отсрочить его начало, как правило, в контексте субъекта, предрасположенного к развитию конкретного заболевания, нарушения или состояния. В некоторых случаях термины также относятся к замедлению прогрессирования заболевания, нарушения или состояния, либо ингибированию его прогрессирования до вредного или иным образом нежелательного состояния.
Используемый в настоящем документе термин «нуждается в профилактике» относится к решению, вынесенному врачом или другим медицинским работником, о том, что субъект нуждается или получит пользу от профилактических мер.
Выражение «терапевтически эффективное количество» означает введение субъекту средства, либо отдельно, либо в виде части фармацевтической композиции, и либо одной дозой, либо в виде части серии доз, в количестве, которое способно оказать измеримый положительный эффект на какой-либо симптом, аспект или характеристику заболевания, нарушения или состояния при введении пациенту. Терапевтически эффективное количество может быть установлено путем измерения соответствующих физиологических эффектов. В случае гипергликемического состояния, снижение или уменьшение уровня глюкозы в крови или улучшение результатов теста на толерантность к глюкозе можно использовать для определения того, является ли количество средства эффективным для лечения гипергликемического состояния. Например, терапевтически эффективное количество представляет собой количество, достаточное для снижения или уменьшения любого уровня (например, базового уровня) глюкозы в плазме крови натощак (FPG), при этом, например, количество является достаточным для снижения уровня FPG с более 200 мг/дл до менее 200 мг/дл, при этом количество является достаточным для снижения уровня FPG с 175 мг/дл - 200 мг/дл до уровня, менее чем начальный уровень, при этом количество является достаточным для снижения уровня FPG с 150 мг/дл - 175 мг/дл до уровня, менее чем начальный уровень, при этом количество является достаточным для снижения уровня FPG с 125 мг/дл - 150 мг/дл до уровня, менее чем начальный уровень, и так далее (например, снижения уровней FPG до уровня менее 125 мг/дл, до уровня менее 120 мг/дл, до уровня менее 115 мг/дл, до уровня менее 110 мг/дл и так далее). Кроме того, в случае уровней HbAIc эффективное количество представляет собой количество, достаточное для снижения или уменьшения уровней более чем примерно с 10% до 9%, более чем примерно с 9% до 8%, более чем примерно с 8% до 7%, более чем примерно с 7% до 6%, более чем примерно с 6% до 5%, и так далее. Более конкретно, по настоящему изобретению предусмотрено снижение или уменьшение уровней HbAIc на примерно 0,1%, 0,25%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 1,5%, 2%, 3%, 4%, 5%, 10%, 20%, 30%, 33%, 35%, 40%, 45%, 50% или более. Терапевтически эффективное количество можно корректировать в зависимости от режима дозирования, а также диагностического анализа состояния субъекта и тому подобного.
Выражение «в количестве, достаточном, чтобы вызвать изменение» означает, что существует поддающаяся определению разница между уровнем индикатора, измеренным до (например, базовым уровнем) и после введения конкретного терапевтического средства. Индикаторы включают любой объективный параметр (например, уровень глюкозы или инсулина) или субъективный параметр (например, самочувствие субъекта).
Используемый в настоящем документе термин «толерантность к глюкозе» означает способность организма субъекта контролировать уровень глюкозы в плазме и/или инсулина в плазме, когда потребление глюкозы колеблется. Например, толерантность к глюкозе включает способность организма субъекта уменьшать, в течение примерно 120 минут, уровень глюкозы в плазме до уровня, определяемого перед потреблением глюкозы.
В широком смысле термины «диабет» и «диабетический» относятся к прогрессирующему заболеванию углеводного метаболизма, включающему неадекватное продуцирование или утилизацию инсулина, часто характеризующемуся гипергликемией и гликозурией. Термины «преддиабет» и «преддиабетический» относятся к состоянию, когда субъект не имеет характеристик, симптомов и тому подобного, как правило, наблюдаемых при диабете, но имеет характеристики, симптомы и тому подобное, которые в отсутствие лечения могут прогрессировать до диабета. Наличие этих состояний можно определять с использованием, например, либо теста на уровень глюкозы в плазме натощак (FPG), либо перорального теста на толерантность к глюкозе (OGTT). В обоих случаях, как правило, необходимо, чтобы субъект не принимал пищу в течение по меньшей мере 8 часов до начала тестирования. В тесте FPG измеряют уровень глюкозы в крови субъекта после завершения периода голодания; как правило, субъект голодает в течение ночи и уровень глюкозы в крови измеряют утром перед приемом пищи субъектом. У здорового субъекта, как правило, концентрация FPG составляет от примерно 90 до примерно 100 мг/дл, у субъекта с «преддиабетом» концентрация FPG, как правило, составляет от примерно 100 до примерно 125 мг/дл и у субъекта с «диабетом» уровень FPG, как правило, превышает примерно 126 мг/дл. В тесте OGTT уровень глюкозы в крови субъекта измеряют после голодания и вновь через два часа после употребления богатого глюкозой напитка. Через два часа после употребления богатого глюкозой напитка у здорового субъекта концентрация глюкозы в крови, как правило, составляет менее примерно 140 мг/дл, у субъекта с преддиабетом концентрация глюкозы в крови, как правило, составляет от примерно 140 до примерно 199 мг/дл и у субъекта с диабетом концентрация глюкозы в крови, как правило, составляет примерно 200 мг/дл или выше. В то время как вышеуказанные гликемические показатели относятся к субъектам-людям, нормальная гликемия, умеренная гипергликемия и выраженная гипергликемия у мышей имеют другую шкалу значений. У здорового субъекта-мыши после четырехчасового периода голодания концентрация FPG, как правило, будет составлять от примерно 100 до примерно 150 мг/дл, у субъекта-мыши с «преддиабетом» концентрация FPG, как правило, составляет от примерно 175 до примерно 250 мг/дл и у субъекта-мыши с «диабетом» концентрация FPG, как правило, превышает примерно 250 мг/дл.
Используемый в настоящем документе термин «устойчивость к инсулину» означает состояние, когда нормальное количество инсулина не способно вызывать нормальный физиологический или молекулярный ответ. В некоторых случаях гиперфизиологическое количество инсулина, либо эндогенно продуцированного, либо экзогенно введенного, способно преодолевать устойчивость к инсулину, полностью или частично, и вызывать биологический ответ.
Термин «метаболический синдром» относится к связанному кластеру признаков, который включает, но не ограничивается ими, гиперинсулинемию, аномальную толерантность к глюкозе, ожирение, перераспределение жира в брюшную полость или верхние части тела, гипертензию, дисфибринолиз и дислипидемию, характеризующуюся высоким уровнем триглицеридов, низким уровнем липопротеинов высокой плотности (ЛВП)-холестерина и высоким уровнем мелких плотных частиц липопротеина низкой плотности (ЛНП). Субъекты, страдающие метаболическим синдромом, имеют риск развития диабета 2 типа и/или других заболеваний (например, атеросклероза).
Выражение «нарушение метаболизма глюкозы» включает любое нарушение, характеризующееся клиническим симптомом или сочетанием клинических симптомов, ассоциированных с повышенным уровнем глюкозы и/или повышенным уровнем инсулина у субъекта по сравнению со здоровым индивидуумом. Повышенные уровни глюкозы и/или инсулина могут проявляться в следующих заболеваниях, нарушениях и состояниях: гипергликемии, диабете II типа, гестационном диабете, диабете I типа, устойчивости к инсулину, нарушенной толерантности к глюкозе, гиперинсулинемии, нарушенном метаболизме глюкозы, преддиабете, других метаболических заболеваниях (таких как метаболический синдром, который также называют синдромом X) и ожирении, в числе прочих. Полипептиды по настоящему изобретению и их композиции можно использовать, например, для достижения и/или поддержания гомеостаза глюкозы, например, для снижения уровня глюкозы в кровотоке и/или для снижения уровня инсулина до диапазона, характерного для здорового субъекта.
Используемый в настоящем документе термин «гипергликемия» означает состояние, при котором в плазме крови субъекта циркулирует повышенное количество глюкозы по сравнению со здоровым индивидуумом. Гипергликемию можно диагностировать способами, известными в данной области, включая измерение уровней глюкозы в крови натощак, как описано в настоящем документе.
Используемый в настоящем документе термин «гиперинсулинемия» означает состояние, при котором имеют место повышенные уровни циркулирующего инсулина, причем в то же время уровни глюкозы в крови являются либо повышенными, либо нормальными. Гиперинсулинемия может быть вызвана устойчивостью к инсулину, которая ассоциирована с дислипидемией, например, высоким уровнем триглицеридов, высоким уровнем холестерина, высоким уровнем липопротеинов низкой плотности (ЛНП) и низким уровнем липопротеинов высокой плотности (ЛВП); высокими уровнями мочевых кислот; синдромом поликистоза яичников; диабетом II типа и ожирением. Гиперинсулинемию можно диагностировать при наличии уровня инсулина в плазме выше чем примерно 2 мкЕ/мл.
Используемый в настоящем документе термин «нарушение массы тела» относится к состояниям, ассоциированным с избыточной массой тела и/или повышенным аппетитом. Различные параметры используют для определения того, имеет ли субъект избыточную массу тела по сравнению с контрольным здоровым индивидуумом, с учетом возраста, роста, пола и состояния здоровья субъекта. Например, субъекта можно считать имеющим избыточную массу тела или тучным на основании оценки индекса массы тела (ИМТ) субъекта, который рассчитывают путем деления массы тела субъекта в килограммах на рост субъекта в квадратных метрах. Взрослый человек с ИМТ в диапазоне от ~18,5 до ~24,9 кг/м2 считается имеющим нормальную массу тела; взрослый человек с ИМТ от ~25 до ~29,9 кг/м2 может считаться имеющим избыточную массу тела (предожирение); и взрослый человек с ИМТ ~30 кг/м2 или выше может считаться тучным. Повышенный аппетит часто приводит к избыточной массе тела. Существует несколько состояний, ассоциированных с повышенным аппетитом, включая, например, синдром ночной еды, который характеризуется утренней анорексией и вечерней полифагией, часто связанной с бессонницей, но который может быть связан с повреждением гипоталамуса.
Термины «полипептид», «пептид» и «белок», используемые в настоящем документе взаимозаменяемо, относятся к полимерной форме аминокислот любой длины, которая может включать кодируемые генетически и не кодируемые генетически аминокислоты, химически или биохимически модифицированные или дериватизированные аминокислоты, а также полипептиды, имеющие модифицированные полипептидные каркасы. Термины включают слитые белки, в том числе, но без ограничения, слитые белки с гетерологичной аминокислотной последовательностью, слитые белки с гетерологичными и гомологичными лидерными последовательностями, с N-концевыми остатками метионина или без них; белки с иммунологическими метками и тому подобное. Следует понимать, что в описании данного изобретения делаются ссылки на аминокислоты, обозначаемые однобуквенным или трехбуквенным кодом.
Используемый в настоящем документе термин «вариант» включает существующие в природе варианты (например, гомологи и аллельные варианты) и не существующие в природе варианты (например, мутеины). Существующие в природе варианты включают гомологи, то есть нуклеиновые кислоты и полипептиды, которые отличаются по нуклеотидной или аминокислотной последовательности, соответственно, у разных биологических видов. Существующие в природе варианты включают аллельные варианты, то есть нуклеиновые кислоты и полипептиды, которые отличаются по нуклеотидной или аминокислотной последовательности, соответственно, у отдельных индивидуумов в пределах одного биологического вида. Не существующие в природе варианты включают нуклеиновые кислоты и полипептиды, которые имеют изменения в нуклеотидной или аминокислотной последовательности, соответственно, при этом изменение в последовательность введено искусственно, например, изменение создано в лаборатории или другом учреждении за счет вмешательства человека («руками человека»).
Термин «нативный» применительно к FGF19 означает биологически активный природный FGF19, включая биологически активные существующие в природе варианты FGF19. Термин включает последовательность зрелого человеческого FGF19 из 194 аминокислот.
Термины «метка», «мечение» и тому подобные при использовании в контексте полипептида или нуклеиновой кислоты (или антитела, в зависимости от обстоятельств) по настоящему изобретению означают в широком смысле любые средства, полезные, например, для очистки, идентификации, выделения и синтеза полипептида. Метки, как правило, ковалентно связаны с интересующим полипептидом и могут быть введены любым методом, известным в данной области, включая присоединение к зрелому полипептиду (как правило, на N- или C-конце), включение в процессе твердофазного пептидного синтеза, или рекомбинантными методами. Примеры включают, но не ограничиваются ими, флуоресцентное мечение, биотинилирование и мечение радиоактивными изотопами. Молекулы полипептидов и нуклеиновых кислот можно метить как in vitro, так и in vivo методами. Реагенты и наборы для мечения можно получать из целого ряда коммерческих источников (например, от компаний Thermo Fischer Scientific, Rockford, IL; и Molecular Probes/Life Technologies; Grand Island, NY).
Используемые в настоящем документе термины «FLAG-метка», «остапептид FLAG» и тому подобные означают пептидный тэг (метку) из восьми аминокислот (DYKDDDDK) (SEQ ID NO: 2), который можно добавлять к полипептиду с использованием методов рекомбинантной ДНК. Антитела к компоненту FLAG полипептида можно использовать, например, для аффинной хроматографии и исследований клеточной локализации с помощью иммунофлуоресценции или для обнаружения методом белкового электрофореза в SDS-ПААГ. FLAG-метку можно использовать в сочетании с другими аффинными метками (например, полигистидиновой меткой (His-меткой) или myc-меткой), и она может быть слита с C-концом или N-концом полипептида.
Используемый в настоящем документе термин «мутеины» в широком смысле означает мутантные рекомбинантные белки, то есть полипептид, имеющий искусственно внесенное изменение в аминокислотной последовательности, например, изменение в аминокислотной последовательности, созданное в лаборатории или другом учреждении за счет вмешательства человека («руками человека»). Эти белки, как правило, имеют одну или несколько аминокислотных замен и часто происходят из клонированных генов, которые были подвергнуты сайт-направленному или случайному мутагенезу, либо из полностью синтетических генов.
Используемые в настоящем документе применительно к нативному человеческому FGF19 или мутеину FGF19 термины «модифицированный», «модификация» и тому подобные означают одно или более изменений, которые усиливают желательное свойство человеческого FGF19, природного варианта FGF19 или мутеина FGF19, при этом изменение(я) не изменяет первичную аминокислотную последовательность FGF19. Такие желательные свойства включают, например, повышенную растворимость, более продолжительный период полувыведения из кровеносной системы, повышенную стабильность, пониженный клиренс, измененную иммуногенность или аллергенность, улучшенные технологические аспекты производства (например, стоимость и эффективность), а также способность инициировать выработку конкретных антител (например, за счет введения уникальных эпитопов) для использования в анализах на обнаружение. Изменения в человеческом FGF19, природном варианте FGF19 или мутеине FGF19, которые можно осуществлять, включают, но не ограничиваются ими, пегилирование (ковалентное присоединение одной или более молекул полиэтиленгликоля (ПЭГ) или его производных); гликозилирование (например, N-гликозилирование), полисиалилирование и гесилирование; слияние с альбумином; связывание альбумина, например, через конъюгированную цепь жирной кислоты (ацилирование); слияние с Fc и слияние с ПЭГ-миметиком. Некоторые конкретные варианты осуществления включают модификации с использованием полиэтиленгликоля, другие конкретные варианты осуществления включают модификации с использованием альбумина и другие конкретные модификации включают модификации с использованием гликозилирования.
Термины «ДНК», «нуклеиновая кислота», «молекула нуклеиновой кислоты», «полинуклеотид» и тому подобные, используемые в настоящем документе взаимозаменяемо, относятся к полимерной форме нуклеотидов любой длины, либо дезоксирибонуклеотидов или рибонуклеотидов, либо их аналогов. Неограничивающие примеры полинуклеотидов включают линейные и кольцевые нуклеиновые кислоты, матричную РНК (мРНК), комплементарнную ДНК (кДНК), рекомбинантные полинуклеотиды, векторы, зонды, праймеры и тому подобное.
Термин «зонд» означает фрагмент ДНК или РНК, соответствующий гену или интересующей последовательности, при этом фрагмент помечен радиоактивно (например, путем включения 32P или 35S) или некоторыми другими поддающимися обнаружению молекулами, такими как биотин, дикислород или флуоресцеин. Поскольку фрагменты ДНК или РНК с комплементарными последовательностями будут гибридизоваться, зонд можно использовать, например, для мечения вирусных бляшек, бактериальных колоний или полос в геле, содержащих интересующий ген. Зонд может представлять собой клонированную ДНК или он может представлять собой синтетическую цепь ДНК; последнюю можно использовать для получения кДНК или геномного клона из выделенного белка путем, например, микросеквенирования части белка, выведения нуклеотидной последовательности, кодирующей белок, синтезирования олигонуклеотида, содержащего данную последовательность, радиоактивного мечения последовательности и использования ее в качестве зонда для скрининга кДНК библиотеки или геномной библиотеки.
Термин «гетерологичный» относится к двум компонентам с определенными структурами, полученным из разных источников. Например, в контексте полипептида «гетерологичный» полипептид может включать функционально связанные аминокислотные последовательности, которые происходят из разных полипептидов. Аналогично, в контексте полинуклеотида, кодирующего химерный полипептид, «гетерологичный» полинуклеотид может включать функционально связанные нуклеотидные последовательности, которые могут происходить из разных генов. Иллюстративные «гетерологичные» нуклеиновые кислоты включают экспрессионные конструкты, в которых нуклеиновая кислота, содержащая кодирующую последовательность, функционально связана с регуляторным элементом (например, промотором), который происходит из генетического источника, иного, чем источник кодирующей последовательности (например, для обеспечения экспрессии в интересующей клетке-хозяине, которая может иметь другое генетическое происхождение, чем промотор, кодирующая последовательность или и то, и другое). В контексте рекомбинантных клеток «гетерологичный» может означать присутствие нуклеиновой кислоты (или генного продукта, такого как полипептид), имеющей другое генетическое происхождение, чем клетка-хозяин, в которой она присутствует.
Термин «функционально связанные» относится к связи между молекулами для обеспечения желаемой функции. Например, «функционально связанные» в контексте нуклеиновых кислот относится к функциональной связи между нуклеотидными последовательностями. В качестве примера, последовательность контроля экспрессии нуклеиновой кислоты (такая как промотор, сигнальная последовательность, или набор сайтов связывания фактора транскрипции) может быть функционально связана со вторым полинуклеотидом, при этом последовательность контроля экспрессии влияет на транскрипцию и/или трансляцию второго полинуклеотида. В контексте полипептида «функционально связанные» относится к функциональной связи между аминокислотными последовательностями (например, разными доменами) для обеспечения описанной активности полипептида.
При использовании в контексте структуры полипептида «N-конец» (или «амино-конец») и «C-конец» (или «карбоксильный конец») означают крайние амино- и карбоксильные концы полипептида, соответственно, в то время как термины «N-концевой» и «C-концевой» относятся к относительным положениям в аминокислотной последовательности полипептида по направлению к N-концу и C-концу, соответственно, и могут включать остатки на N-конце и C-конце, соответственно. Термины «непосредственно N-концевой» или «непосредственно C-концевой» относятся к положению первого аминокислотного остатка относительно второго аминокислотного остатка, когда первый и второй аминокислотные остатки ковалентно связаны для создания непрерывной аминокислотной последовательности.
Выражение «происходящие из» в контексте аминокислотной последовательности или полинуклеотидной последовательности (например, аминокислотная последовательность «происходящая из» полипептида FGF19) указывает на то, что полипептид или нуклеиновая кислота имеет последовательность, в основе которой лежит последовательность эталонного полипептида или нуклеиновой кислоты (например, природного полипептида FGF19 или кодирующей FGF19 нуклеиновой кислоты), и не должно быть ограничений в отношении источника или способа получения белка или нуклеиновой кислоты. В качестве примера, термин «происходящие из» включает гомологи или варианты эталонной аминокислотной последовательности или последовательности ДНК.
В контексте полипептида термин «выделенный» относится к интересующему полипептиду, который, в случае его природного происхождения, находится в окружении, отличном от окружения, в котором он присутствует естественным образом. Термин «выделенный» включает полипептиды, находящиеся в образцах, которые в значительной степени обогащены по данному интересующему полипептиду и/или в которых интересующий полипептид частично или по существу очищен. Если полипептид не является природным, термин «выделенный» указывает на то, что полипептид был отделен от окружения, в котором он был получен либо синтетическими, либо рекомбинантными методами.
«Обогащенный» означает, что образец подвергался неестественным манипуляциям (например, выполняемым ученым или клиницистом) таким образом, что интересующий полипептид присутствует в a) более высокой концентрации (например, по меньшей мере 3-кратно превышающей, по меньшей мере 4-кратно превышающей, по меньшей мере 8-кратно превышающей, по меньшей мере 64-кратно, или более, превышающей), чем концентрация полипептида в исходном образце, таком как биологический образец (например, образец, в котором полипептид естественным образом присутствует или в котором он присутствует после введения), или b) концентрации, превышающей концентрацию в окружении, в котором полипептид был получен (например, как в бактериальной клетке).
«По существу чистый» означает, что компонент (например, полипептид) составляет более чем примерно 50% от общего состава композиции и, как правило, более чем примерно 60% от общего содержания полипептидов. Более конкретно, выражение «по существу чистый» относится к композициям, в которых по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90% или более от общего состава композиции составляет интересующий компонент. В некоторых случаях полипептид будет составлять более чем примерно 90% или более чем примерно 95% от общего состава композиции.
Термины «тестирование» и «измерение» и их грамматические вариации в настоящем документе используются взаимозаменяемо и относятся или к качественным, или к количественным определениям, либо как к качественным, так и количественным определениям. Если термины используют применительно к обнаружению, то подразумевают любые средства оценки относительного количества, включая различные методы, приведенные в настоящем документе и известные в данной области. Например, экспрессию гена можно тестировать или измерять методом нозерн-блоттинга, вестерн-блоттинга, иммунопреципитации или путем измерения активности, функции или количества экспрессируемого белка.
Термины «антитела» (Ат) и «иммуноглобулины» (Ig) относятся к гликопротеинам, имеющим одни и те же структурные характеристики. В то время как антитела обладают специфичностью связывания в отношении определенного антигена, иммуноглобулины включают как антитела, так и другие антитело-подобные молекулы, лишенные антигенной специфичности.
Термин «моноклональное антитело» означает антитело, полученное из популяции по существу гомогенных антител, то есть, отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных естественных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, будучи направлены против одного антигенного сайта. В отличие от препаратов поликлональных антител, препаратов, которые могут включать разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене.
В контексте антитела термин «выделенное» означает антитело, которое было отделено и/или извлечено из сопутствующих компонентов его природного окружения; такие сопутствующие компоненты включают материалы, которые могут препятствовать диагностическому или терапевтическому применению антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества.
Используемый в настоящем документе термин «FGF19-зависимое» и аналогичные термины при использовании в контексте заболевания, нарушения или состояния, относятся к заболеванию, нарушению или другому состоянию, которое полностью или частично вызвано экспрессией FGF19. В конкретных вариантах осуществления экспрессия FGF19 усилена по сравнению с контролем. В некоторых вариантах осуществления экспрессия FGF19 усилена на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более, либо на любую величину в этом численном диапазоне. В некоторых вариантах осуществления усиленная экспрессия FGF19 непосредственно приводит к заболеванию, нарушению или состоянию, либо его симптому. В других вариантах осуществления усиленная экспрессия FGF19 опосредованно приводит к заболеванию, нарушению или состоянию, либо его симптому.
Фактор роста фибробластов 19 (FGF19)
Факторы роста фибробластов (FGF) представляют собой семейство факторов роста, которые играют ключевые роли в клеточной пролиферации и дифференциации. У человека идентифицировано двадцать два члена семейства FGF, все из которых представляют собой структурно родственные сигнальные молекулы. Подсемейство FGF19 факторов роста FGF состоит из FGF21, FGF23 и FGF19 человека и FGF15 мыши.
Физиологические эффекты членов семейства FGF проявляются в результате гепарин-зависимого связывания с одним или более членами семейства рецепторов FGF с тирозинкиназной активностью (FGFR), которое включает четыре члена (FGFR1, FGFR2, FGFR3 и FGFR4), каждый из которых содержит домен тирозинкиназы. Кроме того, каждый из FGFR1, FGFR2 и FGFR3 также имеет два сплайс-варианта, обозначенные «b» и «c» варианты (то есть, FGFR1b, FGFR2b, FGFR3b, FGFR1c, FGFR2c и FGFR3c).
FGF19 имеет в качестве мишеней и оказывает эффекты на адипоциты и гепатоциты. Мыши, получающие рекомбинантный человеческий FGF19, несмотря на содержание их на диете с высоким содержанием жиров, демонстрируют повышенный уровень метаболизма, повышенное окисление жиров, более низкий дыхательный коэффициент и потерю веса. Метаболические эффекты FGF19 осуществляются в результате его связывания с рецепторами FGFR1c, FGFR2c и FGFR3c, причем связывание с FGFR1c и FGFR2c является особенно важным. Для связывания FGF19 с этими рецепторами необходим корецептор Klotho-β (KLB).
Показано также, что FGF19 регулирует производство желчи печенью. Таким образом, FGF19-подобные средства могут играть важную роль в гомеостазе желчных кислот. Результаты свидетельствуют о том, что регуляция FGF19 метаболизма желчных кислот в печени может быть независимой от его снижающего уровень глюкозы эффекта.
Как упоминалось в другом разделе настоящего документа, показано, что использование операции шунтирования желудка для лечения диабета приводит к полному и устойчивому излечению от диабета II типа у большинства пациентов. Этот «бариатрический эффект» проявляется спустя всего несколько дней после операции и задолго до того, как достигается существенное снижение массы тела. Уровни FGF19 возрастают после бариатрической хирургической операции, и он может являться причиной бариатрического эффекта.
FGF19 экспрессируется в виде полипептида из 216 аминокислот, содержащего сигнальный пептид из 22 остатков (GenBank: AAQ88669.1). Зрелый человеческий FGF19 (дикого типа) представляет собой полипептид из 194 аминокислот, содержащий следующую аминокислотную последовательность:
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 3).
FGF19 и гепатоцеллюлярная карцинома
Как описано в настоящем документе, FGF19 ассоциирован с возникновением рака, в частности HCC, наиболее распространенной формы рака печени. В соответствии с некоторыми аспектами изобретения предложены способы и модели для идентификации полипептида, или подпоследовательности, его варианта или модифицированной формы, как указано в настоящем документе, имеющего желательную метаболическую активность (например, снижающую уровень глюкозы активность), но лишенного или практически лишенного активности, связанной с HCC. Различные метаболические нарушения и соответствующие методы (например, методы измерения уровней глюкозы), наряду с методами обнаружения рака, описаны в другом разделе настоящего документа и известны в данной области.
Можно использовать различные методологии скрининга и диагностики HCC, и они хорошо известны квалифицированному специалисту. Индикаторы для HCC включают, но не ограничиваются ими, обнаружение опухолевого маркера, такого как повышенные уровни альфа-фетопротеина (AFP) или дес-гамма карбоксипротромбина (DCP). Также доступен целый ряд различных методов сканирования и визуализации, включая ультразвуковое обследование, КТ-сканирование и МРТ. Что касается конкретных вариантов осуществления способов и моделей, предложенных в настоящем документе, определение того, проявляет ли полипептид (например, полипептид-кандидат) признаки индукции HCC, осуществляют in vivo путем, например, подсчета образовавшихся узлов HCC у модельных животных (например, в модели на мышах db/db), которым вводили полипептид, в сравнении с образовавшимися узлами HCC, индуцированными FGF19 дикого типа. Макроскопрически HCC может иметь форму узлов, при этом опухолевые узлы (которые часто бывают округлыми или овальными, серого или зеленого цвета, четко очерченными, но не инкапсулированными) выглядят либо как одна большая масса, либо как несколько масс меньшего размера. Альтернативно, HCC может выглядеть как инфильтрирующая опухоль, диффузная и плохо очерченная, и часто инфильтрирующая воротные вены. Факторы риска для HCC включают диабет 2 типа (часто усугубленный ожирением). Риск HCC у пациентов с диабетом 2 типа повышен (от ~2,5 до ~7 раз по сравнению с риском людей без диабета) в зависимости от срока наличия диабета и лечебного протокола.
Патоморфологическую оценку образцов печеночной ткани, как правило, проводят после того, как результаты исследования одним или более из вышеуказанных методов указывают на вероятное наличие HCC. Таким образом, некоторые варианты осуществления способов, предложенных в настоящем документе, дополнительно включают оценку образца печеночной ткани от in vivo животной модели, используемой в изучении HCC, с целью определения того, проявляет ли полипептидная последовательность признаки индукции HCC. В конкретных вариантах осуществления in vivo животная модель представляет собой модель на мышах db/db. При микроскопическом исследовании патолог может определять, имеется ли в наличии один из четырех общих архитектурных и гистологических типов (паттернов) HCC (то есть, фиброламеллярный, псевдогландулярный (аденоидный), плеоморфный (гигантоклеточный) и светлоклеточный).
Способы и модели для идентификации вариантных полипептидов FGF19, имеющих желательные характеристики
Вариантные полипептиды FGF19 и другие средства, которые имитируют, по меньшей мере в некоторых отношениях, активность FGF19, описаны как в научной, так и в патентной литературе. Смотри, например, Wu et al., PLos One, 6: e17868 (11 марта 2001 г.); патент США № 8324160 и патентные публикации США №№ 2011/0195895, 2011/0207912 и 2011/0104152. Без каких-либо ограничений, последовательности-кандидаты вариантов FGF19 включают полипептиды, имеющие фрагмент последовательности WGDPI (SEQ ID NO: 4), соответствующий последовательности WGDPI аминокислот 16-20 в FGF19 (SEQ ID NO: 3). Конкретный полипептид, предложенный в настоящем документе, имеет следующую аминокислотную последовательность:
MRDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M70, SEQ ID NO: 1).
В других вариантах осуществления вариант FGF19 содержит или состоит из аминокислотной последовательности, приведенной далее:
RHPIPDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M5, SEQ ID NO: 5);
RDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M6, SEQ ID NO: 6);
RPLAFSDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M7, SEQ ID NO: 7);
RHPIPDSSPHVHYGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M14, SEQ ID NO: 8);
RPLAFSDAGPHVHYGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M15, SEQ ID NO: 9);
RHPIPDSSPLLQFGDQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M32, SEQ ID NO: 10);
RHPIPDSSPLLQFGGNVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M36, SEQ ID NO: 11);
RPLAFSDAGPHVHYGGDIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M43, SEQ ID NO: 12);
RHPIPDSSPLLQFGDQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M50, SEQ ID NO: 13);
RDSSPLLQWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M52, SEQ ID NO: 14);
MDSSPLLQWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M53, SEQ ID NO: 15);
RPLAFSDAGPHVWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M67, SEQ ID NO: 16);
RPLAFSDAGPHVHYWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M68, SEQ ID NO: 17);
RDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M69, SEQ ID NO: 18);
MRDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M70, SEQ ID NO: 1 или 19);
RVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M75, SEQ ID NO: 20);
RGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M76, SEQ ID NO: 21);
RRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M77, SEQ ID NO: 22);
RPLAFSDAAPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M83, SEQ ID NO: 23);
RPLAFSDAGAHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M84, SEQ ID NO: 24);
RPLAFSDAGPHVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIREDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M140, SEQ ID NO: 25);
HPIPDSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M144 (M5-R), SEQ ID NO: 26);
DSSPLLQFGGQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M145 (M6-R), SEQ ID NO: 27);
HPIPDSSPLLQFGDQVRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M146 (M50-R), SEQ ID NO: 28);
RPLAFSDAGPHVHYGWGDPIRQRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEILEDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDSMDPFGLVTGLEAVRSPSFEK (M160, SEQ ID NO: 29);
либо подпоследовательности или фрагмента любой из приведенных выше пептидных последовательностей. В конкретных вариантах осуществления любой из приведенных выше пептидных последовательностей N-концевой остаток R делетирован.
Как описано ранее, один аспект настоящего изобретения относится к способу определения того, является ли тестируемый субъект, имеющий метаболическое нарушение, кандидатом на лечение вариантом FGF19, включающему: (a) выявление тестируемого субъекта, имеющего квалифицирующие признаки онкологического заболевания, субъекта, имеющего метаболическое нарушение, (b) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и (c) определение того, усиливаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие усиления квалифицирующих признаков онкологического заболевания указывает на то, что тестируемый субъект является кандидатом на лечение вариантом FGF19.
Другой аспект настоящего изобретения относится к способу определения того, является ли тестируемый субъект, имеющий метаболическое нарушение, кандидатом на лечение вариантом FGF19, включающему: (a) выявление тестируемого субъекта, имеющего квалифицирующие признаки онкологического заболевания, тестируемого субъекта, имеющего метаболическое нарушение, (b) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и (c) определение того, уменьшаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом уменьшение квалифицирующих признаков онкологического заболевания указывает на то, что тестируемый субъект является кандидатом на лечение вариантом FGF19.
Настоящее изобретение также относится к способу определения того, является ли вариант FGF19 потенциальным лечебным средством для лечения тестируемого субъекта, имеющего метаболическое нарушение, включающему: (a) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, имеющему метаболическое нарушение, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и (b) определение того, наблюдаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие квалифицирующих признаков онкологического заболевания указывает на то, что вариант FGF19 является потенциальным лечебным средством для лечения тестируемого субъекта.
Следующий вариант осуществления, предусмотренный в настоящем документе, относится к способу определения того, является ли вариант FGF19 потенциальным лечебным средством для лечения тестируемого субъекта, имеющего метаболическое нарушение, включающему: (a) выявление тестируемого субъекта, имеющего метаболическое нарушение, тестируемого субъекта, имеющего квалифицирующие признаки онкологического заболевания, (b) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для усугубления онкологического заболевания в контрольной популяции, и (c) определение того, усиливаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие усиления квалифицирующих признаков онкологического заболевания указывает на то, что вариант FGF19 является потенциальным лечебным средством для лечения тестируемого субъекта. В конкретных вариантах осуществления один или более квалифицирующих признаков онкологического заболевания уменьшаются у тестируемого субъекта.
В конкретных вариантах осуществления способов, предложенных в настоящем документе, вариант FGF19 выбирают из группы, состоящей из M5, M6, M7, M14, M15, M32, M36, M43, M52, M53, M67, M68, M69, M70, M75, M76, M77, M83, M84, M140, M144, M145, M146 и M160. В одном варианте осуществления вариант FGF19 представляет собой M5. В другом варианте осуществления вариант FGF19 представляет собой M6. В некоторых вариантах осуществления вариант FGF19 представляет собой M7. В одном варианте осуществления вариант FGF19 представляет собой M14. В другом варианте осуществления вариант FGF19 представляет собой M15. В других вариантах осуществления вариант FGF19 представляет собой M32. В одном варианте осуществления вариант FGF19 представляет собой M36. В другом варианте осуществления вариант FGF19 представляет собой M43. В других вариантах осуществления вариант FGF19 представляет собой M52. В другом варианте осуществления вариант FGF19 представляет собой M53. В некоторых вариантах осуществления вариант FGF19 представляет собой M67. В одном варианте осуществления вариант FGF19 представляет собой M68. В другом варианте осуществления вариант FGF19 представляет собой M69. В некоторых вариантах осуществления вариант FGF19 представляет собой M70. В одном варианте осуществления вариант FGF19 представляет собой M75. В другом варианте осуществления вариант FGF19 представляет собой M76. В других вариантах осуществления вариант FGF19 представляет собой M77. В других вариантах осуществления вариант FGF19 представляет собой M83. В одном варианте осуществления вариант FGF19 представляет собой M84. В другом варианте осуществления вариант FGF19 представляет собой M140. В других вариантах осуществления вариант FGF19 представляет собой M144. В других вариантах осуществления вариант FGF19 представляет собой M145. В одном варианте осуществления вариант FGF19 представляет собой M146. В некоторых вариантах осуществления вариант FGF19 представляет собой M160. В других вариантах осуществления также предусмотрено любое сочетание двух или более из вышеперечисленных вариантов FGF19.
В некоторых вариантах осуществления способов, предложенных в настоящем документе, вариант FGF19 содержит аминокислотную последовательность, приведенную в любой из SEQ ID NOS: 5-29; либо ее подпоследовательность или фрагмент. В конкретных вариантах осуществления N-концевой остаток R делетирован. В некоторых вариантах осуществления вариант FGF19 содержит SEQ ID NO: 5. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 6. В одном варианте осуществления вариант FGF19 содержит SEQ ID NO: 7. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 8. В другом варианте осуществления вариант FGF19 содержит SEQ ID NO: 9. В некоторых вариантах осуществления вариант FGF19 содержит SEQ ID NO: 10. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 11. В другом варианте осуществления вариант FGF19 содержит SEQ ID NO: 12. В некоторых вариантах осуществления вариант FGF19 содержит SEQ ID NO: 13. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 14. В одном варианте осуществления вариант FGF19 содержит SEQ ID NO: 15. В другом варианте осуществления вариант FGF19 содержит SEQ ID NO: 16. В некоторых вариантах осуществления вариант FGF19 содержит SEQ ID NO: 17. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 18. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 19. В некоторых вариантах осуществления вариант FGF19 содержит SEQ ID NO: 20. В одном варианте осуществления вариант FGF19 содержит SEQ ID NO: 21. В некоторых вариантах осуществления вариант FGF19 содержит SEQ ID NO: 22. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 23. В другом варианте осуществления вариант FGF19 содержит SEQ ID NO: 24. В некоторых вариантах осуществления вариант FGF19 содержит SEQ ID NO: 25. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 26. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 27. В некоторых вариантах осуществления вариант FGF19 содержит SEQ ID NO: 28. В других вариантах осуществления вариант FGF19 содержит SEQ ID NO: 29. В конкретных вариантах осуществления вариант FGF19 содержит любую из вышеперечисленных последовательностей, в которой N-концевой остаток R делетирован. В некоторых вариантах осуществления вариант FGF19 содержит подпоследовательность любой из вышеперечисленных последовательностей. В других вариантах осуществления также предусмотрено любое сочетание двух или более из вышеперечисленных вариантов FGF19.
В некоторых вариантах осуществления способов, предложенных в настоящем документе, вариант FGF19 состоит из аминокислотной последовательности, приведенной в любой из SEQ ID NOS: 5-29; либо ее подпоследовательности или фрагмента. В конкретных вариантах осуществления N-концевой остаток R делетирован. В некоторых вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 5. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 6. В одном варианте осуществления вариант FGF19 состоит из SEQ ID NO: 7. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 8. В другом варианте осуществления вариант FGF19 состоит из SEQ ID NO: 9. В некоторых вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 10. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 11. В другом варианте осуществления вариант FGF19 состоит из SEQ ID NO: 12. В некоторых вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 13. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 14. В одном варианте осуществления вариант FGF19 состоит из SEQ ID NO: 15. В другом варианте осуществления вариант FGF19 состоит из SEQ ID NO: 16. В некоторых вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 17. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 18. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 19. В некоторых вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 20. В одном варианте осуществления вариант FGF19 состоит из SEQ ID NO: 21. В некоторых вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 22. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 23. В другом варианте осуществления вариант FGF19 состоит из SEQ ID NO: 24. В некоторых вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 25. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 26. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 27. В некоторых вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 28. В других вариантах осуществления вариант FGF19 состоит из SEQ ID NO: 29. В конкретных вариантах осуществления вариант FGF19 состоит из любой из вышеперечисленных последовательностей, в которой N-концевой остаток R делетирован. В некоторых вариантах осуществления вариант FGF19 состоит из подпоследовательности любой из вышеперечисленных последовательностей. В других вариантах осуществления также предусмотрено любое сочетание двух или более из вышеперечисленных вариантов FGF19.
Как упоминалось выше, настоящее изобретение также относится к различным моделям. Можно использовать любую модель, которая позволяет получать надежные воспроизводимые результаты. Квалифицированному специалисту известны модели, которые можно использовать в сочетании с предметом настоящего изобретения. В некоторых вариантах осуществления используют модели на грызунах, в частности, мышиные модели. В дополнение к моделям на мышах ob/ob, используемым в примерах в экспериментальной части, модели db/db, db/ob и DIO могут найти применение при осуществлении на практике аспектов настоящего изобретения.
Один такой вариант осуществления относится к модели для определения того, является ли вариант FGF19 потенциальным лечебным средством для предотвращения онкологического заболевания, нарушения или состояния у субъекта, имеющего метаболическое нарушение, включающей субъекта, который (i) не проявляет квалифицирующие признаки онкологического заболевания до введения эффективного количества FGF19 или заменителя FGF19, и (ii) проявляет квалифицирующие признаки онкологического заболевания после введения FGF19 или заменителя FGF19; и при этом квалифицирующие признаки онкологического заболевания уменьшаются после введения эффективного количества полипептида, содержащего аминокислотную последовательность, приведенную в SEQ ID NO: 1. В конкретных вариантах осуществления полипептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 1.
Настоящее изобретение также относится к модели для определения того, является ли вариант FGF19 потенциальным лечебным средством для лечения онкологического заболевания, нарушения или состояния у субъекта, имеющего метаболическое нарушение, включающей субъекта, имеющего по меньшей мере один квалифицирующий признак рака, возникающего в результате введения FGF19 или заменителя FGF19, при этом квалифицирующий признак рака уменьшается после введения эффективного количества полипептида, содержащего аминокислотную последовательность, приведенную в SEQ ID NO: 1. В конкретных вариантах осуществления полипептид состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 1.
Некоторые варианты осуществления относятся к модели для определения того, является ли вариант FGF19 потенциальным лечебным средством для предотвращения онкологического заболевания, нарушения или состояния у субъекта, имеющего метаболическое нарушение, включающей субъекта, который i) не проявляет квалифицирующие признаки онкологического заболевания до введения эффективного количества FGF19 или заменителя FGF19, и ii) проявляет квалифицирующие признаки онкологического заболевания после введения FGF19 или заменителя FGF19; и при этом квалифицирующие признаки онкологического заболевания уменьшаются после введения эффективного количества варианта FGF19.
Другие варианты осуществления настоящего изобретения относятся к модели для определения того, является ли вариант FGF19 потенциальным лечебным средством для лечения онкологического заболевания, нарушения или состояния у субъекта, имеющего метаболическое нарушение, включающей субъекта, имеющего по меньшей мере один квалифицирующий признак рака, возникающего в результате введения FGF19 или заменителя FGF19, при этом квалифицирующий признак рака уменьшается после введения эффективного количества варианта FGF19.
В конкретных вариантах осуществления моделей, предложенных в настоящем документе, вариант FGF19 содержит аминокислотную последовательность, приведенную в любой из SEQ ID NOS: 5-29; либо ее подпоследовательность или фрагмент. В других вариантах осуществления моделей, предложенных в настоящем документе, вариант FGF19 состоит из аминокислотной последовательности, приведенной в любой из SEQ ID NOS: 5-29; либо ее подпоследовательности или фрагмента. В конкретных вариантах осуществления N-концевой остаток R делетирован. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 5. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 6. В одном варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 7. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 8. В другом варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 9. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 10. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 11. В другом варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 12. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 13. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 14. В одном варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 15. В другом варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 16. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 17. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 18. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 19. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 20. В одном варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 21. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 22. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 23. В другом варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 24. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 25. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 26. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 27. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 28. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 29. В конкретных вариантах осуществления вариант FGF19 содержит или состоит из любой из вышеперечисленных последовательностей, в которой N-концевой остаток R делетирован. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из подпоследовательности любой из вышеперечисленных последовательностей. В других вариантах осуществления также предусмотрено любое сочетание двух или более из приведенных выше вариантов FGF19.
Оценка эффекта FGF19, введенного совместно с вариантом FGF19
В примерах, приведенных в экспериментальной части, оценивали влияние на мышей db/db FGF19, введенного отдельно или совместно с вариантом FGF19 M70. Аденоассоциированный вирус (AAV) использовали в качестве носителя для доставки и экспрессии экзогенных интересующих генов у мышей и для создания непрерывной персистентной и системной экспозиции белков, кодируемых трансгенами.
На фигуре 2 представлены концентрации FGF19 в плазме, определенные методом ELISA у мышей db/db через пять недель после AAV-опосредованной доставки генов GFP (контроль); FGF19 (две отдельные дозы), а также FGF19 и варианта FGF19 M70 (две отдельные дозы каждого). Высокие концентрации FGF19, наблюдаемые после совместного введения трансгенов FGF19 и M70, отражают вклад от экспрессии обоих вариантов FGF19, M70 и FGF19. FGF19-flag использовали в примерах для облегчения количественной оценки экспериментальных результатов; как указано в экспериментальной части, компонент c-Flag не влияет на онкогенные эффекты FGF19, хотя он может оказывать влияние на антидиабетические эффекты FGF19.
Оценивали потенциальное воздействие совместного введения FGF19 и варианта FGF19 M70 на HCC по сравнению с введением только FGF19. Как показано на фигуре 3, эктопическая экспрессия FGF19 в модели на мышах db/db стимулировала образование множественных крупных выпуклых опухолевых узлов, выступающих над поверхностью печени, в то время как печень от мышей, экспрессирующих как FGF19, так и и M70, была полностью свободна от печеночных узлов (в используемых условиях). Более того, опосредованный FGF19 онкогенез, о чем свидетельствовало появление печеночных очагов, полностью подавляется при совместной экспрессии трансгенов FGF19 и M70. Эти данные удивительны, поскольку они свидетельствуют о том, что генно-инженерный вариант FGF19 M70 не только лишен онкогенного потенциала в организме мышей, связанного с белком дикого типа, но что он способен эффективно препятствовать пролиферативным эффектам белка дикого типа. Хотя четкое понимание основополагающего механизма действия, связанного с этим феноменом, не требуется для практического применения настоящего изобретения, он может заключаться, по меньшей мере частично, в конкуренции M70 с FGF19 дикого типа в сайте связывания FGF19.
В примере 4 был изучен эффект на массу тела мышей, первоначально измеренную до инъекции, и затем определяемую через 3, 5 и 23 недель после инъекции указанных трансгенов. Как показано на фигуре 4, трансгенные мыши db/db, экспрессирующие совместно вариант FGF19 M70 и FGF19, демонстрировали значительное снижение массы тела по сравнению с животными, которым вводили дозы контрольного вещества, в то время как менее впечатляющие эффекты на массу тела наблюдали у мышей, экспрессировавших только трансген FGF19. Изменения в массе тела, наблюдаемые у мышей, экспрессирующих совместно трансгены FGF19 и M70, также нашли отражение в снижении массы печени по сравнению с массой печени, собранной от животных в контрольной группе.
Аналогично тому, как определяли массу тела, также оценивали эффект экспрессии трансгенов на уровень глюкозы в крови до инъекции трансгенов и через 3, 5 и 23 недель после инъекции. Результаты, представленные на фигуре 5, свидетельствуют о том, что трансгенные мыши db/db, экспрессирующие совместно вариант FGF19 M70 и FGF19, демонстрировали значительное снижение концентраций глюкозы в крови по сравнению с контрольными животными.
В качестве продолжения вышеуказанных исследований и данных, и как описано в примерах 6-11 экспериментальной части, создавали in vivo модель онкогенеза у мышей для оценки FGF19-индуцированного канцерогенеза в печени в попытке оказать воздействие на FGF19 в отношении онкогенного потенциала без ущерба для его существенной роли, например, в гомеостазе желчных кислот. В примере 7 описана опосредованная AAV трансгенная система для оценки гепатоцеллюлярного онкогенеза in vivo. Трансген FGF19 для экспрессии вводили с использованием подхода AAV-опосредованной генной доставки (Zhang et al., 2009, Hum.Gene Ther.20, 922-929). Как описано в примере 8, панель вариантов FGF19 оценивали in vivo и идентифицировали не вызывающие опухоль варианты, включая M70. Примечательно, что, как показано в примерах 8 и 9, M70 сохраняет полезную активность регуляции гомеостаза желчных кислот; и M70 также связывает и активирует FGFR4, который предположительно опосредует связанную с FGF19 онкогенную активность (French et al., 2012, PloS one 7, e36713; Wu et al., 2010, J. Biol. Chem. 285, 5165-5170). Как показано в примере 10, FGF19 механистически стимулирует прогрессирование опухоли за счет активации пути STAT3, активности, которая отсутствует у M70. Более того, как показано в примере 11, M70 ингибирует FGF19-зависимый рост опухолей в нескольких опухолевых моделях. Кроме того, как показано в примере 12, M70 ингибирует рост опухоли толстого кишечника в сингенной мышиной модели.
Таким образом, в примерах, приведенных в настоящем документе, природные гормоны были генно-инженерными методами изменены для избирательного удаления потенциально вредной активности (то есть, онкогенной активности), с сохранением полезной функции (то есть, участия в метаболизме желчных кислот) без изменений. В процессе интенсивного анализа структуры и активности M70 был идентифицирован как не вызывающий опухоли вариант FGF19, который связывает и избирательно активирует рецепторный комплекс FGFR4 для поддержания гомеостаза желчных кислот. Мыши, подвергающиеся продолжительному воздействию превышающих физиологические уровней M70 (24 недели в случае мышей db/db, 52 недели в случае мышей rasH2), не имели опухолей печени (пример 8; фигуры 7 и 8). Также было продемонстрировано, что M70 блокирует связанную с FGF19 онкогенную активность у мышей и в случае ксенотрансплантатов раковых опухолей человека (пример 11, фигура 11). Хотя не вызывающие опухоли варианты FGF19 были идентифицированы ранее (Wu et al., 2011, PloS one 6, e17868; Wu et al., 2010a, PNAS, 107, 14158-14163), эти варианты были специально сконструированы для устранения связывания с FGFR4 и, как следствие, были неспособны к регуляции метаболизма желчных кислот. В отличие от них, M70 демонстрирует аналогичную активность и эффективность в связывании FGFR4 и регуляции путей Cyp7a1 и pERK, действующих после FGFR4 (примеры 9 и 10; фигуры 9 и 10). Эти результаты предоставляют in vivo доказательства избирательной активации рецепторного комплекса FGFR4/KLB, которая не приводит к образованию гепатоцеллюлярных опухолей.
Основные различия между M70 и FGF19 лежат в N-концевой области белка. Каждый белок семейства FGF состоит из структурно консервативного центрального сферического домена и фланкирующих N-концевого и C-концевого сегментов, которые обладают структурной гибкостью и имеют расхождения в первичной последовательности (Beenken and Mohammadi, 2009, Nat. Rev. Drag Discov. 8, 235-253). В рентгеновских кристаллических структурах множественных комплексов FGF/FGFR N-концевой сегмент молекулы FGF образует специфический контакт с FGFR и, как считают, играет важную роль, определяя специфичность взаимодействия FGF-FGFR (Beenken and Mohammadi, 2009, Nat. Rev. Drug Diskov. 8, 235-253). Благодаря усилиям авторов изобретения по систематическому in vivo скринингу, показано, что изменение 3 аминокислот на N-конце в сочетании с 5-ак делецией приводит к удалению онкогенной активности без нарушения способности к активации FGFR4-зависимого процесса, такого как регуляция желчных кислот.
Без привязки к какой-либо теории, несколько линий доказательств указывают на то, что M70 проявляет фармакологические характеристики «несимметричного лиганда» или избирательного модулятора. Например, как показано в примере 9 и на фигуре 9, M70 связывается с внеклеточным доменом FGFR4 с активностью и эффективностью, аналогичной таковым у FGF19 дикого типа. M70 активирует фосфорилирование ERK в клетках, трансфицированных FGFR4-KLB или FGFR4, или клетках, экспрессирующих FGFR4-KLB эндогенно. Подобно FGF19, M70 эффективно подавляет Cyp7a1 в первичных гепатоцитах и у мышей. В отличие от FGF19, M70 не стимулирует образование опухолей в печени. Опять-таки, без привязки к какой-либо теории, отсутствие онкогенной активности у M70 может быть объяснено тем, что он не активирует фSTAT3, ключевую сигнальную молекулу в путях гепатоцеллюлярного канцерогенеза.
Как показано в примере 10 и на фигуре 10, FGF19, но не M70, активирует STAT3 в печени. STAT3 является основным звеном в гепатоцеллюлярном онкогенезе (He and Karin, 2011, Cell Res. 21, 159-168). Фосфорилированный (то есть, активированный) STAT3 обнаруживают примерно в 60% случаев HCC у человека (He et al., 2010, Cancer Cell 17, 286-297). Активация STAT3 также коррелирует с неблагоприятным прогнозом для пациентов с HCC (Calvisi et al., 2006, Gastroenterol. 130, 1117-1128). Конститутивно активный STAT3 действует как онкоген в клеточной трансформации (Bromberg et al., 1999, Cell 98, 295-303. Специфическая для гепатоцитов абляция STAT3 предотвращает развитие HCC у мышей (He et al., 2010, Cancer cell 17, 286-297). Ингибиторы активации STAT3 блокируют рост человеческих раковых клеток и проходят тестирование в клинических условиях в качестве средств для лечения различных форм рака, включая HCC (Chen et al., 2010, Clin. Cancer Res,16, 5189-5199; Karras et al., 2000, Cellular immunol. 202, 124-135; Lin et al., 2009, Oncogene 28, 961-972). IL-6, в числе других воспалительных цитокинов, предположительно является основным активатором STAT3 в печени (He et al., 2010, Cancer cell 17, 286-297). Показано, что сигнализация IL-6 стимулирует злокачественное прогрессирование предшественников рака печени (He et al., 2013, Cell 155, 384-396). Повышенное продуцирование IL-6 наблюдали у пациентов с первичным биллиарным циррозом, холестатическим состоянием, ассоциированным с повышенным риском развития HCC (Kakumu et al., 1993, Gastroenterologia Japonica 28, 18-24). В примере 10 и на фигуре 10 также показано, что FGF19 активирует сигнализацию STAT3 in vivo. Этот эффект может быть напрямую опосредован рецепторным комплексом FGFR4 или опосредованно через индукцию цитокинов или факторов роста. Действительно, экспрессия IL-6 повышена в печени получавших FGF19 животных в исследованиях авторов изобретения (пример 10; фигура 10).
M70 может связываться с ортостерическим сайтом на FGFR4, поскольку M70 способен вытеснять или препятствовать связыванию FGF19 и ингибирует связанную с FGF19 онкогенную активность. В то же время, M70 не блокирует все пути без разбора в одинаковой степени. M70 демонстрирует предпочтение в отношении определенных сигнальных путей FGFR4 (то есть Cyp7a1, pERK) при относительном исключении других (то есть связанных с опухолями), что наблюдается в случае некоторых аллостерических модуляторов (фигура 12).
С терапевтической точки зрения исследования авторов изобретения также предоставляют экспериментальные доказательства в пользу применения M70 для лечения хронических заболеваний и рака печени. M70 может быть полезным в качестве противоракового средства для лечения FGF19-зависимых опухолей (смотри, например, примеры 8 и 11; фигуры 7, 8 и 11). Это особенно верно с учетом того, что продуцирование FGF19 увеличено в ~15% случаев HCC человека и его экспрессия повышена при циррозе и холестатических состояниях, которые часто приводят к развитию опухолей. Хотя ранее сообщалось о разработке нейтрализующего анти-FGF19 моноклонального антитела, которое демонстрировало противоопухолевую активность в моделях ксенотрансплантатов (Desnoyers et al., 2008, Oncogene 27, 85-97), такая стратегия приводит к серьезным неблагоприятным эффектам. Введение этого антитела яванским макакам приводит к зависимой от дозы печеночной токсичности, сопровождающейся сильной диареей, вследствие целевого ингибирования эндогенного FGF19, приводящего к повышенному синтезу печеночных желчных кислот, повышенным сывороточным уровням желчных кислот, нарушениям энтерогепатической циркуляции и развитию диареи и печеночной токсичности (Pai et. al., 2012, Toxicological sciences, 126, 446-456).
Как описано в экспериментальной части, и в отличие от нейтрализующих антител, исследования авторов изобретения показали, что M70 сохраняет активность FGF19 в отношении регуляции желчных кислот, при этом утрачивая онкогенную активность (смотри, например, примеры 8, 9 и 11; фигуры 8, 9 и 11). При его использовании в качестве противоракового средства это гарантирует сохранение гомеостаза желчных кислот. Важно отметить, что экспериментальные данные, приведенные в настоящем документе, показывают, что M70 не только лишен онкогенного потенциала, но он также эффективно препятствует онкогенным эффектам, связанным с FGF19 дикого типа. Более того, M70 ингибирует рост ксенотрансплантатов раковых опухолей толстого кишечника, в дополнение к FGF19-опосредованной опухоли HCC. M70 также ингибирует рост раковой опухоли толстого кишечника в сингенной мышиной модели (смотри, например, пример 12 и фигуру 13). Эти результаты подтверждают, что в качестве избирательного модулятора FGFR4 M70 противодействует онкогенной активности FGF19.
Как описано в экспериментальной части, также была создана надежная высокопроизводительная система для оценки нескольких белков на гепатоцеллюлярный онкогенез у взрослых мышей с использованием опосредованной AAV доставки генов. Показано, что избыточная экспрессия FGF19 в ортотопическом сайте (печень) приводит к печеночной дисплазии и развитию HCC у мышей многих линий. Это исключает искажающие результаты факторы в эмбриогенезе и развитии в традиционном подходе с использованием трансгенных мышей. Не нужны никакие химические стимуляторы образования опухолей, такие как диэтилнитрозамин (DEN) или фенобарбитал, для инициирования или стимуляции образования опухолей. Этот же подход можно адаптировать для оценки других онкогенов, сигнальных белков, а также вариантов природных белков.
FGF19 проявляет целый ряд биологических эффектов. Терапевтический потенциал для FGF19 включает лечение хронических заболеваний печени, а также ожирения и диабета, но стимуляция им пролиферации гепатоцитов и канцерогенный потенциал создают проблемы для постоянного использования FGF19. Однако с идентификацией M70 в качестве генно-инженерного варианта FGF19, лишенного онкогенной активности, но сохраняющего его сильные метаболические свойства, могут быть достигнуты терапевтические преимущества без нежелательных побочных эффектов. Результаты, полученные авторами изобретения, не только подтверждают, что избирательная активация рецепторного комплекса FGFR4-KLB не вызывает образование опухолей печени, но дополнительно предоставляют новые возможности для использования этого пути в лечении рака, заболеваний с нарушениями гомеостаза желчных кислот, диабета 2 типа и других метаболических нарушений.
Молекулы полипептидов и нуклеиновых кислот
Настоящее изобретение также относится к активным фрагментам (например, подпоследовательностям) полипептидов, содержащим смежные аминокислотные остатки, происходящие из полипептидных последовательностей, описанных в настоящем документе. Длина пептидной или полипептидной подпоследовательности из смежных аминокислотных остатков варьируется в зависимости от конкретной природной аминокислотной последовательности, из которой происходит подпоследовательность. В конкретных вариантах осуществления пептиды и полипептиды имеют от примерно 5 аминокислот до примерно 10 аминокислот, от примерно 10 аминокислот до примерно 15 аминокислот, от примерно 15 аминокислот до примерно 20 аминокислот, от примерно 20 аминокислот до примерно 25 аминокислот, от примерно 25 аминокислот до примерно 30 аминокислот, от примерно 30 аминокислот до примерно 40 аминокислот, от примерно 40 аминокислот до примерно 50 аминокислот, от примерно 50 аминокислот до примерно 75 аминокислот, от примерно 75 аминокислот до примерно 100 аминокислот или от примерно 100 аминокислот вплоть до полноразмерного полипептида.
В конкретных вариантах осуществления вариантных полипептидов FGF19, предложенных в настоящем документе, общее число аминокислотных остатков (или их миметиков) составляет менее чем примерно 250. В других вариантах осуществления число аминокислотных остатков находится в диапазоне от примерно 190 до примерно 230, от примерно 200 до примерно 225 или от примерно 210 до примерно 220 остатков. В других вариантах осуществления число аминокислотных остатков составляет более 180, более 185, более 190, более 195, более 200, более 205, более 210, более 215, более 220 или более 225 остатков.
Кроме того, в конкретных вариантах осуществления полипептиды имеют определенную идентичность последовательности в сравнении с эталонной последовательностью на протяжении определенного участка из смежных аминокислот (например, в «окне сравнения»). Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с помощью алгоритма локальной гомологии, описанного в статье Smith & Waterman, Adv. Appl. Math. 2: 482 (1981), алгоритма выравнивания для оценки гомологии, описанного в статье Needleman & Wunsch, J. Mol. Biol. 48: 443 (1970), с помощью способа поиска сходства, описанного в статье Pearson & Lipman, Proc. Natʹl. Acad. Sci. USA 85: 2444 (1988), с помощью компьютерных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics Software Package, Madison, Wis.) или путем ручного выравнивания и визуальной инспекции (смотри, например, Current Protocols in Molecular Biology (Ausubel et al., eds. 1995, приложение)).
В качестве примера, в некоторых вариантах осуществления соответствующий полипептид содержит аминокислотную последовательность, имеющую по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, по меньшей мере примерно 98% или по меньшей мере примерно 99% идентичности аминокислотной последовательности с непрерывным участком длиной от примерно 5 аминокислот до примерно 10 аминокислот, от примерно 10 аминокислот до примерно 12 аминокислот, от примерно 12 аминокислот до примерно 15 аминокислот, от примерно 15 аминокислот до примерно 20 аминокислот, от примерно 20 аминокислот до примерно 25 аминокислот, от примерно 25 аминокислот до примерно 30 аминокислот, от примерно 30 аминокислот до примерно 35 аминокислот, от примерно 35 аминокислот до примерно 40 аминокислот, от примерно 40 аминокислот до примерно 45 аминокислот, от примерно 45 аминокислот до примерно 50 аминокислот, от примерно 50 аминокислот до примерно 60 аминокислот, от примерно 60 аминокислот до примерно 70 аминокислот, от примерно 70 аминокислот до примерно 80 аминокислот, от примерно 80 аминокислот до примерно 90 аминокислот, от примерно 90 аминокислот до примерно 100 аминокислот, от примерно 100 аминокислот до примерно 110 аминокислот, от примерно 110 аминокислот до примерно 120 аминокислот, от примерно 120 аминокислот до примерно 130 аминокислот, от примерно 130 аминокислот до примерно 140 аминокислот, от примерно 140 аминокислот до примерно 150 аминокислот, от примерно 150 аминокислот до примерно 160 аминокислот, от примерно 160 аминокислот до примерно 170 аминокислот, от примерно 170 аминокислот до примерно 180 аминокислот, от примерно 180 аминокислот до примерно 190 аминокислот или примерно 194 аминокислоты из одной из аминокислотных последовательностей, описанных в настоящем документе.
В конкретных вариантах осуществления полипептиды выделены из природного источника (например, находятся в окружении, отличном от их естественного окружения) и также могут быть получены рекомбинантным путем (например, в генетически модифицированной клетке-хозяине, такой как бактерии; дрожжи; грибок пичиа; клетки насекомых и тому подобное), при этом генетически модифицированная клетка-хозяин модифицирована нуклеиновой кислотой, содержащей нуклеотидную последовательность, кодирующую полипептид. Полипептиды также могут быть получены синтетически (например, с использованием бесклеточного химического синтеза). Способы получения описаны более подробно ниже.
В некоторых вариантах осуществления полипептид получен с использованием рекомбинантных методов для манипуляций с разными родственными для FGF19 нуклеиновыми кислотами, известными в данной области, с целью создания конструктов, способных кодировать полипептид. Следует принимать во внимание, что в случае конкретной аминокислотной последовательности квалифицированному специалисту известно несколько разных молекул нуклеиновой кислоты, кодирующих такую аминокислотную последовательность, на основании его образования и опыта, например, в области молекулярной биологии.
В некоторых вариантах осуществления настоящее изобретение также относится к полипептидам, которые имеют одно или более изменений в аминокислотных остатках (например, в участках, которые не являются консервативными у разных вариантов или видов) по сравнению с эталонной последовательностью (например, соответствующей последовательностью дикого типа). В таких полипептидах часто сохраняют домены, которые являются консервативными у разных видов и имеют ту же биологическую активность, что и существующие в природе полипептиды. Такие полипептиды также часто имеют одну или более консервативных аминокислотных замен. Выражение «консервативная аминокислотная замена», как правило, означает замену аминокислотных остатков внутри следующих групп: 1) L, I, M, V, F; 2) R, K; 3) F, Y, H, W, R; 4) G, A, T, S; 5) Q, N и 6) D, E. При консервативных аминокислотных заменах сохраняется активность белка за счет замены аминокислоты(аминокислот) в белке аминокислотой с боковой цепью, имеющей аналогичную кислотность, основность, заряд, полярность или размер боковой цепи. Руководство по выполнению замен, вставок или делеций может быть основано на выравнивании аминокислотных последовательностей различных вариантных белков или белков из разных биологических видов.
В конкретных вариантах осуществления предусмотрены модификации области петли-8 в FGF19. В настоящем документе остатки 127-129 в FGF19 (SEQ ID NO: 3) определяют, как составляющие область петли-8, хотя в литературе область петли-8 иногда определяют, как содержащую или состоящую из других остатков (например, остатков 125-129). Определенные сочетания замен R127L и P128E в каркасе FGF19 неожиданно оказали положительный эффект на образование HCC. Сочетание замен R127L и P128E и замены Gln (Q) на Leu (L) в центральной области FGF19 также оказали существенное влияние на предотвращение образования HCC.
Соответственно, в изобретение включены варианты области петли-8 в FGF19, поскольку они способны приводить к уменьшению или устранению образования значительной, измеримой или поддающейся обнаружению HCC. Более того, эффект уменьшения образования HCC можно усиливать путем модификаций аминокислотных остатков за пределами области петли-8 (например, замен аминокислотных остатков в центральной области, например, области, соответствующей аминокислотам 21-29 в SEQ ID NO: 3).
В некоторых вариантах осуществления вариантом с модифицированной петлей-8 является M70:
MRDSSPLVHYGWGDPIRLRHLYTSGPHGLSSCFLRIRADGVVDCARGQSAHSLLEIKAVALRTVAIKGVHSVRYLCMGADGKMQGLLQYSEEDCAFEEEIRPDGYNVYRSEKHRLPVSLSSAKQRQLYKNRGFLPLSHFLPMLPMVPEEPEDLRGHLESDMFSSPLETDS16MDPFGLVTGLEAVRSPSFEK (SEQ ID NO: 70), содержащий замену в области петли-8 FGF19 (подчеркнуто). В конкретных вариантах осуществления вариант M70 с модифицированной петлей-8 содержит замену в области петли-8 FGF19 (подчеркнуто), соответствующую (i) замене R127L, (ii) замене P128E или (iii) замене R127L и замене P128E. В конкретных вариантах осуществления вариант M70 с модифицированной петлей-8 содержит или дополнительно содержит замену в центральной области FGF19. В некоторых вариантах осуществления вариант M70 с модифицированной петлей-8 содержит замену L18Q.
В других вариантах осуществления вариантом с модифицированной петлей-8 является M5 (SEQ ID NO: 5), M6 (SEQ ID NO: 6), M7 (SEQ ID NO: 7), M14 (SEQ ID NO: 8), M15 (SEQ ID NO: 9), M32 (SEQ ID NO: 10), M36 (SEQ ID NO: 11), M43 (SEQ ID NO: 12), M50 (SEQ ID NO: 13), M52 (SEQ ID NO: 14), M53 (SEQ ID NO: 15), M67 (SEQ ID NO: 16), M68 (SEQ ID NO: 17), M69 (SEQ ID NO: 18), M70 (SEQ ID NO: 1 или 19), M75 (SEQ ID NO: 20), M76 (SEQ ID NO: 21), M77 (SEQ ID NO: 22), M83 (SEQ ID NO: 23), M84 (SEQ ID NO: 24), M140 (SEQ ID NO: 25), M5-R (SEQ ID NO: 26), M6-R (SEQ ID NO: 27), M50-R (SEQ ID NO: 28) или M160 (SEQ ID NO: 29). В некоторых вариантах осуществления вариант с модифицированной петлей-8 содержит замену в области петли-8 FGF19, соответствующую аминокислотам 127-129 в SEQ ID NO: 3. В конкретных вариантах осуществления вариант с модифицированной петлей-8 содержит замену в области петли-8 FGF19, соответствующую (i) замене R127L, (ii) замене P128E или (iii) замене R127L и замене P128E. В некоторых вариантах осуществления вариант FGF19 содержит или дополнительно содержит замену в центральной области, соответствующую аминокислотам 21-29 в SEQ ID NO: 3. В конкретных вариантах осуществления вариант FGF19 содержит или дополнительно содержит замену в центральной области, соответствующую замене L22Q.
Молекулы нуклеиновой кислоты, кодирующие полипептиды, описанные в настоящем документе, предусмотрены по настоящему изобретению, включая их природные и неприродные изоформы, аллельные варианты и сплайс-варианты. Настоящее изобретение также включает нуклеотидные последовательности, которые отличаются по одному или более основаниям от природной последовательности ДНК, но все еще транслируются в аминокислотную последовательность, которая соответствует полипептиду вследствие вырожденности генетического кода.
Замены амидной связи
В некоторых случаях полипептид содержит одну или более связей, отличных от пептидных связей, например, по меньшей мере две соседние аминокислоты соединены связью, отличной от амидной связи. Например, для уменьшения или устранения нежелательного протеолиза или других видов деградации, и/или для увеличения стабильности в сыворотке, и/или для ограничения или увеличения конформационной гибкости одна или более амидных связей в каркасе полипептида могут быть заменены.
В другом примере одна или более амидных связей (-CO-NH-) в полипептиде могут быть заменены связью, которая является изостерой амидной связи, например, -CH2NH-, CH2S-, -CH2CH2-, -CH=CH-(цис и транс), -COCH2-, -CH(OH)CH2- или -CH2SO-. Одна или более амидных связей в полипептиде также могут быть заменены, например, восстановленной изостерной псевдопептидной связью. Смотри Couder et al. (1993) Int. J. Peptide Protein Res. 41: 181-184. Такие замены и способы их осуществления известны специалистам в данной области.
Аминокислотные замены
В конкретных вариантах осуществления в полипептиде осуществлены одна или более аминокислотных замен. Далее приведены неограничивающие примеры:
a) замена алкил-замещенных гидрофобных аминокислот, включая аланин, лейцин, изолейцин, валин, норлейцин, (S)-2-аминомасляную кислоту, (S)-циклогексилаланин или другие простые альфа-аминокислоты, замещенные алифатической боковой цепью из C1-C10 атомов углерода, включая замены разветвленным, циклическим и неразветвленным алкилом, алкенилом или алкинилом;
b) замена ароматических-замещенных гидрофобных аминокислот, включая фенилаланин, триптофан, тирозин, сульфотирозин, бифенилаланин, 1-нафтилаланин, 2-нафтилаланин, 2-бензотиенилаланин, 3-бензотиенилаланин, гистидин, включая амино, алкиламино, диалкиламино, аза, галогенированные (фтор, хлор, бром или иод) или алкокси (от C1-C4)-замещенные формы вышеперечисленных ароматических аминокислот, иллюстративными примерами которых являются: 2-, 3- или 4-аминофенилаланин, 2-, 3- или 4-хлорфенилаланин, 2-, 3- или 4-метилфенилаланин, 2-, 3- или 4-метоксифенилаланин, 5-амино-, 5-хлор-, 5-метил- или 5-метокситриптофан, 2ʹ-, 3ʹ- или 4ʹ-амино-, 2ʹ-, 3ʹ- или 4ʹ-хлор-, 2, 3, или 4-бифенилаланин, 2ʹ-, 3ʹ- или 4ʹ-метил-, 2-, 3- или 4-бифенилаланин и 2- или 3-пиридилаланин;
c) замена аминокислот, содержащих основные боковые цепи, включая аргинин, лизин, гистидин, орнитин, 2,3-диаминопропионовую кислоту, гомоаргинин, включая алкил, алкенил или арил-замещенные (от C1-C10 разветвленные, линейные или циклические) производные вышеуказанных аминокислот, расположен ли заместитель на гетероатомах (таких как альфа-атом азота, или дистальный атом или атомы азота, или на альфа-атоме углерода, в про-R положении, например. Соединения, которые служат иллюстративными примерами, включают: N-эпсилон-изопропил-лизин, 3-(4-тетрагидропиридил)-глицин, 3-(4-тетрагидропиридил)-аланин, N,N-гамма,гаммаʹ-диэтил-гомоаргинин. Также включены такие соединения, как альфа-метил-аргинин, альфа-метил-2,3-диаминопропионовая кислота, альфа-метил-гистидин, альфа-метил-орнитин, в которых алкильная группа занимает про-R положение альфа-атома углерода. Также включены амиды, образованные из алкильных, ароматических, гетероароматических (где гетероароматическая группа имеет один или более атомов азота, кислорода или серы, отдельно или в сочетании) карбоновых кислот, или любые из многих хорошо известных активированных производных, таких как кислые хлориды, активные сложные эфиры, активные азолиды и родственные производные), а также лизин, орнитин или 2,3-диаминопропионовую кислоту;
d) замена кислых аминокислот, включая аспарагиновую кислоту, глютаминовую кислоту, гомоглютаминовую кислоту, тирозин, алкил, арил, арилалкил и гетероарил сульфонамиды 2,4-диаминоприопионовой кислоты, орнитина или лизина и тетразол-замещенные алкил-аминокислоты;
e) замена остатка с амидом в боковой цепи, включая аспарагин, глютамин, и алкил или ароматические замещенные производные аспарагина или глютамина; и/или
f) замена гидроксил-содержащих аминокислот, включая серин, треонин, гомосерин, 2,3-диаминопропионовую кислоту, и алкил или ароматические замещенные производные серина или треонина.
В некоторых вариантах осуществления полипептид содержит одну или более существующих в природе не кодируемых генетически L-аминокислот, синтетических L-аминокислот, или D-энантиомеры аминокислот. Например, полипептид может содержать только D-аминокислоты. Например, в конкретных вариантах осуществления полипептид содержит один или более из следующих остатков: гидроксипролин, β-аланин, о-аминобензойная кислота, м-аминобензойная кислота, п-аминобензойная кислота, м-аминометилбензойная кислота, 2,3-диаминопропионовая кислота, α-аминоизомасляная кислота, N-метилглицин (саркозин), орнитин, цитруллин, т-бутилаланин, т-бутилглицин, N-метилизолейцин, фенилглицин, циклогексилаланин, норлейцин, нафтилаланин, пиридилаланин, 3-бензотиенилаланин, 4-хлорфенилаланин, 2-фторфенилаланин, 3-фторфенилаланин, 4-фторфенилаланин, пеницилламин, 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота, β-2-тиенилаланин, метионинсульфоксид, гомоаргинин, N-ацетиллизин, 2,4-диаминомасляная кислота, rho-аминофенилаланин, N-метилвалин, гомоцистеин, гомосерин, ε-аминогексановая кислота, ω-аминогексановая кислота, ω-аминогептановая кислота, ω-аминооктановая кислота, ω-аминодекановая кислота, ω-аминотетрадекановая кислота, циклогексилаланин, α,γ -диаминомасляная кислота, α,β -диаминопропионовая кислота, δ-аминовалериановая кислота и 2,3-диаминомасляная кислота.
Дополнительные модификации
В некоторых вариантах осуществления остаток цистеина или аналога цистеина вводят в полипептид для обеспечения связывания с другим пептидом посредством дисульфидной связи или для обеспечения циклизации полипептида. Способы введения остатка цистеина или аналога цистеина известны в данной области; смотри, например, патент США № 8067532.
В других вариантах осуществления полипептид циклизован. Например, один или более остатков цистеина или аналогов цистеина можно вводить в полипептид, при этом введенный остаток цистеина или аналога цистеина может образовывать дисульфидную связь со вторым введенным остатком цистеина или аналога цистеина. Другие способы циклизации включают введение линкера с оксимом или линкера с лантионином; смотри, например, патент США № 8044175. Можно использовать и/или вводить любое сочетание аминокислот (или не аминокислотных фрагментов), которые могут образовывать циклизующую связь. Циклизующую связь можно создавать с использованием любого сочетания аминокислот (или с аминокислотой и -(CH2)n-CO- или -(CH2)n-C6H4-CO-) с функциональными группами, которые позволяют создавать мост. Некоторыми примерами являются дисульфиды, дисульфидные миметики, такие как -(CH2)n-карба мост, тиоацеталь, тиоэфирные мосты (цистатионин или лантионин) и мосты, содержащие сложные и простые эфиры. В этих примерах n может быть любым целым числом, но часто меньшим, чем десять.
Другие иллюстративные модификации включают, например, N-алкильную (или арильную) замену (ψ [CONR]) или сшивку каркасов для создания лактамов и других циклических структур. Другие производные модулирующих соединений по настоящему изобретению включают C-концевые гидроксиметильные производные, O-модифицированные производные (например, C-концевой гидроксиметильный бензиловый эфир), модифицированные по N-концу производные, включая замещенные амиды, такие как алкиламиды и гидразиды.
В некоторых случаях одна или более L-аминокислот в полипептиде заменены D-аминокислотами.
В некоторых случаях полипептид представляет собой ретро-инверсо аналог (Sela and Zisman (1997) FASEB J. 11: 449). Ретро-инверсо пептидные аналоги представляют собой изомеры линейных полипептидов, в которых направление аминокислотной последовательности является обратным (ретро) и хиральность, D- или L-, одной или более аминокислот в которых является инвертированной (инверсо), например, использование D-аминокислот, а не L-аминокислот. Смотри, например, Jameson et al. (1994) Nature 368: 744; и Brady et al. (1994) Nature 368: 692.
Полипептид может содержать «домен белковой трансдукции» (ДБТ), который представляет собой полипептид, полинуклеотид, углевод, либо органическое или неорганическое соединение, которое облегчает пересечение липидного бислоя, мицелл, клеточной мембраны, мембраны органелл или мембраны везикул. ДБТ, присоединенный к другой молекуле, облегчает пересечение молекулой мембраны, например, переход из внеклеточного пространства во внутриклеточное пространство или из цитозоля в органеллы. В некоторых вариантах осуществления ДБТ ковалентно связан с амино-концом полипептида, в то время как в других вариантах осуществления ДБТ ковалентно связан с карбоксильным концом полипептида. Иллюстративные домены белковой трансдукции включают, но не ограничиваются ими, минимальный ундекапептидный домен белковой трансдукции (соответствующий остаткам 47-57 в TAT ВИЧ-1, включающим YGRKKRRQRRR; SEQ ID NO: 30); полиаргининовую последовательность, содержащую число остатков аргинина, достаточное для прямого проникновения в клетку (например, 3, 4, 5, 6, 7, 8, 9, 10 или 10-50 остатков аргинина); домен VP22 (Zender et al. (2002) Cancer Gene Ther. 9(6): 489-96); домен белковой трансдукции Drosophila antennapedia (Noguchi et al. (2003) Diabetes 52(7): 1732-1737); укороченный человеческий кальцитониновый пептид (Trehin et al. (2004) Pharm. Research 21: 1248-1256); полилизин (Wender et al. (2000) Proc. Natl. Acad. Sci. USA 97: 13003-13008); RRQRRTSKLMKR (SEQ ID NO: 31); транспортан GWTLNSAGYLLGKINLKALAALAKKIL (SEQ ID NO: 32); KALAWEAKLAKALAKALAKHLAKALAKALKCEA (SEQ ID NO: 33) и RQIKIWFQNRRMKWKK (SEQ ID NO: 34). Иллюстративные ДБТ включают, но не ограничиваются ими, YGRKKRRQRRR (SEQ ID NO: 30), RKKRRQRRR (SEQ ID NO: 35); аргининовый гомополимер, содержащий от 3 остатков аргинина до 50 остатков аргинина. Иллюстративные аминокислотные последовательности домена ДБТ включают, но не ограничиваются ими, любые из следующих: YGRKKRRQRRR (SEQ ID NO: 30); RKKRRQRR (SEQ ID NO: 36); YARAAARQARA (SEQ ID NO: 37); THRLPRRRRRR (SEQ ID NO: 38) и GGRRARRRRRR (SEQ ID NO: 39).
Карбоксильная группа COR3 аминокислоты на C-конце полипептида может находиться в свободной форме (R3=OH) или в форме физиологически приемлемой соли щелочных или щелочно-земельных металлов, такой как, например, соль натрия, калия или кальция. Карбоксильная группа также может быть эстерифицирована первичными, вторичными или третичными спиртами, такими как, например, метанол, разветвленные или неразветвленные C1-C6-алкиловые спирты, например, этиловый спирт или трет-бутанол. Карбоксильная группа также может быть амидирована первичными или вторичными аминами, такими как аммиак, разветвленные или неразветвленные C1-C6-алкиламины или C1-C6 диалкиламины, например, метиламин или диметиламин.
Аминогруппа аминокислоты NR1R2 на N-конце полипептида может находиться в свободной форме (R1=H и R2=H) или в форме физиологически приемлемой соли, такой как, например, хлорид или ацетат. Аминогруппа также может быть ацетилирована кислотами так, что R1=H и R2=ацетил, трифторацетил или адамантил. Аминогруппа может находиться в форме, защищенной амино-защитными группами, обычно используемыми в пептидной химии, такими как, например, Fmoc, бензилоксикарбонил (Z), Boc или Alloc. Аминогруппа может быть N-алкилирована так, что R1 и/или R2=C1-C6 алкил или C2-C8 алкенил или C7-C9 аралкил. Алкильные остатки могут быть с прямой цепью, разветвленные или циклические (например, этил, изопропил и циклогексил, соответственно).
Методы получения полипептидов
Полипептид по настоящему изобретению можно получать любым подходящим методом, включая рекомбинантные и не рекомбинантные методы (например, химический синтез).
A. Химический синтез
Если полипептид синтезируют химически, синтез можно выполнять с использованием жидкой фазы или твердой фазы. Твердофазный пептидный синтез (ТФПС) позволяет включать неприродные аминокислоты и/или каркасные модификации пептида/белка. Различные виды ТФПС, например, с использованием Fmoc и Boc, доступны для синтеза полипептидов по настоящему изобретению. Методики химического синтеза известны в данной области (например, Ganesan A. 2006 Mini Rev. Med. Chem. 6: 3-10; и Camarero J.A. et al., 2005 Protein Pept Lett. 12: 723-8).
Твердофазный пептидный синтез можно проводить, как описано далее в настоящем документе. α-функциональные группы (Nα) и любые реакционноспособные боковые цепи защищают кислотно-лабильными или щелочно-лабильными группами. Защитные группы стабильны в условиях для образования амидных связей, но могут легко расщепляться без ущерба для образовавшейся пептидной цепи. Подходящие защитные группы для α-амино функциональных групп включают, но не ограничиваются ими, следующие: т-бутилоксикарбонил (Boc), бензилоксикарбонил (Z), о-хлорбензилоксикарбонил, би-фенилизопропилоксикарбонил, трет-амилоксикарбонил (Amoc), α,α -диметил-3,5-диметокси-бензилоксикарбонил, о-нитросульфенил, 2-циано-т-бутоксикарбонил, 9-флуоренилметоксикарбонил (Fmoc), 1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил (Dde) и тому подобное.
Подходящие защитные группы боковых цепей включают, но не ограничиваются ими: ацетил, аллил (All), аллилоксикарбонил (Alloc), бензил (Bzl), бензилоксикарбонил (Z), т-бутилоксикарбонил (Boc), бензилоксиметил (Bom), о-бромбензилоксикарбонил, т-бутил (tBu), т-бутилдиметилсилил, 2-хлорбензил, 2-хлорбензилоксикарбонил (2-CIZ), 2,6-дихлорбензил, циклогексил, циклопентил, 1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил (Dde), изопропил, 4-метокси-2,3-6-триметилбензилсульфонил (Mtr), 2,3,5,7,8-пентаметилхроман-6-сульфонил (Pmc), пивалил, тетрагидропиран-2-ил, тозил (Tos), 2,4,6-триметоксибензил, триметилсилил и тритил (Trt).
В твердофазном синтезе C-концевую аминокислоту связывают с подходящим материалом подложки. Подходящими материалами подложки являются такие материалы, которые инертны в отношении реагентов и условий реакции ступенчатой конденсации и реакций расщепления в процессе синтеза, и которые не растворяются в используемой реакционной среде. Примеры коммерчески доступных материалов подложки включают сополимеры стирола/дивинилбензола, модифицированные реакционноспособными группами и/или полиэтиленгликолем; хлорметилированные сополимеры стирола/дивинилбензола; гидроксиметилированные или аминометилированные сополимеры стирола/дивинилбензола и тому подобное. Можно использовать полистирол (1%)-дивинилбензол или TentaGel®, дериватизированный 4-бензилоксибензиловым спиртом (Wang-якорь) или 2-хлортритилхлоридом, если нужно получить пептидную кислоту. В случае пептидного амида можно использовать полистирол (1%) дивинилбензол или TentaGel®, дериватизированный 5-(4'-аминометил)-3ʹ,5ʹ-диметоксифенокси)валериановой кислотой (PAL-якорь) или п-(2,4-диметоксифениламинометил)фенокси-группой (амидный Rink-якорь).
Связывание с полимерной подложкой может быть достигнуто за счет реакции C-концевой Fmoc-защищенной аминокислоты с материалом подложки при добавлении реагента активации в этаноле, ацетонитриле, N,N-диметилформамиде (DMF), дихлорметане, тетрагидрофуране, N-метилпирролидоне или аналогичных растворителях при комнатной температуре или повышенной температуре (например, от 40°C до 60°C) и со временем реакции, составляющим, например, от 2 до 72 часов.
Связывание Nα-защищенной аминокислоты (например, Fmoc-аминокислоты) с PAL, Wang или Rink якорем, например, можно осуществлять с помощью сшивающих реагентов, таких как N,Nʹ-дициклогексилкарбодиимид (DCC), N,Nʹ-диизопропилкарбодиимид (DIC) или другие карбодиимиды, 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторборат (TBTU) или другие соли урония, о-ацилмочевины, бензотриазол-1-ил-трис-пирролидинoфосфония гексафторфосфат (PyBOP) или другие соли фосфония, N-гидроксисукцинимиды, другие N-гидроксиимиды или оксимы в присутствии или в отсутствие 1-гидроксибензотриазола или 1-гидрокси-7-азабензотриазола, например, при помощи TBTU с добавлением HOBt, с добавлением или без добавления основания, такого как, например, диизопропилэтиламин (DIEA), триэтиламин или N-метилморфолин, например, диизопропилэтиламин, со временем реакции, составляющим от 2 до 72 часов (например, 3 часа с 1,5-3-кратным избытком аминокислоты и сшивающими реагентами, например, с 2-кратным избытком и при температуре примерно от 10°C до 50°C, например, 25°C, в таком растворителе, как диметилформамид, N-метилпирролидон или дихлорметан, например, диметилформамид).
Вместо сшивающих реагентов также можно использовать активные сложные эфиры (например, пентафторфенил, п-нитрофенил или тому подобное), симметричный ангидрид Nα-Fmoc-аминокислоты, ее кислый хлорид или кислый фторид в условиях, описанных выше.
Nα-защищенную аминокислоту (например, Fmoc-аминокислоту) можно связывать с 2-хлортритиловой смолой в дихлорметане с добавлением DIEA и временем реакции от 10 до 120 минут, например, 20 минут, но условия не ограничиваются использованием данного растворителя и данного основания.
Последовательное связывание защищенных аминокислот можно выполнять общепринятыми методами пептидного синтеза, как правило, в автоматическом пептидном синтезаторе. После отщепления Nα-Fmoc-защитной группы связанной на твердой фазе аминокислоты путем обработки, например, пиперидином (10% - 50%) в диметилформамиде в течение 5-20 минут, например, 2×2 минуты 50% пиперидином в ДМФ и 1×15 минут 20% пиперидином в ДМФ, следующую защищенную аминокислоту в 3-10-кратном избытке, например, в 10-кратном избытке, связывают с предыдущей аминокислотой в инертном неводном полярном растворителе, таком как дихлорметан, ДМФ или их смеси и при температуре примерно от 10°C до 50°C, например, при температуре 25°C. В качестве сшивающих реагентов подходящими являются ранее упомянутые реагенты для связывания первой Nα-Fmoc-аминокислоты с PAL, Wang или Rink якорем. В качестве альтернативы также можно использовать активные сложные эфиры защищенной аминокислоты, либо ее хлориды или фториды, или симметричные ангидриды.
После завершения твердофазного синтеза пептид отщепляют от материала подложки, в то же время отщепляя защитные группы боковых цепей. Отщепление можно осуществлять при помощи трифторуксусной кислоты или другой сильнокислой среды с добавлением 5%-20% (по объему) поглотителей, таких как диметилсульфид, этилметилсульфид, тиоанизол, тиокрезол, м-крезол, анизолэтандитиол, фенол или вода, например, 15% (по объему) смесь диметилсульфид/этандитиол/м-крезол в соотношении 1:1:1, в течение 0,5-3 часов, например, 2 часов. Пептиды с полностью защищенными боковыми цепями получают путем расщепления 2-хлортритилового якоря смесью ледяная уксусная кислота/трифторэтанол/дихлорметан в соотношении 2:2:6. Защищенный пептид можно очищать хроматографией на силикагеле. Если пептид связан с твердой фазой через Wang-якорь и если нужно получить пептид с C-концевым алкиламидированием, расщепление можно выполнять путем аминолиза с помощью алкиламина или фторалкиламина. Аминолиз проводят при температуре примерно от 10°C до 50°C (например, примерно 25°C), и время реакции составляет от примерно 12 до 24 часов (например, примерно 18 часов). Кроме того, пептид можно отщеплять от подложки переэстерификацией, например, с помощью метанола.
Полученный кислый раствор можно смешивать с 3-20-кратным количеством холодного эфира или н-гексана, например, 10-кратным избытком диэтилового эфира, для осаждения пептида и, таким образом, для отделения поглотителей и отщепленных защитных групп, которые остаются в эфире. Дальнейшую очистку можно проводить путем повторного осаждения пептида несколько раз ледяной уксусной кислотой. Полученный осадок можно растворять в воде или трет-бутаноле, либо смесях этих двух растворителей, например, в 1:1 смеси трет-бутанол/вода, и лиофилизировать.
Полученный пептид можно очищать различными хроматографическими методами, включая ионообмен со слабощелочной смолой в форме ацетата; гидрофобную адсорбционную хроматографию на не дериватизированных сополимерах полистирола/дивинилбензола (например, Amberlite® XAD); адсорбционную хроматографию на силикагеле; ионообменную хроматографию, например, на карбоксиметилцеллюлозе; распределительную хроматографию, например, на Sephadex® G-25; противоточную распределительную хроматографию или высокоэффективную жидкостную хроматографию (ВЭЖХ) например, обращенно-фазовую ВЭЖХ на фазах октила или октадецилсилилсиликагеля (ODS).
B. Рекомбинантное продуцирование
Если полипептид получают с использованием рекомбинантных методов, полипептид можно получать в виде внутриклеточного белка или секретируемого белка с использованием любого подходящего конструкта и любой подходящей клетки-хозяина, которая может представлять собой прокариотическую или эукариотическую клетку, такую как бактериальная (например, E. coli) или дрожжевая клетка-хозяин, соответственно. Другие примеры эукариотических клеток, которые можно использовать в качестве клеток-хозяев, включают клетки насекомых, клетки млекопитающих и/или клетки растений. Если используют клетки-хозяева млекопитающих, они могут включать человеческие клетки (например, клетки HeLa, 293, H9 и Jurkat); мышиные клетки (например, клетки NIH3T3, клетки L и клетки C127); клетки приматов (например, Cos 1, Cos 7 и CV1) и клетки хомячков (например, клетки яичника китайского хомячка (CHO)).
Можно использовать различные системы «хозяин-вектор», подходящие для экспрессии полипептида, в соответствии со стандартными методами, известными в данной области. Смотри, например, Sambrook et al., 1989 Current Protocols in Molecular Biology, Cold Spring Harbor Press, New York; и Ausubel et al. 1995 Current Protocols in Molecular Biology, Eds. Wiley и Sons. Методы введения генетического материала в клетки-хозяева включают, например, трансформацию, электропорацию, конъюгацию, методы с использованием фосфата кальция и тому подобное. Метод переноса можно выбирать так, чтобы обеспечить стабильную экспрессию введенной кодирующей полипептид нуклеиновой кислоты. Кодирующую полипептид нуклеиновую кислоту можно вводить в виде наследуемого эписомного элемента (например, плазмиды) или можно встраивать в геном. Различные подходящие векторы для использования в получении интересующего полипептида являются коммерчески доступными.
Векторы могут обеспечивать внехромосомное сохранение в клетке-хозяине или могут обеспечивать интегрирование в геном клетки-хозяина. Экспрессионный вектор предоставляет последовательности регуляции транскрипции и трансляции, и может обеспечивать индуцируемую или конститутивную экспрессию, когда кодирующая область функционально связана под транскрипционным контролем области инициации транскрипции, а также области терминации транскрипции и трансляции. Как правило, последовательности регуляции транскрипции и трансляции могут включать, но не ограничиваются ими, последовательности промотора, сайты связывания рибосомы, последовательности начала и остановки транскрипции, последовательности начала и остановки трансляции, а также последовательности энхансера или активатора. Промоторы могут быть или конститутивными, или индуцируемыми, и могут быть сильными конститутивными промоторами (например, T7).
Экспрессионные конструкты, как правило, имеют удобные сайты рестрикции, расположенные рядом с последовательностью промотора, для обеспечения вставки последовательностей нуклеиновой кислоты, кодирующих интересующие белки. Для облегчения селекции клеток, содержащих вектор, может присутствовать селективный маркер, функциональный в экспрессирующем хозяине. Кроме того, экспрессионный конструкт может включать дополнительные элементы. Например, экспрессионный вектор может иметь одну или две системы репликации, таким образом, он получает возможность сохраняться в организмах, например, в клетках млекопитающих или насекомых для экспрессии и в прокариотических хозяевах для клонирования и амплификации. Кроме того, экспрессионный конструкт может содержать ген селективного маркера, позволяющий отбирать трансформированные клетки-хозяева. Гены селективных маркеров хорошо известны в данной области и варьируются в зависимости от используемой клетки-хозяина.
Выделение и очистку белка можно осуществлять методами, известными в данной области. Например, белок можно выделять из лизата клеток, генетически модифицированных для экспрессии белка конститутивно и/или после индукции, или из синтетической реакционной смеси путем иммуноаффинной очистки, которая, как правило, включает создание контакта образца с антителом против белка, промывание для удаления неспецифически связанного материала и элюирование специфически связанного белка. Выделенный белок можно дополнительно очищать диализом и другими методами, обычно используемыми в очистке белков. В одном варианте осуществления белок можно выделять с использованием методов металл-хелатной хроматографии. Белки могут иметь модификации для облегчения выделения.
Полипептиды можно получать в по существу чистой или выделенной форме (например, свободной от других полипептидов). Полипептиды могут присутствовать в композиции, обогащенной данным полипептидом относительно других компонентов, которые могут присутствовать (например, других полипептидов или других компонентов клетки-хозяина). Например, можно получать очищенный полипептид таким образом, что полипептид будет присутствовать в композиции, которая по существу свободна от других экспрессированных белков, например, другие экспрессированные белки составляют менее 90%, менее 60%, менее 50%, менее 40%, менее 30%, менее 20%, менее 10%, менее 5% или менее 1% композиции.
Терапевтическое и профилактическое применение
В настоящем документе также предложены способы лечения или предотвращения гипергликемии, гиперинсулинемии, нарушения толерантности к глюкозе, нарушения метаболизма глюкозы, ожирения и других нарушений массы тела, а также других метаболических и связанных с метаболизмом заболеваний, нарушений и состояний путем введения определенных средств или их композиций. Более того, как описано в настоящем документе, настоящее изобретение относится к способам лечения или предотвращения множества других заболеваний, нарушений и состояний. Такие способы также могут иметь благоприятный эффект на один или более симптомов, ассоциированных с заболеванием, нарушением или состоянием, путем, например, снижения степени тяжести или частоты проявления симптома. В конкретных вариантах осуществления способ является способом лечения заболевания или нарушения. В других вариантах осуществления способ является способом предотвращения заболевания или нарушения.
В конкретных вариантах осуществления настоящее изобретение относится к способу лечения (или предотвращения, в определенных обстоятельствах) для субъекта с метаболическим нарушением, включающему выявление субъекта, имеющего метаболическое нарушение, при этом субъект имеет квалифицирующие признаки FGF19-индуцированного онкологического заболевания, и введение субъекту терапевтически эффективного количества варианта FGF19, идентифицированного в группе вариантов-кандидатов полипептидов FGF19, как описано в настоящем документе; при этом имеет место уменьшение метаболического нарушения у субъекта.
Неограничивающие примеры заболеваний, нарушений и состояний включают: 1) нарушения утилизации глюкозы и связанные с этим осложнения, включая сахарный диабет (I типа и II типа), гестационный диабет, гипергликемию, устойчивость к инсулину, аномальный метаболизм глюкозы, «преддиабет» (аномальные уровни глюкозы в крови натощак (IFG) или нарушенную толерантность к глюкозе (IGT)), а также другие физиологические нарушения, ассоциированные с, или являющиеся результатом гипергликемического состояния, включая, например, гистопатологические изменения, такие как разрушение панкреатических β-клеток. Другие связанные с гипергликемией нарушения включают поражение почек (например, повреждение канальцев или нефропатию), дегенерацию печени, поражения глаз (например, диабетическую ретинопатию или катаракту) и диабетическое поражение стоп; 2) дислипидемии и их осложнения, такие как, например, атеросклероз, болезнь коронарных артерий, цереброваскулярные нарушения и тому подобное; 3) другие состояния, которые могут быть ассоциированы с метаболическим синдромом, такие как ожирение и избыточная масса тела (включая сопутствующие им состояния, такие как, но не ограничиваясь ими, болезнь неалкогольной жировой инфильтрации печени (NAFLD), неалкогольный стеатогепатит (NASH) и синдром поликистоза яичников (PCOS)), и также включают тромбозы, состояния гиперкоагуляции и протромбоза (артериальные и венозные), гипертензию, сердечно-сосудистые заболевания, инсульт и сердечную недостаточность; 4) заболевания или состояния с вовлечением воспалительных реакций, включая атеросклероз, хронические воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), астму, красную волчанку, артрит или другие воспалительные ревматические заболевания; 5) нарушения клеточного цикла или процессов клеточной дифференциации, например, опухоли из клеток жировой ткани, липоматозные карциномы, включая, например, липосаркомы, солидные опухоли и новообразования; 6) нейродегенеративные заболевания и/или демиелинизирующие заболевания центральной и периферической нервных систем и/или неврологические заболевания с вовлечением нейровоспалительных процессов и/или другие периферические невропатии, включая болезнь Альцгеймера, рассеянный склероз, болезнь Паркинсона, прогрессирующую мультифокальную лейкоэнцефалопатию и синдром Гийена-Барре; 7) кожные и дерматологические заболевания и/или нарушения процессов заживления ран, включая эритемато-сквамозные дерматозы; и 8) другие заболевания, такие как синдром X, остеоартрит и острый респираторный дистресс-синдром.
Для определения того, может ли субъект быть кандидатом на лечение или предотвращение гипергликемии, гиперинсулинемии, нарушения толерантности к глюкозе и/или нарушений метаболизма глюкозы способами, описанными в настоящем документе, можно использовать различные диагностические методы, известные в данной области (например, оценку уровней глюкозы в плазме натощак (FPG) и пероральный тест на толерантность к глюкозе (oGTT)).
Для определения того, может ли субъект быть кандидатом на лечение или предотвращение нарушения массы тела (например, ожирения) способами, описанными в настоящем документе, следует оценивать параметры, такие как, но не ограничиваясь ими, этиология и степень тяжести состояния субъекта (например, насколько избыточную массу тела имеет субъект по сравнению с контрольным здоровым индивидуумом). Например, взрослый человек, имеющий ИМТ от ~25 до ~29,9 кг/м2, может считаться имеющим избыточную массу тела (предожирение), в то время как взрослый человек, имеющий ИМТ ~30 кг/м2 или выше, может считаться тучным. В случае субъектов, имеющих избыточную массу тела и/или неправильную диету (например, диеты с высоким содержанием жира и калорий), обычно сначала используют и оценивают эффект изменения пищевых привычек и/или режимов физических упражнений прежде, чем начинать курс лечения одним или более из полипептидов по настоящему изобретению.
В настоящем документе также предложен способ лечения субъекта (например, животного, такого как человек), имеющего метаболическое или связанное с метаболизмом заболевание, нарушение или состояние, включающий: (i) определение того, является ли тестируемый субъект, имеющий метаболическое нарушение, кандидатом на лечение вариантом FGF19, включающее: (a) выявление тестируемого субъекта, имеющего квалифицирующие признаки онкологического заболевания, субъекта, имеющего метаболическое нарушение, (b) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и (c) определение того, усиливаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие усиления квалифицирующих признаков онкологического заболевания указывает на то, что тестируемый субъект является кандидатом на лечение вариантом FGF19; и при этом, если усиление квалифицирующих признаков онкологического заболевания у тестируемого субъекта отсутствует, тогда способ дополнительно включает (ii) последующее введение варианта FGF19 субъекту (например, животному, такому как человек). В конкретных вариантах осуществления последующее введение варианта FGF19 в терапевтически эффективном количестве приводит к лечению метаболического или связанного с метаболизмом заболевания, нарушения или состояния у субъекта (например, животного, такого как человек).
В настоящем документе также предложен способ лечения субъекта (например, животного, такого как человек), имеющего метаболическое или связанное с метаболизмом заболевание, нарушение или состояние, включающий: (i) определение того, является ли тестируемый субъект, имеющий метаболическое нарушение, кандидатом на лечение вариантом FGF19, включающее: (a) выявление тестируемого субъекта, имеющего квалифицирующие признаки онкологического заболевания, субъекта, имеющего метаболическое нарушение, (b) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и (c) определение того, уменьшаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом уменьшение квалифицирующих признаков онкологического заболевания указывает на то, что тестируемый субъект является кандидатом на лечение вариантом FGF19; и при этом, если имеет место уменьшение квалифицирующих признаков онкологического заболевания у тестируемого субъекта, тогда способ дополнительно включает (ii) последующее введение варианта FGF19 субъекту (например, животному, такому как человек). В конкретных вариантах осуществления последующее введение варианта FGF19 в терапевтически эффективном количестве приводит к лечению метаболического или связанного с метаболизмом заболевания, нарушения или состояния у субъекта (например, животного, такого как человек).
В настоящем документе также предложен способ лечения субъекта (например, животного, такого как человек), имеющего метаболическое или связанное с метаболизмом заболевание, нарушение или состояние, включающий: (i) определение того, является ли вариант FGF19 потенциальным лечебным средством для лечения тестируемого субъекта, имеющего метаболическое нарушение, включающее: (a) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, имеющему метаболическое нарушение, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для индукции онкологического заболевания в контрольной популяции, и (b) определение того, наблюдаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие квалифицирующих признаков онкологического заболевания указывает на то, что вариант FGF19 является потенциальным лечебным средством для лечения тестируемого субъекта; и при этом, если квалифицирующие признаки онкологического заболевания отсутствуют, тогда способ дополнительно включает (ii) последующее введение варианта FGF19 субъекту (например, животному, такому как человек). В конкретных вариантах осуществления последующее введение варианта FGF19 в терапевтически эффективном количестве приводит к лечению метаболического или связанного с метаболизмом заболевания, нарушения или состояния у субъекта (например, животного, такого как человек).
В настоящем документе также предложен способ лечения субъекта (например, животного, такого как человек), имеющего метаболическое или связанное с метаболизмом заболевание, нарушение или состояние, включающий: (i) определение того, является ли вариант FGF19 потенциальным лечебным средством для лечения тестируемого субъекта, имеющего метаболическое нарушение, включающее: (a) выявление тестируемого субъекта, имеющего метаболическое нарушение, тестируемого субъекта, имеющего квалифицирующие признаки онкологического заболевания, (b) совместное введение FGF19 или заменителя FGF19 и варианта FGF19 тестируемому субъекту, при этом количество FGF19 или заменителя FGF19, вводимое тестируемому субъекту, достаточно для усугубления онкологического заболевания в контрольной популяции, и (c) определение того, усиливаются ли квалифицирующие признаки онкологического заболевания у тестируемого субъекта; при этом отсутствие усиления квалифицирующих признаков онкологического заболевания указывает на то, что вариант FGF19 является потенциальным лечебным средством для лечения тестируемого субъекта; и при этом, если усиление квалифицирующих признаков онкологического заболевания у тестируемого субъекта отсутствует, тогда способ дополнительно включает (ii) последующее введение варианта FGF19 субъекту (например, животному, такому как человек). В конкретных вариантах осуществления последующее введение варианта FGF19 в терапевтически эффективном количестве приводит к лечению метаболического или связанного с метаболизмом заболевания, нарушения или состояния у субъекта (например, животного, такого как человек). В некоторых вариантах осуществления один или более квалифицирующих признаков онкологического заболевания уменьшаются у тестируемого субъекта.
В настоящем документе также предложен способ лечения субъекта, имеющего метаболическое или связанное с метаболизмом заболевание, нарушение или состояние, включающий: (a) выявление тестируемого субъекта, имеющего метаболическое нарушение, при этом субъект имеет квалифицирующие признаки FGF19-индуцированного онкологического заболевания, и (b) введение субъекту терапевтически эффективного количества варианта FGF19, идентифицированного в любом из способов или моделей, предложенных в настоящем документе; при этом имеет место уменьшение метаболического или связанного с метаболизмом заболевания, нарушения или состояния у субъекта.
В некоторых вариантах осуществления способов, предложенных в настоящем документе, субъект является животным. В других вариантах осуществления субъект является человеком. В некоторых вариантах осуществления онкологическое заболевание представляет собой опухоль. В конкретных вариантах осуществления опухоль представляет собой опухоль толстого кишечника или опухоль печени. В некоторых вариантах осуществления метаболическое или связанное с метаболизмом заболевание, нарушение или состояние представляет собой метаболическое нарушение. В некоторых вариантах осуществления метаболическое нарушение выбирают из группы, состоящей из гипергликемического состояния, устойчивости к инсулину, гиперинсулинемии, нарушения толерантности к глюкозе, ожирения и метаболического синдрома. В одном варианте осуществления гипергликемическое состояние представляет собой диабет. В другом варианте осуществления лечение приводит к уменьшению метаболического нарушения. В конкретных вариантах осуществления уменьшение метаболического нарушения представляет собой уменьшение уровня глюкозы в крови. В других вариантах осуществления уменьшение метаболического нарушения у субъекта представляет собой снижение массы тела. В конкретных вариантах осуществления уменьшение метаболического нарушения у субъекта представляет собой снижение уровня инсулина.
В другом аспекте настоящего изобретения предложен способ противодействия онкогенной активности FGF19, например, с использованием варианта FGF19, предложенного в настоящем документе. В некоторых вариантах осуществления создают контакт клетки, экспрессирующей FGF19, с вариантом FGF19, предложенным в настоящем документе. В некоторых вариантах осуществления вариант FGF19 представляет собой M70. В конкретных вариантах осуществления настоящего изобретения предложен способ противодействия онкогенной активности FGF19 у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19 и, тем самым, противодействие онкогенной активности FGF19 у субъекта. В некоторых вариантах осуществления предложен способ предотвращения FGF19-зависимого заболевания, нарушения или состояния, либо его симптома, у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19, при этом заболевание, нарушение, состояние или его симптом у субъекта предотвращается. В других вариантах осуществления предложен способ лечения FGF19-зависимого заболевания, нарушения или состояния, либо его симптома, у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19, при этом заболевание, нарушение, состояние или его симптом у субъекта подвергается лечению.
В конкретных вариантах осуществления субъект имеет метаболическое нарушение и/или квалифицирующие признаки онкологического заболевания. В конкретных вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль. В некоторых вариантах осуществления рак или опухоль представляет собой рак или опухоль печени, толстого кишечника, предстательной железы или легкого. В некоторых вариантах осуществления опухоль является доброкачественной. В других вариантах осуществления опухоль является злокачественной.
В конкретных вариантах осуществления субъект имеет FGF19-зависимое заболевание, нарушение или состояние, или риск его развития. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой печеночное (гепатоцеллюлярное) заболевание, нарушение или состояние, такое как цирроз или холестаз. В некоторых вариантах осуществления печеночное заболевание или нарушение представляет собой хроническое печеночное заболевание или нарушение. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль, такую как HCC. В других вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние не является печеночным заболеванием, нарушением или состоянием, таким как цирроз или холестаз. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние не является раком или опухолью, такой как HCC. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль толстого кишечника. В конкретных вариантах осуществления рак или опухоль толстого кишечника представляет собой аденокарциному толстого кишечника. В некоторых вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль предстательной железы. В других вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние представляет собой рак или опухоль легкого. В конкретных вариантах осуществления рак или опухоль легкого представляет собой плоскоклеточную карциному легкого. В некоторых вариантах осуществления FGF19 экспрессируется в первичных или метастатических клетках рака или опухоли. В конкретных вариантах осуществления FGF19-зависимое заболевание, нарушение или состояние является предраковым. Например, цирроз и холестаз иногда приводят к раку печени, такому как HCC, и способы лечения или предотвращения таких печеночных заболеваний и нарушений также предусмотрены. В конкретных вариантах осуществления субъект является субъектом, который нуждается в предотвращении или лечении таких заболеваний. В некоторых вариантах осуществления введение варианта FGF19 поддерживает гомеостаз желчных кислот у субъекта.
В настоящем документе также предложен способ лечения рака или опухоли, например, FGF19-зависимых рака или опухоли, либо их симптомов, у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19. В конкретных вариантах осуществления введение приводит к уменьшению проявлений рака, опухоли или их симптомов у субъекта. В некоторых вариантах осуществления способ приводит к уменьшению числа опухолей, размера опухоли или массы опухоли. В настоящем документе также предложен способ предотвращения рака или опухоли, например, FGF19-зависимых рака или опухоли, либо их симптомов, у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19. В некоторых вариантах осуществления введение приводит к предотвращению рака, опухоли или их симптомов у субъекта. В некоторых вариантах осуществления способ приводит к уменьшению числа опухолей, размера опухоли или массы опухоли. В конкретном варианте осуществления рак или опухоль представляют собой FGF19-зависимые рак или опухоль. В конкретных вариантах осуществления рак или опухоль представляют собой гепатоцеллюлярную карциному. В некоторых вариантах осуществления рак или опухоль не являются гепатоцеллюлярной карциномой. В одном варианте осуществления рак или опухоль представляют собой рак или опухоль толстого кишечника. В некоторых вариантах осуществления рак или опухоль представляют собой рак или опухоль предстательной железы. В конкретных вариантах осуществления рак или опухоль представляют собой рак или опухоль легкого. В конкретных вариантах осуществления вариант FGF19 представляет собой полипептид, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 1. В некоторых вариантах осуществления вариант FGF19 представляет собой полипептид, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO: 1. В конкретных вариантах осуществления субъект является субъектом, который нуждается в этом.
Понятно, что любой из терапевтических или профилактических способов, предложенных в настоящем документе, можно использовать в сочетании с любыми из моделей или других способов, описанных в настоящем документе.
В конкретных вариантах осуществления способов, предложенных в настоящем документе, вариант FGF19 выбирают из группы, состоящей из M5, M6, M7, M14, M15, M32, M36, M43, M52, M53, M67, M68, M69, M70, M75, M76, M77, M83, M84, M140, M144, M145, M146 и M160. В одном варианте осуществления вариант FGF19 представляет собой M5. В другом варианте осуществления вариант FGF19 представляет собой M6. В некоторых вариантах осуществления вариант FGF19 представляет собой M7. В одном варианте осуществления вариант FGF19 представляет собой M14. В другом варианте осуществления вариант FGF19 представляет собой M15. В других вариантах осуществления вариант FGF19 представляет собой M32. В одном варианте осуществления вариант FGF19 представляет собой M36. В другом варианте осуществления вариант FGF19 представляет собой M43. В других вариантах осуществления вариант FGF19 представляет собой M52. В другом варианте осуществления вариант FGF19 представляет собой M53. В некоторых вариантах осуществления вариант FGF19 представляет собой M67. В одном варианте осуществления вариант FGF19 представляет собой M68. В другом варианте осуществления вариант FGF19 представляет собой M69. В некоторых вариантах осуществления вариант FGF19 представляет собой M70. В одном варианте осуществления вариант FGF19 представляет собой M75. В другом варианте осуществления вариант FGF19 представляет собой M76. В других вариантах осуществления вариант FGF19 представляет собой M77. В других вариантах осуществления вариант FGF19 представляет собой M83. В одном варианте осуществления вариант FGF19 представляет собой M84. В другом варианте осуществления вариант FGF19 представляет собой M140. В других вариантах осуществления вариант FGF19 представляет собой M144. В других вариантах осуществления вариант FGF19 представляет собой M145. В одном варианте осуществления вариант FGF19 представляет собой M146. В некоторых вариантах осуществления вариант FGF19 представляет собой M160. В других вариантах осуществления также предусмотрено любое сочетание двух или более из вышеописанных вариантов FGF19.
В некоторых вариантах осуществления способов, предложенных в настоящем документе, вариант FGF19 содержит аминокислотную последовательность, приведенную в какой-либо из SEQ ID NOS: 5-29; либо ее подпоследовательность или фрагмент. В некоторых вариантах осуществления способов, предложенных в настоящем документе, вариант FGF19 состоит из аминокислотной последовательности, приведенной в какой-либо из SEQ ID NOS: 5-29; либо ее подпоследовательности или фрагмента. В конкретных вариантах осуществления N-концевой остаток R делетирован. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 5. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 6. В одном варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 7. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 8. В другом варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 9. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 10. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 11. В другом варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 12. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 13. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 14. В одном варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 15. В другом варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 16. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 17. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 18. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 19. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 20. В одном варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 21. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 22. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 23. В другом варианте осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 24. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 25. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 26. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 27. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 28. В других вариантах осуществления вариант FGF19 содержит или состоит из SEQ ID NO: 29. В конкретных вариантах осуществления вариант FGF19 содержит или состоит из любой из вышеперечисленных последовательностей, при этом N-концевой остаток R делетирован. В некоторых вариантах осуществления вариант FGF19 содержит или состоит из подпоследовательности какой-либо из вышеперечисленных последовательностей. В других вариантах осуществления также предусмотрено любое сочетание двух или более из вышеперечисленных вариантов FGF19.
Фармацевтические композиции
Полипептиды по настоящему изобретению могут находиться в форме композиций, подходящих для введения субъекту. Как правило, такие композиции представляют собой «фармацевтические композиции», содержащие один или более полипептидов и один или более фармацевтически приемлемых или физиологически приемлемых разбавителей, носителей или эксципиентов. В конкретных вариантах осуществления полипептиды присутствуют в терапевтически приемлемом количестве. Фармацевтические композиции можно использовать в способах по настоящему изобретению; так, например, фармацевтические композиции можно вводить ex vivo или in vivo субъекту с целью осуществления на практике терапевтических и профилактических способов и вариантов применения, описанных в настоящем документе.
Фармацевтические композиции по настоящему изобретению могут быть сформулированы так, чтобы быть совместимыми с предполагаемым способом или путем введения; иллюстративные пути введения описаны в настоящем документе. Кроме того, фармацевтические композиции можно использовать в сочетании с другими терапевтически активными средствами или соединениями (например, средствами, снижающими уровень глюкозы), описанными в настоящем документе, с целью лечения или предотвращения заболеваний, нарушений и состояний, предусмотренных по настоящему изобретению.
Фармацевтические композиции, как правило, содержат терапевтически эффективное количество по меньшей мере одного из полипептидов, предусмотренных по настоящему изобретению, и один или более фармацевтически и физиологически приемлемых средств для формулирования. Подходящие фармацевтически приемлемые или физиологически приемлемые разбавители, носители или эксципиенты включают, но не ограничиваются ими, антиоксиданты (например, аскорбиновую кислоту и натрия бисульфат), консерванты (например, бензиловый спирт, метилпарабены, этил или н-пропил, п-гидроксибензоат), эмульгаторы, суспендирующие средства, диспергирующие средства, растворители, наполнители, объемообразующие средства, детергенты, буферы, носители, разбавители и/или адъюванты. Например, подходящий носитель может представлять собой физиологический солевой раствор или цитратно-солевой буфер, возможно, с добавлением других материалов, обычно используемых в фармацевтических композициях, предназначенных для парентерального введения. Нейтральный буферный солевой раствор или солевой раствор, смешанный с сывороточным альбумином, являются другими примерами носителей. Специалистам в данной области известно множество буферов, которые можно использовать в фармацевтических композициях и лекарственных формах. Типичные буферы включают, но не ограничиваются ими, фармацевтически приемлемые слабые кислоты, слабые основания или их смеси. В качестве примера, компонентами буфера могут быть водорастворимые материалы, такие как фосфорная кислота, виннокаменная кислота, молочная кислота, янтарная кислота, лимонная кислота, уксусная кислота, аскорбиновая кислота, аспарагиновая кислота, глютаминовая кислота, а также их соли. Приемлемые буферы включают, например, трис-буфер, N-(2-гидроксиэтил)пиперазин-Nʹ-(2-этансульфоновую кислоту) (HEPES), 2-(N-морфолино)этансульфоновую кислоту (MES), натриевую соль 2-(N-морфолино)этансульфоновой кислоты (MES), 3-(N-морфолино)пропансульфоновую кислоту (MOPS) и N-трис[гидроксиметил]метил-3-аминопропансульфоновую кислоту (TAPS).
После того, как фармацевтическая композиция сформулирована, ее можно хранить в стерильных емкостях в виде раствора, суспензии, геля, эмульсии, твердого вещества или дегидрированного или лиофилизированного порошка. Такие препараты можно хранить в форме, готовой к употреблению, лиофилизированной форме, требующей восстановления перед использованием, жидкой форме, требующей разбавления перед использованием, или другой приемлемой форме. В некоторых вариантах осуществления фармацевтическую композицию предоставляют в одноразовом контейнере (например, одноразовом флаконе, ампуле, шприце или автоматическом инжекторе (аналогично, например, EpiPen®)), в то время как в других вариантах осуществления ее предоставляют в многоразовом контейнере (например, многоразовом флаконе). Для доставки полипептидов можно использовать любое устройство доставки лекарственного средства, включая имплантаты (например, имплантируемые насосы) и системы катетеров, все из которых хорошо известны квалифицированному специалисту. Инъекции веществ замедленного всасывания, которые, как правило, вводят подкожно или внутримышечно, также можно использовать для высвобождения полипептидов, описанных в настоящем документе, в течение определенного периода времени. Инъекции веществ замедленного всасывания, как правило, имеют либо твердофазную, либо масляную основу и, как правило, содержат по меньшей мере один из компонентов препарата, описанных выше. Специалисту в данной области известны возможные препараты и варианты применения инъекций веществ замедленного всасывания. В конкретных вариантах осуществления предусмотрено использование технологии Nano Precision Medical (Nano Precision Medical; Emeryville, CA) для доставки веществ замедленного всасывания. По данной технологии используют мембрану нанотрубок из диоксида титана, которая обеспечивает скорости высвобождения нулевого порядка для макромолекул, таких как белковые и пептидные терапевтические средства. Биосовместимая мембрана располагается в небольшом, подкожном имплантате, который обеспечивает долговременную (например, до одного года) доставку терапевтических макромолекул с постоянной скоростью. Данная технология в настоящее время проходит тестирование, например, для доставки агонистов GLP-1 для лечения диабета II типа.
Фармацевтические композиции могут находиться в форме стерильной инъекционной водной или масляной суспензии. Такую суспензию можно формулировать известными методами с использованием тех подходящих диспергирующих или увлажняющих средств и суспендирующих средств, которые описаны в настоящем документе. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, раствор в 1,3-бутандиоле. Приемлемые разбавители, растворители и дисперсионные среды, которые можно использовать, включают воду, раствор Рингера, изотонический раствор хлорида натрия, кремофор EL™ (BASF, Parsippany, NJ) или фосфатно-солевой буфер (PBS), этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), а также их подходящие смеси. Кроме того, в качестве растворителя или суспензионной среды обычно используют стерильные нелетучие масла. Для этой цели можно использовать любое легкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, в изготовлении инъекционных препаратов находят применение жирные кислоты, такие как олеиновая кислота. Пролонгированной абсорбции конкретных инъекционных препаратов можно достигать за счет включения средства, которое замедляет абсорбцию (например, алюминия моностеарата или желатина).
Фармацевтические композиции, содержащие активный ингредиент, могут находиться в форме, подходящей для перорального использования, например, в виде таблеток, капсул, лепешек, пастилок, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, либо сиропов, растворов, микрогранул или эликсиров. Фармацевтические композиции, предназначенные для перорального использования, можно получать любым методом, известным в данной области для производства фармацевтических композиций, и такие композиции могут содержать одно или более средств, таких как, например, подсластители, ароматизаторы, красители и консерванты, для создания фармацевтических препаратов изящного вида и с приятным вкусом. Таблетки, капсулы и тому подобное содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые подходят для производства таблеток. Эти эксципиенты могут представлять собой, например, разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие средства, например, кукурузный крахмал или альгиновую кислоту; связующие вещества, например, крахмал, желатин или камедь, а также смазывающие средства, например, стеарат магния, стеариновую кислоту или тальк.
Таблетки, капсулы и тому подобное, подходящие для перорального введения, могут не иметь или иметь покрытие, нанесенное известными методами, для замедления дезинтеграции и абсорбции в желудочно-кишечном тракте и, следовательно, обеспечения пролонгированного действия. Например, можно использовать такой замедляющий высвобождение материал, как глицерилмоностеарат или глицерилдистеарат. Они также могут иметь покрытие, нанесенное методами, известными в данной области, для получения осмотических терапевтических таблеток с контролируемым высвобождением. Дополнительные средства включают биоразлагаемые или биосовместимые частицы или полимерное вещество, такое как полиэфиры, полиаминовые кислоты, гидрогель, поливинилпирролидон, полиангидриды, полигликолевая кислота, этиленвинилацетат, метилцеллюлоза, карбоксиметилцеллюлоза, протамина сульфат, или сополимеры лактида/гликолида, сополимеры полилактида/гликолида или сополимеры этиленвинилацетата, для контролируемой доставки введенной композиции. Например, пероральное средство может быть заключено в микрокапсулы, полученные методом коацервации или межповерхностной полимеризации, с использованием гидроксиметилцеллюлозных или желатиновых микрокапсул, либо поли(метилметакрилатных) микрокапсул, соответственно, или в коллоидную систему доставки лекарственного средства. Коллоидные дисперсионные системы включают макромолекулярные комплексы, нанокапсулы, микросферы, микрогранулы и системы на основе липидов, включая эмульсии типа масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Методы получения липосом описаны, например, в патентах США №№ 4235871, 4501728 и 4837028. Способы получения вышеуказанных препаратов известны специалистам в данной области.
Препараты для перорального использования также могут быть предоставлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция, каолином или микрокристаллической целлюлозой, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, например, арахисовым маслом, вазелиновым маслом или оливковым маслом.
Водные суспензии содержат активные материалы в смеси с эксципиентами, подходящими для их производства. Такие эксципиенты могут представлять собой суспендирующие средства, например, натрий-карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, натрия альгинат, поливинилпирролидон, трагакантовую камедь и гуммиарабик; диспергирующие или увлажняющее средства, например, природный фосфатид (например, лецитин), или продукты конденсации алкиленоксида с жирными кислотами (например, полиоксиэтиленстеарат), или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами (например, гептадекаэтиленоксицетанолом), или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и гексита (например, полиоксиэтилен сорбит моноолеат), или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и ангидридов гексита (например, моноолеат полиэтиленсорбитана). Водные суспензии также могут содержать один или более консервантов.
Масляные суспензии можно формулировать путем суспендирования активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, либо в минеральном масле, таком как вазелиновое масло. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Можно добавлять подсластители, такие как те, что описаны выше, и ароматизаторы для создания приятного на вкус перорального препарата.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии путем добавления воды, содержат активный ингредиент в смеси с диспергирующим или увлажняющим средством, суспендирующим средством и одним или более консервантами. Примеры подходящих диспергирующих или увлажняющих средств и суспендирующих средств приведены в настоящем документе.
Фармацевтические композиции по настоящему изобретению также могут находиться в форме эмульсии типа масло-в-воде. Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, вазелиновое масло, или их смеси. Подходящие эмульгаторы могут представлять собой природные камеди, например, гуммиарабик или трагакантовую камедь; природные фосфатиды, например, лецитин сои, а также сложные эфиры или частичные сложные эфиры, полученные из жирных кислот; ангидриды гексита, например, моноолеат сорбитана; и продукты конденсации частичных сложных эфиров с этиленоксидом, например, моноолеат полиоксиэтиленсорбитана.
Препараты также могут содержать носители для защиты композиции от быстрой деградации или выведения из организма, например, препарат с контролируемым высвобождением, включая имплантаты, липосомы, гидрогели, пролекарства и микроинкапсулированные системы доставки. Например, можно использовать замедляющий высвобождение материал, такой как глицерилмоностеарат или глицерилстеарат, отдельно или в сочетании с воском.
По настоящему изобретению предусмотрено введение полипептидов в форме суппозиториев для ректального введения лекарственного средства. Суппозитории можно изготавливать путем смешивания лекарственного средства с подходящим нераздражающим эксципиентом, который является твердым при обычной температуре, но жидким при ректальной температуре и, таким образом, будет плавиться в прямой кишке, высвобождая лекарственное средство. Такие материалы включают, но не ограничиваются ими, масло какао и полиэтиленгликоли.
Полипептиды, предложенные по настоящему изобретению, могут находиться в форме любой подходящей фармацевтической композиции (например, назальных или ингаляционных спреев), известной в настоящее время или разработанной в будущем.
Концентрация полипептида или его фрагмента в препарате может варьироваться в широких пределах (например, от менее чем примерно 0,1%, обычно точно или по меньшей мере примерно 2%, вплоть до 20% - 50% или более по массе) и, как правило, будет выбрана главным образом в зависимости от объемов жидкости, ее вязкости и персональных факторов субъекта, в соответствии, например, с конкретным выбранным способом введения.
Пути введения
По настоящему изобретению предусмотрено введение описанных полипептидов и их композиций любым подходящим способом. Подходящие пути введения включают парентеральный (например, внутримышечный, внутривенный, подкожный (например, инъекция или имплантат), внутрибрюшинный, интрацистернальный, внутрисуставной, внутрибрюшинный, интрацеребральный (интрапаренхимальный) и интрацеребровентрикулярный), пероральный, назальный, вагинальный, подъязычный, внутриглазной, ректальный, местный (например, чрескожный), подъязычный и ингаляцию.
Инъекции веществ замедленного всасывания, которые, как правило, вводят подкожно или внутримышечно, также можно использовать для высвобождения полипептидов, описанных в настоящем документе, в течение определенного периода времени. Инъекции веществ замедленного всасывания, как правило, имеют либо твердофазную, либо масляную основу и, как правило, содержат по меньшей мере один из компонентов препарата, описанных выше. Специалисту в данной области известны возможные препараты и варианты применения инъекций веществ замедленного всасывания.
Что касается антител, в иллюстративном варианте осуществления антитело или фрагмент антитела по настоящему изобретению хранят в концентрации 10 мг/мл в стерильном изотоническом водном солевом растворе для инъекций при температуре 4°C и разбавляют или в 100 мл, или в 200 мл 0,9% раствора хлорида натрия для инъекций перед введением субъекту. Антитело вводят внутривенной инфузией в течение 1 часа в дозе от 0,2 до 10 мг/кг. В других вариантах осуществления антитело вводят внутривенной инфузией в течение периода времени от 15 минут до 2 часов. В других вариантах осуществления введение осуществляют путем подкожной болюсной инъекции.
Комбинированная терапия
По настоящему изобретению предусмотрено использование вариантных полипептидов FGF19, идентифицированных в настоящем документе, в сочетании с одним или более активными лекарственными средствами, или другими профилактическими или терапевтическими методами. В такой комбинированной терапии различные активные средства часто имеют разные механизмы действия. Такая комбинированная терапия может иметь особое преимущество в том, что позволяет снижать дозы одного или более из средств, тем самым уменьшая или устраняя неблагоприятные эффекты, связанные с одним или более из средств; более того, такая комбинированная терапия может иметь синергический терапевтический или профилактический эффект на основное заболевание, нарушение или состояние.
Используемый в настоящем документе термин «сочетание» охватывает терапевтические средства, которые можно вводить раздельно, например, сформулированные отдельно для раздельного введения (например, предоставляемые в наборе), и терапевтические средства, которые можно вводить совместно в одном препарате (то есть, «комбинированный препарат»). Сочетания полипептидов, идентифицированных с использованием способов и моделей, описанных в настоящем документе, с одним или более активными лекарственными средствами, или другими профилактическими или терапевтическими методами, можно вводить или применять последовательно (например, когда одно средство вводят до введения одного или более других средств) или одновременно (например, когда два или более средств вводят в одно и то же, или примерно в одно и то же время). Независимо от того, вводят ли два или более средств последовательно или одновременно, для целей настоящего изобретения считается, что их вводят в сочетании.
Соответственно, способы и варианты применения полипептидов, идентифицированных с использованием способов и моделей, описанных в настоящем документе, можно осуществлять на практике до, практически одновременно или после другого метода лечения, и можно дополнять другими видами терапии. Дополнительные виды терапии включают другие приводящие к снижению уровня глюкозы и/или снижению массы тела виды лечения, например, инсулин, усилитель чувствительности к инсулину и другое медикаментозное лечение, изменение диеты (с низким содержанием сахара, жира и так далее), хирургическую операцию, приводящую к снижению массы тела (уменьшение объема желудка с помощью желудочного шунтирования, гастрэктомию), бандажирование желудка, внутрижелудочный баллон, желудочный рукав и так далее.
По настоящему изобретению предусмотрена комбинированная терапия со многими средствами (и классами средств), включая 1) инсулин, миметики инсулина и средства, вызывающие стимуляцию секреции инсулина, в том числе сульфонилмочевины (например, хлорпропамид, толазамид, ацетогексамид, толбутамид, глибурид, глимепирид, глипизид) и меглитиниды (например, репаглинид (прандин) и натеглинид (старликс)); 2) бигуаниды (например, метформин (глюкофаж)) и другие средства, которые действуют, стимулируя утилизацию глюкозы, уменьшая производство глюкозы в печени и/или уменьшая кишечный выброс глюкозы; 3) ингибиторы альфа-глюкозидазы (например, акарбоза и миглитол) и другие средства, которые замедляют расщепление и последующую абсорбцию углеводов из кишечника и уменьшают постпрандиальную гипергликемию; 4) тиазолидиндионы (например, росиглитазон (авандия), троглитазон (резулин), пиоглитазон (актос), глипизид, балаглитазон, ривоглитазон, нетоглитазон, троглитазон, энглитазон, циглитазон, адаглитазон, дарглитазон), которые усиливают действие инсулина (например, за счет сенсибилизации к инсулину), таким образом, стимулируя утилизацию глюкозы в периферических тканях; 5) глюкагон-подобные пептиды, включая ингибиторы DPP-IV (например, вилдаглиптин (галвус) и ситаглиптин (янувия)) и глюкагон-подобный пептид-1 (GLP-1), а также агонисты и аналоги GLP-1 (например, экзенатид (баета и ITCA 650 (осмотический насос, имплантируемый подкожно, который доставляет аналог экзенатида на протяжении 12-месячного периода; Intarcia, Boston, MA)); 6) и DPP-IV-устойчивые аналоги (миметики инкретина), агонисты PPAR-гамма, агонисты PPAR двойного действия, универсальные агонисты PPAR, ингибиторы PTP1B, ингибиторы SGLT, стимуляторы секреции инсулина, агонисты RXR, ингибиторы гликоген синтазы киназы-3, иммуномодуляторы, агонисты бета-3 адренергических рецепторов, ингибиторы 11бета-HSD1, и аналоги амилина.
Кроме того, по настоящему изобретению предусмотрена комбинированная терапия со средствами и способами, способствующими снижению массы тела, такими как средства, стимулирующие метаболизм или снижающие аппетит, а также изменение диеты и/или режимы физических упражнений для стимуляции снижения массы тела. Подавляющие аппетит лекарственные средства хорошо известны и могут быть использованы в сочетании со способами, предложенными в настоящем документе.
Вариантные полипептиды FGF19 по настоящему изобретению можно использовать в сочетании с одним или более другими средствами любым образом в соответствии с обстоятельствами. В одном варианте осуществления лечение по меньшей мере одним активным средством и по меньшей мере одним полипептидом по настоящему изобретению продолжают в течение некоторого периода времени. В другом варианте осуществления лечение по меньшей мере одним активным средством сокращают или прекращают (например, когда состояние субъекта является стабильным), при этом лечение полипептидом по настоящему изобретению продолжают с постоянным режимом дозирования. В следующем варианте осуществления лечение по меньшей мере одним активным средством сокращают или прекращают (например, когда состояние субъекта является стабильным), при этом лечение полипептидом по настоящему изобретению сокращают (например, используют более низкую дозу, меньшую частоту дозирования или более короткую схему лечения). В другом варианте осуществления лечение по меньшей мере одним активным средством сокращают или прекращают (например, когда состояние субъекта является стабильным), при этом лечение полипептидом по настоящему изобретению увеличивают (например, используют более высокую дозу, большую частоту дозирования или более продолжительную схему лечения). В другом варианте осуществления лечение по меньшей мере одним активным средством продолжают и лечение полипептидом по настоящему изобретению сокращают или прекращают (например, используют более низкую дозу, меньшую частоту дозирования или более короткую схему лечения). В другом варианте осуществления лечение по меньшей мере одним активным средством и лечение полипептидом по настоящему изобретению сокращают или прекращают (например, используют более низкую дозу, меньшую частоту дозирования или более короткую схему лечения).
Дозирование
Полипептиды по настоящему изобретению можно вводить субъекту в количестве, которое зависит, например, от цели введения (например, желательной степени рассасывания опухоли); возраста, массы тела, пола, а также состояния здоровья и физического состояния субъекта, которого лечат; природы полипептида и/или препарата, который вводят; способа введения; а также природы заболевания, нарушения, состояния или его симптома (например, тяжести нарушения регуляции глюкозы/инсулина и стадии заболевания). В режиме дозирования также можно принимать во внимание наличие, характер и степень тяжести неблагоприятных эффектов, ассоциированных с вводимым средством(ами). Эффективные дозируемые количества и режимы дозирования можно с легкостью определять, например, на основании испытаний безопасности и исследований с эскалацией дозы, in vivo исследований (например, с использованием животных моделей), а также другими способами, известными квалифицированному специалисту.
Как правило, принципы дозирования требуют, чтобы дозируемое количество составляло менее, чем количество, которое будет необратимо токсичным для субъекта (то есть, максимально переносимая доза, «MTD»), и не менее, чем количество, необходимое для произведения поддающегося измерению эффекта у субъекта. Такие количества определяют, например, с помощью фармакокинетических и фармакодинамических параметров, связанных с абсорбцией, распределением, метаболизмом и экскрецией («ADME»), принимая во внимание путь введения и другие факторы.
Эффективная доза (ED) представляет собой дозу или количество средства, которое вызывает терапевтический ответ или производит желаемый эффект у некоторого числа субъектов, принимающих его. «Медианная эффективная доза» или ED50 средства представляет собой дозу или количество средства, которое вызывает терапевтический ответ или производит желаемый эффект у 50% людей, которым его вводят. Хотя ED50 обычно используют в качестве меры разумных ожиданий эффекта от средства, она не обязательно является дозой, которую клиницист может счесть целесообразной, принимая во внимание все соответствующие факторы. Таким образом, в некоторых ситуациях эффективное количество составляет больше, чем рассчитанное значение ED50, в других ситуациях эффективное количество составляет меньше, чем рассчитанное значение ED50, и в некоторых других ситуациях эффективное количество является таким же, как рассчитанное значение ED50.
Кроме того, эффективная доза полипептидов по настоящему изобретению может быть количеством, которое при введении в одной или более дозах субъекту производит желаемый результат в сравнении со здоровым субъектом. Например, эффективная доза может быть дозой, которая при введении субъекту, имеющему повышенный уровень глюкозы в плазме и/или инсулина в плазме, приводит к достижению желаемого снижения, в сравнении с показателями у здорового субъекта, на по меньшей мере примерно 10%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80% или более чем 80%.
Соответствующий уровень дозы, как правило, будет составлять примерно от 0,001 до 100 мг/кг массы тела пациента в сутки, это количество можно вводить в одной или нескольких дозах. В некоторых вариантах осуществления уровень дозы будет составлять от примерно 0,01 до примерно 25 мг/кг в сутки, и в других вариантах осуществления от примерно 0,05 до примерно 10 мг/кг в сутки. Подходящий уровень дозы может составлять примерно от 0,01 до 25 мг/кг в сутки, примерно от 0,05 до 10 мг/кг в сутки или примерно от 0,1 до 5 мг/кг в сутки. В пределах этого диапазона доза может составлять от 0,005 до 0,05, от 0,05 до 0,5 или от 0,5 до 5,0 мг/кг в сутки.
Для введения перорального средства композиции могут быть предоставлены в форме таблеток, капсул и тому подобного, содержащих от 1,0 до 1000 миллиграмм активного ингредиента, в частности, 1,0, 3,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0, 100,0, 150,0, 200,0, 250,0, 300,0, 400,0, 500,0, 600,0, 750,0, 800,0, 900,0 и 1000,0 миллиграмм активного ингредиента. Полипептиды можно вводить в режиме, например, от 1 до 4 раз в сутки, и часто один раз или два раза в сутки.
Дозы полипептидов по настоящему изобретению можно повторно вводить с соответствующей частотой, которая может находиться в диапазоне от одного раза в сутки до одного раза в три месяца, в зависимости от фармакокинетики полипептидов (например, периода полувыведения) и фармакодинамического ответа (например, продолжительности терапевтического эффекта полипептида). В некоторых вариантах осуществления, в которых полипептид представляет собой антитело или его фрагмент, или полипептид или его варианты, дозирование часто повторяют с частотой от одного раза в неделю до одного раза в 3 месяца. В других вариантах осуществления такие полипептиды вводят примерно один раз в месяц.
В конкретных вариантах осуществления доза описанных полипептидов содержится в «стандартной лекарственной форме». Выражение «стандартная лекарственная форма» относится к физически дискретным единицам, при этом каждая единица содержит заданное количество полипептида по настоящему изобретению, либо одного, либо в сочетании с одним или более дополнительными средствами, достаточное для произведения желаемого эффекта. Следует принимать во внимание, что параметры стандартной лекарственной формы будут зависеть от конкретного средства и эффекта, который предстоит достичь. Иллюстративные стандартные дозы могут находиться в диапазоне примерно 25-250; 250-500; 500-1000; 1000-2500; 2500-5000; 5000-25000 или 25000-50000 нг; или примерно 25-250; 250-500; 500-1000; 1000-2500; 2500-5000; 5000-25000; 25000-50000 мкг; или примерно 25-250; 250-500; 500-1000; 1000-2500; 2500-5000; 5000-25000 или 25000-50000 мг.
Одну или несколько доз можно вводить, например, несколько раз в сутки, каждый день, через день, еженедельно или с перерывами (например, два раза в неделю, один раз в 1, 2, 3, 4, 5, 6, 7 или 8 недель, или один раз в 2, 3, 4, 5 или 6 месяцев).
Наборы
По настоящему изобретению также предусмотрены наборы, содержащие описанные полипептиды и их фармацевтические композиции. Наборы, как правило, имеют вид физической конструкции, в которой находятся разные компоненты, описанные ниже, и могут быть использованы, например, в осуществлении на практике вышеописанных способов (например, введение полипептида субъекту, который нуждается в восстановлении гомеостаза глюкозы).
Набор может включать один или более из полипептидов, описанных в настоящем документе (предоставленные, например, в стерильном контейнере), которые могут быть в форме фармацевтической композиции, подходящей для введения субъекту. Полипептиды могут быть предоставлены в форме, готовой к употреблению, или в форме, требующей, например, восстановления или разбавления перед введением. Если полипептиды находятся в форме, которая нуждается в восстановлении пользователем, набор также может включать буферы, фармацевтически приемлемые эксципиенты и тому подобное, упакованные вместе или раздельно с полипептидами. Если предполагается комбинированная терапия, набор может содержать несколько средств в отдельности, или они могут быть уже объединены в наборе. Каждый компонент набора может быть заключен в отдельный контейнер и все разные контейнеры могут находиться внутри одной упаковки. Набор по настоящему изобретению может быть сконструирован с учетом условий, необходимых для надлежащей сохранности находящихся в нем компонентов (например, условий охлаждения или заморозки).
Набор может включать этикетку или вкладыш в упаковку, содержащий идентифицирующую информацию для входящих в него компонентов и инструкции по их применению (например, параметры дозирования, данные клинической фармакологии для активного ингредиента(ов), включая механизм действия, фармакокинетику и фармакодинамику, неблагоприятные эффекты, противопоказания и так далее). Этикетки и вкладыши могут содержать информацию от производителя, такую как номера лотов и сроки годности. Этикетка или вкладыш в упаковку могут быть, например, интегрированы в физическую конструкцию, в которой заключены компоненты, находиться отдельно внутри физической конструкции или быть прикреплены к компоненту набора (например, ампуле, пробирке или флакону). Иллюстративные инструкции включают инструкции по уменьшению или снижению уровня глюкозы в крови, лечению гипергликемии, лечению диабета, и так далее, с помощью описанных полипептидов и их фармацевтических композиций.
Этикетки или вкладыши, кроме того, могут содержать или быть включены в машиночитаемый носитель, такой как диск (например, жесткий диск, карту памяти, диск памяти), оптический диск, такой как CD- или DVD-ROM/RAM, DVD, MP3, магнитная лента или электронные носители информации, такие как RAM и ROM или их гибриды, такие как магнитные/оптические носители информации, FLASH-носители или карты памяти. В некоторых вариантах осуществления фактические инструкции отсутствуют в наборе, но в нем предоставлены средства для получения инструкций из отдаленного источника, например, через интернет.
Если не указано иначе, все технические и научные термины, используемые в настоящем документе, имеют то значение, которое им обычно придают специалисты в области, к которой относится данное изобретение. Хотя при практическом использовании или тестировании изобретения можно использовать способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящем документе, подходящие способы и материалы описаны в настоящем документе.
В случае конфликта, спецификация, включая определения, будет иметь преимущественную силу. При использовании в настоящем документе и в прилагаемой формуле изобретения форма единственного числа существительных также подразумевает их множественное число, если из контекста ясно не следует иное. Таким образом, например, ссылка на «пептидную последовательность» или «вариант лечения» включает множество таких последовательностей, вариантов лечения и так далее. Следует также отметить, что формула изобретения может быть составлена так, чтобы исключить любой необязательный элемент. Как таковое, это утверждение предназначено служить в качестве предшествующей основы для использования такой исключающей терминологии, как «исключительно», «только» и тому подобное, в связи с перечислением элементов формулы изобретения, или использования «отрицательного» ограничения.
В случае, если приведен диапазон значений, понятно, что каждое промежуточное значение до десятых долей единицы нижнего предела, если из контекста ясно не следует иное, от верхнего до нижнего предела данного диапазона и любое другое указанное или промежуточное значение в данном указанном диапазоне, входит в объем изобретения. Верхний и нижний пределы этих меньших диапазонов могут независимо быть включены в меньшие диапазоны и также входят в объем изобретения, с учетом любого специально исключенного предела в указанном диапазоне. Если указанный диапазон включает один или оба из таких пределов, диапазоны за исключением любого или обоих из этих включенных пределов также входят в объем изобретения.
Используемые в настоящем документе численные значения в тексте документа часто представлены в формате диапазона. Формат диапазона используется лишь для удобства и краткости и не должен быть истолкован как негибкое ограничение объема изобретения, если из контекста ясно не следует иное. Соответственно, используемый диапазон прямо включает в себя все возможные поддиапазоны, все индивидуальные численные значения в пределах этого диапазона, а также все численные значения или числовые диапазоны, включая целые числа в пределах таких диапазонов и доли значений или целые числа в пределах диапазонов, если из контекста ясно не следует иное. Это истолкование применяется независимо от ширины диапазона и во всех контекстах на протяжении всего этого патентного документа. Таким образом, например, ссылка на диапазон 90-100% включает 91-99%, 92-98%, 93-95%, 91-98%, 91-97%, 91-96%, 91-95%, 91-94%, 91-93% и так далее. Ссылка на диапазон 90-100% также включает 91%, 92%, 93%, 94%, 95%, 96%, 97% и так далее, а также 91,1%, 91,2%, 91,3%, 91,4%, 91,5% и так далее, 92,1%, 92,2%, 92,3%, 92,4%, 92,5% и так далее, и так далее. Кроме того, ссылка на диапазон 1-3, 3-5, 5-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-70, 70-80, 80-90, 90-100, 100-110, 110-120, 120-130, 130-140, 140-150, 150-160, 160-170, 170-180, 180-190, 190-200, 200-225, 225-250 включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и так далее. В следующем примере ссылка на диапазон 25-250, 250-500, 500-1000, 1000-2500, 2500-5000, 5000-25000 или 5000-50000 включает любое численное значение или диапазон в пределах или включая такие значения, например, 25, 26, 27, 28, 29…250, 251, 252, 253, 254…500, 501, 502, 503, 504… и так далее. Использование ряда диапазонов включает комбинации верхних и нижних диапазонов, с созданием другого диапазона. Это истолкование применяется независимо от ширины диапазона и во всех контекстах на протяжении всего этого патентного документа. Таким образом, например, ссылка на ряд диапазонов, например, 5-10, 10-20, 20-30, 30-40, 40-50, 50-75, 75-100, 100-150, включает такие диапазоны, как 5-20, 5-30, 5-40, 5-50, 5-75, 5-100, 5-150 и 10-30, 10-40, 10-50, 10-75, 10-100, 10-150, и 20-40, 20-50, 20-75, 20-100, 20-150 и так далее.
Для краткости в настоящем документе использованы некоторые сокращения. Одним из примеров являются однобуквенные сокращения для обозначения аминокислотных остатков. Аминокислоты и соответствующие им трехбуквенные и однобуквенные сокращения приведены далее:
Изобретение, в целом, изложено в настоящем документе с использованием аффирмативного языка для описания многочисленных вариантов осуществления. Изобретение также специально включает варианты осуществления, в которых конкретный объект изобретения исключен, полностью или частично, например, вещества или материалы, этапы и условия способа, протоколы, процедуры, тесты или анализы. Таким образом, хотя изобретение в настоящем документе, в целом, не изложено с точки зрения того, что изобретение не включает, аспекты, которые прямо не включены в изобретение, тем не менее описаны в настоящем документе.
Приведено описание ряда вариантов осуществления. Тем не менее, понятно, что различные модификации могут быть осуществлены без отклонения от сущности и объема изобретения. Соответственно, описания в экспериментальной части предназначены для иллюстрации, но не ограничения объема изобретения, изложенного в формуле изобретения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Следующие примеры приведены с тем, чтобы предоставить специалистам в данной области полное раскрытие и описание того, как осуществлять на практике и использовать настоящее изобретение, и не должны ограничивать объем того, что авторы настоящего документа считают своим изобретением, и не должны быть истолкованы так, что приведенные ниже эксперименты представляют собой исключительно все проведенные эксперименты. Были предприняты усилия для обеспечения точности в отношении используемых чисел (например, количеств, температуры и так далее), но следует учитывать некоторые экспериментальные ошибки и отклонения.
Если нет иных указаний, части являются частями по массе, молекулярная масса является средневесовой молекулярной массой, температура указана в градусах Цельсия (°C) и давление является атмосферным или примерно атмосферным. Использованы стандартные сокращения, включая следующие: п.н.=пара(ы) нуклеотидов; т.п.н.=тысяча(и) пар нуклеотидов; пл=пиколитр(ы); с или сек=секунда(ы); мин=минута(ы); ч или час=час(ы); ак=аминокислота(ы); н.=нуклеотид(ы); нг=нанограмм; мкг=микрограмм; мг=миллиграмм; г=грамм; кг=килограмм; дл=децилитр; мкл=микролитр; мл=миллилитр; л=литр; мкМ=микромолярный; мМ=миллимолярный; M=молярный; кДа=килодальтон; в/м=внутримышечный(но); в/б=внутрибрюшинный(но); п/к=подкожный(но); bid=два раза в сутки; ВЭЖХ=высокоэффективная жидкостная хроматография; МТ=масса тела; Е=единица; н/з=не является статистически значимым; PG=уровень глюкозы в плазме натощак; FPI=уровень инсулина в плазме натощак; ITT=тест на толерантность к инсулину; PTT=тест на толерантность к пирувату; oGTT=пероральный тест на толерантность к глюкозе; GSIS=стимулированная глюкозой секреция инсулина; AAV=аденоассоциированный вирус; PBS=фосфатно-солевой буфер; ПЦР=полимеразная цепная реакция; NHS=N-гидроксисукцинимид; DMEM=модифицированная по способу Дульбекко среда Игла; гк=геномная копия; ЭДТА=этилендиаминтетрауксусная кислота; FGF19CF=FGF19 с FLAG-меткой на C-конце; GFP=зеленый флуоресцентный белок; ELISA=иммуноферментный анализ; ANOVA=дисперсионный анализ; SEM=стандартная ошибка среднего значения.
ПРИМЕР 1
Материалы и методы для примеров 2-5
Следующие методы и материалы были использованы в приведенных ниже примерах 2-5.
Животные
Мышей db/db (The Jackson Laboratory; Bar Harbor, ME) в возрасте примерно 15 недель и с массой тела примерно 36-48 г на момент начала эксперимента содержали в соответствии с принципами обращения с лабораторными животными в условиях контролируемого освещения (цикл 12 часов света и 12 часов темноты, темнота с 6:30 вечера до 6:30 утра), температуры (22±4°C) и влажности (50% ± 20%). Мыши имели свободны доступ к автоклавированной дистиллированной воде и получали в качестве корма ad libitum коммерчески доступную диету (Harlan Laboratories, Indianapolis, IN, Irradiated 2018 Teklad Global 18% Protein Rodent Diet) с содержанием 18 ккал% жиров, 24 ккал% белков и 58 ккал% углеводов. Все исследования на животных были одобрены институциональной комиссией по содержанию и использованию лабораторных животных NGM.
Нуклеотидные и аминокислотные последовательности
ОРС (ORF) FGF19 (кДНК ОРС, кодирующую чFGF19 (регистрационный № GenBank NM_005117.2), и белковую последовательность, кодируемую ею (регистрационный № GenBank NP_005108.1)), амплифицировали методом ПЦР с использованием рекомбинантной ДНК (кДНК), полученной из ткани тонкого кишечника человека. Набор реагентов для ПЦР с высокоточной ДНК-полимеразой Phusion® ((F-530L; New England BioLabs; Ipswich, MA) использовали со следующими праймерами: прямой праймер для ПЦР: 5ʹ CCGACTAGTCACCatgcggagcgggtgtgtgg (SEQ ID NO: 40) и обратный праймер для ПЦР: 5ʹ ATAAGAATGCGGCCGCTTACTTCTCAAAGCTGGGACTCCTC (SEQ ID NO: 41).
Амплифицированный фрагмент ДНК расщепляли Spe I и Not I (сайты рестрикции были включены в 5ʹ или 3ʹ праймеры для ПЦР, соответственно) и затем лигировали с AAV трансгенными векторами, которые расщепляли теми же ферментами рестрикции. Вектор, используемый для экспрессии, содержал селективный маркер, и экспрессионная кассета состояла из сильного эукариотического промотора в 5ʹ-положении от сайта для вставки клонированной кодирующей последовательности, затем следовала 3ʹ-нетранслируемая область и последовательность полиаденилирования бычьего гормона роста. Экспрессионный конструкт также был фланкирован внутренними концевыми повторами на 5ʹ и 3ʹ концах.
Получение и очистка AAV, кодирующих FGF19 и варианты FGF19
Клетки AAV293 (Agilent Technologies, Santa Clara, CA) культивировали в модифицированной по способу Дульбекко среде Игла (DMEM, Mediatech, Herndon, VA), содержащей 10% эмбриональной бычьей сыворотки и 1× раствор антибиотика антимикотика (Mediatech). Клетки высевали при 50% плотности в день 1 в 150 мм чашки для культивирования клеток и трансфицировали в день 2 методом осаждения с фосфатом кальция следующими тремя плазмидами (20 мкг/чашку каждой): i) трансгенной плазмидой AAV, ii) плазмидами pHelper (Agilent Technologies) и iii) плазмидой AAV2/9 (Rabinowitz et al. 2002). Через сорок восемь часов после трансфекции клетки соскребали с чашек, осаждали центрифугированием при 3000×g и ресуспендировали в буфере, содержащем 20 мМ трис pH 8,5, 100 мМ NaCl и 1 мМ MgCl2. Суспензию замораживали в бане из спирта и сухого льда и затем размораживали в водяной бане с температурой 37°C; цикл замораживания-размораживания повторяли три раза. Бензоназу® (Sigma Aldrich; St. Louis, MO) добавляли до концентрации 50 единиц/мл и дезоксихолат добавляли до конечной концентрации 0,25%. После инкубации при температуре 37°C в течение 30 минут клеточный детрит осаждали центрифугированием при 5000×g в течение 20 минут. Вирусные частицы в супернатанте очищали с использованием прерывистого градиента иодиксанола (Sigma Aldrich), как описано ранее (Zolotukhin et al., (2002) Endocrinology 143(5): 1741-47). Вирусный маточный раствор концентрировали с помощью Vivaspin® 20 (порог отсечения по молекулярной массе (MW) 100000 Да, Sartorius Stedim Biotech; Aubagne, France), ресуспендировали в фосфатно-солевом буфере (PBS) с 10% глицерина и хранили при температуре -80°C.
Для определения числа вирусных геномных копий (гк) 2 мкл вирусного маточного раствора инкубировали в 6 мкл раствора, содержащего 50 единиц/мл бензоназы, 50 мМ трис HCl pH 7,5, 10 мМ MgCl2 и 10 мМ CaCl2, при температуре 37°C в течение 30 минут. Затем добавляли 15 мкл раствора, содержащего 2 мг/мл протеиназы K, 0,5% SDS и 25 мМ ЭДТА, и смесь инкубировали еще в течение 20 минут при температуре 55°C для высвобождения вирусной ДНК. Вирусную ДНК очищали с помощью набора DNeasy® Kit (Qiagen; Valencia, CA) и элюировали 40 мкл воды. Количество гк вируса определяли методом количественной ПЦР. Вирусный маточный раствор разбавляли солевым раствором до желаемого количества гк/мл и рабочий раствор (200 мкл) инъецировали мышам через хвостовую вену.
Анализ уровня глюкозы в крови
Образцы крови собирали от отдельных не голодавших животных, надрезая хвост, и уровни глюкозы в плазме измеряли при помощи глюкометра (Accu-Chek® instruments; Roche Diagnostics, Indianapolis, IN) в соответствии с инструкциями производителя.
Анализ уровня экспозиции в сыворотке FGF19 и вариантов FGF19
Цельную кровь (~50 мкл/мышь) из хвостовых надрезов у мышей собирали в гладкие капилляры (BD Clay Adams SurePrep™, Becton Dickenson; Sparks, MD). Сыворотку и клетки крови разделяли центрифугированием в течение 10 мин при 10000 об/мин, 4°C, в центрифуге Autocrit™ Ultra 3 (Becton Dickinson) и немедленно замораживали при температуре -80°C. Уровни FGF19 и вариантов FGF19 измеряли в сыворотке, используя коммерчески доступный набор для ELISA (Biovendor; Asheville, NC) в соответствии с инструкциями производителя. Человеческий FGF19 использовали в качестве стандарта и определяли относительные концентрации M70. Относительные концентрации других вариантов FGF19 можно определять соответственно.
Измерения жировой массы тела и безжировой массы тела
Не анестезированных животных помещали индивидуально в пластиковый держатель, и композицию тела определяли с использованием ЯМР-МРТ (анализатор общей композиции тела, EchoMRI™, Houston, TX). Регистрировали жировую массу тела, безжировую массу тела и содержание воды (данные не представлены). Вся процедура занимала не более 2 минут для каждого животного.
Макроскопическая оценка опухолевых узлов в печени
Через двадцать четыре недели после инъекции AAV животных подвергали эвтаназии и печень мышей индивидуально изучали в отношении образования макроскопических опухолевых узлов. Определяли и регистрировали количество видимых узлов в печени (>2 мм в диаметре).
Статистический анализ
Все результаты выражали в виде среднего значения ± стандартная ошибка среднего значения (SEM). Однофакторный анализ ANOVA с последующим апостериорным критерием Даннета использовали для сравнения данных от нескольких групп (GraphPad Prism®; San Diego, CA). Где указано, для сравнения двух вариантов лечения использовали непарный критерий Стьюдента. Двухфакторный анализ ANOVA с последующим апостериорным критерием Бонферрони использовали для сравнения нескольких групп при изучении динамики. p значение, составляющее 0,05 или менее, считали статистически значимым.
ПРИМЕР 2
Уровни в плазме FGF19 у мышей db/db после генной доставки
Проводили 24-недельное исследование для определения того, способен ли вариант FGF19 M70 блокировать FGF19-индуцированную онкогенную активность у мышей db/db. В качестве альтернативы общепринятым способам доставки в данном примере (и в следующих далее примерах 2-4) использовали AAV в качестве носителя для доставки и экспрессии экзогенных интересующих генов в организме мышей и для создания непрерывной персистентной и системной экспозиции белков, кодируемых этими трансгенами.
Перед выполнением генной доставки мышей разделяли на шесть групп (5 самцов мышей/группу), как указано в таблице 1, и для каждой мыши регистрировали измеренные показатели уровня глюкозы в крови и массы тела.
FGF19-flag
3e9
FGF19-flag
3e10
В неделю 0 мышам вводили инъекцией либо 0,2 мл солевого раствора, либо 0,2 мл одного из конструктов AAV для групп 2-6. В недели 3 и 5 вновь регистрировали измеренные показатели уровня глюкозы в крови и массы тела для каждой мыши в группах 1-6.
Через пять недель после генной доставки измеряли концентрации FGF19 в сыворотке, полученной от мышей, инъецированных либо солевым раствором (группа 1), либо конструктами AAV (группы 2-6). Поскольку метод ELISA, используемый для измерения концентраций лекарственного средства, не позволял четко различать между FGF19 и M70, уровни в плазме, определенные для групп 5 и 6, представляют суммарные концентрации в плазме обоих белков.
Результаты представлены на фигуре 2. Уровни FGF19, обнаруженные у мышей, получавших низкую (3e9; группа 3) и высокую (3e10; группа 4) дозы рекомбинантного вируса FGF19-flag, были пропорциональны дозе AAV (1,4±0,5 нг/мл и 93,6±12,6 нг/мл, соответственно). У мышей, инъецированных обоими трансгенами FGF19-flag и M70, вирус M70 (3e11) присутствовал либо в 100-кратном, либо в 10-кратном избытке по сравнению с животными, получавшими только конструкт FGF19-flag. В результате совместного введения двух трансгенов высокие сывороточные уровни FGF19 обнаруживали как в случае низкой, так и высокой доз FGF19-flag (734,0±61,1 нг/мл (группа 5) и 453,4±169,4 нг/мл (группа 6), соответственно), что отражало вклад от экспрессии и M70, и FGF19-flag. Напротив, FGF19 не обнаруживали в образцах, полученных от мышей db/db, которым инъецировали солевой раствор или AAV-GFP.
В неделю 23 вновь регистрировали измеренные показатели уровня глюкозы в крови и массы тела для каждой мыши. Через двадцать четыре недели после генной доставки всех животных подвергали эвтаназии и проводили аутопсию.
ПРИМЕР 3
Опосредованное FGF19 образование макроскопических опухолевых узлов в печени мышей db/db в отсутствие и в присутствии варианта FGF19 M70
Используя умерщвленных животных из примера 2, проводили изучение печени отдельных мышей и определяли количество видимых опухолевых узлов. Результаты представлены на фигуре 3. Указания номеров групп соответствуют таблице 1.
Как показано на фигуре 3, эктопическая экспрессия FGF19-flag в модели на мышах db/db стимулировала образование множественных крупных, выпуклых опухолевых узлов, выступающих над поверхностью печени, как при низкой (3e9; группа 3)), так и высокой (3e10; группа 4) дозах вируса (2,4±1,4 очагов на печень и 7,8 очагов на печень, соответственно). Для сравнения, печень, полученная от мышей, экспрессирующих как FGF19-flag, так и M70, была полностью свободна от опухолевых узлов (группа 5 и группа 6). Результаты выражены в виде среднего значения и SEM для всех животных в одной и той же группе исследования. Следует отметить, что компонент c-Flag не оказывал влияния на онкогенные эффекты FGF19, хотя он мог влиять на антидиабетические эффекты FGF19.
Эктопическая экспрессия FGF19-flag стимулирует образование опухолевых узлов в печени у мышей db/db при сывороточной концентрации всего 1 нг/мл. Однако FGF19-опосредованный онкогенез, о чем свидетельствует появление очагов в печени, полностью подавляется, когда трансгены FGF19-flag и M70 совместно экспрессируются в данной модели. Эти данные свидетельствуют о том, что генно-инженерный вариант FGF19 M70 не только лишен онкогенного потенциала в организме мышей, связанного с белком дикого типа, но что он способен эффективно препятствовать пролиферативным эффектам белка дикого типа.
ПРИМЕР 4
Влияние экспрессии трансгенов на массу и композицию тела у мышей db/db
Как упоминалось в примере 2, самцам мышей db/db (n=5) в возрасте 15 недель вводили инъекцией 0,2 мл солевого раствора или рекомбинантного AAV с трансгенами, как указано в таблице 1. Для каждой мыши массу тела измеряли до инъекции (неделя -1) и через 3, 5 и 23 недель после инъекции. Результаты, представленные на фигуре 4, выражены в виде средних значений индивидуальных измерений для всех животных и SEM.
Трансгеннные мыши db/db, экспрессирующие совместно M70 и FGF19-flag (группы 5 и 6), демонстрировали значительное снижение массы тела по сравнению с животными, получавшими солевой раствор (группа 1). Менее выраженное действие на массу тела наблюдали у мышей, экспрессирующих трансген FGF19-flag, хотя снижение, судя по всему, было зависимым от дозы и было существенным в недели 3 и 5 у животных, получавших более высокую дозу (группы 3 и 4).
Следует отметить, что мыши в обеих контрольных группах (которым вводили либо солевой раствор (группа 1), либо AAV-GFP (группа 2)), как правило, демонстрировали значительную потерю массы в конце исследования по сравнению с их максимальной массой тела в недели 3 и 5 после генной доставки. Снижение массы тела у этих животных обычно связано с тяжелой гипергликемией, наблюдаемой у мышей db/db, и прогрессированием диабета 2 типа на протяжении 24-недельного исследования.
Изменения массы тела, наблюдаемые у мышей, экспрессирующих совместно трансгены FGF19 flag и M70, нашли отражение в снижении массы печени по сравнению с печенью, полученной от животных в группе с солевым раствором (данные не представлены); примечательно, что уменьшение размера органа было прямо пропорционально уменьшению массы тела у этих мышей. Напротив, относительная масса печени была увеличена у мышей, экспрессирующих FGF19-flag, хотя эти изменения были несущественными при нормировании на массу тела (данные не представлены).
Кроме того, методом ЯМР-МРТ определяли влияние лечения на композицию тела через 23 недели после инъекции. В соответствии с наблюдаемым снижением массы тела, эктопическая совместная экспрессия трансгенов M70 и FGF19-flag приводила к снижению как жировой массы тела, так и безжировой массы тела у мышей db/db по сравнению с мышами, получавшими солевой раствор (данные не представлены). Экспрессия FGF19-flag оказывала незначительное влияние на композицию тела у мышей db/db, получавших как низкую, так и высокую дозу трансгена (данные не представлены).
ПРИМЕР 5
Влияние экспрессии трансгенов на уровень глюкозы в крови не голодавших мышей db/db
Как упоминалось в примере 2, самцам мышей db/db (n=5) в возрасте 15 недель вводили инъекцией 0,2 мл солевого раствора или рекомбинантного AAV с трансгенами, как указано в таблице 1. Для каждой мыши измеряли уровень глюкозы в крови до инъекции (неделя -1) и через 3, 5 и 23 недель после инъекции. Результаты, представленные на фигуре 5, выражены в виде средних значений индивидуальных измерений для всех животных и SEM.
Трансгеннные мыши db/db, экспрессирующие совместно M70 и FGF19-flag (группы 5 и 6), демонстрировали значительное снижение концентраций глюкозы в крови по сравнению с контрольными животными (группы 1 и 2). Уровни глюкозы снижались быстро у мышей, экспрессирующих совместно трансгены FGF19-flag и M70, достигая уровня плато примерно через 3 недели после генной доставки (160 и 141 мг/дл при высокой дозе (группа 6) и низкой дозе (группа 5) трансгена FGF19-flag, соответственно). Уровни глюкозы в крови у мышей, экспрессирующих FGF19-flag (группы 3 и 4), были значительно ниже, чем в контрольных группах, и сохранялись на исходных базовых уровнях (примерно 400-450 мг/дл) на протяжении 24-недельного исследования. Как указано ранее, хотя компонент c-Flag не влиял на онкогенные эффекты FGF19, он может оказывать влияние на антидиабетические эффекты FGF19. Низкие системные уровни FGF19-flag, наблюдаемые у этих мышей, судя по всему, обеспечивают некоторую защиту от усугубляющейся гликемии, имеющей место у мышей, получавших солевой раствор или AAV-GFP, но не могут приводить к снижению уровней глюкозы ниже исходных значений.
Как и следовало ожидать, никакого снижения уровня глюкозы не наблюдали на протяжении исследования после инъекции солевого раствора (группа 1) или контрольного вируса, AAV GFP (группа 2). Следует отметить, что концентрации глюкозы в крови, определяемые при помощи глюкометра, в контрольных группах (~600 мг/дл) соответствуют верхнему пределу обнаружения для данного устройства и могут неточно отображать фактическую концентрацию глюкозы в этих образцах.
ПРИМЕР 6
Материалы и методы для примеров 7-11
Следующие методы и материалы были использованы в приведенных ниже примерах 7-16.
Конструкты ДНК
кДНК FGF19 человека (NM_005117), FGFR4 человека (NM_022963), FGFR4 мыши (NM_008011), KLB человека (NM_175737) и KLB мыши (NM_031180) приобретали у компании Genecopoeia. Мутации вводили в конструкты FGF19 с использованием набора для сайт-направленного мутагенеза QuickChange™ (Stratagene).
Получение и очистка AAV, кодирующих FGF19 и варианты FGF19
Клетки AAV293 (Agilent Technologies, Santa Clara, CA) культивировали в модифицированной по способу Дульбекко среде Игла (DMEM, Mediatech, Herndon, VA), содержащей 10% эмбриональной бычьей сыворотки и 1× раствор антибиотика антимикотика (Mediatech). Клетки высевали при 50% плотности в день 1 в 150 мм чашки для культивирования клеток и трансфицировали в день 2 методом осаждения с фосфатом кальция следующими тремя плазмидами (20 мкг/чашку каждой): i) трансгенной плазмидой AAV, ii) плазмидами pHelper (Agilent Technologies) и iii) плазмидой AAV2/9 (Rabinowitz et al. 2002). Через сорок восемь часов после трансфекции клетки соскребали с чашек, осаждали центрифугированием при 3000×g и ресуспендировали в буфере, содержащем 20 мМ трис pH 8,5, 100 мМ NaCl и 1 мМ MgCl2. Суспензию замораживали в бане из спирта и сухого льда и затем размораживали в водяной бане с температурой 37°C; цикл замораживания-размораживания повторяли три раза. Бензоназу® (Sigma Aldrich; St. Louis, MO) добавляли до концентрации 50 единиц/мл и дезоксихолат добавляли до конечной концентрации 0,25%. После инкубации при температуре 37°C в течение 30 минут клеточный детрит осаждали центрифугированием при 5000×g в течение 20 минут. Вирусные частицы в супернатанте очищали с использованием прерывистого градиента иодиксанола (Sigma Aldrich), как описано ранее (Zolotukhin et al., (2002) Endocrinology 143(5): 1741-47). Вирусный маточный раствор концентрировали с помощью Vivaspin® 20 (порог отсечения по молекулярной массе (MW) 100000 Да, Sartorius Stedim Biotech; Aubagne, France), ресуспендировали в фосфатно-солевом буфере (PBS) с 10% глицерина и хранили при температуре -80°C.
Для определения числа вирусных геномных копий (гк) 2 мкл вирусного маточного раствора инкубировали в 6 мкл раствора, содержащего 50 единиц/мл бензоназы, 50 мМ трис HCl pH 7,5, 10 мМ MgCl2 и 10 мМ CaCl2 при температуре 37°C в течение 30 минут. Затем добавляли 15 мкл раствора, содержащего 2 мг/мл протеиназы K, 0,5% SDS и 25 мМ ЭДТА, и смесь инкубировали еще в течение 20 минут при температуре 55°C для высвобождения вирусной ДНК. Вирусную ДНК очищали с помощью набора DNeasy® Kit (Qiagen; Valencia, CA) и элюировали 40 мкл воды. Количество гк вируса определяли методом количественной ПЦР. Вирусный маточный раствор разбавляли солевым раствором до желаемого количества гк/мл и рабочий раствор (200 мкл) инъецировали мышам через хвостовую вену.
Эксперименты на животных
Все исследования на животных были одобрены институциональной комиссией по содержанию и использованию лабораторных животных в NGM. Мышей содержали в свободном от патогенов виварии при температуре 22°C с контролируемым циклом 12 часов света/12 часов темноты. Все мыши получали стандартный корм (Harlan Laboratories, Teklad 2918) и автоклавированную воду ad libitum. Использовали самцов мышей, если не указано иначе. Мышей C57BL/6J, FVB/NJ, BDF, ob/ob и db/db приобретали у компании Jackson Laboratory. Гетерозиготных по rasH2 трансгенных мышей приобретали у компании Taconic. В день -7 группы мышей ob/ob или db/db в возрасте 10-12 недель, или мышей C57BL/6J, FVB/NJ, BDF или rasH2 в возрасте 6-8 недель рандомизировали в группы лечения на основании массы тела. Все животные получали одну внутривенную инъекцию 3×1011 геномных копий AAV в объеме 200 мкл через хвостовую вену в день 1. Регистрировали массу тела и собирали кровь через надрез на хвосте для измерения сывороточных уровней FGF19. Животных подвергали эвтаназии и печень собирали через 24 или 52 недель после введения AAV.
Общий, гистологический и иммуногистохимический анализ
Для определения начала изменений в печени у мышей, инъецированных AAV-FGF19, проводили макроскопическую и гистологическую оценку через определенные интервалы времени на протяжении всего года. Массу тела, массу печени и количество опухолевых узлов в печени регистрировали при аутопсии. Для расчета опухолевых показателей в баллах в случае вариантов FGF19 использовали формулу: опухолевый показатель в баллах=число опухолевых узлов на всей поверхности печени при экспрессии варианта/число опухолевых узлов на всей поверхности печени при экспрессии FGF19 дикого типа. Таким образом, FGF19-экспрессирующим мышам присваивали опухолевый показатель в баллах с произвольным значением 1. Срезы фиксированной в формалине и залитой парафином ткани окрашивали гематоксилином и эозином (H & E) для гистологической оценки гиперплазии, гипертрофии или неоплазии гепатоцитов. Где указано, срезы печени обрабатывали для поиска антигенов цитратным буфером (Vector Laboratories), а затем инкубировали с анти-PCNA (Dako), анти-Ki67 (Dako) антителами, антителами против глютамин-синтетазы (Thermofisher) или антителами против β-катенина (Cell Signaling) в концентрации 10 мкг/мл. Для обнаружения использовали биотинилированное вторичное антитело, реагент ABC-HRP и хромогенный субстрат пероксидазы DAB (Vector Laboratories). Для окрашивания на LacZ печень заливали OCT и нарезали в криостате. Срезы тканей фиксировали в PBS, содержащем 4% параформальдегида и 2% глутаральдегида, в течение 10 минут и инкубировали с 1 мг/мл X-gal (Promega) в 5 мМ растворе ферроцианида калия и 5 мМ растворе феррицианида калия при температуре 37°C в течение 2 часов.
Люциферазные анализы
Крысиные миобласты L6 получали из Американской коллекции типовых культур (ATCC) и культивировали в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 10% эмбриональной бычьей сыворотки (ЭБС), в условиях 37°C и 5% CO2. Клетки в 96-луночных планшетах временно трансфицировали экспрессионными векторами, кодирующими KLB мыши, FGFR4 мыши, активатор транскрипции GAL4-Elk-1 (pFA2-Elk1, Stratagene), контролируемые репортером люциферазы светляков сайты связывания GAL4 (pFR-luc, Stratagene) и люциферазу Renilla (pRL-SV40, Promega), с использованием реагента для трансфекции FuGENE® 6 (Roche Applied Science). Через день после трансфекции клетки стимулировали в течение 6 часов лигандами в бессывороточной среде, содержащей 20 мкг/мл гепарина (Sigma). Клетки лизировали лизисным буфером (Promega) и активность люциферазы определяли с использованием системы для анализа люциферазы Dual-Glo® (Promega) и планшетного ридера EnSpire® (Perkin Elmer). Активность люциферазы светляков была нормирована на активность совместно экспрессированной люциферазы Renilla и представлена в виде средних значений ± SEM из трех дублей.
Экспрессия Cyp7a1 в первичных гепатоцитах
Первичные гепатоциты из печени мыши, крысы или человека (Life Technologies) высевали на покрытые коллагеном I типа 96-луночные планшеты (Becton Dickinson) и инкубировали в течение ночи в E-среде Вильямса, содержащей 100 нМ дексаметазона и 0,25 мг/мл матригеля. Клетки обрабатывали рекомбинантными белками FGF19 или M70 в течение 24 часов (мышиные или крысиные гепатоциты) или 6 часов (человеческие гепатоциты). Экспрессию Cyp7a1 в клеточных лизатах определяли методом кОТ-ПЦР с использованием сложной смеси мастер-микс для кОТ-ПЦР QuantiTect (Qiagen) и предварительно полученных праймеров и зондов (Life Technologies; Cyp7a1 мыши: Mm00484150_m1; Cyp7a1 крысы: Rn00564065_m1; Cyp7a1 человека: Hs00167982_m1). Реакции проводили в тройном повторе на Applied Biosystems 7900HT Sequence Detection System. Относительные уровни мРНК рассчитывали сравнительным методом порогового цикла с использованием 18S РНК (мыши и крысы) или актина (человек) в качестве внутреннего стандарта.
Анализ in vivo сигнализации
Мышам db/db (в возрасте 9-11 недель) (Jackson Laboratories) вводили внутрибрюшинной (в/б) инъекцией рекомбинантные белки FGF19 или M70 (1 мг/кг). Печень собирали через 15 минут, 2 часа или 4 часа после инъекции и быстро замораживали в жидком азоте. Замороженные образцы печени гомогенизировали в лизисном буфере RIPA (50 мМ трис pH 7,5, 150 мМ NaCl, 1% NP40 и 0,5% дезоксихолат натрия, 1 мМ дитиотрейтол, 1 мМ PMSF, 2 мМ фторид натрия и 2 мМ ортованадат натрия), содержащем ингибиторы протеаз (Roche) и ингибиторы фосфатаз (Sigma). Равные количества белка (15 мкг), что определяли BCA анализом (Thermo Fisher), разделяли в 4-20% полиакриламидных гелях (Bio-Rad) и переносили на нитроцеллюлозные мембраны (Bio-Rad). Мембраны блокировали в 5% растворе обезжиренного сухого молока в смеси PBS/0,05% Tween 20 и инкубировали с антителами к фSTAT3 (Cell Signaling), STAT3 (Cell Signaling) или коктейлем антител I (Cell Signaling). Связанные антитела обнаруживали при помощи конъюгированных с пероксидазой хрена (HRP) вторичных реагентов и визуализировали с использованием сканера Odyssey® (Li-Cor Biotechnology).
Эксперименты с ксенотрансплантатами
Самкам бестимусных мышей nu/nu (Charles River Laboratories) в возрасте 6-8 недель вводили подкожной инъекцией в бок 5×106 клеток (200 мкл/мышь). Мышей, имеющих опухоли аналогичных объемов (~100 мм3), рандомизировали в группы и вводили однократной инъекцией в хвостовую вену 3×1011 AAV-M70 или контрольного вируса (AAV-GFP). Опухоли измеряли электронным штангенциркулем и средний объем опухолей рассчитывали по формуле: (W2×L)/2, где W и L представляют собой малый и большой диаметр, соответственно.
Статистический анализ
Все результаты выражали в виде среднего значения ± стандартная ошибка среднего значения (SEM). Однофакторный анализ ANOVA с последующим апостериорным критерием Даннета использовали для сравнения данных от нескольких групп (GraphPad Prism®). Где указано, для сравнения двух групп лечения использовали непарный критерий Стьюдента. Двухфакторный анализ ANOVA с последующим апостериорным критерием Бонферрони использовали для сравнения нескольких групп при изучении динамики. p значение, составляющее 0,05 или менее, считали статистически значимым.
ПРИМЕР 7
Опосредованная AAV трансгенная система для оценки гепатоцеллюлярного онкогенеза in vivo
Опосредованная AAV генная доставка позволяет достигать непрерывной экспрессии трансгенов без воспалительных ответов, которые обычно связаны с использованием других вирусных векторов (Zaiss et al., 2002, J. Virol. 76, 4580-4590). Устойчивую экспрессию продолжительностью вплоть до 1 года наблюдали у взрослых мышей при использовании метода доставки генов с помощью AAV (Rivera et al., 1999, PNAS 96, 8657-8662). Первый AAV вектор был недавно одобрен в качестве средства лечения генетического заболевания у человека (Wirth et al., 2013, Gene 525, 162-169).
В описанной ранее трансгенной по FGF19 модели FGF19 эктопически экспрессировался в скелетной мышце, не физиологическом сайте для экспрессии FGF19 (Inagaki et al., 2005, Cell Metabol. 2, 217-225; Nicholes et al., 2002, Amer. J. Pathol. 160, 2295-2307). При патологических состояниях, таких как цирроз или холестаз, экспрессия FGF19 индуцируется в печени (Desnoyers et al., 2008, Oncogene 27, 85-97; Hasegawa Y, 2013, Hepatol. 58, 802A; Schaap et al., 2009, Hepatol. 49, 1228-1235). В качестве альтернативы общепринятым способам получения трансгенных мышей FGF19 вводили при помощи AAV 6-12-недельным мышам (фигура 6A). При использовании данного подхода основной тканью трансгенной экспрессии является печень, лишь с незначительной экспрессией в сердце и мышцах (данные не представлены). Как сообщалось ранее, наблюдали 90-100% трансдукцию гепатоцитов и долговременную экспрессию гена без токсичности после одного введения AAV (Zincarelli et al., 2008, Mol. Ther. 16, 1073-1080) (данные не представлены).
Несколько линий мышей оценивали на латентность и устойчивость FGF19-опосредованного образования опухолей в печени (таблица 2). Контрольный вирус AAV (AAV-GFP, зеленый флуоресцентный белок) не вызывал образование каких-либо опухолей в печени (таблица 2).
Как показано в таблице 2, FGF19 стимулирует гепатоканцерогенез во многих мышиных моделях. Мышам различных линий (в возрасте 6-12 недель) инъецировали 3×1011 геномных копий AAV векторов, кодирующих FGF19 или контрольный ген (GFP, зеленый флуоресцентный белок). Частоту возникновения опухолей оценивали через 24 или 52 недели после введения AAV. н/о, не определено.
Как правило, мыши, которым вводили AAV-GFP, демонстрировали фенотип, сходный с фенотипом животных, которым вводили солевой раствор (данные не представлены). Для простоты, только результаты для получавших AAV-GFP животных показаны в качестве контроля в следующих исследованиях.
Интересно, что латентность образования опухолей варьировалась в зависимости от генетического фона мышей. Мутации в рецепторе лептина часто имеют место в пораженной циррозом печени и связаны с HCC у человека (Ikeda et al., 2014, Gastroenterol., 146: 222-232; Wang et al., 2010, World J. Gastroenterol. 16, 5801-5809). Мыши db/db, которые имеют генетический дефект в рецепторе лептина (Tartaglia et al., 1995, Cell 83, 1263-1271), обеспечивают клинически значимый генетический контекст для оценки потенциально стимулирующих HCC генов. Действительно, среди нескольких протестированных линий мышей мыши db/db отличались самым коротким латентным периодом и высокой пенетрантностью опухолей, с образованием множественных крупных выпуклых опухолевых узлов, выступающих над поверхностью печени, через 24 недели после введения AAV-FGF19 (фигура 6B).
У мышей db/db сывороточные уровни FGF19 достигали ~ 1 мкг/мл через 1 неделю после одной инъекции в хвостовую вену 3×1011 геномных копий AAV-FGF19 (фигура 6C). FGF19 не обнаруживали у мышей, получавших контрольный вирус. Высокие уровни циркулирующего FGF19 сохранялись на протяжении 24-недельного периода исследования (фигура 6C). Подсчитывали видимые опухолевые узлы на всей поверхности печени (фигура 6D). Регистрировали максимальный диаметр опухолевых узлов в печени (фигура 6D). Время от времени небольшое количество опухолевых узлов в печени наблюдали у мышей db/db, которым вводили контрольный вирус или солевой раствор, что, возможно, отражало повышенный уровень онкогенеза в этой генетической модели (фигура 6D и данные не представлены). Была создана система подсчета опухолевого показателя в баллах, основанная на множественности печеночных опухолевых узлов, которая описана в разделе «Материалы и методы» (пример 6) (фигура 6D).
Микроскопическое исследование позволило классифицировать AAV-FGF19-индуцированные in situ опухоли печени как солидные HCC, которые напоминали опухоли у трансгенных по FGF19 животных (фигура 6E). Пролиферативный статус клеток, изученный путем иммуногистохимического окрашивания на Ki-67 и PCNA, свидетельствовал о том, что опухоли были в высокой степени пролиферативными. Аналогично тому, что наблюдалось у трансгенных по FGF19 мышей, опухоли печени у получавших AAV-FGF19 мышей были положительными по глютамин-синтетазе, что предполагает перицентральное происхождение (Nichoels et al., 2002, Amer. J. Pathol. 160, 2295-2307) (фигура 6E). Опухоли печени от получавших AAV-FGF19 мышей также отличались повышенным окрашиванием клеточных ядер на β-катенин (фигура 6E). Таким образом, AAV-опосредованная трансгенная экспрессия обеспечивает надежную систему для оценки FGF19-индуцированного гепатоканцерогенеза in vivo.
ПРИМЕР 8
M70 представляет собой генно-инженерный, не вызывающий образование опухолей вариант FGF19
FGF19 и FGF21 принадлежат к одному и тому же подсемейству FGF, имея 34% идентичности аминокислотных последовательностей. Интересно, что, в отличие от FGF19, FGF21 не вызывает образование опухолей в печени в AAV-опосредованных трансгенных моделях авторов изобретения (данные не представлены). Для идентификации структурных элементов, которые имеют решающее значение для онкогенной активности, индуцируемой FGF19, получали ряд химерных конструктов между FGF19 и FGF21 путем систематического обмена предсказанных вторичных структурных элементов, включая α-нити и β-спирали (таблица 3). В таблице 3 приведены химерные конструкты с аминокислотными последовательностями, происходящими из FGF19 или FGF21. Образование опухолей в печени оценивали через 24 недели после AAV-опосредованной экспрессии трансгенов. Вторичные структурные компоненты (β-складки и петли между β-складками) в FGF19 заменяли систематически. Конструкты индивидуально вводили мышам db/db с помощью AAV для оценки их онкогенного потенциала после 24 недель непрерывного воздействия. N-концевые 10-20 аминокислот в FGF19 были идентифицированы как имеющие решающее значение для онкогенной активности (таблица 3).
В дальнейшем получали дополнительные конструкты, обменивая только аминокислоты в пределах этой области (таблица 4). В таблице 4 представлен анализ соотношений структуры и активности для вариантов FGF19 с изменениями в N-концевой области. Аминокислотные изменения относительно FGF19 дикого типа подчеркнуты. Образование опухолей в печени оценивали через 24 недели после экспрессии трансгенов.
В общей сложности более 30 вариантов FGF19 прошли индивидуальную оценку на их онкогенный потенциал. Вариант FGF19, имеющий 3 аминокислотные замены (A30S, G31S, H33L) и 5-аминокислотную делецию, названный M70 (SEQ ID NO: 1), был выбран для дальнейших исследований (фигура 7A).
В отличие от ситуации с FGF19, печень мышей db/db, подвергавшихся системному воздействию M70 в высокой концентрации в течение 24 недель, была полностью свободна от опухолевых узлов в печени (15,6±2,8 опухолевых узлов на печень и 0,0±0,0 опухолевых узлов на печень для FGF19 и M70, соответственно, n=5, p<0,001; фигура 7B). У экспрессирующих FGF19 мышей наблюдали значительное увеличение массы печени (2,91±0,19 г против 1,86±0,12 г у контрольных мышей, n=5, p<0,001; фигура 7C), что, как сообщалось в предыдущих исследованиях, тесно коррелирует с опухолевой нагрузкой в печени. Напротив, у экспрессирующих M70 мышей не наблюдали никакого увеличения массы печени (1,56±0,09 г против 2,91±0,19 г у мышей с FGF19, n=5, p<0,001; фигура 7C). Аналогичные результаты были получены при расчете отношения массы печени к массе тела (фигура 7D и фигура 7E). У этих мышей средняя сывороточная концентрация M70 составляла 2-3 мкг/мл, примерно в 10000 раз выше, чем уровень циркулирующего FGF19 у человека (фигура 7F). Гистологический анализ печени выявил, что у экспрессирующих M70 мышей не развивались сколь-нибудь заметные пренеопластические и неопластические очаги, связанные с избыточной экспрессией FGF19 у мышей. В частности, не наблюдали очагов в печени, гепатоцеллюлярной дисплазии, гепатоцеллюлярных аденом или гепатоцеллюлярных карцином (фигура 7G). У экспрессирующих FGF19 мышей в свободных от опухолей областях печени наблюдали повышенную плотность клеток вокруг центральной вены, однако такие изменения отсутствовали у экспрессирующих M70 мышей. Избыточная экспрессия M70 не вызывала повышение количества Ki-67-положительных клеток, являющееся следствием избыточной экспрессии FGF19 (фигура 7G). Более того, в то время как опухолевые очаги в печени у экспрессирующих FGF19 мышей становились в высокой степени положительными по глютамин-синтетазе, повышенную экспрессию глютамин-синтетазы не наблюдали в печени экспрессирующих M70 мышей (фигура 7G). И наконец, никакой печеной токсичности не наблюдали после продолжительной 24-недельной экспозиции M70, что определяли по сывороточным уровням печеночных ферментов (фигура 7H). В совокупности, эти результаты показывают, что у M70 отсутствует способность стимулировать гепатоцеллюлярный онкогенез у мышей db/db.
Далее оценивали онкогенную активность M70 в трансгенной мышиной модели rasH2. Мышей CB6F1-RasH2, гемизиготных по трансгену H-RAS человека, интенсивно используют в качестве ускоренного варианта для общепринятого 2-летнего теста на канцерогенность с использованием грызунов (Storer et al., 2010, Toxicologic Pathol. 38, 51-61). У чувствительных как к генотоксичным, так и не генотоксичным канцерогенам мышей rasH2 развиваются как спонтанные, так и индуцированные новообразования раньше, чем у мышей дикого типа. Эта линия также имеет соответствующий генетический фон для изучения гепатоканцерогенеза, поскольку активация сигнального пути RAS часто наблюдается в случае HCC человека (Calvisi et al., 2006, Gastroenterol. 130, 1117-1128).
На протяжении 52-недельного исследования у мышей rasH2, экспрессирующих FGF19 или M70, имело место значительное снижение увеличения массы тела по сравнению с контрольными мышами (фигура 8A). Однако морфология печени в группах животных, экспрессирующих FGF19 и M70, имела значительные различия. Макроскопические морфологические изменения с множественными опухолевыми узлами наблюдали в печени мышей, экспрессирующих FGF19, что согласовалось с образованием HCC (3,8±1,5 опухолевых узлов на печень; фигура 8B). Напротив, печень мышей, экспрессирующих M70, имела нормальную макроскопическую морфологию и была полностью свободна от опухолевых узлов (фигура 8B). Следует отметить, что у контрольных мышей rasH2 наблюдали низкий уровень спонтанного образования опухолей в печени (фигура 8B). У экспрессирующих M70 животных имело место резкое снижение массы печени по сравнению с экспрессирующими FGF19 мышами (0,76±0,05 г против 1,71±0,24 г у мышей с FGF19, n=9, p<0,001; фигура 8C). M70 также приводил к нормализации соотношения массы печени и тела у мышей rasH2 (5,34±0,24% против 8,66±1,36% у мышей с FGF19, n=9, p<0,01; фигура 8D). Сывороточные уровни FGF19 и M70 у этих мышей были сопоставимы, в именно, 155±28 нг/мл и 209±22 нг/мл, соответственно (фигура 8E).
Окрашенные H & E срезы печени от этих мышей оценивали на наличие опухолей и пренеопластических очагов (фигура 8F). Кроме того, проводили окрашивание на глютамин-синтетазу, как маркера FGF19-индуцированной опухоли печени (фигура 8F). Срезы, окрашенные на глютамин-синтетазу, были парными для срезов, окрашенных H & E, и на фотографиях показаны те же самые воротная (p) и центральная (c) вены. У мышей rasH2, экспрессирующих FGF19, наблюдали гепатоцеллюлярную аденому, а также гепатоцеллюлярные карциномы. Пренеопластические гепатоцеллюлярные очаги также были отмечены у экспрессирующих FGF19 мышей rasH2. Примечательно, что ни в одной печени от мышей, экспрессирующих M70, не наблюдали опухоли или гистологические признаки пренеопластических очагов (фигура 8F). В подтверждение гистологических результатов, повышенная экспрессия в печени Ki-67 и AFP (эмбриональный печеночный белок, часто индуцируемый при HCC (Marrero and El-Serag, 2011, Hepatol. 53, 1060-1062) имела место у экспрессирующих FGF19 мышей rasH2, но не у экспрессирующих M70 мышей (фигура 8G).
Эти результаты показывают, что, в отличие от FGF19, продолжительное воздействие высоких уровней циркулирующего M70 (то есть, 24 недели в случае мышей db/db или 52 недели в случае мышей rasH2) не стимулировало образование опухолей в печени.
ПРИМЕР 9
M70 связывается и активирует FGFR4 in vitro и in vivo
Для выяснения молекулярного механизма, лежащего в основе неспособности M70 к индукции образования опухолей в печени, изучали взаимодействие M70 с известным рецепторным комплексом FGF19. Для измерения прямого связывания M70 или FGF19 с FGFR4 использовали анализ методом поверхностного плазмонного резонанса (ППР). В анализе Biacore использовали M70 или FGF19 в потоке над биосенсорами, покрытыми слитым с Fc белком внеклеточного домена (ECD) FGFR4. M70 напрямую взаимодействовал с FGFR4 с аффинностью, сопоставимой с аффинностью в случае FGF19 (константа диссоциации KD=134±47 нМ и 167±5 нМ, соответственно, фигура 9A и фигура 9B). Кроме того, аффинность связывания M70 с KLB была сходна с аффинностью связывания в случае FGF19 (KD=24,1±11,0 пМ и 28,5±0,8 пМ, соответственно; данные не представлены). M70 связывается с тем же сайтом KLB, что и FGF19, это продемонстрировано в конкурентном анализе Biacore (данные не представлены). В твердофазном анализе M70 взаимодействовал с рецепторным комплексом FGFR4-KLB (фигура 9C). Присутствие KLB приводило к резкому повышению аффинности связывания лиганд-рецептор. Константа диссоциации при связывании M70 с рецепторным комплексом FGFR4-KLB указывала на высокоаффинное взаимодействие, с KD, составляющей 2,14 нМ (против KD 2,49 нМ в случае FGF19).
Способность M70 активировать его рецепторы оценивали в клеточном анализе с использованием крысиных клеток L6, трансфицированных FGF-чувствительным люциферазным репортерным геном GAL-Elk1 (Wu et al., 2011, PloS one 6, e17868; Wu et al., 2010a PNAS, 107, 14158-14163). В этом анализе эффективное связывание лиганда с FGFR приводит к активации эндогенного ERK киназного пути, что ведет к последующей активации химерного активатора транскрипции, состоящего из домена активации Elk-1 и ДНК-связывающего домена GAL4. Клетки L6 лишены функциональных FGFR или KLB и реагируют на FGF19 только при совместной трансфекции соответствующими рецепторами (данные не представлены). M70 активировал внутриклеточные сигнальные пути в клетках L6, экспрессирующих совместно FGFR4 и KLB, так же эффективно, как и FGF19 (EC50=38 пМ и 52 пМ для M70 и FGF19, соответственно; фигура 9D). Напротив, сигнализация в клетках, трансфицированных одним только FGFR4, была намного менее чувствительна к любому из лигандов, демонстрируя >500-кратное снижение активности при добавлении или FGF19, или M70 (фигура 9D). Эти результаты свидетельствуют о том, что образование тройного комплекса между корецепторами FGFR4-KLB и соответствующими лигандами важно для эффективной активации внутриклеточной сигнализации. Далее анализировали путь активации FGFR4 в Hep3B, человеческой линии клеток HCC. Клетки Hep3B преимущественно экспрессируют FGFR4, среди изоформ FGFR, и KLB. Рекомбинантный белок M70 индуцировал фосфорилирование и активацию ERK с активностью и эффективностью, аналогичными таковым в случае FGF19 дикого типа (полумаксимальная эффективная концентрация EC50=0,38 нМ и 0,37 нМ для M70 и FGF19, соответственно; фигура 9E).
FGF19/FGF15 участвуют в регуляции метаболизма желчных кислот печени у человека и у грызунов, соответственно (Holt et al., 2003, Genes Dev. 17, 1581-1591), (Inagaki et al., 2005, Cell Metabol. 2, 217-225). FGF19/FGF15 сильно подавляют экспрессию в печени холестерин-7a-гидроксилазы 1 (Cyp7a1) в процессе, который требует FGFR4 (Inagaki et al., 2005, Cell Metabol. 2, 217-225; Wu et al., 2011, PloS one 6, e17868). Оценивали способность M70 регулировать Cyp7a1 в первичных гепатоцитах. При добавлении к культуральной среде M70 эффективно подавлял экспрессию Cyp7a1 в первичных гепатоцитах из печени мыши, крысы или человека (фигура 9F). Активность M70 была сопоставима с активностью FGF19 дикого типа (полумаксимальная ингибирующая концентрация IC50 0,64 пМ для M70 против 0,65 пМ для FGF19 в первичных гепатоцитах мыши; IC50 0,49 пМ для M70 против 3,96 пМ для FGF19 в первичных гепатоцитах крысы; IC50 6,80 пМ для M70 против 1,73 пМ для FGF19 в первичных гепатоцитах человека; фигура 9F). В первичных гепатоцитах человека добавление FGF19 приводило к максимальному подавлению мРНК Cyp7a1 на 97%. Аналогично, M70 был способен снижать экспрессию Cyp7a1 на 98% (фигура 9F).
Для оценки острых эффектов введения M70 на печеночную экспрессию Cyp7a1 in vivo мышам вводили внутрибрюшинной инъекцией (в/б) рекомбинантный белок M70 или FGF19 в диапазоне доз от 0,001 до 10 мг/кг (фигура 9G). Одна в/б инъекция M70 приводила к сильной супрессии мРНК Cyp7a1 с величиной ED50, составляющей 1,29 мкг/кг (фигура 9G). Эти данные показывают, что системное введение M70 может эффективно и быстро запускать FGFR4-опосредованный внутриклеточный путь in vivo.
В итоге, M70 и FGF19 дикого типа демонстрируют сопоставимые профили видов биологической активности, приводящих к активации сигнализации ERK и регуляции Cyp7a1.
ПРИМЕР 10
M70 демонстрирует активацию иного сигнального пути, чем FGF19
M70 связывает рецепторный комплекс FGFR4 и активирует внутриклеточный сигнальный путь, приводящий к подавлению Cyp7a1, но не стимулирует образование опухолей в печени в моделях на мышах db/db или rasH2. Для выяснения молекулярных основ отсутствия онкогенного потенциала анализировали активацию ключевых сигнальных белков, вовлеченных в онкогенез, включая пути ERK, PI3K/AKT, STAT и WNT/β -катенина.
Белки M70 и FGF19 (1 мг/кг) вводили внутрибрюшинной инъекцией мышам db/db. Печень собирали через 15 минут (данные не представлены), 2 часа (фигура 10A) и 4 часа (данные не представлены), и фосфорилирование сигнальных белков определяли методом иммуноблоттинга. В соответствии со способностью обоих молекул к сигнализации в культивируемых первичных гепатоцитах, FGF19 и M70 в сходной степени стимулировали фосфорилирование ERK в тканях печени in vivo. В согласии с предыдущими сообщениями о роли FGF19 в модулировании синтеза белков печени (Kir et al., 2011, Science 331, 1621-1624), как FGF19 дикого типа, так и M70 индуцировали устойчивое фосфорилирование рибосомного белка S6 в печени (фигура 10 и данные не представлены). Это согласуется с мнением, что M70 сохраняет активность в отношении рецепторного комплекса FGFR4-KLB. Ни M70, ни FGF19 не оказывали какого-либо эффекта на уровни фосфорилированного AKT в печени. Активацию GSK3β и β-катенина не наблюдали во всех трех протестированных временных точках.
Примечательно, что FGF19 индуцировал фосфорилирование STAT3 через 2 часа после дозирования (фигура 10A). Этот эффект продолжался до 4 часов после дозирования (данные не представлены). Напротив, M70 не вызывал увеличения фосфорилирования STAT3 (фигура 10A). Показано, что регуляция IL-6, известного активатора STAT3, повышена в печени мышей, получавших FGF19, но не M70 (фигура 10B). Активация фSTAT3 под действием FGF19, вероятно, связана с неклеточным автономным механизмом действия на печень, поскольку никакой индукции фSTAT3 не наблюдали через 15 минут после инъекции белка или в культуре первичных мышиных гепатоцитов (данные не представлены). В подкрепление результатов по фосфорилированию и активации STAT3 повышенную экспрессию генов-мишеней STAT3, включая сурвивин, bcl-XL и циклин D1, наблюдали в печени мышей rasH2, экспрессирующих FGF19, но не M70 (фигура 10C). Поскольку STAT3 является онкогеном, часто активируемым при HCC (He and Karin, 2011, Cell Res. 21, 159-168), его активация под действием FGF19 представляет собой возможный механизм FGF19-индуцированного гепатоканцерогенеза. Неспособность M70 активировать путь STAT3 может быть причиной отсутствия у него онкогенной активности in vivo.
Таким образом, M70 активирует только подгруппу сигнальных путей далее его рецепторов, что является отличительной чертой избирательных модуляторов (Kenakin and Christopoulos, 2013, Nat. Rev. Drug Discov. 12, 205-21). Идентификация и характеризация M70 позволяет авторам изобретения определить два различных биологических процесса, регулируемых через FGF19-FGFR4, гомеостаз желчных кислот и онкогенез.
ПРИМЕР 11
M70 ингибирует опосредуемое FGF19 образование опухолей
Наблюдения авторов изобретения свидетельствуют о том, что M70 действует как избирательный модулятор или «несимметричный лиганд», активируя метаболическую сигнализацию, но не онкогенные сигналы от FGFR4. Далее определяли, можно ли использовать несимметричный агонизм M70 для ингибирования ассоциированного с FGF19 образования опухолей по ортостерическому или аллостерическому механизму.
Мышам db/db вводили инъекцией 3×1010 геномных копий AAV-FGF19 с 10-кратным молярным избытком AAV-M70 (3×1011 геномных копий) или без него. Через 24 недели после экспрессии трансгенов проводили аутопсию мышей и печень извлекали для анализа. В то время как эктопическая экспрессия FGF19 у мышей db/db стимулировала образование опухолевых узлов на поверхности печени (7,8±2,3 опухолевых узлов на печень), печень мышей, экспрессирующих как FGF19, так и M70, была полностью свободна от опухолевых узлов (фигура 11A). Масса печени мышей, экспрессирующих также и M70, была значительно меньше, чем у экспрессирующих FGF19 мышей (1,59 г ± 0,14 г и 2,42 г ± 0,20 г, соответственно, n=5, p<0,01; фигура 11B). Отношение массы печени к массе тела у мышей, находящихся под воздействием совместно M70 и FGF19, существенно не отличалось от такового у контрольных мышей (фигура 11C). Сывороточные уровни FGF19 составляли 94±12 нг/мл при введении только его, и объединенный сывороточный уровень FGF19 и M70 составлял 453±169 нг/мл (фигура 11D). Гистологический анализ печени подтвердил, что, в отличие от экспрессирующих FGF19 мышей, у мышей, экспрессирующих совместно M70 и FGF19, отсутствовали какие-либо гистологические признаки опухолей печени (фигура 11E). Эти данные показывают, что M70 эффективно конкурирует с FGF19, предотвращая образование опухолей у экспрессирующих FGF19 мышей.
Сообщают, что FGF19 амплифицирован и/или избыточно экспрессирован при HCC и раке толстого кишечника (Desnoyers et al., 2008; Sawey et al., 2011, Oncogene 27, 85-97). Был проведен скрининг панели линий раковых клеток печени, толстого кишечника, молочной железы и других линий раковых клеток человека, и было установлено, что FGF19 продуцируется и секретируется, в числе прочих, линиями клеток Huh-7 (HCC) и HCT-116 (рак толстого кишечника) (фигура 11F), которые были выбраны для дальнейших исследований. Уровни FGF19 в культуральной среде достигали 1-2 нг/мл при измерении методом ELISA, что примерно в 10 раз выше, чем физиологическая концентрация FGF19 у человека.
Клетки линии Huh-7 опухоли HCC содержат ампликон 11q13.3 и избыточно экспрессируют FGF19 и CCND1. Был протестирован эффект M70 на опухолеобразующую способность клеток Huh-7. Бестимусным «голым» мышам вводили подкожной инъекцией клетки Huh-7 и давали опухолям возможность достигнуть размера ~100 мм3. В этот момент мышей распределяли в 2 группы лечения: одним вводили внутривенно AAV-M70, другим - контрольный вирус. У получавших M70 мышей наблюдалась тенденция к замедлению роста опухолей на 28% (размер опухолей в терминальной стадии: 1856±348 мм3 у контролей против 1340±406 мм3 после лечения M70; n=10; фигура 11G). Не было отмечено никакого существенного эффекта на массу тела (данные не представлены).
Также изучали эффект M70 на рост ксенотрансплантата раковой опухоли HCT-116 толстого кишечника. Мышам со сформировавшимися раковыми опухолями HCT116 толстого кишечника, вводили AAV-M70 или контрольный вирус. Всего через 8 дней после начала лечения M70 подавлял рост опухоли на 37% (размер опухоли: 459±83 мм3 в контрольной группе против 287±87 мм3 в группе M70; n=5; фигура 11H). В день 15 после начала лечения у получавших M70 мышей наблюдали статистически значимое ингибирование роста опухолей на 71% (размер опухолей в терминальной стадии: 1634±524 мм3 у контролей против 479±155 мм3 после лечения M70, n=5, p<0,001; фигура 11H и 11I). Никакого существенного эффекта на массу тела не наблюдали (фигура 11J).
Эти результаты свидетельствуют о том, что M70 действует как несимметричный лиганд, способный противодействовать FGF19 дикого типа в онкогенной сигнализации, и демонстрируют возможность использования избирательного модулятора, такого как M70, для подавления FGF19-зависимого роста опухолей.
ПРИМЕР 12
M70 ингибирует рост опухоли CT26 толстого кишечника
Данное исследование проводили с целью дальнейшей оценки эффекта M70 на прогрессирование опухолей в сингенной модели на иммунокомпетентных мышах. CT26 представляет собой мышиную линию клеток рака толстого кишечника, которая хорошо приживляется и растет у сингенных мышей Balb/c. CT26 широко используют для изучения влияния соединений/средств на рост опухолей, особенно для оценки иммунотерапевтических средств против рака.
В качестве положительного контроля использовали блокирующее антитело против белка программируемой клеточной гибели 1 (PD-1). PD-1 и его лиганды PD-L1/PD-L2 представляют собой контрольную точку оси иммунитета. Путь PD-1 снижает опухоль-специфический иммунитет за счет нарушения T-клеточных ответов и стимуляции индукции Foxp3+ Treg клеток на периферии. Блокирование пути PD-1 в сочетании с другой иммунотерапией ингибирует прогрессирование опухолей в сингенных моделях. Несколько человеческих анти-PD-1 моноклональных антител (мАт), а также человеческих анти-PD-L1 мАт проходят клинические испытания, и первое анти-PD-1 антитело недавно было одобрено FDA в качестве противоракового терапевтического средства.
Мышей Balb/c приобретали у компании Jackson Laboratory. Животных содержали в свободном от патогенов виварии. Все протоколы экспериментов на животных были одобрены институциональной комиссией по содержанию и использованию лабораторных животных в NGM Biopharmaceuticals.
Мышиную линию клеток CT26 рака толстого кишечника получали от ATCC. Клетки культивировали в среде DMEM с 10% ЭБС и коктейлем пенициллина/стрептомицина. Экспоненциально растущие клетки собирали для имплантации мышам. Клетки ресуспендировали в солевом растворе для инъекций.
Мышам Balb/c имплантировали 1×106 клеток CT26 в правый бок. Через три дня белок M70 вводили подкожной инъекцией мышам Balb/c с имплантатом CT26 один раз в сутки в течение 15 дней. Рост опухоли CT26 измеряли два раза в неделю штангенциркулем. Объем опухолей рассчитывали по формуле: объем опухоли=ширина2 * длина/2.
Как показано на фигуре 13, M70 вызывает задержку роста опухоли в сингенной мышиной модели рака CT26 толстого кишечника после введения доз 10 мг/кг (фигура 13A) или доз 3 мг/кг (фигура 13B) по сравнению с одним только растворителем. Также показано, что M70 приводит к снижению массы тела после введения доз 10 мг/кг (фигура 14A) или доз 3 мг/кг (фигура 14B).
Таким образом, данные исследования показали, что лечение при помощи M70 приводит к задержке роста опухоли CT26 толстого кишечника у иммунокомпетентных сингенных мышей Balb/c, причем противоопухолевую эффективность наблюдали в случае обеих доз M70 (3 мг/кг и 10 мг/кг).
В настоящем документе описаны конкретные варианты осуществления данного изобретения, включая наилучший способ осуществления данного изобретения, известный авторам настоящей заявки. После прочтения приведенного выше описания вариации раскрытых вариантов осуществления могут стать очевидными для специалистов в данной области, и ожидается, что эти квалифицированные специалисты смогут использовать такие вариации в зависимости от обстоятельств. Соответственно, подразумевается, что изобретение будет использовано на практике иным образом, чем конкретно описано в настоящем документе, и что изобретение включает все модификации и эквиваленты объекта изобретения, изложенного в прилагаемой формуле изобретения, в соответствии с действующим законодательством. Кроме того, любое сочетание вышеописанных элементов во всех возможных их вариациях входит в объем изобретения, если нет иных указаний в настоящем документе или иным образом явно не противоречит контексту.
Все публикации, патентные заявки, регистрационные номера и другие литературные источники, цитированные в данной спецификации, включены в настоящий документ посредством ссылки в полном объеме, как если было бы указано, что каждая отдельная публикация или патентная заявка специально и индивидуально включена посредством ссылки. Публикации, обсуждаемые в настоящем документе, приведены исключительно с целью их раскрытия до даты подачи настоящей заявки. Ничто в настоящем документе не должно быть истолковано как признание того, что авторы настоящего изобретения не имеют права датировать задним числом такую публикацию на основании предшествующего изобретения. Кроме того, приведенные даты публикации могут отличаться от фактических дат публикации, которые могут потребовать независимого подтверждения.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая спецификация была подана с копией списка последовательностей в машиночитаемой форме (CRF). CRF файл, называемый 13370-020-228_SEQLIST.txt, который был создан 27 октября 2014 г. и имеет размер 50105 байт, идентичен бумажной копии списка последовательностей и включен в настоящий документ посредством ссылки в полном объеме (см. в графической части).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, ПРИМЕНЕНИЯ И СПОСОБЫ ЛЕЧЕНИЯ НАРУШЕНИЙ И ЗАБОЛЕВАНИЙ ОБМЕНА ВЕЩЕСТВ | 2012 |
|
RU2697762C2 |
| СПОСОБЫ МОДУЛЯЦИИ ГОМЕОСТАЗА ЖЕЛЧНЫХ КИСЛОТ И ЛЕЧЕНИЕ РАССТРОЙСТВ И ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С ЖЕЛЧНЫМИ КИСЛОТАМИ | 2013 |
|
RU2675514C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ВАРИАНТЫ ПЕПТИДОВ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2729161C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА | 2011 |
|
RU2593960C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА | 2011 |
|
RU2732703C2 |
| ЛЕЧЕНИЕ НАРУШЕНИЙ СО СТОРОНЫ ПЕЧЕНИ, ЖЕЛЧНЫХ ПУТЕЙ И ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2017 |
|
RU2740913C2 |
| АНТИТЕЛО К BAG2 И СПОСОБЫ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2020 |
|
RU2815586C2 |
| ВЕКТОР АДЕНОАССОЦИИРОВАННОГО ВИРУСА | 2015 |
|
RU2743382C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ДЕРМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2799211C2 |
| Связывающие белки и способы их применения | 2015 |
|
RU2701434C2 |




















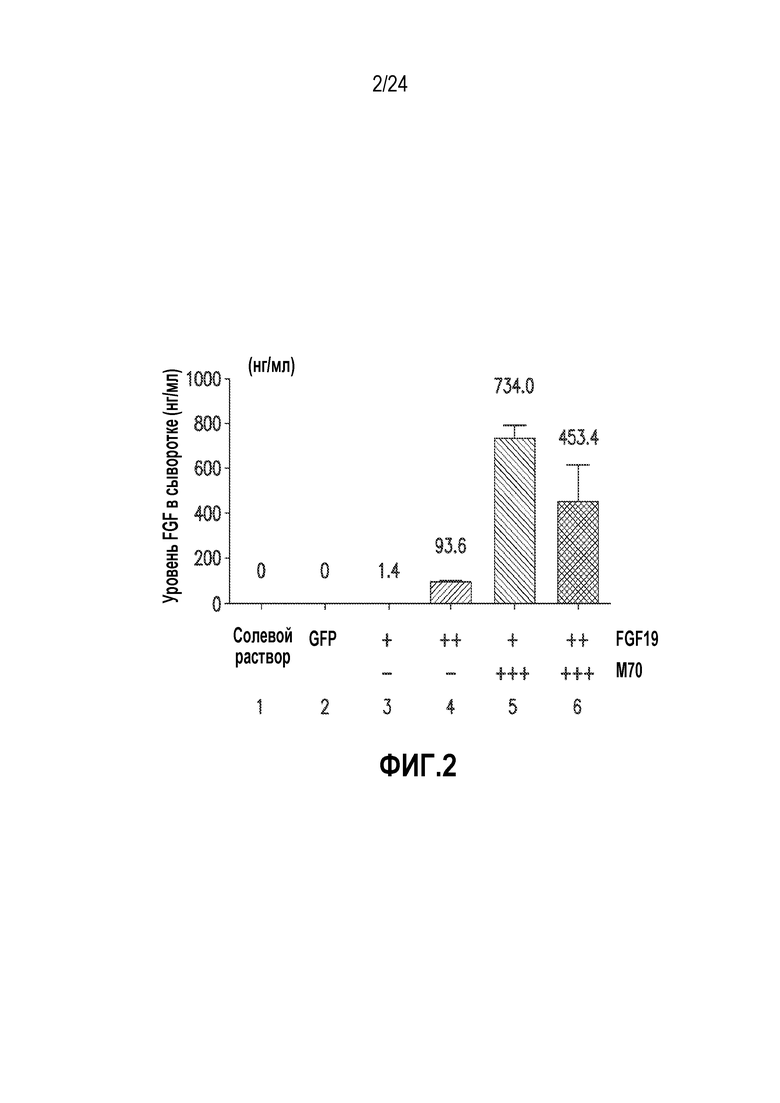
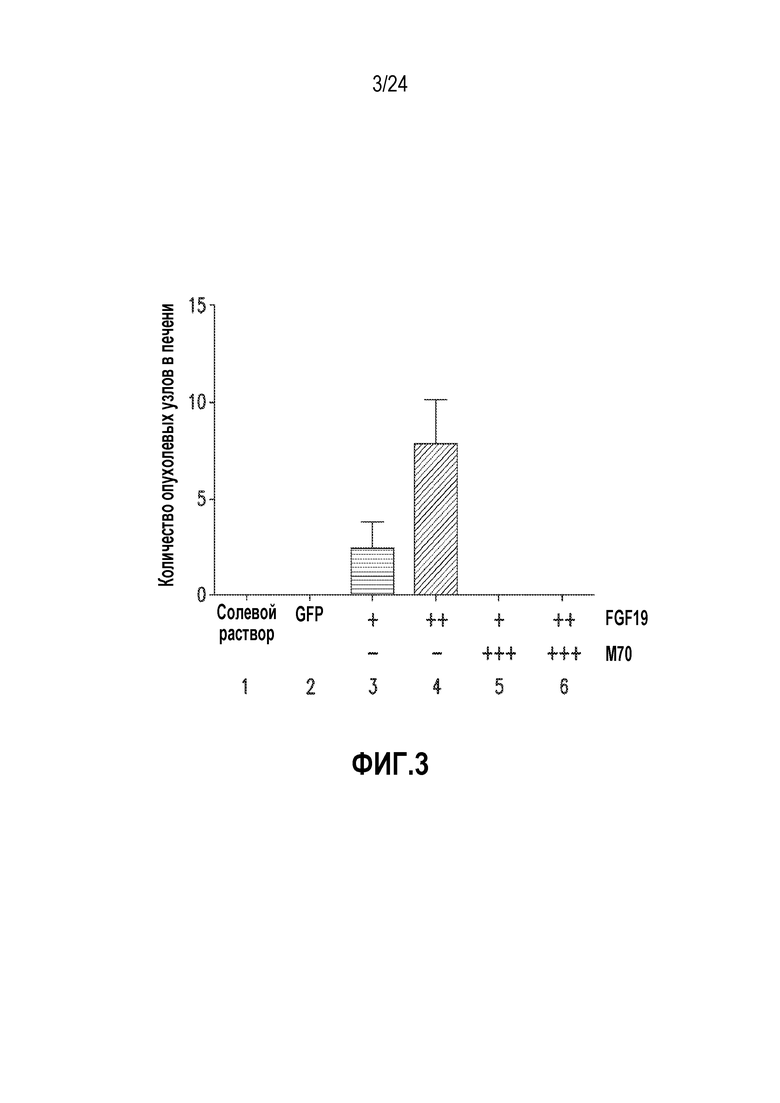
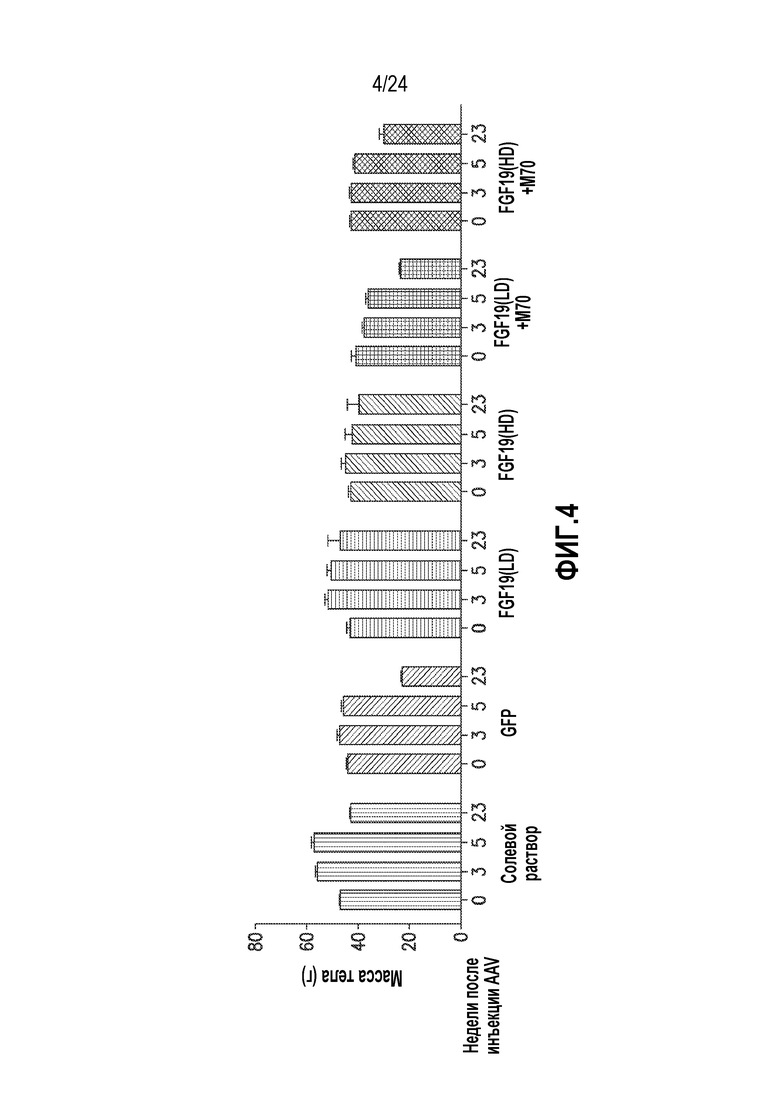
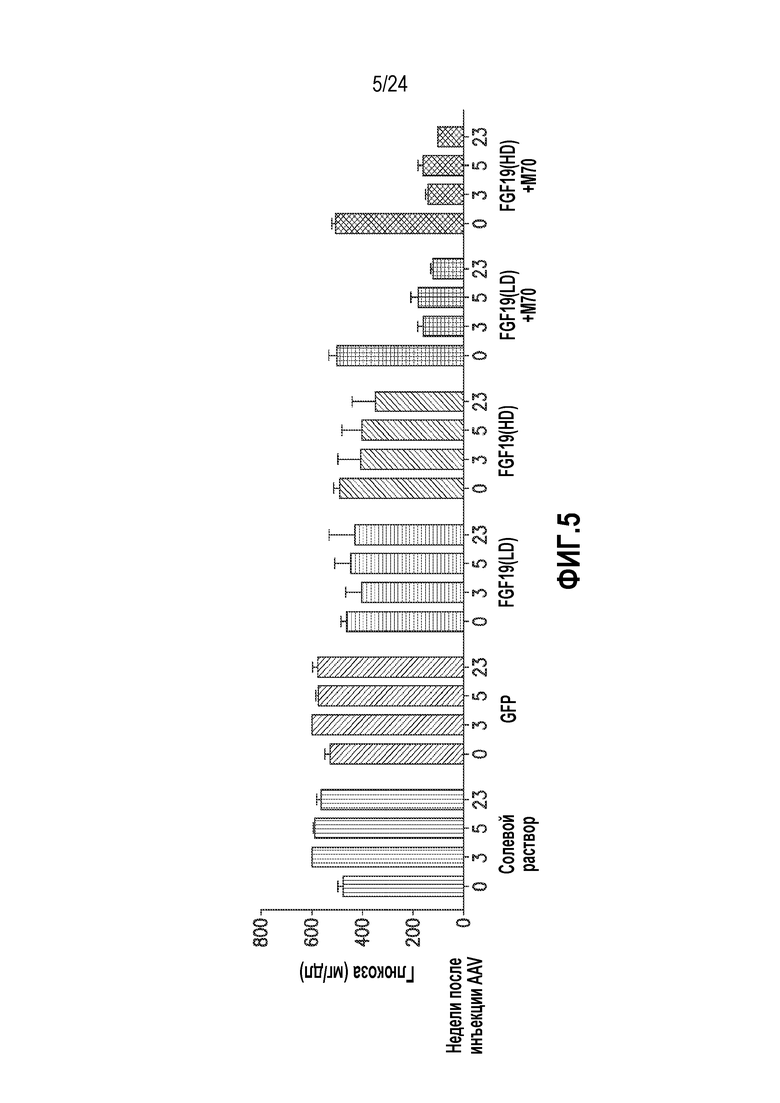
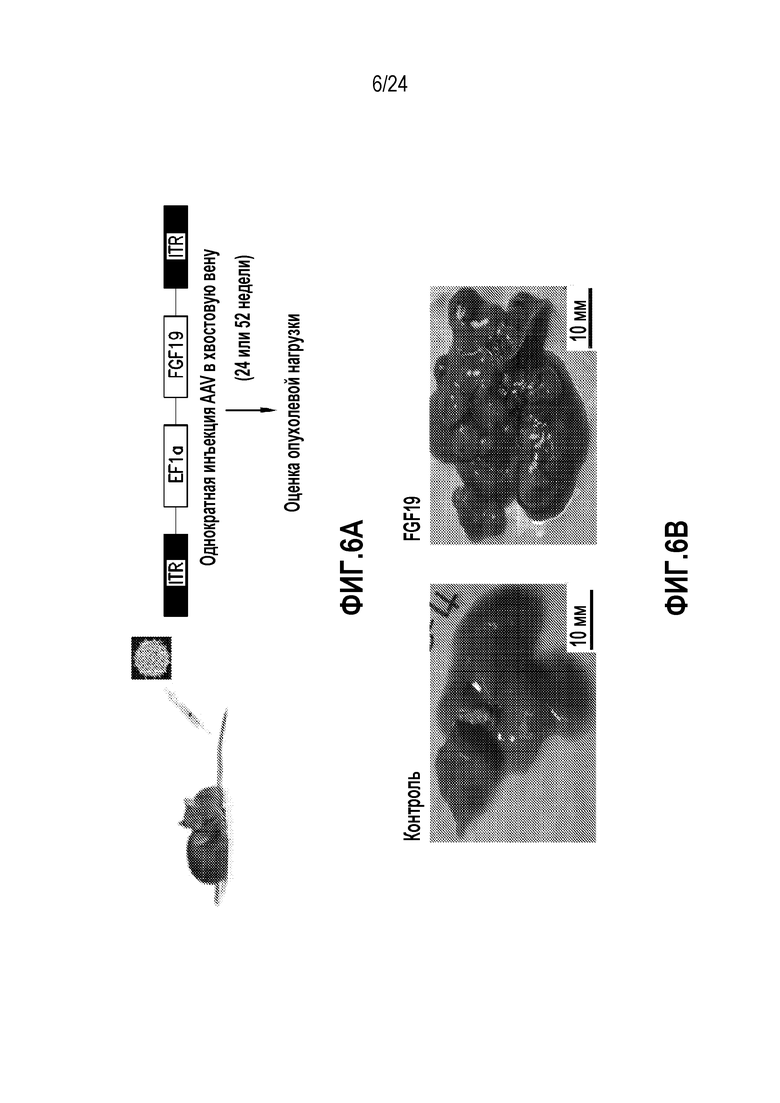
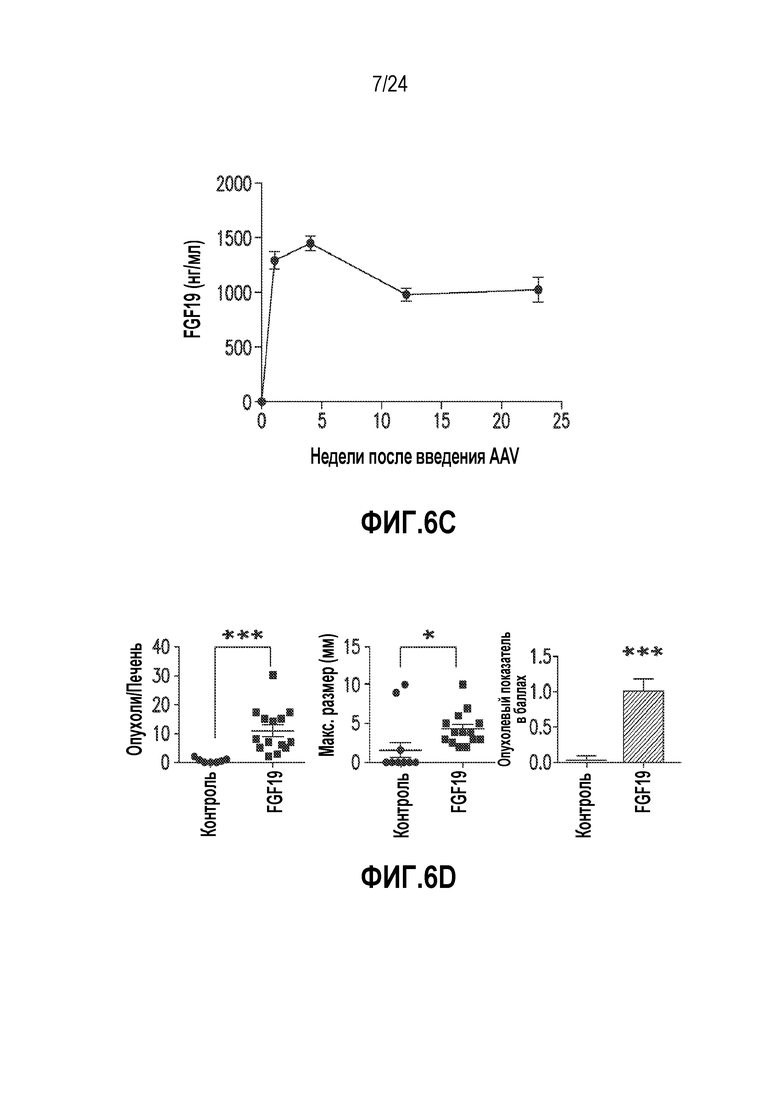
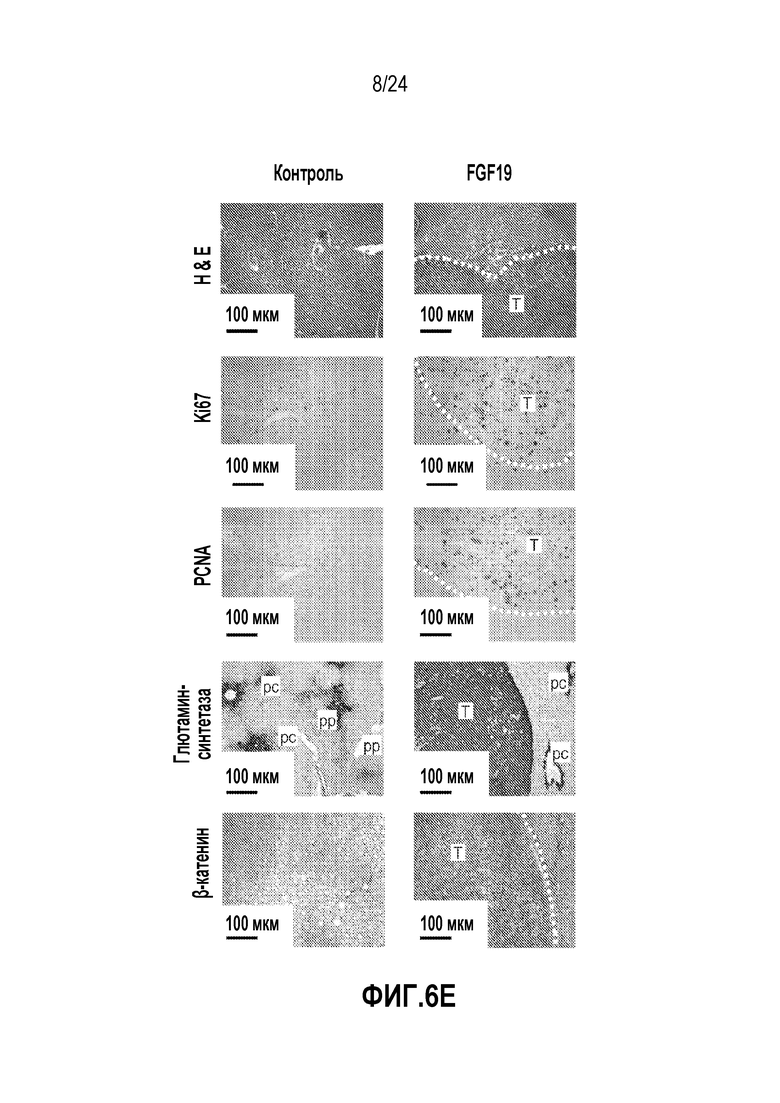
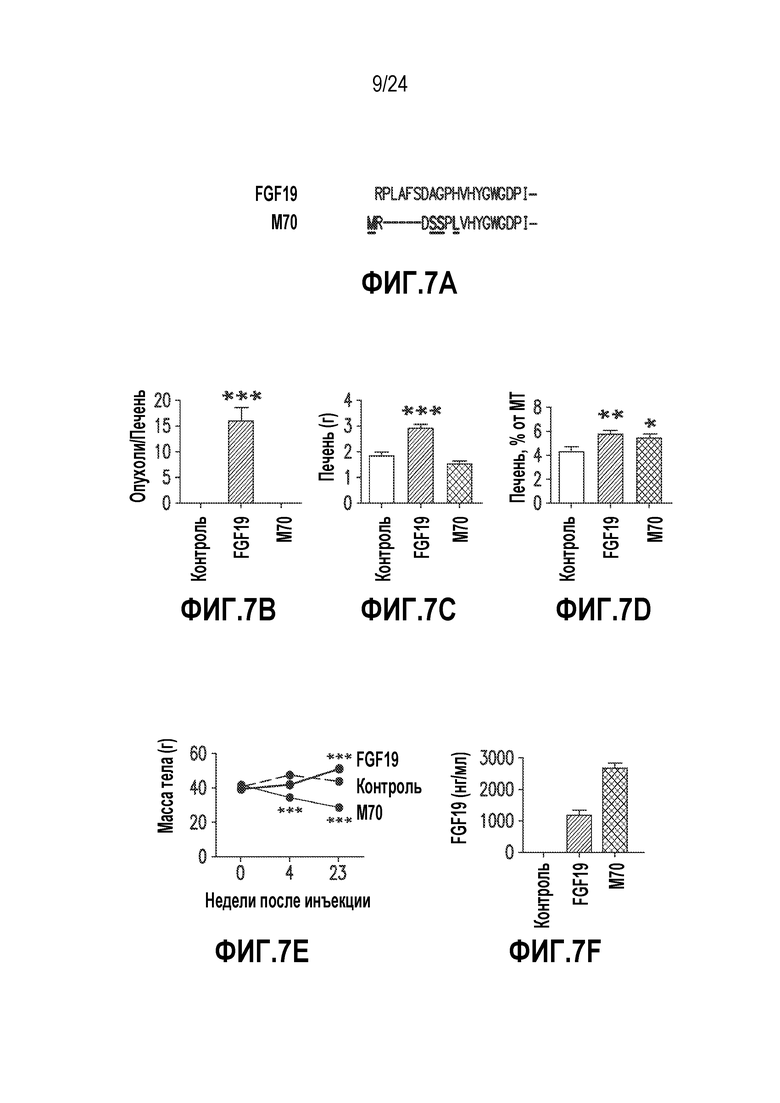
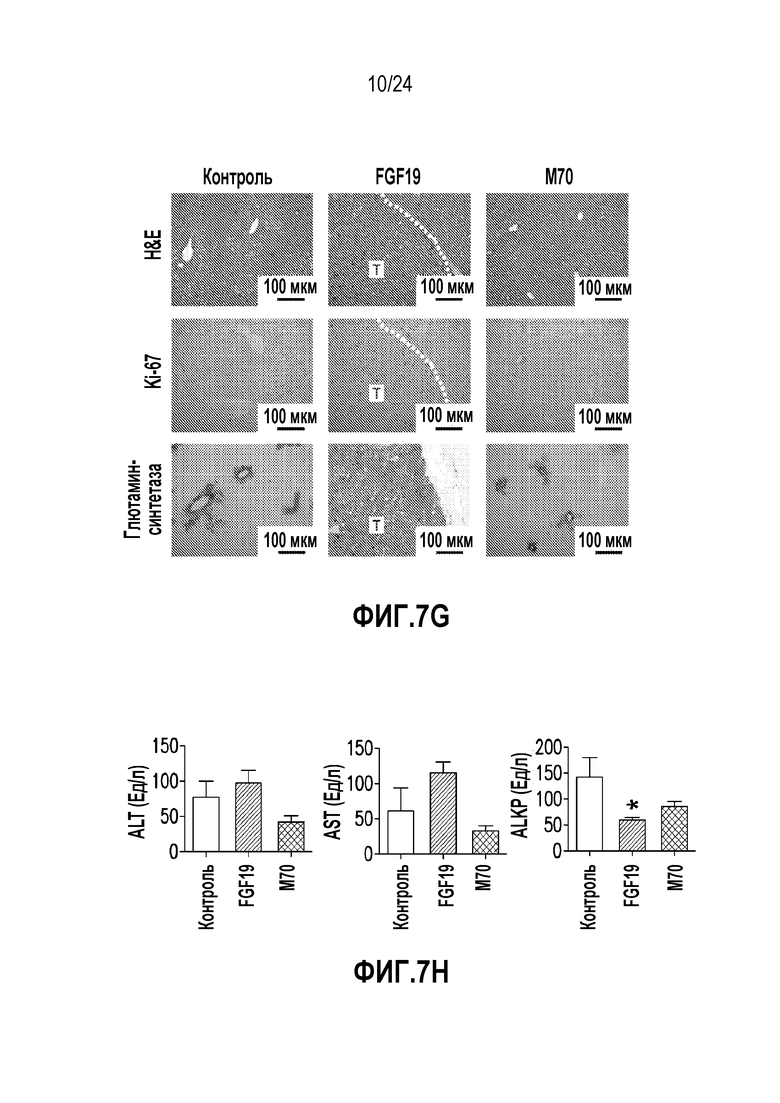
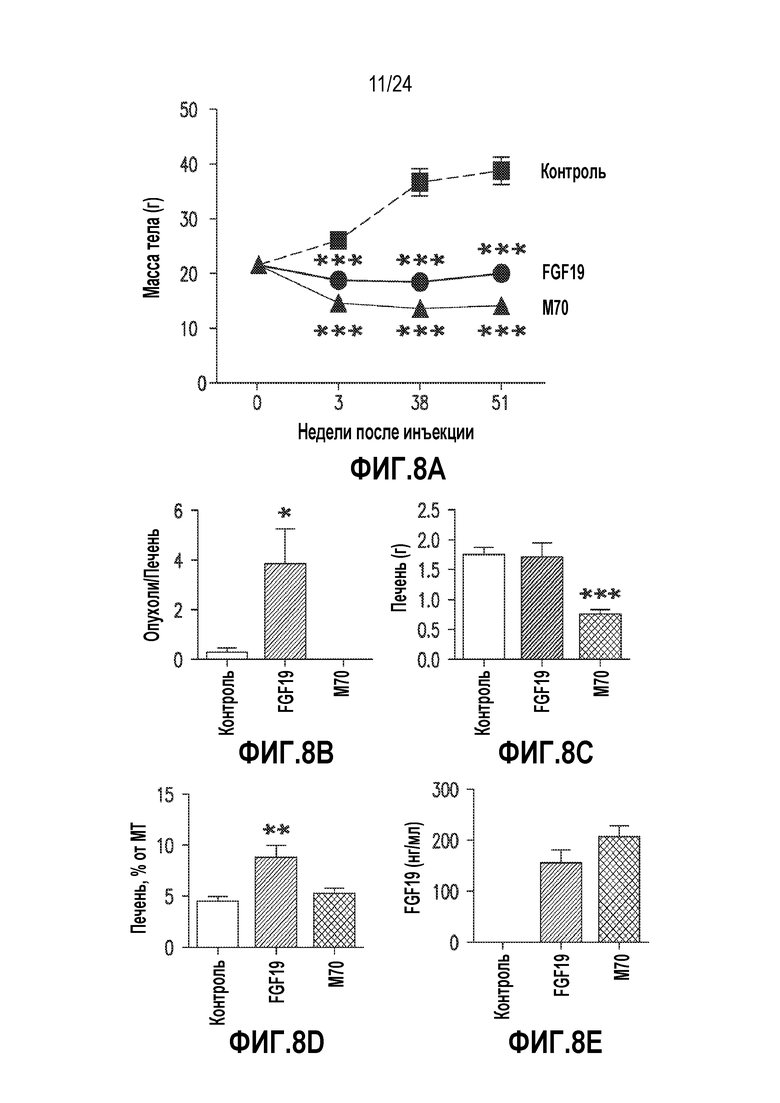
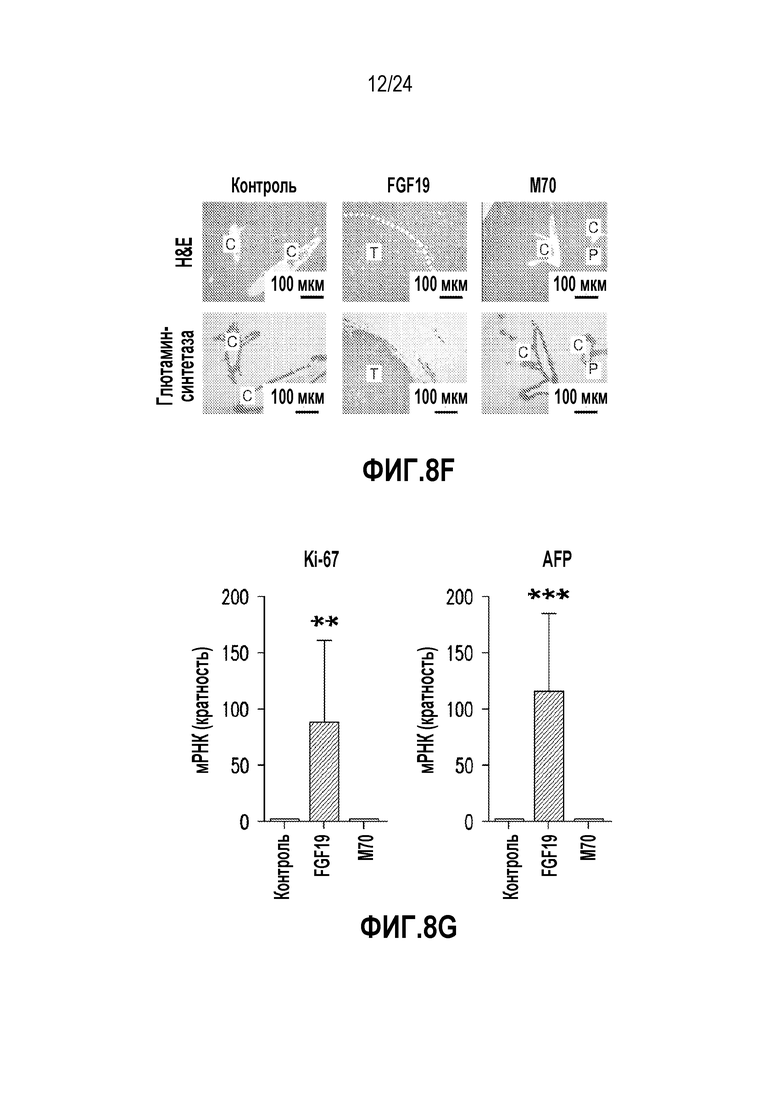
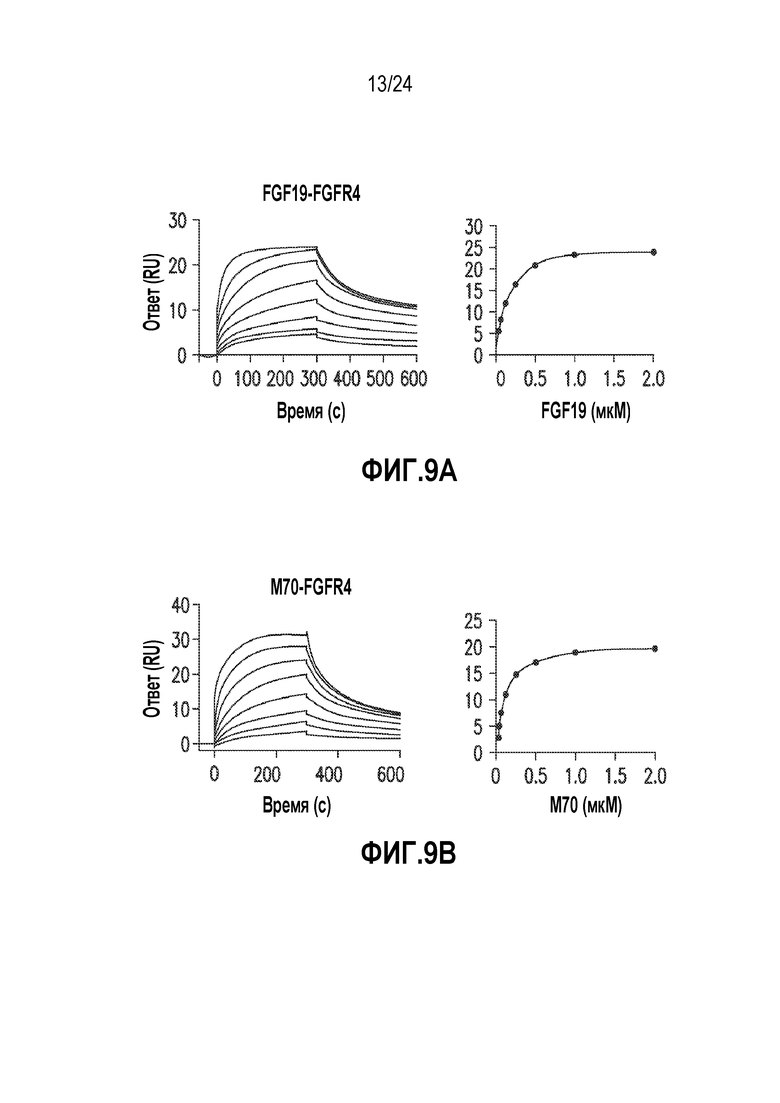
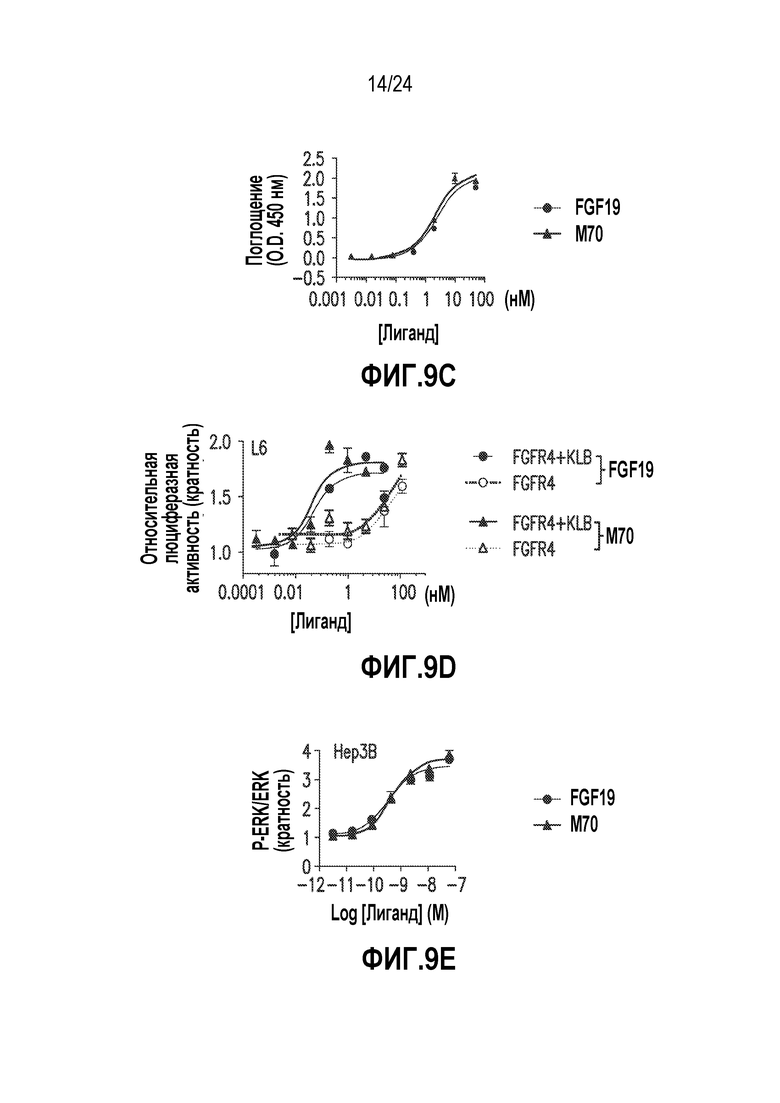
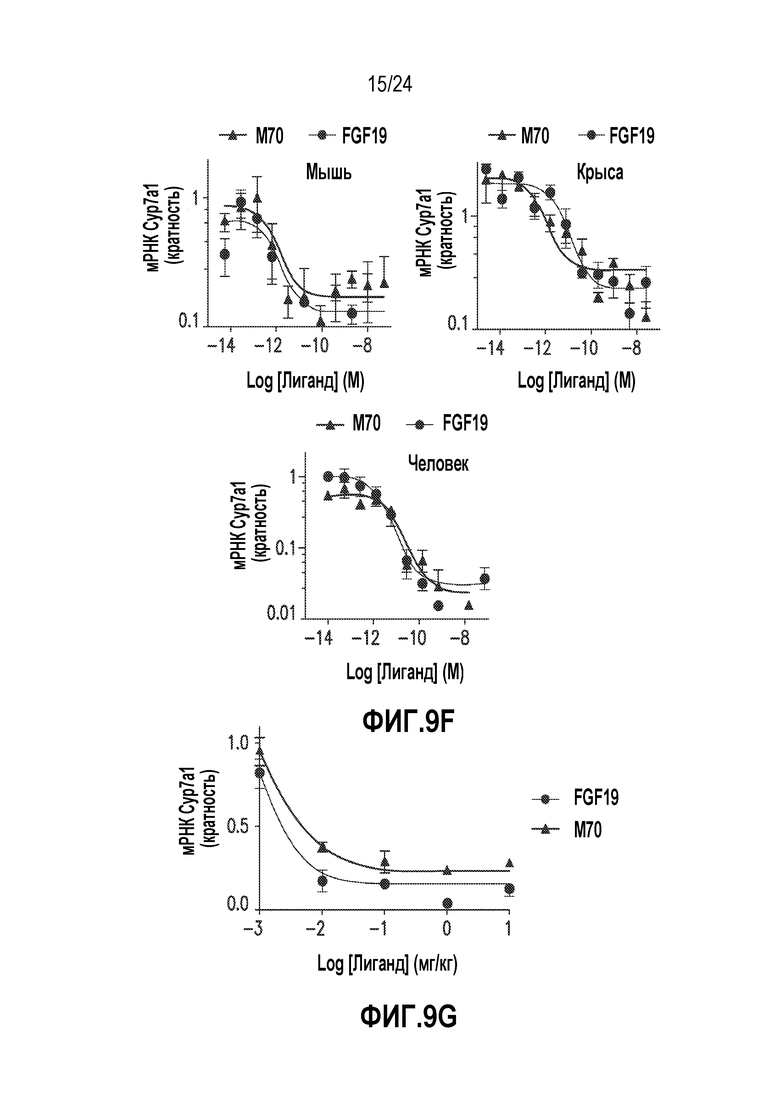
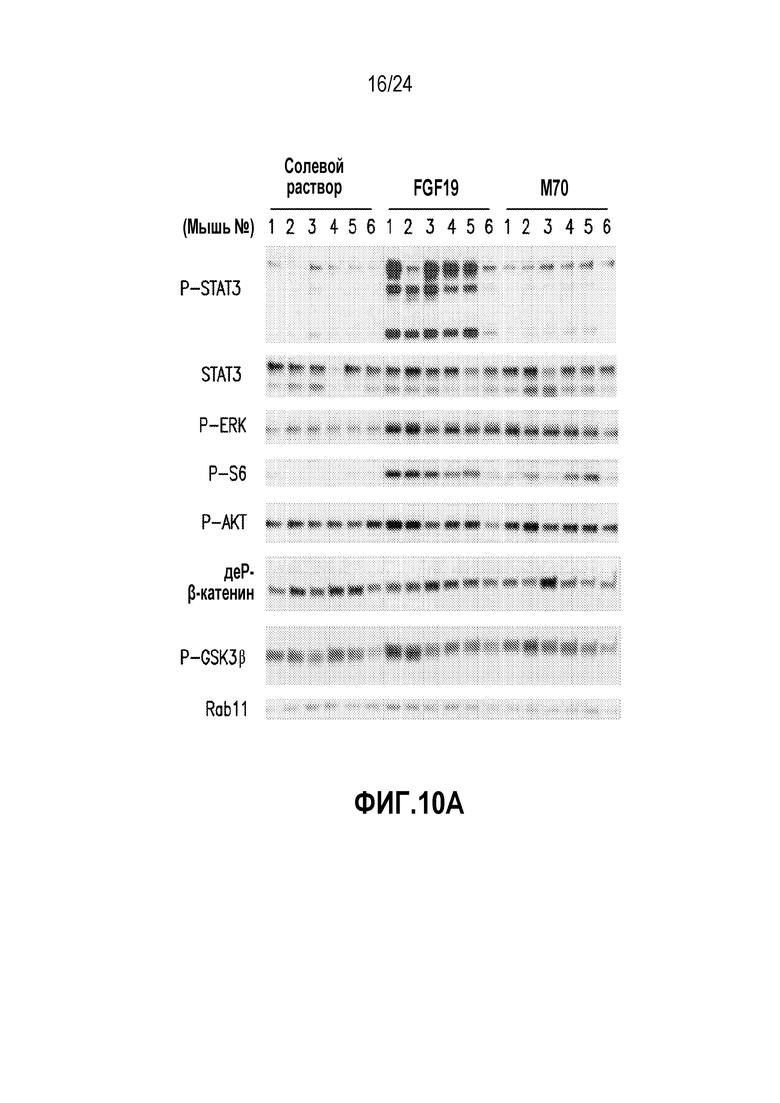
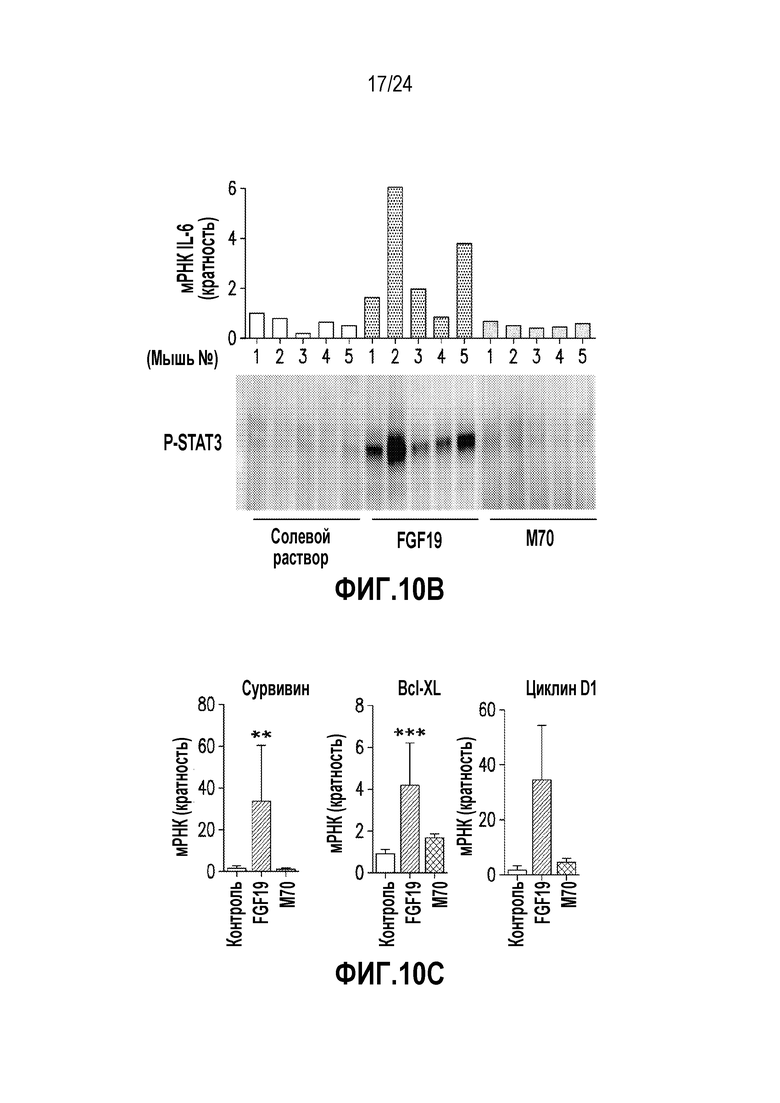
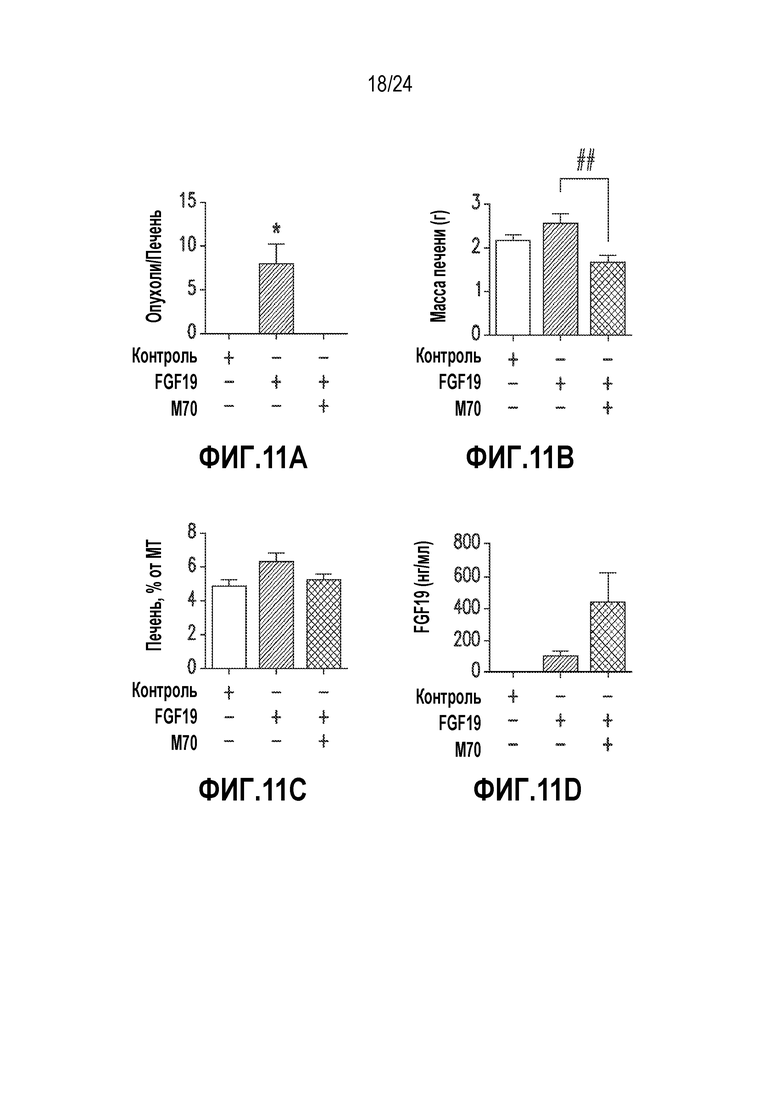
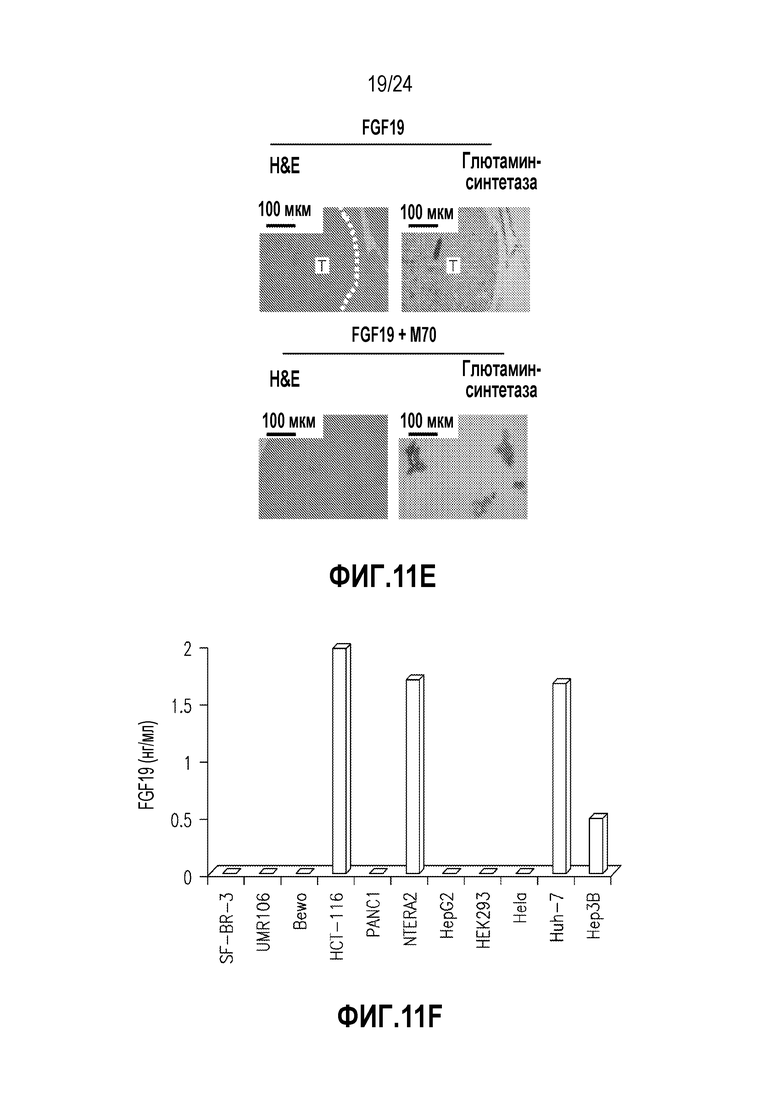
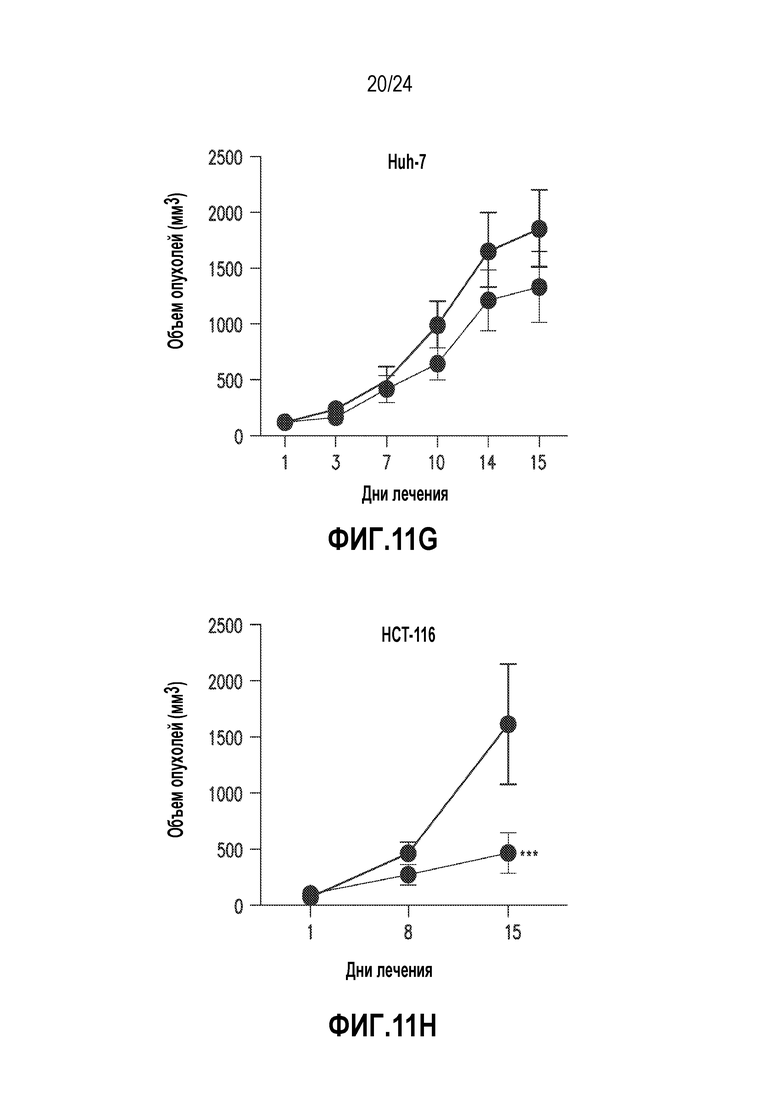
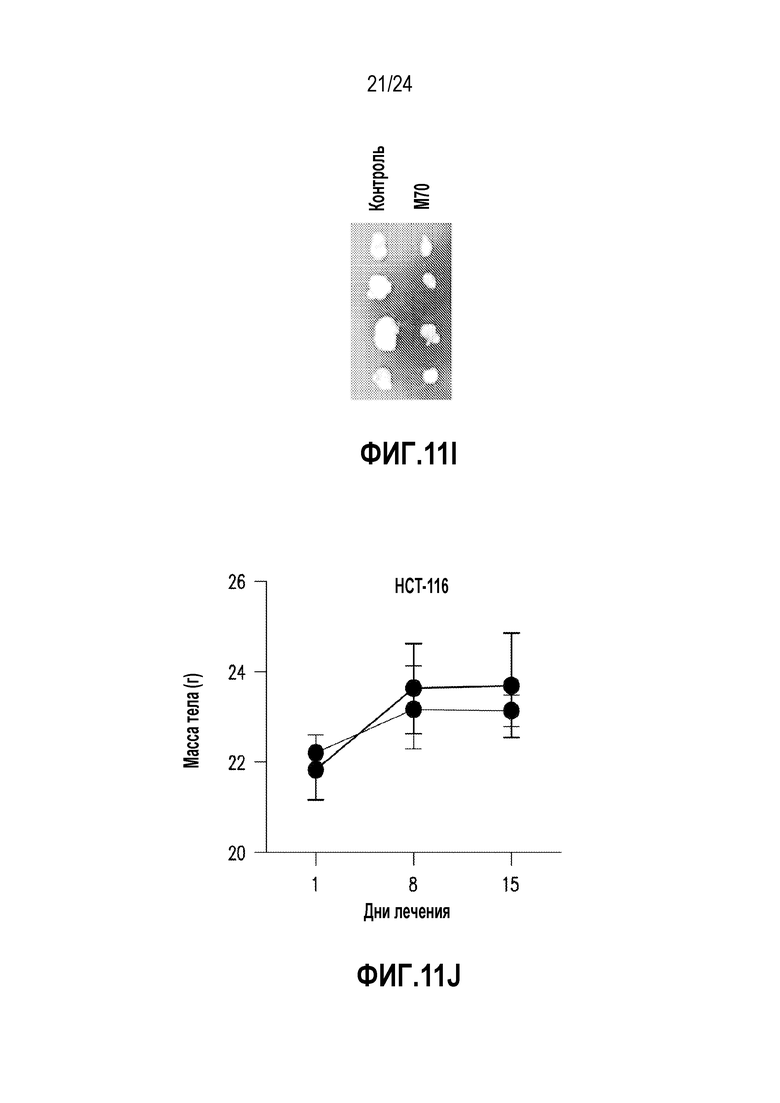
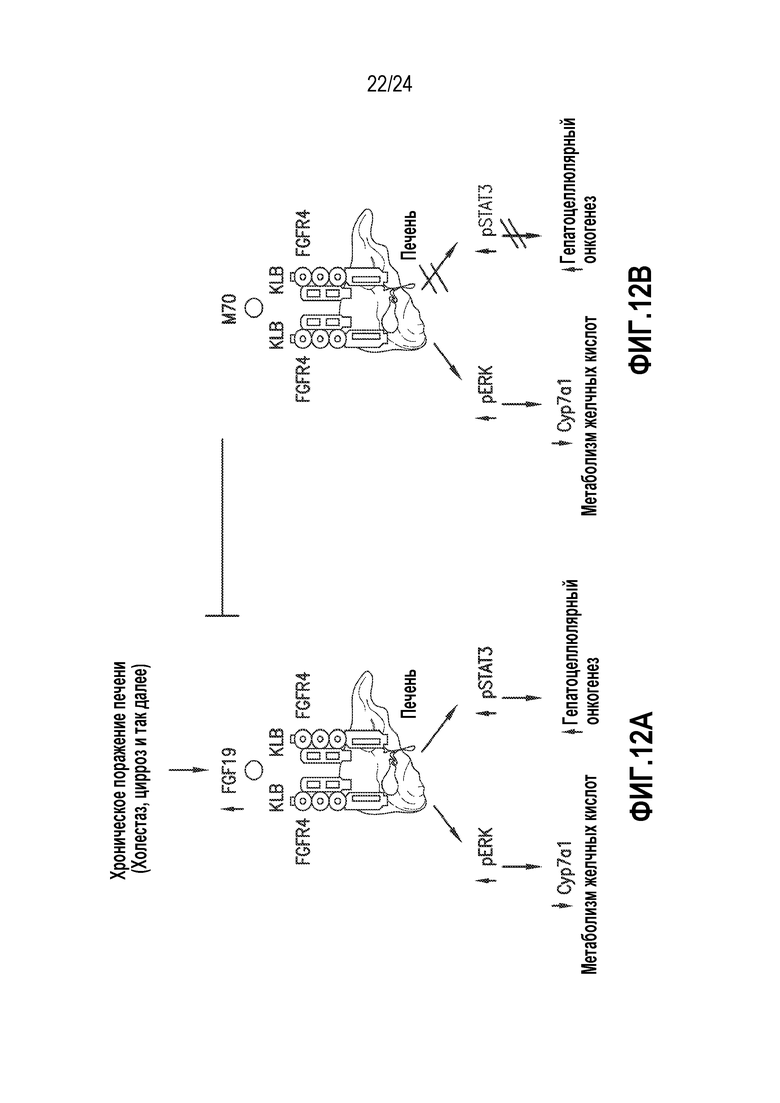
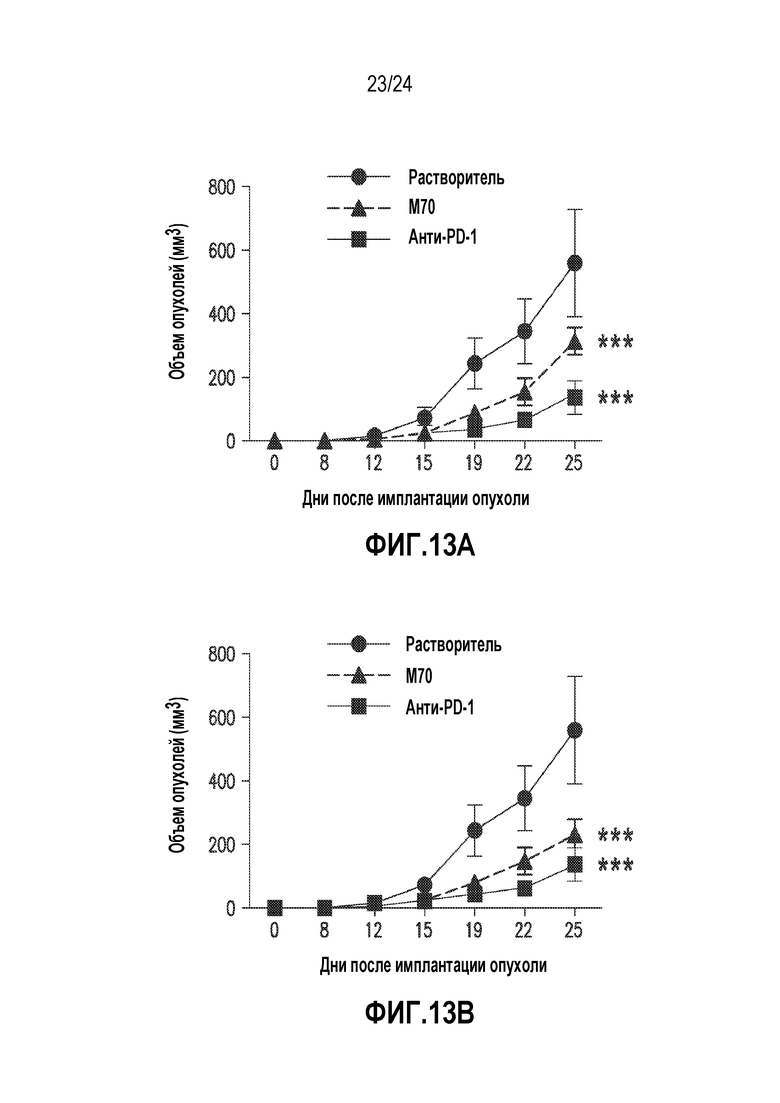
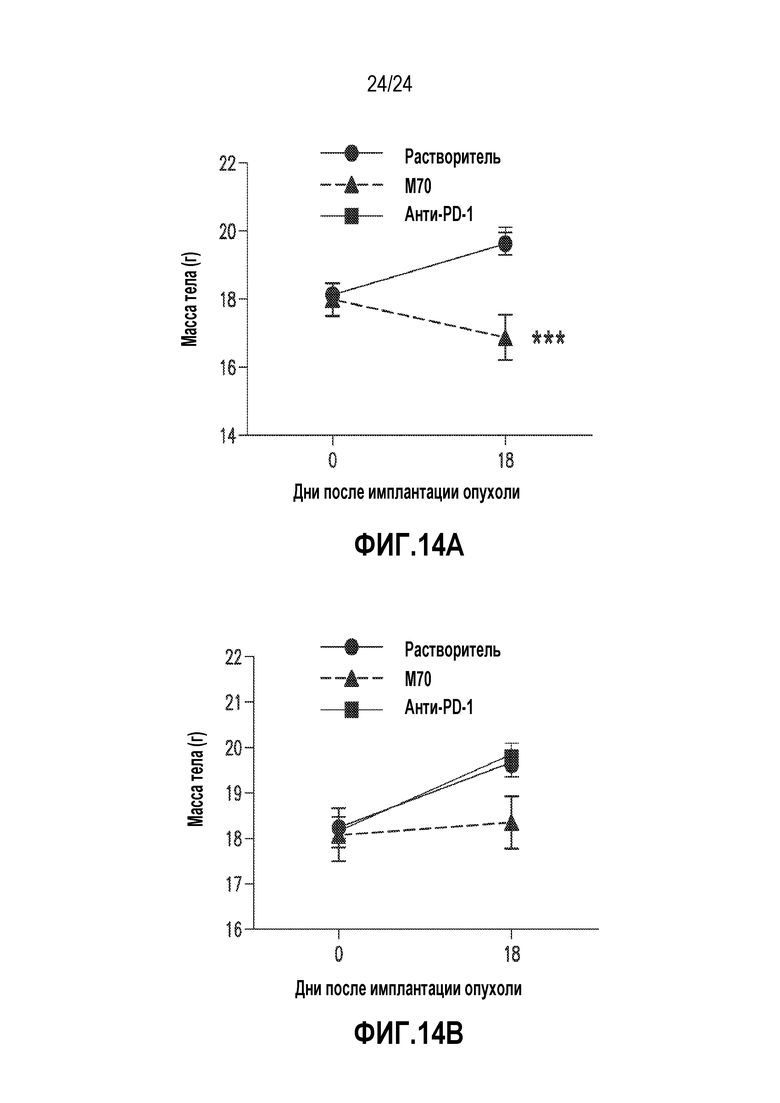
Изобретение относится к биотехнологии, и представляет собой способы противодействия онкогенной активности FGF19 у субъекта и, в конкретных вариантах осуществления, способы предотвращения или лечения заболевания, нарушения или состояния, такого как FGF19-зависимое заболевание, нарушение или состояние, или его симптомов. 3 н. и 18 з.п. ф-лы, 51 ил., 4 табл., 12 пр.
1. Способ противодействия онкогенной активности FGF19 у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19, тем самым противодействуя онкогенной активности FGF19 у субъекта, где вариант FGF19 содержит или состоит из аминокислотной последовательности представленной в любой из SEQ ID NO: 1 и 5-29.
2. Способ по п.1, где вариант FGF19 содержит аминокислотную последовательность, представленную в SEQ ID NO: 1.
3. Способ по п.1, где вариант FGF19 состоит из аминокислотной последовательности, представленной в SEQ ID NO: 1.
4. Способ по п.1, где вариант FGF19 содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 5-29.
5. Способ по п.1, где вариант FGF19 состоит из аминокислотной последовательности, представленной в любой из SEQ ID NO: 5-29.
6. Способ лечения FGF19-зависимого рака, или опухоли, или их симптомов у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19, где наблюдается улучшение в отношении рака, опухоли или ее симптомов у субъекта, где вариант FGF19 содержит или состоит из аминокислотной последовательности, представленной в любой из SEQ ID NO: 1 и 5-29.
7. Способ по п.6, где вариант FGF19 содержит аминокислотную последовательность, представленную в SEQ ID NO: 1.
8. Способ по п.6, где вариант FGF19 состоит из аминокислотной последовательности, представленной в SEQ ID NO: 1.
9. Способ по п.6, где вариант FGF19 содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 5-29.
10. Способ по п.6, где вариант FGF19 состоит из аминокислотной последовательности, представленной в любой из SEQ ID NO: 5-29.
11. Способ предотвращения FGF19-зависимого рака, или опухоли, или их симптомов у субъекта, включающий введение субъекту терапевтически эффективного количества варианта FGF19, где рак, опухоль или их симптом предотвращаются у субъекта, тем самым предотвращая FGF19-зависимый рак или опухоль у субъекта, где вариант FGF19 содержит или состоит из аминокислотной последовательности, представленной в любой из SEQ ID NO: 1 и 5-9.
12. Способ по п.11, где вариант FGF19 содержит аминокислотную последовательность, представленную в SEQ ID NO: 1.
13. Способ по п.11, где вариант FGF19 состоит из аминокислотной последовательности, представленной в SEQ ID NO: 1.
14. Способ по п.11, где вариант FGF19 содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 5-29.
15. Способ по п.11, где вариант FGF19 состоит из аминокислотной последовательности, представленной в любой из SEQ ID NO: 5-29.
16. Способ по любому из пп.1-15, где FGF19-зависимый рак или опухоль представляет собой гепатоцеллюлярную карциному, рак или опухоль толстой кишки, рак или опухоль предстательной железы или рак или опухоль легкого.
17. Способ по п.16, где FGF19-зависимый рак или опухоль представляет собой гепатоцеллюлярную карциному.
18. Способ по п.16, где FGF19-зависимый рак или опухоль представляет собой рак или опухоль толстой кишки.
19. Способ по п.16, где FGF19-зависимый рак или опухоль представляет собой рак или опухоль предстательной железы.
20. Способ по п.16, где FGF19-зависимый рак или опухоль представляет собой рак или опухоль легкого.
21. Способ по любому из пп.1-20, где субъект является субъектом, который нуждается в таком воздействии.
| WO 2013109856 A2 (GENENTECH, INC.), 25.07.2013 | |||
| WO 2012125812 A1 (NOVARTIS AG), 20.09.2012 | |||
| US 20050026832 A1 (SEAN ADAMS), 03.02.2005 | |||
| Ильченко АА., "Желчные кислоты в норме и патологии", Экспериментальная и клиническая гастроэнтерология, номер 4, 2010г., стр | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2019-11-27—Публикация
2014-10-27—Подача