Уровень техники настоящего изобретения
Настоящее изобретение относится к способам лечения или предупреждения нарушений печени, желчных путей и поджелудочной железы путем введения одного или нескольких дефензинов. Также в объем настоящего раскрытия включено лечение определенных метаболических нарушений.
Предшествующий уровень техники настоящего изобретения
Микробиота кишечника
Возрастающая частота случаев распространенных нарушений, таких как ожирение и связанные с ожирением заболевания, тесно ассоциирована с нашим образом жизни и диетой западного типа. Наиболее значительными связанными с ожирением болезнями являются инсулинорезистентность, явный сахарный диабет 2 типа (T2D) и определенные злокачественные опухоли (Faulds & Dahlman-Wright, 2012). Хотя этиология этих заболеваний сложна, многие из них характеризуются общим состоянием в форме неспецифического воспаления, которое может возникать в результате нарушения регуляции в отношении микробиоты кишечника и метаболома (Everard & Cani, 2013; Belkaid & Hand, 2014). Несмотря на то, что проблемы, ассоциированные с современным образом жизни человека и производством животного мяса могут показаться весьма обособленными, предполагается, что ухудшение здоровья кишечника является общим знаменателем. Нарушение регуляции процессов в отношении здоровья кишечника действительно ассоциировано с целым рядом различных заболеваний, таких как ожирение (Ridaura et al, 2013), T2D (Qin et al, 2012), ревматоидный артрит (Zhang et al, 2015) и рак толстой и прямой кишки (Feng et al, 2015). Недавно была описана связь между микробиотой кишечника и, в частности, присутствием определенных липополисахаридов Bacteroides, и более высокой частотой возникновения сахарного диабета 1 типа в Финляндии по сравнению с соседними областями (Leviten 2016).
Ожирение и сопровождающее его неспецифическое воспаление являются сильными определяющими факторами нарушения регуляции метаболического гомеостаза. Turnbaugh et al. (2006) обнаружили, что ассоциированная с ожирением микробиота характеризовалась повышенной способностью к накоплению энергии, и через 2 недели после трансплантации микробиоты от мышей с ожирением у стерильных мышей наблюдали значительно большее увеличение массы жировой ткани, чем при аналогичной трансплантации от худых мышей. Turnbaugh et al. (2008) дополнительно и, что оказалось, важным, обнаружили, что изменения в составе микроорганизмов кишечника были полностью изменены в обратном направлении после перехода на исходную диету у мышей, которых какое-то время кормили с использованием диеты «западного типа» с высоким содержанием жира/сахара. Эти наблюдения были подтверждены у человека Vrieze et al. (2012), которые продемонстрировали, что перенос микробиоты кишечника от худых доноров-людей обеспечивал повышение чувствительности к инсулину у индивидуумов с метаболическим синдромом.
Манипуляции с микробиотой кишечника с целью повышения веса и показателей скорости набора веса в течение многих лет использовались по отношению к сельскохозяйственным животным путем применения низких доз антибиотиков и пробиотиков, таких как Lactobacillus ingluviei. Манипуляции с микробиотой кишечника для обеспечения набора лишнего веса были продемонстрированы у кур (Khan et al, 2007), у уток (Angelakis & Raoult, 2010) и у мышей (Angelakis et al, 2012). У людей также было обнаружено, что дети грудного возраста, получающие антибиотики, были больше, чем в контрольных группах (Trasande et al, 2012), а ранее подвергание воздействию пероральных антибиотиков ассоциировано с избыточным весом у детей (Ajslev et al, 2014). У беременных женщин физиологическое повышение отложения жира и потенциальное развитие гестационного диабета в третьем триместре также, по-видимому, ассоциировано с глубоким изменением микробиоты кишечника (Koren et al, 2012).
Слизистая оболочка кишечника с большим отрывом является самой большой поверхностью организма (примерно 200 м2), подверженной воздействию внешней среды. Таким образом, поверхность кишечника находится в тесном контакте с чужеродным материалом, метаболитами (метаболом), происходящими из нашей диеты, и, по оценкам, 1014 бактериями - кишечной микробиотой, - которые обитают в нашем кишечнике. Таким образом, кишечный барьер находится под постоянным и интенсивным иммунным надзором, для которого требуются функциональные перекрестные взаимодействия между иммунной системой, компонентами диеты и микробиотой кишечника. Виды диетической терапии оказывают существенное влияние на иммунную регуляцию (Mowat & Agace, 2014) и состав микробиоты кишечника (Walter, 2015), причем оба из факторов независимо и синергически воздействуют на метаболический гомеостаз. В этом отношении в двух последних работах подчеркивается (неблагоприятный) потенциал пищевых добавок в отношении модулируемых микробиотой изменений метаболического гомеостаза. В недавно опубликованной статье (Chassaing et al, 2015) проиллюстрировано, как пищевые эмульгаторы ухудшают толерантность к глюкозе, тем самым усиливая набор лишнего веса, а также подверженность развитию колита за счет индукции нарушения регуляции микробиоты кишечника. Результаты наблюдений не удалось воспроизвести у стерильных (GF) мышей, что указывает на ключевую роль микробиоты кишечника. Аналогичным образом, в Suez et al. (2014) недавно было показано, как некалорийные сахарозаменители индуцировали функциональное нарушение метаболизма посредством изменений микробиоты кишечника. Авторы подтвердили свои наблюдения путем переноса фекалий GF-мышам, после чего у GF-мышей стремительно развивалось нарушение толерантности к глюкозе. Эти наблюдения являются воспроизведением новаторского исследования у GF-мышей (Bäckhed et al, 2007), в котором объясняется функциональная роль кишечных микроорганизмов в поддержании метаболического здоровья. В этом исследовании было показано, что в отсутствие симбиотических микроорганизмов, что обуславливает несбалансированный иммунный гомеостаз слизистых оболочек, жировые ткани уменьшаются в размере и их функция подавляется под влиянием диеты с высоким содержанием жиров. Несмотря на отсутствие набора лишнего веса, который в норме будет иметь место как проявление фенотипа, характерного для здорового организма, эктопическое накопление липидов (стеатоз печени и повышенные уровни триглицеридов в сыворотке крови) обуславливало в результате тяжелые метаболические нарушения. У человека было показано, что многообразие генов микробиоты ассоциировано с фенотипом, характерным для здорового организма, тогда как обедненный состав генов (низкое количество генов) коррелирует с повышенным риском развития метаболических нарушений (Le Chatelier et al, 2013).
Wertenbruch et al 2015 продемонстрировали, что уровни противомикробного пептида LL-37/CRAMP (кателицидина), бета-дефензина 2 человека и фактора комплемента C5a повышены в сыворотке крови от пациентов с заболеваниями печени по сравнению со здоровыми контролями. Уровни в сыворотке крови всех трех маркеров находятся в относительно узком диапазоне значений в случае здоровых контролей, однако имеют место отклонения в широком диапазоне значений в уровнях в случае пациентов с заболеваниями печени. Авторы предполагают, что повышенные уровни hBD-2 могут отображать усиленное ремоделирование эпителия желчных путей.
Harada et al в 2004 г. изучили уровни hBD1 и hBD-2 в клетках эпителия внутрипеченочных желчных протоков, в клеточных линиях и в желчи. Экспрессия hBD-2 была обнаружена в желчевыводящих путях в процессе активного воспаления. Было обнаружено, что уровни в желчи коррелируют с уровнями CRP в сыворотке крови. Авторы сделали вывод, что hBD-2 экспрессируется в ответ на локальную инфекцию или активное воспаление, и что hBD1 может представлять собой предсуществующий компонент противомикробной иммунной системы желчных путей.
Дефензины
Дефензины являются одним из основных врожденных защитных механизмов, функции которого заключаются в поддержании здорового микробиома и нейтрализации потенциальных патогенов (Wehkamp et al, 2002 and Salzman et al, 2007). Дефензины представляют собой пептиды, обладающие противомикробной активностью в отношении грамположительных и грамотрицательных бактерий, грибов и архей, а также противовоспалительной активностью, повышая количество противовоспалительных цитокинов и снижая количество воспалительных цитокинов.
Дефензины человека представляют собой небольшие катионные пептиды, которые можно разделить на α- и β-дефензины исходя из топологии их трех внутримолекулярных образуемых остатками цистеина дисульфидных связей. α-дефензины человека могут быть дополнительно подразделены на дефензины, которые впервые были выделены из гранул нейтрофилов (HNP1-4), и дефензины кишечника, которые экспрессируются клетками Панета в криптах тонкого кишечника (HD5 и HD6 или DEFA5 и DEFA6). β-дефензины (DEFBn) вырабатываются главным образом эпителиальными клетками в различных тканях и органах, включая кожу, глаз, среднее ухо, ротовую полость, трахею, легкие, желудочно-кишечном тракт, печень, мочеполовую систему, почки, влагалище, поджелудочную железу и молочные железы. Наиболее охарактеризованными представителями семейства β-дефензинов человека являются hBD1-4. Некоторые из дефензинов человека вырабатываются конститутивно, тогда как другие индуцируются провоспалительными цитокинами или продуктами метаболизма микроорганизмов. Некоторые из дефензинов человека экспрессированы в амниотической жидкости в возрастающих уровнях по мере увеличения гестационного возраста, защищая плод в матке. Грудное молоко и, в частности, молозиво, колострум, содержит как α- и β-дефензины, так и кателицидин, однако только несколько из них обнаруживаются в значимых концентрациях в материнском молоке (Armogida et al, 2004).
Liu et al. (2008) обнаружили, что HNP-1 и HNP-2, оба продуцируемые лейкоцитами и принадлежащие к подгруппе α-дефензинов в крови, были способны к ингибированию гликогенолиза и глюконеогенеза в выделенных гепатоцитах посредством внутриклеточного механизма, явно отличающегося от классического сигнального пути с участием инсулина.
В CN104971343 раскрыто, что мыши, которых кормили с использованием диеты с высоким содержанием жиров и диеты с дефицитом витамина D, страдали от метаболического синдрома. Уровень экспрессии дефензинов после длительного периода пребывания на такой диете с дефицитом витамина D снижается, и, таким образом, приводит к дефициту дефензинов. Введение дефензина HD5 четыре раза на протяжении 25 дней частично обеспечивает снижение уровней глюкозы в плазме крови, однако данные по инсулинорезистентности или гомеостатической модели оценки отсутствуют. В CN104971343 не раскрыто, что с помощью введения дефензина HD5 мышам на диете с высоким содержанием жиров с нормальными уровнями витамина D можно лечить нарушения со стороны печени, поджелудочной железы или желчных путей.
Хотя в уровне техники раскрыта корреляция кателицидина, системы комплемента и бета-дефензинов с усилением воспаления желчных путей или инфекции, идеи или предположения касательно того, что дефензины можно применять для лечения нарушений со стороны печени, поджелудочной железы или желчных путей, отсутствуют.
Краткое раскрытие настоящего изобретения
В настоящем раскрытии продемонстрировано, что α- и β-дефензины кишечника млекопитающего, вводимые перорально, обладают способностью к предупреждению или лечению набора лишнего веса, включая центральный (абдоминальный или висцеральный) набор лишнего веса и накопление липидов. Данные указывают на то, что введение α- и/или β-дефензинов млекопитающих обеспечивает лечение заболеваний или нарушений печени, включая злокачественную опухоль печени и печеночную энцефалопатию, желчных путей и поджелудочной железы, а также определенных метаболических нарушений.
Введение альфа или бета-дефензина мышам, которых кормили с использованием диеты с высоким содержанием жиров, оказывало влияние на печеночный и висцеральный жир, экспрессию маркера стеатоза и маркера метаболизма липидов печени, демонстрируя, что они обеспечивают снижение количества печеночного жира и степени стеатоза. Потребление пищи, эффективность питания, поглощение и экскреция жира не подвергались влиянию, демонстрируя, что введение дефензина не изменяет аппетит.
В соответствии с примером 1, дозировка бета-дефензина 2 человека (hBD-2) была достаточной для снижения набора лишнего веса у мышей на диете с высоким содержанием жиров. Потребление hBD-2 главным образом обеспечивало снижение набора массы жировой ткани. Авторы настоящего изобретения изначально предположили, что в первую очередь снижался набор массы абдоминального, т. е. печеночного и висцерального жира; в примере 2 показано, что масса висцерального жира действительно значительно снижалась после потребления hBD-2 в составе диеты с высоким содержанием жиров, при этом наблюдали тенденцию к снижению массы печени. Как толерантность к глюкозе, так и стимулированная глюкозой инсулиновая реакция в ходе глюкозной нагрузки повышались после введения hBD-2. Уровень экспрессии маркера, который, как известно, коррелирует с накоплением жира, был значительно снижен. Важно отметить, что на потребление пищи тип диеты не оказывал значительного влияния. Введение альфа-дефензина HD5 мышам, которых кормили с использованием диеты с высоким содержанием жиров, приводило в результате к усилению метаболизма жирных кислот.
Как показано в примере 4, введение hBD-2 мышам с ожирением имело тенденцию к снижению набора лишнего веса после введения по сравнению с мышами с ожирением, которые не получали hBD-2, для аналогичного потребления пищи. Введение hBD-2 обеспечивало снижение процентной доли жира от общего веса тела и стремительное повышение толерантности к глюкозе и толерантности к инсулину. Подобные результаты наблюдали после введения HD5.
Введение аналога глюкагоноподобного пептида-1 (GLP-1) оказывало эффект в виде снижения веса у мышей, которых кормили с использованием диеты с высоким содержанием жиров, и обеспечивало в результате снижение накопления жира в печени и более низкие уровни холестерина в плазме крови.
Подводя итог, из представленных в настоящем документе данных видно, что альфа-дефензины, бета-дефензины, GLP-1 и аналоги GLP-1 можно применять для лечения заболеваний или нарушений со стороны печени, желчных путей или поджелудочной железы.
Согласно одному аспекту настоящее раскрытие относится к способу лечения или предупреждения заболевания или нарушения печени, желчных путей, поджелудочной железы или метаболического заболевания или нарушения, причем указанный способ предусматривает введение эффективного количества α-дефензина и/или β-дефензина млекопитающих, и/или кателицидина, и/или аналога GLP-1 нуждающемуся в этом субъекту.
Согласно другому аспекту настоящее раскрытие относится к способу лечения злокачественной опухоли печени, холангиокарциномы или злокачественной опухоли поджелудочной железы, причем указанный способ предусматривает введение эффективного количества α-дефензина и/или β-дефензина млекопитающих, и/или кателицидина, и/или аналога GLP-1 по отдельности или в комбинации с радио-, химио- или иммунотерапией нуждающемуся в этом субъекту.
Согласно еще одному аспекту настоящее раскрытие относится к α-дефензину и/или β-дефензину млекопитающих, и/или кателицидину, и/или аналогу GLP-1 для применения в описанных в настоящем документе способах.
Согласно еще одному аспекту настоящее раскрытие относится к применению α-дефензина и/или β-дефензина млекопитающих, и/или кателицидина, и/или аналога GLP-1 для получения лекарственного препарата для лечения в соответствии с любым из предыдущих пунктов.
Описание чертежей
Фиг. 1. Схематическое представление постановки эксперимента для изучения эффектов альфа- и/или бета-дефензинов млекопитающих в отношении метаболизма у мышей. В неделю -1 мышей распределяли в группы и клетки так, чтоб было 3 мыши на клетку и 4 клетки на группу. В промежутке между неделей -1 и 0 мышей подвергали клиническому обследованию с помощью магнитно-резонансной томографии с целью оценки распределения жировой ткани. В неделю 0, 1 и 4 анализировали микробиом фекалий. В неделю 4 помимо проведения анализа микробиоты мышей подвергали сканированию и измеряли уровни глюкозы и инсулина в крови. В неделю 6 оценивали потребление энергии путем анализа содержания азота и липидов в фекалиях. В неделю 7 проводили инсулинотолерантный тест (ITT). В неделю 8 проводили пероральный глюкозотолерантный тест (OGTT) и тест на стимулированную глюкозой секрецию инсулина (GSIS). В неделю 9 (завершение) проводили несколько анализов, в частности, мышей взвешивали и подвергали сканированию, и оценивали состав плазмы крови и состав микробиоты толстой кишки, слепой кишки и тонкого кишечника. Кроме того, осуществляли анализ белков/РНК в отношении мышечной ткани (четырехглавая мышца), iWAT, eWAT, iBAT, печени, толстой кишки, тощей кишки, подвздошной кишки и двенадцатиперстной кишки. Осуществляли гистологический анализ в отношении мышечной ткани (четырехглавая мышца), iWAT, eWAT, iBAT, печени, толстой кишки, тощей кишки, подвздошной кишки и двенадцатиперстной кишки.
Фиг. 2. Схематическое представление постановки эксперимента для изучения эффектов альфа- и/или бета-дефензинов млекопитающих в отношении метаболизма у мышей. В неделю -1 были получены мыши C57/BL/6J. В неделю 0 собирали образцы фекалий. В ходе подготовительного периода между неделей 0 и неделей 12 мышей кормили с использованием диеты с высоким содержанием жиров. В неделю 12 мышей подвергали клиническому обследованию с помощью магнитно-резонансной томографии с целью оценки распределения жировой ткани, собирали образцы фекалий и проводили пероральный глюкозотолерантный тест (OGTT) и тест на стимулированную глюкозой секрецию инсулина (GSIS). В неделю 13-0 мышей распределяли в группы и клетки с 4 мышами на клетку и 3 клетками на группу. В неделю 0, 12 и 13-10 анализировали микробиом фекалий. В неделю 13-2, 13-4, 13-6, 13-8 и 13-10 мышей подвергали сканированию и измеряли уровни глюкозы и инсулина в крови. В неделю 13-9 проводили инсулинотолерантный тест (ITT). В неделю 13-10 (завершение) проводили несколько анализов, в частности, мышей взвешивали и подвергали сканированию, и оценивали состав плазмы крови и состав микробиоты толстой кишки, слепой кишки и тонкого кишечника. Кроме того, измеряли вес iWAT, eWAT и печени.
Фиг. 3. Множественное выравнивание последовательностей бета-дефензинов 1-4 человека с помощью Clustal W (2.1).
Фиг. 4. Множественное выравнивание последовательностей альфа-дефензинов 5 и 6 человека с помощью Clustal W (2.1).
Фиг. 5: Множественное выравнивание последовательностей пептидов нейтрофилов 1-3 человека с помощью Clustal W (2.1).
Фиг. 6. Множественное выравнивание последовательностей бета-дефензина 2 человека, макака-резуса, шимпанзе, орангутана, козы, овцы, представителя бычьих, лошади, свиньи и мыши с помощью Clustal W (2.1).
В выравниваниях с помощью Clustal W:
* обозначает положения, в которых находится один полностью консервативный остаток.
: обозначает, что одна из следующих «сильных» групп является полностью консервативной:
-S, T, A; N, E, Q, K; N, H, Q, K; N, D, E, Q; Q, H, R, K; M, I, L, V; M, I, L, F; H, Y; F, Y, W.
. обозначает, что одна из следующих «более слабых» групп является полностью консервативной:
-C, S, A; A, T, V; S, A, G; S, T, N, K; S, T, P, A; S, G, N, D; S, N, D, E, Q, K; N, D, E, Q, H, K; N, E, Q, H, R, K; V, L, I, M; H, F, Y.
Фиг. 7. Изменение веса (a), и динамика набора веса (b), и суммарное потребление пищи (c) на протяжении 7 недель лечения мышей с использованием диеты с низким содержанием жиров (LFD), диеты с высоким содержанием жиров (HFD) или HFD и дефензином hBD-2 (HFD + P2).
Фиг. 8. Динамика набора массы безжировой/жировой ткани на протяжении 7 недель лечения мышей с использованием диеты с низким содержанием жиров (LFD), диеты с высоким содержанием жиров (HFD) или HFD и дефензином hBD-2 (HFD + P2). (a) динамика набора массы безжировой ткани в неделю 1 и в неделю 7. (b) динамика набора массы жировой ткани в неделю 1 и в неделю 7.
Фиг. 9. Гомеостаз глюкозы у мышей, которых лечили в течение 7 недель с использованием диеты с низким содержанием жиров (LFD), диеты с высоким содержанием жиров (HFD) или HFD и дефензином hBD-2 (HFD + P2). (a) инсулинотолерантный тест (ITT). (b) пероральный глюкозотолерантный тест. (c) тест на стимулированную глюкозой секрецию инсулина (GSIS). (d) определение уровня инсулина спустя 5 часов голодания.
Фиг. 10. Динамика набора веса (A), эффективность питания (B) и потребление энергии (C) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином hBD-2 (высокое содержание жиров + hBD-2).
Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = C. (A). Динамика набора веса. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) Эффективность питания (грамм набранного веса с поправкой на среднее потребление пищи в клетке). Однофакторный дисперсионный анализ с поправкой Тьюки; NB! n = 4 вследствие совместного содержания мышей в клетках. (C) Потребление энергии. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
Фиг. 11. Содержание жира в виде процентной доли от общего веса тела (A), вес печени в граммах (B) и вес эпидидимального жира (eWAT) в граммах (C) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином hBD-2 (hBD-2). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = C. (A) Процентная доля жира от общего веса тела в разные недели. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) вес эпидидимальной жировой ткани (висцеральная AT) по завершении диеты. Однофакторный дисперсионный анализ с поправкой Тьюки. (C) вес по завершении диеты. Однофакторный дисперсионный анализ с поправкой Тьюки.
Фиг. 12. Гомеостаз глюкозы у мышей, которых лечили в течение 10 недель с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином hBD-2 (высокое содержание жиров + hBD-2). (A) Пероральный глюкозотолерантный тест. (B) тест на стимулированную глюкозой секрецию инсулина (GSIS). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = C. (A) Пероральный глюкозотолерантный тест в неделю 7. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) тест на стимулированную глюкозой секрецию инсулина в неделю 7, проведенный в ходе oGTT. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
Фиг. 13. Гомеостаз глюкозы у мышей, которых лечили в течение 10 недель с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином hBD-2 (высокое содержание жиров + hBD-2). (A) Инсулинотолерантный тест (ITT). (B) HOMA-IR.
Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = C. (A) Инсулинотолерантный тест в неделю 8. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) Гомеостатическая модель оценки (HOMA) в неделю 9. Однофакторный дисперсионный анализ с поправкой Тьюки.
Фиг. 14. Экспрессия активируемого пролифератором пероксисом гамма-рецептора (PPARγ2) (a) и экспрессия пероксисомальной ацил-кофермент A-оксидазы 1 (Acox1) (b) в печени мышей, которых лечили в течение 10 недель с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином hBD-2 (высокое содержание жиров + hBD-2).
Фиг. 15. Динамика набора веса (A) и изменение веса (B) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином hBD-2 (высокое содержание жиров + hBD-2). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = C. (A) Динамика набора веса. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
(B) Изменение веса начиная с недели 13 в конце подготовительного периода и в течение следующих 10 недель на экспериментальных видах диеты. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
Фиг. 16. Содержание жира в виде процентной доли от общего веса тела (A) и изменение % содержания жира начиная с недели 0-4 в граммах (B) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином hBD-2 (hBD-2).
Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = C. (A) Процентная доля жира от общего веса тела в разные недели. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) Изменение процентной доли жира начиная с конца подготовительного периода и в течение 4 недель на экспериментальных видах диеты. Однофакторный дисперсионный анализ с поправкой Тьюки.
Фиг. 17. Вес печени в граммах (A) и вес эпидидимального жира (eWAT) в граммах (B) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином hBD-2 (hBD-2). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = C. (A) Вес печени по завершении диеты. Однофакторный дисперсионный анализ с поправкой Тьюки. (B) вес эпидидимальной жировой ткани (висцеральный жир) по завершении диеты. Однофакторный дисперсионный анализ с поправкой Тьюки.
Фиг. 18. Гомеостаз глюкозы у мышей, которых лечили в течение 10 недель с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином hBD-2 (высокое содержание жиров + hBD-2). (A) Результаты перорального глюкозотолерантного теста для клетки 1 (B). Результаты перорального глюкозотолерантного теста для мыши D1. (C) Инсулинотолерантный тест (ITT). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + hBD-2 = C.
(A) Результаты перорального глюкозотолерантного теста, проводимого повторно раз в две недели начиная с конца подготовительного периода (неделя 13-0), представленные для первой клетки группы, получающей диету с высоким содержанием жиров + hBD-2.(B) Результаты перорального глюкозотолерантного теста, проводимого повторно раз в две недели начиная с конца подготовительного периода (неделя 13-0), представленные ТОЛЬКО для мыши D1 группы, получающей диету с высоким содержанием жиров + hBD-2. (C) Инсулинотолерантный тест в неделю 9. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
Фиг. 19. Экспрессия активируемого пролифератором пероксисом гамма-рецептора (PPARγ2) (A) и экспрессия пероксисомальной ацил-кофермент A-оксидазы 1 (Acox1) (B) в печени мышей, которых лечили на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином hBD-2 (hBD-2).
Фиг. 20. Динамика набора веса (A), эффективность питания (B) и потребление энергии (C) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином HD5 (высокое содержание жиров + HD5). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = C.
(A) Динамика набора веса. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) Эффективность питания (грамм набранного веса с поправкой на среднее потребление пищи в клетке). Однофакторный дисперсионный анализ с поправкой Тьюки; NB! n = 4 вследствие совместного содержания мышей в клетках. (C) Потребление энергии. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
Фиг. 21. Содержание жира в виде процентной доли от общего веса тела (A), вес печени в граммах (B) и вес эпидидимального жира (eWAT) в граммах (C) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином HD5 (HD5). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = C. (A) Процентная доля жира от общего веса тела в разные недели. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) Вес печени по завершении диеты. Однофакторный дисперсионный анализ с поправкой Тьюки. (C) вес эпидидимальной жировой ткани (висцеральная AT) по завершении диеты. Однофакторный дисперсионный анализ с поправкой Тьюки.
Фиг. 22. Гомеостаз глюкозы у мышей, которых лечили в течение 10 недель с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином HD5 (высокое содержание жиров + HD5). (A) Пероральный глюкозотолерантный тест. (B) тест на стимулированную глюкозой секрецию инсулина (GSIS). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = C. (A) Пероральный глюкозотолерантный тест в неделю 7. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) тест на стимулированную глюкозой секрецию инсулина в неделю 7, проведенный в ходе oGTT. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
Фиг. 23. Гомеостаз глюкозы у мышей, которых лечили в течение 10 недель с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином HD5 (высокое содержание жиров + HD5). (A) Инсулинотолерантный тест (ITT). (B) HOMA-IR. Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = C. (A) Инсулинотолерантный тест в неделю 8. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) Гомеостатическая модель оценки (HOMA) в неделю 9. Однофакторный дисперсионный анализ с поправкой Тьюки.
Фиг. 24. Экспрессия активируемого пролифератором пероксисом гамма-рецептора (PPARγ2) (A) и экспрессия пероксисомальной ацил-кофермент A-оксидазы 1 (Acox1) (B) в печени мышей, которых лечили в течение 10 недель с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и профилактического лечения дефензином HD5 (высокое содержание жиров + HD5).
Фиг. 25. Динамика набора веса (A) и изменение веса (B) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином HD5 (высокое содержание жиров + HD5). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = C. (A) Динамика набора веса. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
(B) Изменение веса начиная с недели 13 в конце подготовительного периода и в течение следующих 10 недель на экспериментальных видах диеты. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
Фиг. 26. Содержание жира в виде процентной доли от общего веса тела (A) и изменение % содержания жира начиная с недели 0-4 в граммах (B) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином HD5 (HD-5).
Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = C. (A) Процентная доля жира от общего веса тела в разные недели. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены). (B) изменение процентной доли жира начиная с конца подготовительного периода и до недели 4 на экспериментальных видах диеты. Однофакторный дисперсионный анализ с поправкой Тьюки.
Фиг. 27. Вес печени в граммах (A) и вес эпидидимального жира (eWAT) в граммах (B) на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином HD5 (HD-5). Статистическая значимость: низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = C.
(A) вес печени по завершении диеты. Однофакторный дисперсионный анализ с поправкой Тьюки. (B) вес эпидидимальной жировой ткани (висцеральная AT) по завершении диеты. Однофакторный дисперсионный анализ с поправкой Тьюки.
Фиг. 28. Гомеостаз глюкозы у мышей, которых лечили в течение 10 недель с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином HD5 (высокое содержание жиров + HD5). (A) Результаты перорального глюкозотолерантного теста для клетки 2. (B) Инсулинотолерантный тест (ITT). Статистическая значимость: Низкое содержание жиров в сравнении с высоким содержанием жиров = A; низкое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = B; высокое содержание жиров в сравнении с высоким содержанием жиров + HD-5 = C. (A) Результаты перорального глюкозотолерантного теста, проводимого повторно раз в две недели начиная с конца подготовительного периода (неделя 13-0), представленные для второй клетки группы, получающей диету с высоким содержанием жиров + HD-5.
(B) Инсулинотолерантный тест в неделю 9. Двухфакторный дисперсионный анализ с поправкой Тьюки (сопоставляемые значения объединены).
Фиг. 29. Экспрессия активируемого пролифератором пероксисом гамма-рецептора (PPARγ2) (a) и экспрессия пероксисомальной ацил-кофермент A-оксидазы 1 (Acox1) (b) в печени мышей на протяжении 10 недель лечения мышей с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров) или диеты с высоким содержанием жиров и терапевтического лечения дефензином HD5 (HD-5).
Фиг. 30. Поглощение жира в составе диеты (A) и содержание жира в фекалиях (B) у мышей, которых лечили в течение 10 недель с использованием диеты с низким содержанием жиров (низкое содержание жиров), диеты с высоким содержанием жиров (высокое содержание жиров), диеты с высоким содержанием жиров и профилактического лечения дефензином hBD-2 (высокое содержание жиров + hBD-2) или профилактического лечения дефензином HD5 (высокое содержание жиров + HD5).
Фиг. 31. Схематическое представление постановки эксперимента для изучения эффектов аналога GLP-1 (лираглутид) в отношении воспаления желудочно-кишечного тракта и микробиоты мыши. В неделю -40 были получены мыши C57/BI/6J DIO. Мышей кормили с использованием диеты с высоким содержанием жиров, 60% жира, SSNIFF (диета № D12492) или корма purina в течение 38 недель до достижения среднего веса тела 55 граммов. Начиная с недели -2 мышей поселяли по одной. Образцы фекалий собирали в день -1 и 27 для анализа 16S РНК. Образцы подвздошной кишки собирали на расстоянии 2 см от слепой кишки в день 28.
Фиг. 32. Потеря веса в граммах и в % веса тела в ходе 4-недельного лечения с использованием HFD плюс аналог GLP-1 спустя 38 недель на HFD.
Фиг. 33. Вес печени в граммах по завершении диеты спустя 38 недель на HFD и 4 недели на HFD плюс аналог GLP-1.
Фиг. 34. Концентрации холестерина в плазме крови по завершении диеты спустя 38 недель на HFD и 4 недели на HFD плюс аналог GLP-1.
Фиг. 35. Фармакокинетические данные после перорального введения 4 мг/кг hBD-2 самкам мышей NMRI. По оси Y показан hBD-2 в мкг/г ткани. Результаты приведены в виде среднего значения для группы +/-SEM.
Фиг. 36. Фармакокинетические данные для hBD-2 после подкожного (SC) и внутривенного (IV) введения 1 мг/кг соответственно. По оси Y показан hBD-2 в мкг/мл. На разных кривых представлены результаты для разных экспериментов и способов выявления (ВЭЖХ и ELISA).
Фиг. 37. Фармакокинетические данные для «продукта N-концевого слияния hBD-2 и альбумина» после подкожного и внутривенного введения 16,5 мг/кг соответственно. По оси Y показана концентрация слитого белка в мг/мл. Результаты представляют собой среднее для 4 мышей/момент отбора образцов +/- SD.
Фиг. 38. Фармакокинетические данные для «продукта С-концевого слияния hBD-2 и альбумина» после подкожного и внутривенного введения 16,5 мг/кг соответственно. По оси Y показана концентрация слитого белка в мг/мл. Результаты представляют собой среднее для 4 мышей/момент отбора образцов +/- SD.
Подробное раскрытие настоящего изобретения
Настоящее изобретение является таким, как определено в формуле изобретения.
Определения:
Кателицидин. Термин относится к родственным кателицидину противомикробным пептидам, которые принадлежат к семейству полипептидов, обнаруженных в лизосомах макрофагов и полиморфноядерных лейкоцитов (PMN) и кератиноцитов. Кателицидины выполняют важную роль во врожденной иммунной защите млекопитающих против инвазивной бактериальной инфекции. Пептиды семейства кателицидинов относят к противомикробным пептидам, семейству, которое также включает дефензины. Представители семейства кателицидинов, относящегося к противомикробным полипептидам, характеризуются высококонсервативной областью (домен кателина) и высоковариабельным доменом пептида кателицидина. Примером кателицидина является кателицидин человека, из которого происходит LL-37 (SEQ ID NO: 16).
Дефензин. Термин «дефензин» в контексте настоящего документа относится к полипептидам, которые, как известно специалисту в данной области, принадлежат к классу дефензинов, относящихся к противомикробным пептидам. Дефензины принадлежат к классу альфа-дефензинов или классу бета-дефензинов. Примеры дефензинов включают альфа-дефензин 5 кишечника человека (HD5; SEQ ID NO. 8); альфа-дефензин 6 человека (HD6; SEQ ID NO. 9); пептид нейтрофилов 1 человека (HNP-1); пептид нейтрофилов 2 человека (HNP-2;); пептид нейтрофилов 3 человека (HNP-3), все из которых принадлежат к классу альфа-дефензинов; а также бета-дефензин 1 человека (hBD1; SEQ ID NO. 4); бета-дефензин 2 человека (hBD-2; SEQ ID NO. 5); бета-дефензин 3 человека (hBD3; SEQ ID NO. 6); бета-дефензин 4 человека (hBD4; SEQ ID NO. 7), бета-дефензин 2 шимпанзе (SEQ ID NO: 10), бета-дефензин 2 макака (SEQ ID NO: 11), бета-дефензин 2 орангутана (SEQ ID NO: 3), бета-дефензин 3 мыши (SEQ ID NO: 12), бета-дефензин 2 лошади (SEQ ID NO: 13), бета-дефензин 1 свиньи (SEQ ID NO: 14), бета-дефензин 2 козы (SEQ ID NO: 12), бета-дефензин 2 представителя бычьих (SEQ ID NO: 1), бета-дефензин 2 курицы (SEQ ID NO: 2), принадлежащие к классу бета-дефензинов.
Дефензины экспрессируются в виде предшественников и подвергаются процессингу путем отщепления сигнального пептида, и, в некоторых случаях, пропептидов, также перед секрецией во внеклеточное пространство. Определенные выше последовательности представляют собой предсказанные зрелые биологически активные дефензины. Специалисту в данной области будет понятно, что процессинг может отличаться от клетки к клетке, и что образующийся в результате секретируемый зрелый пептид может отличаться на одну или две C- или N-концевые аминокислоты от предсказанных последовательностей, и по-прежнему сохраняет его биологическую активность.
Желудочно-кишечный тракт:
Желудочно-кишечный тракт представляет собой канал, который у животных используется для перемещения пищи к органам пищеварения, и он включает сами органы пищеварения. Желудочно-кишечный тракт человека в контексте настоящего документа относится к пищеварительной системе, состоящей из ротовой полости, пищевода, желудка, двенадцатиперстной кишки, тощей кишки, подвздошной кишки, слепой кишки, толстой кишки, прямой кишки и анального канала.
Глюкагоноподобный пептид-1 (GLP-1). GLP-1 является нейропептидом и инкретином, образованным из продукта транскрипции гена проглюкагона. Основным источником GLP-1 на периферии является L-клетка кишечника, которая секретирует GLP-1 в виде гормона желудочно-кишечный тракта. Биологически активными формами GLP-1 являются: GLP-1-(7-37) и GLP-1-(7-36)NH2. Эти пептиды образуются в результате селективного расщепления молекулы проглюкагона.
Секреция GLP-1 L-клетками подвздошной кишки зависит от присутствия питательных веществ в просвете тонкого кишечника. Стимуляторы секреции (средства, которые вызывают или стимулируют секрецию) этого гормона включают основные питательные вещества, такие как углеводы, белки и липиды. Оказавшись в кровотоке, GLP-1 характеризуется периодом полувыведения менее 2 минут вследствие быстрого разрушения ферментом дипептидилпептидазой-4.
GLP-1 является гормоном с сильным гипогликемическим действием, индуцирующим высвобождение бета-клетками поджелудочной железы гормона инсулина в ответ на возрастающий уровень глюкозы, подавляющим при этом секрецию глюкагона. Такое глюкозозависимое действие представляет особый интерес, поскольку неконтролируемое высвобождение инсулина, в случае когда концентрация глюкозы в плазме крови находится в нормальном диапазоне измерений натощак, или несвоевременные инъекции инсулина могут быть причиной опасного падения уровня глюкозы в крови - гипогликемии. Этого не происходит в результате действия GLP-1, поскольку GLP-1 прекращает стимулировать β-клетки к высвобождению большего количества инсулина, когда уровни глюкозы в крови достигают диапазона значений натощак. Кроме того, GLP-1 ингибирует секрецию и моторику желудка. Это откладывает и замедляет всасывание углеводов и способствует насыщающему эффекту.
Лираглутид (NN2211) представляет собой длительно действующий агонист рецептора глюкагоноподобного пептида-1, связывающийся с теми же рецепторами, что и эндогенный https://en.wikipedia.org/wiki/Metabolic гормон обмена веществ GLP-1, который стимулирует секрецию инсулина.
Другие аналоги GLP-1 включают эксенатид, ликсисенатид, албиглутид и дулаглутид.
Идентичность. Сходство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывают параметром «идентичность».
Степень идентичности между двумя аминокислотными последовательностями определяют с применением алгоритма по Нидлману–Вуншу (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), реализуемого в программе Needle пакета программного обеспечения EMBOSS (Rice et al., 2000, http://emboss.org), предпочтительно версии 3.0.0 или более поздней. Дополнительные применяемые параметры представляют собой штраф за открытие гэпа 10, штраф за продление гэпа 0,5 и матрицу замен EBLOSUM62 (EMBOSS-версия BLOSUM62). Результат Needle, обозначаемый как «наиболее длинный участок идентичности» (полученный с применением опции nobrief), применяют в качестве процентной идентичности и рассчитывают следующим образом:
(Идентичные остатки × 100)/(Длина выравнивания – Общее число гэпов при выравнивании)
Лечение. Термины «лечение» и «лечащий» в контексте настоящего документа относятся к оказанию медицинской помощи и уходу за пациентом в целях борьбы с состоянием, заболеванием или нарушением. Подразумевается, что термин включает полный спектр мер по лечению данного состояния, от которого страдает пациент, таких как введение активного соединения с целью: ослабления или облегчения симптомов или осложнений; задержки прогрессирования состояния, заболевания или нарушения; излечения или устранения состояния, заболевания или нарушения; и/или предупреждения состояния, заболевания или нарушения, где термин «предупреждающий» или «предупреждение» следует понимать как относящийся к оказанию медицинской помощи и уходу за пациентом в целях препятствия, подавления или задержки развития состояния, заболевания или нарушения, и включает введение активных соединений для предупреждения или снижения риска появления симптомов или осложнений. Подлежащий лечению пациент предпочтительно является млекопитающим, в частности, человеком. Подлежащие лечению пациенты могут быть разных возрастов.
Субъект, пациент. Субъектом является индивидуум одного из видов млекопитающих, раскрытых в настоящем документе. Пациентом является субъект, у которого было диагностировано конкретное нарушение.
Альфа- и бета-дефензины млекопитающих
Настоящее раскрытие относится к применениям альфа- и/или бета-дефензинов млекопитающих и/или кателицидина, как, например, бета-дефензинов представителя бычьих, свиньи, овцы, козы, мыши, обезьяны, лошади или человека, более предпочтительно дефензинов представителя семейства Hominidae, более предпочтительно альфа- и/или бета-дефензина человека и/или кателицидина человека, в лечении нарушений печени, поджелудочной железы или желчных путей и определенных метаболических нарушений. Согласно другому варианту осуществления настоящее раскрытие относится к применениям аналогов GLP-1, таких как лираглутид, в лечении нарушений со стороны печени, поджелудочной железы или желчных путей и определенных метаболических нарушений.
Согласно одному варианту осуществления альфа- и/или бета-дефензины млекопитающих и/или кателицидин характеризуются по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% степенью идентичности с любой из аминокислотных последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16 и/или SEQ ID NO:17. Согласно другому варианту осуществления дефензин отличается от одной из SEQ ID NO:1-15 или 17 менее чем на 10, как, например, менее чем на 8, например, менее чем на 5, как, например, менее чем на 4, например, менее чем на 3, как, например, менее чем на 2 аминокислоты.
Согласно предпочтительному варианту осуществления альфа-дефензины человека включают альфа-дефензин 5 (SEQ ID NO: 8) и/или альфа-дефензин 6 (SEQ ID NO:9). Согласно предпочтительному варианту осуществления бета-дефензины млекопитающих включают бета-дефензин 1 человека (SEQ ID NO:4), бета-дефензин 2 человека (SEQ ID NO:5), бета-дефензин 3 человека (SEQ ID NO:6), бета-дефензин 4 человека (SEQ ID NO:7) и/или усеченный бета-дефензин 2 человека (SEQ ID NO: 17). Согласно другому предпочтительному варианту осуществления кателицидин включает кателицидин человека или LL37 человека (SEQ ID NO: 16), образованный из кателицидина. Согласно предпочтительному варианту осуществления аналог GLP-1 представляет собой лираглутид.
Согласно предпочтительному варианту осуществления альфа-дефензин человека характеризуется по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% степенью идентичности с аминокислотной последовательностью SEQ ID NO: 8. Согласно предпочтительному варианту осуществления альфа-дефензины млекопитающих, являющиеся альфа-дефензинами человека, включают альфа-дефензин 5 (SEQ ID NO: 8). Согласно предпочтительному варианту осуществления бета-дефензин человека характеризуется по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% степенью идентичности с аминокислотной последовательностью SEQ ID NO: 5. Согласно предпочтительному варианту осуществления бета-дефензин человека включает бета-дефензин 2 человека (SEQ ID NO: 5). Согласно предпочтительному варианту осуществления кателицидин человека характеризуется по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% степенью идентичности с аминокислотной последовательностью SEQ ID NO: 16. Согласно предпочтительному варианту осуществления кателицидин человека включает LL37 человека (SEQ ID NO: 16).
В случае видов, отличных от человека, субъектов предпочтительно лечат дефензином или кателицидином, происходящим из того же или родственного вида, или дефензином или кателицидином, характеризующимся по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% идентичностью с аминокислотной последовательностью дефензина или кателицидина этого же вида (например, дефензин, имеющий аминокислотную последовательность, выбранную из SEQ ID NO: 1-3, 10-15).
Согласно еще одному варианту осуществления альфа-дефензины млекопитающих включают альфа-дефензины человека и/или альфа-дефензины мыши и их функционально эквивалентные варианты. Предпочтительно альфа-дефензин млекопитающих включает альфа-дефензин 5 человека, альфа-дефензин 6 человека и их функционально эквивалентные варианты. Более предпочтительно альфа-дефензины млекопитающих включают альфа-дефензин 5 человека и его функционально эквивалентные варианты или ортологи.
Согласно еще одному дополнительному варианту осуществления бета-дефензины млекопитающих включают бета-дефензины человека и/или бета-дефензины мыши и их функционально эквивалентные варианты. Предпочтительно бета-дефензины млекопитающих включают бета-дефензин 1 человека, бета-дефензин 2 человека, бета-дефензин 3 человека, бета-дефензин 4 человека, бета-дефензин 2 шимпанзе, бета-дефензин 2 макака и бета-дефензин 3 мыши, бета-дефензин 2 орангутана, бета-дефензин 2 лошади, бета-дефензин 1 свиньи, бета-дефензин 2 козы, бета-дефензин 2 представителя бычьих или усеченный бета-дефензин 2 человека и их функционально эквивалентные варианты. Более предпочтительно бета-дефензины млекопитающих включают бета-дефензин 1 человека, бета-дефензин 2 человека, бета-дефензин 3 человека, бета-дефензин 4 человека, усеченный бета-дефензин 2 человека и их функционально эквивалентные варианты. Даже более предпочтительно, бета-дефензины млекопитающих включают бета-дефензин 2 человека и его функционально эквивалентные варианты или ортологи.
Согласно еще одному дополнительному варианту осуществления кателицидин млекопитающих включает кателицидин человека и его функционально эквивалентные варианты. Предпочтительно кателицидин млекопитающих включает LL37 человека.
Согласно одному варианту осуществления способы предусматривают введение эффективного количества по меньшей мере одного α-дефензина млекопитающих нуждающемуся в таком лечении субъекту. Согласно другим вариантам осуществления представленные способы предусматривают введение эффективного количества по меньшей мере одного β-дефензина млекопитающих нуждающемуся в таком лечении субъекту. Согласно дополнительному варианту осуществления представленные способы предусматривают введение эффективного количества по меньшей мере одного α-дефензина млекопитающих и по меньшей мере одного β-дефензина млекопитающих нуждающемуся в таком лечении субъекту. В предпочтительном варианте осуществления предусмотрено введение альфа-дефензина млекопитающих HD5 и/или бета-дефензина млекопитающих hBD-2.
Согласно другим вариантам осуществления представленные способы предусматривают введение эффективного количества по меньшей мере одного кателицидина млекопитающих нуждающемуся в таком лечении субъекту. Согласно некоторым вариантам осуществления способы предусматривают введение эффективного количества LL37 человека нуждающемуся в таком лечении субъекту.
Согласно другим вариантам осуществления представленные способы предусматривают введение эффективного количества по меньшей мере одного аналога GLP-1 нуждающемуся в таком лечении субъекту. Согласно конкретному варианту осуществления аналог GLP-1 представляет собой лираглутид.
Согласно дополнительным вариантам осуществления представленные способы предусматривают введение эффективного количества по меньшей мере одного α-дефензина млекопитающих и по меньшей мере одного кателицидина млекопитающих нуждающемуся в таком лечении субъекту. В предпочтительном варианте осуществления предусмотрено введение альфа-дефензина млекопитающих HD5 и/или кателицидина млекопитающих. Согласно дополнительному варианту осуществления представленные способы предусматривают введение эффективного количества по меньшей мере одного β-дефензина млекопитающих и по меньшей мере одного кателицидина млекопитающих нуждающемуся в таком лечении субъекту. В предпочтительном варианте осуществления предусмотрено введение бета-дефензина млекопитающих hBD-2 и/или кателицидина млекопитающих. Согласно некоторым вариантам осуществления способы дополнительно предусматривают введение аналога GLP-1, такого как лираглутид.
«Функционально эквивалентный вариант» альфа- или бета-дефензина или кателицидина млекопитающих (например, человека) представляет собой модифицированный альфа- или бета-дефензин или кателицидин млекопитающих (например, человека), проявляющий примерно такой же эффект в отношении воспаления печени, желчных путей или поджелудочной железы, что и исходные альфа- и/или бета-дефензины и/или кателицидин млекопитающих (например, человека). Функционально эквивалентный вариант дефензина или кателицидина млекопитающих (например, человека) может предусматривать 1-5 аминокислотных модификаций, предпочтительно 1-4 аминокислотные модификации, более предпочтительно 1-3 аминокислотные модификации, наиболее предпочтительно 1-2 аминокислотную(-ые) модификацию(-и), и, в частности, одну аминокислотную модификацию по сравнению с аминокислотной последовательностью дефензина или кателицидина млекопитающих (например, человека). Предпочтительно, в случае бета-дефензина млекопитающих, по сравнению с бета-дефензином 2 человека, характеризующимся SEQ ID NO: 5. Предпочтительно, в случае альфа-дефензина млекопитающих, по сравнению с HD5, характеризующимся SEQ ID NO: 8. Предпочтительно, в случае кателицидина млекопитающих, по сравнению с LL37 человека, характеризующимся SEQ ID NO: 16.
Способы по настоящему изобретению могут также предусматривать введение функциональных эквивалентов аналогов GLP-1 или их модифицированных форм, таких как функциональные эквиваленты лираглутида.
Термин «модификация» означает в настоящем документе любую химическую модификацию дефензина млекопитающих (например, человека), кателицидина млекопитающих или аналога GLP-1, такого как лираглутид. Модификация(-и) может(могут) представлять собой замену(-ы), делецию(-и) и/или вставку(-и) аминокислот(-ы), а также замещение(-я) боковой(-ых) цепи(-ей) аминокислоты; или применение в аминокислотной последовательности аминокислот не природного происхождения с подобными характеристиками. В частности, модификация(-и) может(могут) представлять собой амидирования, такие как амидирование C-конца.
Предпочтительно аминокислотные модификации являются несущественными, то есть представляют собой консервативные аминокислотные замены или вставки, которые не оказывают значительного влияния на фолдинг и/или активность полипептида; единичные делеции; небольшие удлинения амино- или карбокси-конца; или небольшое удлинение, которое облегчает очистку посредством изменения суммарного заряда или другой функции, как, например, полигистидиновая метка, эпитоп или связывающий домен. Согласно одному варианту осуществления небольшое удлинение, такое как полигистидиновая метка, эпитоп или связывающий домен, присоединено к альфа- или бета-дефензину млекопитающих (например, человека) посредством небольшого линкерного пептида длиной до приблизительно 20-25 остатков, и при этом указанный линкер может содержать сайт расщепления для ферментов рестрикции. Представленные на фигурах 3-6 выравнивания с помощью Clustal W можно применять для предсказания того, какие аминокислотные остатки могут быть заменены без значительного влияния на биологическую активность белка. Последовательности выравнивали с применением Clustal W 2.1 (http://www.genome.jp/tools/clustalw/) и следующих параметров: штраф за открытие гэпа:10, штраф за продление гэпа: 0,05, вес транзиций: НЕТ, гидрофильные остатки для белков: GPSNDQE, гэпы в гидрофильной области: ДА, матрица весов: BLOSUM (для БЕЛКА).
Замены в пределах следующей группы (Clustal W, «сильная» консервативная группа) считаются консервативными заменами:
-S, T, A; N, E, Q, K; N, H, Q, K; N, D, E, Q; Q, H, R, K; M, I, L, V; M, I, L, F; H, Y; F, Y, W.
Замены в пределах следующей группы (Clustal W, «слабая» консервативная группа) считаются полуконсервативными заменами:
-C, S, A; A, T, V; S, A, G; S, T, N, K; S, T, P, A; S, G, N, D; S, N, D, E, Q, K; N, D, E, Q, H, K; N, E, Q, H, R, K; V, L, I, M; H, F, Y.
Примерами консервативных замен являются замены, выполненные в группе основных аминокислот (аргинин, лизин и гистидин), кислых аминокислот (глутаминовая кислота и аспарагиновая кислота), полярных аминокислот (глутамин и аспарагин), гидрофобных аминокислот (лейцин, изолейцин и валин), ароматических аминокислот (фенилаланин, триптофан и тирозин) и малых аминокислот (глицин, аланин, серин, треонин и метионин). Аминокислотные замены, которые в целом не изменяют специфическую активность, известны в данной области и описаны, например, Neurath and Hill (1979). Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly.
Помимо 20 стандартных аминокислот, аминокислотные остатки полипептида дикого типа можно заменять нестандартными аминокислотами (такими как 4-гидроксипролин, 6-N-метиллизин, 2-аминоизомасляная кислота, изовалин и альфа-метилсерин). Аминокислотные остатки могут быть заменены ограниченным числом неконсервативных аминокислот, аминокислот, которые не кодируются в соответствии с генетическим кодом, и аминокислот не природного происхождения. «Аминокислоты не природного происхождения» были модифицированы после синтеза белка и/или характеризуются химической структурой их боковой(-ых) цепи(-ей), отличающейся от таковой у стандартных аминокислот. Аминокислоты не природного происхождения могут быть синтезированы химически, и предпочтительно являются коммерчески доступными, и включают пипеколиновую кислоту, тиазолидин-карбоновую кислоту, дегидропролин, 3- и 4-метилпролин и 3,3-диметилпролин.
Незаменимые аминокислоты альфа- и/или бета-дефензина, и/или кателицидина млекопитающих, и/или аналога GLP-1 или его пептидного остова могут быть идентифицированы в соответствии с известными в данной области процедурами, такими как сайт-направленный мутагенез или аланинсканирующий мутагенез (Cunningham and Wells, 1989, Science 244: 1081-1085). Согласно последней методике по отношению к каждому остатку в молекулу вводят единичные мутации по аланину, и полученные в результате мутантные молекулы тестируют на предмет биологической активности (т. е. активности в отношении воспалительного заболевания кишечника и/или подавления активности TNF-альфа) с целью идентификации аминокислотных остатков, которые являются крайне важными для активности молекулы. См. также Hilton et al., 1996, J. Biol. Chem. 271: 4699-4708. Показатели идентичности незаменимых аминокислот также могут быть получены на основе анализа показателей идентичности с использованием полипептидов, родственных альфа- и/или бета-дефензинам, и/или кателицидину млекопитающих, и/или пептидному остову аналогов GLP-1 (см. выравнивания с помощью Clustal W на фигурах 3-6).
Единичные или множественные аминокислотные замены можно выполнять и подвергать тестированию с применением известных способов мутагенеза, рекомбинации и/или шаффлинга, с последующим выполнением соответствующей процедуры скрининга, таких как способы, описанные Reidhaar-Olson and Sauer, 1988, Science 241: 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413 или WO 95/22625. Другие способы, которые можно применять, включают ПЦР с внесением ошибок, фаговый дисплей (например, Lowman et al., 1991, Biochem. 30:10832-10837; патент США № 5223409; WO 92/06204) и направленный на определенную область мутагенез (Derbyshire et al., 1986, Gene 46:145; Ner et al., 1988, DNA 7:127).
Если результат данной замены невозможно предсказать с достоверностью, с целью определения наличия или отсутствия биологической активности без труда можно анализировать производные в соответствии со способами, описанными в настоящем документе выше.
Длительно действующие соединения
Период полувыведения α- или β-дефензина или кателицидина может быть увеличен путем слияния или конъюгирования α- или β-дефензина или кателицидина с другой молекулой, т. е. путем конструирования длительно действующих биологически активных α- или β-дефензина или кателицидина, связанных с фармацевтически приемлемой молекулой, обеспечивающей in vivo период полувыведения из плазмы крови α- или β-дефензина или кателицидина, который значительно увеличен по сравнению с in vivo периодом полувыведения из плазмы крови α- или β-дефензина или кателицидина, вводимых таким же образом, что и в случае α- или β-дефензина или кателицидина.
Длительно действующий биологически активный α- или β-дефензин или кателицидин предусматривает α-дефензин млекопитающих или его аналог, или β-дефензин млекопитающих или его аналог, или кателицидин человека или его аналог, связанные с фармацевтически приемлемой молекулой, выбранной из молекулы, связывающейся с неонатальным Fc-рецептором млекопитающего, трансферрина или CH3(CH2)nCO-, где n равняется 8-22, или полимера.
Агонист α- или β-дефензина или кателицидина также может происходить из вида, не относящегося к млекопитающим, и может быть выбран из малых органических молекул, пептидов, полипептидов и белков.
Агонист α- или β-дефензина или кателицидина может быть связан с фармацевтически приемлемой молекулой различными способами, описанными в литературе из уровня техники, такими как без ограничения химическое соединение посредством бифункционального линкера, методика генной инженерии с применением соединения N-конца или C-конца дефензина, такого как α-дефензин или β-дефензин, или кателицидина, с фармацевтически приемлемой молекулой, такой как альбумин или аналог альбумина. В частности, N-конец альбумина или аналога альбумина, например, альбумина человека, может быть соединен с C-концом α-дефензина, или β-дефензина, или кателицидина или N-концом α- или β-дефензина или кателицидина; или C-конец альбумина, например, альбумина человека, может быть соединен с C-концом α-дефензина, или β-дефензина, или кателицидина или N-концом α- или β-дефензина или кателицидина. Между альбумином и цепью α- или β-дефензина или кателицидина может быть вставлена линкерная последовательность.
Агонист α- или β-дефензина или кателицидина может быть связан с фармацевтически приемлемой молекулой посредством стабильного линкера или более лабильного линкера. Из уровня техники известны несколько линкеров, включая бифункциональные молекулы на основе ПЭГ (например, см. Paige et al. Pharmaceutical Research, vol. 12, no. 12, 1995), гидролизуемые линкеры (Shechter et al. Bioconjugate Chem. 2005,16: 913-920 и International Journal of Peptide Research and Therapeutics, Vol. 13, Nos. 1-2, June 2007 и W02009095479), PDPH и EMCH, см., например, в W02010092135. В частном случае, когда химическая конъюгация (связывание двух или более молекул) агониста α- или β-дефензина или кателицидина с фармацевтически приемлемой молекулой сильно снижает активность функциональных α- или β-дефензина или кателицидина, предпочтительным может быть применение более лабильного линкера, который может обеспечить высвобождение агониста функционального α- или β-дефензина или кателицидина.
Увеличение времени полужизни также может быть достигнуто посредством ацилирования пептидного остова с использованием спейсера, например, γ-L-глутамильного спейсера и дикарбонового производного C-18 жирной кислоты, присоединенных к лизину. Боковая цепь в виде дикарбонового производного жирной кислоты и спейсер опосредуют сильное, но обратимое связывание с альбумином, замедляя высвобождение из сайта введения и снижая почечный клиренс.
Подобных образом, период полувыведения аналога GLP-1, такого как лираглутид, может быть увеличен с помощью известных в данной области способов, в том числе вышеупомянутых способов.
Согласно некоторым вариантам осуществления альфа-дефензин, бета-дефензин, кателицидин или аналог GLP-1 дополнительно содержит по меньшей мере один дополнительный фрагмент, выбранный из группы, состоящей из проникающего в клетку пептида (CPP), альбуминсвязывающего фрагмента (ABM), детектируемого фрагмента (Z) и пептида, увеличивающего период полувыведения.
Согласно другим вариантам осуществления альфа-дефензин, бета-дефензин, кателицидин или аналог GLP-1 не содержит какого-либо проникающего в клетку пептида (CPP), альбуминсвязывающего фрагмента (ABM), детектируемого фрагмента (Z) и пептида, увеличивающего период полувыведения.
Способы и применения
Как продемонстрировано в примере 5, введение лираглутида, аналога GLP-1, как было обнаружено, оказывает эффект в виде снижения веса у мышей, которых кормили с использованием диеты с высоким содержанием жиров. Аналог GLP-1 также снижал накопление жира в печени и уровни холестерина в плазме крови. Следовательно, авторы настоящего изобретения рассматривают лечение заболевания или нарушения со стороны печени, желчных путей, поджелудочной железы или метаболического заболевания или нарушения, или злокачественной опухоли печени, холангиокарциномы или злокачественной опухоли поджелудочной железы, а также другие пути применения, как описано в настоящем документе, с помощью введения GLP-1 или аналога GLP-1.
Предпочтительно GLP-1 или аналоги GLP-1 вводят парентерально посредством либо подкожного, либо внутримышечного введения. Аналог GLP-1 может быть выбран из эксенатида, лираглутида, ликсисенатида, албиглутида и дулаглутида.
Обнаружено, что альфа-дефензин 5 человека и бета-дефензин 2 человека, по отдельности или в комбинации, и/или кателицидин, и/или аналог GLP-1 могут предупреждать или лечить набор лишнего веса, накопление липидов и воспаление у мышей, которых кормили с использованием диеты с высоким содержанием жиров/сахара («западная диета»). Мыши, которых кормили с использованием такой диеты с высоким содержанием жиров/сахара, стремительно набирали вес, и у них накапливался эпидидимальный или висцеральный жир и/или жир в печени в отсутствие какого-либо лечения. Накопление жира в печени приводит к неалкогольной жировой болезни печени, которая на более поздних стадиях может привести к стеатозу, фиброзу, циррозу печени, печеночной энцефалопатии и, в конечном счете, злокачественной опухоли печени. Благодаря снижению степени накопления абдоминального жира, например, в печени, представляется возможным снижение или предупреждение появления NAFLD, NASH и ассоциированных нарушений.
Если можно предупреждать или снижать набор лишнего веса, то также можно предупреждать или снижать накопление эпидидимального или висцерального жира и/или жира в печени, что, таким образом, демонстрирует активность потенциального лекарственного препарата для лечения или предупреждения заболевания печени, включая злокачественную опухоль печени и печеночную энцефалопатию, нарушений со стороны желчных путей и поджелудочной железы и определенных метаболических нарушений. Следовательно, согласно одному аспекту предусмотрены способы лечения или предупреждения нарушений со стороны печени, желчных путей и поджелудочной железы, а также метаболических нарушений, как определено в настоящем документе.
Примеры нарушений со стороны печени включают алкогольную (IDC10: K70) и неалкогольную болезнь печени, токсическое поражение печени (IDC 10: K71), например, жировое перерождение печени, гепатит (IDC 10: K73 и K75), цирроз (IDC 10: K74), печеночную недостаточность (IDC 10: K72), фиброз (IDC 10: K74) и склероз печени и, наиболее важно, неалкогольный стеатогепатит NASH – (IDC 10: K75.8) и неалкогольную жировую болезнь печени (NAFLD) (IDC 10: K76.0). Согласно конкретному варианту осуществления заболевание печени представляет собой NASH или NAFLD.
Неалкогольная жировая болезнь печени (NAFLD) является наиболее распространенным заболеванием печени в мире, с возрастающей частотой случаев вследствие тесной связи с повальным ростом ожирения. Стеатоз, который представляет собой избыточное удерживание липидов в клетке, зачастую происходит в печени, но может меть место в других органах, таких как почки, сердце и мышцы. Стеатоз печени может обуславливать развитие жировой болезни печени (FLD), которая может быть дополнительно классифицирована как алкогольная или неалкогольная жировая болезнь печени (NAFLD), в зависимости от вклада потребления алкоголя.
Простой стеатоз не связан с повышенным риском в отношении заболеваемости и смертности, ассоциированных с печенью; однако неалкогольный стеатогепатит (NASH) может развиться в запущенный фиброз и цирроз печени, и также ассоциирован с повышенным риском развития злокачественной опухоли печени. Субъекты, страдающие от NASH, имеют повышенный риск (5-10%) развития злокачественной опухоли, такой как гепатоцеллюлярная карцинома, по сравнению с риском у субъектов, у которых цирроз развился вследствие гепатита C. По оценкам, приблизительно 1 миллион городских жителей США страдают от NASH, хотя его сложно количественно оценить ввиду того, что при NASH не всегда проявляются симптомы. NASH, однако, диагностирован у 7-9% людей в США, которые проходили биопсию печени, и является основным показанием к трансплантации печени у городских жителей США в возрасте до 25.
NASH зачастую наблюдается у людей с BMI (индексом массы тела), превышающим 30, с сахарным диабетом и/или с инсулинорезистентностью. На сегодняшний день NASH наиболее часто обнаруживают в ходе плановых лабораторных исследований. Дополнительные тесты помогают подтвердить наличие NASH и исключить другие типы заболевания печени. С помощью методов визуальной диагностики (таких как ультразвуковая визуализация, КТ-сканирование или магнитно-резонансная томография) можно выявить накопление жира в печени, но невозможно отличить NASH от других причин заболевания печени, которые характеризуются подобным изображением. Для подтверждения NASH требуется биопсия печени. На сегодняшний день конкретных видов терапии для лечения NASH, отличных от трансплантации печени, не существует, однако коррекция образа жизни может оказать содействие в снижении степени его тяжести.
Повышенные уровни ферментов печени, таких как AST и ALT, можно применять как часть диагностической процедуры с целью идентификации пациентов с NAFLD и NASH. Уровни ALT обычно выше, чем уровни AST у пациентов с NAFLD; однако соотношение AST/ALT, превышающее 1, указывает на запущенную фиброзирующую форму заболевания. Это соотношение является наиболее простой моделью прогнозирования запущенного фиброза, и оно может быть рассчитано с применением легко доступных функциональных проб печени. Несмотря на его простоту, это соотношение характеризуется надлежащей прогностической ценностью отрицательного результата, и его можно применять для исключения наличия запущенного фиброза.
Примеры нарушений со стороны желчных путей и поджелудочной железы включают: холангит (IDC: K 83.0) и, в частности, первичный склерозирующий холангит, холецистит (IDC10: K81.0), холангиокарциному (IDC10: C22.1) и панкреатит (IDC10: K85.0).
Примеры метаболических нарушений включают: нарушения метаболизма липопротеинов (IDC10: E78); гиперхолестеринемию (IDC10: E78.0); гиперглицеридемию (IDC10: E78.1); гиперлипидемию (IDC10: E78.2 и E78.4); гиперхиломикронемию (IDC10: E78.3); гликогеноз (IDC10: E74); нарушения метаболизма сфинголипидов и липидозы (IDC10: E75); липидозы (IDC10: E75.6); ганглиозидоз (IDC10: E75) и сфинголипидоз (IDC10: E75.2).
Общим для этих нарушений является то, что они являются результатом генных мутаций или обусловлены или усугублены образом жизни западного типа, индуцирующим метаболический синдром с ожирением, дислипидемий, нарушением толерантности к глюкозе и инсулинорезистентностью, а также накоплением абдоминального/висцерального или печеночного жира.
С помощью раскрытых в предпочтительных вариантах осуществления способов, посредством введения по меньшей мере альфа-дефензина млекопитающих, и/или по меньшей мере бета-дефензина млекопитающих, и/или кателицидина, и/или аналога GLP-1, такого как лираглутид, можно лечить нарушение со стороны печени, желчных путей, поджелудочной железы или метаболическое нарушение, как описано выше.
Предусмотренный раскрытыми способами нуждающийся в лечении субъект страдает от нарушения со стороны печени, желчных путей, поджелудочной железы или метаболического нарушения, как описано выше.
У предусмотренного раскрытыми способами нуждающегося в лечении субъекта могут наблюдаться один или несколько из следующих симптомов:
Повышенное артериальное давление: ≥ 140/90 мм рт. ст.;
Дислипидемия: триглицериды (TG): ≥ 1,695 ммоль/л и холестерин липопротеинов высокой плотности (HDL-C) ≤ 0,9 ммоль/л (лица мужского пола), ≤ 1,0 ммоль/л (лица женского пола);
Уровень глюкозы натощак > 6,1 ммоль/л;
AST/ALT > 1;
Центральное ожирение: соотношение талия:бедра > 0,90 (лица мужского пола); > 0,85 (лица женского пола) или индекс массы тела > 30 кг/м2; и
Микроальбуминурия: скорость экскреции альбумина с мочой ≥ 20 мг/мин или соотношение альбумин:креатинин ≥ 30 мг/г.
Согласно одному варианту осуществления введение по меньшей мере одного α-дефензина млекопитающих и/или по меньшей мере одного β-дефензина млекопитающих в соответствии с раскрытыми способами обычно является пероральным.
Альфа- и бета-дефензины млекопитающих, и/или кателицидины, и/или аналоги GLP-1 можно использовать в терапевтических целях в виде композиций, составленных для введения любым удобным путем. Согласно одному варианту осуществления альфа- и/или бета-дефензины млекопитающих, и/или кателицидин, и/или аналоги GLP-1 вводят перорально. Согласно другим вариантам осуществления введение является парентеральным, как, например, внутривенным, внутримышечным, подкожным, внутрибрюшинным или ингаляционным.
Согласно некоторым вариантам осуществления композиции предпочтительных вариантов осуществления могут быть составлены в виде лиофилизата, с использованием соответствующих вспомогательных веществ, которые обеспечивают стабильность препарата в форме лиофилизата и после восстановления.
Фармацевтические композиции, содержащие альфа-дефензин млекопитающих и/или бета-дефензин млекопитающих, и/или кателицидин, и/или аналог GLP-1, как, например, альфа-дефензин человека и/или бета-дефензин человека, и/или кателицидин человека, и/или лираглутид, могут быть изготовлены в соответствии с традиционными способами, например, путем смешивания, гранулирования, нанесения оболочки, растворения или с применением процессов лиофилизации. Согласно предпочтительному варианту осуществления фармацевтические композиции, содержащие альфа-дефензин млекопитающих и/или бета-дефензин млекопитающих, составляют в виде стерильного и изотонического раствора.
Согласно одному варианту осуществления предусмотренные фармацевтические композиции содержат по меньшей мере один альфа-дефензин млекопитающих. Примерами альфа-дефензинов млекопитающих являются HD5 и HD6. Согласно предпочтительному варианту осуществления композиции содержат альфа-дефензин млекопитающих HD5. Согласно другому варианту осуществления фармацевтические композиций содержат по меньшей мере один бета-дефензин млекопитающих. Примерами бета-дефензинов млекопитающих являются hBD1, hBD-2, усеченный hBD-2, hBD3 и hBD4. Согласно предпочтительному варианту осуществления композиции содержат бета-дефензин млекопитающих hBD-2. Согласно дополнительному варианту осуществления фармацевтические композиции содержат по меньшей мере один альфа-дефензин млекопитающих и по меньшей мере один бета-дефензин млекопитающих. Примерами альфа-дефензинов млекопитающих являются HD5 и HD6. Примером бета-дефензина млекопитающих является hBD-2. Согласно предпочтительному варианту осуществления композиции содержат альфа-дефензин млекопитающих HD5 и бета-дефензин млекопитающих hBD-2. Согласно другим вариантам осуществления композиции или композиции в форме пищевой добавки содержат один или несколько дефензинов, происходящих из вида, отличного от человека, выбранных из дефензинов, имеющих аминокислотную последовательность, выбранную из SEQ ID NO: 1-3 и 10-15, а также вариантов последовательностей, как определено в настоящем документе. Согласно другому варианту осуществления фармацевтические композиции содержат по меньшей мере один кателицидин, например, кателицидин человека, например, LL37 человека SEQ ID NO: 16. Согласно другому варианту осуществления фармацевтические композиции содержат по меньшей мере один аналог GLP-1, например, лираглутид.
Фармацевтические композиции предпочтительных вариантов осуществления содержат альфа-дефензин млекопитающих и/или бета-дефензин млекопитающих, такой как альфа-дефензин человека и бета-дефензин человека, и/или кателицидин, такой как кателицидин человека, и/или аналог GLP-1, такой как лираглутид, и фармацевтически приемлемый носитель и/или разбавитель.
Фармацевтически приемлемые носители и/или разбавители известны специалистам в данной области. В случае композиций, составленных в виде жидких растворов, приемлемые носители и/или разбавители включают солевой раствор и стерильную воду, и могут необязательно включать антиоксиданты, буферы, бактериостатики и другие общепринятые добавки.
Раскрытое соединение может быть составлено в виде самых разных составов для перорального применения. Препараты в твердой форме могут включать порошки, таблетки, драже, капсулы, облатки, пастилки и диспергируемые гранулы. Другие подходящие для перорального применения формы могут включать препараты в жидкой форме, в том числе эмульсии, сиропы, эликсиры, водные растворы, водные суспензии, зубную пасту, средство для чистки зубов в форме геля, жевательную резинку, или препараты в твердой форме, которые предназначены для быстрого преобразования перед применением в препараты в жидкой форме, такие как растворы, суспензии и эмульсии.
Состав может содержать (помимо альфа-дефензина млекопитающих, и/или бета-дефензина млекопитающих, и/или кателицидина и других необязательных активных ингредиентов) носители, наполнители, средства для улучшения распадаемости таблеток, средства для улучшения текучести, сахара и подсластители, ароматизаторы, консерванты, стабилизаторы, смачивающие вещества, эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления, буферы, разбавители, диспергирующие и поверхностно-активные вещества, связующие вещества, смазывающие вещества и/или другие фармацевтические вспомогательные вещества, известные в данной области.
Специалист в данной области может также составлять альфа-дефензин млекопитающих и бета-дефензины млекопитающих и/или кателицидин подходящим образом и в соответствии с общепринятыми практическими подходами, как, например, таковыми, описанными в Remington's Pharmaceutical Sciences, Gennaro (1990).
Альфа-дефензин млекопитающих и бета-дефензин млекопитающих, такой как альфа-дефензин человека и бета-дефензин человека, можно применять по отдельности или в рамках комбинированной терапии с одним, двумя или более другими фармацевтическими соединениями или лекарственными веществами, например, с инсулином или аналогами инсулина, глюкагоноподобным пептидом-1 (GLP-1) или аналогами GLP-1, или ингибиторами дипептидилпептидазы-IV (DDP-IV), и/или с одним или несколькими фармацевтически приемлемыми вспомогательными веществами.
Альфа-дефензин млекопитающих и/или бета-дефензин млекопитающих, и/или кателицидин, как, например, альфа-дефензин человека, бета-дефензин человека и/или кателицидин человека, можно применять по отдельности или в рамках комбинированной терапии с одним, двумя или более другими фармацевтическими соединениями или лекарственными веществами, например, с антибиотиками; инсулином или аналогами инсулина; глюкагоноподобным пептидом-1 (GLP-1) или аналогами GLP-1; глюкагоноподобным пептидом-2 (GLP2) или аналогами GLP-2; ингибиторами дипептидилпептидазы-IV (DDP-IV); метформином; ингибиторами натрий-зависимого транспортера глюкозы-2 (SGLT-2); антагонистами рецептора глюкагона и/или антагонистом представителя 1 подсемейства V катионных каналов транзиторного рецепторного потенциала (TRPV1) и/или с одним или несколькими фармацевтически приемлемыми вспомогательными веществами.
Альфа-дефензин млекопитающих и/или бета-дефензин млекопитающих, и/или кателицидин, как, например, альфа-дефензин человека, бета-дефензин человека и кателицидин человека, также можно применять в рамках комбинированной терапии с одним из химиотерапии, иммунотерапии, радиотерапии или их комбинации.
Подобных образом, аналог GLP-1 можно применять в отдельности или в рамках комбинированной терапии с одним, двумя или более другими фармацевтическими соединениями или лекарственными веществами, например, с антибиотиками; инсулином или аналогами инсулина; глюкагоноподобным пептидом-1 (GLP-1) или дополнительным аналогом GLP-1; глюкагоноподобным пептидом-2 (GLP2) или аналогами GLP-2; ингибиторами дипептидилпептидазы-IV (DDP-IV); метформином; ингибиторами натрий-зависимого транспортера глюкозы-2 (SGLT-2); антагонистами рецептора глюкагона и/или антагонистом представителя 1 подсемейства V катионных каналов транзиторного рецепторного потенциала (TRPV1) и/или с одним или несколькими фармацевтически приемлемыми вспомогательными веществами.
Аналог GLP-1, такой как лираглутид, также можно применять в рамках комбинированной терапии с одним из химиотерапии, иммунотерапии, радиотерапии или их комбинации.
In vitro синтез
Альфа-дефензины млекопитающих, бета-дефензины млекопитающих, кателицидин и/или аналоги GLP-1 можно получать с помощью in vitro синтеза с применением традиционных способов, известных в данной области. На рынке доступны различные приборы для синтеза, например, автоматические синтезаторы от Applied Biosystems Inc., Beckman и т. д. С помощью синтезаторов встречающиеся в природе аминокислоты можно заменять аминокислотами не природного происхождения, в частности, D-изомерами (или D-формами) например, D-аланином и D-изолейцином, диастереоизомерами, аминокислотами с боковыми цепями, характеризующимися разной длиной или функциональными группами и т. д. Конкретная последовательность и способ получения будут определены с точки зрения удобства, экономических аспектов, требуемой чистоты и т. д.
Химическое связывание можно применять по отношению к различным пептидам или белкам, содержащим подходящие для связывания функциональные группы, такие как аминогруппы для образования амида или замещенного амина, например, восстановительное аминирование, тиольные группы для образования тиоэфира или дисульфида, карбоксильные групп для образования амида и т. д.
При необходимости в ходе синтеза или в ходе экспрессии в пептид могут быть включены различные группы, что обеспечивает возможность связывания с другими молекулами или на поверхности. Таким образом, остатки цистеина можно применять для получения тиоэфиров, остатки гистидина для связывания с комплексом ионов металлов, карбоксильные группы для образования амидов или сложных эфиров, аминогруппы для образования амидов и т.д.
Альфа-дефензины млекопитающих и бета-дефензины млекопитающих, кателицидин и/или аналоги GLP-1 или их функциональные эквиваленты можно также выделять и очищать в соответствии с традиционными способами синтеза на основе рекомбинантных технологий. Синтез на основе рекомбинантных технологий можно осуществлять с применением соответствующих векторов экспрессии и эукариотической системы экспрессии. Можно получать раствор клеток-хозяев, в которых происходит экспрессия, и среды и дефензинов, которые очищают с применением ВЭЖХ, эксклюзионной хроматографии, гель-электрофореза, аффинной хроматографии или другой методики очистки. Способы экспрессии рекомбинантных молекул бета-дефензина 2 человека в E. coli раскрыты в WO 2010/007166 (Novozymes).
Дозы
Альфа-дефензин млекопитающих, бета-дефензин млекопитающих, кателицидин и/или аналог GLP-1, как, например, альфа-дефензин человека, бета-дефензин человека, кателицидин и/или аналог GLP-1, такой как лираглутид, предпочтительно используют в фармацевтических композициях в количестве, которое является эффективным для лечения заболевания печени, нарушений со стороны желчных путей или поджелудочной железы или метаболических нарушений, предпочтительно с допустимой токсичностью для пациента. Альфа-дефензин млекопитающих, бета-дефензин млекопитающих, кателицидин млекопитающих и/или аналог GLP-1, как, например, альфа-дефензин человека, бета-дефензин человека, кателицидин человека и/или аналог GLP-1, также предпочтительно используют в фармацевтических композициях в количестве, которое является эффективным для лечения воспаления печени, желчных путей или поджелудочной железы, предпочтительно с допустимой токсичностью для нуждающихся в лечении пациента или животного.
Для таких вариантов лечения соответствующая доза, разумеется, будет варьироваться в зависимости, например, от химических свойств и имеющихся данных о фармакокинетике применяемого соединения, индивидуума, способа введения и причины и тяжести подлежащих лечению состояний.
В целом у млекопитающих, например, людей, назначенная суточная доза альфа-дефензина человека предпочтительно составляет от приблизительно 0,1 мг HD5/кг веса тела до приблизительно 10 мг HD5/кг веса тела, более предпочтительно от приблизительно 0,5 мг HD5/кг веса тела до приблизительно 10 мг HD5/кг веса тела; как, например, от 1 мг HD5/кг веса тела до 10 мг HD5/кг веса тела, более предпочтительно от приблизительно 1,2 мг HD5/кг веса тела до приблизительно 10 мг HD5/кг веса тела, предпочтительно от приблизительно 1,2 мг HD5/кг веса тела до приблизительно 5 мг HD5/кг веса тела, даже более предпочтительно 1,2 мг HD5/кг веса тела, например, вводимого в виде разделенных доз до одного, двух или трех раз в сутки. Подобные дозы можно применять для других альфа-дефензинов. Согласно некоторым вариантам осуществления альфа-дефензин вводят по меньшей мере два раза в сутки, как, например, три раза в сутки.
Согласно одному варианту осуществления назначенная суточная доза бета-дефензина человека предпочтительно составляет от приблизительно 0,1 мг hBD-2/кг веса тела до приблизительно 10 мг hBD-2/кг веса тела, более предпочтительно от приблизительно 0,5 мг hBD-2/кг веса тела до приблизительно 10 мг hBD-2/кг веса тела; как, например, от 1 мг hBD-2/кг веса тела до 10 мг hBD-2/кг веса тела, более предпочтительно от приблизительно 1,2 мг hBD-2/кг веса тела до приблизительно 10 мг hBD-2/кг веса тела, предпочтительно от приблизительно 1,2 мг hBD-2/кг веса тела до приблизительно 5 мг hBD-2/кг веса тела, даже более предпочтительно 1,2 мг hBD-2/кг веса тела, например, вводимого в виде разделенных доз до одного, двух или трех раз в сутки. Подобные дозы можно применять для других бета-дефензинов. Согласно некоторым вариантам осуществления бета-дефензин вводят по меньшей мере два раза в сутки, как, например, три раза в сутки. Согласно предпочтительным вариантам осуществления введение является пероральным.
Согласно одному варианту осуществления назначенная суточная доза кателицидина человека предпочтительно составляет от приблизительно 0,1 мг кателицидина/кг веса тела до приблизительно 10 мг кателицидина/кг веса тела, например, вводимого в виде разделенных доз до одного, двух или трех раз в сутки. Согласно некоторым вариантам осуществления кателицидин вводят по меньшей мере два раза в сутки, как, например, три раза в сутки. Согласно предпочтительным вариантам осуществления введение является пероральным.
Согласно одному варианту осуществления назначенная суточная доза аналога GLP-1, такого как лираглутид, предпочтительно составляет от приблизительно 0,6 мг аналога GLP-1 до приблизительно 3 мг аналога GLP-1 в сутки. Например, схема приема лираглутида может представлять собой 0,6 мг в сутки в течение одной недели, затем 1,2 мг в сутки в течение одной недели, затем 1,8 мг в сутки в течение одной недели, затем 2,4 мг в сутки в течение одной недели, затем 3 мг в сутки в течение одной недели или больше, как, например, в течение двух недель, как, например, трех недель, как, например, четырех недель или больше. Согласно предпочтительному варианту осуществления аналог GLP-1 вводят внутривенно, внутримышечно или подкожно.
Назначенная суточная доза альфа-дефензина человека вместе с бета-дефензином человека или кателицидином человека предпочтительно составляет от приблизительно 0,1 мг дефензина или кателицидина/кг веса тела до приблизительно 10 мг дефензина/кг веса тела, более предпочтительно от приблизительно 0,5 мг дефензина или кателицидина/кг веса тела до приблизительно 10 мг дефензина/кг веса тела; как, например, от 1 мг дефензина или кателицидина/кг веса тела до 10 мг дефензина или кателицидина/кг веса тела, более предпочтительно от приблизительно 1,2 мг дефензина или кателицидина/кг веса тела до приблизительно 10 мг дефензина/кг веса тела, предпочтительно от приблизительно 1,2 мг дефензина или кателицидина/кг веса тела до приблизительно 5 мг дефензина/кг веса тела, даже более предпочтительно 1,2 мг дефензина или кателицидина/кг веса тела, например, вводимых в виде разделенных доз до одного, двух или трех раз в сутки.
Если два разных дефензина вводят в одной дозе, то доза может содержать равные или примерно равные количества двух дефензинов, определенные по весу или в молях. Соотношение может также отличаться, так что соотношение альфа-дефензина и бета-дефензина варьируется от 10:1 до 1:10, как, например, от 5:1 до 1:5, например, от 2:1 до 1:2, определенные по весу или в молях.
Суточная доза может составлять 0,6 мг HD5/кг веса тела и 0,6 мг hBD-2/кг веса тела.
Согласно определенным вариантам осуществления фармацевтические композиции предпочтительных вариантов осуществления могут включать альфа-дефензин млекопитающих, и/или бета-дефензин млекопитающих, и/или кателицидин млекопитающих, как, например, альфа-дефензин человека, и/или бета-дефензин человека, и/или кателицидин человека в количестве от приблизительно 0,1 мг или меньше до приблизительно 1500 мг или больше на единичную лекарственную форму, как, например, от 0,5 мг или меньше до приблизительно 1500 мг или больше на единичную лекарственную форму, предпочтительно от приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8 или 0,9 мг до приблизительно 150, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900 или 1000 мг и более предпочтительно от приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20 или 25 мг до приблизительно 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 мг. Согласно определенным вариантам осуществления, однако, предпочтительными могут быть дозы, меньше или больше таковых, упомянутых выше. Специалист в данной области без труда сможет определить соответствующие концентрации и дозы. Согласно определенным вариантам осуществления фармацевтические композиции предпочтительных вариантов осуществления включают альфа-дефензин млекопитающих, такой как альфа-дефензин человека. Согласно другим вариантам осуществления фармацевтические композиции предпочтительных вариантов осуществления включают бета-дефензин млекопитающих, такой как бета-дефензин человека. Согласно дополнительным вариантам осуществления фармацевтические композиции предпочтительных вариантов осуществления включают альфа-дефензин млекопитающих и бета-дефензин млекопитающих, такой как альфа-дефензин человека и бета-дефензин человека, где альфа- и бета-дефензины находятся в равных количествах в молярной концентрации или мг/мл.
Согласно одному варианту осуществления альфа- и/или бета-дефензин млекопитающих и/или кателицидин вводят по меньшей мере один раз в сутки, как, например, по меньшей мере два раза в сутки, например, по меньшей мере 3 раза в сутки. Согласно одному варианту осуществления аналог GLP-1 вводят по меньшей мере один раз в сутки, как, например, по меньшей мере два раза в сутки, например, по меньшей мере 3 раза в сутки. Согласно одному варианту осуществления аналог GLP-1 вводят подкожно, внутривенно или внутримышечно.
Согласно другому варианту осуществления альфа- и/или бета-дефензин млекопитающих и/или кателицидин применяют в качестве биологически активной добавки к пище или напиткам.
Настоящее раскрытие дополнительно описано с помощью следующих примеров, которые не должны толковаться как ограничивающие объем настоящего изобретения.
Примеры
Пример 1. Предупреждение набора лишнего веса и повышение соотношения мышечной и жировой ткани, а также предупреждение накопления жира в печени с помощью дефензинов.
Материалы и способы
Мыши: Мышей поселяли по трое, 4 клетки на группу. Показатели потребления пищи регистрировали ежедневно непосредственно перед выключением света (18.00.). Отдельных мышей подвергали процедурам эксперимента в измененном порядке как в группе, так и в клетке. Мышей содержали при комнатной температуре с 12-часовым циклом дня и ночи в стандартных SPF-условиях.
Режимы питания: Для введения дозы средний вес оценивали в 25 граммов на мышь. Мыши съедали примерно 3 грамма корма на мышь в сутки.
Схема лечения: Мышей кормили с использованием либо диеты с высоким содержанием жиров (HFD), либо с использованием контрольной диеты с низким содержанием жиров (LF). HFD предусматривала 4 подгруппы; 1 hBD-2, 1 HD5, 1 hBD-2/HD5 и 1 стандартная HFD без добавления дефензинов. Концентрация дефензина составляла 1,2 мг hBD-2 на кг мыши в сутки. HD5 давали в концентрации, эквимолярной hBD-2. Группе комбинированной обработки давали 50% hBD-2 + 50% HD5, следовательно общее количество дефензинов эквивалентно таковому в остальных тестируемых группах.
Тесты: инсулинотолерантный тест (ITT), тест на стимулированную глюкозой секрецию инсулина (GSIS), пероральный глюкозотолерантный тест (OGTT) и определение уровня инсулина спустя пять часов голодания осуществляли в течение двух дней у 50% мышей на группу в сутки, избегая тем самым суточных отклонений как фактора, искажающего результаты.
Бактериологические анализы осуществляли для исследования микробиоты кишечника. Продолжительное исследование 16S проводили для 4 парных образцов от 60 мышей, в общей сложности для 240 образцов. У каждой мыши брали образец до изменения диеты, через 1 неделю после изменения диеты, через 4 недели после изменения диеты и по завершении диеты, что, таким образом, обеспечивает всестороннее определение характеристик фекальной микробиоты после лечения дефензином. Кроме того, по завершении диеты анализировали содержимое тонкого кишечника (с помощью 16S- или глубокого секвенирования), с получением в результате ценной информации о возможных изменениях в ключевом участке поглощения питательных веществ. Наконец, получали полный метаболомный профиль содержимого слепой кишки для обеспечения возможности интерпретации данных о бактериологических изменениях в контексте метаболизма всего организма. Также осуществляли подробный гистологический и иммуногистохимический анализ печени, двенадцатиперстной кишки, тощей кишки, подвздошной кишки и толстой кишки.
Пример 2. Предупреждение набора лишнего веса и повышение соотношения мышечной и жировой ткани, а также предупреждение накопления жира в печени с помощью дефензинов.
Материалы и способы
Мыши: Мышей поселяли по трое, 4 клетки на группу. Показатели потребления пищи регистрировали ежедневно непосредственно перед выключением света (18.00.). Отдельных мышей подвергали процедурам эксперимента в измененном порядке как в группе, так и в клетке. Мышей содержали при комнатной температуре с 12-часовым циклом дня и ночи в стандартных SPF-условиях.
Режимы питания: Для введения дозы средний вес оценивали в 25 граммов на мышь. Мыши съедали примерно 3 грамма корма на мышь в сутки.
Схема лечения: Мышей кормили с использованием либо диеты с высоким содержанием жиров (HFD), либо с использованием контрольной диеты с низким содержанием жиров (LF). HFD предусматривала 3 подгруппы; 1 hBD-2, 1 HD5 и 1 стандартная HFD без добавления дефензинов. Концентрация дефензина составляла 1,2 мг hBD-2 на кг мыши в сутки. HD5 давали в концентрации, эквимолярной hBD-2. Тесты: инсулинотолерантный тест (ITT), тест на стимулированную глюкозой секрецию инсулина (GSIS), пероральный глюкозотолерантный тест (OGTT) и определение уровня инсулина спустя пять часов голодания осуществляли в течение двух дней у 50% мышей на группу в сутки, избегая тем самым суточных отклонений как фактора, искажающего результаты.
Результаты (примеры 1 и 2)
В группах HFD по завершении диеты у мышей, которых лечили альфа-, бета- и альфа- и бета-дефензинами, наблюдали менее выраженный набор лишнего веса, более высокое соотношение мышечной и жировой ткани, а также менее выраженное накопление жира в печени, по сравнению с мышами, которых не подвергали обработке.
Изменение веса. При том, что потребление пищи было одинаковым во всех трех экспериментальных группах на определенной диете, мыши обоих групп на диете с высоким содержанием жиров (HFD) значительно больше набирали лишний вес по сравнению с мышами эталонной группы на диете с низким содержанием жиров (LFD) в течение 10-недельного периода исследования (*p<0,0001, двухфакторный дисперсионный анализ, апостериорный критерий Тьюки). Мыши группы HFD плюс hBD-2, однако, набирали значительно меньше веса по сравнению с эталонной группой HFD (*p = 0,0028) (фиг. 7 и 10A).
Динамика набора массы безжировой/жировой ткани. Масса безжировой/жировой ткани была одинаково распределена между тремя экспериментальными группами на начальном этапе исследования. В конце исследования мыши обоих групп HFD набрали одинаковую массу безжировой ткани, которая была значительно выше, чем в группе LFD (*p<0,0001, однофакторный дисперсионный анализ, апостериорный критерий Тьюки), вероятно, вследствие увеличенной массы тела. В конце исследования в группе HFD плюс hBD-2 наблюдали тенденцию к увеличению массы жировой ткани по сравнению с группой LFD. Однако оно не было статистически значимым (*p=0,25). Мыши группы HFD набрали почти в четыре раза больше массы жировой ткани по сравнению с мышами группы LFD и в 2 раза больше массы жировой ткани по сравнению с группой HFD плюс hBD-2 (*p<0,0001 и *p=0,005 соответственно) (фиг. 8A).
Инсулинотолерантный тест. Мыши как группы LFD, так и группы HFD плюс hBD-2 были значительно более чувствительными к инсулину по сравнению с мышами группы HFD (p< 0,05) (фиг. 9A и 13A).
Глюкозотолерантный тест. В группе HFD наблюдали нарушение толерантности к глюкозе с продленным выведением глюкозы начиная с максимального уровня через 15 мин. до полувыведения через 120 мин. В группе LFD наблюдали быстрое выведение глюкозы начиная с максимального уровня через 15 мин. В группе HFD плюс hBD-2 наблюдали незначительно продленное выведение глюкозы, но при этом достигались значительно более низкие уровни глюкозы, чем в группе HFD (p<0,05) (фиг. 9B и 12A).
Тест на стимулированную глюкозой секрецию инсулина. В группе HFD наблюдали нарушение гомеостаза глюкозы со значительно более высокой и устойчивой концентрацией инсулина после введения глюкозы (p<0,05). В группе LFD практически отсутствовало повышение концентрации инсулина после стимуляции глюкозой. В группе HFD плюс hBD-2 наблюдали более высокую, но не значительно отличающуюся концентрацию инсулина по сравнению с группой LFD (фиг. 12B и 9B).
Определение уровня инсулина спустя пять часов голодания. В группе HFD наблюдали тяжелые симптомы диабета со значительно более высоким уровнем инсулина натощак по сравнению с LFD (*p = 0,0004) и граничным значительно более высоким уровнем инсулина натощак по сравнению с группой HFD плюс hBD-2 (*p = 0,057). Значимое различие между группами LFD и HFD плюс hBD-2 отсутствовало (*p = 0,17) (фиг. 9D).
*Апостериорный критерий Тьюки, в других случаях апостериорный критерий Даннетта.
Гомеостатическая модель оценки (HOMA-IR) для оценки функции β-клеток и инсулинорезистентности. HOMA-IR для группы HFD плюс hBD-2 был значительно ниже по сравнению с группой HFD, что указывает на сохранившуюся функцию β-клеток и ограниченную инсулинорезистентность (фиг. 13B).
Печеночный метаболизм. Экспрессия активируемого пролифератором пероксисом гамма-рецептора 2 (PPARγ2) в печени индуцирует стеатоз печени, и, как было обнаружено, уровень его экспрессии повышен в контрольной группе, которую кормили с использованием HFD (*p < 0,001). HFD плюс hBD-2 обуславливали значительно более низкий уровень экспрессии PPARγ2 (*p = 0,03), что, как ожидается, коррелирует со сниженным накоплением жира, тем самым потенциально защищая от стеатоза печени (фиг. 14A). Значимое различие в массе печени между группой HFD плюс hBD-2 и группой HFD отсутствовало; обе группы характеризовались значительным увеличением массы печени по сравнению с мышами на LFD (фиг. 11B). Однако значение eWAT в группе HFD плюс hBD-2 было значительно ниже, чем в группе HFD (фиг. 11C).
Выводы касательно hBD-2 как средства предупреждения развития набора лишнего веса, ожирения и накопления жира в печени у мышей, которых кормили с использованием диеты с высоким содержанием жиров:
50% мышей, которых кормили с использованием HFD-hBD-2, характеризовались процентным содержанием жира в организме, сходным таковому у эталонных мышей на LFD, несмотря на то, что их кормили с использованием 60% HFD. Несколько мышей характеризовались % содержанием жира, даже более низким, чем у эталонным мышей на LFD с наиболее низкими показателями.
Неожиданно, наиболее защищенные мыши, которым давали hBD-2, характеризовались одинаковой или меньшей массой висцерального жира по сравнению с эталонными мышами на LFD, что является весьма необычным в случае 60% HFD.
Повышенная чувствительность к инсулину. Показатели у мышей, которым давали hBD-2, значительно не отличались от таковых у эталонных мышей на LFD. Результаты как инсулинотолерантного теста, так и HOMA-IR указывали на усиление передачи сигнала с участием инсулина.
Толерантность к глюкозе была заметно повышена по сравнению с контрольными мышами на HFD. Важно отметить, что как толерантность к глюкозе, так и стимулированная глюкозой инсулиновая реакция в ходе глюкозной нагрузки повышались. Таким образом, организму мышей, которым давали hBD-2, требовалось меньшее количество инсулина для лучшей переработки болюсной дозы глюкозы, чем контрольным мышам на HFD.
Содержание эпидидимального жира снижалось у мышей на HFD плюс hBD-2 по сравнению с контрольными мышами на HFD. HFD плюс hBD-2 обуславливали значительно более низкий уровень экспрессии PPARγ2, что указывает на сниженное накопление жира.
HD-5 для предупреждения набора лишнего веса и повышения соотношения мышечной и жировой ткани, а также предупреждения накопления жира в печени:
Изменение веса. Все группы, которые кормили с использованием HFD, характеризовались одинаковым потреблением пищи в ходе периода исследования и равным набором лишнего веса в ходе подготовительного периода13 недель (фиг. 20A).
Глюкозотолерантный тест. Толерантность к глюкозе в случае животных, которых лечили с использованием HFD+HD5, и в случае мышей на HFD была выше, чем в случае мышей на LFD (фиг. 22A).
Инсулинотолерантный тест. Мыши группы LFD были значительно более чувствительными к инсулину, чем мыши групп, которые кормили с использованием HFD (фиг. 23A).
Тест на стимулированную глюкозой секрецию инсулина. В группах HFD наблюдали нарушение гомеостаза глюкозы со значительно более высокой и устойчивой концентрацией инсулина после введения глюкозы (p<0,05). В группе LFD практически отсутствовало повышение концентрации инсулина после стимуляции глюкозой (фиг. 22B).
Гомеостатическая модель оценки (HOMA-IR) для оценки функции β-клеток и инсулинорезистентности. HOMA-IR в случае группы HFD плюс HD-5 не был значительно ниже, чем в случае группы HFD (фиг. 23B).
Печеночный метаболизм. Уровень экспрессии активируемого пролифератором пероксисом гамма-рецептора 2 (PPARγ2) в печени повышен в группах, которые кормили с использованием HFD, по сравнению с контролем LFD (*p < 0,001), без защитного эффекта HD-5 в отношении HFD (фиг. 24A). Уровень экспрессии пероксисомальной ацил-кофермент A-оксидазы 1 (Acox1) в печени значительно повышен в группе HFD плюс HD-5 по сравнению с контрольной группой LFD (*p = 0,0009), и наблюдается граничное значимое различие между контролем HFD и группой HFD плюс HD-5 (*p = 0,07, однофакторный дисперсионный анализ), что указывает на более высокий уровень окисления жирных кислот, обусловленный HD-5 (фиг. 24B).
Выводы касательно HD5 как средства предупреждения развития набора лишнего веса, ожирения и накопления жира в печени у мышей, которых кормили с использованием диеты с высоким содержанием жиров:
Мыши, которым давали HD5, характеризовались гранично меньшим содержанием висцерального жира по сравнению с контрольными мышами, которых кормили с использованием HFD.
Повышение толерантности к глюкозе отсутствовало, что указывает на отличия в механизмах действия hBD-2 и HD5.
Печеночный метаболизм. В то время как hBD-2 обеспечивал значительное снижение уровня экспрессии PPARγ2, обеспечивая тем самым защиту от развития стеатоза печени, HD5 обеспечивал значительное повышение уровня экспрессии Acox1 и, следовательно, метаболизма жирных кислот. Эти изменения в экспрессии ферментов печени различаются и являются потенциально синергическими, поскольку оба они потенциально способствуют предупреждению накопления жира в печени.
Пример 3. Лечение накопления жира при стеатогепатите с помощью дефензинов.
Материалы и способы
Мыши: Мышей поселяли по трое, 4 клетки на группу. Показатели потребления пищи регистрировали 3 раза в неделю. Отдельных мышей подвергали процедурам эксперимента в измененном порядке как в группе, так и в клетке. Мышей содержали при комнатной температуре в стандартных SPF-условиях.
Режимы питания: Для введения дозы средний вес оценивали в 25 граммов на мышь. Мыши съедали примерно 3 грамма корма на мышь в сутки.
Схема лечения: Мышей кормили с использованием диеты с высоким содержанием жиров (HFD) в течение двенадцати недель. Вес мышей удваивался на протяжении этих двенадцати недель до примерно 50 граммов. Мышей распределяли в четыре подгруппы; 1 hBD-2, 1 HD5, 1 hBD-2/HD5 и 1 стандартная HFD без добавления дефензинов. Концентрация дефензина составляла 1,2 мг hBD-2 на кг мыши в сутки. HD5 давали в концентрации, эквимолярной hBD-2. Группе комбинированной обработки давали 50% hBD-2 + 50% HD5, следовательно общее количество дефензинов эквивалентно таковому в остальных тестируемых группах.
Тесты: инсулинотолерантный тест (ITT), тест на стимулированную глюкозой секрецию инсулина (GSIS) и пероральный глюкозотолерантный тест (OGTT) осуществляли в течение двух дней у 50% мышей на группу в сутки, избегая тем самым суточных отклонений как фактора, искажающего результаты.
Бактериологические анализы осуществляли для исследования микробиоты кишечника. Продолжительное исследование 16S проводили для 4 парных образцов от 60 мышей, в общей сложности для 240 образцов. У каждой мыши брали образец до лечения дефензином, через 1 неделю после начала лечения дефензином, через 4 недели после начала лечения дефензином и по завершении диеты, что, таким образом, обеспечивает всестороннее определение характеристик фекальной микробиоты после лечения дефензином. Кроме того, по завершении диеты анализировали содержимое тонкого кишечника (с помощью 16S- или глубокого секвенирования), с получением в результате ценной информации о возможных изменениях в ключевом участке поглощения питательных веществ. Наконец, получали полный метаболомный профиль содержимого слепой кишки для обеспечения возможности интерпретации данных о бактериологических изменениях в контексте метаболизма всего организма. Также осуществляли подробный гистологический и иммуногистохимический анализ печени, двенадцатиперстной кишки, тощей кишки, подвздошной кишки и толстой кишки.
Результаты
В случае групп, получающих лечение дефензином, по завершении диеты у мышей, которых лечили альфа-, бета- и альфа- и бета-дефензинами, наблюдали приведение в норму динамики накопления жира в печени, потерю веса, повышенное соотношение мышечной и жировой ткани и приведенные в норму метаболические показатели, такие как показатели по результатам инсулинотолерантного теста (ITT), теста на стимулированную глюкозой секрецию инсулина (GSIS) и перорального глюкозотолерантного теста (OGTT), по сравнению с мышами на HFD, которых не подвергали лечению.
Пример 4. Лечение набора лишнего веса, ожирения и накопления жира при стеатогепатите с помощью дефензинов.
Материалы и способы
Мыши: Мышей поселяли по трое, 4 клетки на группу. Показатели потребления пищи регистрировали 3 раза в неделю. Отдельных мышей подвергали процедурам эксперимента в измененном порядке как в группе, так и в клетке. Мышей содержали при комнатной температуре в стандартных SPF-условиях.
Режимы питания: Для введения дозы средний вес оценивали в 25 граммов на мышь. Мыши съедали примерно 3 грамма корма на мышь в сутки.
Схема лечения: Мышей кормили с использованием диеты с высоким содержанием жиров (HFD) в течение двенадцати недель. Вес мышей удваивался на протяжении этих двенадцати недель до примерно 50 граммов. Мышей распределяли в три подгруппы; 1 hBD-2, 1 HD5 и 1 стандартная HFD без добавления дефензинов. Концентрация дефензина составляла 1,2 мг hBD-2 на кг мыши в сутки. HD5 давали в концентрации, эквимолярной hBD-2.
Тесты: инсулинотолерантный тест (ITT), тест на стимулированную глюкозой секрецию инсулина (GSIS) и пероральный глюкозотолерантный тест (OGTT) осуществляли в течение двух дней у 50% мышей на группу в сутки, избегая тем самым суточных отклонений как фактора, искажающего результаты.
Результаты
Изменение веса. Группы, которые кормили с использованием стандартной диеты с высоким содержанием жиров (HFD), характеризовались одинаковым потреблением пищи на протяжении всего периода исследования и характеризовались подобной динамикой набора веса с одинаковыми показателями массы жировой и безжировой ткани первые 13 недель, имея, таким образом, одинаковые исходные позиции до начала диетической терапии. Набор лишнего веса был значительно большим, чем в группе, которую кормили с использованием диеты с низким содержанием жиров (LFD) (*p<0,05, двухфакторный дисперсионный анализ) (фиг. 15A). После диетической терапии в группах HFD наблюдали продолжение повышения веса, в то же время в группе HFD плюс hBD-2 наблюдали тенденцию к набору меньшего веса в первые 4 недели после диетической терапии, однако не являющуюся значимой (*p=0,07, двухфакторный дисперсионный анализ). Начиная с недели 4 и до окончания периода исследования группа HFD плюс hBD-2 набрала такой же вес, что и группа стандартной HFD (*p=0,82, двухфакторный дисперсионный анализ) (фиг. 15B).
Процентная доля жира. Процентная доля жира от общего веса тела на начало периода исследования среди трех экспериментальных групп была одинаковой. На момент начала диетической терапии процентная доля жира в двух группах, которые кормили с использованием HFD, была одинаковой, и в обоих случаях была значительно больше, чем в группе, которую кормили с использованием LFD, с сохранением тенденции на протяжении 10 недель после начала диетической терапии (*p<0,05, двухфакторный дисперсионный анализ) (фиг. 16A). К неделе 4 после начала диетической терапии у ~75% мышей группы HFD плюс hBD-2 наблюдали меньшую процентную долю жира, чем до терапии, что кардинально отличалось от группы стандартной HFD, в которой у всех мышей наблюдали повышенные значения процентной доли жира. (Фиг. 16B) Изменение процентной доли жира было значительно меньшим в группе HFD плюс hBD-2, чем в группе стандартной HFD в данный момент времени. (*p=0,003 двухфакторный дисперсионный анализ). Вес печени по завершении диеты был значительно больше в группах, которые кормили с использованием HFD, по сравнению с группой LFD (*p<0,05, однофакторный дисперсионный анализ) (фиг. 17A). Количество висцерального жира (eWAT) по завершении диеты также было большим в группах HFD по сравнению с LFD (*p<0,05, однофакторный дисперсионный анализ). Значимое различие в количестве висцерального жира (eWAT) между группами, которые кормили с использованием HFD, отсутствовало (фиг. 17B).
Глюкозотолерантный тест. Толерантность к глюкозе стремительно повышалась с момента начала диетической терапии в группе HFD плюс hBD-2, в которой наблюдали меньший максимальный уровень глюкозы в крови, а также более быстрое выведение глюкозы уже спустя 2 недели (фиг. 18A). Было обнаружено, что у мыши с наиболее выраженным нарушением толерантности к глюкозе в исследовании показатели существенно улучшались в первые две недели после перехода со стандартной HFD на HFD плюс hBD-2 (фиг. 18B).
Инсулинотолерантный тест. Мыши группы LFD были значительно более чувствительными к инсулину по сравнению с мышами обоих групп HFD (*p<0,05, двухфакторный дисперсионный анализ). Мыши группы HFD плюс hBD-2 были в то же время более чувствительными к инсулину по сравнению с мышами контрольной группы HFD, что свидетельствует о повышении толерантности к инсулину после диетической терапии (*p<0,05, двухфакторный дисперсионный анализ) (фиг. 18C).
Печеночный метаболизм. Уровень экспрессии пероксисомальной ацил-кофермент A-оксидазы 1 (Acox1) в печени был значительно повышен в группе HFD плюс hBD-2 по сравнению с контрольной группой LFD (*p = 0,0027), что указывает на более высокий уровень окисления жирных кислот благодаря диетической терапии с использованием hBD-2 (фиг. 19). Вес печени и вес eWAT значительно не отличались между контрольной группой HFD и группой HFD плюс hBD-2 (фиг. 17).
Выводы касательно hBD-2 как средства для лечения набора лишнего веса, ожирения и накопления жира в печени у мышей, которых кормили с использованием диеты с высоким содержанием жиров:
- В целом мыши, которым давали hBD-2, набрали меньше веса в первые 4 недели терапии по сравнению с контрольными мышами на HFD (фиг. 15A).
- У 7/8 мышей с ожирением и нарушением толерантности к глюкозе наблюдали значительное повышение толерантности к глюкозе спустя всего 2 недели терапии (фиг. 18A). Одна мышь представляла собой мышь с наиболее выраженным нарушением толерантности к глюкозе на исходном уровне с массой жировой ткани примерно 20 граммов от общего веса тела 50 граммов. Несмотря на фенотип, соответствующий тяжелой патологии, у мыши наблюдалось полное восстановление в контексте нарушения толерантности к глюкозе за 2 недели терапии (фиг. 18B).
- На уровне целого организма у мышей, которым давали hBD-2, наблюдали менее выраженную инсулинорезистентность по сравнению с контрольными мышами на HFD (фиг. 18C). Это является ключевым моментом, поскольку тяжелая системная инсулинорезистентность исключительно сложно поддается обращению и является основным ограничением в лечении заболеваний человека (например, среди прочего, сахарного диабета, форм CVD, определенных злокачественных опухолей).
- У мышей, которым давали hBD-2, наблюдали повышенный уровень окисления жирных кислот в печени (фиг. 19).
HD-5 как средство для лечения набора лишнего веса, ожирения и накопления жира в печени у мышей, которых кормили с использованием диеты с высоким содержанием жиров:
Изменение веса. Все группы, которые кормили с использованием HFD, характеризовались одинаковым потреблением пищи в ходе периода исследования и равным набором лишнего веса в ходе подготовительного периода13 недель (фиг. 25A). После диетической терапии мыши группы, которую кормили с использованием HFD плюс HD-5, набирали значительно меньше веса по сравнению с контролем HFD (*p<0,05, двухфакторный дисперсионный анализ) (фиг. 25B). Кроме того, наблюдалась тенденция к уменьшению процентной доли жира в группе HFD плюс HD-5 (фиг. 26A), и спустя 4 недели после изменения диеты измеряли значительно меньшую процентную долю жира в группе HFD плюс HD-5 по сравнению с контролем HFD (*p=0,009, двухфакторный дисперсионный анализ) (фиг. 26B). Вес печени по завершении диеты снижался в группе, которую кормили с использованием HFD плюс HD-5, по сравнению с контрольной HFD. В частности, у ~50% мышей, которых кормили с использованием стандартной HFD, наблюдали более высокие показатели по сравнению с таковыми у мыши, которую кормили с использованием HFD плюс HD-5, с наиболее высокими показателями (фиг. 27A). Вес висцерального жира был больше в группах, которые кормили с использованием HFD, по сравнению с группой, которую кормили с использованием LFD. (*р<0,05, однофакторный дисперсионный анализ) (фиг. 27B).
Глюкозотолерантный тест. Толерантность к глюкозе в случае животных, которых лечили с использованием HFD+HD5, в репрезентативной клетке, клетке 2, повышалась на протяжении периода времени от начала терапии (неделя 13-0) до недели 13.8 (фиг. 28A)
Инсулинотолерантный тест. Мыши группы LFD были значительно более чувствительными к инсулину, чем мыши групп, которые кормили с использованием HFD (*p<0,05, двухфакторный дисперсионный анализ). Мыши группы HFD плюс HD-5 были более чувствительными к инсулину по сравнению с мышами контрольной группы HFD, что свидетельствует о повышении толерантности к инсулину после диетической терапии (*p<0,05, двухфакторный дисперсионный анализ) (фиг. 28B).
Печеночный метаболизм. Уровень экспрессии пероксисомальной ацил-кофермент A-оксидазы 1 (Acox1) в печени был практически одинаковым во всех трех группах (фиг. 29B), тогда как уровень экспрессии PPARγ2 был значительно выше в обоих группах HFD по сравнению с группой LFD (фиг. 29A).
Выводы касательно HD5 как средства для лечения набора лишнего веса, ожирения и накопления жира в печени у мышей, которых кормили с использованием диеты с высоким содержанием жиров:
Мыши, которым давали HD5, характеризовались значительно сниженным изменением веса по сравнению с контрольными мышами, которых кормили с использованием HFD (фиг. 25B).
- Имела место общая тенденция к снижению массы жировой ткани мышей с ожирением, которых кормили с использованием HFD-HD5 (фиг. 26A и B).
- Масса печени снижалась у мышей, которым давали HD5, по сравнению с контрольными мышами, которых кормили с использованием HFD (фиг. 27A). Поскольку висцеральные и подкожные отложения значительно не отличались (фиг. 27B), такое наблюдение указывает на то, что умеренно сниженный % содержания жира у мышей, которым давали HD5, ограничивается расщеплением жиров в печени/окислением липидов.
- Толерантность к глюкозе у мышей, которым давали HD5, со временем повышалась (фиг. 28A).
- У мышей, которым давали HD5, наблюдали менее выраженную инсулинорезистентность по сравнению с контрольными мышами, которых кормили с использованием HFD (фиг. 28b).
Важно отметить, что поглощение жира в составе диеты значительно не отличалось между мышами на HFD, мышами на HFD плюс hBD-2 и мышами на HFD плюс HD-5 (фиг. 30A), что согласовывается с наблюдением, что содержание жира в фекалиях во всех трех группах также было практически одинаковым (фиг. 30B).
Пример 5. Лечение набора лишнего веса, ожирения и накопления жира в печени у мышей, которых кормили с использованием диеты с высоким содержанием жиров, с помощью аналога глюкагоноподобного пептида-1 (GLP-1) (лираглутид).
Материалы и способы.
Мыши: Самцов мышей C57Bl/6J DIO 4-недельного возраста кормили с использованием диеты с высоким содержанием жиров (HFD с 60% содержанием жира, SSNIFF (диета №D12492)) или кормом purina в течение 36 недель. У мышей группы, которую кормили с использованием HFD, средний вес достигал примерно 55 граммов от начала терапии. Мышей поселяли группами по 10 на клетку до наступления недели -2. Начиная с недели -2 мышей поселяли по одной в течение всего периода исследования. Показатели потребления пищи регистрировали ежедневно непосредственно перед выключением света (15.00.). Отдельных мышей подвергали процедурам эксперимента в измененном порядке как в группе, так и в клетке. Мышей содержали при комнатной температуре с 12-часовым циклом дня и ночи в стандартных SPF-условиях.
Схема лечения: Мышей кормили с использованием либо диеты с высоким содержанием жиров (HFD), либо с использованием контрольной диеты с низким содержанием жиров (LF). HFD предусматривала 2 подгруппы; 1 с аналогом GLP-1 и 1 стандартная HFD без добавления аналога GLP-1. Аналог GLP-1 лираглутид растворяли в PBS и добавляли 0,1% BSA. Аналог GLP-1 вводили в дозе 0,2 мг/кг BID подкожно. Результаты.
Было обнаружено, что аналог GLP-1 оказывает эффект в виде снижения веса, так как мыши, которых лечили аналогом GLP-1, теряли 25-30% веса тела или в среднем 15 граммов по сравнению с эталонной группой мышей на HFD, которых не подвергали лечению (фиг. 32).
Аналог GLP-1 также, вероятно, обеспечивал снижение накопление жира в печени, так как вес печени в граммах по завершении диеты в группе мышей, которых лечили аналогом GLP-1, не характеризовался статистически значимой разницей (p<0,001) с весом печени в группе мышей, которых кормили кормом (фиг. 33).
В соответствии с такими эффектами уровень холестерина в плазме крови, со статистической значимостью, был ниже в группе мышей, которых лечили аналогом GLP-1, (p<0,01) по сравнению с эталонной группой мышей на HFD (фиг. 34).
Пример 6. Фармакокинетическое исследование для определения биодоступности при пероральном введении и установления фармакокинетического профиля hBD-2 после однократного введения через желудочный зонд 4 мг/кг мышам NMRI.
Материалы и способы
Схема обработки: 21 самке мышей NMRI через желудочный зонд вводили дозу 5 мл/кг с применением желудочного зонда и шприца на 1 мл в соответствии с индивидуальными показателями веса тела, полученными в день введения дозы. Образцы мочи получали в случайные моменты времени путем аккуратного массирования паховой области живота. Первый образец крови брали с применением подчелюстного способа забора образцов. Второй образец крови собирали от мышей, получивших анестезию с использованием изофлурана. Образцы кишечника брали после умерщвления. У каждой мыши проводили вскрытие брюшной полости и в качестве образцов брали три секции отделов кишечника.
Результаты
hBD-2 по всей видимости не всасывался в здоровом кишечнике, поскольку hBD-2 не возможно было выявить с помощью ВЭЖХ ни в одном из образцов сыворотки крови или мочи, так как все значения были ниже предела выявления < 10 пг/мл. Это указывает на то, что hBD-2 не является системно доступным после перорального введения мышам дозы 4 мг/кг (фиг. 35).
Пример 7. Фармакокинетические профили hBD-2, слитого с C-концом (молекулярная масса 71,336 Да) или N-концом (молекулярная масса 71,666 Да) сывороточного альбумина человека после подкожного или внутривенного введения молярного эквивалента 1 мг/кг hBD-2 (молекулярная масса 66437 Да) самкам мышей NMRI.
Материалы и способы
Схема обработки: Животным вводили дозу 10 мл/кг исходной концентрации 1,65 мг/мл в соответствии с индивидуальными показателями веса тела (300 мкл для мыши весом 30 граммов). Первый образец крови брали с применением подчелюстного способа забора образцов, а второй образец брали после анестезии с использованием изофлурана и умерщвления.
Результаты
Было показано, что период полувыведения hBD-2 составляет 1 час, а период полувыведения двух слитых белков составляет 12 часов. AUC подвергался кардинальному изменению. Показатели почечного клиренса также изменялись от 10 мл/мин для hBD-2 до 0,5-2,2 мл/мин для двух слитых молекул (фигуры 36, 37 и 38).
В примере продемонстрировано, что период полувыведения hBD-2 может быть заметно увеличен с помощью C- или N-концевого конъюгирования с альбумином.
Пример 8. Противовоспалительный эффект «продукта N-концевого слияния hBD-2 и альбумина» в модели индуцированного декстраном сульфата натрия (DSS) в течение 10 дней острого колита у мышей.
Материалы и способы
Схема обработки: «Продукт N-концевого слияния hBD-2 и альбумина» вводили внутривенно в хвостовую вену или подкожно с применение стерильной иглы 25G в объеме вводимой дозы 10 мл/кг веса тела. Животные получали 1 дозу в сутки в течение 10 рабочих дней. Дексаметазон (DEX) в качестве активного контроля вводили подкожно в дозе 1 мг/кг в объеме вводимой дозы 10 мл/кг веса тела OD.
Результаты
Обработка «продуктом N-концевого слияния hBD-2 и альбумина» обуславливала значимое ингибирование индекса активности заболевания (DAI) при введении ежесуточно в дозе 1,65 мг/кг внутривенным путем (p<0,05). Кроме того, в день 10 значимое ингибирование показателя DAI также наблюдали при введении «продукта N-концевого слияния hBD-2 и альбумина» ежесуточно соответственно в дозе 1,65 мг/кг и в дозе 125 мг/кг подкожно (p<0,05).
Введение декстрана сульфата натрия обуславливало значимое воспаление и поражение ткани толстой кишки, о чем свидетельствовали данные гистологического исследования. Обработка «продуктом N-концевого слияния hBD-2 и альбумина» не обуславливала какое-либо статистически значимое снижение степени гистологического повреждения, однако аналогичным образом DEX в качестве активного контроля не смог обеспечить значительное снижение степени гистологического поражения.
Из результатов также видно значимое повышение веса тела в день 7 у животных, которых обрабатывали «продуктом N-концевого слияния hBD-2 и альбумина» несмотря на временное уменьшение веса тела в дни 2 и 3, что указывает на то, что «продукт N-концевого слияния hBD-2 и альбумина» оказывает выраженный эффект в отношении сохранения веса в DSS-модели на мышах, которая обычно ассоциирована с существенной потерей веса. В отличие от этого, DEX-обработанные животные характеризовались снижением веса тела начиная с дня 5 и далее с высоким уровнем значимости (p<0,01).
В примере продемонстрировано, что продукт N-концевого слияния hBD-2 и альбумина является биологически активным в животной модели воспалительного состояния (фиг. 39).
Пример 9. Противовоспалительный эффект «продукта C-концевого слияния hBD-2 и альбумина» в модели индуцированного декстраном сульфата натрия (DSS) в течение 10 дней острого колита у мышей.
Материалы и способы
Схема обработки: «Продукт C-концевого слияния hBD-2 и альбумина» вводили внутривенно в хвостовую вену или подкожно с применение стерильной иглы 25G в объеме вводимой дозы 10 мл/кг веса тела. Животные получали 1 дозу в сутки в течение 10 рабочих дней. Преднизолон (Pred) в качестве активного контроля вводили через желудочный зонд в дозе 1 мг/кг в объеме вводимой дозы 10 мл/кг веса тела OD.
Результаты
Обработка «продуктом C-концевого слияния hBD-2 и альбумина» обуславливала значимое ингибирование DAI при введении ежесуточно в дозе 1,6 мг/кг внутривенным путем (p<0,05). Кроме того, «продукт C-концевого слияния hBD-2 и альбумина» обуславливал значимое ингибирование DAI при введении через день, в дни 0, 2, 4, 6, 8 и 10, в дозе 1,6 мг/кг внутривенным путем (p<0,05). Ежесуточная обработка Pred обуславливала значимое ингибирование DAI в день 9 (p<0,05).
Введение декстрана сульфата натрия обуславливало значимое воспаление и поражение ткани толстой кишки, о чем свидетельствовали данные гистологического исследования. Обработка «продуктом C-концевого слияния hBD-2 и альбумина» в дозе 1,6 мг/кг обуславливала статистически значимое снижение степени такого гистологического повреждения (p<0,05). Аналогичным образом, ежесуточная обработка «продуктом C-концевого слияния hBD-2 и альбумина» в дозе 1,6 мг/кг и 16,5 мг/кг в дни 0, 2, 4, 6, 8 и 10 обуславливала значимое снижение степени гистологического повреждения толстой кишки (p<0,01). Обработка Pred в качестве активного контроля не смогла обеспечить значительное снижение степени гистологического поражения в проксимальной части толстой кишки, но обеспечила снижение степени поражения в дистальных отделах толстой кишки (p<0,01).
Из результатов также видно значимое повышение веса тела у животных, обработанных «продуктом C-концевого слияния hBD-2 и альбумина» (p<0,05), что указывает на наличие эффекта «продукта C-концевого слияния hBD-2 и альбумина» в отношении сохранения веса.
В примере продемонстрировано, что продукт C-концевого слияния hBD-2 и альбумина является биологически активным в животной модели воспалительного состояния.
Пример 10. Последовательности.
Список литературы
Ajslev TA, et al, 2014. Trends in parent-child correlations of childhood body mass index during the development of the obesity epidemic. PLoS One 9(10).
Angelakis E and Raoult D, 2010. The increase of Lactobacillus species in the gut flora of newborn broiler chicks and ducks is associated with weight gain. PLoS One 5(5).
Angelakis E., et al 2012. An evaluation of the effects of Lactobacillus ingluviei on body weight, the intestinal microbiome and metabolism in mice. Microb Pathog 52(1):61-8.
Armogida SA, et al, 2004. Identification and quantification of innate immune system mediators in human breast milk. Allergy Asthma Proc. 25(5):297-304.
Bäckhed F, et al, 2007. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice. Proc Natl Acad Sci USA 104(3):979-84.
Belkaid W and Hand TW, 2014. Role of the microbiota in immunity and inflammation. Cell 157(1):121-41.
Bowie JU and Sauer RT, 1989. Identifying determinants of folding and activity for a protein of unknown structure. Proc. Natl. Acad. Sci. USA 86: 2152-2156;
Chassaing B, et al, 2015. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature 519(7541):92-6.
Cunningham BC and Wells JA, 1989. High-resolution epitope mapping of hGH-receptor interactions by alanine-scanning mutagenesis. Science 244: 1081-1085.
Derbyshire KM, Salvo JJ and Grindley ND, 1986. A simple and efficient procedure for saturation mutagenesis using mixed oligodeoxynucleotides. Gene 46:145-152.
Everard A and Cani PD, 2013. Diabetes, obesity and gut microbiota. Best Pract Res Clin Gastroenterol 27(1):73-83.
Faulds MH and Dahlman-Wright K, 2012. Metabolic diseases and cancer risk. Curr Opin Oncol. 24(1):58-61.
Favre-Godal Q, et al, 2014. Comprehensive approach for the detection of antifungal compounds using a susceptible strain of Candida albicans and confirmation of in vivo activity with the Galleria mellonella model. Phytochemistry. 105: 68-78.
Feng Q, et al, 2015. Gut microbiome development along the colorectal adenoma-carcinoma sequence. Nat Commun 6:6528.
Giannouli M, et al. Use of larvae of the wax moth Galleria mellonella as an in vivo model to study the virulence of Helicobacter pylori. 2014. BMC Microbiol14: 228.
Hilton DJ, et al, 1996. Saturation mutagenesis of the WSXWS motif of the erythropoietin receptor. J. Biol. Chem. 271: 4699-4708.
Harada K, et al, 2004. Peptide antibiotic human beta-defensin-1 and -2 contribute to antimicrobial defense of the intrahepatic biliary tree. Hepatology, vol 40: 925-932.
Khan M, et al, 2007. Growth-promoting effects of single-dose intragastrically administered probiotics in chickens. Br Poult Sci 48(6):732-5.
Koren O, et al, 2012. Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell 150(3):470-80.
Le Chatelier E et al. 2013. Richness of human gut microbiome correlates with metabolic markers. Nature 500(7464):541-6.
Leviten M, 2016. The Finnish connection. Biocentury Innovations, June 16.
Liu hY et al, 2008. Suppression of hepatic glucose production by human neutrophil α-defensin through a signaling pathway distinct from insulin. The Journal of Biological Chemistry 283(18):12056-12063.
Lowman HB, Bass SH, Simpson N and Wells JA, 1991. Selecting high-affinity binding proteins by monovalent phage display. Biochem 30:10832-10837.
Mowat AM and Agace WW, 2014. Regional specialization within the intestinal immune system. Nat Rev Immunol. 14(10):667-85.
Needleman SB and Wunsch CD, 1970. A general method applicable to the search for similarities in the amino acid sequence of two proteins. J. Mol. Biol. 48: 443-453.
Ner SS, Goodin DB and Smith M, 1988. A simple and efficient procedure for generating random point mutations and for codon replacements using mixed oligodeoxynucleotides. DNA 7:127-134.
Neurath H and Hill RL, 1979. The Proteins. Academic Press, New York.
Paige et al. Pharmaceutical Research, vol. 12, no. 12, 1995. Prolonged circulation of recombinant human granulocyte-colony stimulating factor by covalent linkage to albumin through a heterobifunctional polyethylene glycol.
Qin J, et al 2012. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 490(7418):55-60.
Reidhaar-Olson JF and Sauer RT, 1988. Combinatorial cassette mutagenesis as a probe of the informational content of protein sequences. Science 241:53-57;
Gennaro AR, 1990. Remington 's Pharmaceutical Sciences. Ed. Mack Publishing Co., Easton, PA.
Rice P, Longden I and Bleasby A, 2000. EMBOSS: the European Molecular Biology Open Software Suite. Trends in Genetics 16: 276-277.
Ridaura VK, et al, 2013. Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science 341(6150):1241214.
Salzman NH, Underwood MA and Bevins CL, 2007. Paneth cells, defensins, and the commensal microbiota: a hypothesis on intimate interplay at the intestinal mucosa. Semin Immunol 19(2):70-83.
Shechter et al. Bioconjugate Chem. 2005,16: 913-920
Shechter et al. International Journal of Peptide Research and Therapeutics, Vol. 13, Nos. 1-2, June 2007
Suez J, et al, 2014. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature 514(7521):181-6.
Trasande L, Blustein J, Liu M, Corwin E, Cox LM and Blaser MJ, 2012. Infant antibiotic exposures and early-life body mass. Int J Obes (Lond) 37(1):16-23.
Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER and Gordon JI, 2006. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 2006 Dec 21;444(7122):1027-31.
Turnbaugh PJ, Bäckhed F, Fulton L and Gordon JI, 2008. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell Host Microbe 3(4):213-23.
Vrieze A, et al 2012. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroent 143(4):913-6.
Walter, 2015. Murine gut microbiota-diet trumps genes. Cell Host Microbe 17(1):3-5.
Wehkamp J, et al, 2002. Innate immunity and colonic inflammation: enhanced expression of epithelial alpha-defensins. Dig Dis Sci. 47(6):1349-55.
Wertenbruch S, et al, 2015. The anti-microbial peptide LL-37/CRAMP is elevated in patients with liver diseases and acts as a protective factor during mouse liver injury. Digestion, 91:307-317.
Zhang X, et al, 2015. The oral and gut microbiomes are perturbed in rheumatoid arthritis and partly normalized after treatment. Nat Med 21(8):895-905.
И следующие патенты и заявки на патент:
WO 2010/007166
WO 92/06204
WO 95/17413
WO 95/22625
US 5223409
CN104971343


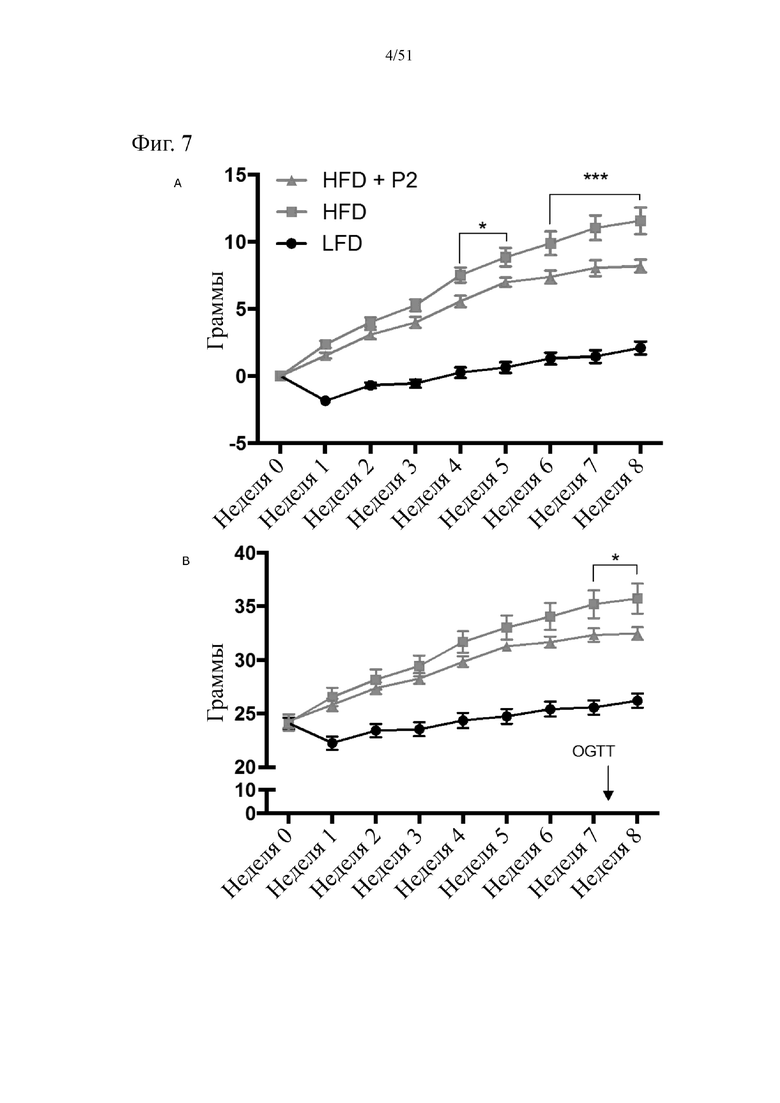
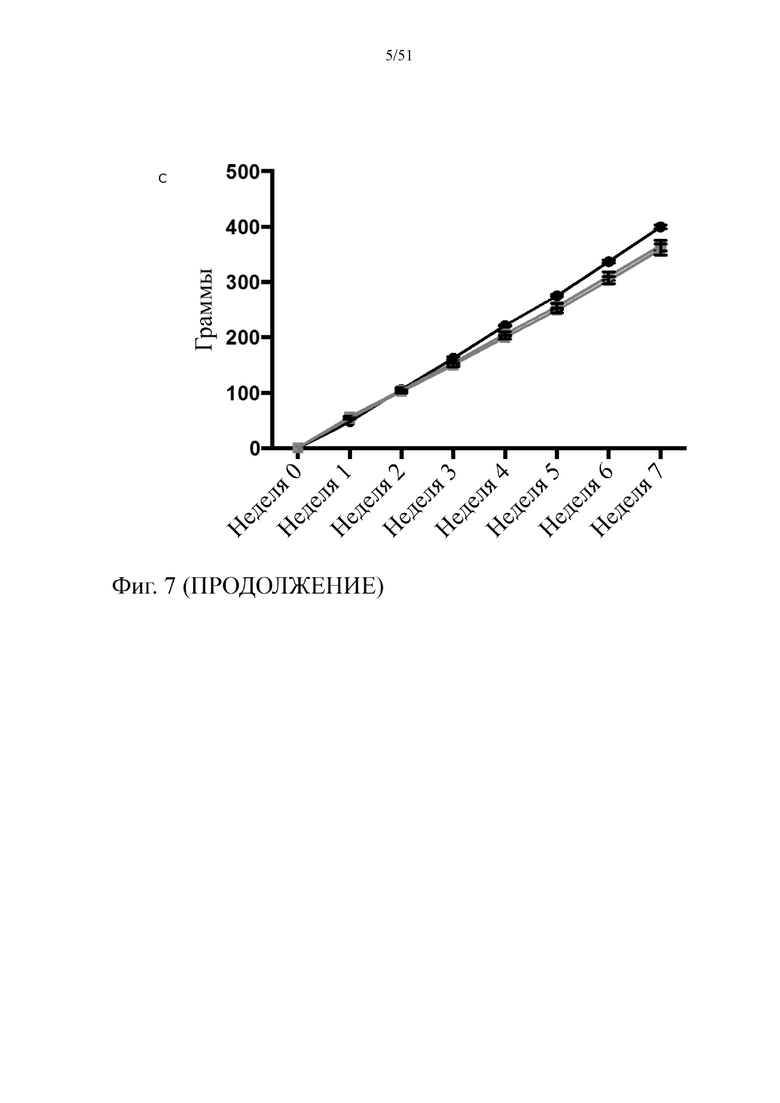
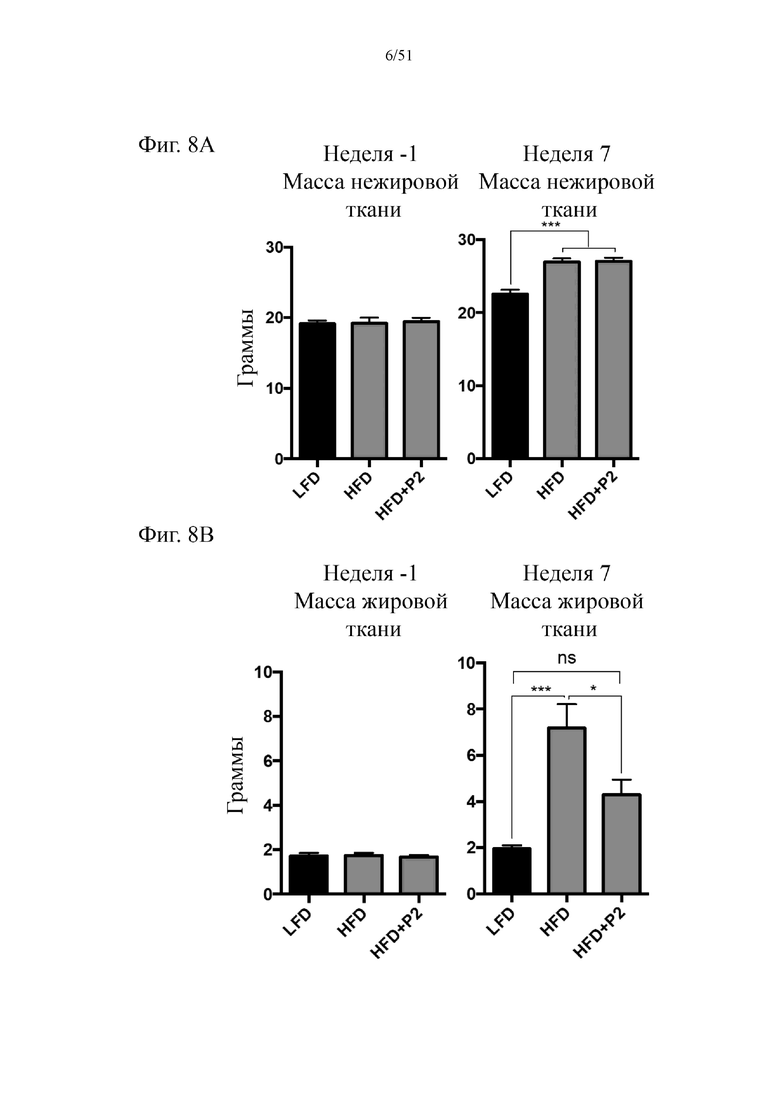
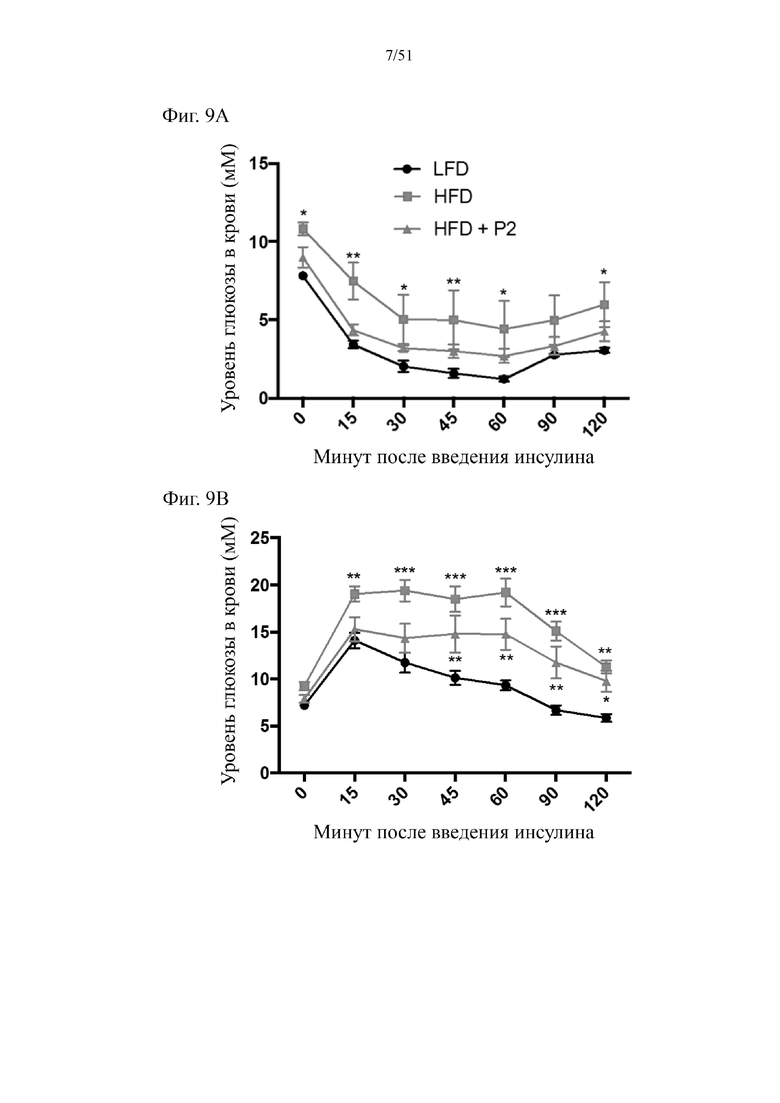
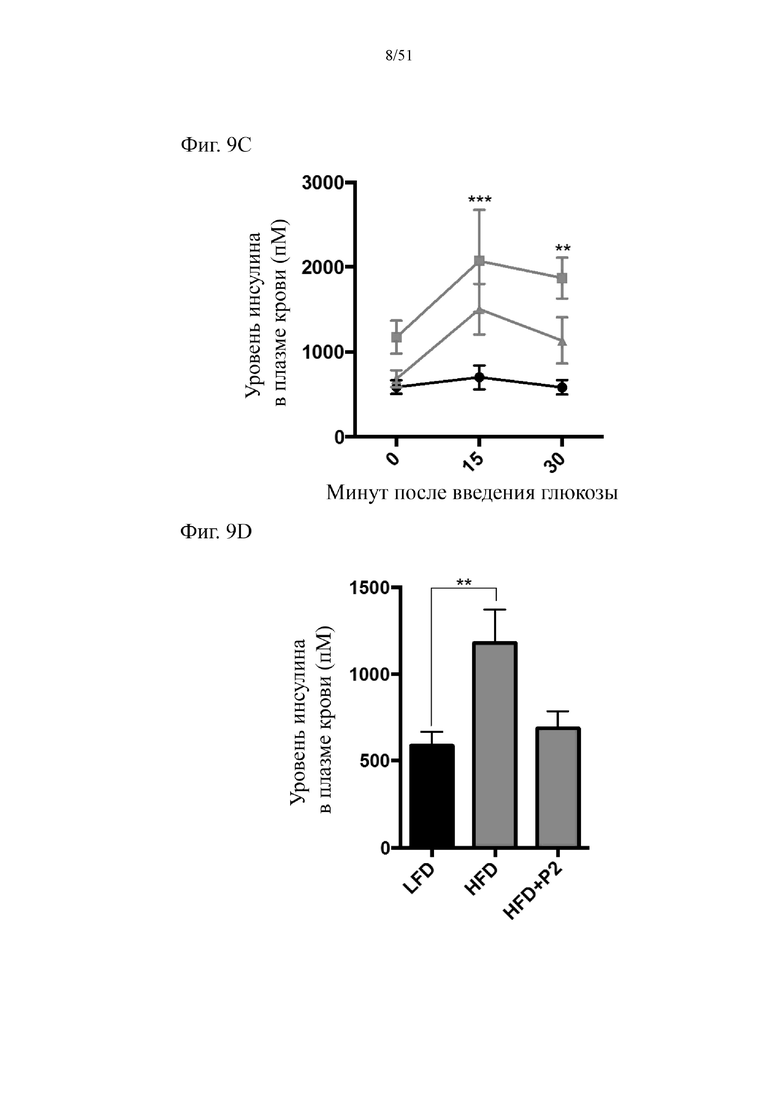
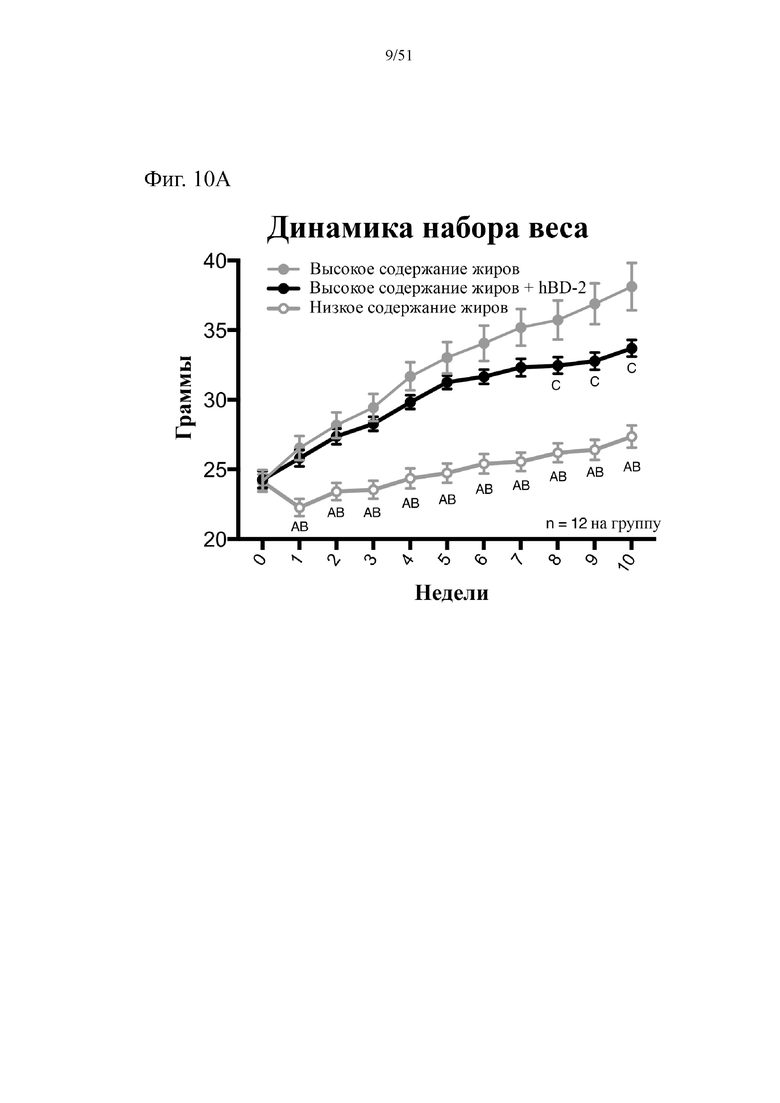
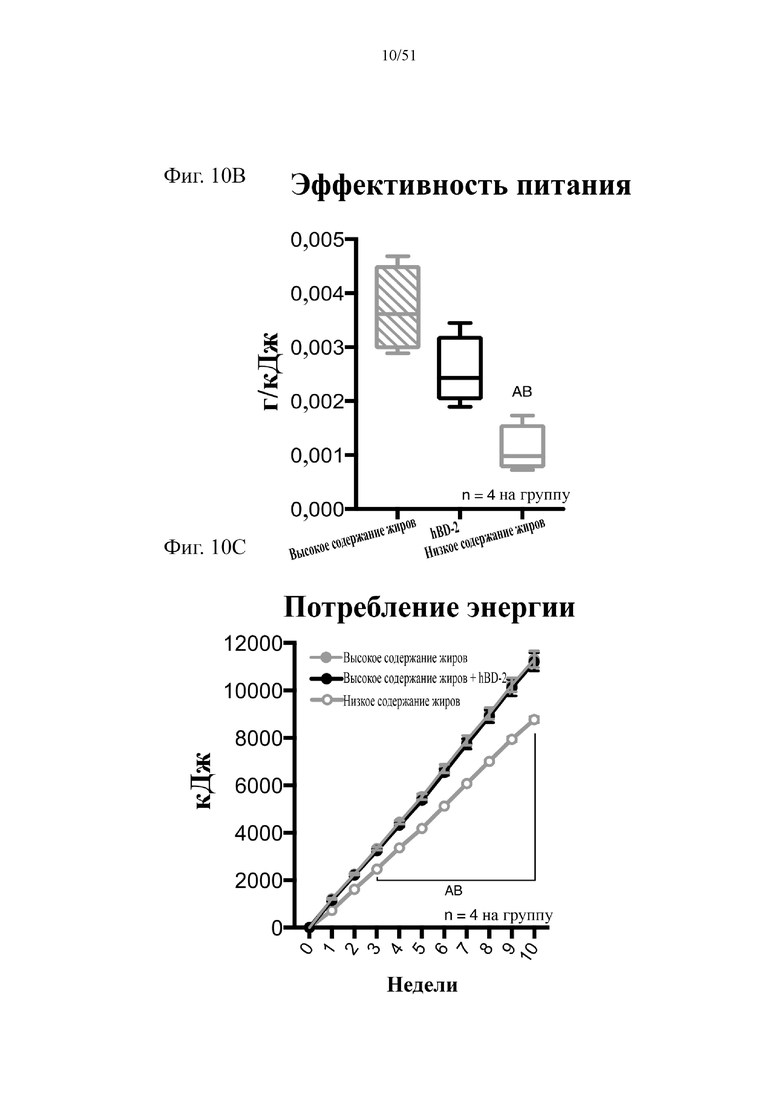
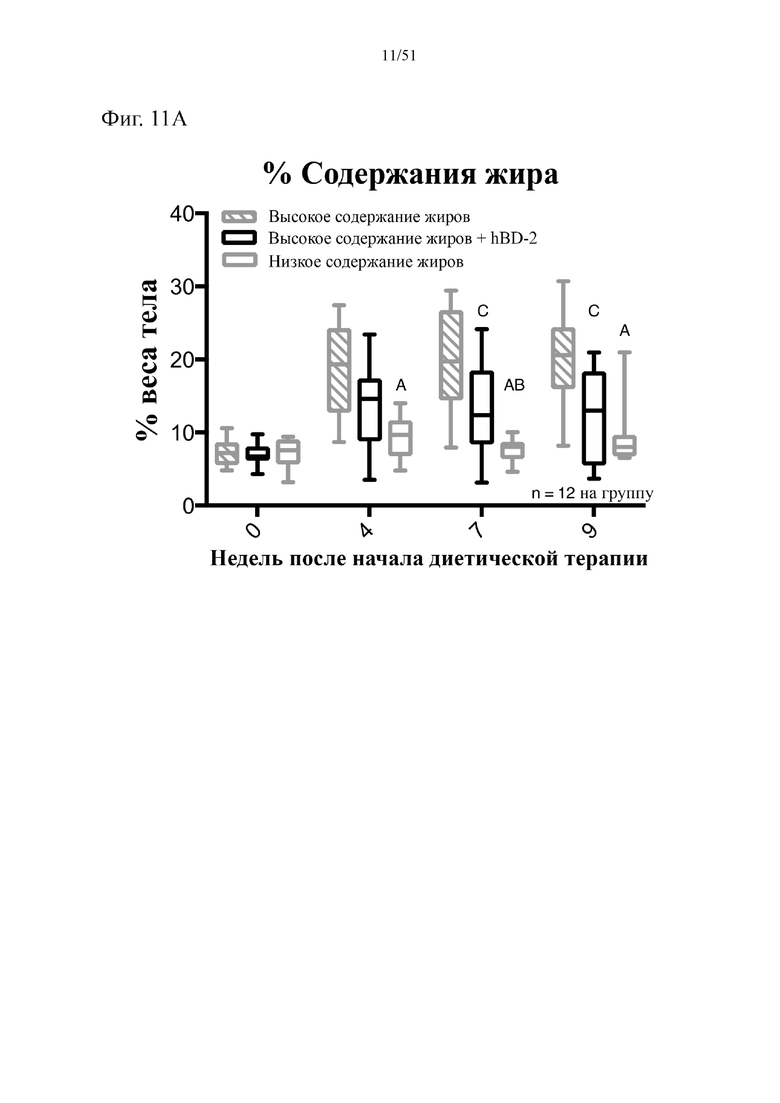
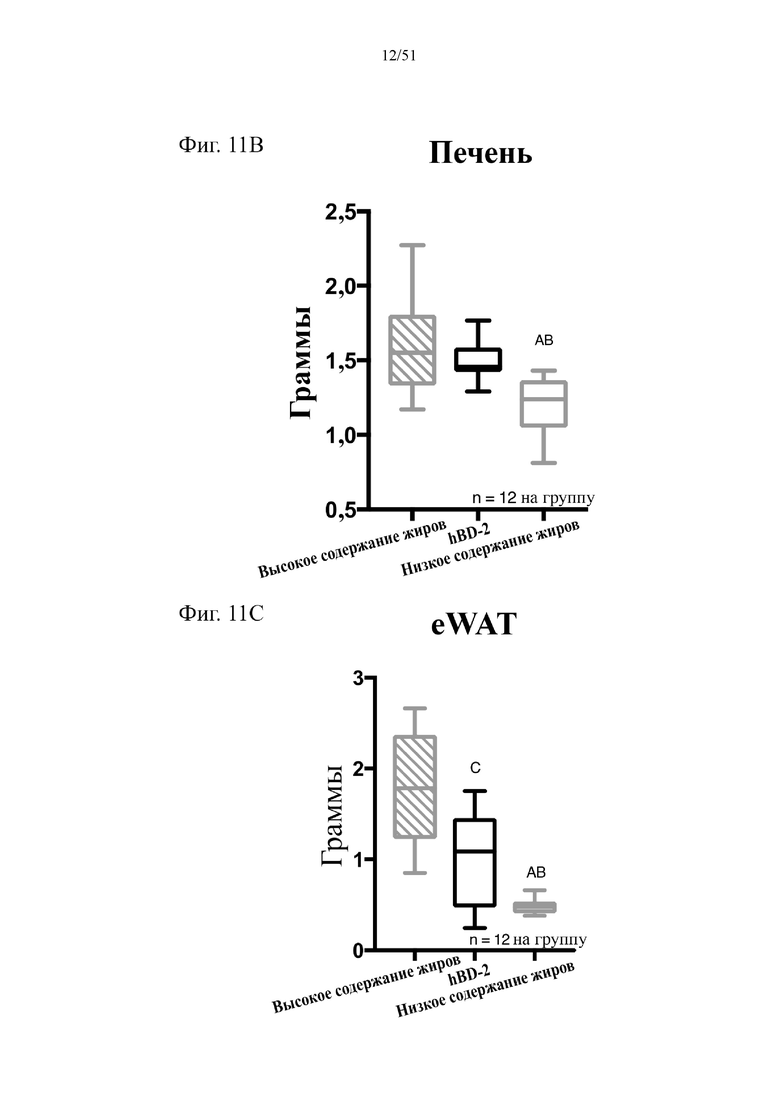
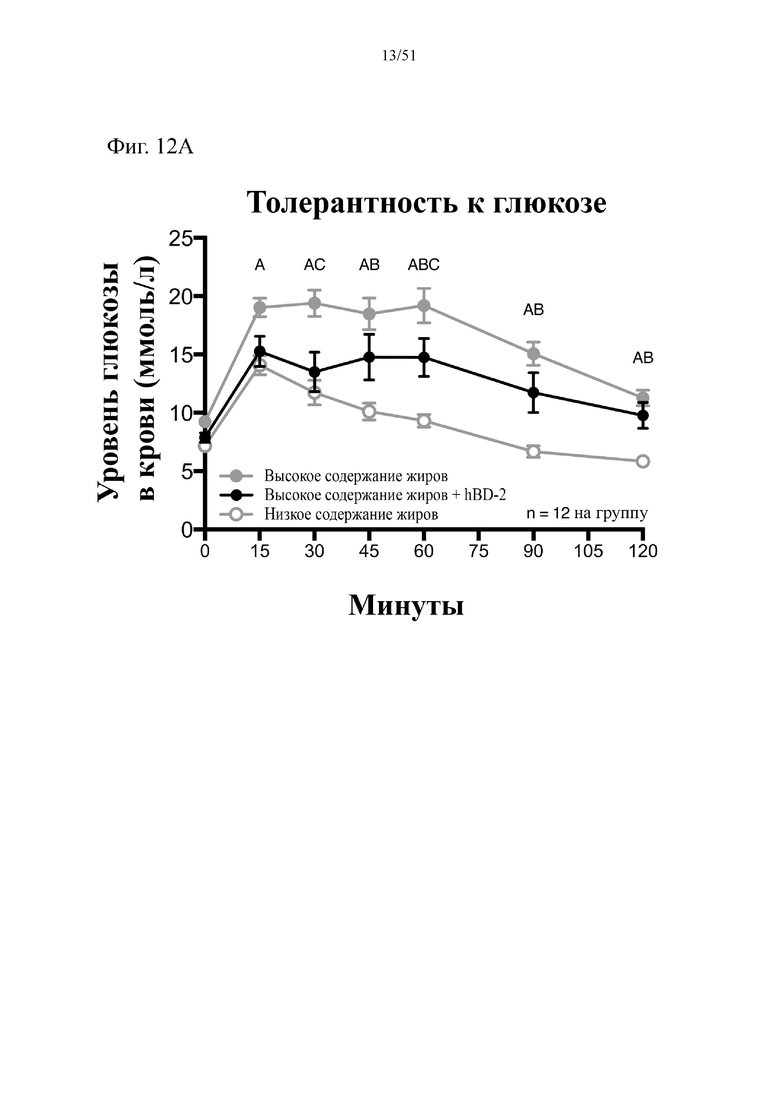
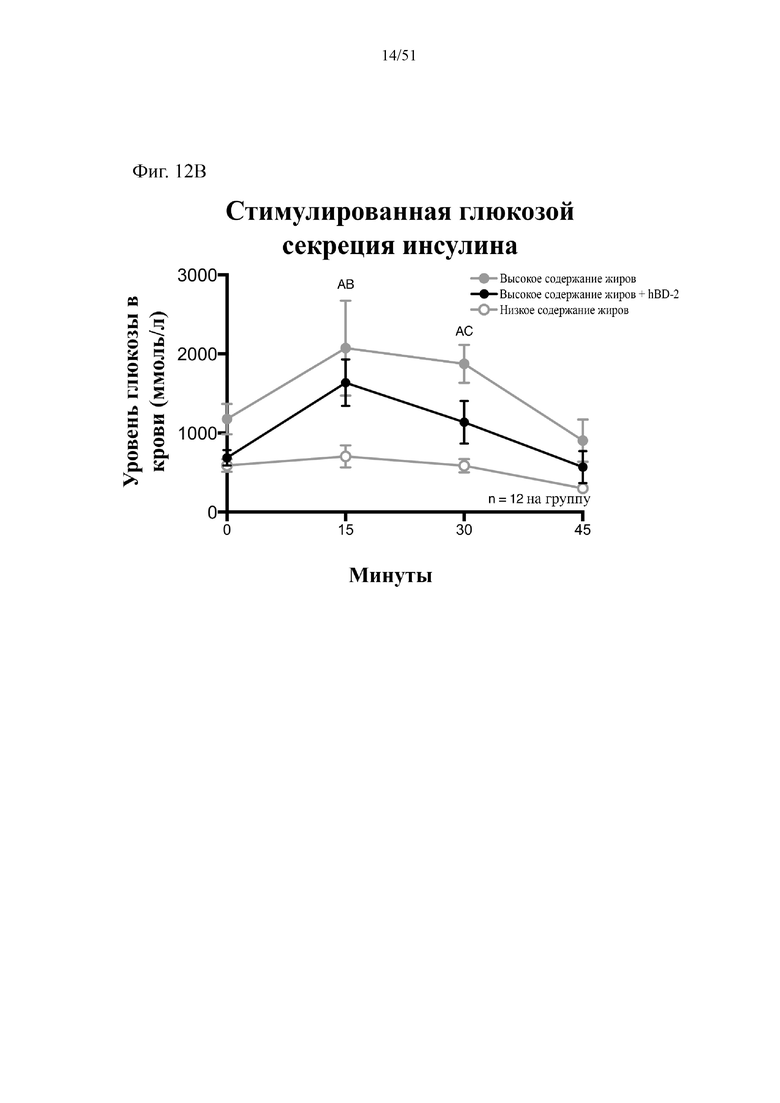
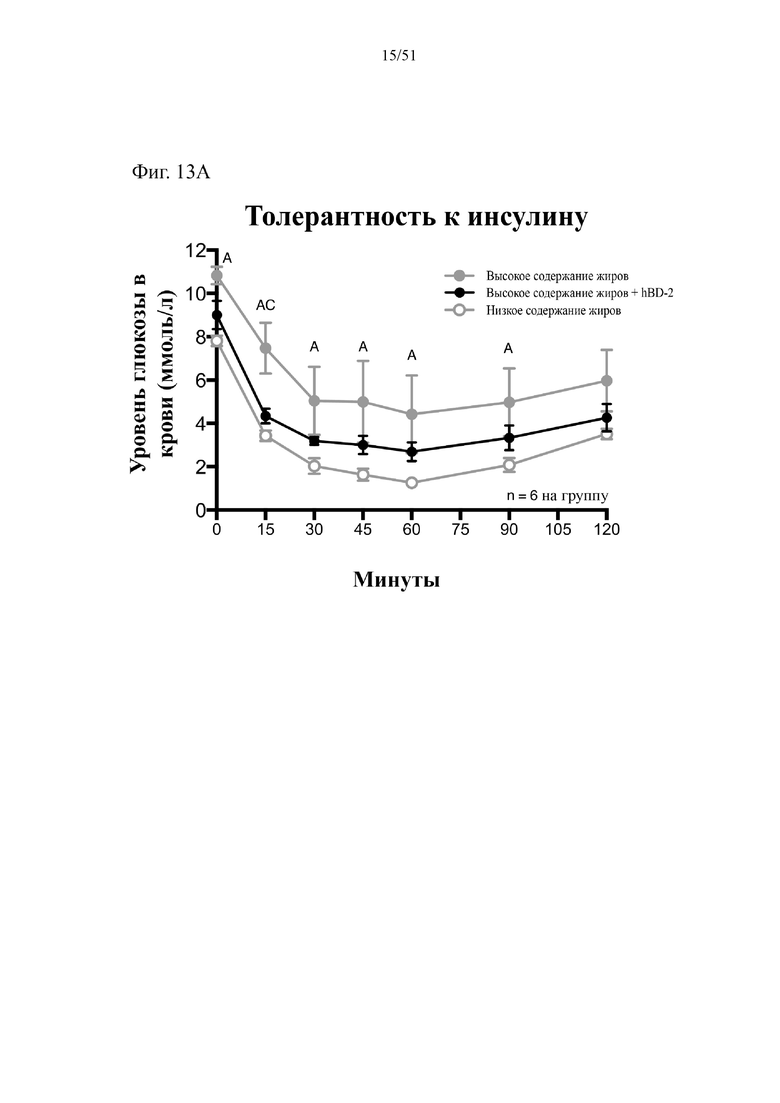
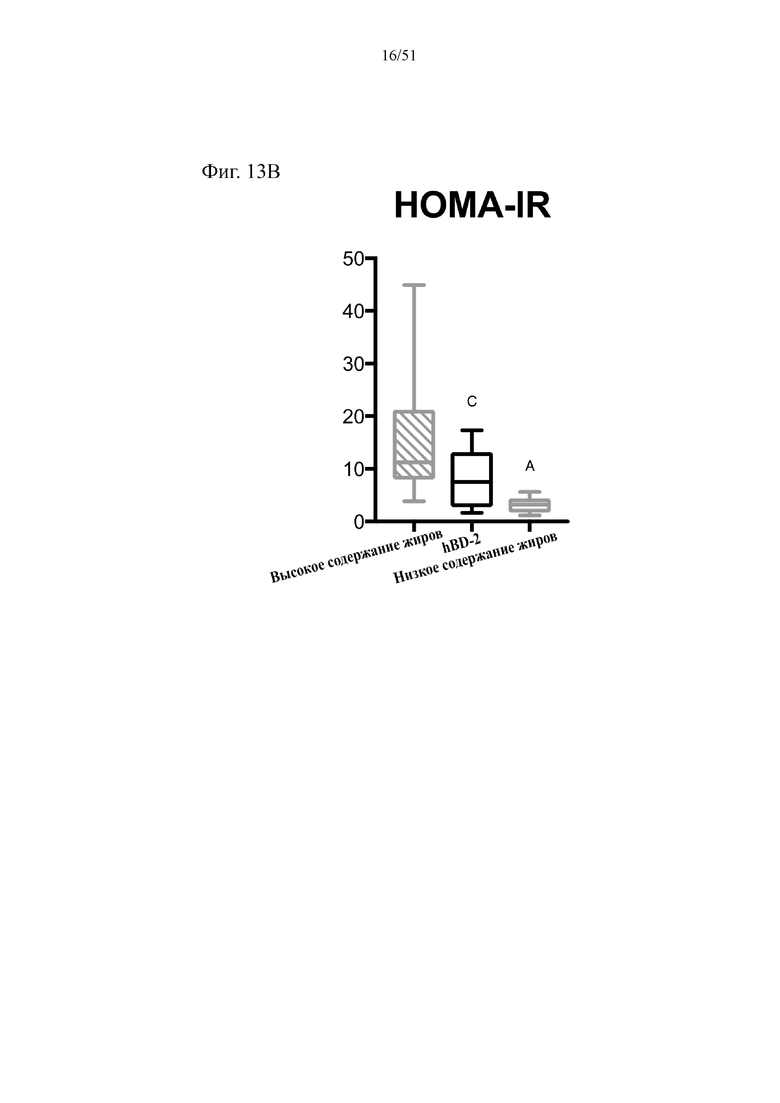
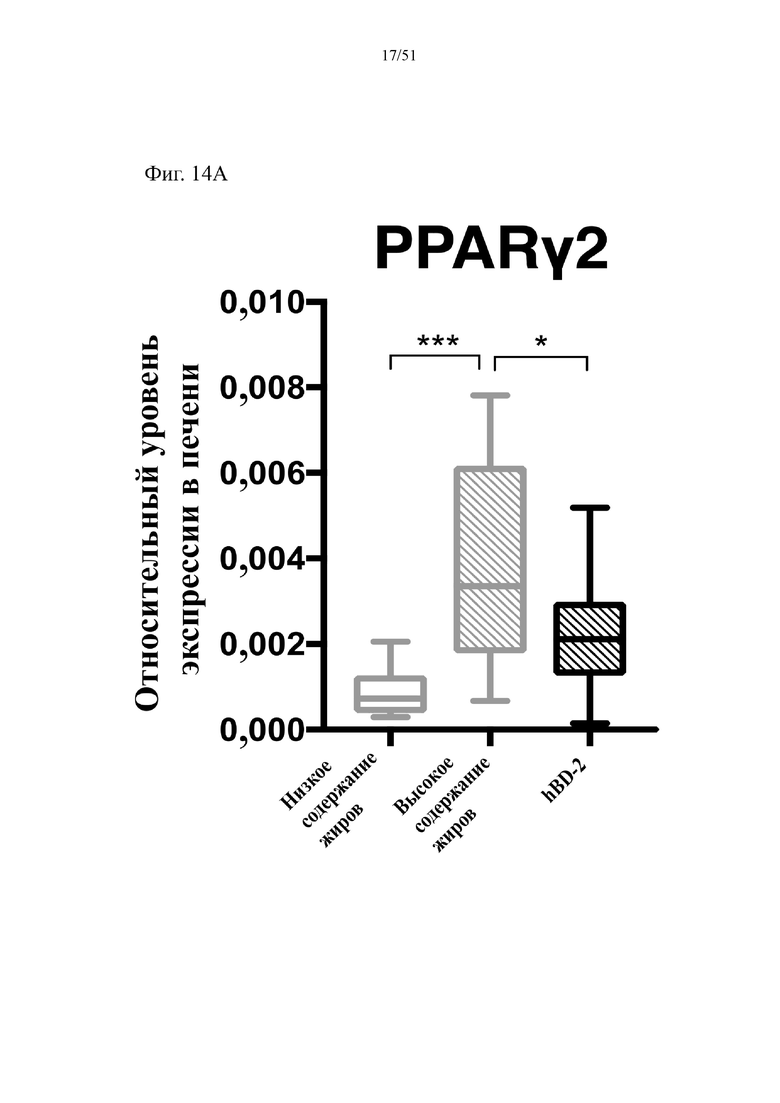
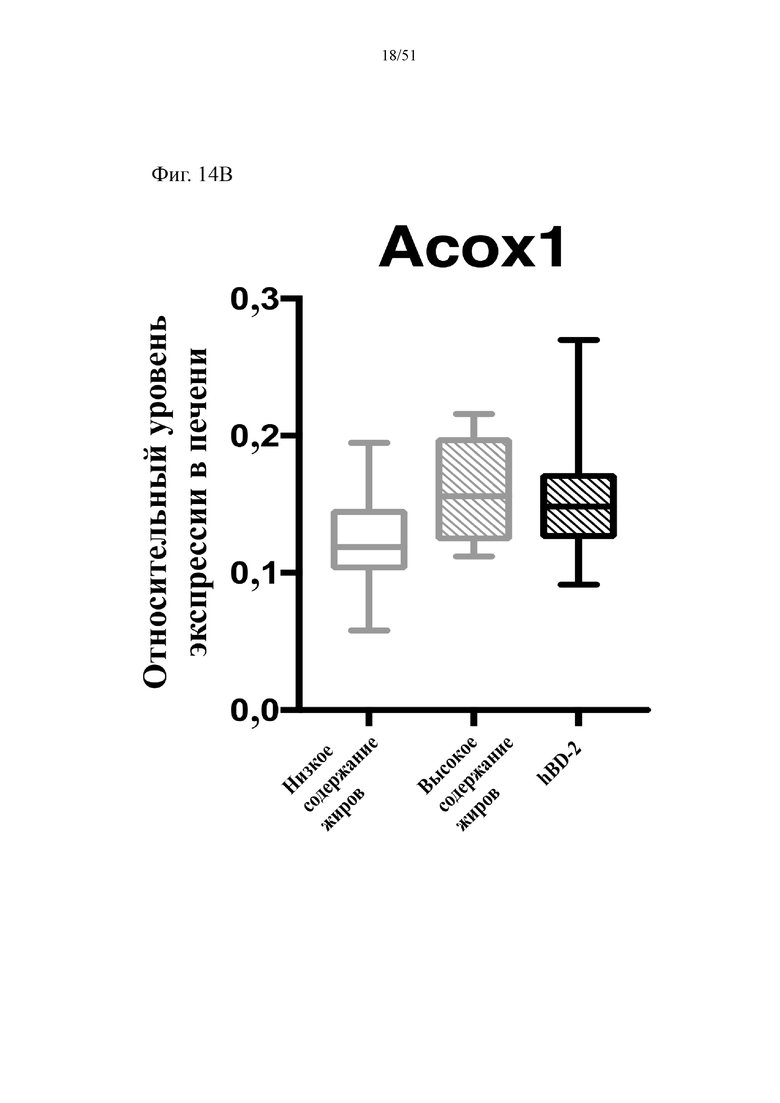
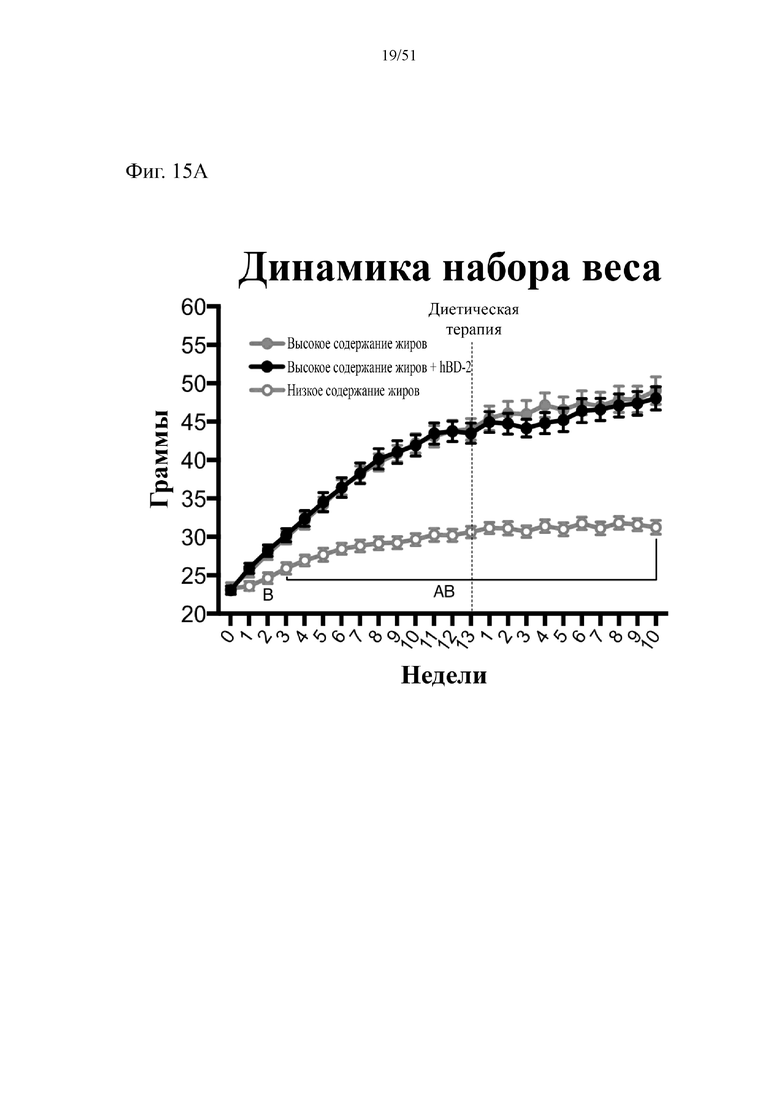
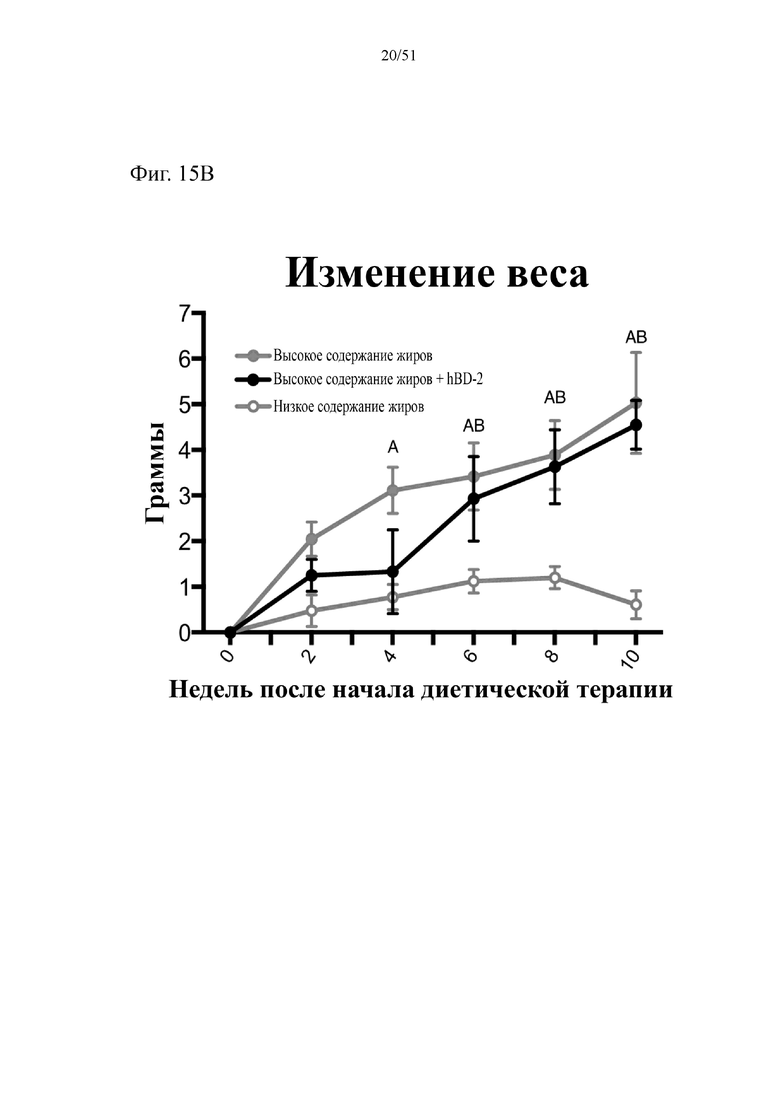
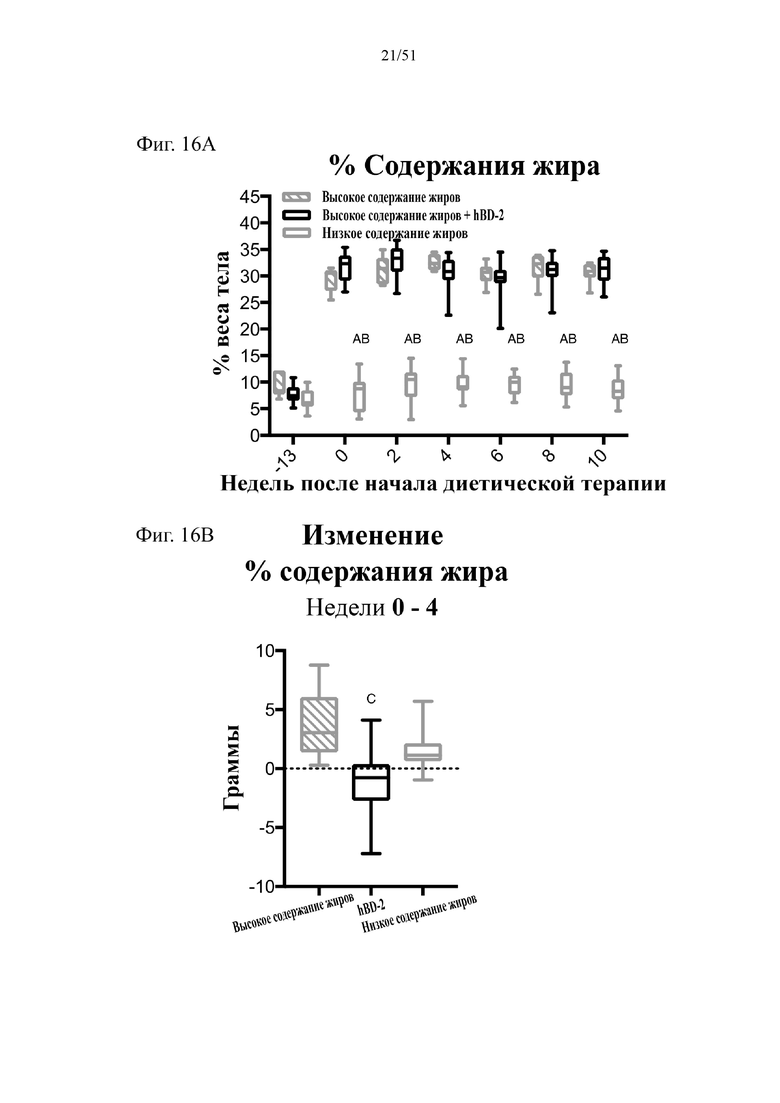
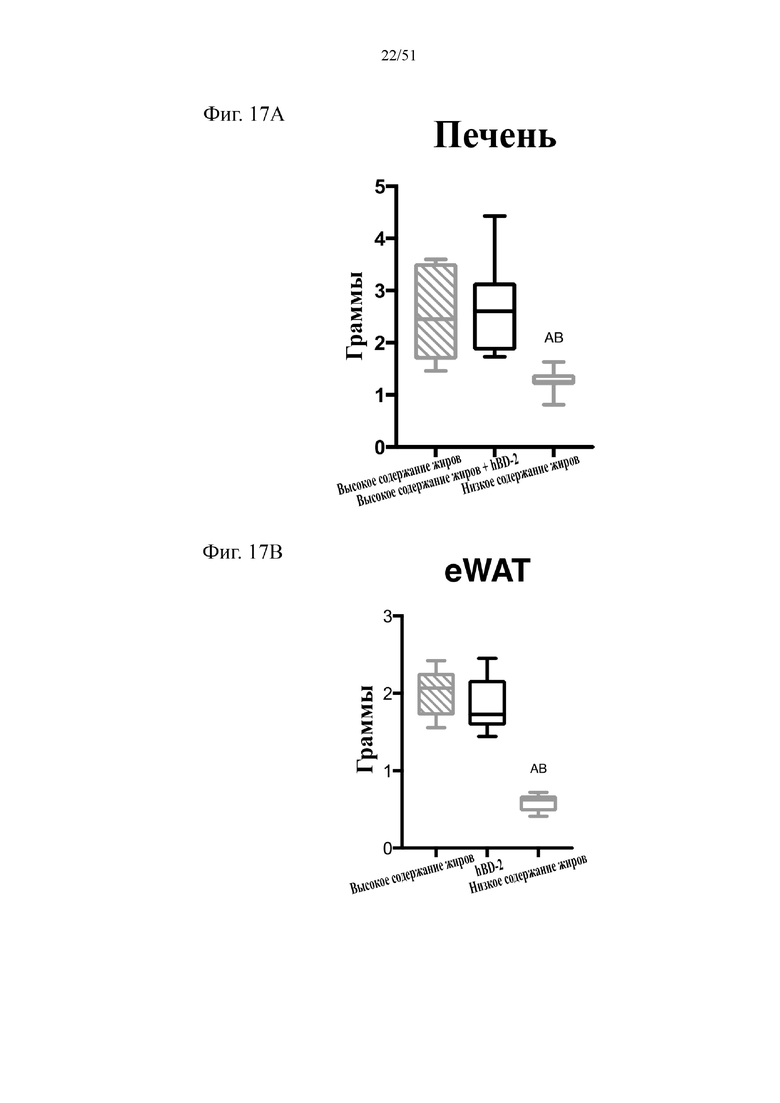
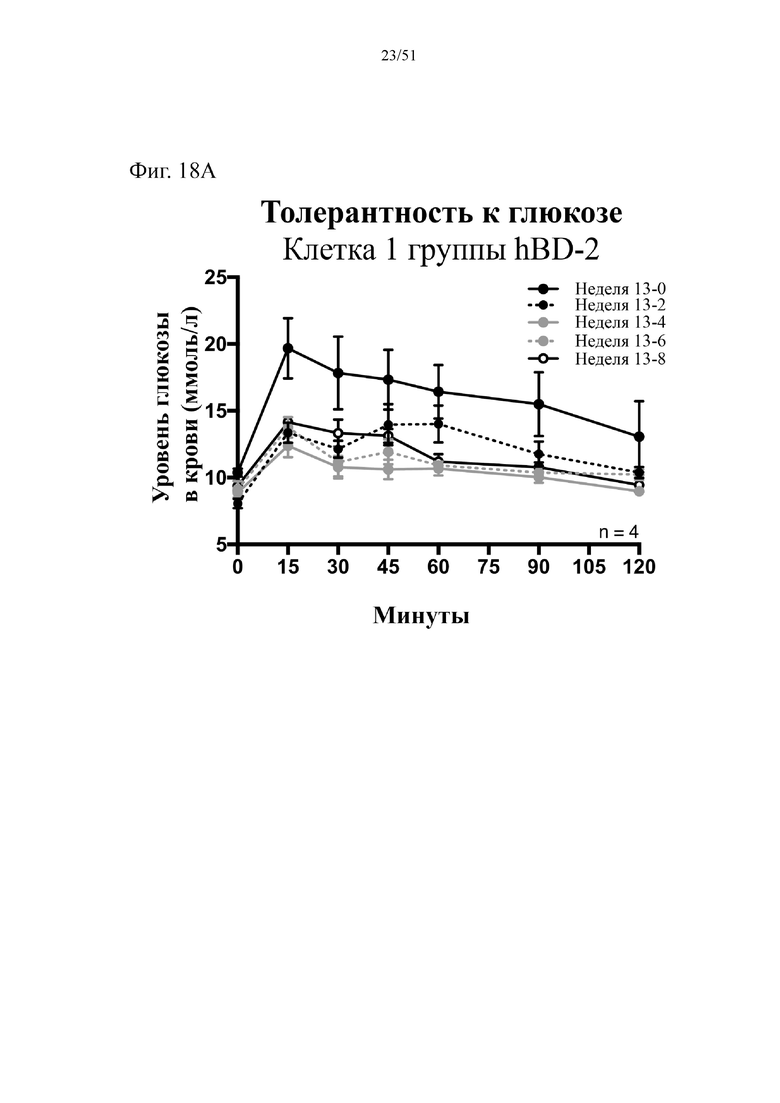
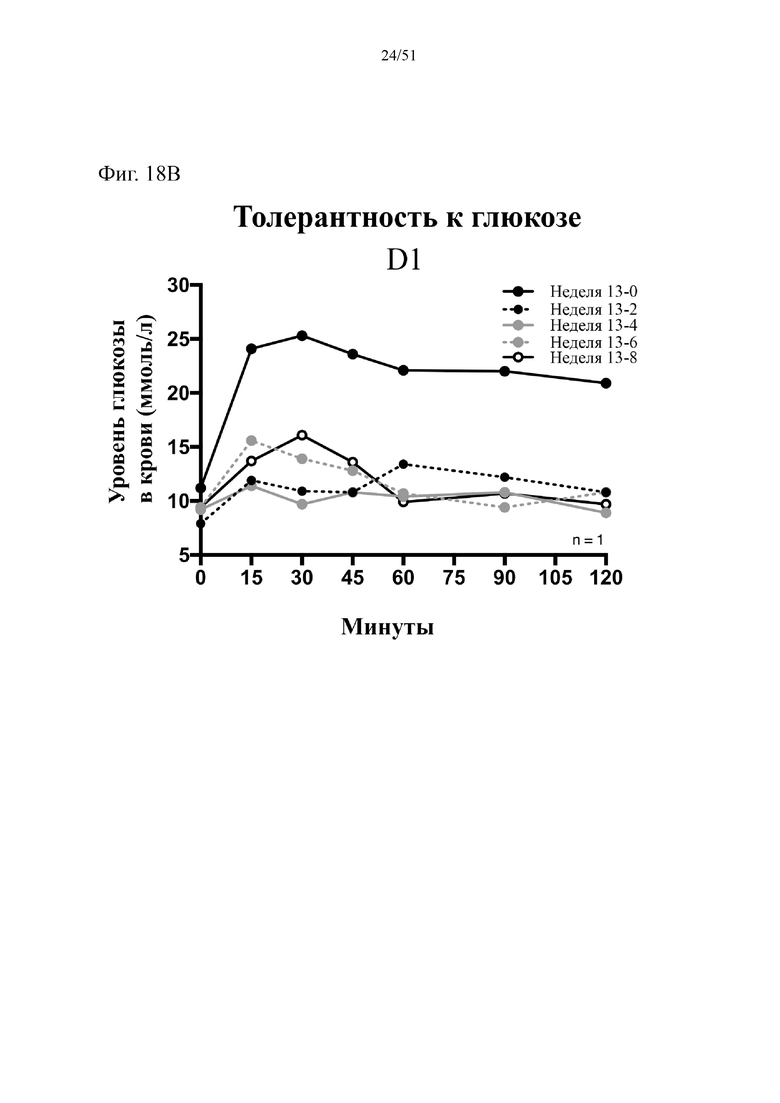
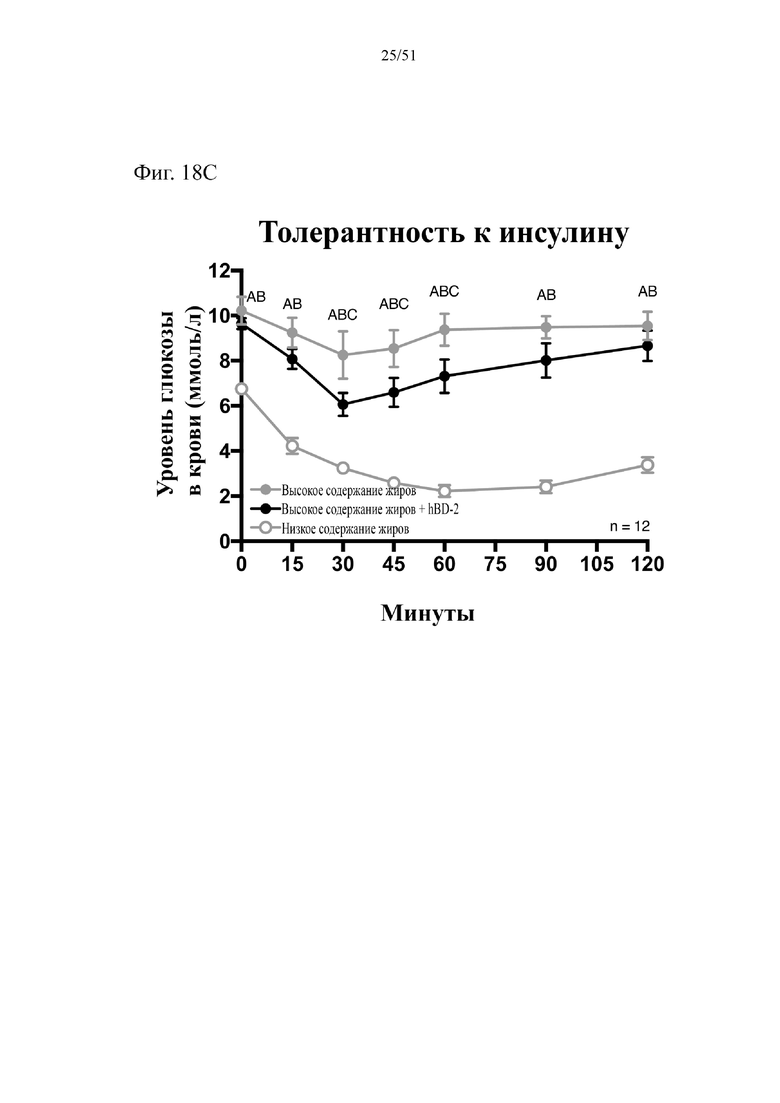
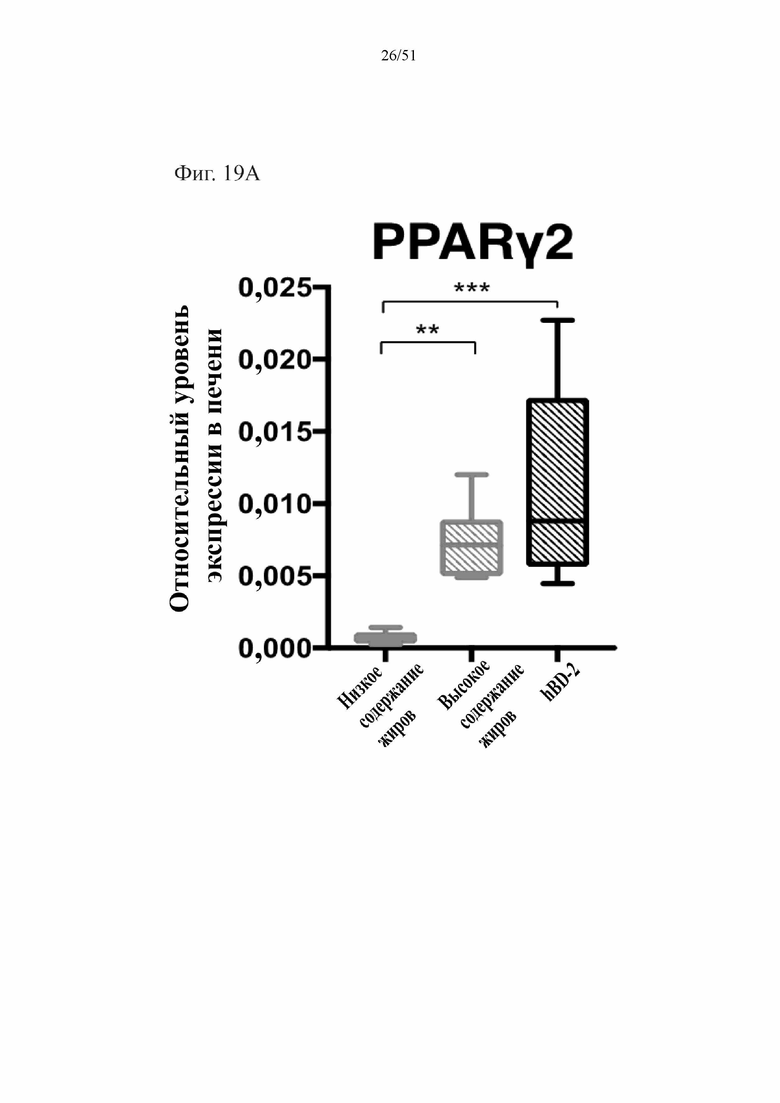
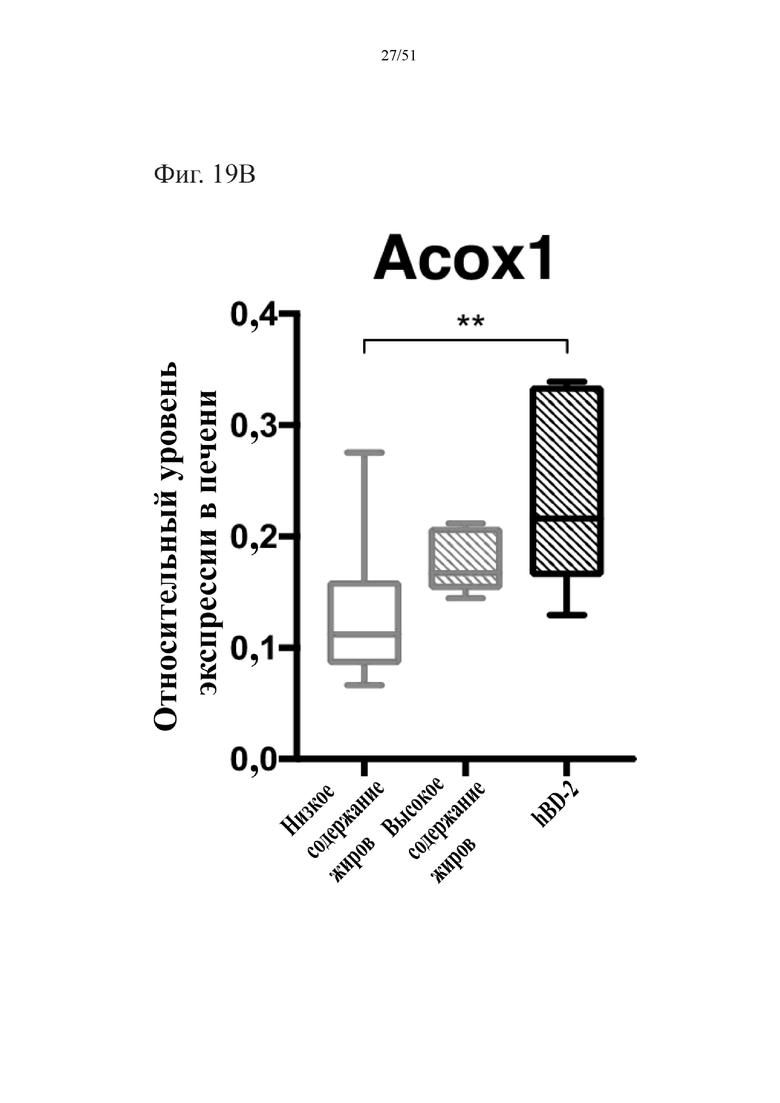
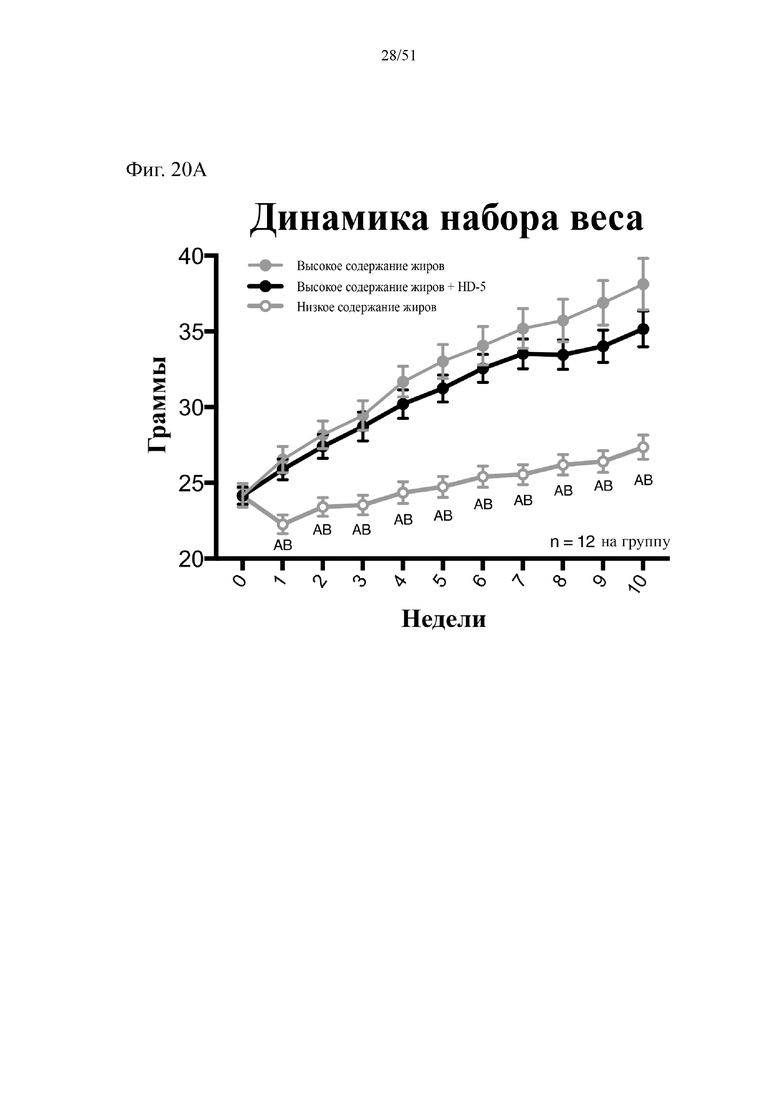
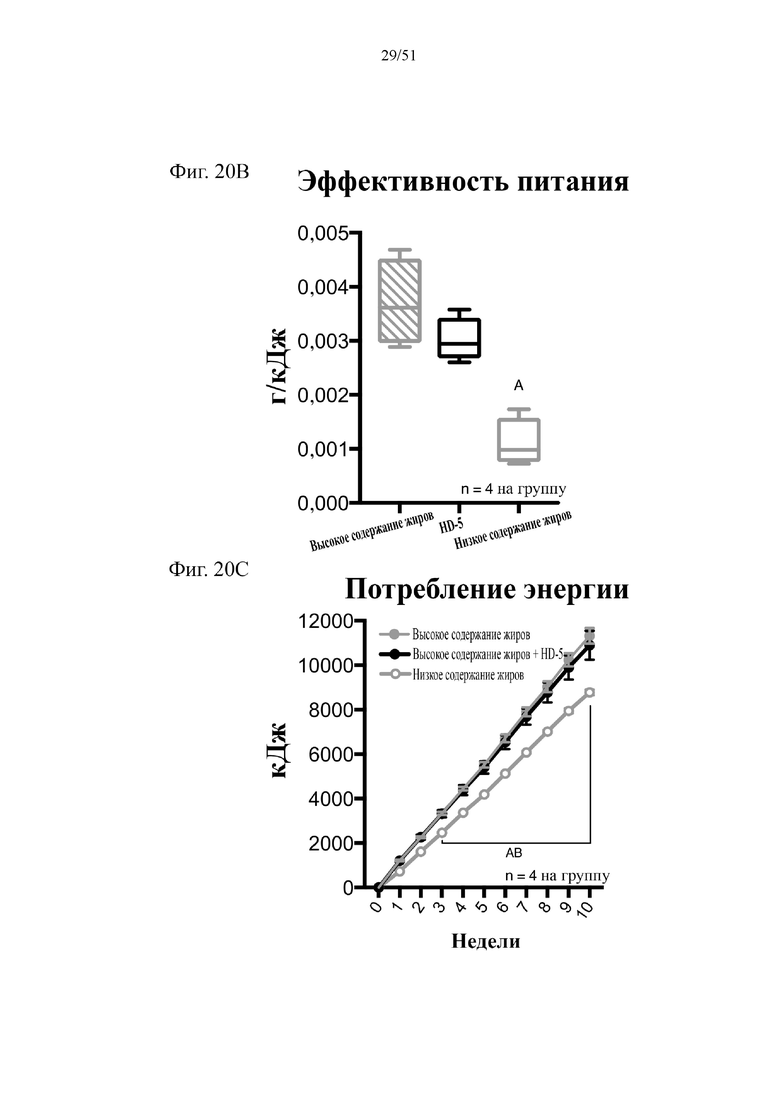
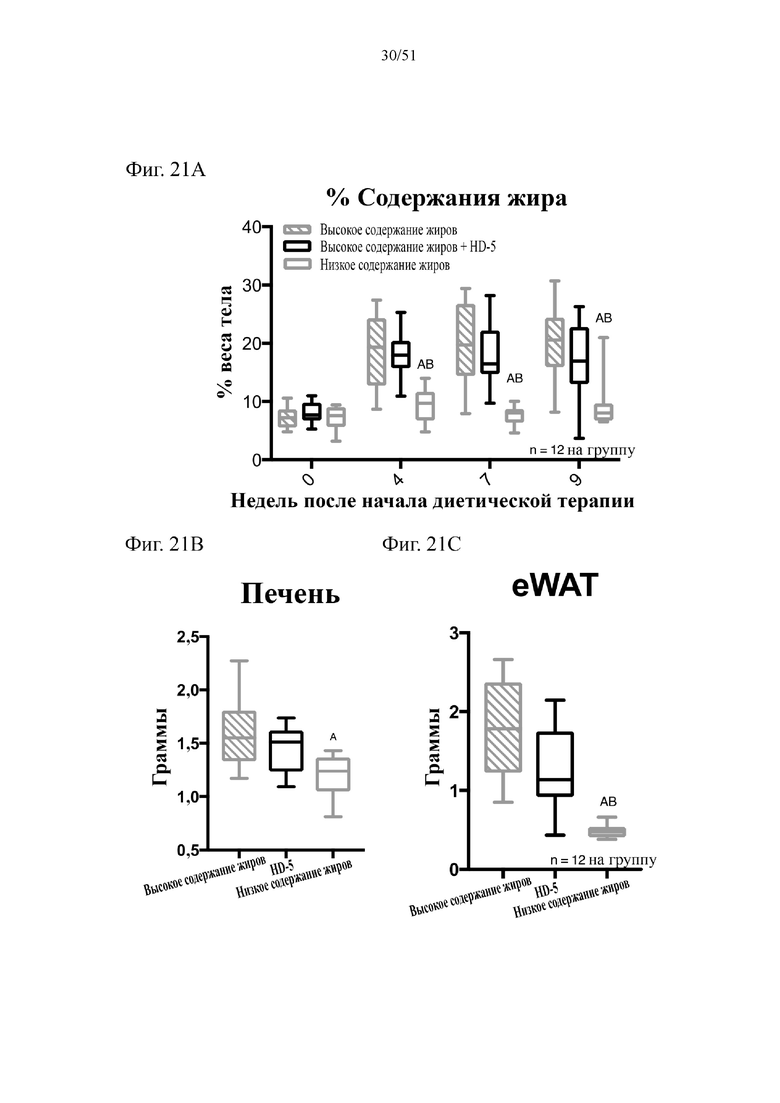
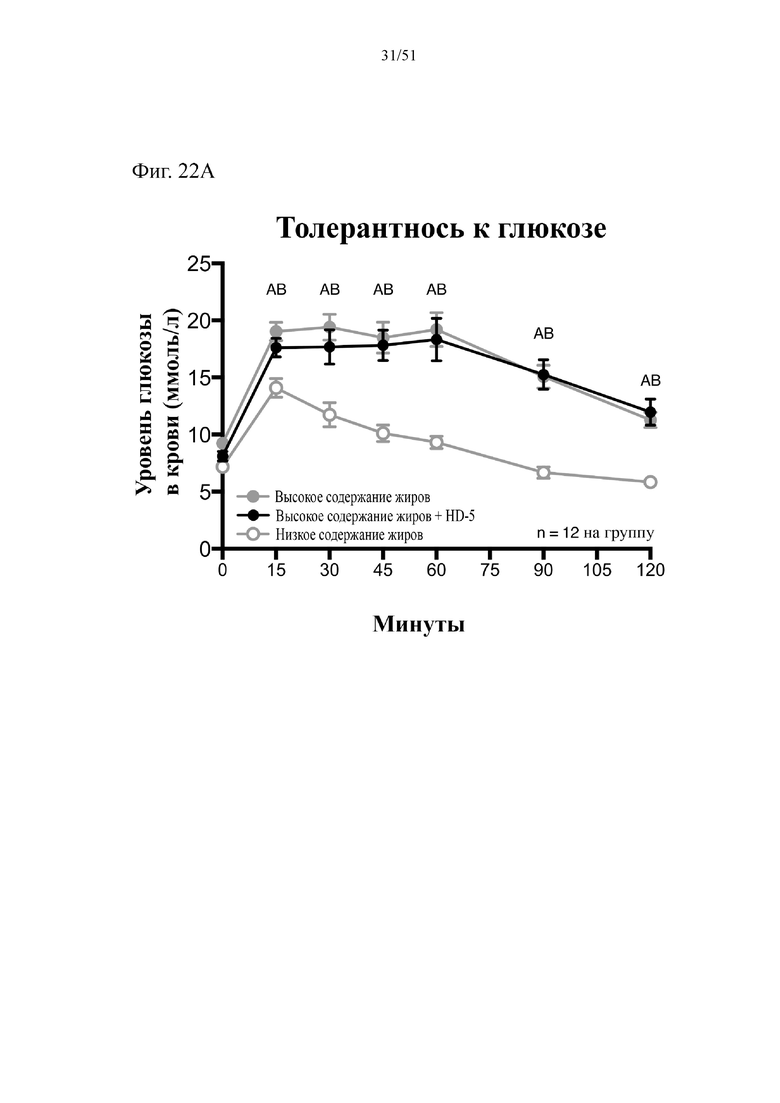
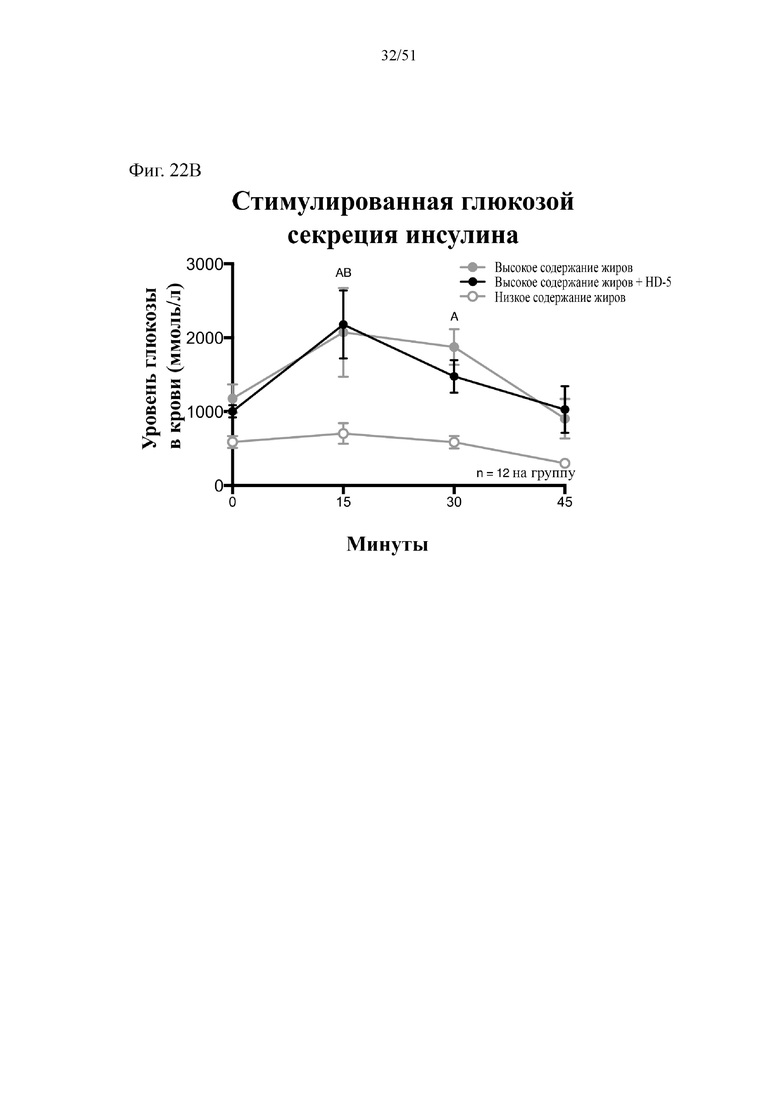
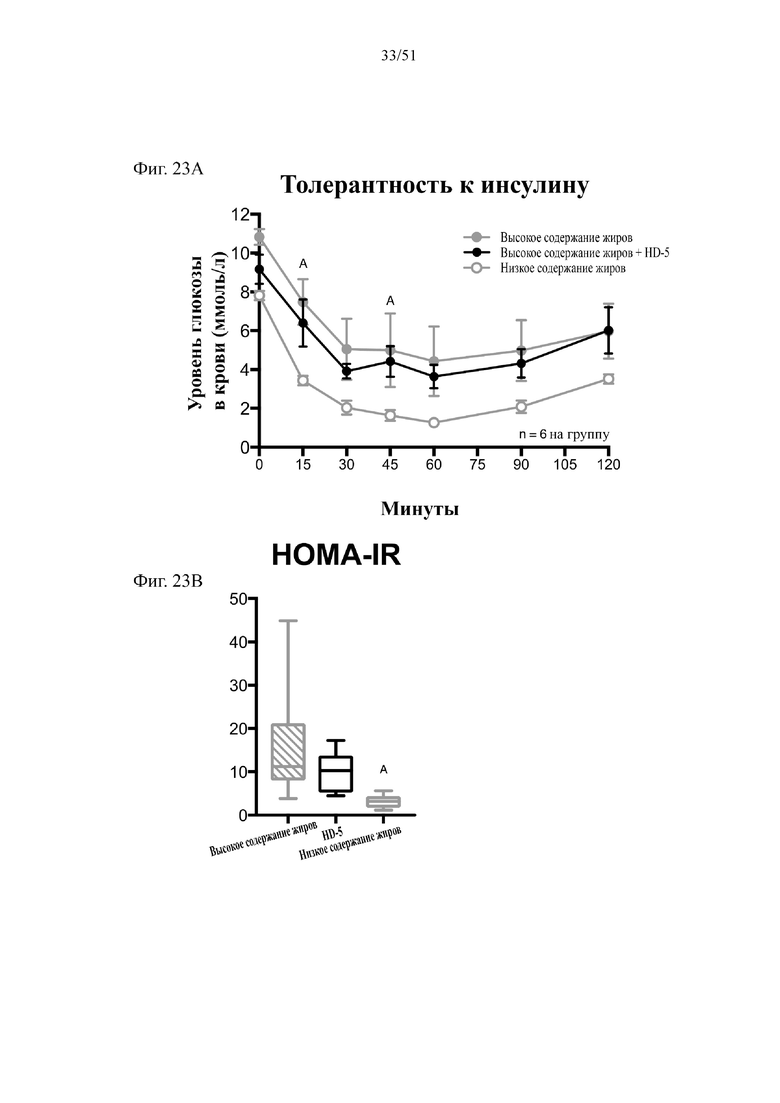
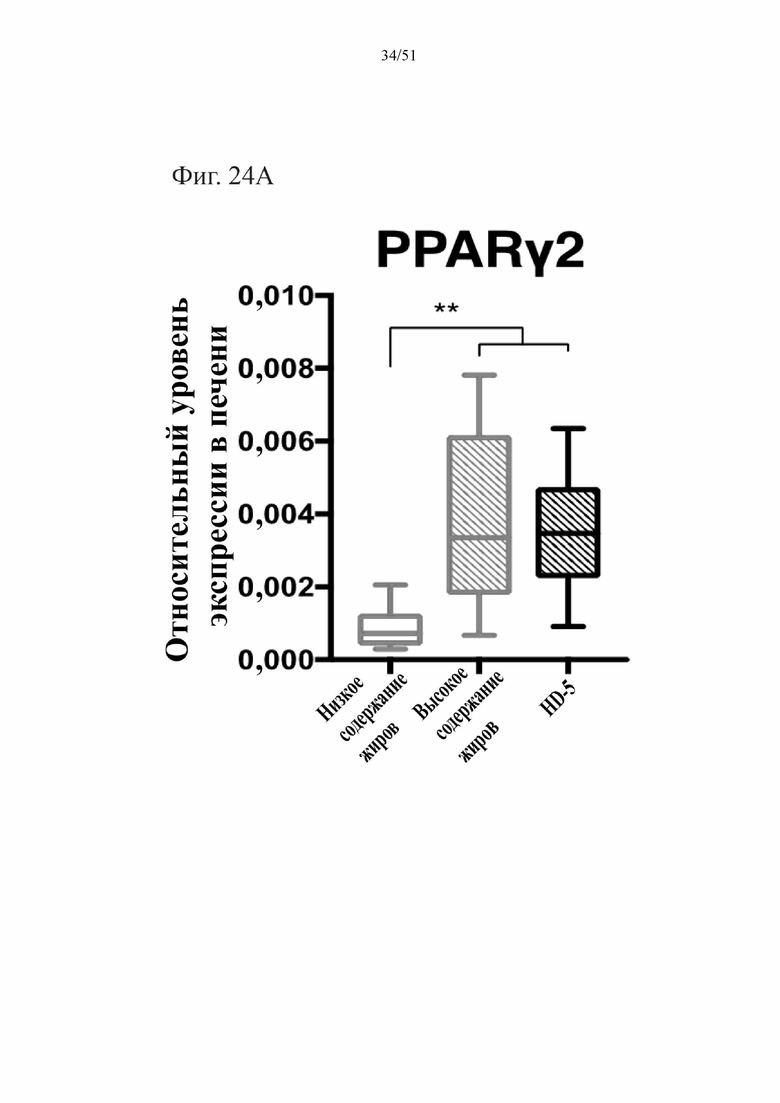
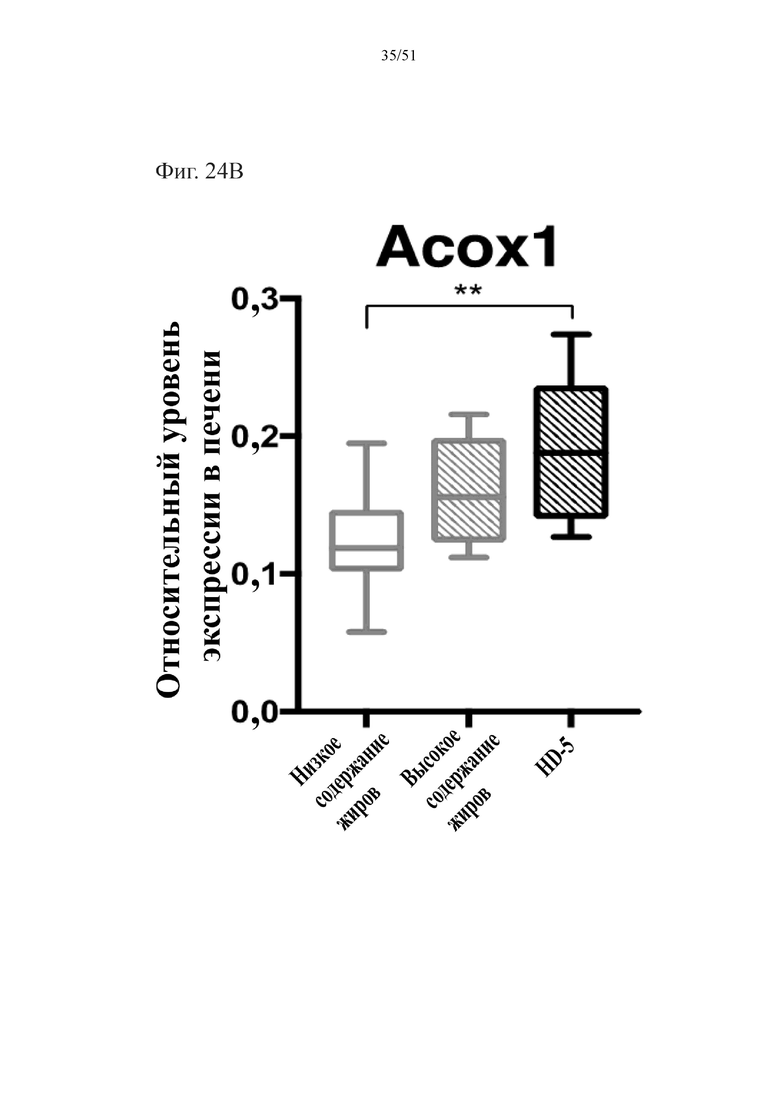
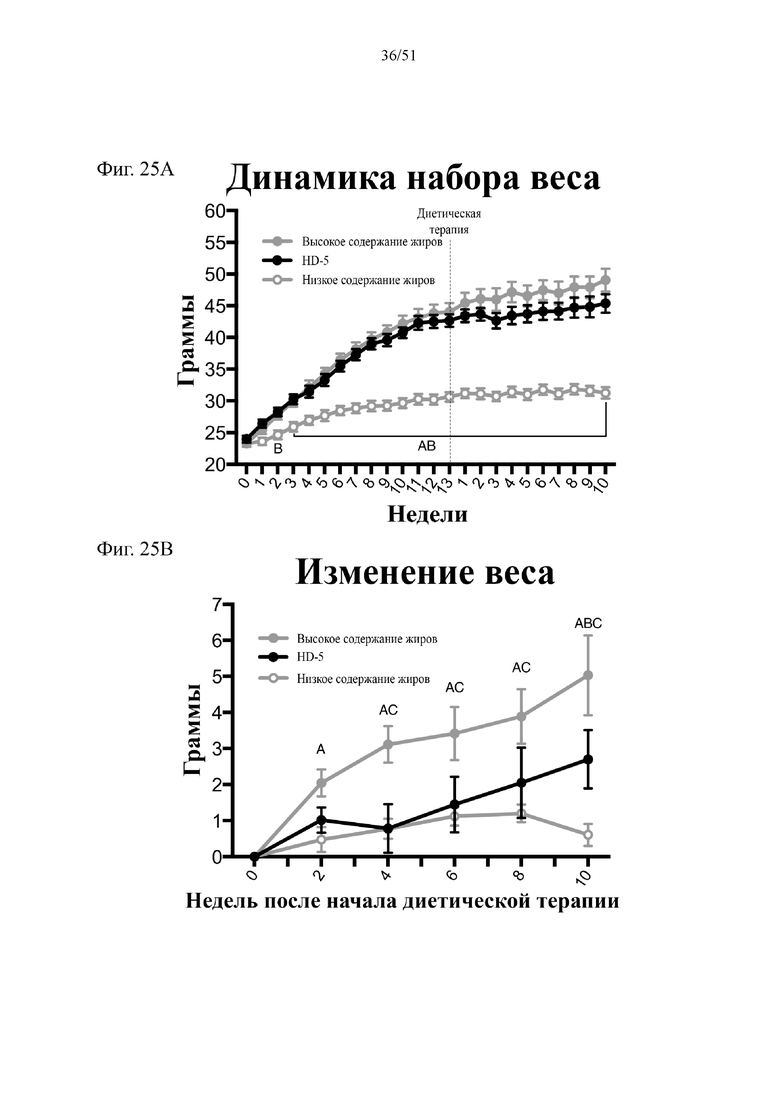

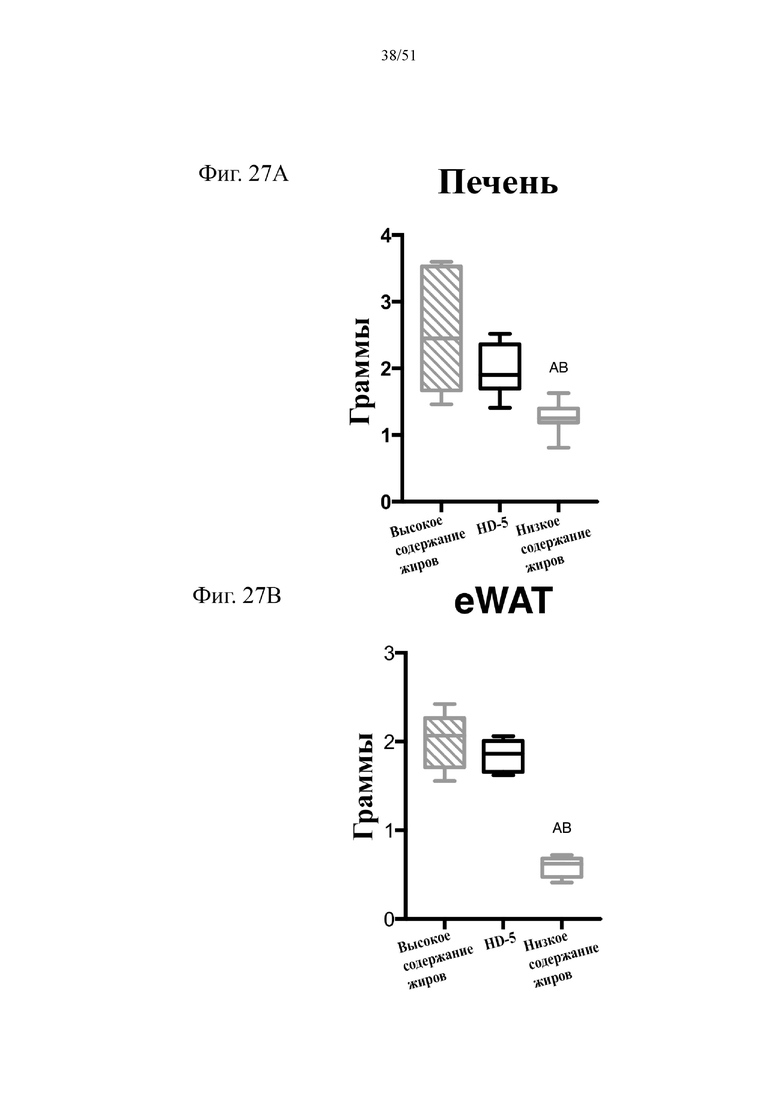
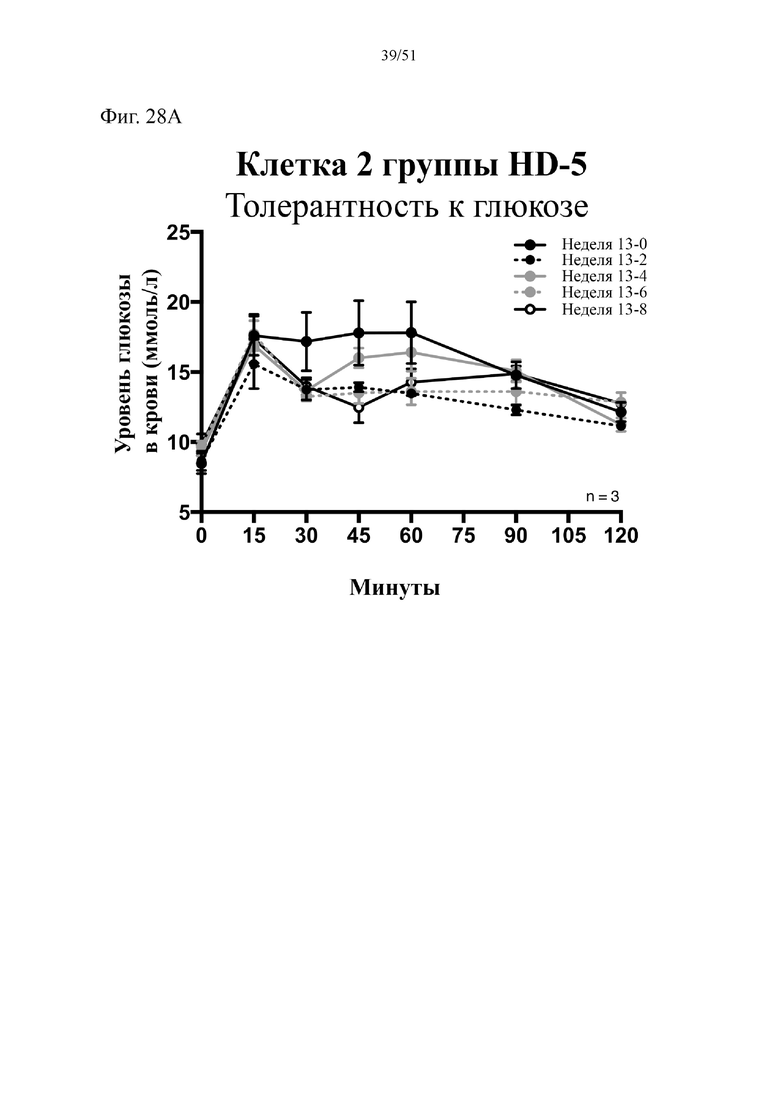
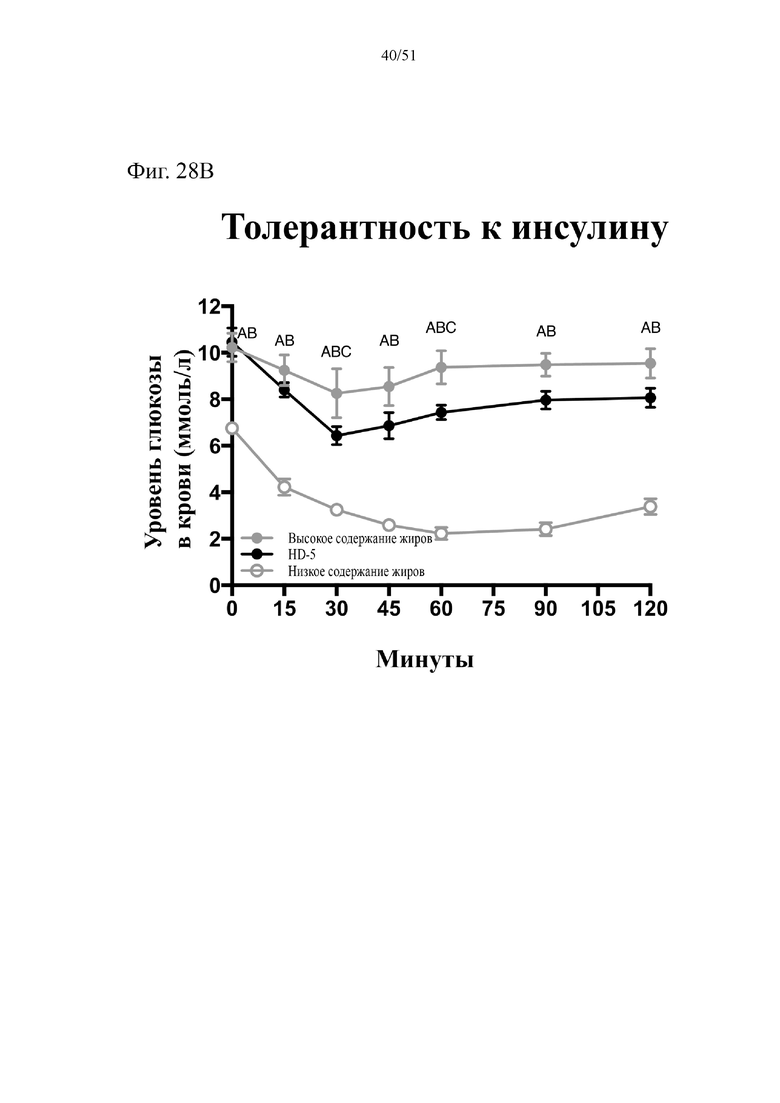
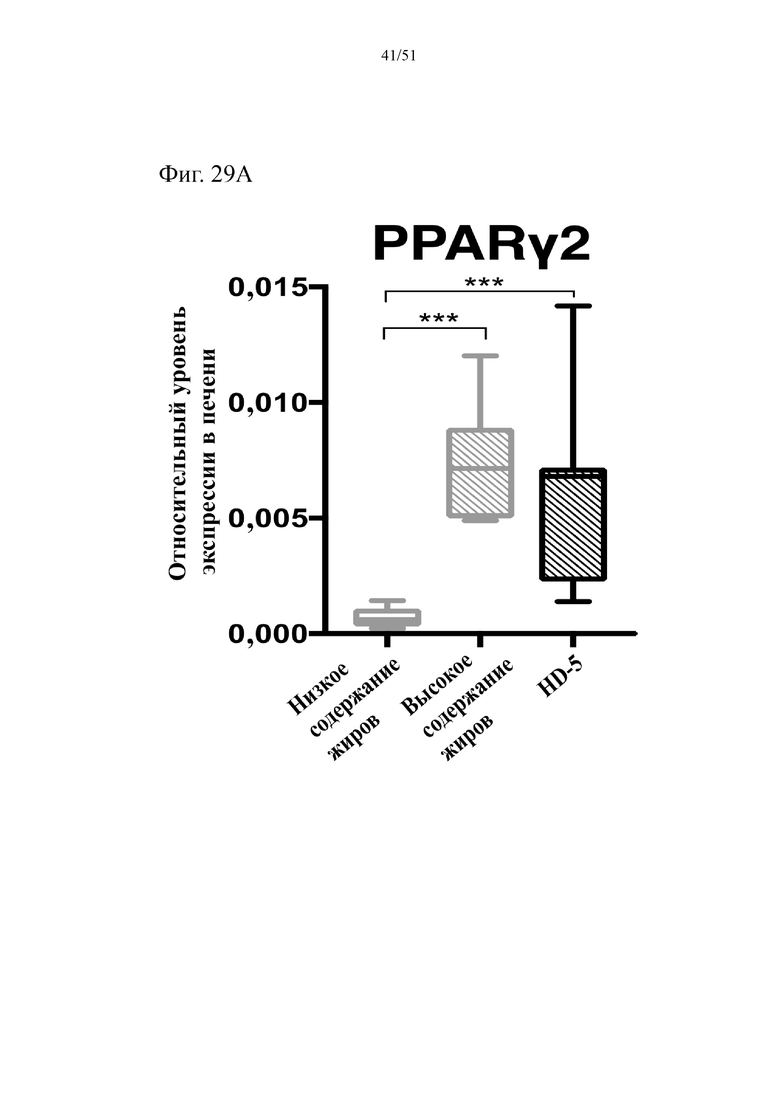
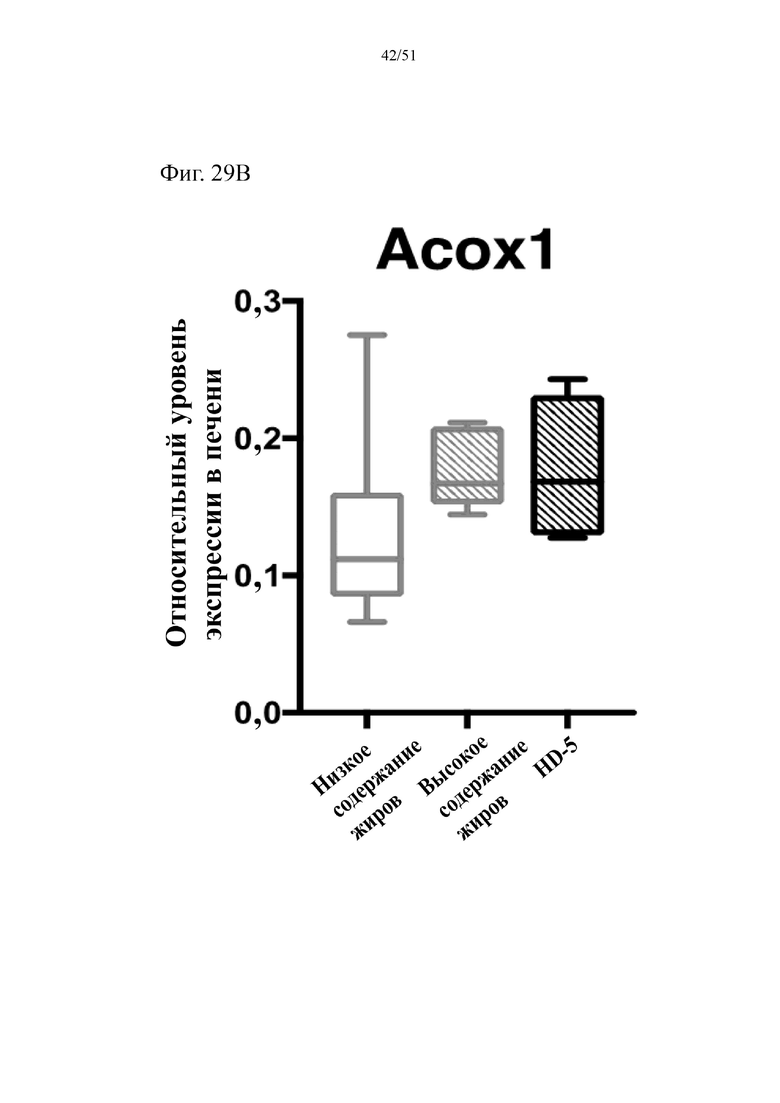
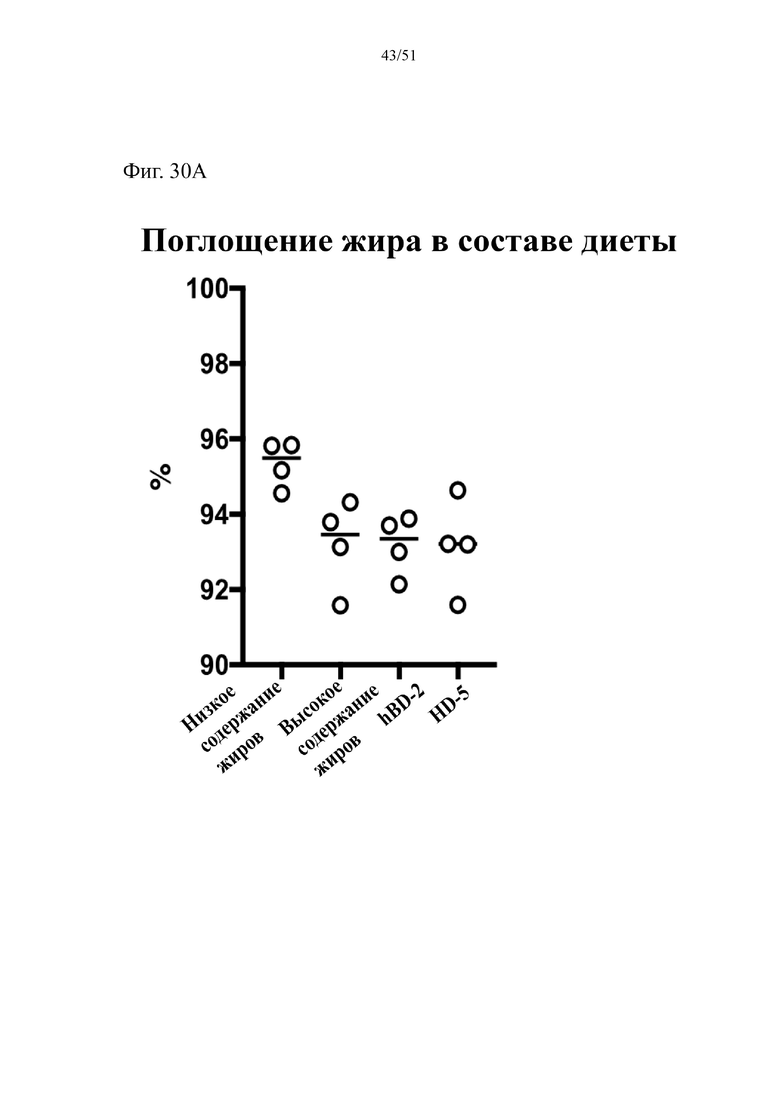
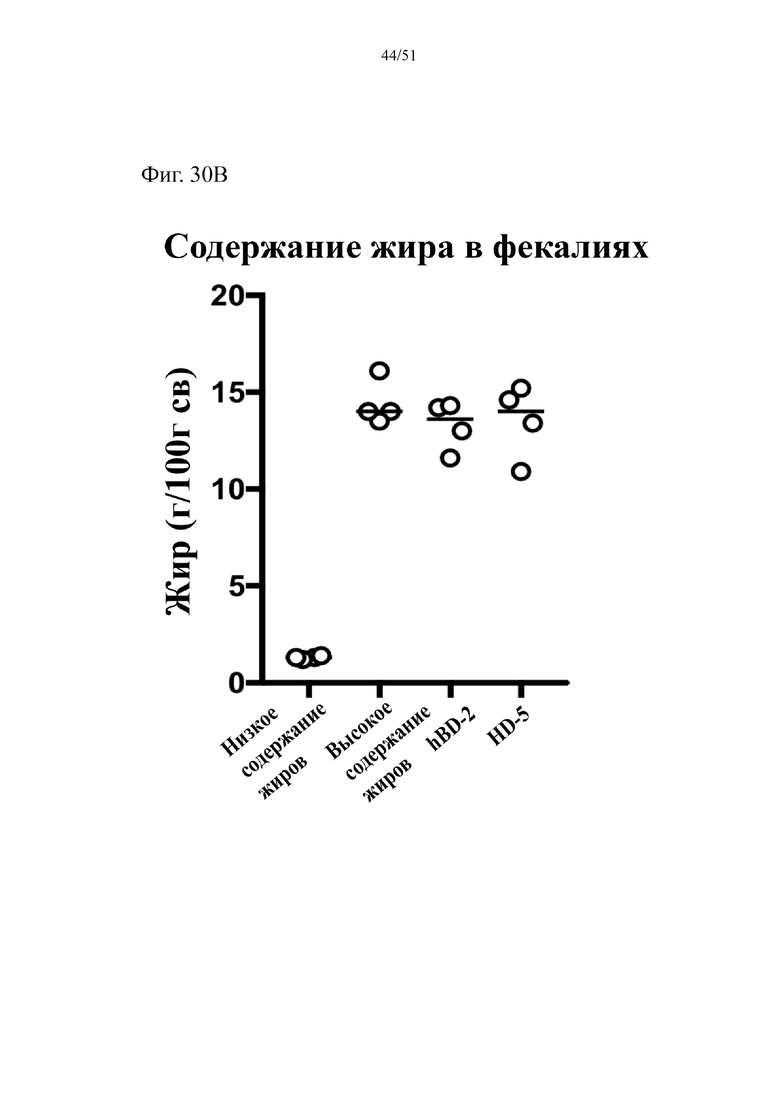
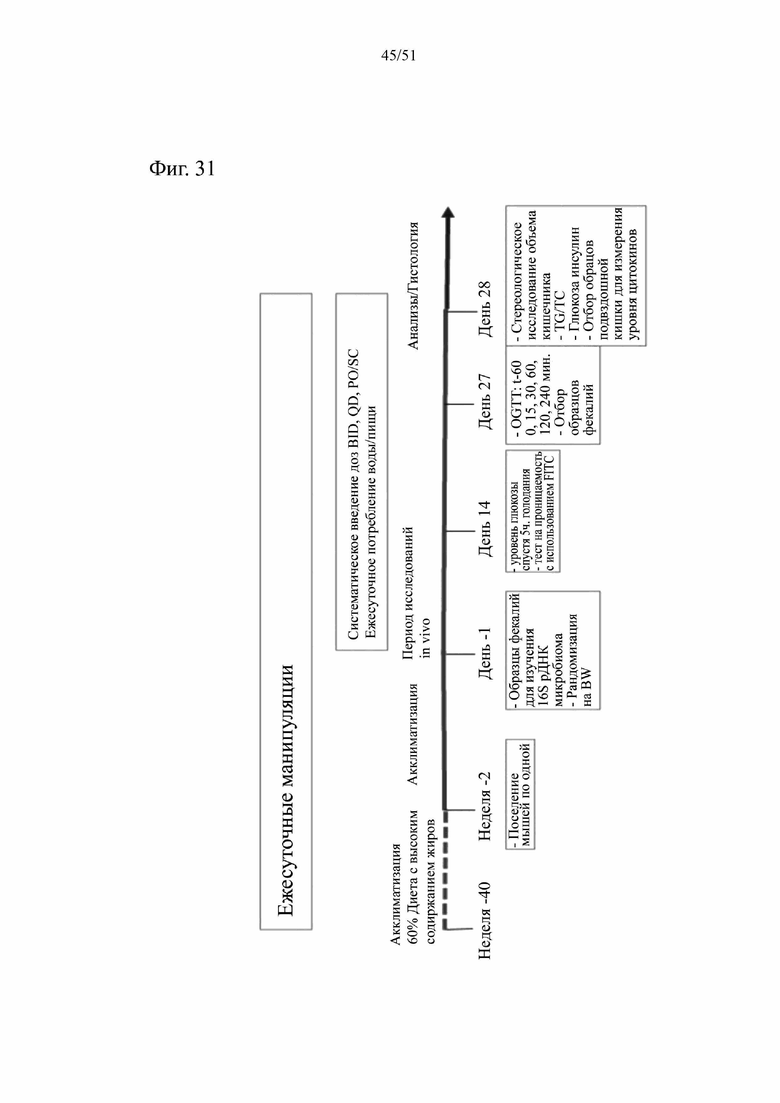
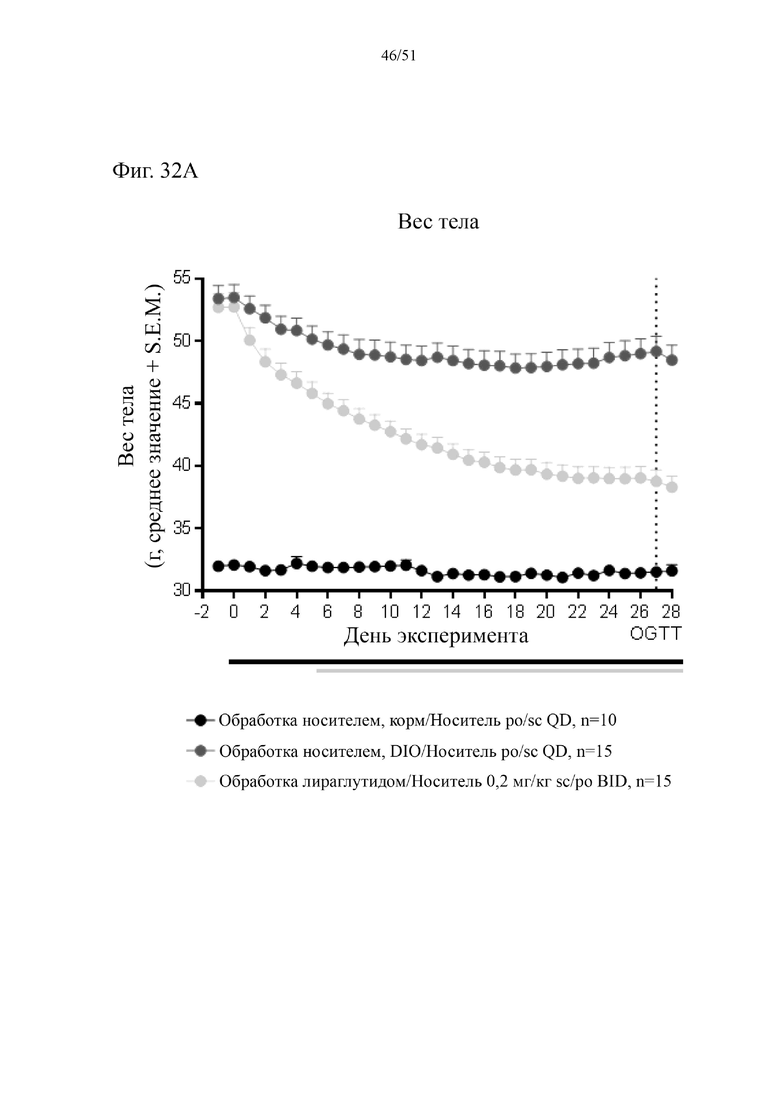
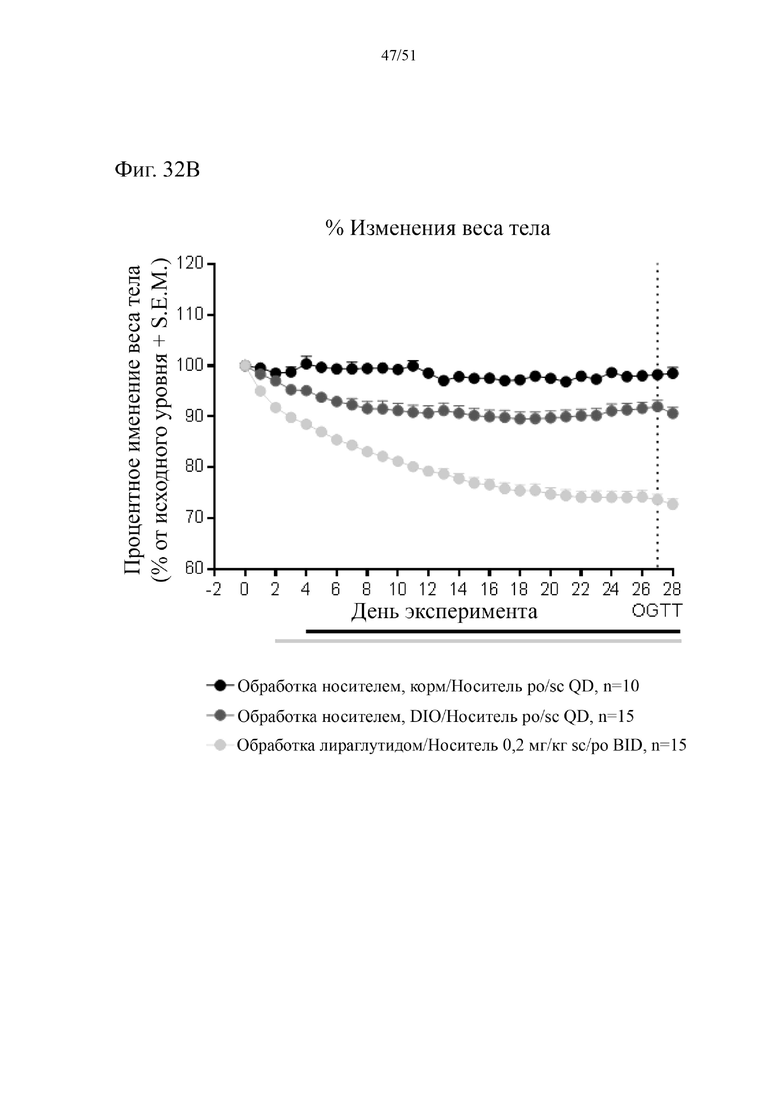
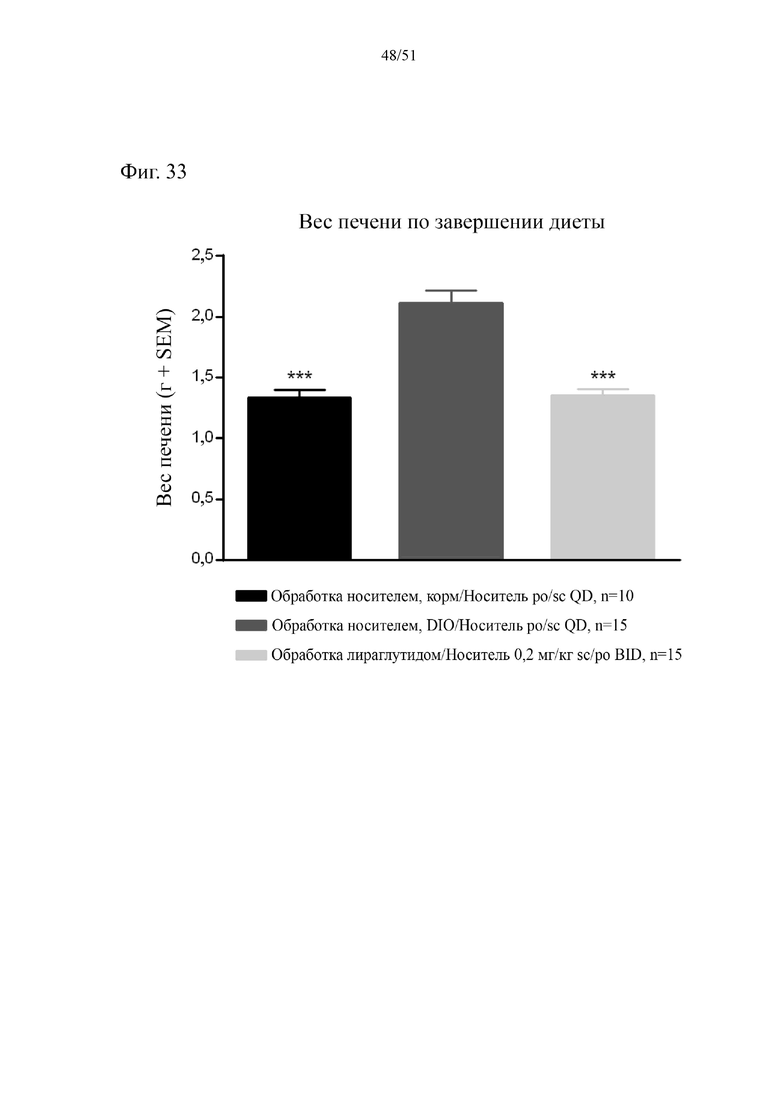
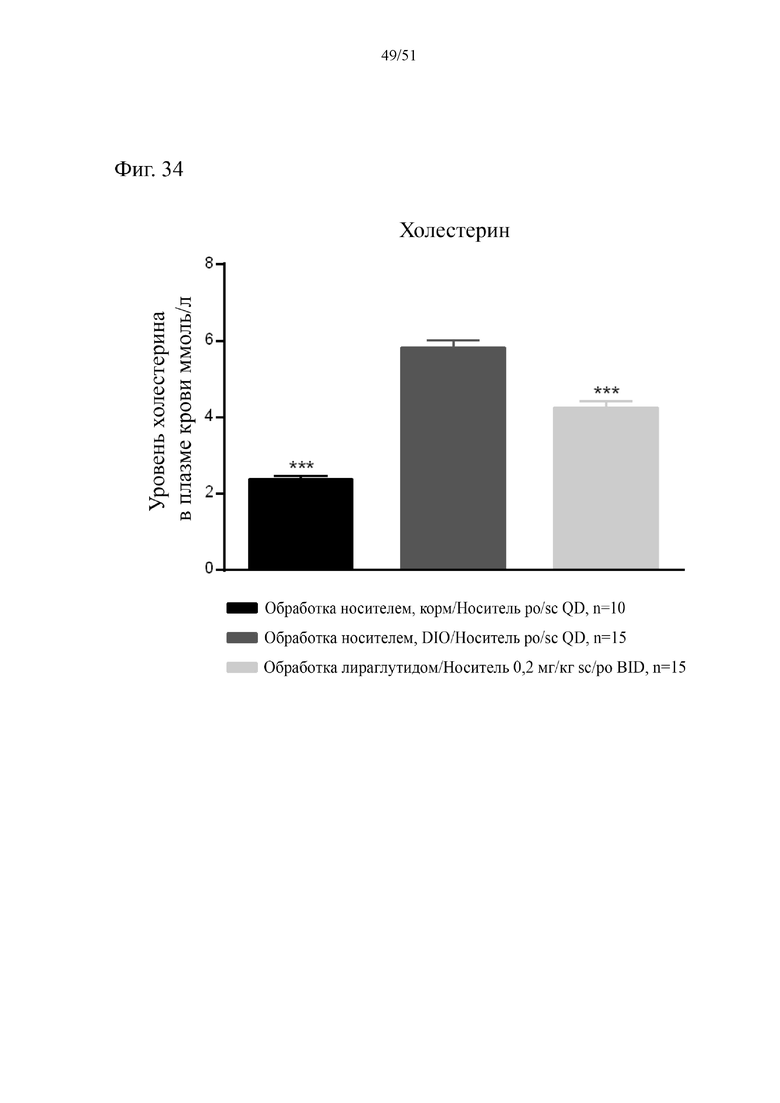
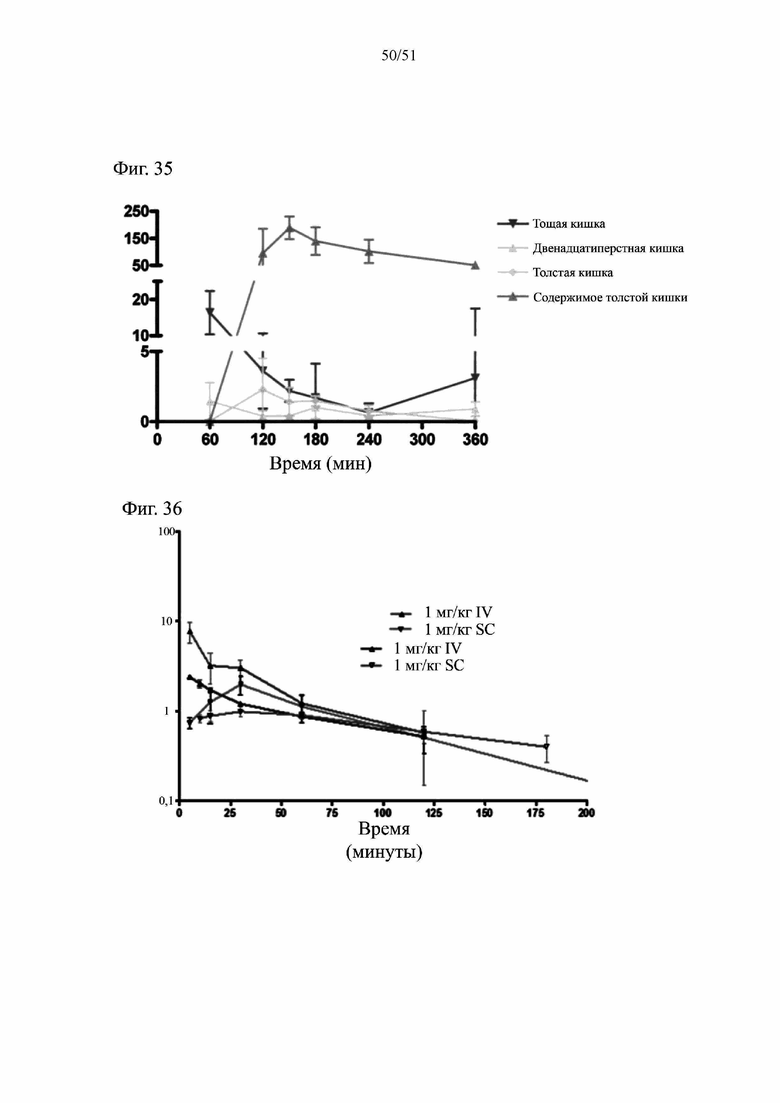
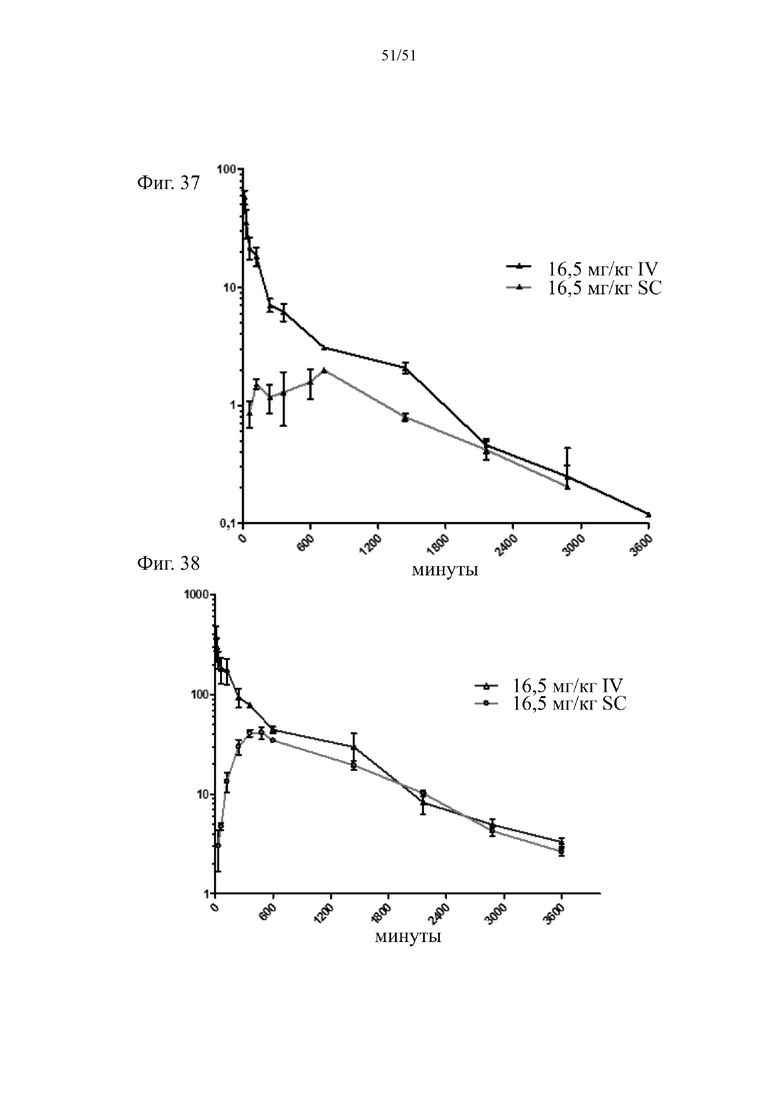
Группа изобретений относится к способам лечения или предупреждения нарушений со стороны печени, желчных путей и поджелудочной железы. Способ лечения или предупреждения заболевания или нарушения печени, выбранного из группы, состоящей из токсического поражения печени, алкогольной или неалкогольной жировой болезни печени (NAFLD), цирроза печени, печеночной недостаточности, фиброза печени, склероза печени, печеночной энцефалопатии, неалкогольного стеатогепатита (NASH), причем указанный способ предусматривает введение эффективного количества α-дефензина и/или β-дефензина млекопитающих, выбранного из группы, состоящей из hBD-2 (SEQ ID NO: 5), усеченного hBD2 (SEQ ID NO: 17), hBD-1 (SEQ ID NO: 4), hBD-3 (SEQ ID NO: 6), и hBD-4 (SEQ ID NO: 7), β-дефензина, который отличается от hBD1, hBD2, hBD3, hBD4, или усеченного hBD2 (SEQ ID NO: 17) менее чем на 5 консервативных аминокислотных замен, HD5 (SEQ ID NO: 8), и/или HD6 (SEQ ID NO: 9), нуждающемуся в этом субъекту. Также раскрыты способ лечения или предупреждения заболевания или нарушения желчных путей, способ лечения или предупреждения заболевания или нарушения поджелудочной железы, способ лечения или предупреждения метаболического заболевания или нарушения, применение α-дефензина и/или β-дефензина млекопитающих в способе лечения и для получения лекарственного препарата. 6 н. и 29 з.п. ф-лы, 38 ил., 10 пр.
1. Способ лечения или предупреждения заболевания или нарушения печени, выбранного из группы, состоящей из токсического поражения печени, алкогольной или неалкогольной жировой болезни печени (NAFLD), цирроза печени, печеночной недостаточности, фиброза печени, склероза печени, печеночной энцефалопатии, неалкогольного стеатогепатита (NASH), причем указанный способ предусматривает введение эффективного количества α-дефензина и/или β-дефензина млекопитающих, выбранного из группы, состоящей из hBD-2 (SEQ ID NO: 5), усеченного hBD2 (SEQ ID NO: 17), hBD-1 (SEQ ID NO: 4), hBD-3 (SEQ ID NO: 6), и hBD-4 (SEQ ID NO: 7), β-дефензина, который отличается от hBD1, hBD2, hBD3, hBD4, или усеченного hBD2 (SEQ ID NO: 17) менее чем на 5 консервативных аминокислотных замен, HD5 (SEQ ID NO: 8), и/или HD6 (SEQ ID NO: 9), нуждающемуся в этом субъекту.
2. Способ лечения или предупреждения заболевания или нарушения желчных путей, выбранного из группы, состоящей из холангита, первичного склерозирующего холангита и холецистита, причем указанный способ предусматривает введение эффективного количества α-дефензина и/или β-дефензина млекопитающих, выбранного из группы, состоящей из hBD-2 (SEQ ID NO: 5), усеченного hBD2 (SEQ ID NO: 17), hBD-1 (SEQ ID NO: 4), hBD-3 (SEQ ID NO: 6), и hBD-4 (SEQ ID NO: 7), β-дефензина, который отличается от hBD1, hBD2, hBD3, hBD4, или усеченного hBD2 (SEQ ID NO: 17) менее чем на 5 консервативных аминокислотных замен, HD5 (SEQ ID NO: 8), и/или HD6 (SEQ ID NO: 9), нуждающемуся в этом субъекту.
3. Способ лечения или предупреждения заболевания или нарушения поджелудочной железы, выбранного из панкреатита, причем указанный способ предусматривает введение эффективного количества α-дефензина и/или β-дефензина млекопитающих, выбранного из группы, состоящей из hBD-2 (SEQ ID NO: 5), усеченного hBD2 (SEQ ID NO: 17), hBD-1 (SEQ ID NO: 4), hBD-3 (SEQ ID NO: 6), и hBD-4 (SEQ ID NO: 7), β-дефензина, который отличается от hBD1, hBD2, hBD3, hBD4, или усеченного hBD2 (SEQ ID NO: 17) менее чем на 5 консервативных аминокислотных замен, HD5 (SEQ ID NO: 8), и/или HD6 (SEQ ID NO: 9), нуждающемуся в этом субъекту.
4. Способ лечения или предупреждения метаболического заболевания или нарушения, выбранного из группы, состоящей из гиперхолестеринемии; гиперглицеридемии; гиперлипидемии; гиперхиломикронемии; гликогеноза; ганглиозидоза и сфинголипидоза, причем указанный способ предусматривает введение эффективного количества α-дефензина и/или β-дефензина млекопитающих, выбранного из группы, состоящей из hBD-2 (SEQ ID NO: 5), усеченного hBD2 (SEQ ID NO: 17), hBD-1 (SEQ ID NO: 4), hBD-3 (SEQ ID NO: 6), и hBD-4 (SEQ ID NO: 7), β-дефензина, который отличается от hBD1, hBD2, hBD3, hBD4, или усеченного hBD2 (SEQ ID NO: 17) менее чем на 5 консервативных аминокислотных замен, HD5 (SEQ ID NO: 8), и/или HD6 (SEQ ID NO: 9), нуждающемуся в этом субъекту.
5. Способ по любому из пп. 1-4, в котором α-дефензин и/или β-дефензин млекопитающих вводят по меньшей мере два-три раза в сутки, как, например, два раза в сутки, как, например, три раза в сутки.
6. Способ по любому из пп. 1-4, в котором α-дефензин и/или β-дефензин млекопитающих дополнительно не содержат пептид, увеличивающий период полувыведения.
7. Способ по любому из пп. 1-4, в котором дефензин вводят нуждающемуся в этом субъекту при суточной дозе от 0,1 мг hBD-2/кг до 10 мг hBD-2/кг.
8. Способ по любому из пп. 1-4, в котором дефензин вводят нуждающемуся в этом субъекту при суточной дозе 1,2 мг hBD-2/кг.
9. Способ по любому из пп. 1-4, в котором дефензин вводят нуждающемуся в этом субъекту при суточной дозе от 0,1 мг HD5/кг до 10 мг HD5/кг.
10. Способ по любому из пп. 1-4, в котором дефензин вводят нуждающемуся в этом субъекту при суточной дозе 1,2 мг HD5/кг.
11. Способ по любому из пп. 1-4, в котором α- и β-дефензины вводят нуждающемуся в этом субъекту при любом отношении, например при суточной дозе 0,6 мг HD5/кг и 0,6 мг hBD-2/кг.
12. Способ по любому из пп. 1-4, в котором указанный дефензин дополнительно содержит по меньшей мере один дополнительный фрагмент, выбранный из группы, состоящей из проникающего в клетку пептида (CPP), альбумин связывающего фрагмента (ABM), детектируемого фрагмента (Z) и пептида, увеличивающего период полувыведения.
13. Способ по п. 1, в котором заболевание или нарушение печени выбрано из NAFLD и NASH.
14. Способ по любому из пп. 1-4, предусматривающий введение по меньшей мере одного α-дефензина млекопитающих.
15. Способ по любому из пп. 1-4, предусматривающий введение по меньшей мере одного β-дефензина млекопитающих.
16. Способ по любому из пп. 1-4, предусматривающий введение по меньшей мере одного α-дефензина млекопитающих и по меньшей мере одного β-дефензина млекопитающих.
17. Способ по любому из пп. 1-4, причем указанный способ предусматривает введение эффективного количества α-дефензина и/или β-дефензина млекопитающих, по отдельности или в комбинации с антибиотиками, и/или инсулином/аналогами инсулина, и/или глюкагоноподобным пептидом-1 (GLP-1)/аналогами GLP-1, и/или глюкагоноподобным пептидом-2 (GLP-2)/аналогами GLP-2, и/или ингибитором дипептидилпептидазы IV (DPP-IV), и/или метформином, и/или ингибитором натрий-зависимого транспортера глюкозы-2 (SGLT-2), и/или антагонистом рецептора глюкагона, и/или антагонистом представителя 1 подсемейства V катионных каналов транзиторного рецепторного потенциала (TRPV1) нуждающемуся в этом субъекту.
18. Способ по любому из пп. 1-4, в котором дефензин млекопитающих представляет собой HD5 и/или дефензин млекопитающих представляет собой hBD-2.
19. Способ по любому из пп. 1-4, в котором у субъекта наблюдается BMI 25 или больше, как, например, 30 или больше, например 35 или больше, как, например, 40 или больше.
20. Способ по любому из пп. 1-4, в котором у субъекта наблюдается соотношение талии и бедер по меньшей мере 0,80, например 0,80-0,84, как, например, по меньшей мере 0,85 «для лиц женского пола», или по меньшей мере 0,90, например 0,9-0,99, как, например, выше 1,00 «для лиц мужского пола».
21. Способ по любому из пп. 1-4, в котором у субъекта наблюдается уровень глюкозы в крови натощак по меньшей мере 6,1 ммоль/л, например по меньшей мере 7,0 ммоль/л.
22. Способ по любому из пп. 1-4, в котором у субъекта наблюдается уровень гликированного гемоглобина по меньшей мере 42 ммоль/моль Hb, как, например, от 42 до 46 ммоль/моль Hb, как, например, по меньшей мере 48 ммоль/моль Hb.
23. Способ по любому из пп. 1-4, в котором у субъекта наблюдается один или более из следующих симптомов:
- Повышенное артериальное давление: ≥ 140/90 мм рт.ст.;
- Дислипидемия: триглицериды (TG): ≥ 1,695 ммоль/л и холестерин липопротеинов высокой плотности (HDL-C) ≤ 0,9 ммоль/л «для лиц мужского пола», ≤ 1,0 ммоль/л «для лиц женского пола»;
- AST/ALT > 1;
- Уровень глюкозы натощак > 6,1 ммоль/л;
- Центральное ожирение: соотношение талия:бедра > 0,90 «для лиц мужского пола»; > 0,85 «для лиц женского пола» или индекс массы тела > 30 кг/м2; и
- Микроальбуминурия: скорость экскреции альбумина с мочой ≥ 20 мкг/мин или соотношение альбумин:креатинин ≥ 30 мг/г.
24. Способ по п. 12, в котором дополнительный фрагмент представляет собой пептид, увеличивающий период полувыведения.
25. Способ по п. 12, в котором дополнительный фрагмент выбран из группы, состоящей из молекулы, способной к связыванию с неонатальным Fc-рецептором (FcRn), трансферрина, альбумина (HSА), XTEN или ПЭГ, гомо-аминокислотного полимера (HAP), полимера на основе пролина-аланина-серина (PAS) или эластинподобного пептида (ELP), гиалуроновой кислоты, отрицательно заряженного сиалированного пептида, такого как карбокси-концевой пептид (CTP) β-цепи хорионического гонадотропина (CG), IgG человека и CH3(CH2)nCO-, где n равняется 8-22.
26. Способ по любому из пп. 1-4, в котором дефензин вводят нуждающемуся в этом субъекту один раз в сутки.
27. Способ по любому из пп. 1-4, в котором дефензин вводят нуждающемуся в этом субъекту два раза в сутки.
28. Способ по любому из пп. 1-4, в котором дефензин вводят нуждающемуся в этом субъекту три раза в сутки.
29. Способ по любому из пп. 1-4, в котором дефензин вводят нуждающемуся в этом субъекту один раз, два раза или три раза в неделю, например, через сутки.
30. Способ по любому из пп. 1-4, в котором дефензин применяют в качестве биологически активной добавки к пище или напиткам.
31. Способ по любому из пп. 1-4, в котором введение дефензина нуждающемуся в этом субъекту является пероральным.
32. Способ по любому из пп. 1-4, в котором введение дефензина нуждающемуся в этом субъекту является подкожным.
33. Способ по п. 17, в котором введение аналога GLP-1 является подкожным.
34. Применение α-дефензина и/или β-дефензина млекопитающих, выбранного из группы, состоящей из hBD-2 (SEQ ID NO: 5), усеченного hBD2 (SEQ ID NO: 17), hBD-1 (SEQ ID NO: 4), hBD-3 (SEQ ID NO: 6), и hBD-4 (SEQ ID NO: 7), β-дефензина, который отличается от hBD1, hBD2, hBD3, hBD4, или усеченного hBD2 (SEQ ID NO: 17) менее чем на 5 консервативных аминокислотных замен, HD5 (SEQ ID NO: 8), и/или HD6 (SEQ ID NO: 9) в способе лечения по любому из пп. 1-33.
35. Применение α-дефензина и/или β-дефензина млекопитающих, выбранного из группы, состоящей из hBD-2 (SEQ ID NO: 5), усеченного hBD2 (SEQ ID NO: 17), hBD-1 (SEQ ID NO: 4), hBD-3 (SEQ ID NO: 6), и hBD-4 (SEQ ID NO: 7), β-дефензина, который отличается от hBD1, hBD2, hBD3, hBD4, или усеченного hBD2 (SEQ ID NO: 17) менее чем на 5 консервативных аминокислотных замен, HD5 (SEQ ID NO: 8), и/или HD6 (SEQ ID NO: 9) для получения лекарственного препарата для лечения по любому из пп. 1-33.
| CN 104971343 A, 14.10.2015 | |||
| WO 2012177929 A2, 27.12.2012 | |||
| WO 2007148078 A1, 27.12.2007 | |||
| CN 105504063 A, 20.04.2016 | |||
| Mattar E.H | |||
| et.al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Способ приготовления массы для обмазки железных электродов, применяемых в электросварке | 1925 |
|
SU2785A1 |
| БЕЛИКОВ В.Г | |||
| Фармацевтическая химия: М., Высшая школа, 1993, с | |||
Авторы
Даты
2021-01-21—Публикация
2017-04-28—Подача