ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к разведению рыбы, в частности, к разведению лососевых, более конкретно к новому корму для рыбы и способу для смолтификации и предупреждения десмолтификации лососевых и к профилактике и лечению геморрагического синдрома смолта (ГСС) у лососевых.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Salmo sp., Onchorhynchus sp.и Salvelinus sp. представляют собой виды, относящиеся к семейству лососевых, которые ведут анадромный образ жизни. Анадромный образ жизни означает, что рыбы на протяжении своей жизни обитают и в пресной, и в морской воде.
В пресной воде лососевые, решающие мигрировать в морскую воду, проходят физиологический процесс под названием смолтификация.
В природе процесс смолтификации управляется эндогенными процессами в организме рыбы, которые синхронизируются с внешними сигналами из окружающей рыбу среды (например, темнотой, светом, температурой воды и т.д.). Смолтами называют лососевых рыб в пресной воде, готовых к миграции в морскую воду. В процессе смолтификации задействовано несколько эндокринных сигнальных субстанций, таких как мелатонин, рилизинг-гормоны гипофиза, тиреотропный гормон (ТТГ), пролактин (ПРЛ), гормон роста (ГР) и адренокортикотропный гормон (АКТГ). В организме рыбы мишенями данных соединений являются несколько органов (примерами являются щитовидная железа и надпочечники), которые секретируют сигнальные вещества, которые в свою очередь изменяют внешний вид, поведение, рост и обмен веществ, состав тканей тела и способность поддерживать осмотический баланс в морской воде.
Чтобы справиться с избытком воды в организме в пресной воде лососевые закачивают внутрь ионы (Cl-, Na+, K+, Са2+) из окружающей среды (например, через жабры), реабсорбируют ионы из мочи (например, Са2+, Mg2+) и одновременно экскретируют сильно разведенную мочу. Когда рыбы адаптируются к морской воде, эта физиологическая активность должна переключаться в обратном направлении. Благодаря процессу смолтификации лососевые приобретают способность выкачивать соль из организма (например, Na+и Cl- через жабры), экскретировать избыток ионов с концентрированной мочой (например, Са2+, Mg2+) и реабсорбировать воду из мочи в почках.
У выращиваемого лосося, проходящего смолтификацию в пресной воде, иногда наблюдается вялость, оттопыренная чешуя, бледные жабры и множественные кровотечения во внутренних органах, таких как сердечная и скелетные мышцы, печень и висцеральная жировая ткань. В группе рыб может умеренно повышаться смертность. Описанное состояние носит название геморрагического синдрома смолта (ГСС). Причина данного заболевания полностью не изучена. В научной литературе в качестве возможных объяснений предлагали недостаточность питания, генетические нарушения, а также присутствие вирусных частиц в тканях.
Смолты, остающиеся в пресной воде после завершения процесса смолтификации, склонны к появлению взъерошенной чешуи. Взъерошенная чешуя затрудняет обращение с рыбой и ее транспортировку, поскольку легко происходит повреждение кожи. Такие повреждения представляют собой входные ворота для инфекций (например, Saprolegnia sp, Moritella viscosa, Tenacibaculum maritimum) и вызывают появление язв и нарушение осмотического баланса, как в пресной воде, так и в морской воде.
Если, достигнув стадии смолта, или покатного состояния, рыба остается в пресной воде, процесс смолтификации будет развиваться в обратном направлении, и рыба будет стараться заново достигнуть физиологического баланса, подходящего для жизни в пресной воде. Данный процесс, называемый десмолтификацией, может сопровождаться потерей аппетита, ерошением чешуи и иногда умеренным увеличением смертности.
Применение обычного зимнего сигнала (фоторегулирование с чередованием 12 ч света и 12 ч темноты в течение суток) при выращивании смолта лосося встречает определенные трудности. Зимний сигнал снижает суточное потребление корма и рост приблизительно на 30%. Зимний сигнал применяют приблизительно в течение 7 недель, затем следует летний сигнал (24-часовой световой день) до тех пор, пока не будет достигнуто покатное состояние. Кроме того, в резервуарах с высокой плотностью рыб (например, >70 кг/м3), что наблюдается в рыбозаводах с интенсивными условиями производства, рыба получает разное количество света, что также вызывает смолтификацию рыбы в разное время. Рыба, живущая на дне глубоких резервуаров среди темных стен, скорее будет получать недостаточно света.
Слишком большое количество биомассы в резервуарах может негативно сказываться на качестве воды (например, уровень CO2 повышается >15 мг/л), если не производится достаточная обработка воды или не происходит замена воды. Плохое качество воды негативно влияет на процесс смолтификации.
Кроме того, крупные рыбы проходят смолтификацию раньше мелких рыб, то же касается и десмолтификации. В рыбозаводах с интенсивными условиями производства сложно поддерживать одинаковый размер рыбы в каждом резервуаре, поскольку число резервуаров ограничено. Таким образом, группа рыб обычно включает рыб разного размера, и смолтификация и десмолтификация происходят в группе в разное время.
По мере того, как протекает процесс смолтификации, рыбам становится все труднее оставаться в пресной воде, поскольку физиология рыбы приспосабливается к морской воде. Это может проявляться умеренным повышением смертности в группе рыб. На этой стадии выращивания обычно находят рыб с ГСС, а также наблюдают снижение аппетита и роста.
В целом, эти явления затрудняют выращивание как в пресной воде, так и в морской воде. При выращивании в пресной воде наблюдается снижение роста и некоторая смертность, а при выращивании в морской воде в морскую воду переходят группы смолтов с неоднородным покатным состоянием. Это означает, что некоторые рыбы в морской воде либо погибают от проблем с осморегуляцией, либо могут выжить, но плохо кормятся и больше подвержены затяжному стрессу и возникновению вторичных заболеваний. Средний уровень смертности при выращивании норвежского лосося от времени перевода до отлова, на протяжении многих лет составлял приблизительно 20%. Исследования, проведенные Управлением по контролю качества продуктов питания Норвегии (2013) показали, что приблизительно в 40% случаев смертность обусловлена низким качеством смолтов.
Органы, задействованные в процессе смолтификации (например, шишковидная железа, гипоталамус, гипофиз, почки, кишечник, жабры и кожа), имеют на внешней поверхности клеточной стенки рецепторы, относящиеся к типу кальций-чувствительных рецепторов (CaSR, от англ. Calcium Sensing Receptors). На CaSR могут воздействовать различные модуляторы, включая ионы (такие как Са2+, Mg2+, Cl-, Na+, Н+) и свободные аминокислоты (такие как триптофан). Стимуляция CaSR приводит к активации или подавлению различных видов внутриклеточной активности. Контролируемая стимуляция CaSR может вызывать ответ, соответствующий процессу смолтификации.
Примером такой контролируемой стимуляции является метод SuperSmolt ®, при котором в эксплуатируемую воду добавляют ионы (Са2+, Mg2+, Cl-) в комбинации с кормом для рыб, содержащим добавленные ионы Na+, Cl- и триптофан. Метод SuperSmolt ® описан в заявке на международный патент WO 02/30182, содержание которого включено во всей полноте в данное описание путем ссылки. Термин «корм для рыб», как его понимают в контексте метода SuperSmolt ® и используют далее в данной заявке, означает корм, состоящий из белков, жиров, углеводов, витаминов и минералов, предназначенный для пестряток и смолтов лососевых в пресной воде. Композиция такого корма для выращивания может содержать указанные сырые вещества или их части. Специалисту в области техники знакомы типы корма, предназначенные для этих целей, в отличие от корма, предназначенного для других биологических видов или стадий роста. Примером такого корма для рыб, применяемого в методе SuperSmolt®, является семейство продуктов, известных как SuperSmolt Xcelerator ™ и SuperSmolt Xcelerator Plus 2.5.. ™, производимых дочерней компанией заявителя Polarfeed AS, которые должны использоваться под руководством дочерней корпорации ACD Pharmeceuticals AS. Эти специальные корма содержат белки (44%), жиры (24%), воду (7>%) и другие ингредиенты, включая рыбий жир, мясо рыбы, пшеницу, глютен пшеницы, сою, подсолнечник, витамины и минералы, пигменты и мясо криля в качестве дополнительного усилителя вкуса. Корм имеет энергетическую ценность МДж/кг минимум 21 с содержанием белка морепродуктов минимум 75%. Размер гранул составляет 2,5 мм для рыб размером (г) 25-60, и размер гранул 3,0 мм для рыб размером (г) 40-150.
Метод SuperSmolt® делает возможным процесс смолтификации лососевых без применения зимнего и летнего сигналов (темнота/свет), но с применением непрерывного освещения (24 часа/сутки) вплоть до перевода в морскую воду, таким образом, избегая применения зимнего сигнала, снижающего рост. Кроме того, применение данного способа позволяет поддерживать рыб на стадии смолта, предотвращая десмолтификацию, что обеспечивает нормальный рост также во время процесса смолтификации в пресной воде.
Очевидным преимуществом метода SuperSmolt ® является эффективность выращивания, как в пресной, так и в морской воде. Становится возможным поддержание нормального роста в пресной и морской воде, перевод групп смолтов в морскую воду, при этом рыбы имеют однородное покатное состояние, и таким образом, сокращаются производственные потери по причине смертности, снижения аппетита и повышенного риска возникновения заболеваний.
Однако метод SuperSmolt ® имеет несколько недостатков. Данный метод требует добавления больших количеств солей (ионов) в эксплуатируемую воду, на протяжении длительного периода времени (3-6 недель). Это затруднительно с практической точки зрения и значительно повышает стоимость выращивания. Таким образом, данный способ редко применяют для содержания рыбы в пресной воде в течение длительного времени (<6 недель), поскольку стоимость и практические обстоятельства делают его неподходящим.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, задачей данного изобретения в одном аспекте является обеспечение корма для рыб и способа, которые устранят или уменьшат недостатки метода SuperSmolt ®. Это достигается путем составления корма для рыб, который сам по себе может обеспечить смолтификацию рыбы без применения солей в эксплуатируемой воде и, в то же время, позволяет поддерживать рыбу в стадии смолта в течение длительного времени. В изобретении предложен упрощенный процесс смолтификации, по сравнению с SuperSmolt ®, поскольку нет необходимости добавления солей в эксплуатируемую воду, и его можно легко применять в качестве дополнительного стимула к применению зимнего и летнего сигналов или в качестве дополнительного стимула при неадекватных зимнем и летнем сигналах в процессе смолтификации. Кроме того, предполагается, что возможно содержание лососевых в пресной воде без десмолтификации, гибели или медленного роста рыбы, без возникновения геморрагического синдрома смолта или ерошения чешуи вплоть до достижения товарного размера (размер >200 граммов, зачастую более 4-6 кг).
Согласно одному аспекту изобретения предложен способ, при котором рыбу можно содержать в пресной воде до достижения товарного размера.
Согласно одному аспекту изобретения предложен корм для рыбы, содержащий белки, жиры, углеводы, витамины, минералы и воду, NaCl от 10 до 100 г/кг, с добавлением модулятора рецепторов поливалентных катионов (PVCR, от англ. polyvalent cation receptor modulator), например, триптофана или фенилаланина, 1-10 г/кг, также с добавлением солей магния (Mg2+), таких как MgCl2, от 0,1 до 100 г/кг и/или солей кальция (Са2+), например, CaCl2, от 0,1 до 100 г/кг.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В одном аспекте данного изобретения предложен корм для рыб, в который добавлены соли (ионы) и модуляторы PVCR (свободные аминокислоты) согласно следующей Таблице 1. Все указанные численные значения охватывают различные промежуточные диапазоны, как если бы эти промежуточные диапазоны были упомянуты в явном виде, например, следует понимать, что диапазон 1-10 также включает 1-9, 1-8, 1-7 (и т.д.); 2-10, 3-10, 4-10 (и т.д.); 1-9, 2-8, (и т.д.).

Модуляторы PVCR включают свободные аминокислоты, упомянутые в описании, в отдельности или в комбинации: Триптофан, тирозин, фенилаланин, серии, аланин, аргинин, гистидин, лейцин, изолейцин, аспарагиновую кислоту, глутаминовую кислоту, глицин, лизин, метионин, пролин, глутамин, аспарагин, треонин, валин и цистеин, в концентрациях 1-10 граммов/кг корма для рыбы.
Согласно другому аспекту корм для рыб может содержать различные комбинации указанных выше дополнительных компонентов. Неисчерпывающими примерами таких комбинаций являются:
1. Na, Cl, Са и Mg
2. Cl, Са, Mg,
3. Са, Mg,
4. Са, Na, Cl
5. Са, Na, Mg
6. Са, Na
7. Са, Cl
8. Са
9. Mg, Na, Cl
10. Cl, Mg
11. Mg
12. свободные аминокислоты, Na, Cl и Са
13. свободные аминокислоты, Na, Cl и Mg
14. свободные аминокислоты, Na, Са, Mg
15. свободные аминокислоты, Na, Са
16. свободные аминокислоты, Na, Mg
17. свободные аминокислоты, Cl, Са, Mg
18. свободные аминокислоты, Cl, Mg
19. свободные аминокислоты, Cl, Са
20. свободные аминокислоты, Са, Mg, Cl
21. свободные аминокислоты, Са, Mg
22. свободные аминокислоты, Са.
Термин «корм для рыб» в данном описании понимают как корм, состоящий из белков, жиров, углеводов, витаминов, минералов, пигментов и воды, подходящий для пестряток и смолтов лососевых в пресной воде. Композиция такого корма для выращивания может содержать указанные сырые вещества или их части:
Источник белка:
Концентрат белка сои (например, SPC65), белок сои (например, HiPro Soy), белок гороховой муки, мука подсолнечника, глютен пшеницы, глютен кукурузы, конские бобы/кормовые бобы, рапсовая мука, люпин, куриная мука, мясокостная мука, кровяная мука, гуаровая мука, белки микроорганизмов (после ферментации различных субстратов), белки водорослей, мука из моллюсков, мука из криля, гидролизат криля, гидролизат рыбы, рыбная мука (например, из норвежской сельди, скумбрии, ставриды, песчанки, мойвы, анчоусов, менхадена и др.).
Источник углеводов:
Пшеница или другие подходящие источники углеводов, известные в области техники
Источник жиров:
Рыбий жир (например, из норвежской сельди, скумбрии, ставриды, песчанки, мойвы, анчоусов, менхадена и др.), масло из семян рапса, масло из семян льна.
Минералы и витамины:
Добавляют согласно действующим рекомендациям по кормлению пестряток и смолтов лососевых в пресной воде
Пигменты:
Астаксантины или другие пигменты, известные в области техники
Специалисту в области техники знакомы такие корма и надлежащий состав, который необходимо рассчитать для обеспечения роста пестряток и смолтов лососевых в пресной воде.
Корм для рыб согласно изобретению, неожиданно позволяет обеспечить:
 Выращивание смолта анадромных лососевых для перевода в морскую воду (10-150 г)
Выращивание смолта анадромных лососевых для перевода в морскую воду (10-150 г)
 Поддержание нормального ионного баланса и осморегуляции для анадромных лососевых в пресной воде, включая, без ограничений:
Поддержание нормального ионного баланса и осморегуляции для анадромных лососевых в пресной воде, включая, без ограничений:
 Предупреждение десмолтификации лососевых в пресной воде,
Предупреждение десмолтификации лососевых в пресной воде,
 Предупреждение и/или лечение геморрагического синдрома смолта (ГСС) у анадромных лососевых,
Предупреждение и/или лечение геморрагического синдрома смолта (ГСС) у анадромных лососевых,
 Предупреждение и/или лечение отека чешуйных кармашков, вызывающего выпадение чешуи.
Предупреждение и/или лечение отека чешуйных кармашков, вызывающего выпадение чешуи.
 Выращивание пост-смолтов анадромных лососевых в пресной воде для перевода в морскую воду (>150 г).
Выращивание пост-смолтов анадромных лососевых в пресной воде для перевода в морскую воду (>150 г).
 Выращивание анадромных лососевых в пресной воде до достижения товарного размера для потребления (>100 граммов, чаще всего более 5000 г).
Выращивание анадромных лососевых в пресной воде до достижения товарного размера для потребления (>100 граммов, чаще всего более 5000 г).
 Создание маточного стада анадромных лососевых в пресной воде для получения икры.
Создание маточного стада анадромных лососевых в пресной воде для получения икры.
Согласно одному аспекту изобретение включает комбинирование эквивалента корма SuperSmolt ® с добавлением в корм солей магния и/или кальция, без примешивания указанных солей в эксплуатируемую воду, как в методе SuperSmolt ®.
Согласно другому аспекту изобретения предложен способ:
 Выращивания смолта анадромных лососевых для перевода в морскую воду (10-150 г)
Выращивания смолта анадромных лососевых для перевода в морскую воду (10-150 г)
 Поддержание нормального ионного баланса и осморегуляции у анадромных лососевых в пресной воде, для достижения, без ограничений:
Поддержание нормального ионного баланса и осморегуляции у анадромных лососевых в пресной воде, для достижения, без ограничений:
 Предупреждения десмолтификации лососевых в пресной воде,
Предупреждения десмолтификации лососевых в пресной воде,
 Предупреждения, лечения и/или излечения геморрагического синдрома смолта (ГСС) у анадромных лососевых,
Предупреждения, лечения и/или излечения геморрагического синдрома смолта (ГСС) у анадромных лососевых,
 Предупреждения, лечения и/или излечения такого нарушения, как отек чешуйных кармашков, вызывающий потерю чешуи.
Предупреждения, лечения и/или излечения такого нарушения, как отек чешуйных кармашков, вызывающий потерю чешуи.
 Выращивание пост-смолтов анадромных лососевых в пресной воде для перевода в морскую воду (>150 г).
Выращивание пост-смолтов анадромных лососевых в пресной воде для перевода в морскую воду (>150 г).
 Выращивание анадромных лососевых в пресной воде до достижения товарного размера для потребления (>100 граммов, чаще всего более 5000 г).
Выращивание анадромных лососевых в пресной воде до достижения товарного размера для потребления (>100 граммов, чаще всего более 5000 г).
 Создание маточного стада анадромных лососевых в пресной воде для получения икры.
Создание маточного стада анадромных лососевых в пресной воде для получения икры.
Способ включает осуществление следующих стадий:
а. Обеспечение корма для пестряток или смолта, содержащего белки, жиры, углеводы, витамины, минералы и воду, NaCl от 10 до 100 г/кг, с добавлением модулятора рецепторов поливалентных катионов (PVCR), например, триптофана или фенилаланина, от 1 до 10 г/кг, также с добавлением солей кальция (Са2+), например, CaCl2, от 0,1 до 100 г/кг, и/или солей магния (Mg2+), таких как MgCl2, от 0,1 до 100 г/кг.
b. Подачи корма рыбам в соответствии с аппетитом, при их нахождении в пресной воде или солоноватой воде, до наступления смолтификации.
c. Перевод рыбы в морскую воду после смолтификации.
В альтернативном варианте, рыбу можно оставлять после смолтификации в пресной воде, в данном случае способ может включать после стадий а и b:
Содержание рыбы в пресной воде после наступления смолтификации,
d. Продолжение внесения рыбам корма для рыб до достижения ими желаемого веса в пресной воде и пригодности для потребления человеком или до достижения ими возраста/массы, подходящих для индукции полового созревания, когда от них можно получать икру для выращивания новых рыб или для потребления.
Изобретение более подробно описано ниже, приведены следующие примеры.
Материалы и методы
Биологический материал, условия внешней среды и постановка эксперимента
Провели шесть полевых испытаний с использованием видов атлантического лосося (Salmo salar) и радужной форели (Onchorhynchus mykiss). Перед началом испытаний рыб вакцинировали вакциной на масляной основе и после вакцинации у них восстановился аппетит. Средняя масса рыб перед началом испытаний составила минимум 40 граммов, а в конце в пресной воде - максимум 180 граммов. Экспериментальный рацион применяли в обычных производственных условиях в Норвегии и в Чили в 2012 и 2013 гг. Рыбы получали экспериментальный рацион в течение как минимум 3 недель и не более 11 недель, и только при нахождении в пресной воде. В Таблицах 2 и 3 приведена информация о видах, стадиях, условиях освещения, температуре воды, количестве рыб, размерах рыб, экспериментальном корме и постановке эксперимента.
Таблица 2. Общая характеристика полевых испытаний, условий освещения, температуры воды и типа экспериментальных рационов 


Состав экспериментальных рационов
Корм для рыб в данном описании понимают как корм, состоящий из белков, жиров, углеводов, витаминов и минералов, подходящий для пестряток и смолтов лососевых в пресной воде.
Экспериментальный рацион 1 (соответствующий корму SuperSmolt®):
а. Корм для рыб с добавлением 7% NaCl
b. Корм для рыб с добавлением 0,4% L-триптофана
Экспериментальный рацион 2 (соответствующий воплощению корма для рыб согласно данному изобретению):
a. Корм для рыб с добавлением 6% NaCl
b. Корм для рыб с добавлением 0,75% CaCl2
c. Корм для рыб с добавлением 0,25% MgCl2
d. Корм для рыб с добавлением 0,4% L-триптофана Контрольные рационы:
a. Корм для выращивания пестряток и смолтов, произведенный Skretting AS
b. Корм для выращивания пестряток и смолтов, произведенный Ewos AS.
Параметры для мониторинга влияния экспериментального и контрольного рационов
Образцы отбирали непосредственно перед получением рыбой экспериментального/контрольного рационов и непосредственно перед переводом рыбы в морскую воду. Кроме того, брали образцы между первоначальным и последним взятием образцов.
Активность фермента Na+-K+-АТФазы в тканях жабр
Образцы отбирали непосредственно перед получением рыбой экспериментального рациона и непосредственно перед переводом рыбы в морскую воду. Кроме того, взятие образцов выполняли с разной степенью полноты между первоначальным и последним взятием образцов.
Увеличение количества фермента Na+-K+-АТФазы в тканях жабр во время смолтификации является естественным. Основной функцией данного фермента является выкачивание солей из организма рыбы, необходимое для поддержания осмотического баланса в морской воде. Ткань жабр второй жаберной дуги переносили в пробирку, немедленно замораживали в жидком азоте (-180°С), для последующего анализа количества фермента в жабрах в лабораториях FishGuard AS, Leknes (ранее MultiLab AS), согласно методу, описанному McGormick (1993).
Число копий мРНК альфа 1а (пресноводной АТФазы):
Образцы отбирали непосредственно перед получением рыбой экспериментального рациона и непосредственно перед переводом рыбы в морскую воду. Кроме того, взятие образцов выполняли с разной степенью полноты между первоначальным и последним взятием образцов.
Основной функцией фермента, кодируемого мРНК альфа 1а, является закачивание солей из пресной воды в организм рыбы. Адаптация к жизни в морской воде означает, что активность данного фермента и экспрессия гена должны снизиться. В процессе смолтификации число копий мРНК альфа 1а в жабрах рыбы снижается. Ткань жабр третьей жаберной дуги переносили в пробирку с реагентом mRNA-later для анализа числа копий мРНК альфа 1а согласно методу, разработанному FishGuard AS (2013).
Индекс смолта
В процессе смолтификации наблюдали за внешними изменениями (морфологическими изменениями) рыб. Данные изменения описывали с помощью индекса смолта, основанного на визуальной оценке в баллах от 1 до 4 каждого из следующих параметров: серебристость кожи, темные полосы на боках и черные края плавников, см. Таблицу 4. Индекс смолта представляет собой средний балл этих трех параметров вместе взятых. Индекс смолта регистрировали в то же время, когда брали образцы ткани жабр на анализ фермента Na+-K+-АТФазы.

Хлориды в плазме крови рыбы в тесте с морской водой
При возможности проведения теста с морской водой отбирали рыб для перевода в 34%о морскую воду и содержали в ней в течение 96 часов во время процесса смолтификации. Затем у рыб брали образцы крови и анализировали содержание хлорид-ионов (Cl-) в плазме крови согласно методу, используемому в центральной лаборатории Норвежской Школы Ветеринарных Наук (2012). Данный способ позволяет определить удовлетворительность смолтификации лососевых рыб в пресной воде. Если у рыб осморегуляция в морской воде нормальная (уровень хлоридов в плазме крови составляет 120-150 ммоль/л) в 34%о морской воде через 96 часов, это является признаком того, что рыба находится в стадии смолта.
Ионы в плазме крови рыб в пресной воде
В ходе двух полевых испытаний собирали образцы крови рыб, находящихся в пресной воде, для анализа Са, Mg и Cl в плазме крови. Анализ проводила центральная лаборатория Норвежской Школы Ветеринарных Наук (2012).
Уровень смертности в пресной воде и морской воде
Регистрировали процент гибели в пресной воде при использовании экспериментального корма до перевода рыб в морскую воду. Наблюдали за уровнем смертности в морской воде в группе, получавшей контрольный корм, по сравнению с группой, получавшей экспериментальный корм в пресной воде. Регистрировали уровень смертности через 30, 60 и 90 дней, а также общую смертность при отлове (одно хозяйство с морской водой).
Статистика
Проводили статистическую обработку ряда данных для определения, являются ли различия между двумя точками измерений в экспериментальной группе статистически достоверными (р=0,05 и р=0,01). Аналогичное исследование проводили в контрольной группе.
Результаты
Полевое испытание 1
Активность фермента Na+-K+-АТФазы в тканях жабр
На диаграмме 1 показана динамика фермента Na+-K+-АТФазы в тканях жабр в полевом испытании 1, где экспериментальный рацион 1 применяли в сравнении с контрольным рационом а, представляющим собой корм для выращивания молоди, произведенный Skretting AS. Результаты представляют собой среднее значение для проб, отобранных из 4 экспериментальных резервуаров (n=24 пробы) и 4 контрольных резервуаров (n=24 пробы).
Диаграмма 1: Динамика среднего значения активности фермента Na+-K+-АТФазы в тканях жабр после зимнего сигнала у атлантического лосося, получавшего экспериментальный рацион 1 и контрольный корм а (в каждой группе n=24 пробы)
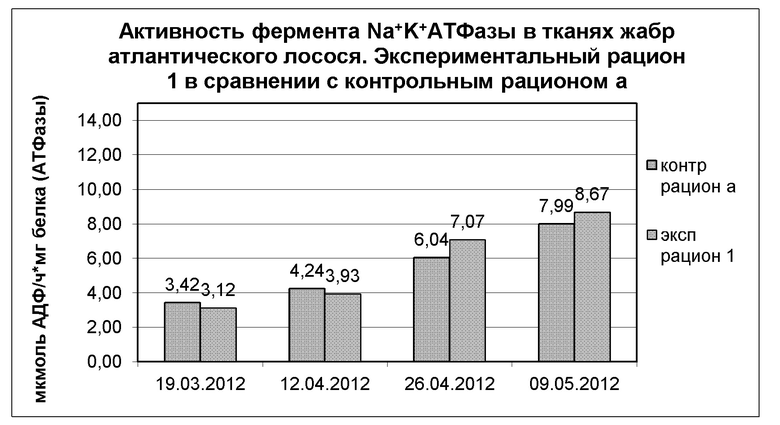
Между 19.03.12 и 12.04.12 наблюдалось значимое изменение АТФазы (р=0,05) в контрольной группе, тогда как в экспериментальной группе не наблюдалось значимых изменений АТФазы (р=0,05). Между 26.04.12 и 09.05.12 наблюдалось значимое изменение АТФазы в контрольной группе в пределах 99% доверительного интервала (р=0,05 и р=0,01), тогда как в экспериментальной группе происходило значимое изменение АТФазы в пределах 95% доверительного интервала (р=0,05). В Таблице 5 представлены обобщенные данные по теме.

Число копий мРНК альфа 1а (пресноводной АТФазы)
Образцы для анализа числа копий мРНК альфа 1а, пресноводной АТФазы, не отбирали.
Индекс смолта
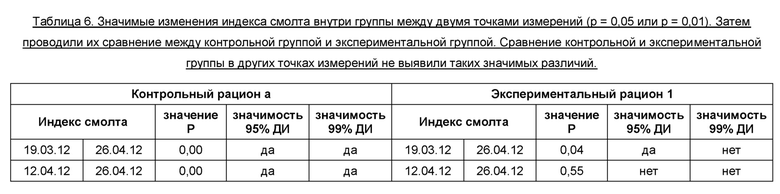
На диаграмме 2 показана динамика индекса смолта в полевом испытании 1, где экспериментальный рацион 1 сравнивали с контрольным рационом а, кормом для выращивания молоди, произведенным Skretting AS. Результаты представляют собой среднее значение для проб, отобранных из 4 экспериментальных резервуаров (n=24 пробы) и 4 контрольных резервуаров (n=24 пробы). Между 19.03.12 и 26.04.12 наблюдалось значимое изменение индекса смолта (р=0,01) в контрольной группе, тогда как в экспериментальной группе не наблюдалось значимых изменений индекса смолта (р=0,01). Между 12.04.12 и 26.04.12 наблюдалось значимое изменение индекса смолта (р=0,05 и 0,01) в контрольной группе, тогда как в экспериментальной группе не наблюдалось значимых изменений индекса смолта (р=0,05 и 0,01). В Таблице 6 представлены обобщенные данные по теме.
Диаграмма 2: Динамика индекса смолта после зимнего сигнала у атлантического лосося, получавшего экспериментальный рацион 1 и контрольный корм а (в каждой группе n=24 пробы).

Хлориды в плазме крови рыбы в нагрузочном тесте с морской водой
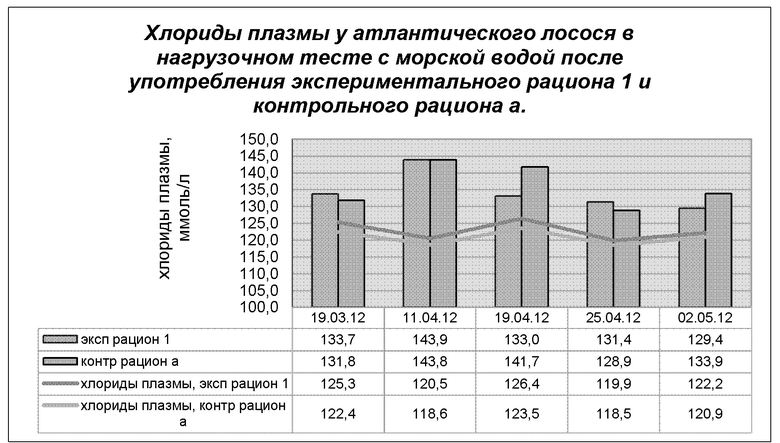
На диаграмме 3 показана динамика хлоридов в плазме в полевом испытании 1, где применяли экспериментальный рацион 1 и сравнивали его с контрольным рационом а, кормом для выращивания молоди, произведенным Skretting AS. Результаты представляют собой среднее значение для проб, отобранных из 2 экспериментальных резервуаров (n=15 проб) и 2 контрольных резервуаров (n=15 проб).
Диаграмма 3: Динамика средней концентрации хлоридов плазмы после зимнего сигнала в морской воде (34%о, 96 часов) у рыб, получавших экспериментальный рацион 1 и контрольный рацион а (в каждой группе n=15 проб).
Ионы в плазме крови рыб в пресной воде
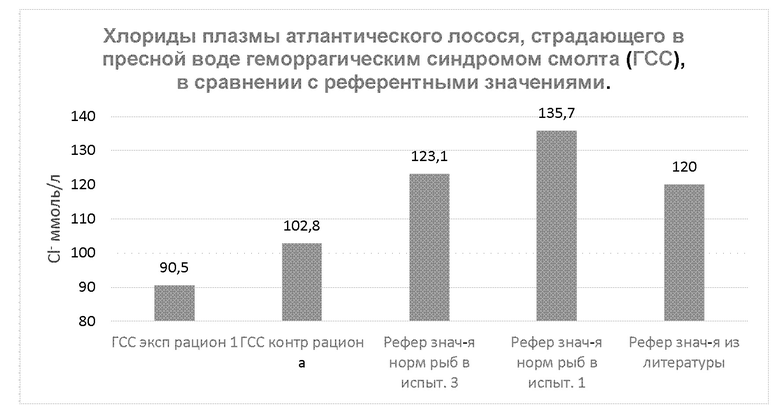
На диаграммах 4 и 5 показано точечное измерение магния плазмы, кальция плазмы и хлоридов плазмы 11 апреля 2012, в пресной воде в полевом испытании 1, где применяли экспериментальный рацион 1 и сравнивали его с контрольным рационом а. Показаны усредненные результаты для рыб, страдающих геморрагическим синдромом смолта (ГСС) в экспериментальных резервуарах (n=6) и контрольных резервуарах (n=6). Их сравнивали со средними показателями нормальных рыб в контрольной группе (n=6), нормальных рыб в пресной воде в полевом испытании 3 (n=19) и референтными значениями из литературы (Jakobsen, 2013). В литературе не удалось найти референтные значения для нормальной концентрации кальция плазмы атлантического лосося.
Диаграмма 4: точечное измерение 11 Апреля 2012 магния плазмы и кальция плазмы в пресной воде в полевом испытании 1, где применяли экспериментальный рацион 1 в сравнении с контрольным рационом а. Показаны усредненные результаты для рыб, страдающих геморрагическим синдромом смолта (ГСС), в экспериментальных резервуарах (n=6) и контрольных резервуарах (n=6). Эти значения сравнивали со средними показателями нормальных рыб в контрольной группе (n=6), нормальных рыб в пресной воде в полевом испытании 3 (n=19) и референтными значениями из литературы (Jakobsen, 2013).

Диаграмма 5: точечное измерение 11 Апреля 2012 хлоридов плазмы в пресной воде в полевом испытании 1, где применяли экспериментальный рацион 1 в сравнении с контрольным рационом а. Показаны усредненные результаты для рыб, страдающих геморрагическим синдромом смолта (ГСС), в экспериментальных резервуарах (n=6) и контрольных резервуарах (n=6). Их сравнивали со средними показателями нормальных рыб в контрольной группе (n=6), нормальных рыб в пресной воде в полевом испытании 3 (n=19) и референтными значениями из литературы (Jakobsen, 2013).
Уровень смертности в пресной воде
Смертность в ходе эксперимента в пресной воде показана на диаграмме 6. Наиболее высокая смертность наблюдалась приблизительно 10 апреля 2012. При вскрытии рыб обнаруживали классические признаки, соответствующие геморрагическому синдрому смолта, включая бледную окраску жабр и бледную окраску внутренних органов, множественные петехиальные кровоизлияния в мышцы, абдоминальную жировую ткань и внутренние органы (Halse, 2012).
Диаграмма 6: Уровень смертности в пресной воде в группе, получавшей экспериментальный рацион 1, в сравнении с группой, получавшей контрольный рацион а. Повышенный уровень смертности вызван геморрагическим синдромом смолта (Halse, 2012).

Полевое испытание 2
Активность фермента Na+-K+-АТФазы в тканях жабр
На диаграмме 7 показана динамика фермента Na+-K+-АТФазы в тканях жабр в полевом испытании 2, где применяли экспериментальный рацион 2 в сравнении с контрольным рационом а, которая представляет собой корм для выращивания молоди, произведенный Skretting AS. Результаты представляют собой среднее значение для проб, отобранных из 4 садков в пресной воде в экспериментальной группе (n=25 проб) и 4 садков в пресной воде в контрольной группе (n=25 проб).
Диаграмма 7: Динамика средней активности фермента Na+-K+-АТФазы в тканях жабр после зимнего сигнала (12 часов света/12 часов темноты) у радужной форели, получавшей экспериментальный рацион 2 и контрольный рацион а (в каждой группе n=25 образцов). Испытание проводили в садках в пресноводном озере (4 экспериментальных садка и 4 контрольных садка), Чили. Между 12 и 20 сентября 2012 отбраковывали и удаляли наиболее мелких рыб перед выпуском.

Между точками отбора 30.08.12 и 06.09.12, 30.08.12 и 20.09.12, 30.08.12 и 27.09.12 наблюдалось значимое повышение АТФазы (р=0,01) в экспериментальной группе, тогда как в контрольной группе не наблюдалось значимых изменений АТФазы ни в пределах 99%, ни в пределах 95% доверительного интервала (р=0,01 и р=0,05). Между 06.09.12 и 12.09.12 наблюдалось значимое повышение АТФазы в контрольной группе в пределах 99% доверительного интервала (р=0,01), наблюдавшееся на неделю позже, чем в экспериментальной группе. Между 12.09.12 и 20.09.12 наблюдалось значимое снижение АТФазы в контрольной группе в пределах 99% доверительного интервала, тогда как в экспериментальной группе не происходило значимого изменения АТФазы. В Таблице 7 представлены обобщенные данные по теме.

Число копий мРНК альфа 1а (пресноводной АТФазы)
Образцы для анализа числа копий мРНК альфа 1а, пресноводной АТФазы, не отбирали.
Индекс смолта
В данном исследовании не проводили определения индекса смолта.
Хлориды в плазме крови рыбы в нагрузочном тесте с морской водой
Хозяйство, разводящее смолтов, не имело возможности проводить тест с морской водой и образцы не отбирали.
Ионы в плазме крови рыб в пресной воде
Образцы для определения ионов в плазме рыб в пресной воде не отбирали.
Уровень смертности в пресной воде и морской воде
Смертность в пресноводной фазе находилась в пределах нормы. Через 60 дней в море уровень смертности составил 0,62% у рыб, получавших экспериментальный рацион 2, и 0,71% у рыб, получавших в пресной воде контрольный рацион а.
Полевое испытание 3
Активность фермента Na+-K+-АТФазы в тканях жабр
На диаграмме 8 показана динамика средних значений фермента Na+-K+-АТФазы в тканях жабр в полевом испытании 3, где применяли экспериментальный рацион 2 в сравнении с контрольным рационом а. Результаты представляют собой среднее значение для проб, отобранных из 3 резервуаров с пресной водой в экспериментальной группе (n=30 проб) и 3 резервуаров с пресной водой в контрольной группе (n=30 проб).
Диаграмма 8: Динамика средней активности фермента Na+-K+-АТФазы в тканях жабр при применении непрерывного освещения у атлантического лосося, получавшего экспериментальный рацион 2 и контрольный рацион а (в каждой группе n=30 образцов). Исследование проводили в резервуарах с пресной водой, эксперимент проводили в трех повторностях.
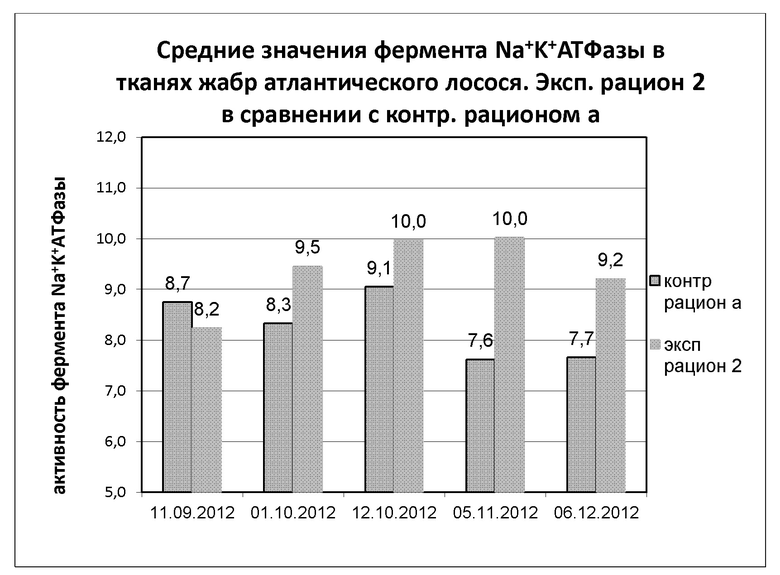
Между точками отбора 11.09.12 и 12.10.12, 11.09.12 и 05.11.12 наблюдалось значимое повышение АТФазы (р=0,05) в экспериментальной группе, тогда как в контрольной группе не наблюдалось значимых изменений АТФазы в пределах 95% доверительного интервала (р=0,05). Между 12.10.12 и 05.11.12 наблюдалось значимое снижение АТФазы в контрольной группе в пределах 95% доверительного интервала (р=0,05), тогда как в экспериментальной группе не наблюдалось значимых изменений. В Таблице 8 представлены обобщенные данные по теме.

Число копий мРНК альфа 1а (пресноводной АТФазы)
Взятие образцов для анализа числа копий мРНК альфа 1а, пресноводной АТФазы, частично осуществляли в повторностях 1 и 2. Результаты приведены на диаграммах 9 и 10. В 1 повторное™ через 2 недели применения экспериментального рациона 2 (01.10.12) наблюдалась вариация копий мРНК альфа-1а (пресноводная АТФаза) от 441000 до 501000. Это очевидно ниже пограничного значения 1186000 копий. В случае контрольного рациона а можно заметить, что у рыб экспрессируется большое число копий мРНК альфа 1а 12.10.12, а после этого происходит снижение экспрессии до того же уровня, как в случае экспериментального рациона 2.
Диаграмма 9: Динамика средних показателей экспрессии мРНК альфа 1а в тканях жабр атлантического лосося при непрерывном освещении при использовании экспериментального рациона 2 и контрольного рациона а (в каждой группе n=30 образцов). Первое измерение отсутствует. Второе измерение проведено 01.10.2012.
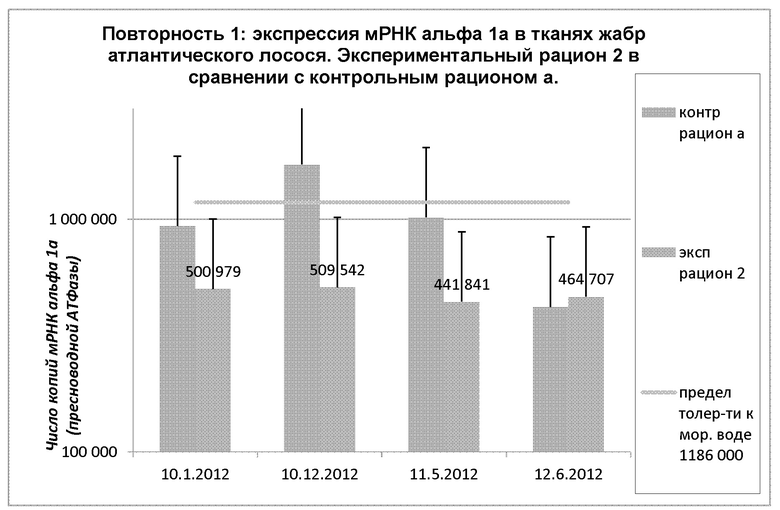
Между точками измерений 01.10.12 и 12.10.12 наблюдалось значимое увеличение экспрессии мРНК альфа 1а (р=0,05) в контрольной группе, тогда как в экспериментальной группе не наблюдалось значимых изменений мРНК альфа 1а в пределах 95% доверительного интервала (р=0,05). Между 01.10.12 и 06.12.12 наблюдалось значимое снижение числа копий мРНК альфа 1а в контрольной группе в пределах 99% доверительного интервала (р=0,01), тогда как в экспериментальной группе не наблюдалось значимых изменений. То же самое наблюдалось между 12.10.12 и 05.11.12 (в пределах 95% доверительного интервала), 12.10.12 и 06.12.12, а также между 05.11.12 и 06.12.12. В экспериментальной группе не наблюдалось аналогичных изменений между точками измерений. В Таблице 9 представлены обобщенные данные по теме.

Во 2 повторности контрольный рацион со 2 недели применения (01.10.12) приводил к вариации копий мРНК альфа-1а (пресноводной АТФазы) от 1517000 до 786000. Это выше пограничного значения толерантности к морской воде (установленного на уровне 1186000 копий) для первых трех взятий образцов, тогда как при последнем взятии образцов значение находится ниже пограничного уровня. В случае экспериментального рациона 2 видно, что 05.11.12 и 06.12.12 у рыб экспрессируется низкое число копий мРНК альфа 1а, от 413000 до 396000 копий. В Таблице 10 представлены обобщенные данные по теме.
Диаграмма 10: Динамика средних показателей экспрессии мРНК альфа 1а в тканях жабр атлантического лосося при непрерывном освещении и применении экспериментального рациона 2 и контрольного рациона а (в каждой группе n=30 образцов). Первая точка измерений в обеих группах, а также вторая и третья точки в экспериментальной группе отсутствуют.
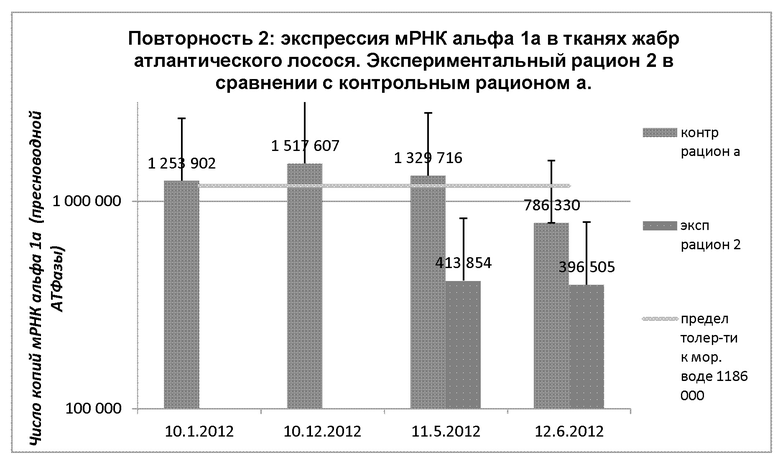
Между точками измерений 12.10.12 и 06.12.12 наблюдалось значимое снижение экспрессии числа копий мРНК альфа 1а в контрольной группе (р=0,01). Между 05.11.12 и 06.12.12 значимого снижения числа копий мРНК альфа 1а в пределах 95% доверительного интервала (р=0,01) не наблюдалось ни в контрольной группе, ни в экспериментальной группе. В Таблице 10 представлены обобщенные данные по теме.

Число копий мРНК альфа 1а (пресноводной АТФазы) в зависимости от температуры воды
Результаты мРНК альфа 1а в экспериментальной группе и контрольной группе коррелируют с температурой пресной воды. На диаграмме 11 показана процентная доля тех образцов, в которых число копий мРНК альфа 1а находится ниже 1186000, пограничного значения толерантности к морской воде. На диаграмме также показана температура воды в тот же период. При температуре воды от 8,1 до 8,9°С, 90 и 100% значений образцов в экспериментальной группе находилась ниже пограничного значения толерантности к морской воде. Эта доля оставалась стабильной на протяжении всего процесса смолтификации, так же, как была стабильна и температура воды. Соответствующие значения в контрольной группе колебались от 20% до 100%, а наименьшая доля наблюдалось в начале периода наблюдений.
Диаграмма 11: Доля образцов с уровнем экспрессии мРНК альфа 1а в ткани жабр ниже 1186000 копий при использовании постоянного освещения. Диаграмма показывает корреляцию с температурой воды, атлантический лосось получал экспериментальный рацион 2 и контрольный рацион а (n=8-10 образцов в каждой из двух групп, экспериментальной и контрольной).
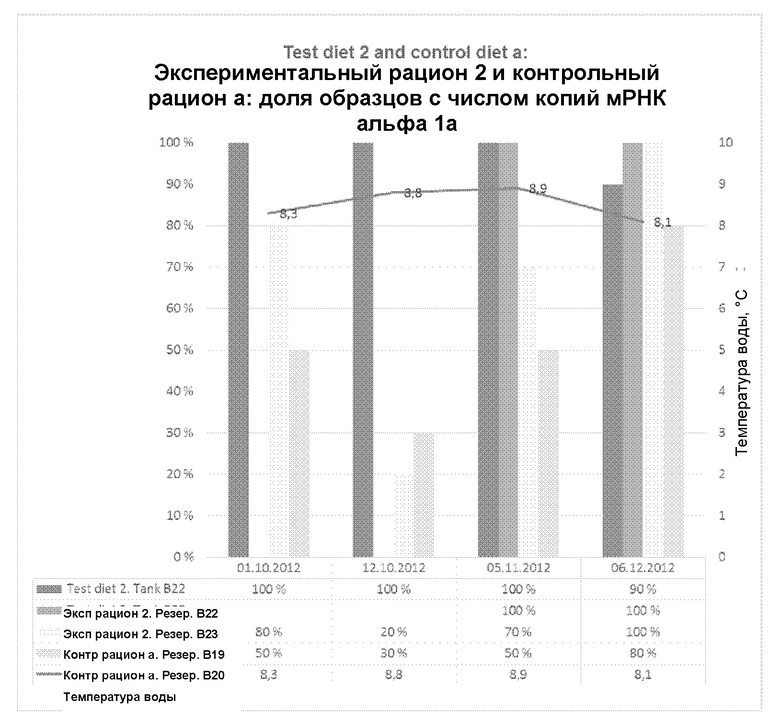
Индекс смолта
На диаграмме 12 показана динамика индекса смолта в полевом испытании 3, где экспериментальный рацион 2 сравнивали с контрольным рационом а, кормом для выращивания молоди производства Skretting AS. Результаты представляют собой среднее значение для образцов, взятых в 3 резервуарах в экспериментальной группе (n=30 образцов) и 3 резервуаров в контрольной группе (n=30 образцов).
Диаграмма 12: Динамика средних показателей индекса смолта при непрерывном освещении у рыб, получавших экспериментальный рацион 2 и контрольный рацион а (n=30 образцов в каждой группе/точке измерения). Исследование проводили в резервуарах с пресной водой, в эксперименте использовали трипликаты.
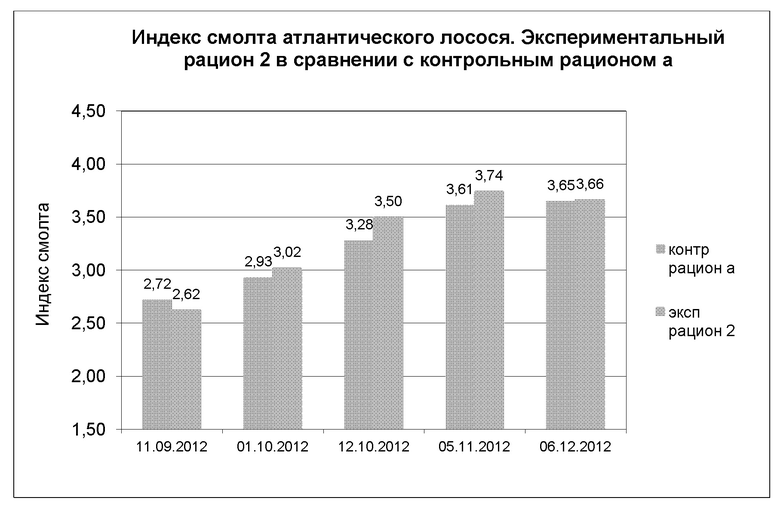
Между 11.09.12 и 01.10.12 наблюдалось значимое увеличение индекса смолта (р=0,01) в экспериментальной группе, тогда как в контрольной группе не наблюдалось значимых изменений индекса смолта (р=0,05). Между 01.10.12 и 12.10.12 наблюдалось значимое увеличение индекса смолта (р=0,05) в контрольной группе, тогда как в экспериментальной группе наблюдалось более выраженное увеличение индекса смолта (р=0,01). Между 12.10.12 и 06.12.12 наблюдалось значимое увеличение индекса смолта (р=0,01) в контрольной группе, тогда как в экспериментальной группе не наблюдалось значимых изменений индекса смолта (р=0,05). В Таблице 11 представлены обобщенные данные по теме.

Хлориды в плазме крови рыб в нагрузочном тесте с морской водой
На диаграммах 13 и 14 показан уровень хлоридов плазмы в полевом испытании 3 после воздействия на рыб 34%о морской воды в течение 144 часов, где использовали экспериментальный рацион 2 в сравнении с контрольным рационом а, за 11 недель до воздействия морской воды. Результаты представляют собой среднее значение для образцов, взятых в 3 резервуарах в экспериментальной группе (n=30 образцов) и 3 резервуарах в контрольной группе (n=20 образцов). Средние значения хлоридов плазмы в контрольной группе составили в среднем 139,6 ммоль/л, а в экспериментальной группе 139,0 ммоль/л.
Диаграмма 13: Точечная диаграмма для атлантического лосося, демонстрирующая корреляцию хлоридов плазмы (ммоль/л) после воздействия морской воды (34%о, 144 часа) на рыб, получавших экспериментальный рацион 2 и контрольный рацион в течение 11 недель, с их массой (г). В экспериментальной группе n=30 образцов, в контрольной группе n=20 образцов.

Диаграмма 14: Хлориды плазмы (ммоль/л) у атлантического лосося после воздействия морской воды (34%о, 144 часа) на рыб, получавших в течение 11 недель в пресной воде экспериментальный рацион 2 и контрольный рацион а. В экспериментальной группе n=30 образцов, в контрольной группе n=20 образцов. Показаны референтные значения хлоридов для пресной воды (n=17 в экспериментальной группе и n=19 в контрольной группе).

Другие ионы в плазме крови рыб в пресной воде и морской воде
В полевом испытании 3 рыб с геморрагическим синдромом смолта не наблюдалось. На диаграмме 15 показаны средние уровни магния и кальция в плазме крови лосося в пресной воде и в морской воде.
Диаграмма 15: Магний и кальций в плазме крови (ммоль/л) атлантического лосося после воздействия морской воды (34%о, 144 часа) на рыб, получавших в течение 11 недель в пресной воде экспериментальный рацион 2 и контрольный рацион а. В экспериментальной группе n=30 образцов, в контрольной группе n=20 образцов. Также показаны значения для пресной воды (n=17 в экспериментальной группе и n=19 в контрольной группе).

Уровень смертности в пресной воде и морской воде
Аномальной смертности не наблюдалось. После 144 часов нахождения в морской воде рыбу уничтожали.
Полевое испытание 4
Активность фермента Na *-К *-АТФазы в тканях жабр
На диаграмме 16 показана динамика фермента Na+-K+-АТФазы в ткани жабр в полевом испытании 4, где применяли экспериментальный рацион 2 в сравнении с контрольным рационом b, который представлял собой корм для выращивания молоди, произведенный Ewos AS. Результаты представляют собой среднее значение для образцов, взятых в экспериментальном садке в пресной воде (n=20 образцов) и в контрольном садке в пресной воде (n=20 образцов). Эксперимент проводили при естественном освещении, преимущественно после осеннего равноденствия.
Диаграмма 16: Динамика средней активности фермента Na+-K+-АТФазы в тканях жабр атлантического лосося, получавшего экспериментальный рацион 2 в сравнении с контрольным рационом b, в условиях естественного освещения (n=20 образцов в каждой группе).

Между 10.09.12 и 01.10.12 наблюдалось значимое изменение АТФазы (р=0,01) в экспериментальной группе, тогда как в контрольной группе в тот же период не наблюдалось значимых изменений АТФазы (р=0,05). Между 10.09.12 и 15.10.12 наблюдалось значимое изменение АТФазы в экспериментальной группе в пределах 99% доверительного интервала (р=0,01), тогда как в контрольной группе значимого изменения АТФазы в пределах 95% доверительного интервала не происходило (р=0,05). В Таблице 12 представлены обобщенные данные по теме.

Число копий мРНК альфа 1а (пресноводной АТФазы):
тбирали образцы для анализа числа копий мРНК альфа 1а, пресноводной АТФазы. Результаты приведены на диаграмме 17. Показано, что экспериментальный рацион 2 приводит к пониженной экспрессии пресноводной АТФазы по сравнению с контрольным рационом b. В случае экспериментального рациона 2 наблюдается снижение числа копий мРНК альфа 1а от 2,59 миллионов до 0,67 миллионов копий, что несомненно ниже пограничного значения 1186000 копий. Различия между точками измерений являются значимыми в пределах 99% доверительного интервала (р=0,01). Применение контрольного рациона b вызывает ограниченное снижение числа копий, от 2,59 миллионов до 2,57 миллионов копий в последней точке измерений. Между точками измерений значимого снижения не происходит. В Таблице 13 представлены обобщенные данные по теме.
Диаграмма 17: Динамика средних показателей экспрессии мРНК альфа 1а в тканях жабр в условиях естественного освещения у атлантического лосося, получавшего экспериментальный рацион 2 в сравнении с контрольным рационом b (в каждой группе n=14 образцов).


Индекс смолта
На диаграмме 18 показана динамика индекса смолта в полевом испытании 4, при применении экспериментального рациона 2 в сравнении с контрольным рационом b. Результаты представляют собой среднее значение для образцов, взятых в садке в экспериментальной группе (n=20 образцов) и контрольном садке (n=20 образцов).
Диаграмма 18: Динамика средних показателей индекса смолта атлантического лосося в условиях естественного освещения, получавшего экспериментальный рацион 2 или контрольный рацион b (n=20 образцов в каждой группе).

Между 10.09.12 и 15.10.12 наблюдалось значимое увеличение индекса смолта (р=0,05) в экспериментальной группе, тогда как в контрольной группе в течение того же периода не наблюдалось значимых изменений индекса смолта (р=0,05). В Таблице 14 представлены обобщенные данные по теме.

Хлориды в плазме крови рыб в нагрузочном тесте с морской водой.
В данном полевом испытании не проводили нагрузочный тест с морской водой.
Ионы в плазме крови рыб в пресной воде
При нахождении рыб в пресной воде образцы для анализа ионов в плазме крови не отбирали.
Уровень смертности в пресной воде и морской воде
В пресной воде аномальной смертности не наблюдалось. Рыб, получавших экспериментальный рацион 2, предварительно метили, обрезая жировой плавник. Этих рыб переводили в море в том же садке, что и фоторегулируемую группу (отличную от контрольной пресноводной группы). От начала воздействия до забоя рыбы уровень смертности составил 0,08%. Смертность возникала немедленно после воздействия морской воды.
Полевое испытание 5
Активность фермента Na+-K+-АТФазы в тканях жабр
На диаграмме 19 показана динамика фермента Na+-K+-АТФазы в тканях жабр в полевом испытании 5, где применяли экспериментальный рацион 2 в сравнении с контрольным рационом b, который представлял собой корм для выращивания молоди, произведенный Ewos AS. Результаты представляют собой среднее значение для образцов, взятых в 3 резервуарах в экспериментальной группе и 2 резервуаров в контрольной группе. Сводная информация о числе резервуаров и количестве рыб при каждом отборе проб приведена в Таблице 15.
Диаграмма 19: Динамика средних показателей активности фермента Na+-K+-АТФазы в тканях жабр после зимнего сигнала у атлантического лосося, получавшего экспериментальный рацион 2 и контрольный рацион b. Число образцов в каждой точке измерения указано в Таблице 14.

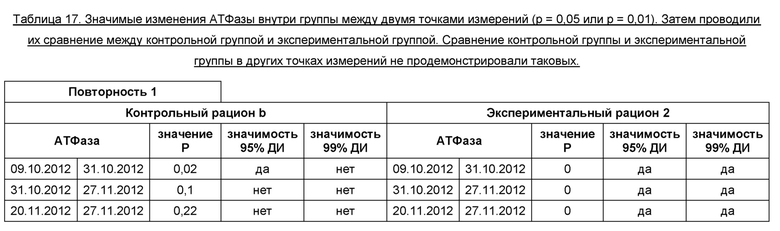
Между 09.10.12 и 31.10.12 наблюдалось более выраженное повышение АТФазы (р=0,01) в экспериментальной группе, тогда как в контрольной группе наблюдалось менее выраженное повышение АТФазы (р=0,05). Аналогичная ситуация наблюдалась между точками измерения 20.11.12 и 04.12.12. Между 20.11.12 и 04.12.12 наблюдалось значимое повышение АТФазы в контрольной группе в пределах 95% доверительного интервала (р=0,05), тогда как в экспериментальной группе значимого изменения АТФазы в пределах 95% доверительного интервала не происходило (р=0,05). Между 04.12.12 и 18.12.12 в обеих группах значение р было достаточно близким (р=0,01), однако только в контрольной группе происходило значимое повышение АТФазы в пределах 99% доверительного интервала. В экспериментальной группе наблюдалось значимое повышение между точками измерений в пределах 95% доверительного интервала (р=0,05). Кроме того, мы видим, что в экспериментальной группе происходило значимое повышение (р=0,01) АТФазы между 12.12.12 и 18.12.12, тогда как в контрольной группе значимого повышения АТФазы в пределах 95% или 99% доверительного интервала не происходило (р=0,05 и 0,01). В Таблице 16 представлены обобщенные данные по теме.

Активность фермента Na+-K+-АТФазы в тканях жабр в каждой повторности
На диаграмме 20 показана динамика активности фермента Na+-K+-АТФазы в тканях жабр в 1 повторности, когда применяли экспериментальный рацион 2 в сравнении с контрольным рационом b.
Диаграмма 20: Динамика средних показателей активности фермента Na+-K+-АТФазы в тканях жабр после зимнего сигнала у атлантического лосося, получавшего экспериментальный рацион 2 и контрольный рацион b.
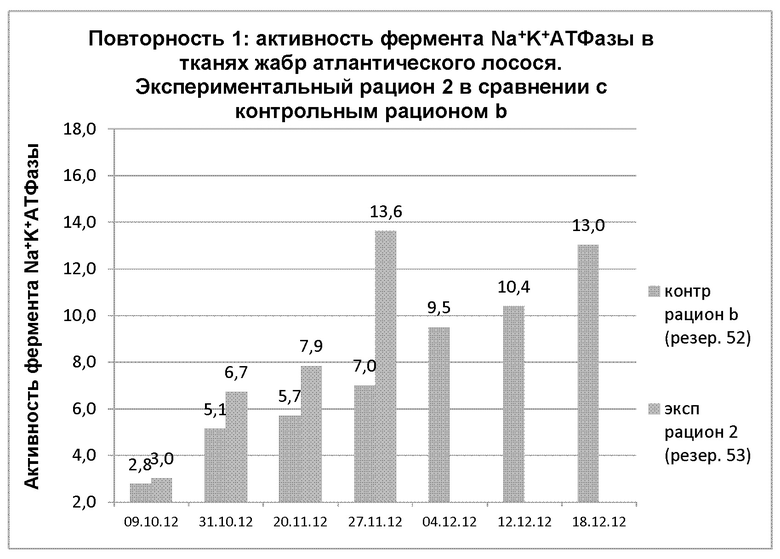
Между 09.10.12 и 31.10.12 наблюдалось значимое повышение (р=0,01) АТФазы в экспериментальной группе, тогда как в контрольной группе значимое изменение АТФазы происходило лишь в пределах 95% доверительного интервала (р=0,05). Между точками измерения 31.10.12 и 27.11.12, а также между 20.11.12 и 27.11.12 наблюдалось значимое повышение в пределах 99% доверительного интервала в экспериментальной группе, тогда как в контрольной группе не происходило значимого повышения. В Таблице 17 представлены обобщенные данные по теме.
На диаграмме 21 показана динамика активности фермента Na+-K+-АТФазы в тканях жабр в повторности 2а, когда применяли экспериментальный рацион 2 в сравнении с контрольным рационом b.
Диаграмма 21: Динамика средних показателей активности фермента Na+-K+-АТФазы в тканях жабр после зимнего сигнала у атлантического лосося, получавшего экспериментальный рацион 2 и контрольный рацион b.
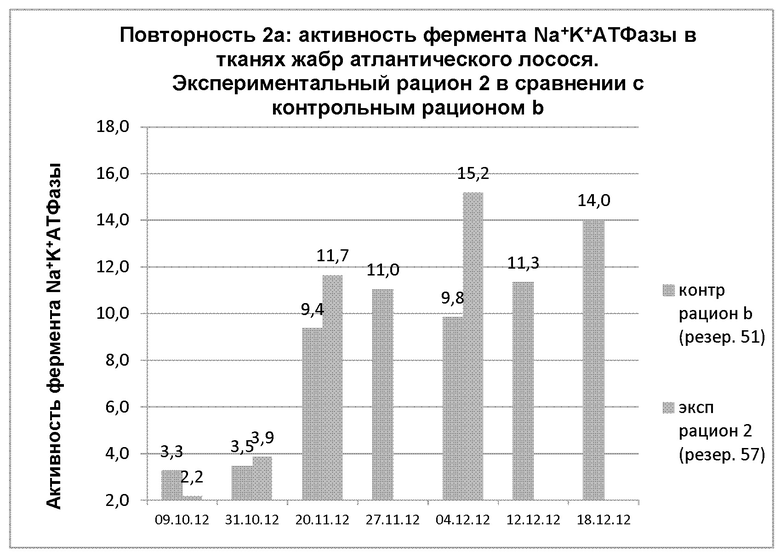
Между 09.10.12 и 31.10.12 наблюдалось значимое повышение АТФазы (р=0,05) в экспериментальной группе, тогда как в контрольной группе не наблюдалось значимого повышения АТФазы (р=0,05). Аналогичная ситуация наблюдалась между точками измерения 20.11.12 и 04.12.12. В Таблице 18 представлены обобщенные данные по теме.

На диаграмме 22 показана динамика активности фермента Na+-K+-АТФазы в тканях жабр в повторности 26, когда применяли экспериментальный рацион 2 в сравнении с контрольным рационом b.
Диаграмма 22: Динамика средних показателей активности фермента Na+-K+-АТФазы в тканях жабр после зимнего сигнала у атлантического лосося, получавшего экспериментальный рацион 2 и контрольный рацион b.

Между 20.11.12 и 18.12.12 наблюдалось значимое повышение АТФазы в экспериментальной группе в пределах 99% доверительного интервала (р=0,01), тогда как в контрольной группе происходило значимое повышение АТФазы в пределах 95% доверительного интервала (р=0,05). В точках измерения 12.12.12 и 18.12.12 в экспериментальной группе наблюдалось значимое повышение в пределах 95% доверительного интервала (р=0,05), тогда как в контрольной группе значимого повышения не наблюдалось (р=0,05). В Таблице 19 представлены обобщенные данные по теме.

Число копий мРНК альфа 1а (пресноводной АТФазы) в зависимости от температуры воды.
Пробы отбирали только в экспериментальной группе, получавшей экспериментальный рацион 2. Анализировали число копий мРНК альфа 1а (пресноводной АТФазы) На диаграмме 23 показана доля тех образцов, в которых число копий мРНК альфа 1а находилось ниже 1186000, пограничного значения толерантности к морской воде. На диаграмме также показана температура воды в тот же период. В первые две недели температура находилась выше 6°С. Через 2 недели кормления, в 83 и 100% образцов толерантность к морской воде находилась ниже пограничного значения. Эта доля еще более снижалась в ходе процесса смолтификации, что согласуется с понижением температуры воды.
Диаграмма 23: Доля образцов с уровнем экспрессии мРНК альфа 1а в ткани жабр ниже 1186000 копий после зимнего сигнала. Диаграмма показывает корреляцию с температурой воды, атлантический лосось получал экспериментальный рацион 2 и контрольный рацион b (n=6-10 образцов в каждой из трех экспериментальных групп).

Индекс смолта
На диаграмме 24 показана динамика индекса смолта в полевом испытании 5, где применяли экспериментальный рацион 2 в сравнении с контрольным рационом b. Результаты представляют собой среднее значение для образцов, взятых в 3 резервуарах в экспериментальной группе и 2 резервуарах в контрольной группе. Сводная информация о числе резервуаров и количестве рыб в каждой точке измерения приведена в Таблице 14.
Диаграмма 24: Динамика средних показателей индекса смолта у атлантического лосося после зимнего сигнала при применении экспериментального рациона 2 и контрольного рациона b. Сводная информация о количестве образцов в каждой точке измерения приведена в Таблице 14.

Между 20.11.12 и 12.12.12 наблюдалось значимое увеличение индекса смолта в контрольной группе в пределах 99% доверительного интервала (р=0,01), тогда как в экспериментальной группе в тот же период происходило значимое увеличение индекса смолта в пределах 95% доверительного интервала (р=0,05). Между 04.12.12 и 12.12.12 наблюдалось значимое увеличение индекса смолта в контрольной группе в пределах 99% доверительного интервала (р=0,01), тогда как в экспериментальной группе в тот же период не происходило значимого увеличения индекса смолта в пределах 95% доверительного интервала (р=0,05). В Таблице 20 представлены обобщенные данные по теме.

Хлориды в плазме крови рыб в нагрузочном тесте с морской водой.
В данном полевом испытании не проводили нагрузочный тест с морской водой.
Ионы в плазме крови рыб в пресной воде
В данном полевом испытании образцы для анализа ионов в плазме крови не отбирали.
Уровень смертности в пресной воде и морской воде
В пресной воде аномальная смертность не наблюдалась. Также не наблюдалось рыб с заболеванием ГСС. Сводная информация о смертности при выращивании в морской воде приведена в Таблице 21 для тех резервуаров, в которых можно было проследить применение экспериментального и контрольного рационов в пресной воде.

Полевое испытание 6
Активность фермента Na+-K+-АТФазы в тканях жабр
На диаграмме 25 показана динамика фермента Na+-K+-АТФазы в тканях жабр в полевом испытании 6, где применяли экспериментальный рацион 2 в сравнении с контрольным рационом b, который представлял собой корм для выращивания молоди, произведенный Ewos AS. Результаты представляют собой среднее значение для образцов, взятых в одном садке в пресной воде в экспериментальной группе (n=20 образцов) по сравнению с одним контрольным садком в пресной воде (n=20 образцов). Эксперимент представляет собой сравнение двух способов выращивания, в экспериментальной группе рыбы находились при непрерывном освещении и получали экспериментальный рацион 2, тогда как в контрольной группе рыбы находились при классическом фоторегулировании (вначале зимний сигнал, затем летний сигнал) и получали контрольный рацион b (обычный корм для выращивания).
Диаграмма 25: Сравнение средней активности фермента Na+-K+-АТФазы в тканях жабр атлантического лосося. Экспериментальная группа находилась при непрерывном освещении и получала экспериментальный рацион 2, тогда как контрольная группа находилась при классическом фоторегулировании и получала контрольный рацион b (в каждой группе n=20 образцов).

Наиболее высокое среднее значение АТФазы в экспериментальной группе определялось приблизительно на 5 недель раньше по сравнению с контрольной группой. Экспериментальная группа реагирует значимым повышением (р=0,01) АТФазы через 2 недели после получения экспериментального рациона 2. Контрольная группа отвечала значимым повышением (р=0,01) АТФазы через 6 недель после получения летнего сигнала. В Таблице 22 представлены обобщенные данные.

Число копий мРНК альфа 1а (пресноводной АТФазы)
Отбирали образцы для анализа числа копий мРНК альфа 1а, пресноводной АТФазы. Результаты приведены на диаграмме 26. Показано, что экспериментальный рацион 2 в сочетании с непрерывным освещением приводит к пониженной экспрессии пресноводной АТФазы по сравнению с контрольным рационом b и классическим фоторегулированием. В случае экспериментального рациона 2 наблюдается снижение числа копий мРНК альфа 1а от 6,07 миллионов в первом измерении до 0,75 миллионов копий в последнем измерении, что несомненно ниже пограничного значения толерантности к морской воде на уровне 1,186 милилонов копий. Различия между точками измерений в экспериментальной группе являются значимыми в пределах 99% доверительного интервала (р=0,01) и совпадают с увеличением ферментативной активности АТФазы.
Применение контрольного рациона b вызывает увеличение числа копий, от 2,49 миллионов в первом измерении до 2,98 миллионов копий в последнем измерении. Наиболее низкое среднее значение было зарегистрировано 23.10.13 и составило 1,76 миллионов копий, что совпадает со значимым увеличением ферментативной активности АТФазы. Снижение, наблюдавшееся между 26.08.13 и 23.10.13 находится в пределах 99% доверительного интервала (р=0,01), тогда как снижение между 12.09.13 (началом летнего сигнала) и 23.10.13 не является значимым (р=0,05). В Таблице 23 представлены обобщенные данные по теме.
Диаграмма 26: Динамика средних показателей экспрессии мРНК альфа 1а в тканях жабр атлантического лосося. Экспериментальная группа находилась при непрерывном освещении и получала экспериментальный рацион 2, тогда как контрольная группа находилась при классическом фоторегулировании и получала контрольный рацион b. Контрольная группа получала летний сигнал с 12.09.13 (в каждой группе n=20 образцов).


Индекс смолта
На диаграмме 27 показана динамика индекса смолта в полевом испытании 6. Результаты представляют собой среднее значение для образцов, взятых в одном садке в пресной воде в экспериментальной группе (n=20 образцов), по сравнению с одним контрольным садком в пресной воде (n=20 образцов).
Диаграмма 27: Сравнение среднего индекса смолта атлантического лосося. Экспериментальная группа находилась при непрерывном освещении и получала экспериментальный рацион 2, тогда как контрольная группа находилась при классическом фоторегулировании и получала контрольный рацион b (в каждой группе n=20 образцов).

Как в экспериментальной группе, так и в контрольной группе наблюдалось значимое повышение индекса смолта в пределах 99% доверительного интервала (р=0,01) между точками измерений 26.08.13 и 23.09.13. Экспериментальную группу переводили в морскую воду после 23.09.13, тогда как контрольную группу переводили в морскую воду через пять недель после экспериментальной группы. В течение этого времени в контрольной группе наблюдалось значимое увеличение индекса смолта между несколькими точками измерения. В Таблице 24 представлены обобщенные данные по теме.

Хлориды в плазме крови рыб в нагрузочном тесте с морской водой.
В данном полевом испытании не проводили нагрузочный тест с морской водой.
Ионы в плазме крови рыб в пресной воде
В данном полевом испытании образцы для анализа ионов в плазме крови не отбирали.
Уровень смертности в пресной воде и морской воде
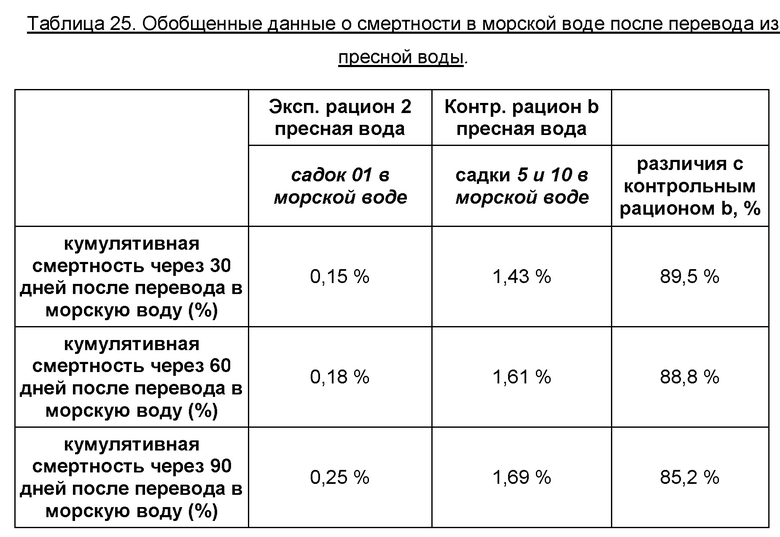
В пресной воде аномальная смертность не наблюдалась. Также не наблюдалось рыб с заболеванием ГСС. В Таблице 25 приведена обобщенная информация о смертности при выращивании в морской воде.
Обсуждение
Выбор метода и оценка процесса смолтификации
Присутствие CaSR в различных органах, связанных с осморегуляцией и эндокринной активностью, ассоциированных с процессом смолтификации, было продемонстрировано в методе SuperSmolt ®, и известно, как влиять на активность этих клеток с помощью ионов и аминокислот, стимулирующих CaSR. Метод SuperSmolt ® также обеспечивает повышение активности фермента Na+-K+-АТФазы, повышение индекса смолта, улучшает поведение смолтов в пресной воде, обеспечивает нормальную осморегуляцию в морской воде (34%о) и хорошую выживаемость (смертность <1% через 30 дней) при выращивании в морской воде. Все эти параметры являются общепринятыми для оценки удовлетворительности смолтификации рыбы. Эксперименты, проведенные с 2002 по 2014 гг. на более чем 300 миллионах суперсмолтифицированных лососей подтверждают, что данный способ с применением добавок солей в эксплуатируемую воду может выполнять функцию процесса смолтификации.
При оценке эффективности корма для рыбы и способа по данному изобретению использовали подход, аналогичный подходу, использованному для оценки эффективности метода SuperSmolt ®, в котором использовали сведения, известные о CaSR, в сочетании с традиционными параметрами смолтификации.
В трех из шести полевых испытаний экспериментальный корм использовали в сочетании с традиционным фоторегулированием. В этих случаях авторы изобретения предполагали, что эндокринная активность рыб отвечала нормальному процессу смолтификации. В остальных экспериментах применяли непрерывное освещение или естественное освещение после наступления осеннего равноденствия, оба обстоятельства затрудняли удовлетворительное протекание процесса смолтификации и способность к нормальной осморегуляции, выживанию и росту после перевода в морскую воду.
При использовании термина «смолтификация», относящегося к применению экспериментального рациона 2, подразумевают, что эндокринную активность в экспериментальном материале не исследуют, но рассматривают изменения общепринятых характеристик смолта. Таким образом, сущностью данной работы в большей мере является практический подход к смолтификации при выращивании смолтов, а не полное изучение физиологических факторов, относящихся к фактическому процессу смолтификации.
Влияние экспериментальных рационов 1 и 2 на процесс смолтификации в сравнении с классическим фоторегулированием
В полевом испытании 1 применяли обычное фоторегулирование в сочетании с экспериментальным рационом 1, тогда как в полевых испытаниях 2 и 5 применяли обычное фоторегулирование в сочетании с экспериментальным рационом 2.
Полевое испытание 1:
Экспериментальный рацион 1 не вызывал значимого увеличения активности фермента Na+-K+-АТФазы, так же, как и в контрольной группе. Аналогичные результаты наблюдались в отношении увеличения индекса смолта. Через 96 часов нагрузочного теста с морской водой в 35%о морской воде значимого изменения хлоридов плазмы не наблюдалось. Как в контрольной группе, так и в экспериментальной группе хлориды плазмы находились в нормальном диапазоне, 120-150 ммоль/л. Однако, согласно наблюдениям, рыбы, получавшие экспериментальный рацион 1 в период смолтификации, в среднем имели более чем в 20 раз более высокую смертность, ассоциированную с заболеванием ГСС, по сравнению с контрольной группой. Эксперименты проводили в воде с температурой 3-5°С, что для рыб такого размера должно соответствовать суточной величине кормового рациона 0,2-0,4% (таблица рационов компании Skretting, 2009).
Однако при таком достаточно большом потреблении корма в экспериментальной группе наблюдалась повышенная смертность, и не похоже, чтобы повышенная температура воды, которая увеличивала потребление пищи, благоприятно сказывалась на выживаемости в экспериментальной группе. В целом, наблюдения позволяют предположить, что только экспериментальный корм 1 в отдельности не является подходящим рационом для стимуляции процесса смолтификации у лососевых. Экспериментальный рацион 1 представляет собой тип корма, который используют в методе SuperSmolt ®, но в сочетании с этим в эксплуатируемую воду добавляют Са2+ и Mg2+.
Полевое испытание 5:
В полевом испытании 5 использовали экспериментальный рацион 2. В данном эксперименте температура воды составляла от 8 до 6°С в течение первых двух недель процесса смолтификации (после поступления летнего сигнала), затем температура воды вначале снизилась до 4°С, затем до 3°С. Снижение температуры считается внешним сигналом, препятствующим процессу смолтификации. Снижение температуры воды приводило к уменьшению потребления корма, но похоже, что первые две недели с наиболее высокой температурой воды и относительно высоким потреблением корма, экспериментального рациона 2, были решающими для прохождения процесса смолтификации. Повышение активности фермента АТФазы между двумя точками измерений было значительно более выраженным в начале процесса смолтификации у рыб, получавших экспериментальный рацион 2 (по существу в пределах 99% доверительного интервала) по сравнению с контрольной группой (по существу в пределах 95% доверительного интервала). Индекс смолта не показал соответствующего повышения, которое бы свидетельствовало о преимуществе экспериментального рациона 2. Индекс смолта в некоторой степени является субъективной оценкой и могли сыграть роль различия в баллах, присваиваемых разными работниками рыбоводного хозяйства. Кроме того, количество образцов в каждой группе на более поздней стадии периода смолтификации было ограниченным (n=10). Индекс смолта редко применяют для определения времени перевода в морскую воду, он скорее является дополнительным параметром в процессе смолтификации.
Поскольку состояние смолтификации у рыб, получавших экспериментальный рацион 2, было удовлетворительным, экспериментальные группы в повторностях 1 и 2а перевели в морскую воду, соответственно на 3 и 2 недели раньше по сравнению с контрольной группой. Перевод экспериментальной группы в повторности 2b осуществили в то же время, что и контрольную группу. Однако на основании показателей АТФазы перевод в морскую воду экспериментальной группы был возможен на 4 недели раньше, чем контрольных рыб.
Процентная доля образцов мРНК альфа 1а (пресноводной АТФазы) в экспериментальной группе со значением ниже 1,186 миллионов копий, значимо повышалась от начала эксперимента до второй точки измерения (приблизительно 2 недели) (диаграмма 23). В данном периоде температура воды составила 6°С. По мере снижения температуры процентная доля рыб с количеством копий мРНК альфа 1а (пресноводной АТФазы) менее 1,186 миллионов также снижалась. Данное наблюдение может быть непосредственно отнесено на счет потребления корма рыбами, поскольку снижение температуры воды вызывало уменьшенное потребление корма. В то же время, авторы изобретения заметили, что экспериментальный рацион 2 служил дополнительным стимулом для рыб в экспериментальной группе, что выражалось в дополнительном усилении образования фермента АТФазы по сравнению с контрольной группой.
В практическом рыбоводстве поздний осенний перевод рыб в море может быть затруднителен в плане достижения удовлетворительного размера рыбы до наступления зимнего сезона. Такие рыбы больше подвержены зимним повреждениям, чем рыбы, которые пришли в море более ранней осенью. Перевод ранней осенью позволяет в большей мере использовать более высокую температуру морской воды ранней осенью и добиться более быстрого прироста и сократить время выращивания от перевода до забоя. При выращивании смолта часто имеет место перевод поздней осенью, совпадающий с понижением температуры пресной воды и затрудняющий процесс смолтификации. Экспериментальный рацион 2 является средством, обеспечивающим более раннее время перевода при осеннем понижении температуры воды.
Уровень смертности в морской воде, через 30, 60 и 90 дней после перевода, соответственно, был удовлетворительным, как в экспериментальной, так и в контрольной группах. Однако рыбы, получавшие экспериментальный рацион 2 в пресной воде, имели более низкий уровень смертности по сравнению с контрольной группой. Чем больше времени рыбы находились в морской воде, тем более высоким было различие в смертности, выраженное в процентах. Состояние смолтификации может влиять на выживаемость в морской воде и существует повышенный риск вторичных проблем, связанных с плохой способностью к осморегуляции. Кроме того, данные результаты подтверждают, что экспериментальный рацион 2 безопасен в применении и не сказывается отрицательным образом на выращивании.
Полевое испытание 2:
Полевое испытание 2 проводили на радужной форели. Рыбы получали зимний сигнал за счет использования естественного освещения зимой в южном полушарии (перед весенним равноденствием). После этого они получали дополнительное количество света, служившее летним сигналом. Экспериментальный рацион 2 использовали в качестве дополнительного стимула к сигналу о наступлении летнего периода. О процессе смолтификации у радужной форели говорить не принято, но фактом является то, что при переводе в морскую воду физиологические ответы у радужной форели должны быть такими же, как у лосося. Преадаптация в пресной воде перед переводом рыбы в морскую воду оказывается разумной стратегией уменьшения осморегуляторного стресса у радужной форели. Экспериментальная группа демонстрирует значимое увеличение активности фермента АТФазы на неделю раньше по сравнению с контрольной группой.
Рыбоводное хозяйство осуществляло процедуру отбраковывания самых мелких рыб в группе перед переводом в море. Данная практика вызывает стресс у рыб и приводит к снижению АТФазной активности, что подтверждает предыдущий опыт. И экспериментальная группа, и контрольная группа отвечали численным снижением количества фермента АТФазы после стрессового воздействия. Однако, только в контрольной группе происходило снижение АТФазы, которое было значимым в пределах 99% доверительного интервала. Падение активности фермента АТФазы в экспериментальной группе не было значимым. Повышение АТФазы в последнюю неделю перед переводом в морскую воду в контрольной группе не было значимым, но может быть расценено как возможное восстановление после стрессового воздействия.
В первое время после перевода в море у радужной форели происходит истощение (мелкая рыбешка). Такие рыбы могут выживать в морской воде в течение длительного периода, но плохо питаются и нормально не растут. Их нелегко удалить из садка; обычно они остаются в нем на протяжении всего времени до вылова. Затем подсчитывают всех рыб и обнаруживается реальный масштаб проблемы мелких рыбешек. Данное болезненное состояние полностью не изучено. Однако полагают, что основным фактором является плохая осморегуляция в морской воде. В данном полевом испытании уровень смертности через 60 дней после перевода был удовлетворительным как в экспериментальной, так и в контрольной группах, но в экспериментальной группе наблюдалась более низкая смертность.
Полевое испытание 2 указывает, что экспериментальный рацион 2 является средством для лучшей преадаптации радужной форели к жизни в морской воде по сравнению с традиционным способом выращивания.
Влияние экспериментального рациона 2 на процесс смолтификации без применения фоторегулирования, а также влияние экспериментального рациона 2 на десмолтификацию
Полевые испытания 3, 4 и 6 представляют собой эксперименты, проведенные без использования фоторегулирования в процессе смолтификации.
Полевое испытание 3
Рыбы в полевом испытании 3, помещенные в резервуар вне здания рыбозавода, находились при непрерывном искусственном освещении. Затем рыб переводили внутрь помещения, и они продолжали находиться при искусственном освещении 24 часа в сутки. Эксперимент проводили, когда рыбы находились внутри помещения. Непрерывного освещения обычно недостаточно для достижения удовлетворительного процесса смолтификации, но известно, что такие условия в сочетании с высокой температурой воды (>8°С) могут обеспечить рыбам высокую активность фермента АТФазы в жабрах. Такие рыбы будут иметь нормальную осморегуляцию в морской воде. Однако покатное состояние в таких группах рыб зачастую оказывается неоднородным, не подходящим для перевода в море.
Один аспект, который может иметь значение, это то, что рыбы находились в августе и сентябре под темным ночным небом. Это могло восприниматься как зимний сигнал, несмотря на поступление относительно скромного количества света от дополнительного искусственного освещения резервуара, по сравнению с темнотой ночного неба. При переводе в помещение в условия непрерывного освещения без перепадов, стимул мог восприниматься рыбами как летний сигнал. По-видимому, он вносил вклад в процесс смолтификации. Независимо от условий освещения, можно с достаточной уверенностью сказать, что эти рыбы находились при субоптимальном режиме освещения, по сравнению со стандартным фоторегулированием смолта.
Экспериментальный рацион 2 обеспечивает более раннюю и более высокую активность фермента АТФазы, по сравнению с контрольной группой. Это справедливо на протяжении всего экспериментального периода, длившегося на протяжении 11 недель. Наблюдается значимое увеличение в экспериментальной группе в раннем процессе смолтификации (между первой и третьей точками измерения), тогда как единственным значимым изменением в контрольной группе является снижение АТФазы между третьей и четвертой точками измерения. В случае экспериментального рациона 2 наблюдается соответствующий ответ АТФазы, аналогичный наблюдавшемуся в полевых испытаниях 2 и 5.
Кроме того, мы видим, что индекс смолта в экспериментальной группе значимо повышается между первой и третьей точками измерения, тогда как в контрольной группе не происходило никакого значимого изменения. Между второй и третьей точками измерения в экспериментальной группе (в пределах 99% доверительного интервала) наблюдалось более значимое повышение по сравнению с контрольной группой (в пределах 95% доверительного интервала). В данном случае увеличение индекса смолта в экспериментальной группе происходит ранее, чем в контрольной группе и совпадает с повышением активности фермента АТФазы. Оценка индекса смолта выполнялась одним и тем же человеком в каждой точке измерения (за исключением первого измерения) и количество данных в 3 раза превышает аналогичное количество в полевом испытании 5 (n=30 по сравнению с n=10). Это подкрепляет данное наблюдение при сравнении с полевым испытанием 5, в котором явный эффект экспериментального рациона 2 на индекс смолта отсутствовал.
В материале, в котором анализировали число копий мРНК альфа 1а (пресноводной АТФазы), можно отметить, что доля образцов с числом копий меньше 1,186 миллиона практически стабильна на протяжении всего экспериментального периода 11 недель по сравнению с контрольной группой (диаграмма 11). К сожалению, в эксперименте отсутствуют измерения в начале эксперимента, но второе измерение во 2 повторности указывает на большое число копий до начала испытания. В отличие от полевого испытания 5, в котором температура воды снижалась ниже 6°С, в данном случае мы имеем стабильную температуру воды между 8,3-8,9°С. Температура воды оказывает влияние на потребление корма и при 8°С потребление корма стабильно, что не было достигнуто в полевом испытании 5. Разумно предположить, что это имеет важное значение для того, чтобы доля образцов, в которых число копий мРНК альфа 1а ниже 1,186 миллионов копий (пограничное значение для толерантности к морской воде), была стабильной. Данный результат, кажется, напрямую связан с потреблением экспериментального рациона 2 и не может быть достигнут при применении обычного корма для выращивания. Это иллюстрирует, что возможно поддерживать рыб в стадии смолта, когда они остаются в пресной воде в течение длительного периода времени. Это имеет конкретное практическое приложение при выращивании смолта в силу того, что рыбы не подвергаются десмолтификации, а покатное состояние синхронизируется у всей популяции рыб в резервуаре. Данный аспект имеет важное значение для роста и выживаемости в морской воде, а также обеспечивает гибкость во времени перевода смолта в морскую воду. При надлежащей температуре воды, надлежащем состоянии окружающей водной среды и хорошем здоровье рыбы возможно выращивать пост-смолтов (1-2 кг) в пресной воде для выпуска в установки в морской воде или выращивать лосось в пресной воде непосредственно до товарного размера ((>2 кг).
Авторы изобретения отметили, что в контрольной группе на протяжении экспериментального периода происходило значимое увеличение и снижение пресноводной АТФазы, тогда как в экспериментальной группе не происходило значимых изменений. Возможно, это объясняется тем фактом, что первая точка измерения для этого типа анализа отсутствует в обоих повторностях 1 и 2, и что экспериментальный рацион 2 поддерживает пресноводную АТФазу рыб на стабильно низком уровне (диаграммы 9 и 10). Однако, в контрольной группе уровень пресноводной АТФазы снижается приблизительно до того же уровня, что и в экспериментальной группе после 11 недель эксперимента. Это может объясняться тем, что рыбы вступили в процесс смолтификации, занявший приблизительно 654 дня с момента, когда рыбу перевели внутрь помещения рыбозавода (предположительное начало летнего сигнала). Обычно рыбы достигают стадии смолта через 350 дней при летнем сигнале. Сравнивая активность фермента АТФазы с пресноводной АТФазой на протяжении того же периода, мы видим, что при последнем измерении активность фермента АТФазы составляет 7,7 в контрольной группе и 9,2 в экспериментальной группе. Уровень в контрольной группе указывает на десмолтификацию, либо рыбы подверглись отрицательному воздействию окружающей среды и в таких случаях значимое снижение активности фермента АТФазы является обычным. Уровни пресноводной АТФазы не свидетельствуют в пользу десмолтификации, скорее наоборот. Наиболее вероятной причиной снижения ферментативной активности АТФазы является стрессовое воздействие. Таким стрессовым воздействием может быть высокая плотность посадки в небольших экспериментальных резервуарах. Аналогичное наблюдение было сделано при сортировке радужной форели в полевом испытании 2, когда у рыб, получавших экспериментальный рацион 2, поддерживались более высокие значения АТФазы по сравнению с контрольной группой, несмотря на добавившееся стрессовое воздействие.
В полевом испытании 3 рыб не переводили в морскую воду для дальнейшего выращивания. Однако, перед уничтожением группы рыб проводили нагрузочный тест с морской водой. Данный тест показывает, что уровень хлоридов плазмы был удовлетворительным (120-150 ммоль/л) как в контрольной, так и в экспериментальной группах (диаграмма 14). Авторы изобретения отметили в контрольной группе тенденцию, которая в основном показывала, что размер рыб положительно влиял на уровень хлоридов плазмы по сравнению с тем, что наблюдалось в экспериментальной группе (диаграмма 13). Данное наблюдение подтверждает, что экспериментальный рацион 2 улучшает способность рыб к осморегуляции в морской воде.
Полевое испытание 4
Полевое испытание 4 проводили при понижающейся температуре воды и укорачивающейся продолжительности дня после осеннего равноденствия. Рыбы в течение дня больше находились в темноте, чем при освещении, и в течение эксперимента доля темного времени суток каждый день увеличивалась. И температура воды, и укороченная продолжительность светового дня являются отрицательными сигналами для процесса смолтификации. У рыб, получавших экспериментальный рацион 2, происходило значимое повышение активности фермента АТФазы в пределах 99% доверительного интервала, тогда как у контрольных рыб не происходило значимого изменения активности фермента АТФазы. В случае экспериментального рациона 2 данные были аналогичны полученным в полевом испытании 3.
Происходило значимое повышение индекса смолта между первым и последним измерением у рыб, получавших экспериментальный рацион 2, тогда как у контрольных рыб в течение того же периода индекс смолта не изменялся. В случае экспериментального рациона 2 ответ аналогичен наблюдавшемуся в полевом испытании 3.
Образцы, в которых определяли мРНК альфа 1а (пресноводную АТФазу), демонстрируют значимое снижение между точками измерения в случае экспериментального рациона 2 в пределах 99% доверительного интервала. Данное снижение не наблюдалось в контрольной группе. Толерантность к морской воде при втором измерении в экспериментальной группе (приблизительно через 2 недели от начала эксперимента) находилась ниже пограничного значения, на уровне 1,186 миллионов копий пресноводной АТФазы. Данный ответ наблюдался в полевом испытании 3, а также в полевом испытании 5.
При переводе в морскую воду уровень смертности оставался очень низким на протяжении всего периода выращивания вплоть до отлова.
В целом, данный эксперимент показывает, что экспериментальный рацион 2 безопасен в применении при обычном выращивании, а также демонстрирует влияние на смолтификацию, не смотря на отсутствие обычных сигналов к смолтификации. В практическом рыбоводстве рыбы будут получать время от времени неполные сигналы к смолтификации (отсутствие/неполноценность зимнего и летнего сигналов), и в таких ситуациях это можно компенсировать с помощью экспериментального рациона 2.
Полевое испытание 6:
Полевое испытание 6 проводили для сравнения двух различных способов выращивания, непрерывного освещения в сочетании с экспериментальным рационом 2 или традиционного фоторегулирования и обычного корма для выращивания. В данном случае выращивание проводили на открытом воздухе, в садках в пресной воде. Рыбы в экспериментальной группе получали непрерывное освещение. Кроме того, процесс смолтификации завершался перед осенним равноденствием. Таким образом, продолжительность светлого времени суток у рыб превышала продолжительность темного времени суток. Рыбы в контрольной группе находились при естественном освещении до 12 сентября 2012, и темнота во время ночного периода служила зимним сигналом. При воздействии искусственного освещения он воспринимался рыбами как летний сигнал. Основной целью данного эксперимента было оценить возможность перевода рыб в морскую воду на более ранней стадии, по сравнению с тем, что позволяет фоторегулирование. Кроме того, изучали влияние экспериментального рациона 2 на смолтификацию и выживание рыб после перевода в морскую воду.
Эксперимент показал, что экспериментальный рацион 2 в данном случае способен обеспечить перевод смолтов в морскую воду на 5 недель раньше, чем при выращивании с фоторегулированием. Основной причиной этому является то, что рыбы не получают зимнего сигнала и, таким образом, у них может сохраняться нормальное потребление корма. Таким образом, рыбы достигают размеров, подходящих для вакцинации, раньше, чем рыбы, получающие зимний сигнал.
Смолтификация происходит после выполнения вакцинации. У данного хозяйства по разведению смолтов нет возможности применять искусственный зимний сигнал, поскольку садки содержатся в пресноводном озере. Хозяйство по разведению смолтов вынуждено выжидать достаточное число дней, когда ночи бывают темными (в августе и сентябре), и искусственное освещение, служащее летним сигналом в процессе смолтификации, включается в сентябре, после зимнего сигнала. Между первой и второй точками измерения в экспериментальной группе происходит значимое повышение активности фермента АТФазы в пределах 99% доверительного интервала, тогда как в контрольной группе в тот же период не происходило никакого значимого изменения АТФазы (диаграмма 25). В случае экспериментального рациона 2 ответ аналогичен наблюдавшемуся в полевых испытаниях 3 и 4.
Динамика индекса смолта в данном эксперименте была одинаковой в экспериментальной и в контрольной группе. Это может быть обусловлено тем, что и экспериментальная, и контрольная группа получали большее количество естественного дневного освещения, чем в полевых испытаниях 3, 4 и 5. Известно, что интенсивность света влияет на величину индекса смолта. При ярком освещении индекс смолта выше, чем при тусклом освещении.
Образцы, в которых определяли мРНК альфа 1а (пресноводную АТФазу), демонстрируют значимое снижение между точками измерений в случае экспериментального рациона 2 в пределах 99% доверительного интервала. Данное снижение между первым и вторым измерениями также наблюдается в контрольной группе, однако снижение в экспериментальной группе в численном выражении превышает аналогичное изменение в контрольной группе. Снижение между первым и вторым измерениями в экспериментальной группе происходит с 6,07 до 1,48 миллиона копий. Для сравнения, снижение в контрольной группе происходит с 2,5 до 2,23 миллиона копий. Между второй и третьей точками измерения в контрольной группе не происходит значимых изменений, но в экспериментальной группе продолжается снижение до 0,75 миллиона копий. Изменение в экспериментальной группе соответствует тому, что наблюдалось в полевых испытаниях 3, 4 и 5, но происходит несколько позже по сравнению с другими. Это может быть связано с тем, что в экспериментальной группе число копий мРНК альфа 1а исходно было более высоким и для снижения ее экспрессии требуется более длительное время. В контрольной группе при переводе в морскую воду не происходило снижение мРНК альфа 1а ниже пограничного значения толерантности к морской воде, 1,186 миллионов копий. Известно, что корреляция между активностью фермента АТФазы и мРНК альфа 1а у рыб при фоторегулировании имеет форму U-образной кривой. АТФазе 1-9 соответствует меньшее количество копий мРНК, тогда как АТФазе 9-22 соответствует большее количество копий мРНК. Предположительно, в области АТФазы 9-20 рыбы используют двойственную стратегию и способны как к десмолтификации в пресной воде, так и к жизни в морской воде. Это затрудняет определение нижней границы для пресноводной АТФазы при измерении, что может иметь место в данном эксперименте. В то же время авторы изобретения отметили, что уровень фермента АТФазы у рыб не превышал 8,29, и это указывает, что они были не готовы к жизни в морской воде на момент перевода. Тем не менее, выживаемость и рост в морской воде в контрольной группе были хорошими. Можно предположить, что активность фермента АТФазы была подавлена стрессовым воздействием и «высвободилась» при переводе в морскую воду.
Уровень смертности у рыб, получавших в пресной воде экспериментальный рацион 2, был очень низким в первые 8 месяцев, проведенных в морской воде, составив 0,36%.
В целом, данный эксперимент показывает, что экспериментальный рацион 2 безопасен для применения при стандартном выращивании, и что рыбы могут проходить смолтификацию без применения фоторегулирования, только благодаря экспериментальному рациону 2. Однако, опыт применения данного типа выращивания ограничен по сравнению с методом SuperSmolt ®, в котором сочетается применение непрерывного освещения. Таким образом, будут естественными осторожность в его применении, выбор благоприятных условий выращивания (высокая температура воды, здоровые рыбы и хорошее качество воды) и постепенное накопление опыта практического применения описанного способа перед расширением его применения.
Физиологическая оценка, связанная с геморрагическим синдромом смолта (ГСС) атлантического лосося, и применение экспериментального рациона 2 против ГСС
ГСС является нарушением, которое встречается относительно часто на стадии смолтификации у атлантического лосося. Nylund et al. (2003) связывает заболевание с вирусной инфекцией, однако возбудитель заболевания не был найден. Также предполагают, что возможными причинами могут быть ненадлежащее питание или генетические заболевания (Rodgers and Richards, 1998). Обычно ГСС страдает самая крупная рыба в группе и это та рыба, у которой процесс смолтификации зашел дальше, чем у других.
Физиологически, смолты в пресной воде будут активно выкачивать через жабры Na+ и Cl- и экскретировать Mg2+ и Са2+ через почки. Если лосось находится на стадии пестрятки, он будет забирать из окружающей среды Na+, Cl-, Са2+ и Mg2+. Проблема ГСС возникает, когда рыба является смолтом, адаптированным к морской воде, но продолжает находиться в пресной воде, и еще больше усиливается, когда рыба получает корм, повышающий интенсивность питья. Экспериментальный рацион 1 приводит к увеличению заболеваемости ГСС, приводя к более чем 20-кратному увеличению смертности по сравнению с рыбами, получавшими обычный корм для выращивания. Экспериментальный рацион 1 содержит только Na+и Cl-, но не свободные Mg2+ и Са2+. Можно предположить, что содержание 7% NaCl в корме повышает интенсивность потребления пресной воды и усиливает и без того установившуюся в группе рыб повышенную интенсивность питья. Например, можно отметить, что у рыб с ГСС из полевого испытания 1, получавших экспериментальный рацион 1, хлориды плазмы составляли 90,5 ммоль/л, тогда как у рыб с ГСС, получавших контрольный рацион, хлориды плазмы составляли 102,8 ммоль/л. Нормальные значения хлоридов плазмы в пресной воде у здоровых рыб составляют 120-135 ммоль/л. Это указывает, что секреция хлоридов плазмы рыбами с ГСС, получавшими экспериментальный рацион 1, усиливается по сравнению с рыбами с ГСС, получавшими корм для выращивания. Хлориды плазмы у рыб с ГСС явно ниже по сравнению с нормальными рыбами, что указывает на то, что усиленная экскреция Cl- является частью патологического паттерна. Возможно, поэтому активность фермента Na+-K+-АТФазы стимулирует поступление хлорид-ионов у рыб, дополнительно получающих их с кормом. У рыб с ГСС значения фермента АТФазы совместимы со стадией смолтификации (АТФаза приблизительно 10 или выше), что соответствует хорошей способности выкачивать соли из организма (MultiLab, 2012).
В то же время, поскольку рыбы активно секретируют соли из организма через почки и жабры, осмотический градиент между телом рыбы и водой работает таким образом, что вода поступает в организм рыбы, а соли вымываются. Потеря солей по осмотическому градиенту преобладает, рыбы даже активно выкачивают соли.
Высокий почечный диурез у рыб позволяет выделять избыток воды, в то же время способность реабсорбировать такие ионы, как Са2+ и Mg2+ низкая, что соответствует тому, что происходит у лосося в морской воде. Таким образом, происходит потеря данных ионов, что является негативным фактором при нахождении рыбы в пресной воде. Вследствие этого у рыб возникает состояние гипокальциемии и гипомагниемии. Это проиллюстрировано на диаграммах 4 и 15. Магний в плазме рыб с ГСС (в экспериментальной и контрольной группах) составлял 1,04 и 1,08 ммоль/л, соответственно. Согласно данным литературы, нормальное значение для пресной воды составляет 2 ммоль/л (Jakobsen, 2013), тогда как у рыб в полевом испытании 3 оно составило 1,44 ммоль/л.
Аналогично, референтное значение кальция плазмы у здоровых рыб в полевом испытании 3 составило 3,8 ммоль/л, тогда как у рыб с ГСС (в экспериментальной и контрольной группах) оно составило 2,42 и 2,2 ммоль/л, соответственно. Са2+ и Mg2+ являются частью механизма, позволяющего рыбам осуществлять нормальные мышечные сокращения. Известно, что у других биологических видов, таких как крупный рогатый скот, гипокальциемия/гипомагниемия вызывает мышечную слабость, снижение частоты сердечных сокращений и летаргию. Внутривенное введение кальция и магния может справиться с данным нарушением. Можно отметить, что в клинической картине ГСС у рыб летаргия является типичным проявлением. Рыбы плавают медленно, и это можно интерпретировать как мышечную слабость (сердечной и скелетных мышц) вследствие гипокальциемии/гипомагниемии. Как показывают эмпирические данные, добавление морской воды в пресную снижает или устраняет смертность данного типа. Морская вода очень богата магнием.
Другой важной находкой при ГСС на аутопсии является асцит (жидкость в брюшной полости). Если сердечная мышца не способна выполнять нормальные сокращения, и частота сердечного ритма снижается, ток крови в кровеносных сосудах затрудняется. Это может вызвать транссудацию в брюшную полость рыб, которую обнаруживают как асцит. В ситуации, когда рыбы, испытывающие недостаток солей, физиологически адаптированы к жизни в морской воде, но находятся в пресной воде, они начинаю пить для компенсации потери солей. Это может относиться к Са2+, Mg2+, а также к Na+или Cl-. Однако то, что для смолта должно было быть морской водой, оказывается пресной водой, не содержащей солей. Это заставляет рыб пить беспрестанно и постепенно вызывает развитие гиперволемии. Обычно на аутопсии рыб с ГСС обнаруживают отек мышечных тканей, что указывает на избыток жидкости в периферической циркуляции. Наблюдаются такие клинические признаки, как торчащая чешуя, и это предположительно вызвано отеком кожи/чешуйных кармашков вследствие гиперволемии.
Другой важной находкой на аутопсии рыб с нарушением являются множественные петехиальные кровоизлияния во внутренние органы и мышцы. Кровеносные сосуды имеют гладкие мышцы, которым для нормальных сокращений необходимы Са2+ и Mg2+. Отсутствие этих ионов приводит к снижению контрактильной способности, а в условиях гиперволемии это может приводить к разрыву кровеносных сосудов и кровоизлияниям. У радужной форели в морской воде повреждение функции сфинктера привратника (обструкция) может приводить к нарушению баланса осморегуляции, поскольку кишечник не получает достаточно воды из желудка. Это обстоятельство запускает потребность в воде и для предотвращения обезвоживания рыбы начинают пить морскую воду. Они будут потреблять воду в таком количестве, что это вызовет нарушение под названием «водяной живот». Это аномалия, при которой желудок увеличен и наполнен морской водой. Нарушение может принять такие масштабы, что приведет к разрыву абдоминальных мышц, но рыба все еще остается живой. Это является аналогом ГСС, когда лосось в таком количестве пьет морскую воду для получения солей, что это вызывает гиперволемию, которая приводит к разрыву кровеносных сосудов и обширным кровоизлияниям в различные органы. Транссудат (асцит), который обнаруживается при ГСС, очевидно является следствием пониженной способности сердца прокачивать поступающую кровь и может усиливаться у рыб в состоянии гиперволемии.
Корм для рыб согласно данному изобретению содержит Na+, Cl-, Са2+ и Mg2+ и может применяться при смолтификации, периоде, когда ГСС возникает чаще всего. Предполагают, что корм для рыб согласно данному изобретению можно применять для предотвращения и лечения состояния ГСС у лососевых. Получая корм для рыб, предложенный в данном изобретении, рыбы не будут потреблять пресную воду для замещения указанных ионов, и, следовательно, не будут развиваться гиперволемия, кровотечения, асциты, мышечная слабость или отек чешуйных кармашков, что позволит избежать такой проблемы при выращивании, как ГСС. Это также относится к выращиванию крупных лососей (вплоть до товарного размера) в пресной воде, где обычными проблемами при выращивании являются потеря аппетита, ГСС, отек чешуйных кармашков и потеря чешуи.
Различия между методом SuperSmolt и кормом для рыб согласно данному изобретению
Согласно методу SuperSmolt ®, в эксплуатируемую воду добавляют катионные модуляторы Са2+, Mg2+ в сочетании с Na+, Cl- и свободным триптофаном в корме для рыб, предназначенном для лососевых. Назначением способа SuperSmolt ® является перевод лососей в морскую воду.
В отличие от метода SuperSmolt®, корм для рыб, предложенный в данном изобретении, содержит все катионные модуляторы в самом корме и не требует отдельного добавления рыбам модуляторов в эксплуатируемую воду. Назначением корма для рыб, предложенного в данном изобретении, является перевод лососевых в морскую воду, а также поддержание рыб в стадии смолта для получения крупных лососевых в морской воде в течение длительного времени, и в то же время контроль заболевания ГСС и десмолтификации. Корм для рыб, способ смолтификации и области практического применения обладают новизной относительно метода SuperSmolt®.
Кроме того, авторы изобретения отмечают, что применение одних только модуляторов Na+, Cl- и триптофана в корме (как в случае с кормом согласно методу SuperSmolt ®) вызывает увеличение заболеваемости ГСС у атлантического лосося. Это подчеркивает, что рацион, которую обеспечивает корм согласно методу SuperSmolt ®, не достаточен для удовлетворительного протекания процесса смолтификации, без добавления в пресную воду модуляторов Са2+, Mg2+ согласно данному методу.
Области применения корма для рыб согласно данному изобретению
Корм для рыб согласно данному изобретению можно применять в качестве:
1. Дополнительного сигнала к смолтификации лососевых в сочетании со стандартным фоторегулированием.
2. Способа смолтификации в сочетании с непрерывным освещением, естественным освещением или неполным фоторегулированием смолтификации.
3. Синхронизации групп смолтов в пресной воде.
4. Предупреждения десмолтификации лососевых в пресной воде.
5. Профилактики и лечения ГСС, отека чешуйных кармашков и потери чешуи.
6. Кормовой композиции для выращивания в пресной воде пост-смолтов различных видов лососевых и достижения рыбами товарного размера, с учетом предупреждения возникновения заболеваний, упомянутых выше в пп. 4 и 5, а также поддержания нормального роста, аналогичного тому, который наблюдается в морской воде.
7. Кормовой композиции для выращивания в пресной воде маточного стада различных видов лососевых до размеров, при которых желательна/возможна подача сигнала к достижению половозрелости и сбор икры для потребления или для дальнейшего выращивания рыбы, для предупреждения возникновения заболеваний, упомянутых выше в пп. 4 и 5, а также для поддержания нормального роста, аналогично тому, который наблюдается в морской воде.
| название | год | авторы | номер документа |
|---|---|---|---|
| Корм для подращивания смолта атлантического лосося | 1991 |
|
SU1784152A1 |
| СПОСОБ ВЫРАЩИВАНИЯ ПРЕСНОВОДНОГО ЛОСОСЯ | 2015 |
|
RU2614601C1 |
| Способ определения стадии смолтификации у молоди лососевых рыб | 1986 |
|
SU1376996A1 |
| СПОСОБ ПОЛУЧЕНИЯ КОРМА ДЛЯ МОЛОДИ ЛОСОСЕВЫХ РЫБ | 2007 |
|
RU2342849C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ СЛИЗИ НА ЖАБРАХ РЫБ | 2016 |
|
RU2709758C2 |
| КОРМОВАЯ ДОБАВКА | 2010 |
|
RU2525002C2 |
| СПОСОБ ВОСПРОИЗВОДСТВА ПОПУЛЯЦИЙ СЕВРЮГИ И БАЛТИЙСКОГО ЛОСОСЯ | 2014 |
|
RU2582347C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ПРОХОДНЫХ ТИХООКЕАНСКИХ ЛОСОСЕЙ | 2001 |
|
RU2206988C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТЕИНОВОЙ КОРМОВОЙ ДОБАВКИ ДЛЯ ЛОСОСЕВЫХ РЫБ В АКВАКУЛЬТУРЕ | 2023 |
|
RU2817148C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КОРМА ДЛЯ РАННЕЙ МОЛОДИ ЛОСОСЕВЫХ РЫБ | 2007 |
|
RU2366265C1 |
Группа изобретений относится к разведению рыбы, в частности к корму для рыбы, пригодного для способа смолтификации, способу предупреждения десмолтификации и способу профилактического и/или терапевтического лечения геморрагического синдрома смолта у лососевых. Корм для рыбы содержит белки, жиры, углеводы, витамины, минералы, воду, а также Na+ от 3,934 до 39,340 г/кг массы, модулятор рецепторов поливалентных катионов (PVCR) в форме свободных аминокислот от 1 до 10 г/кг массы, Mg2+ от 0,026 до 25,530 г/кг массы и Са2+ от 0,036 до 36,110 г/кг массы. Использование группы изобретений позволит предупреждать заболевания, а также поддерживать нормальный рост. 4 н. и 16 з.п. ф-лы, 25 табл.
1. Корм для рыбы, содержащий белки, жиры, углеводы, витамины, минералы и воду, и дополнительно содержащий Na+ от 3,934 до 39,340 г/кг массы, модулятор рецепторов поливалентных катионов (PVCR) в форме свободных аминокислот от 1 до 10 г/кг массы, Mg2+ от 0,026 до 25,530 г/кг массы и Са2+ от 0,036 до 36,110 г/кг массы.
2. Корм для рыбы согласно п. 1, где свободные аминокислоты выбраны из группы, состоящей из триптофана, тирозина, фенилаланина, серина, аланина, аргинина, гистидина, лейцина, изолейцина, аспарагиновой кислоты, глутаминовой кислоты, глицина, лизина, метионина, пролина, глутамина, аспарагина, треонина, валина, цистеина и любой их комбинации.
3. Корм для рыбы согласно п. 1, где модулятор рецепторов поливалентных катионов содержит триптофан или фенилаланин в форме свободных аминокислот.
4. Корм для рыбы согласно п. 1, где модулятор рецепторов поливалентных катионов представляет собой триптофан в форме свободной аминокислоты.
5. Корм для рыбы согласно любому из предшествующих пунктов, где Na+, Mg2+ и Са2+ находятся в форме солей.
6. Корм для рыбы согласно п. 1, где соли натрия представляют собой NaCl.
7. Корм для рыбы согласно п. 1, где соли магния представляют собой MgCl2.
8. Корм для рыбы согласно п. 1, где соли кальция представляют собой CaCl2.
9. Корм для рыбы согласно п. 1, где корм для рыбы содержит Сl- от 6,202 до 199,020 г/кг массы.
10. Корм для рыбы согласно п. 1, содержащий 6% по массе NaCl, 0,75% по массе CaCl2,0,25% по массе MgCl2 и 0,4% по массе L-триптофан.
11. Корм для рыбы согласно любому из пп. 1-10, где корм для рыбы подходит для индукции смолтификации и/или предупреждения десмолтификации у лососевых.
12. Способ смолтификации у лососевых, включающий стадии, при которых: а. берут корм для рыбы согласно любому из пп. 1-11,
б. вносят корм для рыбы в пресную воду, популяции лососевых, где популяция включает пестряток или десмолтифицированных рыб, с целью индукции состояния смолтификации или толерантности к морской воде у рыб,
в. держат рыб на рационе, включающем корм для рыбы, до достижения рыбами состояния смолтификации или же достижения толерантности к морской воде.
13. Способ согласно п. 12, где корм для рыбы дают пестряткам до тех пор, пока не наступит смолтификация, корм дают без добавления дополнительных ионов в пресную воду, указанные ионы представляют собой Mg2+ и Са2+.
14. Способ согласно п. 13, где корм для рыбы дают пестряткам до тех пор, пока не наступит смолтификация, корм дают в отсутствие фоторегулирования, указанное фоторегулирование относится к типу, который включает воздействие на популяцию рыб искусственного режима освещения и темноты с целью индукции смолтификации.
15. Способ согласно п. 14, где корм для рыбы дают пестряткам в сочетании с режимом непрерывного освещения до тех пор, пока не наступит смолтификация.
16. Способ предупреждения десмолтификации у лососевых, включающий стадии, при которых:
а. берут корм для рыбы согласно любому из пп. 1-11,
б. вносят корм для рыбы в пресную воду, популяции лососевых, где популяция включает смолтифицированных рыб, с целью поддержания состояния смолтификации или толерантности к морской воде у рыб.
17. Способ согласно п. 16, где способ дополнительно включает содержание рыбы в пресной воде на рационе, обеспечиваемом кормом для рыбы, до тех пор пока рыбы не достигнут товарного размера.
18. Способ согласно п. 16 или 17, где способ дополнительно включает содержание рыбы в пресной воде на рационе, обеспечиваемом кормом для рыбы, индуцирующем половое созревание рыб, и сбор икры для выращивания новых рыб или для потребления.
19. Способ согласно п. 12, где корм для рыбы дают пестряткам в сочетании с режимом фоторегулирования, указанное фоторегулирование относится к типу, который включает воздействие на популяцию рыб искусственного режима освещения и темноты с целью индукции смолтификации.
20. Способ согласно пп. 12 или 16, где корм для рыбы дают в соответствии с аппетитом рыбы и в качестве полного заменителя другого корма для рыбы.
21. Способ профилактического и/или терапевтического лечения геморрагического синдрома смолта (ГСС) у лососевых, включающий стадии:
а. выявления в популяции лососевых рыб, страдающих или имеющих риск развития геморрагического синдрома смолта (ГСС),
б. обеспечения рыб кормом согласно любому из пп. 1-11,
в. внесения корма для рыбы в пресную воду популяции лососевых до тех пор, пока не наступит облегчение геморрагического синдрома смолта (ГСС) или пока рыбы не достигнут товарного размера.
22. Способ по п. 21, где популяция включает пестряток, и корм для рыбы дают пестряткам до тех пор, пока не наступит смолтификация, корм дают без добавления дополнительных ионов в пресную воду, указанные ионы представляют собой Mg2+ и Са2+.
23. Способ по п. 21, где популяция включает пестряток, и корм для рыбы дают пестряткам до тех пор, пока не наступит смолтификация, корм дают в отсутствие фоторегулирования, указанное фоторегулирование относится к типу, который включает воздействие на популяцию рыб искусственного режима освещения и темноты с целью индукции смолтификации.
24. Способ по п. 21, где популяция включает пестряток, и корм для рыбы дают пестряткам в сочетании с режимом непрерывного освещения до тех пор, пока не наступит смолтификация.
25. Способ по п. 21, где способ дополнительно включает содержание рыб в пресной воде на рационе, обеспечиваемом кормом для рыбы, до тех пор, пока рыбы не достигнут товарного размера.
26. Способ по п. 21, где способ дополнительно включает содержание рыб в пресной воде на рационе, обеспечиваемом кормом для рыбы, индуцирующем половое созревание рыбы, и сбор икры для выращивания новых рыб или для потребления.
27. Способ по п. 21, где популяция включает пестряток, и корм для рыбы дают пестряткам в сочетании с режимом фоторегулирования, указанное фоторегулирование относится к типу, который включает воздействие на популяцию рыб искусственного режима освещения и темноты с целью индукции смолтификации.
28. Способ по п. 21, где корм для рыбы дают в соответствии с аппетитом рыбы и в качестве полного заменителя другого корма для рыбы.
29. Способ по п. 21, где корм для рыбы дают рыбам, которые уже находятся на стадии смолта для дополнительного предупреждения десмолтификации рыбы.
| Способ изготовления резьбовых калибров-колец | 1989 |
|
SU1670321A1 |
| WO 0230182 A2, 18.04.2002 | |||
| US 2013142905 A1, 06.06.2013. | |||
Авторы
Даты
2019-12-04—Публикация
2015-09-22—Подача