Изобретение относится к области синтеза новых аналитических реагентов комплексообразующего типа и может быть использовано в области люминесцентного анализа, в частности для клинической диагностики белковых объектов биогенного происхождения, а также в областях науки и техники, связанных с процессами комплексообразования ионов тяжелых металлов и применения наноразмерных люминесцирующих реагентов.
Известен способ флуоресцентно-спектроскопического определения биологически активных веществ, при осуществлении которого используются маркеры на основе хелатов лантаноидов, связанных с определяемыми веществами посредством полиаминополикарбоновых кислот типа диэтилентриаминопентауксусной кислоты (ДТПА), обладающих высокими константами связывания ионов лантаноидов (>1018 М-1) (США, патент №4808541, класс НКИ 436/501 [1]). Недостатком этих соединений является отсутствие люминесцентных свойств, что определяет необходимость использования «диссоциативных» технологий иммуноанализа.
Аналогом к заявляемым соединениям по сущности изобретения является реагент для мечения на основе хелатов лантаноидов с бис-β-дикетонатными структурами, содержащими также хромофорную (ароматическую) и электроноакцепторную (фторзамещенные алкильные группы) части (США, патент №6166251, класс НКИ 562/828 [2]). Хелаты обладают высокой интенсивностью флуоресценции, более чем в 10 раз превышающую интенсивность флуоресценции реагентов известных систем (LKB). Хелаты на основе бис-β-дикетонатных структур позволяют проводить измерения на твердой фазе и в жидкости, так как вследствие достаточно высокой константы стабильности не требуется их перекомплексовывания, синтезируются с высоким выходом и дешевы. Недостатком использования указанных соединений является то, что максимум возбуждения комплексов не превышает 340 нм и отсутствуют спейсеры для подшивки биоорганических молекул.
Наиболее близки к заявляемым реагентам дибензосодержащие циклические соединения, содержащие два β-дикарбонильных заместителя с фторированными радикалами среди которых описаны и соответствующие соединения ряда карбазола (РФ, патент №2296756 и [Кострюкова, Т.С; Ивановская, Н.П.; Затонский, Г.В.; Осин, Н.С.; Васильев, Н.В. Биоорг. Хим., 2015, 41(2), 212.]). Хелаты этих соединений обладают высокой интенсивностью флуоресценции, имеют высокие константы стабильности, длинноволновый максимум длин волн возбуждения соединений ряда карбазола (380-390 нм), не требуют перекомплексовывания. Недостатком этих соединений является то, что в большинстве своем они не имеют реакционноспособных групп для взаимодействия с белками. Некоторые соединения, имеющие две активные метоксикарбонильные группы, могут взаимодействовать с белками [Кострюкова, Т.С.; Ивановская, Н.П.; Затонский, Г.В.; Осин, Н.С.; Васильев, Н.В. Биоорг. Хим., 2015, 41(2), 212.], но при этом существенно снижается константа стабильности образующегося комплекса. Кроме этого, наличие у некоторых соединений двух метоксикарбонильных групп, отделенных спейсерами дифторметиленового типа, может приводить к «сшивкам» белковых молекул, препятствующим биоспецифическому взаимодействию.
Задачей является создание соединений, способных к образованию люминесцирующих комплексов с ионами металлов, имеющих активную реакционноспособную группу, отделенную от хромофорного фрагмента спейсером.
Техническим результатом, достигаемым при использовании заявляемых соединений, является их улучшенные люминесцентно-спектральные характеристики при образовании комплексов с ионами металлов, что позволяет проводить обнаружение, как самих ионов, так и других аналитов, маркированных комплексами этих соединений. В частности, соединения образуют стабильные длительно люминесцирующие (времена жизни порядка 500-700 мкс) комплексы с ионами Eu3+ при возбуждении в области 375 нм.
Кроме того, технический результат достигается тем, что заявленные соединения имеют реакционноспособную группу, присоединенную через спейсер к азоту конденсированной системы, и могут быть ковалентно связаны с белковыми молекулами или другими аналитами (биологическими объектами).
Кроме того, технический результат достигается тем, что заявленные соединения обладают повышенной сорбируемостью на наночастицах и образуют стабильные нанодисперсные системы для иммунофлуоресцентного анализа.
Технический результат достигается предлагаемыми соединениями, представляющими собой соединения ряда карбазола, содержащие в 3- и 6-м положениях конденсированной системы два β-дикарбонильных заместителя с фторированными радикалами и функциональные (карбокси) группы, присоединенные через спейсер к азоту конденсированной системы, для использования в качестве комплексообразующих соединений, общей формулы
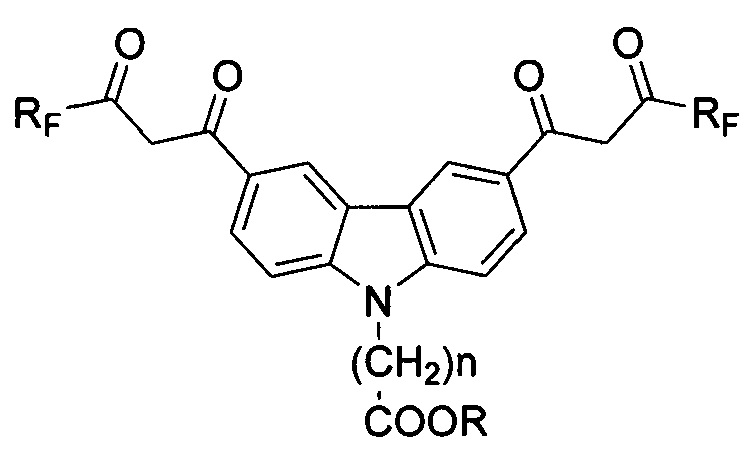
где Rf: (CF2)nCF3, где n=0-3;
где R: H, n=1-6.
Авторам не известны соединения ряда карбазола, содержащие в 3- и 6-м положениях конденсированной системы два β-дикарбонильных заместителя с фторированными радикалами и функциональные группы, присоединенные через спейсер к азоту конденсированной системы. Кроме того, авторам неизвестны соединения ряда карбазола с фторированными радикалами и содержащие функциональные группы, присоединенные через спейсер к азоту конденсированной системы, которые, при использовании в условиях проведения анализа биоспецифического связывания, обеспечивали бы указанный выше технический результат. Следовательно, заявляемое техническое решение удовлетворяет критерию «Новизна».
Заявляемые соединения позволяют получать люминесцирующие конъюгированные хелаты Eu3+ с высокими константами связывания и возбуждением в области 375 нм, что позволяет применить для реализации методик биомедицинского анализа дешевое светодиодное оборудование. Следовательно, предлагаемое техническое решение соответствует критерию "Уровень техники".
Изобретение может быть использовано для детектирования, идентификации и количественного определения материалов, которые способны связываться со специфическими связывающими агентами, в частности биологических материалов, таких как антигены, микроорганизмы и нуклеиновые кислоты. Способ может быть использован для детектирования низкой концентрации микроорганизмов специфических генов, видов или серотипов в изолированной форме или в качестве контаминантов пищи, окружающей среды или образцов судебной экспертизы. Заявляемые соединения и их комплексы с ионами лантаноидов могут найти применение в качестве маркеров в различных вариантах анализа с использованием флуориметрии с временным разрешением люминесценции. В области аналитической химии заявляемые реагенты могут быть также применены для обнаружения редкоземельных элементов, их концентрирования и выделения, в том числе в хроматографии. В области техники они могут быть применены в качестве экстрагентов тяжелых и редкоземельных металлов с целью их извлечения, или напротив очистки от их примесей сточных и контурных вод.
Следовательно, заявляемые соединения соответствуют критерию «Промышленная применимость».
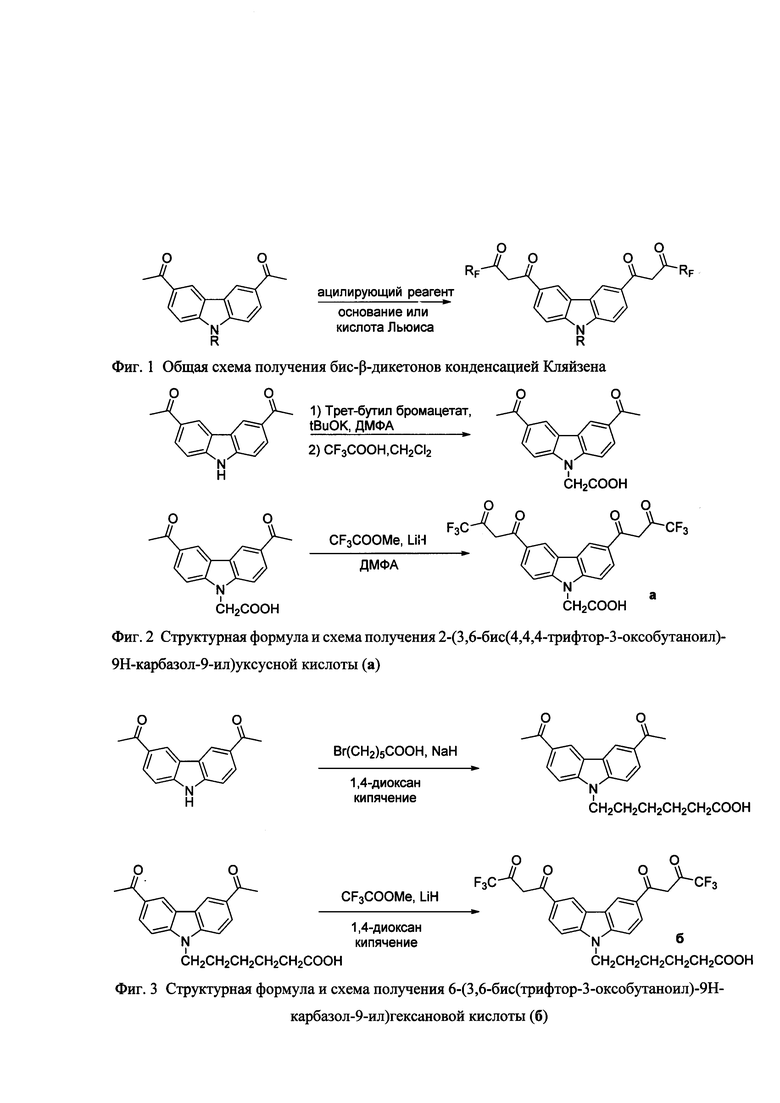
В общем случае заявляемые бис-β-дикетоны получаются по трехстадийной или двухстадийной методике, с применением на последней стадии конденсации Кляйзена (фиг. 1), хотя для создания каждого типа тетракетонов следует искать свои оптимальные параметры: ацилирующий реагент, основание (или кислота Льюиса), условия реакции, стехиометрия компонентов и т.п.
В качестве ацилирующего реагента можно использовать сложные эфиры и ангидриды, галогенангидриды алифатических кислот, предпочтительно, однако, применять алкиловые эфиры перфторкарбоновых кислот.
В качестве оснований можно применять этилат натрия, метилат натрия, металлический натрий, амид натрия, гидриды натрия и лития. Если целевые бис-β-дикетоны получаются в присутствии гидридов металлов (LiH, NaH) с удовлетворительными выходами, то следует использовать эти реагенты, так как они коммерчески доступны.
В качестве растворителей при осуществлении конденсации Кляйзена используются любые инертные растворители, не меняющиеся в условиях реакции. К ним, в частности, принадлежат: ациклические и циклические простые эфиры, ациклические и циклические углеводороды, апротонные биполярные растворители. При этом предпочтительно применять простые эфиры как циклические, так и алифатические.
При проведении реакции предпочтительным оказалось соотношение компонентов: диацетильное производное карбазола : конденсирующий агент : основание - 1:5:2,9, хотя оно может изменяться в каждом конкретном случае.
Температура реакции может колебаться от -5°С до температуры кипения растворителя, однако предпочтительно проводить реакцию не ниже 50°С.
Реакции можно проводить как при атмосферном, так и при повышенном или пониженном давлении, однако обычно работают при атмосферном давлении. Использование инертной атмосферы может являться предпочтительным в некоторых случаях.
Перечень фигур
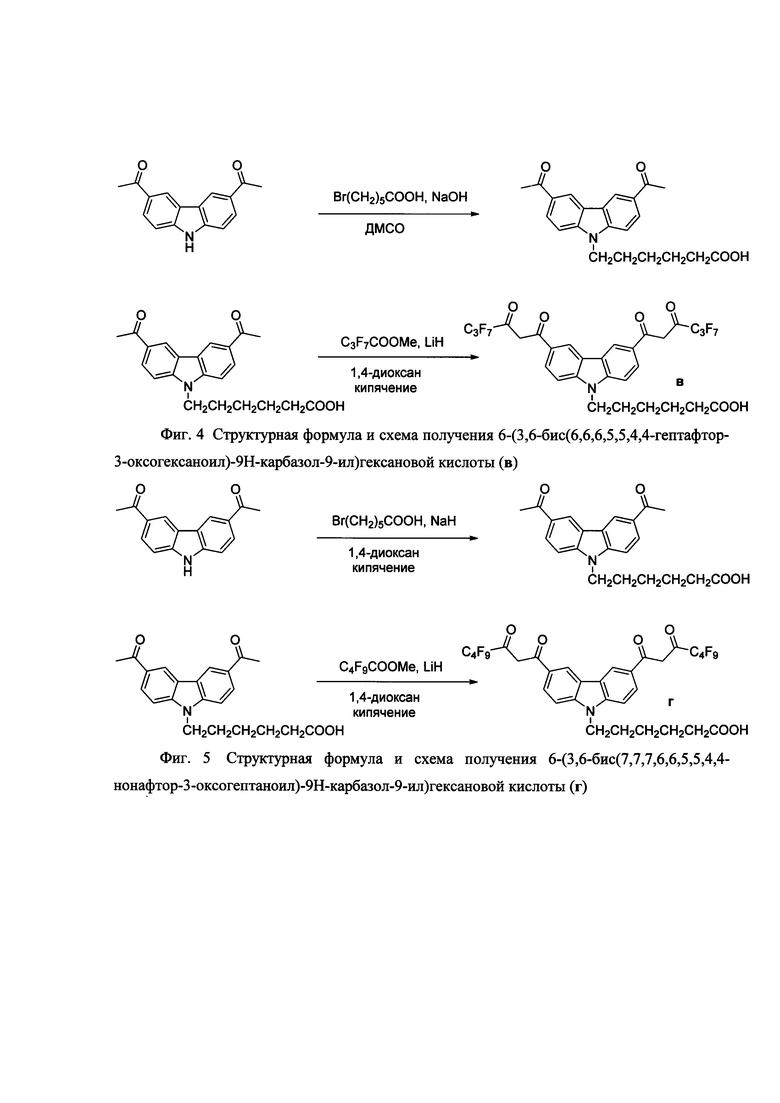
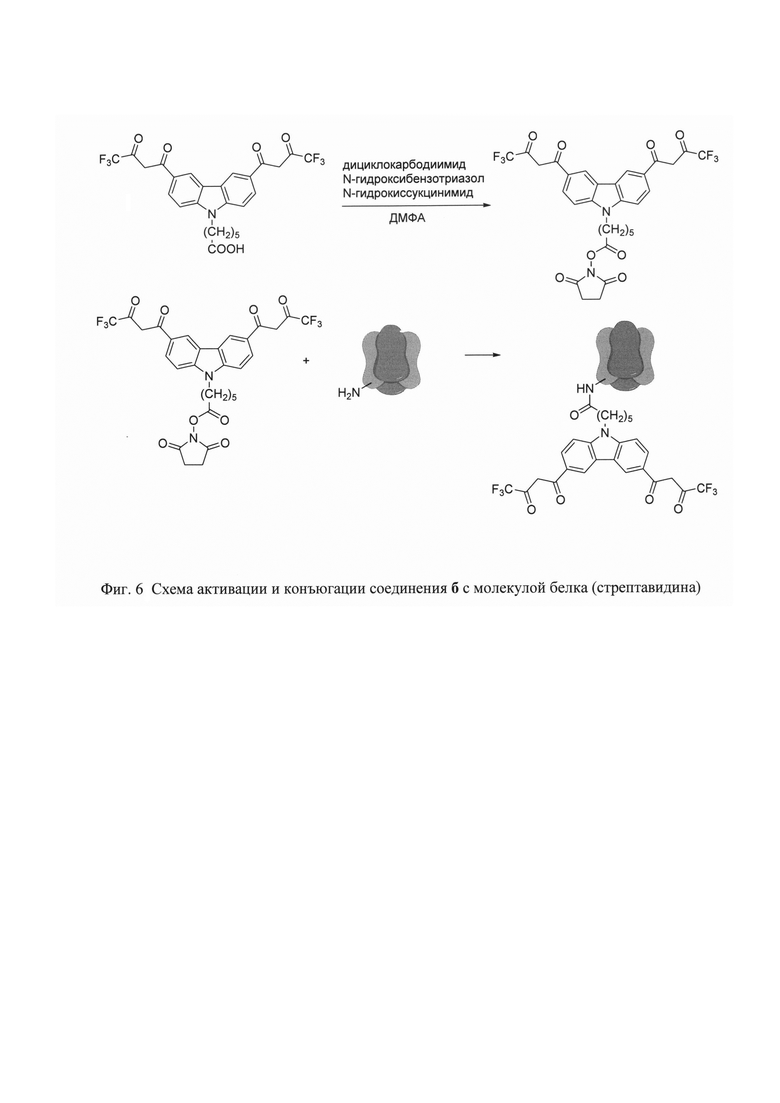
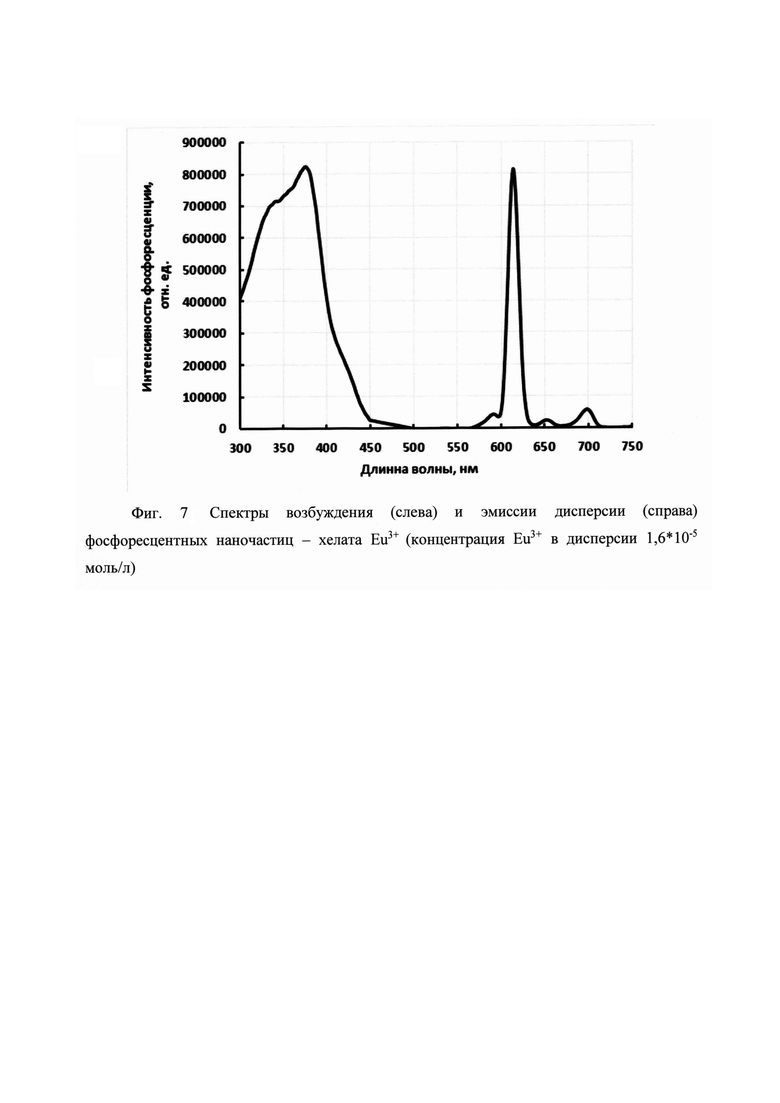
На фигуре 1 приведена общая схема получения бис-β-дикетонов конденсацией Кляйзена, на фигуре 2 приведена структурная формула и схема получения соединения 2-(3,6-бис(4,4,4-трифтор-3-оксобутаноил)-9Н-карбазол-9-ил)уксусной кислоты (а), на фигуре 3 - структурная формула 6-(3,6-бис(4,4,4-пентафтор-3-оксобутаноил)-9Н-карбазол-9-ил)гексановой кислоты (б), на фигуре 4 структурная формула 6-(3,6-бис(6,6,6,5,5,4,4-гептафтор-3-оксогексаноил)-9Н-карбазол-9-ил)гексановой кислоты (в), на фигуре 5 структурная формула 6-(3,6-бис(7,7,7,6,6,5,5,4,4-нонафтор-3-оксогептаноил)-9Н-карбазол-9-ил)гексановой кислоты (г), на фигуре 6 схема активации и конъюгации соединения 6 с молекулой белка (стрептавидин), на фигуре 7 спектры возбуждения (слева) и эмиссии дисперсии (справа) фосфоресцентных наночастиц - хелата Eu3+.
Примеры
Пример 1 (три стадии).
2-(3,6-Бис(4,4,4-трифтор-3-оксобутаноил)-9Н-карбазол-9-ил)уксусная кислота (а).
Стадия 1. Трет-бутиловый эфир 6-(3,6-диацетил-9Н-карбазол-9-ил)уксусной кислоты.
К раствору 2,03 ммоль 3,6-диацетилкарбазола (синтезирован по модифицированному методу F.E. Ray and G. Rieveshl «Organic Synthesis. An Annual Publication of Satisfactory Methods for the Preparation of Organic Chemicals», J.Wiley & Sons, 1948, v. 28, p. 3-14) в 18 мл сухого ДМФА прибавляют 6,80 ммоль трет-бутилата калия и перемешивают 20 минут. Затем прибавляют 3,00 ммоль трет-бутилового эфира бромуксусной кислоты и перемешивают 18 ч. Реакционную массу выливают в 80 мл этилацетата и промывают органический слой насыщенным раствором хлорида натрия (4×20 мл) и затем водой (2×20 мл). Сушат органический слой сульфатом натрия и упаривают растворитель в вакууме ≈20 Торр. Остаток перекристаллизовывают из этанола получая промежуточный трет-бутиловый эфир 6-(3,6-диацетил-9Н-карбазол-9-ил)уксусной кислоты с т.пл. 117-119°С. Выход 1,06 ммоль (53%).
1Н-ЯМР: 1,42 (с, 9Н, -С(СН3)3); 2,71 (с, 6Н, 2СН3); 4,94 (с, 2Н, СН2); 7,36 (д, 2Н, карб., J=8); 8,16 (дд, 2Н, карб., J=8, J=2); 8,76 (д, 2Н, карб., J=2).
Стадия 2. 6-(3,6-диацетил-9Н-карбазол-9-ил)уксусная кислота.
К 0,82 ммоль трет-бутилового эфира 6-(3,6-диацетил-9Н-карбазол-9-ил)уксусной кислоты в 10 мл хлористого метилена добавляют 8,2 ммоль трифторуксусной кислоты и перемешивают в течении 12 часов. Смесь упаривают в вакууме ≈20 Торр и 3 раза сооупаривают с метанолом добавляя 3×20 мл и получают светлосерый порошок с Тпл=279-284°С (разл). Выход 6-(3,6-диацетил-9Н-карбазол-9-ил)уксусной кислоты 0,80 ммоль (98%).
1Н-ЯМР: 2,68 (с, 6Н, 2СН3); 5,35 (с, 2Н, СН2); 7,68 (д, 2Н, карб., J=8); 8,06 (дд, 2Н, карб., J=8, J=2); 9,01 (д, 2Н, карб., J=2).
Стадия 3. 2-(3,6-Бис(4,4,4-трифтор-3-оксобутаноил)-9Н-карбазол-9-ил)уксусная кислота (а).
К раствору 0,65 ммоль 6-(3,6-диацетил-9Н-карбазол-9-ил)уксусной кислоты, в 8 мл сухого ДМФА при комнатной температуре добавляют 3,23 ммоль гидрида лития и перемешивают 5 минут. Затем прикапывают 1,62 ммоля метилтрифторацетата и перемешивают смесь в течение 20 часов при комнатной температуре. Реакционную массу выливают в 50 мл 5% соляной кислоты и экстрагируют этилацетатом (2×20 мл). Промывают органический слой насыщенным раствором NaCl (2×10 мл), сушат сульфатом натрия и упаривают летучие примеси при пониженном давлении. Продукт перекристаллизовывают из 75 мл хлороформа и получают тетракетон а желтого цвета с Тпл=263-268°С (разл.). Выход целевого продукта 0,48 ммоль (74%).
1Н-ЯМР: 5,38 (с, 2Н, СН2); 7,15 (с, 2Н, =СН); 7,89 (д, 2Н, карб., J=8 Гц); 8,22 (дд, 2Н, карб., J=8 Гц, J=2 Гц); 9,24 (д, 2Н, карб., J=2 Гц).
19F-ЯМР: -74,57 (с, 6F, 2CF3).
Пример 2 (две стадии).
6-(3,6-Бис(3,3,3-трифтор-3-оксобутаноил)-9Н-карбазол-9-ил)гексановой кислоты(б).
Стадия 1. Синтез 6-(3,6-диацетил-9Н-карбазол-9-ил)гексановой кислоты.
К смеси 0,79 ммоль 3,6-диацетилкарбазола, синтезированного по аналогии с примером 1, и 1,69 ммоль 6-бромгексановой кислоты в 30 мл сухого диоксана добавляют 3 ммоль гидрида натрия (60%) и кипятят смесь 2 суток. После охлаждения до комнатной температуры смесь выливают в 100 мл 2% соляной кислоты со льдом (20 гр). Фильтруют выпавший осадок, промывают водой (2×50 мл). Сушат над Р2О5 в эксикаторе и перекристаллизовывают из 18 мл этилацетата. Тпл=122-123°С. Выход светло-бежевого порошка 6-(3,6-диацетил-9Н-карбазол-9-ил)гексановой кислоты 0,36 ммоль (45%).
1Н-ЯМР: 1,25 (м, 2Н, СН2); 1,44 (м, 2Н, СН2); 1,75 (м, 2Н, СН2); 2,12 (м, 2Н, СН2); 2,69 (с, 6Н, 2СН3); 4,44 (м, 2Н, СН2); 7,69 (д, 2Н, карб., J=8); 8,05 (дд, 2Н, карб., J=8, J=2); 9,01 (д, 2Н, карб., J=2).
Стадия 2. Синтез 6-(3,6-бис(3,3,3-трифтор-3-оксобутаноил)-9Н-карбазол-9-ил)гексановой кислоты (б).
К охлажденной до 5°С суспензии 6,3 ммоль гидрида лития в 30 мл сухого 1,4-диоксане прикапывают 2,7 ммоль метилтрифторацетата и добавляют 1,1 ммоль 6-(3,6-диацетил-9Н-карбазол-9-ил)гексановой кислоты в 10 мл сухого 1,4-диоксана. Затем полученную смесь выдерживают при температуре 80°С 96 ч. Охлажденную до к.т. реакционую массу выливают в смесь льда и 4% серной кислоты. Водный слой экстрагируют хлороформом (3×15 мл), промывают дистиллированной водой (2×10 мл), сушат сульфатом натрия и упаривают при пониженном давлении насухо. После остаток растворяют в 8 мл хлороформа и высаживают 15 мл гептана и получают тетракетон б желтого цвета с Тпл=108-112°С. Выход целевого продукта 0,47 ммоль (43%).
1Н-ЯМР: 1,25 (м, 2Н, СН2); 1,44 (м, 2Н, СН2); 1,75 (м, 2Н, СН2); 2,12 (м, 2Н, СН2); 2,69 (с, 6Н, 2СН3); 4,48 (м, 2Н, СН2); 7,13 (с, 2Н, =СН); 7,76 (д, 2Н, карб., J=8 Гц); 8,20 (дд, 2Н, карб., J=8 Гц, J=2 Гц); 9,18 (д, 2Н, карб., J=2 Гц).
19F-ЯМР: -74.55 (с, 6F, 2CF3).
Пример 3 (две стадии).
6-(3,6-бис(6,6,6,5,5,4,4-гептафтор-3-оксогексаноил)-9Н-карбазол-9-ил)гексановой кислоты (в).
Стадия 1. Синтез 6-(3,6-диацетил-9Н-карбазол-9-ил)гексановой кислоты.
К раствору 1,99 ммоль диацетилкарбазола, синтезированного по аналогии с примером 1, в 12 мл сухого ДМСО добавляют 6,97 ммоль измельченного гидроксида натрия и перемешивают 30 минут при 60°С. Затем порциями вносят 2,39 ммоля 6-бромгексановую кислоту и перемешивают 18 часов при той же температуре. Полученную смесь выливают в 150 мл 2% раствор гидроксида калия. Фильтруют от 0,29 ммоль непрореагировавшего исходного карбазола. Затем подкисляют фильтрат 3% соляной кислотой до рН 2. Фильтруют выпавший продукт. Перекристаллизовывают из 19 мл этилацетата. Тпл=122-123°С. Выход продукта 0,39 ммоль (70%).
1Н-ЯМР: 1,25 (м, 2Н, СН2); 1,44 (м, 2Н, СН2); 1,75 (м, 2Н, СН2); 2,12 (м, 2Н, СН2); 2,69 (с, 6Н, 2СН3); 4,44 (м, 2Н, СН2); 7,69 (д, 2Н, карб., J=8); 8,05 (дд, 2Н, карб., J=8, J=2); 9,01 (д, 2Н, карб., J=2).
Стадия 2. Синтез 6-(3,6-бис(6,6,6,5,5,4,4-гептафтор-3-оксогексаноил)-9Н-карбазол-9-ил)гексановой кислоты (в).
К охлажденной до 5°С суспензии 11,3 ммоль гидрида лития в 30 мл сухого 1,4-диоксане прикапывают 5,5 ммоль метилперфторбутаноата и добавляют 1,1 ммоль 6-(3,6-диацетил-9Н-карбазол-9-ил)гексановой кислоты в 10 мл сухого 1,4-диоксана. Затем полученную смесь кипятят 84 ч. Охлажденную до к.т. реакционную массу выливают в смесь льда и 4% серной кислоты. Водный слой экстрагируют хлороформом (3×15 мл), промывают дистиллированной водой (2×10 мл), сушат сульфатом натрия и упаривают при пониженном давлении насухо до объема смеси 15 мл. Добавляют 5 мл гептана и кристаллизуют при -20°С Полученные мелкие кристаллы отфильтровывают, фильтрат упаривают при пониженном давлении и получают тетракетон в в виде порошка желто-зеленого цвета с Тпл=110-114°С. Выход целевого продукта в 0,39 ммоль (36%).
1H-ЯМР: 1,25 (м, 2Н, СН2); 1,44 (м, 2Н, СН2); 1,75 (м, 2Н, СН2); 2,12 (м, 2Н, СН2); 2,69 (с, 6Н, 2СН3); 4,43 (м, 2Н, СН2); 7,15 (с, 2Н, =СН); 7,79 (д, 2Н, карб., J=8 Гц); 8,22 (дд, 2Н, карб., J=8 Гц, J=2 Гц); 9,21 (д, 2Н, карб., J=2 Гц).
19F-ЯМР: -83,4 (с, 6F, CF3, J=12,0); -127,1 (м, 4F, CF2); -129,4 (м, 4F, CF2),
Пример 4
Синтез 6-(3,6-бис(7,7,7,6,6,5,5,4,4-нонафтор-3-оксогептаноил)-9Н-карбазол-9-ил)гексановой кислоты (г).
К охлажденной до 5°С 11,3 ммоль суспензии гидрида лития в 30 мл сухого 1,4-диоксана прикапывают 5,5 ммоль метилперфторпентаноата и добавляют 1,1 ммоль 6-(3,6-диацетил-9Н-карбазол-9-ил)гексановой кислоты (полученного по аналогии с примером 2, стадия 1) в 10 мл сухого 1,4-диоксана. Затем полученную смесь кипятят 72 ч. Охлажденную до к.т. реакционную смесь выливают в смесь льда и 4% серной кислоты, экстрагируют хлороформом (3×20 мл), промывают дистиллированной водой (2×10 мл), сушат сульфатом натрия и упаривают при пониженном давлении насухо. Остаток растворяют в 30 мл хлороформа и кипятят с активированным углем в течении 1 часа. После фильтрования угля, половину объема хлороформа упаривают при пониженном давлении, продукт высаживают 20 мл гептана и получают тетракетон г зеленого цвета с Тразл=140-146°С. Выход целевого продукта г 0,64 ммоль (58%).
1Н-ЯМР: 1,25 (м, 2Н, СН2); 1,44 (м, 2Н, СН2); 1,75 (м, 2Н, СН2); 2,12 (м, 2Н, СН2); 2,69 (с, 6Н, 2СН3); 4,44 (м, 2Н, СН2); 7,14 (с, 2Н, =СН); 7,80 (д, 2Н, карб., J=8 Гц); 8,24 (дд, 2Н, карб., J=8 Гц, J=2 Гц); 9,19 (д, 2Н, карб., J=2 Гц).
19F-ЯМР: -82,2 (т, 6F, CF3, J=6.0); -121,3 (м, 4F, CF2); -124,3 (м, 4F, CF2); -127,0 (м, 4F, CF2).
Пример 5
Люминесцентно-спектральные свойства хелатов заявляемых соединений с Eu3+.
Регистрацию спектрально-люминесцентных характеристик комплексов осуществляли в диапазоне длин волн 300-800 нм на микропланшетном ридере Varioscan Flash фирмы Thermofisher Scientific. Соответствующие результаты приведены в табл. 1.
Все характеристики получены в водных растворах - бидистиллированной воде (БДВ), либо в мицелярно-буферном растворе, состоящим из 0,1% Тритона Х-100 и 0,05 М Трис-буфера рН 7,8. Приведены результаты, полученные от комплексов лиганд - Eu3+-ТОФО стехиометрического состава 3:2:6 (концентрация европия 3,3×10-6 М). Для комплекса сравнения с известным реагентом иммунофлуоресцентного анализа нафтоилтрифторацетоном состав лиганд - Eu3+-ТОФО 3:1:3.
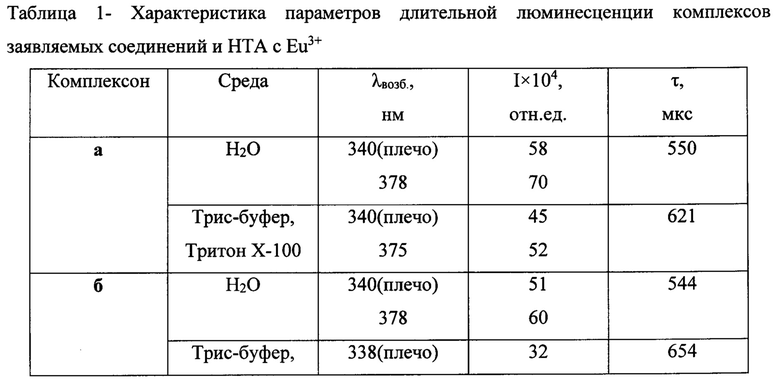
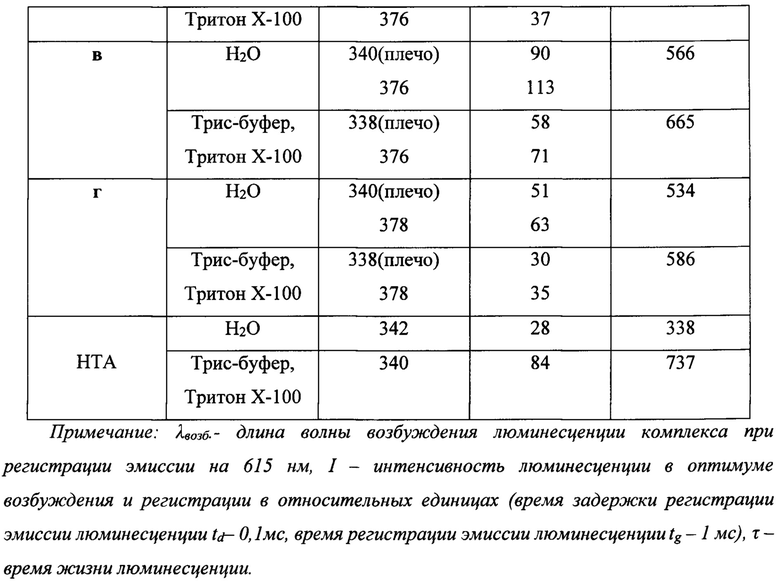
Из данных, приведенных в таблице 1, следует, что заявляемые соединения образуют интенсивно и длительно люминесцирующие комплексы с Eu3+, превосходящие по своей интенсивности НТА. При этом использование мицеллярных растворов увеличивает время жизни люминесцентного состояния, но наличие гидрофильной карбоксильной группы на конце спейсера дестабилизирует комплекс внутри гидрофобной мицеллы. Подобный эффект отсутствует у N-незамещенного карбазола (Пат. РФ 2296756 и [Пугачев, Д.Е.; Кострюкова, Т.С.; Затонский, Г.В.; Вацадзе С.З.; Васильев, Н.В. ХГС, 2018, 54 (5), 528.]). Все полученные соединения а-г имеют максимумы полосы возбуждения, расположенные в области свыше 360 нм.
Пример 6
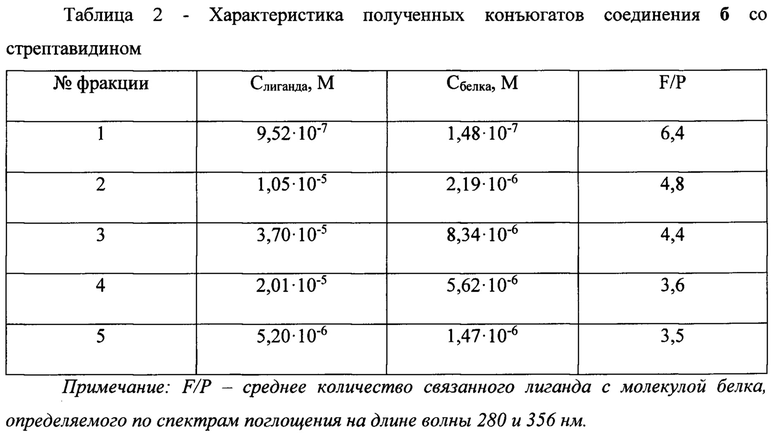
Коньюгация соединения б со стрептавидином.
Для активации карбоксильной группы лиганда:
К 6⋅10-3 М раствору соединения 6 в 875 мкл ДМФА прибавляют раствор 0,4 М 1-гидроксибензотриазола в 13,25 мкл ДМФА и 0,2 М дициклогексилкарбодиимида в 26,5 мкл ДМФА. Перемешивают в течении 15 минут. Затем вносят 0,2 М N-гидроксисукцинимида в 26,5 мкл ДМФА, после чего продолжают перемешивание 19 часов при комнатной температуре (20°С).
Для конъюгации со стрептавидином к 436 мкл белка с концентрацией 1,554 мг/мл в 0,05 М фосфатном буфере рН 8,0 прибавляют 41 мкл активированного лиганда. Перемешивают 3,5 ч при комнатной температуре. Очищают полученный конъюгат гель-фильтрацией на колонке, содержащей сефадекс G25, со скоростью 14 мл/ч, элюент 0,05 М Трис-буфер рН 7,75. Объем собираемых фракций 0,5 мл. Фиг 6.
Пример 7
Допирование наносиликатных частиц на основе «Аэросила 380».
10 Мл водной дисперсии «Аэросила 380» 0,2%, предварительно дезагрегировали в ультразвуке (4 ч. 37 кГц, мощность генератора 30 Вт), доводили объем до 1 л, при комнатной температуре и перемешивании медленно вводили 1 мл предварительно подготовленного раствора в ДМФА комплекса Eu3+ с тетракетоном а в присутствии синергиста люминесценции триоктилфосфиноксида (ТОФО) (CEu3+: Са: СТОФО; 1,6*10-2:2,4*10-2: 4,8*10-2 моль/л). Образованная дисперсия подвергалась диализной очистке, циклами (3-4 цикла) длительностью от 5 до 15 ч каждый. Процедуру осуществляли в диализных трубках (cellulose tubular membrane, CelluSep 4, MWCO 12000-14000 г/моль, ширина трубки 30 мм) против 1,5 л дистиллированной воды. Объем диализуемой дисперсии 5-10 мл. Величины люминесценции полученной дисперсии сравнимы с люминесценцией независимо приготовленного комплекса, однако устойчивость люминесценции существенно выше. Спектры возбуждения и эмиссии дисперсии приведены на фиг. 7.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКСООБРАЗУЮЩИЕ ДИБЕНЗОСОДЕРЖАЩИЕ ПЯТИЧЛЕННЫЕ ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ДВА СИММЕТРИЧНЫХ БЕТА-ДИКАРБОНИЛЬНЫХ ЗАМЕСТИТЕЛЯ С ФТОРИРОВАННЫМИ РАДИКАЛАМИ | 2005 |
|
RU2296756C2 |
| КОМПЛЕКСЫ ТЕХНЕЦИЯ И РЕНИЯ С БИС(ГЕТЕРОАРИЛАМИ) И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2539584C2 |
| СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ 3-АМИНОЗАМЕЩЕННЫЕ 6-(3,5-ДИМЕТИЛПИРАЗОЛ-1-ИЛ)-1,2,4,5-ТЕТРАЗИНЫ | 2012 |
|
RU2519218C2 |
| Способ получения ω-(бис(пиридин-2-илметил)амино)алифатических кислот - прекурсоров с хелатными центрами для связывания металлов | 2016 |
|
RU2616974C1 |
| Димерные соли пиридиния, содержащие фурановый фрагмент, обладающие биоцидным действием, способ получения, применение | 2024 |
|
RU2834421C1 |
| Четвертичные аммониевые соединения на основе производных пентаэритрита и пиридоксина, обладающие антибактериальной активностью | 2023 |
|
RU2811203C1 |
| Новые производные гелиомицина и фармацевтические композиции на их основе, ингибирующие опухолевый рост | 2018 |
|
RU2670763C1 |
| НОВЫЕ СУБСТРАТЫ КОНЦЕВОЙ ДЕЗОКСИНУКЛЕОТИДИЛТРАНСФЕРАЗЫ | 2003 |
|
RU2278869C2 |
| НОВЫЕ ФТОРАЛКИЛЗАМЕЩЕННЫЕ ЦИКЛОТРИСИЛОКСАНЫ, ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ ПОЛУЧЕНИЯ НОВЫХ ПОЛИМЕРОВ И НОВЫЕ ПОЛИМЕРЫ | 2000 |
|
RU2230747C2 |
| ДИМЕРНЫЕ ДИПЕПТИДНЫЕ МИМЕТИКИ НЕЙРОТРОФИНА-3 | 2022 |
|
RU2800369C1 |
Изобретение относится области люминесцентного анализа, в частности для медицинской диагностики биологических соединений и структур. Предложены соединения, представляющие собой хелатообразующие карбазолы общей формулы 1, имеющие два симметричных фторсодержащих β-дикарбонильных заместителя в положениях 3 и 6, а также N-карбоксилсодержащий спейсер. Соединения обладают хорошей хелатообразующей способностью в отношении ионов редкоземельных элементов, в частности европия, и образуют с ним интенсивные длительно люминесцирующие комплексы, возбуждаемые светом с длинной волны 375 нм. Через карбоксилсодержащий спейсер можно осуществлять прямую конъюгацию с биомолекулами, благодаря чему соединения могут быть использованы в качестве маркеров молекулярного типа или в виде нанодисперсий в различных вариантах анализа на основе биоспецифических взаимодействий. Детектирование комплексов возможно как на твердой, так и в жидкой фазе. 7 ил., 2 табл., 7 пр.
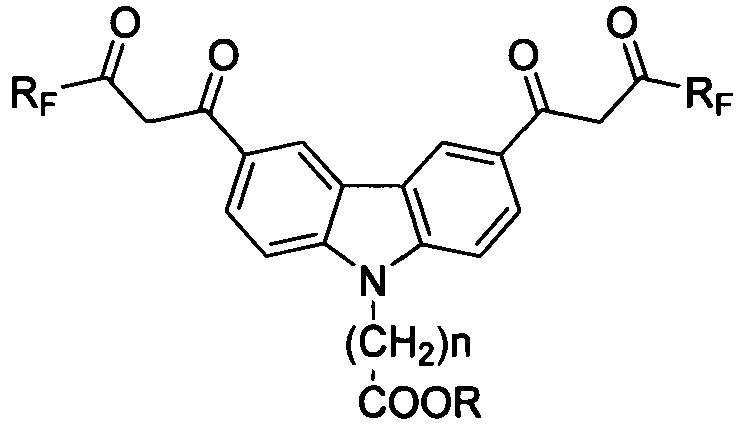
RF: (CF2)nCF3, где n=0-3;
R: Н, n=1-6.
Соединения ряда карбазола, имеющие два симметричных фторсодержащих β-дикарбонильных заместителя в положениях 3 и 6, а также N-карбоксилсодержащий спейсер, для использования в качестве комплексообразующих соединений маркеров иммунофлуоресцентного анализа, общей формулы 1
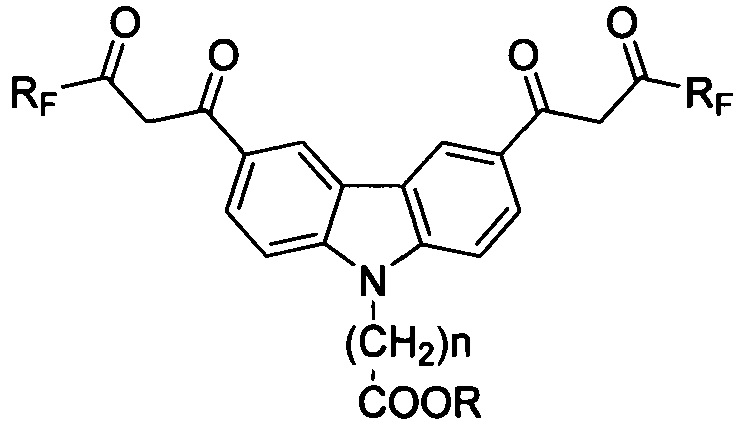
где RF: (CF2)nCF3, где n=0-3;
где R: Н, n=1-6.
| КОМПЛЕКСООБРАЗУЮЩИЕ ДИБЕНЗОСОДЕРЖАЩИЕ ПЯТИЧЛЕННЫЕ ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ДВА СИММЕТРИЧНЫХ БЕТА-ДИКАРБОНИЛЬНЫХ ЗАМЕСТИТЕЛЯ С ФТОРИРОВАННЫМИ РАДИКАЛАМИ | 2005 |
|
RU2296756C2 |
| Пугачев Д.Е | |||
| и др | |||
| "Фторированные тетракетоны ряда N-замещенных карбазолов и их комплексы с европием (III) для иммунофлуоресцентного медико-биологического анализа", Химия гетероциклических соединений, 2018, 54(5), 528-534. | |||
Авторы
Даты
2019-12-17—Публикация
2019-08-29—Подача