Изобретение относится к онкологической медицине, в частности к тестировнию злокачественного процесса, высоко-устойчивые клетки которого, могут быть обнаружены с помощью физического анализа биологических материалов, что может быть использовано для прогнозирования повышенной множественной устойчивости раковых клеток in vivo, при его тестировании in vitro.
Несмотря на серьезные и разносторонние исследования последних лет в области онкологии остается много нерешенных проблем, которые связаны в первую очередь с тем, что радиационная и химиотерапия во многих случаях остается малоэффективной. Главным фактором, ограничивающим успешность применения противораковых средств, является высокая устойчивость части опухолевых клеток к различным повреждениям, часто формирующаяся в условиях гипоксии. Такая устойчивость может быть: первичной и, следовательно, свойством злокачественных клеток до начала лечения; или вторичной, которая развивается в ответ на радиационное облучение и/или введение лекарств.
Обычно в начале лечения наблюдается положительная динамика, но через некоторое время она исчезает. Высокая изменчивость опухолевых клеток и постоянно действующий отбор клеток с большей выживаемостью и злокачественностью приводит к тому, что первоначально с помощью лечения удается уменьшить размер опухоли за счет гибели опухолевых клеток с низкой устойчивостью. Оставшаяся субпопуляция клеток приобретает повышенную способность к выживанию в неблагоприятных условиях и становится резистентной сразу к радиационному облучению и к целой группе лекарств, то есть развивается так называемая множественная устойчивость, сопровождающаяся часто рецидивом болезни и появлением метастазов. Одним из направлений своевременного выявления таких опухолей является поиск новых, специфических индикаторов, свойственных высоко-устойчивым опухолевым клеткам, а также разработка методов их быстрого определения in vitro с помощью как уже известных, так и новых опухолевых маркеров.
Обычно опухолевыми маркерами называют соединения (белки, биологически активные пептиды, гормоны, ферменты и метаболиты), которые синтезируются раковыми клетками и отсутствуют в нормальных клетках. Большинство известных опухолевых маркеров относятся к онкофетальным белкам, которые обнаруживаются в эмбриональных тканях человека и крови в период внутриутробного развития. Они исчезают полностью или остаются в следовых количествах после рождения. В ходе опухолевой прогрессии они начинают синтезироваться снова и секретируются в кровь. Однако конкретные онко-фетальные соединения синтезируются лишь в определенных эмбриональных и опухолевых тканях. Например, альфа-фетопротеин является нормальным сывороточным белком зародыша и синтезируется в печени плода, а также при развитии рака печени. В качестве онко-фетальных маркеров часто используют белки плаценты (хорионический гонадотропин или плацентарную щелочную фосфатазу). Иммуногистохимическое обнаружение таких белков служит хорошим онкологическим маркеров рака яичников или семенников, что позволяет следить за ходом их лечения. Для рака предстательной железы в качестве чувствительного онкомаркера используется простато-специфический антиген PSA (от англ., prostate specific antigen). Однако на большом материале, полученном не только на экспериментальных животных, но и на человеке, показано, что подавляющее большинство онко-фетальных биомаркеров является ткане-специфическими. Более того, эти онкомаркеры часто не определяются на ранней стадии болезни и могут индуцироваться также при воспалительных заболеваниях печени, поджелудочной железы и легких. Кроме того, известно, что онко-фетальные маркеры существуют не для всех солидных опухолей.
Хотя в процессе злокачественной трансформации нарушаются некоторые механизмы, контролирующие рост и дифференцировку тканей, но ряд опухолей все же не ускользает полностью из-под регуляторного влияния организма, сохраняя рецепторы гормонов и нейромедиаторов на поверхности или внутри клеток. К ним, в частности, относятся опухоли, происходящие из гормонозависимых тканей: молочной железы, матки, яичников, гипофиза, надпочечников, щитовидной и предстательной желез. Более половины опухолей молочной железы, яичников и эндометрия содержат рецепторы эстрогенов и прогестерона, которые служат онкомаркерами гормоно-чувствительных опухолей. Опухоли, не содержащие рецепторов, малочувствительны к гормонотерапии, поэтому определение уровня рецепторов эстрогенов и прогестинов широко используют для прогнозирования эффективности гормонотерапии при опухолях молочной железы, яичников и матки. Однако эти опухолевые маркеры не позволяют тестировать повышенную устойчивость раковых клеток к повреждающему действию химиотерапии или радиации.
Существуют разные механизмы возникновения множественной устойчивости опухолевых клеток, среди которых множественная лекарственная устойчивость является наиболее изученной. Такая устойчивость обычно тестируется по снижению накопления противо-опухолевых препаратов внутри клеток или по высокому уровню экспрессии АТФ-зависимого трансмембранного Р-гликопротеина, способного эффективно откачивать различные противоопухолевые препараты или красители из устойчивых, опухолевых клеток, таким путем повышая их выживаемость. Важно отметить, что Р-гликопротеин выявляется не только в опухолевых, но и в нормальных тканях, в частности в почках, печени, гемато-энцефалическом барьере. Уровень экспрессии Р-гликопротеин может также повышаться и при воспалении [Но Е., et al. Regulation of MDR by pro-inflammatory cytokines. "Curr. Cancer Drug Targets", 2006, 5(4), 295-301]. Более того, эффективность работы Р-гликопротеина тесно зависит от уровня образования АТФ в митохондриях [Zhou Y., et al. Intracellular ATP levels are a pivotal determinant of chemoresistance in colon cancer cell. "Cancer Res.", 2012, 72(1), 304-314]. Для опухолевых митохондрий характерно снижение уровня образования АТР, особенно в условиях гипоксии, что ограничивает работу Р-гликопротеина. Однако такие клетки при неблагоприятных условиях часто сохраняют высокую выживаемость, что достигается благодаря активации альтернативных путей метаболизм, в частности активации аэробного гликолиза, а также работы пентозофосфатного пути, интенсивно продуцирующего восстановленный NAD(P)H [никотинамиддинуклеотидфосфат].
Исследования последних лет убедительно показали, что устойчивые опухолевые клетки для своего выживания в условиях гипоксии и окислительного стресса, нуждаются в постоянном образовании NAD(P)H. [Tamada М., et al. Modulation of glucose metabolism by CD44 contributes to antioxidant status and drug resistance in cancer cells. Cancer Res." 2012, 72(6), 1438-1448]. NAD(P)H участвует в активации ключевой анти-оксидантной защиты опухолевых клеток, активируя ферменты, поддерживающие синтез глутатиона [Gruning N-M & Raiser М. Sacrifice for survival "Nature", 2011, 480:190-191; Hamanaka R & Chandel N. Warburg effect and redox balance. "Science", 2011, 334: 1219-1220]. Однако NAD(P)H нельзя отнести к числу классических опухолевых маркеров, так как он синтезируется и в нормальных клетках. Тем не менее показатели эндогенной флуоресценции NAD(P)H/NADH in vitro можно использовать при прогнозировании процессов метастазирования in vivo [Xu H.N., Nioka S., Clickon J.D., Chance В., Li L.Z. Quantitative mitochondrial redox imaging of breast cancer metastatic potential. "J Biomedical. Optics", 2010, 15 (3): 136010].
Техническая задача, на решение которой направлено предлагаемое изобретение, состоит в обеспечении возможности тестировать наличие злокачественных клеток и степень их устойчивости к повреждениям (степень злокачественности), проводя измерения на живых клетках без их окрашивания.
Поставленная задача решена тем, что предложен экспресс-способ определения риска злокачественности клеток, заключающийся в том, что из образца биопсии, полученной от субъекта, готовят клеточный отпечаток или суспензию клеток, в котором создают условия гипоксии, подвергают повторяющимся воздействиям повреждающего агента, выбранного из УФ-света, проводят спектро-флурометрическое исследование образца после повторяющегося воздействия УФ-светом, и в случае, если в темновых условиях обнаружен прирост интенсивности флуоресценции NAD(P)H, диагностируют клетки как злокачественные.
В качестве повреждающего агента можно использовать в частности УФ-свет, или иной агент, например химический или фармакологический.
Способность к более продолжительному выживанию злокачественных клеток в условиях гипоксии и повторяющихся повреждений (повышенную устойчивость) оценивают по неоднократно повторяющейся репарации пула NAD(P)H, характерной только для опухолевых клеток. Репарацию пула NAD(P)H в условиях гипоксии оценивают по приросту интенсивности NAD(P)H флуоресценции после кратковременного выдерживания исследуемого образца клеток в темновых условиях, нахождение в которых следует за повторяющимися повреждениями (в частности УФ-светом), и по количеству циклов репарации NAD(P)H флуоресценции и величине их прироста в каждом цикле оценивают in vitro потенциальную устойчивость различных опухолевых клеток. Это позволяет выявить высоко-устойчивые раковые клетки как показатели негативного опухолевого прогноза in vivo для той опухоли, из которой взят исследуемый образец.
Предлагаемый способ экспресс-определения злокачественности является неспецифическим и позволяет в течение нескольких минут выявить злокачественные клетки и установить степень их устойчивости для всех типов рака, как асцитных, так и солидных.
Предложенный способ экспресс-определения степени злокачественности и устойчивости раковых клеток заключается в том, что из образца биопсии готовят клеточный отпечаток или суспензию клеток, которым создают условия гипоксии и повторяющееся воздействие повреждающего агента, например УФ-света, и проводят спектро-флурометрическое исследование этих клеток в динамике развития процесса фотодеструкции NAD(P)H флуоресценции, и по приросту интенсивности флуоресценции NAD(P)H в темновых условиях, судят о наличии опухолевых клеток и их потенциальной устойчивости.
Условия гипоксии могут быть созданы путем помещения суспензии клеток или клеточного отпечатка между двумя стеклами, края которых залиты парафином, для последующих цитологических исследований. Спектрофлурометрическое исследование может быть проведено в диапазоне 440-470 нм, при длине волны возбуждения 365-370 нм.
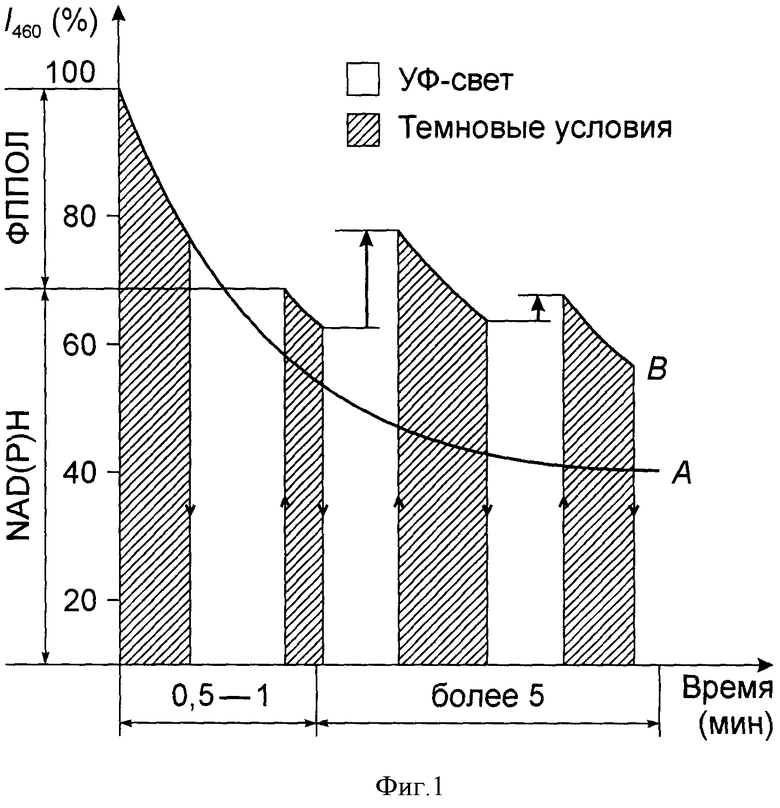
Сущность изобретения заключается в том, что экспериментальным путем были установлены принципиальные различия в потенциальной устойчивости опухолевых и нормальных клеток к выживанию в условиях действия гипоксии и УФ-света. При этом выживание клеток оценивали, в частности, по изменению интенсивности NAD(P)H флуоресценции и способности, присущей только раковым клеткам, частично восстанавливать пул NAD(P)H в темновых условиях. Сущность изобретения поясняется графическими материалами, где на фиг. 1 показана типичная кривая изменения суммарной интенсивности флуоресценции при λ=460 nm (I460), характерная для перевиваемых опухолевых клеток асцитной карциномы Эрлиха (АКЭ), находящихся в условиях гипоксии при действии на них УФ-света (заштрихованные участки) и в темновых условиях (после выключения УФ-света; не заштрихованные участки). Суммарная интенсивность эндогенной флуоресценции живых клеток (в полосе 440-470 nm) обусловлена флуоресценцией двух основных флуоресцентных компонентов: 1) флуоресцирующими продуктами перекисного окисления липидов (ФППОЛ), которые высокочувствительны к УФ-индуцируемой фотодеструкции [после 0,5-1 мин действия УФ-света (λ-365 nm), флуоресценция от ФППОЛ не обнаруживается] и 2) пулом восстановленных NAD(P)H, интенсивность флуоресценции которых достигает максимальна в условиях гипоксии. Доля каждого из этих компонентов (в процентах) в общей полосе флуоресценции (с максимумом I460), характерная для большинства опухолевых АКЭ клеток, указана на шкале ординат.
А - кинетика фотодеструкции флуоресценции (I460) опухолевых АКЭ клеток, при постоянном действии УФ-света (λ-365 nm)
В - репарация пула NAD(P)H, измеряемая по приросту интенсивности NAD(P)H-флуоресценции после нахождения гипоксических опухолевых АКЭ клеток в темновых условиях [т.е. без повреждающего действия УФ-света (λ-365 nm)]. Величина прироста I460 (в процентах) после каждого цикла восстановления NAD(P)H флуоресценции, обозначена величиной стрелок, направленных вверх.
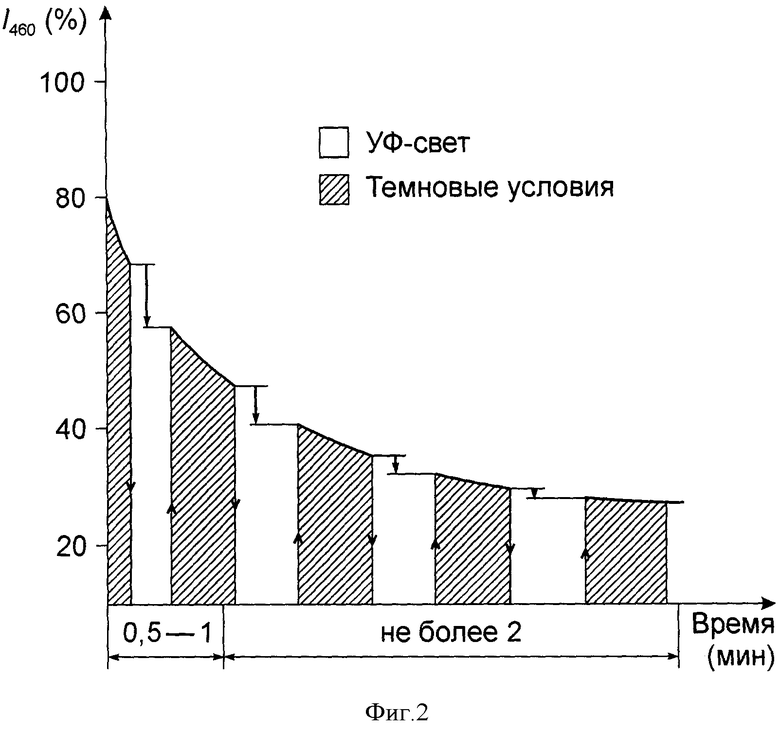
На фиг.2 показаны кинетические особенности I460 фотодеструкции лимфоцитов, выделенных из лимфоузла здоровых животных и помещенных в условия гипоксии. Для нормальных лимфоцитов характерна, перманентная фотодеструкция флуоресценции (при I460), которая наблюдалась, как при действии УФ-света (λ-365 nm) (заштрихованные участки), так и в темновых условиях (при выключении УФ-света; не заштрихованные участки). Величина I460 фотодеструкции обозначена величиной стрелок, направленных вниз, что указывает на низкую устойчивость нормальных лимфоидных клеток к выживанию в условиях гипоксии. Противоположный эффект характерен для опухолевых АКЭ клеток (фиг.1), обладающих повышенной потенциальной устойчивостью в аналогичных условиях гипоксии. Обнаруженные различия между поведением (а именно выживанием) опухолевых и нормальных клеток в условиях повреждения могут быть использованы in vitro как индикатор злокачественности, с помощью которого можно идентифицировать единичные опухолевые клетки, а также прогнозировать их выживаемость in vivo в гипоксических зонах опухоли.
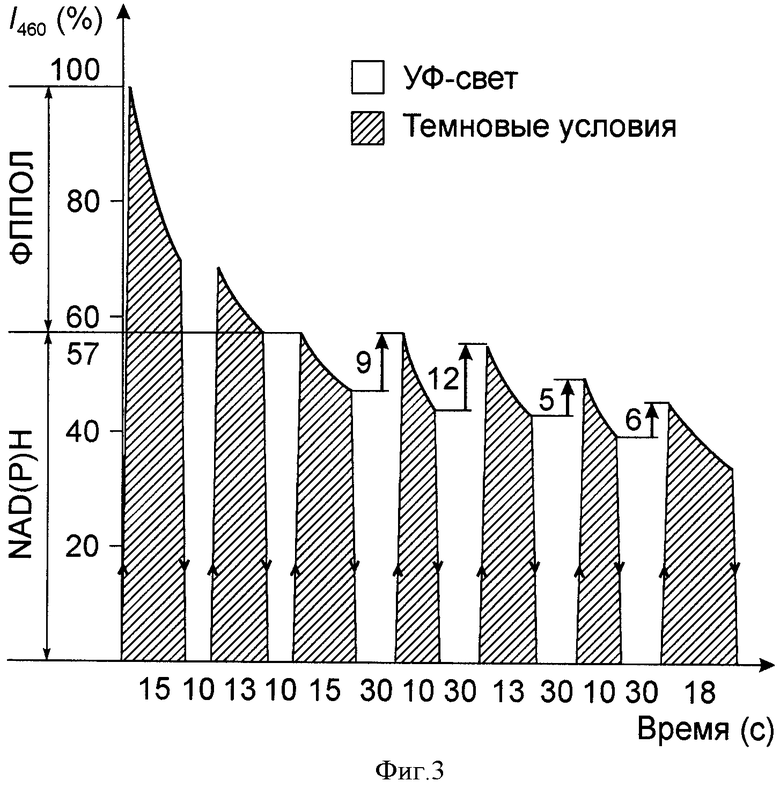
На фиг.3 аналогичные исследования представлены для другого типа высокоагрессивных опухолевых клеток - асцитной гепатомы Зайделя (АГЗ) [изучались АГЗ клетки, находящиеся в асцитной жидкости и при их метастазировании в селезенку, а также нормальные спленоциты, окружающие метастаз (фиг.4)]. Асцитные АГЗ клетки, а также АГЗ клетки метастаза (Фиг.3) отличались высокой потенциальной устойчивостью к повреждающему действию гипоксии и УФ-света, так как они были способны в 3-5-кратному восстановлению пула NAD(P)H, оцениваемому по приросту интенсивности I460 [величина прироста обозначена цифрами (в %) и отмечена стрелками, направленными вверх]. Время действия УФ-света на АГЗ клетки и их нахождение в темновых условиях обозначено в секундах на шкале абсцисс.
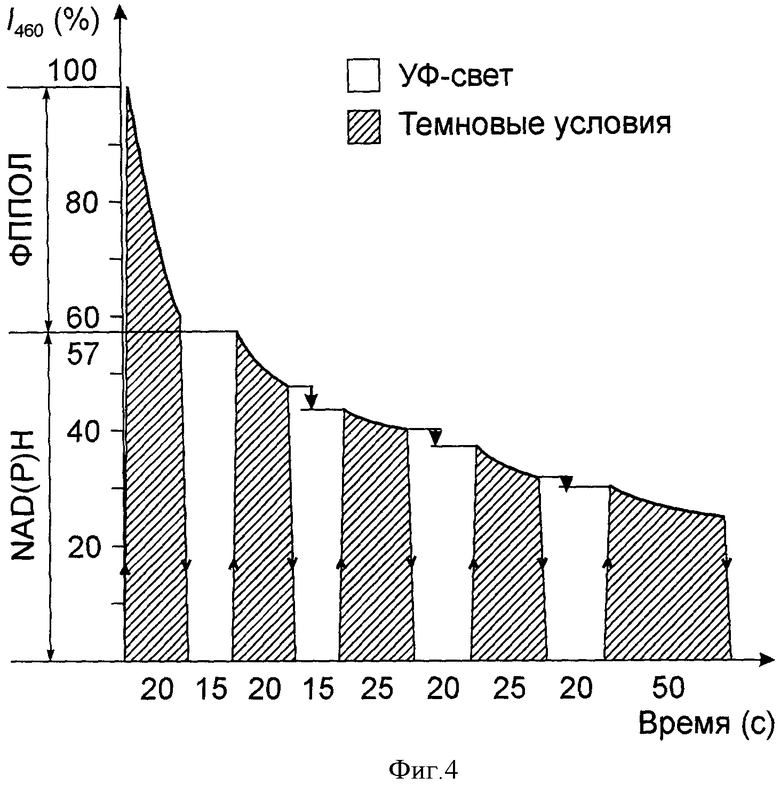
на фиг.4 - представлены аналогичные спектро-флуоресцентные исследования клеток от тканевого отпечатка селезенки опухоленосителя (фиг.3), проведены в условиях гипоксии для спленоцитов т.е. нетрансформированных клеток селезенки, окружающих клетки АГЗ метастаза. Такие спленоциты характеризовались низкой потенциальной устойчивостью к повреждающему действию УФ-света, так как для них была характерна перманентная фотодеструкции флуоресценции NAD(P)H при λ=460 нм (I460), выявляемая (в %) как при действии УФ-света, так и в него отсутствии.
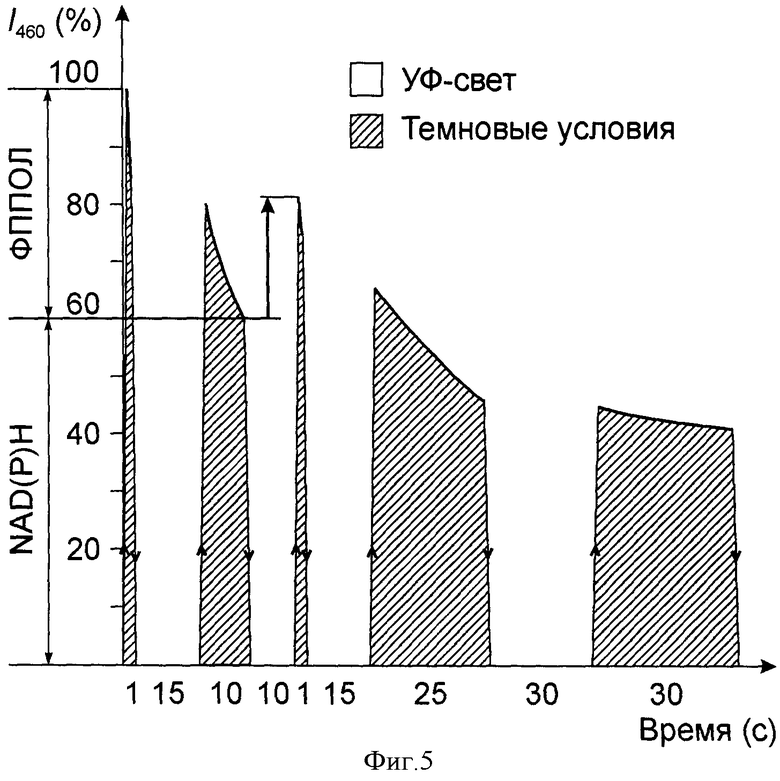
на фиг.5 представлены результаты спектро-флуоресцентных исследований клеток [из биопсии подмышечного лимфатического узла пациентки (46 лет)], которые были диагностированы как раковые. В условиях гипоксии, эти клетки проявляли способность восстанавливать NAD(P)H флуоресценцию в темновых условиях [при выключении УФ-света (не заштрихованные участки)], которая измерялось по приросту I460 (в %). Величина прироста I460 обозначена стрелкой, направленной вверх. Количество циклов NAD(P)H флуоресценции в таких клетках было невелико (всего 2 цикла), однако прирост интенсивности NAD(P)H флуоресценции в первом цикле был весьма значительным, что указывало на повышенную устойчивость клеток этого метастаза к выживанию в неблагоприятных условиях in vivo.
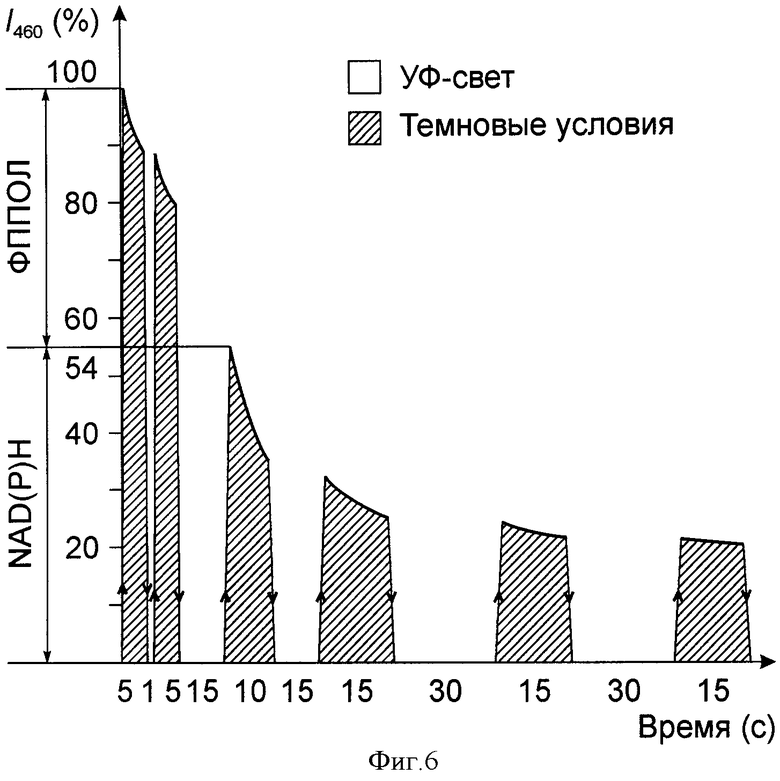
на фиг.6 представлены результаты спектро-флуоресцентных исследования той же суспензии клеток (из биопсийного материала пациентки), которые были диагностированы как не трансформированные. Для этих клеток была характерна перманентная УФ-индуцируемая фотодеструкция I460, как при действии УФ-света (заштрихованные участки), так и в отсутствие УФ-света (не заштрихованные участки). Для этих клеток также была типично увеличение содержания ФППОЛ (в %) и снижение доли базальной NAD(P)H флуоресценции (I460, шкала ординат).
Сущность изобретения поясняется также примером конкретного осуществления.
ПРИМЕР.
У больной К. (46 лет), с подозрением на развитие процессов метастазирования рака молочной железы в близлежащий лимфоузел, был взят биопсийный материал (в виде клеточной суспензии) для цитологического и гистологического исследования. Часть изъятого биопсийного образца была помещена во влажную, охлаждаемую камеру, с целью сохранения клеток во время их транспортировки в лабораторию. Выявление злокачественности и устойчивости клеток было проведено через 1,5 часа после изъятия клеточного материала. С этой целью исследуемую суспензию клеток помещали между предметным и покровными стеклами, края которых плотно запечатывали жидким парафином для создания условий гипоксии в изучаемых клетках. Далее на люминесцентном микроскопе МЛД-2, используя ртутную лампу сверхвысокого давления ДРШ-250-2 в качестве источника УФ-света (1-365 nm), проводили спектрофлуоресцентные исследования кинетики фотодеструкции I460 в анализируемых клетках, находящихся в условиях гипоксии при действии на них УФ-света и при его выключении (темновые условия). Проводили поиск клеток, которые обладали способностью к репарации интенсивности NAD(P)H флуоресценции (I460) в темновых условиях. Такие клетки диагностировались как злокачественные (раковые) [фиг.5, эффект указан стрелкой, направленной вверх]. Другие же клетки, для которых была характерна перманентная УФ-индуцируемая фотодеструкция, как при действии УФ-света, так и при отсутствии УФ-воздействия, диагностировались как не трансформированные (фиг.6). Полученные результаты представлены на фиг.5 и фиг. 6. Как видно из фиг.5 и фиг.6., в условиях сохраняющейся гипоксии, среди анализируемых клеток были обнаружены клетки (фиг.5), способные к приросту интенсивности NAD(P)H флуоресценции (I460) в темновых условиях, что позволяло идентифицировать их как злокачественные клетки. Эти клетки обнаруживали единичные циклы репарации NAD(P)H флуоресценции в темновых условиях (единичная стрелка вверх), что позволяло их идентифицировать как раковые клетки, хотя они и не обладали столь высокой потенциальной устойчивость к гипоксии как АГЗ клетки (Фиг.3). Весь процесс тестирования от момента создания условий гипоксии для исследуемых клеток до получения результатов анализа составил не более 5 минут.
Большинство анализируемых клеток в образце не проявляло способность к репарации NAD(P)H флуоресценции в темновых условиях (Фиг.6), что позволяло их отнести к не трансформированным клеткам.
Диагноз затем был подтвержден гистологически.
Таким образом, приведенные выше данные подтверждают возможность экспресс тестирования образцов (отпечатков или клеточных взвесей) на злокачественность и потенциальную устойчивость тестируемых опухолей к повреждающим воздействиям.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ РАКА И ПОТЕНЦИАЛЬНОЙ УСТОЙЧИВОСТИ ЗЛОКАЧЕСТВЕННЫХ КЛЕТОК К ГИПОКСИИ | 2011 |
|
RU2463963C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ АСЦИТНЫХ ОПУХОЛЕЙ | 2011 |
|
RU2464974C1 |
| КОМПЛЕКСЫ МЕТАЛЛ-ГЛИКОПРОТЕИН И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ХИМИОТЕРАПЕВТИЧЕСКИХ СОЕДИНЕНИЙ | 2016 |
|
RU2742981C2 |
| ЛЕЧЕНИЕ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО ИНГИБИТОРАМИ ATR | 2012 |
|
RU2648507C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА | 2016 |
|
RU2626600C1 |
| Способ ингибирования роста опухоли у млекопитающего | 2018 |
|
RU2713153C1 |
| Способ оптимизации лимфодиссекции при первично операбельном раке молочной железы | 2017 |
|
RU2691568C1 |
| Модифицированный фотосенсибилизатор на основе наночастиц селена и гидрофильного полимера | 2024 |
|
RU2835425C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ МЕТОДОМ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2006 |
|
RU2314806C1 |
| Тетра(пирен-1-ил)тетрацианопорфиразин как мультифункциональный агент терапии злокачественных новообразований | 2019 |
|
RU2725641C1 |
Изобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано для определения риска злокачественности клеток. Для этого из образца биопсии, полученного от субъекта, готовят клеточный отпечаток или суспензию клеток, создают условия гипоксии. Подвергают повторяющимся воздействиям повреждающего агента, выбранного из УФ-света. Проводят спектро-флурометрическое исследование образца после повторяющегося воздействия УФ-светом, и в случае, если в темповых условиях обнаружен прирост интенсивности флуоресценции NAD(P)H, диагностируют клетки как злокачественные. Изобретение обеспечивает выявить высоко-устойчивые раковые клетки как показатели негативного опухолевого прогноза in vivo для той опухоли, из которой взят исследуемый образец. Время выявления злокачественности и устойчивости опухолевых клеток составляет несколько минут. 6 ил., 1 пр.
Способ определения риска злокачественности клеток, заключающийся в том, что из образца биопсии, полученного от субъекта, готовят клеточный отпечаток или суспензию клеток, в котором создают условия гипоксии, подвергают повторяющимся воздействиям повреждающего агента, выбранного из УФ-света, проводят спектрофлурометрическое исследование образца после повторяющегося воздействия УФ-светом, и в случае, если в темновых условиях обнаружен прирост интенсивности флуоресценции NAD(P)H, диагностируют клетки как злокачественные.
| ШВАРЦБУРГ П.М | |||
| Окислительный стресс во взаимодействии опухоли и организма: Диссертация в виде научного доклада на соискание ученой степени доктора биологических наук | |||
| - Пущино, 1997, с.44 | |||
| СПОСОБЫ И МАТЕРИАЛЫ ДЛЯ ОБНАРУЖЕНИЯ АПОПТОЗА | 2007 |
|
RU2450273C2 |
| СПОСОБ ДИАГНОСТИКИ НА ОСНОВЕ РАСТВОРА | 2003 |
|
RU2315312C2 |
| СПОСОБ ОБНАРУЖЕНИЯ НЕОПЛАСТИЧЕСКИХ ЗАБОЛЕВАНИЙ ИСХОДЯ ИЗ СОЛЮБИЛИЗИРОВАННОГО ФИЗИОЛОГИЧЕСКОГО ОБРАЗЦА | 2004 |
|
RU2405158C2 |
| АНАЛИЗЫ И СПОСОБЫ ПРИМЕНЕНИЯ БИОМАРКЕРОВ | 2006 |
|
RU2409817C2 |
| IRENE GEORGAKOUDI et al | |||
| NAD(P)H and collagen as in | |||
Авторы
Даты
2014-02-27—Публикация
2012-07-16—Подача