Изобретение относится к области биотехнологии, а именно к полученной новой клеточной линии рака молочной железы человека BrCCh4e, обладающей стабильными культуральными и морфологическими характеристиками. Данная клеточная линия может использоваться для лабораторных и доклинических исследований с целью оценки эффективности противоопухолевых препаратов.
Высокий процент онкологических заболеваний молочной железы стимулирует развитие новых таргетных и персонализированных методов лечения. При персонализированном подходе схема лечения учитывает различные молекулярные характеристики опухоли конкретного пациента - экспрессию определенных ферментов, рецепторов гормонов и белковых факторов. Индивидуальной характеристикой опухоли также является ее чувствительность или резистентность к различным противоопухолевым препаратам. Поиск новых мишеней для таргетной терапии происходит с использованием данных протеомного и транскриптомного анализов опухолевого материала, а для валидации найденных потенциальных мишеней используют различные опухолевые линии клеток в качестве моделей [1]. Тем не менее, только совокупность иммортализованных линий опухолевых клеток может моделировать гетерогенность опухолей человека [2-4]. Поэтому, расширение арсенала охарактеризованных опухолевых клеточных линий для изучения опухолевой прогрессии и разработки терапевтических подходов остается актуальной задачей.
В настоящее время каталог Специализированной коллекции культур клеток позвоночных Российской коллекции клеточных культур (ИНЦ РАН, Санкт-Петербург) содержит 5 клеточных линий рака молочной железы человека - MCF-7, ВТ-20, ВТ-474, Hs578T и ZR-75-1, из которых 4 формируют опухоли у иммунодефицитных животных при трансплантации. В настоящее время морфологическая классификация, в совокупности со статусом рецепторов стероидных гормонов и рецептора HER2 позволяют проводить классификацию рака молочной железы [5]. Преимущественные сайты метастазирования рака молочной железы существенно коррелируют с его субтипом [6]. Предлагаемая клеточная линия рака молочной железы человека BrCCh4e в соответствии с указанной классификацией может быть отнесена к HER2 субтипу опухолей молочной железы. Встречаемость этого типа рака в популяции составляет около 7-20%. Показано, что стандартные методы химиотерапии снижают безрецидивный период выживаемости и общую выживаемость пациентов с HER2 субтипом опухолей молочной железы, а наибольшая эффективность показана для таргетной терапии к HER2 рецептору препаратами трастузумаб и пертузумаб совместно с таксанами, за исключением пациентов с серьезной сердечной недостаточностью [7]. Несмотря на существующий широкий спектр одобренных для клинической практики анти-HER2 препаратов, случаи резистентности к такой терапии мотивируют расширять спектр анти-HER2 агентов. Тестирование эффективности таких агентов проводят на соответствующих моделях - клеточных линиях рака молочной железы соответствующего субтипа.
Наиболее широко используемыми линиями рака молочной железы субтипа HER2 коллекции АТСС (https://www.atcc.org) являются линии клеток SKBR-3, MDA-MB-435 и НСС1954.
Клеточная линия SKBR-3 (в АТСС шифр НТВ-30) получена из сайта метастазирования рака молочной железы и ее фенотип ERs-/PR-/HER2+/EGFRhigh/Ki-67(20%). Клетки SKBR-3 туморогенны в мышах nude и формируют слабо дифференцированные опухоли. По сравнению с предлагаемой линией BrCCh4e, клетки SKBR-3 имеют низкую экспрессию Ki-67. Эта клеточная линия широко используется как модель для исследования цитотоксических и противоопухолевых свойств таргетных препаратов, нацеленных на HER2. Показано, что клеточные линии SKBR-3 и НСС1954 могут являются моделями для исследования резистентности рака молочной железы подтипа HER2 к лапатинибу [8].
Клеточная линия MDA-MB-435 (в АТСС шифр НТВ-129) также получена из сайта метастазирования рака молочной железы и ее фенотип ERs-/PR-/HER2+/EGFR-/Ki-67(80%) [9]. На клеточной линии MDA-MB-435 были проведены исследования, показывающие усиление чувствительности к таксолам при предварительной обработке клеток препаратом монокланального антитела anti-ErbB2/HER2 Герцептин (Trastuzumab) [10]. Тем не менее, с развитием методов анализа экспрессии генов на чипах показано, что клетки MDA-MB-435 имеют происхождение от меланомы, и в настоящее время в АТСС линия MDA-MB-435 аннотирована как меланома.
Наиболее близкой к заявляемой клеточной линии - прототипом, является клеточная линия рака молочной железы человека НСС1954 коллекции АТСС с коллекционным номером CRL-2338 [11]. Клеточная линия НСС1954 получена из карциномы протока молочной железы пациента, получавшего курс радиотерапии. Эти клетки экспрессируют эстрогеновые рецепторы, не экспрессируют рецептор прогестерона и гиперэкспрессируют рецептор HER2: клетки имеют фенотип ERs-/PR-/HER2+/Ki-67(95%). Клетки линии НСС1954 также характеризуются экспрессией эпителиального гликопротеина 2 и цитокератина 19, имеют фенотип низкодифференцированных опухолевых клеток, культивируются как адгезионная культура.
Техническим результатом изобретения является расширение арсенала клеточных линий, обладающих туморогенностью и способностью метастазировать, которые могут быть использованы для тестирования активности новых противоопухолевых препаратов, а также для поиска новых потенциальных терапевтических маркеров.
Указанный технический результат достигается новой клеточной линией рака молочной железы человека BrCCh4e, обладающей способностью образовывать опухоли у мышей линии scid при подкожной трансплантации (туморогенностью) и метастазировать, которая может быть использована для тестирования противоопухолевых агентов.
Заявляемая клеточная линия хранится в Специализированной коллекции культур клеток позвоночных Российской коллекции клеточных культур под регистрационным номером РККК(П) 799Д.
Полученная клеточная линия BrCCh4e обладает стабильными культуральными и морфологическими характеристиками.
Родословная клеточной линии BrCCh4e представлена следующим образом.
Культура клеток рака молочной железы BrCCh4e приготовлена из фрагмента опухолевой ткани, полученной в результате резекции опухоли молочной железы больной П, 69 лет, T4N1M0, проходившей лечение в специализированном онкологическом медицинском учреждении и получившей 4 курса химиотерапии циклофосфаном с доксорубицином.
Методологически клеточную линию BrCCh4e получали следующим образом. Полученный в результате операции свежий образец опухолевой ткани размером около 1 см3 немедленно помещали в ростовую среду DMEM, содержащую раствор антибиотиков-антимикотиков (100 ед/мл пенициллин, 0.1 мг/мл стрептомицин и 0.25 мкг/мл амфотерицин, далее а/а) и транспортировали на льду. Образец опухолевой ткани максимально очищали от соединительной ткани и кровеносных сосудов, промывали раствором PBS с а/а и измельчали скальпелем до фрагментов размера около 1 мм3, которые далее помещали в ростовую среду IMDM с 10% FBS (эмбриональная сыворотка телят) и культивировали в лунке 6-луночного планшета при температуре 37.0±1.0°С в атмосфере 5.0±0.5% СО2. Каждые 2-3 дня при смене среды в лунке, ростовую среду с неприкрепившимися живыми клетками и мелким эксплантатами, переносили в новую лунку планшета и ежедневно добавляли по 1 мл свежей ростовой среды. Эту манипуляцию повторяли 2-3 раза для сохранения разнообразия пула клеток, после чего клетки открепляли добавлением раствора TripLE (Gibco BRL Co., Invitrogen) и объединяли для продолжительного культивирования. На первом пассаже клеток в культуральную среду также добавляли ингибитор Rho-киназы (ROCK) (Sigma, США) для супрессии апоптоза и стимуляции пролиферативной активности в соответствии с рекомендациями производителя. Стабильно растущая клеточная линия была получена на 5 пассаже.
Морфологические признаки клеточной линии рака молочной железы человека BrCCh4e характеризуются следующим образом.
Культура представлена клетками округлой формы, иногда с двумя-тремя длинными отростками. Более 80% клеток окрашиваются антителами против Ki-67.
Маркерные признаки клеточной линии BrCCh4e следующие:
Методом проточной цитометрии определена эпителиальная природа культивируемых клеток - в 89% клеток присутствует Е-кадгерин, у 92% отсутствует N-кадгерин, методом иммуноцитохимии определена незначительная экспрессия виментина - ≤10%.
Клетки негативны по экспрессии рецепторов стероидных гормонов (ERa, ERβ, PR, по данным ПНР в реальном времени со специфическими праймерами), слабо позитивны по экспрессии EGFR (≤10%, вестерн блот), 97% позитивны по экспрессии ЕрСАМ, около 50% окрашиваются антителами против HER2 (по данным проточной цитометрии).
Культуральные свойства клеточной линии BrCCh4e характеризуются следующим образом.
Клеточная линия BrCCh4e культивируется в питательной среде IMDM в присутствии 10% FBS, 2 мМ L-глутамина, раствора антибиотиков-антимикотиков (100 ед/мл пенициллина, 0.1 мг/мл стрептомицина и 0.25 мкг/мл амфотерицина). На первом пассаже после криоконсервации клетки культивируются также в присутствии добавки MITO+ Serum Extender (Becton Dickinson, США) для культивирования эпителиальных клеток. Культура имеет адгезионный монослойный тип роста. При субкультивировании клетки пересаживают каждые 3-4 дня, кратность рассева - 1:3 - 1:4 при использовании раствора TripLE (Gibco BRL Co., Invitrogen)
Условия криоконсервации следующие.
Среда IMDM, 50%, FBS, 40%, DMSO, 10%. Стандартный режим замораживания, хранение в жидком азоте, 2×106 клеток/ампулу. Размораживание быстрое, при 37°С. 1 мл клеточной суспензии разводят в 10 мл среды DMEM, осаждают центрифугированием, 800 об/мин, клетки ресуспендируют в 4 мл IMDM с 20% FBS во флакон с площадью поверхности 25 см2. Жизнеспособность после криоконсервации ≥70% (Окраска трипановым синим).
Анализ контаминации.
При длительном культивировании бактерии и грибы в культуре не обнаружены. Анализ уреаплазмы и микоплазмы выполнен методом ОТ ПЦР в режиме реального времени с использованием пары праймеров: 5'GGCGAATGGGTAAGTAACACG3' и 5'CGATAACGCTTGCGACCTAT3', позволяющих выявлять Mycoplasma hyorhinis, Mycoplasma fermentans, Acholeplasma laidlawii, Mycoplasma arginini, Mycoplasma orale, Mycoplasma genitalium, Mycoplasma hominis, Mycoplasma pirum, Mycoplasma pneumoniae, Mycoplasma salivarium и Ureaplasma urealyticum. Тест на микоплазму и уреаплазму отрицательный.
Кариологическая характеристика клеточной линии BrCCh4e следующая.
Клетки BrCCh4e имеют псевдотриплоидный набор хромосом с пределами изменчивости по числу хромосом 49-78, модальное число хромосом 71.
Около 50% хромосом в каждой пластинке имеют GTG рисунок нормальных хромосом человека.
Анализ особенности ультраструктуры.
Методом электронной микроскопии показано, что клетки BrCCh4e имеют фенотип малодифференцированных опухолевых клеток.
Специфической особенностью предлагаемой линии является туморогенность в мышах scid. Подкожная трансплантация (2 млн клеток/мышь) в матригеле (Matrigel™, BD). Метастазирование в лимфоузлы средостения.
Полученная клеточная линия может быть использована в качестве модели для лабораторных исследований метастазирующего рака молочной железы человека.
Изобретение иллюстрируется следующими примерами.
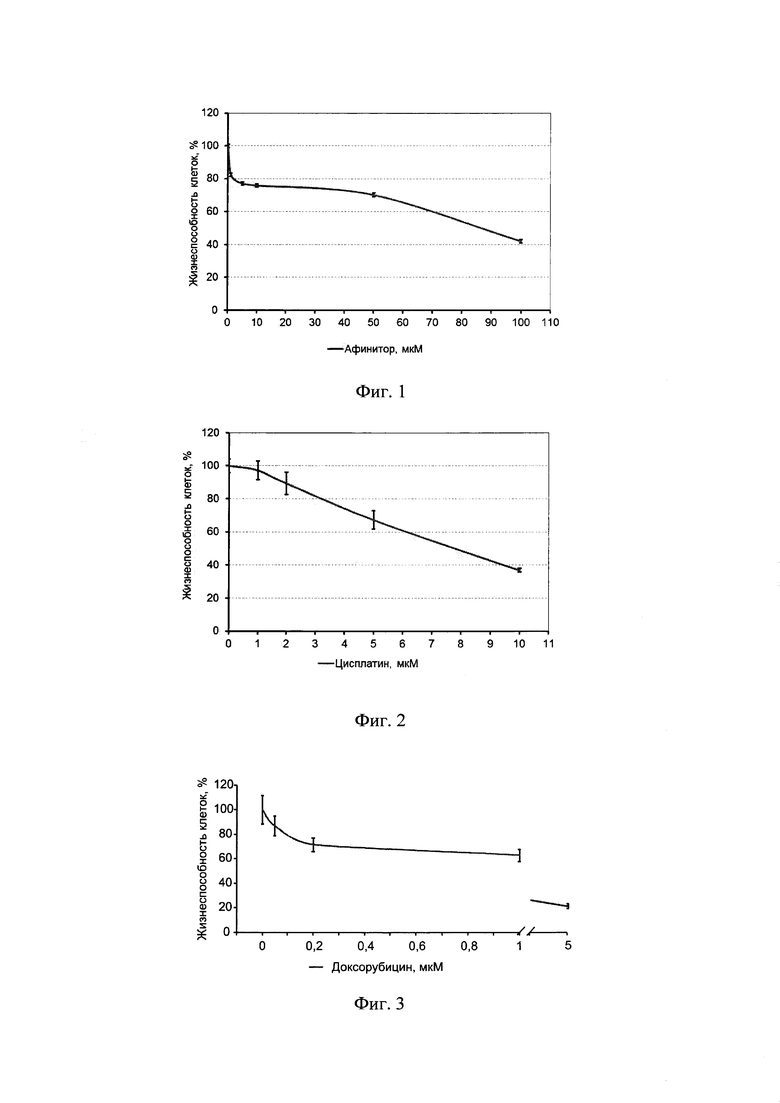
Пример 1. Использование клеточной линии BrCCh4e как модельной системы для оценки цитотоксического потенциала доксорубицина, цисплатина и афинитора in vitro.
Клетки линии BrCCh4e рассаживали в 96-луночные культуральные планшеты в среде RPMI в присутствии 10% FBS и раствора 2 мМ L-глутамина. Через 24 ч к клеткам добавляли 100 мкл исследуемых соединений, растворенных в среде RPMI-1640 (Gibco, Life Technologies, UK) и растили клетки в течение 48 ч в стандартных условиях.
Цтотоксический эффект препаратов оценивали в МТТ-тесте. Для этого среду в лунках заменяли на 100 мкл среды RPMI-1640 без сыворотки, содержащей МТТ (0.25 мг/мл), инкубировали 4 ч при 37°С. Далее, удаляли среду из лунок и добавляли в лунки по 150 мкл DMSO.
Оптическую плотность раствора в лунках измеряли на спектрофотометре при длине волны λ=570 нм. Жизнеспособность обработанных клеток определяли относительно жизнеспособности контрольных клеток (100%)±SD по трем независимым экспериментам.
Результаты эксперимента представлены на фиг. 1-3 и позволяют рассчитать значение IC50 (концентрацию препарата, приводящую к снижению жизнеспособности на 50%). Таким образом, для афинитора IC50 составило 74 мкМ, для цисплатина IC50 составило 7.3 мкМ, а для доксорубицина IC50 составило 0.9 мкМ. Полученные данные свидетельствуют о том, что клетки BrCCh4e обладают низкой чувствительностью к доксорубицину, цисплатину и афинитору.
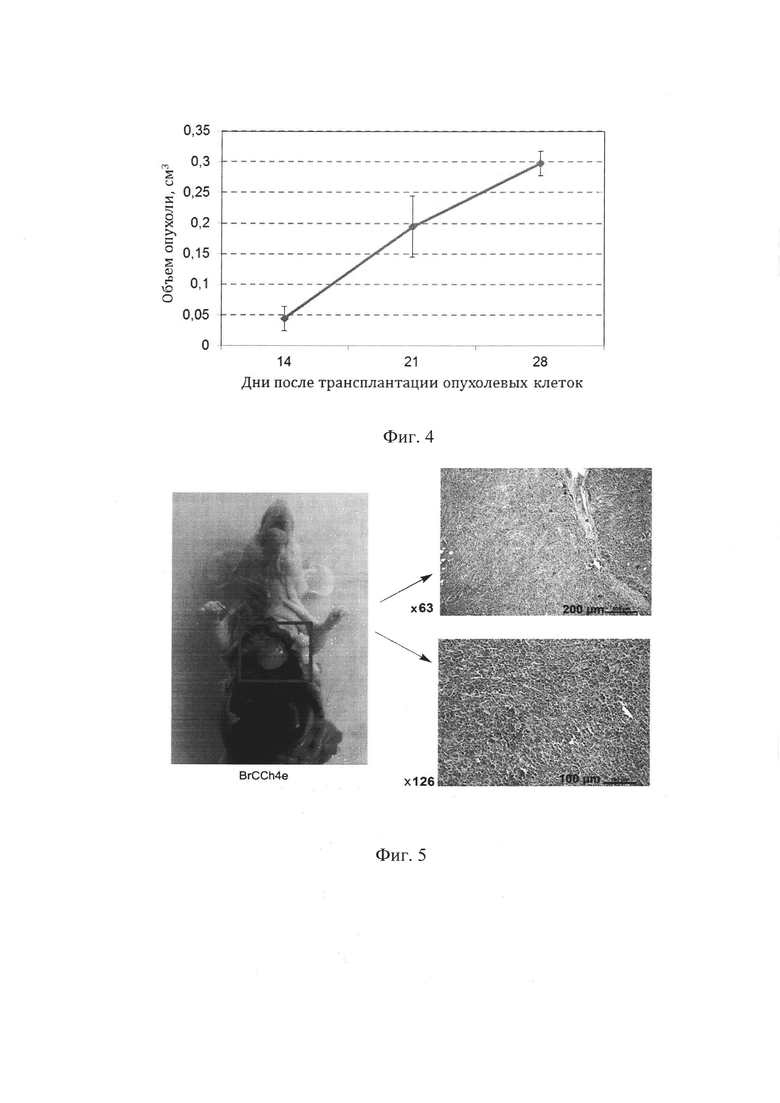
Пример 2. Трансплантация клеточной линии BrCCh4e иммунодефицитным мышам как модель для оценки эффективности противоопухолевых препаратов in vivo.
Клеточную линию BrCCh4e культивировали аналогично примеру 1 в культуральных флаконах площадью 75 см2 в стандартных условиях. Клетки открепляли от подложки с помощью TripLE, дважды промывали клеточный осадок добавлением пяти объемов PBS и осаждали центрифугированием при 800 об/мин. Далее клетки разбавляли холодным физиологическим раствором до концентрации 3×106 кл/мл, после чего к суспензии клеток добавляли равный объем матригеля (Matrigel Basement Membrane Matrix, BD Biosciences, США) и трансплантировали иммунодефицитным мышам подкожно, инъекцией в объеме 100 мкл.
Размеры опухолей у животных с трансплантированными клетками BrCCh4e измеряли дважды в неделю штангенциркулем. Динамика роста опухоли BrCCh4e представлена на фиг. 4.
На фиг. 4 можно видеть, что через 28 дней после трансплантации опухолевых клеток опухолевые узлы в среднем составляли 0.3 см3, что позволяет формировать группы животных для тестирования эффективности противоопухолевых препаратов in vivo.
Пример 3. Использование клеточной линии BrCCh4e для анализа метастазирования.
Клеточную линию BrCCh4e культивировали и подкожно тарнсплантировали животным как описано в примере 2. По достижению опухоли размера не менее 0.7×0.7. см2 в двух перпендикулярных измерениях, животных умерщвляли ингаляцией СО2, проводили патоморфологический осмотр животного для выявления очагов метастазирования. На фиг. 5. представлено репрезентативное изображение метастаза в лимфатическом узле средостения у мышей с опухолью BrCCh4e. Справа представлен гистологический анализ метастаза. Выявлено, что предпочтительным сайтом метастазирования клеток BrCCh4e в мышах scid при подкожной трансплантации являются лимфоузлы средостения.
Полученная клеточная линия BrCCh4e, обладающая стабильными культуральными и морфологическими характеристиками, может быть использована для тестирования противоопухолевых и антиметастатических препаратов и позволит расширить арсенал моделей для тестирования противоопухолевых препаратов in vitro и in vivo.
Источники информации.
1. van Staveren W.C.G., 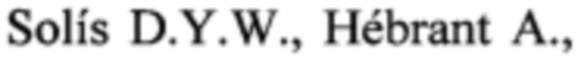 Detours V., Dumont J.E., MaenhautC. Human cancer cell lines: Experimental models for cancer cells in situ? For cancer stem cells. // Biochim. Biophys. Acta BBA - Reviews on Cancer. - 2009. - V. 1795 - №2. - P. 92-103.
Detours V., Dumont J.E., MaenhautC. Human cancer cell lines: Experimental models for cancer cells in situ? For cancer stem cells. // Biochim. Biophys. Acta BBA - Reviews on Cancer. - 2009. - V. 1795 - №2. - P. 92-103.
2. Vargo-Gogola Т., Rosen J.M. Modelling breast cancer: one size does not fit all // Nat. Rev. Cancer. - 2007. - V. 7 - №9. - P. 659-672.
3. Hynds R.E., Vladimirou E., Janes S.M. The secret lives of cancer cell lines // Dis. Model. Mech. - 2018. - V. 11 - №11. - P. Dmm037366.
4. Ben-David U., Siranosian В., Ha G., Tang H., Oren Y., Hinohara K., Strathdee C.A., Dempster J., Lyons N.J., Burns R., et al. Genetic and transcriptional evolution alters cancer cell line drug response // Nature. - 2018. - V. 560 - №7718. - P. 325-330.
5. Sorlie Т., PerouC, Tibshirani R., Aas Т., Geisler S., Johnsen H., Hastie Т., Eisen M.B., van de Rijn M., Jeffrey S.S., Thorsen Т., Quist H., Matese J.C., Brown P.O., Botstein D., 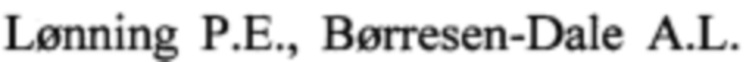 Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications // Proc. Natl. Acad. Sci. USA. - 2001. - V. 98 - №19. - P. 10869-10874.
Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications // Proc. Natl. Acad. Sci. USA. - 2001. - V. 98 - №19. - P. 10869-10874.
6. Kennecke H., Kennecke H., Yerushalmi R., Woods R., Cheang M.C., Voduc D., Speers C.H., Nielsen Т.О., Gelmon K. Metastatic behavior of breast cancer subtypes // J. Clin. Oncol. - 2010. - V. 28 - №20. - P.3271-3277.
7. Giordano S.H., Temin S., Davidson N.E. Systemic therapy for patients with advanced human epidermal growth factor receptor 2-positive breast cancer: ASCO clinical practice guideline update // J. Clin. Oncol. - 2018. - V. 36 - №26. - P. 2736-2740.
8. Eustace A.J., Conlon N.T., McDermott M.S.J., Browne B.C., O'Leary P., Holmes F.A., Espina V., Liotta L.A., O'Shaughnessy J., et al. Development of acquired resistance to lapatinib may sensitise HER2-positive breast cancer cells to apoptosis induction by obatoclax and TRAIL // BMC Cancer. - 2018. - V.18 - №l. - P. 1-14.
9. Subik K., Lee J.F., Baxter L., Strzepek Т., Costello D., Crowley P., Xing L., Hung M.C., Bonfiglio Т., Hicks D.G., Tang P. The expression patterns of ER, PR, HER2, CK5/6, EGFR, Ki-67 and AR by immunohistochemical analysis in breast cancer cell lines // Breast Cancer (Auckl). - 2010. - V. 4. - P. 35-41.
10. Lee S., Yang W., Lan K.H., Sellappan S., Klos K., Hortobagyi G., Hung M.C., Yu D. Enhanced sensitization to taxol-induced apoptosis by herceptin pretreatment in ErbB2-overexpressing breast cancer cells // Cancer Res. - 2002. - V. 62 - №20. - P. 5703-5710.
11. Gazdar A., Kurvari V., Virmani A., Gollahon L., Sakaguchi M., Westerfield M., Kodagoda D., Stasny V., Cunningham H., Wistuba I., Tomlinson G., Tonk V., Ashfaq R., Leitch A., Minna J., Shay J. Characterization of paired tumor and non-tumor cell lines established from patients with breast cancer // Int. J. Cancer. - 1998. - V.6. - P. 766-774.
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантная клеточная линия рака молочной железы человека BrCCh4e-134, экспрессирующая простат-специфический мембранный антиген человека | 2019 |
|
RU2726541C1 |
| СТАБИЛЬНАЯ КЛЕТОЧНАЯ ЛИНИЯ КАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА SKBR-kat | 2018 |
|
RU2709675C1 |
| КЛЕТОЧНАЯ ЛИНИЯ РАКА МОЧЕВОГО ПУЗЫРЯ ЧЕЛОВЕКА 190 BICan KAG | 2021 |
|
RU2779948C1 |
| Натрий-кобальт-полигалактуронат, обладающий противоопухолевой активностью | 2023 |
|
RU2794885C1 |
| КЛЕТОЧНАЯ ЛИНИЯ РАКА МОЧЕВОГО ПУЗЫРЯ ЧЕЛОВЕКА 198 BlCan RLA | 2019 |
|
RU2733230C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ОБРАЗОВАНИЯ МЕТАСТАЗОВ И ПОВЫШЕНИЯ ЧУВСТВИТЕЛЬНОСТИ (СЕНСИБИЛИЗАЦИИ) ОПУХОЛЕЙ К ХИМИОТЕРАПЕВТИЧЕСКИМ ПРЕПАРАТАМ | 2007 |
|
RU2328282C1 |
| КЛЕТОЧНАЯ ЛИНИЯ РАКА МОЧЕВОГО ПУЗЫРЯ ЧЕЛОВЕКА 587 BlCan TVV | 2020 |
|
RU2742244C1 |
| РЕКОМБИНАНТНЫЙ ТАРГЕТНЫЙ ТОКСИН, СПЕЦИФИЧНЫЙ К КЛЕТКАМ, ЭКСПРЕССИРУЮЩИМ РЕЦЕПТОР HER2 | 2016 |
|
RU2627215C1 |
| СПОСОБ ИНГИБИРОВАНИЯ РАДИАЦИОННО-ИНДУЦИРОВАННОГО УВЕЛИЧЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2800366C2 |
| СПОСОБ СНИЖЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК АДЕНОКАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2798550C2 |
Изобретение относится к области биотехнологии. Предложена новая клеточная линия рака молочной железы человека BrCCh4e, обладающая стабильными культуральными и морфологическими характеристиками. Клеточная линия BrCCh4e хранится в Специализированной коллекции культур клеток позвоночных Российской коллекции клеточных культур под регистрационным номером РККК(П) 799Д. Указанная клеточная линия предназначена для исследования канцерогенеза и метастазирования, тестирования активности противоопухолевых препаратов in vitro и in vivo. Изобретение обеспечивает расширение арсенала клеточных линий, обладающих туморогенностью и способностью метастазировать, которые могут быть использованы для тестирования активности новых противоопухолевых препаратов, а также для поиска новых потенциальных терапевтических маркеров. 5 ил., 3 пр.
Клеточная линия рака молочной железы человека BrCCh4e, используемая для тестирования противоопухолевых и антиметастатических препаратов, хранится в Специализированной коллекции культур клеток позвоночных Российской коллекции клеточных культур под регистрационным номером РККК(П) 799Д.
| GAZDAR A.F | |||
| et al., Characterization of paired tumor and non-tumor cell lines established from patients with breast cancer, Int | |||
| J | |||
| Cancer., 1998, Volume 78, Issue 6, pp.766-774 | |||
| NUSHTAEVA A.A | |||
| et al., Characterization of primary normal and malignant breast cancer cell and their response to chemotherapy and immunostimulatory agents, BMC Cancer, |
Авторы
Даты
2020-03-24—Публикация
2019-08-05—Подача