[1001] Настоящая заявка испрашивает приоритет согласно и в пользу предварительной заявки на патент США № 62/035,682 под названием «Устройство и способы управления глубиной введения иглы», поданной 11 августа 2014 г. и предварительной заявки на патент США № 62/014,766 под названием «Канюля переменного диаметра для доставки лекарственного средства», поданной 20 июня 2014 г., содержание каждой из которых полностью включено в настоящую заявку посредством ссылки.
Область и уровень техники
[1002] Рассмотренные в настоящем описании варианты реализации настоящего изобретения относятся в целом к области офтальмологической терапии и конкретнее к использованию микроиглы для доставки и/или удаления субстанции, такой как жидкое лекарственное средство, в глазные ткани и/или из них для лечения глаза.
[1003] Хотя иглы используют при трансдермальной и внутриглазной доставки препаратов, существует необходимость в улучшенных связанных с микроиглами устройствах и способах и, особенно, в доставке материалов (например, препаратов) в заднюю область глаза. Многие воспалительные и пролиферативные заболевания в задней области (или других областях) глаза требуют долгосрочного фармакологического лечения. Примеры таких заболеваний включают дегенерацию желтого пятна, диабетическую ретинопатию и увеит. Зачастую затруднительно доставлять эффективные дозы препарата к задней части глаза, используя обычные способы доставки, такие как местное нанесение или интравитреальное введение (IVT), обладающие плохой эффективностью, и системное введение, часто вызывающее значительные побочные эффекты. Например, хотя глазные капли полезны при лечении заболеваний, воздействующих на внешнюю поверхность глаза или тканей в передней части глаза, часто не происходит достаточной передачи глазных капель к задней части глаза, что может быть необходимо для лечения некоторых упомянутых выше заболеваний сетчатки.
[1004] Хотя в прошедшее десятилетие имели место достижения, связанные с использованием системно доставляемых субстанций, существуют препятствия к широкому распространению таких способов. Например, в определенных ситуациях может быть эффективной непосредственная инъекция в глаз (например, в стекловидное тело) при использовании обычных игл и шприцов калибра 27 или 30. Однако, непосредственная инъекция может быть связана со значительным риском для безопасности и от врачей часто требуют профессиональной подготовки для эффективной реализации таких способов. Кроме того, в определенных случаях желательна целенаправленная инъекция терапевтического средства. Однако, в таких случаях относительно малые анатомические структуры глаза часто приводят к значительным затруднениям при размещении иглы в целевом местоположении при использовании известных устройств и способов, особенно, при размещении дистального конца иглы на нужной глубине внутри глаза. Кроме того, интравитреальное введение может иметь побочные эффекты, такие как увеличенное внутриглазное давление или ускоренное начало формирования катаракты.
[1005] Кроме того, много известных способов непосредственной инъекции препарата в глаз включают введение иглы или канюли под острым углом к поверхности глаза, что может сделать проблематичным управление глубиной введения. Например, некоторые такие способы включают управление угловой ориентацией иглы таким образом, что введенная субстанция выходит из иглы в определенном местоположении. Кроме того, некоторые известные способы инъекции материалов в глазную ткань включают сложную систему или датчики визуализации для управления размещением иглы или канюли.
[1006] Известные устройства для инъекции в глаз не обеспечивают механизм для регулировки длины иглы таким образом, чтобы игла могла быть введена в глаз на необходимую глубину. Известные системы также не обеспечивают надежный механизм для определения нахождения наконечника иглы в необходимом местоположении, например, в супрахороидальном пространстве глаза. Такие недостатки известных систем и способов усилены тем, что размер и толщина различных включенных в глаз слоев могут быть по существу разными у разных людей. Например, толщина конъюнктивы и склеры может быть по существу разной, а их истинное значение не может быть легко заранее определено посредством стандартных способов. Кроме того, толщина этих слоев может также быть разной в различных частях глаза и в разное время дня в том же самом глазу и местоположении. Поэтому, при использовании известных систем и способов может быть проблематичным определение и/или регулировка длины иглы для пункции глаза так, чтобы наконечник иглы был на нужной глубине, например, в супрахориоидальном пространстве. Слишком короткая игла не способна проникнуть через склеру, а слишком длинная игла способна пройти за супрахориоидальное пространство и повредить сетчатку глаза. Кроме того, известные системы не обеспечивают удобный способ обнаружения положения наконечника иглы внутри глаза.
[1007] Вследствие чувствительностей, связанных с внутриглазной инъекцией (например, чувствительности ткани, потенциального воздействия на внутриглазное давление и т.п.), многие известные системы используют ручную инъекцию, часто применяя иглы и/или канюли малого диаметра (например, калибра 27 и 30, или еще меньше) и большой длины 12 мм, 15 мм или еще длиннее. Подробнее, многие известные устройства и способы включают пользователя, вручную прилагающего силу (например, посредством подталкивания штока шприца большим пальцем или другими пальцами) для выталкивания текучей среды (например, препарата) в глаз. Вследствие малого размера иглы и/или особенностей вводимого препарата некоторые такие устройства и способы используют уровни силы, превышающие удобные для пользователя уровни. Например, некоторые исследования показали, что пользователям обычно не нравится прилагать превышающую 2 Н силу к глазу во время инъекции в него. Соответственно, в определенных ситуациях пользователь, возможно, недолжным образом подает лекарственное средство при использовании известных систем и способов вследствие его нежелания прилагать силу, полностью выталкивающую лекарственное средство.
[1008] Кроме того, инъекция в различные целевые слои глаза может вызвать изменчивость величины силы, необходимой для введения иглы и/или инъекции лекарственного средства. Различные слои глаза могут обладать различными значениями плотности. Например, склера обычно обладает более высокой плотностью, чем конъюнктива или супрахориоидальное пространство. Различия в плотности целевой области или слоя могут образовать различное противодавление на выходе иглы, то есть, у наконечника иглы, из которого выходит текучая среда. Таким образом, инъекция в относительно плотный глазной материал, такой как склера, требует большего значения давления при перемещении для выталкивания лекарственного средства из иглы, чем необходимо при инъекции лекарственного средства в супрахориоидальное пространство.
[1009] Кроме того, сила инъекции, необходимая для выталкивания лекарственного средства, также зависит от плотности и вязкости жидкого лекарственного средства, длины иглы и/или диаметра иглы. Инъекция определенных лекарственных средств в глаз через необходимые иглы (например, калибра 27, калибра 30 или еще меньше) может потребовать приложения большей силы, чем с удобством прилагают (или способны прилагать) многие практикующие врачи.
[1010] Таким образом, существует необходимость в улучшенных устройствах и способах, способных содействовать в облегчении инъекции вязкого лекарственного средства в глазную ткань.
Раскрытие сущности изобретения
[1011] В определенных вариантах реализации настоящего изобретения устройство содержит микроиглу, которая образует проходящий через нее просвет. Микроигла имеет проксимальную концевую часть, дистальную концевую часть и центральную частью между проксимальной концевой частью и дистальной концевой частью. Проксимальная концевая часть выполнена с возможностью соединения с контейнером для лекарственного средства, таким, например, как шприц. Часть просвета внутри проксимальной концевой части имеет первый диаметр. Дистальная концевая часть выполнена с возможностью прокола ткани-мишени. Часть просвета внутри дистальной концевой части имеет второй диаметр, который меньше первого диаметра. Центральная часть имеет поверхность, выполненную с возможностью контакта с тканью-мишенью при размещении дистальной концевой части внутри ткани-мишени.
Краткое описание чертежей
[1012] На фиг. 1 показан вид в поперечном сечении человеческого глаза.
[1013] На фиг. 2 показан вид в поперечном сечении части человеческого глаза по фиг. 1, взятый по линии 2-2.
[1014] На фиг. 3 и 4 показаны виды в поперечном сечении части человеческого глаза по фиг. 1, взятые по линии 3-3, иллюстрирующие супрахориоидальное пространство с наличием и без наличия, соответственно, текучей среды.
[1015] На фиг. 5 схематически показано устройство, содержащее приводной шток и микроиглу согласно варианту реализации настоящего изобретения.
[1016] На фиг. 6 показан вид в поперечном сечении микроиглы согласно варианту реализации настоящего изобретения.
[1017] На фиг. 7 показан перспективный вид медицинского инъектора согласно варианту реализации настоящего изобретения.
[1018] На фиг. 8 показан в разобранном виде медицинский инъектор по фиг. 7.
[1019] На фиг. 9 показан в разобранном виде узел иглы по фиг. 7.
[1020] На фиг. 10 показан вид в поперечном сечении узла иглы по фиг. 9, взятый по линии 10-10.
[1021] На фиг. 11A показан в разобранном виде узел иглы согласно варианту реализации настоящего изобретения.
[1022] На фиг. 11B показан вид сбоку узла иглы по фиг. 11A в собранной конфигурации.
[1023] На фиг. 11C показан вид в поперечном сечении узла иглы по фиг. 11A в собранной конфигурации.
[1024] На фиг. 12 схематически показано устройство, содержащее медицинский инъектор, сжимаемый элемент и разъем иглы согласно варианту реализации настоящего изобретения.
[1025] На фиг. 13 показан боковой вид в поперечном сечении устройства по фиг. 12 в первой конфигурации.
[1026] На фиг. 14 показан боковой вид в поперечном сечении устройства по фиг. 12 во второй конфигурации.
[1027] На фиг. 15 показан боковой вид в поперечном сечении устройства по фиг. 12 в третьей конфигурации.
[1028] На фиг. 16 показан боковой вид в поперечном сечении части устройства, содержащего медицинский инъектор, сжимаемый элемент, разъем иглы и стопорный механизм в первой конфигурации согласно варианту реализации настоящего изобретения.
[1029] На фиг. 17 показан боковой вид в поперечном сечении устройства по фиг. 16 во второй конфигурации.
Осуществление изобретения
[1030] Рассмотренные в настоящем описании варианты реализации настоящего изобретения относятся к системам и устройствам для доставки текучей среды (например, препарата) в склеру глаза или извлечения текучей среды из нее. Кроме того, рассмотренные в настоящем описании варианты реализации настоящего изобретения относятся к микроиглам и/или доставочным канюлям, выполненным с возможностью подачи вязкого лекарственного средства в глазную ткань. Рассмотренные в настоящем описании варианты реализации настоящего изобретения также относятся к системам, устройствам и способам управления глубиной введения доставочного элемента, такого как, например, микроигла, в глаз, для доставки терапевтического средства, например, в заднюю область глаза (например, через супрахориоидальное пространство). Рассмотренные в настоящем описании варианты реализации настоящего изобретения также относятся к микроиглам и/или доставочными канюлями, выполненным с возможностью образования по существу непроницаемого для текучей среды уплотнения вокруг канала доставки, образованного посредством введения доставочного элемента, например, микроиглы, в глаз, для предотвращения утечки субстанции и/или глазной текучей среды от места введения.
[1031] В определенных вариантах реализации настоящего изобретения микроиглы, включенные в рассмотренные в настоящем описании варианты реализации, содержат скошенную кромку на дальнем наконечнике, что упрощает проникновение в склеру и/или супрахориоидальное пространство с минимальным сопутствующим повреждением. Кроме того, в определенных вариантах реализации настоящего изобретения раскрытые в настоящем описании микроиглы могут определять узкий просвет (например, с калибром, превышающим калибр 30, калибр 32, калибр 34, калибр 36 и т.д. или равный им), что позволяет супрахориоидальную доставку препаратов при минимизации диаметра следа иглы, вызванного введением микроиглы. В определенных вариантах реализации настоящего изобретения просвет и соотношение сторон скошенной кромки рассмотренных в настоящем описании микроигл отличны от стандартных игл калибра 27 и калибра 30, которые в настоящее время обычно используют для внутриглазной инъекции. Например, микроиглы, включенные в рассмотренные в настоящем описании варианты реализации, могут быть любой из игл, описанных в опубликованной заявке на международный патент № WO2014/036009, озаглавленной «Устройство и способы для доставки препаратов посредством микроигл» поданной 27 августа 2013 г., содержание которой полностью включено в настоящую заявку посредством ссылки (упомянута ниже как «PCT заявка ʹ009»).
[1032] В определенных вариантах реализации настоящего изобретения устройство содержит микроиглу, образующую проходящий через нее просвет. Микроигла имеет проксимальную концевую часть, дистальную концевую часть и центральную часть между проксимальной концевой частью и дистальной концевой частью. Проксимальная концевая часть выполнена с возможностью соединения с контейнером для лекарственного средства, таким, например, как шприц. Часть просвета внутри проксимальной концевой части имеет первый диаметр. Дистальная концевая часть выполнена с возможностью прокола ткани-мишени. Часть просвета внутри дистальной концевой части имеет второй диаметр, меньший первого диаметра. Центральная часть содержит поверхность, выполненную с возможностью контакта с тканью-мишенью при размещении дистальной концевой части внутри ткани-мишени.
[1033] В определенных вариантах реализации настоящего изобретения устройство содержит микроиглу, образующую проходящий через нее просвет. Микроигла имеет проксимальную концевую часть, дистальную концевую часть и центральной частью между проксимальной концевой частью и дистальной концевой частью. Часть просвета внутри центральной части обладает диаметром, изменяемым вдоль продольной оси просвета. Другими словами, диаметр просвета претерпевает изменение внутри центральной части от значения первого диаметра в проксимальной концевой части до значения второго, меньшего диаметра, в дистальной концевой части. Центральная часть микроиглы имеет на дистальном конце выпуклую поверхность, которая выполнена с возможностью контакта с целевой поверхностью ткани-мишени, при перемещении субстанции через иглу в ткань-мишень. В определенных вариантах реализации настоящего изобретения дистальная концевая поверхность имеет уплотнительную часть, выполненную с возможностью образования по существу непроницаемого для текучей среды уплотнения с целевой поверхностью при контакте дистальной концевой поверхности с целевой поверхностью.
[1034] В определенных вариантах реализации настоящего изобретения способ включает введение части иглы с дистальным концом медицинского инъектора в ткань-мишень для образования канала доставки внутри ткани-мишени. За этим следует размещение выпуклой поверхности центральной части иглы в контакте с целевой поверхностью ткани-мишени для изоляции по текучей среде канала доставки. Затем способ включает перемещение, выполняемое после размещения, субстанции в ткань-мишень через иглу. Перемещение представляет собой перемещение субстанции через проксимальную концевую часть иглы, имеющую первый диаметр, и дистальную концевую часть иглы, имеющую второй диаметр. В определенных вариантах реализации настоящего изобретения ткань-мишень представляет собой глаз, а целевая поверхность представляет собой конъюнктиву глаза. В определенных вариантах реализации настоящего изобретения канал доставки проходит через склеру глаза, а перемещение включает перемещение субстанции в по меньшей мере одно место из супрахориоидального пространства или нижней части склеры. В таких вариантах реализации настоящего изобретения способ может дополнительно включать регулировку, перед перемещением, длины иглы, проходящей от дистальной концевой поверхности центральной части.
[1035] В определенных вариантах реализации настоящего изобретения способ включает введение дистальной концевой части иглы медицинского инъектора в ткань-мишень для образования канала доставки внутри ткани-мишени. Введение выполнено таким образом, что средняя линия иглы по существу перпендикулярна к целевой поверхности ткани-мишени. За этим следует размещение дистальной концевой поверхности центральной части иглы в контакте с целевой поверхностью ткани-мишени для изоляции по текучей среде канала доставки. Затем способ включает перемещение, выполняемое после размещения, субстанции в ткань-мишень через иглу. В определенных вариантах реализации настоящего изобретения доставка выполняется таким образом, что средняя линия канала доставки и линия поверхности, касательная к целевой поверхности, образует угол входа, составляющий от примерно 75 градусов до примерно 105 градусов.
[1036] В определенных вариантах реализации настоящего изобретения устройство содержит разъем иглы и пункционный элемент. Разъем иглы выполнен с возможностью соединения с контейнером для лекарственного средства. Дистальная концевая поверхность разъема иглы выполнена с возможностью контакта с целевой поверхностью ткани-мишени. Пункционный элемент подсоединен внутри канала разъема иглы. При соединении разъема иглы с контейнером для лекарственного средства пункционный элемент образует проходящий через него просвет, связанный по текучей среде с контейнером для лекарственного средства. Дистальная концевая часть пункционного элемента проходит в дистальном направлении от дистальной концевой поверхности разъема иглы. Проксимальная концевая часть пункционного элемента образует первый внутренний диаметр, а дистальная концевая часть пункционного элемента образует второй внутренний диаметр. Второй внутренний диаметр меньше первого внутреннего диаметра.
[1037] В определенных вариантах реализации настоящего изобретения устройство содержит контейнер для лекарственного средства, разъем иглы и микроиглу. Контейнер для лекарственного средства содержит лекарственное средство, имеющее значение вязкости, составляющее по меньшей мере примерно 100 сантипуаз. Приводной шток расположен в контейнере для лекарственного средства. Разъем иглы выполнен с возможностью соединения с контейнером для лекарственного средства. Разъем иглы образует канал. Дистальная концевая поверхность разъема иглы выполнена с возможностью контакта с целевой поверхностью ткани-мишени. Микроигла связана внутри канала разъема иглы. При связи разъема иглы с контейнером для лекарственного средства микроигла образует просвет в связи по текучей среде с контейнером для лекарственного средства. Дистальная концевая часть микроиглы проходит в дистальном направлении от дистальной концевой поверхности разъема иглы. Дистальная концевая часть микроиглы образует внутренний диаметр, имеющий калибр 30 или меньше. Длина дистальной концевой части микроиглы такова, что происходит передача лекарственного средства через просвет при приложении силы, меньшей примерно 6 Н, к приводному штоку. В определенных вариантах реализации настоящего изобретения длина такова, что передача лекарственного средства через просвет происходит при мощности потока, составляющей от примерно 0,1 мкл/сек до примерно 10 мкл/сек, при приложении силы, меньшей примерно 6 Н, к приводному штоку. В определенных вариантах реализации настоящего изобретения длина такова, что передача лекарственного средства через просвет происходит при мощности потока, составляющей по меньшей мере примерно 1,0 мкл/сек.
[1038] В определенных вариантах реализации настоящего изобретения устройство содержит контейнер для лекарственного средства, разъем иглы и иглу. Контейнер для лекарственного средства содержит лекарственное средство и эластомерный элемент, размещенный в нем таким образом, что перемещение эластомерного элемента передает лекарственное средство внутри контейнера для лекарственного средства. Разъем иглы выполнен с возможностью связи с контейнером для лекарственного средства. Игла выполнена с возможностью соединения с контейнером для лекарственного средства через разъем иглы. Игла образует просвет, связанный по текучей среде с контейнером для лекарственного средства. Дистальная концевая часть иглы образует внутренний диаметр калибра 30 или меньше и имеет длину, составляющую от примерно 200 микрон до примерно 1500 микрон. Проксимальная концевая часть иглы образует внутренний диаметр калибра 27 или больше. Игла содержит переходную часть между проксимальной концевой частью и дистальной концевой частью. Наружная поверхность переходной части выполнена с возможностью соединения с целевой поверхностью ткани-мишени во время события инъекции.
[1039] В определенных вариантах реализации настоящего изобретения устройство содержит узел контейнера для лекарственного средства, иглу, разъем иглы и сжимаемый элемент. Игла находится в связи по текучей среде с узлом контейнера для лекарственного средства. Разъем иглы выполнен с возможностью функциональной связи с дистальной концевой частью узла контейнера для лекарственного средства. Разъем иглы образует первый канал. Дистальная концевая поверхность разъема иглы выполнена с возможностью контакта с целевой поверхностью ткани-мишени. Сжимаемый элемент размещен между разъемом иглы и дистальной концевой частью узла контейнера для лекарственного средства. Сжимаемый элемент образует второй канал, а первый канал и второй канал ориентированы для получения, по меньшей мере части, проходящей через них иглы. Сжимаемый элемент выполнен с возможностью сжатия в качестве реакции на силу, прилагаемую к узлу контейнера для лекарственного средства, таким образом, что происходит уменьшение толщины сжимаемого элемента от первой толщины до второй толщины.
[1040] При использовании в настоящем описании грамматические формы единственного числа включают и множественное число, если контекст явно не указывает на иное. Таким образом, например, термин «элемент» предназначен для указания или на один элемент или на комбинацию элементов, а термин «материал» предназначен для указания на один материал или на большее количество материалов или на их комбинацию.
[1041] При использовании в настоящем описании слова «проксимальный» и «дистальный» относятся к направлению с приближением и удалением, соответственно, от оператора (например, хирурга, врача, медсестры, медтехника и т.д.), вводящего медицинское устройство в пациента, причем сначала происходит введение в тело пациента конца с наконечником (то есть, дистального конца). Таким образом, например, конец описанной в настоящем описании микроиглы, сначала введенный в тело пациента, будет дистальным концом, а противоположный конец микроиглы (например, конец медицинского устройства, управляемого оператором) будет проксимальным концом микроиглы.
[1042] При использовании в настоящем описании слово «набор» может иметь отношение к нескольким особенностям или к одной особенности с несколькими частями. Например, при упоминании набора стенок этот набор стенок можно рассматривать как одну стенку с различными частями, или набор стенок можно рассматривать как множество стенок.
[1043] При использовании в настоящем описании термины «около» и «примерно» обычно означают плюс-минус 10% от указанного значения. Например, примерно 0,5 включает значения 0,45 и 0,55, примерно 10 включает значения от 9 до 11, примерно 1000 включает значения от 900 до 1100.
[1044] При использовании в настоящем описании термины «доставочный элемент», «пункционный элемент» и «пунктирующий элемент» использованы взаимозаменяемо для указания на изделие, выполненное с возможностью прокалывания слоев ткани и доставки субстанции в слой ткани-мишени, например, на иглу или микроиглу.
[1045] При использовании в настоящем описании термины «контейнер для лекарственного средства и «камера для удержания лекарственного средства» использованы взаимозаменяемо для указания на изделие, выполненное с возможностью содержать объем субстанции, например, лекарственного средства.
[1046] Термин «непроницаемый для текучей среды» означает как герметичное уплотнение (то есть, уплотнение, непроницаемое для газа), так и уплотнение, непроницаемое для жидкости. Термин «по существу» при его использовании в связи с «непроницаемым для текучей среды», «непроницаемым для газа» и/или «непроницаемым для жидкости» предназначен для указания на то, что хотя желательна полная непроницаемость для текучей среды, некоторая минимальная утечка вследствие производственных допусков или других практических соображений (таких, например, как давление, приложенное к уплотнению и/или внутри текучей среды) может иметь место даже в «по существу непроницаемом для текучей среды» уплотнении. Таким образом, «по существу непроницаемое для текучей среды» уплотнение представляет собой уплотнение, которое предотвращает прохождение через него текучей среды (включая газы, жидкости и/или жидкие растворы) при поддержании уплотнения в постоянном положении и при манометрическом давлении текучей среды меньшем, чем примерно 5 фунтов на кв. дюйм, меньшем, чем примерно 10 фунтов на кв. дюйм, меньшем, чем примерно 20 фунтов на кв. дюйм, меньшем, чем примерно 30 фунтов на кв. дюйм, меньшем, чем примерно 50 фунтов на кв. дюйм, меньшем, чем примерно 75 фунтов на кв. дюйм, меньшем, чем примерно 100 фунтов на кв. дюйм и при всех промежуточных значениях. Точно так же «по существу непроницаемое для жидкости» уплотнение представляет собой уплотнение, которое предотвращает прохождение через него жидкости (например, жидкого лекарственного средства) при поддержании уплотнения в постоянном положении и подвергнуто воздействию манометрического давления жидкости меньшего, чем примерно 5 фунтов на кв. дюйм, меньшего, чем примерно 10 фунтов на кв. дюйм, меньшего, чем примерно 20 фунтов на кв. дюйм, меньшего, чем примерно 30 фунтов на кв. дюйм, меньшего, чем примерно 50 фунтов на кв. дюйм, меньшего, чем примерно 75 фунтов на кв. дюйм, меньшего, чем примерно 100 фунтов на кв. дюйм и при всех промежуточных значениях.
[1047] Рассмотренные в настоящем описании варианты и способы реализации настоящего изобретения могут быть использованы для лечения, доставки субстанций в различные ткани-мишени в глазу и/или субстанций аспирата из таких тканей. Для ссылки, на фиг. 1-4 показаны различные виды человеческого глаза 10 (причем фиг. 2-4 представляют собой виды в поперечном сечении). Хотя указаны определенные области, специалистам в данной области техники понятно, что эти идентифицированные области не описывают глаз 10 в полной мере, а скорее эти идентифицированные области представлены в виде упрощенного примера, подходящего для обсуждения рассмотренных в настоящем описании вариантов реализации. Глаз 10 содержит как передний отрезок 12 (часть глаза перед и включая хрусталик) так и задний отрезок 14 (часть глаза позади хрусталика). Передний отрезок 12 ограничен роговицей 16 и хрусталиком 18, а задний отрезок 14 ограничен склерой 20 и хрусталиком 18. Передний отрезок 12 далее подразделен на переднюю камеру 22 между радужной оболочкой 24 и роговицей 16 и заднюю камеру 26 между хрусталиком 18 и радужной оболочкой 24. Роговица 16 и склера 20 вместе образуют каемку 38 в точке их встречи. Открытая часть склеры 20 на переднем отрезке 12 глаза защищена прозрачной мембраной, называемой конъюнктивой 45 (см., например, фиг. 2 и 3). Под склерой 20 размещены сосудистая оболочка 28 и сетчатка 27, вместе называемые сетчатохороноидальной тканью. Стекловидное тело 30 размещено между ресничным телом 32 (включая ресничную мышцу и ресничный отросток) и сетчаткой 27. Передняя часть сетчатки 27 формирует границу 34 между зрительной и слепой частями сетчатки. Свободная соединительная ткань, или потенциальное пространство, между сосудистой оболочкой 28 и склерой 20 названо супрахороидальным пространством. На фиг. 2 показана роговица 16, состоящая из эпителия 40, слоя 41 Боумена, стромы 42, мембраны 43 Дессемета и эндотелия 44. На фиг. 3 показана склера 20, окруженная капсулой 46 Тенона или конъюнктивой 45, супрахориоидальное пространство 36, сосудистая оболочка 28 и сетчатка 27, по существу без текучей среды и/или разделения ткани в супрахориоидальном пространстве 36 (то есть, в этой конфигурации, пространство представляет собой «потенциальное» супрахориоидальное пространство). Как показано на фиг. 3, склера 20 имеет толщину, составляющую примерно от 500 мкм до 700 мкм. На фиг. 4 показаны склера 20, окруженная капсулой 46 Тенона или конъюнктивой 45, супрахориоидальное пространство 36, сосудистая оболочка 28 и сетчатка 27 с текучей средой 50 в супрахориоидальном пространстве 36.
[1048] При использовании в настоящем описании термин «супрахориоидальное пространство» описывает пространство (или объем) и/или потенциальное пространство (или потенциальный объем) в области глаза 10, расположенной между склерой 20 и сосудистой оболочкой 28. Эта область в основном составлена из плотно упакованных слоев длинных пигментированных отростков, полученных из каждой из двух соседних тканей; однако, некоторое пространство может быть образовано в этой области вследствие накопления текучей среды или другого материала в супрахориоидальном пространстве и соседних тканях. Супрахориоидальное пространство может быть расширено накоплением текучей среды вследствие определенного болезненного состояния в глазу или вследствие определенной травмы или хирургического вмешательства. В определенных вариантах реализации настоящего изобретения накопление текучей среды преднамеренно создано посредством доставки, инъекции и/или инфузии рецептуры препарата в супрахориоид для образования и/или дополнительного расширения супрахориоидального пространства 36 (то есть, посредством размещения в нем рецептуры препарата). Этот объем может служить путем для увеосклерального оттока (то есть, естественного процесса перемещения текучей среды в глазу из одной области глаза к другой) и может стать пространством в случаях хориоидального отделения от склеры.
[1049] Пунктирная линия на фиг. 1 представляет собой экватор глаза 10. В определенных вариантах реализации настоящего изобретения и/или в рассмотренных в настоящем описании способах место введения любой из микроигл расположено между экватором и каемкой 38 (то есть, в передней части 12 глаза 10). Например, в определенных вариантах реализации настоящего изобретения место введения расположено на расстоянии примерно от двух миллиметров до 10 миллиметров после каемки 38. В других вариантах реализации настоящего изобретения место введения микроиглы расположено примерно на экваторе глаза 10. В других вариантах реализации настоящего изобретения место введения расположено за экватором глаза 10. Таким образом, состав препарата может быть введен (например, через микроиглу) в супрахориоидальное пространство 36 на месте введения и может течь через супрахориоидальное пространство 36 от места введения во время события инфузии (например, во время инъекции).
[1050] В определенных вариантах реализации настоящего изобретения система для офтальмологической инъекции может содержать контейнер для лекарственного средства и канюлю (также называемую микроиглой), которая облегчает доставку субстанции, размещенной в контейнере для лекарственного средства к ткани-мишени, например, в супрахориоидальное пространство. Например, на фиг. 5 показана система 100, согласно варианту реализации настоящего изобретения. Система 100 содержит приводной шток 120, поршень 128 (или эластомерный элемент), контейнер 130 для лекарственного средства и микроиглу 140. Система 100 может быть выполнена с возможностью доставки лекарственного средства в область и/или слой целевого местоположения, например, в глаз пациента, (например, в супрахориоидальное пространство глаза), как рассмотрено в настоящем описании.
[1051] Приводной шток 120 содержит проксимальную концевую часть 122 и дистальную концевую часть 124. Проксимальная концевая часть 122 выполнена с возможностью приложения силы F (например, силы, вручную прилагаемой пользователем) для облегчения инъекции лекарственного средства М, как рассмотрено в настоящем описании. В определенных вариантах реализации настоящего изобретения система 100 может содержать узел содействия инъекции (не показанный на фиг. 5), функционально соединенный с приводным штоком 120 и выполненный с возможностью содействия образованию силы F. В таких вариантах реализации настоящего изобретения узел содействия инъекции способен выработать по меньшей мере часть силы F для перемещения приводного штока 120 внутри контейнера для 130 лекарственного средства. В определенных вариантах реализации настоящего изобретения узел содействия инъекции может содержать элемент накопления энергии, например, спиральную пружину, пружину сжатия, растяжения, с пружинной шайбой, с тарельчатой шайбой, коническую пружину и любой другой тип пружины. В других вариантах реализации настоящего изобретения узел содействия инъекции может содержать контейнер со сжатым газом или контейнер, содержащий пропеллент. Узел содействия инъекции может быть любым из описанных в заявке на патент США № 14/268687 под названием «Устройство и способы офтальмологической инъекции», поданной 2 мая 2014 г., содержание которой полностью включено в настоящую заявку посредством ссылки.
[1052] Дистальная концевая часть 124 приводного штока 120 размещена внутри контейнера 130 для лекарственного средства. Дистальная концевая часть 124 может быть соединена и/или контактировать с поршнем 128 (также называемым плунжером, стопором или эластомерным элементом), который состоит в связи по текучей среде с субстанцией М (например, с лекарственным средством, таким как, например, фактор роста эндотелия сосудов, ингибитор фактора роста эндотелия сосудов, с их комбинацией или с любым другим рассмотренным в настоящем описании лекарственным средством), размещенной во внутреннем объеме, определенном контейнером 130 для лекарственного средства. Дистальная концевая часть 124 приводного штока 120 выполнена с возможностью перемещения во внутреннем объеме, определенном контейнером 130 для лекарственного средства, например, вследствие приложения силы F большим пальцем оператора (или узлом содействия инъекции), как рассмотрено в настоящем описании. Таким образом, приводной шток 120 способен перемещать поршень 128 внутри контейнера 130 для лекарственного средства для всасывания или выталкивания субстанции М из дистальной концевой части 142 микроиглы 140, как рассмотрено в настоящем описании. Боковые стенки поршня 128 могут быть выполнены с возможностью контакта с боковыми стенками контейнера 130 для лекарственного средства таким образом, что поршень 128 образует по существу непроницаемое для текучей среды уплотнение с боковой стенкой контейнера 130 для лекарственного средства, например, для предотвращения утечки субстанции M. Поршень 128 может быть выполнен из инертного и/или биологически совместимого материала, который негибкий, но мягкий. Взятые в качестве примера материалы включают резину, силикон, пластмассу, полимеры, любой другой подходящий материал или их комбинацию. В определенных вариантах реализации настоящего изобретения поршень 128 может быть монолитно сформирован с приводным штоком 120.
[1053] Микроигла 140 содержит проксимальную концевую част 143, дистальную концевую часть 142 и центральную часть 144 и образует проходящий через них просвет 141. Проксимальная концевая часть 143 может быть соединена с контейнером 130 для лекарственного средства для размещения просвета в связи по текучей среде с контейнером 130 для лекарственного средства. Проксимальная концевая часть 143 может содержать любые подходящие соединительные элементы, например, соединители Люэра, резьбу, защелкиваемый разъем, пружинную защелку, замок, фрикционную посадку или любые другие подходящие соединительные элементы.
[1054] Дистальная концевая часть 142 микроиглы 140 может иметь острый наконечник и/или скошенную кромку таким образом, что игла 140 выполнена с возможностью прокалывания целевого местоположения T, например, телесной ткани (например, глазной ткани). Таким образом, дистальная концевая часть 142 может быть расположена в первой области R1 и/или во второй области R2 целевого местоположения T, как рассмотрено в настоящем описании. Скошенная кромка обеспечивает возможность легкого проникновения в склеру и/или супрахориоидальное пространство с минимальными сопутствующими повреждениями. В определенных вариантах реализации настоящего изобретения значения просвета и отношения сторон скошенной кромки рассмотренных в настоящем описании микроигл отличны от стандартных значений для игл калибров 27 и 30. Например, микроиглы, включенные в рассмотренные в настоящем описании варианты реализации настоящего изобретения, могут быть любой из игл, описанных в опубликованной заявке на международный патент № WO2014/036009, озаглавленной «Устройство и способы для доставки лекарственных средств посредством микроигл» поданной 27 августа 2013 г., содержание которой полностью включено в настоящую заявку посредством ссылки (упомянута ниже как «PCТ заявка ʹ009»).
[1055] Центральная часть 144 микроиглы 140 размещена между проксимальной концевой частью 143 иглы 140 и дистальной концевой частью 142 иглы 140. Центральная часть 144 служит в качестве переходной области между проксимальной концевой частью 143 иглы и дистальной концевой частью 142 иглы. Центральная часть 144 может быть по существу выгнута в форме, показанной на фиг. 5, и содержит контактную поверхность 145. Контактная поверхность 145 центральной части 144 выполнена с возможностью контакта с глазом. Таким образом, контактная поверхность 145 способна управлять глубиной проникновения дистальной концевой части 142 и/или может образовать уплотнение по текучей среде с поверхностью глаза, как рассмотрено в настоящем описании.
[1056] Микроигла 140 образует просвет 141, находящийся в связи по текучей среде с субстанцией М, размещенной во внутреннем объеме, определенном контейнером 130 для лекарственного средства. Таким образом, микроигла 140 выполнена с возможностью установления связи по текучей среде с контейнером 130 для лекарственного средства и целевым местоположением T, например, первой областью R1 и/или второй областью R2 целевого местоположения T. В определенных вариантах реализации настоящего изобретения целевое местоположение T может быть глазом, так что первая область R1 представляет собой супрахориоидальное пространство глаза, а вторая область R2 представляет собой склеру глаза. Просвет 141 микроиглы 140 может иметь любой подходящий размер или диаметр. Точнее, часть просвета внутри проксимальной концевой части 143 определена первым диаметром, а часть просвета внутри дистальной концевой части 142 определена вторым диаметром, который меньше первого диаметра. Также можно сказать, что микроигла 140 обладает переменным в пространстве значением внутреннего диаметра. Таким образом, длина части с меньшим значением диаметра (то есть, дистальной концевой части 142) может быть сведена к минимуму для уменьшения потерь на трение, связанных с передачей лекарственного средства через микроиглу 140. Уменьшение потерь на трение, в свою очередь, уменьшает силу F и/или внутреннее давление, прилагаемое приводным штоком 120 для передачи лекарственного средства M. При определенных обстоятельствах давление лекарственного средства М внутри контейнера 130 для лекарственного средства может быть смоделировано законом Хагена-Пуазейля, как указано ниже:
P=(8 * μ*L*Q)/(π*R4) (1)
[1057] где P представляет собой давление лекарственного средства М внутри контейнера 130 для лекарственного средства, μ представляет собой вязкость лекарственного средства М, L представляет собой длину иглы 140, Q равно мощности потока лекарственного средства М через иглу 140, и R представляет собой радиус просвета, определенный иглой 140. Поскольку давление (и/или сила), необходимые для инъекции текучей среды высокой вязкости через иглу с малым отверстием, обратно пропорциональны четвертой степени радиуса просвета иглы, давление лекарственного средства М внутри контейнера 130 для лекарственного средства, необходимое для достижения необходимой мощности потока, может, время от времени, быть относительно высоким. Посредством уменьшения длины части микроиглы 140 с малым диаметром может быть сведено к минимуму требование к величине силы, необходимой для выполнения необходимой инъекции. Например, при размере второго диаметра калибра 30 или меньше, длина дистальной концевой части 142 может быть такова, что передача лекарственного средства через просвет 141 происходит при приложении силы F меньшей, чем примерно 6 Н, к приводному штоку 122 (или к эластомерному элементу). В определенных вариантах реализации настоящего изобретения значение длины таково, что передача лекарственного средства через просвет происходит при мощности потока, составляющей от примерно 0,1 мкл/сек до примерно 10 мкл/сек, при приложении к приводному штоку силы, меньшей чем примерно 6 Н. В определенных вариантах реализации настоящего изобретения значение длины таково, что передача лекарственного средства через просвет происходит при мощности потока, составляющей по меньшей мере примерно 1,0 мкл/сек.
[1058] При использовании оператор (например, доктор, медтехник, медсестра, врач, офтальмолог и т.д.) может управлять системой 100 для введения микроиглы 140, например, в глазную ткань. Таким образом, дистальная концевая часть 142 микроиглы 140 может быть продвинута внутри ткани-мишени для прокола склеры и размещения контактной поверхности 145 центральной части 144 в контакте с наружной поверхностью склеры (например, склеры 20 глаза 10 на фиг. 1). Дистальный наконечник микроиглы 140 может быть перемещен далее в направлении к ближнему концу относительно глазной ткани для образования связи по текучей среде просвета 141 микроиглы 140 с супрахориоидальным пространством (например, супрахориоидальным пространством 36 глаза 10 на фиг. 1, или области R1 на фиг. 5). При наличии связи по текучей среде просвета 141 микроиглы 140 с супрахориоидальным пространством приводной шток 120 может быть перемещен относительно контейнера 130 для лекарственного средства из его первого положения в его второе положение. При образовании по существу уплотнения по текучей среде (то есть, по существу герметичного уплотнения) дистальной концевой частью 124 приводного штока 120 с внутренней поверхностью контейнера 130 для лекарственного средства, перемещение приводного штока 120 в его второе положение проталкивает состав препарата (размещенного во внутреннем объеме контейнера 130 для лекарственного средства) через просвет 141 микроиглы 140. Таким образом, медицинский инъектор 100 способен доставить состав М препарата в супрахориоидальное пространство глаза и состав препарата может течь внутри супрахориоидального пространства для доставки, например, в заднюю область глаза.
[1059] Контейнер 130 для лекарственного средства выполнен с возможностью содержать лекарственное средство М, обладающее высокой вязкостью (то есть, лекарственное средство, обладающее вязкостью по меньшей мере в 100 сантипуаз). Лекарственное средство М может быть любым лекарственным средством, подходящим для инъекции в тело, таким как любое из рассмотренных в настоящем описании лекарственных средств или других терапевтических рецептур (включая биолекарственные средства, клетки и т.п.). Например, в определенных вариантах реализации настоящего изобретения лекарственное средство M может быть субстанцией высокой вязкости для лечения глаз (например, гелеподобной субстанцией, подобной пасте субстанцией, эмульсией, содержащей и жидкий компонент и твердый компонент и т.п.). В определенных вариантах реализации настоящего изобретения лекарственное средство M может иметь вязкость, составляющую по меньшей мере примерно 1000 сантипуаз. В определенных вариантах реализации настоящего изобретения лекарственное средство M может иметь вязкость, составляющую по меньшей мере примерно 10000 сантипуаз. В других вариантах реализации настоящего изобретения лекарственное средство M может иметь вязкость, составляющую по меньшей мере 100000 сантипуаз. В других вариантах реализации настоящего изобретения лекарственное средство M может иметь вязкость, составляющую от примерно 40000 сантипуаз до примерно 60000 сантипуаз. Как описано выше, количество кинетической энергии, необходимое для перемещения приводного штока 120 внутри контейнера 130 для лекарственного средства, зависит, среди прочего, от вязкости лекарственного средства M, необходимой мощности потока лекарственного средства M через дистальную концевую часть 142 микроиглы 140, длины микроиглы 140 и/или размера просвета 141, определенного иглой 140. Одно преимущество настоящего изобретения состоит в способности уменьшить длину дальней части 142 микроиглы 140, что, в свою очередь, сильно уменьшает потери на трение. При этом оператор системы 100 может ввести лекарственное средство M посредством уменьшенной величины силы F.
[1060] На фиг. 6 показан вид в поперечном сечении микроиглы 240 согласно варианту реализации настоящего изобретения. Микроигла 240 содержит проксимальную концевую часть 243, дистальную концевую часть 242, центральную часть 244 и образует просвет 241 при прохождении через них. Хотя показан тупой конец, дистальная концевая часть 242 микроиглы 240 может образовать острый наконечник и/или скошенную кромку таким образом, что игла 240 способна проколоть целевое местоположение. Центральная часть 244 микроиглы 240 размещена между проксимальной концевой частью 243 иглы 240 и дистальной концевой частью 242 иглы 240. Центральная часть 244 представляет собой переходную область между проксимальной концевой частью 243 иглы и дистальной концевой частью 242 иглы. Центральная часть 244 может быть подобна конической форме, как показано на фиг. 6, и содержать контактную поверхность 245. Контактная поверхность 245 центральной части выполнена с возможностью контакта с глазом. Таким образом, контактная поверхность 245 может управлять глубиной проникновения дистальной концевой части 242и/или может формировать уплотнение по текучей среде с поверхностью глаза.
[1061] Микроигла 240 образует просвет 241. Просвет 241 микроиглы 240 может иметь любой подходящий размер или диаметр. Точнее, часть просвета внутри проксимальной концевой части 243 обладает первым диаметром d1, а часть просвета 241 внутри дистальной концевой части 242 обладает вторым диаметром d2, меньшим первого диаметра. Другими словами, микроигла 240 имеет изменяемый в пространстве внутренний диаметр. Типичный диапазон значений диаметра для d1 составляет от 0,072 дюйма (размер иглы калибра 15) до 0,083 дюйма (размер иглы калибра 14). В определенных вариантах реализации настоящего изобретения диаметр d1 может иметь любое значение, большее чем примерно 0,072 дюйма (размер иглы калибра 15). В других вариантах реализации настоящего изобретения диаметр d1 может иметь любое значение, большее чем примерно 0,03575 дюйма (размер иглы калибра 20). В других вариантах реализации настоящего изобретения диаметр d1 может иметь любое значение, больше чем примерно 0,01625 дюйма (размер иглы калибра 27). Значения диаметра d2 могут составлять от примерно 0,00825 дюйма (размер иглы калибра 33) до 0,01225 дюйма (размер иглы калибра 30). В определенных вариантах реализации настоящего изобретения диаметр d2 может иметь любое значение, меньше чем примерно 0,01225 дюйма (размер иглы калибра 30). Однако, в определенных вариантах реализации настоящего изобретения диаметр d2 может иметь любое значение, меньшее чем примерно 0,01625 дюйма (размер иглы калибра 27). Таким образом, длина части с меньшим значением диаметра (то есть, дистальной концевой части 242) может быть сведена к минимуму для уменьшения потерь на трение, связанных с передачей лекарственного средства через микроиглу 240.
[1062] Часть просвета внутри проксимальной концевой части 243 обладает длиной L1, а часть просвета 241 внутри дистальной концевой части 242 обладает второй длиной L2, которая меньше первой длины. Длина L1 проксимальной концевой части 243 микроиглы 240 может составлять примерно 0,300 дюйма. Длина L2 дистальной концевой части 242 микроиглы 240 может составлять примерно 0,650 дюйма. В других вариантах реализации настоящего изобретения длина дистальной концевой части может иметь любое подходящее значение для облегчения нацеленной инъекции в определенную область, когда промежуточная (или центральная) часть 245 контактирует с тканью-мишенью. Например, в определенных вариантах реализации настоящего изобретения длина L2 дистальной концевой части 242 микроиглы 240 (или любой из рассмотренных в настоящем описании игл) может составлять от примерно 200 микрон до примерно 1500 микрон. В других вариантах реализации настоящего изобретения длина L2 дистальной концевой части 242 микроиглы 240 (или любой из рассмотренных в настоящем описании игл) может составлять от примерно 900 микрон до примерно 1100 микрон. Посредством уменьшения длины части микроиглы 240 с малым диаметром может быть сведено к минимуму требование к величине силы, необходимой для выполнения необходимой инъекции.
[1063] В дополнение к уменьшению потерь на трение уменьшенная длина части с меньшим значением диаметра также улучшает механическую целостность микроиглы. В частности, уменьшенная длина L2 может увеличить прочность на продольный изгиб дистальной концевой части 242. Это, в свою очередь, обеспечивает возможность уменьшения толщины стенок дистальной концевой части 242.
[1064] Рассмотренные в настоящем описании иглы 140 и 240 могут быть использованы вместе с разъемом иглы и инъектором. Например, любая из рассмотренных в настоящем описании игл может быть использована вместе с любым из устройств, показанных и описанных в заявке на международный патент № PCT/US2015/036299, поданной 17 июня 2015 г. под названием «Способы и устройства для лечения заболеваний задней части глаза», содержание которой полностью включено в настоящую заявку посредством ссылки. Кроме того, на фиг. 7 показан перспективный вид медицинского инъектора 300, выполненного с возможностью использования с рассмотренными в настоящем описании иглами согласно варианту реализации настоящего изобретения. Медицинский инъектор 300 содержит ручку 350, контейнер 330 для лекарственного средства, привод 320 (показан на фиг. 8) и узел 360 иглы. Узел 360 иглы содержит разъем 370 иглы и иглу 340. Игла 340 может быть выполнена как микроигла. Медицинский инъектор 300 может быть выполнен с возможностью доставки лекарственного средства в область и/или слой целевого местоположения, например, в глаз пациента (например, в супрахориоидальное пространство глаза), как рассмотрено в настоящем описании.
[1065] На фиг. 8 показан в разобранном виде медицинский инъектор по фиг. 7 в конфигурации, где медицинский инъектор не прикреплен к узлу иглы, согласно варианту реализации настоящего изобретения. Ручка 350 содержит первую часть 352 и вторую часть 354, которые могут быть соединены вместе для образования внутренней области для размещения, по меньшей мере части, контейнера 330 для лекарственного средства и/или привода 320. Первая часть 352 и вторая часть 354 ручки 350 могут быть сменным образом или устойчиво соединены вместе посредством использования любых подходящих средств, например, винтов, гаек, болтов, заклепок, клея, защелок, вырезок, канавок, выемок, пружинной защелки, замка или любого другого подходящего приспособления для связи. Ручка 350 содержит часть 356 захвата. Множество выступов (например, ребер) расположено на части 356 захвата, что позволяет пользователю легко захватывать ручку 350, например, между указательным пальцем и/или средним пальцем и большим пальцем. В определенных вариантах реализации настоящего изобретения множество гребней 332 размещено на наружной поверхности контейнера 330 для лекарственного средства. Гребни 332 могут предоставить пользователю дополнительную захватную поверхность для надежного удержания ручки 350. Например, пользователь может захватить часть 356 захвата первой рукой и захватить гребни 332 второй рукой для ограничения любого нежелательного перемещения ручки 350 и для большего контроля во время инъекции лекарственного средства, размещенного в контейнере 330 для лекарственного средства.
[1066] Первая часть 352 и/или вторая часть 354 ручки содержат, в своей внутренней области, часть 358 для зацепления с приводом. Часть 358 для зацепления с приводом выполнена с возможностью установки и/или сохранения части 326 для зацепления ручки привода 320, так что линейное перемещение ручки 350 вдоль продольной оси медицинского инъектора 300 заcтавляет привод 320 также выполнить перемещение вдоль продольной оси относительно контейнера 330 для лекарственного средства. Другими словами, пользователь может использовать ручку 350 для приведения в действие привода 320.
[1067] Привод 320 содержит часть 326 для зацепления ручки и плунжерную часть 327, подвижно размещенную во внутреннем объеме, определенном контейнером 330 для лекарственного средства. По меньшей мере часть привода 320 размещена с возможностью скольжения во внутреннем объеме, определенном контейнером 330 для лекарственного средства. Таким образом, привод 320 может быть перемещен во внутреннем объеме, определенном контейнером 330 для лекарственного средства, для втягивания лекарственного средства во внутренний объем и/или выталкивания лекарственного средства из внутреннего объема, определенного контейнером 330 для лекарственного средства. Как обсуждено выше, часть 326 для зацепления ручки привода 320 может быть жестко соединена с ручкой 350. Таким образом, любое линейное смещение ручки 350 вдоль продольной оси медицинского инъектора 300 также заставляет привод 320 скользить во внутреннем объеме контейнера 330 для лекарственного средства.
[1068] Часть 326 для зацепления ручки привода 320 может быть выполнена с любым подходящими размером, формой или конфигурацией. Например, как показано на фиг. 8, часть 326 для зацепления ручки может иметь отверстие, выполненное с возможностью получения, по меньшей мере части, части 358 для зацепления с приводом ручки. Таким образом, ручка 350 и часть привода 320 могут быть жестко и функционально соединены друг с другом и, таким образом, все вместе выполнены с возможностью передачи силы контейнеру 330 для лекарственного средства таким образом, что текучая среда может быть передана из контейнера 330 для лекарственного средства, как подробно рассмотрено в настоящем описании.
[1069] Плунжерная часть 327 привода может быть соединена и/или быть в контакте с поршнем 328, который имеет связь по текучей среде с субстанцией (например, с лекарственным средством, таким как, например, фактор роста эндотелия сосудов (VEGF), ингибитор фактора роста эндотелия сосудов (VEGF inhibitor), их комбинацией или любым другим рассмотренным в настоящем описании лекарственным средством), размещенной во внутреннем объеме, определенном контейнером 330 для лекарственного средства. Плунжерная часть 327 привода выполнена с возможностью перемещения во внутреннем объеме, определенном контейнером 330 для лекарственного средства, например, вследствие силы, приложенной пользователем, как рассмотрено в настоящем описании. Таким образом, привод 320 способен перемещать поршень 328 внутри контейнера для лекарственного средства для всасывания или выталкивания субстанции М из дистального наконечника иглы 340, как рассмотрено в настоящем описании. Боковые стенки поршня 328 могут быть выполнены с возможностью контакта с боковыми стенками контейнера 330 для лекарственного средства таким образом, что поршень 328 образует по существу непроницаемое для текучей среды уплотнение с боковой стенкой контейнера 330 для лекарственного средства, например, для предотвращения утечки субстанции M. Поршень 328 может быть выполнен из инертного и/или биологически совместимого материала, который негибкий, но мягкий. Взятые в качестве примера материалы включают резину, силикон, пластмассу, полимеры, любой другой подходящий материал или их комбинацию. В определенных вариантах реализации настоящего изобретения поршень 328 может быть монолитно сформирован с приводом 320. Кроме того, поршень 328 может иметь размер, форму и/или может быть выполнен из определенного материала таким образом, что перемещение привода 320 и/или поршня внутри контейнера 330 для лекарственного средства ограничено при приложении силы ниже заранее определенного порогового значения. Таким образом, поршень 328 и привод 320 вместе со всем медицинским инъектором 300 (например, контейнером для лекарственного средства, подлежащей инъекции субстанции т.п.) выполнены таким образом, что приложенная сила может быть достаточной для введения лекарственного средства при размещении дистальной концевой части иглы в первой области ткани-мишени (например, в супрахориоидальном пространстве), но недостаточной для введения лекарственного средства при размещении дистальной концевой части иглы во второй области ткани-мишени.
[1070] Контейнер 330 для лекарственного средства образует внутренний объем, выполненный с возможностью размещения лекарственного средства (например, ацетонида триамцинолона, фактора роста эндотелия сосудов, ингибитора фактора роста эндотелия сосудов, или любого другого рассмотренного в настоящем описании лекарственного средства). Контейнер 330 для лекарственного средства содержит доставочную часть 334. Доставочная часть 334 содержит нити 336 резьбы для соединения доставочной части с узлом 360 иглы. Хотя она показана в виде нитей 336 резьбы, доставочная часть 334 может содержать любой подходящий соединительный элемент, предназначенный для соединения доставочной части с разъемом 370 иглы, например, соединители Люэра, защелкиваемый разъем, пружинную защелку, замок, фрикционную посадку или любые другие подходящие соединительные элементы. Контейнер для лекарственного средства может быть тем же самым или подобен любому из контейнеров для лекарственного средства, описанных в заявке на патент США № 14/268687, поданной 2 мая 2014 г. под названием «Устройство и способы для офтальмологической инъекции», содержание которой полностью включено в настоящую заявку посредством ссылки.
[1071] Как показано на фиг. 9-10, разъем 370 иглы содержит часть 371 зацепления, соединительную часть 372 и доставочную часть 373. Внешняя боковая стенка части 371 зацепления и внутренняя боковая стенка соединительной части 372 определяют выемку 374, выполненную с возможностью размещения доставочной части 334 контейнера 330 для лекарственного средства. Внутренняя боковая стенка соединительной части 372 содержит резьбу 375, выполненную с возможностью зацепления с резьбой 336 контейнера 330 для лекарственного средства и, таким образом, соединения разъема 370 иглы с контейнером 330 для лекарственного средства. Внешняя боковая стенка соединительной части 372 содержит ряд гребней 376. Гребни 376 могут облегчить пользователю захват разъема 370 иглы, например, для соединения или рассоединения разъема 370 иглы с контейнером 330 для лекарственного средства. Часть 371 зацепления образует первый канал 377 для текучей среды, выполненный с возможностью сцепления с каналом для текучей среды контейнера 330 для лекарственного средства и установления связи по текучей среде между контейнером 330 для лекарственного средства и разъемом 370 иглы. Доставочная часть 373 образует второй канал 378 для текучей среды, выполненный с возможностью съемного размещения иглы 340, например, микроиглы (например, любой рассмотренной в настоящем описании подходящей микроиглы). Игла 340 выполнена с возможностью размещения внутри ткани-мишени, например, глазной ткани и образует просвет 341, так что игла 340 выполнена с возможностью установления связи по текучей среде между контейнером 330 для лекарственного средства и частью тела пользователя (например, глазом). В определенных вариантах реализации настоящего изобретения игла 340 может быть жестко расположена во втором канале 378 текучей среды. В определенных вариантах реализации настоящего изобретения игла 340 может быть монолитно выполнена с разъемом 370 иглы таким образом, что второй канал 378 для текучей среды и просвет иглы 341 могут быть сформированными непрерывно и/или бесшовно.
[1072] Игла 340 содержит проксимальную концевую часть 343, дистальную концевую часть 342 и центральную часть 344 и образует просвет 341 в них. Хотя показано, что скошенная дистальная концевая поверхность имеет острый наконечник, в качестве альтернативы дистальная концевая часть 342 иглы 340 может иметь тупой конец. Центральная часть 344 иглы 340 размещена между проксимальной концевой частью 343 иглы 340 и дистальной концевой частью 342 иглы 340. Центральная часть 344 служит переходной областью между проксимальной концевой частью 343 иглы и дистальной концевой частью 342 иглы. Центральная часть 344 может быть подобна конической форме, показанной на фиг. 6. В определенных вариантах реализации настоящего изобретения игла 340 может обладать длиной, достаточной для включения в центральную часть 344 контактной поверхности (не показана), выполненной с возможностью контактирования с глазом. Длина дистальной концевой части 342, выходящей за пределы дистальной концевой поверхности 381 разъема 370 иглы, может быть любой подходящей длиной, например, примерно 900 микронов. Таким образом, контактная поверхность может управлять глубиной проникновения дистальной концевой части и/или может образовать уплотнение по текучей среде с поверхностью глаза.
[1073] Игла 340 образует просвет 341. Просвет 341 иглы 340 может иметь любой подходящий размер или диаметр. Точнее, часть просвета внутри проксимальной концевой части 343 имеет первый диаметр, а часть просвета 341 внутри дистальной концевой части 342 имеет второй диаметр, меньший первого диаметра. Другими словами, игла 340 имеет изменяемый в пространстве внутренний диаметр. Типичный диапазон значений первого диаметра составляет от примерно 0,072 дюйма (размер иглы калибра 15) до примерно 0,083 дюйма (размер иглы калибра 14). В определенных вариантах реализации настоящего изобретения первый диаметр может иметь любое значение, большее чем примерно 0,072 дюйма (размер иглы калибра 15). В других вариантах реализации настоящего изобретения первый диаметр может иметь любое значение, большее чем примерно 0,03575 дюйма (размер иглы калибра 20). В других вариантах реализации настоящего изобретения первый диаметр может иметь любое значение, большее чем примерно 0,01625 дюйма (размер иглы калибра 27). Значения второго диаметра могут составлять от примерно 0,00825 дюйма (размера иглы калибра 33) до 0,01225 дюйма (размер иглы калибра 30). В определенных вариантах реализации настоящего изобретения второй диаметр может иметь любое значение, меньшее чем примерно 0,01225 дюйма (размер иглы калибра 30). Однако, в определенных вариантах реализации настоящего изобретения второй диаметр может иметь любое значение, меньшее чем примерно 0,01625 дюйма (размер иглы калибра 27). Таким образом, длина части с меньшим значением диаметра (то есть, дистальной концевой части) может быть сведена к минимуму для уменьшения потерь на трение, связанных с передачей лекарственного средства через микроиглу 340.
[1074] Часть просвета внутри проксимальной концевой части 343 имеет первую длину, а часть просвета 341 внутри дистальной концевой части 342 имеет вторю длину, которая меньше первой длины. Первая длина проксимальной концевой части 343 иглы 340 может составлять примерно 0,300 дюйма. Вторая длина дистальной концевой части 342 иглы 340 может составлять примерно 0,650 дюйма. В других вариантах реализации настоящего изобретения длина дистальной концевой части может иметь любое подходящее значение для облегчения направленной инъекции в определенную область, когда промежуточная (или центральная) часть иглы контактирует с тканью-мишенью. Например, в определенных вариантах реализации настоящего изобретения длина дистальной концевой части 342 микроиглы 340 (или любой из рассмотренных в настоящем описании игл), может составлять от примерно 200 микрон до примерно 1500 микрон. В других вариантах реализации настоящего изобретения длина дистальной концевой части 342 микроиглы 340 (или любой из рассмотренных в настоящем описании игл), может составлять от примерно 900 микрон до примерно 1100 микрон. Посредством уменьшения длины части иглы 340 с малым диаметром может быть сведено к минимуму требование к величине силы, необходимой для выполнения необходимой инъекции.
[1075] В дополнение к уменьшению потерь на трение посредством уменьшения длины части с уменьшенным диаметром эта уменьшенная длина части с меньшим значением диаметра также улучшает механическую целостность микроиглы. В частности, уменьшенная вторая длина способна увеличить прочность на продольный изгиб дистальной концевой части 342. Это, в свою очередь, обеспечивает возможность уменьшения толщины стенок дистальной концевой части 342.
[1076] Как показано на фиг. 10, разъем 370 иглы выполнен с возможностью физического соединения и соединения по текучей среде с иглой 340 таким образом, что между ними образован путь потока текучей среды. Например, просвет 341 иглы 340 имеет связь по текучей среде с первым каналом 377 текучей среды и вторым каналом 378 текучей среды разъема 370 иглы при физической связи и связи по текучей среде иглы 340 внутри второго канала 378 текучей среды. Дистальная концевая часть 342 иглы 340 проходит в дистальном направлении от дистальной концевой поверхности 381 разъема 370 иглы. Разъем 370 иглы может иметь любую подходящую форму, размер и/или конфигурацию. Например, в определенных вариантах реализации настоящего изобретения разъем 370 иглы способен определить внутренний объем, который способен вмещать, хранить или иным образом содержать терапевтическое средство. В других вариантах реализации настоящего изобретения разъем 370 иглы может быть выполнен с возможностью получения картриджа (не показан), содержащего состав медикамента (например, профилактическое средство, терапевтическое средство и/или диагностическое средство). Дистальная концевая поверхность 381 разъема 370 иглы может быть по существу выпуклой или искривленной, что позволяет дистальной концевой поверхности соответствовать ткани-мишени (например, глазной ткани). Кроме того, дистальная концевая поверхность 381 может иметь уплотнительную поверхность, выполненную с возможностью образования по существу герметичного уплотнения по текучей среде с тканью-мишенью, например, глазной тканью (например, конъюнктивой или склерой), при давлении дистальной концевой поверхности 381 разъема 370 иглы на глазную ткань (например, конъюнктиву или склеру), как рассмотрено в настоящем описании. Дистальная концевая поверхность разъема иглы может включать уплотнительную часть, выполненную с возможностью образования по существу непроницаемого для текучей среды уплотнения с целевой поверхностью. Уплотнительная часть может окружить центральную линию иглы. Хотя показано использование разъема 370 иглы, устройство может содержать любой подходящий твердый разъем иглы. Разъем 370 иглы может быть выполнен из относительно твердого материала, такого как металл или твердый пластик. Разъем 370 иглы может быть тем же самым или аналогичным любому из разъемов, описанных в заявке на патент США № 14/268687, поданной 2 мая 2014 г. под названием «Устройство и способы офтальмологической инъекции», содержание которой полностью включено в настоящую заявку посредством ссылки.
[1077] Разъем 370 иглы может быть сформирован в виде монолитной структуры, как показано на фиг. 10. В качестве альтернативы в определенных вариантах реализации настоящего изобретения разъем иглы может быть сформирован из отдельных частей, соединенных вместе с образованием разъема 370 иглы. Например, на фиг. 11A-11C показан узел 460 иглы согласно варианту реализации настоящего изобретения. На фиг. 11A показан в разобранном виде узел 460 иглы. Узел 460 иглы содержит разъем 470 иглы и иглу 440. Разъем 470 иглы содержит первую часть 479 и вторую часть 480. Первая часть 479 и вторая часть 480 могут быть выполнены по отдельности и соединены вместе. Первая часть 479 и вторая часть 480 могут быть соединены вместе посредством сварки, клея или любых других подходящих средств. Как показано на фиг. 11A, вторая часть 480 может быть надежно прикреплена к игле 440 до соединения с первой частью 479. Игла 440 может быть выполнена в виде канюли переменного диаметра, как описано со ссылками на иглы 140, 240 и 340 выше.
[1078] На фиг. 11B показан вид сбоку узла 460 иглы в собранной конфигурации, где первая часть 479 соединена со второй частью 480. Разъем 470 иглы имеет дистальную концевую поверхность 481, которая выполнена с возможностью контакта с целевой поверхностью ткани-мишени. Ткань-мишень может быть, например, глазом, а целевая поверхность может быть, например, конъюнктивой глаза или склерой глаза. Дистальная концевая поверхность разъема иглы может иметь уплотненительную часть, выполненную с возможностью образования по существу непроницаемого для текучей среды уплотнения с целевой поверхностью. Уплотнительная часть может окружать центральную линию иглы 440.
[1079] На фиг. 11C показан вид в поперечном сечении узла 460 иглы, взятый вдоль линии C-C на фиг. 11B. Первая часть 479 разъема 470 иглы может включать резьбу 475 для соединения узла 460 иглы с контейнером для лекарственного средства. Хотя показана резьба 475, разъем 470 иглы может содержать любой подходящий соединительный элемент, выполненный с возможностью соединения разъема 470 иглы с контейнером для лекарственного средства, например, соединитель Люэра, защелкиваемый разъем, пружинную защелку, замок, фрикционную посадку или любые другие подходящие соединительные элементы.
[1080] Игла 440 может представлять собой любую рассмотренную в настоящем описании подходящую иглу, например, микроиглу (например, калибра 27, калибра 30 или еще меньшую иглу). Игла 440 может иметь многие различные значения диаметра. Кроме того, игла 440 может иметь любую подходящую длину, например, фиксированную длину, составляющую примерно 900 мкм или примерно 1100 мкм, или любое промежуточное значение. Дополнительно, длины дистальной концевой части 442 и проксимальной концевой части 443 могут быть любой подходящей длиной. Например, при внутреннем диаметре дистальной концевой части 442 калибра 30 или меньше длина дистальной концевой части 442 может быть такова, что передача лекарственного средства через просвет 441 происходит при величине силы, приложенной к приводному штоку, меньшей чем примерно 6 Н. Дополнительно, длина дистальной концевой части 442 иглы 440 может быть меньше полной длины иглы 440. Аналогичным образом, та длина, на которую дистальная концевая часть 442 проходит за пределы дистальной концевой поверхности 481 разъема 470 иглы, может быть любой подходящей длиной, например, составлять примерно 900 микронов. Дистальный наконечник иглы 440 может определять острый и/или скошенный наконечник таким образом, что игла 440 выполнена с возможностью прокола целевого местоположения, например, ткани тела (например, глазной ткани). Таким образом, дистальный наконечник может быть расположен в первой области и/или второй области целевого местоположения, как рассмотрено в настоящем описании. Игла 440 образует просвет 441, выполненный с возможностью связи по текучей среде с субстанцией, размещенной во внутреннем объеме, определенном контейнером для лекарственного средства и/или во внутреннем объеме 482, определенном разъемом 470 иглы. Таким образом, игла 440 выполнена с возможностью установления связи по текучей среде между контейнером для лекарственного средства и целевым местоположением, например, первой областью целевого местоположения, как рассмотрено в настоящем описании. В определенных вариантах реализации настоящего изобретения первая область целевого местоположения может иметь первую плотность, а вторая область может иметь вторую плотность, которая больше первой плотности. В определенных вариантах реализации настоящего изобретения первая область целевого местоположения вырабатывает первое значение противодавления на дистальный наконечник иглы, а вторая область вырабатывает второе значение противодавления на дистальный наконечник иглы, которое больше первого значения противодавления. Другими словами, первая область целевого местоположения вырабатывает первое давление, которое оказывает сопротивление и/или противостоит потоку из дистального наконечника иглы, а вторая область вырабатывает второе давление, которое оказывает сопротивление и/или противостоит потоку из дистального наконечника иглы, которое больше первого давления. В определенных вариантах реализации настоящего изобретения целевое местоположение может быть глазом, так что первая область представляет собой супрахориоидальное пространство глаза, а вторая область представляет собой склеру глаза.
[1081] Хотя показана неподвижная игла, в определенных вариантах реализации настоящего изобретения, таких как варианты реализации, показанные на фиг. 12-17, узел иглы может выполнять перемещение относительно контейнера для лекарственного средства для получения переменной длины иглы. В определенных вариантах реализации настоящего изобретения устройство для инъекции лекарственного средства в ткань-мишень может содержать медицинский инъектор и разъем иглы со сжимаемым элементом, расположенным между ними. Сжимаемый элемент выполнен с возможностью сжатия и/или деформации в качестве реакции на приложение силы для обеспечения возможности регулировки длины иглы. Другими словами, сжимаемый элемент может быть деформирован для обеспечения возможности прохождения длины иглы в дистальном направлении от регулируемого разъема иглы. Это устройство может, например, обеспечивать возможность регулировки расстояния, на которое игла проникает в ткань-мишень (то есть, глубины введения иглы), например, в глазную ткань. Обратимся теперь к фиг. 12-15. Устройство 500 содержит медицинский инъектор 510, разъем 570 иглы и сжимаемый элемент 578. Медицинский инъектор 510 содержит приводной шток 520, контейнер 530 для лекарственного средства и иглу 540. Хотя показано, что устройство содержит медицинский инъектор 510, устройство 500 может содержать любой другой подходящий медицинский инъектор. Примеры медицинских инъекторов, которые могут быть использованы в устройстве 500, описаны в заявке на патент США № 14/268687, теперь в патентной публикации США № 2015/0038905 (также упомянутой в настоящем описании как «заявка ʹ687»), поданной 02 мая 2014 г. под названием «Устройство и способы офтальмологической инъекции», содержание которой полностью включено в настоящую заявку посредством ссылки.
[1082] Игла 540 может быть любым подходящим пункционным элементом, выполненным с возможностью пункции ткани-мишени типов, показанных и рассмотренных в настоящем описании. Например, игла 540 может быть микроиглой, выполненной с возможностью пункции глазной ткани. В определенных вариантах реализации настоящего изобретения игла 540 может быть микроиглой калибра 30, микроиглой калибра 32 или микроиглой калибра 34 (или иметь размер внутри диапазона от примерно калибра 30 до примерно калибра 34). В определенных вариантах реализации настоящего изобретения такая микроигла может быть по существу подобной или аналогичной пункционным элементам и микроиглам, описанным в «заявке ʹ009 PCT», включенной в настоящую заявку посредством ссылки выше. В определенных вариантах реализации настоящего изобретения форма и/или размер иглы 540 могут соответствовать, по меньшей мере частично, по меньшей мере части ткани-мишени. Например, в определенных вариантах реализации настоящего изобретения, длина иглы 540 может соответствовать толщине части глазной ткани таким образом, что при введении иглы 540 в глазную ткань по меньшей мере часть иглы 540 будет размещена внутри склеры или супрахориоидального пространства глаза, как в подробностях рассмотрено в настоящем описании. Кроме того, как рассмотрено в настоящем описании, подвергаемая воздействию длина иглы может быть отрегулирована. Игла 540 образует просвет 541, который проходит через проксимальный конец 543 и дистальный конец 542 иглы 540. Дистальный конец 542 иглы 540 может содержать скошенную кромку или заточенный наконечник, выполненные с возможностью пункции ткани-мишени. По меньшей мере часть проксимального конца 543 иглы 540 может быть расположена в первом канале 576, определенном разъемом 570 иглы, и во втором канале 579, определенном сжимаемым элементом 578, как рассмотрено в настоящем описании.
[1083] Контейнер 530 для лекарственного средства медицинского инъектора 510 имеет проксимальную концевую часть 532 и дистальную концевую часть 534. Контейнер 530 для лекарственного средства образует внутренний объем 536, который может хранить, вмещать и/или иным образом содержать субстанцию (например, лекарственное средство, профилактическое средство, терапевтическое средство и/или диагностическое средство). Например, в определенных вариантах реализации настоящего изобретения картридж или что-то подобное, содержащее состав препарата или лекарственное средство (например, фактор роста эндотелия сосудов, ингибитор фактора роста эндотелия сосудов, ацетонид триамцинолона, любое другое рассмотренное в настоящем описании лекарственное средство или их комбинацию), может быть расположено в пределах внутреннего объема 536 контейнера 530 для лекарственного средства. В других вариантах реализации настоящего изобретения состав препарата может быть расположен непосредственно в пределах внутреннего объема 536 (например, без картриджа или другого промежуточного резервуара). В определенных вариантах реализации настоящего изобретения внутренний объем 536 может содержать состав препарата с объемом, составляющим примерно 0,5 мл или меньше. В других вариантах реализации настоящего изобретения внутренний объем 536 может содержать состав препарата с объемом, составляющим примерно 0,1 мл. В других вариантах реализации настоящего изобретения внутренний объем 536 может содержать состав препарата с объемом, превышающим примерно 0,5 мл. В определенных вариантах реализации настоящего изобретения контейнер 530 для лекарственного средства может быть по существу подобным любому контейнеру для лекарственного средства, описанному в заявке ʹ687.
[1084] Проксимальная концевая часть 532 контейнера 530 для лекарственного средства по существу открыта для получения приводного штока 520. Конкретнее, дистальная концевая часть 524 приводного штока 520 расположена в пределах внутреннего объема 536 и может быть перемещена между первым положением (например, ближним положением) и вторым положением (например, дальним положением). Другими словами, дистальная концевая часть 524 приводного штока 520 может переместить расстояние инъекции в пределах внутреннего объема 536. Уплотнительный элемент, такой как, например, поршень или эластомерный элемент, может быть связан с дистальной концевой частью 524 приводного штока 520 и/или перемещен этой частью. Уплотнительный элемент может быть выполнен с возможностью образования фрикционной посадки с одной или большим количеством поверхностей контейнера 530 для лекарственного средства, которые определяют внутренний объем 536. Таким образом, уплотнительный элемент и контейнер 530 для лекарственного средства могут образовать по существу непроницаемое для текучей среды уплотнение, которое по существу изолирует часть внутреннего объема 536, который является дальним по отношению к уплотнительнмоу элементу, от части внутреннего объема 536, который является ближним относительно уплотнительного элемента. Другими словами, контейнер 530 для лекарственного средства и приводной шток 520 образуют по меньшей мере часть шприца.
[1085] Дистальная концевая часть контейнера 530 для лекарственного средства соединена со сжимаемым элементом 578 и разъемом 570 иглы таким образом, что сжимаемый элемент 578 размещен между разъемом 570 иглы и дистальной концевой частью 534 контейнера 530 для лекарственного средства. Как описано более подробно ниже, сжимаемый элемент 578 и разъем 570 иглы могут быть связаны с контейнером 530 для лекарственного средства любым подходящим образом. Например, в определенных вариантах реализации настоящего изобретения сжимаемый элемент 578 и/или разъем 570 иглы могут представлять собой единый узел, содержащий фиксатор Люэра, выполненный с возможностью связи с соответствующей клиновидной частью контейнера 530 для лекарственного средства (который может быть, например, предварительно заполненным шприцем). В других вариантах реализации настоящего изобретения сжимаемый элемент 578 и разъем 570 иглы могут быть выполнены отдельно и/или по-отдельности связаны с контейнером для лекарственного средства клеем, резьбовым соединением или любым другим подходящим приспособлением.
[1086] Разъем 570 иглы образует первый канал 576, выполненный с возможностью получения через него иглы 540 таким образом, что дистальный конец 542 иглы походит по существу на длину первого канала 576, и может проходить мимо дистальной концевой поверхности 575 разъема 570 иглы. Дистальная концевая поверхность 575 разъема 570 иглы может быть по существу выпуклой или искривленной, что позволяет дистальной концевой поверхности соответствовать ткани-мишени (например, глазной ткани). Кроме того, дистальная концевая поверхность 575 может определять уплотнительную поверхность, выполненную с возможностью образования по существу герметичного уплотнения по текучей среде с тканью-мишенью, например, глазной тканью (например, конъюнктивой), при давлении дистальной концевой поверхности 575 разъема 570 иглы на глазную ткань (например, конъюнктиву), как рассмотрено в настоящем описании. Уплотнительная поверхность 575 может окружить центральную линию иглы 540. Хотя показано использование разъема 570 иглы, устройство 500 может содержать любой подходящий твердый разъем иглы. Примеры разъемов иглы, которые могут быть использованы с устройством 500, описаны в Заявке ʹ687. Разъем 570 иглы может быть выполнен из относительно твердого материала, такого как метал или твердый пластик.
[1087] Сжимаемый элемент 578 размещен между контейнером 530 для лекарственного средства и разъемом 570 иглы и выполнен с возможностью сжатия. Другими словами, сжимаемый элемент 578 выполнен и/или сконструирован для уменьшения толщины в качестве реакции на силу, прилагаемую к медицинскому инъектору 510, и противоположную силу, прилагаемую к разъему 570 иглы, как рассмотрено в настоящем описании. Сжимаемый элемент 578 образует второй канал 579, выполненный с возможностью получения по меньшей мере проксимальной концевой части 543 иглы 540. Второй канал 579 сжимаемого элемента 578 находится в связи с первым каналом 576 разъема 570 иглы и/или ориентирован с ним таким образом, что игла 540 проходит через первый канал 576 и второй канал 579. Сжимаемый элемент 578 может быть выполнен из по-существу сжимаемого материала, такого как, например, резина, силикон, гидрогели, гели-золи, пена, губка, аэрогели, нелинейный упругий материал, любой другой сжимаемый материал или их комбинация. В определенных вариантах реализации настоящего изобретения сжимаемый элемент 578 может содержать пружину, такую как, например, спиральную пружину, пружину сжатия, растяжения, с пружинной шайбой, с тарельчатой шайбой, коническую пружину, любой другой тип пружины или любой другой подходящий смещающий элемент. Дистальная концевая часть 542 иглы порходит в дистальном направлении от дистальной концевой поверхности 575 разъема 570 иглы на первую длину, когда сжимаемый элемент 578 обладает первой толщиной, и на вторую длину, когда сжимаемый элемент 578 обладает второй толщиной. Вторая длина может составлять от примерно 900 микрон до примерно 1100 микрон.
[1088] В определенных вариантах реализации настоящего изобретения максимальное уменьшение толщины, которое сжимаемый элемент 578 способен претерпеть в качестве реакции на заранее определенную силу (например, в диапазоне от примерно 0,5 Н до примерно 6 Н, и конкретнее в диапазоне от примерно 0,5 Н до примерно 2 Н), приложенную к медицинскому инъектору 510, может быть реализовано с возможностью соответствия максимальной глубине введения дистального конца 542 иглы 540 в ткань-мишень (например, глазную ткань). Например, в определенных вариантах реализации настоящего изобретения, сжимаемый элемент 578 может быть выполнен с возможностью испытать максимальное уменьшение толщины от примерно 900 мкм до примерно 1200 мкм в качестве реакции на силу в диапазоне от примерно 0,5 Н до примерно 6 Н, прилагаемую к проксимальной концевой части 522 приводного штока 520. В других вариантах реализации настоящего изобретения сжимаемый элемент 578 может быть выполнен с возможностью испытать максимальное уменьшение толщины от примерно 900 мкм до примерно 1200 мкм в качестве реакции на силу в диапазоне от примерно 0,5 Н до примерно 2 Н, прилагаемую к проксимальной концевой части 522 приводного штока 520. В других вариантах реализации настоящего изобретения сжимаемый элемент 578 может быть выполнен с возможностью испытать максимальное уменьшение толщины примерно на 300 мкм в качестве реакции на силу в диапазоне меньше, чем примерно 6 Н. Эта деформация и/или уменьшение толщины позволяют разъему 570 иглы выполнять перемещение в проксимальном направлении относительно контейнера 530 для лекарственного средства на расстояние, составляющее от примерно 900 мкм до примерно 1 200 мкм, тем самым, выдвигая дистальный конец 542 иглы 540 от дистальной концевой поверхности 575 разъема 570 иглы на то же самое или аналогичное расстояние. Таким образом можно управлять максимальной глубиной, на которую дистальный конец 542 иглы 540 может быть вставлен в ткань-мишень (например, в глазную ткань), или, иначе, глубиной введения иглы 540. В определенных вариантах реализации настоящего изобретения отношение толщины сжимаемого элемента 578 к глубине введения иглы 540 может быть выполнено таким образом, что дистальный конец 542 иглы 540 может быть введен на необходимую глубину в ткань-мишень (например, внутри или около супрахориоидального пространства глазной ткани), при приложении к медицинскому инъектору 510 заранее определенной силы, например, в диапазоне от примерно 0,5 Н до примерно 6 Н (или точнее, в диапазоне от примерно 0,5 Н до примерно 2 Н), как рассмотрено в настоящем описании.
[1089] Сжимаемый элемент 578 может иметь любую форму или размер. Например, сжимаемый элемент 578 может быть выполнен в форме круглого диска, прямоугольного диска, квадратного диска, кольца, множества частей сжимаемого материала, расположенных между разъемом 570 иглы и контейнером 530 для лекарственного средства, или с любой другой подходящей формой или размером. Сжимаемый элемент 578 может быть связан с дистальной концевой поверхностью контейнера 530 для лекарственного средства любым подходящим приспособлением. В определенных вариантах реализации настоящего изобретения сжимаемый элемент 578 может быть связан с контейнером 530 для лекарственного средства и с разъемом 570 иглы при использовании, например, клея, горячей сварки, присоединения методом сплавления, винтов, гаек, болтов, заклепок и любого другого подходящего приспособления для связи или их комбинации. В других вариантах реализации настоящего изобретения адаптер (например, адаптер Льюэра, хомут и т.п.) или любая другая часть могут быть расположены между разъемом 570 иглы и контейнером 530 для лекарственного средства, и могут функционировать для связи сжимаемого элемента 578 с контейнером 530 для лекарственного средства.
[1090] Как рассмотрено в настоящем описании, устройство 500 может быть использовано для управления глубиной введения дистального конца 542 иглы 540 в ткань-мишень, например, в глазную ткань. Таким образом, устройство 500 может быть использовано для перемещения (или направления перемещения) дистального конца 542 иглы 540 на необходимую глубину в ткани-мишени для обеспечения доставки лекарственного средства к целевому местоположению в ткани-мишени (например, в супрахориоидальное пространство глазной ткани). Например, в определенных вариантах реализации настоящего изобретения устройство 500 может быть выполнено с возможностью доставки лекарственного средства в супрахориоидальное пространство глаза. На фиг. 13 показана часть устройства 500, содержащая разъем 570 иглы и сжимаемый элемент 578 в первой конфигурации. В первой конфигурации дистальная концевая поверхность 575 разъема 570 иглы может быть расположена на конъюнктиве C глаза и в контакте с ней. Как рассмотрено в настоящем описании, разъем 570 иглы выполнен из твердого материала таким образом, что дистальная концевая поверхность 575 выполнена с возможностью образования по существу непроницаемого для текучей среды уплотнения с конъюнктивой C глаза. Кроме того, в первой конфигурации сжимаемый элемент 578 несжат и имеет первую толщину t1. Первая толщина t1 такова, что в первой конфигурации дистальный конец 542 иглы 540 расположен внутри разъема 570 иглы (то есть, дистальный конец 542 иглы 540 не выходит из дистальной концевой поверхности 575 разъема 570 иглы). Таким образом, например, разъем 570 иглы и сжимаемый элемент 578 могут служить приспособлением безопасности для предотвращения случайной пункции или иного удара дальним концом 542 иглы 540 до и после использования.
[1091] Во второй конфигурации, как показано на фиг. 14, сила в направлении, показанном стрелкой F, может быть приложена к устройству 500, например, к проксимальной концевой части 522 приводного штока 520. В качестве альтернативы сила F может быть приложена непосредственно к контейнеру 530 для лекарственного средства. Как показано, сила F может заставить дистальную концевую поверхность 575 разъема 570 иглы нажать на конъюнктиву C. Поскольку разъем 570 иглы представляет собой по существу твердый элемент, жесткость которого существенно больше жесткости конъюнктивы C (например, жесткость, по существу равная жесткости нержавеющей стали), приложение силы F деформирует конъюнктиву C без существенной деформации разъема 570 иглы. Величина силы F может быть недостаточной для вдавливания дистальной концевой поверхности 575 разъема 570 иглы дальше в конъюнктиву C. Например, известно, что практикующие врачи обычно предпочитают ограничивать ручную силу, прилагаемую к глазу, внутри диапазона от примерно 0,5 Н до 6 Н (или точнее, внутри диапазона от примерно 0,5 Н до примерно 2 Н). Таким образом, разъем 570 иглы и сжимаемый элемент 578 могут быть выполнены с возможностью деформации и/или отклика на силу внутри этого диапазона для облегчения нужного проникновения иглы 540. В частности, сила F может быть достаточной для сжатия сжимаемого материала 578 таким образом, что сжимаемый материал 578 испытывает уменьшение толщины с переходом от первой толщины t1 ко второй толщине t2. Это позволяет контейнеру 530 для лекарственного средства и/или игле 540 выполнить перемещение в проксимальном направлении относительно разъема 570 иглы. Это перемещение в проксимальном направлении вынуждает дистальный конец 542 иглы 540 также выполнить перемещение в проксимальном направлении относительно глаза таким образом, что дистальный конец 542 иглы 540 прокалывает конъюнктиву C и размещен в склере S глаза.
[1092] В третьей конфигурации, показанной на фиг. 15, сила F может быть поддержана таким образом, что происходит уменьшение толщины сжимаемого элемента до третьей толщины t3. Это дальнейшее уменьшение толщины сжимаемого элемента 578 обеспечивает возможность проникновения дистального конца 542 иглы 540 далее в глаз, пока дистальный конец 542 не будет размещен в супрахориоидальном пространстве (например, в целевом слое) глаза, но он не проникает далее в глаз (например, в сетчатку R, стекловидное тело или в другие слои). При нахождении устройства 500 в третьей конфигурации лекарственное средство может быть введено в супрахориоидальное пространство или вручную или посредством узла содействия инъекции, примеры которого описаны в Заявке ʹ687. В определенных вариантах реализации настоящего изобретения толщина и/или сжимаемость (или иначе коэффициент жесткости) сжимаемого элемента 578 могут быть такими, что толщина сжимаемого материала 578 не может быть легко уменьшена до толщины, меньшей t3. Таким образом, сжимаемый элемент 578 может управлять глубиной введения дистального конца 542 иглы 542 и/или ограничивать ее, например, в диапазоне от примерно 900 мкм до примерно 1200 мкм. Это расстояние может быть достаточным для обеспечения возможности введения дистального конца 542 иглы 540 в супрахориоидальное пространство глаза, но может предотвратить любое перемещение дистального конца 542 иглы 540 вне супрахориоидального пространства в сетчатку R. Таким образом, сжимаемый элемент 578 может также служить в качестве стопорного механизма для контроля нахождения значения глубины введения дистального наконечника 542 иглы 540 в пределах необходимого диапазона.
[1093] Например, в определенных вариантах реализации настоящего изобретения сжимаемый элемент 578 может быть выполнен из материала (или комбинации материалов) таким образом, что скорость деформации нелинейна. В частности, скорость деформации может быть уменьшена при превышении силой F определенного порогового значения (например, 6 Н), ограничивая, таким образом, дальнейшую деформацию. В определенных вариантах реализации настоящего изобретения, например, сжимаемый элемент 578 может быть сложным изделием, выполненным из слоев различных материалов.
[1094] Хотя разъем 570 иглы описан выше как по существу жесткий (и недеформируемый), в определенных вариантах реализации настоящего изобретения разъем 570 иглы может обладать значением жесткости, промежуточным к жесткости конъюнктивы C и склеры S. В таких вариантах реализации настоящего изобретения приложение силы F может вынудить разъем 570 иглы деформировать конъюнктиву C до тех пор, пока дистальная концевая поверхность 375 разъема 570 иглы не будет рядом со склерой S. Поскольку жесткость разъема 570 иглы меньше жесткости склеры S, дальнейшее приложение силы F вынудит дистальную концевую поверхность 575 разъема 570 иглы претерпеть деформацию без какой-либо существенной деформации склеры S. Таким образом, разъем 570 иглы может препятствовать приложению чрезмерной силы, вызывающей повреждения или иную деформацию и/или прокалывание внутренних слоев глаза.
[1095] Хотя сжимаемый элемент 578 описан выше, как при необходимости выполненный с возможностью ограничения его деформации, в определенных вариантах реализации настоящего изобретения устройство может содержать стопорный механизм, предназначенный для остановки или ограничения иным способом сжатия сжимаемого элемента для образования максимальной глубины введения дистального конца иглы в ткань-мишень. Обратимся теперь к фиг. 16 и 17. Устройство 600 содержит медицинский инъектор 610, иглу 640, разъем 670 иглы, сжимаемый элемент 678 и стопорный механизм 680. Медицинский инъектор 610 содержит контейнер 630 для лекарственного средства и привод (не показан). Медицинский инъектор 610 может быть по существу аналогичен медицинскому инъектору 510 и поэтому не рассмотрен в настоящем описании в подробностях.
[1096] Разъем 670 иглы и сжимаемый элемент 678 могут быть по существу аналогичны разъему 570 иглы и сжимаемому элементу 578, соответственно описанными в связи с устройством 500. Стопорный механизм 680 содержит опору 681 и ряд стопоров 682. Дистальная концевая часть контейнера 630 для лекарственного средства связана с опорой 681 таким образом, что опора 681 размещена между контейнером 630 для лекарственного средства и сжимаемым элементом 678. Опора 681 может быть выполнена из по существу твердого материала, такого как, например, металлы или пластик. В определенных вариантах реализации настоящего изобретения опора 681 может быть жестко соединена с дистальной концевой частью контейнера 630 для лекарственного средства и/или со сжимаемым элементом, например, посредством клея, горячей сварки, присоединения сплавлением, винтами, гайками, болтами, заклепками и тому подобным. В определенных вариантах реализации настоящего изобретения опора 681 может быть монолитно выполнена с контейнером 630 для лекарственного средства. Опора 681 образует отверстие 683, внутри которого размещена по меньшей мере проксимальная концевая часть 643 иглы 640.
[1097] Стопоры 682 могут содержать стержни или иные выступы. Дистальная концевая часть каждого стопора 682 жестко связана с разъемом 670 иглы. Например, дистальная концевая часть стопоров 682 может быть размещена внутри полостей, определенных разъемом 670 иглы, ввернутой, защелкнутой, запрессованной, вставленной по скользящей посадке, жестко соединенной с разъемом 670 иглы посредством использования клеев, горячей сварки, присоединения сплавлением или любого другого подходящего приспособления для связи. В определенных вариантах реализации настоящего изобретения стопоры 682 могут быть монолитно выполнены с разъемом 670 иглы. Стопоры 682 могут быть сформированы из по существу твердого материала, такого как, например, металлы или пластик. По меньшей мере часть каждого стопора 682 размещена внутри сквозных отверстий, определенных внутри сжимаемого элемента 678 таким образом, что стопоры 682 проходят через сжимаемый элемент 678. Таким образом, стопоры 682 способны свободно скользить, выполнять перемещение или иначе менять положение вместе со сквозными отверстиями, определенными сжимаемым элементом 678. Проксимальная концевая часть каждого стопора 682 размещена внутри соответствующего канала из набора каналов 684, определенных опорой 681, таким образом, что проксимальная концевая часть стопоров 682 способна скользить внутри каналов 684. В определенных вариантах реализации настоящего изобретения выступ 685 может быть расположен на проксимальной концевой части стопора 682. Выступ 685 может, например, быть выполнен с возможностью взаимодействия с набором канавок или борозд, определенных в соответствующем канале 684 для обеспечения возможности смещения выступа 685 внутри каналов 684 с фиксированными или иначе заранее определенными приращениями. Таким образом, выступы 685 могут обеспечить сжимаемому элементу 678 возможность испытать уменьшение толщины, а разъему 670 иглы выполнять перемещение в проксимальном направлении относительно контейнера 630 для лекарственного средства с фиксированными приращениями. Кроме того, каналы 684 могут иметь заранее определенную длину для обеспечения возможности смещения проксимальной концевой части стопоров 682 до тех пор, пока дистальная концевая часть стопоров 682 не вступит в контакт с задней стенкой 686 канала 685. Таким образом, каналы 684 и/или опора 681 могут ограничить смещение дистальной концевой части стопоров 682 в проксимальном направлении относительно контейнера 630 для лекарственного средства и, таким образом, определить максимальную длину, на которую дистальный конец 642 иглы 640 может выступать из дистальной концевой поверхности 675 разъема 670 иглы. Другими словами, длина каналов 684, определенных опорой 681, может быть выполнена с возможностью образования максимальной глубины введения дистального конца 642 иглы 640 в ткань-мишень (например, в глазную ткань).
[1098] Далее на фиг. 16 показано устройство 600 в первой конфигурации. В первой конфигурации дистальная концевая поверхность 675 разъема 670 иглы может быть расположена напротив конъюнктивы C глазной ткани. Кроме того, сжимаемый элемент 678 несжат и образует первую толщину t4. Дистальный конец 642 иглы 640 расположен внутри первого канала 676, определенного разъемом 670 иглы таким образом, что дистальный наконечник иглы 640 размещен внутри первого канала 676 и не выступает из дистальной концевой поверхности 675 разъема 670 иглы. По меньшей мере проксимальная концевая часть 643 иглы 640 расположена внутри отверстия 683, определенного опорой 681 и проходит через второй канал 679, определенный сжимаемым элементом 678. Игла 640 образует просвет 641 внутри нее, предназначенный для доставки субстанции, например, лекарственного средства, размещенного в камере 630 лекарственного средства, к целевому местоположению в глазной ткани, например, в супрахориоидальное пространство. Проксимальная концевая часть каждого стопора 682 размещена внутри соответствующего канала 684, определенного опорой 681 таким образом, что ближние концы стопоров 682 являются дальними по отношению к задней стенке 686 каналов 684.
[1099] Пользователь может приложить силу в направлении, показанном стрелкой F на медицинском инъекторе 610, для перехода устройства во вторую конфигурацию, как показано на фиг. 17. Дистальная концевая поверхность 675 разъема 670 иглы может быть прижата к конъюнктиве и образовать по существу непроницаемое для текучей среды уплотнение с конъюнктивой C, как рассмотрено в настоящем описании. Однако, любое дальнейшее перемещение разъема 670 иглы предотвращено конъюнктивой C и/или нижележащей глазной тканью. Поддержка или увеличение величины силы F может заставить медицинский инъектор 610 и, таким образом, контейнер 630 для лекарственного средства и/или иглу 640 выполнить перемещение в проксимальном направлении относительно разъема 670 иглы. Это заставляет дистальный конец 642 иглы 640 проникать через конъюнктиву C и в склеру S глаза. Это также заставляет стопоры 682 выполнить перемещение в проксимальном направлении относительно разъема 670 иглы внутри каналов 684. Сила F сжимает сжимаемый элемент 678 между твердой опорой 681 и твердым разъемом 670 иглы. Как показано на фиг. 17, сила F может быть поддержана до тех пор пока задняя стенка 686 не вступит в контакт с проксимальным концом стопоров 682 и сжимаемый элемент не сожмется до второй толщины t5. Дальнейшее уменьшение толщины сжимаемого элемента 678 предотвращено контактом задней стенки 686 с проксимальным концом стопоров 682. Таким образом, стопорный механизм 680 может определить максимальное уменьшение толщины, которую сжимаемый элемент 678 может испытать и, таким образом, максимальное расстояние, на которое дистальный конец 642 иглы 640 может быть введен в глаз, то есть, максимальную глубину введения дистального конца 642 иглы 640. Например, стопорный механизм 680 может быть выполнено с возможностью ограничения максимальной глубины введения дистального конца 642 иглы 640 к супрахориоидальному пространству (например, от примерно 900 мкм до примерно 1200 мкм) и предотвратить введение дистального конца 642 иглы 640 в сетчатку R глаза.
[1100] Рассмотренные в настоящем описании варианты реализации настоящего изобретения могут быть сформированы или выполнены из одного или большего количества биологически совместимых материалов. Примеры подходящих биологически совместимых материалов включают металлы, стекло, керамику или полимеры. Примеры подходящих металлов включают нержавеющую сталь фармацевтического качества, золото, титан, никель, железо, платину, олово, хром, медь и их сплавы. Полимер может быть разлагаемым микроорганизмами или неразлагаемым микроорганизмами. Примеры подходящих разлагаемых микроорганизмами полимеров включают полилактиды, полигликолиды, сополимеры молочной и гликолевой кислот, полиангидриды, полиортоэстеры, полиэтерэстеры, поликапролактоны, полиэстерамиды, поли-(масляная кислота), поли-(валериановая кислота), полиуретаны и их сополимеры и смеси. Примеры неразлагаемых микроорганизмами полимеров включают нейлоны, полиэфиры, поликарбонаты, полиакрилаты, полимеры ацетатов этиленового винила и другой ацетатат-целлюлозы с замещенным ацилом, неразлагаемые полиуретаны, пенопласты, поливиниловый хлорид, поливиниловое фтористое соединение, поли-(виниловый имидазол), хлоросульфоатные полиолефины, окись полиэтилена, их смеси и сополимеры.
[1101] Рассмотренные в настоящем описании микроиглы могут быть изготовлены множеством способов. Например, в определенных вариантах реализации настоящего изобретения, полая микроигла изготовлена при использовании лазерного или подобного источника оптической энергии. В одном примере микроканюля может быть разрезана при использовании лазера для получения необходимой длины микроиглы. Лазер может также быть использован для образования одного или множества отверстий наконечника. Однократные или множественные надрезы могут быть выполнены на одной микроканюле для образования необходимой структуры микроиглы. В одном примере микроканюля может быть выполнена из металла, такого как нержавеющая сталь, и разрезана посредством использования лазера с длиной волны в инфракрасной области светового спектра (0,7-300 мкм). Дальнейшая обработка может быть выполнена посредством использования способов электрополировки металлов, известных специалистам в данной области техники. В другом варианте реализации настоящего изобретения длину микроиглы и необязательную скошенную кромку образуют посредством процесса физического шлифования, который, например, может включать шлифование металлической канюли против перемещаемой жесткой поверхности. Процесс изготовления может далее включать прецизионную шлифовку, обработку реактивной струей с микробусинками и ультразвуковую очистку для образования формы необходимого прецизионного наконечника микроиглы.
[1102] В определенных вариантах реализации настоящего изобретения игла переменного диаметра показанных и рассмотренных в настоящем описании типов (например, игла 240) может быть изготовлена процессом глубокой вытяжки. Этот процесс может быть использован для изготовления рассмотренных в настоящем описании монолитных игл с переменным диаметром. Кроме того, в процессе глубокой вытяжки может быть изготовлена игла с малой толщиной стенок.
[1103] Большое разнообразие глазных заболевания и нарушений можно лечить рассмотренными в настоящем описании способами и устройствами. Неограничивающие примеры глазных заболевания включают увеит, глаукому, диабетический отек желтого пятна или ретинопатию, дегенерацию желтого пятна, ретинобластому и генетические заболевания. Рассмотренные в настоящем описании способы особенно полезны для местной доставки лекарств, которые должны быть применены к задней области глаза, например, к ретинохороидальной ткани, пятнам и зрительного нерва в заднем отрезке глаза. В одном варианте реализации настоящего изобретения рассмотренные в настоящем описании способы и устройства доставки могут быть использованы в генно-терапевтических приложениях. Например, эти способы могут доставлять жидкий состав лекарственного средства в супрахориоидальное пространство для доставки определенных ДНК, РНК или олигонуклеотидов к предназначенным глазным тканям.
[1104] Микроиглы могут быть использованы для направленной доставки к определенным тканям или областям внутри глаза или в соседней ткани. В различных вариантах реализации настоящего изобретения эти способы могут быть предназначены для доставки препарата специально к склере, сосудистой оболочке, оболочке Бруха, сетчаточному эпителию пигмента, подсетчаточному пространству, сетчатке, пятну, диску зрительного нерва, зрительному нерву, ресничному телу, трабекулярной сети, внутриглазной жидкости, стекловидному телу и к другой глазной ткани или соседней ткани, нуждающихся в лечении.
[1105] Широкий диапазон препаратов может быть определен для доставки к глазным тканям при использовании рассмотренных в настоящем описании настоящих систем и устройств. Кроме того, любое из рассмотренных в настоящем описании устройств и/или способов доставки может вовлекать, включать и/или содержать любой из рассмотренных в настоящем описании препаратов. Например, в определенных вариантах реализации настоящего изобретения контейнер 130, 330, 530, 630 для лекарственного средства или любой другой контейнер для лекарственного средства может содержать любой из рассмотренных в настоящем описании препаратов и/или рецептур. При использовании в настоящем описании термин «препарат» (или «лекарственное средство») относится к любому профилактическому, терапевтическому или диагностическому средству (например, к контрастным средствам). Препарат может быть выбран из подходящих белков, пептидов и их фрагментов, которые могут быть естественными, синтезированными или произведенными комбинированными способами. Представительные примеры типов препаратов для доставки к глазным тканям включают антитела, антивирусные агенты, химиотерапевтические средства (например, ингибиторы топоизомеразы), аналгезирующие средства, анестезирующие средства, аптамеры, антигистамины, противовоспалительные средства и противоопухолевые средства. В одном варианте реализации настоящего изобретения препарат представляет собой триамцинолон или ацетонид триамцинолона.
[1106] «Терапевтический состав», лекарственное средство или препарат, доставленные посредством способов и устройств, рассмотренных в одном варианте реализации в настоящем описании, представляют собой водный раствор или суспензию, и содержат эффективное количество препарата или терапевтического средства, например, клеточной суспензии. В определенных вариантах реализации настоящего изобретения терапевтический состав представляет собой состав препарата в виде текучей среды. «Состав препарата» представляет собой состав препарата, который обычно содержит один или большее количество фармацевтически приемлемых материалов наполнителя, известных в данной области техники. Термин «наполнитель» относится к любому неактивному ингредиенту состава, предназначенному для облегчения обработки, стабильности, дисперсности, смачиваемости, кинетики выпуска и/или инъекции препарата. В одном варианте реализации настоящего изобретения наполнитель может содержать воду или солевой раствор или состоять из них.
[1107] Терапевтический состав, доставляемый в супрахориоидальное пространство глаза человека для лечения увеита (например, неинфекционного увеита), отека желтого пятна, связанного с увеитом (например, неинфекционным увеитом), отека желтого пятна, связанного с окклюзией вены сетчатки или влажной возрастной дегенерацией желтого пятна, может быть в форме жидкого препарата, жидкого раствора, содержащего препарат или терапевтическое средство в подходящем растворителе, или жидкой суспензии. Жидкая суспензия может содержать микрочастицы или наночастицы, диспергированные в подходящем жидком связующем для вливания. В различных вариантах реализации настоящего изобретения препарат включен в жидкое связующее, в микрочастицы или наночастицы, или и в связующее и в частицы. Состав препарата достаточно жидка для протекания в супрахориоидальное пространство и внутри его, а также в окружающие задние глазные ткани. В одном варианте реализации настоящего изобретения вязкость жидкого состава лекарственного средства составляет примерно 1 сП при 37°C.
[1108] В одном варианте реализации настоящего изобретения состав препарата (например, жидкий состав препарата) содержит микрочастицы или наночастицы, каждая из которых содержит по меньшей мере один препарат. По желанию, микрочастицы или наночастицы предусмотрены для контролируемого выпуска препарата в супрахориоидальное пространство и в окружающую заднюю глазную ткань. При использовании в настоящем описании термин «микрочастица» означает микросферы, микрокапсулы, микрочастицы и гранулы, имеющие значение среднего диаметра от примерно 1 мкм до примерно 100 мкм, например, от примерно 1 до примерно 25 мкм, или от примерно 1 мкм до примерно 7 мкм. «Наночастицы» представляют собой частицы со средним диаметром от примерно 1 нм до примерно 1000 нм. В одном варианте реализации настоящего изобретения микрочастицы имеют значение D50, составляющее примерно 3 мкм или меньше. В другом варианте реализации настоящего изобретения значение Д50 примерно равно 2 мкм. В другом варианте реализации настоящего изобретения значение D50 для частиц в составе препарата составляет примерно 2 мкм или меньше. В другом варианте реализации настоящего изобретения значение D50 для частиц в составе препарата составляет примерно 1000 нм или меньше. В одном варианте реализации настоящего изобретения состав препарата содержит микрочастицы, имеющие значение D99, составляющее 10 мкм или меньше. В одном варианте реализации настоящего изобретения микрочастицы имеют значение D50, составляющее примерно 3 мкм или меньше. В другом варианте реализации настоящего изобретения значение D50 составляет примерно 2 мкм. В другом варианте реализации настоящего изобретения значение D50 для частиц в составе препарата составляет примерно 2 мкм или меньше. В другом варианте реализации настоящего изобретения значение D50 для частиц в составе препарата составляет примерно 1000 нм или меньше. В одном варианте реализации настоящего изобретения состав препарата содержит микрочастицы, имеющие значение D99, составляющее примерно 10 мкм или меньше. В одном варианте реализации настоящего изобретения микрочастицы имеют значение Д50, составляющее примерно 3 мкм или меньше. В другом варианте реализации настоящего изобретения значение D50 составляет примерно 2 мкм. В другом варианте реализации настоящего изобретения значение D50 для частиц в составе препарата составляет примерно 2 мкм или меньше. В другом варианте реализации настоящего изобретения значение D50 для частиц в составе препарата составляет от примерно 100 нм до 1000 нм. В одном варианте реализации настоящего изобретения состав препарата содержит микрочастицы, имеющие значение D99, составляющее от примерно 1000 нм до примерно 10 мкм. В одном варианте реализации настоящего изобретения микрочастицы имеют значение D50, составляющее от примерно 1 мкм до примерно 5 мкм или меньше. В другом варианте реализации настоящего изобретения состав препарата содержит частицы, имеющие значение D99, составляющее примерно 10 мкм. В другом варианте реализации настоящего изобретения значение D99 для частиц в составе меньше чем примерно 10 мкм, или меньше чем примерно 9 мкм, или меньше чем примерно 7 мкм или меньше чем примерно 3 мкм. В еще одном варианте реализации настоящего изобретения микрочастицы или наночастицы содержат противовоспалительный препарат. В еще одном варианте реализации настоящего изобретения противовоспалительный препарат представляет собой триамцинолон.
[1109] Микрочастицы и наночастицы могут или не могут быть сферическими по форме. «Микрокапсулы» и «нанокапсулы» определены как микрочастицы и наночастицы с внешней оболочкой, окружающей ядро из другого материала. Ядро может быть жидкостью, гелем, твердым телом, газом или их комбинацией. В одном случае микрокапсула или нанокапсула может быть «микропузырем» или «нанопузырем» с внешней оболочкой, окружающей ядро из газа, причем препарат размещен на поверхности внешней оболочки, непосредственно во внешней оболочке или в ядре. (Микропузыри и нанопузыри способны, как известно при современном уровне техники, реагировать на акустические колебания для диагноза или разрыва микропузырей с целью выпуска их содержимого в выбранном месте глазной ткани.) «Микросферы» и «наносферы» могут быть твердыми сферами, могут быть пористыми и иметь структуру типа губки или ячеек, образованную порами или пустотами в материале матрицы или оболочки, или могут содержать множество дискретных пустот в материале матрицы или оболочки. Микрочастицы или наночастицы могут дополнительно содержать материал матрицы. Материал матрицы или оболочки может представлять собой полимер, аминокислоту, сахарид или другой материал, известный в технике микрокапсуляции.
[1110] Содержащие препарат микрочастицы или наночастицы могут быть взвешены в водном или неводном жидком связующем. Жидкое связующее может быть фармацевтически приемлемым водным раствором и при необходимости может дополнительно содержать поверхностно-активную добавку. Микрочастицы или наночастицы самого препарата могут содержать материал наполнителя, такой как полимер, полисахарид, поверхностно-активный материал и т.д., которые известны в технике управления кинетикой высвобождения препарата из частиц.
[1111] В одном варианте реализации настоящего изобретения состав препарата дополнительно содержит средство, эффективное для ухудшения волокон коллагена или глюкозаминогликана в склере, что может увеличить проникновение/высвобождение препарата в глазные ткани. Это средство может быть, например, ферментом, таким как гиалуронидаза, коллагеназа или их комбинацией. В качестве вариации этого способа фермент вводят в глазную ткань в ходе отдельной (от предыдущей или последующей) операции инфузии препарата. Фермент и препарат применяют в одном и том же месте.
[1112] В другом варианте реализации настоящего изобретения состав препарата представляет собой состав, претерпевающий фазовый переход после введения. Например, жидкий состав препарата может быть введен через полые микроиглы в супрахориоидальное пространство, где он затем загустевает, и происходит диффузия препарата из геля в качестве контролируемого высвобождения.
[1113] В одном варианте реализации настоящего изобретения терапевтическая субстанция разработана с одним или большим количеством полимерных наполнителей для ограничения миграции терапевтической субстанции и/или увеличения вязкости рецептуры. Полимерный наполнитель может быть выбран и сформулирован для действия в качестве вязкого гелеподобного материала in-situ и, таким образом, распространения в область супрахориоидального пространства и однородного распределения и сохранения препарата. В одном варианте реализации настоящего изобретения наполнитель полимера выбран и сформулирован для обеспечения соответствующих свойств вязкости, потока и растворения. Например, карбоксиметилцеллюлоза использована в одном варианте реализации настоящего изобретения для образования гелеподобного материала в супрахориоидальном пространстве. В одном варианте реализации настоящего изобретения вязкость полимера увеличена посредством адекватной химической модификации полимера для усиления ассоциативных свойств, такие как добавление гидрофобных материалов, выбор полимера с более высокой молекулярной массой или посредством состава с соответствующими поверхностно-активными материалами.
[1114] В одном варианте реализации настоящего изобретения свойства растворения терапевтического состава отрегулированы посредством варьирования растворимости в воде, молекулярной массы и концентрации полимерного наполнителя в диапазоне соответствующих тиксотропных свойств для обеспечения возможности доставки через иглу малого калибра и локализации в супрахориоидальном пространстве. Полимерный наполнитель может быть сформулирован для увеличения вязкости или для сшивки после доставки для дополнительного ограничения миграции или растворения материала и входящего в состав препарата.
[1115] Растворимые в воде полимеры, которые физиологически совместимы, подходят для использования в качестве полимерных наполнителей в рассмотренных в настоящем описании терапевтических составах, а для доставки посредством рассмотренных в настоящем описании способов и устройств включают, не ограничиваясь этим, синтетические полимеры, такие как поливиниловый спирт, поливинилпироллидон, гликоль полиэтилена, окись полиэтилена, полигидроксиэтилматакрилат, гликоль полипропилена и окись пропилена, и биологические полимеры, такие как производные целлюлозы, производные хитина, альгинат, желатин, производные крахмала, гиалуроновую кислоту, сульфат хондроитина, сульфат дерматина и другие гликозаминогликаны, а также смеси или сополимеры таких полимеров. В одном варианте реализации настоящего изобретения полимерный наполнитель выбран для обеспечения возможности растворения со временем со скоростью, управляемой концентрацией, молекулярной массой, растворимостью в воде, образованием поперечных межмолекулярных связей, лабильностью фермента и свойствами приклеивания к ткани полимера.
[1116] В одном варианте реализации настоящего изобретения средство для изменения вязкости присутствует в терапевтическом составе, доставляемый одним из рассмотренных в настоящем описании способов и/или устройств. В еще одном варианте реализации настоящего изобретения средство изменения вязкости представляет собой поливиниловый спирт, поливинилпирролидон, метилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, гидроксиметилтилцеллюлозу или гидроксипропилцеллюлозу. В другом варианте реализации настоящего изобретения состав содержит желатинирующее средство, такое как поли-(гидроксиметилметакрилат), поли-(Н-винилпирролидон), поливиниловый спирт или полимер акриловой кислоты, такой как карбопол.
[1117] В одном варианте реализации настоящего изобретения терапевтический состав доставяется посредством одного из рассмотренных в настоящем описании способов и/или устройств в качестве липосомального состава.
[1118] Липосомы могут быть образованы множеством способов. Процедура Bangham (J. Mol. Biol. 13 (1):238-52, 1965) вырабатывает обычные многослойные пузырьки. Lenk и др. (патенты США № 4522803, 5030453 и 5169637), Fountain и др. (патент США № 4 588 578) и Cullis и др. (Патент США № 4975282) раскрывают способы выработки многослойных липосом, имеющих по существу равное распределение межламеллярной субстанции в каждой из их водных ячеек. Paphadjopoulos и др. (патент США № 4 235 871) раскрывают подготовку олиголамеллярных липосом посредством обращенно-фазового выпаривания. Каждая из ссылок на патенты в этом абзаце означает, что содержание каждого патента полностью включено в настоящую заявку посредством ссылки для всех целей.
[1119] В одном варианте реализации настоящего изобретения липосомальный состав содержит фозолипид. В еще одном варианте реализации настоящего изобретения липосомальный состав содержит стерин, такой как холестерин.
[1120] В другом варианте реализации настоящего изобретения липосомальный состав содержит однослойные пузырьки. Однослойные пузырьки могут быть образованы из многослойных пузырьков многими способами, например, экструдированием согласно Cullis и др. (патент США № 5 008 050) и Loughrey и др. (патент США № 5 059 421). Разрушение ультразвуком и гомогенизация могут быть использованы для образования меньших однослойных липосом из бóльших липосом (см., например, Paphadjopoulos и др., Biochim. Biophys. Acta. 135:624-638, 1967; Deamer (патент США № 4 515 736); и Chapman и др., Liposome Technol. 1984, стр. 1-18). Обзор этих и других способов выработки липосом может быть найден в книге «Липосомы» (ред. Marc Ostro), Marcel Dekker, Inc., Нью-Йорк, 1983, Глава 1, соответствующие части которой включены в настоящую заявку посредством ссылки. См. также Szоka, Jr. и др., (1980, Ann. Rev. Biophys. Bioeng. 9:467). Каждая из ссылок в этом абзаце означает, что содержание каждого ссылки полностью включено в настоящую заявку посредством ссылки для всех целей.
[1121] Термин «антитело» предназначен для указания в широком смысле на любой иммунологический связующий агент, такой как IgG, IgM, IgA, IgD и IgE. Антитело может быть моноклональным или поликлональным, а в одном варианте реализации настоящего изобретения представляет собой гуманизированное антитело. Термин «антитело» также использован для указания на любую молекулу, подобную антителу, которая имеет связывающую область, и содержит фрагменты антитела, такие как Fabʹ, Fab, F(abʹ)2, одиночные доменные антитела (DABs), Fv, scFv (одиночная цепь Fv), и технические поливалентные фрагменты антитела, такие как двойные тела, тройные тела и мультитела. Способы подготовки и использования различных основанных на антителе конструкций и фрагментов известны при современном уровне техники (см., например, Антитела: Лабораторный справочник, Cold Spring Harbor Laboratory, 1988; включено в настоящую заявку посредством ссылки).
[1122] Неограничивающие примеры определенных препаратов и классов препаратов включают β - антагонисты адренорецептора (например, картеолол, цематолол, бетаксолол, левобунолол, метипранолол, тимолол), миотики (например, пилокарпин, карбахол, физостигмин), симпатомиметики (например, адреналин, дипивефринин), ингибиторы карбоангидразы (например, ацетазоламид, дорзоламид), ингибиторы топоизомеразы (например, топотекан, иринотекан, камптотецин, ламелларин D, этопозид, тенипосид, доксорубицин, митоксантрон, амсакрин), простагландины, антимикробные составы, включая антибактериальные и противогрибковые составы (например, хлорамфеникол, хлортетрациклин, ципрофлоксацин, фрамицетин, фусидовую кислоту, гентамицин, неомицин, норфлоксацин, офлоксацин, полимиксин, пропамидин, тетрациклин, тобрамицин, квинолины), антивирусные составы (например, ацикловир, цидофовир, идоксуридин, интерфероны), ингибиторы альдоредуктазы, противовоспалительные и/или антиаллергические составы (например, стероидные составы, такие как бетаметазон, клобетазон, дексаметазон, флуорометолон, гидрокортизон, преднизолон и нестероидные составы, такие как антазолин, бромфенак, диклофенак, индометацин, лодоксамид, сапрофен, хромогликат натрия), терапевтические средства, связанные с искусственными слезами/сухим глазом, местные обезболивающие средства (например, аметокаин, лигнокаин, оксбупрокаин, проксиметакаин), циклоспорин, диклофенак, урогастрон и факторы роста, такие как эпидермальный фактор роста, мидриатики и циклoплегики, митомицин С, ингибиторы коллагеназы и препараты для лечения возрастной дегенерации желтого пятна, такие как пегагтаниб натрия, ранибизумаб, афлиберцепт и бевацизумаб.
[1123] В одном варианте реализации настоящего изобретения препарат представляет собой антагонист интегрина, антагонист селектина, антагонист молекулы адгезии (например, молекулы межклеточной адгезии ICAM-1, ICAM-2, ICAM-3, молекулы эндотелиальной адгезии тромбоцита (PCAM), молекулы адгезии сосудистого эндотелия (VCAM)), цитокин, стимулирующий адгезию лейкоцита или антагонист фактора роста (например, α - фактор некроза опухолей (TNF-α), интерлeйкин 1β (IL-1β), хемотактический белок 1 моноцитов (MCP-1), или фактор роста эндотелия сосудов (VEGF)). В определенных вариантах реализации настоящего изобретения ингибитор фактора роста эндотелия сосудов применяют с одной из рассмотренных в настоящем описании микроигл. В определенных вариантах реализации настоящего изобретения два препарата доставляют рассмотренными в настоящем описании способами. Составы могут быть применены в одном составе, или применены последовательно, в двух отдельных составах. Например, выполняют доставку и ингибитора фактора роста эндотелия сосудов и фактора роста эндотелия сосудов. В определенных вариантах реализации настоящего изобретения ингибитор фактора роста эндотелия сосудов представляет собой антитело, например, гуманизированное моноклональное антитело. В других вариантах реализации настоящего изобретения антитело фактора роста эндотелия сосудов представляет собой бевацизумаб. В другом варианте реализации настоящего изобретения ингибитор фактора роста эндотелия сосудов представляет собой ранибизумаб, афлиберцепт или пегаптаниб. В других вариантах реализации настоящего изобретения рассмотренные в настоящем описании устройства и способы могут быть использованы для доставки одного или большего количества следующих антагонистов фактора роста эндотелия сосудов: AL8326, антитело 2C3, антитело AT001, HyBEV, бевацизумаб (авастин), ANG3070, антитело APX003, антитело APX004, понатиниб (AP24534), BDM-E, антитело VGX100 (VGX100 CIRCADIAN), VGX200 (индуцированное протоонкогеном c-fos моноклональное антитело фактора роста), VGX300, COSMIX, антитело DLX903/1008, ENMД2076, сутент (малат сунитиниба), INDUS815C, антитело R84, KD019, NM3, аллогеннные мезенхимальные клетки предшественника, объединенные с антиагентом или антителом фактора роста эндотелия сосудов, MGCD265, MG516, ингибиторы киназы рецептора фактора роста эндотелия сосудов, MP0260, NT503, биспецифическое антитело к DLL4/фактору роста эндотелия сосудов, PAN90806, паломид 529, антитело BD0801, XV615, луцитаниб (AL3810, E3810), AMG706 (дифосфат мотесаниба), AAV2-sFLT01, растворимый рецептор Flt1, цедираниб (рецентин), AV-951 (тивозаниб, KRN-951), cтиварга (регорафениб), волазертиб (BI6727), CEP11981, KH903, ленватиниб (E7080), терамепрозол (EM1421), ранибизумаб (луцентис), вотриент (гидрохлорид пазопаниба), PF00337210, PRS050, SP01 (куркумин), оротат карбоксиамидотриазола, гидроксихлороквин, линифаниб (ABT869, RG3635), илувиен (ацетoнид флуоцинолона), ALG1001, AGN150998, DARPin MP0112, AMG386, понатиниб (AP24534), AVA101, варгатеф (нинтеданиб), BMS690514, KH902, голватиниб (E7050), афинитор (эверолимус), лактат довитиниба (TKI258, CHIR258), ORA101, ORA102, акситиниб (инлита, AG013736), плитидепсин (аплидин), мезилaт ленватиниба, PTC299, афлиберцепт (зальтрап, эйлея), натрия пегаптаниб (макуген, LI900015), висудин (вертепорфин), буцилламин (риматил, ламин, бримани, ламит, бумик), антитело R3, антитело AT001/r84, тропонин (BLS0597), EG3306, ваталаниб (PTK787), Bmab100, GSK2136773, альтераза анти-фактора роста эндотелия сосудов, авила, CEP7055, CLT009, ESBA903, антитело HuMax-фактора роста эндотелия сосудов, GW654652, HMPL010, GEM220, HYB676, JNJ17029259, TAK593, антитело XtendVEGF, Nova21012, Nova21013, CP564959, умное антитело анти-фактора роста эндотелия сосудов, AG028262, AG13958, CVX241, SU14813, PRS055, PG501, PG545, PTI101, TG100948, ICS283, XL647, гидрохлорид энзастаурина (LY317615), BC194, квинолины, COT601M06.1, COT604M06.2, мабион-фактор роста эндотелия сосудов, сферы для селективного внутреннего облучения, соединенные с анти-фактором роста эндотелия сосудов или антителом для рецептора фактора роста эндотелия сосудов, апатиниб (YN968D1), и AL3818. Кроме того, доставка ингибитора фактора роста эндотелия сосудов или антагониста фактора роста эндотелия сосудов с использованием раскрытых в настоящем описании микроигл и способов может быть объединена с одним или большим количеством перечисленных в настоящем описании средств или с другими средствами, известными при современном уровне техники.
[1124] В одном варианте реализации настоящего изобретения доставка антагониста фактора роста эндотелия сосудов в супрахориоидальное пространство глаза при использовании раскрытых в настоящем описании устройств и способов использована для лечения, предотвращения и/или улучшения состояния при заболевании или нарушении, выбранных из лейкоза, рецидивирующего/резистентного лейкоза, острого лимфобластного лейкоза, острого миегогенного лейкоза, рецидивирующего/резистентного острого миелоидного лейкоза, аллергического дерматита, рецидивной или метастатической уротелиальной карциномы, запущенной уротелиальной карциномы, нарушений кровоснабжения, миелофиброза, опухоли головного мозга, глиобластомы, глиомы, менингиомы, рака, ракового менингита (неопластического менингита), хориоидального образования новых сосудов (CNV), субфовеального хориоидального образования новых сосудов, хронического лимфоцитарного лейкоза, хронического миелогенного лейкоза, резистентного хронического миелогенного лейкоза, рака толстой кишки, рака ободочной и прямой кишки, дегенеративных заболеваний нерва, нейродегенеративных заболеваний, диабетического отека желтого пятна, ухудшения зрения вследствие диабетического отека желтого пятна, диабетической ретинопатии, синдрома сухих глаз (воспаления и повреждения роговичных тканей сухого глаза), внутриматочного рака, глазных заболеваний, образования новых сосудов в глазу, рака глаза, нейрофиброматозы типа II, раковых образований головы и шеи, гематологических новообразований, саркомы Капоши, гепатоцеллюлярного рака, рака легких, дегенерации желтого пятна, возрастной дегенерации желтого пятна, экссудативной возрастной дегенерации желтого пятна, неоваскулярной (влажной) возрастной дегенерации желтого пятна, субфовеальной неоваскулярной возрастной дегенерации желтого пятна, отека желтого пятна, отека желтого пятна, связанного с окклюзией ветки вены сетчатки, отека желтого пятна после окклюзии вены сетчатки, отека желтого пятна с окклюзией вены сетчатки, множественной миеломы, рецидивирующей или резистентной множественной миеломы, рассеянного склероза, близорукости, патологической близорукости, нейроэндокринной опухоли, опухоли карциноида, неходжкинской лимфомы, диффузной В-крупноклеточной лимфомы, немелкоклеточного рака легких, несквамозного немелкоклеточного рака легких, аденокарциномы «немелкоклеточного легкого», сквамозного немелкоклеточного рака легких, роговичного отторжения трансплантата, остеоартрита, рецидивного симптоматического злокачественного асцита, периферической Т-лимфоцитарной лимфомы, андроген-независимого псориаза, легочного фиброза, идиопатического легочного фиброза, респираторных заболеваний, отслойки сетчатки, сетчаточных нарушений, пигментной дистрофии сетчатки, окклюзии вены сетчатки, окклюзии ветви вены сетчатки, окклюзии центральной вены сетчатки, ревматоидного артрита, саркомы, альвеолярной саркомы мягких тканей, саркомы мягкой ткани, склероза склеродермии/системного склероза, твердых опухолей, резистентных опухолей зародышевой клетки, рака щитовидной железы, дифференцированного или медуллярного рака щитовидной железы и синдрома Веста (инфантильного спазма).
[1125] В определенных вариантах реализации настоящего изобретения препарат, доставленный в супрахориоидальное пространство посредством раскрытых в настоящем описании устройств и способов представляет собой рапамицин (сиролимус, рапамун). В одном варианте реализации настоящего изобретения раскрытые в настоящем описании устройства (например, устройства микроиглы) и способы используют вместе с рапамицином для лечения, предотвращения и/или улучшения состояния в широком диапазоне заболеваний или нарушений включая следующее, но не ограничиваясь им: брюшные опухоли, синдром приобретенного иммунодефицита, острый коронарный синдром, острый лимфобластный лейкоз, острый миелоцитарный лейкоз, острый нелимфобластный лейкоз, аденокарцинома, аденома, аденомиоэпителиома, заболевания придаточных органов, анапластическую астроцитому, анапластическая крупноклеточная лимфома, анапластическая плазмоцитома, анемия, стенокардия, ангиоиммунобластическая лимфаденопатия с диспротеинемией, ангиомиолипома, окклюзии артерии, артериосклероз, астроцитома, атеросклероз, аутоиммунные заболевания, В-лимфоцитарная лимфома, нарушения коагуляции крови, нарушения белка крови, рак кости, заболевания костного мозга, заболевания мозга, мозговые опухоли, опухоли груди, бронхиальные опухоли, карциноидный синдром, карциноидная опухоль, рак, плоскоклеточный рак, заболевания центральной нервной системы, опухоли центральной нервной системы, заболевания сосудистой оболочки, опухоли хороидного сплетения, хориоидальное образование новых сосудов, хориоидит, хронический лимфоцитарный лейкоз, хронический относящийся к спинному мозгу лейкоз, хронический миеломоноцитарный лейкоз, хронические миелопролиферативные нарушения, хронический нейтрофильный лейкоз, светлоклеточный почечно-клеточный рак, относящиеся к ободочной и толстой кишке заболевания, относящиеся к ободочной и толстой кишке опухоли, колоректальные опухоли, заболевание коронарной артерии, коронарное заболевание, коронарная окклюзия, коронарный рестеноз, коронарный стеноз, тромбоз венечных сосудов, кожная Т-лимфоцитарная лимфома, сахарный диабет, опухоли пищеварительной системы, синдромы сухих глаз, ушные заболевания, отек, опухоли эндокринной железы, заболевания эндокринной системы, внутриматочные опухоли, внутриматочные стромальные опухоли, саркома Юинга, экзантема, глазные опухоли, фиброз, фолликулярная лимфома, желудочно-кишечные заболевания, желудочно-кишечные опухоли, опухоли гениталий, глиобластома, глиома, глиосаркома, заболевания, связанные с отторжением трансплантата, гематологические заболевания, гематологические опухоли, геморрагические нарушения, гемостатические нарушения, заболевания Ходжкина, лимфомы Ходжкина, гомологичные изнуряющие заболевания, иммунобластическая лимфаденопатия, иммунологические синдромы дефицита, иммунопролиферативные нарушения, образование инфаркта, воспаление, кишечные заболевания, кишечные опухоли, ишемия, рак почек, заболевания почек, почечные опухоли, лейкоз, лейкоз В-лимфоцитов, лимфоидный рак печени, заболевания печени, заболевания легких, лимфатические заболевания, лимфообластная лимфома, лимфома, дегенерация желтого пятна, отек желтого пятна, меланома, опухоли рта, множественное миеломное заболевание, миелодиспластические синдромы, миелофиброз, миелопролиферативные нарушения, нейроэктодермальные опухоли, нейроэндокринные опухоли, нейроэпителиома, нейрофиброма, рак почек, заболевания дыхательных путей, дегенерация сетчатки, заболевания сетчатки, опухоли сетчатки, ретинобластома, рабдомиосаркома, опухоли груди, увеит, сосудистые заболевания, макроглобулинемия Вальденстрема и влажная дегенерация желтого пятна. Кроме того, доставка рапамицина при использовании раскрытых в настоящем описании устройств микроиглы и способов может быть объединена с одним или большим количеством перечисленных в настоящем описании средств или с другими средствами, известными при современном уровне техники.
[1127] В одном варианте реализации настоящего изобретения препарат, который уменьшает, подавляет, предотвращает и/или ослабляет воспаление, например, один из указанных выше препаратов, доставляют в супрахориоидальное пространство глаза, используя раскрытые в настоящем описании устройства и способы микроиглы, и используют для лечения, предотвращения и/или ослабления заболевания или нарушения, выбранного из артрита, дегенеративного артрита, псориатического артрита, артритических нарушений, артритической боли, артроза, аутоиммунного артрита, аутоиммунных заболеваний, аутоиммунных нарушений, осевого спондилоартрита, хронической инфекции в протезных соединениях, индуцированного коллагеном артрита, остеоартрита, ревматоидного артрита, сенильного артрита, серонегативного олигоартрита колена, аллергических и аутоиммунных воспалительных заболеваний, воспалительных заболеваний, воспалительных заболеваний, диффузных болезней соединительной ткани, дискоидной красной волчанки, иммунных дефицитов, иммунопатологических заболеваний, иммунологических нарушений, заболевания иммуннодефицита, иммунодефицитов, дефицита иммуноглобулина (иммуноглобулина класса G2), дефицита иммуноглобулина, воспаления, синдрома миастении Ламберта-Итона, полимиозита, дерматомиоситиса, полиневрита, послеоперационного глазного воспаления, полихондритиса, спорадического миозита с включенными тельцами, системной красной волчанки, дефицита Т-лимфоцитов, периодического синдрома, связанного с рецептором фактора некроза опухолей, тропического спастического парапареза, гранулематоза Вегенера, связанного с Х-хромосомой тяжелого комбинированного заболевания иммуннодефицита, заболевания Бехчета, заболевания Крона, фистулы Крона, кожной красной волчанки, острого воспаления, острого воспалительного отека, адренокортикальной недостаточности, мозгового воспаления, хронического воспаления легкого, кортикоид-чувствительного воспалительного заболевания кожи, кожного воспаления, кожного воспаления, воспалительного заболевания сухой кожи, ушного отека, ушного воспаления, глоссита, воспалительного заболевания кишечника, воспалительного дегенеративного заболевания, воспалительного заболевания глаза и/или уха, воспалительных поражений при микозах, воспалительных поражений, воспалительной боли, воспалительных кожных заболеваний или нарушений, воспалений рта и челюсти, воспалений рта и горла, скелетно-мышечных нарушений, отита, воспаления тазовых элементов, околоанального воспаления, послеоперационного воспаления, легочного воспаления, ректального воспаления, невосприимчивых идиопатических воспалительных миопатий, себорейного дерматита, набухания, ящурного образования язвы, хронического полиартрита, ювенильного ревматоидного артрита, ревматического заболевания, синдрома Шегрена, офтальмического синдрома Шегрена, отторжения трансплантата, острого отторжения аллотрансплантата, хронического отторжения трансплантата, реакции "трансплантат против хозяина", гуморального отторжения при пересадке сердца, гуморального отторжения при пересадке почки, отторжения органа при пересадке почки, отторжении целого органа-трансплантата, облитерирующего бронхиолита после пересадки легких, отторжения трансплантата костного мозга, хронического отторжения трансплантата легкого, отторжения роговичного трансплантата, задержанной функции трансплантата при пересадке почки, отторжения трансплантата сердца, отторжения при гомотрансплантации, иммунного отторжения терапевтических трансплантатов из стволовых клеток человеческого эмбриона, отторжения трансплантата почек, отторжения трансплантата печени, отторжения трансплантата легкого, отторжения органа, отторжения трансплантации панкреатического островка при диабете типа 1, отторжении ренального трансплантата и отторжении ксенотрансплантата.
[1128] В одном варианте реализации настоящего изобретения препарат, доставляемый в супрахориоидальное пространство, при использовании раскрытых в настоящем описании устройств и способов микроиглы лечит, предотвращает и/или ослабляет дегенерацию желтого пятна (например, возрастную дегенерацию желтого пятна, сухую возрастную дегенерацию желтого пятна, эсссудативную возрастную дегенерацию желтого пятна, географическую атрофию, связанную с возрастной дегенерацией желтого пятна, неоваскулярную (влажную) возрастную дегенерацию желтого пятна, неоваскулярную макулопатию и возрастную дегенерацию желтого пятна, заболевание непонятного происхождения без классической хороидальной неоваскуляризации при возрастной дегенерации желтого пятна, заболевание Штаргардта, субфовеальную влажную возрастную дегенерацию желтого пятна, и витреоадгезию желтого пятна, связанную с неоваскулярной возрастной дегенерацией желтого пятна). Примеры препаратов, которые лечат, предотвращают и/или ослабляют дегенерацию желтого пятна, и которые могут быть использованы вместе с рассмотренными в настоящем описании устройствами и способами, включают, не ограничиваясь этим: А0003, пептид А36, AAV2-sFLT01, ACE041, ACU02, ACU3223, ACU4429, AdPEDF, афлиберцепт, AG13958, аганирсен, AGN150998, AGN745, AL39324, AL78898A, AL8309B, ALN-VEG01, алпростадил, AM1101, антитело к амилоид-бета, анекортава ацетат, алтераза Anti-VEGFR-2, аптоцин, APX003, ARC1905, ARC1905 с луцентисом, ATG3, АТФ-связывающая кассета, подсемейство A, ген элемента 4, ATXS10, авастин с висудином, AVT101, AVT2, бертилимумаб, бевацизумаб с вертепорфином, бевасираниба натрий, бевасираниба натрий с ранибизумабом, бримонидина тартрат, BVA301, санакинумаб, Cand5, Cand5 с луцентисом, CERE140, реснитчатый нейротрофический фактор, CLT009, CNTO2476, моноклональное антитело коллагена, аптамер (пегилированный) компонента 5 комплемента, аптамер (пегилированный) компонента 5 комплемента с ранибизумабом, компонент С3 комплемента, антитело фактора В комплемента, антитело фактора D комплемента, окись меди с лютеином, витамин С, витамин Е и окись цинка, далантерцепт, DE109, дексаметазон с ранибизумабом и вертепорфином, диситертида, вызывающий повреждение ДНК олигонуклеотид транскрипта 4, E10030, E10030 с луцентисом, EC400, экулизумаб, EGP, EHT204, эмбриональные стволовые клетки, человеческие стволовые клетки, эндоглин моноклональное антитело эндоглина, ингибитор EphB4 RTK, Растворимый Рецептор EphB4, ESBA1008, ETX6991, эвизон, айбар, айпромисе пять, айви, айлеа, F200, FCFD4514S, фенретинид, флуоцинолона ацетонид, флуоцинолона ацетонид с ранибизумабом, олигонуклеотид fms-cвязанной киназы 1 тирозина, олигонуклеотид fms-cвязанной киназы 1 тирозина с рецептором 169 домена вставки киназы, фосбретабулина трометамин, гамунекс, GEM220, GS101, GSK933776, HC31496, человеческий n-CoDeR, HYB676, IBI-20089 с луцентисом, iCo-008, икон1, и-голд, иларис, илувиен, илувиен с луцентисом, иммуноглобулины, фрагменты иммуноглобулина интегрина alpha5beta1, ингибитор интегрина, IRIS лютеин, I-сенс окушилд, изонеп, изопропила унопростон, JPE1375, JSM6427, KH902, лентивуе, LFG316, LP590, LPO1010AM, луцентис, луцентис с висудином, лютеин экстра, лютеин с экстрактом черники, лютеин с зеаксантином, М200, М200 с луцентисом, макуген, MC1101, MCT355, мекамиламин, микроплазмин, мотексафина лутетиум, MP112, ингибиторы оксидазы восстановленного никотинамидадениндинуклеотидфосфата, неоретна, ген неуротрофина 4, Nova21012, Nova21013, NT501, NT503, нутри-стуллн, окриплазмин, окуссан, офтан макула, оптрин, ORA102 с авастином, P144, P17, паломид 529, PAN90806, панзем, панзем, ингибиторы поли(ADF-рибозы) полимеразы, пазопаниба гидрохлорид, пегаптаниба натрий, PF4523655, PG11047, пирибедил, аптамер (пегилированный) полученного из тромбоцитов полипептида с фактором-бета роста, аптамер (пегилированный) полученного из тромбоцитов полипептида с фактором-бета роста с ранибизумабом, PLG101, PMX20005, PMX53, POT4, PRS055, PTK787, ранибизумаб, ранибизумаб с ацетонидом триамцинолона, ранибизумабвит вертепорфина, ранибизумаб с волоциксимабом, RD27, рескула, ретаан, клетки эпителия пигмента сетчатки, ретиностат, RG7417, RN6G, RT101, RTU007, SB267268, ингибитор серпина пептидазы, клад F, ген элемента 1, экстракт хряща акулы, Shef1, SIR1046, SIR1076, Sirna027, сиролимус, SMTD004, снелвит, миметики супероксиддисмутазазы, солирис, зонепсизумаб, сквуаламина лактат, ST602, старген, T2TrpRS, TA106, талапорфин натрия, тауроурсодеоксихоликовая кислота, TG100801, TKI, TLCx99, TRC093, TRC105, ацетонид триамцинолона с вертепорфином, тривастал ретард, TT30, урса, урсодиол, вангиолукс, VAR10200, антитело фактора роста эндотелия сосудов, антитело фактора В роста эндотелия сосудов, киноид фактора роста эндотелия сосудов, олигонуклеотид фактора роста эндотелия сосудов, составы VAST, ваталаниб, ингибитор фактора роста эндотелия сосудов, вертепорфин, висудин, висудин с луцентисом и дексаметазоном, висудин с ацетонидом триамцинолона, вивис, волоциксимаб, вотриент, XV615, зеаксантин, ZFP TF, цинковый моноцистеин и зибрестат. В одном варианте реализации настоящего изобретения один или большее количество описанных выше препаратов лечения дегенерации желтого пятна соединены с одним или большим количеством упомянутых выше в настоящем описании средств или с другими средствами, известными при современном уровне техники.
[1129] В одном варианте реализации настоящего изобретения предложенные в настоящем описании способы и устройства использованы для доставки триамцинолона или ацетонида триамцинолона в супрахориоидальное пространство глаза нуждающегося в этом пациента. В еще одном варианте реализации настоящего изобретения триамцинолон или ацетонид триамцинолона доставляют для лечения симпатической офтальмии, височного артериита, увеита и/или глазных воспалительных заболеваний. В одном варианте реализации настоящего изобретения триамцинолон или ацетонид триамцинолона доставляют в супрахориоидальное пространство глаза пациента, нуждающегося в лечении симпатической офтальмии, рассмотренными в настоящем описании способами и устройствами. В другом варианте реализации настоящего изобретения триамцинолон или ацетонид триамцинолона доставляют в супрахориоидальное пространство глаза пациента, нуждающегося в лечении височного артериита, рассмотренными в настоящем описании способами и устройствами. В еще одном варианте реализации настоящего изобретения триамцинолон или ацетонид триамцинолона доставляют в супрахориоидальное пространство глаза пациента, нуждающегося в лечении увеита, рассмотренными в настоящем описании способами и устройствами. В другом варианте реализации настоящего изобретения триамцинолон или ацетонид триамцинолона доставляют в супрахориоидальное пространство глаза пациента, нуждающегося в лечении одного или большего количества глазных воспалительных заболеваний, рассмотренными в настоящем описании способами и устройствами.
[1130] В одном варианте реализации настоящего изобретения обеспеченный в настоящем описании состав триамцинолона представляет собой суспензию, содержащую микрочастицы или наночастицы триамцинолона или ацетонида триамцинолона. В одном варианте реализации настоящего изобретения микрочастицы имеют значение D50, составляющее примерно 3 мкм или меньше. В еще одном варианте реализации настоящего изобретения значение D50 составляет примерно 2 мкм. В другом варианте реализации настоящего изобретения значение D50 составляет примерно 2 мкм или меньше. В другом варианте реализации настоящего изобретения значение D50 составляет примерно 1000 нм или меньше. В одном варианте реализации настоящего изобретения значение D99 для микрочастиц составляет примерно 10 мкм или меньше. В другом варианте реализации настоящего изобретения значение D99 составляет примерно 10 мкм. В другом варианте реализации настоящего изобретения значение D99 составляет меньше, чем примерно 10 мкм или меньше, чем примерно 9 мкм или еще меньше.
[1131] В одном варианте реализации настоящего изобретения состав триамцинолона содержит микрочастицы триамцинолона. В другом варианте реализации настоящего изобретения состав содержит полисорбат 80. В другом варианте реализации настоящего изобретения состав триамцинолона содержит один или большее количество препаратов из CaCl2, MgCl2, ацетата натрия и цитрата натрия. В одном варианте реализации настоящего изобретения состав содержит полисорбат 80 в процентном отношении веса к объему 0,02% или примерно 0,02%, 0,015% или примерно 0,015%.
[1132] В определенных вариантах реализации настоящего изобретения препарат, доставляемый в глазные ткани посредством раскрытых в настоящем описании устройств и способов микроиглы, лечит, предотвращает и/или ослабляет фиброз (например, миелофиброз, фиброз в диабетической нефропатии, мусовисцедоз, рубцевание и фиброз кожи).
[1133] В одном варианте реализации настоящего изобретения препарат, который лечит, предотвращает и/или ослабляет фиброз, использован вместе с рассмотренными в настоящем описании устройствами и способами и доставляют в супрахориоидальное пространство глаза. В другом варианте реализации настоящего изобретения препарат представляет собой актиммун с пирфенидоном, ACUHTR028, AlphaVBeta5, аминобензоат калия, амилоид Р, ANG1122, ANG1170, ANG3062, ANG3281, ANG3298, ANG4011, Anti-CTGF RNAi, аплидин, экстракт астрагала перепончатого с шалфеем и лимонником китайским, блокатор атеросклеротических бляшек, азол, AZX100, BB3, антитело фактора роста соединительной ткани, СЕ140, даназол, эсбриет, EXC001, EXC002, EXC003, EXC004, EXC005, F647, FG3019, фибросорин, фоллистатин, FT011, ингибиторы галестина-3, GKT137831, GMCT01, GMCT02, GRMD01, GRMD02, GRN510, хеберон алфа R, интерферон алфа-2b, интерферон гамма-1b с пирфенидоном, ITMN520, JKB119, JKB121, JKB122, KRX168, антагонист рецептора LPA1, MGN4220, MIA2, олигонуклеотид microRNA 29a, MMI0100, ноксапин, PBI4050, PBI4419, ингибитор рецептора к фактору роста, выделенному из тромбоцитов, PF-06473871, PGN0052, пиреспа, пирфенекс, пирфенидон, плитидепсин, PRM151, Px102, PYN17, PYN22 с PYN17, реливерген, белок слияния rhPTX2, RXI109, секретин, STX100, ингибитор трансформирующего бета-фактора роста, трансформирующий фактор роста, олигонуклеотид бета-рецептор 2, VA999260 или XV615. В одном варианте реализации настоящего изобретения один или большее количество описанных выше препаратов лечения фиброза соединены с одним или большим количеством упомянутых выше в настоящем описании средств или с другими средствами, известными при современном уровне техники.
[1134] В одном варианте реализации настоящего изобретения препарат, который лечит, предотвращает и/или ослабляет диабетический отек желтого пятна, использован вместе с рассмотренными в настоящем описании устройствами и способами и доставлен в супрахориоидальное пространство глаза. В еще одном варианте реализации настоящего изобретения препарат представляет собой AKB9778, бевасираниб натрия, санд5, холина фенофибрат, сортиджест, олигонуклеотид с-raf 2-метоксиэтилфосфоротиоата, DE109, дексаметазон, вызывающий повреждение ДНК олигонуклеотид транскрипта 4, FOV2304, iCo007, KH902, MP0112, NCX434, оптина, озурдекс, PF4523655, SAR1118, сиролимус, SK0503 или трилипикс. В одном варианте реализации настоящего изобретения один или большее количество описанных выше препаратов лечения диабетического отека желтого пятна соединены с одним или большим количеством упомянутых выше в настоящем описании средств или с другими средствами, известными при современном уровне техники.
[1135] В одном варианте реализации настоящего изобретения препарат, который лечит, предотвращает и/или ослабляет отек желтого пятна, использован вместе с рассмотренными в настоящем описании устройствами и способами и доставлен в супрахориоидальное пространство глаза. В еще одном варианте реализации настоящего изобретения препарат представляет собой денуфозол тетранатрия, дексаметазон, экаллантид, пегаптаниб натрия, ранибизумаб или триамцинолон. Кроме того, препараты, доставляемые в глазные ткани посредством раскрытых в настоящем описании устройств и способов микроиглы, которые лечат, предотвращают и/или ослабляют отек желтого пятна, как упомянуто выше, могут быть соединены с одним или большим количеством упомянутых выше в настоящем описании средств или с другими средствами, известными при современном уровне техники.
[1136] В одном варианте реализации настоящего изобретения препарат, который лечит, предотвращает и/или ослабляет глазную артериальную гипертензию, использован вместе с рассмотренными в настоящем описании устройствами и способами и доставлен в супрахориоидальное пространство глаза. В еще одном варианте реализации настоящего изобретения препарат представляет собой 2-MeS-beta gamma-CCl2-ATP, ацетадиазол, ацетазоламид, аристомол, артеоптик, AZD4017, беталмик, бетаксолола гидрохлорид, бетимол, бетоптик S, бримодин, бримонал, бримонидин, бримонидина тартрат, бринидин, калте, картеолола гидрохлорид, косопт, CS088, DE092, DE104, DE111, дорзоламид, дорзоламида гидрохлорид, гидрохлорид дорзоламида с малеатом тимолола, дроптимол, фортинол, глаумол, хипадил, исмотик, изопропиловый унопростон, исосорбид, латалукс, латанопрост, латанопрост с малеатом тимолола, левобунолола гидрохлорид, лотенсин, манниген, маннитол, метипранолол, мифепристон, микелан, миникс метипранолол, мирол, нипрадилол, нортенз, окупресс, олмесартан, офталол, пилокарпина нитрат, пиобадж, рексула, RU486, рисмон TG, CAD448, сафлутан, хемол, тафлотан, тафлупрост, тафлупрост с тимололом, тиабоот, тимосомод, тимолол, тимолол актавис, тимолол гемигидрат, малеат тимолола, траваст, травопрост, унилат, ксалаком, ксалатан или зомилол. Кроме того, лекарственные средства, доставленные в глазные ткани посредством раскрытых в настоящем описании устройств и способов микроиглы, которые лечат, предотвращают и/или ослабляют глазную артериальную гипертензию, как упомянуто выше, могут быть соединены с одним или большим количеством упомянутых выше в настоящем описании средств или с другими средствами, известными при современном уровне техники.
[1137] В определенных вариантах реализации настоящего изобретения один или большее количество препаратов могут быть доставлены в глазные ткани и/или в супрахориоидальное пространство посредством систем и устройств, указанных в настоящем описании. Доставка одного или большего количества препаратов в супрахориоидальное пространство при использовании указанного в настоящем описании устройства микроиглы может быть выполнена при использовании одной или большего количества микроигл. Кроме того, комбинации одного или большего количества препаратов могут быть доставлены в супрахориоидальное пространство посредством использования указанного в настоящем описании устройства микроиглы в комбинации с доставкой одного или большего количества препаратов посредством интравитреального введения (например, интравитреальной инъекции, интравитреальной имплантации или глазных капель). Способы интравитреального введения известны при современном уровне техники. Примеры лекарств, которые могут быть применены посредством интравитреального введения, включают, не ограничиваясь этим: A0003, A0006, ацедолон, AdPEDF, афлиберцепт, AG13958, аганирсен, AGN208397, AKB9778, AL78898A, амилоид P, ингибитор ангиогенеза при генной терапии, ARC1905, ауросорт, бевасираниб натрия, бримонидин, бримонидин, бримонидина тартрат, бромфенак натрия, Cand5, CERE140, сиганклор, CLT001, CLT003, CLT004, CLT005, аптамер (пегилированный) компонента 5 комплемента, антитело фактора D комплемента, кортиджест, олигонуклеотид с-raf 2-метоксиэтилфосфоротиоата, циклоспорин, триамцинолон, DE109, денуфосола тетранатрий, дексаметазон, фосфат дессаметазона, диситертид, вызывающий повреждение ДНК олигонуклеотид транскрипта 4, E10030, экаллантид, EG3306, Eos013, ESBA1008, ESBA105, эйлея, FCFD4514S, флуоцинолона ацетонид, олигонуклеотид fms-cвязанной киназы 1 тирозина, фомивирсен натрия, фосбретабулин трометамина, FOV2301, FOV2501, ганцикловир, ганцикловир натрия, GS101, GS156, гиалуронидаза, IBI20089, iCo007, илувиен, INS37217, изонеп, JSM6427, калбитор, KH902, лерделимумаб, LFG316, луцентис, M200, макуген, макиуеидо, микроплазмин, MK0140, MP0112, NCX434, ген неуротрофина 4, OC10X, окриплазмин, ORA10, озурдекс, P144, P17, паломид 529, пазопаниба гидрохлорид, пегаптаниб натрия, плазменные ингибиторы калликреина, аптамер (пегилированный) полученного из тромбоцитов полипептида с фактором-бета роста, POT4, PRM167, PRS055, QPI1007, ранибизумаб, ресвератрол, ретилон, ген специфического для эпителия белка 65kDa сетчаточного пигмента, ретисерт, выделенный из палочек сетчатки глаза фактор жизнеспособности колбочек, RPE65 генотерапия, RPGR генотерапия, RTP801, Sd-rxRNA, ген ингибитора пептидазы серпина (клада F, элемент 1), сирна027, сиролимус, зонепцизумаб, SRT501, STP601, TG100948, трабио, триамцинолон, ацетонид триамцинолона, триварис, антитело фактора некроза опухоли, фактор роста эндотелия сосудов/ rGel-Op, вертепорфин, висудин, витраза, витразерт, витравен, витреалс, волоциксимаб, вотриент, XG102, ксибром, XV615 и зибрестат. Соответственно, способы настоящего изобретения включают управление через интравитреальное введение одного или большего количества упомянутых выше препаратов в комбинации с одним или большим количеством раскрытых в настоящем описании препаратов, доставленных в супрахориоидальное пространство посредством устройства микроиглы, упомянутого в настоящем описании.
[1138] В одном варианте реализации настоящего изобретения препарат предназначен для хранения и доставки через устройство микроиглы, рассмотренное в настоящем описании. «Состав препарата» представляет собой состав препарата, который обычно содержит один или большее количество фармацевтически приемлемых материалов наполнителя, известных при современном уровне техники. Термин «наполнитель» относится с любому неактивному ингредиенту состава, предназначенному для облегчения обработки, стабильности, способности к диспергации, смачиваемости, кинетики выделения и/или инъекции препарата. В одном варианте реализации настоящего изобретения наполнитель может содержать воду или солевой раствор или состоять из них.
[1139] В одном варианте реализации настоящего изобретения состав препарата в форме текучей среды содержит микрочастицы или наночастицы, каждая из которых может содержать по меньшей мере один препарат. При желании микрочастицы или наночастицы предусматривают управляемый выпуск препарата в глазную ткань. При использовании в настоящем описании термин «микрочастица» охватывает микросферы, микрокапсулы, микрочастицы и гранулы со среднечисловым диаметром от 1 до 100 мкм, наиболее предпочтительно от 1 до 25 мкм. Термин «наночастицы» охватывает частицы со среднечисловым диаметром от 1 до 1000 нм. Микрочастицы могут быть, а могут и не быть сферическими по форме. «Микрокапсулы» определены как микрочастицы, имеющие внешнюю оболочку, окружающую ядро из другого материала. Ядро может быть в виде жидкости, геля, твердого тела, газа или в виде их комбинации. В одном случае микрокапсула может представлять собой «микропузырь», имеющий внешнюю оболочку, окружающую газовое ядро, причем препарат размещен на поверхности внешней оболочки, непосредственно во внешней оболочке или в ядре. Как известно при современном уровне техники микропузыри могут реагировать на акустические колебания для диагноза и/или которые могут быть использованы для разрушения микропузыря с целью выпуска его полезного содержимого в выбранном месте глазной ткани. «Микросферы» могут быть выполнены в виде твердых сфер, могут быть пористыми и содержать подобную губке или ячеистую структуру, образованную порами или пустотами в матричном материале или оболочке, или могут содержать многочисленные дискретные пустоты в матричном материале или в оболочке. Микрочастица или наночастицы могут дополнительно содержать матричный материал. Материал оболочки или матрицы может представлять собой полимером, аминокислоту, сахарид или другой материал, известный в современной технике микрокапсуляции.
[1140] Содержащие препарат микрочастицы или наночастицы могут быть взвешены в водном или неводном жидком связующем. Жидкое связующее может быть фармацевтически приемлемым водным раствором и при необходимости может дополнительно содержать поверхностно-активный материал. Сами микрочастицы или наночастицы препарата могут содержать материал наполнителя, такой как полимер, полисахарид, поверхностно-активный материал и т.д., которые, как известно при современном уровне техники, управляют кинетикой выпуска препарата из частиц.
[1141] В одном варианте реализации настоящего изобретения состав препарата в форме текучей среды дополнительно содержит средство, эффективное для ухудшения коллагеновых или глюкозаминоглюкановых волокон в склере, что может увеличить проникновение/выпуск препарата в глазные ткани. Это средство может быть, например, ферментом, таким как хиалуронидаза, коллагеназа или их комбинацией. В варианте этого способа фермент доставляют в глазную ткань при операции, проводимой отдельно (или раньше или позже) от операции инфузии препарата. Фермент и препарат применяют в одном и том же месте.
[1142] В другом варианте реализации настоящего изобретения состав препарата представляет собой состав, претерпевающий фазовый переход при введении. Например, жидкий состав препарата может быть введен через полые микроиглы в супрахориоидальное пространство, где он затем загустевает и препарат диффундирует из геля с управляемым выпуском.
[1143] Хотя в настоящем описании варианты реализации и способы настоящего изобретения описывают доставку препарата в ткань-мишень, рассмотренные в настоящем описании варианты реализации могут быть выполнены с возможностью облегчения процедуры биопсии и/или удаления субстанции из целевого местоположения.
[1144] Хотя варианты реализации были описаны выше с использованием для глазной ткани, в определенных случаях рассмотренные в настоящем описании варианты реализации и способы могут быть использованы в отношении любой другой подходящей физической ткани. Например, в определенных случаях использование иглы с регулируемой длиной может быть полезным в сочетании с обычными способами венотомии во время вливания препарата и/или взятия крови из вены. Таким образом, хотя варианты реализации и способы настоящего изобретения были специфично описаны выше в отношении глазной ткани, следует понимать, что варианты реализации и способы настоящего изобретения были представлены лишь в качестве примера, а не ограничения.
[1145] Хотя выше были описаны различные варианты реализации настоящего изобретения, следует понимать, что они были представлены лишь в качестве примера, а не ограничения. Хотя описанные выше способы указывают на определенные операции, выполняемые в определенном порядке, порядок выполнения определенных операций может быть изменен. Кроме того, определенные операции могут быть выполнены при возможности одновременно в параллельном процессе, а также выполнены последовательно, как описано выше.
[1146] Хотя системы и способы показаны и рассмотрены в настоящем описании как обеспечивающие доставку лекарственных средств в супрахориоидальное пространстве, в других вариантах реализации настоящего изобретения рассмотренные в настоящем описании системы и способы могут быть применены для доставку любой подходящей терапевтической субстанции в любую часть глаза, такую как роговица, сетчаточная область или стекловидное тело. В других вариантах реализации настоящего изобретения любая из рассмотренных в настоящем описании систем, способов и устройств может быть использована для доставки любой подходящей терапевтической субстанции в любую нужную ткань-мишень (включая неглазную ткань).
[1147] В других вариантах реализации настоящего изобретения канюли, микроиглы и/или способы могут быть использованы для доставки лекарственных средств в любую подходящую часть тела, включая кожные инъекции и т.п.
[1148] Хотя описанные выше схемы и/или варианты реализации настоящего изобретения указывают на определенные компоненты, размещенные в определенных ориентациях или положениях, размещение компонентов может быть изменено. Аналогичным образом, при указании посредством описанных выше способов и/или событий на определенные события и/или процедуры, выполняемые в определенном порядке, порядок выполнения определенных событий и/или процедур может быть изменен. Хотя были показаны и описаны конкретные варианты реализации настоящего изобретения, следует понимать, что могут быть внесены различные изменения относительно формы и деталей.
[1149] Хотя различные варианты реализации настоящего изобретения были описаны как содержащие определенные особенности и/или комбинации компонентов, возможны другие варианты реализации настоящего изобретения, содержащие комбинацию любых особенностей и/или компонентов из любых рассмотренных выше вариантов реализации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И УСТРОЙСТВА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА К ГЛАЗНОЙ ТКАНИ С ПОМОЩЬЮ МИКРОИГЛЫ | 2011 |
|
RU2635320C2 |
| ИМПЛАНТИРУЕМОЕ УСТРОЙСТВО И СПОСОБ ДОСТАВКИ ТЕКУЧЕГО ЛЕКАРСТВЕННОГО ПРЕПАРАТА В ТКАНЬ | 2007 |
|
RU2423154C2 |
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА ВНУТРЬ ГЛАЗА | 2007 |
|
RU2440102C2 |
| СПОСОБ ВВЕДЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА В СУПРАХОРИОДАЛЬНОЕ ПРОСТРАНСТВО ГЛАЗНОГО ЯБЛОКА | 2024 |
|
RU2835865C1 |
| СИСТЕМА ДОСТАВКИ ГЛАЗНОГО ИМПЛАНТАТА | 2013 |
|
RU2636859C2 |
| УСТРОЙСТВО ДОСТАВКИ ВНУТРИГЛАЗНОГО ИМПЛАНТАТА И СПОСОБЫ ЕГО ИСПОЛЬЗОВАНИЯ | 2015 |
|
RU2728195C2 |
| УСТРОЙСТВА ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА, ИМЕЮЩИЕ ОТДЕЛЯЕМЫЕ МИКРОИГЛЫ | 2016 |
|
RU2721298C2 |
| ИНЪЕКЦИОННОЕ УСТРОЙСТВО | 2015 |
|
RU2687176C2 |
| РАСШИРЯЕМЫЕ УСТРОЙСТВА ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СПОСОБЫ ИСПОЛЬЗОВАНИЯ | 2015 |
|
RU2708958C2 |
| УСТРОЙСТВА РАСШИРЯЮЩИХСЯ ОФТАЛЬМОЛОГИЧЕСКИХ ИМПЛАНТАТОВ | 2013 |
|
RU2650203C2 |

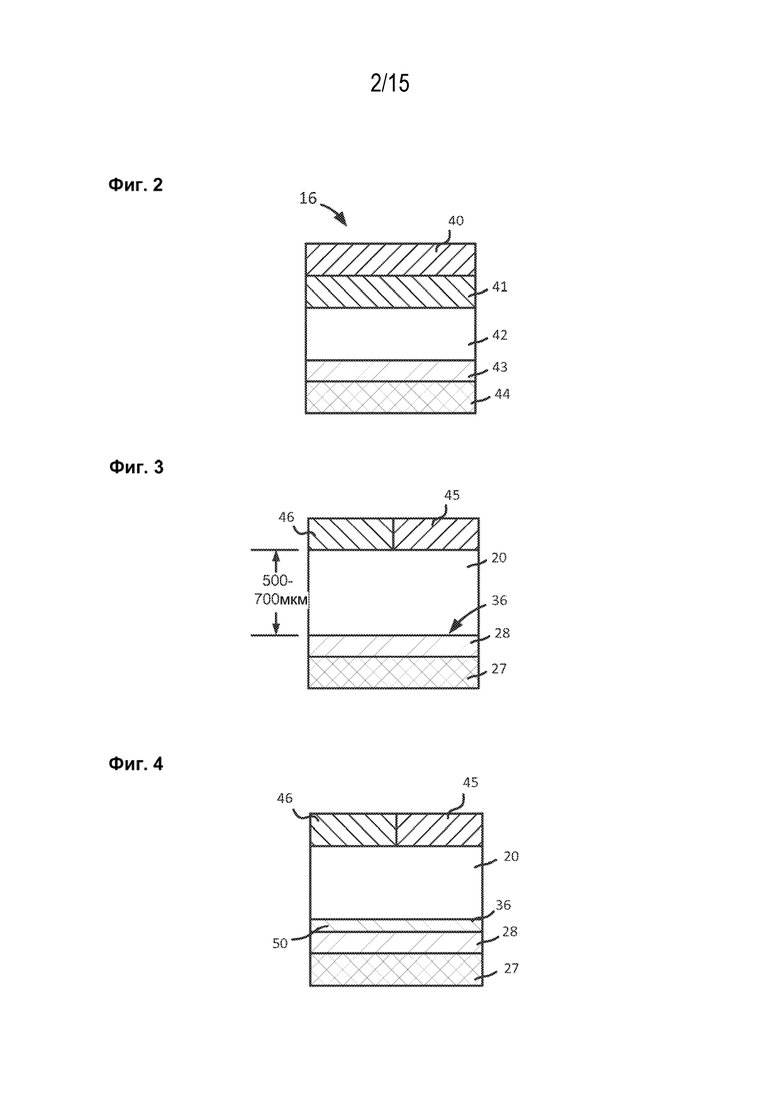
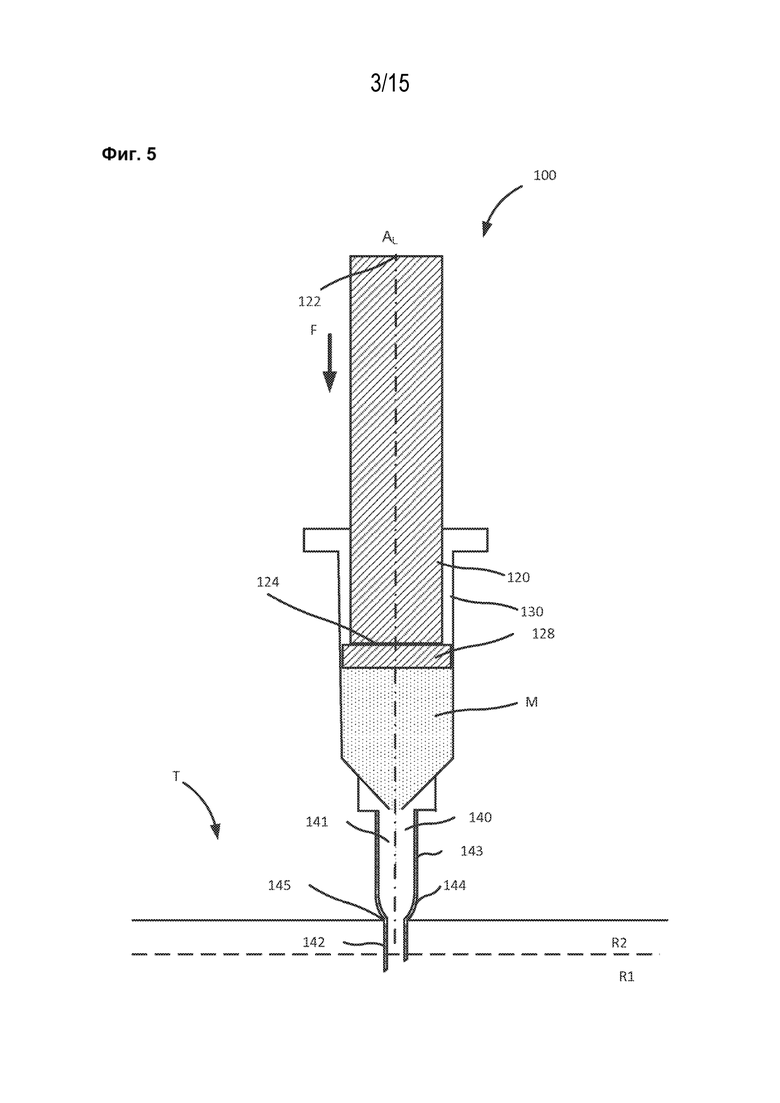

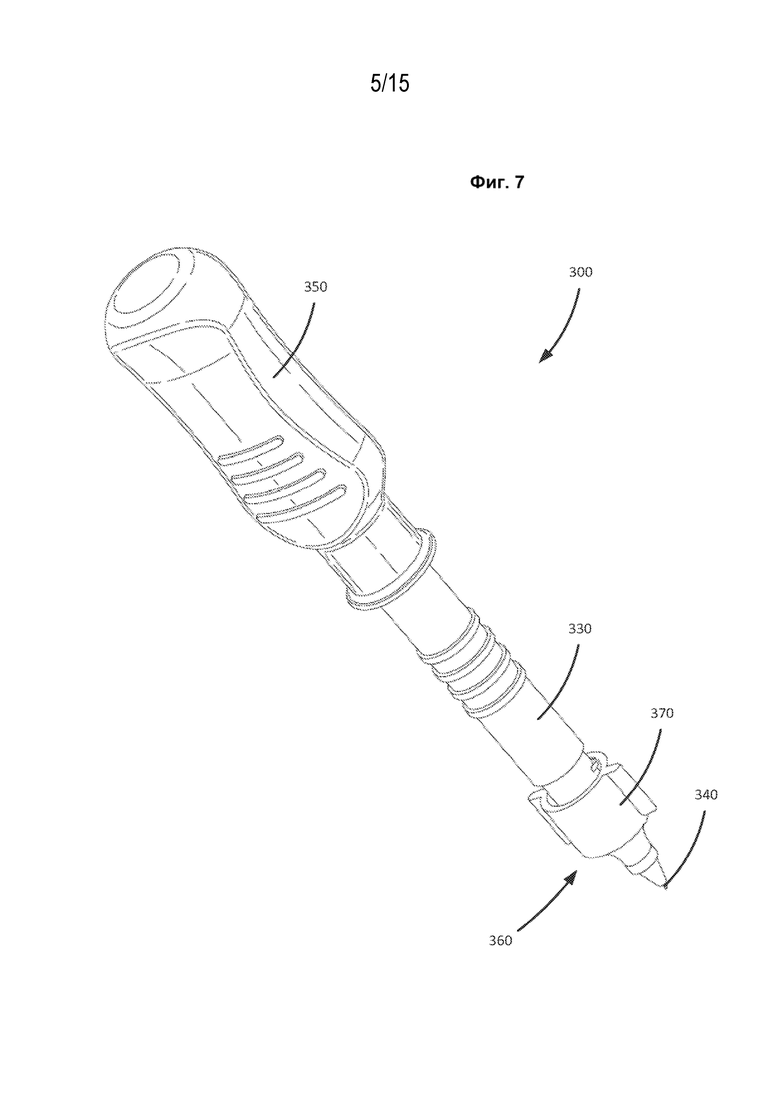
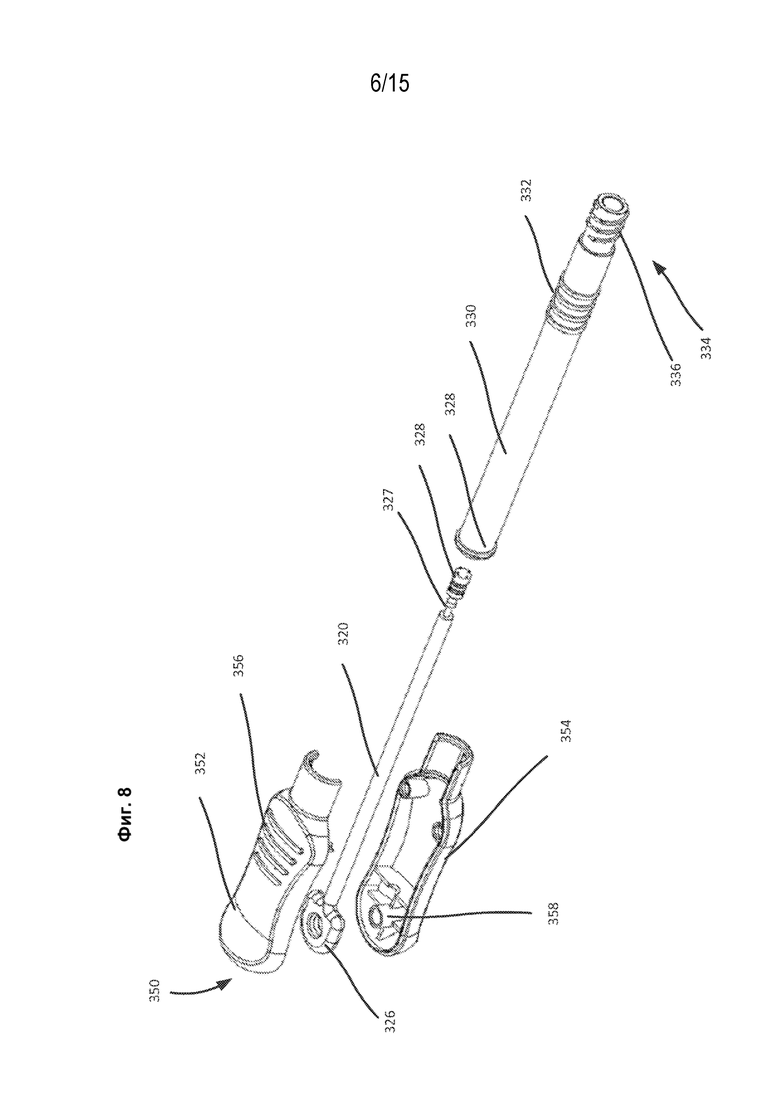
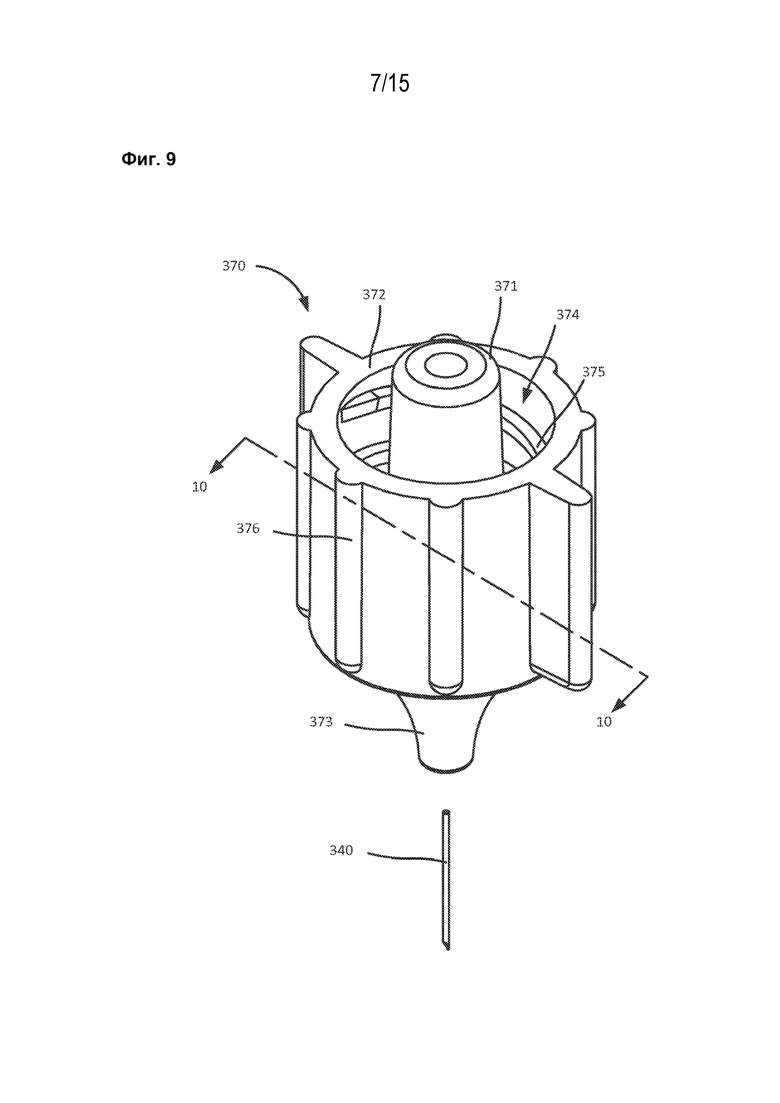


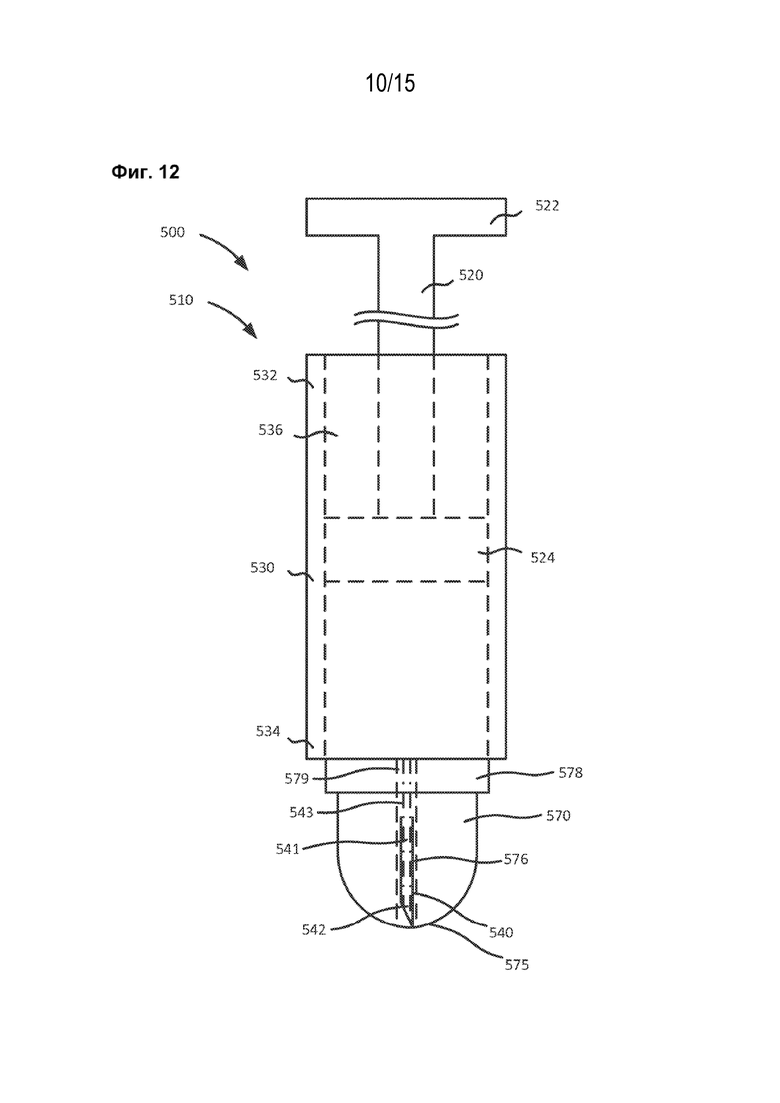
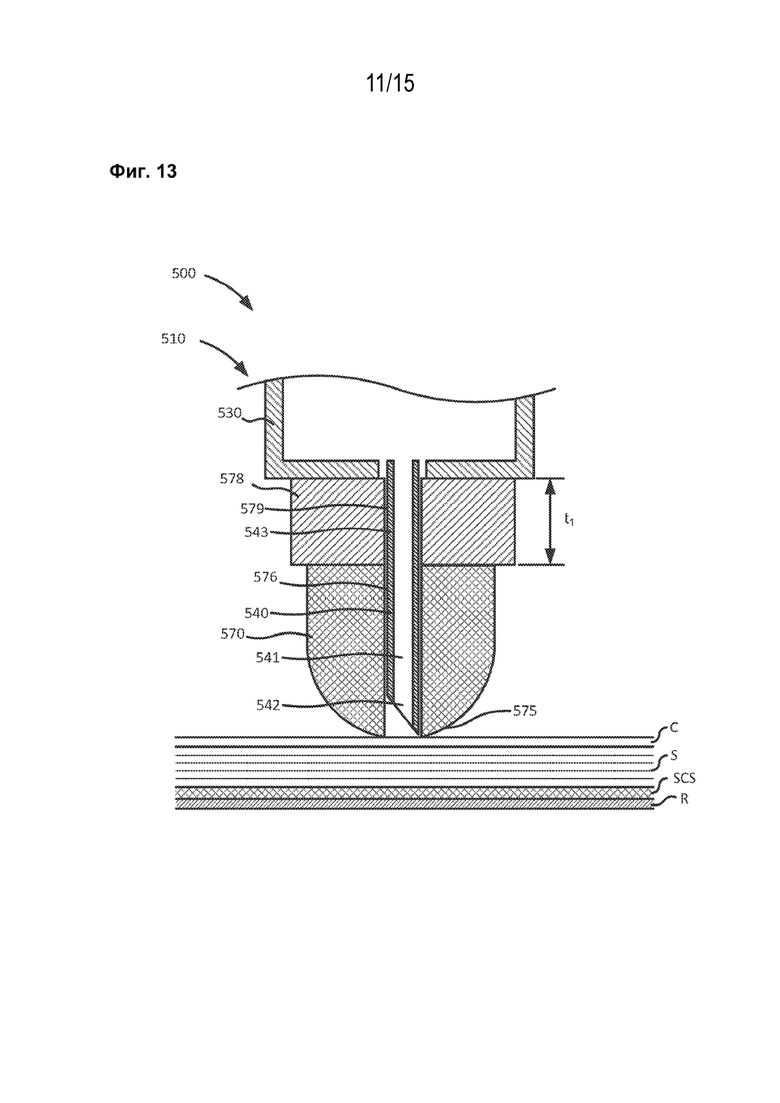
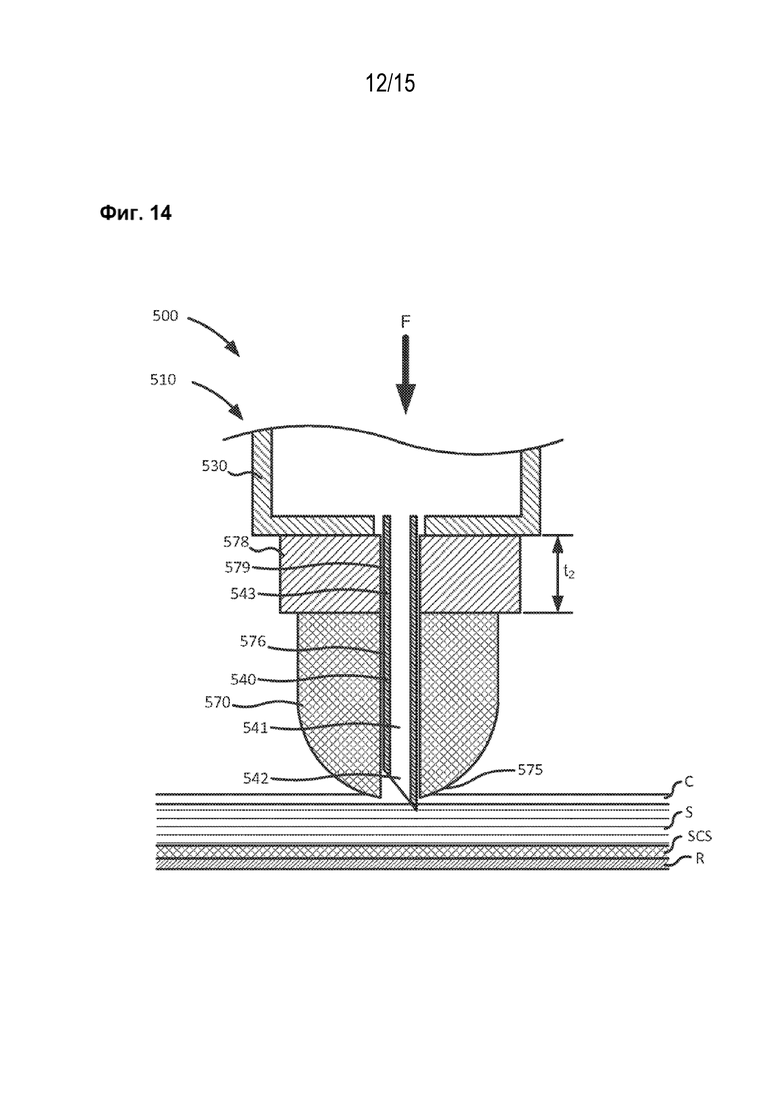
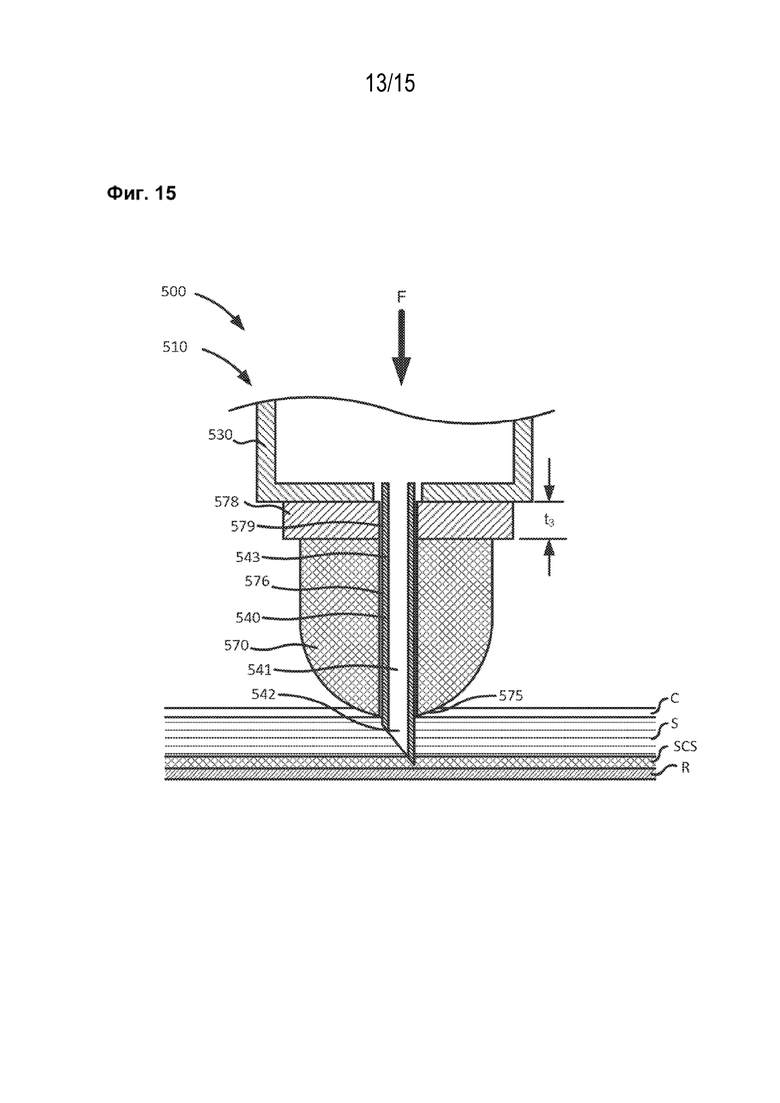

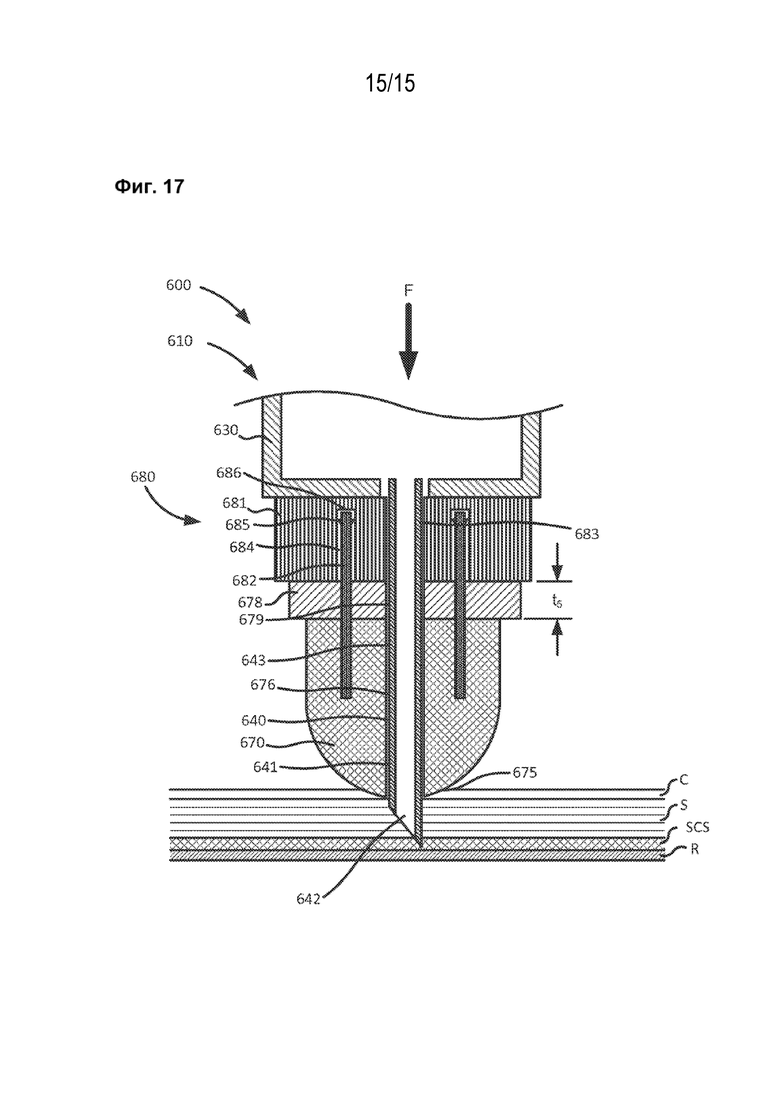
Изобретение относится к медицинской технике, а именно к устройствам для инъекции лекарственного средства в глазную ткань. Устройство содержит: корпус, выполненный с возможностью вмещения по меньшей мере части контейнера для лекарственного средства; разъем иглы, соединенный с корпусом и образующий канал, выполненный с возможностью приема через него пункционного элемента, причем разъем иглы имеет дистальную концевую поверхность, выполненную с возможностью контакта с целевой поверхностью ткани-мишени, когда субстанция перемещается через пункционный элемент; и приводной шток, выполненный с возможностью герметичного уплотнения с контейнером для лекарственного средства. И приводной шток, и пункционный элемент выполнены так, что дистальная концевая часть приводного штока перемещается внутри контейнера для лекарственного средства, и длина пункционного элемента, проходящая в дистальном направлении от дистальной концевой поверхности разъема иглы, увеличивается в качестве реакции на силу, прилагаемую к приводному штоку, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени, и перемещение пункционного элемента относительно дистальной концевой поверхности разъема иглы в качестве реакции на силу, прилагаемую к приводному штоку, ограничено, когда дистальная концевая часть пункционного элемента размещена внутри второй области ткани-мишени. Причем сила имеет величину меньше порогового значения. 3 н. и 42 з.п. ф-лы, 17 ил.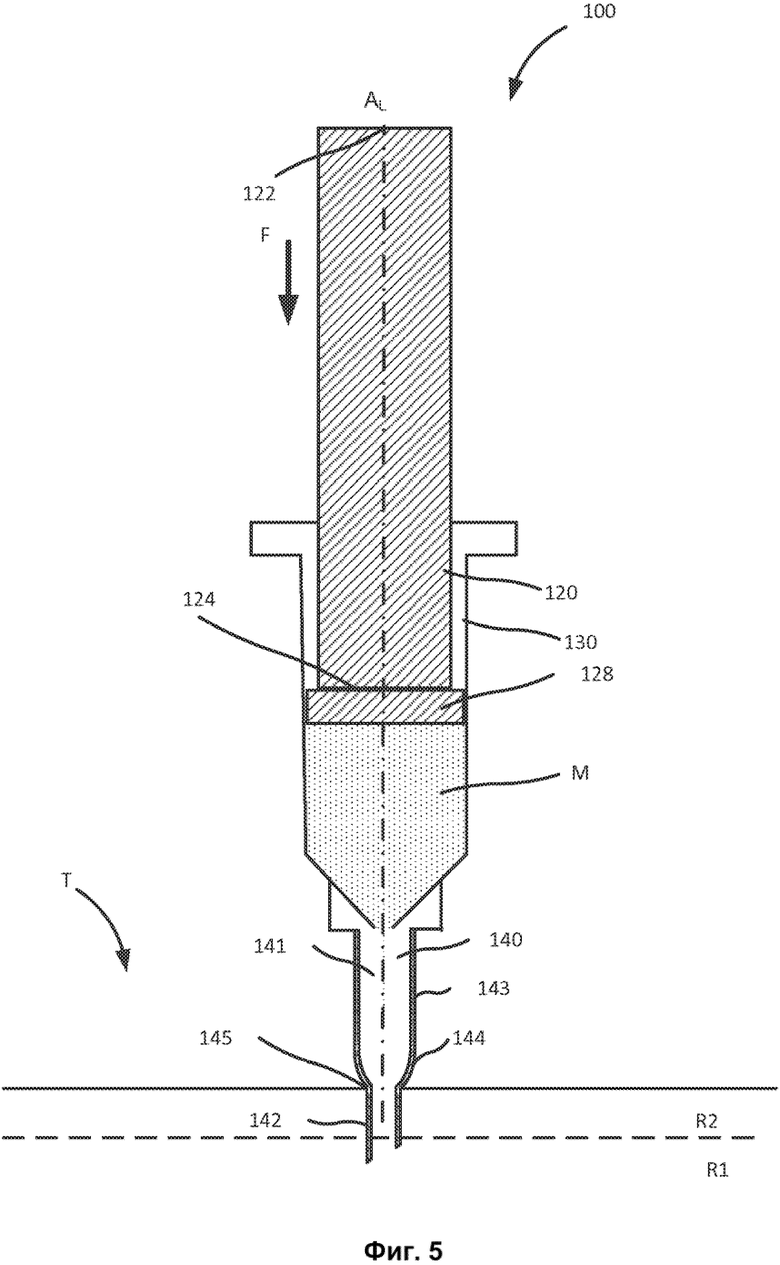
1. Устройство для инъекции лекарственного средства в глазную ткань, содержащее:
корпус, выполненный с возможностью вмещения по меньшей мере части контейнера для лекарственного средства;
разъем иглы, соединенный с корпусом и образующий канал, выполненный с возможностью приема через него пункционного элемента, причем разъем иглы имеет дистальную концевую поверхность, выполненную с возможностью контакта с целевой поверхностью ткани-мишени, когда субстанция перемещается через пункционный элемент; и
приводной шток, выполненный с возможностью герметичного уплотнения с контейнером для лекарственного средства, и приводной шток и пункционный элемент выполнены так, что дистальная концевая часть приводного штока перемещается внутри контейнера для лекарственного средства, и длина пункционного элемента, проходящая в дистальном направлении от дистальной концевой поверхности разъема иглы, увеличивается в качестве реакции на силу, прилагаемую к приводному штоку, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени, и перемещение пункционного элемента относительно дистальной концевой поверхности разъема иглы в качестве реакции на силу, прилагаемую к приводному штоку, ограничено, когда дистальная концевая часть пункционного элемента размещена внутри второй области ткани-мишени, причем сила имеет величину меньше порогового значения.
2. Устройство по п.1, в котором приводной шток и пункционный элемент выполнены так, что длина пункционного элемента, проходящая в дистальном направлении от дистальной концевой поверхности разъема иглы, увеличивается в качестве реакции на силу, прилагаемую к приводному штоку, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени и дистальная концевая поверхность разъема иглы находится в контакте с целевой поверхностью ткани-мишени.
3. Устройство по п.1, в котором пороговое значение составляет приблизительно 6 Н.
4. Устройство по п.1, в котором сила составляет от приблизительно 0,5 Н до приблизительно 2 Н.
5. Устройство по п.1, в котором ткань-мишень представляет собой глаз, а целевая поверхность представляет собой любое из конъюнктивы глаза или склеры глаза,
первая область представляет собой верхнюю часть склеры глаза и
вторая область содержит по меньшей мере одно из: супрахориоидального пространства, нижней части склеры, сосудистой оболочки глаза, подсетчаточного пространства глаза или сетчатки глаза.
6. Устройство по п.1, в котором, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени, сила недостаточна для перемещения субстанции из контейнера для лекарственного средства в ткань-мишень через пункционный элемент.
7. Устройство по п.1, которое выполнено с возможностью перемещения субстанции через пункционный элемент в качестве реакции на силу, прилагаемую к приводному штоку, когда дистальная концевая часть пункционного элемента размещена внутри второй области ткани-мишени.
8. Устройство по п.1, в котором пункционный элемент жестко связан с разъемом иглы так, что разъем иглы перемещается вместе с пункционным элементом, когда пункционный элемент перемещается относительно целевой поверхности.
9. Устройство по п.1, в котором центральная линия пункционного элемента по существу перпендикулярна к линии поверхности, касательной к разъему иглы.
10. Устройство по п.1, в котором, при наличии контакта дистальной концевой поверхности разъема иглы с целевой поверхностью и герметичного уплотнения приводного штока с контейнером для лекарственного средства, сила, действующая на приводной шток, вызывает увеличение длины пункционного элемента, проходящей в дистальном направлении от дистальной концевой поверхности разъема иглы, так что дистальная концевая часть пункционного элемента перемещается изнутри первой области ткани-мишени во вторую область ткани-мишени.
11. Устройство по п.1, в котором, когда дистальная концевая часть пункционного элемента перемещена из первой области во вторую область, сила достаточна для преодоления обратного давления второй области таким образом, что перемещение пункционного элемента относительно дистальной концевой поверхности разъема иглы уменьшено и субстанция перемещена в ткань-мишень.
12. Устройство по п.1, дополнительно содержащее:
контейнер для лекарственного средства, содержащий субстанцию, при этом субстанция представляет собой по меньшей мере одно из: фактора роста эндотелия сосудов (VEGF), ингибитора фактора роста эндотелия сосудов (VEGF inhibitor) или их комбинации.
13. Устройство по п.1, в котором дистальная концевая поверхность разъема иглы содержит уплотнительную часть, выполненную с возможностью образования по существу непроницаемого для текучей среды уплотнения с целевой поверхностью, при этом уплотнительная часть расположена симметрично вокруг центральной линии пункционного элемента.
14. Устройство по п.1, дополнительно содержащее сжимаемый элемент, функционально соединенный с контейнером для лекарственного средства, при этом по меньшей мере часть пункционного элемента размещена внутри канала, образованного сжимаемым элементом.
15. Устройство по п.14, в котором сжимаемый элемент выполнен таким образом, что длина, проходящая в дистальном направлении от дистальной концевой поверхности разъема иглы, не может увеличиваться сверх приблизительно 1200 мкм в качестве реакции на силу, при этом сила составляет от приблизительно 0,5 Н до приблизительно 2 Н.
16. Устройство для инъекции лекарственного средства в глазную ткань, содержащее:
корпус, выполненный с возможностью вмещения по меньшей мере части контейнера для лекарственного средства;
разъем иглы, соединенный с корпусом и образующий канал, выполненный с возможностью вмещения через него пункционного элемента, причем разъем иглы имеет дистальную концевую поверхность, выполненную с возможностью контакта с целевой поверхностью ткани-мишени;
сжимаемый элемент, функционально соединенный с контейнером для лекарственного средства; и
приводной шток, выполненный с возможностью герметичного уплотнения с контейнером для лекарственного средства, причем приводной шток, сжимаемый элемент и пункционный элемент выполнены так, что дистальная концевая часть приводного штока перемещается внутри контейнера для лекарственного средства и длина пункционного элемента, проходящая в дистальном направлении от дистальной концевой поверхности разъема иглы, увеличивается в качестве реакции на силу, прилагаемую к приводному штоку, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени, и перемещение пункционного элемента относительно дистальной концевой поверхности разъема иглы в качестве реакции на силу, прилагаемую к приводному штоку, ограничено, когда дистальная концевая часть пункционного элемента размещена внутри второй области ткани-мишени, причем сила имеет величину меньше порогового значения.
17. Устройство по п.16, в котором приводной шток, сжимаемый элемент и пункционный элемент выполнены так, что длина пункционного элемента, проходящая в дистальном направлении от дистальной концевой поверхности разъема иглы, увеличивается в качестве реакции на силу, прилагаемую к приводному штоку, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени и дистальная концевая поверхность разъема иглы находится в контакте с целевой поверхностью ткани-мишени.
18. Устройство по п.16, в котором пороговое значение составляет приблизительно 6 Н.
19. Устройство по п.16, в котором сила составляет от приблизительно 0,5 Н до приблизительно 2 Н.
20. Устройство по п.16, в котором:
ткань-мишень представляет собой глаз, а целевая поверхность представляет собой любое из конъюнктивы глаза или склеры глаза,
первая область представляет собой верхнюю часть склеры глаза и
вторая область содержит по меньшей мере одно из: супрахориоидального пространства, нижней части склеры, сосудистой оболочки глаза, подсетчаточного пространства глаза или сетчатки глаза.
21. Устройство по п.16, в котором, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени, сила недостаточна для перемещения субстанции из контейнера для лекарственного средства в ткань-мишень через пункционный элемент.
22. Устройство по п.16, в котором, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени и приводной шток герметично уплотнен с контейнером для лекарственного средства, субстанция перемещается через пункционный элемент в качестве реакции на силу, прилагаемую к приводному штоку.
23. Устройство по п.16, в котором пункционный элемент жестко связан с разъемом иглы таким образом, что разъем иглы перемещается вместе с пункционным элементом, когда пункционный элемент перемещен относительно целевой поверхности.
24. Устройство по п.16, в котором центральная линия пункционного элемента по существу перпендикулярна к линии поверхности, касательной к разъему иглы.
25. Устройство по п.16, в котором при наличии контакта дистальной концевой поверхности разъема иглы с целевой поверхностью и герметичного уплотнения приводного штока с контейнером для лекарственного средства сила, действующая на приводной шток, вызывает увеличение длины пункционного элемента, проходящей в дистальном направлении от дистальной концевой поверхности разъема иглы, так что дистальная концевая часть пункционного элемента перемещена изнутри первой области ткани-мишени во вторую область ткани-мишени.
26. Устройство по п.16, в котором, когда дистальная концевая часть пункционного элемента перемещена из первой области во вторую область, сила достаточна для преодоления обратного давления второй области с таким расчетом, что перемещение пункционного элемента относительно дистальной концевой поверхности разъема иглы уменьшается и субстанция перемещается в ткань-мишень.
27. Устройство по п.16, дополнительно содержащее контейнер для лекарственного средства, содержащий субстанцию, при этом субстанция представляет собой по меньшей мере одно из: фактора роста эндотелия сосудов (VEGF), ингибитора фактора роста эндотелия сосудов (VEGF inhibitor), ингибитора рецепторов тромбоцитарного фактора роста (PDGFR inhibitor) или их комбинации.
28. Устройство по п.16, в котором дистальная концевая поверхность разъема иглы содержит уплотнительную часть, выполненную с возможностью образования по существу непроницаемого для текучей среды уплотнения с целевой поверхностью, при этом уплотнительная часть расположена симметрично вокруг центральной линии пункционного элемента.
29. Устройство по п.16, в котором по меньшей мере часть пункционного элемента размещена внутри канала, образованного сжимаемым элементом.
30. Устройство по п.16, в котором сжимаемый элемент выполнен так, что длина, проходящая в дистальном направлении от дистальной концевой поверхности разъема иглы, не может увеличиваться сверх приблизительно 1200 мкм в качестве реакции на силу, при этом сила составляет от приблизительно 0,5 Н до приблизительно 2 Н.
31. Способ инъекции лекарственного средства в глазную ткань, согласно которому:
вводят дистальную концевую часть пункционного элемента медицинского инъектора в ткань-мишень для образования канала доставки внутри ткани-мишени и таким образом, чтобы дистальная концевая поверхность разъема иглы медицинского инъектора находилась в контакте с целевой поверхностью ткани-мишени;
прикладывают силу к приводному штоку медицинского инъектора, когда дистальная концевая поверхность разъема иглы находится в контакте с целевой поверхностью ткани-мишени, при этом сила имеет величину меньше порогового значения, причем сила вызывает перемещение приводного штока внутри контейнера для лекарственного средства, соединенного с медицинским инъектором, и увеличивает длину пункционного элемента, проходящую в дистальном направлении от дистальной концевой поверхности разъема иглы, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени и дистальная концевая поверхность разъема иглы находится в контакте с целевой поверхностью ткани-мишени; и
перемещают, в качестве реакции на приложение силы, субстанцию из контейнера для лекарственного средства в ткань-мишень через пункционный элемент, когда дистальная концевая часть пункционного элемента размещена внутри второй области ткани-мишени.
32. Способ по п.31, согласно которому сила увеличивает длину пункционного элемента, проходящую в дистальном направлении от дистальной концевой поверхности разъема иглы, когда дистальная концевая поверхность разъема иглы находится в контакте с целевой поверхностью, таким образом, что дистальная концевая часть пункционного элемента перемещается во вторую область ткани-мишени.
33. Способ по п.31, согласно которому перемещение пункционного элемента относительно дистальной концевой поверхности разъема иглы в качестве реакции на силу ограничено, когда дистальная концевая часть пункционного элемента размещена внутри второй области ткани-мишени, и дистальная концевая поверхность разъема иглы находится в контакте с целевой поверхностью ткани-мишени.
34. Способ по п.31, согласно которому, когда дистальная концевая часть пункционного элемента перемещена из первой области во вторую область, сила достаточна для преодоления обратного давления второй области с таким расчетом, что перемещение дистальной концевой части пункционного элемента относительно разъема иглы уменьшается, и субстанция перемещается в ткань-мишень.
35. Способ по п.31, согласно которому пороговое значение составляет приблизительно 6 Н.
36. Способ по п.31, согласно которому введение выполняют так, что центральная линия пункционного элемента перпендикулярна к целевой поверхности.
37. Способ по п.31, согласно которому введение выполняют так, что центральная линия пункционного элемента перпендикулярна целевой поверхности.
38. Способ по п.31, согласно которому ткань-мишень представляет собой глаз, а целевая поверхность представляет собой любое из конъюнктивы глаза или склеры глаза.
39. Способ по п. 31, согласно которому ткань-мишень представляет собой глаз, а целевая поверхность представляет собой любое из конъюнктивы глаза или склеры глаза, причем вторая область содержит по меньшей мере одно из: супрахориоидального пространства, нижней части склеры, сосудистой оболочки глаза, подсетчаточного пространства глаза или сетчатки глаза.
40. Способ по п. 31, согласно которому первая область представляет собой нижнюю часть склеры глаза.
41. Способ по п.31, согласно которому субстанция представляет собой по меньшей мере одно из: фактора роста эндотелия сосудов (VEGF), ингибитора фактора роста эндотелия сосудов (VEGF inhibitor), ингибитора рецепторов тромбоцитарного фактора роста (PDGFR inhibitor) или их комбинации.
42. Способ по п.31, согласно которому дистальная концевая поверхность разъема иглы содержит уплотнительную часть, выполненную с возможностью образования непроницаемого для текучей среды уплотнения с целевой поверхностью, при этом уплотнительная часть расположена симметрично вокруг центральной линии пункционного элемента.
43. Способ по п.31, согласно которому дополнительно при приложении силы поддерживают силу, прилагаемую к медицинскому инъектору, таким образом, чтобы разъем иглы образовал по существу непроницаемое для текучей среды уплотнение с целевой поверхностью.
44. Способ по п.31, согласно которому, когда дистальная концевая часть пункционного элемента размещена внутри первой области ткани-мишени, сила недостаточна для перемещения субстанции из контейнера для лекарственного средства в ткань-мишень через пункционный элемент.
45. Способ по п.31, согласно которому пункционный элемент жестко связан с разъемом иглы таким образом, что разъем иглы перемещается вместе с пункционным элементом, когда пункционный элемент перемещают относительно целевой поверхности.
| US 2010010452 A1, 14.01.2010 | |||
| US 2012265149 A1, 18.10.2012 | |||
| Устройство для сушки фильмов | 1929 |
|
SU14351A1 |
| US 2006089607 A1, 27.04.2006. | |||
Авторы
Даты
2019-12-26—Публикация
2015-06-19—Подача