ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Данная заявка заявляет приоритет предварительной заявки США с регистрационным номером 61/787,753, поданной 15 марта 2013 г., и предварительной заявки США с регистрационным номером 61/791,537 поданной 15 марта 2013 г., полное содержание которых является введенным в данную заявку в качестве ссылки.
1. Область техники
Данное изобретение относится к нацеливанию на фосфатидилсерин (PtdS), который находится на клеточных мембранах, при использовании пептидов и полипептидов Gla домена. Раскрывается применение таких пептидов и полипептидов в качестве диагностических и терапевтических агентов.
2. Предшествующий уровень техники
Фосфатидилсерин (PtdS) представляет собой негативно заряженный фосфолипидный компонент, который обычно локализуется на внутренней поверхности (цитоплазматическая сторона) клеточной мембраны. Однако PtdS может также транспортироваться с помощью скрамблазы (член семейства флиппазы) от внутренней к внешней поверхности и выходить на поверхность клетки. С очень немногими исключениями, эта активная экстернализация PtdS является ответом на повреждение клеток (van den Eijnde и др., 2001; Erwig and Henson, 2008). Например, повреждение тканей подает сигнал тромбоцитам, лейкоцитам и клеткам эндотелия быстро и обратимо перераспределить PtdS, что приводит к стимуляции коагуляции и активации комплемента на поверхности клеток. Подобно этому, апоптические сигналы приводят в экстернализации PtdS, но более постепенным и устойчивым образом. Этот внешний PtdS обеспечивает ключевой маркер распознавания, что позволяет макрофагам поглощать умирающие клеток из окружающих тканей (Erwig and Henson, 2008). Указанный процесс удаления имеет важное значение для гомеостаза тканей и в "здоровой" среде является очень эффективным. На самом деле, несмотря на потерю >109 клеток в сутки, гистологическое выявление апоптоза клеток является редким событием в нормальных тканях (Elltiot and Ravichandran 2010; Elltiot и др., 2009). Тем не менее, существуют данные, свидетельствующие о том, что при многих патологических состояниях апоптический процесс удаления клеток является перегруженным, задерживается или отсутствует (Elltiot and Ravichandran 2010; Lahorte и др., 2004). Например, несколько онкологических исследований дают возможность предположить, что высокий апоптический индекс связан с более высокой степенью развития опухолей, увеличением скорости метастазирования и плохим прогнозом для пациента (Naresh и др., 2001; Loose и др., 2007;. Kurihara и др., 2008; Kietselaer и др., 2002). Эти исследования, а также другие, подобные им, предполагают, что апоптоз и экспрессия внешнего PtdS может быть мощным маркером заболевания (Elltiot and Ravichandran, 2010).
Существует несколько белков, которые обладают высоким сродством для анионных фосфолипидных поверхностей с аннексином-V, который наиболее широко используется в качестве PtdS нацеливающего зонда (Lahorte и др., 2004). При использовании высокой аффинности для везикул, содержащих PtdS (Kd=0,5-7 нМ), и молекулярной массы (37 кДа), которая является ниже порога фильтрации почек (приблизительно 60 кДа), аннексин-V был продемонстрирован как перспективный в клинических испытаниях в качестве зонда для апоптоза (Lin и др., 2010; Tait and Gibson, 1992). Кроме того, он был использован для широкого диапазона показаний, в том числе в онкологии, неврологии и кардиологии (Lahorte и др., 2004;. Boersma и др., 2005; Blankenberg, 2009; Reutelingsperger и др., 2002). Было продемонстрировано как в условиях in vitro, так и in vivo, и применение биологических зондов, которые являются нацеленными на экспрессию PtdS на поверхности клеток. В то время как их полезность при клиническом применении является многообещающей, они, по большей части, пока не использовались.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Таким образом, в соответствии с настоящим изобретением обеспечивается способ нацеливания на фосфатидилсерин (PtdS) клеточных мембран, включающий (а) получение изолированного полипептида, содержащего домен гамма-карбоксиглутаминовой кислоты (GLA) и не имеющего домена протеазы или гормон-связывающего домена; и (б) приведение в контакт пептида с клеточной поверхностью, где полипептид связывается с PtdS на клеточной мембране. Клеточная мембрана может представлять собой мембрану клеток сердца, мембрану нейронных клеток, мембрану эндотелиальных клеток, мембрану инфицированных вирусом клеток, мембрану апоптических клеток, мембрану тромбоцитов или мембрану раковых клеток. Полипептид может дополнительно содержать домен, связывающий EGF, домен Крингла и/или домен блока ароматической аминокислоты. Gla домен может иметь происхождение от фактора II, фактора VII, фактора IX, фактора X, белка S или белка С.
Полипептид может дополнительно содержать способную к обнаружению метку, например, флуоресцентную метку, хемилюминисцентную метку, радиоактивную метку, фермент, краситель или лиганд. Полипептид может дополнительно содержать терапевтический агент такой, как противораковый агент, в том числе химиотерапевтический агент, радиотерапевтический агент, цитокин, гормон, антитело или фрагмент антитела или токсин, или противовирусный агент.Терапевтический агент может представлять собой фермент, такой как фермент для превращения пролекарственного средства, цитокин, фактор роста, фактор свертывания крови или антикоагулянт. Полипептид может содержать 300 остатков или менее, 200 остатков или менее, или 100 остатков или менее, включая интервалы 100-200 и 100-300 остатков.
Полипептид может содержать 5-15 Gla остатков, 9-13 Gla остатков, в том числе 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 остатков Gla. Полипептид может содержать более чем 13 остатков Gla, но менее, чем 30% от общего количества остатков Gla. Полипептид может иметь размер приблизительно от 4,5 до 30 кДа. Полипептид может содержать, по крайней мере, одну дисульфидную связь или 2-5 дисульфидных связей. Полипептид может содержать Gla домен белка S. Полипептид может содержать Gla домен белка S плюс EGF домен белка S, Gla домен протромбина, Gla домен протромбина плюс Крингл домен протромбина, Gla домен белка Z, Gla домен белка Z плюс Крингл домен протромбина, Gla домен фактора VII или Gla домен фактора VII плюс Крингл домен протромбина. Полипептид может дополнительно содержать Fc участок антитела. Любой из вышеперечисленных может содержать консервативные замены нативных последовательностей для вышеуказанных белков и/или демонстрировать процент гомологии с представленными нативными доменами.
В другом варианте осуществления изобретения обеспечивается способ лечения рака у субъекта, включающий введение субъекту изолированного полипептида, содержащего домен гамма-карбоксиглутаминовой кислоты (Gla) и не имеющего домена протеазы или гормон-связывающего домена, где полипептид является связанным с терапевтической полезной загрузкой. Терапевтическая полезная загрузка может представлять собой химиотерапевтический агент, радиотерапевтический агент или токсин. Рак может представлять собой рак молочной железы, рак мозга, рак желудка, рак легких, рак предстательной железы, рак яичников, рак яичек, рак толстой кишки, рак кожи, рак прямой кишки, рак шейки матки, рак матки, рак печени, рак поджелудочной железы, рак головы и шеи или рак пищевода.
Еще в одном варианте осуществления обеспечивается способ лечения вирусного заболевания у субъекта, включающий введение субъекту изолированного полипептида, содержащего домен гамма-карбоксиглутаминовой кислоты (Gla) и не имеющего домена протеазы или гормон-связывающего домена, где полипептид является связанным с противовирусным агентом. Вирусное заболевание может представлять собой вирус гриппа, вирус иммунодефицита человека, вирус лихорадки денге, вирус Западного Нила, вирус оспы, респираторно-синцитиальный вирус, вирус корейской геморрагической лихорадки, авипоксивирус, вирус ветряной оспы, вирус простого герпеса 1 или 2, вирус Эпштейна-Барра, вирус маргбурской болезни, хантавирус, вирус желтой лихорадки, вирус гепатита А, В, С или Е, вирус Эбола, вирус папилломы человека, риновирус, вирус Коксаки, вирус полиомиелита, вирус кори, вирус краснухи, вирус бешенства, вирус ньюкаслской болезни, ротавирус, HTLV-1 и -2.
Предполагается, что любой способ или композиция, описанные в данной заявке, могут быть реализованы в соответствии с любым другим способом или композицией, описанными в данной заявке.
Другие задачи, признаки и преимущества настоящего изобретения станут очевидными из нижеследующего подробного описания. Следует понимать, однако, что подробное описание и конкретные примеры, демонстрирующие конкретные варианты осуществления изобретения, приводятся только в качестве иллюстрации, поскольку различные изменения и модификации в пределах сущности и объема изобретения станут очевидными для специалистов в данной области техники из этого подробного описания.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Следующие фигуры представляют собой часть настоящего описания и включены для дополнительной демонстрации определенных аспектов данного изобретения. Описание может быть более понятным со ссылкой на одну или несколько из этих фигур в сочетании с подробным описанием.
ФИГ. 1 - Конструирование панели белков Gla и Gla-EGF/Крингл домен.
ФИГ. 2 - Исследование конструкций белка Gla домена для экспрессии. Осуществляли транзиентную трансфекцию в клетки 293 при использовании 293cellFectin. Загружали 10% гели при использовании восстановленных образцов и 2,3 мкл среды.
ФИГ. 3 - Исследование конструкций белка Gla домена для экспрессии. Осуществляли транзиентную трансфекцию в клетки ВНК21. Загружали 10% гели при использовании восстановленных образцов и 20 мкл среды (1/100 от общего дебриса клеток).
ФИГ. 4 - Изменение сигнальной последовательности для преобразования секреции. Осуществляли транзиентную трансфекцию в клетки ВНК21. Загружали 10% гели при использовании восстановленных образцов и 13,3 мкл среды
ФИГ. 5 - Gla белка S + последовательность EGF.
ФИГ. 6 - Очистка Gla белка S+EGF. F1-F4 представляют собой фракции колоночной хроматографии. 10% гели, невосстанавливающие условия.
ФИГ. 7 - Анализы на апоптоз для Gla белка S+EGF. Верхняя и нижняя панели представляют собой идентичные процедуры в двукратной повторности, за исключением того, что количество Gla белка S+EGF было снижено, а также было снижено количество анти-His домена антитела.
ФИГ. 8 - Анализы на апоптоз для Gla белка S+EGF. Верхняя и нижняя панели представляют собой идентичные процедуры в двукратной повторности, за исключением того, что использовали количества аннексина V, которые были в два раза выше в нижних панелях.
ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
Подобно аннексину, белки домена гамма-карбоксиглутаминовой кислоты (Gla), подобно факторам II, VII, IX, X, белку С и белку S, связывают анионные мембраны. В действительности, Gla-домен использовали в качестве модели для малой молекулы, которая была рационально сконструирована для того, чтобы быть специфическим для апоптоза зондом (Cohen и др., 2009). В данной заявке изобретатели предлагают использование нацеливания на мембраны частей этих белков Gla-домена в качестве нового класса биологических зондов, специфичных для апоптоза и заболевания. Использование этих существующих в природе нацеливающих белков может привести к повышению специфичности сравнению с существующими в настоящее время зондами с дополнительным преимуществом меньшего размера (<30 кДа). Даже в больших вариантах воплощения, которые будут включать EGF и/или Крингл домены, эти белки все еще могут оставаться меньшими, чем аннексин V (37 кДа), и являются такими малыми, как <5 кДа. Эти биологические зонды могут быть нацелены на экспрессию PtdS на поверхности клеток как in vitro, так и in vivo. Таким образом, является возможным разработать нацеленный на апоптоз/заболевание зонд, который превосходит аннексин V в отношении аффинности, специфичности и размера с дополнительным потенциалом для использования в качестве терапевтического средства. Эти и другие аспекты описания являются представленными более подробно ниже.
Всякий раз, когда это является уместным, термины, используемые в единственном числе, будут также включать в себя множественное число и наоборот. В случае, если какое-либо определение, представленное ниже, входит в противоречие с использованием этого слова в любом другом документе, в том числе в любом документе, который является включенным в данную заявку в качестве ссылки, определение, представленное ниже, всегда будет главенствовать для целей интерпретации этого описания, и связанных с ним пунктов формулы, если только противоположное значение явным образом не подразумевается (например, в документе, где этот термин первоначально использовался). Использование союза "или" означает "и/или", если не указано иное. Использование слова "любой/какой-либо" в данной заявке означает "один или более", если не указано иное или где использование "один или более" явно не подходит. Использование выражений "включают в себя", "включает в себя", "включающий", "содержат", "содержит", "содержащий" являются взаимозаменяемыми и не ограничивающими. Например, термин "включающий" означает "включающий, но не ограничивающийся таковым." Слово "приблизительно" означает плюс или минус 5% от определенного значения.
Выражение "изолированный пептид или полипептид", как используется в данной заявке, предназначен для обозначения пептида или полипептида, который по существу свободен от других биологических молекул, в том числе пептидов или полипептидов, имеющих отличные последовательности. В некоторых вариантах осуществления выделенный пептид или полипептид имеет, по крайней мере, 75%, приблизительно 80%, приблизительно 90%, приблизительно 95%, приблизительно 97%, приблизительно 99%, приблизительно 99,9% или приблизительно 100% чистоты от сухого веса. В некоторых вариантах осуществления чистота может быть измерена с помощью такого способа, такие как колоночная хроматография, электрофорез в полиакриламидном геле или анализ ВЭЖХ.
Как используется в данной заявке, термин "консервативные замены" относится к модификации полипептида, которая вовлекает замену одной или более аминокислот на аминокислоты, имеющие сходные биохимические свойства, которые не приводят к потере биологической или биохимической функции полипептида. "Консервативная аминокислотная замена" представляет собой одну из таких, в которых аминокислотный остаток заменяется на аминокислотный остаток, имеющий сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в области техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Антитела в соответствии с настоящим изобретением могут иметь одну или несколько консервативных аминокислотных замен, но сохраняют при этом активность связывания антигена.
Для нуклеиновых кислот и полипептидов термин "существенная гомология" указывает на то, что две нуклеиновые кислоты или два полипептида, или их сконструированные последовательности при оптимальном выравнивании и сравнении являются идентичными с соответствующими нуклеотидным или аминокислотными вставками или делениями, по крайней мере, приблизительно в 80% нуклеотидов или аминокислот, обычно не менее 85%, в некоторых вариантах приблизительно в 90%, 91%, 92%, 93%, 94% или 95%, по крайней мере, в одном варианте осуществления, по крайней мере, приблизительно в 96%, 97%, 98%, 99%, 99,1%, 99,2%, 99,3%, 99,4% или 99,5% нуклеотидов или аминокислот. Альтернативно, существенная гомология для нуклеиновых кислот существует тогда, когда сегменты будут подвергаться гибридизации при селективных условиях гибридизации с комплементом цепи. Также сюда включаются последовательности нуклеиновых кислот и полипептидов, имеющие существенную гомологию по отношению к специфическим последовательностям нуклеиновых кислот и аминокислотным последовательностям, указанным в данной заявке.
Процент идентичности между двумя последовательностями представляет собой функцию от числа идентичных положений, общих для последовательностей (т.е. % гомологии = число идентичных положений / общее количество положений × 100), принимая во внимание количество пробелов и длину каждого пробела, который необходимо ввести для оптимального выравнивания двух последовательностей. Сравнение последовательностей и определение процента идентичности между двумя последовательностями может быть достигнуто при использовании математического алгоритма, такого как, но без ограничения таковым, AlignX™ модуль VectorNTI™ (Invitrogen Corp., Carlsbad, CA). Для AlignX™ параметры по умолчанию множественного выравнивания представляют собой следующие: открытие пробела: 10; удлинение пробела: 0,05; диапазон штрафа за разрыв пробела: 8; % идентичности для задержки выравнивания: 40 (более подробно смотри в информационной системе Internet на invitrogen.com/site/us/en/home/LINNEA-Online-Guides/LINNEA-Communities/Vector-NTI-Community/Sequence-analysis-and-data-management-software-for-PCs/AlignX-Module-for-Vector-NTI-Advance.reg.us.html).
Другой способ определения наилучшего общего совпадения между исследуемой последовательностью (последовательностью в соответствии с настоящим изобретением) и референтной последовательностью, также известный как глобальное выравнивание последовательностей, может осуществляться с помощью компьютерной программы CLUSTALW (Thompson и др. Nucleic Acids Res, 1994, 2 (22): 4673-4680.), которая основана на алгоритме Higgins и др. (Computer Applications in the Biosciences (CABIOS), 1992, 8(2): 189-191. При выравнивании последовательностей исследуемая последовательность и референтная последовательность обе представляют собой ДНК-последовательности. Результат глобального выравнивания последовательности выражают в процентах идентичности. Параметры, которые могут быть использованы в соответствие ClustalW выравниваний последовательностей ДНК для расчета процента идентичности с помощью попарного выравнивания, являются следующими: матрица = IUB, k-набор = 1, число основных диагоналей = 5, пробел = 3, штраф за открытие пробела = 10, штраф за удлинение пробела=0,1. Для множественного выравнивания можно использовать следующие параметры ClustalW: штраф за открытие пробела = 10, параметр удлинения пробела = 0,05; интервал штрафа за разделение пробела = 8; % идентичности для задержки выравнивания = 40.
Нуклеиновые кислоты могут присутствовать в цельных клетках, в клеточном лизате или в частично очищенной или практически чистой форме. Нуклеиновая кислота является "изолированной" или "по существу чистой" тогда, когда является очищенной от других клеточных компонентов, с которыми она обычно связана в естественной среде. Для выделения нуклеиновой кислоты могут быть использованы следующим стандартные методики, такие как: щелочная SDS обработка, расслоение жидкости при центрифугировании в CsCl, колоночная хроматография, электрофорез в агарозном геле и другие, хорошо известные в данной области техники.
I. Фосфатидилсерин (PtdS)
А. Структура и синтез
Фосфатидилсерин (сокращенное обозначение PtdS, Ptd-L-Ser или PS) представляет собой фосфолипидный компонент, который обычно удерживается на внутренней стороне (цитозольной стороне) клеточных мембран с помощью фермента флиппазы. Когда клетка подвергается апоптозу, фосфатидилсерин больше не ограничивается цитозольной частью мембраны и выходит на поверхность клетки. Химическая формула PtdS - C13H24NO10P, он имеет молекулярную массу 385,304. Его структура представлена ниже:
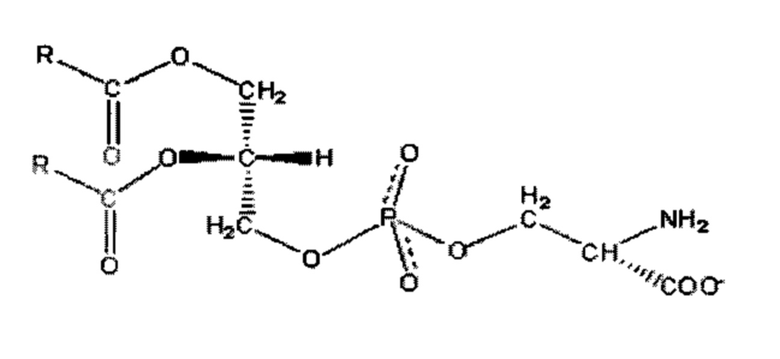
Фосфатидилсерин биосинтезируется в бактериях путем конденсации аминокислоты серина с CDP (цитидин дифосфат)-активированной фосфатидной кислотой. У млекопитающих фосфатидилсерин образуется путем катионообменных реакций между фосфатидилхолином и фосфатидилэтаноламином. И наоборот, фосфатидилсерин может также приводить к образованию фосфатидилэтаноламина, фосфатидилхолина, несмотря на то, что у животных путь для образования фосфатидилхолина из фосфатидилсерина осуществляется только в печени.
В. Функция
Ранние исследования фосфатидилсерина осуществлялись при использовании этого вещества, очищенного химическим путем из мозга крупного рогатого скота. Современные исследования и коммерчески доступные продукты являются изготовленными из сои из-за опасений по поводу коровьего бешенства. Жирные кислоты, присоединенные к серину, в соевом продукте не являются идентичными тем, которые находятся в продукте, полученном из крупного рогатого скота, и также не являются чистыми. Предварительные исследования на крысах показывают, что соевый продукт является, по крайней мере, столь же эффективным, как и таковой бычьего происхождения.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) присвоил статус "квалифицированного утверждения о полезности для здоровья" фосфатидилсерину, заявив, что "потребление фосфатидилсерина может снизить риск развития деменции в пожилом возрасте" и что "потребление фосфатидилсерина может снизить риск когнитивной дисфункции у пожилых людей".
Фосфатидилсерин был продемонстрирован как такой, который ускоряет восстановления, предотвращает боли в мышцах, улучшает самочувствие, и, возможно, обладает эргогенными свойствами для спортсменов, которые занимаются велосипедным спортом, занимаются поднятием тяжестей и для повышения выносливости. Было сообщено, что соевый PtdS зависимым от дозы образом (400 мг), является эффективным дополнением для борьбы со стрессом, вызванным тренировками, путем нейтрализации индуцированного тренировками повышения уровней кортизола. PtdS добавка способствует установлению желаемого гормонального баланса для спортсменов и может ослаблять физиологические ухудшения, которые сопровождают избыточные и/или чрезмерные тренировки. В недавних исследованиях PtdS был продемонстрирован как такой, который улучшает настроение в группе молодых людей во время умственного напряжения и для повышения точности нанесения ударов во время боксерского поединка за счет увеличения устойчивости к стрессу у игроков. Первые экспериментальные исследования показывают, что добавки PtdS могут быть полезными для детей с синдромом дефицита внимания и гиперактивности.
Традиционно, PtdS добавки были получены из коры головного мозга крупного рогатого скота (ВС-PS); однако, из-за потенциальной передачи инфекционных заболеваний в качестве потенциально безопасной альтернативы имеющий был создан происхождение от сои PS (S-PS). Полученный из сои PS в целом признан безопасным (GRAS) и представляет собой безопасную пищевую добавку для пожилых людей, если его принимать в дозировке 200 мг три раза в день. Фосфатидилсерин был продемонстрирован как такой, который уменьшает специфический иммунный ответ у мышей.
PtdS обнаруживается в мясе, но наиболее распространенным он является в головном мозге и во внутренних органах, таких как печень и почки. Только небольшое количество PS можно найти в молочных продуктах или в овощах, за исключением белой фасоли.
Аннексин-А5 представляет собой натуральный белок с высокой связывающей аффинностью по отношению к PtdS. Меченый аннексин-А5 позволяет визуализировать клетки, которые находятся в раннем - среднем состоянии апоптоза in vitro или in vivo. Другой связывающий PtdS белок представляет собой Mfge8. Меченный технецием аннексин-А5 позволяет различать злокачественные и доброкачественные опухоли, патология которых включает в себя высокую скорость клеточного деления и уровень апоптоза в злокачественной ткани по сравнению с низким уровнем апоптоза в доброкачественных опухолях.
II. Белки Gla домена
A. Gla домены
Общая структура белков Gla-домена является такой же, как и для Gla домена, сопровождающегося EGF доменами, после которых следует С концевой домен серинпротеазы. Исключениями являются протромбин, который содержит Крингл домены на месте EGF доменов, а также белок S, который не имеет домена серинпротеазы, вместо которого содержатся глобулин-подобные домены, связывающие половой гормон такие, как (SHBG) домены (Hansson and Stenflo, 2005). Аффинности белков Gla-домена по отношению к анионным мембранмм варьируют. Грубо говоря, они попадают в 3 категории: 1) связывающие агенты, имеющие высокую аффинность, с Kd 30-50 нМ, 2) связывающие агенты, имеющие среднюю аффинность, с Kd 100-200 нМ и 3) связывающие агенты, имеющие высокую аффинность, с Kd 1000-2000 нМ. Белки с высокой аффинностью к Gla домену были продемонстрированы как такие, которые связываются с анионными мембранами с помощью белка S, демонстрируя специфическое связывание с апоптическими клетками с помощью его взаимодействия с PtdS (Webb и др., 2002). Белки, которые имеют низкое сродство к Gla домену, используют вторичный рецептор для связывания с клеточной мембраной. Например, FVII использует тканевый фактор (TF). Gla домен/1-й EGF домен, как полагают, имеет высокую аффинность связывания TF домена FVII. Является важным, что существует много исследований, которые показали повышение уровня TF на поверхности раковых клеток, включая колоректальный рак, NSCL карциномы и рак молочной железы, и такие высокие уровни TF были связаны с плохим прогнозом (Yu и др., 2004). Несмотря на то, что аффинность к анионным мембранам является относительно низкой для FVII, прибавление TF взаимодействия с высокой аффинностью наряду с задокументированным повышением уровня TF при раке делает его потенциально интересным специфическим для рака зондом.
В. Белки, содержащие Gla домен
1. Фактор II
Протромбин, также известный как фактор коагуляции II, протеолитически расщепляется с образованием тромбина в каскаде коагуляции, который, в конечном счете, приводит к приостановлению кровопотери. Тромбин, в свою очередь, действует в качестве серинпротеазы, которая преобразует растворимый фибриноген в нерастворимые фибриновые нити, а также катализирует много других реакций, связанных со свертыванием крови. Он в основном экспрессируется в печени.
Ген, кодирующий протромбин, расположен на хромосоме 11 в участке центромеры. Он состоит из 14 экзонов и содержит 24 тысячи пар нуклеотидов ДНК. Ген кодирует сигнальный участок, участок пропептида, домен глутаминовой кислоты, 2 Крингл участка и каталитический домен. Фермент гамма-глутамилкарбоксилаза в присутствии витамина К преобразует N-концевые остатки глутаминовой кислоты в остатки гамма-карбоксиглутаминовой кислоты. Эти остатки гамма-карбоксиглутаминовой кислоты являются необходимыми для связывания протромбина с фосфолипидами на мембранах тромбоцитов.
Унаследованный дефицит фактора II представляет собой аутосомно-рецессивное заболевание, которое может проявляться как гипопротромбинемия, снижение общего синтеза протромбина или как диспротромбинемия, синтез нефункционального протромбина. Гомозиготные индивидуумы, как правило, являются бессимптомными и имеют функциональные уровни протромбина 2-25%. Тем не менее, симптоматические индивидуумы могут испытывать незначительные синяки, носовое кровотечение, кровоизлияния мягких тканей, чрезмерное кровотечение, послеоперационное кровотечение и/или меноррагию.
Протромбин играет важную роль в развитии хронической крапивницы, аутоиммунного заболевания, и различных сосудистых нарушений. Ливедо васкулопатия является связанной с комплексом антитела на основе иммуноглобулина (Ig)M антифосфатидилсерин-протромбин. Наличие комплекса антитела антифосфатидилсерин-протромбин и гистопатологический некротический васкулит в верхних - средних слоях дермы указывает скорее на кожный лейкоцитокластический васкулит, чем на накожный узелковый полиартериит.
Помимо недостаточности протромбина, другое протромбиновое расстройство представляет собой мутацию протромбина 20210а. Семейная причина венозной тромбоэмболии, связанной с мутацией протромбина 20210а, приводит к повышению уровня протромбина в плазме крови и одновременному повышенному риску для развития тромбоза. Несмотря на то что точный механизм этого заболевания не выяснен, мутация протромбина 20210а включает замену аденина для гуанин в положении 20210 в нетранслируемом 3'-участке гена протромбина. Эта мутация приводит к изменению полиаденилирования сайта гена и вызывает повышение синтеза мРНК с последующим увеличением экспрессии белка.
2. Фактор VII
Фактор VII (ранее известный как проконвертин) представляет собой один из белков, которые вызывают свертывание крови в каскаде коагуляции крови. Ген фактора VII находится в хромосоме 13 (13q34). Этот фермент представляет собой таковой класса серинпротеаз, а рекомбинантная форма человеческого фактора VIIa (NovoSeven) была одобрена Администрацией США по пищевым продуктам и лекарственным веществам для неконтролируемого кровотечения у больных гемофилией. Он иногда используется без лицензии при тяжелом неконтролируемом кровотечении, несмотря на то, что существуют проблемы безопасности. Биоподобная форма рекомбинантного активированного фактора VII (AryoSeven) изготавливается AryoGen Biopharma.
Основная роль фактора VII (FVII) заключается в инициации процесса коагуляции в сочетании с тканевым фактором (TF/фактор III). Тканевой фактор находится на внешней стороне кровеносных сосудов и в норме не являются вовлеченным в кровоток. При повреждении сосуда тканевой фактор подвергается действию крови и циркулирующего фактора VII. После связывания с TF фактор VII активируется с образованием FVIIa при использовании различных протеаз, среди которых можно указать тромбин (фактор IIа), фактор Ха, IXa, ХIIа и сам комплекс FVIIa-TF. Наиболее важными субстратами для FVIIa-TF являются фактор X и фактор IX. Фактор VII, как было показано, взаимодействуют с тканевым фактором (TF).
Действию фактора препятствует ингибитор пути тканевого фактора (TFPI), который выделяется почти сразу после инициации коагуляции. Фактор VII является зависимым от витамина К; он вырабатывается в печени. Использование варфарина или подобных антикоагулянтов снижает синтез печеночного FVII.
Дефицит встречается редко (врожденный дефицит проконвертина) и наследуется рецессивно. Дефицит фактора VII является представленным как подобное гемофилии расстройство кровотечение. Это состояние лечится с помощью рекомбинантного фактора VIIa (NovoSeven или AryoSeven). Рекомбинантный фактор VIIa используется также для людей с гемофилией (с дефицитом фактора VIII или фактора IX), которые имеют развитые ингибиторы против замены фактора коагуляции крови. Он также используется в условиях неконтролируемого кровотечения, но его роль в этой ситуации является спорной с недостаточным количеством доказательств в поддержку его использования при отсутствии клинических испытаний. Первое сообщение о его использовании при кровоизлиянии поступило от израильского солдата с неконтролируемым кровотечением в 1999. Риски его использования включают увеличение артериального тромбоза.
3. Фактор IX
Фактор IX (или кристмас-фактор, тромбопластический фактор плазмы В) представляет собой одну из сериновых протеаз системы свертывания крови; он принадлежит к семейству пептидаз S1. Ген фактора IX находится в Х-хромосоме (Xq27.1-q27.2) и, следовательно, является сцепленным с Х-хромосомой рецессивным геном: мутации в этом гене проявляют свое влияние у мужчин гораздо чаще, чем у женщин. Дефицит этого белка вызывает гемофилию В. Фактор IX вырабатывается как зимоген, неактивный предшественник. Он подвергается воздействию для удаления сигнального пептида, гликозилируется и затем расщепляется фактором XIa (контактный путь) или фактором VIIa (путь тканевого фактора) с образованием двухцепочечной формы, в которой цепи соединены дисульфидным мостиком. При активации с превращением в фактор IXa в присутствии Са2+, мембранных фосфолипидов и кофактора фактор VIII, он гидролизует одну связь аргинин-изолейцин в факторе X с образованием фактора Ха. Фактор IX ингибируется с помощью антитромбина.
Факторы VII, IX и X все играют ключевую роль в коагуляции крови, а также имеют общую архитектуру домена. Белок фактора IX состоит из четырех доменов белка. Таковые представляют собой домен Gla, две тандемные копии домена EGF и С-концевой трипсиноподобный домен пептидазы, которая осуществляет каталитическое расщепление. N-концевой домен EGF был продемонстрирован как такой, который, по крайней мере, частично отвечает за связывание тканевого фактора. Wilkinson и др. сделали вывод, что остатки от 88 до 109 второго домена EGF опосредуют связывание с тромбоцитами и сборку комплекса активации фактора X. Были установлены структуры всех четырех доменов. Структура из двух доменов EGF и трипсинподобного домена была определена для белка свиньи. Структура домена Gla, который отвечает за зависимое от Са(II) фосфолипидное связывание, была также определена с помощью ЯМР. Были определены некоторые структуры "супер активных" мутантов, что раскрывает природу активации фактора IX с помощью других белков в каскаде свертывания крови.
Дефицит фактора IX вызывает болезнь Кристмаса (гемофилия В). Было описано более 100 мутаций фактора IX; некоторые из них не вызывают никаких симптомов, но многие приводят к значительному расстройству кровотечения. Рекомбинантный фактор IX используется для лечения болезни Кристмаса и является коммерчески доступным как Бенефикс. Некоторые редкие мутации фактора IX приводят к повышенной активности свертываемости, а также могут приводить к заболеваниям, связанным со свертываемостью крови таким, как тромбоз глубоких вен.
4. Фактор X
Фактор X (стюарт-прауэр фактор; протромбиназа) представляет собой фермент каскада свертывания крови. Ген фактора X человека расположен в тринадцатой хромосоме (13q34). Это серинэндопептидаза (протеаза группа S1). Фактор X синтезируется в печени и требует витамина К для своего синтеза. Фактор X активируется с образованием фактора Ха как с помощью фактора IX (с его кофактором, фактором VIII, в комплексе, известном как intrinsic Xase), так и фактора VII с его кофактором, тканевым фактором (комплекс известен как extrinsic Xase). Период полувыведения фактора X составляет 40-45 часов. Таким образом, он представляет собой первый член окончательного общего пути или тромбинового пути. Он действует путем расщепления протромбина в двух местах (связь arg-thr, а потом -arg-ile), что обеспечивает получение активного тромбина. Этот процесс является оптимизированным, когда фактор Ха представляет собой комплекс с активированным кофактором V в комплексе протромбиназы. Фактор X является частью свежезамороженной плазмы крови и протромбиназного комплекса. Единственный коммерчески доступный концентрат представляет собой "Фактор ХР Behring", который производится CSL Behring.
Фактор Ха инактивируется с помощью зависимого от белка Z ингибитора протеазы (ZPI), ингибитора серинапротеазы (серпина). Аффинность этого белка для фактор Ха увеличивается в 1000 раз в присутствии белка Z, в то время как он не требует белка Z для инактивации фактора XI. Дефициты и дефекты в белке Z приводят к повышению активности фактора Ха и склонности к тромбозу.
Врожденный дефицит фактора X встречается очень редко (1: 500000) и может представлять собой эпистаксис (носовые кровотечение), гемартроз (кровоизлияние в суставы) и желудочно-кишечные потери крови. Помимо врожденного дефицита, низкий уровень фактора X иногда возникает при ряде болезненных состояний. Например, дефицит фактора X можно наблюдать при амилоидозе, где фактор X, адсорбируется на амилоидных фибриллах в сосудистой сети. Кроме того, дефицит витамина К или антагонизм при использовании варфарина (или аналогичного препарата) приводит к получению неактивного фактора X. В терапии при использовании варфарина является желательным предотвратить тромбоз. По состоянию на конец 2007 года четыре из пяти новых антикоагуляционных терапий были направлены на этот фермент. Непосредственные ингибиторы Ха представляют собой популярные антикоагулянты.
Традиционные модели свертывания крови, разработанные в 1960-х годах, предусмотривали два отдельных каскада, внешний (тканевой фактор (TF)) путь и внутренний путь. Эти пути сходятся в общей точке, образование комплекса фактор Ха/фактоp Va, который вместе с кальцием и в связанной на фосфолипидной поверхности форме образует тромбин (фактор IIа) из протромбина (фактор II). Новая модель, модель на основе происходящих от клетки антикоагулянтов, как обнаружилось, объясняет более полно этапы коагуляции. Эта модель имеет три этапа: 1) инициация коагуляции на клетках, несущих TF, 2) усиление прокоагулянтного сигнала с помощью тромбина, который вырабатывается на клетках, несущих TF 3) распространение образования тромбина на поверхности тромбоцитов. Фактор Ха играет ключевую роль во всех этих трех этапах.
На этапе 1 фактор VII связывается с трансмембранным белком TF на поверхности клеток и превращается в фактор VIIa. Результатом этого является образование комплекса фактор VIIa/TF, который катализирует активацию фактора X и фактора IX. Фактор Ха, который образуется на поверхности клетки, несущей TF, взаимодействует с фактором Va с образованием протромбиназного комплекса, который вырабатывает небольшие количества тромбина на поверхности клеток, несущих TF. На этапе 2, стадия расширения, если образовалось достаточное количество тромбина, то происходит активация тромбоцитов и тромбоцитов, связанных с кофакторами. На этапе 3, стадия образования тромбина, фактор XIa активизирует свободный фактор IX на поверхности активированных тромбоцитов. Активированный фактор IXa с фактором VIIIa образует комплекс "теназы". Этот комплекс включает больше фактора X, который, в свою очередь, формирует новые протромбиназные комплексы с фактором Va. Фактор Ха является главным компонентом протромбиназного комплекса, который преобразует большие количества протромбина - "выброс тромбина". Каждая молекула фактора Ха может образовывать 1000 молекул тромбина. Этот большой выброс тромбина является ответственным за полимеризацию фибрина с образованием тромба.
Ингибирование синтеза или активности фактора X представляет собой механизм действия для многих используемых сегодня антикоагулянтов. Варфарин, синтетическое производное кумарина, является наиболее широко используемым пероральным антикоагулянтом в США. В некоторых европейских странах используются другие производные кумарина (фенпрокумон и аценокумарол). Эти агенты представляют собой антагонисты витамина К (ВКА). Витамин К является необходимым для синтеза в печени факторов II (протромбина), VII, IX и X. Гепарин (нефракционированный гепарин) и его производные с низкой молекулярной массой (LMWH) связываются с кофактором плазмы крови, антитромбином (AT), чтобы инактивировать несколько факторов коагуляции IIa, Ха, ХIIа и XIa.
Недавно была разработана новая серия специфических, непосредственно действующих ингибиторов фактора Ха. К ним относятся лекарственные средства ривароксабан, апиксабан, бетриксабан, LY517717, дарексабан (YM150), эдоксабан и 813893. Эти агенты обладают некоторыми теоретическими преимуществами по сравнению с существующей терапией. Они могут назначаться перорально и имеют быстрое начало действия, а также они могут быть более эффективными против фактора Ха в отношении того, что они ингибируют как свободный фактор Ха, так и фактор Ха в составе протромбиназного комплекса.
5. Белок S
Белок S представляет собой зависимый от витамина К гликопротеин плазмы крови, который синтезируется в эндотелии. В процессе циркуляции белок S существует в двух формах: свободной форме и сложной форме, связанной с белком комплемента C4b-связывающим белком (С4ВР). В организме человека белок S кодируется геном PROS1. Наилучшим образом охарактеризованная функция белка S представляет собой его роль в пути антикоагуляции, где он функционирует в качестве кофактора к белку С в инактивации факторов Va и VIIIa. Только свободная форма обладает кофакторной активностью.
Белок S может связываться с отрицательно заряженными фосфолипидами помощью карбоксилированного Gla домена. Это свойство позволяет белку S осуществлять свою функцию по удалению клеток, которые подверглись апоптозу. Апоптоз представляет собой форму гибели клеток, которая используется организмом для удаления нежелательных или поврежденных клеток из тканей. Клетки, которые являются апоптическими (т.е. находяться в процессе апоптоза), перестают активно управлять распределением фосфолипидов в своей наружной мембране и, следовательно, начинают демонстрировать отрицательно заряженные фосфолипиды такие, как фосфатидилсерин, на поверхности клетки. В здоровых клетках зависимый от АТФ (аденозинтрифосфата) фермент удаляет их из внешнего слоя клеточной мембраны. Эти отрицательно заряженные фосфолипиды узнаются фагоцитами такими, как макрофаги. Белок S может связываться с отрицательно заряженными фосфолипидами и функционирует в качестве молекулы, соединяющей с помощью мостика апоптические клетки и фагоциты. Мостиковые свойства белка S усиливают фагоцитоз апоптической клетки, что позволяет удалить их "аккуратно" без каких-либо симптомов повреждения тканей таких, как возникающее воспаление.
Мутации в гене PROS1 могут приводить к возникновению дефицита белка S, что является редким расстройством системы крови, которое может привести к увеличению риска тромбозов. Как было продемонстрировано, что белок S взаимодействует с фактором V.
6. Белок С
Белок С, который также является известным как аутопротромбин IIA и фактор свертывания крови XIV, является зимогенным (неактивным) белком, активированная форма которого играет важную роль в регуляции коагуляции крови, воспаления, гибели клеток и поддержании проницаемости стенок кровеносных сосудов у людей и других животных. Активированный белок С (АРС) осуществляет эти операции, в первую очередь, путем протеолитической инактивации белков фактора Va и фактора VIIIa. АРС классифицируется как серинпротеаза, поскольку он содержит остаток серина в активном центре. В организме человека белок С кодируется геном PROC, который находится в хромосоме 2.
Зимогенная форма белка С представляет собой зависимый от витамина К гликопротеин, который циркулирует в плазме крови. Его структура представляет собой двухцепочечный полипептид, который состоит из легкой цепи и тяжелой цепи, соединенных дисульфидной связью. Зимоген белка С активируется, когда он связывается с тромбином, другим белком, который активно участвует в коагуляции, и активация белка С в значительной степени активируется при наличии тромбомодулина и эндотелиальных рецепторов белка С (EPCR). Благодаря роли EPCR, активированный белок С находится в основном вблизи эндотелиальных клеток (то есть, тех, которые образуют стенки кровеносных сосудов), и именно эти клетки и лейкоциты (белые клетки крови), являются теми, на которые воздействует АРС. По причине важной роли, которую играет белок С в качестве антикоагулянта, пациенты, которые имеют дефицит белка С, или обладают какой-либо устойчивостью к АРС, страдают от значительно повышенного риска формирования опасных сгустков крови (тромбоза).
Исследования в области клинического применения активированного белка С, также известного как дротрекогин альфа-активированный (продается под названием Xigris) выявили противоречия. Производитель Эли Лилли энд Компани развернул интенсивную маркетинговую компанию для того, чтобы способствовать его применения у людей с тяжелым сепсисом и септическим шоком, включая спонсорство Руководства компании выживания при сепсисе 2004 года. Однако в 2011 году в своем обзоре указал, что его применение не может быть рекомендовано, поскольку оно не способствует выживанию (а также повышает риск кровотечения).
Человеческий белок С представляет собой зависимый от витамина К гликопротеин, являющийся структурно подобным другим зависимым от витамина К белкам, которые влияют на свертывание крови, таким, как протромбин, фактор VII, фактор IX и фактор X. Синтез белка С осуществляется в печени и начинается с образования одноцепочечной молекулы предшественника: N-терминального сигнального пептида, который состоит из 32 аминокислот и предшествует образованию пропептида. Белок С формируется тогда, когда удаляется дипептид, состоящий из Lys198 и Arg199, что вызывает превращение в гетеродимер с N-связанным углеводом на каждой цепи. Этот белок имеет одну легкую цепь (21 кДа) и одну тяжелую цепь (41 кДа), соединенные с помощью дисульфидной связи между Cys183 и Cys319.
Неактивный белок С содержит 419 аминокислот в нескольких доменах: один Gla домен (остатки 43-88); спиральный ароматический сегмент (89-96); два домена, подобных эпидермальному фактору роста (EGF) (97-132 и 136-176); пептид активации (200-211); и трипсиноподобный домен серинпротеазы (212-450). Легкая цепь содержит Gla и EGF-подобные домены, а также ароматический сегмент. Тяжелая цепь содержит домен протеазы и пептид активации. Именно в таком виде 85-90% протеина С циркулирует в плазме крови в качестве зимогена, ожидая активации. Остальной зимоген белка С включает несколько модифицированных форм белка. Активация фермента происходит тогда, когда молекула тромбина отщепляет пептид активации от N-конца тяжелой цепи. Активный сайт содержит каталитическую триаду, типичную для серинпротеаз (His253, Asp299 и Ser402).
Активации белка С сильно способствует тромбомодулин и рецептор эндотелиального белка С (EPCR), последний из которых находится в основном на эндотелиальных клетках (клетки на внутренней стороне кровеносных сосудов). Наличие тромбомодулина ускоряет активацию на несколько порядков величины, а EPCR ускоряет активацию примерно в 20 раз. Если какой-либо из этих двух белков отсутствует в мышиных образцах, то мышь умирает от чрезмерного свертывания крови еще в зачаточном состоянии. На эндотелии АРС осуществляет важную функцию в регулировании свертываемости крови, воспалении и смерти клеток (апоптоз). По причине ускоряющего эффекта тромбомодулина на активацию белка С, можно сказать, что белок активируется не только тромбином, но и комплексом тромбин-тромбомодулин (или даже тромбин-тромбомодулин-EPCR). После превращения в активную форму АРС может или не может оставаться связанным с EPCR, по отношению к которому он имеет примерно такую же аффинность, что и белок зимогена.
Gla домен является особенно полезным для связывания с отрицательно заряженными фосфолипидами для осуществления антикоагуляции и связывания с EPCR для осуществления защиты клетки. Один определенный экзосайт значительно увеличивает способность белка С в отношении инактивации фактора Va. Другой является необходимым для взаимодействия с тромбомодулином.
Белок С в форме зимогена присутствует в нормальной плазме крови взрослого человека в концентрациях от 65 до 135 МЕ/дл. Уровень активированного белка С является примерно в 2000 раз ниже, чем указанный выше. Средний дефицит белка С соответствует уровням в плазме крови свыше 20 МЕ/дл, но ниже нормального диапазона. Умеренно серьезные дефициты белка С определяются концентрациями в крови от 1 до 20 МЕ/дл; серьезные дефекты вызывают уровни белка С, которые ниже 1 МЕ/дл или которые не возможно обнаружить. Уровни белка С у здорового младенца в среднем составляют 40 МЕ/дл. Концентрация белка С увеличивается до шести месяцев, когда среднее значение уровня составляет 60 МЕ/дл; уровень остается низким в детстве, пока не достигнет уровня взрослых после подросткового возраста. Период полувыведения активированного белка С составляет около 15 минут.
Путь белка С представляет собой специфические химические реакции, которые контролируют уровень экспрессии АРС и его активность в организме. Белок С является плейотропным, с двумя основными классами функций: антикоагулянтной и функцией защиты клетки (его непосредственное действие на клетки). Какую функцию выполняет белок С зависит от того, остается ли АРС связанным с EPCR после активации; антикоагулянтные эффекты АРС возникают тогда, когда он является несвязанным. В этом случае белок С функционирует в качестве антикоагулянта путем необратимой протеолитической инактивации фактор Va и фактора VIIIa, превращая их в фактор Vi и фактор VIIIIi, соответственно. Тогда, когда он все еще связан с EPCR, активированный белок С выполняет свои цитопротективные эффекты, воздействуя на эффекторный субстрат PAR-1, активируемый протеазой рецептор-1. В некоторой степени антикоагулянтные свойства АРС являются независимыми от его цитопротективных свойств, что выражается в том, что экспрессия одного пути не подвергается влиянию путем существования другого.
Активность белка С может снижаться путем снижения количества либо доступного тромбомодулина, либо EPCR. Это может быть сделано с помощью воспалительных цитокинов, таких, как интерлейкин-1 (IL-1) и фактор некроза опухоли-альфа (TNF-альфа). Активированные лейкоциты высвобождают эти медиаторы воспаления при воспалении, ингибируя образование как тромбомодулина, так и EPCR, и индуцируя их шеддинг из поверхности эндотелия. Оба эти действия снижают активацию белка С. Сам тромбин также может оказывать влияние на уровень EPCR. Кроме того, белки, высвобождаемые из клеток, могут препятствовать активации белка С, например, из эозинофилов, что может объяснить тромбоз при гиперэозинофильные болезни сердца. Белок С может подвергаться повышающей регуляции с помощью тромбоцитарного фактора 4. Этот цитокин, как предполагается, улучшает активацию белка С путем формирования электростатического моста от Gla домена белка С до домена гликозаминогликана (GAG) тромбомодулина, снижая при этом константу Михаэлиса (KM) для их реакция. Кроме того, белок С подвергается ингибированию с помощью ингибиторов белка С.
Генетический дефицит белка С в своей мягкой форме, ассоциируется с риском венозного тромбоза у взрослых. Если плод является гомозиготным или находится в компаунд-гетерозиготном для дефицита состоянии, может присутствовать молниеносная пурпура, тяжелое диссеминированное интраваскулярное свертывание и одновременная венозная тромбоэмболия в утробе матери; это очень тяжелые заболевания и, как правило, они имеют смертельный исход. Удаление гена белка С у мышей вызывает гибель плода на момент рождения. Плод мышей, не имеющий белка С, сначала нормально развивается, но испытывает сильное кровотечение, коагулопатию, отложение фибрина и некроз печени. Частота возникновения дефицита белка С среди бессимптомных лиц составляет от 1 из 200 в 1 из 500. В отличие от этого, значительные симптомы дефицита могут быть обнаружены у 1 из 20000 особей. При этом не было обнаружено ни расовых, ни этнических склонностей.
Резистентность активированного белка С возникает тогда, когда АРС является не в состоянии выполнять свои функции. Это заболевание имеет аналогичные симптомы с дефицитом белка С. Наиболее распространенная мутация, которая приводит к резистентности активированного белка С среди представителей белой европеоидной расы, находится в сайте расщепления фактора V для АРС. Так, Arg506 заменяется Gln с образованием фактора V Лейдена. Эта мутация также называется R506Q. Мутация, которая приводит к потере этого сайта расщепления, фактически останавливает АРС в отношении эффективной инактивации как фактора Va, так и фактора VIIIa. Таким образом, кровь индивидуума свертывается слишком легко, и он постоянно подвергается повышенному риску тромбоза. Лица, гетерозиготные по мутации фактора VЛейдена, имеют риск венозного тромбоза, который в 5-7 раз выше, чем в общей популяции. Гомозиготные индивидуумы имеют риск, который в 80 раз выше, чем в общей популяции. Эта мутация также является наиболее распространенным наследственным риском для венозного тромбоза среди представителей белой европеоидной расы.
Около 5% АРС резистентности не связано с упомянутой выше мутацией и фактором VЛейдена. Другие генетические мутации вызывают АРС резистентность, но не в той степени, как это делает фактор VЛейдена. Эти мутации включают в себя различные другие варианты фактора V, спонтанное образование аутоантител к фактору V и нарушение функции любого из кофакторов АРС. Кроме того, некоторые возникающие условия могут снизить эффективность АРС при осуществлении им своих антикоагулянтных функций. Исследования показывают, что от 20% до 60% пациентов с тромбофилией страдают от некоторой формы АРС резистентности.
С. Пептиды и полипептиды, содержащие Gla домен
Настоящее изобретение предусматривает конструирование, получение и применение различных пептидов и полипептидов, содержащих Gla домен. Структурные свойства этих молекул являются следующими. Во-первых, пептиды или полипептиды имеют Gla домен, имеющий приблизительно 30-45 последовательных остатков, включающих Gla домен. Таким образом, термин "пептид, содержащий не более, чем "X" последовательных остатков", даже тогда, когда включает термин "содержащий" не может подразумевать такой, который включает в себя большее количество последовательных остатков. Во-вторых, пептиды и полипептиды могут содержать дополнительные остатки, которые не являются Gla доменом, такие как EGF домены, Крингл домены, Fc домены и тому подобное
В общем случае пептиды и полипептиды будут содержать 300 остатков или менее, опять же, включающих 30-45 последовательных остатков Gla домена. Общая длина может составлять 30, 40, 50, 60, 70, 80, 90, 100,125, 150, 175, 200, 225, 250, 275 и вплоть до 300 остатков. При этом подразумеваются интервалы длины пептида 50-300 остатков, 100-300 остатков, 150-300 остатков, 200-300, остатков, 50-200 остатков, 100-200 остатков и 150-300 остатков, а также 150-200 остатков. Количество последовательных остатков Gla может составлять 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15.
Настоящее изобретение может использовать L-конфигурации аминокислот, D-конфигурации аминокислот или их смесь. В то время как L-аминокислоты представляют подавляющее большинство аминокислот, обнаруженных в белках, D-аминокислоты обнаружены в некоторых белках, которые вырабатываются экзотическими морскими организмами такими, как улитка конус. Они также являются избыточными компонентами пептидогликана клеточной стенки бактерий. D-серин может функционировать в качестве нейротрансмиттера в мозге. Условное обозначение L и D для конфигурации аминокислот относится не к оптической активности самой аминокислоты, а к оптической активности изомера глицеринового альдегида, из которого аминокислота теоретически может быть синтезирована (D-глицеральдегид является правовращающим; а L-глицеральдегид является левовращающим).
Одна из форм "весь-D" пептид представляет собой ретро-инверсо пептид. Модификация ретро-инверсо существующих в природе полипептидов вовлекает синтетическую сборку аминокислот со стереохимией α-углерода, противоположной той, которая соответствует L-аминокислотам, то есть, D-аминокислоты находятся в обратном порядке по отношению к последовательности нативного пептида. Ретро-инверсо аналог, таким образом, имеет перевернутые концы и обратное направление пептидных связей (NH-CO, а не CO-NH), при наличии приблизительного поддержания топологии боковых цепей как в последовательности нативного пептида. Смотри патент США №6,261,569, включенный в данную заявку в качестве ссылки.
D. Синтез
Будет выгодным получать пептиды и полипептиды с использованием методик твердофазных синтеза (Merrifield, 1963). Другие способы пептидного синтеза являются хорошо известными специалистам в данной области техники (Bodanszky и др, 1976; Peptide Synthesis, 1985; Solid Phase Peptide Synthelia, 1984). Соответствующие защитные группы для использования в таких способах синтеза можно найти в указанных выше источниках, а также в Protective Groups in Organic Chemistry (1973). Эти способы синтеза включают последовательное добавление одного или нескольких остатков аминокислот или соответствующих защищенных остатков аминокислот к увеличивающейся пептидной цепи. Обычно аминогруппа или карбоксильная группа первого аминокислотного остатка является защищенной с помощью подходящей, селективно удаляемой защитной группы. Альтернативно, селективно удаляемая защитная группа используется для аминокислот, содержащих реакционноспособную боковую группу, таких, как лизин.
При использовании твердофазного синтеза в качестве примера, защищенную или дериватизованную аминокислоту присоединяют к инертному твердому носителю с помощью его незащищенной карбоксильной группы или аминогруппы. Защитную группу амино- или карбоксильной группы затем селективно удаляют и прибавляют следующую аминокислоту в последовательности, которая имеет комплементарную (амино- или карбоксильную) группу, защищенную соответствующим образом, и подвергают реакции с остатком, уже присоединенным к твердой подложке. Защитную группу амино- или карбоксильной группы затем удаляют из этого вновь добавленного аминокислотного остатка, и затем добавляют следующую аминокислоту (соответствующим образом защищенную) и так далее. После того, как все желаемые аминокислоты были связаны в надлежащей последовательности, любую оставшуюся терминальную и боковую группу защитных групп (а также твердый носитель) удаляют последовательно или одновременно, чтобы обеспечить заключительный пептид. Пептиды и полипептиды в соответствии с данной заявкой предпочтительно не имеют бензилированных или метилбензилированных аминокислот. Такие фрагменты защитной группы могут быть использованы в процессе синтеза, но их удаляют перед использованием пептидов и полипептидов. Могут быть необходимыми дополнительные реакции, как описывается в различных источниках, чтобы сформировать внутримолекулярные связи для укрепления конформации.
Помимо двадцати стандартных аминокислот, которые могут использоваться, существует огромное количество "нестандартных" аминокислот. Две из них могут кодироваться с помощью генетического кода, но являются довольно редкими в белках. Селеноцистеин является встроенным в некоторые белки при UGA кодоне, который, как правило, представляет собой стоп-кодон. Пирролизин применяется некоторыми метаногенными архебактериями в ферментах, которые они используют для производства метана. Он кодируется с помощью кодона UAG. Примеры нестандартных аминокислот, которые не встречаются в белках, включают лантионин, 2-аминоизомасляную кислоту, дегидроаланин и нейромедиатор гамма-аминомасляную кислоту. Нестандартные аминокислоты часто образуются в качестве промежуточных метаболических путей для стандартных аминокислот, например, орнитин и цитруллин образуются в цикле мочевины, части процесса катаболизма аминокислот. Нестандартные аминокислоты, как правило, формируется посредством изменения стандартных аминокислот. Например, гомоцистеин образуется с помощью пути транссульфурации или путем деметилирования метионина при использовании промежуточного метаболита S-аденозил метионина, в то время как гидроксипролин образуется при посттрансляционной модификации пролина.
Е. Линкеры
Линкеры или перекрестно сшивающие агенты могут использоваться для слияния пептидов или полипептидов Gla домена с другими белковыми последовательностями (например, Fc доменами антител). Бифункциональные перекрестно сшивающие реагенты широко используются для различных целей, в том числе для получения аффинных матриц, модификации и стабилизации различных структур, идентификации сайтов связывания лиганда и рецептора, а также для структурных исследований. Гомобифункциональные реагенты, которые несут две одинаковые функциональные группы оказались весьма эффективными в индукции перекрестного связывания между идентичными и различными макромолекулами или субъединицами макромолекулы и связывания полипептидных лигандов с их специфическими сайтами связывания. Гетеробифункциональные реагенты содержат две различные функциональные группы. Воспользовавшись преимуществом дифференциальных реакционных способностей двух различных функциональных групп, перекрестное сшивание может контролироваться как селективно, так и последовательно. Реагенты для бифункционального сшивания могут быть разделены в соответствии со спецификой их функциональных групп, например, специфических для аминогрупп, сульфгидрильных, гуанидиновых, индольных или карбоксильных групп. Из этих групп реагенты, направленные на свободные аминогруппы, являются особенно популярными из-за своей коммерческой доступности, легкости синтеза и мягких условий реакции, при которых они могут применяться. Большинство гетеробифункциональных перекрестно сшивающих реагентов содержит первичную амино-реактивную группу и тиол-реактивную группу.
В другом примере гетеробифункциональные перекрестно сшивающие реагенты и способы использования перекрестно сшивающих реагентов описаны в патенте США №5,889,155, который является специфически включенным в данную заявку в качестве ссылки в полном объеме. Перекрестно сшивающие реагенты соединяют нуклеофильный остаток гидразида с электрофильным остатком малеимида, позволяя осуществлять слияние в одном примере, альдегидов со свободными тиолами. Перекрестно сшивающий реагент может быть модифицирован для осуществления перекрестной сшивки различных функциональных групп и, таким образом, является полезным для сшивания полипептидов. В случаях, когда конкретный пептид не содержит остатка, который является пригодным для данного сшивающего реагента в своей нативной последовательности, могут быть использованы консервативные генетические или синтетические замены аминокислоты в первичной последовательности.
F. Дополнительные пептидные/полипептидные последовательности
Одним из факторов разработки лекарственного препарата является достижение адекватного периода полувыведения в системе кровообращения, что оказывает влияние на дозирование, введение лекарственного препарата и эффективность, и это имеет особо важное значение для биотерапевтических препаратов. Маленькие белки размером, меньше 60 кДа, быстро выводятся через почки и, следовательно, не достигают своей цели. Это означает, что высокие дозы являются необходимыми для достижения эффективности. Модификации, которые в настоящее время используются для увеличения периода полувыведения белков в системе кровообращении, включают: конъюгацию или генетическое слияние с некоторыми белками, например, трансферрином (WO 06096515A2), альбумином, гормоном роста (публикация патентной заявки США №2003104578АА); конъюгацию с целлюлозой (Levy and Shoseyov, 2002); конъюгацию или слияние с Fc фрагментами; гликозилирование и подходы мутагенеза (Carter, 2006).
В случае ПЭГилирования полиэтиленгликоль (ПЭГ) конъюгируют с белком, который может представлять собой, например, белок плазмы крови, антитело или фрагмент антитела. Первые исследования, касающиеся эффекта ПЭГилирования антител, проводили в 1980-х годах. Конъюгацию можно осуществлять либо ферментативно, либо химически, и это является хорошо известным в данной области техники (Chapman, 2002; Veronese и Pasut, 2005). Путем ПЭГилирования общий размер молекулы может быть увеличен, что снижает вероятность почечной фильтрации. ПЭГилирование дополнительно защищает молекулу от протеолитической деградации и замедляет выведение из крови. Кроме того, сообщалось, что ПЭГилирование может снижать иммуногенность и повышать растворимость. Улучшенные фармакокинетические свойства, достигаемые с помощью добавления ПЭГ, связывают с несколькими различными механизмами: увеличение размера молекулы, защита от протеолиза, снижение антигенности и маскирование определенных последовательностей из клеточных рецепторов. В случае фрагментов антител (Fab) было достигнуто 20-кратное увеличение периода полувыведения в плазме крови с помощью ПЭГилирования (Chapman, 2002).
На сегодняшний день существует несколько утвержденных ПЭГилированных лекарственных средств, например, ПЭГ-интерферон альфа2b (ПЭГ-Интрон), который поступил на рынок в 2000 году, и альфа2А (Пегасис), который начал продаваться с 2002 года. ПЭГилированный фрагмент антитела против TNF-альфа под названием Симзия или Цертолизумаб Пэгол был подан на утверждения FDA для лечения болезни Крона в 2007 году и был одобрен 22 апреля 2008 года. Фактором, ограничивающим ПЭГилирование, является трудность в синтезе длинных монодисперсных видов, в частности, тогда, когда являются необходимыми цепи ПЭГ длиной более 1000 кДа. Для многих применений используется полидисперсные ПЭГ с длиной цепи более 10000 кДа, что приводит к получению популяции конъюгатов, имеющих цепочки ПЭГ различной длины, которые нуждаются в обширных аналитических средствах, чтобы обеспечить эквивалентные партии продуктов. Различная длина цепей ПЭГ может привести к различным биологическим эффектам и, следовательно, к различным фармакокинетикам. Другим ограничением применения ПЭГ является уменьшение аффинности или активности, как наблюдали в случае с альфа-интерфероном Пэгасис, который имеет только 7% противовирусной активности нативного белка, но также обладает улучшенной фармакокинетикой вследствие улучшенного периода полувыведения из плазмы крови.
Другой подход заключается в конъюгации лекарственного средства с белками, которые имеют длинный период жизни, например, альбумином, который имеет массу 67 кДа и обладает периодом полувыведения из плазмы крови человека 19 дней. Альбумин является наиболее распространенным белком в плазме крови и участвует в регуляции рН плазмы, а также служит в качестве носителя веществ в плазме. В случае CD4 увеличение периода полувыведения из плазмы крови было достигнуто после слияния его с человеческим сывороточным альбумином (Yeh и др., 1992). Другие примеры слитых белков представляют собой инсулин, гормон роста человека, трансферрин и цитокины (Duttaroy и др., 2005; Melder и др., 2005; Osborn и др., 2002;. Osborn и др., 2002; Sung и др., 2003), а также смотри публикацию патентной заявки США №2003104578 A1, WO 06096515 A2 и WO 07047504 A2, которые являются включенными в данную заявку в полном объеме в качестве ссылки).
Влияние гликозилирования на период полувыведения из плазмы крови и активность белка плазмы также широко изучены. В случае тканевого активатора плазминогена (tPA) прибавление новых сайтов гликозилирования уменьшало клиренс из плазмы крови и улучшало эффективность (Keyt и др., 1994). Гликоинжиниринг был успешно использован для ряда рекомбинантных белков и иммуноглобулинов (Elliott и др., 2003; Raju и Scallon, 2007; Sinclair и Elliott, 2005; Umana и др., 1999). Кроме того, гликозилирование влияет на стабильность иммуноглобулинов (Mimura и др., 2000; Raju и Scallon, 2006).
Другая молекула, которая используется для синтеза слитых белков, представляет собой Fc фрагмент IgG (Ashkenazi и Chamow, 1997). Подход при использовании Fc был использован, например, в технологии ловушки, разработанной Regeneron (например, IL1 ловушка и VEGF ловушка). Применение альбумина для продления периода полувыведения пептидов было описано в публикации патентной заявки США №2004001827А1, а также для Fab фрагментов и ScFv-HSA слитого белка. Было показано, что длительный период полувыведения из сыворотки крови альбумина осуществляется благодаря процессу рециклинга, опосредованного FcRn (Anderson и др., 2006; Chaudhury и др., 2003).
Другая стратегия заключается в использовании методик направленного мутагенеза, нацеленных на взаимодействие иммуноглобулинов с их рецептором для того, чтобы улучшить их связующие свойства, т.е. созревание аффинности в участке Fc. С повышением аффиности к FcRn может быть достигнут длительный период полувыведения в условиях in vivo (Ghetie и др., 1997; Hinton и др., 2006; Jain и др., 2007; Petkova и др., 2006а; Vaccaro и др., 2005). Тем не менее, стратегии созревания аффинности требуют нескольких циклов мутагенеза и тестирования. Для этого является необходимым определенный период времени, что является дорогостоящим и ограничено по количетсву аминокислот, которые при мутациях приводят к длительному периоду полувыведения. Таким образом, являются необходимыми простые альтернативные подходы для улучшения периода полувыведения биотерапевтических агентов в условиях in vivo. Терапевтические агенты с удлиненным периодом полувыведения в условиях in vivo являются особенно важными для лечения хронических заболеваний, аутоиммунных расстройств, воспалительных, метаболических, инфекционных и глазных заболеваний, а также рака, особенно тогда, когда терапия требуется в течение длительного периода времени. Соответственно, все еще существует необходимость в разработке терапевтических агентов (например, антител и слитых белков Fc) с улучшенной персистенцией и периодом полувыведения в системе циркуляции крови для того, чтобы уменьшить дозировку и/или частоту инъекций различных терапевтических агентов.
G. Метки
Пептиды и полипептиды в соответствии с настоящим изобретением могут быть конъюгированы с метками для диагностических целей, например, для идентификации раковых клеток или инфицированных вирусом клеток, включая их применение в гистохимии. Метка в соответствии с настоящим изобретением определяется как любая группа, которая может быть обнаружена при использовании анализа. Неограничивающие примеры репортерных молекул включают ферменты, радиоактивные метки, гаптены, флуоресцентные метки, фосфоресцирующие молекулы, хемилюминесцентные молекулы, хромофоры, фотоаффинные молекулы, окрашенные частицы или лиганды, такие как биотин.
Конъюгаты с меткой обычно являются предпочтительными для использования в качестве диагностических агентов. Диагностические агенты обычно попадают в два класса, те, которые используются в диагностики in vitro, и те, которые используются в диагностических прописях in vivo, как правило, известные как "целевые изображения." Многие подходящие агенты для получения изображений являются известными в данной области техники, так же, как и способы их прикрепления к пептидам и полипептидам (смотри, например, патенты США №№5021236, 4,938,948 и 4,472,509). Используемые остатки для получения изображений могут представлять собой парамагнитные ионы, радиоактивные изотопы, люминофоры, обнаруживаемые с помощью ЯМР вещества и агенты для получения рентгеновских изображений.
В случае парамагнитных ионов в качестве примера можно упомянуть такие ионы, как хрома (III), марганца (II), железа (III), железа (II), кобальта (II), никеля (II), меди (II), неодима (III), самария (III) иттербия (III), гадолиния (III), ванадия (II), тербия (III), диспрозия (III), гольмия (III) и/или эрбия (III), с гадолинией, который является особенно предпочтительным. Ионы, полезные в других контекстах, например, для получения рентгеновских изображений, включают в себя, но не ограничиваются такими, как лантан (III), золото (III), свинец (II) и, в частности, висмут (III).
В случае радиоактивных изотопов для терапевтического и/или диагностического применения, можно упомянуть астатин211, 14углерод, 51хром, 36хлор, 57кобальт, 58кобальт, медь67, 152европий, галлий67, 3водород, йод123, йод125, йод131, индий111, 59железо, 32фосфор, рений186, рений188, 75селен, 35серу, технеций99m и/или иттрий90. 125I часто является предпочтительным для использования в некоторых вариантах осуществления, а технеций99m и/или индий111 также часто являются предпочтительными из-за их низкой энергии и пригодности для определения в течение длительного периода времени. Меченные радиоактивной меткой пептиды и полипептиды могут быть получены в соответствии с хорошо известными в данной области способами. Например, пептиды и полипептиды можно подвергать иодизации при контакте иодида натрия и/или калия с химическим окислительным агентом таким, как гипохлорит натрия или ферментативным окислительным агентом таким, как лактопероксидаза. Пептиды могут быть меченными при использовании технеция99m при использовании процесса обмена лигандов, например, путем восстановления пертехната при использовании раствора олова, хелатирования восстановленного технеция на колонке с сефадексом и применения пептида к этой колонке. Кроме того, могут быть использованы непосредственные способы мечения, например, путем инкубации пертехната, восстанавливающего агента, такого как SnCl2, буферного раствора, такого как раствор фталата натрия-калия, и пептида. Промежуточные функциональные группы, которые часто используются для связывания радиоизотопов, которые существуют в виде ионов металла, с пептидом, представляют собой диэтилентриаминпентауксусную кислоту (DTPA) или этилендиаминтетрауксусную кислоту (ЭДТА).
Флуоресцентные метки, которые предусматриваются для использования в качестве конъюгатов, включают Alexa 350, Alexa 430, АМСА, BODIPY 630/650, ВСЮГРУ 650/665, BODIPY-FL, BODIPY-R6G, BODIPY-TMR, BODIPY-TRX, Каскад голубой, Су3, Су5, 6-FAM, флуоресцентный изотиоцианат, HEX, 6-JOE, орегонский зеленый 488, орегонский зеленый 500, орегонский зеленый 514, тихоокеанский голубой, REG, родамин зеленый, родамин красный, ренографин, ROX, TAMRA, ТЕТ, тетраметилродамин и/или техасский красный.
Другой из предусмотренных типов конъюгатов представляет собой такой, который предназначен, в первую очередь, для использования в условиях in vitro, где пептид является связанным со вторичным связывающим лигандом и/или с ферментом (ферментная метка), который будет образовывать окрашенный продукт при контакте с хромогенным субстратом. Примеры подходящих ферментов включают уреазу, щелочную фосфатазу, гидрогенпероксидазу хрена или глюкозаоксидазу. Предпочтительные вторичные связывающие лиганды представляют собой соединения биотина, авидина и стрептавидина. Использование таких меток является хорошо известным специалистам в данной области техники и описано, например, в патентах США №№3,817,837, 3,850,752, 3,939,350, 3,996,345, 4,277,437, 4,275,149 и 4,366,241.
Другие способы для прикрепления или конъюгации пептида с его остатком конъюгации являются известными в данной области техники. Некоторые способы соединения включают использование хелатного комплекса металлы при использовании, например, органического хелатирующего агента такого, как ангидрид диэтилентриаминпентауксусной кислоты (DTPA); этилентриаминтетрауксусной кислоты; N-хлор-п-толуолсульфонамида; и/или тетрахлор-3α-6α-дифенилгликоурил-3, присоединенных к антителу (патенты США №№4,472,509 и 4,938,948). Пептиды или полипептиды также можно подвергать взаимодействию с ферментом в присутствии связывающего агента такого, как глутаровый альдегид или периодат. Конъюгаты с флуоресцентными маркерами получают в присутствии этих агентов слияния или путем реакции с изотиоцианатом.
IV. Диагностические и терапевтические агенты
А. Фармацевтические композиции и способы введения
В том случае, если предполагается клиническое применение, необходимо приготовить фармацевтические композиции в форме, подходящей для намеченного применения. Как правило, это предполагает приготовление композиций, которые по существу не содержит пирогенов, а также других примесей, которые могут быть вредными для человека или животных.
В общем случае, если имеется желание использовать соответствующие соли и буферы для обеспечения доставки, получают стабильные векторы и обеспечивают поглощения их клетками-мишенями. Буферы также будут использоваться тогда, когда рекомбинантные клетки вводят пациенту. Водные композиции в соответствии с настоящим изобретением содержат эффективное количество вектора для введения в клетки, растворенного или диспергированного в фармацевтически приемлемом носителе или водной среде. Такие композиции также называются инокулятом. Фраза "фармацевтически или фармакологически приемлемый" относится к молекулярным частицам и композициям, которые не вызывают негативных, аллергических или других неблагоприятных реакций при введении животному или человеку. Как используется в данной заявке, выражение "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты задержки абсорбции и тому подобное. Применение таких сред и агентов для фармацевтически активных веществ является хорошо известным в данной области техники. За исключением тех случаев, когда предполагается любая традиционная среда или агент является несовместимым с векторами или клетками в соответствии с настоящим изобретением, предполагается их применение в терапевтических композициях. Дополнительные активные ингредиенты могут также быть включенными в композиции.
Активные композиции в соответствии с настоящим изобретением могут включать в себя классические фармацевтические препараты. Введение этих композиций в соответствии с настоящим изобретением будет осуществляться посредством любого общего пути при условии, что ткань-мишень является доступной при использовании этого пути. Такие способы включают пероральный, назальный, буккальный, ректальный, вагинальный или местный способы введения. Кроме того, введение может осуществляться с помощью ортотопической, внутрикожной, подкожной, внутримышечной, внутрибрюшинной, внутриопухолевой или внутривенной инъекции. Такие композиции, как правило, можно вводить в виде фармацевтически приемлемых композиций, описанных ранее.
Активные соединения могут быть также введены парентерально или внутрибрюшинно. Растворы активных соединений в виде свободного основания или фармакологически приемлемых солей могут быть приготовлены в воде, соответственно смешанной с поверхностно-активным веществом таким, как гидроксипропилцеллюлоза. Дисперсии могут быть также приготовлены в глицерине, жидких полиэтиленгликолях, их смесях и в маслах. В обычных условиях хранения и использования эти препараты содержат консервант для предотвращения роста микроорганизмов.
Фармацевтические формы, пригодные для инъекционного применения, включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий. Во всех случаях форма должна быть стерильной и должна быть жидкой до такой степени, чтобы осуществлять ее введение с помощью шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего воздействия микроорганизмов таких, как бактерии и грибки. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль, и т.п.), их подходящие смеси и растительные масла. Надлежащую текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и при использовании поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть достигнуто с помощью различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п. Во многих случаях будет предпочтительным включать в состав изотонические агенты, например, сахара или хлорид натрия. Пролонгированная абсорбция инъекционных композиций может быть достигнута при использовании в композициях агентов, задерживающих абсорбцию, например, моностеарата алюминия и желатина.
Стерильные инъекционные растворы получают путем введения активных соединений в необходимом количестве в соответствующий растворитель с различными другими ингредиентами, такими, как те, что перечислены выше, по мере необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают путем включения различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты, выбранные из тех, которые перечислены выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами приготовления являются способы вакуумной сушки и сушки вымораживанием, которые обеспечивают получение порошка активного ингредиента плюс любой дополнительный желательный ингредиент из предварительно стерилизованного фильтрацией раствора.
Как используется в данной заявке, "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты задержки абсорбции и тому подобное. Применение таких сред и агентов для фармацевтически активных веществ является хорошо известным в данной области техники. За исключением тех случаев, когда предполагается любая традиционная среда или агент является несовместимым с векторами или клетками в соответствии с настоящим изобретением, предполагается их применение в терапевтических композициях. Дополнительные активные ингредиенты могут также быть включены в состав композиции.
Для перорального введения пептиды и полипептиды в соответствии с настоящим изобретением могут быть объединены с наполнителями и используются в виде не предусмотренной для проглатывания жидкости для полоскания рта и зубных порошков и паст. Жидкости для полоскания рта могут быть получены путем включения активного ингредиента в требуемом количестве в соответствующий растворитель, например, раствор бората натрия (раствор Добелля). Кроме того, активный ингредиент может быть введен в антисептическую промывку, содержащую борат натрия, глицерин и бикарбонат калия. Активный ингредиент может быть также диспергирован в средствах для чистки зубов, включая гели, пасты, порошки и взвеси. Активный ингредиент может быть добавлен в терапевтически эффективном количестве в зубную пасту, и такими ингредиентами могут быть вода, связующие агенты, абразивы, ароматизаторы, пенообразователи и увлажнители.
Композиции в соответствии с изобретением, по существу, могут быть получены в нейтральной или солевой форме. Фармацевтически приемлемыми солями являются, например, кислотно-аддитивные соли (образованные свободными аминогруппами белка), полученные из неорганических кислот, таких как, например, соляная кислота или фосфорная кислота, или из органических кислот, таких, как, например, уксусная, щавелевая, винная, миндальная кислоты и подобные им. Соли, образованные свободными карбоксильными группами белка, могут быть также получены из неорганических оснований таких, как, например, гидроксиды натрия, калия, аммония, кальция или железа, или из органических оснований, таких, как изопропиламин, триметиламин, гистидин, прокаин и т.п.
После рецептирования растворы предпочтительно вводят способом, совместимым с данной лекарственной формой, и в терапевтически эффективном количестве. Такие препараты могут быть легко введены в различных лекарственных формах, таких как растворы для инъекций, капсулы, высвобождающие лекарственные средства, и т.п. Для парентерального введения в водном растворе указанный раствор обычно соответствующим образом забуферивают, но сначала ему придают изотоничность путем добавления жидкого разбавителя с достаточным количеством физиологического раствора или глюкозы. В частности, такие водные растворы являются особенно приемлемыми для внутривенного, внутримышечного, подкожного и интраперитонеального введения. В этой связи стерильные водные среды, которые могут использоваться, будут известными специалисту в данной области техники в свете описания данной заявки. Например, одна доза может быть растворена в 1 мл изотонического раствора NaCl, а затем ее либо добавляют к 1000 мл жидкости для введения в подкожную клетчатку, либо вводят путем инъекции в предлагаемый участок инфузии (см., например, руководство Remington's Pharmaceutical Sciences," 15-ое изд., стр. 1035-1038 и 1570-1580)). Некоторые вариации дозировки будут с необходимостью возникать в зависимости от состояния индивидуума, которого подвергают лечению. Лицо, которое отвечает за введение, в любом случае, будет определять подходящую дозу для конкретного индивидуума. Кроме того, препараты, предназначенные для введения человеку, должны удовлетворять стандартам стерильности, апирогенности, общей безопасности и чистоты в соответствии с требованиями Департамента по биологическим стандартам Управления по контролю за качеством продуктов питания и лекарственных средств (FDA).
В. Болезненные состояния и расстройства
1. Рак
Рак возникает в результате разрастания клональной популяции клеток из ткани. Развитие рака, которое называют канцерогенезом, может быть смоделировано и охарактеризовано с помощью ряда способов. Связь между развитием рака и воспалением уже давно определена. Воспалительная реакция является вовлеченной в защиту хозяина от микробной инфекции, а также приводит к восстановлению и регенерации тканей. Веские доказательства указывают на связь между воспалением и риском развития рака, то есть, хроническое воспаление может привести к дисплазии. Существуют сотни различных форм рака человека, и с увеличением понимания лежащих в их основе генетики и биологии рака, эти формы дополнительно подразделяются и подвергаются переклассификации.
Определить то, что вызывает рак, является сложным. Многие факторы являются известными как такие, которые увеличивают риск развития рака, в том числе употребление табака, некоторые инфекции, радиация, отсутствие физической активности, ожирение и загрязнение окружающей среды. Они могут непосредственно повреждать гены или сочетаться с существующими генетическими дефектами в клетках с последующим возникновением заболевания. Примерно от пяти до десяти процентов случаев рака являются полностью наследственными.
Рак может быть обнаружен с помощью ряда способов, включая наличие определенных признаков и симптомов, скрининг-тесты или получение медицинских изображений. После того, как определяют возможный рак, его диагностируют с помощью микроскопического исследования образца ткани. Рак, как правило, подвергают лечению при использовании химиотерапии, лучевой терапии и хирургии. Шансы на выживание при этом заболевании варьируют в значительной степени в зависимости от места расположения и типа рака, а также степени заболевания в начале лечения. В то время как рак может поражать людей всех возрастов, несколько видов рака являются более распространенными у детей, в общем случае риск развития рака увеличивается с возрастом. В 2007 году рак составлял около 13% всех случаев смерти людей во всем мире (7,9 миллионов). Эти показатели растут, поскольку все больше людей доживают до старости и в развивающихся странах происходит изменение образа жизни населения.
Лечение включает пять основных категорий: хирургия, химиотерапия, лучевая терапия, альтернативная медицина и паллиативое лечение. Хирургия является основным методом лечения большинства солидных видов рака и может играть определенную роль во временном облегчении и продлении выживания. Это, как правило, является важной частью постановки окончательного диагноза и стадии развития опухоли, поскольку, как правило, требуется биопсия. При локализованной хирургии рака, как правило, пытаются удалить всю массу, а в некоторых случаях, также вместе с лимфатическими узлами в этой области. Для некоторых видов рака это все, что необходимо для устранения рака.
Химиотерапия в дополнение к хирургии оказалась полезной при ряде различных видов рака, включая рак молочной железы, колоректальный рак, рак поджелудочной железы, остеогенную саркому, рак яичка, рак яичников и некоторых видах рака рак легких. Эффективность химиотерапии часто ограничивается ее токсичностью для других тканей в организме.
Лучевая терапия включает в себя использование ионизирующего излучения в попытке либо излечить, либо улучшить симптомы рака. Она используется примерно в половине всех случаев, при этом излучение может исходить либо из внутренних источников в виде брахитерапии, либо внешних источников. Излучение, как правило, используется в дополнение к хирургии и химиотерапии, но для некоторых видов рака таких, как ранний рак головы и шеи, оно может использоваться самостоятельно. При болезненных костных метастазах было обнаружено, что лучевая терапия является эффективной приблизительно у 70% пациентов.
Альтернативные и дополнительные методы лечения включают различные группы систем лечения, методов и продуктов, которые не являются частью традиционной медицины "Дополнительная медицина" относится к методам и веществам, которые используются вместе с традиционной медициной, в то время как "альтернативная медицина" относится к соединениям, используемым вместо традиционной медицины. Большинство дополнительных и альтернативных лекарственных агентов для рака не были тщательно изучены и проверены. Некоторые альтернативные методы лечения были изучены и доказали свою неэффективность, но до сих пор продолжаю поступать на рынок и рекламироваться.
Наконец, паллиативное лечение означает лечение, которое пытается позволить пациенту чувствовать себя лучше и может или не может сочетаться с попыткой лечения рака. Паллиативная помощь включает в себя меры по сокращению физических, эмоциональных, духовных и психосоциальных проблем в отношении людей, больных раком. В отличие от лечения, направленного на непосредственное уничтожение раковых клеток, основной задачей паллиативной помощи является улучшение качества в жизни пациента.
2. Вирусная инфекция
Вирус представляет собой небольшой инфекционный агент, который может реплицироваться только внутри живых клеток организма. Вирусы могут заражать все виды организмов, от животных и растений до бактерий и архебактерий. Были описаны подробно около 5000 вирусов, хотя существуют миллионы различных типов. Вирусы находятся практически в каждой экосистеме на Земле и представляют собой наиболее распространенный тип биологического объекта.
Вирусные частицы (известные как вирионы) состоят из двух или трех частей: I) генетический материал, представленный ДНК или РНК, длинные молекулы, которых несут генетическую информацию; II) белковая оболочка, которая защищает эти гены; и в некоторых случаях, III) липидная оболочка, которая окружает белковую оболочку, когда вирусы находятся за пределами клетки. Формы вирусов варьируют от простых спиральных и икосаэдрических форм до более сложных структур. Средний вирус имеет размер, который составляет около одной сотой размера средней бактерии. Большинство вирусов слишком малы, чтобы их можно было увидеть непосредственно с помощью оптического микроскопа.
Вирусы распространяются с помощью различных путей; вирусы в растениях часто передаются от растения к растению насекомыми, которые питаются соком растений, такими, как тля; вирусы животных могут передаваться с помощью кровососущих насекомых. Эти переносящие болезнь организмы являются известными как векторы. Вирусы гриппа распространяется при кашле и чихании. Норовирус и ротавирус, которые представляют собой распространенные причины вирусного гастроэнтерита, передаются фекально-оральным путем, а также передаются от человека к человеку при контакте, попадая в организм через пищу или воду. ВИЧ является одним из нескольких вирусов, передающихся при половом контакте и при попадании в организм зараженной крови. Множество клеток-хозяев, которые вирус может заразить, называется его "кругом хозяев". Он может быть узким или, в случае, когда вирус способен инфицировать многие виды, широким.
Вирусные инфекции у животных вызывают иммунный ответ, который, как правило, устраняет инфицирующий вирус. Иммунный ответ может быть также получен с помощью вакцин, которые обеспечивают искусственно приобретенный иммунитет к конкретной вирусной инфекции. Тем не менее, некоторые вирусы, в том числе те, которые вызывают СПИД и вирусный гепатит, уклоняются от таких иммунных реакций и приводят к возникновению хронической инфекции. Антибиотики не воздействуют на вирусы, хотя было разработано несколько антивирусных препаратов.
Разнообразные заболевания способствовали развитию вирусных инфекций, включая грипп, вирус иммунодефицита человека, вирус денге, вирус Западного Нила, вирус оспы, респираторно-синцитиальный вирус, вирус корейской геморрагической лихорадки, вирус ветряной оспы, вирус простого герпеса 1 или 2, вирус Эпштейна-Барр, вирус марбургской болезни, хантавирус, вирус желтой лихорадки, вирус гепатита А, В, С или Е, вирус Эбола, вирус папилломы человека, риновирусы, вирус Коксаки, вирус полиомиелита, вирус кори, вирус краснухи, вирус бешенства, вирус ньюкаслской болезни, ротавирус, HTLV-1 и -2.
С. Способы лечения
Пептиды и полипептиды могут быть введены млекопитающим (например, человеку) отдельно или в сочетании с другими препаратами, которые лечат болезни, указанные выше. Дозировка зависит от необходимости выбора пути введения; природы препарата, в том числе от дополнительных агентов, присоединенных к полипептиду; природы болезни пациента; размера субъекта, веса, площади поверхности тела, возраста и пола; дальнейшей комбинированной терапии; и решения лечащего врача. Приемлемые дозы лежат в интервале от 0,0001 до 100 мг/кг. Широких вариаций уровня необходимой дозировки следует ожидать с учетом разнообразия доступных соединений и различной эффективности различных путей введения. Например, пероральное введение, как следует ожидать, будет требовать более высоких доз, чем введение путем внутривенной инъекции. Различия в этих дозах может быть скорректировано при использовании стандартных эмпирических процедур для оптимизации дозировки, как является хорошо известным специалистам в данной области техники. Введение может быть однократным или множественным (например, 2, 3, 4, 6, 8, 10, 20, 50, 100, 150 или более раз). Инкапсуляция полипептида в подходящем носителе для доставки (например, полимерных микрочастицах или имплантируемых устройствах) может повысить эффективность доставки, в частности, в случае пероральной доставки.
Сконструированные белки Gla домена могут быть использованы в качестве нацеливающих агентов для доставки терапевтической полезной загрузки для раковых клеток такой, как радионуклиды, химиотерапевтические агенты или токсины. Конкретные химиотерапевтические агенты включают темозоломид, эпотилоны, мелфалан, кармустин, бусульфан, ломустин, циклофосфамид, дакарбазин, полифепросан, ифосфамид, хлорамбуцил, мехлоретамин, бусульфан, циклофосфамид, карбоплатин, цисплатин, тиотепа, капецитабин, стрептозоцин, бикалутамид, флутамид, нилутамид, лейпролид ацетат, доксорубицин гидрохлорид, блеомицин сульфат, даунорубицин гидрохлорид, дактиномицин, липосомальный даунорубицин цитрат, липосомальный доксорубицин гидрохлорид, эпирубицин гидрохлорид, идарубицин гидрохлорид, митомицин, доксорубицин, валрубицин, анастрозол, торемифен цитрат, цитарабин, фторурацил, флударабин, флоксуридин, интерферон α-2b, пликамицин, меркаптопурин, метотрексат, интерферон α-2а, медроксипрогестерон ацетат, эстрамустин фосфат натрия, эстрадиол, лейпролид ацетат, мегестролацетат, октреотид ацетат, диэтилстилбестрол дифосфат, тестолактон, гозерелин ацетат, этопозид фосфат, винкристин сульфат, этопозид, винбластин, этопозид, винкристин сульфат, тенипозид, трастузумаб, гемтузумаб, озогамицин, ритуксимаб, эксеместан, иринотекан гидрохлорид, аспарагиназу, гемцитабин гидрохлорид, алтретамин, топотекан гидрохлорид, гидроксимочевину, кладрибин, митотан, прокарбазин гидрохлорид, винорелбин тартрат, пентростатин натрия, митоксантрон, пенаспаргазу, денилейкин дифтитокс, алтретиноин, порфимер, бексаротен, паклитаксел, доцетаксел, триоксид мышьяка или третиноин. Токсины включают экзотоксин Pseudomonas (РЕ38), цепь рицина А, дифтерийный токсин, кроме РЕ и RT, антивирусный белок фитолакки американской (РАР), сапорин и гелонин. Радионуклиды для раковой терапии включают Y-90, Р-32, I-131, In-111, Sr-89, Re-186, Sm-153 и Sn-117m.
Агенты или факторы, приемлемые для терапии вирусных инфекций, включают абакавир, ацикловир, адефовир, амантадин, ампренавир амплиген, арбидол, атазанавир, атрипла, боцепревир эртет, цидофовир, комбивир, дарунавир, делавирдин, диданозин, докозанол, эдоксудин, эфавиренц, эмтрицитабин, энфувиртид, энтекавир, ингибиторы проникновения в клетку, фамцикловир, фомивирсен, фосампренавир, фосфкарнет, фосфонет, ганцикловир, ивацитабин, имуновир, идоксуридин, имиквимод, индинавир, инозин, ингибитор интегразы, интерферон типа III, интерферон типа II, интерферон типа I, интерферон, ламивудин, лопинавир, ловирид, маравирок, мороксидин, метизазон, нелфинавир, невирапин, нексавир, аналоги нуклеозидов, озелтамивир, пегинтерферон альфа-2а, пенцикловир, перамивир, плеконарил, подофиллотоксин, ингибитор протеазы, ралтегравир, ингибитор обратной транскриптазы, рибавирин, ремантадин, ритонавир, пирамидин, саквинавир, ставудин, синергетический усилитель (антиретровирусный), масло чайного дерева, телапревир, тенофовир, дизопроксилфумарат, типранавир, трифлуридин, тризивир, тромантадин, трувада, валацикловир, валганцикловир, викривирок, видарабин, вирамидин, зальцитабин, занамивир и зидовудин.
Специалиста в данной области техники следует адресовать к "Remington's Pharmaceutical Sciences" 15-е издание, глава 33, в частности, страницы 624-652. Некоторые изменение дозы будут обязательно иметь место в зависимости от состояния субъекта, которого подвергают лечению. Лицо, ответственное за введение лекарственного средства, в любом случае, будет определять соответствующую дозу для отдельного субъекта. Кроме того, для введения человеку препараты должны отвечать требованиям стерильности, апирогенности, стандартам чистоты и общим правилам техники безопасности в соответствии с требованиями Департамента по биологическим стандартам Управления по контролю за качеством продуктов питания и лекарственных средств (FDA).
V. Примеры
Приведенные ниже примеры включены в данное описание для демонстрации конкретных вариантов осуществления изобретения. Специалисты в этой области техники должны иметь в виду тот факт, что методики, раскрытые в примерах, которые приведены ниже, представляют собой способы, раскрытые изобретателем для нормального функционирования при реализации изобретения, и, таким образом, могут рассматриваться как предпочтительные способы практической реализации. Тем не менее, специалистам в данной области техники должно быть понятным в свете настоящего описания, что многие изменения могут быть сделаны в конкретных вариантах, которые раскрыты, и при этом все-таки можно получить похожий или аналогичный результат без отступления от сущности и объема изобретения.
ПРИМЕР 1
Аффинности белков Gla-домена для клеточных мембран были определены в условиях in vitro с помощью подготовленных фосфолипидных везикул (Shah и др., 1998; Nelsestuen, 1999). Однако не до конца понятно, каким образом эти значения in vitro можно перевести в контекст условий in vivo. Взаимодействие FVII с TF, например, подчеркивает тот факт, что, хотя Gla домены этих белков очень гомологичными, дополнительные различия в связывающей специфичности их клеточной мембраны и аффинность могут быть опосредованы с помощью их EGF и/или Крингл доменов. К сожалению, эти взаимодействия не могут воспроизводиться с помощью исследований, которые основываются исключительно на фосфолипидных везикулах и могут оставаться неидентифицированными.
Таким образом, изобретатели предложил создать и подвергнуть исследованию Gla+EGF/Крингл домены, а также Gla домен, взятый отдельно, из следующей панели белков: hS (связующий агент с высокой аффинностью), hZ (связующий агент со средней аффинностью), hPT (связующий агент, содержащий Крингл домен со средней аффинностью), hFVII (вторичный "рецептор", использующий низкую аффинность, который также подвергается повышающей регуляции при раке) и В0178 (hFVII с повышенной фосфолипидной аффинностью). Эти белки потенциально имеют варьирующие в условиях in vivo характеристики связывания, которые могут быть полезными при их использовании в качестве зондов (и, если будут подтверждены и селективны, потенциально в качестве терапевтических средств) и которые на сегодняшний день являются непризнанными.
Общий подход заключался в том, чтобы сконструировать рекомбинантные белки и проверить их на экспрессию. После этого следует разработать анализы для оценки связывания. Далее будет необходимым оптимизировать способы экспрессии и очистки, после чего осуществляется контроль качества гамма-карбоксилирования.
ФИГ. 1 показывает последовательности из различных белков Gla домена, включая сайты карбоксилирования. ФИГ. 2 показывает экспрессию различных белков Gla домена, которые были сконструированы и транзиентно экспрессированы в клетках 293. ФИГ. 3 показывает аналогичное исследование в клетках ВНК21. Учитывая, что одной из лучших экспрессирующих конструкций была конструкция белок S+EGF, сигнальная последовательность из белка S была использована для Gla протромбина + Крингл домен и белок Z+EGF. Тем не менее наблюдали только внутриклеточную экспрессию (ФИГ. 4).
Конструкция Gla белка S+EGF была выбрана для дальнейшего изучения. Последовательность показана в ФИГ. 5. Белок вырабатывается в клетках ВНК21 при использовании RF286 среды. 600 мл среды собирали и концентрировали 4Х. Очистку осуществляли в три этапа:
1. Ni-NTA колонка на 10 мл, свежеупакованная. Среду загружали на колонку и элюировали при использовании градиента имидазола. Все фракции подвергали вестерн блоттингу Gla, чтобы идентифицировать меченную His конструкцию Gla белок S G+Е.
2. Hitrap Q с этапом элюирования при использовании СаСl2. Позитивные по Gla фракции соединяли и подвергали исследованию при использовании 1 мл Hitrap Q при элюировании с использованием 10 мМ СаСl2.
3. Hitrap Q с градиентом CaCl2 (0-10 мМ теневой градиент). Очищенные Gla белки применяли к Q и элюировали с градиентом CaCl2 (вплоть до 10 мМ). В общей сложности получали 0,9 мг белка с уровнем чистоты 95%. ФИГ. 6 показывает очистку фракций как при восстанавливающих, так и невосстанавливающих условиях. Фиг. 7 и 8 показывают различные анализы апоптоза на основе FACs. Обе фигуры показывают, что конструкция Gla белка S+EGF является специфической для клеток, которые подверглись апоптозу, подобно аннексину V (ФИГ. 7), и что аннексии V может конкурировать за связывание конструкции Gla белка S+EGF.
В целом, была экспрессирована и очищена конструкция Gla белка S+EGF. Анализ на очищенном материале дает возможность предположить, что она является в высокой степени гамма-карбоксилированной. Анализы апоптоза на основе FACs показали, что конструкция G белка S+Е (11 Gla) может связываться с "апоптотическими клетками", и что это связывание с клетками осуществляется с помощью нацеливания на фосфатидилсерин, как было продемонстрировано с помощью конкурентных анализов при использовании аннексина V.
Все композиции и/или способы, раскрытые и заявленные в данной заявке, могут быть сделаны и осуществлены без излишних экспериментов в свете настоящего описания. Хотя композиции и способы в соответствии с данной заявкой были описаны в контексте предпочтительных вариантов осуществления, специалистам в данной области техники будет очевидным, что изменения могут быть применены к композициям и/или способам, к этапам или к последовательности этапов способа, описанного в данной заявке, без отхода от концепции, духа и объема изобретения. В частности, будет очевидным, что определенные агенты, которые являются как химически, так и физиологически близкими, могут быть заменены агентами, описанными в данной заявке, в при этом будут достигнуты те же или аналогичные результаты. Все такие сходные замены и модификации, очевидные для специалистов в данной области техники, будут считаться такими, которые соответствуют духу, объему и концепции изобретения, как определяется в прилагаемой формуле изобретения.
VI. Ссылки
Следующие ссылки, в той степени, в которой они обеспечивают примеры, процедуры или другие детали дополнительно к тем, которые изложены в настоящем документе, являются специально включенными в данную заявку в качестве ссылки:
Патент США №5,440,013
Патент США №5,446,128
Патент США №5,475,085
Патент США №5,597,457
Патент США №5,618,914
Патент США №5,670,155
Патент США №5,672,681
Патент США №5,674,976
Патент США №5,710,245
Патент США №5,790,421
Патент США №5,840,833
Патент США №5,859,184
Патент США №5,889,155
Патент США №5,929,237
Патент США №6,093,573
Патент США №6,261,569
Патентная заявка США №2005/0015232
Патентная заявка США №2004/001827А1
Патентная заявка США №2003/104578А2
Патентная заявка США №2003/104578А1
WO 06096515A2
WO 07047504A2
WO 06096515A2
Aaronson и Horvath, Science, 296(5573): 1653-5,2002.
Abe and Kufe, Cancer Res., 49(11): 2834-2839, 1989.
Agata и др., Cancer Res., 68: 6136-44, 2008.
Ahmad и др., Cancer Res., 68: 2920-2926, 2008.
Ahmad и др., J. Biol. Chem., 281: 35764-9, 2006.
Ahmad и др., Nat. Cell Biol, 9: 1419-1427, 2007.
Alvarez и др., Cancer Res., 65(12): 5054-62, 2005.
Alvarez и др., Cancer Res., 66(6): 3162-8, 2006.
Anderson и др., Trends Immunol 27 343-348, 2006.
Ashkenazi and Chamow, Curr Op Immunol 9,195-200, 1997.
Baldus и др., Clin. Cancer Res., 10(8): 2790-2796, 2004.
Blankenberg, Proc Am Thorac Soc, 6, стр. 469-476, 2009.
Bodanszky и др., J. Antibiot., 29(5): 549-53,1976.
Boersma и др., J Nuclear Med, 46 (12), p 2035-2050, 2005.
Bowman и др., Oncogene, 19(21): 2474-88, 2000.
Bromberg и др., Cell, 98(3): 295-303, 1999.
Buerger и др., J. Biol. Chem., 278(39): 37610-21, 2003.
Carter, Nature Reviews Immunol 6, 343-357, 2006.
Chapman, Advanced Drug Delivery Reviews 54, 531-545, 2002.
Chaudhury и др., J Exper Med 197, 315-322, 2003.
Chen и Greene, Mol. Cell. Biol. 5: 392-401, 2004.
Cohen и др., J. Med. Chem., 33: 883-894, 1990.
Cohen и др., Cell Res, 19 стр. 625-637, 2009.
Duraisamy и др., Gene, 373: 28-34, 2006.
Duttaroy и др., Diabetes 54, 251-258, 2005.
Elliott и др., Nat Biotechnol 21, 414-421, 2003.
Elltiot и др., Nature, 461, стр. 2-286, 2009.
Elltiot and Ravichandran, J. Cell Biol, 189 (7) стр. 1059-1070, 2010.
Erwig and Henson, Cell Death Differentiation 15, стр. 243-250, 2008.
Fischer, Med. Res. Rev., 27(6): 755-796, 2007.
Gaemers и др., J. Biol. Chem., 276: 6191-6199, 2001.
Gendler и др., J. Biol. Chem., 263: 12820-12823, 1988.
Germain and Frank, Clin. Cancer Res., 13(19): 5665-9, 2007.
Gerondakis и др., Oncogene 25(51): 6781-99, 2006.
Ghetie и др., Nature Biotechnol 15, 637-640, 1997.
Ghosh и др., Annu. Rev. Cell. Dev. Biol., 16: 225-60, 1998.
Gilmore, доступно из NF-kB.org, 2008.
Grillot и др., J. Immunol., 158: 4750-7, 1997.
Gronenborn и др., Anal. Chem., 62(1): 2-15, 1990.
Hansson and Stenflo. J Thrombosis Haemostasis, 3, стр. 2633-2648, 2005.
Hayden and Ghosh, Cell, 132: 344-62, 2008.
Hinton и др., J Immunol 176, 346-356, 2006.
Hodel и др., Mol. Cell, 10(2): 347-58, 2002.
Hoffman и др., Oncogene, 25: 6706-16, 2006.
Huang и др., Cancer Biol Ther., 2: 702-706, 2003.
Huang и др., Cancer Res., 65: 10413-10422, 2005.
Huxford и др., Cell 95(6): 759-70,1998.
Jackson, Seminars in Oncology, 24: L164-172,1997.
Jacobs и др., Cell, 95: 749-58,1998.
Jain и др., Trends Biotechnol 25, 307-316, 2007.
Johnson и др., In: Biotechnology and Pharmacy, Pezzuto и др. (ред.),
Chapman and Hall, NY, 1993.
Jones и др., J. Med. Chem., 39: 904-917, 1996.
Karin and Lin, Nat. Immunol, 3: 221-7, 2002.
Kau и др., Nat. Rev. Cancer, 4(2): 106-17, 2004.
Kawano и др., Cancer Res., 67: 11576-84, 2007.
Keyt и др., Proc Natl Acad Sci USA91, 3670-3674,1994.
Kietselaer и др., Netherlands Heart J, 10(7/8), стр. 313-317, (002).
Kinlough и др., J. Biol. Chem., 279(51): 53071-53077, 2004.
Kufe и др., Hybridoma, 3: 223-232, 1984.
Kurihara и др., Appl Radiat Isot, 66(9); стр. 1175-1182, 2008.
Lagow and Carson, J. Cell. Biochem., 86: 759-72, 2002.
Lahorte и др., Eur J Nuclear Medicine Mol Imaging, 31 (6), стр. 887-919, 2004.
Lee и др., Cancer Cell, 15(4): 283-293, 2009.
Leng и др., J. Biol. Chem., 282: 19321-19330, 2007.
Levitan и др., J. Biol. Chem., 280: 33374-33386, 2005.
Levy and Shoseyov, Biotechnol Advances 20,191-213, 2002.
Li и др., Cancer Biol. Ther., 2: 187-193, 2003b.
Li и др., J. Biol Chem., 276: 35239-35242, 2001.
Li и др., J. Biol. Chem., 276: 6061-6064, 2001.
Li и др., Mol. Cancer Res., 1: 765-775, 2003c.
Li и др., Mol Cell Biol, 18: 7216-7224, 1998.
Li и др., Oncogene, 22: 6107-6110, 2003a.
Ligtenberg и др., J. Biol. Chem., 267, 6171-6177, 1992.
Lin и др., Amino Acids, опубликовано онлайн 17 марта 2010 года.
Loose и др., Eur J Nucl Med Mol Imaging, 2007.
Macao, Nat. Struct. Mol. Biol., 13, 71-76, 2006.
McPherson, J. Biol. Chem., 251: 6300-6306,1976.
Melder и др., Cancer Immunol Immunother 54, 535-5475, 2005.
Merlo и др., Cancer Res., 49, 6966-6971, 1989.
Merrifield, J. Am. Chem. Soc, 85: 2149-2154,1963.
Micheau and Tschopp, Cell, 114: 181-90, 2003.
Mimura и др., Mol Immunol 37, 697-706, 2000.
Muthuswamy, Nat. Cell Biol., 3(9): 785-92, 2001.
Naresh и др., Cancer, 91(3), p578-548, 2001.
Natoli и др., Nat. Immunol., 6: 439-45, 2005.
Navia и др., Curr. Opin. Struct. Biol, 2: 202-210, 1992.
Nelsestuen, Trends Cardiovasc Med, 9(6), стр. 162-167,1999.
Osborn и др., J Pharmacol Experimental Therapeutics 303, 540-548, 2002a.
Osborn и др., Eur J Pharmacol 456,149-158, 2002b.
Pasparakis и др., Cell Death Differ. 13: 861-72, 2006.
Заявка PCT/US 00/03745
Заявка PCT/US 00/14667
Заявка PCT/US 99/11913
Заявка PCT/US 99/18441
Peptide Synthesis, 1985
Percipalle и др., J. Mol. Biol, (4): 722-32,1997.
Percy и др., Cancer Res., 52(22): 6365-6370, 1992.
Petkova и др, International Immunol 18, 1759-1769, 2006a.
Protective Groups in Organic Chemistry, 1973
Protein NMR Spectroscopy, Principles and Practice, J. Cavanagh и др.,
Academic Press, San Diego, 1996.
Raina и др., Direct targeting of the Gla domain oncoprotein blocks survival and tumorigenicity of human breast carcinoma cells. Cancer Res., 2009 (в печати).
Raina и др., EMBO J., 25: 3774-3783, 2006.
Raina и др., J. Biol. Chem., 279: 20607-20612, 2004.
Raju и Scallon, Biotechnol Prog 23, 964-971, 2007.
Raju и Scallon, Biochem Biophys Res Commun 341, 797-803, 2006.
Ramasamy и др., Mol. Cell, 27: 992-1004, 2007.
Remington's Pharmaceutical Sciences, 15-e изд., 1035-1038 и 1570-1580, 1990.
Remington's Pharmaceutical Sciences, 15-e изд., 3: 624-652, 1990.
Ren и др., Cancer Cell, 5: 163-175, 2004.
Ren и др., J. Biol. Chem., 277: 17616-17622, 2002.
Reutelingsperger и др., J Immunol Methods 265, 123-132, 2002.
Ryan and Wente, Curr. Opin. Cell Biol, 12(3): 361-71, 2000.
Schneider-Brachert и др., Immunity, 21: 415-28, 2004.
Schroeder и др., J. Biol. Chem., 276(16): 13057-13064 2001.
Schroeder и др., Oncogene, 23: 5739-5747, 2004.
Shah и др., Proc. Natl. Acad. Sci. USA 95, стр. 4229-4234,1998.
Shuai, Oncogene, 19(21): 2638-44, 2000.
Siddiquee и др., Proc. Natl. Acad. Sci. USA, 104(18): 7391-6, 2007.
Siddiqui и др., Proc. Natl. Acad. Sci. USA, 85: 2320-2323,1988.
Sinclair and Elliott, J Pharmaceutical Sci 94,1626-1635, 2005.
Solid Phase Peptide Synthelia, 1984
Song и др., Proc. Natl. Acad. Sci. USA, 102(13): 4700-5, 2005.
Soule и др., Cancer Res., 50(18): 6075-6086,1990.
Suh and Gumbiner, Exp.Cell Res., 290(2): 447-56, 2003.
Sung и др., J Interferon Cytokine Res 23, 25-36, 2003.
Tait и Gibson. Arch Biochem Biophys. 298(1), стр. 187-191, 1992.
Truscott и др., J Cell Biol, 163(4): 707-713, 2003.
Umanawdp., Nat Biotechnol 17,176-180,1999.
Vaccaro и др., Nature Biotechnol 23,1283-1288, 2005.
van den Eijnde и др., J Cell Science, 114, стр. 3631-3642, 2001.
Vermeer и др., Nature, 422(6929): 322-6, 2003.
Veronese and Pasut, Drug Discovery Today 10,1451-1458, 2005.
Webb и др., J Immunol, 169 стр. 2580-2586, 2002.
Weber, Advances Protein Chem., 41: 1-36,1991.
Wegenka и др., Mol. Cell Biol., 14(5): 3186-96, 1994.
Wei и др., Cancer Cell, 7: 167-178, 2005.
Wei и др., Cancer Res., 67(4): 1853-8, 2007.
Wei и др., Mol. Cell, 21: 295-305, 2006.
Weis, Cell, 112(4): 441-51, 2003.
Wen и др., J. Biol. Chem., 278: 38029-38039, 2003.
Wider, BioTechniques, 29: 1278-1294, 2000.
Yamamoto и др., J. Biol. Chem., 272: 12492-12494, 1997.
Yeh и др., Proc. Nat'l Acad. Sci. USA 89,1904-1908,1992.
Yin и др., J. Biol. Chem., 278: 35458-35464, 2003.
Yin и др., J. Biol. Chem., 279: 45721-45727, 2004.
Yin и др., J. Biol. Chem., 282: 257-266, 2007.
Young и др., Cell. 112(l): 41-50, 2003.
Yu и др., Seminars Thrombosis Hemostasis, 30(1), стр. 21-30, 2004.
Yu and Jove, Nat. Rev. Cancer, 4(2): 97-105, 2004.
Zhang и др., Mol. Cell. Biol, 19: 7138-7146, 1999.
| название | год | авторы | номер документа |
|---|---|---|---|
| GLA ДОМЕНЫ В КАЧЕСТВЕ НАЦЕЛИВАЮЩИХ АГЕНТОВ | 2014 |
|
RU2731507C1 |
| GLA ДОМЕНЫ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2014 |
|
RU2705786C2 |
| ХИМЕРНЫЕ МОЛЕКУЛЫ ФАКТОРА VII | 2010 |
|
RU2563231C2 |
| ДОСТАВКА ПОЛЕЗНОЙ НАГРУЗКИ К СТВОЛОВЫМ КЛЕТКАМ | 2018 |
|
RU2795155C1 |
| СПОСОБ АДРЕСНОГО ВОЗДЕЙСТВИЯ НА ЭКЗОСОМЫ | 2018 |
|
RU2781640C2 |
| ПОЛИПЕПТИДЫ НА ОСНОВЕ МОДИФИЦИРОВАННОГО ФАКТОРА VII И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2571931C2 |
| МОДИФИЦИРОВАННЫЕ ВИТАМИН К-ЗАВИСИМЫЕ ПОЛИПЕПТИДЫ | 2005 |
|
RU2396347C2 |
| РАЗРАБОТКА СТАБИЛЬНОГО ГЕТЕРОДИМЕРНОГО АНТИТЕЛА С МУТАЦИЯМИ В ДОМЕНЕ Fc | 2012 |
|
RU2675319C2 |
| КОМПОЗИЦИЯ АНТИТЕЛ К HER2 | 2005 |
|
RU2361880C2 |
| АНТИТЕЛА-АНТАГОНИСТЫ ПРОТИВ Notch3 И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СВЯЗАННЫХ С Notch3 ЗАБОЛЕВАНИЙ | 2007 |
|
RU2493167C2 |








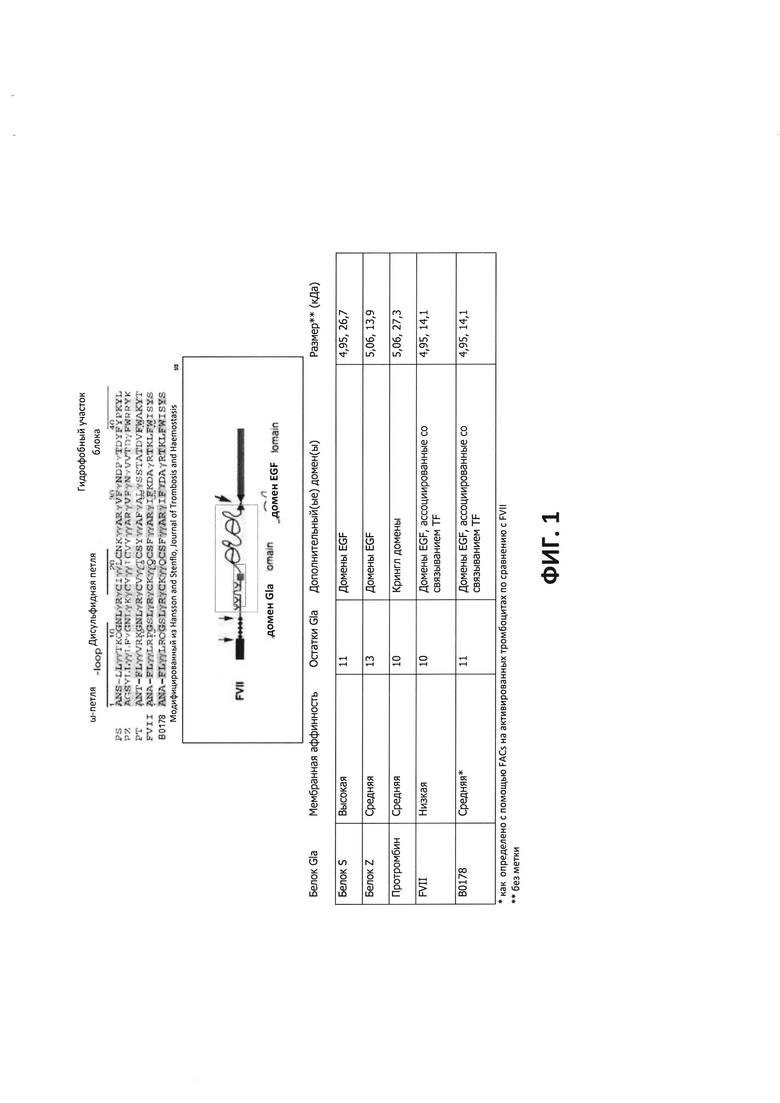

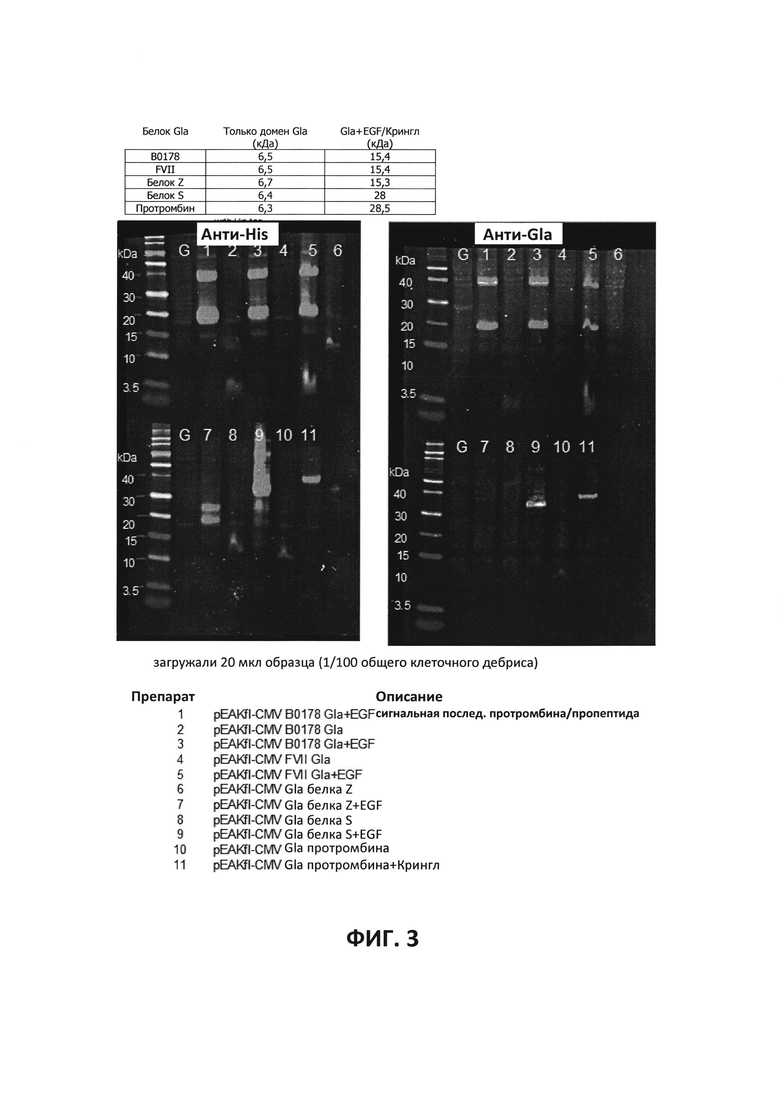
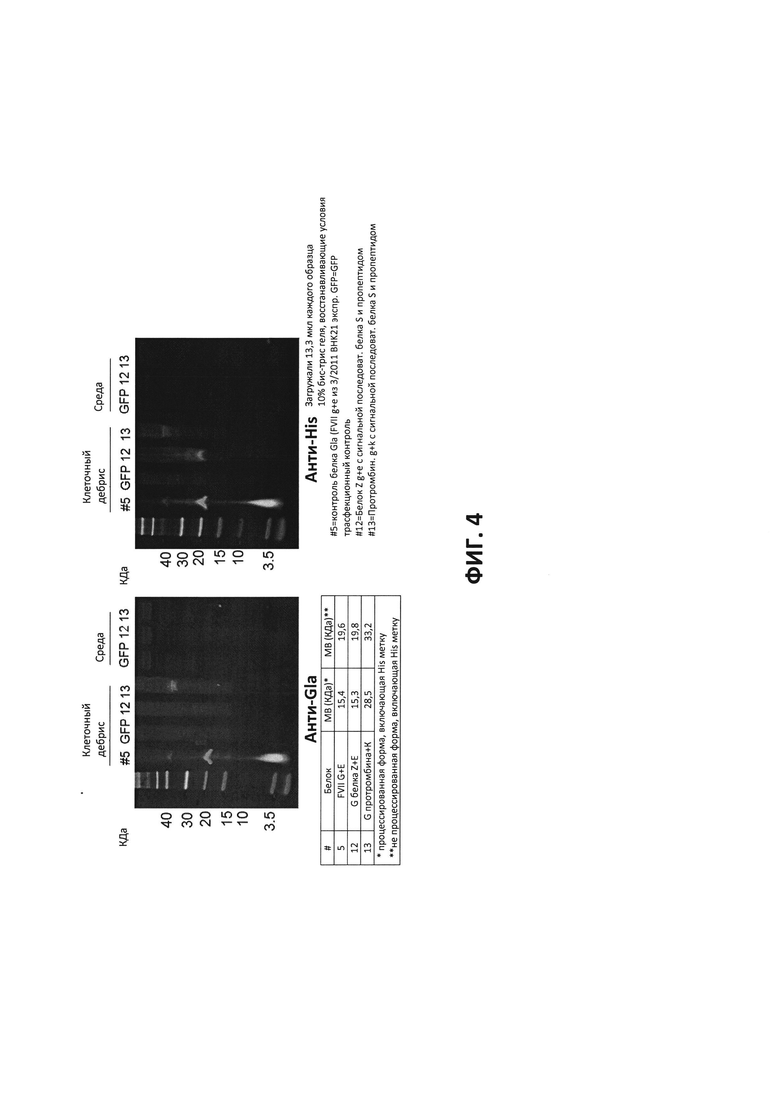

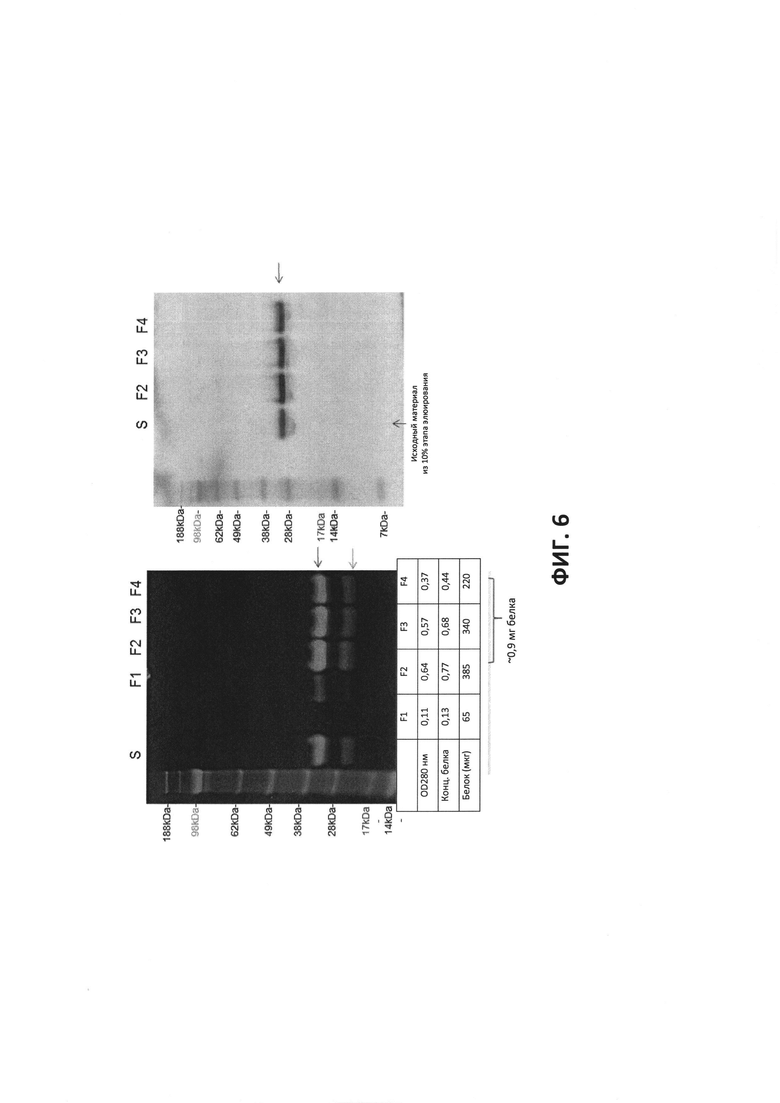
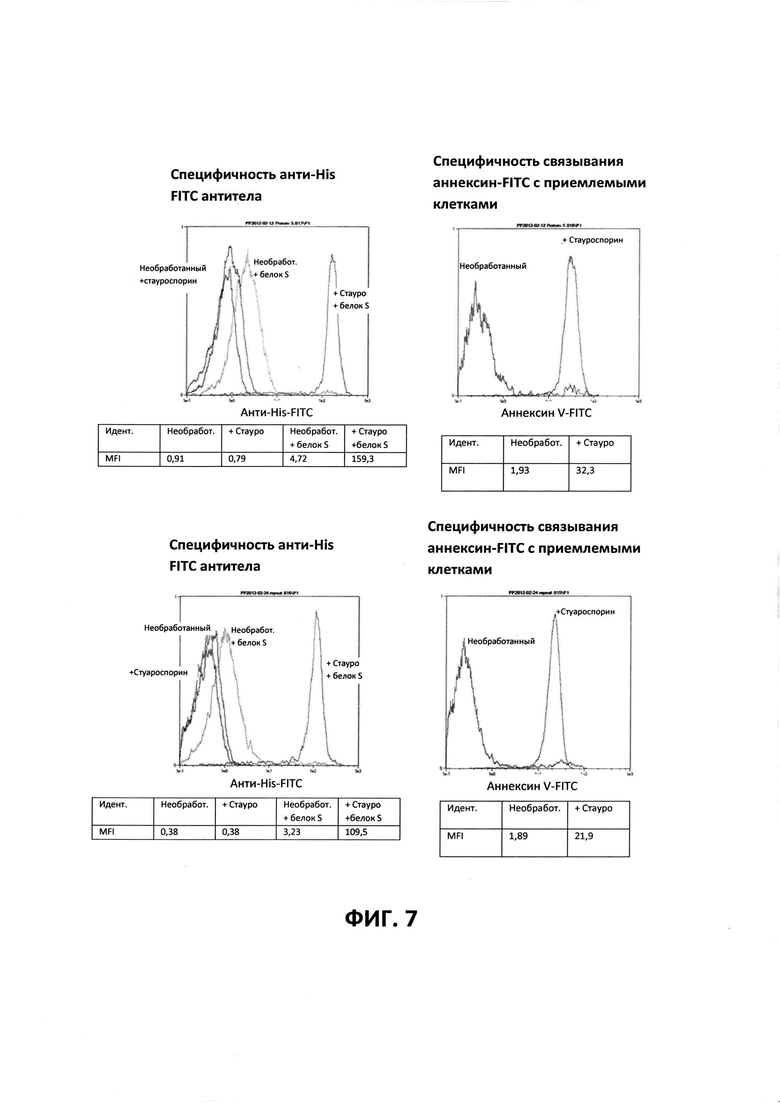
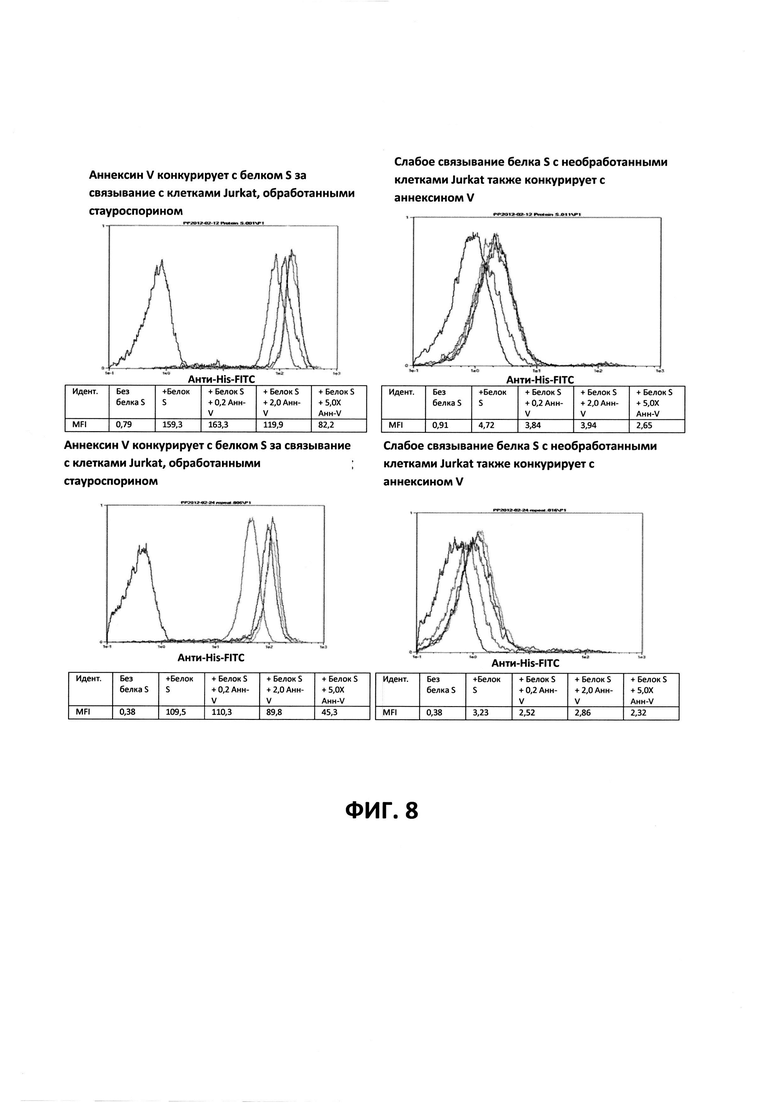
Изобретение относится к области биотехнологии, конкретно к рекомбинантным полипептидам для нацеливания на выделяющийся фосфатидилсерин. Описан полипептид для нацеливания на выделяющийся фосфатидилсерин, который включает: (a) домен гамма-карбоксиглутаминовой кислоты белка S, содержащий последовательность, представленную в SEQ ID NO: 1, или последовательность по меньшей мере на 95% гомологичную ей, и не содержащий домен протеазы или гормонсвязывающий домен; и (b) белок S домена EGF, где указанный полипептид конъюгирован с полезным грузом, выбранным из детектируемой метки, белковой последовательности, полиэтиленгликоля, целлюлозы, белка альбумина и терапевтического агента. Фармацевтические композиции для лечения рака и вирусных заболеваний. Изобретение позволяет диагностировать и лечить нарушения, связанные с повышением уровня экспрессии PtdS, что ассоциировано с апоптозом. Изобретение может быть использовано в медицине. 7 н. и 26 з.п. ф-лы, 8 ил., 1 пр.
1. Полипептид для нацеливания на выделяющийся фосфатидилсерин, который включает:
(a) домен гамма-карбоксиглутаминовой кислоты белка S, содержащий последовательность, представленную в SEQ ID NO: 1, или последовательность по меньшей мере на 95% гомологичную ей, и не содержащий домен протеазы или гормонсвязывающий домен; и
(b) EGF домен белка S,
где указанный полипептид связан с полезным грузом, выбранным из детектируемой метки, белковой последовательности, полиэтиленгликоля, целлюлозы, белка альбумина и терапевтического агента.
2. Полипептид по п. 1, где белковая последовательность выбрана из альбумина, гормона роста, трансферрина и Fc-фрагмента.
3. Полипептид по п. 1 или 2, где указанный полипептид содержит по меньшей мере одну дисульфидную связь.
4. Полипептид по любому из пп. 1-3, где указанный полипептид содержит 2-5 дисульфидных связей.
5. Полипептид по любому из пп. 1-4, где указанный полипептид представляет собой полипептид из 300 аминокислот или меньше.
6. Полипептид по любому из пп. 1-5, где указанный полипептид составляет примерно от 4,5 до 30 кДа в размере.
7. Полипептид по любому из пп. 1-6, где полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 6.
8. Полипептид по любому из пп. 1-7, где указанная детектируемая метка представляет собой флуоресцентную метку, хемилюминесцентную метку, радиоактивную метку, фермент, краситель или лиганд.
9. Полипептид по п. 8, где детектируемую метку выбирают из хрома (III), марганца (II), железа (III), железа (II), кобальта (II), никеля (II), меди (II), неодима (III), самария (III), иттербия (III), гадолиния (III), ванадия (II), тербия (III), диспрозия (III), гольмия (III) и/или эрбия (III).
10. Полипептид по п. 8, где детектируемую метку выбирают из лантана (III), золота (III), свинца (II) и, в особенности, висмута (III).
11. Полипептид по п. 8, где радиоактивную метку выбирают из 211астата, 14углерода, 51хрома, 36хлора, 57кобальта, 58кобальта, 67 меди, 152европия, 67 таллия, 3водорода, 123йода, 125йода, 131йода, 111индия, 59железа, 32фосфора, 186рения, 188рения, 75 селена, 35 серы, 99m технеция и/или 90иттрия.
12. Полипептид по п. 8, где детектируемую метку выбирают из Alexa 350, Alexa 430, АМСА, BODIPY 630/650, BODIPY 650/665, BODIPY-FL, BODIPY-R6G, BODIPY-TMR, BODIPY-TRX, Каскада голубого, Су3, Су5, 6-FAM, флуоресцеин изотиоцианата, HEX, 6-JOE, Oregon Green 488, Oregon Green 500, Oregon Green 514, Pacific Blue, REG, родамина зеленого, родамина красного, ренографина, ROX, TAMRA, ТЕТ, тетраметилродамина или Texas Red.
13. Полипептид по п. 8, где фермент выбирают из уреазы, щелочной фосфатазы, гидрогенпероксидазы хрена или глюкозооксидазы.
14. Полипептид по любому из пп. 1-13, где указанный терапевтический агент представляет собой противораковый агент.
15. Полипептид по п. 14, где указанный противораковый агент представляет собой химиотерапевтический, радиотерапевтический агент, цитокин, гормон, антитело, или фрагмент антитела, или токсин.
16. Полипептид по п. 15, где химиотерапевтический агент выбирают из группы, состоящей из темозоломида, эпотилонов, мелфалана, кармустина, бусульфана, ломустина, циклофосфамида, дакарбазина, полифепросана, ифосфамида, хлорамбуцила, мехлоретамина, -, циклофосфамида, карбоплатина, цисплатина, тиотепы, капецитабина, стрептозоцина, бикалутамида, флутамида, нилутамида, лейпролид ацетата, доксорубицина гидрохлорида, блеомицина сульфата, даунорубицина гидрохлорида, дактиномицина, липосомального даунорубицина цитрата, липосомального доксорубицина гидрохлорида, эпирубицина гидрохлорида, идарубицина гидрохлорида, митомицина, доксорубицина, валрубицина, анастрозола, торемифена цитрата, цитарабина, фторурацила, флударабина, флоксуридина, интерферона α-2b, пликамицина, меркаптопурина, метотрексата, интерферона α-2а, медроксипрогестерона ацетата, эстрамустина фосфата натрия, эстрадиола, лейпролида ацетата, мегестролацетата, октреотида ацетата, диэтилстилбестрола дифосфата, тестолактона, гозерелина ацетата, этопозид фосфата, винкристина сульфата, этопозида, винбластина,, тенипозида, трастузумаба, гемтузумаба озогамицина, ритуксимаба, эксеместана, иринотекана гидрохлорида, аспарагиназы, гемцитабина гидрохлорида, алтретамина, топотекана гидрохлорида, гидроксимочевины, кладрибина, митотана, прокарбазина гидрохлорида, винорелбина тартрата, пентростатина натрия, митоксантрона, пегаспаргазы, денилейкина дифтитокса, алтретиноина, порфимера, бексаротена, паклитаксела, доцетаксела, триоксида мышьяка и третиноина.
17. Полипептид по п. 15, где токсин выбран из группы, состоящей из экзотоксина Pseudomonas (РЕ38), цепи рицина А, дифтерийного токсина, антивирусного белка фитолакки американской (РАР), сапорина и гелонина.
18. Полипептид по п. 15, где радионуклид выбирают из Y-90, Р-32, I-131, In-111, Sr-89, Re-186, Sm-153 и Sn-117m.
19. Полипептид по любому из пп. 1-13, где указанный терапевтический агент представляет собой противовирусный агент.
20. Полипептид по п. 19, где противовирусный агент выбирают из группы, состоящей из абакавира, акикловира, ацикловира, адефовира, амантадина, ампренавира, амплигена, арбидола, атазанавира, атриплы, боцепревирертета, цидофовира, комбивира, дарунавира, делавирдина, диданозина, докозанола, эдоксудина, эфавиренца, эмтрицитабина, энфувиртида, энтекавира, ингибиторов проникновения, фамцикловира, фомивирсена, фосампренавира, фоскарнета, фосфонета, ганцикловира, ибацитабина, имуновира, идоксуридина, имиквимода, индинавира, инозина, ингибитора интегразы, интерферона типа III, интерферона типа II, интерферона типа I, интерферона, ламивудина, лопинавира, ловирида, маравирока, мороксидина, метисазона, нелфинавира, невирапина, нексавира, аналогов нуклеозидов, озелтамивира, пегинтерферона альфа-2а, пенцикловира, перамивира, плеконарила, подофиллотоксина, ингибитора протеазы, ралтегравира, ингибитора обратной транскриптазы, рибавирина, ремантадина, ритонавира, пирамидина, саквинавира, ставудина, синергетического усилителя (антиретровирусного), масла чайного дерева, телапревира, тенофовира, тенофовира дизопроксила, типранавира, трифлуридина, тризивира, тромантадина, трувады, валацикловира, валганцикловира, викривироца, видарабина, вирамидина, зальцитабина, занамивира или зидовудина.
21. Полипептид по любому из пп. 1-13, где терапевтический агент представляет собой фермент.
22. Полипептид по п. 21, где фермент представляет собой фермент, превращающий пролекарственное средство.
23. Полипептид по любому из пп. 1-13, где терапевтический агент представляет собой цитокин, фактор роста, фактор свертывания крови или антикоагулянт.
24. Фармацевтическая композиция для лечения рака, содержащая эффективное количество полипептида по любому из пп. 1-23 и фармацевтически приемлемый носитель.
25. Фармацевтическая композиция для лечения вирусных заболеваний, содержащая эффективное количество полипептида по любому из пп. 1-23, и фармацевтически приемлемый носитель.
26. Применение полипептида по любому из пп. 1-23 для лечения рака.
27. Применение по п. 26, где рак выбирают из группы, состоящей из рака молочной железы, рака мозга, рака желудка, рака легких, рака предстательной железы, рака яичников, тестикулярного рака, рака толстой кишки, рака кожи, рака прямой кишки, рака шейки матки, рака матки, рака печени, рака поджелудочной железы, рака головы и шеи или рака пищевода.
28. Применение полипептида по любому из пп. 1-23 для лечения вирусных заболеваний.
29. Применение полипептида по п. 28, где вирусное заболевание выбирают из группы, состоящей из вируса гриппа, вируса иммунодефицита человека, вируса лихорадки денге, вируса Западного Нила, вируса оспы, респираторно-синцитиального вируса, вируса корейской геморрагической лихорадки, авипоксивируса, вируса ветряной оспы, вируса простого герпеса 1 или 2, вируса Эпштейна-Барра, вируса марбургской болезни, хантавируса, вируса желтой лихорадки, вируса гепатита А, В, С или Е, вируса Эбола, вируса папилломы человека, риновируса, вируса Коксаки, вируса полиомиелита, вируса кори, вируса краснухи, вируса бешенства, вируса ньюкаслской болезни, ротавируса, HTLV-1 и -2.
30. Применение фармацевтической композиции по п. 24 для лечения рака.
31. Применение по п. 30, где рак выбирают из группы, состоящей из рака молочной железы, рака мозга, рака желудка, рака легких, рака предстательной железы, рака яичников, тестикулярного рака, рака толстой кишки, рака кожи, рака прямой кишки, рака шейки матки, рака матки, рака печени, рака поджелудочной железы, рака головы и шеи или рака пищевода.
32. Применение фармацевтической композиции по п. 25 для лечения вирусных заболеваний.
33. Применение по п. 32, где вирусное заболевание выбирают из группы, состоящей из вируса гриппа, вируса иммунодефицита человека, вируса лихорадки денге, вируса Западного Нила, вируса оспы, респираторно-синцитиального вируса, вируса корейской геморрагической лихорадки, авипоксивируса, вируса ветряной оспы, вируса простого герпеса 1 или 2, вируса Эпштейна-Барра, вируса марбургской болезни, хантавируса, вируса желтой лихорадки, вируса гепатита А, В, С или Е, вируса Эбола, вируса папилломы человека, риновируса, вируса Коксаки, вируса полиомиелита, вируса кори, вируса краснухи, вируса бешенства, вируса ньюкаслской болезни, ротавируса, HTLV-1 и -2.
| JACOBS M | |||
| et al., Membrane Binding Properties of the Factor IX y-Carboxyglutamic Acid-rich Domain Prepared by Chemical Synthesis, The J | |||
| of Biol | |||
| Chem., 1994, v.269, no.41, is.14, pp.25494-25500 | |||
| US 6312694 B1, 06.11.2001 | |||
| WO 2010151736 A1, 29.12.2010 | |||
| US 20090130060 A1, 21.05.2009 | |||
| WO 2005079766 A2, 01.09.2005 | |||
| ВАРИАНТЫ ДОМЕНА GLA ФАКТОРА VII ИЛИ VIIa | 2004 |
|
RU2373282C2 |
Авторы
Даты
2020-01-15—Публикация
2014-03-13—Подача