Область техники, к которой относится изобретение
Настоящее изобретение касается новых полипептидных вариантов домена Gla фактора VII (FVII) или фактора VIIa (FVIIa), а также применения таких полипептидных вариантов в терапии, в частности, для лечения различных заболеваний, связанных с нарушением свертываемости крови.
Уровень техники
Свертывание крови представляет собой процесс, включающий сложное взаимодействие многочисленных компонентов (или факторов) крови, которое обычно приводит к образованию фибринового сгустка. Обычно факторы крови, которые участвуют в так называемом “каскаде свертывания”, представляют собой предшественники ферментов или зимогены, то есть энзиматически неактивные белки, которые превращаются в активную форму под действием определенного активатора. Одним из таких факторов свертывания крови является фактор FVII.
Фактор FVII является витамин К-зависимым белком плазмы крови, который синтезируется в печени и секретируется в кровь в виде одноцепочечного гликопротеина с молекулярной массой 53 кДа (Broze & Majerus, J. Biol Сhem. 1980; 255:1242-1247). Зимоген FVII превращается в активную форму (FVIIa) в результате протеолитического расщепления в единственном участке, R152-1153, что приводит к образованию двух полипептидных цепей, связанных между собой одним дисульфидным мостиком. Фактор FVIIa в комплексе с тканевым фактором (комплекс FVIIa) способен переводить два других фактора свертываемости крови, фактор IX (FIX) и фактор Х (FX), в их активные формы, что запускает реакции, приводящие к быстрому образованию тромбина и формированию фибринового сгустка (Osterud & Rapaport, Proc Natl Acad Sci USA 1977; 74:5260-5264).
Фактор FVII подвергается пост-трансляционным модификациям, включая витамин К-зависимое карбоксилирование, приводящее к образованию десяти остатков γ-карбоксиглутаминовой кислоты на N-концевом участке молекулы. Таким образом, остатки под номерами 6, 7, 14, 16, 19, 20, 25, 26, 29 и 35, показанные в SEQ ID NO:1, являются остатками γ-карбоксиглутаминовой кислоты в домене Gla, который важен для активности FVII. Другие пост-трансляционные модификации включают присоединение сахарного компонента к двум имеющимся природным участкам N-гликозилирования в положениях 145 и 322 соответственно и к двум природным участкам 0-гликозилирования в положениях 52 и 60 соответственно.
Установлено, что ген, кодирующий фактор FVII человека (hFVn), расположен в 13 хромосоме в локусе q34-qter 9 (de Grouchy et al., Hum Genet 1984; 66:230-233). Он содержит девять экзонов и занимает область размером 12,8 т.п.н. (O'Наrа et al., Proc Natl Acad Sci USA 1987; 84:5158-5162). Организация гена и структура молекулы белка FVII подобны другим витамин К-зависимым прокоагулянтным белкам, у которых экзоны 1а и 1b кодируют сигнальную последовательность; экзон 2 кодирует пропептид и домен Gla; экзон 3 кодирует короткий гидрофобный участок; экзоны 4 и 5 кодируют домен, подобный эпидермальному фактору роста; и экзоны от 6 до 8 кодируют каталитический домен сериновой протеазы (Yoshitake et al., Biochemistry 1985; 24:3736-3750).
В литературе имеются сообщения о трехмерной структуре hFVIIa (Pike et al., Natl Acad Sci USA 1999; 96:8925-8930 и Kemball-Cook et al., J. Syruct. Biol., 1999; 127:213-223) и о структуре комплекса hFVIIa с растворимым тканевым фактором, полученные методами рентгеновской кристаллографии (Banner et al., Nature, 1996; 380:41 и Zhang et al., J. Mol. Biol. 1999; 285:2089), а также о структуре небольших фрагментов hFVII (Мuranyi et al., Biochemistry, 1998; 37:10605 и Као et al., Biochemistry, 1999; 38:7097).
Имеется также несколько сообщений о вариантах FVII, полученных методами белковой инженерии (Dickmson & Ruf, J Biol Chem, 1997; 272:19875-19879; Kemball-Cook et al., J Biol Chem 1998; 273:8516-8521; Bharadwa; et al., J Biol Chem, 1996; 271:30685-30691; Rufet al., Biochemistruy, 1999; 38:1957-1966).
Имеются сообщения об экспрессии FVII в клетках ВНК или в других клетках млекопитающих (WO 92/15686, WO 91/11514 и WO 88/10295) и совместной экспрессии FVII и эндопротеазы kex2 в клетках эукариот (WO 00/28065).
Коммерческие препараты рекомбинантного FVIIa человека (rhFVIIa) продаются под торговой маркой NovoSeven®. NovoSeven® предназначен для лечения кровотечений у пациентов с гемофилией типа А и В. NovoSeven® является единственным препаратом rhFVIIa для эффективного и надежного лечения кровотечений, который доступен на рынке в настоящее время.
О неактивной форме FVII, в которой модифицированы аргинин 152 и/или изолейцин 153 (1153), сообщалось в WO 91/11514. Эти аминокислоты расположены в участке активации. В WO 96/12800 описана инактивация FVIIa ингибитором сериновых протеаз. Об инактивации FVIIa посредством карбамилирования ос-аминокислотной группы 1153 сообщалось в работе Petersen et al., Eur J Biochem, 1999; 261:124-129. Инактивированная форма способна конкурировать с факторами дикого типа FVII или FVIIa за связывание тканевого фактора и способна ингибировать свертывающую активность. Предполагается использовать инактивированную форму FVIIa для лечения пациентов, страдающих от заболеваний, связанных с повышенной свертываемостью крови, например, пациентов с сепсисом, риском инфаркта миокарда или страдающих образованием тромбов.
В связи с лечением неконтролируемых кровотечений, например, при травмах, предполагается, что FVIIa способен превращать FX в активный FXa без связывания тканевого фактора, и, как предполагается, эта реакция активации происходит, в первую очередь, на поверхности активированных тромбоцитов (Hedner et al. Blod Coagulfion & Fibrinolysis, 2000; 11:107-111). Однако hFVIIa или rhFVIIa в отсутствие тканевого фактора имеют низкую активность в отношении FX и, следовательно, предотвращение неконтролируемых кровотечений, например, у пациентов с травмами, требует неоднократного использования относительно высоких доз hFVIIa или rhFVIIa. Таким образом, для более эффективного лечения неконтролируемых кровотечений (для снижения потери крови) необходимо иметь усовершенствованные (improved) молекулы FVIIa, которые обладают высокой активностью по отношению к FX в отсутствие тканевого фактора. Такие усовершенствованные молекулы FVIIa должны демонстрировать пониженное время свертывания (более быстрое действие/повышенную свертывающую активность) по сравнению с rhFVIIa при применении в случаях неконтролируемых кровотечений.
Варианты домена Gla фактора FVII/FVIIa были раскрыты в WO 99/20767, US 6017882 и WO 00/66753, где некоторые остатки, расположенные в домене Gla, как было установлено, являются важными для связывания с фосфолипидными мембранами и, следовательно, для активации FX. В частности, было установлено, что остатки 10 и 32 являются критически важными и что повышенное сродство для связывания с фосфолипидными мембранами и, следовательно, повышенная активация FX может быть достигнута за счет мутаций P10Q [замена остатка пролина (Р) в положении 10 на остаток глутамина (Q)] и К32Е [замена остатка лизина (К) в положении 32 на остаток глутаминовой кислоты (Е)]. В частности, было установлено, что активация FX была усилена по сравнению с rhFVIIa при незначительных условиях для свертывания, таких как условия в присутствии низкого уровня тканевого фактора.
WO 01/58935 раскрывает новую стратегию получения молекул FVII или FVIIa, имеющих inter alia (ко всему прочему) увеличенное время полужизни за счет направленного гликозипирования или присоединения полиэтиленгликоля.
WO 03/093465 раскрывает варианты FVII или FVIIa, имеющие определенные модификации в домене Gla и имеющие один или более участков N-гликозилирования, введенные за пределами домена Gla.
WO 2004/029091 раскрывает варианты FVII или FVIIa, имеющие определенные модификации в участке связывания тканевого фактора.
В настоящем изобретении идентифицированы новые остатки в домене Gla, которые обеспечивают дальнейшее увеличение сродства при связывании фосфолипидных мембран и, следовательно, дальнейшее увеличение активации FX. Варианты FVII или FVIIa данного изобретения могут также демонстрировать пониженное сродство при связывании тканевого фактора.
Предметом настоящего изобретения является получение усовершенствованных молекул FVII или FVIIa (вариантов FVII или FVIIa), которые способны более эффективно активировать превращение FX в FXa, чем hFVIIa, rhFVIIa или [P10Q+K32E]rhFVIIa. В частности, предметом настоящего изобретения является получение усовершенствованных молекул FVII или FVIIa (вариантов FVII или FVIIa), которые способны более эффективно активировать превращение FX в FXa, чем hFVIIa, rhFVIIa или [P10Q+K32E]rhFVIIa в отсутствие тканевого фактора. Данные цели были поставлены при создании вариантов FVII или FVIIa, описываемых в данном изобретении.
Раскрытие изобретения
В своем первом аспекте настоящее изобретение касается полипептидного варианта фактора VII (FVII) или фактора Vila (FVIIa), имеющего аминокислотную последовательность, включающую 1-15 модификаций аминокислот по отношению к фактору VII человека (bFVII) или фактору Vila человека (hFVIIa) с аминокислотной последовательностью, показанной в SEQ ID NO:1, где в положение 34 посредством замены введен гидрофобный аминокислотный остаток.
В своем втором аспекте настоящее изобретение касается полипептидного варианта фактора VII (FVII) или фактора Vila (FVIIa), имеющего аминокислотную последовательность, включающую 1-15 модификаций аминокислот по отношению к фактору VII человека (hFVII) или фактору VIIa человека (hFVIIa) с аминокислотной последовательностью, показанной в SEQ ID NO:1, где аминокислотная последовательность включает замену аминокислоты в положении 36.
В своем третьем аспекте настоящее изобретение касается полипептидного варианта фактора VII (FVII) или фактора VIIa (FVIIa), имеющего аминокислотную последовательность, включающую 3-15 модификаций аминокислот по отношению к фактору VII человека (hFVII) или фактору VIIa человека (bFVIIa) с аминокислотной последовательностью, показанной в SEQ ID NO:1, где аминокислотная последовательность включает замены аминокислот в положениях 10 и 32 и, по меньшей мере, еще одну замену аминокислоты в положении, которое выбирают из группы, состоящей из положений 74, 77 и 116.
Следующие аспекты настоящего изобретения касаются нуклеотидной последовательности, кодирующей полипептидные варианты настоящего изобретения, экспрессионного вектора, включающего эту последовательность, и клетки-хозяина, включающей нуклеотидную последовательность или экспрессионный вектор.
Следующие аспекты настоящего изобретения касаются также фармацевтической композиции, включающей полипептидные варианты настоящего изобретения, использования полипептидных вариантов настоящего изобретения или фармацевтической композиции настоящего изобретения в качестве медикамента, а также способов лечения с использованием полипептидных вариантов или фармацевтических композиций настоящего изобретения.
Следующие аспекты настоящего изобретения станут понятными из приведенного ниже описания, а также из приведенной формулы изобретения.
Краткое описание фигур
На Фигуре 1 показана зависимость времени свертывания крови от концентрации для вариантов настоящего изобретения в условиях, описанных в “Анализе цельной крови”.
На Фигуре 2 показана максимальная скорость фактор-зависимого образования тромбина для вариантов настоящего изобретения в условиях, описанных в “Определении тромбограммы”.
На Фигуре 3 показана максимальная скорость фосфолипид-зависимого образования тромбина для вариантов настоящего изобретения в условиях, описанных в “Определении тромбограммы”.
Осуществление изобретения
Определения
В контексте настоящего описания и формулы изобретения применяются следующие определения.
Термин “FVII” или “полипептид FVII” обозначает молекулу FVII (facfor VII), представленную в форме одной полипептидной цепи. Примером полипептида FVII является FVII дикого типа человека. (hFVII), имеющий аминокислотную последовательность, показанную в SEQ ID NO:1. Необходимо, однако, понимать, что термин “полипептид FVII” также включает hFVII-подобные молекулы, такие как фрагменты или варианты в SEQ ID NO:1, в частности, варианты, в которых последовательность включает, по меньшей мере, одну или до 15, предпочтительно до 10 модификаций аминокислот по сравнению с SEQ ID NO:1.
Термин “FVIIa” или “полипептид FVIIa” обозначает молекулу FVII в ее активированном (FVII activate) двухцепочечном состоянии. В тех случаях, когда для описания аминокислотной последовательности FVIIa используется аминокислотная последовательность, представленная в SEQ ID NO:1, необходимо понимать, что пептидная связь между R152 и I153 одноцепочечной формы была расщеплена, и одна образовавшаяся цепь включает аминокислотные остатки 1-152, а другая цепь включает остатки 153-406.
Термины “rFVII” и “rFVIIa” обозначают полипептиды FVII и FVIIa, полученные с использованием техники получения рекомбинантных белков (recombinant FVII/FVIIa).
Термины “hFVII” и “hFVIIa” обозначают FVII и FVIIa дикого типа человека (Аммдм FVII/FVIIa), соответственно, с аминокислотной последовательностью, показанной в SEQ ID NO:1.
Термины “rhFVII” и “rhFVIIa” обозначают FVII и FVIIa дикого типа человека, имеющие аминокислотную последовательность, показанную в SEQ ID NO:1, полученные с помощью рекомбинантной техники. Примером rhFVIIa является NovoSeven®.
Термин “домен Gla” используется для обозначения аминокислотных остатков, занимающих область от 1 до 45 в SEQ ID NO:1.
Соответственно, термин “положение, находящееся за пределами домена Gla”, охватывает аминокислотные остатки в положениях 46-406 в SEQ ID NO:1.
Аббревиатуры “FX”, “TF” и “TFP%” обозначают фактор X, тканевой фактор (tissue factor) и ингибитор пути с участием тканевого фактора (tissue factor parhway inhibitor) соответственно.
Термин “протеазный домен” обозначает аминокислотные остатки в области 153-406, считая от N-конца.
Термин “каталитический центр” (catalytic site, каталитический участок) используется для обозначения обеспечивающей каталитическую активность триады аминокислот, состоящей из S344, D242 и HI 93 полипептидного варианта.
Термин “исходная(ый)” (рarent) используется для обозначения молекулы, которая будет модифицирована/усовершенствована согласно настоящему изобретению. Хотя исходный полипептид, который будет подвергнут модификации согласно настоящему изобретению, может быть любым полипептидом FVII или FVIIa и, следовательно, может иметь любое происхождение, например, может быть полипептидом не человека, а других млекопитающих, предпочтительно, чтобы исходный полипептид являлся hFVII или hFVIIa.
“Вариантом” является полипептид, который отличается одним или более аминокислотным остатком от исходного полипептида, обычно 1-15 аминокислотными остатками (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотными остатками), в случае отличия 1-10 аминокислотными остатками, например, 1-8, 1-6, 1-5 или 1-3 аминокислотными остатками. Как правило, исходный полипептид является hFVII или hFVIIа.
Термин “конъюгат” (или взаимозаменяемо “конъюгированный полипептид”) применяется для обозначения гетерогенной (в смысле составной или химерной) молекулы, образованной при ковалентном присоединении одного или более полипептидов к одному или более не-полипептидным компонентам, таких как молекулы полимеров, липофильные соединения, остатки сахаров иди агенты органического происхождения. Предпочтительно, чтобы конъюгат был растворимым при используемых концентрациях и условиях, то есть был растворимым в физиологических жидкостях, таких как кровь. Примеры конъюгированных полйпептидов настоящего изобретения включают гликозилированные и/или связанные с полиэтиленгликолем (ПЭГ) полипептиды.
Термин “ковалентное присоединение” или “ковалентно присоединенный” обозначает, что полипептидный вариант и не-полипептидный компонент либо ковалентно связаны непосредственно друг с другом, либо ковалентно связаны друг с другом не напрямую, а, по меньшей мере, через один промежуточный компонент, такой как мостик, вставка или бифункциональный связывающий агент.
Термин “не-полипептидный компонент” используется для обозначения молекулы, отличной от пептидного полимера, построенного из аминокислотных мономеров, связанных друг с другом пептидными связями, молекула которого может быть связана с группой полипептидного варианта настоящего изобретения, способной к такому присоединению. Предпочтительные примеры таких молекул включают полимерные молекулы, остатки сахаров, липофильные компоненты или агенты органического происхождения. При использовании термина “конъюгированные варианты” в контексте настоящего изобретения необходимо понимать, что не-полипептидный компонент связан с полипептидной частью конъюгированного варианта через способную к присоединению группу полипептида. Как отмечалось выше, не-полипептидный компонент может быть ковалентно связан с группой для присоединения либо напрямую, либо через промежуточный компонент.
“Полимерная молекула” является молекулой, образованной за счет ковалентного соединения двух или более мономеров, из которых ни один мономер не является аминокислотным остатком, за исключением случаев, когда полимером является сывороточный альбумин человека или другой белок плазмы крови, присутствующий в ней в значительном количестве. Термин “полимер” может использоваться взаимозаменяемо с термином “полимерная молекула”. Данный термин также используется для обозначения молекул углеводов, присоединяемых in vitro в процессе гликозилирования, то есть при искусственном гликозилировании, обычно проводимом in vitro и заключающемся в ковалентном присоединении молекулы углевода к способной к присоединению группе полипептидного варианта, иногда с использованием бифункционального сшивающего агента.
Термин “сахарный компонент” используется для обозначения углевод-содержащей молекулы, включающей один или более моносахаридных остатков, которые могут быть присоединены к полипептидному варианту (для получения конъюгата полипептидного варианта в виде гликозилированного полипептидного варианта) посредством гликозилирования in vivo. Термин “гликозилирование in vivo” используется для обозначения присоединения любого сахарного компонента, происходящего in vivo, то есть в процессе посттрансляционного процессинга в обеспечивающих гликозилирование клетках, используемых для экспрессии полипептидного варианта, например, путем N-гликозилирования или O-гликозилирования. Точная структура присоединяемого олигосахарида в значительной степени зависит от организма, используемого для экспрессии и последующего гликозилирования.
“Участок N-гликозилирования” имеет последовательность N-X-S/T/C, где Х представляет собой любой аминокислотный остаток, кроме пролина, N является аспарагином, a S/T/C являются серином, треонином или цистеином, предпочтительно серином или треонином и наиболее предпочтительно треонином. Предпочтительно, чтобы аминокислотный остаток в положении +3 по отношению к аспарагину не являлся пролином.
“Участок O-гликозилирования” является ОН-группой серинового или треонинового остатка.
Термин “группа для присоединения” используется для обозначения функциональной группы полипептидного варианта, в частности группы аминокислотного остатка или углеводного компонента этого варианта, способной к присоединению не-полипептидного компонента, такого как молекула полимера, липофильная молекула, сахарный компонент или органический агент для получения производных. Подходящие группы для присоединения и соответствующие им не-полипептидные компоненты представлены в приведенной ниже таблице.
Углеводный компонент
Полимер, например, ПЭГ
Protein Modification, CRC Press Inc., Florida, USA
При N-гликозилировании in vivo термин “группа для присоединения” используется в нетрадиционном значении для обозначения аминокислотных остатков, входящих в состав участка N-гликозилирования (с последовательностью N-X-S/T/C, как говорилось выше). Хотя остаток аспарагина в участке N-гликозилирования является тем остатком, к которому в процессе гликозилирования присоединяется сахарный компонент, это присоединение не может происходить, если отсутствуют другие аминокислотные остатки, входящие в состав участка N-гликозилирования.
Таким образом, когда не-полипептидный компонент является сахарным компонентом и его конъюгация происходит при гликозилировании in vivo, термин “аминокислотные остатки, составляющие группу для присоединения не-полипептидного компонента”, используемый в связи с изменениями в аминокислотной последовательности, необходимо понимать, что один или несколько аминокислотных остатков, составляющих участок N-гликозилирования in vivo, были изменены таким образом, чтобы ввести в аминокислотную последовательность функциональный участок N-гликозилирования in vivo.
В настоящей заявке названия аминокислот и обозначения атомов (например, СА, СВ, CD, CG, SG, NZ, N, О, С и т.д.) используются в соответствии с принятыми в Protein DataBank (PDB) (www.pdb.org) на основе номенклатуры IUPAC (IUPAC Nomenclature and Symbolism for Ammo Acids and Peptides (residue names, atom names, etc.), Еyr. J. Biochem., 138:9-37 (1984), с учетом изменений, внесенных в Еyr. J. Biochem., 152, 1 (1985).
Термин “аминокислотный остаток” используется для обозначения любого природного или синтетического аминокислотного остатка, в первую очередь для обозначения аминокислотных остатков, входящих в группу из 20 аминокислот, обычно встречающихся в природных белках, то есть остаток выбирают из группы, состоящей из остатков аланина (А1а или А), пистеина (Cys или С), аспарагиновой кислоты (Asp или D), глутаминовой кислоты (Glu или Е), фенилаланина (Phe или F), глицина (Gly или G), гистидина (His или Н), изолейцина (Ilе или I), лизина (Lys или К), лейцина (Leu или L), метионина (Met или М), аспарагина (Asn или N), пролина (Pro или Р), глутамина (Gin или Q), аргинина (Arg или R), серина (Ser или S), треонина (Тhr или Т), валина (Val или V), триптофана (Тrр или W) и тирозина (Туг или Y).
Терминология, используемая для обозначения положения аминокислоты, заключается в следующем: G124 означает, что в положении 124 аминокислотной последовательности, показанной в SEQ ID NO:1, расположен остаток глицина. G124R означает, что остаток глицина в положении 124 был заменен на остаток аргинина. Альтернативные замены обозначаются с помощью значка “/”, например, N145S/T означает аминокислотную последовательность, в которой остаток аспарагина в положении 145 заменен либо на серин, либо на треонин. Множественные замены обозначаются значком “+”, например, K143N+N145S/T означает аминокислотную последовательность, которая включает замену остатка лизина в положении 143 на остаток аспарагина и замену остатка аспарагина в положении 145 на остаток серина или треонина. Вставка дополнительного остатка аминокислоты, например, вставка остатка аланина после G124 обозначается как G124GA. Вставка двух дополнительных остатков аланина обозначается как G124GAA и так далее. Использование выражений “вставка в положение X” или “вставленный в положение X” означает, что аминокислотный остаток (остатки) вставлен (вставлены) между аминокислотными остатками Х и Х+1. Деления аминокислотного остатка обозначается звездочкой. Например, деления остатка глицина в положении 124 обозначается как G124*.
Если не указано иначе, нумерация аминокислотных остатков, приводимая в настоящем изобретении, соответствует нумерации аминокислотной последовательности полипептида hFVII/hFVIIa (SEQ ID NO:1).
Термин “отличается от…”, используемый в связи со специфическими мутациями, предназначен для обозначения дополнительных отличий помимо специфических различий в аминокислотной последовательности. Например, помимо модификаций, внесенных в Gla домен для увеличения активации FX, полипептид может иметь другие модификации, которые не обязательно имеют отношение к этому эффекту.
Таким образом, кроме модификаций аминокислот, раскрываемых в настоящем изобретении, необходимо понимать, что аминокислотная последовательность полипептидного варианта настоящего изобретения, если это необходимо, может содержать и другие изменения, то есть другие замены, вставки или делепии. Например, такие изменения могут включать укорачивание N- и/или С-конца на один или более аминокислотный остаток (например, на 1-10 аминокислотных остатков) или присоединение одного или более добавочных аминокислотных остатков к N- и/или С-концу, например, добавление остатка метионина к N-концу или введение остатка пистеина вблизи С-конца, а также “консервативные аминокислотные замены”, то есть замены, проводимые внутри групп аминокислот с близкими характеристиками, например, внутри групп аминокислот с маленьким радикалом, кислых аминокислот, полярных аминокислот, основных аминокислот, гидрофобных аминокислот и ароматических аминокислот.
Примеры таких консервативных замен показаны в приведенной ниже таблице.
Другие примеры дополнительных модификаций раскрываются в разделах “Модификации за пределами домена Gla” и “Другие модификации за пределами домена Gla”.
Термин “нуклеотидная последовательность” используется для обозначения непрерывного участка, состоящего из двух или более молекул нуклеотидов. Нуклеотидная последовательность по происхождению может быть геномной, кДНК, РНК, полусинтетической, синтетической или любой их комбинацией.
Термин “вектор” обозначает плазмиду или другие нуклеотидные последовательности, способные к репликации внутри клетки-хозяина или способные интегрироваться в геном клетки-хозяина и которые, таким образом, подходят для выполнения различных функций в соответствующей клетке-хозяине (система вектор-хозяин) для облегчения клонирования нуклеотидной последовательности, то есть для получения необходимых количеств последовательности, обеспечивающих экспрессию продукта гена, кодируемого данной последовательностью, и для интегрирования нуклеотидной последовательности в геном клетки-хозяина. Вектор может содержать различные компоненты в зависимости от тех функций, которые необходимо обеспечить.
“Клетка”, “клетка-хозяин”, “линия клеток” и “культура клеток” используются в настоящем изобретении взаимозаменяемо, и, как следует понимать, данные термины включают потомство, получаемое при выращивании или культивировании клеток.
Термины “трансформация” и “трансфекция” используются взаимозаменяемо для обозначения процесса введения ДНК в клетку.
Термин “функционально связанный” обозначает ковалентное соединение двух или более нуклеотидных последовательностей с помощью ферментативного лигирования или другим способом для получения такой конфигурации последовательностей относительно друг друга, которая обеспечивает нормальное функционирование всех последовательностей. Обычно “функционально связанный” означает, что нуклеотидные последовательности связаны непрерывно и, в случае наличия обеспечивающего секрецию лидера, располагаются рядом в пределах одной рамки считывания. Связывание обеспечивается с помощью лигирования по подходящим сайтам рестрикции. Если такие сайты отсутствуют, используются синтетические олигонуклеотидные адаптеры или линкеры с применением стандартных методов работы с рекомбинантными ДНК.
В контексте настоящего изобретения термин “модификация” или “модификация аминокислоты” используется для обозначения замены боковой цепи аминокислоты, замены аминокислотного остатка, делении аминокислотного остатка или вставки аминокислотного остатка.
Термин “ввести” обозначает введение аминокислотного остатка, в частности посредством замены существующего аминокислотного остатка, или, как альтернатива, посредством вставки дополнительного аминокислотного остатка.
Термин “удалить” обозначает удаление аминокислотного остатка, в частности посредством замены аминокислотного остатка, который необходимо удалить, другим аминокислотным остатком, или, как альтернатива, посредством делении (без замены) аминокислотного остатка, который необходимо удалить.
В контексте настоящего изобретения термин “активность” должен пониматься как соответствующая активность, измеренная в условиях, в которых эта активность действительно измеряется.
В соответствии с этим термин “амидолитическая активность” (aminodolytic activity) используется для обозначения активности, измеряемой в приведенном здесь “Измерении амидолитической активности”. Для проявления “амидолитической активности” вариант настоящего изобретения в своей активированной форме должен иметь, по меньшей мере, 10% от амидолитической активности rhFVIIa при измерении в условиях, описанных в приведенном здесь “Измерении амидолитической активности”. В предпочтительных воплощениях настоящего изобретения вариант, в своей активированной форме, имеет, по меньшей мере, 20% от амидолитической активности rhFVIIa, например, по меньшей мере 30% или, по меньшей мере, 40%, более предпочтительно, по меньшей мере, 50%, например 60%, или, по меньшей мере, 70%, даже более предпочтительно, по меньшей мере, 80%, например, по меньшей мере, 90% от амидолитической активности rhFVIIa при измерении в условиях, описанных в приведенном здесь “Измерении амидолитической активности”. В наиболее интересных воплощениях вариант, в своей активированной форме, имеет практически одинаковую с rhFVIIa амидолитическую активность, например, амидолитическую активность на уровне 75-125% от амидолитической активности rhFVIIa.
Термин “свертывающая активность” обозначает активность, измеряемую в описанном здесь “Анализе цельной крови”, то есть означает время, необходимое для образования сгустка. Таким образом, меньшее время свертывания соответствует более высокой свертывающей активности.
Термин “повышенная свертывающая активность” используется в том случае, когда время свертывания для полипептидного варианта статистически достоверно ниже по сравнению с таковым, полученным при использовании rhFVIIa или [P10Q+K32E]rhFVIIa, при его измерении в сравнимых условиях в соответствии с описанным здесь “Анализом цельной крови”
В контексте настоящего изобретения термин “активность” также используется в отношении способности вариантов активировать превращение FX в FXa. Эта активность также обозначается как “способность активировать FX” или “FXa-образующая активность” и может быть измерена, как описано ниже в “Анализе TF-независимой активации фактора Х”.
Термин “повышенная способность активировать FX” или “повышенная FXa-образующая активность” используется для обозначения того, что вариант настоящего изобретения, в своей активированной форме, имеет статистически достоверно увеличенную способность превращать FX в FXa по сравнению с молекулой сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa. To, до какой степени вариант настоящего изобретения (в своей активированной форме) может увеличивать скорость перехода FX в активное состояние, можно легко измерить, как описано ниже в “Анализе TF-независимой активации фактора Х”.
Термин “иммуногенность” используется в отношении используемого вещества для обозначения способности этого вещества индуцировать ответ иммунной системы. Иммунный ответ может быть клеточным или ответом, опосредуемым антителами (смотри, например, Roitt: Essential Immunology (10th Edition, Blackwell) для более детального определения иммуногенности). Иммуногенность может быть определена с использованием любого подходящего метода, известного специалистам в данной области, например, in vivo или in vitro.
Термин “время функционального полураспада in vivo” используется в своем стандартном смысле, то есть обозначает время, в течение которого 50% биологической активности полипептида все еще присутствует в теле/органе-мишени, или время, в течение которого активность полипептида составляет 50% от ее исходного значения.
В качестве альтернативы измерению времени функционального полураспада in vivo можно измерять “время полураспада в сыворотке”, то есть время, в течение которого 50% полипептида циркулирует в плазме или кровотоке. Определение времени полураспада в сыворотке часто является более простым, чем определение времени функционального полураспада in vivo, и значение времени полураспада в сыворотке обычно является хорошим показателем времени функционального полураспада in vivo. Альтернативными термину “время полураспада в сыворотке” являются термины “время полураспада в плазме”, “время полувыведения при циркуляции”, “клиренс сыворотки”, “клиренс плазмы” или “время полувыведения”. Удаление полипептида из циркуляции обеспечивается в результате работы одной или более ретикулоэндотелиальных систем (RES), почек, селезенки или печени, за счет удаления тканевого фактора, опосредованного SEC рецептором или другими рецепторами, или за счет специфического или неспецифического протеолиза. Обычно клиренс зависит от размера (относительно порога проницаемости при клубочковой фильтрации, glomerular filtration), заряда, наличия присоединенных углеводных цепей, а также наличия клеточных рецепторов для данного белка. Функциональные качества, которые необходимо сохранить, обычно выбирают из прокоагулянтной активности, протеолитической или рецептор-связывающей активности. Время функционального полураспада in vivo и время полураспада в сыворотке можно определить с помощью любого подходящего метода, известного специалистам в данной области.
Термин “увеличенное” в отношении времени функционального полураспада in vivo или времени полураспада в сыворотке используется для обозначения того, что время полураспада варианта полипептида статистически достоверно выше такового для молекулы сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa, при определении в сравнимых условиях (обычно определяется на экспериментальных животных, таких как крысы, кролики, свиньи или обезьяны).
Термин “AUCiv” или “площадь под кривой при внутривенном введении” (Area Under the Curve when administered intravenously) используется в своем стандартном значении, то есть для обозначения площади под кривой временной зависимости активности в сыворотке крови, когда полипептидный вариант вводится внутривенно, в частности, при внутривенном введении крысам. Обычно измеряемая активность является “свертывающей активностью” в соответствии с данным выше определением. После измерения активности в эксперименте в определенных временных точках параметр AUCiv можно легко рассчитать с помощью компьютерной программы, такой как GraphPad Prism 3.01.
Необходимо понимать, что для прямого сравнения значений AUCiv различных молекул (например, для вариантов настоящего изобретения и молекул сравнения, таких как rhFVIIa или [P10Q+K32E]rhFVIIa) необходимо вводить их в одинаковых по активности количествах. Следовательно, значения AUCiv обычно являются нормализованными (то есть скорректированными с учетом различий во вводимых дозах) выражаются как отношение AUCiv/применяемая доза.
Термин “пониженная чувствительность к протеолитической деградации” в первую очередь означает, что полипептидный вариант имеет пониженную чувствительность к протеолитической деградации по сравнению с hFVIIa, rhFVIIa или [P10Q+K32E]rhFVIIa при измерении в одинаковых условиях. Предпочтительно, чтобы протеолитическая деградация была снижена не менее чем на 10% (например, на 10-25% или на 10-50%), например, по меньшей мере, на 25% (например, на 25-50%, или на 25-75%, или на 25-100%), более предпочтительно не менее чем на 35%, например, на 50% (например, на 50-75% или на 50-100%) и даже более предпочтительно не менее чем 75% (например, на 75-100%) или даже, по меньшей мере, на 90%.
Термин “почечный клиренс” (renal clerans) используется в своем стандартном значении для обозначения любого клиренса, происходящего в почках, например, при клубочковой фильтрации, канальцевой секреции (tubular excretion) или деградации в клетках почечных канальцев. Почечный клиренс зависит от физических характеристик полипептида, включая размер (диаметр), гидродинамический объем, симметрию, форму/жесткость и заряд. Обычно молекулярная масса около 67кДа считается предельным значением для порога почечного клиренса. Почечный клиренс может быть измерен с помощью любого подходящего метода, например, методом, используемым для измерения in vivo. Обычно почечный клиренс определяется путем введения меченых полипептидов (например, радиоактивно или флуоресцентно меченых) пациенту и измерения активности используемой метки в моче, собираемой у пациента. Пониженный почечный клиренс определяется по отношению к полипептиду сравнения, например, rhFVIIa или [P10Q+K32E]rhFVIIa, при измерении в одинаковых условиях. Предпочтительно, чтобы почечный клиренс полипептидного варианта был снижен, по меньшей мере, на 50%, предпочтительно, по меньшей мере, на 75% и более предпочтительно, по меньшей мере, на 90% по сравнению с rhFVIIa или [P10Q+K32E]rhFVIIa.
Термины “участок связывания тканевого фактора”, “область активного центра” и “поверхности связывающей щели активного центра” определяются путем отсылки к Примеру 1.
Термин “гидрофобные аминокислотные остатки” включает следующие аминокислотные остатки: изолейцин (I), лейцин (L), метионин (М), валин (V), фенилаланин (Р), тирозин (Y) и триптофан (W).
Термин “отрицательно заряженные аминокислотные остатки” включает следующие аминокислотные остатки: аспарагиновая кислота (D) и глутаминовая кислота (Е).
Термин “положительно заряженные аминокислотные остатки” включает следующие аминокислотные остатки: лизин (К), аргинин (R) и гистидин (Н).
Варианты настоящего изобретения
Модификации, произведенные в Gla домене исходного полипептида, предпочтительно обеспечивают получение молекулы с повышенным сродством к связыванию фосфолипидной мембраны, с улучшенной способностью активировать FX в FXa и/или повышенной свертывающей активностью. Варианты настоящего изобретения могут также иметь пониженное сродство к связыванию тканевого фактора и пониженную активность после связывания тканевого фактора.
Не ограничиваясь какой-либо конкретной теорией, в настоящее время предполагается, что повышенное сродство к связыванию фосфолипидных мембран приводит к более высокой локальной концентрации активированных вариантов полипептида в непосредственной близости от других факторов свертывания, в частности, FX. Таким образом, скорость превращения FX в FXa будет выше просто за счет более высокого молярного соотношения активированного варианта FVII и FX. Повышенная скорость активации FX, в свою очередь, приведет к образованию большего количества активного тромбина, то есть к увеличению скорость полимеризации фибрина.
Вследствие этого предполагается, что медицинское применение полипептидного варианта согласно настоящему изобретению может обеспечить преимущества по сравнению с доступным в настоящее время соединением rhFVIIa (NovoSeven®), так как может использоваться в более низкой дозе, иметь повышенную эффективность и/или более быстрое действие.
Кроме того, предполагается, что варианты, не зависимые от тканевого фактора, то есть варианты, которые имеют пониженную активность в связанном с тканевым фактором виде по сравнению с фактором VIIa дикого типа человека, могут иметь определенные преимущества в безопасности применения, например пониженный риск нежелательного свертывания крови (например, тромбоза или тромбоэмболии), в частности, при применении для лечения острых неконтролируемых кровотечений, таких как травма.
Таким образом, в наиболее предпочтительном воплощении настоящего изобретения полипептидный вариант в своем активном состоянии при сравнении с молекулой сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa, имеет повышенную способность активировать FX, в частности, при измерении в отсутствие тканевого фактора, как описано в ниже в “Измерении активации фактора Х в отсутствие тканевого фактора”. Более конкретно, предпочтительно, чтобы соотношение между способностью полипептидного варианта в его активной форме активировать FX и способность молекулы сравнения активировать FX составляла, по меньшей мере, 1,25 при измерении в описанном здесь “Измерении активации фактора Х в отсутствие тканевого фактора”. Более предпочтительно, чтобы это соотношение составляло не менее 1,5, например, по меньшей мере, 1,75 или, по меньшей мере, 2 и еще более предпочтительно не менее 3, например, по меньшей мере, 4, и наиболее предпочтительно, по меньшей мере, 5.
Когда молекулой сравнения является rbFVIIa, соотношение способности полипептидного варианта в его активном состоянии активировать FX и способность rhFVIIa активировать FX предпочтительно составляет не менее 5, обычно, по меньшей мере, 10, при измерении в условиях, описанных в ниже в “Измерении активации фактора Х в отсутствие тканевого фактора”, например, по меньшей мере, около 15 или 20.
В другом наиболее предпочтительном воплощении настоящего изобретения варианты изобретения обладают повышенной свертывающей активностью (то есть уменьшенным временем свертывания) по сравнению с rhFVIIa или [P10Q+K32E]rhFVIIa.
В предпочтительном воплощении настоящего изобретения соотношение между временем до образования сгустка в присутствии варианта (tвариант) и временем до образования сгустка в присутствии rhFVIIa (twt) или [P10Q+K32E]rhFVIIa (tР10Q+K32E) составляет не более чем 0,9 при измерении в условиях, описанных в приведенном ниже “Анализе цельной крови”. Более предпочтительно, чтобы это соотношение было не более 0,75, например 0,7, или еще более предпочтительно, чтобы это соотношение было не более 0,6, и самое предпочтительное, чтобы это соотношение было не более 0,5.
Одно или более из названных выше свойств может быть достигнуто с помощью раскрываемых здесь модификаций.
Варианты настоящего изобретения, содержащие гидрофобный аминокислотный остаток в положении 34
Как отмечалось выше, настоящее изобретение в своем первом аспекте касается полипептидных вариантов FVII или FVIIa, имеющих аминокислотные последовательности, включающие 1-15 аминокислотных модификаций по отношению к hFVII или hFVIIa (SEQ ID NO:1), где в положение 34 путем замены введен гидрофобный аминокислотный остаток.
Гидрофобный аминокислотный остаток, вводимый в положение 34, может быть выбран из группы, включающей I, L, М, V, F, Y и W, предпочтительно I, L и V, в частности L.
В предпочтительном воплощении вариант также включает аминокислотную замену в положении 10, в частности P10Q, и/или аминокислотную замену в положении 32, в частности К32Е. В определенном предпочтительном воплощении настоящего изобретения вариант включает обе замены в положениях 10 и 32, такие как P10Q+K32E.
В соответствии с этим в одном из интересных воплощений настоящего изобретения вариант включает замены P10Q+K32E+A34L.
В определенном интересном воплощении настоящего изобретения вариант также включает вставку, по меньшей мере, одного (обычно одного) аминокислотного остатка в положение между 3 и 4 остатками. Предпочтительно, чтобы вставленный аминокислотный остаток являлся гидрофобным аминокислотным остатком. Наиболее предпочтительной вставкой является A3AY. В соответствии с этим в определенном интересном воплощении настоящего изобретения вариант включает модификации A3AY+P10Q+K32E+A34L.
В дополнение к любым указанным выше модификациям вариант может включать дополнительную замену в положении 33. Предпочтительно, чтобы в положение 33 путем замены был введен гидрофобный аминокислотный остаток, в частности D33F.
Домен Gla может также содержать модификации в других положениях, в частности в положениях 8, 11 и 28, такие как R28F или R28E. С другой стороны, необходимо понимать, что домен Gla не должен быть модифицирован до такой степени, чтобы его способность связываться с мембранами была нарушена. В соответствии с этим предпочтительно, чтобы не было сделано модификаций остатков, которые подвергаются γ-карбоксилированию, то есть предпочтительно, чтобы не было модификаций по остаткам 6, 7, 14, 16, 19, 20, 25, 26, 29 и 35. Аналогично этому, обычно не является предпочтительным, чтобы не-полипептидные компоненты, такие как остатки сахара и/или группы ПЭГ были введены в домен Gla. Соответственно, является предпочтительным, чтобы не было произведено модификаций, создающих в домене Gla участка N-гликозилирования in vivo.
Наконец, необходимо понимать, что обсуждаемые в данном разделе модификации в домене Gla могут выгодно сочетаться с одной или более модификациями в положениях, находящихся за пределами домена Gla (смотри ниже разделы под названием “Модификации за пределами домена Gla” и “Другие модификации за пределами домена Gla”).
Варианты настоящего изобретения, включающие аминокислотную замену в положении 36
Как отмечалось выше, в своем втором аспекте настоящее изобретение касается полипептидного варианта FVII или FVIIa, имеющего аминокислотную последовательность, включающую 1-15 аминокислотных модификаций по отношению к hFVII или hFVIIa (SEQ ID NO:1), где названная аминокислотная последовательность включает аминокислотную замену в положении 36.
Предпочтительно, чтобы вводимый путем замены в положение 36 аминокислотный остаток был отрицательно заряженным аминокислотным остатком, например R36E или R36D, в частности R36E.
В предпочтительном воплощении вариант также включает аминокислотную замену в положении 10, в частности P10Q, и/или аминокислотную замену в положении 32, в частности K32Е. В определенном предпочтительном воплощении настоящего изобретения вариант включает обе замены в положениях 10 и 32, такие как P10Q+K32E.
Вариант настоящего изобретения может также содержать замену в положении 38. Предпочтительно, чтобы вводимый путем замены в положение 38 аминокислотный остаток был отрицательно заряженным аминокислотным остатком, например K38Е или K38D, в частности K38Е.
В соответствии с этим интересным вариантом является вариант, который включает следующие замены: P10Q+K32E+R36E или P10Q+K32E+R36E+K38E.
В определенном интересном воплощении настоящего изобретения вариант также включает аминокислотную замену в положении 34 (то есть получаемый вариант включает замены следующих остатков: 10+32+34+36 или 10+32+34+36+38). Предпочтительно, чтобы вводимый путем замены в положение 34 аминокислотный остаток был отрицательно заряженным аминокислотным остатком, например А34Е или A34D.
Специфическими примерами предпочтительных вариантов являются такие варианты, которые включают следующие замены: P10Q+K32E+A34E+R36E или P10Q+K32E+A34D+R36E+K38E.
В интересном воплощении настоящего изобретения вариант также включает вставку, по меньшей мере, одного (обычно одного) аминокислотного остатка в положение между 3 и 4 остатками. Предпочтительно, чтобы вставленный аминокислотный остаток являлся гидрофобным аминокислотным остатком. Наиболее предпочтительной вставкой является A3AY.
В дополнение к любым указанным выше модификациям вариант может включать дополнительную замену в положении 33. Предпочтительно, чтобы в положение 33 путем замены был введен гидрофобный аминокислотный остаток, в частности D33F.
Домен Gla может также содержать модификации в других положениях, в частности в положениях 8, 11 и 28, такие как R28F или R28E. С другой стороны, необходимо понимать, что домен Gla не должен быть модифицирован до такой степени, чтобы его способность связываться с мембранами была нарушена. В соответствии с этим предпочтительно, чтобы не было сделано модификаций остатков, которые подвергаются γ-карбоксилированию, то есть предпочтительно, чтобы не было модификаций по остаткам 6, 7, 14, 16, 19, 20, 25, 26, 29 и 35. Аналогично этому, обычно не является предпочтительным, чтобы не-полипептидные компоненты, такие как остатки сахара и/или группы ПЭГ были введены в домен Gla. Соответственно, является предпочтительным, чтобы не было произведено модификаций, создающих в домене Gla участка N-гликозилирования in vivo.
Наконец, необходимо понимать, что обсуждаемые в данном разделе модификации в домене Gla могут выгодно сочетаться с одной или более модификациями в положениях, находящихся за пределами домена Gla (смотри ниже разделы под названием “Модификации за пределами домена Gla” и “Другие модификации за пределами домена Gla”).
Варианты настоящего изобретения, включающие аминокислотные замены в положениях 74, 77 или 116
Как отмечалось выше, в своем третьем аспекте настоящее изобретение касается полипептидного варианта FVII или FVIIa, имеющего аминокислотную последовательность, включающую 1-15 аминокислотных модификаций по отношению к hFVII или hFVIIa (SEQ ID NO:1), где названная аминокислотная последовательность включает аминокислотные замены в положении 10, 32 и, по меньшей мере, одну аминокислотную замену в положении, которое выбирают из группы, включающей положения 74, 77 и 116.
В предпочтительном воплощении аминокислотной заменой в положении 10 является P10Q и аминокислотной заменой в положении 32 является К32Е.
Также предпочтительно, чтобы замены в положениях 74, 77 или 116 были выбраны из группы, включающей of P74S, E77A и E116D.
В интересном воплощении настоящего изобретения вариант также включает аминокислотную замену в положении 34. Предпочтительно, чтобы вводимый путем замены в положение 34 аминокислотный остаток был отрицательно заряженным аминокислотным остатком, например А34Е или A34D, в частности А34Е.
В другом интересном воплощении настоящего изобретения вариант также включает вставку, по меньшей мере, одного (обычно одного) аминокислотного остатка в положение между 3 и 4 остатками. Предпочтительно, чтобы вставленный аминокислотный остаток являлся гидрофобным аминокислотным остатком. Наиболее предпочтительной вставкой является A3AY.
Таким образом, специфические примеры интересных вариантов включают варианты, содержащие следующие модификации: A3AY+P10Q+K32E+E116D, A3AY+P10Q+K.32E+E77A и P10Q+K32E+A34E-hP74S.
В дополнение к любым указанным выше модификациям вариант может включать дополнительную замену в положении 33. Предпочтительно, чтобы в положение 33 путем замены был введен гидрофобный аминокислотный остаток, в частности D33F.
Домен Gla может также содержать модификации в других положениях, в частности в положениях 8, 11 и 28, такие как R28F или R28E. Как говорилось выше, домен Gla не должен быть модифицирован до такой степени, чтобы его способность связываться с мембранами была нарушена, то есть предпочтительно, чтобы не было модификаций по остаткам 6, 7, 14, 16, 19, 20, 25, 26, 29 и 35, и предпочтительно, чтобы не было произведено модификаций, создающих в домене Gla участка N-гликозилирования in vivo.
Наконец, необходимо понимать, что обсуждаемые в данном разделе модификации в домене Gla могут выгодно сочетаться с одной или более модификациями в положениях, находящихся за пределами домена Gla (смотри ниже разделы под названием “Модификации за пределами домена Gla” и “Другие модификации за пределами домена Gla”).
Модификации за пределами домена Gla
Время полураспада при циркуляции rhFVIIa составляет 2,3 часа, как сообщается в "Summary Basis for Approval for NovoSeven®" (FDA reference number 96-0597). Для достижения и поддержания желаемого лечебного или профилактического эффекта необходимо часто принимать относительно высокие дозы данного соединения. Как следствие этого, возникают определенные трудности в подборе адекватной дозы и трудности, связанные с частым внутривенным введением, что накладывает определенные ограничения на образ жизни пациентов.
Молекула с большим временем полураспада и/или повышенной биодоступностью (например, с увеличенной “площадью под кривой” по сравнению с rhFVIIa при внутривенном введении) будет требовать более редкого применения. С учетом имеющейся потребности в частом введении и необходимости достижения оптимальных терапевтических уровней FVIIa с целью получения желаемого эффекта совершенно очевидна потребность в получении FVII- или FVIIa-подобных молекул о улучшенными свойствами.
В соответствии с этим дальнейшей целью настоящего изобретения является получение усовершенствованных молекул FVII или FVIIа (вариантов FVII или FVIIa) с улучшенной биодоступностью (такой как “площадь под кривой” по сравнению с молекулой сравнения, например rhFVIIa или [P10Q+K32E]rhFVIIa, при внутривенном введении), которые способны активировать фактор Х или фактор Ха (без связывания с тканевым фактором) более эффективно, чем молекула сравнения, например, rhFVIIa или [P10Q+K32E]rhFVIIa (то есть могут быть использованы при неконтролируемых кровотечениях, таких как травма, или при хронических состояниях, таких как гемофилия, более эффективно).
Таким образом, интересными вариантами настоящего изобретения являются такие варианты, которые, в своем активированном состоянии, при сравнении с молекулой сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa, обеспечивают увеличенную “площадь под кривой” при внутривенном введении (AUCiv). Это можно легко определить при внутривенном введении в опытах на крысах. Более конкретно, интересными вариантами настоящего изобретения являются такие варианты, для которых соотношение AUCiv названного варианта в его активированной форме и AUCiv молекулы сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa, составляет не менее 1,25, например, по меньшей мере, 1,5, то есть 1,75, более предпочтительно не менее 2, например, по меньшей мере 3, еще более предпочтительно не менее 4, например, по меньшей мере, 5, в частности при (внутривенном) введении в опытах на крысах.
Этот эффект обычно соответствует увеличенному времени функционального полураспада in vivo и/или увеличенному времени полураспада в сыворотке по сравнению с молекулой сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa. В соответствии с этим в другом интересном воплощении настоящего изобретения соотношение между временем функционального полураспада in vivo или временем полураспада в сыворотке варианта в его активной форме и временем функционального полураспада in vivo или временем полураспада в сыворотке молекулы сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa, составляет, по меньшей мере, 1,25. Более предпочтительно, чтобы соотношение между соответствующим временем полураспада варианта в его активированной форме и соответствующим временем полураспада молекулы сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa, составляло не менее 1,5, например, по меньшей мере, 1,75 или, по меньшей мере, 2, еще более предпочтительно не менее 3, например, по меньшей мере, 4 или, по меньшей мере, 5.
Одним из способов увеличения времени полураспада белка при циркуляции является снижение для него почечного клиренса. Это может быть достигнуто присоединением к белку химического компонента, например, полиэтиленгликоля (ПЭГ), который может обеспечить пониженный почечный клиренс белка.
Более того, присоединение химического компонента к белку или замена аминокислот, доступных для протеолиза, могут эффективно блокировать контакт с протеолитическим ферментом, что иначе приводит к протеолитической деградации данного белка.
Как отмечалось выше, связанная с протеолитической деградацией нестабильность является в настоящее время известной проблемой при лечении с использованием rhFVIIa. Таким образом, протеолитическая деградация является главной проблемой для получения препарата в растворенной форме в отличие от лиофилизированного продукта. Преимуществом получения стабильного препарата в растворенной форме является удобство обращения с ним для пациента и, в случае острой необходимости, более быстрое действие, что потенциально может сохранить жизнь. Попытки предотвратить протеолитическую деградацию с помощью направленного мутагенеза по основным участкам расщепления раскрыты в WO 88/10295.
WO 01/58935 раскрывает ряд подходящих модификаций, приводящих к увеличению AUCiv, времени функционального полураспада in vivo и/или времени полураспада в сыворотке. Варианты, раскрываемые в WO 01/58935 являются результатом новой общей стратегии, направленной на получение усовершенствованных молекул FVII или FVIIa, которые также могут быть использованы в качестве исходных полипептидов FVII или FVIIa в настоящем изобретении.
Более конкретно, путем удаления или введения аминокислотных остатков, включающих группы, по которым возможно присоединение, или не-полипептидные компоненты в исходный полипептид FVII или FVIIa можно специфически адаптировать полипептид таким образом, чтобы сделать его молекулу более доступной для конъюгации с выбранным не-полипептидным компонентом, оптимизировать присоединяемую часть (например, подобрать оптимальное расположение и количество не-полипептидных компонентов на поверхности полипептидного варианта FVII или FVIIa для обеспечения того, чтобы только необходимые для присоединения группы присутствовали в молекуле) и, таким образом, получить новую конъюгированную молекулу, обладающую амидолитической активностью и одним или более улучшенным свойством по сравнению с rhFVIIa.
В интересном воплощении настоящего изобретения изменен более чем один аминокислотный остаток, расположенный за пределами домена Gla, например, такие изменения включают удаление или введение аминокислотного остатка, включающего предназначенную для присоединения выбранного не-полипептидного компонента группу. Кроме удаления и/или введения аминокислотных остатков полипептидный вариант может включать другие замены, которые не имеют отношения к введению и/или удалению таких аминокислотных остатков, включающих группы для присоединения не-полипептидного компонента.
Полипептидный вариант также может быть соединен с ингибитором сериновых протеиназ для ингибирования каталитического центра полипептидного варианта. Альтернативно этому, один или более аминокислотных остатков, входящих в каталитический центр (S344, D242 и Н193), могут быть мутированы с целью получения в результате неактивного варианта. Примером такой мутации является S344A.
Аминокислотный остаток, включающий группу, предназначенную для присоединения не-полипептидного компонента, подбирается на основе природы выбранного не-полипептидного компонента и, в большинстве случаев, исходя из метода, с помощью которого будет производиться соединение полипептидного варианта с не-полипептидным компонентом. Например, когда не-полипептидным компонентом является полимерная молекула, такая как полиэтиленгликоль или производное полиалкиленоксида, аминокислотный остаток, включающий предназначенную для присоединения группу, выбирают из группы, состоящей из лизина, цистеина, аспарагиновой кислоты, глутаминовой кислоты, гистидина и тирозина, предпочтительно из лизина, цистеина, аспарагиновой кислоты и глутаминовой кислоты, более предпочтительно из лизина и цистеина, в частности цистеина.
Когда группа, предназначенная для присоединения не-полипептидного компонента должна быть введена или удалена из исходного полипептида, положение предназначенного для модификации аминокислотного остатка предпочтительно должно находиться на поверхности исходного полипептида FVII или FVIIa и более предпочтительно должно принадлежать аминокислотному остатку, боковая цепь которого, по меньшей мере, на 25% экспонирована на поверхности (как описано здесь в Примере 1), предпочтительно боковая цепь, по меньшей мере, на 50% должна быть экспонирована на поверхности (как описано здесь в Примере 1). Такие положения могут быть определены на основе анализа 3D-структуры молекул hFVII или hFVIIa, как описано в WO 01/58935.
Более того, положение, предназначенное для модификации, предпочтительно выбирается из той части молекулы FVII или FVIIa, которая расположена за пределами участка связывания тканевого фактора, и/или за пределами участка активного центра, и/или за пределами поверхности связывающей щели активного центра. Эти участки/области определены здесь в Примере 1 и в WO 01/58935.
В случае удаления предназначенной для присоединения группы соответствующий аминокислотный остаток, содержащий такую группу и занимающий определенное выше подходящее положение, предпочтительно заменяется на другой аминокислотный остаток, который не имеет подходящей группы для присоединения обсуждаемого не-полипептидного компонента. Обычно предназначенным для удаления является аминокислотный остаток, присоединение к которому было бы нежелательным, например, аминокислотный остаток, расположенный в или вблизи функционального участка полипептида (следовательно, присоединение к такому участку может привести к инактивации или снижению активности полученного конъюгата в результате, например, нарушенного узнавания рецептора). В этом контексте термин “функциональный участок” используется для обозначения одного или более аминокислотного остатка, который является существенным или как-то другим образом вовлечен в функционирование или поведение FVII или FVIIa. Такие аминокислотные остатки являются частью функциональных участков. Функциональный участок может быть определен с помощью методов, известных специалистам в данной области, и предпочтительно определяться на основе анализа структуры комплекса FVIIa с тканевым фактором (смотри Banner et al., Nature 1996; 380:41-46).
В случае введения предназначенной для присоединения группы аминокислотный остаток, содержащий такую группу, вводится в подходящее положение, предпочтительно путем замены аминокислотного остатка, занимающего это положение.
Точное количество предназначенных для присоединения групп и подходящие положения в полипептидах FVII или FVIIa зависят от желаемого эффекта, который планируется достигнуть в результате присоединения. Эффект, который будет достигнут, зависит, например, от природы и степени конъюгации (например, идентичности не-полипептидных компонентов, желаемого числа не-полипептидных компонентов или возможности их присоединения к полипептидному варианту, мест, где конъюгация должна произойти или где ее необходимо избежать, и т.д.).
Общее количество аминокислотных остатков, которые будут модифицированы за пределами домена Gla исходного полипептида FVII или FVIIa (по сравнению с аминокислотной последовательностью, представленной в SEQ ID NO:1), обычно не превышает 10. Предпочтительно, чтобы вариант FVII или FVIIa включал аминокислотную последовательность, которая отличается на 1-10 аминокислотных остатков от аминокислотных остатков 46-406, показанных в SEQ ID NO:1, обычно на 1-8 или на 2-8 аминокислотных остатков, например на 1-5 или на 2-5 аминокислотных остатков, в частности на 1-4 или на 1-3 аминокислотных остатка, например на 1, 2 или 3 аминокислотных остатка от аминокислотных остатков 46-406, представленных в SEQ ID NO:1.
Аналогично этому, полипептидный вариант настоящего изобретения может содержать 1-10 (дополнительных) не-полипептидных компонентов, обычно 1-8 или 2-8 (дополнительных) не-полипептидных компонентов, предпочтительно 1-5 или 2-5 (дополнительных) не-полипептидных компонентов, например, 1-4 или 1-3 (дополнительных) не-полипептидных компонента, в частности 1, 2 или 3 (дополнительных) не-полипептидных компонента. Необходимо понимать, что такие дополнительные не-полипептидные компоненты ковалентно присоединены к предназначенным для присоединения группам, расположенным за пределами домена Gla.
Полипептидные варианты изобретения, где не-полипептидный компонент является остатком сахара
В предпочтительном воплощении настоящего изобретения группа, предназначенная для присоединения сахарного остатка, такая, как участок гликозилирования, в частности участок для гликозилирования in vivo, такая, как участок для N-гликозилирования in vivo, может быть введена и/или удалена, предпочтительно введена, в положение, расположенное за пределами домена Gla.
При использовании в данном контексте термин “существующий естественный участок глизолирования” включает участки гликозилирования в положениях N145, N322, S52 и S60. Термин “существующий естественный участок O-гликозилирования in vivo” включает положения S52 и S60, тогда как термин “существующий естественный участок N-гликозилирования in vivo” включает положения N145 и N322.
Таким образом, в очень интересном воплощении настоящего изобретения не-полипептидный компонент является остатком сахара и введенная группа, предназначенная для присоединения, является участком гликозилирования, предпочтительно участком гликозилирования in vivo, таким как участок O-гликозилирования in vivo или участок N-гликозилирования in vivo, в частности участок N-гликозилирования in vivo. Обычно может быть введено 1-10 участков гликозилирования, в частности участков N-гликозилирования in vivo, предпочтительно 1-8, 1-6, 1-4 или 1-3 участка гликозилирования, в частности участка N-гликозилирования in vivo может быть введено в одно или несколько позиций, расположенных за пределами домена Gla.
Например, 1,2 или 3 участка гликозилирования, в частности участка N-гликозилирования in vivo может быть введено за пределами домена Gla предпочтительно путем замены.
Необходимо понимать, что для получения полипептидного варианта, где полипептидный вариант включает один или более участков гликозилирования, полипептидный вариант должен быть экспрессирован в клетке-хозяине, способной присоединять сахарный (олигосахаридный) остаток в участке (участках) гликозилирования или вместо этого полипептидный вариант должен быть гликозилирован in vitro. Примеры обеспечивающих гликозилирование клеток-хозяев приведены ниже в разделе, называемом “Присоединение к сахарному остатку”.
Примеры положений, где могут быть введены участки гликозилирования, в частности участки N-гликозилирования in vivo, включают аминокислотные остатки, у которых, по меньшей мере, 25% их боковой цепи экспонировано на поверхности (которые определены здесь в Примере 1), как, например, такие, у которых, по меньшей мере, 50% боковой цепи экспонировано на поверхности. Положение предпочтительно выбирают в той части молекулы, которая расположена за пределами участка связывания тканевого фактора, и/или участка активного центра, и/или за пределами поверхности связывающей щели активного центра, как определено здесь в Примере 1. Должно быть понятно, что когда термин “по меньшей мере, 25% (или, по меньшей мере, 50%) боковой цепи аминокислоты экспонировано на поверхности” используют в связи с введением участка N-гликозилирования in vivo, этот термин касается доступности поверхности боковой цепи аминокислоты в положении, где фактически прикреплен сахарный компонент. Во многих случаях необходимо ввести остаток серина или треонина в положение +2 относительно остатка аспарагина, к которому действительно прикреплен сахарный компонент, и эти положения, где введены остатки серина или треонина, могут быть “утопленными” (скрытыми), то есть иметь экспонированными на поверхности менее чем 25% их боковых цепей.
Специфические и предпочтительные примеры таких замен, создающих участок N-гликозилирования in vivo, включают замену, которую выбирают из группы, состоящей из A51N, G58N, T106N, K109N, 0124N, K143N+N145T, А175Т, I205S, I205T, V253N, T267N, T267N+S269T, S314N+K316S, S314N+K316T, R315N+V317S, R315N+V317T, K316N+G318S, K316N+G318T, G318N, D334N и их комбинаций. Более предпочтительно участок N-гликозилирования in vivo вводят посредством замены, которую выбирают из группы, состоящей из A51N, G58N, T106N, K109N, G124N, K143N+N145T, А175Т, I205T, V253N, T267N+S269T, S314N+K316T, R315N+V317T, K316N+G318T, G318N, D334N и их комбинаций. Даже более предпочтительно участок N-гликозилирования in vivo вводят посредством замены, которую выбирают из группы, состоящей из T106N, А175Т, I205T, V253N, T267N+S269T и их комбинаций, в частности при введении одной, двух или трех из T106N, I205T и V253N.
В одном воплощении только один участок N-гликозилирования in vivo был введен посредством замены. В другом воплощении два или более (например, два) участка N-гликозилирования in vivo были введены посредством замены. Примеры предпочтительных замен, создающих два участка N-гликозилирования in vivo, включают замены, которые выбирают из группы, состоящей из A51N+G58N, A51N+T106N, A51N+K109N, A51N+G124N, A51N+K143N+N145T, A51N+A175T, A51N+I205T, A51N+V253N, A51N+T267N+S269T, A51N+S314N+K316T, A51N+R315N+V317T, A51N+K316N+G318T, A51N+G318N, A51N+D334N, G58N+T106N, G58N+K109N, 058N+0124N, G58N+K143N+N145T, G58N+A175T, 058N+I205T, G58N+V253N, 058N+T267N+S269T, G58N+S314N+K316T, G58N+R315N+V317T, G58N+K316N+G318T, G58N-K318N, G58N+D334N, T106N+K109N, T106N+G124N, T106N+K143N+N145T, T106N+A175T, T106N+I205T, T106N+V253N, T106N+T267N+S269T, T106N+S314N+K316T, T106N+R315N+V317T, T106N+K316N+G318T, T106N+G318N, T106N+D334N, K109N+G124N, K109N+K143N+N145T, K109N+A175T, K109N+I205T, K109N+V253N, K109N+T267N+S269T, K109N+S314N+K316T, K109N+R315N+V317T, K109N+K316N+G318T, K109N+G318N, K109N+D334N, G124N+K143N+N145T, G124N+A175T, G124N+I205T, G124N+V253N, G124N+T267N+S269T, G124N+S314N+K316T, G124N+R315N+V317T, G124N+K316N+G318T, G124N+G318N, G124N+D334N, K143N+N145T+A175T, K143N+N145T+I205T, K143N+N145T+V253N, K143N+N145T+T267N+S269T, K143N+N145T+S314N+K316T, K143N+N145T+R315N+V317T, K143N+N145T+K316N+G318T, K143N+N145T+G318N, K143N+N145T+D334N, A175T+I205T, A175T+V253N, A175T+T267N+S269T, A175T+S314N+K316T, A175T+R315N+V317T, A175T+K316N+G318T, A175T-H3318N, A175T+D334N, I205T+V253N, I205T+T267N+S269T, I205T+S314N+K316T, I205T+R315N+V317T, I205T+K316N+G318T, I205T+G318N, I205T+D334N, V253N+T267N+S269T, V253N+S314N+K316T, V253N+R315N+V317T, V253N+K316N+G318T, V253N+G318N, V253N+D334N, T267N+S269T+S314N+K316T, T267N+S269T+R315N+V317T, T267N+S269T+K316N+G318T, T267N+S269T+G318N, T267N+S269T+D334N, S314N+K316T+R315N+V317T, S314N+K316T+G318N, S314N+K316T+D334N, R315N+V317T+K316N+G318T, R315N+V317T+G318N, R315N+V317T+D334N и G318N+D334N. Более предпочтительно замены выбирают из группы, состоящей из T106N+A175T, T106N+I205T, T106N+V253N, T106N+T267N+S269T, A175T+I205T, A175T+V253N, A175T+T267N+S269T, I205T+V253N, I205T+T267N+S269T и V253N+T267N+S269T, даже более предпочтительно из группы, состоящей из T106N+I205T, T106N+V253N и I205T+V253N.
В следующем воплощении три или более (например, три) участка N-гликозилирования in vivo были введены посредством замены. Примеры предпочтительных замен, создающих три участка N-гликозилирования in vivo, включают замены, которые выбирают из группы, состоящей из I205T+V253N+T267N+S269T и T106N+I205T+V253N.
Как обсуждалось выше, является предпочтительным, когда участок N-гликозилирования in vivo вводят в положение, которое не образует часть участка связывания тканевого фактора, участка активного центра или поверхности связывающей щели активного центра, как определено в данном описании.
Необходимо понимать, что любые модификации, отмеченные в предыдущих секциях, могут быть скомбинированы друг с другом, в дополнение к существующим могут быть скомбинированы с описанными выше заменами в положении 34 и/или 36, в частности A34E/L и/или R36E, и предпочтительно в комбинации с описанными выше заменами в положении 10 и/или 32, в частности P10Q и/или К32Е. Среди установленных выше модификаций, необходимых для введения участка N-гликозилирования in vivo, предпочтительные модификации включают одну, две или три из T106N, I205T и V253N, в частности две из этих модификаций, то есть T106N+I205T, T106N+V253N или I205T+V253N.
Поэтому в одном предпочтительном воплощении изобретения FVII или FVIIa вариант включает модификации P10Q+K32E+A34E+R36E+T106N+I205T.
В следующем предпочтительном воплощении FVII или FVIIa вариант включает модификации P10Q+K32E+A34E+R36E+T106N+V253N.
В следующем предпочтительном воплощении FVII или FVIIa вариант включает модификации P10Q+K32E+A34E+R36E+I205T+V253N.
В следующем предпочтительном воплощении FVTI или FVIIa вариант включает модификации P10Q+K32E+A34L+T106N+I205T.
В следующем предпочтительном воплощении FVII или FVIIa вариант включает модификации P10Q+K32E+A34L+T106N+V253N.
В следующем предпочтительном воплощении FVII или FVIIa вариант включает модификации P10Q+K32E+A34L+I205T+V253N.
В следующем предпочтительном воплощении FVII или FVIIa вариант включает модификации P10Q+K32E+A34L+R36E+T106N+I2Q5T.
В следующем предпочтительном воплощении FVII или FVIIa вариант включает модификации P10Q+K32E+A34L+R36E+T106N+V253N.
В следующем предпочтительном воплощении FVII или FVIIa вариант включает модификации P10Q+K32E+A34L+R36E+I205T+V253N.
Как также объяснялось выше, любая одна или большее число из этих модификаций может в дополнение комбинироваться со вставкой, по меньшей мере одного аминокислотного остатка, типично одного аминокислотного остатка, между положениями 3 и 4, где встроенный остаток является предпочтительно гидрофобным аминокислотным остатком. Наиболее предпочтительно вставкой является A3AY. Поэтому в дополнительных предпочтительных воплощениях изобретения FVII или FVIIa вариант включает модификации, которые выбирают из:
A3AY+P10Q+K32E+A34E+R36E+T106N+I205T;
A3AY+P10Q+K32E+A34E+R36E+T106N+V253N;
A3AY+P10Q+K32E+A34E+R36E+I205T+V253N;
A3AY+P10Q+K32E+A34L+T106N+I205T;
A3AY+P10Q+K32E+A34L+T106N+V253N;
A3AY+P10Q+K32E+A34L+I205T+V253N;
A3AY+P10Q+K32E+A34L+R36E+T106N+I205T;
A3AY+P10Q+K32E+A34L+R36E+T106N+V253N;
A3AY+P10Q+K32E+A34L+R36E+I205T+V253N.
Другие модификации за пределами домена Gla
В следующем воплощении настоящего изобретения FVII или FVIIa вариант может, в дополнение к модификациям, описанным выше в предыдущих секциях, также содержать мутации, которые, как уже известно, приводят к увеличению активности, присущей полипептиду, например, те, которые описаны в WO 02/22776.
Например, вариант может содержать, по меньшей мере, одну модификацию в положении, которое выбирают из группы, состоящей из 157, 158, 296, 298, 305, 334, 336, 337 и 374. Примеры предпочтительных замен включают замены, которые выбирают из группы, состоящей из V158D, E296D, M298Q, L305V и К337А. Более предпочтительно названные замены выбраны из группы, состоящей из V158D+E296D+M298Q+L305V+K337A, V158D+E296D+M298Q+K337A, V158D+E296D+M298Q+L305V, V158D+E296D+M298Q, M298Q, L305V+K337A, L305V и К337А.
В следующем воплощении настоящего изобретения FVII или FVIIa вариант может, в дополнение к модификациям, описанным выше в предыдущих секциях, также содержать другие мутации, такие как замена K341Q, раскрытая в Neuenschwander et al, Biochemistry, 1995; 34, 8701-8707. Другие возможные дополнительные замены включают D196K, D196N, G237L, G237GAA и их комбинации.
Дополнительная детальная информация о присоединении к вариантам FVII и FVIIa не-полипептидных компонентов изложена в патентных заявках WO 01/58935 и WO 03/093465, на которые сделана ссылка и которые включены в данное описание путем отсылки.
Методы получения соединенного конъюгирования варианта изобретения
Вообще конъюгированный вариант, согласно изобретению, может быть получен посредством культивирования соответствующей клетки-хозяина в условиях, благоприятных для экспрессии варианта полипептида и восстановления варианта полипептида, где а) вариант полипептида содержит, по меньшей мере, один участок N-или О-гликозилирования и клетка-хозяин является эукариотической клеткой-хозяином, способной к гликозилированию in vivo, и/или b) присоединение к варианту полипептида не-полипептидного компонента осуществляется in vitro.
Присоединения к полимерной молекуле
Полимерной молекулой, предназначенной для соединения с полипептидным вариантом, может быть любая подходящая полимерная молекула, такая как природный, либо синтетический гомополимер, либо гетерополимер, молекулярный вес которого, как правило, находится в пределах около 300-100000 Да, например 500-20000 Да, более предпочтительно в пределах около 500-15000 Да или наиболее предпочтительно в пределах около 2-12 кДа, например в пределах около 3-10 кДа. В данном случае, когда термин “около” используется в отношении конкретного молекулярного веса, слово “около” обозначает приблизительный средний молекулярный вес и отражает тот факт, что при данном способе приготовления полимера будет наблюдаться определенное распределение по молекулярному весу.
Примеры гомополимеров включают полиспирт (т.н. poly-OH), полиамин (т.н. poly-NH2) и поликарбоксильную кислоту (т.н. poly-COOH). Гетерополимер - это полимер, включающий различные присоединенные группы, такие как гидроксильная группа и аминогруппа.
Примеры подходящих полимерных молекул включают в себя полимерные молекулы, которые выбирают из группы, состоящей из полиалкиленоксида (ПАО, РАО), включающей полиалкиленгликоль (ПАГ, PAG), такой как полиэтиленгликоль (ПЭГ, PEG) и полипропиленгликоль (ППГ, PPG), разветвленные полиэтиленгликоли, поливиниловый спирт (ЛВС, PVA), поликарбоксилат, поли-(винилпирролидон), ангидрид полиэтилен-комалеиновой кислоты, ангидрид полистирен-комалеиновой кислоты, декстран, включая карбоксиметил-декстран, либо любой иной биополимер, подходящий для снижения иммуногенности и/или увеличения времени функционального полураспада in vivo и/или времени полураспада в сыворотке. Другим примером полимерной молекулы является альбумин человека либо другой белок плазмы, присутствующий в значительном количестве. Как правило, полиалкиленгликоль-производные полимеры являются биосовместимыми, нетоксичными, неантигенными, неиммуногенными, водорастворимыми и легко выводятся живыми организмами.
ПЭГ является предпочтительной полимерной молекулой, так как он имеет всего несколько реакционно-способных групп, способных к образованию сшивок по сравнению, например, с полисахаридами, такими как декстран. В частности, монофункциональный ПЭГ, например метоксиполиэтиленгликоль (мПЭГ, mPEG), представляет определенный интерес, поскольку химия его связывания является относительно простой (всего одна реакционно-способная группа доступна для соединения с боковыми группами полипептида). Следовательно, поскольку риск образования дополнительных сшивок исключается, получающиеся в результате варианты соединений являются более гомогенными, и реакцию связывания полимерных молекул с полипептидным вариантом легче контролировать.
Для увеличения эффективности ковалентного присоединения полимерной молекулы (молекул) к полипептидному варианту концевые гидроксильные группы полимерной молекулы должны быть приведены в активированную форму, то есть в форму с реакционно-способными функциональными группами, примеры которых включают, прежде всего, аминогруппы, гидразид (HZ), тиол, сукцинат (SUC), сукцинимидилсукцинат (SS), сукцинимидилсукцинамид (SSA), сукцинимидилпропионат (SPA), сукцинимидилбутират (SBA), сукцинимидилкарбоксиметилат (SCM), бензотриазолкарбонат (ВТС), N-гидроксисукцинимид (NHS), альдегид, нитрофенилкарбонат (NPC) и трезилат (TRES). Подходящие активированные полимерные молекулы являются коммерчески доступными, например от Nektar Therapeutics, Huntsville, AL, USA, либо от PolyMASC Phannaceuticals pie, UK.
Специфические примеры активированных линейных либо разветвленных полимерных молекул для использования в настоящем изобретении раскрыты в Nektar Molecule Engineering Catalog 2003 (Nektar Therapeutics), включенном в данное описание путем отсылки.
Специфические примеры активированных ПЭГ полимеров включают в себя следующие линейные ПЭГи (PEGs): NHS-PEG (например, SPA-PEG, SSPA-PEG, SBA-PEG, SS-PEG, SSA-PEG, SC-PEG, SG-PEG, и SCM-PEG), и NOR-PEO, BTC-PEG, EPOX-PEG, NCO-PEG, NPC-PEG, CDI-PEG, ALD-PEG, TRES-PEG, VS-PEG, IODO-PEG, и MAL-PEG, и разветвленные ПЭГи, такие как PEG2-NHS, а также раскрытые в US 5932462 и US 5643575, которые оба включены в данное описание путем отсыпки. Дополнительные публикации, представляющие подходящие полимерные молекулы, химию присоединения ПЭГ и методы присоединения, перечислены в WO 01/58935 и WO 03/093465.
Специфические примеры активированных ПЭГ полимеров, в частности предпочтительных для соединения с остатками пистеина, включают в себя следующие линейные ПЭГи: винилсульфон-ПЭГ (VS-PEG), предпочтительно винилсульфон-мПЭГ (VS-mPEG); малеимид-ПЭГ (MAL-PEG), предпочтительно малеимид-мПЭГ (MAL-mPEG) и ортопиридилдисульфид-ПЭГ (OPSS-PEG), предпочтительно ортопиридилдисульфид-мПЭГ (OPSS-mPEG). Как правило, такие полимеры ПЭГ или мПЭГ будут иметь размер около 5 кДа, около 10 кДа, около 12 кДа или около 20 кДа,
Специалисту в данной области должно быть известно, что используемый в каждом случае метод активации и/или химия присоединения зависит от предназначенной для присоединения группы (групп) полипептидного варианта (примеры которых дополнительно приведены выше), также как и от функциональных групп полимера (например являющихся амином, гидроксилом, карбоксилом, альдегидом, сульфгидрилом, сукцинимидилом, малеимидом, винилсульфоном или галоацетатом). Присоединение ПЭГ может происходить по всем доступным боковым группам полипептидного варианта (то есть по таким боковым группам, которые экспонированы на поверхность полипептида) либо может быть направленным на одну или более специфическую боковую группу, например N-концевую аминогруппу, как описано в US 5985265 или остатки пистеина. Более того, присоединение может быть достигнуто в один шаг либо в пошаговой манере (например, как описано в WO 99/55377).
Для присоединения ПЭГ к остаткам пистеина (см. выше) вариант FVII или FVIIa, как правило, обрабатывается восстанавливающим агентом, таким как дитиотреитол (DDT), перед присоединением ПЭГ. Восстанавливающий агент впоследствии удаляется посредством любого традиционного метода, такого как, например, обессоливание. Присоединение ПЭГ к остатку пистеина, как правило, производится в подходящем буфере при рН 6-9 и температурах, варьирующих от 4°С до 25°С за время инкубации до 16 часов.
Необходимо понимать, что присоединение ПЭГ должно быть проведено определенным образом, чтобы обеспечить получение оптимальной молекулы в отношении числа присоединенных молекул ПЭГ, размера и формы таких молекул (например, чтобы они были линейными или разветвленными) и участка (участков) присоединения в полипептидном варианте. Молекулярный вес предполагаемого к использованию полимера может, например, быть выбран в зависимости от желаемого эффекта, который необходимо достичь.
В связи с присоединением только к единственной группе в молекуле белка (например, к N-концевой аминогруппе) благоприятным может явиться тот факт, что молекула полимера, которая может быть линейной или разветвленной, имеет большой молекулярный вес, предпочтительно около 10-25 кДа, такой как около 15-25 кДа, например, около 20 кДа.
Как правило, присоединение полимера осуществляется в таких условиях, когда как можно большее число групп, доступных для прикрепления полимера, стремится прореагировать с как можно большим числом молекул полимера. Это достигается посредством соответствующего молярного избытка полимера относительно полипептида. Как правило, молярные соотношения активированных молекул полимера к полипептиду достигают около 1000-1, таких как до 200-1 или до 100-1. В некоторых случаях соотношение может быть несколько ниже, однако достигать таких значений, как около 50-1,10-1, 5-1,2-1 или 1-1, для того чтобы достигнуть оптимальных условий реакции.
В соответствии с настоящим изобретением существует также возможность присоединять полимерные молекулы к полипептиду через промежуточный мостик. Подходящие мостики хорошо известны специалистам в данной области, см. также WO 01/58935.
После реакции присоединения оставшиеся активированные молекулы полимера блокируются с помощью методов, известных специалистам в данной области исследований, например, посредством добавления первичного амина в реакционную смесь, после чего инактивированные молекулы полимера удаляются с использованием подходящего метода.
Необходимо понимать, что в зависимости от обстоятельств, например, от аминокислотной последовательности полипептидного варианта, природы используемого активированного соединения ПЭГ и специфических условий присоединения ПЭГ, включая молярное соотношение ПЭГ и полипептида, могут быть достигнуты различные уровни присоединения ПЭГ; более высокие уровни присоединения ПЭГ, главным образом, достигаются при более высоком соотношении ПЭГ к полипептидному варианту. Полипептидные варианты с присоединенным ПЭГ, полученные в результате любого из вариантов присоединения ПЭГ, будут, однако, в обычных обстоятельствах включать в себя стохастическое распределение конъюгированных полипептидных вариантов, имеющих несколько различный уровень присоединения ПЭГ.
Присоединение к углеводному компоненту
Для того, чтобы провести гликозилирование in vivo молекулы FVII, содержащей в себе один или более участков гликозилирования, последовательность нуклеотидов, кодирующая полипептидный вариант, должна быть вставлена в способную к гликозилированию эукариотическую экспрессирующую клетку-хозяина. Экспрессирующая клетка-хозяин может быть выбрана из клеток грибов (нитчатые грибы либо дрожжи), клеток насекомых или животных либо из клеток трансгенных растений. В одном из воплощений клетка-хозяин является клеткой млекопитающего, такой как клетка СНО, клетка ВНК. или НЕК, например, НЕК 293, или клеткой насекомого, такой как клетка SF9, либо дрожжевой клеткой, например, Saccharomyces cerevisiae или Pichia pastoris, или любой из нижеупомянутых клеток-хозяев.
Ковалентное присоединение углеводов (таких как декстран) in vitro к аминокислотным остаткам полипептидного варианта также может быть использовано, например, как описано, в WO 87/05330 и в Aplin et al, CRC Crit Rev. Biochem, pp.259-306, 1981. Смотри также WO 03/093465 для получения дополнительной информации относительно in vitro гликозилирования вариантов FVII или FVIIa.
Присоединение ингибитора сериновых протеаз
Присоединение ингибитора сериновых протеаз может быть осуществлено в соответствии с методом, описанным в WO 96/12800.
Способы получения полипептидного варианта, являющегося предметом настоящего изобретения
Полипептидный вариант, являющийся предметом настоящего изобретения, необязательно в гликозилированной форме, может быть получен с использованием любого подходящего метода, известного специалистам в данной области исследований. Такие методы включают в себя создание нуклеотидной последовательности, кодирующей полипептидный вариант, и экспрессию данной последовательности в подходящем трансформированном либо трансфелированном хозяине. Предпочтительно, когда клетка-хозяин - это способная к γ-карбоксилированию клетка-хозяин, такая как клетка млекопитающего. Кроме того, варианты полипептидов, являющиеся предметом настоящего изобретения, могут быть также получены, хотя и с меньшей эффективностью, посредством химического синтеза либо комбинации химического синтеза и технологии рекомбинантных ДНК.
Последовательность нуклеотидов, кодирующая полипептид, являющийся предметом настоящего изобретения, может быть сконструирована путем выделения или синтеза нуклеотидной последовательности, кодирующей исходный FVII, такой как hFVn, последовательность аминокислот которого представлена как SEQ ID NO:1, и последующего изменения последовательности нуклеотидов с целью появления в ней (то есть вставки либо замены) или исчезновения (то есть делении или замены) важного аминокислотного остатка (остатков).
Нуклеотидная последовательность может быть легко модифицирована посредством сайт-направленного мутагенеза в соответствии с общепринятыми методами. В качестве альтернативы, нуклеотидная последовательность может быть получена путем химического синтеза, например, с использованием синтезатора олигонуклеотидов (oligonucleotide synthesizer), где олигонуклеотиды создаются исходя из последовательности аминокислот желаемого полипептида и выбираются предпочтительно такие кодоны, которые являются преимущественными не редкими для клетки-хозяина, в которой будет продуцироваться рекомбинантный полипептид. Например, несколько маленьких олигонуклеотидов, кодирующих участки желаемого полипептида, могут быть синтезированы и собраны посредством ПЦР (PCR, полимеразной цепной реакции), лигирования или лигазной цепной реакции (LCR, ligation chainreaction) (Barany, Proc Natl Acad Sci USA, 88:189-193, 1991). Индивидуальные олигонуклеотиды, как правило, имеют перекрывающиеся 5'- или 3'-области для комплементарной сборки.
Будучи однажды создана (посредством синтеза, сайт-направленного мутагенеза либо иного метода), нуклеотидная последовательность, кодирующая полипептид, вставляется в рекомбинантный вектор, где она должна быть функционально сопряжена с регуляторными последовательностями, необходимыми для экспрессии FVII в желаемых трансформированных клетках-хозяевах.
Специалисты в данной области исследований будут способны подобрать подходящие векторы, регуляторные последовательности для экспрессии и клетки-хозяева для экспрессии полипептида. Рекомбинантный вектор может быть автономно реплицирующимся вектором, то есть вектором, который присутствует в клетке как внехромосомный объект, репликация которого является независимой от репликации хромосом, например, плазмидой. В качестве альтернативы, вектор может быть одним из таких, которые при введении в клетку-хозяина интегрируют в геном клетки-хозяина и реплицируются вместе с хромосомами, в которые они интегрированы.
Предпочтительно вектор является экспрессионным вектором, в котором последовательность нуклеотидов, кодирующая полипептидный вариант, являющийся предметом настоящего изобретения, функционально сопряжена с дополнительными сегментами, необходимыми для транскрипции нуклеотидной последовательности. Как правило, вектор получают из плазмидной либо вирусной ДНК. Множество подходящих экспрессионных векторов для экспрессии в клетках-хозяевах, упомянутых здесь, являются коммерчески доступными либо описаны в литературе. Подробная информация о подходящих векторах для экспрессии FVII может быть найдена в WO 01/58935, включенной в данное описание путем отсылки.
Термин “регуляторная последовательность” в данном случае используется для обозначения всей совокупности компонентов, которые необходимы или обеспечивают преимущества при экспрессии полипептидного варианта, являющегося предметом настоящего изобретения. Каждая регуляторная последовательность может быть естественной или чужеродной по отношению к нуклеотидной последовательности, кодирующей полипептидный вариант. Такая регуляторная последовательность включает в себя, но не ограничивается этим, лидирующую последовательность, последовательность сигнала полиаденилирования, последовательность пропептида, промотор, энхансер или выше расположенную активаторную последовательность, последовательность сигнального пептида и терминатор транскрипции. В минимальном варианте регуляторная последовательность включает в себя промотор.
Большое разнообразие регуляторных последовательностей экспрессии может быть использовано в настоящем изобретении, например, любая из регуляторных последовательностей, раскрытых в WO 01/58935, включенной в данное описание путем отсылки.
Нуклеотидная последовательность, являющаяся предметом настоящего изобретения, кодирующая полипептидный вариант, полученная либо посредством сайт-направленного мутагенеза, синтеза, ПЦР либо других методов, может необязательно включать в себя последовательность нуклеотидов, которая кодирует сигнальный пептид. Сигнальный пептид присутствует в том случае, когда вариант полипептида должен секретироваться из клеток, в которых он экспрессируется. Такой сигнальный пептид, когда он имеется, должен узнаваться клеткой, выбранной для экспрессии варианта полипептида. Сигнальный пептид может быть гомологичным (то есть естественно ассоциированным с hFVII) либо гетерологичным (то есть происходящим из иного источника по отношению к hFVII) к полипептиду либо может быть гомологичным или гетерологичным по отношению к клетке-хозяину, то есть сигнальным пептидом, естественно экспрессирующимся в клетке-хозяине, либо одним из тех, которые в норме не экспрессируются в клетке-хозяине. Для получения дополнительной информации о подходящих сигнальных пептидах смотри WO 01/58935.
Каждый подходящий хозяин может быть использован для продуцирования полипептидного варианта, включая бактерии (хотя в данном случае это не предпочтительно), грибы (включая дрожжи), растения, насекомых, млекопитающих либо другие подходящие животные клетки или клеточные линии, например, трансгенные животные и растения. Предпочтительными являются клетки млекопитающих. Примеры бактериальных клеток-хозяев включают в себя грамположительные бактерии, такие как штаммы Bacillus, например, B. brevis или B.subtilis, Psedomonas или Streptomysces, либо грамотрицательные бактерии, такие как штаммы Е. соli. Примеры подходящих клеток-хозяев нитчатых грибов включают штаммы Aspergilus, например, А. oruzae, А. niger или А. nidulans, Fusarium или Тrichoderma. Примеры подходящих клеток-хозяев дрожжей включают в себя штаммы Szccharomyces, например, S. cerevisiae, Schizoccharomyces, Klyveromyces, Pichia, такие как P. pastoris или P. methanolica, Hansenula, такие как H. polymorpha или Yarrowia. Примеры подходящих клеток-хозяев насекомых включают в себя клеточные линии Lepidoptora, такие как Spodoptera frugiperda (Sf9 или Sf21) или клетки Trichoplusioa (High Five) (US 5077214). Примеры подходящих клеток-хозяев млекопитающих включают в себя линии клеток яичника китайского хомячка (СНО, Chinese hamster ovary) (например, СНО-К1; АТСС CCL-61), линии клеток зеленой мартышки (COS) (например, COS 1 (АТСС CRL-1650), COS 7 (АТСС CRL-1651); клетки мыши (например, NS/0), линии клеток почек новорожденного хомячка (ВНК, baby hsmster kidney) (например, АТСС CRL-1632 или АТСС CCL-10) и клетки человека (например, НЕК 293 (АТСС CRL-1573)). Дополнительные подходящие клеточные линии известны в данной области исследований и доступны в общественных депозитариях, таких как American Type Culture Collection, Rockville, Maryland. Кроме того, клетки млекопитающих, такие как клетки СНО, могут быть модифицированы таким образом, что будут экспрессироватъ сиалилтрансферазу, например, 1,6-сиалилтрансферазу, например, как это описано в US 5047335, с целью обеспечить повышенный уровень гликозилирования полипептидного варианта.
С целью увеличить секрецию в некоторых случаях полезно продуцировать вариант полипептида, являющийся предметом настоящего изобретения, вместе с эндопротеазой, в частности вместе с РАСЕ (paired basic amino asid converting enzyme) (например, как описано в US 5986079), такой как эндопротеаза Keх2 (например, как описано в WO 00/28065).
Методы интродукции экзогенной ДНК в упомянутые выше типы клеток, равно как и иная информация, касающаяся экспрессии, продуцирования и очистки вариантов FVII, найдена в WO 01/58935, включенной в данное описание путем отсылки.
Фармацевтическая композиция, являющаяся предметом настоящего изобретения, и ее использование
В своем следующем аспекте настоящее изобретение касается композиции, точнее, фармацевтической композиции, включающей в себя полипептидный вариант, являющийся предметом настоящего изобретения, и фармацевтически приемлемый носитель или наполнитель.
Полипептидный вариант или фармацевтическая композиция, в соответствии с настоящим изобретением, могут быть использованы в качестве медикамента.
Благодаря усовершенствованным свойствам, упоминавшимся выше, полипептидные варианты, являющиеся предметом настоящего изобретения, либо фармацевтическая композиция, являющаяся предметом настоящего изобретения, пригодны, в частности, для лечения неконтролируемых кровотечений у травмированных пациентов, больных тромбоцитопенией, больных, проходящих курс лечения антикоагулянтами и страдающих циррозом с варицеплярным кровотечением либо другими верхними желудочно-кишечными кровотечениями, пациентам, перенесшим ортотопическую трансплантацию печени либо резекцию печени, позволяющую не прибегать к пересадке (allowing for transfusion free surgery), либо больных гемофилией.
Под травмой понимается повреждение живой ткани, вызванное внешним агентом. Это четвертая лидирующая причина смертности в США, приводящая к значительной финансовой нагрузке на экономику.
Травмы подразделяются на тупые или проникающие. Тупая травма приводит к сдавливанию внутренностей, повреждению органов и внутреннему кровоизлиянию, в то время как проникающая рана (как результат действия предмета, проникающего в тело и разрушающего ткань, сосуды и органы) приводит к внешнему кровотечению.
Травма может быть вызвана множеством причин, например, дорожно-транспортными происшествиями, огнестрельными ранениями, падениями, несчастными случаями на производстве (механическими повреждениями) и колотыми ранами.
Цирроз печени может быть вызван прямым повреждением печени, включая хронический алкоголизм, хронические вирусные гепатиты (типа В, С, и D), и аутоиммунные гепатиты, равно как и непрямыми повреждениями в виде повреждения желчного протока, включая первичный билиарный цирроз, первичные склерозирующие холангиты и билиарную атрезию. Менее обычные причины цирроза включают в себя прямые повреждения печени вследствие наследственного заболевания, такого как муковисцидоз, недостаточность альфа-1-анпитрипсина, гемомеланоз, болезнь Вилсона (Wilson's disease), галактоземия и избыточное накопление гликогена в клетках - гликогеноз (например, болезнь Андерсена). Основным способом для лечении пациентов с поздними стадиями цирроза является трансплантация.
Таким образом, в своем следующем аспекте настоящее изобретение касается полипептидного варианта, являющегося предметом настоящего изобретения, с точки зрения производства медикамента для лечения болезней либо расстройств, при которых желательно формирование кровяного сгустка. Следующий аспект настоящего изобретения касается способа лечения млекопитающих, имеющих заболевание либо расстройство, при котором желательно формирование кровяного сгустка, включающего в себя введение в нуждающееся млекопитающее эффективного количества полипептидного варианта либо фармацевтической композиции, являющихся предметом настоящего изобретения.
Примеры заболеваний/расстройств, при которых желательно увеличение эффективности формирования кровяного сгустка, включают в себя, но ими не ограничиваются, кровоизлияния, включая кровоизлияния в мозг, также как и тяжелые неконтролируемые кровотечения у больных, например, при травмах. Дальнейшие примеры включают пациентов, перенесших жизненно необходимые трансплантации, пациентов, перенесших резекцию, и пациентов с варицеллярным кровотечением. Другим широко распространенным заболеванием/расстройством, при котором, как считается, цолипептиды, являющиеся предметом настоящего изобретения, будут полезны для увеличения эффективности формирования кровяного сгустка, является гемофилия, например болезнь фон Виллебрандта (vor Willebrand disease), гемофилия А, гемофилия В или гемофилия С.
Полипептидные варианты, являющиеся предметом настоящего изобретения, вводятся пациенту в терапевтически эффективной дозе, в норме, приблизительно соответствующей применяемой дозе при терапии с использованием rFVII, такого как NovoSeven®, либо в меньшем количестве. Под “терапевтически эффективной дозой” в данном случае понимается доза, достаточная для получения желаемого эффекта по сравнению с тем состоянием, когда эта доза была введена. Точная доза будет зависеть от обстоятельств и будет устанавливаться специалистом в данной области с использованием известных техник. Как правило, доза должна обеспечивать способность предотвращать или уменьшать тяжесть или распространение состояния или симптома, который подвергается лечению. Для специалистов в данной области будет видно, что эффективное количество полипептидного варианта или композиции, являющихся предметом настоящего изобретения, зависит, inter alia от заболевания, дозы, графика введения лекарства в тех случаях, когда полипептидный вариант или композиция вводятся индивидуально либо вместе с другими терапевтическими агентами, от времени полураспада композиции в плазме крови и от общего состояния здоровья пациента.
Полипептидный вариант, являющийся предметом настоящего изобретения, предпочтительно вводится в виде композиции, включающей в себя фармацевтически приемлемый носитель или наполнитель. “Фармацевтически приемлемый” означает носитель или наполнитель, который не вызывает никаких неблагоприятных эффектов у того пациента, которому он вводится. Такие фармацевтически приемлемые носители и наполнители, равно как и подходящие способы приготовления лекарств, хорошо известны специалистам в данной области (смотри, например, Remington's Pharmaceutical Sciences, 18-е издание, A.R.Gennaro, Ed., Mack Publishing Company [1990]; Pharmaceutical Formulation Development of Peptides and Proteins, S.Frokjaer and L.Hovgaard, Eds., Taylor & Francis [2000]; и Handbook of Pharmaceutical Excipients, 3-е издание, A.Kibbe, Ed., Pharmaceutical Press [2000]).
Полипептидный вариант, являющийся предметом настоящего изобретения, может быть использован “как есть” и/или в форме его солей. Подходящие соли включают в себя, но ими не ограничиваются, соли щелочных или щелочноземельных металлов, таких как натрий, калий, кальций и магний, равно как и, например, соли цинка. Эти соли или комплексы могут существовать как кристаллические и/или аморфные структуры.
Фармацевтическая композиция, являющаяся предметом настоящего изобретения, может вводиться индивидуально либо вместе с другими терапевтическими агентами. Эти агенты могут вводиться как часть той же фармацевтической композиции, либо могут вводиться отдельно от полипептидного варианта, являющегося предметом настоящего изобретения, как одновременно, так и в соответствии с другим графиком лечения. Кроме того, полипептидный вариант либо фармацевтическая композиция, являющиеся предметом настоящего изобретения, могут применяться как вспомогательное средство при других терапиях.
Понятие “пациент” в контексте настоящего изобретения включает как человека, так и других млекопитающих. Таким образом, способы применимы как для терапии человека, так и для нужд ветеринарии, в частности, для лечения человека.
Фармацевтическая композиция, содержащая полипептидный вариант, являющийся предметом настоящего изобретения, может быть изготовлена в виде разнообразных лекарственных форм, например, таких как жидкость, гель, как лиофильно высушенное или спрессованное твердое вещество. Предпочтительная форма будет зависеть от того, какой именно симптом будет лечиться, и она будет очевидна специалисту в данной области.
В частности, фармацевтическая композиция, содержащая полипептидный вариант, являющийся предметом настоящего изобретения, может быть изготовлена в лиофильно высушенной либо стабильной растворимой форме. Полипептидный вариант может быть лиофилизирован посредством множества процедур, известных в данной области. Полипептидный вариант может быть приготовлен в стабильной растворимой форме благодаря удалению либо экранированию участков протеолитической деградации, как описано в данной работе. Преимущество получения стабильного растворимого препарата заключается в легкости обращения с ним для пациента и, в случае критических ситуаций, более быстрого использования, которое, потенциально, может спасти жизнь. Предпочтительная форма будет зависеть от того, какой именно симптом будет лечиться, и она будет очевидна специалисту в данной области.
Введение препаратов, являющихся предметом настоящего изобретения, может быть осуществлено множеством способов, включающих, но ими не ограничивающимися, такими, как оральный, подкожный, внутривенный, интрацеребральный, интраназальный, трансдермальный, внутрибрюшинный, внутримышечный, внутрилегочный, вагинальный, ректальный, внутриглазной или любой другой подходящий способ. Препараты могут вводиться посредством непрерывного вливания (капельницы), хотя болюсное вливание также применимо, с использованием хорошо известных в данной области техник, таких как насосы или имплантации. В некоторых отдельных случаях препараты могут применяться прямо в виде раствора либо спрея.
Источники
Предпочтительный пример фармацевтической композиции - это раствор, в частности водный раствор, созданный для парентерального введения. Хотя во многих случаях приготовленные фармацевтические растворы предоставляются в жидком виде, подходящем для немедленного применения, такие парентеральные препараты могут также предоставляться в замороженном либо в лиофилизированном виде. В первом из упомянутых выше случаев композиция должна быть разморожена перед использованием. Последняя же форма зачастую используется для увеличения стабильности активного вещества, содержащегося в композиции, в случае самых различных условий хранения, так как это является общепризнанным для специалистов в данной области, что лиофилизированные препараты, как правило, более стабильны, чем их жидкие аналоги. Такие лиофилизированные препараты восстанавливают перед использованием посредством добавления одного или более подходящего фармацевтически приемлемого растворителя, такого как стерильная вода для инъекций либо стерильный физиологический солевой раствор.
В случае исходных материалов они изготавливаются для хранения как лиофилизированные препараты или водные растворы посредством перемешивания, если это приемлемо, полипептидного варианта, имеющего желаемую степень очистки, с одним или более фармацевтически приемлемым носителем, наполнителем или стабилизатором, обычно используемым в данной области (все из которых называются “наполнители”, ехсipients), к которым относятся, к примеру, буферные агенты, стабилизирующие агенты, консерванты, изотонизаторы, неионные сурфактанты (surfactants) или детергенты, антиоксиданты и/или другие смешанные добавки, такие как вещества, придающие объем или наполнители, хелатирующие агенты, антиоксиданты и сорастворители.
Подробная информация о приготовлении исходных материалов, пригодных для введения вариантов FVII, равно как и о препаратах длительного высвобождения, может быть найдена в WO 01/58935 и WO 03/093465, включенных в данное описание путем отсылки.
Настоящее изобретение далее описывается с помощью нижеследующих примеров, но ими не ограничивается.
Материалы и методы
Участок активного центра
Участок активного центра определен как любые остатки, имеющие, по меньшей мере, один атом, расположенный на расстоянии в пределах 10 A от любого атома в каталитической триаде (остатки HI 93, D242, S344).
Измерение пониженной чувствительности к протеолитической деградации
Протеолитическая деградация может быть измерена при использовании анализа, описанного в US 5580560, Примере 5, где протеолиз является автопротеолизом.
Кроме того, пониженный протеолиз может быть зарегистрирован в модели in vivo при использовании радиоактивно-меченых проб и сравнении протеолиза rhFVIIa и полипептидного варианта данного изобретения посредством отбора проб крови и проведения их анализа методом SDS-электрофореза в полиакриламидном геле (SDS-PAGE) и авторадиографии.
Независимо от анализа, использованного для определения протеолитической деградации, термин “пониженная протеолитическая деградация” предназначен для обозначения измеримого уменьшения в расщеплении по сравнению с тем, что получено для rhFVIIa при измерении посредством сканирования гелей, полученных после проведения SDS-PAGE и окрашивания Coomassie, HPLC или при измерении величины сохранившейся каталитической активности по сравнению с диким типом при использовании анализа активности, независимой от тканевого фактора, описанного ниже.
Определение молекулярного веса полипептидных вариантов
Молекулярный вес полипептидных вариантов определяют любым из следующих методов: SDS-PAGE, гель-фильтрация, Вестерн-блоттинг, выполненная с помощью матрицы лазерная десорбционная масс-спектрометрия mstrix assisted laser desorption mass spectrometry) или равновесное центрифугирование, например, SDS-PAGE согласно Laenmui, U.K., Nature, vol.227 (1970), pp.680-685.
Определение сродства при связывании фосфолипидных мембран
Сродство при связывании фосфолипидных мембран может быть определено, как описано в Nelsestuen et al., Biochemistry, 1977; 30, 10819-10824 или как описано в Примере 1 в US 6017882.
Анализ TF-независимой активации фактора X
Этот анализ был описан в деталях на странице 39826 в работе Nelsestuen et al., J Biol. Chem., 2001; 276:39825-39831.
Кратко, анализируемую молекулу (либо hFVIIa, rhFVIIa либо полипептидный вариант изобретения в активированной форме) смешивают с источником фосфолипида (предпочтительно с фосфатидилхолином и фосфатидилсерином в отношении 8:2) и релипидированным фактором Х в трис-буфере, содержащем бычий сывороточный альбумин (BSA). После определенного времени инкубации реакцию останавливают добавлением избытка ЭДТА. Затем измеряют концентрацию фактора Ха из изменения поглощения при 405 нм после добавления хромогенного субстрата (S-2222, Chromogenix). После поправки на фон определяют активность rhFVIIa (awt), независимую от тканевого фактора, как изменение поглощения за 10 минут и активность полипептидного варианта изобретения (авариант), независимую от тканевого фактора, также измеряют как изменение поглощения за 10 минут. Отношение активности полипептидного варианта в активированной форме и активности rhFVIIa определяют как авариант/awt.
Анализ свертывания
Свертывающие активности FVIIa и его вариантов измеряли в одностадийных анализах и времена свертывания регистрировали на Thrombotrack IV коагулометре (Medinor). Плазму человека, истощенную в отношении фактора VII (American Diagnostica), восстанавливали и уравновешивали при комнатной температуре в течение 15-20 минут. 50 микролитров плазмы затем переносили в чашечки коагулометра.
FVIIa и его варианты разбавляли буфером глиоксалиновым буфером (5,7 мМ барбитурат, 4,3 мМ цитрат натрия, 117 мМ NaCl, 1 мг/мл BSA, pH 7,35). Пробы вносили в чашечку в количестве 50 мкл и инкубировали при 37°С в течение 2 минут.
Тромбопластин (Medinor) восстанавливали с водой и добавляли CaCl2 до конечной концентрации 4,5 мМ. Реакцию начинали добавлением 100 мкл тромбопластина.
Для измерения свертывающей активности в отсутствие TF был использован тот же анализ без добавления тромбопластина. Данные анализировали, используя программное обеспечение PRISM.
Анализ цельной крови
Свертывающие активности FVIIa и его вариантов измеряли в одностадийных анализах и времена свертывания регистрировали на коагулометре Thrombotrack IV (Medinor). 100 мкл FVIIa или его вариантов разводили в буфере, содержащем 10 мМ глицилглицина, 50 мМ NaCl, 37,5 мМ CaCl2, pH 7,35, и переносили в чашечку для реакции. Реакцию свертывания начинали добавлением 50 мкл крови, содержащей 10% 0,13 М тринатриевой соли лимонной кислоты в качестве антикоагулянта. Данные анализировали, используя программное обеспечение Excel или PRISM.
Амидолитический анализ
Способность вариантов расщеплять маленькие пептидные субстраты может быть измерена при использовании хромогенного субстрата S-2288 (D-Ile-Pro-Arg-пара-нитроанилид). FVIIa разводят до примерно 10-90 нМ в буфере для анализа (50 мМ Na-Hepes, pH 7,5, 150 мМ NaCl, 5 мМ CaCl2, 0.1% BSA, 1 ед/мл гепарин). Кроме того, растворимый TF (soluble TF, sTF) разводят до 50-450 нМ в буфере для анализа. 120 мкл буфера для анализа смешивают с 20 мкл пробы с FVIIa и 20 мкл sTF. После 5 мин инкубации при комнатной температуре при мягком покачивании и последующей инкубации в течение 10 мин при 37°С реакцию начинают добавлением субстрата S-2288 до концентрации 1 мМ и измеряют абсорбцию при 405 нм в нескольких временных точках.
Анализ методом ELISA
Концентрации FVII/FVIIa (или варианта) определяют при помощи ELISA метода. Ячейки микропланшета сенсибилизируют антителами против протеазного домена, используя раствор, содержащий 2 мкг/мл антител в PBS (100 мкл на ячейку). После сенсибилизации в течение ночи при комнатной температуре (room temperature, R.T.) ячейки промывают 4 раза буфером ТНТ (100 мМ NaCl, 50 мМ трис-HCl, pH 7,2, 0,05% Tween-20). Потом 200 мкл 1% казеина (полученного при разведении исходного 2,5% раствора казеина раствором 100 мМ NaCl, 50 мМ трис-HCl, pH 7,2) добавляют в ячейку для блокирования. После 1 часа инкубации при R.T. ячейки опорожняют и вносят в них 100 мкл пробы, необязательно разбавленной буфером для разведения (ТНТ+0,1% казеина). После следующей инкубации в течение 1 часа при комнатной температуре ячейки промывают 4 раза буфером ТНТ и добавляют 100 мкл антител против EGF-подобного домена, меченных биотипом (1 мкг/мп). После следующей инкубации в течение 1 часа при R.T., за которой следуют 4 дополнительные промывки буфером ТНТ, добавляют 100 мкл конъюгата стрептавидин-пероксидаза хрена (DAKO A/S, Glostrup, Denmark, разведение 1/10000). После следующей инкубации в течение 1 часа при R.T., за которой следуют 4 дополнительные промывки буфером ТНТ, добавляют 100 мкл ТМВ (3,3',5,5'-тетраметилбензидин, Kem-en-Tech A/S, Denmark). Через 30 мин инкубации при R.T. в темноте добавляют 100 мкл 1 М H2SO4 и определяют величину оптической плотности при 450 нм (OD450нм). Стандартную кривую получают, используя rhFVIIa (NovoSeven®).
Альтернативно, количество FVII/FVIIa или вариантов может быть определено через связывание Gla домена, а не через протеазный домен. В таких анализах с использованием метода ELISA ячейки сенсибилизируют в течение ночи антителами против EGF-подобного домена и для детекции используют кальций-зависимые моноклональные антитела против Gla-домена, меченные биотином (2 мкг/мл, 100 мкл на ячейку). При использовании этого варианта анализа к ТНТ и буферам для разведения добавляют 5 мМ CaCl2.
Определение тромбограммы
Эффект hFVIIa, rhFVIIa или вариантов FVIIa на образование тромбина в плазме человека проверяют, используя модифицированную версию анализа, описанного на странице 589 в работе Hemker et al. (2000) Thromb Haemost 83:589-591. Кратко, анализируемую молекулу (или hFVIIa, rhFVIIa или вариант) смешивают с истощенной по фактору FVII обедненной тромбоцитами плазмой (platelet poor plasma, РРР), содержащей или релипидированный рекомбинантный тканевый фактор (такой как Innovin из Dade Behring), или фосфолипид (фосфатидилхолин и фосфатидилсерин в отношении 8:2 или фосфатидилхолин, фосфатидилсерин и фосфатидилэтанол в отношении 4:2:4).
Реакцию начинают добавлением субстрата тромбина, дающего флуоресцирующие продукты, и хлористого кальция. Флуоресценцию измеряют непрерывно и амидолитическую активность тромбина определяют, рассчитывая наклон кривой флуоресценции (увеличение флуоресценции во времени). Этим способом определяют время, за которое достигается максимум амидолитической активности тромбина (Тmах), и скорость образования тромбина (максимальное увеличение активности тромбина), а также рассчитывают суммарную активность тромбина (“площадь под кривой”, area under the сurve, AUC).
Замороженную плазму с добавленным цитратом, истощенную в отношении фактора FVII, оттаивают в присутствии ингибитора трипсина из кукурузы (100 мкг/мл сыворотки) для ингибирования сопряженного пути коагуляции. В каждую ячейку микропланшета с 96 ячейками добавляют 80 мкл плазмы и 20 мкл буфера, содержащего rhFVII или вариант, который должен быть проанализирован, в конечных концентрациях в диапазоне 0,1-100 нМ. Рекомбинантный тканевый фактор человека (rTF) добавляют в 5 мкл буфера для анализа до конечной концентрации 1 пМ. Буфер для анализа содержит 20 мМ Hepes, 150 мМ NaCl и 60 мг/мл BSA и приготовлен на дистиллированной воде. Реакцию начинают, добавляя 20 мкл раствора субстрата, содержащего 0,1 М СаСl. Планшет, используемый для анализа, и реагенты предварительно нагревают до 37°С и проводят реакцию при этой температуре. Используемым флуориметром является BMG Fluonneter с фильтром для возбуждающего света с максимумом пропускания при 390 нм и с фильтром для испускаемого света с максимумом пропускания при 460 нм. Флуоресценцию измеряют в каждой ячейке планшетов с 96 ячейками с прозрачным дном с интервалами в 20-40 секунд на протяжении 30-180 минут. Данные анализируют, используя программное обеспечение PRISM.
Определение связывания тканевого фактора методом поверхностного плазменного резонанса (Biacore Assay)
Для измерения относительной связывающей способности фактора VIIa дикого типа и его вариантов с растворимым тканевым фактором использовали метод поверхностного плазменного резонанса (surface plasmon resonance). Рекомбинантный растворимый тканевый фактор, содержащий внеклеточный домен, связывали с платами для измерения чипа Biacore СМ5, тип 270, с использованием метода связывания NHS/EDC. Связывание растворимого тканевого фактора проводили при рН 4,5, что обеспечивает прочное взаимодействие с поверхностью чипа,
В данном исследовании связывание тканевого фактора с белком фактора VII проводили при одной концентрации FVIIa или варианта, что делает возможным проведение относительного сравнения вариантов с диким типом. Эту концентрацию определяли по стандартной кривой для FVIIa дикого типа, который пропускали над поверхностью чипа в концентрациях в диапазоне 75-0 мкг/мл. Удаление FVIIa проводили, промывая чип 10 мМ раствором ЭДТА. Таким способом было установлено, что концентрация 15 мкг/мл обеспечивает связывание в линейном диапазоне. После этого над поверхностью чипа пропускали растворы вариантов FVIIa с концентрацией 15 мкг/мл для определения относительной связывающей способности FVIIa или вариантов с тканевым фактором.
Примеры
Пример 1
Для этого примера используются данные рентгеноструктурного анализа hFVIIа в комплексе с растворимым тканевым фактором, приведенные Banner et al., J Mol Biol, 1996; 285:2089. Для дополнительной информации о расчетах, используемых в этом примере, см. WO 01/58935.
Экспонирование на поверхности
При проведении фракционных расчетов ASA для следующих остатков было определено, что более чем 25% их боковой цепи экспонировано на поверхности: A1, N2, A3, F4, L5, Е6, Е7, L8, R9, Р10, S12, L13, Е14, Е16, К18, Е19, Е20, Q21, S23, F24, Е25, Е26, R28, Е29, F31, К32, D33, А34, Е35, R36, К38, L39, W41, I42, S43, S45, G47, D48, Q49, А51, S52, S53, Q56, 058, S60, К62, D63, Q64, L65, Q66, S67,169, F71, L73, Р74, А75, Е77, G78, R79, Е82, Т83, Н84, К85, D86, D87, Q88, L89,190, V92, N93, Е94, G97, Е99, S103, D104, Н105, Т106, 0107, Т108, К109, Sill, R.113, Е116, G117, S119, L120, L121, А122, D123, 0124, V125, S126, Т128, Р129, Т130, V131, Е132, 1140, L141, Е142, К143, R144, N145, А146, S147, К148, Р149, Q150, G151, R152, G155, К157, V158, Р160, К161, Е163, L171, N173, G174, А175, N184, Т185, 1186, Н193, К197, К199, N200, R202, N203, 1205, S214, Е215, Н216, D217, G218, D219, S222, R224, S232, Т233, V235, Р236, G237, Т238, Т239, N240, Н249, Q250, Р251, V253, Т255, D256, Е265, R266, Т267, Е270, R271, F275, V276, R277, F278, L280, L287, L288, D289, R290, G291, А292, Т293, L295, Е296, N301, М306, Т307, Q308, D309, L311, Q312, Q313, R315, К316, V317, G318, D319, S320, Р321, N322, Т324, Е325, Y326, Y332, S333, D334, S336, К337, К341, G342, Н351, R353, 0354, Q366, 0367, Т370, V371, 0372, R379, Е385, Q388, К389, R392, S393, Е394, Р395, R396, Р397, 0398, V399, L400, L401, R402, Р404 и Р406 (A1-S45 локализованы в домене Gla, остатки в остальных положениях локализованы за пределами домена Gla).
Было определено, что у следующих остатков более чем 50% их боковой цепи экспонировано на поверхности: A1, A3, F4, L5, Е6, Е7, L8, R9, Р10, Е14, Е16, К18, Е19, Е20, Q21, S23, Е25, Е26, Е29, К32, А34, Е35, R36, К38, L39, 142, S43, 047, D48, А51, S52, S53, Q56, 058, S60, К62, L65, Q66, S67, 169, F71, L73, Р74, А75, Е77, 078, R79, Е82, Н84, К85, D86, D87, Q88, L89, 190, V92, N93, Е94, 097, Т106, 0107, Т108, К109, Sill, E116, S119, L121, А122, D123, 0124, V131, Е132, L141, Е142, К143, R144, N145, А146, S147, К148, Р149, Q150, 0151, R152, 0155, К157, Р160, N173, 0174, А175, К197, К199, N200, R202, S214, Е215, Н216, G218, R224, V235, Р236, G237, Т238, Н249, Q250, V253, D256, Т267, F275, R277, F278, L288, D289, R290, G291, А292, Т293, L295, N301, М306, Q308, D309, L311, Q312, Q313, R315, К316, G318, D319, N322, Е325, D334, К341, G354, G367, V371, Е385, К389, R392, Е394, R396, Р397, G398, R402, Р404 и Р406 (A1-S43 локализованы в домене Gla, остатки в остальных положениях локализованы за пределами домена Gla).
Участок связывания тканевого фактора
При помощи расчетов ASA было определено, что следующие остатки, локализованные в hFVII, изменяют их ASA в комплексе. Было установлено, что следующие остатки составляют участок связывания рецептора: L13, К18, F31, Е35, R36, L39, F40,142, S43, S60, К62, D63, Q64, L65,169, С70, F71, С72, L73, Р74, F76, Е77, G78, R79, Е82, К85, Q88,190, V92, N93, Е94, R271, А274, F275, V276, R277, F278, R304, L305, М306, Т307, Q308, D309, Q312, Q313, Е325 и R379.
Участок активного центра
Участок активного центра определен как любой аминокислотный остаток, имеющий, по меньшей мере, один атом на расстоянии в пределах 10 А от любого атома триады аминокислот, обеспечивающей каталитическую активность (остатки HI 93, D242, S344): 1153, Q167, V168, L169, L170, L171, Q176, L177, С178, G179, 0180, T181, V188, V189, S190, A191, A192, H193, C194, F195, D196, K197,1198, W201, V228,1229,1230, P231, S232, T233, Y234, V235, Р236, G237, Т238, T239, N240, H241, D242, 1243, A244, L245, L246, V281, S282, G283, W284, G285, Q286, Т293, T324, Е325, Y326, M327, F328, D338, S339, C340, К341, G342, D343, S344, G345, G346, P347, H348, L358, T359, G360, 1361, V362, S363, W364, G365, C368, V376, Y377, ТЭ78, R379, V380, Q382, Y383, W3.86, L387, L400 и F405.
Поверхность связывающей щели активного центра
Участок “поверхность связывающей щели активного центра” (active site binsding cleft) был определен посредством визуального исследования структуры FVIIa 1FAK.pdb как: N173, А175, К199, N200, N203, D289, R290, D291, А292, Р321 и Т370.
Пример 2
Конструкция экспрессионной кассеты для экспрессии rhFVII в клетках млекопитающих
Экспрессионная кассета для экспрессии rhFVII была сконструирована и клонирована, как описано в Примере 2 в патентной заявке WO 01/58935.
Пример 3
Конструкция экспрессионной кассеты, кодирующей варианты данного изобретения
Метод ПЦР с использованием последовательностей с дополнительными выступающими участками (sequense overhang extension, SOE PCR) был использован для создания конструкций, способных кодировать варианты открытых рамок считывания FVII с замененными кодонами, при использовании стандартных методов.
Пример 4
Экспрессия полипептидных вариантов в клетках СНО К1
Линию клеток СНО K1 (ATCC # CCL-61) засевают при 50% слиянии в культуральные колбы Т-25, используя МЕМα, 10% FCS (Gibco/BRL Cat # 10091), P/S и 5 мкг/мл фиплохинона, и дают возможность расти до слияния. Слившийся моноклеточный слой трансфецируют 5 мкг нужной плазмиды, описанной выше, используя агент для трансфекции Lipofectamine 2000 (Life Technologies) согласно инструкции производителя. Через 24 часа после трансфекции отбирают пробу и измеряют количество варианта при использовании, например, метода ELISA с применением антител против домена EGF1 фактора hFVII. С целью образования совокупности стабильных трансфектантов в этот момент времени может быть проведена соответствующая селекция клеток (например, с использованием Hygromycin В). При использовании клеток СНО К1 и гена устойчивости к Hygromycin В, находящегося в составе плазмиды в качестве селективного маркера, на наличие плазмиды, это обычно достигается в пределах одной недели.
Пример 5
Получение клеток СНО К1, стабильно экспрессирующих полипептидные варианты
Пробирку с пулом трансфецированных клеток СНО-К1 оттаивают и засевают клетки во флаконы для выращивания тканей с площадью 175 см2, содержащие 25 мл МЕМα, 10% FCS, филлохинон (5 мкг/мл), 100 ед/л пенициллина, 100 мкг/л стрептомицина, и выращивают в течение 24 часов. Клетки собирают, разводят и вносят в 96-луночные микропланшеты при плотности клеток 1/2-1 клетка на ячейку. По истечении 1 недели роста в ячейках присутствуют колонии из 20-100 клеток, и те ячейки, которые содержат только одну колонию, маркируют; После следующих двух недель среду во всех ячейках, содержащих только одну колонию, заменяют 200 мкл свежей среды. После 24 часов отбирают пробу среды и анализируют, например, методом ELISA. Высокопроизводительные клоны отбирают и используют для наработки большого количества FVII или его вариантов.
Пример 6
Очистка полипептидных вариантов и последующая активация.
Очистку вариантов FVII и FVIIа проводят следующим образом: Процедуру осуществляют при 4°С. Собранную культуральную жидкость после крупномасштабного выращивания клеток подвергают ультрафильтрации при использовании системы Millipore TFF с мембранами Pellicon, отсекающими белки размером более 30 кДа. После концентрирования среды добавляют цитрат до 5 мМ и рН доводят до 8,6. По необходимости, электропроводность снижают до значения ниже 10 мСм/см. Затем пробу наносят на колонку с O-сефарозой FF, уравновешенной 50 мМ NaCl, 10 мМ трис, рН 8,6. После промывания колонки 100 мМ NaCl, 10 мМ трис, рН 8,6, а затем раствором 150 мМ NaCl, 10 мМ трис, рН 8,6, элюируют FVII, используя 10 мМ трис, 25 мМ NaCl, 35 мМ CaCl2, рН 8,6.
Для второго этапа хроматографии готовят аффинную колонку посредством связывания моноклональных кальций-зависимых антител против Gla-домена с CNBr-активированной сефарозой FF. Около 5,5 мг антител связывают с 1 мл смолы. Колонку уравновешивают раствором 10 мМ трис, 100 мМ NaCl, 35 мМ CaCl2, рН 7,5. Затем в пробу добавляют NaCl до концентрации 100 мМ и доводят рН до 7,4-7,6. После O/N нанесения пробы колонку промывают раствором 100 мМ NaCl, 35 мМ CaCl2, 10 мМ трис, рН 7,5 и элюируют белок FVII раствором 100 мМ NaCl, 50 мМ цитрат, 75 мМ трис, рН 7,5.
Для третьего этапа хроматографии электропроводность пробы по необходимости снижают до значения ниже 10 мСм/см и доводят рН до 8,6. Затем пробу наслаивают на колонку с Q-сефарозой (уравновешенную 50 мМ NaCl, 10 мМ трис, рН 8,6) при плотности около 3-5 мг белка на 1 мл геля для получения эффективной активации. После нанесения колонку промывают раствором 50 мМ NaCl, 10 мМ трис, рН 8,6 в течение около 4 часов с пропусканием 3-4 объемов колонки за час. Белок FVII элюируют, используя градиент 0-100% 500 mM NaCl, 10 тМ трис, рН 8,6, пропуская более 40 объемов колонки. Фракции, содержащие FVII, объединяют.
Для заключительного этапа хроматографии электропроводность пробы снижают до значения ниже 10 мСм/см. Затем пробу наносят на колонку с Q-сефарозой (уравновешенную раствором 140 мМ NaCl, 10 мМ глицилглицин, рН 8.6) при концентрации 3-5 мг белка на 1 мл геля. Затем колонку промывают раствором 140 мМ NaCl, 10 мМ глицилглицина, рН 8,6 и элюируют FVII раствором 140 мМ NaCl, 15 мМ CaCl2, 10 мМ глицилглицина, рН 8,6. Элюат разводят до концентрации CaCl2 10 мМ и рН доводят до значения 6,8-7,2. В заключение добавляют Tween-80 до концентрации 0,01% и доводят рН до 5,5 для хранения пробы при -80°С.
Пример 7
Экспериментальные результаты - способность активировать FX
При проведении исследования "Анализ TF-независимой активации фактора Х" с использованием вариантов изобретения были получены следующие результаты (результаты выражали как процент от активности варианта P10Q+K32E, использованного в качестве контроля):
Как видно из приведенных выше результатов, варианты изобретения показали повышенную способность активировать FX по сравнению с rhFVIIa, а также по сравнению с [P10Q+K32E]rhFVIIa.
Пример 8
Экспериментальные результаты - свертывающая активность при "Анализе цельной крови"
Подвергая варианты изобретения исследованию "Анализ цельной крови", выявили, что они показывали повышенную свертывающую активность (то есть меньшее время свертывания) по сравнению с rhFVIIa, так же как и с [P10Q+K.32E]rhFVIIa. Экспериментальные результаты приведены на Фигуре 1 и в Таблице 2 ниже.
Пример 9
Экспериментальные результаты - свертывающая активность в эксперименте "Измерение свертывающей активности"
При измерении TF-зависимой свертывающей активности (условия эксперимента "Измерение свертывающей активности" описаны выше в секции Материалы и методы) было очевидно, что варианты данного изобретения, имеющие замену R36E, проявляют значительно сниженную свертывающую активность по сравнению с rhFVII или другими вариантами данного изобретения, см. Таблицу 3 ниже. Тем не менее, как проиллюстрировано в Примере 7 выше, варианты, имеющие замену R36E, проявляют повышенную способность активировать фактор Х в эксперименте “Анализ TF-независимой активации фактора Х”.
Пример 10
Экспериментальные результаты - образование тромбина в эксперименте "Определение тромбограммы"
Используя обе тромбограммы - фосфолипид (РL)-зависимую и зависимую от тканевого фактора - (ТР)-зависимую (см. выше описание Определение тромбограммы), определяли максимальную скорость образования тромбина для вариантов FVIIa при разных концентрациях белков. При графическом изображении зависимости максимальных скоростей образования тромбина (выраженных как единицы флуоресценции (fluorescence units, FU) на сек2) как функции концентрации варианта в пМ, были получены результаты, представленные на Фигуре 2 (максимальное значение скорости зависимого от тканевого фактора образования тромбина) и Фигуре 3 (максимальное значение скорости фосфолипид-зависимого образования тромбина). Из этих результатов видно, что FVIIa-вариант P10Q К32Е А34Е R36E проявляет дифференцированную способность образовывать тромбин, находящуюся в зависимости от того, является ли реакция PL-зависимой или TF-зависимой. Максимальная скорость TF-зависимого образования тромбина этого варианта снижена приблизительно в 10 раз (прерывистая линия на Фигуре 2) по сравнению с FVIIa-вариантами P10Q К32Е или A3AY P10Q К32Е A34L. Также время задержки, время до максимального накопления, высота пика и (в меньшей степени) AUC имеют меньшие значения для P10Q К32Е А34Е R36E по сравнению с другими вариантами (результаты не показаны). В отличие от TF-зависимой активности PL-зависимая активность варианта P10Q К32Е А34Е R36E является равнозначной активности других вариантов, проанализированных в этом примере (см. Фигуру 3), то есть этот вариант имеет полную PL-зависимую активность, хотя TF-зависимая активность существенно снижена. В том же эксперименте вариант P10Q К32Е А34Е R36E прямо сравнивали с вариантом P10Q К32Е А34Е P74S, который имеет самую высокую скорость TF-зависимого образования тромбина, как показано на Фигуре 2. Различия в TF-связывании между этими двумя вариантами (то есть снижение TF-связывания варианта P10Q К32Е А34Е R36E) определяется наличием замены R36E, возможно ее совместным действием с заменой А34Е.
Пример 11
Экспериментальные результаты - связывание FVIIa с тканевым фактором в Biacore Assay
При анализе вариантов изобретения методом поверхностного плазменного резонанса на Biacore system с использованием TF-чипа, как описано в разделе Материалы и Методы, были получены следующие результаты:
В соответствии с данными о TF-зависимой скорости образования тромбина, полученными в эксперименте “Определение тромбограммы” (Пример 10), результаты, представленные в Таблице 4, указывают на то, что замена R36E приводит к уменьшению связывания с тканевым фактором. В таких же анализах на Biacore system варианты FVIIa, имеющие такие же модификации, как и варианты, перечисленные в Таблице 4, в комбинации с двумя дополнительными модификациями, вводящими два сайта гликозилирования (T106N и V253N или I205T), были также проанализированы в отношении связывания с тканевым фактором. Результаты приведены ниже в Таблице 5.
Эти результаты согласуются с результатами, представленными в Таблице 4, и показывают, что по сравнению с такими же вариантами (или диким типом), не имеющими дополнительных сайтов гликозилирования, представленными в Таблице 4, в вариантах, представленных в Таблице 5, присутствие двух новых сайтов гликозилирования обеспечивает (дополнительное) уменьшение связывания тканевого фактора. Как и в случае вариантов, представленных в Таблице 4, присутствие замены R36E в гликозилированном варианте приводит к существенному снижению уровня связывания тканевого фактора по сравнению со связыванием тканевого фактора гликозилированными вариантами, которые не имеют этой замены.


| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЫ, ПОДОБНЫЕ ФАКТОРУ VII ИЛИ VIIA | 2001 |
|
RU2278123C2 |
| ПОЛИПЕПТИДЫ НА ОСНОВЕ МОДИФИЦИРОВАННОГО ФАКТОРА VII И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2571931C2 |
| ХИМЕРНЫЕ МОЛЕКУЛЫ ФАКТОРА VII | 2010 |
|
RU2563231C2 |
| КОНЪЮГАТ ПОЛИПЕПТИДА ФАКТОРА VII, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ЕГО ПРИМЕНЕНИЕ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2003 |
|
RU2362807C2 |
| СПОСОБ СНИЖЕНИЯ СОДЕРЖАНИЯ ДИМЕРА В КОМПОЗИЦИИ, СОДЕРЖАЩЕЙ ПОЛИПЕПТИД ФАКТОРА VII ПУТЕМ ТЕПЛОВОЙ ОБРАБОТКИ | 2008 |
|
RU2483079C2 |
| МОДИФИЦИРОВАННЫЙ КОАГУЛИРУЮЩИЙ ФАКТОР VIIa С ПРОДЛЕННЫМ ВРЕМЕНЕМ ПОЛУЖИЗНИ | 2007 |
|
RU2466141C2 |
| СПОСОБ ПОЛУЧЕНИЯ, СПОСОБ ОЧИСТКИ И СПОСОБ СТАБИЛИЗАЦИИ ПОЛИПЕПТИДОВ ФАКТОРА VII, IX И X | 2004 |
|
RU2364626C2 |
| МОДИФИЦИРОВАННЫЕ ВИТАМИН К-ЗАВИСИМЫЕ ПОЛИПЕПТИДЫ | 2005 |
|
RU2396347C2 |
| СТАБИЛИЗАЦИЯ БЕЛКА В РАСТВОРЕ | 2004 |
|
RU2364609C2 |
| НОВЫЕ АНТИТЕЛА К ТКАНЕВОМУ ФАКТОРУ В КАЧЕСТВЕ АНТИКОАГУЛЯНТОВ | 2003 |
|
RU2345789C2 |
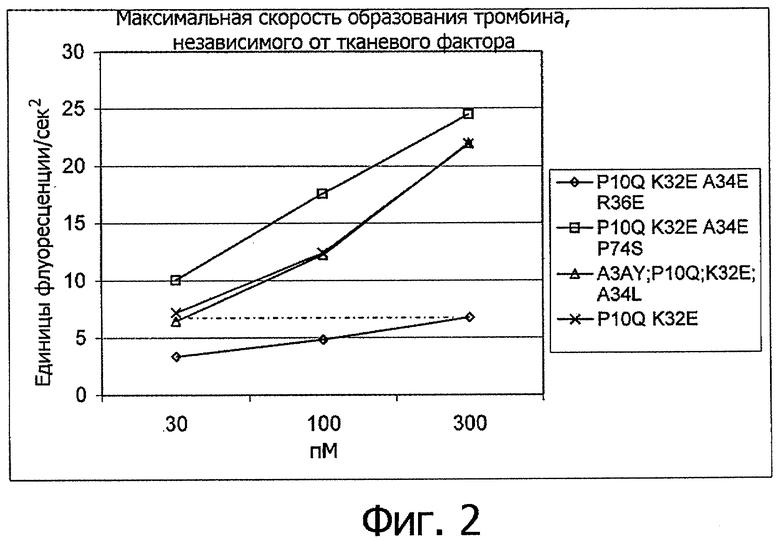
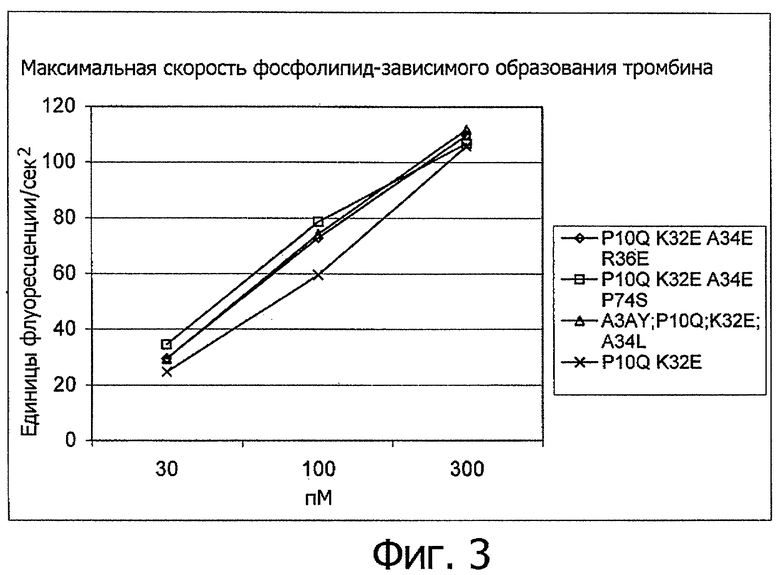
Изобретение относится к области биотехнологии, конкретно к получению вариантов домена Gla фактора VII человека и фактора VIIa человека, и может быть использовано в медицине. Получают аминокислотную последовательность варианта FVII или FVIIa, которая отличается по 1-15 аминокислотным остаткам по отношению к аминокислотной последовательности фактора VII человека (hFVII) или фактору VIIa человека (hFVIIa), в которой отрицательно заряженный аминокислотный остаток введен путем замены в положение 36. Полученные варианты FVII или FVIIa используют в составе композиции для лечения млекопитающих, имеющих заболевание или нарушение, где желательным является образование сгустка крови. Изобретение позволяет получить варианты FVII или FVIIa с повышенной свертывающей активностью и/или повышенной активацией фактора X по сравнению с природной формой hFVIIa. 3 н. и 39 з.п. ф-лы, 3 ил., 5 табл.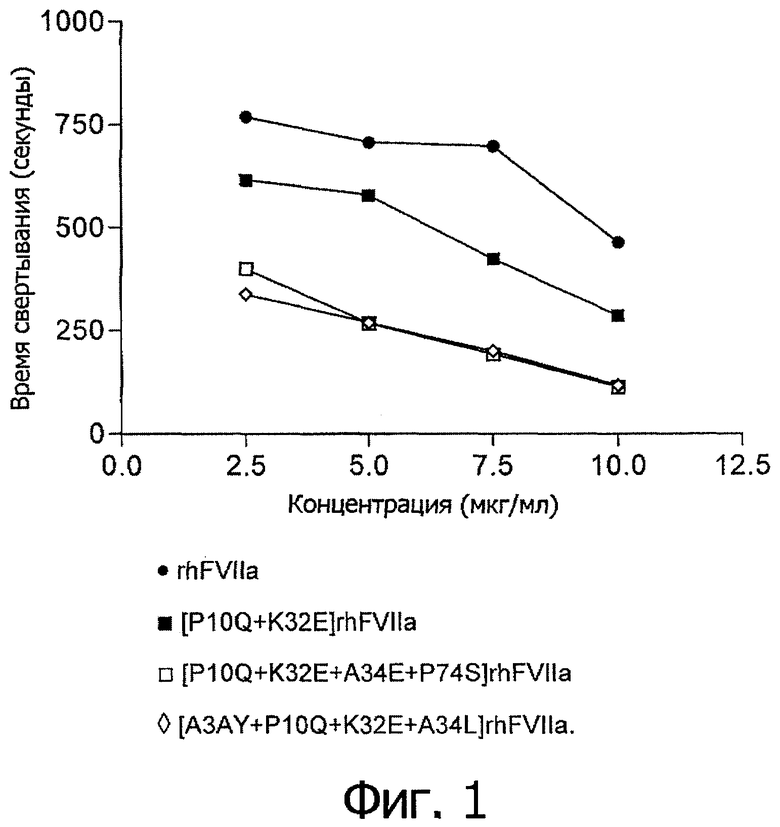
1. Полипептидный вариант фактора VII (FVII) или фактора VIIa (FVIIa), имеющий аминокислотную последовательность, которая отличается по 1-15 аминокислотным остаткам по отношению к аминокислотной последовательности фактора VII человека (hFVII) или фактора VIIa человека (hFVIIa), показанной в SEQ ID NO:1, в котором отрицательно заряженный аминокислотный остаток был введен путем замены в положении 36.
2. Полипептидный вариант по п.1, где названной заменой является R36D.
3. Полипептидный вариант по п.1, где названной заменой является R36E.
4. Полипептидный вариант по любому из пп.1-3, дополнительно включающий замену аминокислоты в положении 34.
5. Полипептидный вариант по п.4, включающий замену A34L.
6. Полипептидный вариант по п.4, включающий замену А34Е.
7. Полипептидный вариант по п.6, включающий замены A34E+R36E.
8. Полипептидный вариант по любому из предшествующих пунктов, дополнительно включающий замены аминокислот, выбранные из группы, состоящей из P10Q, К32Е и их комбинаций.
9. Полипептидный вариант по п.8, включающий замену К32Е.
10. Полипептидный вариант по п.8, включающий замену P10Q.
11. Полипептидный вариант по п.8, включающий замены P10Q+K32E.
12. Полипептидный вариант по п.11, включающий замены P10Q+K32E+A34+R36E.
13. Полипептидный вариант по п.11, включающий замены P10Q+K32E+A34L+R36E.
14. Полипептидный вариант по любому из предшествующих пунктов, в котором по меньшей мере один аминокислотный остаток, включающий группу для присоединения не-полипептидного компонента, введен в положение, находящееся за пределами домена Gla.
15. Полипептидный вариант по п.14, где названная группа для присоединения является участком гликозилирования in vivo.
16. Полипептидный вариант по п.15, где участок гликозилирования представляет собой участок N-гликозилирования in vivo, введенный посредством замены.
17. Полипептидный вариант по п.16, где названный участок N-гликозилирования in vivo введен посредством замены, которую выбирают из группы, состоящей из A51N, G58N, T106N, K109N, G124N, K143N+N145T, А175Т, I205S, I205T, V253N, T267N, T267N+S269T, S314N+K316S, S314N+K316T, R315N+V317S, R315N+V317T, K316N+G318S, K316N+G318T, G318N, D334N и их комбинаций.
18. Полипептидный вариант по п.17, включающий по меньшей мере одну замену, которую выбирают из группы, включающей T106N, I205T и V253N.
19. Полипептидный вариант по п.18, включающий два сайта N-гликозилирования in vivo, введенные путем замен, выбранных из группы, состоящей из T106N+I205T, T106N+V253N, I205T+V253N.
20. Полипептидный вариант по п.19, включающий замены Р10Q+K32E+A34E+R36E+T106N+I205T.
21. Полипептидный вариант по п.19, включающий замены P10Q+K32E+A34E+R36E+T106N+V253N.
22. Полипептидный вариант по п.19, включающий замены P10Q+K32E+A34E+R36E+I205T+V253N.
23. Полипептидный вариант по п.19, включающий замены Р10Q+K32E+A34L+R36E+Т106N+I205T.
24. Полипептидный вариант по п.19, включающий замены P10Q+K32E+A34L+R36E+T106N+V253N.
25. Полипептидный вариант по п.19, включающий замены P10Q+K32E+A34L+R36E+I205T+V253N.
26. Полипептидный вариант по любому из предшествующих пунктов, дополнительно включающий вставку по меньшей мере одного аминокислотного остатка между положениями 3 и 4.
27. Полипептидный вариант по п.26, включающий вставку одного аминокислотного остатка между положениями 3 и 4.
28. Полипептидный вариант по п.26 или 27, где между положениями 3 и 4 вставлен гидрофобный аминокислотный остаток.
29. Полипептидный вариант по п.28, где названной вставкой является A3AY.
30. Полипептидный вариант по п.29, включающий инсерцию A3AY и замены P10Q+K32E+A34E+R36E.
31. Полипептидный вариант по п.29, включающий инсерцию A3AY и замены P10Q+K32E+A34L+R36E.
32. Полипептидный вариант по п.29, включающий инсерцию A3AY и замены Р10Q+K32E+A34E+R36E+T106N+I205T.
33. Полипептидный вариант по п.29, включающий инсерцию A3AY и замены Р10Q+K32E+A34E+R36E+T106N+V253N.
34. Полипептидный вариант по п.29, включающий инсерцию A3AY и замены P10Q+K32E+A34E+R36E+I205T+V253N.
35. Полипептидный вариант по п.29, включающий инсерцию A3AY и замены P10Q+K32E+A34L+R36E+T106N+I205T.
36. Полипептидный вариант по п.29, включающий инсерцию A3AY и замены P10Q+K32E+A34L+R36E+T106N+V253N.
37. Полипептидный вариант по п.29, включающий инсерцию A3AY и замены P10Q+K32E+A34L+R36E+I205T+V253N.
38. Полипептидный вариант по любому из предшествующих пунктов, где названный вариант находится в его активированной форме.
39. Композиция, свертывающая кровь, включающая полипептидный вариант по любому из пп.1-38 и по меньшей мере один фармацевтически приемлемый носитель или наполнитель.
40. Способ лечения млекопитающих, имеющих заболевание или нарушение, где желательным является образование сгустка крови, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества полипептидного варианта по любому из пп.1-38 или композиции по п.39.
41. Способ по п.40, где названное заболевание или нарушение выбирают из группы, состоящей из кровоизлияний, включая кровоизлияние в мозг, тяжелых неконтролируемых кровотечений, таких как травма, кровотечений у пациентов после трансплантации или резекции, кровотечений из варикозно расширенных вен и гемофилии.
42. Способ по п.41, где названное заболевание или нарушение является травмой.
43. Способ по п.41, где названное заболевание или нарушение является гемофилией.
| Приспособление к чуркозаготовительному станку для автоматической осевой подачи кругляков при нарезании из них кружков | 1941 |
|
SU66753A1 |
| SHAH A.M | |||
| et al | |||
| Manipulation of the membrane binding site of vitamin K-dependent proteins: enhanced biological function of human factor VII, Proc | |||
| Natl | |||
| Acad | |||
| Sci., USA, 1998, v.95, n.8, p.4229-4234 | |||
| 0 |
|
SU158935A1 | |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКА, ОБЛАДАЮЩЕГО ОПОСРЕДОВАННОЙ ФАКТОРОМ VII АКТИВНОСТЬЮ В СВЕРТЫВАНИИ КРОВИ | 1986 |
|
RU2122583C1 |
Авторы
Даты
2009-11-20—Публикация
2004-06-18—Подача