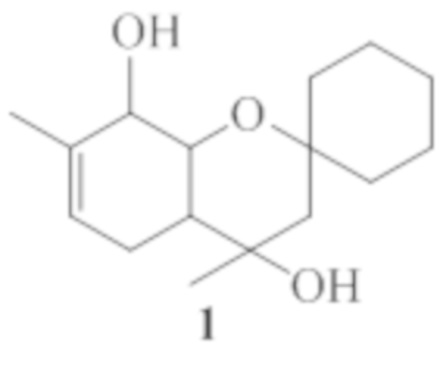
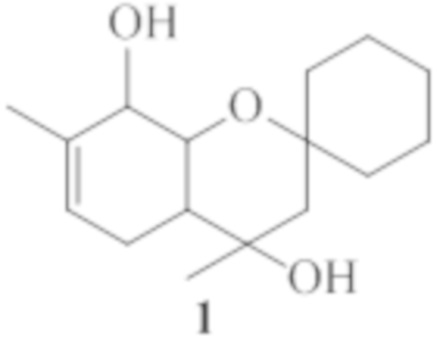
Изобретение относится к области органической химии и медицины, а именно, к новым органическим соединениям, конкретно к 4,7-диметил-3,4,4a,5,8,8a-гексагидроспиро[хромен-2,1'-циклогексан]-4,8-диолу общей формулы 1, включая его пространственные изомеры, в том числе оптически активные формы, обладающему анальгезирующей активностью.
Аналогами предлагаемого средства по фармакологическому действию являются ненаркотические анальгетики, такие как ацетилсалициловая кислота, анальгин и диклофенак натрия [1]. Данные по активности на модели «уксусные корчи» (ED50), острой токсичности (LD50) и широте терапевтического действия (IS50= LD50/ED50) этих лекарственных средств представлены в таблице 1 [2,3].
Недостатками ацетилсалициловой кислоты являются низкая активность и гастротоксичность, анальгина - возможное угнетение кроветворения вплоть до полного агранулоцитоза, побочными эффектами диклофенака натрия являются желудочно-кишечные расстройства и гастротоксичность.
Наиболее близким к заявляемому средству по фармакологическому действию - прототипом, является диклофенак натрия.
Таблица 1. Токсичность и анальгетическое действие известных препаратов [2,3]
и предлагаемого агента 1
Задача, на решение которой направлено изобретение, заключается в поиске нового эффективного низкотоксичного лекарственного средства, обладающего анальгезирующей активностью.
Поставленная задача решается путем использования в качестве анальгезирующего средства 4,7-диметил-3,4,4a,5,8,8a-гексагидроспиро[хромен-2,1'-циклогексан]-4,8-диола общей формулы 1, включая его пространственные изомеры.
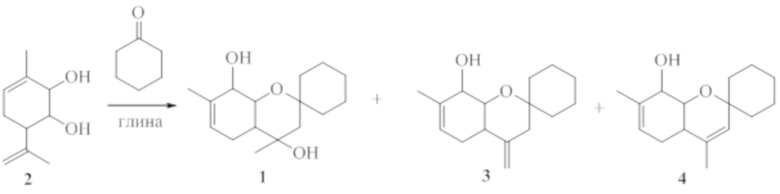
Соединение 1 не было ранее описано в литературе, оно может быть синтезировано в соответствии со схемой 1 взаимодействием 3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола 2 с циклогексаноном в присутствие кислотного катализатора, предпочтительно монтмориллонитовой глины. В качестве других межмолекулярных продуктов в этой реакции могут образовываться соединения 3 и 4.
Схема 1
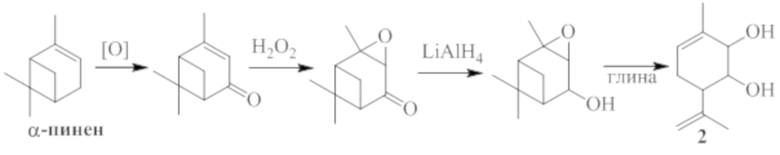
Для получения соединения 1 в виде различных стереоизомеров, в том числе и в оптически активном виде, можно использовать в качестве исходных веществ различные пространственные изомеры соединения 2, в том числе и обладающие оптической активностью. Соединение 2, в свою очередь, может быть синтезировано, например, в соответствии со схемой 2, исходя из монотерпена α-пинена, широко распространенного в отечественном растительном сырье, по ранее описанным методикам [4,5].
Схема 2
Острая токсичность соединения 1 определялась на белых беспородных мышах массой 20-22 г при однократном внутрижелудочном введении по методу Кербера [6]. Введение соединения 1 в дозах 500 мг/кг, 700 мг/кг и 1000 мг/кг не привело к гибели животных, и не оказало влияния на физическое и психо-эмоциональное состояние животных, вес тела и количество потребляемой пищи и воды. Таким образом, соединение 1 является умеренотоксичным веществом: LD50 превышает 1000 мг/кг.
Анальгетическая активность соединения 1 изучалась на модели висцеральной боли «уксусные корчи» [7, 8] путем однократного введения в дозах 0.1, 1 и 10 мг/кг (таблица 2).
«Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Оценка активности осуществлялась по количеству корчей в течение 3 мин.
Установлено, что соединение 1 уже в дозе 0.1 мг/кг проявляет высокую анальгетическую активность в тесте «уксусные корчи» (таблица 2), а широта терапевтического действия (SI=LD50/ED50) этого вещества превышает 10000, значительно превосходя аналогичный индекс препаратов сравнения (таблица 1).
Таким образом, соединение 1 сочетает высокую анальгетическую активность с низкой токсичностью и является перспективным для использования его в качестве эффективного низкотоксичного анальгезирующего лекарственного средства.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 4,7-диметил-3,4,4a,5,8,8a-гексагидроспиро[хромен-2,1'-циклогексан]-4,8-диола 1 исходя из 4,7-диметил-2-(проп-1-енил)-3,4,4а,5,8,8а-гексагидро-2H-хромен-4,8-диола 2 в присутствии монтмориллонита К10
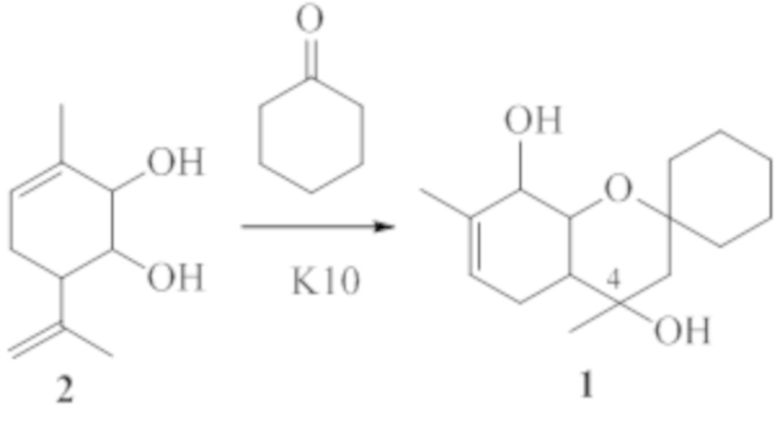
К суспензии 0.60 г монтмориллонита К10, прокаленного в течение 3 ч при 105°С, в 5 мл СН2Cl2 прибавили раствор 0.26 г циклогексанона в 5 мл СН2Сl2, затем прибавили по каплям раствор 0.22 г соединения 2 в 5 мл СН2Cl2. Растворитель отогнали, реакционную смесь выдерживали при комнатной температуре в течение 4 суток. Добавили 20 мл этилацетата. Катализатор отфильтровали, растворитель упарили. Полученную реакционную смесь делили на колонке с 17 г силикагеля (элюент - гексан с градиентом этилацетата от 0 до 100%). Выделили 0.170 г (49%) 4,7-диметил-3,4,4a,5,8,8a-гексагидроспиро[хромен-2,1'-циклогексан]-4,8-диола 1 в виде смеси двух диастереомеров по положению 4 в соотношении 2 : 1, 102 мг смеси соединений 7-метил-4-метилен-3,4,4a,5,8,8a-гексагидроспиро[хромен-2,1'-циклогексан]-8-ол 3 и 4,7-диметил-4a,5,8,8a-тетрагидроспиро[хромен-2,1'-циклогексан]-8-ол 4 (31%, 1:1), 0.021 г исходного соединения 2 (конверсия 91%).
Основной изомер соединения 1. 1H-NMR (500 MГц, CDCl3, δ, м.д.): 1.39 (3H, с, CH3-16), 1.77 (3H, м, CH3-17), 1.99-2.04 (2H, м, 2H-7), 3.69 (1H, дд, J(1e,6a) = 2.7 Гц, J(1e,10e) = 2.5 Гц, He-1), 3.77 (1H, ш.с, He-10), 5.54-5.58 (1H, м, H-8). Сигналы остальных протонов проявляются в виде перекрывающихся мультиплетов в областях 1.15-1.68 ppm, 1.91-2.00 м.д. и 2.20-2.38 м.д. 13C-NMR (125 МГц, CDCl3, δ, м.д.): 70.38 (CH, C-1), 72.94 (C, C-3), 41.23 (CH2, C-4), 70.78 (C, C-5), 38.70 (CH, C-6), 22.05 (CH2, C-7), 124.40 (CH, C-8), 132.06 (C, C-9), 71.32 (CH, C-10), 32.09 и 45.41 (2CH2, C-11, C-15), 21.87 (CH2, C-12, C-14), 25.68 (CH2, C-13), 29.28 (CH3, C-16), 20.45 (CH3, C-17). HR-MS: 266.1873 (M+, C16H26O3+; рассч. 266.1876).
Минорный изомер соединения 1. 1H-NMR (500 МГц, CDCl3, δ, м.д.): 1.12 (3H, с, CH3-16), 1.77 (3H, м, CH3-17), 1.81-1.87 (2H, м, 2H-7), 3.76 (1H, ш.с, He-10), 4.12 (1H, дд, J(1e,6a) = 2.5 Hz, J(1e,10e) = 2.2 Гц, He-1), 5.48-5.52 (1H, м, H-8). Сигналы остальных протонов проявляются в виде перекрывающихся мультиплетов в областях 1.15-1.68 м.д., 1.91-2.00 м.д. and 2.20-2.38 м.д.. 13C-NMR (125 МГц, CDCl3, δ, м.д.): 67.24 (CH, C-1), 72.52 (C, C-3), 40.73 (CH2, C-4), 71.49 (C, C-5), 38.18 (CH, C-6), 24.01 (CH2, C-7), 124.05 (CH, C-8), 132.12 (C, C-9), 71.18 (CH, C-10), 32.26 и 43.11 (2CH2, C-11, C-15), 21.84 (CH2, C-12, C-14), 25.90 (CH2, C-13), 29.34 (CH3, C-16), 20.86 (CH3, C-17). HR-MS: 266.1873 (M+, C16H26O3+; рассч. 266.1876).
Соединение 3. 1H-NMR (600 МГц, CDCl3, δ, м.д.): 1.80-1.86 (1H, м, He-7), 1.81 (3H, м, CH3-17), 1.97 (1H, d, 2J = 13.8 Гц, Ha-4), 2.24 (1H, дт, 2J = 13.8 Гц, J(4e,16) = 2.0 Гц, He-4), 2.24-2.31 (1H, м, Ha-7), 2.39 (1H, ддд, J(6a,7a) = 10.8 Гц, J(6a,7e) = 6.2 Гц, J(6a,1e) = 2.5 Гц, Ha-6), 3.74 (1H, дд, J(1e,6a) = 2.5 Hz, J(1e,10e) = 2.2 Гц, He-1), 3.76 (1H, ш.с, He-10), 4.68 (1H, дд, 2J= 2.5 Гц, J(16,4e) = 2.0 Гц, H-16), 4.86 (1H, дд, 2J= 2.5 Гц, J(16´,4e) = 2.0 Гц, H´-16), 5.57-5.60 (1H, м, H-8). Сигналы циклогексанового кольца проявляются в виде перекрывающихся мультиплетов в областях 1.17-1.60 м.д., 1.63-1.73 м.д. и 1.87-1.94 м.д. 13C-NMR (150 MHz, CDCl3, δ, м.д.): 71.86 (CH, C-1), 73.89 (C, C-3), 40.81 (CH2, C-4), 145.92 (C, C-5), 37.04 (CH, C-6), 25.73 (CH2, C-7), 124.70 (CH, C-8), 131.61 (C, C-9), 71.02 (CH, C-10), 30.00 и 39.54 (2CH2, C-11, C-15), 21.46 и 21.82 (2CH2, C-12, C-14), 25.94 (CH2, C-13), 110.25 (CH2, C-16), 21.01 (CH3, C-17). HR-MS: 248.1767 (M+, C16H24O2+; расч. 248.1771).
Соединение 4. 1H-NMR (600 МГц, CDCl3, δ, м.д.): 1.68 (3H, d, J(16,4) =1.4 МГц, CH3-16), 1.76-1.84 (1H, м, H-7), 1.80 (3H, ш.с, CH3-17), 1.86-1.90 (1H, м, Ha-6), 2.17-2.23 (1H, м, H´-7), 3.74 (1H, ш.т, He-1), 3.79 (1H, ш.с, He-10), 5.22 (1H, ш.с, H-4), 5.53-5.56 (1H, м, H-8). Сигналы циклогексанового кольца проявляются в виде перекрывающихся мультиплетов в областях 1.18-1.50 м.д. и 1.54-1.74 м.д. 13C-NMR (150 МГц, CDCl3, δ, м.д.): 71.40 (CH, C-1), 74.15 (C, C-3), 127.06 (CH, C-4), 136.18 (C, C-5), 32.84 (CH, C-6), 27.95 (CH2, C-7), 124.34 (CH, C-8), 132.04 (C, C-9), 71.23 (CH, C-10), 33.56 и 38.12 (2CH2, C-11, C-15), 21.73 и 21.85 (2CH2, C-12, C-14), 25.52 (CH2, C-13), 21.62 (CH3, C-16), 20.84 (CH3, C-17). HR-MS: 248.1769 (M+, C16H24O2+; расч. 248.1771).
Пример 2. Синтез (4aR,8R,8aS)-4,7-диметил-3,4,4a,5,8,8a-гексагидроспиро-[хромен-2,1'-циклогексан]-4,8-диола 1 на глине Н-К10
Приготовление катализатора Н-К10 [9]. Суспензию монтмориллонита К10 (5 г) в 1 М HCl (100 мл) перемешивали при 80°С в течение 6 часов. Осадок отфильтровали, промывая несколько раз водой, чтобы полностью удалить Cl–, затем сушили при 120°С в течение 12 ч.
При перемешивании к 1.00 г соединения 2 добавили 0.70 г циклогексанона, затем 1.70 г глины Н-К10, прокаленной в течение 1 ч при 120°С. Реакционную смесь выдерживали при комнатной температуре в течение 24 часов. Добавили 25 мл этилацетата. Катализатор отфильтровали, растворитель упарили. Полученную реакционную смесь делили на колонке с 17 г силикагеля (элюент - гексан с градиентом этилацетата от 0 до 100%). Выделили 1.027 г (65 %, (S)/(R) = 2:1) (4aR,8R,8aS)-4,7-диметил-3,4,4a,5,8,8a-гексагидроспиро[хромен-2,1'-циклогексан]-4,8-диола 1, 0.577 г смеси соединений 3 и 4 (39%, 1:1), 0.097 г исходного соединения 2 (конверсия 90%).
Пример 3. Определение острой токсичности соединения 1.
Острая токсичность соединения 1 определялась на белых беспородных мышах массой 20-22 г при однократном внутрижелудочном введении по методу Кербера [6]. Введение соединения 1 в дозах 500, 700 и 1000 мг/кг не привело к гибели животных, и не оказало влияния на физическое и психо-эмоциональное состояние животных, вес тела и количество потребляемой пищи и воды. Таким образом, соединение 1 является умеренотоксичным веществом: его LD50 превышает 1000 мг/кг.
Пример 4. Исследование анальгетической активности соединения 1 в тесте «уксусные корчи»
Эксперимент проводили на беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Исследуемое соединение 1 в дозах 0.1, 1, 10 и 20 мг/кг вводился однократно внутрижелудочно за час до воспроизведения модели. Контролем являлись животные с введением только уксусной кислоты. Оценка активности осуществлялась по количеству корчей в течение 3 мин. Эталоном сравнения служил диклофенак натрия в дозе 10 мг/кг. Результаты приведены в таблице 2.
Установлено, что соединение 1 на модели «уксусные корчи» в дозах 0.1 и 10 мг/кг проявляет высокую анальгетическую активность, блокируя развитие болевого эффекта, вызванного введением уксусной кислоты.
Таблица 2. Анальгетическая активность предлагаемого агента 1
(мг/кг)
(кол-во)
а % УБР (угнетение болевой реакции) = 100% * (Кконтроль - Копыт) / Кконтроль,
*P < 0.5, **P < 0.01 по сравнению с контрольной группой, где P - критерий наличия статистически значимых различий сравниваемых данных.
Источники информации
1. Машковский М.Д. Лекарственные средства. Т. 1. М.: Медицина. 1993.
2. Сюбаев Р.Д., Машковский М.Д., Шварц Г.Я., Покрышкин В.И. Сравнительная фармакологическая активность современных нестероидных противовоспалительных препаратов. Хим.-фарм. журн. 1986. Т. 20. № 1. С. 33-39.
3. Справочник Видаль. Лекарственные препараты в России: Справочник. М.: АстраФармСервис. 2002. З-90.
4. Il'ina I.V., Volcho K.P., Korchagina D.V., Barkhash V.A., Salakhutdinov N.F. Helv. Chim. Acta. 2007. V. 90. № 2. P. 353-368.
5. Волчо К.П., Рогоза Л.Н., Салахутдинов Н.Ф., Толстиков А.Г., Толстиков Г.А. Препаративная химия терпеноидов. Часть 1. Бициклические монотерпеноиды. Новосибирск: ГУ Издательство СО РАН, 2006, 280 с.
6. Pershin GN (1971) Methods of experimental chemotherapy: practical guidance. 2nd edn, Medicina, Moscow
7. T.G. Tolstikova, A.V. Pavlova, E.A. Morozova, T.M. Khomenko, K.P. Volcho, N.F. Salakhutdinov, Lett. Drug Des. Discov., 2012, 9, 513.
8. M.V. Khvostov, S.A. Borisov, T.G. Tolstikova, A.V. Dushkin, B.D. Tsyrenova, Y.S. Chistyachenko, N.E. Polyakov, G.G. Dultseva, A.A. Onischuk, S.V. An'kov, Eur. J. Drug Metab. Ph., 2017, 42, 431.
9. Baishya G., Sarmah B., Hazarika N. Synlett 2013, 24(9), 1137-1141.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4,7-ДИМЕТИЛ-2-(2,4,5-ТРИМЕТОКСИФЕНИЛ)-3,4,4a,5,8,8a-ГЕКСАГИДРО-2H-4,8-ЭПОКСИХРОМЕН, ОБЛАДАЮЩИЙ АНАЛЬГЕЗИРУЮЩЕЙ АКТИВНОСТЬЮ | 2012 |
|
RU2477283C1 |
| 2-(4-ГИДРОКСИ-3-МЕТОКСИФЕНИЛ)-4,7-ДИМЕТИЛ-3,4,4а,5,8,8а-ГЕКСАГИДРО-2Н-ХРОМЕН-4,8-ДИОЛ - НОВОЕ АНАЛЬГЕЗИРУЮЩЕЕ СРЕДСТВО | 2010 |
|
RU2430100C1 |
| ПРОИЗВОДНЫЕ 5,7-ДИМЕТИЛ-1,3-ДИАЗААДАМАНТАН-6-ОНА, СОДЕРЖАЩИЕ МОНОТЕРПЕНОВЫЙ ОСТАТОК, НОВЫЕ АНАЛЬГЕЗИРУЮЩИЕ СРЕДСТВА | 2014 |
|
RU2564446C1 |
| ЗАМЕЩЁННЫЕ ИЗОКСАЗОЛЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2733945C2 |
| Фармацевтические композиции Тиохроменола на основе гексагидро-гетероциклического соединения, обладающие анальгезирующим действием, и методы их использования у домашних и сельскохозяйственных животных | 2022 |
|
RU2812294C2 |
| 3-АРИЛ-4а-ИЗОПРОПИЛ-4аН-ХРОМЕНО[6',7':4,5]ФУРО[3,2-с][1,2]ОКСАЗИН-8-ОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ И АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2622768C1 |
| 2-(3-ГИДРОКСИ-4-МЕТОКСИФЕНИЛ)-4,7-ДИМЕТИЛ-3,4,4а,5,8,8а-ГЕКСАГИДРО-2Н-ХРОМЕН-4,8-ДИОЛ В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2013 |
|
RU2506079C1 |
| ПРОИЗВОДНЫЕ 2Н-ХРОМЕНА В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩИХ СРЕДСТВ | 2014 |
|
RU2555361C1 |
| Производные пиримидина - ингибиторы репродукции вирусов, относящихся к роду Orthoflavivirus | 2023 |
|
RU2831118C1 |
| ПРИМЕНЕНИЕ 4,7-ДИМЕТИЛ-2-(ПРОП-1-ЕНИЛ)-3,4,4a,5,8,8a-ГЕКСАГИДРО-2Н-ХРОМЕН-4,8-ДИОЛА В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2009 |
|
RU2418578C1 |
Изобретение относится к 4,7-диметил-3,4,4a,5,8,8a-гексагидроспиро[хромен-2,1'-циклогексан]-4,8-диолу общей формулы 1, включая его пространственные изомеры, в том числе оптически активные формы. Технический результат – получено новое соединение, которое может найти применение в медицине в качестве анальгезирующего средства. 2 табл., 4 пр.
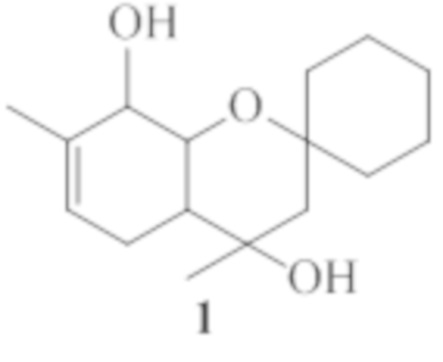
4,7-Диметил-3,4,4a,5,8,8a-гексагидроспиро[хромен-2,1'-циклогексан]-4,8-диол общей формулы 1, включая его пространственные изомеры, в том числе оптически активные формы,
в качестве средства, обладающего анальгезирующей активностью.
| ЗАМЕЩЕННЫЕ ОКТАГИДРОХРОМЕНЫ В КАЧЕСТВЕ СРЕДСТВА ПРОТИВ ВИРУСА ГРИППА | 2017 |
|
RU2664728C1 |
| (Е)-4'-АРИЛ-7'-АРИЛМЕТИЛЕН-4',5',6',7'-ТЕТРАГИДРО-2'Н-СПИРО[ЦИКЛОАЛКАН -1,3'-ЦИКЛОПЕНТА[b]ПИРАН]-2'-ОНЫ, ПРОЯВЛЯЮЩИЕ АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2455300C2 |
| US 8487121 B2, 16.07.2013 | |||
| WO 2010045402 A1, 22.04.2010. | |||
Авторы
Даты
2020-02-11—Публикация
2019-11-13—Подача