ОБЛАСТЬ ТЕХНИКИ
[0001]
Настоящее изобретение относится к пептиду, полученному из GPC3, более конкретно, к иммуногенному пептиду для презентации антигена для Т-клетки посредством связывания с человеческим лейкоцитарным антигеном, фармацевтической композиции для лечения или предотвращения рака с его использованием, индуктору иммунитета, способу получения антиген-презентирующей клетки и тому подобное.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002]
Хотя считается, что раковые клетки всегда случайно появляются в живом организме, была выдвинута гипотеза, что обычно происходит реакция природного иммунитета для устранения специфического ракового антигена, полученного из раковых клеток, и что в этом случае индуцируется специфический иммунный ответ, вызывающий реакцию удаления раковых клеток лимфоцитами и другими клетками.
[0003]
Для распознавания антигена раковых клеток требуется образование комплекса человеческим лейкоцитарным антигеном (HLA), присутствующим на поверхности клетки и лимфоцита. Молекула HLA как основной антиген гистосовместимости делится примерно на молекулы I класса (тип HLA A, B и C) и молекулы класса II (типы HLA DP, DQ и DR). Реакция элиминирования раковой клетки цитотоксической Т-клеткой (CTL) индуцируется специфическим распознаванием ракового антигена (CTL-эпитопа), состоящего из 8-11 аминокислот, которые представлены молекулой HLA класса I на поверхности раковой клетки T-клеточным антигенным рецептором (TCR) на CTL.
[0004]
В настоящее время проводится поиск иммуногенных пептидов с целью их применения для лечения или предупреждения различных заболеваний, связанных с иммунной системой; например, в выложенном патенте Японии № 08-151396 описано, что олигопептид, состоящий из определенной аминокислотной последовательности, обладает способностью связываться с HLA.
Список литературы
Патентная литература
[0005]
Патентная литература 1: выложенный патент Японии № 08-151396
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая задача
[0006]
Известны много пептидов, обладающих HLA-связывающей способностью; однако все еще существует потребность в пептидах, которые могут быть использованы для лечения или предотвращения различных видов рака. Поскольку ген HLA богат полиморфизмом, существует также потребность в многотипных иммуногенных пептидах, каждый из которых адаптируется к множеству типов HLA.
Решение задачи
[0007]
Ввиду вышеописанных обстоятельств объектом настоящего изобретения является иммуногенный пептид, способный связываться с молекулой HLA класса I, в частности, пептид, способный индуцировать CTL, фармацевтическая композиция для лечения или профилактики рака с использованием пептида, индуктор иммунитета и способ получения антиген-презентирующей клетки.
[0008]
В частности, настоящее изобретение включает в себя следующие изобретения.
(1) Пептид, содержащий 8 или более последовательных аминокислотных остатков в аминокислотной последовательности любой из SEQ ID NOS: 1-11 и состоящий из 11 или менее аминокислотных остатков.
(2) Пептид в соответствии с (1), где в аминокислотной последовательности 1 или несколько аминокислот замещены, вставлены, удалены или добавлены, и пептид обладает иммуногенностью.
(3) Пептид в соответствии с (2), где в аминокислотной последовательности, аминокислота в положении 2 заменена на тирозин, фенилаланин, метионин, триптофан, валин, лейцин или глутамин, и/или аминокислота на С-конце заменена на фенилаланин, лейцин, изолейцин, триптофан, метионин или валин.
(4) Фармацевтическая композиция для лечения или предотвращения рака, содержащая пептид в соответствии с любым из (1)-(3).
(5) Фармацевтическая композиция в соответствии с (4), где композиция представлена в виде вакцины.
(6) Фармацевтическая композиция в соответствии с (4) или (5), где пептид может связываться с одним или более типами молекул HLA.
(7) Индуктор иммунитета, содержащий пептид в соответствии с любым из (1)-(3).
(8) Индуктор иммунитета в соответствии с (7), где индуктор предназначен для индуцирования цитотоксической Т-клетки.
(9) Индуктор иммунитета в соответствии с (7) или (8), где пептид может связываться с одним или более типами молекул HLA.
(10) Способ получения антиген-презентирующей клетки, обладающей CTL-индуцирующей активностью, включающий стадию контактирования пептида в соответствии с любым из (1)-(3) с антиген-презентирующей клеткой in vitro.
Положительные эффекты изобретения
[0009]
В последние годы в качестве метода лечения рака привлекает внимание иммунотерапия. Ожидается, что пептид по настоящему изобретению может быть использован в качестве противораковой вакцины из-за его высокой способности связываться с HLA, а также в связи с его высокой способностью индуцировать CTL. Также предполагается его применение в различных иммунотерапиях, особенно в терапии дендритной клеткой.
[0010]
Глипикан-3 (GPC3) представляет собой белок, относящийся к семейству глипиканов. Глипикан является одним из протеогликанов и, как известно, связывается с гликозил-фосфатидилинозитолом на поверхности клетки. Глипикан контролирует активность различных факторов роста клеток, включая Wnts, и полагают что действие связано с ускорением или ингибированием взаимодействий между факторами роста клеток и рецепторами глипиканом. В частности, было обнаружено, что GPC3 экспрессируется почти во всех случаях гепатоцеллюлярной карциномы (HCC), а с другой стороны, едва выражен в нормальной печени, циррозе печени и т. д. Кроме того, известно, что GPC3 высоко экспрессируется не только при гепатоцеллюлярной карциноме, но также в меланоме, раке яичников и т. д.
1. «Glypican-3: a marker and a therapeutic target in hepatocellular carcinoma». Jorge Filmus and Mariana Capurro, FEBS J., 280: 2471-2476, 2013.
2. «Glypican-3: a new target for cancer immunotherapy». Mitchell Ho and Heungnam Kim, Eur. J. Cancer, 47, 333-338, 2011.
[0011]
В случае гепатоцеллюлярной карциномы ранее были проведены клинические исследования противораковой вакцины с пептидом, полученным из GPC3, который высоко экспрессируется в клетках гепатоцеллюлярной карциномы, и сообщалось о безопасности и способности индуцировать иммунитет.
3. «Peptide vaccines for hepatocellular carcinoma». Daisuke Nobuoka, Toshiaki Yoshikawa, Yu Sawada, Toshiyoshi Fujiwara and Tetsuya Nakatsura, Human Vaccines & Immunotherapeutics, 9, 210-212, 2013.
4. «Phase I Trial of a Глипикан-3-Производному пептиду Vaccine for Advanced Hepatocellular Carcinoma: Immunologic Evidence and Potential of Improving Overall Survival». Yu Sawada, et.al., Clin. Cancer. Res., 18, 3636-3696, 2012.
[0012]
В настоящем изобретении было идентифицировано несколько пептидов, каждый из которых представляет собой пептид, полученный из GPC3, отличный от любого из пептидов, зарегистрированных в клинических исследованиях, и который связывается с молекулой HLA и обладает способностью индуцировать иммунитет. В числе пептидов по настоящему изобретению конкретный пептид может связываться с множеством типов HLA. Таким образом, пептид по настоящему изобретению позволяет, например, обеспечить терапию противораковой вакциной и дендритной клеткой, охватывающую чрезвычайно широкий круг больных раком.
Краткое описание чертежей
[0013]
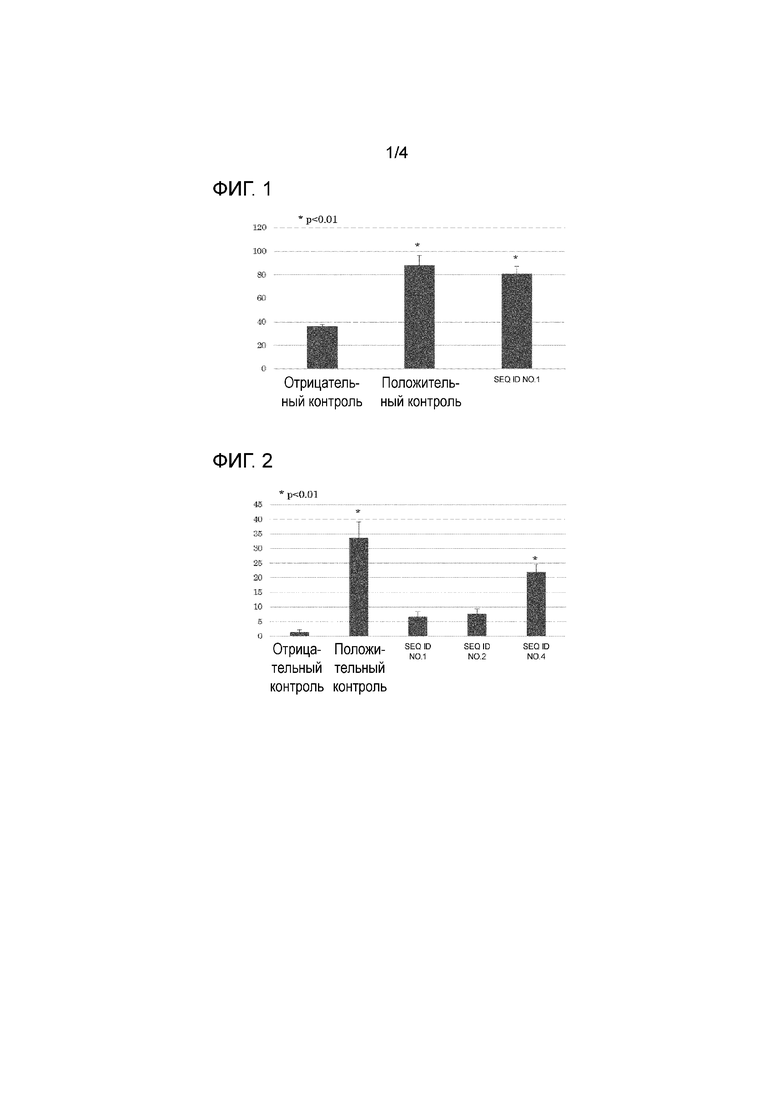
[Фигура 1] На фигуре 1 представлен график, показывающий результаты анализа ELISPOT (количество IFN-γ-продуцирующих клеток), когда образцы, полученные от пациентов [0] (тип HLA: 24: 02/24:02), получавших терапию дендритными клетками HSP70, были стимулированы пептидом SEQ ID NO: 1.
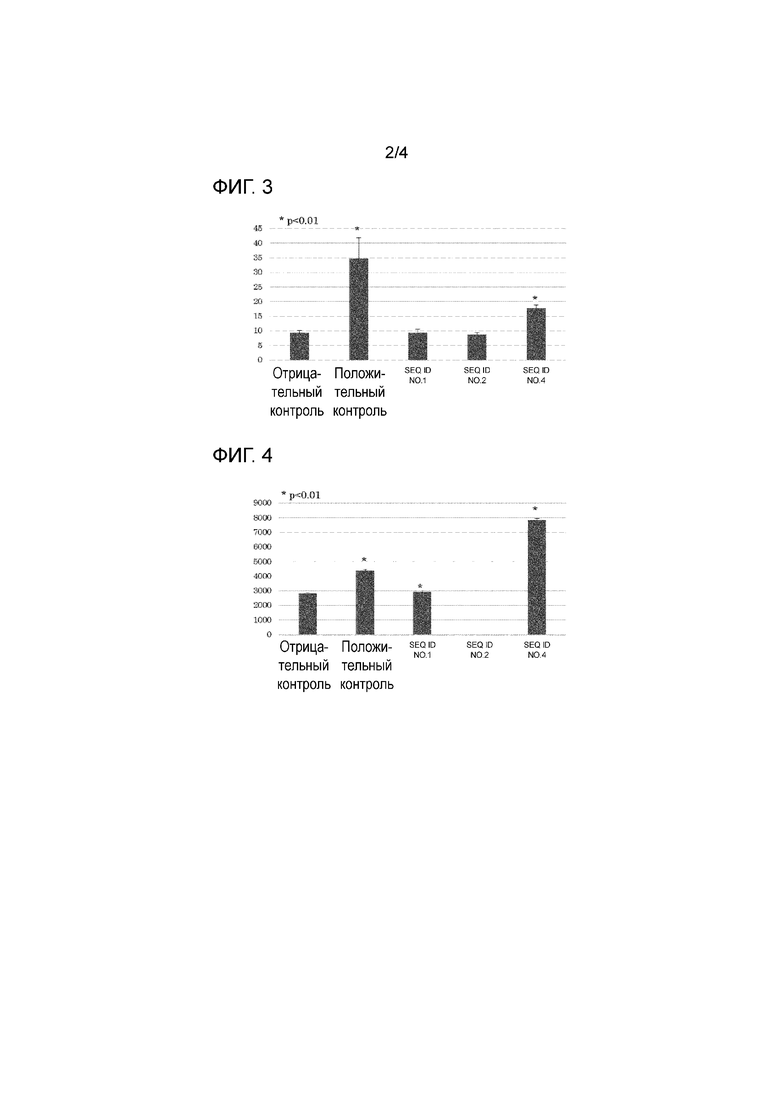
[Фигура 2] На фигуре 2 представлен график, показывающий результаты анализа ELISPOT (количество IFN-γ-продуцирующих клеток), когда образцы, полученные от пациентов (тип HLA: 02: 01/24:02), получавших терапию дендритными клетками HSP70, были стимулированы пептидом SEQ ID NO: 1, 2 или 4.
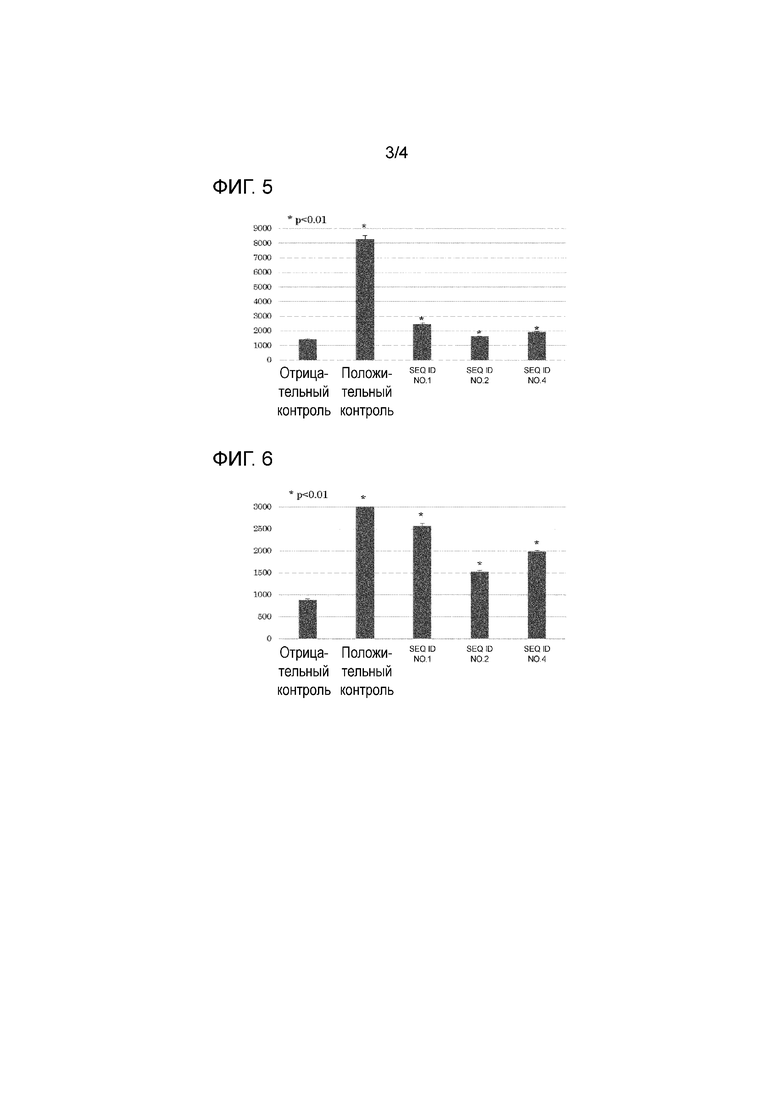
[Фигура 3] На фигуре 3 представлен график, показывающий результаты анализа ELISPOT (количество IFN-γ-продуцирующих клеток), когда образцы, полученные от пациентов (тип HLA: 02: 01/33:03), получавших терапию дендритными клетками HSP70, были стимулированы пептидом SEQ ID NO: 1, 2 или 4.
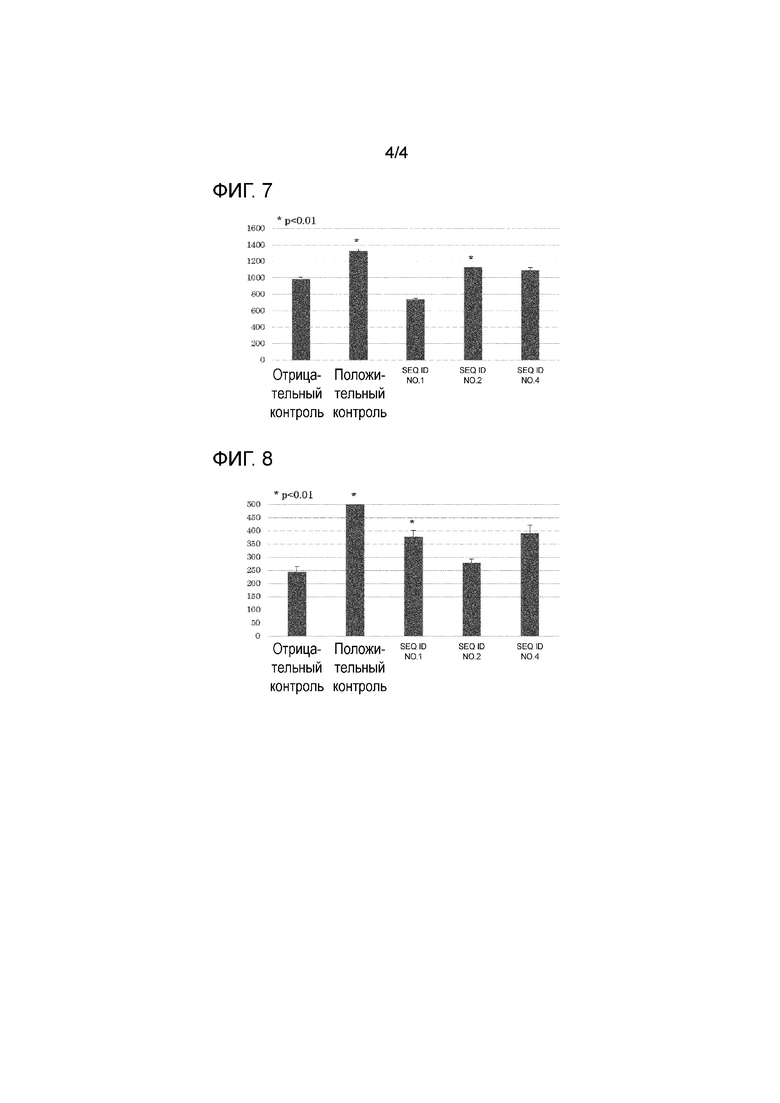
[Фигура 4] На фигуре 4 представлен график, показывающий результаты анализа ELISA (количество IFN-γ-продуцирующих клеток), когда образцы, полученные от пациентов (тип HLA: 24: 02/26:01), получавших терапию дендритными клетками HSP70, были стимулированы пептидом SEQ ID NO: 1, 2 или 4.
[Фигура 5] На фигуре 5 представлен график, показывающий результаты анализа ELISA (количество IFN-γ-продуцирующих клеток), когда образцы, полученные от пациентов (тип HLA: 24: 02/24:02), получавших терапию дендритными клетками HSP70, были стимулированы пептидом SEQ ID NO: 1, 2 или 4.
[Фигура 6] На фигуре 6 представлен график, показывающий результаты анализа ELISA (количество IFN-γ-продуцирующих клеток), когда образцы, полученные от пациентов (тип HLA: 11: 01/24:02), получавших терапию дендритными клетками HSP70, были стимулированы пептидом SEQ ID NO: 1, 2 или 4.
[Фигура 7] На фигуре 7 представлен график, показывающий результаты анализа ELISA (количество IFN-γ-продуцирующих клеток), когда образцы, полученные от пациентов (тип HLA: 02: 01/24:02), получавших терапию дендритными клетками HSP70, были стимулированы пептидом SEQ ID NO: 1, 2 или 4.
[Фигура 8] На фигуре 8 представлен график, показывающий результаты анализа ELISA (количество IFN-γ-продуцирующих клеток), когда образцы, полученные от пациентов (тип HLA: 02: 01/33:03), получавших терапию дендритными клетками HSP70, были стимулированы пептидом SEQ ID NO: 1, 2 или 4.
Описание вариантов осуществления
[0014]
1. Иммуногенный пептид
Пептиды по настоящему изобретению, каждый, представляют собой пептид, содержащий 8 или более последовательных аминокислотных остатков в аминокислотной последовательности любой из SEQ ID NO: 1-11 и состоящий из 11 или менее, предпочтительно, 10 или менее, более предпочтительно, 9 или менее аминокислотных остатков всего. Пептид по настоящему изобретению может представлять собой пептид, состоящий из аминокислотной последовательности любой из SEQ ID NO: 1-11. Пептид по настоящему изобретению получают из GPC3, который является одним из глипиканов. Была выбрана аминокислотная последовательность, у которой связывающая способность к молекуле HLA составляет 3 или более в терминах значения -log Kd, и связывающая способность в настоящем документе была прогнозирована согласно гипотезе, полученной с использованием метода активного экспериментального обучения (выложенный японский патент № 08-151396) на основе аминокислотной последовательности, составляющей GPC3.
[0015]
Аминокислотная последовательность, составляющая каждый пептид по настоящему изобретению, и его оценка результата прогнозирования HLA-связывания показаны в таблице 1 ниже.
[Таблица 1]
(SEQ ID NO: 1)
(SEQ ID NO: 2)
(SEQ ID NO: 3)
(SEQ ID NO: 4)
(SEQ ID NO: 5)
(SEQ ID NO: 6)
(SEQ ID NO: 7)
(SEQ ID NO: 8)
(SEQ ID NO: 9)
(SEQ ID NO: 10)
(SEQ ID NO: 11)
[0016]
Пептид по настоящему изобретению обладает способностью связываться с HLA и обладает иммуногенностью (в дальнейшем иногда называется просто «пептид HLA» или «иммуногенный пептид»). Используемый здесь термин «иммуногенность» означает способность индуцировать иммунный ответ и, например, средство, обладающее индуцирующую CTL активностью и, следовательно, имеющее цитотоксическую активность против раковых клеток.
[0017]
В предпочтительном варианте осуществления пептид по настоящему изобретению представляет собой многоатомный HLA-пептид, способный связываться с множеством аллелотипов гена HLA-A. Например, пептид SEQ ID NO: 7 прочно связывается с продуктом гена HLA-A*24:02 (молекула HLA-A*24:02), продуктом гена HLA-A*02:01 (молекула HLA-A*02:01), и продуктом гена HLA-A*02:06 (молекула HLA-A*02:06) и обладает высокой иммуногенностью.
[0018]
Подтип HLA, с которым может связываться пептид по настоящему изобретению, не ограничивается HLA-A*24:02, HLA-A*02:01 или HLA-A*02:06. Однако эти подтипы HLA покрывают порядка 85% жителей востока, включая японцев, и порядка 55% жителей запада; таким образом, полагают, что мульти-HLA-пептид по настоящему изобретению достигает широкого охвата пациентов, например, при иммунотерапии.
[0019]
Пептид по настоящему изобретению может быть модифицирован по аминокислотным остаткам, составляющих аминокислотную последовательность любой из SEQ ID NO: 1-11 или ее части, если он сохраняет иммуногенность. Аминокислотная последовательность каждой из SEQ ID NO: 1-11 предполагает состояние, которое представлено в антиген-презентирующей клетке; однако, когда пептид по настоящему изобретению непосредственно вводится в организм, пептид иногда испытывает изменения, такие как деструкцию его конца в органах пищеварения и тому подобное, в зависимости от пути введения. Таким образом, перед включением в антиген-презентирующую клетку пептид по настоящему изобретению может быть представлен в виде предшественника, который образуется путем добавления одного или нескольких аминокислотных остатков или тому подобное в N-конец и/или С-конец таким образом, чтобы аминокислотная последовательность любой из SEQ ID NO: 1-11 сохранялась при связывании с заранее определенной молекулой HLA класса I в антиген-презентирующей клетке.
[0020]
Кроме того, пептид по настоящему изобретению может иметь 1 или несколько аминокислотных остатков, составляющих пептид по настоящему изобретению, замещенные, вставленные, удаленные или добавленные и/или имеющие модификации, такие как добавление сахарной цепи, окисление боковой цепи и/или фосфорилирование, если пептид обладает желаемой иммуногенностью.
Термин «аминокислота» в настоящем документе используется в самом полном смысле этого слова и включает в себя варианты и производные искусственных аминокислот в дополнение к природным аминокислотам. Примерами аминокислот в настоящем документе являются природные белковые L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как аминокислотные варианты и производные; природные небелковые аминокислоты, такие как норлейцин, β-аланин и орнитин; и химически синтезированные соединения, обладающие свойствами, известными в данной области, характерными для аминокислот. Примеры неприродной аминокислоты включают α-метил аминокислоты (например, α-метилаланин), D-аминокислоты, гистидиноподобные аминокислоты (например, β-гидроксигистидин, гомогистидин, α-фторметилгистидина и α-метилгистидин), аминокислоты, имеющие дополнительный метилен на боковой цепи («гомо» аминокислоты) и аминокислоты, в каждой из которых функциональная группа карбоновой кислоты на боковой цепи замещена группой сульфоновой кислоты (например, цистеиновая кислота).
[0021]
В случае замещения аминокислотного остатка и тому подобное с учетом регулярности пептидной последовательности, имеющей связывающую способность в отношении HLA (J. Immunol., 152: p3913, 1994; Immunogenetics, 41: p178, 1995; J. Immunol., 155: p4307, 1994), специалисты в данной области техники могут правильно заменить аминокислотный остаток в качестве компонента пептида по настоящему изобретению.
[0022]
Более конкретно, в случае пептидного связывания с молекулой HLA-A*24:02 аминокислота в положении 2 пептида может быть заменена тирозином, фенилаланином, метионином или триптофаном, и/или С-концевая аминокислота может быть заменена фенилаланином, лейцином, изолейцином, триптофаном или метионином. В случае пептидного связывания с молекулой HLA-A*02:01 аминокислота в положении 2 может быть заменена лейцином или метионином, и/или С-концевая аминокислота может быть заменена валином или лейцином. Кроме того, в случае пептидного связывания с молекулой HLA-A*02:06 аминокислота в положении 2 может быть заменена валином или глутамином, и/или С-концевая аминокислота может быть заменена валином или лейцином.
[0023]
Каждый пептид по настоящему изобретению может быть получен с использованием методов, известных специалистам в данной области. Например, он может быть искусственно синтезирован твердофазным методом, таким как метод Fmoc или tBoc-метод, или жидкофазным методом. Желаемый пептид также может быть получен путем экспрессии полинуклеотида, кодирующего пептид по настоящему изобретению, или рекомбинантного вектора, содержащего полинуклеотид. Полученные таким образом пептиды могут быть идентифицированы с использованием методов, известных специалистам в данной области. Например, его можно идентифицировать с использованием метода деградации Эдмана или метода масс-спектрометрии.
[0024]
2. Фармацевтическая композиция
Фармацевтическая композиция для лечения или предотвращения рака в соответствии с настоящим изобретением содержит в качестве активного ингредиента, например, пептид, содержащий 8 или более последовательных аминокислотных остатков в одной или нескольких аминокислотных последовательностях, выбранных из группы, включающей SEQ ID NO: 1-11 и состоящих всего из 11 или менее, предпочтительно, 10 или менее, более предпочтительно, 9 или менее аминокислотных остатков. Пептид, содержащийся в фармацевтической композиции, может представлять собой пептид, состоящий из аминокислотной последовательности любой из SEQ ID NO: 1-11. Пептид является таким, как определено выше.
[0025]
Пептид по настоящему изобретению индуцирует CTL, предоставляя его на антиген-презентирующую клетку, и индуцированный CTL поражает раковую клетку. Таким образом, активный ингредиент фармацевтической композиции по настоящему изобретению не ограничивается пептидом по настоящему изобретению, а может представлять собой компонент, способный прямо или косвенно индуцировать CTL, например, полинуклеотид, кодирующий пептид, или вектор, содержащий полинуклеотид, или антиген-презентирующую клетку, предоставляющую комплекс пептида и молекулы HLA на поверхность, или экзосому, секретируемую из антиген-презентирующей клетки, или их комбинацию. Примеры используемой антиген-презентирующей клетки включают макрофаг и дендритную клетку, однако предпочтительно использовать дендритную клетку, которая обладает высокой способностью индуцировать CTL. В фармацевтической композиции по настоящему изобретению может содержаться любой из других ингредиентов, которые, как известно, используются для лечения рака, такой как хемокин, цитокин, фактор некроза опухоли и химиотерапевтический агент. Доза пептида, когда пациент является взрослым, может составлять, например, от 1 до 10 мг в день. Однако доза варьирует в зависимости от возраста и массы тела пациента, способа введения и тому подобного и, таким образом, надлежащим образом определяется специалистами в данной области.
[0026]
Предполагается, что фармацевтическая композиция по настоящему изобретению может быть использована для уничтожения раковых клеток, например, но не ограничиваясь этим, в соответствии со следующим механизмом действия. Введение фармацевтической композиции по настоящему изобретению конкретному пациенту с раком приводит к тому, что пептид в фармацевтической композиции представлен в состоянии, в котором он связан с молекулой HLA на поверхности антиген-презентирующей клетки. При распознавании пептида в такой антиген-презентирующей клетке CTL активируется, пролиферируется и циркулирует в системном кровотоке. Когда пептид-специфический CTL проникает в раковую ткань, он распознает тот же пептид, полученный из специфического ракового антигена, естественно связывающегося с молекулой HLA, присутствующей на поверхности раковых клеток, для уничтожения раковой клетки. Такое действие способствует лечению рака.
[0027]
Фармацевтическая композиция по настоящему изобретению может использоваться не только для лечения рака, но также для предотвращения рака. Например, введение фармацевтической композиции по настоящему изобретению в здоровый организм человека индуцирует CTL, и индуцированные цитотоксические Т-клетки остаются в организме и, таким образом, при возникновении конкретной раковой клетки могут повреждать эту раковую клетку. Аналогичным образом, композицию можно вводить в организм человека после лечения рака, чтобы предотвратить рецидив рака.
[0028]
Любой рак, экспрессирующий GPC3, рассматривается как рак, подлежащий лечению или предотвращению. Более конкретные примеры рака, представляющие интерес, включают, но не предназначены для ограничения, гепатоцеллюлярный рак, кожный рак, такой как меланома и рак яичников. Например, поскольку GPC3, из которого получен пептид по настоящему изобретению, сверхэкспрессируется при гепатоцеллюлярном раке, полагают, что пептид по настоящему изобретению эффективен, в частности, при лечении или предотвращении гепатоцеллюлярного рака. Когда присутствует множество видов рака, подлежащих лечению или предотвращению, в фармацевтическую композицию по настоящему изобретению может быть включено множество активных ингредиентов, включая иммуногенный пептид.
[0029]
Фармацевтическая композиция по настоящему изобретению может быть растворена в водном растворителе, представлена в виде фармацевтически приемлемой соли и введена пациентам. Примеры вида такой фармацевтически приемлемой соли включают форму, забуференную физиологическим PH в виде физиологически приемлемой водорастворимой соли, например, соли натрия, калия, магния или кальция. Помимо водорастворимого растворителя также может быть использован растворитель, не растворимый в воде; примеры такого нерастворимого в воде растворителя включают спирты, такие как этанол и пропиленгликоль.
[0030]
Препарат, содержащий фармацевтическую композицию по настоящему варианту осуществления, может содержать агенты для различных целей; примеры таких агентов включают консервант и буферный агент. Примеры консерванта включают бисульфит натрия, бисульфат натрия, тиосульфат натрия, хлорид бензалкония, хлорбутанол, тимеросал, ацетат фенилртути, фенилртуть-нитрат, метилпарабен, поливиниловый спирт, фенилэтиловый спирт, аммиак, дитиотреитол и бета-меркаптоэтанол. Примеры буферного агента включают карбонат натрия, борат натрия, фосфат натрия, ацетат натрия и бикарбонат натрия. Эти агенты могут присутствовать в количестве, способном поддерживать рН системы в значении от 2 до 9, предпочтительно от 4 до 8.
[0031]
Лекарственная форма фармацевтической композиции по настоящему изобретению особо не ограничена; однако, когда она используется в виде вакцины, примеры ее лекарственной формы включают инъекции (внутримышечные, подкожные и внутрикожные), пероральные составы и препараты капель для носа. Когда фармацевтическая композиция по настоящему изобретению представлена в виде вакцины, это может быть смешанная коктейльная вакцина, содержащая множество активных ингредиентов. Например, такая вакцина может содержать любые два или более пептидов с SEQ ID NO: 1-11 или содержать множество активных ингредиентов в сочетании с другими активными ингредиентами.
[0032]
Вакцина по настоящему изобретению может представлять собой вакцину, содержащую инертный ингредиент, включающую ингредиент, который является ингредиентом, отличным от фармацевтической композиции, не имеет активности сам по себе и обладает эффектом дальнейшего усиления действия фармацевтической композиции в качестве вакцины. Примеры инертного ингредиента включают адъювант и токсоид. Примеры адъюванта включают, но не ограничиваются ими, вещества в виде осадков, такие как гидроксид алюминия, фосфат алюминия и фосфат кальция, а также в виде масел, такие как полный адъювант Фрейнда и неполный адъювант Фрейнда.
[0033]
Когда она представлена в виде вакцины, фармацевтическая композиция по настоящему изобретению предпочтительно вводится в организм путем инъекции или инфузии, такой как внутрикожное, подкожное или внутримышечное введение, или путем кожного введения или ингаляции через слизистую оболочку носа, глотки или тому подобное. Ее разовая доза может быть установлена в интервале между дозой, способной значительно индуцировать цитотоксические Т-клетки, и дозой, при которой поражаются значительное количество не раковых клеток.
[0034]
Фармацевтическая композиция по настоящему изобретению предназначена для не только для введения в организм человека, но и для экстракорпорального применения. Более конкретно, фармацевтическая композиция по настоящему изобретению может использоваться для стимуляции антиген-презентирующей клетки in vitro или ex vivo для увеличения ее индуцирующей CTL активности. Например, в случае, когда фармацевтическая композиция по настоящему изобретению используется в терапии дендритными клетками для лечения рака, композиция может быть введена в контакт с антиген-презентирующими клетками, такими как дендритные клетки, полученные от пациента, нуждающегося в лечении или предупреждении рака, заблаговременно, после чего следует введение антиген-презентирующих клеток пациенту, возвращая их в организм пациента. Пептид, содержащийся в фармацевтической композиции, можно вводить в антиген-презентирующую клетку, например, методом липофекции или методом инъекции. Когда при таком применении используют полинуклеотид, кодирующий пептид по настоящему изобретению, полинуклеотид можно вводить в антиген-презентирующую клетку с помощью методов, известных в данной области. Например, антиген-презентирующая клетка, полученная от пациента, может быть трансформирована in vitro с использованием интересующего полинуклеотида или вектора, кодирующего полинуклеотид, методом липофекции, способом электропорации, методом микроинъекции, методом слияния клеток, методом DEAE декстрана, кальций фосфатным методом или тому подобное.
[0035]
3. Индуктор иммунитета
Индуктор иммунитета в соответствии с настоящим изобретением содержит в качестве активного ингредиента, например, пептид, содержащий 8 или более последовательных аминокислотных остатков в одной или нескольких аминокислотных последовательностях, выбранных из группы, включающей SEQ ID NO: 1-11, и состоящих всего из 11 или менее, предпочтительно, 10 или менее, более предпочтительно, 9 или менее аминокислотных остатков. Пептид, содержащийся в индукторе иммунитета, может представлять собой пептид, состоящий из аминокислотной последовательности любой из SEQ ID NO: 1-11. Пептид является таким, как определено выше.
[0036]
Полагают, что пептид по настоящему изобретению индуцирует иммунитет, будучи представленным на антиген-презентирующей клетке. Таким образом, активный ингредиент индуктора иммунитета по настоящему изобретению не ограничивается пептидом по настоящему изобретению, а может представлять собой компонент, способный прямо или косвенно индуцировать иммунитет, например, полинуклеотид, кодирующий пептид по настоящему изобретению, или экспрессирующий вектор, содержащий пептид, или антиген-презентирующую клетку, предоставляющую комплекс пептида и молекулы HLA на поверхности, или экзосому, секретируемую из антиген-презентирующей клетки, или их комбинацию. Примеры используемой антиген-презентирующей клетки включают макрофаг и дендритную клетку; однако предпочтительно использовать дендритную клетку, которая обладает высокой способностью индуцировать CTL
[0037]
Индуктор иммунитета по настоящему изобретению предназначен не только для введения в организм человека, но и для экстракорпорального применения. Более конкретно, индуктор иммунитета по настоящему изобретению может использоваться для стимуляции антиген-презентирующей клетки in vitro или ex vivo для увеличения ее индуцирующей CTL активности. Например, в случае, когда индуктор иммунитета по настоящему изобретению используется в терапии дендритными клетками для лечения рака, композиция может быть введена в контакт с антиген-презентирующими клетками, такими как дендритные клетки, полученные от пациента, нуждающегося в лечении или предупреждении рака, заблаговременно, после чего следует введение антиген-презентирующих клеток пациенту, возвращая их в организм пациента. Пептид, содержащийся в индукторе иммунитета, можно вводить в антиген-презентирующую клетку, например, путем трансфекции через липосому (метод липофекции) или методом инъекции. Когда при таком применении используют полинуклеотид, кодирующий пептид по настоящему изобретению, полинуклеотид можно вводить в антиген-презентирующую клетку с помощью методов, известных в данной области. Например, антиген-презентирующая клетка, полученная от пациента, может быть трансформирована in vitro с использованием интересующего полинуклеотида или вектора, экспрессирующего полинуклеотид, методом липофекции, способом электропорации, методом микроинъекции, методом слияния клеток, методом DEAE декстрана, кальций фосфатным методом или тому подобное.
[0038]
Используемый в настоящем документе термин «индукция иммунитета» означает индуцирование иммунного ответа, например, увеличение индуцирующей CTL активности антиген-презентирующей клетки и дальнейшее увеличение цитотоксической активности CTL против раковой клетки. Используемый здесь термин «индуцирование CTL» означает индуцирование или пролиферирование CTL, специфически распознающих определенный антиген, или дифференцирование наивной Т-клетки в эффекторную клетку, обладающую способностью уничтожать клетку-мишень (цитотоксическая активность), такую как раковую клетку, и/или увеличение цитотоксической активности CTL путем предоставления пептида по настоящему изобретению на поверхность антиген-презентирующей клетки in vitro или in vivo. CTL-индуцирующую активность можно измерить, оценивая продукцию цитокинов (например, интерферона (ИФН)-γ)) с помощью CTL. Например, индуцирующую CTL активность можно измерить путем оценки увеличения цитокин-продуцирующих клеток, индуцированных из клеток-предшественников антиген-презентирующими клетками, таких как моноциты периферической крови, стимулированные пептидом по настоящему изобретению, с использованием известного высоко чувствительного иммуноанализа, такого как ELISPOT (фермент-связанный иммуноспецифический анализ) и ELISA (иммуноферментный анализ с ферментным связыванием). Цитотоксическую активность также можно измерить известным способом, таким как метод высвобождения 51Cr. Когда активность значительно увеличивается, например, на 5% или более, 10% или более, 20% или более, предпочтительно, 50% или более, по сравнению с контролем, иммунитет или CTL могут быть оценены как индуцированные.
[0039]
4. Способ получения антиген-презентирующей клетки
Способ получения антиген-презентирующей клетки в соответствии с настоящим изобретением включает стадию контактирования, например, пептида, содержащего 8 или более последовательных аминокислотных остатков в одной или нескольких аминокислотных последовательностях, выбранных из группы, состоящей из SEQ ID NO: 1-11, и состоящий из 11 или менее, предпочтительно 10 или менее, более предпочтительно, 9 или менее аминокислотных остатков в целом, с антиген-презентирующей клеткой in vitro. Пептид, используемый в способе получения по настоящему изобретению, может представлять собой пептид, состоящий из аминокислотной последовательности любой из SEQ ID NO: 1-11. Пептид является таким, как определено выше.
[0040]
Полагают, что пептид, используемый в способе получения по настоящему изобретению, связывается с молекулой HLA класса I на поверхности антиген-презентирующей клетки, представлен CTL в качестве антигенного пептида и, таким образом, индуцирует CTL-активность антиген-презентирующей клетки. Таким образом, компонент, который должен связаться с антиген-презентирующей клеткой, не ограничивается пептидом по настоящему изобретению и может представлять собой компонент, способный прямо или косвенно индуцировать CTL, например, полинуклеотид, кодирующий пептид, или вектор, содержащий полинуклеотид, или антиген-презентирующую клетку, предоставляющую комплекс пептида и молекулы HLA на поверхность, или экзосому, секретируемую из антиген-презентирующей клетки, или их комбинацию. Примеры используемой антиген-презентирующей клетки включают макрофаг и дендритную клетку; однако предпочтительно использовать дендритную клетку, которая обладает высокой способностью индуцировать CTL.
[0041]
Предполагается, что антиген-презентирующая клетка, полученная способом по настоящему изобретению, используется не только в качестве активного ингредиента фармацевтической композиции или индуктора иммунитета, но также используется для иммунотерапии и тому подобное. Например, в случае, когда полученные антиген-презентирующие клетки используются в терапии дендритными клетками для лечения рака, клетки могут контактировать с антиген-презентирующими клетками, такими как дендритные клетки, обладающие низкой способностью к CTL-индуцированию, полученные от пациента, при необходимости индукции иммунитета, заранее, с последующим введением антиген-презентирующих клеток пациенту, возвращая их в организм пациента.
Пептид по настоящему изобретению может быть введен в антиген-презентирующую клетку, например, путем трансфекции через липосому (метод липофекции) или методом инъекции. Когда при таком применении используют полинуклеотид, кодирующий пептид по настоящему изобретению, полинуклеотид можно вводить в антиген-презентирующую клетку с помощью методов, известных в данной области. Например, антиген-презентирующая клетка, полученная от пациента, может быть трансформирована in vitro с использованием интересующего полинуклеотида или вектора, экспрессирующего полинуклеотид, методом липофекции, способом электропорации, методом микроинъекции, методом слияния клеток, методом DEAE декстрана, кальций фосфатным методом или тому подобное.
Пример 1
[0042]
Настоящее изобретение более конкретно описано далее со ссылкой на примеры. Однако они не предназначены для ограничения настоящего изобретения.
[0043]
В частности, способы прогнозирования, эксперимент и оценка в данном примере были выполнены на основе активного обучающего экспериментального дизайна, описанного в международной публикации № WO 2006/004182. Порядок был выстроен путем повторения следующих шагов в целом.
[0044]
(1) Обучающий алгоритм низкого ранга, который описан далее, был опробован. То есть, было генерировано множество гипотез на основе случайной перевыборки из накопленных данных, и выбрана точка, в которой колебания предсказанных значений случайно сформированных кандидатных элементов запроса (пептидов) является наибольшей в качестве элемента запроса для проведения эксперимента.
[0045]
(2) Пептид в выбранной точке запроса получают способами синтеза и очистки, которые описаны ниже. Фактическая связывающая способность определяется путем эксперимента, который описан ниже и добавлен к накопленным данным.
[0046]
Осуществление такого активного обучающего метода может уменьшить количество экспериментов по связыванию, которые в противном случае были бы необходимы для выполнения по всем 5 сотням миллиардов (=209) или более возможных кандидатных веществ HLA-связывающих пептидов, состоящих из 9 аминокислотных остатков.
[0047]
Используя порядок, описанный выше, были взяты аминокислотные последовательности SEQ ID NO: 1-11.
[0048]
<Синтез и очистка пептида>
Пептиды с аминокислотными последовательностями SEQ ID NO: 1-11 были вручную синтезированы твердофазным методом Меррифилда, используя аминокислоты Fmoc. У полученных последовательностей удаляли защиту и затем подвергали очистке методом ВЭЖХ с обращенной фазой, используя колонку С18, до чистоты 95% или выше. Идентификацию пептидов и подтверждение их чистоты проводили масс-спектрометрией MALDI-TOF (AB SCIEX MALDI-TOF/TOF5800). Количественное определение пептида проводили методом Micro BCA (Thermo Scientific Co., Ltd.), используя BSA в качестве стандартного белка.
[0049]
<Эксперимент по связыванию пептида с молекулой HLA-A*24:02>
Способность каждого пептида связываться с молекулой HLA-A*24:02 в виде продукта гена HLA-A*24:02 определяли, используя клетки C1R-A24, экспрессирующие молекулу HLA-A*24:02 (клетки, полученные профессором Масафуми Такегути, Университет Кумамото, были предоставлены Assoc с его позволения).
[0050]
Сначала клетки C1R-A24 подвергали воздействию кислых условий при рН 3,3 в течение 30 секунд для диссоциации и удаления эндогенных пептидов, которые первоначально были связаны с молекулой HLA-A*24:02, и легкой цепи, β2m, которая обычно связана с молекулами HLA класса I. После нейтрализации очищенную β2m добавляли к клеткам C1R-A24, которые затем добавляли к сериям разведения пептида. Затем эти смеси, каждую, инкубировали на льду в течение 4 часов. 3-молекулярный агрегат (MHC-pep), состоящий из молекулы HLA-A*24:02, пептида и β2m, которые вновь соединялись в процессе инкубирования, окрашивали флуоресцентно меченным моноклональным антителом, 17А12, распознающим этот агрегат.
[0051]
Затем количественно определяли число клеток MHC-pep на клетку C1R-A24 (которое пропорционально интенсивности флуоресценции вышеуказанного флуоресцентного антитела), используя анализатор флуоресцентных клеток FACScan (Becton, Dickinson and Company). Константу диссоциации связывания, величину Kd, между молекулой HLA-A*24:02 и пептидом рассчитывали по средней интенсивности флуоресценции на клетку, используя способ, опубликованный автором настоящего изобретения в статье (Udaka et al., Immunogenetics, 51, 816-828, 2000).
[0052]
<Эксперимент по связыванию пептида с молекулой HLA-A*02:01>
Способность каждого пептида связываться с молекулой HLA-A*24:01 в виде продукта гена HLA-A*24:01 определяли, используя клеточную линию, T2, (приобретенную от компании АТСС), экспрессирующую молекулу HLA-A*02:01.
[0053]
Клетки Т2 и очищенную β2m добавляли к сериям ступенчатого разведения пептида, связывающую способность которого измеряют, а затем инкубировали при температуре 37°С в течение 4 часов. Молекулу HLA-A*24:01, уровень экспрессии которой к этому моменту времени увеличивался в зависимости от концентрации, окрашивали агрегат-специфическим моноклональным антителом, меченным флуоресцентной меткой, BB7.2.
[0054]
После этого измеряли количество флуоресценции на клетку, используя проточный цитометр, а константу диссоциации, значение Kd, рассчитывали, используя способ, опубликованный автором настоящего изобретения в статье (Udaka et al., Immunogenetics, 51, 816-828, 2000).
[0055]
<Эксперимент по связыванию пептида с молекулой HLA-A*02:06>
Cпособность каждого пептида связываться с молекулой HLA-A*24:06, продуктом гена HLA-A*24:06, измеряли, используя клетки RA2.6 (клеточная линия, недавно полученная в университете Kochi), в которых кДНК гена HLA-A*24:06 была введена в RMAS, клеточную линию мыши, дефицитную по TAP (транспортер, связанный с процессингом антигена).
[0056]
Сначала клетки RA2.6 культивировали в течение ночи при температуре 26°C для увеличения количества молекул HLA-A*24:06, не связанных с пептидом на поверхности клетки. Любую из серий разбавления пептида добавляли для связывания при температуре 26°C в течение 60 минут.
[0057]
Затем смесь культивировали при температуре 35°C в течение 4 часов, что приводило к денатурации пустой молекулы HLA-A*24:06, не связанной с пептидом, и к потере ее стерической структуры. Затем добавляли флуоресцентно меченное моноклональное антитело, BB7.2, специфически распознающее пептид, связанный с молекулой HLA-A*24:06, затем инкубировали на льду в течение 20 минут для окрашивания клеток.
[0058]
После этого измеряли количество флуоресценции на клетку, используя проточный цитометр, а константу диссоциации, значение Kd, рассчитывали, используя способ, опубликованный автором настоящего изобретения в статье (Udaka et al., Immunogenetics, 51, 816-828, 2000).
[0059]
<Результат оценки эксперимента по связыванию>
В результате были получены данные эксперимента по связыванию пептидов по настоящему изобретению с каждой молекулой HLA, как показано в следующей таблице.
[Таблица 2]
(SEQ ID NO: 2)
(SEQ ID NO:3)
(SEQ ID NO:4)
(SEQ ID NO: 5)
(SEQ ID NO:6)
(SEQ ID NO:7)
(SEQ ID NO: 8)
(SEQ ID NO:9)
(SEQ ID NO: 10)
(SEQ ID NO: 11)
[0060]
Аминокислотные последовательности SEQ ID NO 1-11 получают из полноразмерной последовательности заданного геномного белка GPC3, зарегистрированного в GENBANK (SEQ ID NO: 12) (>gi|4758462|ref|NP_004475.1| предшественник изоформы 2 глипикана-3 [Homo sapiens]).
[0061]
<Исследование индукции иммунитета пептидом>
(1) Получение пептид-стимулированной дендритной клетки
День 0-9 (индукция дендритной клетки)
Создающую адгезию на колбе для культуры клеточную фракцию моноцитов периферической крови, полученных путем плазмафереза у пациента [0], получавшего терапию дендритными клетками HSP70, культивировали в среде AIM-CM (торговое название «Gibco» от компании Thermo Fisher Scientific Co., Ltd.) при температуре 37°C в течение 10 дней. В процессе культивирования в среду в 0-ой день и 3-ий день добавляли 15 мкл IL-4 и 30 мкл гранулоцитарно-моноцитарного колониестимулирующего фактора (GM-CSF), а на 5-ый день добавляли 15 мкл IL-4, 30 мкл GM-CSF и 75 мкл фактора некроза опухоли (TNF).
[0062]
10-ый день (Стимуляция пептидом и выделение дендритной клетки)
Индуцированные дендритные клетки снова выделяли в среду AIM-CM, и добавляли каждый из пептидов по настоящему изобретению (SEQ ID NO:1-11) до 20 мкл/мл. Затем среду, содержащую дендритные клетки, культивировали при 37°С в течение 2 часов. В качестве положительных и отрицательных контролей использовали следующие пептиды.
Положительный контроль для HLA-A*24:02 (EBV LMP2, 419-427: TYGPVFMCL (SEQ ID NO: 13))
Отрицательный контроль для HLA-A*24:02 (HIV env gp160, 584-592: RYLRDQQLL (SEQ ID NO: 14))
Положительный контроль для HLA-A*02:01 (Flu A MP, 58-66: GILGFVFTL (SEQ ID NO: 15))
Отрицательный контроль для HLA-A*02:01 (HIV gap p17, 77-85: SLYNTVATL (SEQ ID NO: 16))
Положительный контроль для HLA-A*02:06 (EBV LMP2 453-461: LTAGFLIFL (SEQ ID NO: 17))
Отрицательный контроль для HLA-A*02:06 (HIV gap p24 341-349: ATLEEMMTA (SEQ ID NO: 18))
[0063]
Дендритные клетки выделяли, промывали 3 раза или более достаточным количеством среды AIM-CM и подсчитывали.
[0064]
(2) Получение клеток CD8T
День от 0 до 9
Не создающую адгезию на колбе для культуры свободную клеточную фракцию (включая лимфоциты) из периферических моноцитов крови, полученных путем плазмафереза у пациента, получавшего два или более раз вышеуказанную вакцину, культивировали в среде AIM-CM (от компании GIBCO Co., Ltd.) при температуре 37°C в течение 10 дней. В процессе культивирования в среду 4-ый день и 6-ой день добавляли 40 мкл IL-2.
[0065]
День 10
Используя набор «CD8 Negative Selection Kit» (от компании Miltenyi Biotec), клетки CD8T отделяли от среды и подсчитывали.
[0066]
(3) Сокультура
Дендритные клетки и клетки CD8T, полученные в (1) и (2) выше, сокультивировали в среде AIM при температуре 37°C в следующих условиях.
клетки CD8T: 5×105 клетки/лунка
Дендритные клетки: 2×105 клетки/лунка
[0067]
День 12 или 13
В вышеуказанную среду добавляли 0,4 мл/лунка среды AIM-CM, содержащей IL-2, в количестве 20 Ед/мл.
[0068]
(4) Анализ ELISPOT
День 17
Клетки CD8T добавляли к 96-луночному планшету для ELISPOT (от компании Millipore), покрытому анти-TFN-γ-моноклональными антителами (от компании Mabtech AB) до 2×104 клеток/лунка. Для каждого образца использовали 3 или более лунок. В каждую лунку добавляли 100 мкл AIM-V (торговой марки «Gibco» от компании Thermo Fisher Scientific Co., Ltd.). 96-луночный планшет для ELISPOT культивировали при температуре 37°C.
[0069]
День 18
В каждую лунку добавляли анти-TFN-γ-антитело, и затем подвергали взаимодействию с вторичным антителом, меченным ферментом HRP, для измерения количества IFN-γ-продуцирующих клеток по цветной реакции. Характерные результаты анализа ELISPOT для пациентов, у которых был 24:02/24:02 тип HLA, показаны на фигуре 1; для пациентов с 02:01/24:02 типом на фигуре 2; и для пациентов с 02:01/33:03 типом на фигуре 3. На каждой фигуре указано среднее из 3 результатов анализа.
[0070]
(5) Анализ ELISA
День 17
Супернатант культуры на 7-й день после сокультивирования Т-клеток с дендритными клетками, стимулированными каждым из вышеуказанных пептидов, разбавляли до 4 уровней ×1, ×5, ×25 и ×125 для определения степени разбавления, попадающей в пределы измерения с использованием набора IFN-γ ELISA MAX Deluxe Set (от компании BioLegend Inc.). После этого каждый образец измеряли 3 раза на идентифицируемом уровне разбавления. Характерные результаты анализа ELISA для пациентов, у которых был 24:02/26:01 тип HLA, для пациентов, у которых 24:02/24:02 тип HLA, для пациентов, у которых был 11:01/24:02 тип HLA, для пациентов, у которых был 02:01/24:02 тип HLA, и для пациентов, у которых был HLA 02:01/33:03 тип HLA, показаны на фигурах 4-8, соответственно.
[0071]
Настоящее изобретение было описано выше на основе примера. Этот пример является просто иллюстративным, и специалистам в данной области должно быть понятно, что его можно различным образом модифицировать, и что модификации также входят в объем настоящего изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CYTLIMIC INC.
<120> ПЕПТИД, ПОЛУЧЕННЫЙ ИЗ GPC3, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ РАКА С ЕГО ИСПОЛЬЗОВАНИЕМ, ИНДУКТОР ИММУНИТЕТА И СПОСОБ ПОЛУЧЕНИЯ АНТИГЕН-ПРЕЗЕНТИРУЮЩИХ КЛЕТОК
<130> PC53-9002WO
<150> JP2015-046463
<151> 2015-03-09
<160> 18
<170> Патент в версии 3.5
<210> 1
<211> 9
<212> PRT
<213> Homo sapiens
<400> 1
Met Val Asn Glu Leu Phe Asp Ser Leu
1 5
<210> 2
<211> 9
<212> PRT
<213> Homo sapiens
<400> 2
Leu Phe Asp Ser Leu Phe Pro Val Ile
1 5
<210> 3
<211> 9
<212> PRT
<213> Homo sapiens
<400> 3
Ser Ala Leu Asp Ile Asn Glu Cys Leu
1 5
<210> 4
<211> 9
<212> PRT
<213> Homo sapiens
<400> 4
Ser Leu Gln Val Thr Arg Ile Phe Leu
1 5
<210> 5
<211> 9
<212> PRT
<213> Homo sapiens
<400> 5
Ser Leu Thr Pro Gln Ala Phe Glu Phe
1 5
<210> 6
<211> 9
<212> PRT
<213> Homo sapiens
<400> 6
Gly Tyr Ile Cys Ser His Ser Pro Val
1 5
<210> 7
<211> 9
<212> PRT
<213> Homo sapiens
<400> 7
Ala Leu Asn Leu Gly Ile Glu Val Ile
1 5
<210> 8
<211> 9
<212> PRT
<213> Homo sapiens
<400> 8
Leu Leu Gln Ser Ala Ser Met Glu Leu
1 5
<210> 9
<211> 9
<212> PRT
<213> Homo sapiens
<400> 9
Lys Leu Thr Thr Thr Ile Gly Lys Leu
1 5
<210> 10
<211> 9
<212> PRT
<213> Homo sapiens
<400> 10
Gly Met Ile Lys Val Lys Asn Gln Leu
1 5
<210> 11
<211> 9
<212> PRT
<213> Homo sapiens
<400> 11
Ala Arg Leu Asn Met Glu Gln Leu Leu
1 5
<210> 12
<211> 580
<212> PRT
<213> Homo sapiens
<400> 12
Met Ala Gly Thr Val Arg Thr Ala Cys Leu Val Val Ala Met Leu Leu
1 5 10 15
Ser Leu Asp Phe Pro Gly Gln Ala Gln Pro Pro Pro Pro Pro Pro Asp
20 25 30
Ala Thr Cys His Gln Val Arg Ser Phe Phe Gln Arg Leu Gln Pro Gly
35 40 45
Leu Lys Trp Val Pro Glu Thr Pro Val Pro Gly Ser Asp Leu Gln Val
50 55 60
Cys Leu Pro Lys Gly Pro Thr Cys Cys Ser Arg Lys Met Glu Glu Lys
65 70 75 80
Tyr Gln Leu Thr Ala Arg Leu Asn Met Glu Gln Leu Leu Gln Ser Ala
85 90 95
Ser Met Glu Leu Lys Phe Leu Ile Ile Gln Asn Ala Ala Val Phe Gln
100 105 110
Glu Ala Phe Glu Ile Val Val Arg His Ala Lys Asn Tyr Thr Asn Ala
115 120 125
Met Phe Lys Asn Asn Tyr Pro Ser Leu Thr Pro Gln Ala Phe Glu Phe
130 135 140
Val Gly Glu Phe Phe Thr Asp Val Ser Leu Tyr Ile Leu Gly Ser Asp
145 150 155 160
Ile Asn Val Asp Asp Met Val Asn Glu Leu Phe Asp Ser Leu Phe Pro
165 170 175
Val Ile Tyr Thr Gln Leu Met Asn Pro Gly Leu Pro Asp Ser Ala Leu
180 185 190
Asp Ile Asn Glu Cys Leu Arg Gly Ala Arg Arg Asp Leu Lys Val Phe
195 200 205
Gly Asn Phe Pro Lys Leu Ile Met Thr Gln Val Ser Lys Ser Leu Gln
210 215 220
Val Thr Arg Ile Phe Leu Gln Ala Leu Asn Leu Gly Ile Glu Val Ile
225 230 235 240
Asn Thr Thr Asp His Leu Lys Phe Ser Lys Asp Cys Gly Arg Met Leu
245 250 255
Thr Arg Met Trp Tyr Cys Ser Tyr Cys Gln Gly Leu Met Met Val Lys
260 265 270
Pro Cys Gly Gly Tyr Cys Asn Val Val Met Gln Gly Cys Met Ala Gly
275 280 285
Val Val Glu Ile Asp Lys Tyr Trp Arg Glu Tyr Ile Leu Ser Leu Glu
290 295 300
Glu Leu Val Asn Gly Met Tyr Arg Ile Tyr Asp Met Glu Asn Val Leu
305 310 315 320
Leu Gly Leu Phe Ser Thr Ile His Asp Ser Ile Gln Tyr Val Gln Lys
325 330 335
Asn Ala Gly Lys Leu Thr Thr Thr Ile Gly Lys Leu Cys Ala His Ser
340 345 350
Gln Gln Arg Gln Tyr Arg Ser Ala Tyr Tyr Pro Glu Asp Leu Phe Ile
355 360 365
Asp Lys Lys Val Leu Lys Val Ala His Val Glu His Glu Glu Thr Leu
370 375 380
Ser Ser Arg Arg Arg Glu Leu Ile Gln Lys Leu Lys Ser Phe Ile Ser
385 390 395 400
Phe Tyr Ser Ala Leu Pro Gly Tyr Ile Cys Ser His Ser Pro Val Ala
405 410 415
Glu Asn Asp Thr Leu Cys Trp Asn Gly Gln Glu Leu Val Glu Arg Tyr
420 425 430
Ser Gln Lys Ala Ala Arg Asn Gly Met Lys Asn Gln Phe Asn Leu His
435 440 445
Glu Leu Lys Met Lys Gly Pro Glu Pro Val Val Ser Gln Ile Ile Asp
450 455 460
Lys Leu Lys His Ile Asn Gln Leu Leu Arg Thr Met Ser Met Pro Lys
465 470 475 480
Gly Arg Val Leu Asp Lys Asn Leu Asp Glu Glu Gly Phe Glu Ser Gly
485 490 495
Asp Cys Gly Asp Asp Glu Asp Glu Cys Ile Gly Gly Ser Gly Asp Gly
500 505 510
Met Ile Lys Val Lys Asn Gln Leu Arg Phe Leu Ala Glu Leu Ala Tyr
515 520 525
Asp Leu Asp Val Asp Asp Ala Pro Gly Asn Ser Gln Gln Ala Thr Pro
530 535 540
Lys Asp Asn Glu Ile Ser Thr Phe His Asn Leu Gly Asn Val His Ser
545 550 555 560
Pro Leu Lys Leu Leu Thr Ser Met Ala Ile Ser Val Val Cys Phe Phe
565 570 575
Phe Leu Val His
580
<210> 13
<211> 9
<212> PRT
<213> Вирус Эпштейна-Барра
<400> 13
Thr Tyr Gly Pro Val Phe Met Cys Leu
1 5
<210> 14
<211> 9
<212> PRT
<213> Вирус иммунодефицита человека
<400> 14
Arg Tyr Leu Arg Asp Gln Gln Leu Leu
1 5
<210> 15
<211> 9
<212> PRT
<213> Вирус гриппа A
<400> 15
Gly Ile Leu Gly Phe Val Phe Thr Leu
1 5
<210> 16
<211> 9
<212> PRT
<213> Вирус иммунодефицита человека
<400> 16
Ser Leu Tyr Asn Thr Val Ala Thr Leu
1 5
<210> 17
<211> 9
<212> PRT
<213> Вирус Эпштейна-Барра
<400> 17
Leu Thr Ala Gly Phe Leu Ile Phe Leu
1 5
<210> 18
<211> 9
<212> PRT
<213> Вирус иммунодефицита человека
<400> 18
Ala Thr Leu Glu Glu Met Met Thr Ala
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИННАЯ КОМПОЗИЦИЯ ПРОТИВ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2013 |
|
RU2721574C2 |
| ПЕПТИД, ПОЛУЧЕННЫЙ ИЗ FOXM1, И ВКЛЮЧАЮЩАЯ ЕГО ВАКЦИНА | 2016 |
|
RU2738418C2 |
| ПЕПТИД, ПОЛУЧЕННЫЙ ИЗ MPHOSPH1, И ВКЛЮЧАЮЩАЯ ЕГО ВАКЦИНА | 2016 |
|
RU2731099C2 |
| ИНДУКТОР ИММУНИТЕТА | 2016 |
|
RU2835947C2 |
| ИНДУКТОР ИММУНИТЕТА | 2016 |
|
RU2758112C2 |
| ИСКУССТВЕННЫЕ АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2763798C1 |
| HLA-A*1101-ОГРАНИЧЕННЫЙ ПЕПТИД WT1 И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2007 |
|
RU2481398C2 |
| ПЕПТИД, ПОЛУЧЕННЫЙ ИЗ DEPDC1, И СОДЕРЖАЩАЯ ЕГО ВАКЦИНА | 2016 |
|
RU2765574C2 |
| Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ | 2017 |
|
RU2775623C2 |
| Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ КОМПЛЕКСА ОПУХОЛЕВЫЙ АНТИГЕН NY-ESO-1/HLA-A*02 | 2016 |
|
RU2775394C2 |
Настоящее изобретение относится к области биотехнологии, конкретно к иммуногенным пептидам, и может быть использовано для получения антиген-презентирующей клетки, обладающей активностью в отношении индукции цитотоксической Т-клетки (CTL), нацеленной на GPC3-экспрессирующую раковую клетку. Изобретение позволяет эффективно индуцировать специфические CTL. 2 н. и 3 з.п. ф-лы, 8 ил., 2 табл., 1 пр.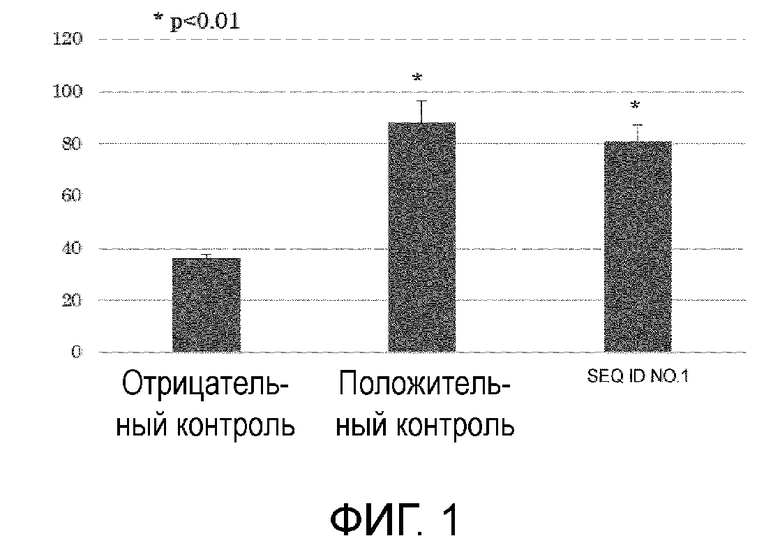
1. Пептид, способный индуцировать цитотоксическую Т-клетку (CTL), состоящий из аминокислотной последовательности согласно любой из SEQ ID NO: 1, 2 или 4.
2. Фармацевтическая композиция для лечения или предотвращения рака, содержащая пептид по п.1.
3. Фармацевтическая композиция по п.2, где композиция представлена в виде вакцины.
4. Фармацевтическая композиция по п.3, где пептид может связываться с одним или более типами молекул HLA.
5. Способ получения антиген-презентирующей клетки, обладающей CTL-индуцирующей активностью в отношении GPC3-экспрессирующей раковой клетки, включающей стадию контактирования пептида по п.1 с антиген-презентирующей клеткой in vitro.
| US 2013217122, 22.08.2013 | |||
| IWAMA, T | |||
| et al., Identification of an H2-Kb or H2-Db restricted and glypican-3-derived cytotoxic T-lymphocyte epitope peptide, INT | |||
| J | |||
| ONCOL., 2013, v.42, n | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| KOMORI H | |||
| et al., Identification of HLA-A2- or HLA-A24-restricted CTL epitopes possibly useful for glypican-3-specific immunotherapy of | |||
Авторы
Даты
2020-02-11—Публикация
2016-03-09—Подача