Изобретение относится к области химии биологически активных соединений и медицине, а именно к получению холиноблокирующих и противосудорожных лекарственных средств. Изобретение может быть использовано для профилактики и лечения интоксикаций, сопровождаемых развитием судорожного синдрома, в частности острых отравлений веществами с антихолинэстеразной активностью - карбаматами.
Генерализованные судороги развиваются при тяжелых интоксикациях нейротоксическими ядами. При этом, судорожный симптомокомплекс является характерным признаком острой фазы тяжелого отравления необратимыми ингибиторами холинэстераз - фосфорорганическими пестицидами (ФОС) и боевыми фосфорорганическими отравляющими веществами (ФОВ) [Куценко С.А., Бутомо Н.В., Гребенюк А.Н. и др. Военная токсикология, радиобиология и медицинская защита. / Спб.: ООО «Издательство ФОЛИАНТ», 2004. - 528 с.; Clinical neurotoxicology: syndromes, substances, environment. Ed. by M. Dobbs. - N-Y., Saunders Elsevier, 2009. - 691 р.]. Токсический судорожный синдром является также основным проявлением тяжелой формы отравления производными карбаминовой кислоты - карбаматами, которые в настоящее время широко используются в качестве пестицидов и лекарственных препаратов [Куценко С.А., Бутомо Н.В., Гребенюк А.Н. и др. Военная токсикология, радиобиология и медицинская защита. / Спб.: ООО «Издательство ФОЛИАНТ», 2004. - 528 с.]. Карбаматы обладают высокой и чрезвычайно высокой токсичностью, их основная биологическая активность заключается в способности обратимо ингибиторовать холинэстеразы, а как лекарственные препараты карбаматы характеризуются весьма узкой широтой терапевтического действия [Рамш С.М., Петров А.Н. Подходы к рациональному конструированию обратимых ингибиторов ацетилхолинэстеразы в качестве средств для лечения болезни Альцгеймера. - СПб.: СПХФА, 1999. - 98 с]. По причине высокой токсичности ряд производных карбаминовой кислоты в настоящее время рассматриваются в качестве потенциальных средств химического терроризма, что в случае их использования в этом качестве будет сопровождаться массовым отравлением населения с развитием судорог [Антонов Н.С. Химическое оружие на рубеже двух столетий - Прогресс, 1994. - 175 с.; Гладких В.Д., Назаров В.Б. Антидотная терапия острых отравлений антихолинэстеразными веществами // В кн.: Антидотная терапия отравлений высокотоксичными веществами в условиях чрезвычайных ситуаций. Руководство / под научн. ред. д.м.н., проф. В.Д. Гладких, д.м.н., проф. С.Х. Сарманаева, к.м.н., доц. Ю.Н. Остапенко / ФМБА России. - М.: Комментарий, 2014. - С. 123-143.]. Помимо патогенетически значимых проявлений в острой фазе интоксикации для судорожных состояний химического генеза характерны также тяжелые последствия перенесенной интоксикации с высокой вероятностью инвалидизации..
Выше изложенные аргументы определяют необходимость разработки эффективных средств купирования токсического судорожного синдрома с целью устранения угрозы жизни пострадавших, подвергшихся острой интоксикации, и последующей коррекции последствий отравления судорожными агентами.
Известно, что эффективными антидотами химических соединений с холиномиметической и антихолинэстеразной активностью являются холиноблокаторы, в том числе тропиновый эфир троповой кислоты - атропин (торговое название - сульфат атропина) [Flanagan R.J., Jone3s A.L. Antidotes. Taylor and Francis. London, 2002. - 326 p.; Профилактика, клиника, диагностика и лечение острых отравлений в войсках: Методические указания / научн. ред.: А.Н. Гребенюк и А.Е. Сосюкин. - М: ГВМУ МО РФ, 2010. - 352 с.]. Выступая как М-холинолитик, то есть мускариновый антагонист, атропин способен блокировать М-холинорецепторы и тем самым в условиях воздействия на организм антихолинэстеразных веществ защищать рецепторы от воздействия избыточных концентраций эндогенного ацетихолина, который образуется в результате утраты ингибированной ацетилхолинэстеразой своей ферментативной активности - принцип «физиологического противоядия».
Известно, что, являясь высокоафинными и селективными лигандами М2-холинорецепторов в центральной нервной системе и на периферии, выраженной М-холиноблокирующей активностью обладают также карбоксилаты N-метил-4-пиперидинола [Barlow В.В., Shepherd М.K. A search for selective antagonists at M2-muscarinic receptors // Br. J. Pharmacol. - 1985. -V. 85. - P. 427-435; Waelbroeck M. et al. Binding properties of nine 4-diphenyl-acetoxy-N-methyl-piperedine (4-DAMP) analogues to M1, M2, M3 and putative M4 muscarinic receptor subtypes // Br. J. Pharmacol. - 1985. - V. 105. - P. 97-102].
Особо следует отметить то обстоятельство, что противосудорожные эффекты большинства холиноблокаторов являются одним из компонентов спектра их фармакологической активности.
Во врачебной практике в качестве лекарственных препаратов, обладающих выраженной противосудорожной активностью, в настоящее время наиболее широко используют вальпроевую кислоту и ее производные. Так, известно применение вальпроевой кислоты и ее производных в качестве эффективных противосудорожных лекарственных средств при различных типах эпилептических судорог [Upmanyu N., Gupta S., Grover J., Mishra P. Synthesis of Valproic acid derivatives and their evaluation for anticonvulsant activity // The Internet Journal of Alternative Medicine. - 2008 - V. 7(1). - P. 1-6; Browne T.R. Valproic Acid // N. Engl. J. Med. - 1980. - V. 302. - P. 661-665); Ibrahim T.S. et al. Synthesis, anticonvulsant activity and cytotoxicity of novel Valproic acid derivatives // IOSR Journal of Applied Chemistry (IOSR-JAC) eISSN. - 2017. - V. 10, Issue 5. - P. 33-40].
Известен также ряд работ по синтезу эфиров и амидов вальпроевой кислоты, а также по применению этих соединений в качестве «пролекарств», то есть веществ, приобретающих целевую фармакологическую активность после биотрансформации в условиях in vivo [Scott K.R. et al. Synthesis and evaluation of amino analogues of Valproic Acid // Pharmaceutical Research. - 1994. - V. 11. No. 4. - P. 571-574].
В экспериментах на животных при изучении противосудорожной активности ряда производных вальпроевой кислоты продемонстрировано сходство особенностей их противосудорожных эффектов со свойствами известного противосудорожного лекарственного средства фенитоина, а именно высокая активность этих производных по устранению судорог, индуцированных электрошоком, и отсутствие противосудорожной активности по купированию судорог, вызванных химическими воздействиями (например, введением животным пентилентетразола /коразола/) [Hadad S. et al. Pharmacocinetic analysis of ester prodrugs of Valproic Acid // Journal of Pharmaceutical Scien. - 1992. - V. 81. - P. 1047-1050; Isoherranen N. et al. Characterization of the anticonvulsant profile and enantioselective pharmacokinetics of the chiral valproylamide propylisopropyl acetamide in rodents // Br. J. Pharmacol. - 2003. - V. 138(4). - P. 602-613].
По причине неэффективности фенитоина в качестве лекарственного средства устранения судорог при острой интоксикации химическими соединениями, а, напротив, его способности усиливать токсичность некоторых судорожных агентов (например, кокаина и теофилина) [Мс Donough J.H.Jr., Shih Т.М. Neuropharmacological mechanisms of nerve agent induced seizure and neuropathoplogy // Neurosci. Biobehav. Rev. - 1997. - V. 21(5). - P. 559-579], применение этого препарата в качестве медикаментозного средства лечения судорог не рекомендуется.
Известно также, что в готовых лекарственных формах, содержащих производные вальпроевой кислоты, используется как сама кислота, так и ее натриевая соль (торговые названия лекарственных препаратов: конвулекс, депакин, ацедипрол). Недостатком депакина является кратковременный лечебный эффект, обусловленный коротким периодом полувыведения действующего начала из организма, что требует повторных введений препарата [Hadad S. et al. Pharmacocinetic Analysis of Ester Prodrugs of Valproic Acid // Journal of Pharmaceutical Scienes. - 1992. - V. 81. - P. 1047-1050]. Этот недостаток характерен и для других препаратов вальпроевой кислоты.
При повторных введениях лекарственных препаратов с вальпроевой кислотой в качестве действующего начала наблюдаются также побочные эффекты: диспептические нарушения, атаксия, сонливость; в ряде случаев могут развиваться токсические поражения печени [Машковский М.Д. Лекарственные средства. 16 изд. - М.: Новая Волна, 2012. - С. 39-40; Scott et al. Synthesis and Evaluation of Amino Analogues of Valproic Acid // Pharmaceutical Research. - 1994. - V. 11. - P. 571-574].
В патентах, зарегистрированных в США в 1960 и 1983 годах (patent US 2962499, 1960; patent US 4411902, 1983), описаны сложные эфиры тропина и вальпроевой кислоты, которые обладают М-холиноблокирующим действием. Четвертичные соли этих эфиров - октатропина метилбромид и анизотропина метилбромид (торговые наименования лекарственных препаратов: Valpin, Endovalpin, Lytispasm) применяют per os в качестве спазмолитиков при лечении желудочно-кишечных заболеваний. Эти соединения, являясь четвертичными производными тропинового эфира вальпроевой кислоты, не способны проникать в центральную нервную систему и, следовательно, не могут рассматриваться как антиконвульсанты.
Применения сложных эфиров тропина и вальпроевой кислоты в качестве противосудорожных средств при острых отравлениях нейротоксикантами не известно.
Прототипом настоящего изобретения выбран классический М-холиноблокатор - атропин сульфат. К недостаткам атропина как лекарственного средства лечения отравлений нейротоксикантами с антихолинэстеразной активностью следует отнести его слабо выраженную противосудорожную активность. Это объясняется тем, что в спектре фармакологической активности атропина преобладают эффекты, обусловленные взаимодействием его молекулы с преимущественно периферическими М-холинорецепторами, а не с М-холинорецепторами, локализованными в центральной нервной системе. В фармацевтической группе холиноблокаторов атропин позиционируется как холиноблокатор с преимущественно периферической активностью.
В процессе лечения острых отравлений фосфорорганическими ингибиторами холинэстераз для усиления противосудорожной активности атропина как лечебного антидота его необходимо применять совместно с симптоматическими противосудорожными средствами производными бензодиазепина (диазепам, феназепам), оксибутиратом натрия и другими подобными лекарственными препаратами [Медицинская токсикология: национальное руководство / под ред. Е.А. Лужникова. - М.: ГЭОТАР-Медиа, 2012. - 928 с.]. В реальной врачебной практике описанный выше алгоритм требует последовательного введения нескольких лекарственных препаратов, что создает определенные неудобства его практического использования в медицине критических состояний.
При острых отравлениях карбаматами атропин применяется в качестве основного средства медикаментозной терапии. Однако, в сравнении с фосфорорганическими ингибиторами холинэстераз, карбаматы являются нейротоксикантами со значительно меньшей продолжительностью токсического воздействия на организм пострадавших. Поэтому использование атропина на фоне восстановления активности ацетилхолинэстеразы имеет следствием реализацию его холинолитических эффектов в условиях отсутствия избыточных концентраций эндогенного ацетилхолина. При этом, весьма вероятно развитие нежелательных явлений избыточной атропинизации [Clinical neurotoxicology: syndromes, substances, environment / Ed. by M. Dobbs. - N-Y.: Saunders Elsevier, 2009. - 691 p.], что затрудняет подбор оптимальной курсовой дозы атропина в процессе лечения пострадавших от острого отравления подобными нейротоксикантами.
Задачей настоящего изобретения является получение химического соединения, обладающего активностью центрального холиноблокатора и противосудорожного агента и не обладающего собственной выраженной токсичностью, что позволит применять это соединение в качестве антидота при отравлении химическими веществами с антихолинэстеразной активностью, в частности карбаматами. Настоящее изобретение решает также задачу лечения судорожного синдрома при остром отравлении нейротоксикантами подобного типа.
Поставленные задачи решаются направленным синтезом гидрохлорида (1-метилпиперидин-4-ил)-2-пропилпентаноата (соединение I):
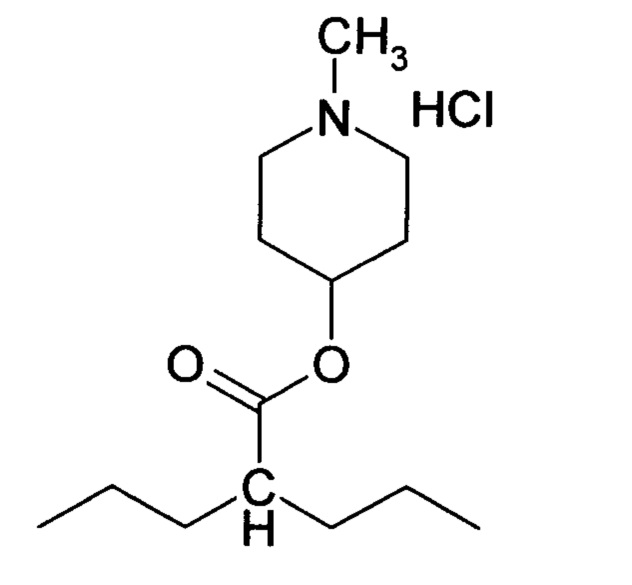
Согласно изобретению заявляемое вещество представляет собой производное 2-пропилпентановой (вальпроевой) кислоты, а именно сложный эфир этой кислоты с N-метил-4-пиперидинолом. Данное химическое соединение сочетает в своей молекуле N-метил-4-пиперидинольный фрагмент, способный взаимодействовать с анионным центром М-холинорецепторов в ЦНС, тем самым блокируя рецепторы от перевозбуждения избытком ацетилхолина в результате угнетения ацетилхолинэстеразы ингибиторами этого фермента. Эта часть молекулы ответственна за антидотный эффект заявляемого вещества при его использовании в условиях острых отравлений антихолинэстеразными веществами. Другой же фрагмент, который, отщепляясь при гидролизе сложноэфирной связи в условиях in vivo, образует вальпроевую кислоту, и эта часть молекулы ответственна за противосудорожный эффект заявляемого вещества.
Сочетание в одной молекуле двух перечисленных фармакофорных фрагментов обеспечивает комплексный характер фармакологической активности заявляемого химического соединения и позволяет достигать высокой эффективности соединения (I) как антидота при острых отравлениях антихолинэстеразными ядами при умеренной собственной токсичности данного соединения.
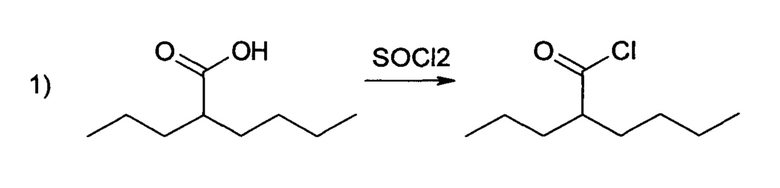
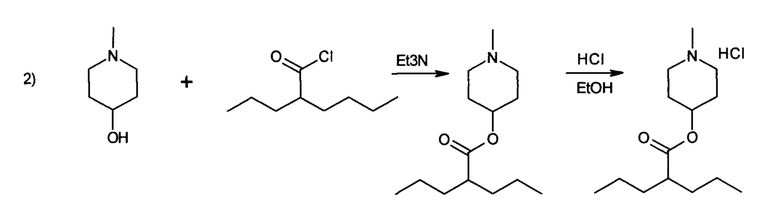
Синтез заявляемого вещества осуществляется в две стадии, согласно следующей схеме:
На первой стадии синтеза получают хлорангидрид 2-пропилпентановой (вальпроевой) кислоты.
На второй стадии синтеза получают гидрохлорид (1-метилпиперидин-4-ил)-2-пропилпентаноата (соединение 1).
Вышеприведенную схему иллюстрирует описание получения содинения 1 (пример 1), в котором приведены последовательность и условия синтеза, а также данные по выходам вещества, его молекулярной массе, спектру ПМР. Чистота заявляемого химического соединения контролировалась методом тонкослойной хроматографии.
При тестировании биологической активности полученного химического соединения на экспериментальных животных (белые беспородные крысы), источник поступления которых, принципы отбора и условия содержания описаны до примеров, иллюстрирующих биологическую активность заявляемого соединения, установлено, что соединение (I) обладает целевой биологической активностью. В частности, экспериментально установлено наличие холинолитической активности (пример 4, табл. 2) и продемонстрирован противосудорожный эффект (примеры 2 и 3, рис. 1 и табл. 1) заявляемого соединения. Соединение (I) может применяться как лечебный антидот при острых интоксикациях ингибиторами холинэстераз, в частности карбаматами (пример 4, табл. 2). По совокупности целевых фармакологических эффектов соединение (I) превосходит выбранный в качестве прототипа атропин сульфат. При этом, по критерию оценки острой токсичности (ЛД50, при внутрибрюшинном введении) как соединение (I) (пример 5, табл. 3), так и атропин сульфат - соединение прототип относятся 3 классу умеренно токсичных химических веществ.
Заявителю неизвестны какие-либо источники информации, в которых бы содержались сведения об идентичных технических решениях, что позволяет сделать вывод о соответствии заявляемого изобретения условию патентоспособности «Новизна».
Как показывают приведенные ниже примеры, заявляемое вещество обеспечивает важный технический результат, состоящий в значительном уменьшении выраженности и продолжительности токсического судорожного синдрома при воздействии судорожных агентов с активностью ингибиторов холинэстераз, а также предупреждении летальности при остром отравлении ингибитором холинэстераз - фенилкарбаматом.
Заявителем не выявлены какие-либо источники информации, содержащие сведения о влиянии признаков изобретения на достигаемый вследствие их реализации технический результат. Это свидетельствует о соответствии данного технического решения условию патентоспособности «Изобретательский уровень».
Сущность изобретения иллюстрируется следующими примерами.
Пример 1. Синтез гидрохлорида (1-метилпиперидин-4-ил)-2-пропилпентаноата [соединение (I)].
На первой стадии синтеза получают хлорангидрид 2-пропилпентановой (вальпроевой) кислоты: к 5 г вальпроевой кислоты при охлаждении ледяной водой прикапывают 3 мл хлористого тионила, выдерживют 1 час при комнатной температуре, после чего кипятя 5 часов с обратным холодильником. Реакционную массу охлаждают, избыток тионила испаряют в вакууме, остаток перегоняю в вакууме водоструйного насоса и получают 5.45 г бесцветной жидкости с температурой кипения 60°С/20 мм.
На второй стадии синтеза получают гидрохлорид (1-метилпиперидин-4-ил)-2-пропилпентаноата: К раствору 3.86 г (0.0335М)] N-метил-4-пиперидинола и 3.35 г (4.7 мл, 0.0335М) триэтиламина в 15 мл сухого хлороформа при охлаждении ледяной водой добавляют 5.45 г (0.0335М) хлорангидрида вальпроевой кислоты, перемешивают 30 мин при комнатной температуре, а затем кипятят 4-5 часов и оставляют на 12 часов при комнатной температуре. Затем реакционную массу выливают в делительную воронку и промывают 2 раза 10 мл 10% раствора соды. Органический слой отделяю, сушат над безводным сульфатом магния, хлороформ испаряют. Остаток в виде масла переводят в гидрохлорид с помощью спиртового раствора НС1. В итоге, получают 7.1 г белого кристаллического вещества с tпл 125-127°С. Выход - 76% от теории.
Структура полученного соединения подтверждается спектром ПМР (δ, м.д.): 11.08 (1Н, s, N+H); 5.01 (1Н, m, СН); 3.30 (1Н, m, СН); 3.09 (2Н, m, СН2); 2.71 (3Н, s, CH3N); 2.69 (2Н, m, СН2); 2.34 (1Н, m, СН); 2.02 (2Н, m, СН2); 1.87 (2Н, m, СН2); 1.50 (2Н, m, СН2); 1.41 (2Н, m, СН2); 1.24 (4Н, m, 2СН2); 0.86 (6Н, t, 2СН3).
Для изучения фармакологической активности заявляемого химического соединения и атропина сульфата как соединения прототипа (примеры 2-4), а также для оценки их острой токсичности (пример 5) в экспериментах использовали белых беспородных крыс-самцов возрастом 3 месяца; источник поступления животных - питомник «Рапполово» (г. Санкт-Петербург). Лабораторные животные до проведения исследований для обеспечения их адаптации к условиям опытов содержались 5 дней в контролируемых условиях окружающей среды (18-26°С и относительной влажности воздуха 30-70%). В комнатах содержания животных поддерживался 12 часовой цикл освещения. Во время этого периода каждый день путем визуального осмотра контролировалось клиническое состояние животных. Животные с обнаруженными в ходе осмотра отклонениями в экспериментальные группы не включались. В качестве корма был использован «Корм для содержания лабораторных животных» ПК-120-1, приготовленный по ГОСТ Р 50258-92. Животным также давали воду, соответствующую ГОСТу "Вода питьевая" Р 51232-98. Корм и вода были доступны животным и употреблялись ими ad libitum («по желанию»).
Известно, что химические соединения с холиноблокирующей активностью могут использоваться как лечебные антидоты при острых отравлениях антихолинэстеразными соединениями [Медицинская токсикология: национальное руководство / под ред. Е.А. Лужникова. - М.: ГЭОТАР-Медиа, 2012. - 928 с.]. Считается, что лечебный эффект холиноблокаторов (например, атропина сульфата) при отравлениях ингибиторами холинэстераз, включая карбаматы, является одним из компонентов их фармакологической активности. Так как при изучении продолжительности судорожного синдрома, развивающегося у крыс при остром отравлении фенилкарбаматом, установлено, что часть экспериментальных животных погибает в отдаленном периоде острой интоксикации (как правило, на протяжении 1 суток после введения фенилкарбамата), то помимо определения длительности манифестации судорожного симптомокомплекса необходимо исследовать также сравнительную защитную эффективность противосудорожных агентов (заявляемого соединения (I) и атропина сульфата) по критерию летальности животных в течение 24 часов от начала развития судорожного симптомокомплекса, вызванного потенциально летальной дозой фенилкарбамата.
Пример 2. Исследование влияния гидрохлорида (1-метилпиперидин-4-ил) 2-пропилпентаноата [соединение (I)] или атропина на выраженность и продолжительность судорог, вызванных судорожным агентом - фенилкарбаматом (фениловым эфиром диметилкарбаминовой кислоты).
В предварительных экспериментах устанавливают дозу фенилкарбамата, вызывающую у крыс в условиях острой интоксикации и выбранном способе введения судорожный симптомокомплекс с минимальным процентом гибели животных. Для фенилкарбамата при однократном введении внутрибрюшинно крысам эта доза составляет 1,0 мг/кг.
В экспериментах по оценке противосудорожного эффекта соединения I или же атропина фенилкарбамат белым беспородным крысам всех экспериментальных подгрупп вводят внутрибрюшинно, однократно, в дозе 1,0 мг/кг и дожидаются развития судорог, достигающих 4-6 уровней по шкале Racine (ранее установлено, что у крыс судороги этих уровней по их выраженности соответствуют эпилептическому статусу у человека). Затем в течение первых минут развития судорог данного уровня экспериментальным животным разных подгрупп в качестве лечебного средства вводят соединение (I) или атропин сульфат. Вышеназванные средства фармакологической коррекции судорог (фактически противосудорожные лечебные антидоты) крысам вводят также внутрибрюшинно в следующих дозах: соединение (I) - 43 мг/кг, атропин - 1 мг/кг. Межвидовой пересчет эффективных лечебных доз с человека на крысу производят с использованием соответствующих коэффициентов [Freireich E.J., Gehan Е.А., Rail D.P., Schmidt L.H., Skipper H.E. Quantitative comparison of toxicity of anticancer agents in mouse, rat, hamster, dog, monkey, and man // Cancer Chemother Rep. - 1966. - V. 50(4). - P. 219-244]. Для каждого животного, исходя из значения его массы тела, рассчитывают эквивалентный выбранным дозам индивидуальный объем растворов исследуемых соединений.
Выраженность судорожного синдрома у экспериментальных животных всех подгрупп оценивают по модернизированной шкале Racine [Racine R.J. Modification of seizure activity by electrical stimulation. II. Motor seizure// Electroencephalogr Clin Neurophysiol. - 1972. - Vol. 32(3). - P. 281-294.], фиксируя его соответствие 6 уровням: уровень 0 - отсутствие изменений в поведении животных; уровень 1 - снижение двигательной активности животных; уровень 2 - наличие движения ртом/головой, жевание, кивание головой; уровень 3 - унилатеральный/билатеральный клонус передних лап без роющих движений, симптом Штрауба, вытягивание тела; уровень 4 - клонус обеих передних конечностей с роющими движениями; уровень 5 - вытягивание тела и лежачее положение; уровень 6 - полноценные тонические судороги.
Результаты исследования выраженности судорожного синдрома и продолжительности судорог при остром отравлении крыс фенилкарбаматом после применения исследуемых субстанций как лечебных антидотов представлены на рисунке 1.
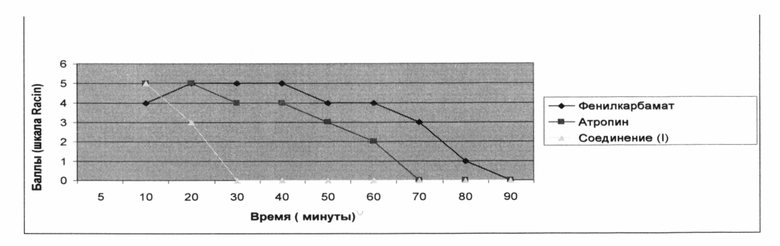
Рис. 1. Интенсивность и продолжительность судорожного синдрома у белых крыс при острой интоксикации фенилкарбаматом в условиях отсутствия коррекции и при фармакологической коррекции судорожного симптомокомплекса соединением 1 или атропином сульфатом.
Видно, что при применении в качестве лечебного антидота как соединения (I), так и атропина достигается коррекция выраженности судорожного симптомокомплекса, свойственного острым отравлениям ингибиторами холинэстеразы, в частности карбаматами. Однако, при использовании в качестве лечебного антидота атропина динамика уменьшения выраженности судорог незначительна. Так, в подгруппе крыс с лечением атропином по сравнению с погруппой крыс без лечения к 60 минутам судороги достигают 2 уровня интенсивности (в сравниваемой подгруппе без лечения - 4 уровень интенсивности судорог. К 70 минуте наблюдения: в подгруппе крыс с лечением - 0 уровень судорожного симптомокомплекса, а в подгруппе без лечения - 3 уровень. При использовании в качестве лечебного антидота соединения (I) во временном промежутке от 5 до 20 минут после использования антидота выраженность судорожного симптомокомплекса соответствует 2 уровню интенсивности по шкале Racine, а на 30 минуте достигается 0 уровень выраженности судорог.
Таким образом, при использовании в качестве антидота соединения (I) в сравнении с атропином показана очевидная положительная динамика уменьшения интенсивности судорожного симптомокомплекса, вызванного острой интоксикацией крыс фенилкарбаматом. При использовании соединения 1 противосудорожный эффект наступает в 2-3 раза быстрее, чем при использовании атропина.
Пример 3. Исследование сравнительной лечебной эффективности гидрохлорида (1-метилпиперидин-4-ил)-2-пропилпентаноата [соединение (1)] и атропина сульфата при остром отравлении крыс фенилкарбаматом (по критерию продолжительности манифестации судорожного симптомокомплекса у отравленных животных).
Так же, как и в экспериментах, описанных в примере 2, в этом примере в качестве судорожного агента используют фенилкарбамат, который вводят крысам в дозе 1 мг/кг, внутрибрюшинно. Для фармакологической коррекции развивающегося судорожного симптомокомплекса крысам также внутрибрюшинно вводят как лечебные антидоты (т.е. на высоте развившихся судорог) соединение (I) в дозе 43 мг/кг или атропин сульфат в дозе 1 мг/кг. Для определения более точного значения сравниваемых моментов достижения полного противосудорожного эффекта в каждую сравниваемую подгруппу животных включают по 8 крыс и индивидуально для каждого включенного в исследование животного фиксируют момент (т.е. время) полного прекращения судорог у выживших животных. Продолжительность судорожного синдрома оценивают в минутах и определяют среднее время достижения полного лечебного эффекта и ошибку средней (М±m). Результаты определения лечебной эффективности соединения 1 и атропина по критерию противосудорожного эффекта приведены в таблице 1.
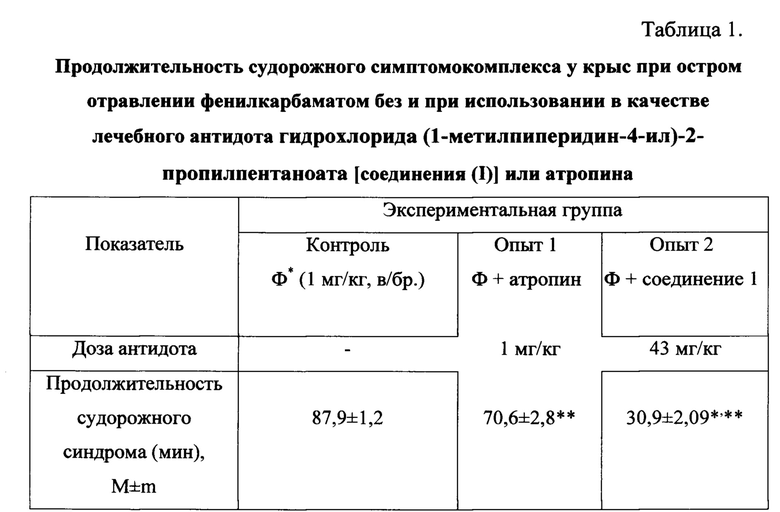
Примечание: * - Ф - фенилкарбамат,
соединение 1 - гидрохлорид (1-метилпиперидин-4-ил)-2-пропилпентаноата,
** - отличие подгрупп опыт 1 и 2 от контрольной подгруппы (p<0,05),
*** - отличие подгруппы опыт 2 от подгруппы опыт 1 (p<0,01).
Видно, что в подгруппе крыс, получавших в качестве лечебного антидота соединение (I), продолжительность судорожного синдрома практически в три раза меньше, чем в подгруппе крыс без лечения и достоверно (более, чем в 2 раза) меньше, чем в подгруппе крыс, пролеченных атропином. Судорожный симптомокомплекс у крыс, отравленных фенилкарбаматом и пролеченных соединением (I), по продолжительности не превышает 30 минут. Подобный эффект заявляемого вещества [соединение (1)] можно объяснить тем, что при перевозбуждении центральной нервной системы при острой интоксикации нейротоксикантами с антихолинэстеразной активностью, в частности карбаматами, в патогенезе судорожного синдрома, наряду с нарушением нейромышечного проведения (т.е. процессов нейромедиации) большое значение имеют нарушения ионной проводимости (т.е. функционирования ионных каналов). Хорошо известно, что вальпроаты - производные 2-пропилпентановой (вальпроевой) кислоты нормализуют работу ионных каналов, нарушенную при различных заболеваниях, в частности при острых отравлениях нейротоксикантами.
Таким образом, при остром отравлении крыс фенилкарбаматом соединение (I) в качестве противосудорожного средства существенно превосходит атропин сульфат по эффективности целевого фармакологического эффекта.
Пример 4. Исследование сравнительной защитной эффективности гидрохлорида (1-метилпиперидин-4-ил)-2-пропилпентаноата [соединение (I)] и атропина сульфата (по критерию летальности экспериментальных животных, перенесших вызванный фенилкарбаматом судорожный синдром и погибающих в течение 1 суток интоксикации).
Летальность в указанный срок (через 24 часа после интоксикации) оценивают как долю погибших животных (в процентах) в общем количестве крыс в соответствующих экспериментальных подгруппах, которым вводят антихолинэстеразное средство - фенилкарбамат. Фенилкарбамат всем животным экспериментальных подгрупп вводят в дозе 1 мг/кг, внутрибрюшинно. Фармакологическую коррекцию антидотами осуществляют на высоте развития судорожного симптомокомплекса (как в примерах 2 и 3), вводя соединение (I) или же атропин сульфат внутрибрюшинно в дозах: соединение (I) - 43 мг/кг, атропинсульфат - 1 мг/кг. Через 24 часа учитывают количество погибших животных в экспериментальных подгруппах (в каждую подгруппу включают по 8 крыс).
Полученные результаты иллюстрируют данные, представленные в таблице 2.
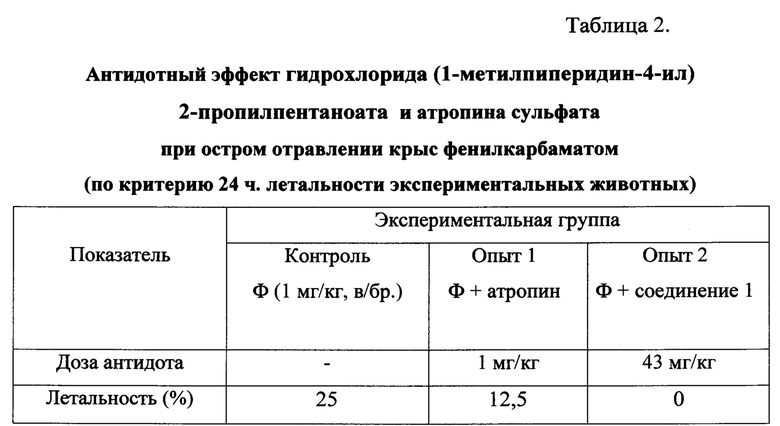
Примечание: Ф - фенилкарбамат, соединение 1 - гидрохлорид 1-метилпи-перидин-4-ил-2-пропилпентаноата.
Из данных, представленных в таблице 2, видно, что в подгруппе крыс, получивших в качестве лечебного антидота соединение 1, погибшие животные отсутствуют. Летальность в подгруппе крыс, получивших атропин, составляет 12,5%, а у животных, не получивших лечения - 25%.
Таким образом, при лечении острой интоксикации ингибитором холинэстераз фенилкарбаматом продемонстрирована эффективность лечения отравленных крыс соединения (I) по критерию уменьшения летальности на протяжении 1 суток наблюдения. Причем защитная эффективность соединение 1 как лечебного антидота при отравлении антихолинэстеразными соединениями этого типа двукратно превосходит лечебную эффективность, атропина сульфата как соединения сравнения (прототипа).
Пример 5. Исследование острой токсичности гидрохлорида (1-метилпиперидин-4-ил)-2-пропилпентаноата [соединение (1)].
При оценке значений средних эффективных доз соединения (I) применяют табличный экспресс-метод В.Б. Прозоровского (1994). В качестве экспериментальных животных используют белых беспородных (нелинейных) крыс, которых содержат и готовят к эксперименту так, как описано выше. В опытах по оценке острой токсичности соединения 1 перед постановкой эксперимента из предварительно подготовленных крыс компонуют 4 группы по 3 крысы в каждой группе. Далее по известным таблицам [Прозоровский В.Б. Методическое пособие по ускоренному определению эффективных доз и концентраций биологически активных веществ. - Байкольск, 1994. - 46 с.] выбирают конкретные значения 4-х соседних доз и в соответствии с этими значениями готовят растворы соединения 1 разной концентрации.
Соединение (I) экспериментальным животным каждой группы вводят однократно, внутрибрюшинно (в/бр) в различающихся дозах. Конкретное значение объема раствора соединения (I) рассчитывают, исходя из заранее определенной массы конкретной особи. По результатам учета гибели крыс в каждой группе после их «затравки» растворами соединения 1, т.е. получившими тестируемое соединение в дозах, соответствующих выбранным в таблице значениям, определяют значение ЛД50 соединения 1. Выбранные для введения крысам при определении ЛД50 конкретные значения различающихся доз соединения (I) (в порядке возрастания вводимой дозы) соответствуют следующим значениям доз: 126, 158, 200, 250 мг/кг.
Результаты оценки острой токсичности (ЛД50) соединения 1 при внутрибрюшинном введении по экспресс методу В.Б. Прозоровского (1994) представлены в таблице 3.
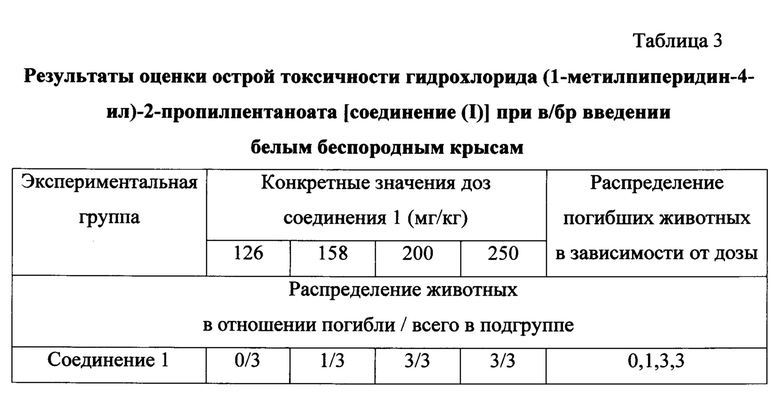
Из данных, приведенных в таблице 3, следует, что при в/б введении соединения (I) крысам установлено следующее распределение летального исхода отравленных особей: 0,1,3,3, что позволяет определить величину ЛД50 соединения (I). Экспериментально установленная ЛД50 гидрохлорида соединения (I) при в/бр введении для беспородных белых крыс оказалась равна 170±1,2 мг/кг.
По литературным данным ЛД50 атропина сульфата как соединения, выбранного в качестве прототипа (острая интоксикация беспородных белых крыс, в/бр путь введения), составляет - 215 мг/кг [Dangerous properties of industrial materials, 8th ed (3 Volumes) / N.I. Sax, R.J. Lewis, eds. - New York, Van Nostrand Reinhold, 1992. - 4300 p. /http://www.inchem.org/documents/antidote/antidote/atropine.htm#8.3/].
Таким образом, несмотря на то, что острая токсичность для крыс соединения (I) на 20% выше, чем у соединения прототипа, однако в соответствии с нормативными документами [ГОСТ 12.1.007-76 «Система стандартов безопасности труда (ССБТ). Вредные вещества. Классификация и общие требования безопасности (с Изменениями №1, 2)». - Утвержден и введен в действие Постановлением Государственного комитета СССР по стандартам от 10.03.76 №579] соединение (I) (также как атропин сульфат) должен быть отнесен к 3 классу умеренно токсичных химических веществ. Это заключение подтверждают и данные литературы [Березовская И.В. Классификация химических веществ по параметрам острой токсичности при парентеральных способах введения // Хим.-фарм. журнал. - 2003. - Том 37. - №3. - С. 32-34.].
Отсутствие выраженной токсичности в совокупности с активностью заявляемого соединения как средства купирования судорожного синдрома позволяет положительно оценить перспективность использования сиединения (I) как противосудорожного лекарственного средства.
Как показывают приведенные выше примеры, заявляемое химическое соединение обеспечивает важный технический результат, состоящий в наличии у соединения (I) биологической активности, более высокой, чем у классического холиноблокатора атропина сульфата как соединения прототипа, а именно способности защищать (при использовании в качестве лечебного средства) от острого отравления нейротоксикантами с антихолинэстеразной активностью, в частности карбаматами. Соединение (I) более активено, чем атропин сульфат и по способности купировать судорожный симптомокомплекс химического генеза, в частности судорожный симптомокомплекс, сопутствующий острым отравлениям нейротоксикантами с антихолинэстеразной активностью. Общая токсичность соединения (I) сравнима с известным фармакологическим аналогом, выбранным в качестве прототипа.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ ОСТРЫХ ОТРАВЛЕНИЙ ОРГАНОФОСФАТАМИ | 2013 |
|
RU2555764C1 |
| СРЕДСТВО ТЕРАПИИ СУДОРОЖНОГО СИНДРОМА | 2006 |
|
RU2314828C1 |
| СРЕДСТВО ТЕРАПИИ СУДОРОЖНОГО СИНДРОМА | 2001 |
|
RU2191017C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ПРОТИВОСУДОРОЖНОЙ АКТИВНОСТЬЮ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ | 2011 |
|
RU2463052C1 |
| СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ОТРАВЛЕНИЙ ФОСФОРОРГАНИЧЕСКИМИ ИНСЕКТИЦИДАМИ (ФОИ) | 2008 |
|
RU2415668C2 |
| КОМПОЗИЦИЯ ДЛЯ ТЕРАПИИ СУДОРОЖНОГО СИНДРОМА | 2006 |
|
RU2314829C1 |
| Фармацевтическая композиция для устранения судорожного синдрома на основе никетамида и препаратов бензодиазепиновой группы | 2022 |
|
RU2801050C1 |
| ХЛОРГИДРАТ 2-БЕНЗОИЛАМИНОМЕТИЛБЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЙ ПРОТИВОСУДОРОЖНЫЙ, АНТИГИПОКСИЧЕСКИЙ И АНТИТОКСИЧЕСКИЙ ЭФФЕКТ ПРИ ВОЗДЕЙСТВИИ РАЗЛИЧНЫХ СУДОРОЖНЫХ АГЕНТОВ | 1994 |
|
RU2109737C1 |
| СПОСОБЫ ПРИМЕНЕНИЯ ДАНТРОЛЕНА ДЛЯ ЛЕЧЕНИЯ ВОЗДЕЙСТВИЯ НЕРВНО-ПАРАЛИТИЧЕСКОГО ВЕЩЕСТВА | 2018 |
|
RU2817851C2 |
| Способ лечения и профилактики отравлений фосфорорганическими инсектицидами | 2019 |
|
RU2705370C1 |
Изобретение относится к 1-метилпиперидин-4-ил 2-пропилпентаноата гидрохлориду формулы I, обладающему холинолитической и противосудорожной активностью. Заявляемое средство обеспечивает значительное уменьшение выраженности и сокращение продолжительности токсического судорожного синдрома, а также снижение летальности при острых отравлениях ингибиторами холинэстеразы, в частности карбаматами, путем использования заявляемого вещества как специфического антидота. 3 табл., 5 пр.
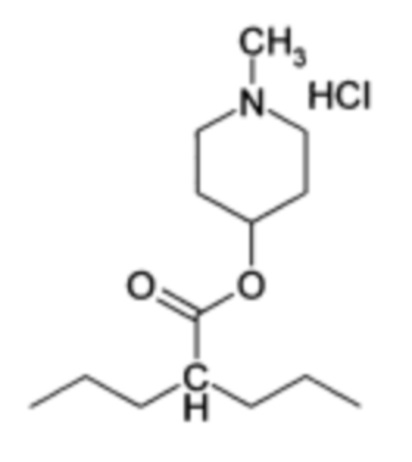 (I)
(I)
Гидрохлорид 1-метилпиперидин-4-ил 2-пропилпентаноата [соединение (I)]
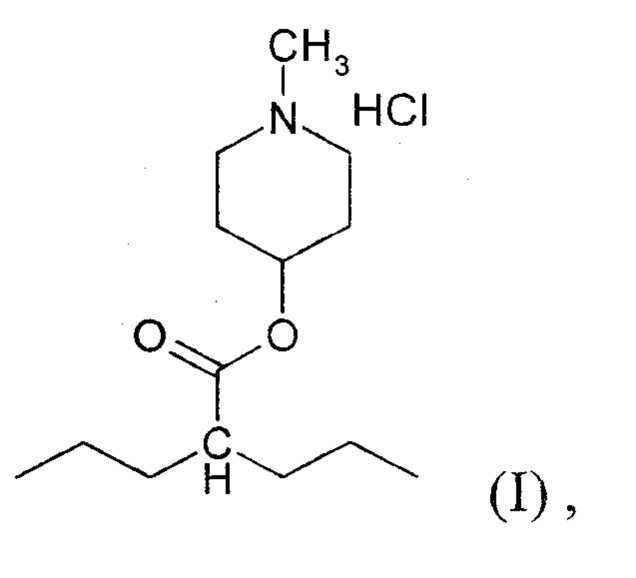
обладающий холинолитической и противосудорожной активностью.
| "Клапанный механизм для пневматического оружия | 1976 |
|
SU585729A1 |
| US 4411902 A1, 25.10.1983 | |||
| US 2962499 A1, 29.11.1960 | |||
| РЕАКТИВНАЯ ГАЗОВАЯ ТУРБИНА | 1926 |
|
SU5684A1 |
Авторы
Даты
2020-02-12—Публикация
2019-11-22—Подача