Область техники
Настоящее изобретение относится к хинолиновым соединениям, способам их получения и их применению в качестве лекарственного средства, ингибирующего транспортер уратов.
Уровень техники
Лекарственные средства, ингибирующие транспортер уратов (URAT1), используются для лечения гиперурикемии, подагры и других заболеваний.
Раскрытие изобретения
Настоящее изобретение относится к разновидностям хинолиновых соединений, а также к их применению в качестве лекарственного средства, ингибирующего транспортер уратов.
Настоящее изобретение относится к соединениям формулы (А) или их оптическим изомерам или сольватам или химически приемлемым солям или пролекарствам,
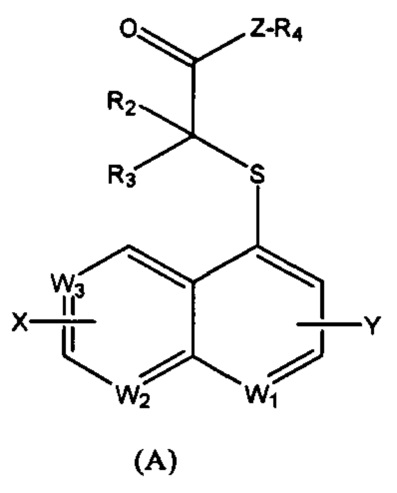
где
Z выбран из О, S или -NH-;
W1 выбран из N или CRa; W2 выбран из N или CRb; W3 выбран из N или CRc;
Ra, Rb, Rc, R2 и R3 независимо выбраны из группы, включающей водород, галоген, циано, нитро, алкил, алкенил, алкинил, циклоалкил, гетероциклический радикал, арил, гетероарил, -ORd, -S(O)mRd, -C(O)Rd, C(O)ORd, -C(O)NReRf, -NReRf или NReC(O)Rf, соответственно, где указанный алкил, алкенил, алкинил, циклоалкил, гетероциклический радикал, арил или гетероарил независимо и необязательно дополнительно замещены одним или более заместителями, которые выбраны из группы, включающей галоген, циано, нитро, оксо-, алкил, галогеналкил, гидроксиалкил, алкенил, алкинил, циклоалкил, гетероциклический радикал, арил, гетероарил, -ORd, -S(O)mRd, -C(O)Rd, C(O)ORd, -C(O)NReRf, -NReRf или NReC(O)Rf, соответственно;
Rd выбран из группы, включающей водород, галоген, алкил, циклоалкил, гетероциклический радикал, арил или гетероарил, где указанный алкил, циклоалкил, гетероциклический радикал, арил или гетероарил независимо и необязательно дополнительно замещен одним или более заместителями, которые выбраны из группы, включающей галоген, циано, нитро, гидроксил, оксо-, алкил, галогеналкил, гидроксиалкил, алкокси, циклоалкил, гетероциклический радикал, арил, гетероарил, карбоксил, эфир карбоновой кислоты, -C(O)NReRf, -NReRf или NReC(O)Rf, соответственно;
Re, Rf независимо выбраны из группы, включающей водород, алкил, циклоалкил, гетероциклический радикал, арил или гетероарил, соответственно, где указанный алкил, циклоалкил, гетероциклический радикал, арил или гетероарил независимо и необязательно дополнительно замещены одним или более заместителями, выбранными из группы, включающей галоген, циано, нитро, гидроксил, оксо-, алкил, галогеналкил, гидроксиалкил, алкокси, циклоалкил, гетероциклический радикал, арил, гетероарил, карбоксил, группу эфира карбоновой кислоты, соответственно; и m представляет собой 0, 1 или 2;
X, Y независимо выбраны из группы, включающей водород, галоген, циано, нитро, алкил, циклоалкил, галогеналкил или гидроксиалкил, соответственно;
Когда Z выбран из О или S; R4 выбран из водорода или C1-С6 алкила, циклоалкила, где указанный алкил и циклоалкил независимо и необязательно замещены одним или более заместителями, выбранными из галогена, циано, нитро, гидроксила, оксо-, алкила, галогеналкила, гидроксиалкила, алкокси, циклоалкила, гетероциклического радикала, арила, гетероарила, карбоксила, группы эфира карбоновой кислоты, -C(O)NReRf, -NReRf или NReC(O)Rf; когда Z выбран из -NH-, R4 выбран из водорода, арила или гетероарила, и пиридил является предпочтительным.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства имеют структуру формулы (I):
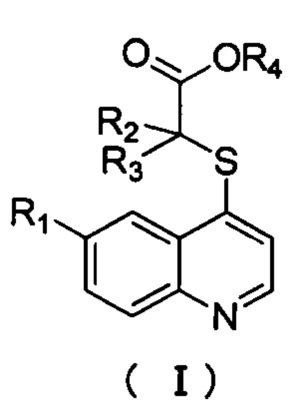
где R1 выбран из водорода, галогена, трифторметила, циано, нитро, алкила, алкенила, алкинила, циклоалкила, гетероциклического радикала, арила, гетероарила, -ORd, -S(O)mRd, -C(O)Rd, C(O)ORd, -C(O)NReRf, -NReRf или NReC(O)Rf, в котором указанный алкил, алкенил, алкинил, циклоалкил, гетероциклический радикал, арил или гетероарил независимо и необязательно дополнительно замещены одним или более заместителями, выбранными из галогена, циано, нитро, оксо, алкила, галогеналкила, гидроксиалкила, алкенила, алкинила, циклоалкила, гетероциклического радикала, арила, гетероарила, -ORd, -S(O)mRd, -C(O)Rd, C(O)ORd, -C(O)NReRf, -NReRf или NReC(O)Rf;
R2, R3, R4, Rd, Re, Rf, и m все они имеют то же значение, что и в формуле (А). Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где
R1 выбран из группы, включающей галоген, трифторметил, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, и замещенный или незамещенный циклоалкил. R2 и R3 независимо выбраны из группы, включающей водород, галоген, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил и замещенный или незамещенный циклоалкил, соответственно. R4 выбран из группы, включающей водород или C1-С6 алкил, С3-С6 циклоалкил.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, в которых когда Z представляет собой О, R4 выбран из водорода.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, в которых R1 выбран из группы, включающей галоген, трифторметил, замещенный или незамещенный арил, замещенный или незамещенный пиридил, замещенный или незамещенный пиримидинил, замещенный или незамещенный пирролил, замещенный или незамещенный имидазолил, замещенный или незамещенный фурил, замещенный или незамещенный тиенил, замещенный или незамещенный оксазолил, замещенный или незамещенный тиазолил, замещенный или незамещенный оксадиазолил, замещенный или незамещенный тиадиазолил или С3-С6 циклоалкил.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из группы, включающей F, Br, Cl, пиридил, пиримидинил, пирролил, имидазолил, фенил, трифторметил или циклопропил, где указанный фенил необязательно дополнительно замещен одним или более заместителями, выбранными из группы, включающей метокси, этокси, фтор, хлор, бром или трифторметил.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, в которых R2 и R3 независимо выбраны из водорода, галогена или C1-C6 алкила, соответственно.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, в которых
или R2 выбран из водорода и R3 выбран из метила;
или R2 выбран из водорода и R3 выбран из этила;
или R2 выбран из водорода и R3 выбран из изопропила;
или R2 и R3 оба выбраны из метила;
или R2 и R3 оба выбраны из этила;
или R2 и R3 оба выбраны из н-пропила.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где соединения имеют структуру формулы (Iа):
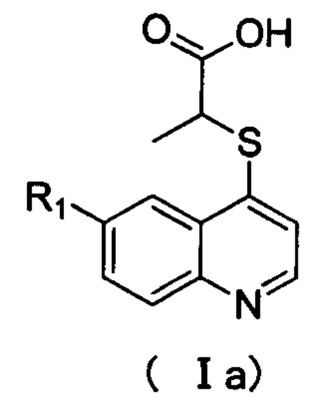
где R1 имеет значение, указанное в п. 2.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из группы, включающей галоген, трифторметил, замещенный или незамещенный арил, замещенный или незамещенный пиридил, замещенный или незамещенный пиримидинил, замещенный или незамещенный пирролил, замещенный или незамещенный имидазолил, замещенный или незамещенный фурил, замещенный или незамещенный тиенил, замещенный или незамещенный оксазолил, замещенный или незамещенный тиазолил, замещенный или незамещенный оксадиазолил, замещенный или незамещенный тиадиазолил или С3-С6 циклоалкил.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из группы, включающей F, Br, Cl, трифторметил, пиридил, пиримидинил, пирролил, имидазолил, фенил или циклопропил, где указанный фенил необязательно дополнительно замещен одним или более заместителями, выбранными из метокси, этокси, фтора, хлора, брома или трифторметила. Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где соединения имеют структуру формулы (lb):
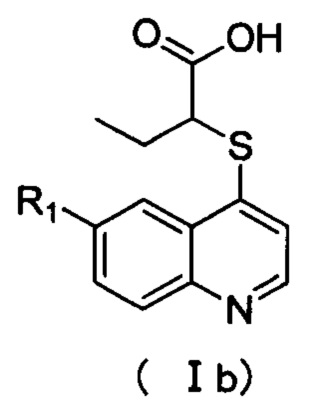
где R1 имеет значение, указанное в п. 2.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из группы, включающей галоген, трифторметил, замещенный или незамещенный арил, замещенный или незамещенный пиридил, замещенный или незамещенный пиримидинил, замещенный или незамещенный пирролил, замещенный или незамещенный имидазолил, замещенный или незамещенный фурил, замещенный или незамещенный тиенил, замещенный или незамещенный оксазолил, замещенный или незамещенный тиазолил, замещенный или незамещенный оксадиазолил, замещенный или незамещенный тиадиазолил или C3-C6 циклоалкил.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из группы, включающей F, Br, Cl, трифторметил, пиридил, пиримидинил, пирролил, имидазолил, фенил или циклопропил, где указанный фенил необязательно дополнительно замещен одним или более заместителями, выбранными из метокси, этокси, фтор, хлор, бром или трифторметил. Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где соединения имеют структуру формулы (Ic):
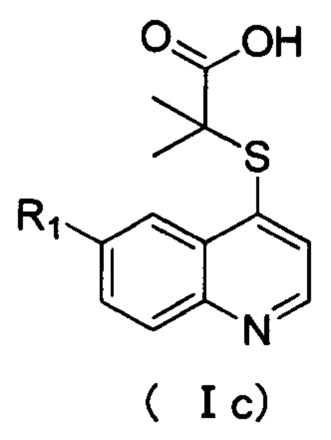
где R1 имеет значение, указанное в п. 2.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из группы, включающей галоген, трифторметил, замещенный или незамещенный арил, замещенный или незамещенный пиридил, замещенный или незамещенный пиримидинил, замещенный или незамещенный пирролил, замещенный или незамещенный имидазолил, замещенный или незамещенный фурил, замещенный или незамещенный тиенил, замещенный или незамещенный оксазолил, замещенный или незамещенный тиазолил, замещенный или незамещенный оксадиазолил, замещенный или незамещенный тиадиазолил или C3-C6 циклоалкил.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из группы, включающей F, Br, Cl, трифторметил, пиридил, пиримидинил, пирролил, имидазолил, фенил или циклопропил, где указанный фенил необязательно дополнительно замещен одним или более заместителями, выбранными из метокси, этокси, фтора, хлора, брома или трифторметила.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где соединения имеют структуры формулы (Id) или (1е).
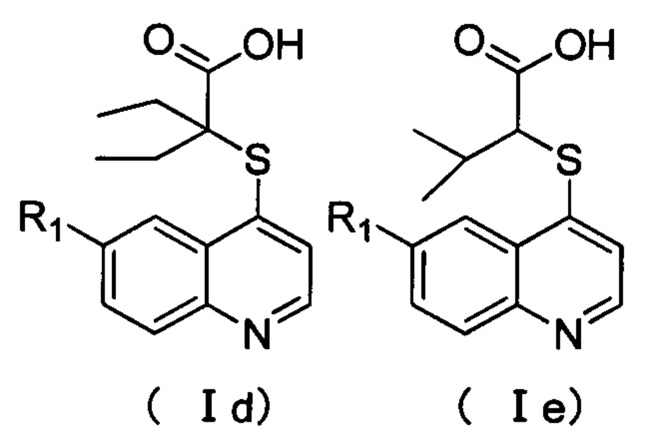
где R1 имеет значение, указанное в п. 2.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из группы, включающей галоген, трифторметил, замещенный или незамещенный арил, замещенный или незамещенный пиридил, замещенный или незамещенный пиримидинил, замещенный или незамещенный пирролил, замещенный или незамещенный имидазолил, замещенный или незамещенный фурил, замещенный или незамещенный тиенил, замещенный или незамещенный оксазолил, замещенный или незамещенный тиазолил, замещенный или незамещенный оксадиазолил, замещенный или незамещенный тиадиазолил или C3-C6 циклоалкил.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из группы, включающей F, Br, Cl, трифторметил, пиридил, пиримидинил, пирролил, имидазолил, фенил или циклопропил, где указанный фенил необязательно дополнительно замещен одним или более заместителями, выбранными из метокси, этокси, фтора, хлора, брома или трифторметила. Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из циклопропила, и R2 и R3 оба имеют значение, указанное в формуле(А).
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R2 и R3 независимо выбраны из водорода, галогена или C1-С6 алкила, соответственно.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из пиридила, и R2 и R3 оба имеют значение, указанное в формуле(А).
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R2 и R3 независимо выбраны из водорода, галогена или C1-С6 алкила.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из фенила, замещенного одной или двумя метокси группами, и R2 и R3 оба имеют значение, указанное в формуле(А).
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R2 и R3 независимо выбраны из водорода, галогена или C1-С6 алкила, соответственно.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из Br, и R2 и R3 оба имеют значение, указанное в формуле(А).
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R2 и R3 независимо выбраны из водорода, галогена или C1-C6 алкила.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из фторфенила, и R2 и R3 оба имеют значение, указанное в формуле (А).
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R2 и R3 независимо выбраны из водорода, галогена или C1-C6 алкила.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R1 выбран из трифторметилфенила, и R2 и R3 оба имеют значение, указанное в формуле(А).
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где R2 и R3 независимо выбраны из водорода, галогена или C1-C6 алкила.
Кроме того, соединения или их оптические изомеры или сольваты или химически приемлемые соли или пролекарства, где указанное соединение является одним из следующих соединений:
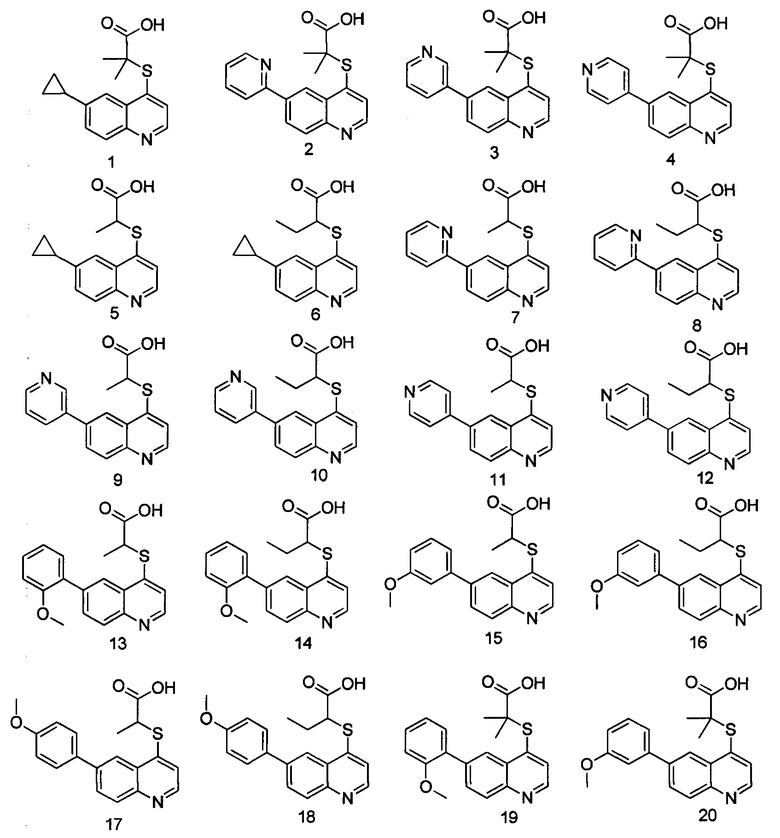
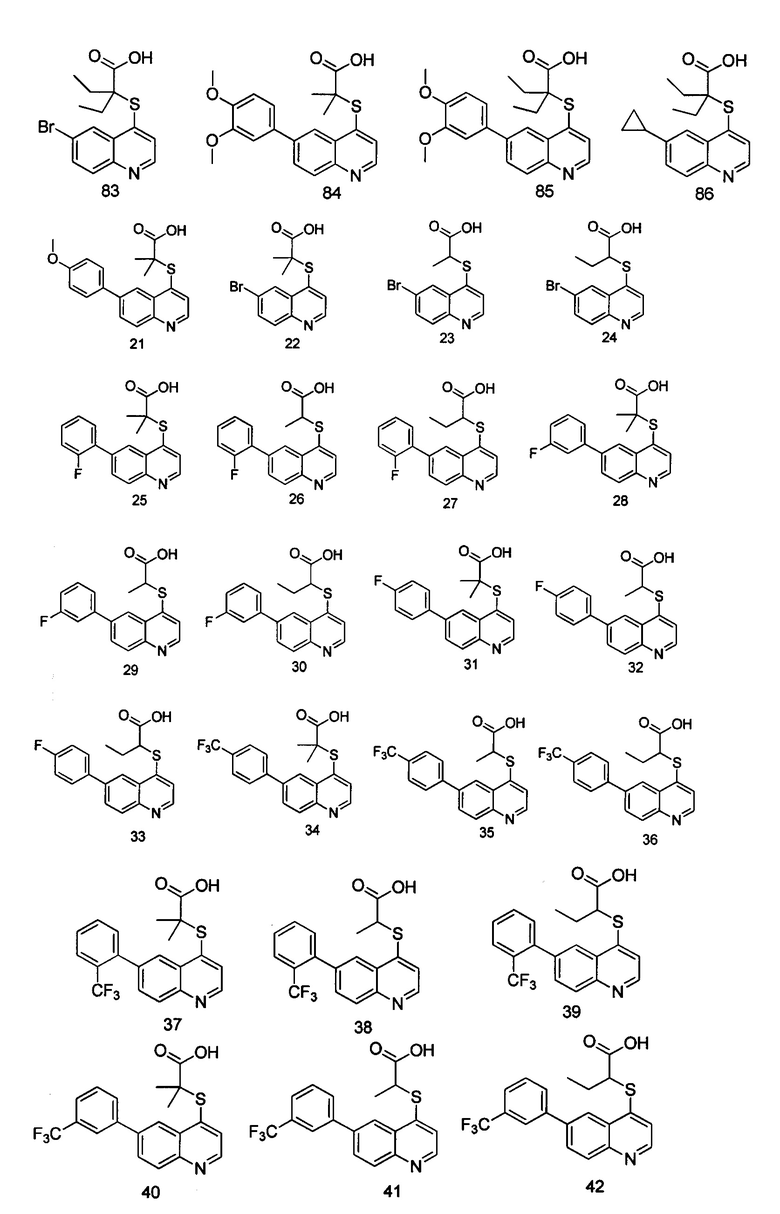
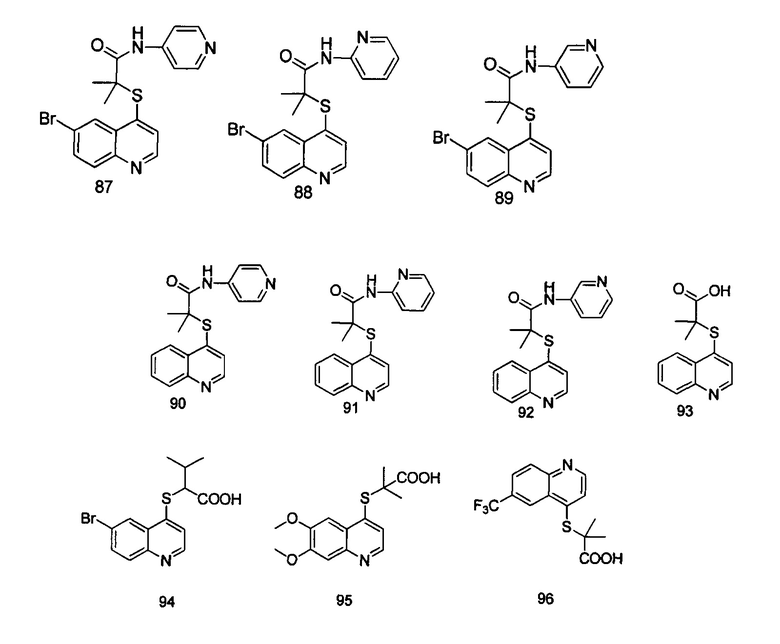
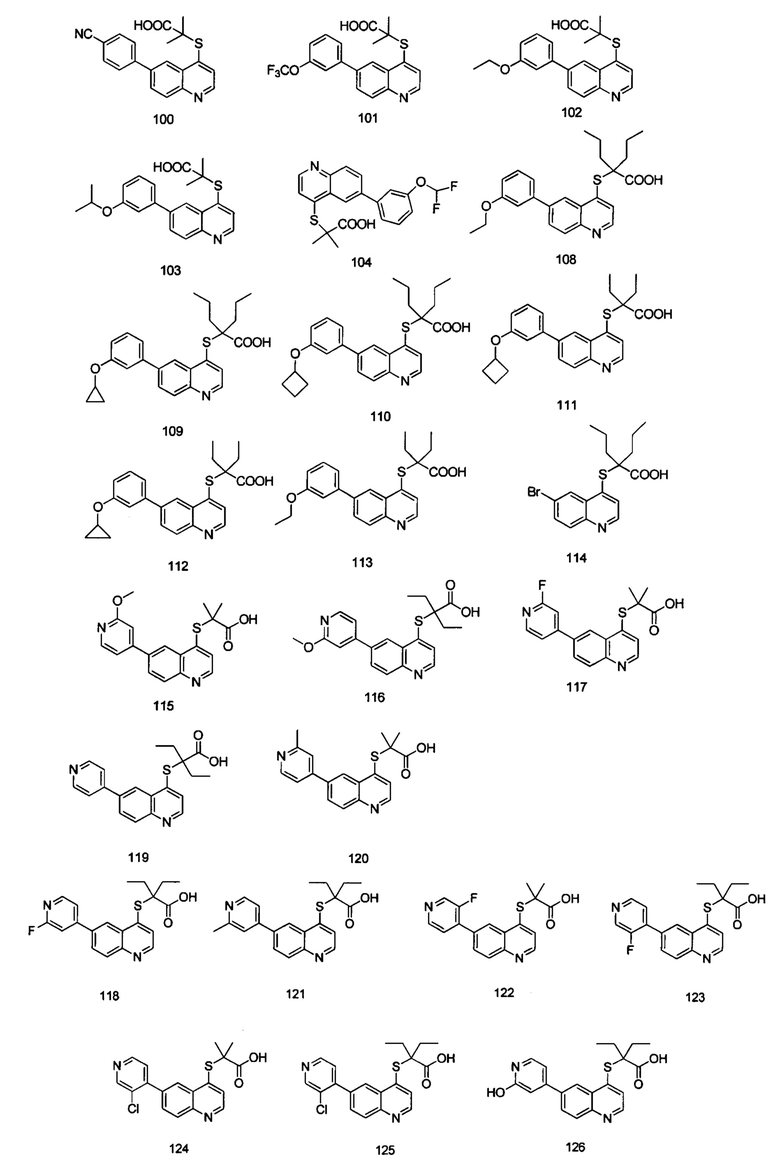
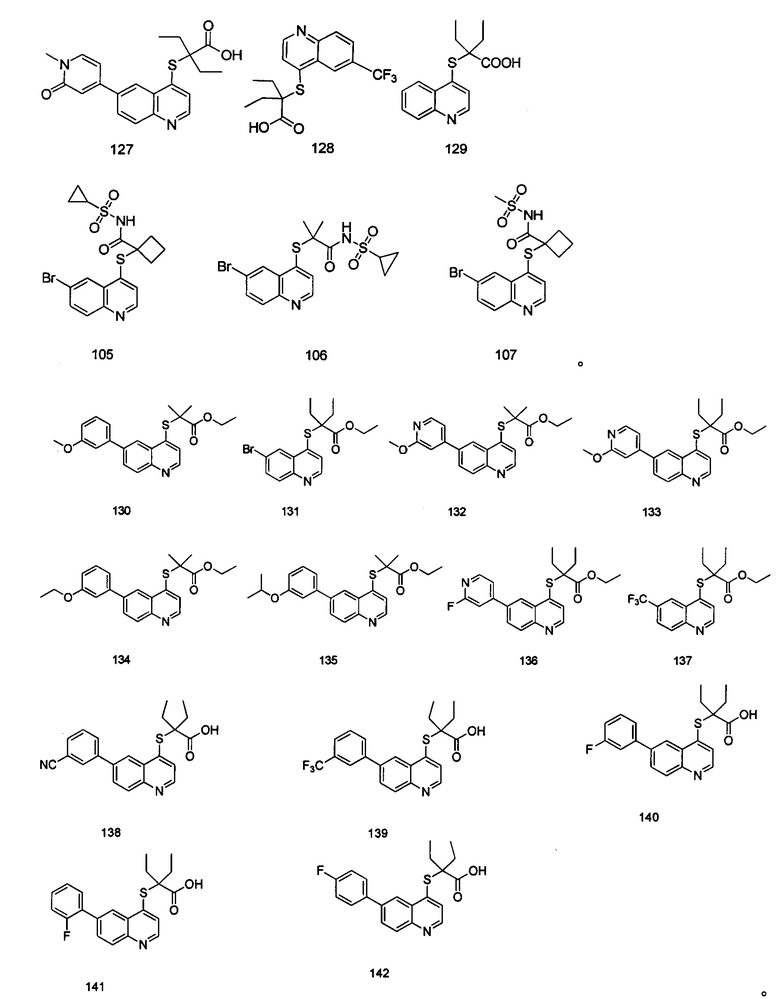
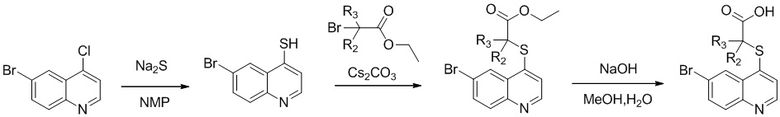
В настоящем изобретении предложен способ получения указанных соединений, включающий процедуру, выполняемую по следующей схеме,
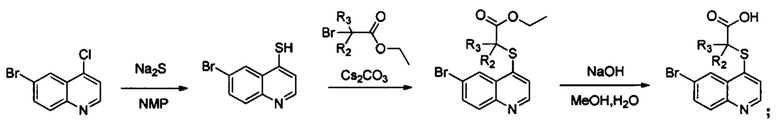
или включающий процедуру, выполняемую по следующей схеме,
В настоящем изобретении предложено применение указанных соединений или его оптических изомеров или сольватов или фармацевтически приемлемых солей или пролекарств для получения лекарственных средств, ингибирующих URAT1. Кроме того, указанные лекарственные средства применяют для предотвращения и/или лечения подагры, рецидивирующего приступа подагры, подагрического артрита, гиперурикемии, гипертонии, сердечно-сосудистых заболеваний, коронарной болезни сердца, синдрома Леша-Нихана, синдрома Кернса-Сайре, нефропатии, почечного камня, почечной недостаточности, воспаления суставов, артрита, мочекаменной болезни, отравления свинцом, гиперпаратиреоза, псориаза, саркоидоза или заболевания, вызванного недостатком гипоксантин-гуанинфосфорибозилтрансферазы, и лекарственные средства для предотвращения и/или лечения подагры или гиперурикемии являются предпочтительными.
В настоящем изобретении также предложена комбинация, которая представляет собой состав, полученный с соединениями или их оптическими изомерами или сольватами или фармацевтически приемлемыми солями или пролекарствами согласно формуле изобретения, совместно с фармацевтически приемлемыми вспомогательными веществами. В настоящем изобретении также предложено применение указанной комбинации для получения лекарственных средств, ингибирующих URAT1.
Кром того, указанные лекарственные средства применяют для предотвращения и/или лечения подагры, рецидивирующего приступа подагры, подагрического артрита, гиперурикемии, гипертонии, сердечно-сосудистых заболеваний, коронарной болезни сердца, синдрома Леша-Нихана, синдрома Кернса-Сайре, нефропатии, почечного камня, почечной недостаточности, воспаления суставов, артрита, мочекаменной болезни, отравления свинцом, гиперпаратиреоза, псориаза, саркоидоза или заболевания, вызванного недостатком гипоксантин-гуанинфосфорибозилтрансферазы, и лекарственные средства для предотвращения и/или лечения подагры или гиперурикемии являются предпочтительными.
Различные соединения и их соли, гидраты или оптические изомеры или сольваты или фармацевтически приемлемые соли или пролекарства, предложенные в настоящем изобретении, являются своего рода селективными ингибиторами реабсорбции мочевой кислоты, которые могут быть использованы для лечения гиперурикемии и подагры путем стимуляции экскреции мочевой кислоты организма и снижения количества сывороточной мочевой кислоты и имеют эффект снижения количества мочевой кислоты в организме животного и в организме человека.
Кроме того, у соединений по настоящему изобретению их изотопно замещенные формы, такие как дейтерий, тритий, 14С и 15N замещенные соединения, имеют ту же активность и области применения. Например, изотопно замещенные формы могут быть получены заменой водорода дейтерием и/или тритием. Аналогичным образом, природный распространенный 12С может быть заменен на 13С или 14С, природный распространенный 14N на 15N и природный распространенный 1бО на 17O или 18O и ту же самую или любую комбинацию.
В настоящем изобретении указанный C1-C6 -алкил обозначает C1, С2, С3, С4, C5 и С6 -алкилы, то есть линейный или разветвленный алкил с 1-6 атомами углерода, такой как метил, этил, пропил, бутил, пентил, гексил, изопропил, изобутил, трет-бутил, втор-бутил, трет-бутилметил и тому подобное.
В настоящем изобретении указанный C3-C6 -циклоалкил обозначает С3, С4, С5 и С6 -циклический алкил, содержащий 3-6 атомов углерода, такой как циклопропил, циклобутил, циклопентил, циклогексил, циклопропилметил, циклобутилметил, циклопентилметил и так далее.
В настоящем изобретении «фармацевтически приемлемый» означает, что определенные носители, среды, разбавители, адъюванты и/или полученные соли обычно совместимы химически или физически с другими компонентами лекарственной формы лекарственного средства, а также физиологически совместимы с рецептором.
В настоящем изобретении «соли» относятся к кислотным и/или основным солям, образованным соединениями или их стереоизомерами с неорганическими и/или органическими кислотами или основаниями, а также включают амфотерные ионные соли (внутренние соли) и дополнительно включают соли четвертичного аммония, такие как соли алкиламмония. Указанные соли могут быть непосредственно получены после окончательного разделения и очистки соединений, а также могут быть получены путем соответствующего смешивания соединений или их стереоизомеров с определенным количеством кислоты или основания (например, равной эквивалентности). Указанные соли могут осаждаться в растворе и их собирают фильтрованием или получают после выпаривания растворителя, или получают путем лиофилизации после реакции в водной среде. В настоящем изобретении указанными солями могут быть гидрохлорат, сульфат, цитрат, бензолсульфонат, гидробромат, гидрофторид, фосфат, ацетат, пропионат, сукцинат, оксалат, малат, сукцинат, фумарат, малеат, тартрат или трифторацетат соединений, а также могут быть щелочные соли металлов, такие как натриевая соль, калиевая соль. Очевидно, что на основе вышеприведенного содержания настоящего изобретения другие различные виды модификации, изменений или вариаций могут быть реализованы в соответствии с обычными техническими знаниями и обычными средствами в данной области техники, не отступая от основных технических идей настоящего изобретения. Вышеуказанное содержание настоящего изобретения будет дополнительно подробно разъяснено со ссылкой на конкретные варианты реализации примеров. Однако не следует истолковывать, что указанный выше объем настоящего изобретения ограничивается только следующими примерами. Все технологии, реализованные на основе, вышеуказанного содержания настоящего изобретения, относятся к объему настоящего изобретения.
Варианты реализации
Общая схема реакции была описана ниже:
Пример 1:
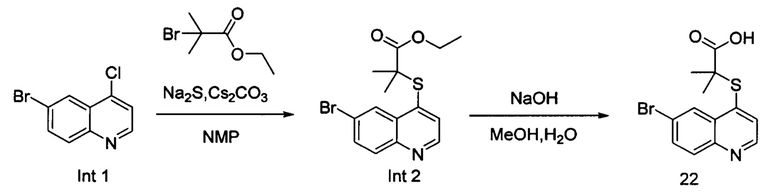
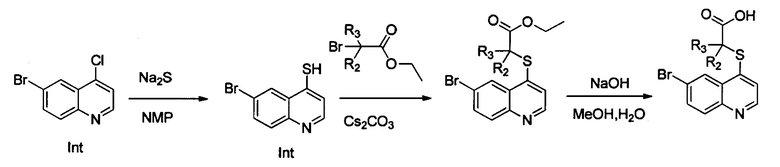
Синтез этил-2-((6-бромхинолин-4-ил)тио)-2-метилпропаноата (Int. 2)
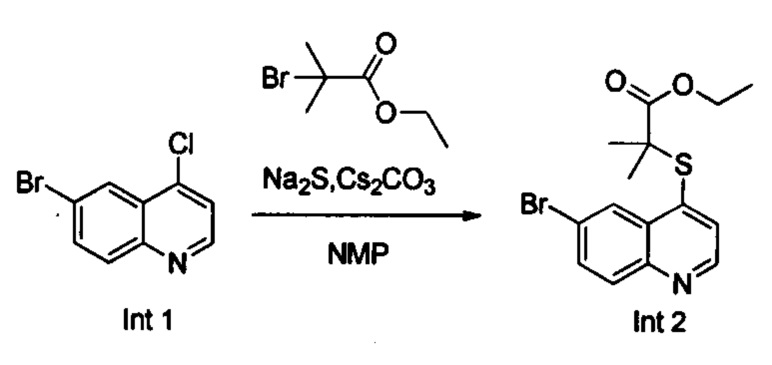
В реакционную емкость объемом 100 мл добавляли 6-бром-4-хлорхинолин (2,42 г, 10 ммоль), сульфид натрия (1,17 г, 15 ммоль), и N-метилпирролидон (30 мл), и смесь нагревали до 120°С и оставляли взаимодействовать в течение 2 часов, затем к ней добавляли CS2CO3 (6,52 г, 20 ммоль) и этил 2-бром-2-метилпропаноат (2,15 г, 11 ммоль). Смесь продолжала взаимодействовать при 100°С в течение 2 часов. После завершения реакции добавляли воду (150 мл) и реакционную смесь экстрагировали этилацетатом трижды (3×100 мл). Органические слои объединяли, промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали с помощью роторного испарителя. Остаток очищали с помощью колоночной хроматографии с получением Int 2 (2,1 г, выход 60%), MS: 354, 356 (М+Н+).
Синтез 2-((6-бромхинолин-4-ил)тио)-2-метилпропановой кислоты (22)
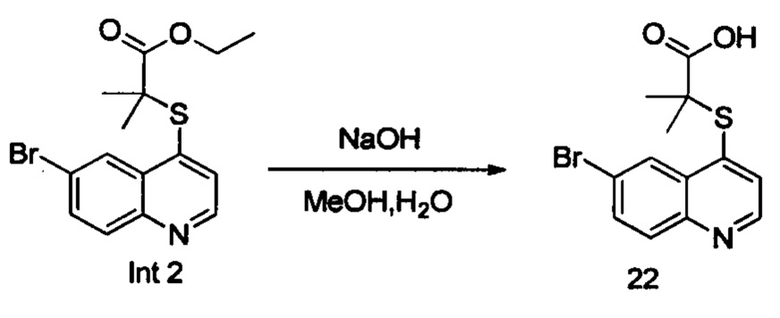
В реакционную емкость объемом 100 мл добавляли Int. 2 (354 мг, 1 ммоль), СН3ОН (5 мл) и воду (5 мл), и смесь оставляли взаимодействовать при комнатной температуре в течение 16 часов. После завершения реакции смесь доводили до рН примерно 5 с помощью 2N HCl на ледяной бане, затем фильтровали. Фильтрационный остаток промывали водой (10 мл) и сушили с получением соединения 22 (228 мг, выход 70%). 1Н ЯМР (400 МГц, ДМСО): δ (ppm) 13,09 (s, 1Н), 8,89 (d, J=4,0 Гц, 1Н), 8,51 (d, J=4,0 Гц, 1Н), 7,96 (m, 2Н), 7,64 (d, J=4,0 Гц, 1Н), 1,55 (s, 6Н). MS: 326,1, 328,1 (М+Н+).
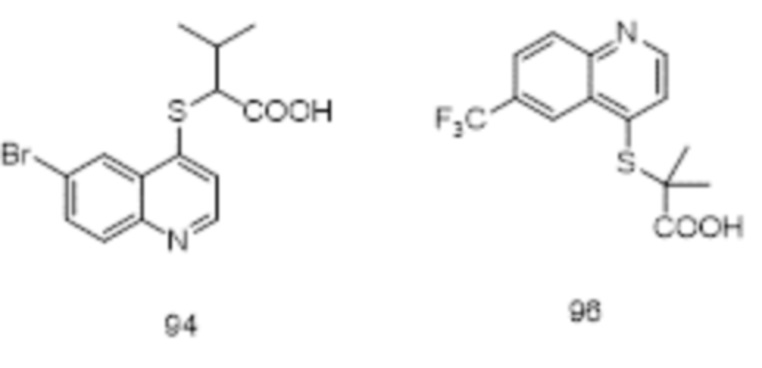
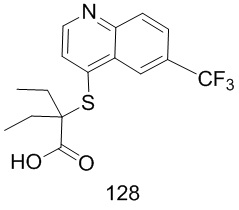
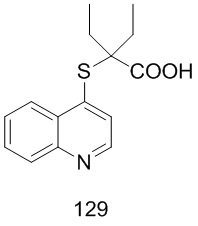
Целевые продукты 23, 24, 83, 93, 94, 95, 96, 114, 128, 129 были синтезированы в соответствии с тем же способом, с использованием соответствующих реагентов.
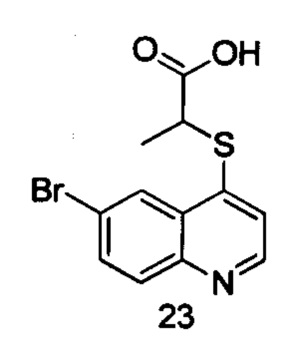
Продукт 23 (2-(6-бромхинолин-4-илтио)пропановая кислота): 312,0, 314,0 (М+Н+).
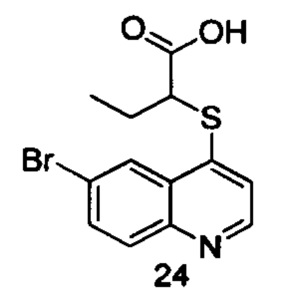
Продукт 24 (2-(6-бромхинолин-4-илтио)бутановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 13,22 (s, 1Н), 8,81 (d, J=4,8 Гц, 1Н), 8,28 (d, J=l,2 Гц, 1H), 7,99-7,94 (m, 2Н), 7,65 (d, J=4,8 Гц, 1Н), 4,29 (t, J=7,2 Гц, 1Н), 2,01-1,90 (m, 2Н), 1,06 (t, J=7,2 Гц, 3H); MS: 325,9, 327,9 (М+Н+).
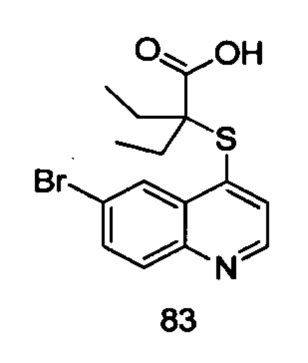
Продукт 83 (2-(6-бромхинолин-4-илтио)-2-этилбутановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 13,09 (s, 1Н), 8,87(d, J=4,0 Гц, 1H), 8,56 (d, J=4,0 Гц, 1Н), 7,96 (m, 2Н), 7,61 (d, J=4,0 Гц, 1Н), 1,84-1,77 (m, 4Н), 0,92 (t, 6Н). MS: 354,0, 356,0 (М+Н+).
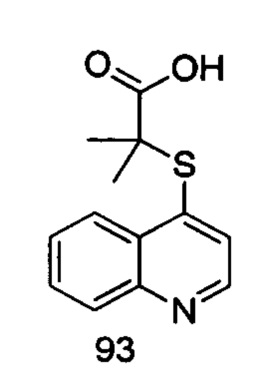
Продукт 93 (2-(хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (CDCl, 400 МГц): δ (ppm) 8,60 (d, J=4,0 Гц, 1Н), 8,35 (d, J=4,0 Гц, 1Н), 8,07 (d, J=4,0 Гц, 1Н), 7,65 (m, 2Н), 7,51 (t, J=4,0 Гц, 1Н), 1,81 (t, 6Н). MS: 324,1 (М+Н+).
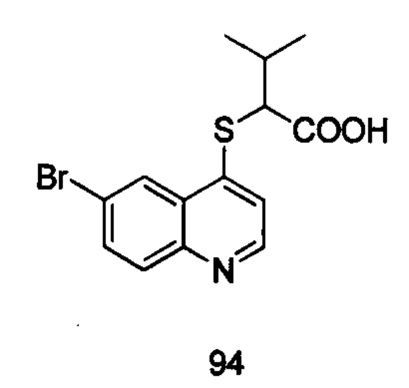
Продукт 94 (2-(6-бромхинолин-4-илтио)-3-метилбутановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 13,10 (s, 1Н), 8,79 (d, J=8,0 Гц, 1Н), 8,29 (d, J=4,0 Гц, 1H), 7,96 (m, 2Н), 7,61 (d, J=8,0 Гц, 1H), 4,13 (d, J=7,6 Гц, 1Н), 2,27-2,24 (m, 1Н), 1,14-1,10 (t, 6Н). MS: 340,0, 342,0 (М+Н+).
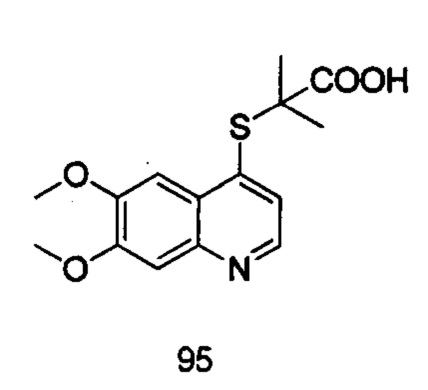
Продукт 95 (2-(6,7-диметоксихинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 8,62 (d, J=4,0 Гц, 1Н), 7,67 (s, 1H), 7,45 (d, J=4,0 Гц, 1Н), 7,40 (1Н, s), 3,94 (6Н, s), 1,51 (6Н, s); MS: 308,1 (М+Н+).
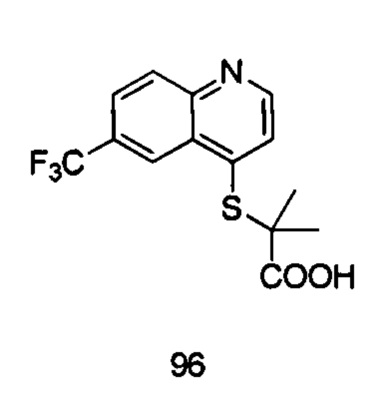
Продукт 96 (2-(6-трифторметилхинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 13,10 (s, 1H), 8,96 (d, J=8,0 Гц, 1Н), 8,28 (d, J=4,0 Гц, 1Н), 8,05 (m, 2Н), 7,40 (d, J=8,0 Гц, 1Н), 1,5 (s, 6Н); MS: 316,0 (М+Н+).
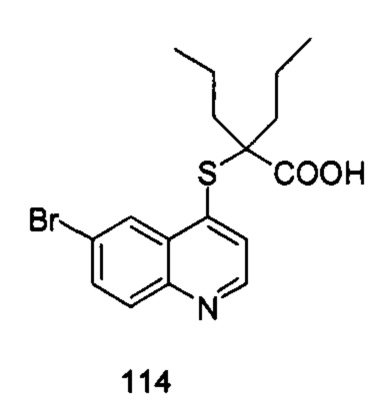
Продукт 114 (2-(6-бромхинолин-4-илтио)-2-пропилпентановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm): 8,84 (d, J=4,0 Гц, 1H), 8,54 (d, J=4,0 Гц, 1H), 7,94 (m, 2H), 7,61 (d, J=4,0 Гц, 1H), 1,78-1,65 (m, 4H), 1,46-1,29 (m, 4H), 0,89-0,82 (m, 6H); MS: 381,9, 383,9 (M+H+).
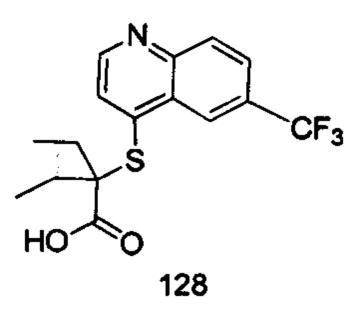
Продукт 128 (2-(6-трифторметил-хинолин-4-илтио)-2-пропилпентановая кислота): 1H ЯМР (ДМСО, 400 МГц): δ (ppm): 13,01 (s, 1Н), 8,81 (d, J=4,0 Гц, 1Н), 8,47 (d, J=4,0 Гц, 1Н), 7,94 (m, 2Н), 7,59 (d, J=4,0 Гц, 1Н), 1,77-1,62 (m, 4Н), 1,45-1,27 (m, 4Н), 0,87-0,80 (m, 6Н); MS: 344,1 (М+Н+).
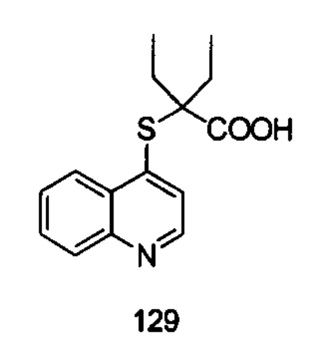
Продукт 129 (2-(хинолин-4-илтио)-2-пропилпентановая кислота) MS: 276,1 (М+Н+) Пример 2:
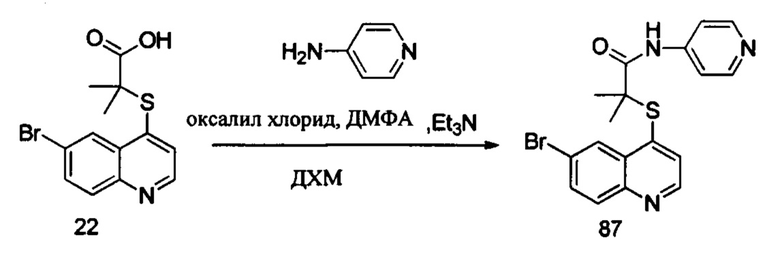
Синтез продукта 87
В реакционную емкость объемом 100 мл добавляли Int.2 (325 мг, 1 ммоль), дихлорметан (10 мл), ДМФА (20 мг) и затем добавляли оксалил хлорид (1 г, 8 ммоль). Смесь нагревали до 40°С и оставляли взаимодействовать в течение 1 часа, и концентрировали досуха. Затем добавляли CH2Cl2 (10 мл) и триэтиламин (500 мг, 5 ммоль) и наконец добавляли 4-аминопиридин (190 мг, 2 ммоль). Смесь нагревали до 40°С и она реагировали в течение 1 часа. После завершения реакции добавляли воду (50 мл) и смесь трижды экстрагировали этилацетатом (3×50 мл). Органические слои объединяли, промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали с помощью роторного испарителя. Остаток очищали с помощью колоночной хроматографии с получением продукта 87 (160 мг, выход 40%). MS: 401,0, 403,0 (М+Н+).
Целевые продукты 88, 89, 90, 91, 92 были синтезированы в соответствии с тем же способом, с использованием соответствующих реагентов.
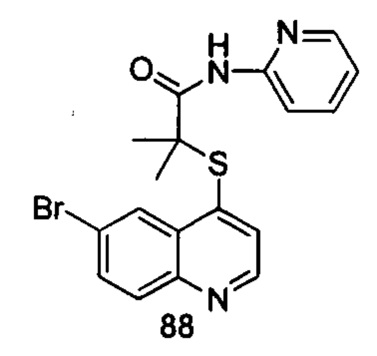
Продукт 88 (2-(6-бромхинолин-4-илтио)-2-метилпропионил-(2-аминопиридин)): MS: 401,0, 403,0 (М+Н+).
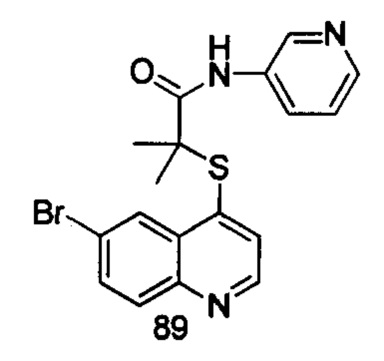
Продукт 89 (2-(6-бромхинолин-4-илтио)-2-метилпропионил-(3-амино пиридин)): MS: 401,0, 403,0 (М+Н+).
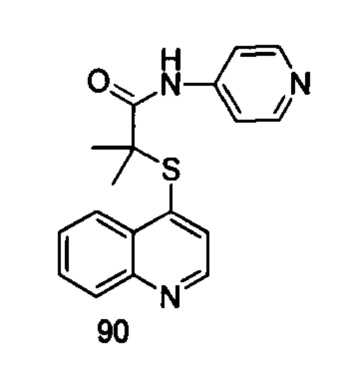
Продукт 90 (2-(хинолин-4-илтио)-2-метилпропионил-(4-аминопиридин)): MS: 324,1 (М+Н+).
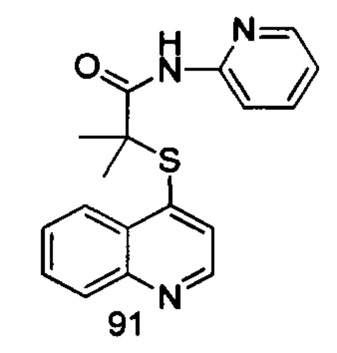
Продукт 91 (2-(хинолин-4-илтио)-2-метилпропионил-(2-аминопиридин)): MS: 324,1 (М+Н+).
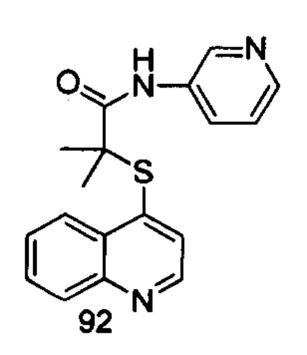
Продукт 92 (2-(хинолин-4-илтио)-2-метилпропионил-(3-аминопиридин)): MS: 324,1 (M+H+).
Пример 3:
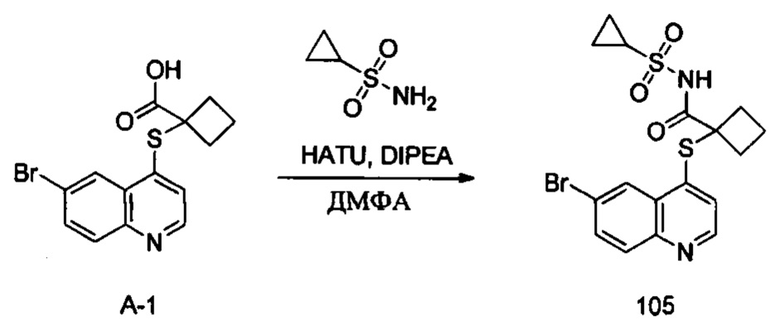
В реакционную емкость объемом 50 мл добавляли Int. А-1 (112 мг, 0,33 ммоль), циклопропансульфонамид (52 мг, 0,43 ммоль), HATU (163 мг, 0,43 ммоль), DIPEA (129 мг, 1 ммоль) и ДМФА (3 мл) и перемешивали при комнатной температуре в течение 16 часов. После завершения реакции добавляли воду (20 мл) и смесь экстрагировали этилацетатом (15 мл × 3) и сушили с помощью роторного испарителя. Остаток очищали с помощью преп-ВЭЖХ с получением соединения 105 (50 мг, выход 34%). 1Н ЯМР (400 МГц, CDCl3) δ 8,70 (d, J=4,6 Hz, 1H), 8,23 (d, J=2,0 Hz, 1H), 8,01 (d, J=8,8 Гц, 1H), 7,85 (m, 1H), 6,95 (d, J=4,8 Гц, 1H), 3,18-3,10 (m, 2H), 2,83-2,73 (m, 2H), 2,42 (dd, J=11,2 Гц, 2H), 2,26-2,14 (m, 1H), 1,18-l,12 (m, 2H), 0,91-0,84 (m, 2H). MS: 440,8, 442,8 (M+H+).
Соединения 106 и 107 были получены в соответствии с тем же способом получения, с использованием соответствующих исходных веществ.
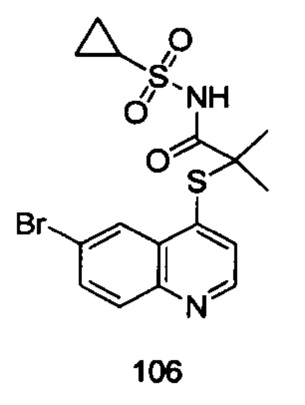
Продукт 106 2-(6-бромхинолин-4-илтио)-N-(циклопропилсульфонил)-2-метилпропанамид: 1Н ЯМР (400 МГц, CDCl3) δ 8,78 (d, J=4,7 Hz, 1Н), 8,41 (d, J=2,1 Hz, 1H), 8,02 (d, J=8,9 Hz, 1H), 7,85 (m, 1H,), 7,33 (d, J=4,6 Гц, 1Н), 2,98-2,90 (m, 2H), 1,73 (s, 6H), 2,26-2,14 (m, 1H), 1,38-1,31 (m, 2H); MS: 428,8, 430,8 (M+H+).
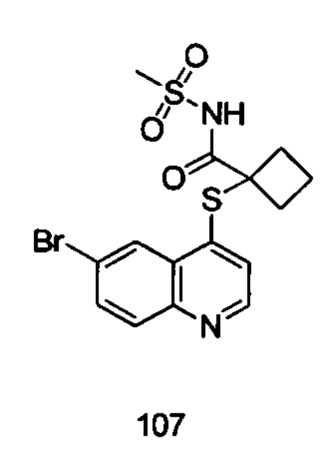
Продукт 107 1-(6-бромхинолин-4-илтио)-N-(метилсульфонил)циклобутил-1-формамид (107): MS: 414,8, 416,8 (M+H+).
Пример 4:
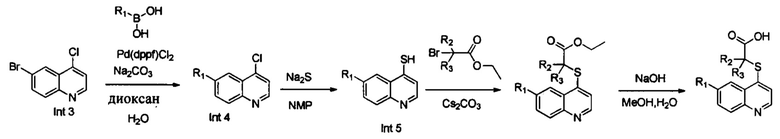
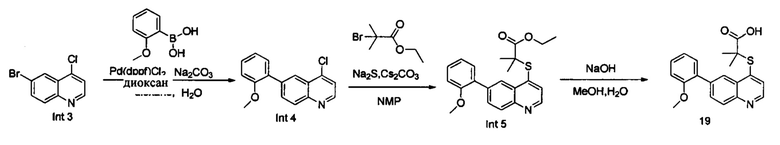 Синтез Int. 4
Синтез Int. 4
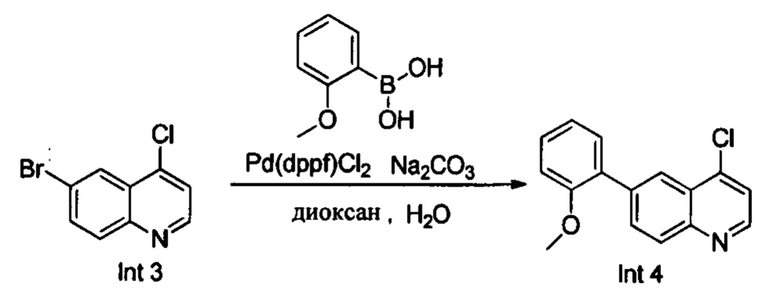
В реакционную емкость объемом 50 мл добавляли Int. 3 (241 мг, 1 ммоль), 2-метоксифенилборную кислоту (152 мг, 1 ммоль), Na2CO3 (212 мг, 2 ммоль), Pd(dppf)Cl2 (37 мг, 0,05 ммоль), диоксан (6 мл) и воду (3 мл), и затем продували азотом. Смесь нагревали до 110°С в защитной атмосфере азота N2 и оставляли взаимодействовать в течение 2 часов. После завершения реакции добавляли воду (50 мл) и смесь трижды экстрагировали этилацетатом (3×50 мл). Органические слои объединяли, промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и выпаривали на роторном испарителе. Остаток очищали с помощью колоночной хроматографии с получением Int. 4 (190 мг, выход 50%). MS: 270,0, 272,0 (М+Н+).
Синтез Int. 5
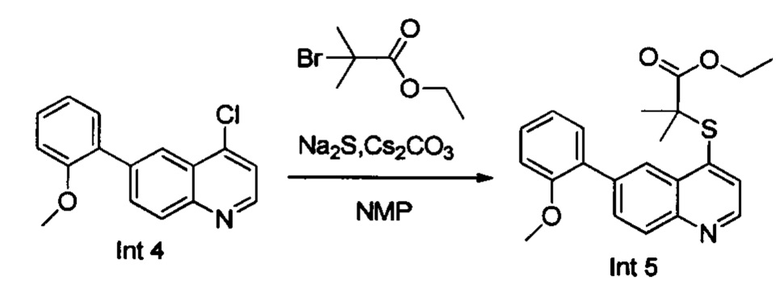
В реакционную емкость объемом 100 мл добавляли Int. 4 (2,69 г, 10 ммоль), Na2S (1,17g, 15 ммоль), N-метилпирролидон (30 мл), и смесь нагревали до 120°С и оставляли взаимодействовать в течение 2 часов. Затем в реакционную емкость добавляли CS2CO3 (6,52 г, 20 ммоль) и этил-2-бром-2-метилпропаноат (2,15 г, 11 ммоль) и реакционную смесь продолжали нагревать до 100°С в течение 2 часов. После завершения реакции добавляли 150 мл воды и реакционную смесь трижды экстрагировали этилацетатом (3×100 мл). Органические слои объединяли, промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и выпаривали на роторном испарителе. Остаток очищали с помощью колоночной хроматографии с получением Int. 5 (2,1 г, выход 60%). MS: 382,0 (М+Н+).
Синтез 19
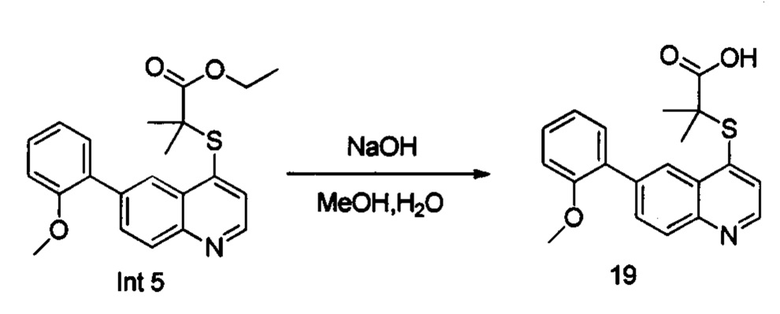
В реакционную емкость объемом 100 мл добавляли Int. 5 (381 мг, 1 ммоль), СН3ОН (5 мл) и воду (5 мл) и смесь оставляли взаимодействовать при комнатной температуре в течение 16 часов. После завершения реакции реакционную смесь доводили до рН примерно 5 с помощью 2N HCl на ледяной бане и фильтровали. Фильтрационный остаток промывали водой (10 мл) и сушили с получением соединения 19 (247 мг, выход 70%). MS: 354,1 (М+Н+).
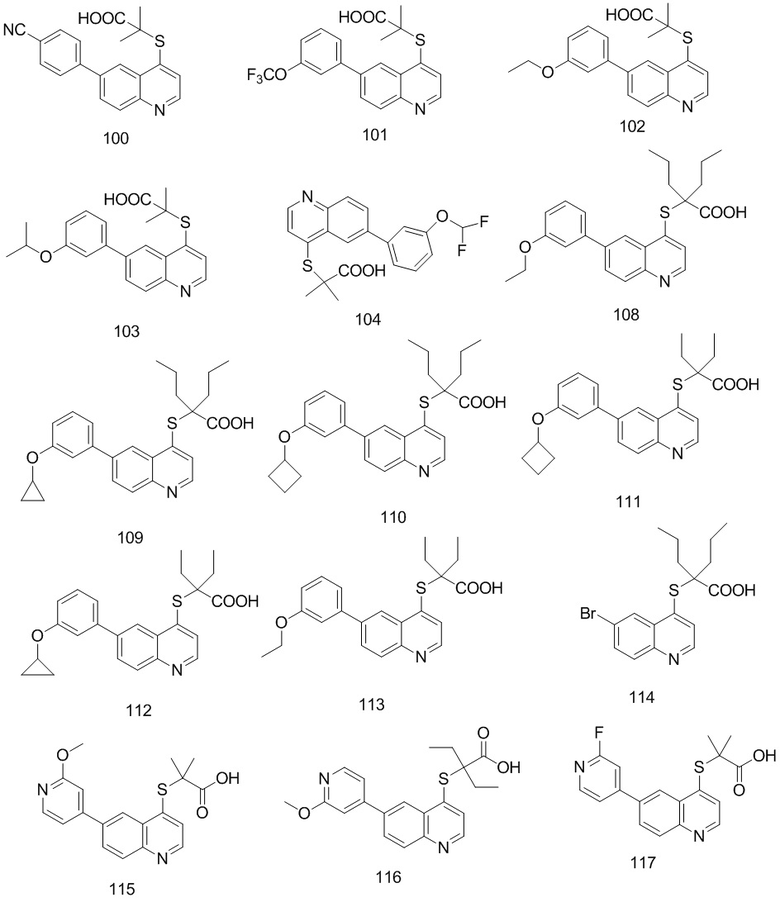
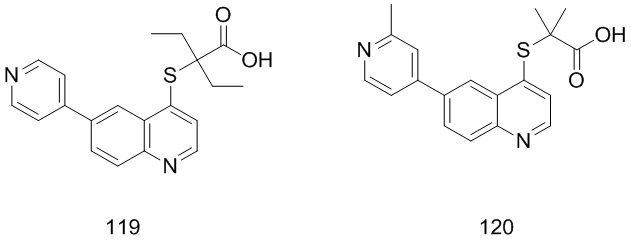
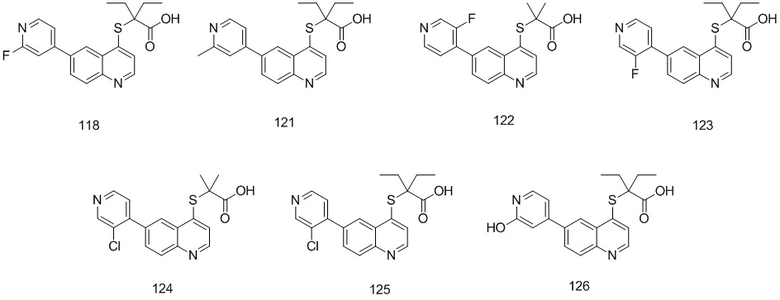
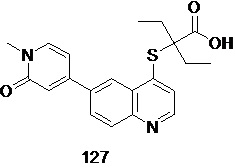
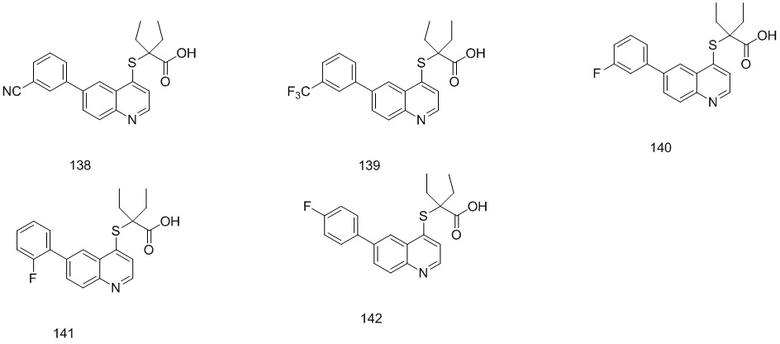
Соединения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 21, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 84, 85, 86, 100, 101, 102, 103, 104, 108, 109, 110, 111, 112, 113, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 138, 139, 140, 141, 142 были синтезированы в соответствии с тем же способом, с использованием соответствующих реагентов.
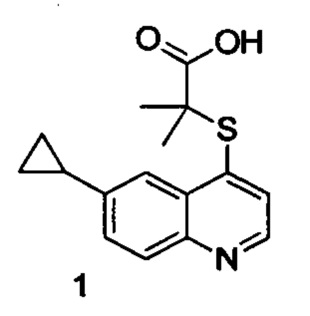
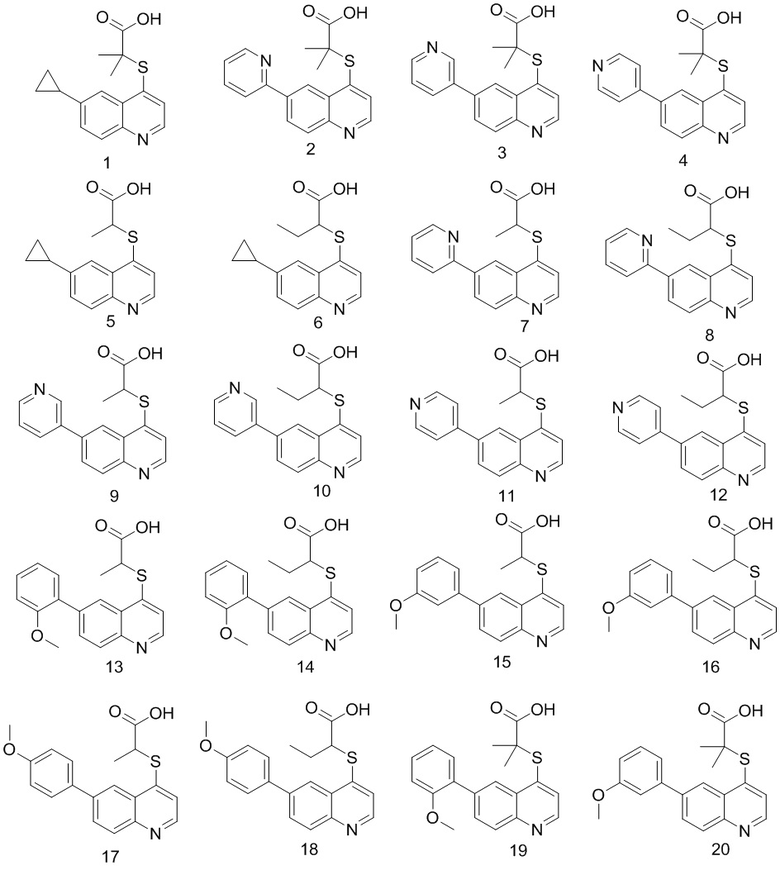
Продукт 1 (2-(6-циклопропилхинолин-4-илтио)-2-метилпропановая кислота: 1Н ЯМР (400 МГц, ДМСО): δ (ppm) 12,97 (s, 1H), 8,72 (d, J=4,0 Гц, 1Н), 8,03 (d, J=4,0 Гц, 1Н), 7,93 (d, J=4,0 Гц, 1Н), 7,52-7,47 (m, 2Н), 2,20-2,09 (m, 1Н), 1,55 (s, 6Н), 1,10-1,02(m, 2Н), 0,83-0,75 (m, 2Н). MS: 288,1 (М+Н+).
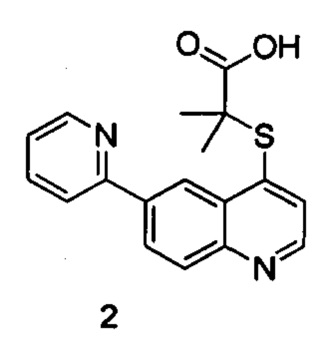
Продукт 2 (2-(6-(пиридин-2-ил)хинолин-4-илтио)-2-метилпропановая кислота): MS: 325,1 (М+Н+).
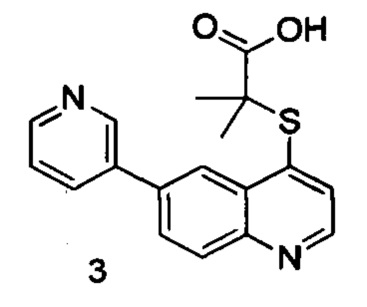
Продукт 3 (2-(6-(пиридин-3-ил)хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (400 МГц, ДМСО): δ (ppm) 12,94 (s, 1Н), 9,04 (d, J=4,0 Гц, 1Н), 8,88 (m, 1Н), 8,66-8,62 (m, 2Н), 8,22-8,16 (m, 3H), 7,66 (d, J=4,0 Гц, 1Н), 7,58 (m, 1Н), 1,58 (s, 6Н). MS: 325,1 (М+Н+).
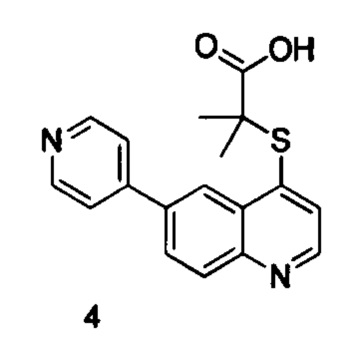
Продукт 4 (2-(6-(пиридин-4-ил)хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (400 МГц, ДМСО): δ (ppm) 13,00 (s, 1Н), 8,90 (d, J=4,0 Гц, 1Н), 8,74-8,70 (m, 3H), 8,22-8,20 (m, 2Н), 7,86 (m, 2Н), 7,67 (d, J=4,0 Гц, 1H), 1,58 (s, 6Н). MS: 325,1 (М+Н+).
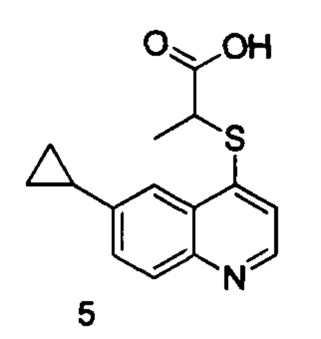
Продукт 5 (2-(6-циклопропилхинолин-4-илтио)пропановая кислота: MS: 274,1 (М+Н+).
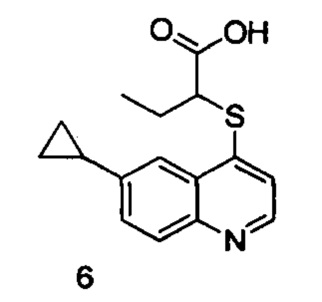
Продукт 6 (2-(6-циклопропилхинолин-4-илтио)бутановая кислота): MS: 288,1 (М+Н+).
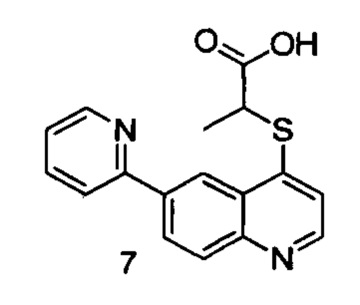
Продукт 7 (2-(6-(пиридин-2-ил)хинолин-4-илтио)пропановая кислота): MS: 311,1 (М+Н+).
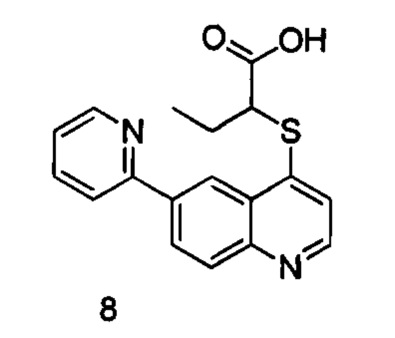
Продукт 8 (2-(6-(пиридин-2-ил)хинолин-4-илтио)бутановая кислота): MS: 325,1 (М+Н+). 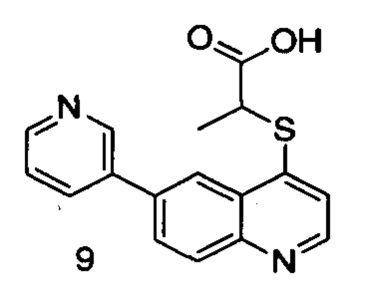
Продукт 9 (2-(6-(пиридин-3-ил)хинолин-4-илтио)пропановая кислота): MS: 311,1 (М+Н+).
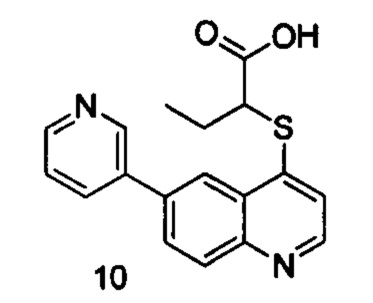
Продукт 10 (2-(6-(пиридин-3-ил)хинолин-4-илтио)бутановая кислота): MS: 325,1 (М+Н+).
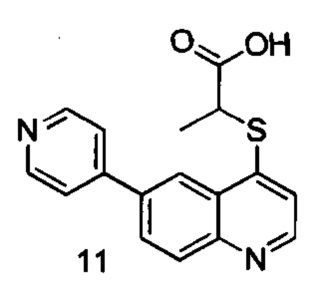
Продукт 11 2-((6-(пиридин-4-ил)хинолин-4-илтио)пропановая кислота): MS: 311,1 (М+Н+).
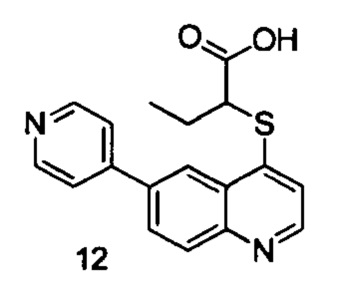
Продукт 12 (2-(6-(пиридин-4-ил)хинолин-4-илтио)бутановая кислота): MS: 325,1 (М+Н+).
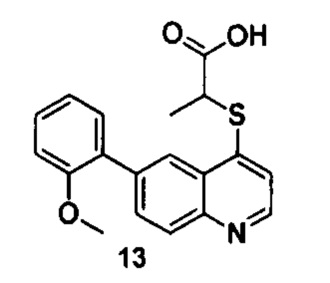
Продукт 13 (2-(6-(2-метоксифенил)-хинолин-4-илтио)пропановая кислота): MS: 340,1 (М+Н+).
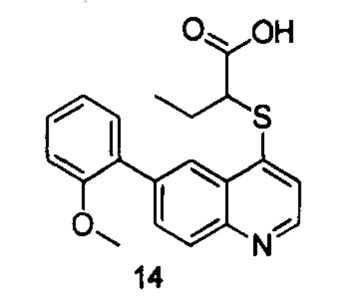
Продукт 14 (2-(6-(2-метоксифенил)хинолин-4-илтио)бутановая кислота): MS: 354,1 (М+Н+).
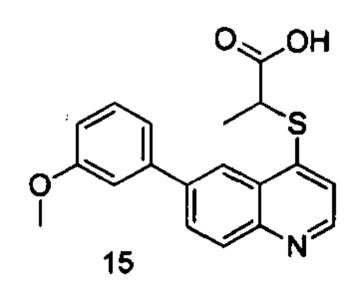
Продукт 15 (2-(6-(3-метоксифенил)-хинолин-4-илтио)пропановая кислота): MS: 340,1 (М+Н+).
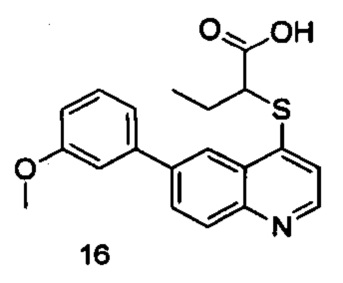
Продукт 16 (2-(6-(3-метоксифенил)-хинолин-4-илтио)бутановая кислота): MS: 354,1 (М+Н+).
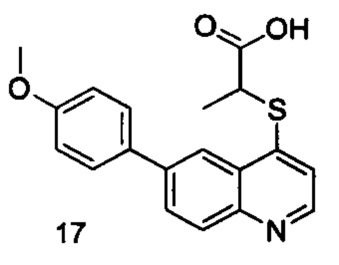
Продукт 17 (2-(6-(4-метоксифенил)-хинолин-4-илтио)пропановая кислота): MS: 340,1 (М+Н+).
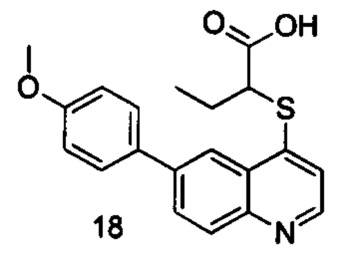
Продукт 18 (2-(6-(4-метоксифенил)хинолин-4-илтио)бутановая кислота): MS: 354,1 (М+Н+).
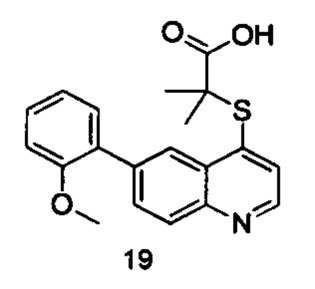
Продукт 19 (2-(6-(2-метоксифенил)-хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 12,98 (s, 1Н), 8,84 (d, J=4,0 Гц, 1Н), 8,43 (d, J=4,0 Гц, 1Н), 8,06 (d, J=4,0 Гц, 1Н), 7,95 (m, 1Н), 7,58 (d, J=4,0 Гц, 1H), 7,44-7,41 (m, 2Н), 7,19 (d, J=4,0 Гц, 1H), 7,13-7,09 (m, 1Н), 3,87 (s, 3H), 1,56 (s, 6Н); MS: 354,1 (М+Н+).
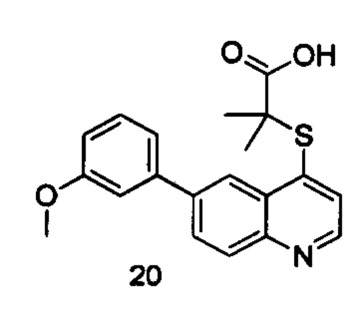
Продукт 20 (2-(6-(3-метоксифенил)-хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 8,92 (d, J=4,9 Гц, 1H), 8,55 (d, J=1,8 Гц, 1Н), 8,22 (dt, J=22,3, 5,3 Гц, 2Н), 7,67 (d, J=4,9 Гц, 1Н), 7,49 (t, J=7,9 Гц, 1H), 7,42-7,31 (m, 2Н), 7,05 (dd, J=8,1, 1,8 Гц, 1Н), 3,87 (s, 3H), 1,64 (s, 6Н); MS: 354,1 (М+Н+).
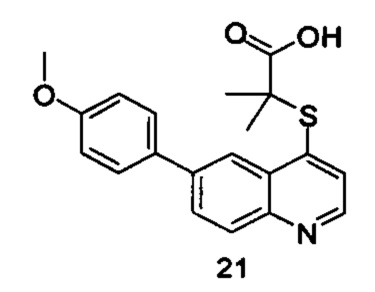
Продукт 21 (2-(6-(4-метоксифенил)хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 12,99 (s, 1Н), 8,81 (d, J=4,0 Гц, 1Н), 8,51 (d, J=4,0 Гц, 1Н), 8,10 (m, 2Н), 7,77 (d, J=4,0 Гц, 2Н), 7,60 (d, J=4,0 Гц, 1Н), 7,11 (d, J=4,0 Гц, 2Н), 3,84 (s, 3H), 1,57 (s, 6Н); MS: 354,1 (М+Н+).
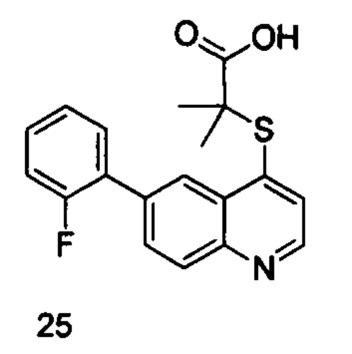
Продукт 25 (2-(6-(2-фторфенил)-хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 13,02 (s, 1Н), 8,88 (d, J=4,0 Гц, 1Н), 8,52 (d, J=4,0 Гц, 1Н), 8,15 (d, J=8,0 Гц, 1H), 8,02-8,0 (m, 1Н), 8,00-7,99 (m, 1Н),7,72 (d, J=8,0 Гц, 1H), 7,54-7,49 (m, 1H), 7,43-7,38 (m, 2Н), 1,57 (s, 6Н); MS: 342,0 (М+Н+).
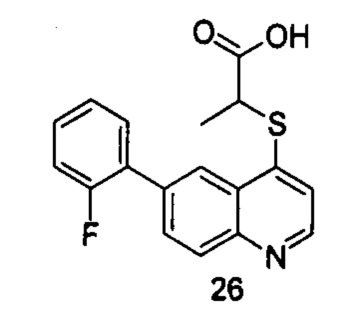
Продукт 26 (2-(6-(2-фторфенил)-хинолин-4-илтио)пропановая кислота): MS: 328,0 (М+Н+).
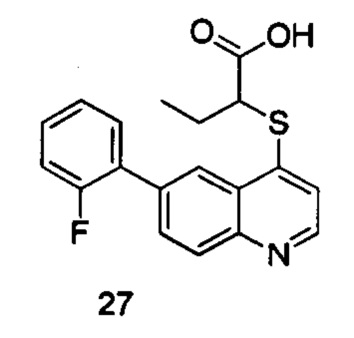
Продукт 27 (2-(6-(2-фторфенил)-хинолин-4-илтио)бутановая кислота): MS: 342,0 (М+Н+).
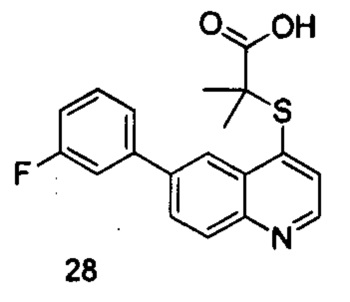
Продукт 28 (2-(6-(3-фторфенил)-хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 12,97 (s, 1Н), 8,87 (d, J=8,0 Гц, 1Н), 8,59 (s, 1Н), 8,18-8,13 (m, 2Н), 7,69-7,60 (m, 4Н), 7,32-7,27 (m, 1Н), 1,58 (s, 6Н); MS: 342,0 (М+Н+).
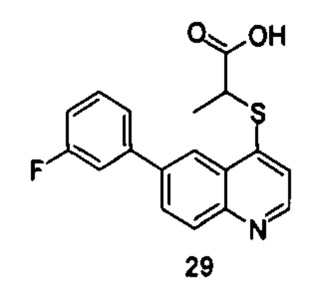
Продукт 29 (2-(6-(3-фторфенил)хинолин-4-илтио)пропановая кислота): MS: 328,0 (М+Н+).
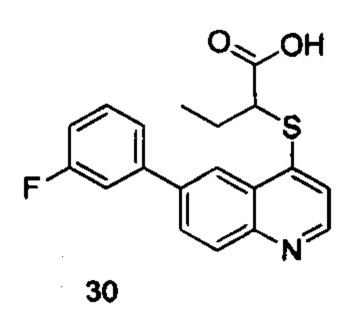
Продукт 30 (2-(6-(3-фторфенил)-хинолин-4-илтио)бутановая кислота): MS: 342,0 (М+Н+).
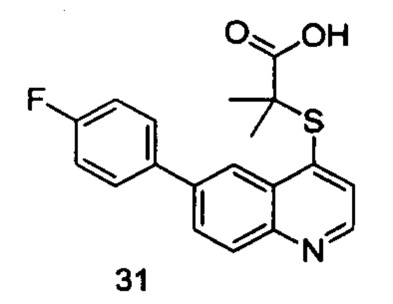
Продукт 31 (2-(6-(4-фторфенил)-хинолин-4-илтио)-2-метилпропановая кислота): MS: 342,0 (М+Н+).
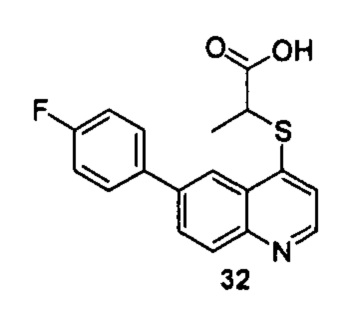
Продукт 32 (2-(6-(4-фторфенил)хинолин-4-илтио)пропановая кислота): MS: 328,0 (М+Н+).
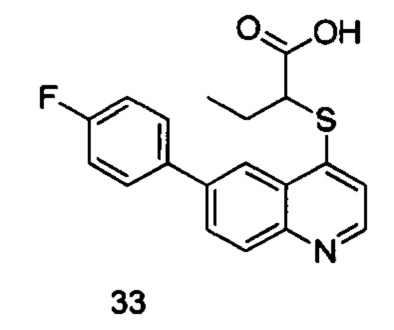
Продукт 33 (2-(6-(4-фтор-фенил)-хинолин-4-илтио)бутановая кислота): MS: 342,0 (М+Н+).
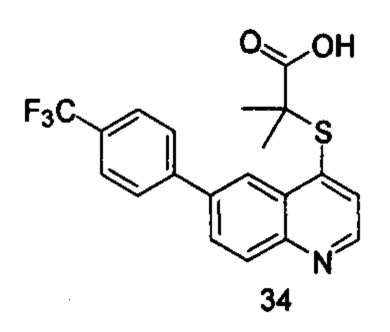
Продукт 34 (2-(6-(4-(трифторметил)фенил)хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 12,98 (s, 1Н), 8,89 (d, J=4,0 Гц, 1Н), 8,64 (s, 1Н), 8,19 (d, J=4,0 Гц, 2Н), 8,06 (d, J=4,0 Гц, 2Н), 7,91 (d, J=4,0 Гц, 2Н), 7,66 (d, J=4,0 Гц, 1Н), 1,57 (s, 6Н); MS: 392,0 (М+Н+).
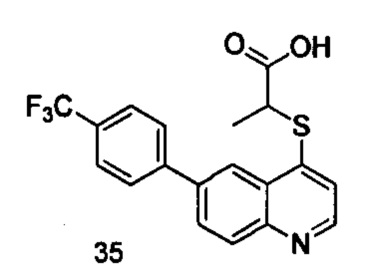
Продукт 35 (2-(6-(4-трифторметил-фенил)-хинолин-4-илтио)пропановая кислота): MS: 378,0 (М+Н+).
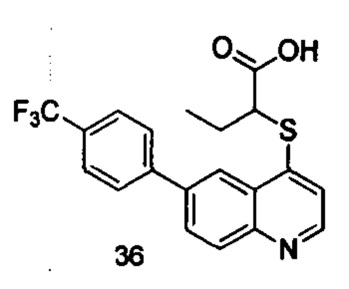
Продукт 36 (2-(6-(4-трифторметил-фенил)-хинолин-4-илтио)бутановая кислота): MS: 392,0 (М+Н+).
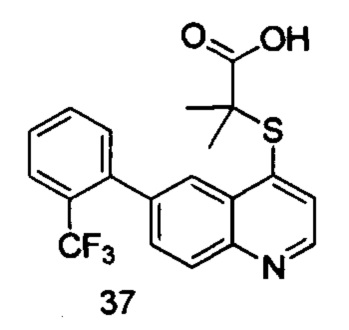
Продукт 37 (2-(6-(2-(трифторметил-фенил)-хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm) 13,02 (s, 1Н), 8,89 (d, J=4,0 Гц, 1Н), 8,25 (d, J=4,0 Гц, 1Н), 8,12 (d, J=8,0 Гц, 1Н), 7,91 (d, J=4,0 Гц, 1Н), 7,78-7,70 (m, 3H), 7,61-7,55 (m, 2Н), 1,53 (s, 6Н); MS: 392,0 (М+Н+).
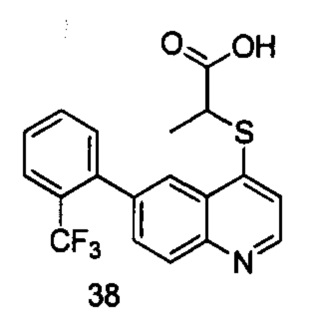
Продукт 38 (2-(6-(2-трифторметил-фенил)-хинолин-4-илтио)пропановая кислота): MS: 378,0 (М+Н+).
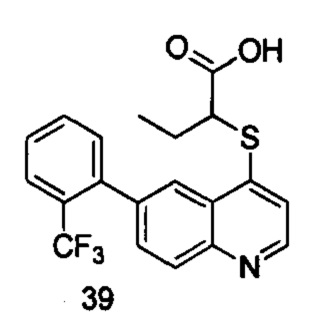
Продукт 39 (2-(6-(2-трифторметил-фенил)-хинолин-4-илтио)бутановая кислота): MS: 392,0 (М+Н+).
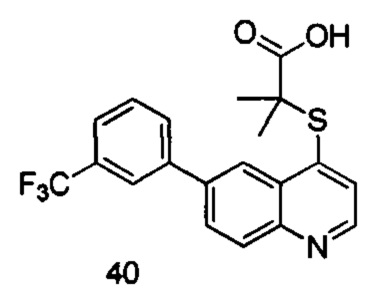
Продукт 40 (2-(6-(3-трифторметил-фенил)хинолин-4-илтио)-2-метилпропановая кислота): MS: 392,0 (М+Н+).
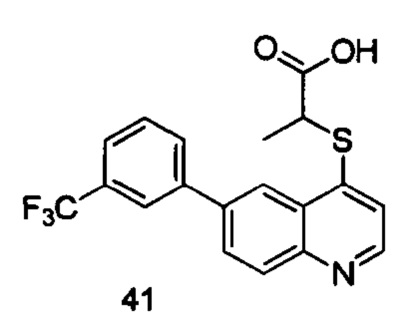
Продукт 41 (2-(6-(3-трифторметил-фенил)-хинолин-4-илтио)пропановая кислота): MS: 378,0 (М+Н+).
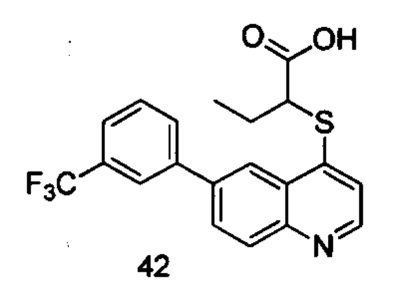
Продукт 42 (2-(6-(3-трифторметил-фенил)-хинолин-4-илтио)бутановая кислота): MS: 392,0 (М+Н+).
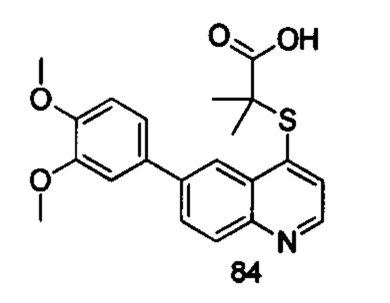
Продукт 84 (2-(6-(3,4-диметокси-фенил)-хинолин-4-илтио)-2-метилпропановая кислота): MS: 384,0 (М+Н+).
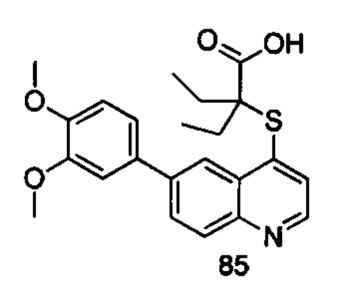
Продукт 85 (2-(6-(3,4-диметокси-фенил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 412,0 (М+Н+).
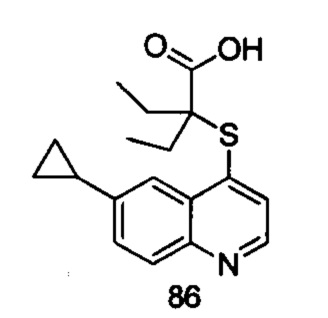
Продукт 86 (2-(6-циклопропилхинолин-4-илтио)-2-этилбутановая кислота): MS: 316,0 (М+Н+).
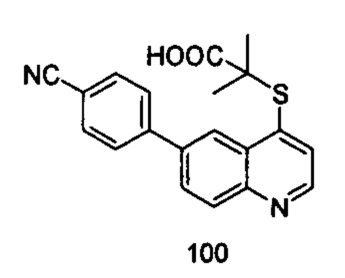
Продукт 100 (2-(6-(4-циано-фенил)-хинолин-4-илтио)-2-метилпропановая кислота): MS: 349,0 (М+Н+).
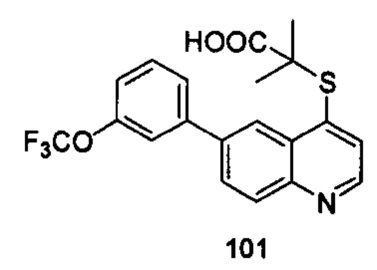
Продукт 101 (2-(6-(3-трифторметокси-фенил)-хинолин-4-илтио)-2-метилпропановая кислота (101): MS: 408,0 (М+Н+).
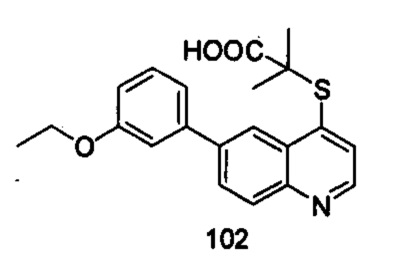
Продукт 102 (2-(6-(3-этокси-фенил)-хинолин-4-илтио)-2-метилпропановая кислота): MS: 368,0 (М+Н+).
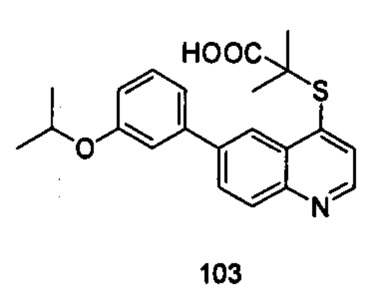
Продукт 103 (2-(6-(3-изопропокси-фенил)-хинолин-4-илтио)-2-метилпропановая кислота): MS: 382,0 (М+Н+).
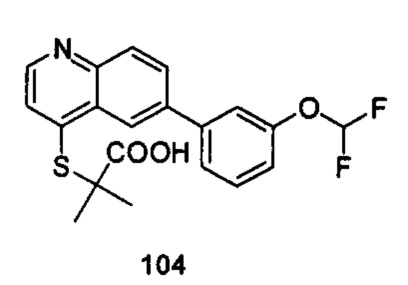
Продукт 104 (2-(6-(3-(дифторметокси-фенил)-хинолин-4-илтио)-2-метилпропановая кислота): MS: 390,0 (М+Н+).
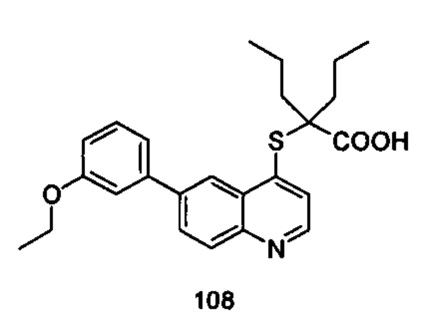
Продукт 108 (2-(6-(3-этокси-фенил)-хинолин-4-илтио)-2-пропилпентановая кислота): MS: 424,1 (М+Н+).
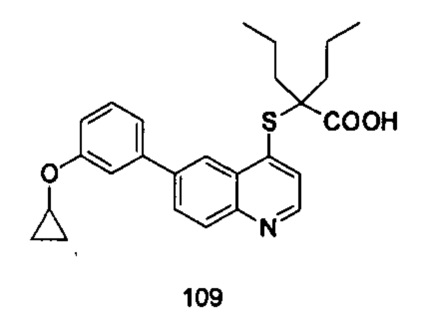
Продукт 109 (2-(6-(3-циклопропилокси-фенил)-хинолин-4-илтио)-2-пропилпентановая кислота): MS: 436,1 (М+Н+).
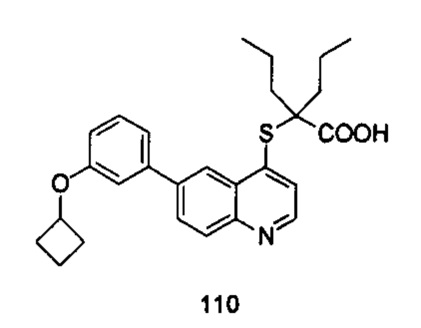
Продукт 110 (2-(6-(3-циклобутилокси-фенил)-хинолин-4-илтио)-2-пропилпентановая кислота): MS: 450,1 (М+Н+).
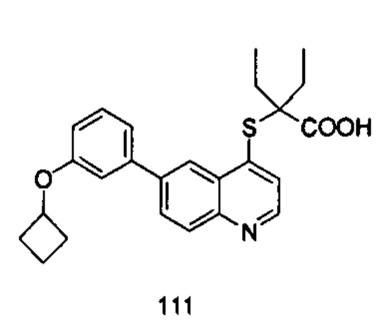
Продукт 111 (2-(6-(3-циклобутилокси-фенил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 422,1 (М+Н+).
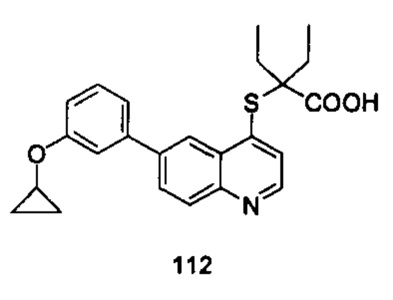
Продукт 112 (2-(6-(3-циклопропилокси-фенил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 408,1 (М+Н+).
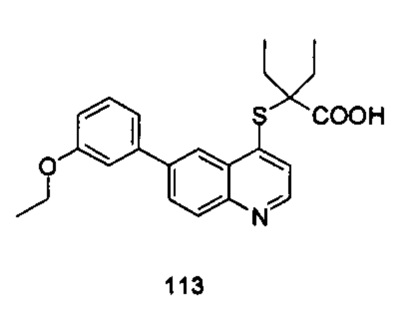
Продукт 113 (2-(6-(3-этокси-фенил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 396,1 (М+Н+).
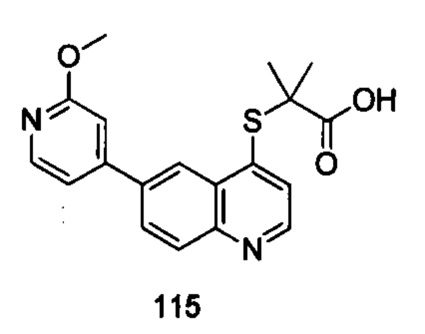
Продукт 115 (2-(6-(2-метоксипиридин-4-ил)хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm): 13,02 (s, 1Н), 8,95 (d, J=4,0 Гц, 1Н), 8,77 (d, J=4,0 Гц, 1Н), 8,36 (d, J=4,0 Гц, 1Н), 8,20 (m, 2Н), 7,66 (d, J=4,0 Гц, 1Н), 7,47 (m, 1Н), 7,24 (s, 1Н), 3,94 (s, 3H), 0,95-0,85 (m, 6Н); MS: 355,1 (М+Н+).
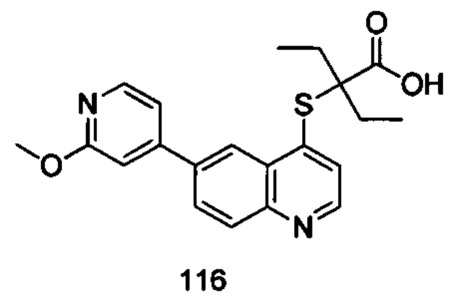
Продукт 116 (2-(6-(2-метоксипиридин-4-ил)хинолин-4-илтио)-2-этилбутановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm): 12,96 (s, 1Н), 8,87 (d, J=4,0 Гц, 1Н), 8,74 (d, J=4,0 Гц, 1H), 8,33 (d, J=4,0 Гц, 1Н), 8,18 (m, 2Н), 7,64 (d, J=4,0 Гц, 1Н), 7,44 (m, 1Н), 7,24 (s, 1Н), 3,94 (s, 3H), 1,91-1,82 (m, 4Н), 0,95-0,85 (m, 6Н); MS: 383,2 (М+Н+).
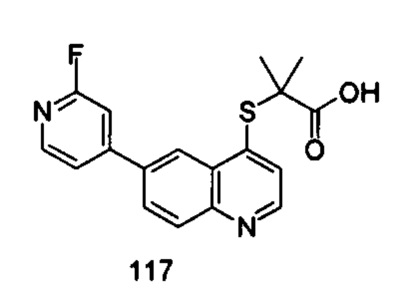
Продукт 117 (2-(6-(2-фторпиридин-4-ил)-хинолин-4-илтио)-2-метилпропановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm): 13,02 (s, 1Н), 8,95 (d, J=4,0 Гц, 1Н), 8,77 (d, J=4,0 Гц, 1Н), 8,36 (d, J=4,0 Гц, 1Н), 8,20 (m, 2Н), 7,66 (d, J=4,0 Гц, 1Н), 7,47 (m, 1Н), 7,24 (s, 1Н), 0,93 (m, 6Н); MS: 343,0 (М+Н+).
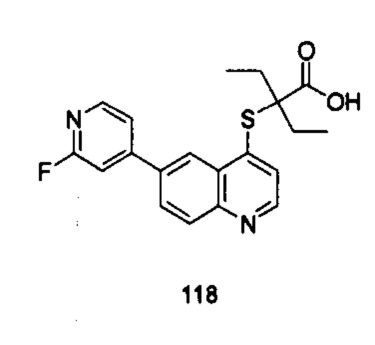
Продукт 118 (2-(6-(2-фторпиридин-4-ил)-хинолин-4-илтио)-2-этилбутановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm): 12,96 (s, 1Н), 8,87 (d, J=4,0 Гц, 1Н), 8,74 (d, J=4,0 Гц, 1Н), 8,33 (d, J=4,0 Гц, 1Н), 8,18 (m, 2Н), 7,64 (d, J=4,0 Гц, 1Н), 7,44 (m, 1Н), 7,24 (s, 1Н), 3,94 (s, 3H), 1,89 (m, 4Н), 0,91 (m, 6Н); MS: 371,0 (М+Н+).

Продукт 119 (2-(6-(пиридин-4-ил)хинолин-4-илтио)-2-этилбутановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm): 13,00 (s, 1Н), 8,90 (d, J=8,0 Гц, 1Н), 8,72 (m, 3H), 8,21 (m, 2Н), 7,86 (m, 2Н), 7,67 (d, J=4,0 Гц, 1Н), 1,93 (m, 4Н), 1,58 (m, 6Н); MS: 353,1 (М+Н+).
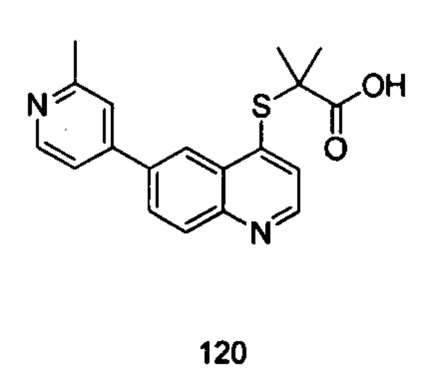
Продукт 120 (2-(6-(2-метилпиридин-4-ил)хинолин-4-илтио)-2-метилпропановая кислота): 13,03 (s, 1Н), 8,87 (d, J=4,0 Гц, 1H), 8,74 (d, J=4,0 Гц, 1Н), 8,33 (d, J=4,0 Гц, 1Н), 8,18 (m, 2Н), 7,64 (d, J=4,0 Гц, 1Н), 7,44 (m, 1Н), 7,24 (s, 1Н), 2,71 (s, 3H), 1,52 (m, 6Н); MS: 339,1 (М+Н+).
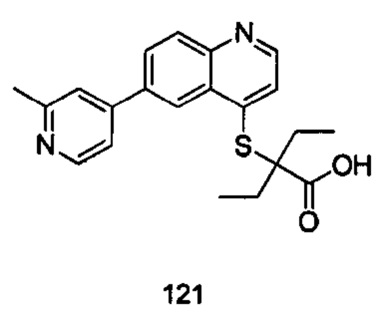
Продукт 121 (2-(6-(2-метилпиридин-4-ил)-хинолин-4-илтио)-2-этилбутановая кислота): 1Н ЯМР (ДМСО, 400 МГц): δ (ppm): 12,99 (s, 1Н), 8,85 (d, J=4,0 Гц, 1Н), 8,77 (d, J=4,0 Гц, 1Н), 8,35 (d, J=4,0 Гц, 1Н), 8,15 (m, 2Н), 7,69 (d, J=4,0 Гц, 1Н), 7,47 (m, 1H), 7,26 (s, 1H), 3,94 (s, 3H), 1,92 (m, 4Н), 0,9 (m, 6Н); MS: 367,1 (М+Н+).
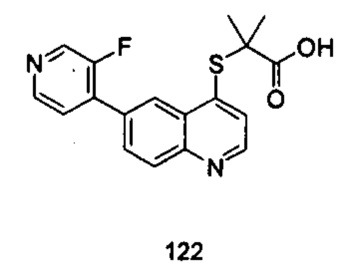
Продукт 122 (2-(6-(3-фторпиридин-4-ил)-хинолин-4-илтио)-2-метилпропановая кислота): MS: 343,1 (М+Н+).
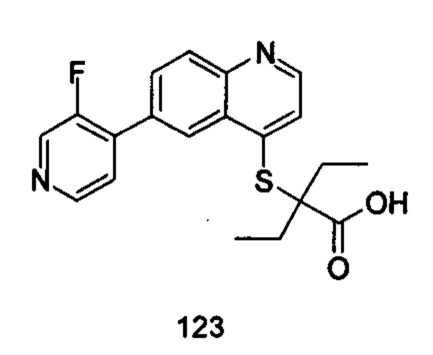
Продукт 123 (2-(6-(3-фторпиридин-4-ил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 371,1 (М+Н+).
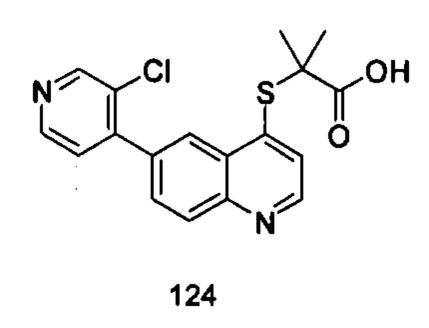
Продукт 124 (2-(6-(3-хлорпиридин-4-ил)-хинолин-4-илтио)-2-метилпропановая кислота): MS: 359,0 (М+Н+).
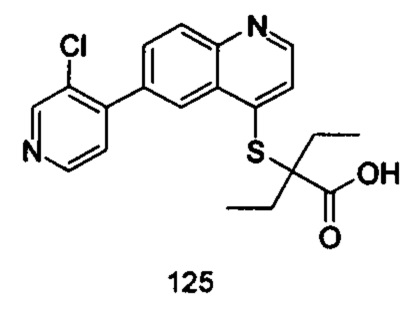
Продукт 125 (2-(6-(3-хлорпиридин-4-ил)-хинолин-4-илтио)-2-этилбутановая кислота (125): MS: 387,0 (М+Н+).
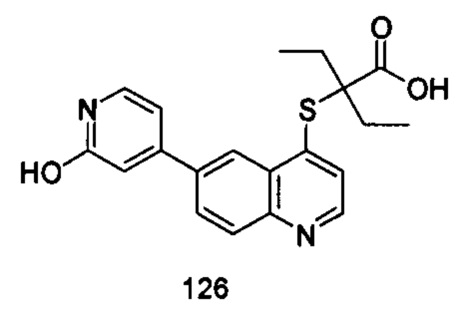
Продукт 126 (2-(6-(2-гидроксипиридин-4-ил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 369,0 (M+H+).
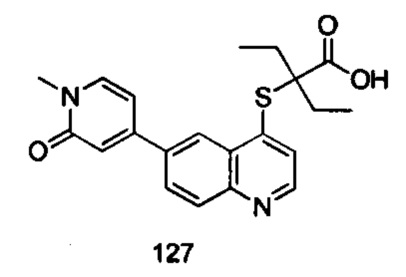
Продукт 127 (2-(6-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)-хинолин-4-илтио)-2-этилбутановая кислота (127): MS: 383,0 (М+Н+).
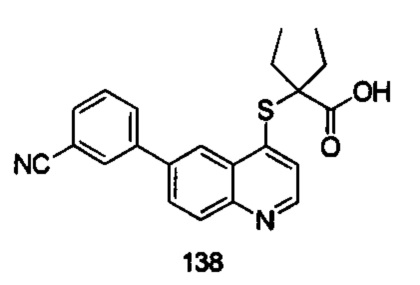
Продукт 138 (2-(6-(3-циано-фенил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 377,1 (М+Н+).
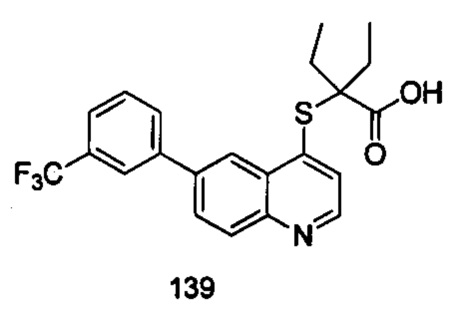
Продукт 139 (2-(6-(3-трифторметил-фенил)-хинолин-4-илтио)-2-этилбутановая кислота (139): MS: 420,1 (М+Н+).
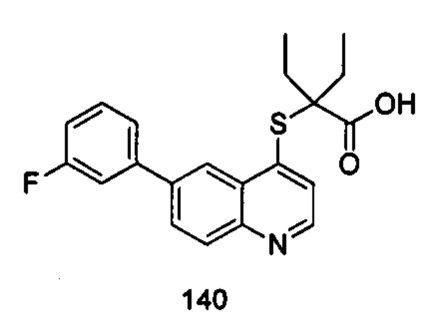
Продукт 140 (2-(6-(3-фтор-фенил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 370,1 (М+Н+).
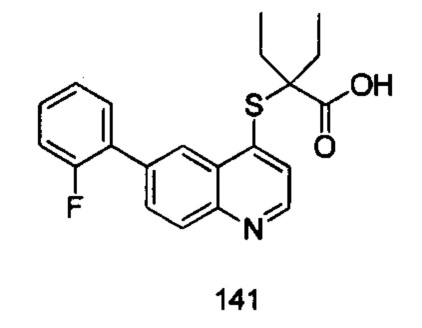
Продукт 141 (2-(6-(2-фтор-фенил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 370,1 (М+Н+).
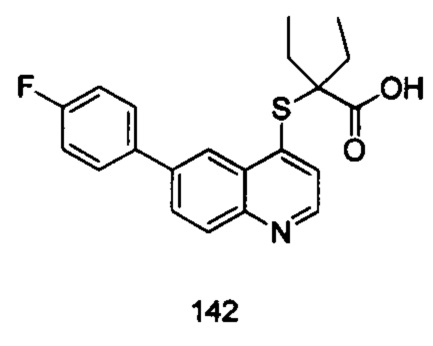
Продукт 142 (2-(6-(4-фтор-фенил)-хинолин-4-илтио)-2-этилбутановая кислота): MS: 370,1 (М+Н+).
Пример 2 Биологический анализ соединений в соответствии с настоящим изобретением
Пример исследования: Определение ингибирующей активности соединений в соответствии с настоящим изобретением в отношении URAT1
Материалы для эксперимента
- FBS (Invitrogen, Cat. No. 10099141)
- Трипсин (Invitrogen, Cat. No. 25200056)
- DPBS (Invitrogen, Cat. No. 14190250)
- DMEM (Invitrogen, Cat. No. 10564)
- Пенициллин-стрептомицин (Invitrogen, Cat. No. 15070-063)
- Реагент для трансфекции TransIT-293 (MIRUS BIO, Cat. No. MIR2706)
- Минимальная сывороточная среда Opti-MEM® I (Invitrogen, Cat. No. 31985-070)
- Плазмида URAT1 (Genecopoeia, Cat. No. EX-T4563-M03)
- Мочевая кислота [8-14C] (ARC, Cat. No. ARC0513-250UCI)
- Ultima Gold™ XR (PerkinElmer, Cat. No. 6013111)
- Бензбромарон (J&K Scientific, Cat. No. 3562-84-3)
- Натриевая соль D-глюконовой кислоты (Aladdin, Cat. No. 527-07-1)
- D-глюконат калия (Aladdin, Cat. No. 299-27-4)
- Глюконат кальция (Aladdin, Cat. No. 299-28-5)
- ДМСО (Sigma, Cat. No. D2650)
- Пробирка, 15 мл (Greiner, Cat. No. 07030115)
- Пробирка, 50 мл (BD Falcon, Cat. No. 352098)
- 96-луночный планшет, поли-D-лизин (BD, Cat. No. 356461)
- Микропланшет Isoplate-96 (PERKIN ELMER, Cat. No. 6005040)
Способ эксперимента:
Получение буфера

Клеточная культура:
1. Клетки HEK-293t, которые экспрессировали стабильную экспрессию hURATl, культивировали в среде DMEM, содержащей 10% FBS и 1% P/S, и инкубировали в течение ночи в инкубаторе при 37°С в атмосфере 5% диоксида углерода.
2. культуральную среду удаляли и клетки промывали PBS, а затем панкреатин добавляли для обеспечения расщепления в течение 2 минут. После отделения клетки от тарелки добавляли 10 мл среды для прекращения расщепления.
3. Клетки помещали в центробежный аппарат и центрифугировали в течение 2 минут со скоростью 1000 об/мин с последующим добавлением 10 мл свежей среды для повторного суспендирования клеток и подсчета количества клеток. Количество клеток доводили до 4×105 клеток / мл.
4. указанные выше подсчитанные клетки инокулировали в 96-луночный планшет при 100 мкл/лунка.
5. 96-луночный планшет с инокулированными клетками помещали в клеточный инкубатор при 37°С и культивировали в течение ночи.
Эксперимент по абсорбции мочевой кислоты, помеченной изотопом С14:
1. В 15 мл центрифужную пробирку добавляли 5 мл буферного раствора HBSS, не содержащего Cl, затем добавляли мочевую кислоту, меченную С14, и концентрация мочевой кислоты составляла 2 мкКи/мл.
2. Среду в 96-луночном планшете, которую предварительно культивировали в течение ночи, удаляли и планшет трижды промывали 100 мл предварительно нагретого буфера HBSS, не содержащего Cl.
3. Буфер в хорошо промытом 96-луночном планшете удаляли.
4. В каждую лунку 96-луночного планшета добавляли 50 мл буферного раствора HBSS, не содержащего Cl, содержащего мочевую кислоту, меченую С-14, и затем добавляли раствор соединения для тестирования в ДМСО,.
5. Затем 96-луночный планшет выдерживали в течение 5 минут при комнатной температуре, всю жидкость из него удаляли.
6. 100 мл предварительно охлажденного буфера HBSS, не содержащего Cl, добавляли для промывки планшета три раза.
7. После того, как оставшаяся жидкость в планшетах была полностью удалена, в каждую лунку добавляли 50 мкл клеточного лизиса и планшет перемешивали на смесителе со скоростью 600 об/мин в течение 10 минут.
8. После добавления 50 мкл сцинтилляционного коктейля Ultima GoldTM XR планшет продолжали перемешивать в течение 10 минут. Хорошо перемешанный планшет был герметизирован, и данные были прочитаны на MicroBeta Trilux.
9. Тестируемое соединение растворяли в ДМСО и ДМСО в той же концентрации добавляли лунки с HEK293/hURATl без тестируемых соединений. Поглощение мочевой кислоты при каждой тестовой концентрации выражали как среднее процентное отношение ингибирования, сравнимое с контрольным ДМСО. Излучение, полученное из лунки, содержащей ДМСО, считается за 100% клеточного поглощения. Значения IC50 соединений могут быть рассчитаны по скорости ингибирования при различных концентрациях.
Значения IC50 (мМ) ингибирующей активности в отношении hURATl для соединений согласно настоящему изобретению показаны в таблице 1. Среди них контрольное соединение 1 синтезировали в соответствии со способом, описанным в патенте WO 2011/159839 А2. Контрольное соединение 2 и контрольное соединение 3 синтезировали в соответствии со способом, описанным в патенте WO 2014/183555 А1, и они тестировались с соединениями 83 и 129, соответственно, при тех же условиях. Значения IC50 для контрольного соединения 2 и соединения 83 являются средними для многочисленных прямых сравнительных тестов. Значения IC50 контрольного соединения 3 и 129 являются средними из двух сравнительных тестов.
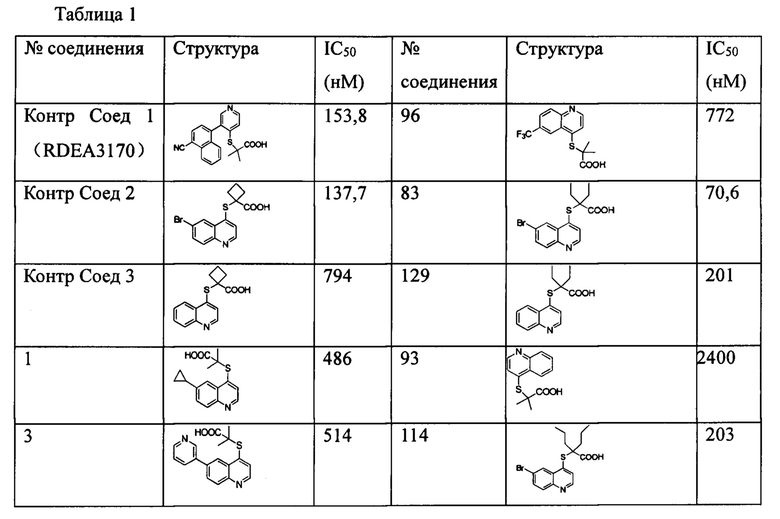
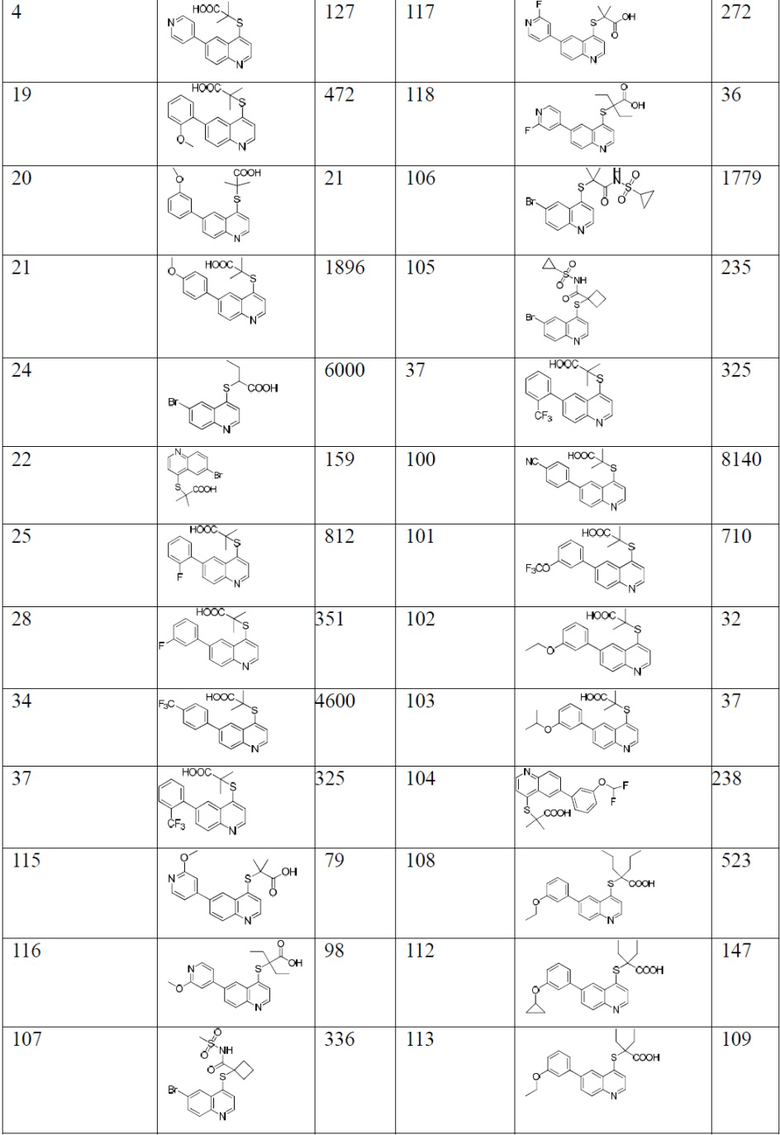
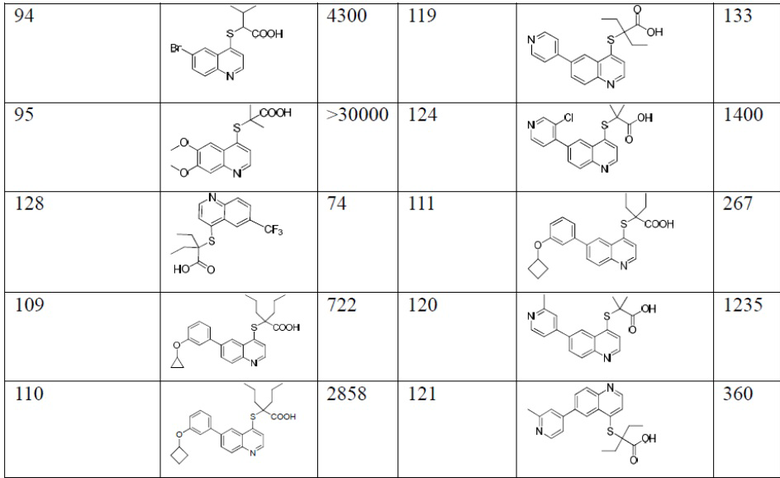
Из приведенной выше таблицы видно, что соединения в соответствии с настоящим изобретением проявляют очевидное ингибирующее действие на транспортер мочевой кислоты URAT1.
Известные контрольные соединения 1 и 2 являются высокоактивными ингибиторами в отношении транспортера мочевой кислоты URAT1. Соединение 83 показало лучшую ингибирующую активность в отношении транспортера мочевой кислоты, чем соединение 1. Между тем статистический анализ данных по активности соединения 83 и контрольного соединения 2, полученный в результате нескольких прямых тестов, показан в таблице 2, и результаты продемонстрировали что активность соединения 83 значительно отличается от активности контрольного соединения 2. В сочетании со структурой и сопоставлением активности соединения 129 и соединений 3, в настоящем изобретении очевидно, что циклоалкилы в определенном положении соединений замещены алкилами раскрытого кольца, особенно диэтиловым заместителем, значительно увеличивающим ингибирующую активность соединения в отношении транспортера мочевой кислоты URAT1.
Таблица 2
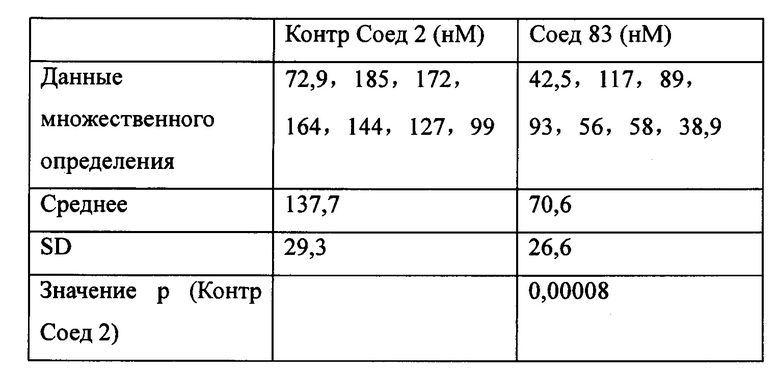
Различные соединения и соли, гидраты или сольваты, предлагаемые в настоящем изобретении, представляют собой ингибитор обратного захвата мочевой кислоты с более высокой селективностью, чем типичные соединения в данной области. Они могут стимулировать выделение мочевой кислоты из организма и уменьшать содержание мочевой кислоты в сыворотке крови для лечения или профилактики заболеваний, характеризующихся аномальными уровнями мочевой кислоты. Среди них заболевания, выбранные из подагры, повторяющихся симптомов подагры, гиперурикемии, сердечно-сосудистых заболеваний, синдрома Леша-Нихана, синдрома Кернса-Сайре, заболевания почек, артрита, мочекаменной болезни, отравления свинцом, гиперпаратиреоза, псориаза, саркоидоза или заболевания, вызванного недостатком гипоксантин-гуанинфосфорибозилтрансферазы, характеризующиеся эффектом уменьшения мочевой кислоты в организме животных и человека.
| название | год | авторы | номер документа |
|---|---|---|---|
| КЛАСС КОНДЕНСИРОВАННЫХ КОЛЬЦЕВЫХ СОЕДИНЕНИЙ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2831125C1 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ ПИРИМИДИН-4(3H)-ОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2839367C1 |
| ПРОИЗВОДНЫЕ 1,2,4-ТРИАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ СИГМА РЕЦЕПТОРА | 2007 |
|
RU2451015C2 |
| МНОГОФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ ХИНОЛИНА В КАЧЕСТВЕ АНТИНЕЙРОДЕГЕНЕРАТИВНЫХ АГЕНТОВ | 2013 |
|
RU2642466C2 |
| ЦИАНОХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2011 |
|
RU2600928C2 |
| ПРОИЗВОДНЫЕ 3-АМИНО-ПИРИДИНА ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКИХ НАРУШЕНИЙ | 2007 |
|
RU2460729C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2769696C2 |
| БЕТА-АРИЛ-АЛЬФА-ОКСИЗАМЕЩЕННЫЕ АЛКИЛКАРБОНОВЫЕ КИСЛОТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ ЗАБОЛЕВАНИЙ НА ОСНОВЕ НОВЫХ СОЕДИНЕНИЙ | 1998 |
|
RU2235094C2 |
| Спироконденсированные пирролидиновые производные в качестве ингибиторов деубиквитилирующих ферментов (DUB) | 2017 |
|
RU2730552C2 |
| Аза-арил-1Н-пиразол-1-ил-сульфонамиды | 2013 |
|
RU2627268C2 |
Изобретение относится к области органической химии, а именно к производному хинолина формулы (А) или к его фармацевтически приемлемой соли, где Z выбран из O или -NH-; W1 представляет собой N; W2 представляет собой CRb; W3 представляет собой CRc; R2 выбран из водорода и R3 выбран из метила; или R2 выбран из водорода и R3 выбран из этила; или R2 выбран из водорода и R3 выбран из изопропила; или R2 и R3 оба выбраны из метила; или R2 и R3 оба выбраны из этила; или R2 и R3 оба выбраны из н-пропила; Rb выбран из группы, включающей водород, галоген, C1-C3-алкил, C3-циклоалкил, C6-арил, гетероарил, выбранный из пиридина, где указанный алкил, арил или гетероарил независимо и необязательно замещены одним-тремя заместителями, которые выбраны из группы, включающей галоген, циано, оксо-, С1-алкил, С1-галогеналкил, -ORd; Rc выбран из группы, включающей галоген, C1-C3-алкил, C3-циклоалкил, C6-арил, гетероарил, выбранный из пиридина, где указанный алкил, арил или гетероарил независимо и необязательно замещены одним-тремя заместителями, которые выбраны из группы, включающей галоген, циано, оксо-, С1-алкил, С1-галогеналкил, -ORd; Rd выбран из группы, включающей водород, C1-C3-алкил, C3-C4-циклоалкил, где указанный алкил независимо и необязательно замещен двумя-тремя заместителями, которые представляют собой галоген; X, Y представляют собой водород; когда Z представляет собой O, R4 представляет собой водород. Также изобретение относится к способу получения соединения формулы (А) и его применению. Технический результат: получено новое производное хинолина, ингибирующее URAT1 и полезное при лечении подагры, рецидивирующего приступа подагры, подагрического артрита, гиперурикемии. 3 н. и 6 з.п. ф-лы, 2 табл., 2 пр.
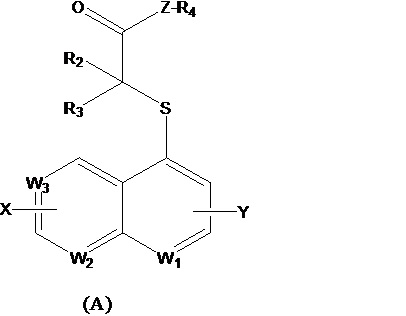
1. Соединение формулы (A) или его фармацевтически приемлемые соли
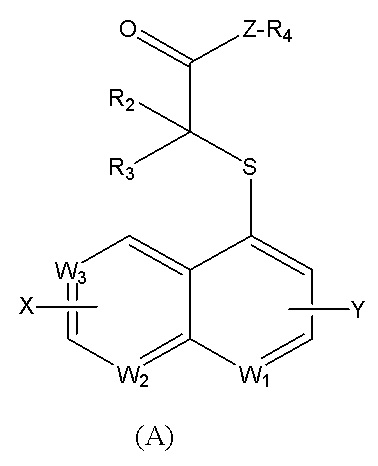
где Z выбран из O или -NH-;
W1 представляет собой N; W2 представляет собой CRb; W3 представляет собой CRc;
R2 выбран из водорода и R3 выбран из метила; или R2 выбран из водорода и R3 выбран из этила; или R2 выбран из водорода и R3 выбран из изопропила; или R2 и R3 оба выбраны из метила; или R2 и R3 оба выбраны из этила; или R2 и R3 оба выбраны из н-пропила;
Rb выбран из группы, включающей водород, галоген, C1-C3-алкил, C3-циклоалкил, C6-арил, гетероарил, выбранный из пиридина, где указанный алкил, арил или гетероарил независимо и необязательно замещены одним-тремя заместителями, которые выбраны из группы, включающей галоген, циано, оксо-, С1-алкил, С1-галогеналкил, -ORd;
Rc выбран из группы, включающей галоген, C1-C3-алкил, C3-циклоалкил, C6-арил, гетероарил, выбранный из пиридина, где указанный алкил, арил или гетероарил независимо и необязательно замещены одним-тремя заместителями, которые выбраны из группы, включающей галоген, циано, оксо-, С1-алкил, С1-галогеналкил, -ORd;
Rd выбран из группы, включающей водород, C1-C3-алкил, C3-C4-циклоалкил, где указанный алкил независимо и необязательно замещен двумя-тремя заместителями, которые представляют собой галоген;
X, Y представляют собой водород;
когда Z представляет собой O, R4 представляет собой водород.
2. Соединение по п. 1 или его фармацевтически приемлемые соли, где соединение имеет структуру формулы (I)
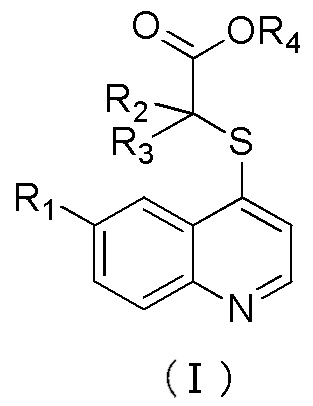
где R1 выбран из галогена, C1-C3-алкила, C3-циклоалкила, C6-арила, гетероарила выбранного из пиридина, где указанный алкил, арил или гетероарил независимо и необязательно замещены одним-тремя заместителями, выбранными из галогена, циано, оксо, С1-алкила, С1-галогеналкила, -ORd;
R2, R3, R4 и Rd все имеют значения, указанные в п. 1.
3. Соединение по п. 2 или его фармацевтически приемлемые соли, где R1 выбран из группы, включающей F, Br, Cl, пиридил, фенил, трифторметил или циклопропил, где указанный фенил необязательно дополнительно замещен одним заместителем, выбранным из группы, включающей метокси, этокси, фтор, хлор, бром или трифторметил.
4. Соединение по пп. 1-3 или его фармацевтически приемлемые соли, где соединение имеет структуру формулы (Id) или (Ie):
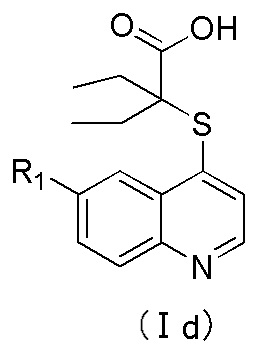
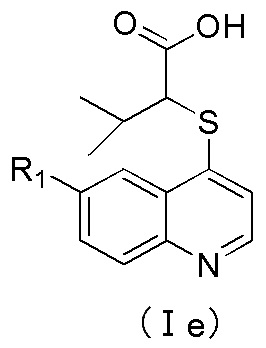
где R1 имеет значение, определенное в п. 2.
5. Соединение по п. 4 или его фармацевтически приемлемые соли, где R1 выбран из группы, включающей галоген, трифторметил, C6-арил, пиридил, или C3-циклоалкил, где указанный арил, или пиридил независимо и необязательно замещен одним заместителем, который выбран из группы, включающей галоген, циано, оксо-, С1-алкил, С1-галогеналкил, -ORd;
Rd выбран из группы, включающей водород, C1-C3-алкил, C3-C4-циклоалкил, где указанный алкил необязательно замещен двумя-тремя заместителями, которые представляют собой галоген;
предпочтительно, R1 выбран из группы, включающей F, Br, Cl, трифторметил, пиридил, фенил или циклопропил, где указанный фенил необязательно дополнительно замещен одним заместителем, выбранным из метокси, этокси, фтора, хлора, брома или трифторметила;
его фармацевтически приемлемые соли включают соли, образованные основаниями, и натриевая соль является предпочтительной; дополнительно включают соли, образованные фармацевтически приемлемыми кислотами.
6. Соединение по п. 1 или его фармацевтически приемлемые соли, причем соединение выбрано из группы, включающей
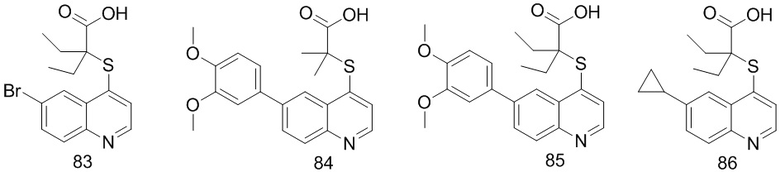
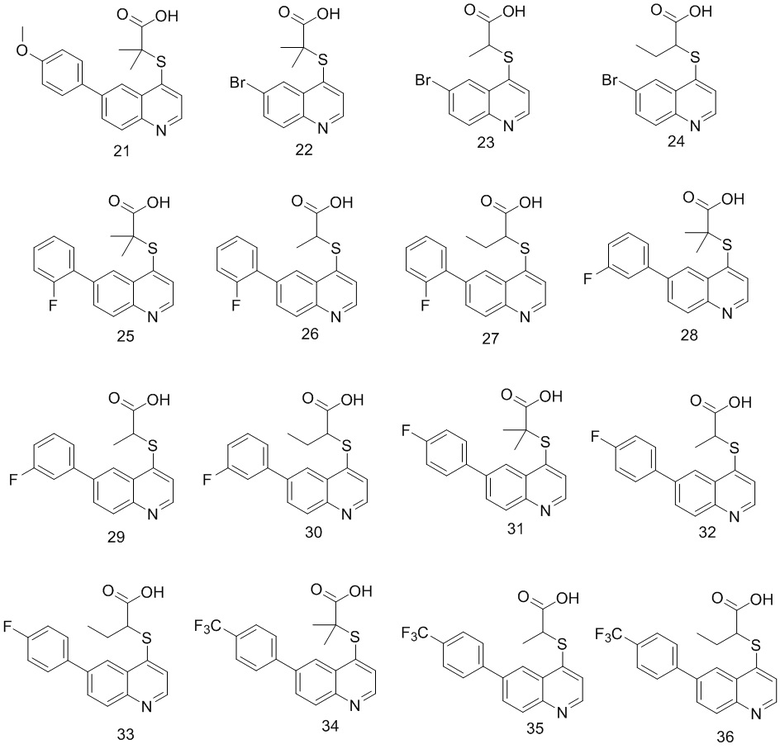
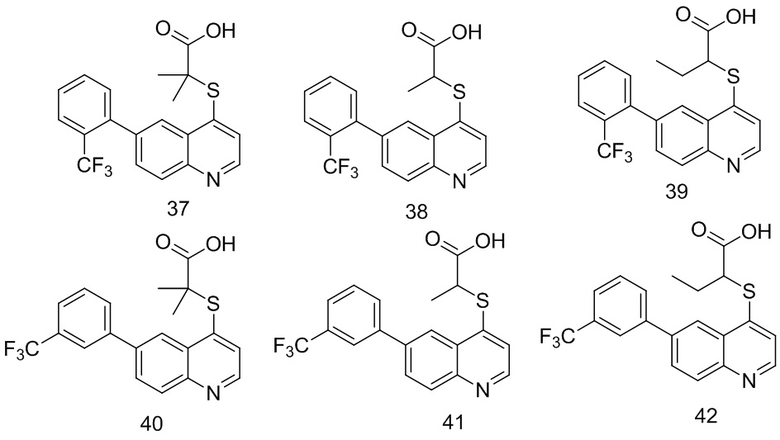
7. Способ получения соединений по любому из пп. 1-6, который характеризуется включением процедуры, выполняемой по следующей схеме:
 ;
;
или включением процедуры, выполняемой по следующей схеме:
диоксан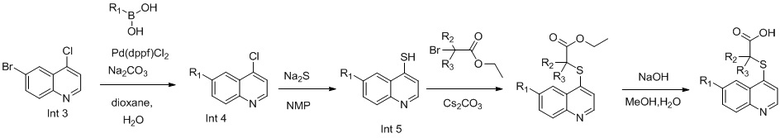 .
.
8. Применение соединений по любому из пп. 1-7 или его фармацевтически приемлемых солей для получения лекарственных средств, ингибирующих URAT1.
9. Применение по п. 8, отличающееся тем, что лекарственные средства представляют собой лекарственные средства для предотвращения и/или лечения подагры, рецидивирующего приступа подагры, подагрического артрита, гиперурикемии.
| SROGL JIRI и др.: "Bio- organometallic Organosulfur Chemistry | |||
| Transition Metal-Catalyzed Cross-Coupling Using Coenzyme M or Thioglycoli Acid as the Leaving Group", Journal of the American Chemical Society, 1999, American Chemical Society, т.121, стр.9449-9450 | |||
| СПОСОБ РЕГУЛИРОВКИ ЧАСТОТЫ КОЛЕБАНИЙ УЗЛА ЧАСОВ | 2011 |
|
RU2568037C2 |
| СПОСОБ ОБРАБОТКИ ДЛИННОМЕРНЫХ ЖЕЛЕЗНОДОРОЖНЫХ РЕЛЬСОВ | 1992 |
|
RU2096140C1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2020-02-26—Публикация
2016-12-06—Подача