Изобретение относится к медицине, в частности к фармакологии, может быть использовано для снижения прооксидантного действия антиконвульсантов и найти применение в экспериментальной медицине и клинической практике.
Применение противоэпилептических препаратов вызывает увеличение образования свободных радикалов и окислительное повреждение нейронов, результатом которого может быть снижение эффективности или развитие функциональной толерантности к противосудорожным средствам, а прооксидантные эффекты антиконвульсантов, связанные прежде всего со снижением активности антиоксидантной системы и, следовательно, накоплением продуктов липопероксидации, индуцируют развитие нежелательных побочных эффектов [1, Липатова Л.В., Алексеева Д.В., СПб., 2018]. Большинство используемых базисных противоэпилептических средств, в частности вальпроевая кислота, карбамазепин, метаболизируются посредством генерирования реактивных метаболитов, способных к ковалентному связыванию макромолекул, результатом которого может быть не только подавление эпилептических припадков, но и развитие системной токсичности, и в первую очередь гепатотоксичности [2, Martinc В., Grabnar I., Vovk Т., 2012]. Кроме этого, длительный прием противоэпилептических средств приводит к снижению дыхательной активности тканей, разобщению дыхания с фосфорилированием [3, Nishimura A. et al., Biol. Pharm. Bull., 2008], что усугубляет метаболические нарушения и предопределяет целесообразность назначения в комплексной терапии эпилепсии лекарственных средств, обладающих антиоксидантной и антигипоксантной активностью.
Известен способ противосудорожной терапии с использованием антиоксидантов токоферола и ионола в дозах 0,1-100 мг/кг внутрибрюшинно, 2-этил-6-метил-3-оксипиридина в дозах 25-150 мг/кг внутрибрюшинно за 45 минут до индукции эпилептической активности у крыс [4, Никушкин Е.В., автореф. дис. д-ра мед. наук, 1991].
Известен способ ослабления прооксидантных реакций у крыс, базируемый на изменении количественной характеристики малонового диальдегида и активности антиоксидантных ферментов, при использовании комбинированного противосудорожного, нейропротективного, ноотропного, анальгетического, антидепрессивного, актопротективного и антиоксидантного средства, включающего в качестве активной основы карбамазепин в дозе 10 мг/кг и тиотриазолин (МНН: морфолиний-метил-триазолил-тиоацетат; производители: ПАО «Киевмедпрепарат», Украина, Регистрационный номер ЛСР-002165/10 (таблетки) и ПАО "Галичфарм", Украина, Регистрационный номер ЛСР-002170/10 (раствор)) в дозе 25 мг/кг [5, Опрышко В.И. и соавт., Патент РФ №2361591]. Недостатком карбамазепина в комбинации с тиотриазолином является низкая эффективность при эпилептической патологии [6, Липатова Л.В. и соавт., Патент РФ №2538724].
Известен способ коррекции поведенческой активности у крыс, подвергнутых воздействию антиконвульсанта вальпроата натрия, введением сукцинатсодержащего препарата Цитофлавин в дозе 100 мг/кг по сукцинату в течение 7, 14, 21 и 28 дней [7, Семинский И.Ж., Охремчук Л.В., Забайкальский медицинский вестник, 2018]. В данном способе отсутствует изучение влияния антиконвульсанта в комбинации с цитофлавином на интенсивность процессов липопероксидации, являющихся во многом определяющими в формировании побочных эффектов и осложнений. Данное техническое решение взято нами за прототип.
Технической проблемой, решаемой данным изобретением, является расширение арсенала средств, снижающих прооксидантное действие антиконвульсантов и формирование побочных эффектов у крыс, на основе отечественной фармацевтической продукции в условиях уменьшения курсовой дозы сукцинатсодержащего корректора и, следовательно, повышения фармакоэкономической эффективности.
Проблема решена путем разработки нового способа снижения прооксидантного действия антиконвульсантов в эксперименте внутрибрюшинным введением крысам препарата Реамберин (группировочное наименование: меглюмина натрия сукцинат) производства НТФФ «Полисан» г. Санкт-Петербург (Регистрационный номер: Р N001048/01 от 06.09.2007 г.). Препарат Реамберин представляет собой раствор для инфузий (фармакотерапевтическая группа: растворы, влияющие на водно-электролитный баланс), в состав которого входит меглюмина натрия сукцинат - 15,0 г, полученный по следующей прописи: N-метилглюкамин (меглюмин) [C7H17NO5] - 8,725 г, янтарная кислота [С4Н6О4] - 5,280 г; и вспомогательные вещества: натрия хлорид - 6,0 г, калия хлорид - 0,30 г, магния хлорид (в пересчете на безводный) - 0,12 г, натрия гипоксид - 1,788 г, вода для инъекций до 1,0 л. Ионный состав на 1 л: натрий-ион - 147,2 ммоль, калий-ион - 4,0 ммоль, магний-ион -1,2 ммоль, хлорид-ион - 109,0 ммоль, сукцинат-ион - 44,7 ммоль, N-метилглюкаммоний-ион - 44,7 ммоль.
Сущность изобретения заключается в том, что в способе снижения прооксидантного действия антиконвульсантов в эксперименте, включающем ежедневное внутрибрюшинное введение лабораторным животным сукцинатсодержащего препарата в дозе 100 мг/кг по сукцинату, крысам вводят Реамберин ежедневно в течение 10 дней, за 90 минут до внутрижелудочного введения Карбамазепина в дозе 150 мг/кг, или Вальпроевой кислоты в дозе 150 мг/кг.
Осуществление способа. Экспериментальным животным (крысам), находящимся в стандартных условиях вивария, в течение 10 дней за 90 минут до внутрижелудочного введения антиконвульсанта (Карбамазепин или Вальпроевая кислота) в дозе 150 мг/кг, ежедневно внутрибрюшинно вводят Реамберин в дозе 100 мг/кг по сукцинату (20 мл/кг).
Эксперимент проводили на 50 белых беспородных крысах-самцах массой 180-200 г, содержащихся на стандартном рационе питания, в течение 10 дней. Животные были разделены на 5 групп: 1-я - интактная группа, животные находились в стандартных условиях вивария, получали ежедневно внутрибрюшинно эквиобъемное вводимому препарату Реамберин количество раствора натрия хлорида 0,9% (20 мл/кг); 2-я - контрольная группа 1, животным в течение 10 дней осуществляли внутрижелудочное введение Карбамазепина в дозе 150 мг/кг на фоне внутрибрюшинного введения эквиобъемного вводимому препарату Реамберин количества раствора натрия хлорида 0,9% (20 мл/кг); 3-я - экспериментальная группа 1, животным в течение 10 дней вводили препарат Реамберин в дозе 20 мл/кг (100 мг/кг по сукцинату) за 90 минут до внутрижелудочного введения Карбамазепина в дозе 150 мг/кг; 4-я - контрольная группа 2, животным в течение 10 дней осуществляли внутрижелудочное введение Вальпроевой кислоты в дозе 150 мг/кг на фоне внутрибрюшинного введения эквиобъемного вводимому препарату Реамберин количества раствора натрия хлорида 0,9% (20 мл/кг); 5-я - экспериментальная группа 2, животным в течение 10 дней вводили препарат Реамберин в дозе 20 мл/кг (100 мг/кг по сукцинату) за 90 минут до внутрижелудочного введения Вальпроевой кислоты в дозе 150 мг/кг.
В эксперименте использовали противоэпилептические препараты в дозе 150 мг/кг (средняя терапевтическая доза у лабораторных животных) согласно литературным данным [8, Опрышко В.И. и соавт., Морфология, 2012]. Перед внутрижелудочным введением антиконвульсанты разводили в 1%-ной крахмальной слизи. В интактной группе животных крысам вводили суспензию 1%-ной крахмальной слизи в объеме, аналогичном в контрольных и экспериментальных группах.
На 11й день эксперимента животные забивались путем декапитации. Результаты учитывались по соотношению содержания продуктов ПОЛ (гидроперекисей липидов, диеновых конъюгатов, малонового диальдегида), основных компонентов антиоксидантной системы (АОС) - церулоплазмина, витамина Е - в плазме крови и ткани печени крыс экспериментальных групп в сравнении с животными интактной и контрольных групп, обработаны стандартными параметрическими методами с использованием t-критерия Стьюдента.
Способ позволил обеспечить снижение прооксидантного действия антиконвульсантов в эксперименте, базируемое на уменьшении содержания продуктов пероксидации в крови и печени животных и увеличении активности компонентов антиоксидантной системы, в условиях снижения курсовой дозы сукцинатсодержащего корректора в сравнении с прототипом.
Исследовано содержание продуктов ПОЛ в плазме крови крыс интактной, контрольных и экспериментальных групп на 11й день эксперимента (таблица 1). Результаты исследования показали, что содержание гидроперекисей липидов в крови контрольных животных (1), получавших Карбамазепин, достоверно выше на 47,2% относительно интактных крыс (р<0,05), диеновых конъюгатов - на 32,5% (р<0,05), малонового диальдегида - на 62,5% (р<0,05), что свидетельствует о повышении интенсивности процессов пероксидации в условиях введения противоэпилептического средства. Уровень гидроперекисей липидов в плазме крови крыс, получавших на фоне введения антиконвульсанта Реамберин, достоверно ниже на 26,8%, чем в контрольной группе (Карбамазепин) животных (р<0,05), диеновых конъюгатов - на 19,1% (р<0,05), малонового диальдегида - на 29,3% (р<0,05).
Использование противоэпилептического средства Вальпроевой кислоты сопровождается достоверным накоплением продуктов липопероксидации в плазме крови крыс на 32,9% (гидроперекиси липидов), 31,0% (диеновые конъюгаты), 45,0% (малоновый диальдегид), что свидетельствует о прооксидантном действии данного антиконвульсанта. Введение сукцинатсодержащего корректора Реамберин позволило снизить в плазме крови крыс, получавших Вальпроевую кислоту, уровень гидроперекисей липидов на 17,5% (р<0,05), диеновых конъюгатов - на 15,9% (р<0,05), малонового диальдегида - на 17,3% (р<0,05).
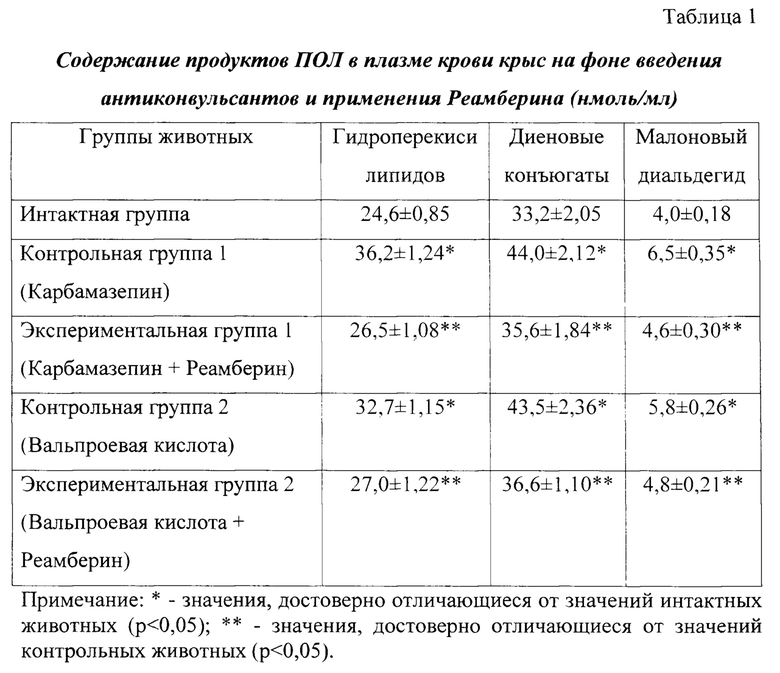
Повышение интенсивности процессов пероксидации в условиях введения антиконвульсантов сопровождается снижением активности компонентов АОС в крови контрольных животных в сравнении с интактными крысами (таблица 2): уровень церулоплазмина в плазме крови животных группы контроля, получавших Карбамазепин, ниже на 36,5% (р<0,05), витамина Е - на 25,5% (р<0,05). В крови экспериментальных животных, получавших Реамберин на фоне антиконвульсанта, содержание церулоплазмина достоверно выше на 35,1% по сравнению с контрольной группой крыс (р<0,05), уровень витамина Е - на 28,8% (р<0,05).
Введение крысам Вальпроевой кислоты сопровождается достоверным снижением уровня церулоплазмина в плазме крови животных на 30,8% (р<0,05), витамина Е - на 20,5% (р<0,05), что свидетельствует об уменьшении активности АОС в условиях применения противоэпилептического средства. Использование сукцинатсодержащего корректора Реамберин в эксперименте позволяет повысить активность основных компонентов антиоксидантной защиты в условиях прооксидантного действия Вальпроевой кислоты на 21,9% (церулоплазмин) и 16,4% (витамин Е).
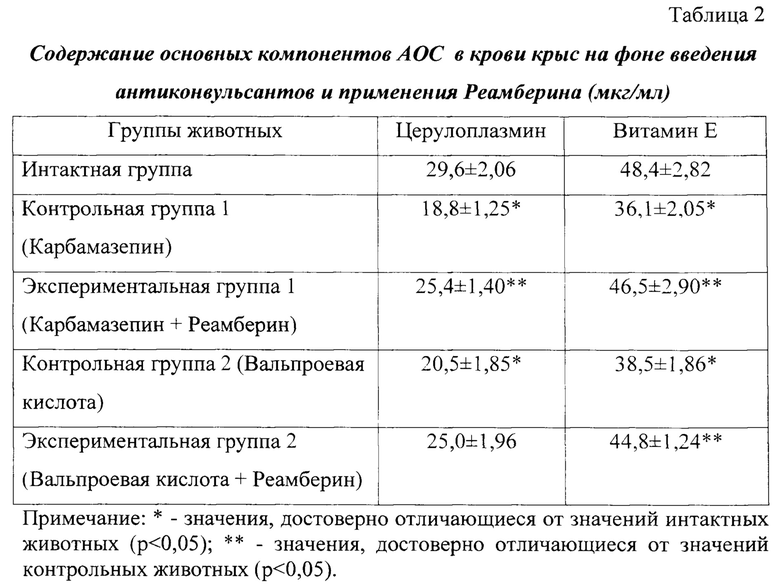
Исследование содержания продуктов ПОЛ в ткани печени крыс интактной, контрольных и экспериментальных групп показало (таблица 3), что содержание гидроперекисей липидов в крови контрольных (Карбамазепин) животных достоверно выше на 40,4% относительно интактных крыс (р<0,05), диеновых конъюгатов - на 44,2% (р<0,05), малонового диальдегида - на 64,6% (р<0,05), что свидетельствует о повышении интенсивности процессов пероксидации в печени при использовании противоэпилептического средства. Введение Реамберина препятствует накоплению продуктов липопероксидации на фоне применения Карбамазепина: содержание гидроперекисей липидов в печени крыс экспериментальной группы (1) достоверно ниже на 22,9% относительно контроля (р<0,05), диеновых конъюгатов - на 24,2% (р<0,05), малонового диальдегида - на 36,1% (р<0,05).
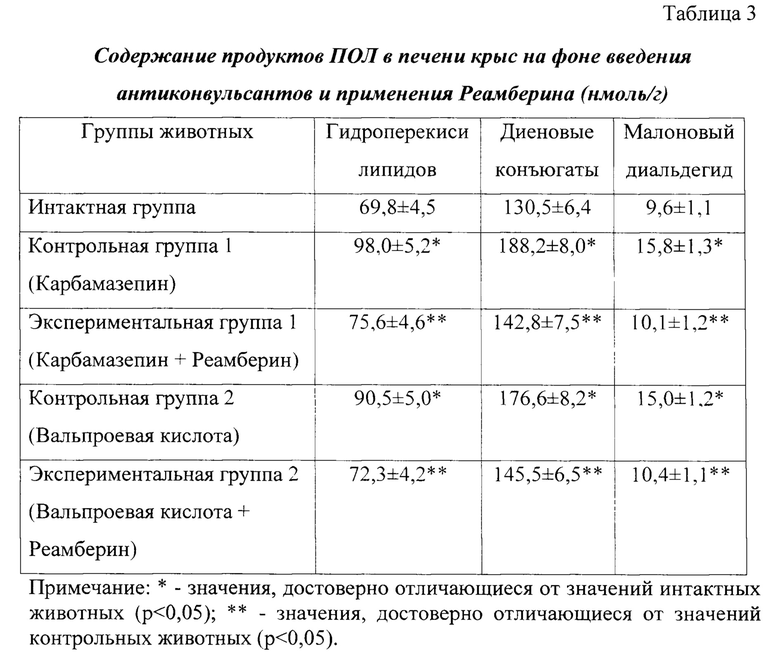
Аналогичная тенденция прослеживается в условиях введения антиконвульсанта Вальпроевой кислоты, способствующего повышению интенсивности процессов перекисного окисления липидов в печени крыс, что сопровождается достоверным увеличением содержания гидроперекисей липидов на 29,6% (р<0,05), диеновых конъюгатов - на 35,3% (р<0,05), малонового диальдегида - на 56,3% (р<0,05) относительно интактных животных. Реамберин сдерживает степень накопления продуктов радикального характера в печени крыс, получавших Вальпроевую кислоту, на 20,2% (гидроперекиси липидов), 17,7% (диеновые конъюгаты), 30,7% (малоновый диальдегид) относительно контрольных животных (р<0,05).
Анализ активности компонентов АОС в ткани печени в условиях введения антиконвульсантов свидетельствует о снижении уровня церулоплазмина в группе контроля (Карбамазепин) на 54,6% (р<0,05), витамина Е - на 42,3% (р<0,05) в сравнении с интактными крысами (таблица 4).
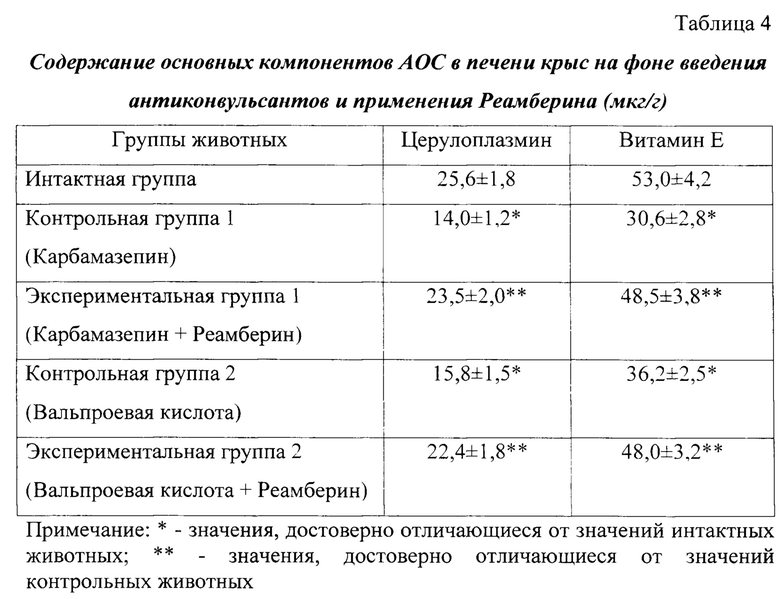
В условиях введения Реамберина экспериментальным животным содержание церулоплазмина достоверно выше на 67,8% по сравнению с контрольной группой крыс (Карбамазепин), уровень витамина Е - на 58,5% (р<0,05).
Введение Вальпроевой кислоты сопровождается достоверным уменьшением активности компонентов АОС в печени животных относительно интактных крыс на 38,3% (церулоплазмин) и 31,7% (витамин Е), что свидетельствует о неблагоприятном воздействии антиконвульсанта на печень и запускает в дальнейшем механизм формирования побочного действия Вальпроевой кислоты - гепатотоксичности. Использование сукцинатсодержащего препарата Реамберин в условиях введения Вальпроевой кислоты способствует повышению активности церулоплазмина в печени крыс на 41,8% относительно контроля (р<0,05), витамина Е - на 32,6% (р<0,05), что подтверждает наличие у препарата Реамберин гепатопротекторной, мембраностабилизирующей, антиоксидантной активности и согласуется с литературными данными [9, Патент РФ №2678313,2019].
Таким образом, экспериментально установлена возможность снижения прооксидантного действия антиконвульсантов в эксперименте введением препарата Реамберин, основанная на уменьшении содержания продуктов пероксидации и увеличении активности основных компонентов АОС в крови и печени животных, что свидетельствует о способности Реамберина препятствовать формированию окислительного стресса, подтверждая антиоксидантную активность препарата, и, следовательно, развитию побочных эффектов. В целом, базируясь на полученных результатах, предложенный способ обеспечивает снижение прооксидантного действия антиконвульсантов в эксперименте в условиях уменьшения курсовой дозы сукцинатсодержащего препарата в сравнении с прототипом.
Технический результат использования изобретения заключается в уменьшении длительности курса коррекции антиоксидантного статуса теплокровного организма до 10 дней введением сукцинатсодержащего препарата Реамберин лабораторным животным, получавшим антиконвульсанты, в сравнении с прототипом.
ИНФОРМАЦИОННЫЕ ИСТОЧНИКИ
1. Липатова Л.В., Алексеева Д.В. Применение антиоксидантов в комплексной терапии больных фармакорезистентной эпилепсией: методические рекомендации / НМИЦ ПН им. В.М. Бехтерева. - СПб., 2018. - 21 с.
2. Martinc В., Grabnar I., Vovk Т. The role of reactive species in epileptogenesis and influence of antiepileptic drug therapy on oxidative stress. Curr Neuropharmacol. 2012; 10(4):328-343. doi:10.2174/157015912804143504.
3. Nishimura A., Honda N., Sugioka N. Evaluation of carbamazepine pharmacokinetic profiles in mice with kainic acid - induced acute seizures // Biol. Pharm. Bull. - 2008. - Vol. 31 (12). - P. 2302-2308.
4. Никушкин E.B. Перекисное окисление липидов при эпилепсии. Антиоксиданты в противосудорожной терапии: автореф. дис.д-ра мед. наук. - Москва, 1991. - 50 с.
5. Опрышко В.И., Мамчур В.И., Мазур И.А., Беленичев И.Ф., Марценюк В.П., Грошевой Т.А., Зленко Е.Т., Куник А.В., Хомяк Е.В., Кравченко К.А. Противосудорожное лекарственное средство. - Патент РФ на изобретение №2361591. - Опубликовано: 20.07.2009.
6. Липатова Л.В., Чурилова И.В., Егорова Д.А., Леонова Н.В., Дубинина Е.Е., Серебряная Н.Б., Сивакова Н.А., Василенко А.В., Алексеева Д.В. Способ лечения эпилепсии. - Патент РФ на изобретение №2538724. - Опубликовано: 10.01.2015.
7. Семинский И.Ж., Охремчук Л.В. Протекторный эффект адеметионина, цитофлавина, дигидрокверцетина при нарушении поведенческой активности беспородных крыс, подвергнутых воздействию вальпроата натрия в токсической дозе // Забайкальский медицинский вестник, 2018. - №4. - С. 48-63.
8. Опрышко В.И., Сквирская К.А., Мамчур В.И., Мазур И.А., Кучеренко Л.И. Характеристика морфологических изменений клеток печени, миокарда и желудка у крыс в условиях совместного применения карбамазепина и тиотриазолина // Морфология, 2012. - Т. 6, №3. - С. 37-42.
9. Симонова Н.В., Доровских В.А., Штарберг М.А., Носаль Л.А., Бондаренко Д.А. Способ снижения токсического повреждения печени крыс четыреххлористым углеродом. - Патент РФ на изобретение №2678313. - Опубликовано: 25.01.2019, Бюл. №3.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ коррекции антиоксидантного статуса при монотерапии эпилепсии у детей | 2019 |
|
RU2712146C1 |
| СПОСОБ КОРРЕКЦИИ ПРОЦЕССОВ ЛИПОПЕРОКСИДАЦИИ ПРИ АКУСТИЧЕСКОЙ НАГРУЗКЕ В ЭКСПЕРИМЕНТЕ | 2023 |
|
RU2806662C1 |
| Способ снижения токсического повреждения печени крыс четыреххлористым углеродом | 2018 |
|
RU2678313C1 |
| Способ снижения прооксидантного действия переменного магнитного поля низкой частоты в эксперименте | 2022 |
|
RU2792899C1 |
| Способ коррекции когнитивных функций при монотерапии эпилепсии у детей | 2020 |
|
RU2763332C1 |
| Способ моделирования оксидативного стресса в эксперименте | 2022 |
|
RU2783903C1 |
| Способ снижения прооксидантного воздействия ультрафиолетового облучения на организм | 2017 |
|
RU2664441C1 |
| Способ коррекции окислительного стресса у новорожденных телят | 2019 |
|
RU2717940C1 |
| Способ коррекции антиоксидантного статуса в условиях теплового воздействия на организм | 2017 |
|
RU2661601C1 |
| СПОСОБ КОРРЕКЦИИ ОКИСЛИТЕЛЬНОГО СТРЕССА В УСЛОВИЯХ УЛЬТРАФИОЛЕТОВОГО ОБЛУЧЕНИЯ | 2016 |
|
RU2619875C1 |
Изобретение относится к медицине, а именно к фармакологии и экспериментальной медицине, и может быть использовано для снижения прооксидантного действия антиконвульсантов в эксперименте. Способ включает ежедневное внутрижелудочное введение противоэпилептического средства на фоне внутрибрюшинного введения лабораторным животным сукцинатсодержащего препарата в дозе 100 мг/кг по сукцинату. В качестве сукцинатсодержащего препарата крысам вводят Реамберин за 90 минут до введения Карбамазепина или Вальпроевой кислоты в дозе 150 мг/кг ежедневно, в течение 10 дней. Способ обеспечивает снижение прооксидантного действия антиконвульсантов в эксперименте за счет уменьшения содержания продуктов пероксидации в крови и печени животных и увеличения активности компонентов антиоксидантной системы, в условиях снижения курсовой дозы Реамберина. 2 н.п. ф-лы, 4 табл.
1. Способ снижения прооксидантного действия антиконвульсантов в эксперименте, включающий ежедневное внутрижелудочное введение противоэпилептического средства на фоне внутрибрюшинного введения лабораторным животным сукцинатсодержащего препарата в дозе 100 мг/кг по сукцинату, отличающийся тем, что в качестве сукцинатсодержащего препарата крысам вводят Реамберин за 90 минут до введения Карбамазепина в дозе 150 мг/кг ежедневно, в течение 10 дней.
2. Способ снижения прооксидантного действия антиконвульсантов в эксперименте, включающий ежедневное внутрижелудочное введение противоэпилептического средства на фоне внутрибрюшинного введения лабораторным животным сукцинатсодержащего препарата в дозе 100 мг/кг по сукцинату, отличающийся тем, что в качестве сукцинатсодержащего препарата крысам вводят Реамберин за 90 минут до введения Вальпроевой кислоты в дозе 150 мг/кг ежедневно, в течение 10 дней.
| Семинский И.Ж., Охремчук Л.В | |||
| Протекторный эффект адеметионина, цитофлавина, дигидрокверцетина при нарушении поведенческой активности беспородных крыс, подвергнутых воздействию вальпроата натрия в токсической дозе // Забайкальский медицинский вестник, 2018 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
| Способ профилактики хронической токсической коагулопатии у экспериментальных животных | 2018 |
|
RU2683723C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПАРОКСИЗМАЛЬНОГО РАССТРОЙСТВА | 2009 |
|
RU2434306C2 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, ОБЛАДАЮЩИЙ ПРОТИВОСУДОРОЖНЫМ И ПСИХОТРОПНЫМ ДЕЙСТВИЕМ | 2007 |
|
RU2342144C1 |
Авторы
Даты
2020-03-02—Публикация
2019-07-15—Подача