ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение по существу относится к катализаторам для получения акриловой кислоты, производных акриловой кислоты или их смесей. В частности, настоящее изобретение относится к получению акриловой кислоты, производных акриловой кислоты или их смесей путем приведения в контакт потока поступающих материалов, содержащего молочную кислоту, производные молочной кислоты или их смеси, с катализатором в жидкой фазе.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Акриловая кислота, производные акриловой кислоты или их смеси в настоящее время применяют в различных промышленных материалах, таких как адгезивы, связывающие вещества, покрытия, краски, лаки, моющие средства, флокулянты, диспергирующие вещества, тиксотропные вещества, комплексообразователи и суперабсорбирующие полимеры (SAP), которые используют в абсорбирующих изделиях, выполненных с возможностью разового использования, включая подгузники и гигиенические изделия. С точки зрения процесса производства акриловую кислоту в настоящее время, как правило, получают в ходе двухстадийного каталитического окисления пропилена, который, в свою очередь, производят из ископаемых ресурсов, таких как нефть или природный газ. Более подробную информацию об окислении пропилена для получения акриловой кислоты и других способах производства можно найти в публикации Kirk-Othmer Encyclopedia of Chemical Technology, Vol. 1, pgs. 342–369 (5th Ed., John Wiley & Sons, Inc., 2004).
При производстве акриловой кислоты из ресурсов ископаемого происхождения используют невозобновляемые компоненты, так как требуется сотня тысяч лет для их естественного формирования и совсем немного времени для их израсходования, и при этом из-за высокого содержания углерода ископаемого происхождения они способствуют выбросу в атмосферу парниковых газов. С другой стороны, возобновляемые ресурсы относятся к материалам, которые производят с помощью естественного процесса со скоростью, сравнимой со скоростью их потребления (например, в пределах 100-летнего периода времени), и можно восполнять естественным образом или с помощью сельскохозяйственных методов. К примерам возобновляемых ресурсов относятся растения, например, сахарный тростник, сахарная свекла, кукуруза, картофель, цитрусовые, древесные растения, лигноцеллюлоза, углеводы, гемицеллюлоза и отходы целлюлозы, животные, рыбы, бактерии, грибы и продукция лесного хозяйства. Поскольку ископаемые ресурсы становятся все более и более дефицитными, более дорогостоящими и потенциально подлежат регулированию в отношении выбросов CO2, существует растущая потребность в акриловой кислоте неископаемого происхождения, производных акриловой кислоты неископаемого происхождения или их смесях, которые могут служить альтернативой акриловой кислоте ископаемого происхождения, производным акриловой кислоты ископаемого происхождения или их смесям.
За последние 80 лет предпринимали много попыток получения акриловой кислоты неископаемого происхождения, производных акриловой кислоты неископаемого происхождения или их смесей из возобновляемых источников, таких как молочная кислота (также известная как 2-гидроксипропионовая кислота) и других материалов. Из этих ресурсов в настоящее время получают только молочную кислоту из сахара с высоким выходом и чистотой (≥ 90% теоретического выхода или, что эквивалентно, ≥ 0,9 г молочной кислоты на грамм сахара), при экономических параметрах, которые способны обеспечивать стоимость производства акриловой кислоты, конкурентную по сравнению с акриловой кислотой ископаемого происхождения. Таким образом, молочная кислота или лактат предоставляют реальную возможность использования в качестве сырьевого материала для акриловой кислоты, производных акриловой кислоты на биологической основе или их смесей.
В подавляющем большинстве научной литературы и патентов описывают газофазную дегидратацию молочной кислоты, производных молочной кислоты или их смесей до акриловой кислоты, производных акриловой кислоты или их смесей. Однако жидкофазная дегидратация должна обеспечивать существенные преимущества в сравнении с газофазной дегидратацией, например, более низкие рабочие температуру и давление, более длительную продолжительность пребывания, более низкие потребление энергии и выбросы CO2, более широкий спектр типов катализаторов (например, гомогенные и гетерогенные) и вариантов катализаторов, более низкий потенциал коксуемости катализаторов, меньшие проблемы с безопасностью, более низкий потенциал коррозии молочной кислотой, более широкий выбор вариантов конструкций реакторов, и т. п. В патенте США 9,309,180 (выданном Evonik Industries AG) описывается процесс дегидратации молочной кислоты и производства акриловой кислоты в жидкой фазе с использованием различных катализаторов на основе солей металлов, таких как K2HPO4, KH2PO4, BaHPO4, и смесей аналогичных солей. При температуре 300 °C и времени реакции в диапазоне от 4,4 ч до 5,5 ч выход акриловой кислоты находился в диапазоне от 0,1 мол.% до 1,3 мол.%.
Соответственно, существует потребность в способах жидкофазной дегидратации молочной кислоты, производных молочной кислоты или их смесей до акриловой кислоты, производных акриловой кислоты или их смесей с высоким выходом и избирательностью.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящего изобретения обеспечивают катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей путем дегидратации молочной кислоты, производных молочной кислоты или их смесей. Катализатор представляет собой расплавленную соль и содержит ионную жидкость (ИЖ) и кислоту; причем указанная ИЖ имеет бромидный анион (Br-); при этом указанная кислота растворима в указанной ИЖ и выбрана из группы, состоящей из кислоты Льюиса, кислоты Бренстеда и их смесей; причем указанная кислота Льюиса выбрана из группы, состоящей из CaBr2, MgBr2, AlBr3, CuBr2 и их смесей; и при этом указанная кислота Бренстеда имеет pKa менее приблизительно 5 в воде при 25 °C.
В другом варианте осуществления настоящего изобретения обеспечивают катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей путем дегидратации молочной кислоты, производных молочной кислоты или их смесей. Катализатор представляет собой расплавленную соль и содержит ИЖ и кислоту; причем указанная ИЖ представляет собой бромид тетрабутилфосфония (PBu4Br), а указанная кислота представляет собой пирофосфорную кислоту (H4P2O7); при этом молярное соотношение указанного PBu4Br и указанной H4P2O7 составляет приблизительно 4,75; и при этом указанную акриловую кислоту получают с выходом по меньшей мере приблизительно 30 мол.%.
В еще одном варианте осуществления настоящего изобретения обеспечивают катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей путем дегидратации молочной кислоты, производных молочной кислоты или их смесей. Катализатор представляет собой расплавленную соль и содержит ИЖ и кислоту; причем указанная ИЖ представляет собой этилтрифенилфосфоний бромид (EtPPh3Br), а указанная кислота представляет собой бромоводородную кислоту (HBr); при этом молярное соотношение указанного EtPPh3Br и указанной HBr составляет от приблизительно 2 до приблизительно 5; и при этом указанную акриловую кислоту получают с выходом по меньшей мере приблизительно 25 мол.%.
В еще одном варианте осуществления настоящего изобретения обеспечивают катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей путем дегидратации молочной кислоты, производных молочной кислоты или их смесей. Катализатор представляет собой расплавленную соль и содержит ИЖ и кислоту; причем указанная ИЖ представляет собой PBu4Br, а указанная кислота представляет собой 2-бромпропионовую кислоту (2-BrPA); при этом молярное соотношение указанного PBu4Br и указанной 2-BrPA составляет приблизительно 20; и при этом указанную акриловую кислоту получают с выходом по меньшей мере приблизительно 52 мол.%.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Применяемый в данном документе термин материал «ископаемого происхождения» относится к материалу, который производят из ресурсов ископаемого происхождения, таких как неочищенная нефть (нефтепродукт), природный газ, уголь, торф и т. д.
Применяемый в данном документе термин «неископаемого происхождения» относится к материалу, который производят из ресурсов неископаемого происхождения. Для ясности и для целей настоящего изобретения термины «возобновляемый» материал, «материал на биологической основе», «ненефтяной» материал и материал «неископаемого происхождения» используют взаимозаменяемо.
Применяемый в данном документе термин «возобновляемый» материал относится к материалу, который производят из возобновляемого ресурса, который представляет собой ресурс, произведенный с помощью естественного процесса со скоростью, сравнимой со скоростью его потребления (например, в пределах 100-летнего временного интервала). Возобновляемый ресурс можно восполнять естественным путем или с помощью сельскохозяйственных методов. К не имеющим ограничительного характера примерам возобновляемых ресурсов относятся растения (такие как сахарный тростник, свекла, кукуруза, картофель, цитрусовые, древесные растения, лигноцеллюлоза, гемицеллюлоза и отходы целлюлозы), животные, рыбы, бактерии, грибы и продукция лесного хозяйства. Такие ресурсы могут представлять собой организмы, встречающиеся в природе, гибриды или организмы, созданные методами генетической инженерии. Формирование ископаемых ресурсов занимает более 100 лет, и, таким образом, их не считают возобновляемыми ресурсами.
Применяемый в данном документе термин «возобновляемое содержание» обозначает количество углерода из возобновляемого ресурса в процентах по весу (по массе) от общего органического углерода в материале согласно определению Методики B стандарта ASTM D6866-10.
Применяемый в данном документе термин «химически инертный» материал относится к материалу, который остается в той же химической форме в условиях равновесия при приведении в контакт с другим материалом или материалами. В контексте настоящего изобретения более приблизительно 90 мас.% материала должно оставаться в той же химической форме для рассмотрения материала в качестве «значительно химически инертного» материала, и более приблизительно 98 мас.% материала должно оставаться в той же химической форме для рассмотрения материала в качестве «по существу химически инертного» материала.
Применяемый в настоящем документе термин «отпаривающий газ» относится к газу, который используют для физического отделения одного или более компонентов от потока жидкости. Как правило, отпаривающий газ вводят во взаимодействие с потоком жидкости в направлении или против направления потока для обеспечения выделения летучих компонентов, содержащихся в потоке жидкости, в газ и вынесения потоком газа для последующего сбора.
Применяемый в данном документе термин «лучшая уходящая группа» относится к химической группе, присоединенной к углероду в α положении в молочной кислоте, которую проще удалять (т. е. для которой характерны более мягкие рабочие условия, меньшая энергия активации или большая скорость удаления), чем гидроксильную группу α углерода молочной кислоты в реакции дегидратации. Лучшие уходящие группы выполнены с возможностью обеспечения лучшей по сравнению с гидроксидным анионом стабилизации дополнительной плотности электронов, которая обусловлена гетеролизом связей; т. е. лучшие уходящие группы демонстрируют более низкое ΔG элиминации, чем ΔG элиминации аниона гидроксида. Перечень лучших уходящих групп в сравнении с гидроксильной группой можно найти в таблице 10.10 публикации J. March, Advanced Organic Chemistry – Reactions, Mechanisms, and Structure, 4th Ed., Wiley 1992, причем конкретными примерами лучших уходящих групп являются: –N2+, –OR2+, –OSO2F, OSO2CF3, –I, –Br, –Cl, –F, –OH2+, –NH3+ и –OAr.
Применяемый в данном документе термин «LA» относится к молочной кислоте, термин «AA» относится к акриловой кислоте, термин «AcH» относится к ацетальдегиду, а термин «PA» относится к пропионовой кислоте.
Применяемый в данном документе термин «ИЖ» означает соль в жидком состоянии.
Применяемый в данном документе термин «молочнокислый эквивалент» относится к количеству молей молочной кислоты, содержащемуся в молочной кислоте, лактиде или их смесях. Таким образом, молочнокислый эквивалент 1 моля молочной кислоты равен 1 молю, молочнокислый эквивалент 1 моля лактида равен 2 молям молочной кислоты, и молочнокислый эквивалент 1 моля смеси молочной кислоты и лактида зависит от молярной доли молочной кислоты в смеси.
Применяемый в данном документе термин «превращение» в мол.% определяют как [расход на входе молочной кислоты, производных молочной кислоты или их смесей (моль/мин.) - расход на выходе молочной кислоты, производных молочной кислоты или их смесей (моль/мин.)] / [расход на входе молочной кислоты, производных молочной кислоты или их смесей (моль/мин.)] x 100.
Применяемый в данном документе термин «выход» в % определяют как [расход продукта на выходе (моль/мин.) / расход на входе молочной кислоты, производных молочной кислоты или их смесей (моль/мин.)] x 100.
Применяемый в данном документе термин «избирательность» в мол.% определяют как [выход / превращение] x 100.
Применяемый в данном документе термин «часовая объемная скорость на единицу массы» или «WHSV» в ч-1 определяют как 60 x [общий расход молочной кислоты (г/мин.) / масса катализатора (г)]. Для целей настоящего определения масса катализатора не включает в себя массу любой инертной подложки.
Используемый в настоящем документе термин «стандартная свободная энергия Гиббса для образования оксида» в кДж/моль определяют как изменение свободной энергии Гиббса, сопровождающее образование 1 моль оксида в его стандартном состоянии из составляющих элементы в их стандартных состояниях (давление 0,1 кПа (1 бар) и температура 25 °C или 298,15° K), что хорошо известно специалистам в данной области. Типичная нотация для стандартной свободной энергии Гиббса такова: ΔGf0.
Применяемый в данном документе термин «pKa» представляет собой отрицательный логарифм по основанию 10 константы диссоциации кислоты в водном растворе кислоты при 25 °C, что хорошо известно специалистам в данной области.
Применяемые в данном документе термины «расплавленный солевой катализатор», «реакторная среда» и «реакционная среда» используют взаимозаменяемо.
II. Катализаторы для дегидратации молочной кислоты или ее производных до акриловой кислоты или ее производных
Неожиданно было обнаружено, что расплавленные солевые катализаторы, содержащие ИЖ и кислоту (кислоту Льюиса, или кислоту Бренстеда, или их смеси) могут дегидратировать молочную кислоту, производные молочной кислоты или их смеси до акриловой кислоты, производных акриловой кислоты или их смесей с высоким выходом и избирательностью (т. е. при меньшем количестве и с меньшим количеством побочных продуктов). Кислота растворима в ИЖ, и ИЖ содержит бромидный анион (Br-). Более того, кислота Льюиса выбрана из группы, состоящей из CaBr2, MgBr2, AlBr3, CuBr2 и их смесей, а кислота Бренстеда имеет значение pKa менее приблизительно 5 в воде при 25 °C. Не желая быть связанными какой-либо теорией, заявители выдвигают гипотезу, что комбинация ИЖ и кислоты приводит к замещению кислородсодержащей группы у α-углеродного атома молочной кислоты или производного молочной кислоты Br-, поступающим из ИЖ. Br- далее либо удаляют в последующей реакции элиминирования вместе с протоном у β-углерода или изомеризуют к β-углероду, а затем удаляют в последующей реакции элиминирования вместе с протоном от α-углерода (удалению протона помогает сопряженное основание кислоты) с образованием двойной связи в акриловой кислоте или производных акриловой кислоты. Кроме того, заявители выдвигают гипотезу, что кислота Льюиса содержит оксофильный металл, имеющий стандартную свободную энергию Гиббса образования оксида менее приблизительно -600 кДж/моль, и Br- так, что суммарный заряд кислоты Льюиса равен 0.
Для целей настоящего изобретения термин «расплавленный солевой катализатор» относится к катализатору, который содержит ИЖ и кислоту. ИЖ представляют собой соли в жидком состоянии, и в некотором контексте термин относится к солям с температурой плавления ниже температуры кипения воды. Хотя типичные жидкости состоят из электрически нейтральных молекул, ИЖ главным образом состоят из плохо скоординированных ионов и короткоживущих ионных пар. К другим названиям ИЖ, встречающимся в литературе, относятся «расплавленные при комнатной температуре соли», «соли с низкой температурой плавления», «расплавленные при температуре окружающей среды соли», «ионные расплавы», «ионные жидкости», «солевые расплавы», «ионные стекла», «жидкие электролиты» и «жидкая органическая соль». Не имеющими ограничительного характера примерами ИЖ являются 1-этил-3-метилимидазолия хлорид, 1-бутил-3-метилимидазолия хлорид, 1-этил-3-метилимидазолия метансульфонат, 1-бутил-3-метилимидазолия метансульфонат, метилимидазолия хлорид, 1-этил-3-метилимидазолия ацетат, 1-этил-3-метилимидазолия этилсульфат, 1-этил-3-метилимидазолия тиоцианат, 1-бутил-3-метилимидазолия гексафторфосфат, 1-этил-3-метилимидазолия тетрафторборат, тетрабутилфосфония бромид, тетрабутиламмония бромид, 1-бутилпиридиния бромид, 1-бутил-1-метилпирролидиния хлорид и тетрагексиламмония йодид.
Будучи солями, ИЖ имеют анион и катион. В одном варианте осуществления настоящего изобретения указанная ИЖ имеет органический катион. В другом варианте осуществления настоящего изобретения указанная ИЖ имеет органический катион, выбранный из группы, состоящей из имидазолия, пиридиния, пирролидиния, аммония, фосфония, их производных и их смесей. В еще одном варианте осуществления настоящего изобретения указанная ИЖ имеет катион фосфония. В еще одном варианте осуществления настоящего изобретения указанный катион фосфония выбран из группы, состоящей из катионов алкилзамещенного фосфония, катионов арилзамещенного фосфония, смешанных катионов алкиларилзамещенного фосфония и их смесей. Не имеющими ограничительного характера примерами алкилзамещенных катионов фосфония являются тетрабутилфосфоний, трибутилэтилфосфоний, дибутилдиэтилфосфоний и бутилтриэтилфосфоний. Не имеющими ограничительного характера примерами арилзамещенных катионов фосфония являются тетрафенилфосфоний, трифенил-п-толилфосфоний, дифенил-ди-п-толилфосфоний, фенил-три-п-толилфосфоний и тетра-п-толилфосфоний. Не имеющими ограничительного характера примерами алкиларилзамещенных катионов фосфония являются этил-трифенилфосфоний, диэтилдифенилфосфоний, триэтилфенилфосфоний, трибутилфенилфосфоний и трибутил-п-толилфосфоний. В одном варианте осуществления настоящего изобретения указанная ИЖ имеет катион тетрабутилфосфония. В другом варианте осуществления настоящего изобретения указанная ИЖ имеет катион этилтрифенилфосфония. В другом варианте осуществления настоящего изобретения указанная ИЖ имеет органический анион. В еще одном варианте осуществления настоящего изобретения указанный органический анион выбран из группы, состоящей из алкилсульфата, тосилата, метансульфоната и их смесей. В одном варианте осуществления настоящего изобретения указанная ИЖ имеет неорганический анион. В другом варианте осуществления настоящего изобретения указанный неорганический анион выбран из группы, состоящей из хлорида (Cl-), бромида (Br-), йодида (I-), тетрафторбората (BF4-), гексафторфосфата (PF6-), бис(трифторметилсульфонил)амида и их смесей. В еще одном варианте осуществления настоящего изобретения указанный неорганический анион представляет собой бромид (Br-). В еще одном варианте осуществления настоящего изобретения указанная ИЖ имеет бромидный (Br-) анион и катион фосфония. В одном варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br). В другом варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид этилтрифенилфосфония ([EtPPh3]Br).
В одном варианте осуществления настоящего изобретения указанная кислота растворима в указанной ИЖ и выбрана из группы, состоящей из кислоты Льюиса, кислоты Бренстеда и их смесей. В другом варианте осуществления настоящего изобретения указанная кислота представляет собой кислоту Бренстеда. В еще одном варианте осуществления настоящего изобретения указанная кислота Бренстеда имеет pKa менее приблизительно 5 в воде при 25 °C. Не имеющими ограничительного характера примерами кислот Бренстеда с pKa менее приблизительно 5 в воде при 25 °C являются уксусная кислота (CH3CO2H), фосфорная кислота (H3PO4), пирофосфорная кислота (H4P2O7), серная кислота (H2SO4), бромоводородная кислота (HBr), 2-бромпропионовая кислота (2-BrPA), 3-бромпропионовая кислота (3-BrPA), хлороводородная кислота (HCl) и азотная кислота (HNO3). В одном варианте осуществления настоящего изобретения указанная кислота Бренстеда представляет собой пирофосфорную кислоту (H4P2O7). В другом варианте осуществления настоящего изобретения указанная кислота Бренстеда представляет собой бромоводородную кислоту (HBr). В еще одном варианте осуществления настоящего изобретения указанная кислота Бренстеда представляет собой серную кислоту (H2SO4). В еще одном варианте осуществления настоящего изобретения указанная кислота Бренстеда представляет собой фосфорную кислоту (H3PO4). В одном варианте осуществления настоящего изобретения указанная кислота Бренстеда представляет собой уксусную кислоту (CH3CO2H). В другом варианте осуществления настоящего изобретения указанная кислота Бренстеда представляет собой 2-бромпропионовую кислоту (2-BrPA). В еще одном варианте осуществления настоящего изобретения указанная кислота Бренстеда представляет собой 3-бромпропионовую кислоту (3-BrPA). В одном варианте осуществления настоящего изобретения указанную 2-бромпропионовую кислоту получают путем реакции молочной кислоты или лактида и бромида 3-метил-1-(4-бутансульфоновая кислота) имидазолия ([MIMBS]Br). В другом варианте осуществления настоящего изобретения указанную 2-бромпропионовую кислоту получают путем реакции молочной кислоты или лактида и бромида 3-метил-1-(4-бутансульфоновая кислота) имидазолия ([MIMBS]Br) при температуре от приблизительно 100 °C до приблизительно 140 °C при молярном соотношении [MIMBS]Br и молочной кислоты от приблизительно 1 : 1 до приблизительно 6 : 1 и времени реакции приблизительно 5 ч.
В одном варианте осуществления настоящего изобретения указанная кислота представляет собой кислоту Льюиса. В другом варианте осуществления настоящего изобретения указанная кислота представляет собой смесь кислоты Льюиса и кислоты Бренстеда. В еще одном варианте осуществления настоящего изобретения указанная кислота Льюиса выбрана из группы, состоящей из CaBr2, MgBr2, AlBr3, CuBr2 и их смесей. В еще одном варианте осуществления настоящего изобретения указанная кислота Льюиса содержит оксофильный металл, имеющий стандартную свободную энергию Гиббса образования оксида менее приблизительно -600 кДж/моль, а также ион Br- так, что суммарный заряд кислоты Льюиса равен 0. Не имеющими ограничительного характера примерами кислот Льюиса, содержащих оксофильный металл, имеющий стандартную свободную энергию Гиббса образования оксида менее приблизительно -600 кДж/моль, а также ион Br- так, что суммарный заряд кислоты Льюиса равен 0, являются CaBr2, MgBr2, AlBr3, BaBr2, SiBr4, BeBr2, CrBr6 и WBr6.
В одном варианте осуществления настоящего изобретения оксофильный металл имеет степень окисления от +1 до +6. В другом варианте осуществления настоящего изобретения оксофильный металл имеет степень окисления +2 или +3. В еще одном варианте осуществления настоящего изобретения оксофильный металл имеет степень окисления +4, или +5, или +6.
В одном варианте осуществления настоящего изобретения молярное соотношение указанной кислоты Бренстеда и указанной кислоты Льюиса составляет от приблизительно 0,1 до приблизительно 10. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанной кислоты Бренстеда и указанной кислоты Льюиса составляет от приблизительно 0,5 до приблизительно 5. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанной кислоты Бренстеда и указанной кислоты Льюиса составляет приблизительно 1.
В одном варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а указанная кислота представляет собой пирофосфорную кислоту (H4P2O7). В другом варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а указанная кислота представляет собой уксусную кислоту (CH3CO2H). В еще одном варианте осуществления настоящего изобретения указанная ИЖ представляет собой [PBu4]Br, а указанная кислота выбрана из группы, состоящей из CaBr2, MgBr2, AlBr3, CuBr2 и их смесей. В еще одном варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а указанная кислота представляет собой серную кислоту (H2SO4). В одном варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а указанная кислота представляет собой бромоводородную кислоту (HBr). В другом варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид этилтрифенилфосфония ([EtPPh3]Br), а указанная кислота представляет собой бромоводородную кислоту (HBr). В еще одном варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а указанная кислота состоит из HBr и кислоты Льюиса, выбранной из группы, состоящей из CaBr2, MgBr2, AlBr3, CuBr2 и их смесей. В еще одном варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а указанная кислота представляет собой 2-бромпропионовую кислоту (2-BrPA). В одном варианте осуществления настоящего изобретения указанная ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а указанная кислота представляет собой 3-бромпропионовую кислоту (3-BrPA).
В одном варианте осуществления настоящего изобретения молярное соотношение указанной ИЖ и указанной кислоты составляет от приблизительно 1 до приблизительно 30. В другом варианте осуществления настоящего изобретения молярное соотношение указанной ИЖ и указанной кислоты составляет от приблизительно 2 до приблизительно 15. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанной ИЖ и указанной кислоты составляет от приблизительно 3 до приблизительно 7. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанной ИЖ и указанной кислоты составляет приблизительно 4. В одном варианте осуществления настоящего изобретения молярное соотношение указанной ИЖ и указанной кислоты составляет приблизительно 4,75. В другом варианте осуществления настоящего изобретения молярное соотношение указанной ИЖ и указанной кислоты составляет приблизительно 10. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанной ИЖ и указанной кислоты составляет приблизительно 20.
В одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H4P2O7 составляет от приблизительно 1 до приблизительно 30. В другом варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H4P2O7 составляет от приблизительно 3 до приблизительно 10. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H4P2O7 составляет от приблизительно 3,5 до приблизительно 7. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H4P2O7 составляет приблизительно 4,75.
В одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной HBr составляет от приблизительно 1 до приблизительно 20. В другом варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной HBr составляет от приблизительно 2 до приблизительно 10. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной HBr составляет от приблизительно 2 до приблизительно 5. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной HBr составляет приблизительно 4,75.
В одном варианте осуществления настоящего изобретения молярное соотношение указанного [EtPPh3]Br и указанной HBr составляет от приблизительно 1 до приблизительно 20. В другом варианте осуществления настоящего изобретения молярное соотношение указанного [EtPPh3]Br и указанной HBr составляет от приблизительно 2 до приблизительно 10. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [EtPPh3]Br и указанной HBr составляет от приблизительно 2 до приблизительно 5. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [EtPPh3]Br и указанной HBr составляет приблизительно 4.
В одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H2SO4 составляет от приблизительно 3 до приблизительно 10. В другом варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H2SO4 составляет от приблизительно 3,5 до приблизительно 7. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H2SO4 составляет от приблизительно 4 до приблизительно 5. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H2SO4 составляет приблизительно 4,75.
В одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H3PO4 составляет от приблизительно 3 до приблизительно 10. В другом варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H3PO4 составляет от приблизительно 3,5 до приблизительно 7. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H3PO4 составляет от приблизительно 4 до приблизительно 5. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной H3PO4 составляет приблизительно 4,75.
В одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной уксусной кислоты (CH3CO2H) составляет от приблизительно 3 до приблизительно 10. В другом варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной уксусной кислоты (CH3CO2H) составляет от приблизительно 3,5 до приблизительно 7. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной уксусной кислоты (CH3CO2H) составляет от приблизительно 4 до приблизительно 5. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной уксусной кислоты (CH3CO2H) составляет приблизительно 4,75.
В одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной 2-бромпропионовой кислоты (2-BrPA) составляет приблизительно 10. В другом варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной 2-бромпропионовой кислоты (2-BrPA) составляет приблизительно 20. В другом варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной 3-бромпропионовой кислоты (3-BrPA) составляет приблизительно 10. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной 3-бромпропионовой кислоты (3-BrPA) составляет приблизительно 20.
В одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанного CaBr2 составляет приблизительно 4,75. В другом варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанного MgBr2 составляет приблизительно 4,75. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанного AlBr3 составляет приблизительно 4,75. В еще одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанного CuBr2 составляет приблизительно 4,75. В одном варианте осуществления настоящего изобретения молярное соотношение указанного [PBu4]Br и указанной эквимолярной смеси HBr и AlBr3 составляет приблизительно 4,75. В другом варианте осуществления настоящего изобретения молярное соотношение HBr и AlBr3 составляет от приблизительно 0,1 до приблизительно 10. В еще одном варианте осуществления настоящего изобретения молярное соотношение HBr и AlBr3 составляет от приблизительно 0,5 до приблизительно 5. В еще одном варианте осуществления настоящего изобретения молярное соотношение HBr и AlBr3 составляет приблизительно 1.
В одном варианте осуществления настоящего изобретения расплавленный солевой катализатор, содержащий ИЖ и кислоту, дополнительно содержит другое соединение, которое значительно химически инертно по отношению к указанным ИЖ и кислоте. В другом варианте осуществления настоящего изобретения указанное другое соединение содержит катион и анион. Не имеющими ограничительного характера примерами анионов в другом соединении являются арсенаты, конденсированные арсенаты, нитраты, сульфаты, конденсированные сульфаты, бораты, карбонаты, хроматы, конденсированные хроматы, ванадаты, ниобаты, танталаты, селенаты, конденсированные силикаты, конденсированные алюминаты, германаты, конденсированные германаты, молибдаты, конденсированные молибдаты, другие мономерные оксианионы, полиоксианионы, гетерополифосфаты, такие как арсенатофосфаты, фосфоалюминаты, фосфобораты, фосфохроматы, фосфомолибдаты, фосфосиликаты, фосфосульфаты, фосфовольфраматы и фосфатные аддукты, такие как фосфатные анионы с теллуровой кислотой, галиды, бораты, карбонаты, нитраты, сульфаты, хроматы, силикаты, оксалаты, их смеси или иные соединения, которые могут быть очевидны специалистам в данной области.
В одном варианте осуществления настоящего изобретения указанный расплавленный солевой катализатор дополнительно содержит инертную подложку. Не имеющие ограничительного характера примеры инертных подложек представляют собой кремнезем, силикат, оксид алюминия, алюминат, алюмосиликат, оксид титана, титанат, оксид циркония, цирконат, уголь (такой как активированный уголь, алмаз, графит или фуллерен), сульфат, фосфат, танталат, оксид церия, другие оксиды металлов и их смеси. В другом варианте осуществления настоящего изобретения указанная инертная подложка состоит по существу из оксида кремния. В еще одном варианте осуществления настоящего изобретения указанный кремнезем выбран из группы, состоящей из аморфного кремнезема, кварца, тридимита, кристобалита, моганита, коэсита и их смесей. В еще одном варианте осуществления настоящего изобретения указанный кремнезем представляет собой аморфный кремнезем. В другом варианте осуществления настоящего изобретения указанный кремнезем имеет удельную площадь поверхности, составляющую менее приблизительно 10 м2/г. В другом варианте осуществления настоящего изобретения инертная подложка составляет по количеству от приблизительно 20 мас.% до приблизительно 90 мас.% от общей массы активного катализатора.
В одном варианте осуществления настоящего изобретения масса ИЖ и кислоты на основе общей массы расплавленного солевого катализатора составляет приблизительно 100 мас.%. В другом варианте осуществления настоящего изобретения масса ИЖ и кислоты на основе общей массы расплавленного солевого катализатора составляет от приблизительно 5 мас.% до приблизительно 90 мас.%. В еще одном варианте осуществления настоящего изобретения масса ИЖ и кислоты на основе общей массы расплавленного солевого катализатора составляет от приблизительно 20 мас.% до приблизительно 80 мас.%. В еще одном варианте осуществления настоящего изобретения масса ИЖ и кислоты на основе общей массы расплавленного солевого катализатора составляет от приблизительно 40 мас.% до приблизительно 60 мас.%. В одном варианте осуществления настоящего изобретения масса ИЖ и кислоты на основе общей массы расплавленного солевого катализатора составляет приблизительно 50 мас.%.
В одном варианте осуществления настоящего изобретения катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой расплавленную соль и содержит ИЖ и кислоту. В другом варианте осуществления настоящего изобретения катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой расплавленную соль и содержит ИЖ и кислоту; причем ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а кислота представляет собой пирофосфорную кислоту (H4P2O7); причем молярное соотношение [PBu4]Br и H4P2O7 составляет приблизительно 4,75; и при этом акриловую кислоту получают с выходом по меньшей мере приблизительно 30 мол.%. В еще одном варианте осуществления настоящего изобретения катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой расплавленную соль и содержит ИЖ и кислоту; причем ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а кислота представляет собой бромоводородную кислоту (HBr); причем молярное соотношение [PBu4]Br и HBr составляет от приблизительно 2 до приблизительно 5; и при этом акриловую кислоту получают с выходом по меньшей мере приблизительно 18 мол.%. В еще одном варианте осуществления настоящего изобретения обеспечивают катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей путем дегидратации молочной кислоты, производных молочной кислоты или их смесей; причем катализатор представляет собой расплавленную соль и содержит ИЖ и кислоту; причем указанная ИЖ представляет собой этилтрифенилфосфоний бромид ([EtPPh3]Br), а указанная кислота представляет собой бромоводородную кислоту (HBr); причем молярное соотношение указанного [EtPPh3]Br и указанной HBr составляет от приблизительно 2 до приблизительно 5; и при этом указанную акриловую кислоту получают с выходом по меньшей мере приблизительно 25 мол.%. В еще одном варианте осуществления настоящего изобретения катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой расплавленную соль и содержит ИЖ и кислоту; причем ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а кислота представляет собой 2-бромпропионовую кислоту (2-BrPA); причем молярное соотношение [PBu4]Br и 2-BrPA составляет приблизительно 10; и при этом акриловую кислоту получают с выходом по меньшей мере приблизительно 47 мол.%. В еще одном варианте осуществления настоящего изобретения катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой расплавленную соль и содержит ИЖ и кислоту; причем ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а кислота представляет собой 3-бромпропионовую кислоту (3-BrPA); причем молярное соотношение [PBu4]Br и 3-BrPA составляет приблизительно 10; и при этом акриловую кислоту получают с выходом по меньшей мере приблизительно 47 мол.%. В одном варианте осуществления настоящего изобретения катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой расплавленную соль и содержит ИЖ и кислоту; причем ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а кислота представляет собой 2-бромпропионовую кислоту (2-BrPA); причем молярное соотношение [PBu4]Br и 2-BrPA составляет приблизительно 20; и при этом акриловую кислоту получают с выходом по меньшей мере приблизительно 52 мол.%. В еще одном варианте осуществления настоящего изобретения катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой расплавленную соль и содержит ИЖ и кислоту; причем ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br), а кислота представляет собой 3-бромпропионовую кислоту (3-BrPA); причем молярное соотношение [PBu4]Br и 3-BrPA составляет приблизительно 20; и при этом акриловую кислоту получают с выходом по меньшей мере приблизительно 52 мол.%.
Помимо ИЖ и кислоты, расплавленный солевой катализатор настоящего изобретения может включать в себя фосфиноксид OPX3, где X может быть выбран из разнообразных групп. Не имеющими ограничительного характера примерами фосфиноксидов являются трифенилфосфиноксид (TPPO), трибутилфосфиноксид (TBPO), триэтилфосфиноксид (TEPO) и триоктилфосфиноксид (TOPO).
Расплавленный солевой катализатор настоящего изобретения можно использовать для катализа нескольких химических реакций. Не имеющими ограничительного характера примерами реакций являются: дегидратация молочной кислоты, производных молочной кислоты или их смесей до акриловой кислоты; дегидратация 3-гидроксипропионовой кислоты, 3-производных гидроксипропионовой кислоты или их смесей до акриловой кислоты; дегидратация глицерина до акролеина; изомеризация молочной кислоты в 3-гидроксипропионовую кислоту в присутствии воды; восстановление гидроксипропионовой кислоты до пропионовой кислоты или 1-пропанола в присутствии газообразного водорода; дегидратация алифатических спиртов до алкенов или олефинов; дегидрогенизация алифатических спиртов до эфиров; другие реакции дегидрогенизации, гидролиза, алкилирования, деалкилирования, окисления, диспропорционирования, эстерификации, циклизации, изомеризации, конденсации, ароматизации, полимеризации; и другие реакции, которые могут быть очевидны специалисту в данной области техники.
III. Способы получения акриловой кислоты, производных акриловой кислоты или их смесей
Предложен способ дегидратации гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей до акриловой кислоты, производных акриловой кислоты или их смесей. В одном варианте осуществления настоящего изобретения указанная гидроксипропионовая кислота выбрана из группы, состоящей из молочной кислоты (2-гидроксипропионовой кислоты), 3-гидроксипропионовой кислоты и их смесей; а указанные производные гидроксипропионовой кислоты выбраны из группы, состоящей из производных молочной кислоты, производных 3-гидроксипропионовой кислоты и их смесей.
В другом варианте осуществления настоящего изобретения указанная гидроксипропионовая кислота представляет собой молочную кислоту, а указанные производные гидроксипропионовой кислоты представляют собой производные молочной кислоты. Молочная кислота может представлять собой D-молочную кислоту, L-молочную кислоту или их смеси (включая рецемическую смесь). Специалистам в данной области хорошо известно, что гидроксильная группа у α-углерода молочной кислоты не является хорошей уходящей группой, и что карбоксильная группа молочной кислоты склонна к декарбоксилированию или декарбонилированию. Это декарбоксилирование и декарбонилирование является более легким, чем удаление гидроксильной группы, и по этой причине окончились неудачно многие прошлые попытки производства коммерчески приемлемых количества акриловой кислоты. Не желая быть связанными какой-либо теорией, заявители считают, что коммерчески приемлемые количества акриловой кислоты можно производить из молочной кислоты, если заменять гидроксильную группу лучшей уходящей группой и защищать карбоксильную группу.
Не имеющими ограничительного характера примерами производных молочной кислоты с защищенной карбоксильной группой являются металлические или аммонийные соли молочной кислоты (также именуемые лактатами металлов или аммония), алкиловые эфиры молочной кислоты (также именуемые алкиллактатами), циклические диэфиры молочной кислоты или их смеси. Не имеющие ограничительного характера примеры лактатов представляют собой лактат натрия, лактат калия и лактат кальция; не имеющими ограничительного характера примерами лактатов являются метиллактат (MLA), этиллактат (ELA), бутиллактат и 2-этилгексиллактат; и не имеющим ограничительного характера примером циклических сложных диэфиров молочной кислоты является дилактид (также именуемый лактидом).
Не имеющими ограничительного характера примерами производных молочной кислоты с заменой гидроксильной группы лучшей уходящей группой являются 2-алкоксипропионовые кислоты, 2-арилоксипропионовые кислоты, 2-ацилоксипропионовые кислоты, 2-фторпропионовая кислота (2-FPA), 2-хлорпропионовая кислота (2-ClPA), 2-бромпропионовая кислота (2-BrPA), 2-йодпропионовая кислота (2-IPA), или их смеси. Не имеющие ограничительного характера примеры 2-алкоксипропионовых кислот представляют собой 2-метоксипропионовую кислоту и 2-этоксипропионовую кислоту; не имеющий ограничительного характера пример 2-арилоксипропионовой кислоты представляет собой 2-феноксипропионовую кислоту; и не имеющими ограничительного характера примерами 2-ацилоксипропионовой кислоты является 2-ацетоксипропионовая кислота (2-APA) и 2-трифторацетоксипропионовая кислота (2-TFPA).
Не имеющими ограничительного характера примерами производных молочной кислоты, имеющими как замену гидроксильной группы лучшей уходящей группой, так и защиту карбоксильной группы, являются сложные эфиры 2-алкоксипропионовой кислоты, алкиловые эфиры 2-арилоксипропионовой кислоты, алкиловые эфиры 2-ацилоксипропионовой кислоты или их смеси. Не имеющими ограничительного характера примерами алкиловых эфиров 2-алкоксипропионовой кислоты являются этил 2-метоксипропионат и метил 2-этоксипропионат; не имеющими ограничительного характера примерами алкиловых эфиров 2-арилоксипропионовой кислоты являются метил 2-феноксипропионат и этил 2-феноксипропионат; и не имеющими ограничительного характера примерами алкиловых эфиров 2-ацилоксипропионовой кислоты являются метил 2-ацетоксипропионат (MAPA), этил 2-ацетоксипропионат (EAPA) и этил 2-трифторацетоксипропионат (ETFP).
В одном варианте осуществления настоящего изобретения производные молочной кислоты выбраны из группы, состоящей из молочной кислоты с защищенной карбоксильной группой, молочной кислоты с гидроксильной группой, замененной лучшей уходящей группой, молочной кислоты с защищенной карбоксильной группой и с гидроксильной группой, замененной лучшей уходящей группой, и их смесей. В другом варианте осуществления настоящего изобретения производные молочной кислоты выбраны из группы, состоящей из лактида, 2-ацетоксипропионовой кислоты (2-APA), ETFP и 2-бромпропионовой кислоты (2-BrPA). В еще одном варианте осуществления настоящего изобретения производное молочной кислоты представляет собой ETFP. Другие производные молочной кислоты могут представлять собой олигомеры молочной кислоты, ангидрид молочной кислоты и 3-бромпропионовую кислоту (3-BrPA).
Молочная кислота в указанном потоке поступающих материалов может присутствовать в мономерной форме или в форме олигомеров. В одном варианте осуществления настоящего изобретения олигомеры молочной кислоты в указанном потоке поступающих материалов составляют менее приблизительно 30 мас.% в пересчете на общее количество молочной кислоты, производных молочной кислоты или их смесей. В другом варианте осуществления настоящего изобретения олигомеры молочной кислоты в указанном потоке поступающих материалов составляют менее приблизительно 10 мас.% в пересчете на общее количество молочной кислоты, производных молочной кислоты или их смесей. В еще одном варианте осуществления настоящего изобретения олигомеры молочной кислоты в потоке поступающих материалов составляют менее приблизительно 5 мас.% в пересчете на общее количество молочной кислоты, производных молочной кислоты или их смесей. В еще одном варианте осуществления настоящего изобретения молочная кислота в указанном потоке поступающих материалов присутствует по существу в мономерной форме.
Процесс удаления олигомеров из потока поступающих материалов может включать в себя этап очистки или этап гидролиза путем стадии нагревания. В одном варианте осуществления настоящего изобретения стадия нагревания может включать нагревание потока поступающих материалов при температуре от приблизительно 50 °C до приблизительно 100 °C для обеспечения гидролиза олигомеров молочной кислоты. В другом варианте осуществления настоящего изобретения стадия нагревания может включать в себя нагревание потока поступающих материалов при температуре от приблизительно 95 °C до приблизительно 100 °C для обеспечения гидролиза олигомеров молочной кислоты. В еще одном варианте осуществления настоящего изобретения стадия нагревания может включать в себя нагревание потока поступающих материалов при температуре от приблизительно 50 °C до приблизительно 100 °C для обеспечения гидролиза олигомеров молочной кислоты и для создания потока поступающих материалов с мономерной молочной кислотой, содержащего по меньшей мере 80 мас.% молочной кислоты в мономерной форме в пересчете на общее количество молочной кислоты, производных молочной кислоты или их смесей. В еще одном варианте осуществления настоящего изобретения стадия нагревания может включать в себя нагревание потока поступающих материалов при температуре от приблизительно 50 °C до приблизительно 100 °C для обеспечения гидролиза олигомеров молочной кислоты и для создания потока поступающих материалов с мономерной молочной кислотой, содержащего по меньшей мере 95 мас.% молочной кислоты в мономерной форме в пересчете на общее количество молочной кислоты, производных молочной кислоты или их смесей. В одном варианте осуществления настоящего изобретения приблизительно 88 мас.% водного раствора молочной кислоты, производных молочной кислоты или их смесей разбавляют водой и гидролизируют олигомеры для произведения водного раствора на основе приблизительно 20 мас.% молочной кислоты.
Производные 3-гидроксипропионовой кислоты могут представлять собой соли металла или аммония 3-гидроксипропионовой кислоты, алкиловые сложные эфиры 3-гидроксипропионовой кислоты, олигомеры 3-гидроксипропионовой кислоты, 3-алкоксипропионовые кислоты или их алкиловые сложные эфиры, 3-арилоксипропионовые кислоты или их алкиловые сложные эфиры, 3-ацилоксипропионовые кислоты или их алкиловые сложные эфиры или их смеси. Не имеющие ограничительного характера примеры солей металла 3-гидроксипропионовой кислоты представляют собой 3-гидроксипропионат натрия, 3-гидроксипропионат калия и 3-гидроксипропионат кальция. Не имеющие ограничительного характера примеры алкиловых сложных эфиров гидроксипропионовой кислоты представляют собой метил-3-гидроксипропионат, этил-3-гидроксипропионат, бутил-3-гидроксипропионат, 2-этилгексил-3-гидроксипропионат и их смеси. Не имеющие ограничительного характера примеры 3-алкоксипропионовых кислот представляют собой 3-метоксипропионовую кислоту и 3-этоксипропионовую кислоту. Не имеющий ограничительного характера пример 3-арилоксипропионовой кислоты представляет собой 3-феноксипропионовую кислоту. Не имеющий ограничительного характера пример 3-ацилоксипропионовой кислоты представляет собой 3-ацетоксипропионовую кислоту.
Можно получать гидроксипропионовую кислоту, производные гидроксипропионовой кислоты или их смеси путем ферментации сахара или химического превращения сахаров или иных исходных материалов, таких как глицерин. Почти все мировое производство молочной кислоты осуществляют в настоящее время путем ферментации сахара; однако существуют технологии химических превращений, осуществляемые в настоящее время в пробном или демонстрационном масштабе. Кроме того, сахарное сырье может представлять собой сахар поколения 1 (т. е. сахар из кукурузы, сахарного тростника, сахарной свеклы, пшеницы, картофеля, риса и т. п.) или сахар поколения 2 (т. е. сахар, полученный путем гидролиза биомассы или сельскохозяйственных отходов, таких как жмых, кукурузная солома, рисовая шелуха, пшеничная солома, и т. п.).
Производные акриловой кислоты могут представлять собой соли металла или аммония акриловой кислоты, алкиловые сложные эфиры акриловой кислоты, олигомеры акриловой кислоты или их смеси. Не имеющие ограничительного характера примеры солей металла акриловой кислоты представляют собой акрилат натрия, акрилат калия и акрилат кальция. Не имеющие ограничительного характера примеры алкиловых сложных эфиров акриловой кислоты представляют собой метилакрилат, этилакрилат, бутилакрилат, 2-этилгексилакрилат или их смеси.
В одном варианте осуществления настоящего изобретения поток поступающих материалов содержит жидкость. В другом варианте осуществления настоящего изобретения поток поступающих материалов содержит твердое вещество. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов содержит жидкость и твердое вещество. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов содержит жидкость и газ.
В одном варианте осуществления настоящего изобретения способ получения акриловой кислоты, производных акриловой кислоты или их смесей включает приведение потока поступающих материалов, содержащих молочную кислоту, производные молочной кислоты или их смеси, в контакт с расплавленным солевым катализатором в реакторе при определенной температуре, причем расплавленный солевой катализатор содержит ИЖ и кислоту, и при этом акриловую кислоту, производные акриловой кислоты или их смеси получают в результате дегидратации в реакторе.
В другом варианте осуществления настоящего изобретения указанный поток поступающих материалов дополнительно содержит по существу химически инертный разбавитель. В контексте настоящего изобретения по существу химически инертный разбавитель представляет собой любой разбавитель, который является по существу химически инертным по отношению к указанным гидроксипропионовой кислоте, производным гидроксипропионовой кислоты или их смесям, но не обязательно по отношению к указанному расплавленному солевому катализатору. К не имеющим ограничительного характера примерам по существу химически инертных разбавителей относят воду, углеводороды, хлорированные углеводороды, бромированные углеводороды, фторированные углеводороды, сложные эфиры, простые эфиры, кетоны и их смеси. Не имеющие ограничительного характера примеры углеводородов представляют собой линейные и разветвленные C5–C8 алканы. Не имеющий ограничительного характера пример сложных эфиров представляет собой этилацетат. Не имеющий ограничительного характера пример эфиров представляет собой дифениловый эфир. Не имеющий ограничительного характера пример кетонов представляет собой ацетон. В еще одном варианте осуществления настоящего изобретения указанный по существу химически инертный разбавитель содержит воду. В еще одном варианте осуществления настоящего изобретения указанный по существу химически инертный разбавитель состоит по существу из воды. В одном варианте осуществления настоящего изобретения указанный поток поступающих материалов состоит по существу из гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей.
В другом варианте осуществления настоящего изобретения поток поступающих материалов, содержащий гидроксипропионовую кислоту, производные гидроксипропионовой кислоты или их смеси, может дополнительно содержать один или более антиоксидантов. В другом варианте осуществления настоящего изобретения поток поступающих материалов, содержащий гидроксипропионовую кислоту, производные гидроксипропионовой кислоты или их смеси, дополнительно содержит бутилированный гидрокситолуол (BHT), бутилированный гидроксианизол (BHA) или их смеси. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов, содержащий гидроксипропионовую кислоту, производные гидроксипропионовой кислоты или их смеси, дополнительно содержит этиленгликоль, этандитиол, метанол, метантиол или их смеси.
В одном варианте осуществления настоящего изобретения концентрация гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей в указанном потоке поступающих материалов составляет от приблизительно 1 мас.% до приблизительно 100 мас.%. В другом варианте осуществления настоящего изобретения концентрация гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей в указанном потоке поступающих материалов составляет от приблизительно 5 мас.% до приблизительно 95 мас.%. В еще одном варианте осуществления настоящего изобретения концентрация гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей в указанном потоке поступающих материалов составляет от приблизительно 20 мас.% до приблизительно 80 мас.%. В еще одном варианте осуществления настоящего изобретения концентрация гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей в указанном потоке поступающих материалов составляет приблизительно 25 мас.%. В одном варианте осуществления настоящего изобретения концентрация гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей в указанном потоке поступающих материалов составляет приблизительно 50 мас.%.
В одном варианте осуществления настоящего изобретения концентрация молочной кислоты, производных молочной кислоты или их смесей в указанном потоке поступающих материалов составляет от приблизительно 1 мас.% до приблизительно 100 мас.%. В другом варианте осуществления настоящего изобретения концентрация молочной кислоты, производных молочной кислоты или их смесей в указанном потоке поступающих материалов составляет от приблизительно 5 мас.% до приблизительно 95 мас.%. В еще одном варианте осуществления настоящего изобретения концентрация молочной кислоты, производных молочной кислоты или их смесей в указанном потоке поступающих материалов составляет от приблизительно 20 мас.% до приблизительно 80 мас.%. В еще одном варианте осуществления настоящего изобретения концентрация молочной кислоты, производных молочной кислоты или их смесей в указанном потоке поступающих материалов составляет приблизительно 25 мас.%. В другом варианте осуществления настоящего изобретения концентрация молочной кислоты, производных молочной кислоты или их смесей в указанном потоке поступающих материалов составляет приблизительно 50 мас.%.
Не имеющими ограничительного характера примерами реакторов, подходящих для применения в настоящем изобретении, являются статические реакторы, реакторы с перемешиванием, реакторы с рециркуляцией, реакторы с орошаемым слоем и их комбинации. В одном варианте осуществления настоящего изобретения реактор представляет собой реактор с перемешиванием. В другом варианте осуществления настоящего изобретения реактор с перемешиванием представляет собой однослойный реактор. Однослойный реактор состоит из единственного слоя (также именуемого стенкой), который проходит от внутренней поверхности к наружной поверхности и имеет толщину стенки. Внутренняя поверхность контактирует с расплавленным солевым катализатором, потоком поступающих материалов и потоком продукта. В одном варианте осуществления настоящего изобретения однослойный реактор содержит стенку, наружную поверхность и внутреннюю поверхность; причем указанная стенка изготовлена из материала стенки, имеет толщину стенки и проходит от указанной наружной поверхности к указанной внутренней поверхности; и при этом указанная внутренняя поверхность контактирует с указанным расплавленным солевым катализатором, потоком поступающих материалов и потоком продукта.
В одном варианте осуществления настоящего изобретения толщина стенки однослойного реактора составляет от приблизительно 2 мм до приблизительно 30 мм. В другом варианте осуществления настоящего изобретения толщина стенки однослойного реактора составляет от приблизительно 3 мм до приблизительно 20 мм. В еще одном варианте осуществления настоящего изобретения толщина стенки однослойного реактора составляет от приблизительно 4 мм до приблизительно 10 мм. В еще одном варианте осуществления настоящего изобретения толщина стенки однослойного реактора составляет от приблизительно 5 мм до приблизительно 8 мм.
В одном варианте осуществления настоящего изобретения реактор с перемешиванием представляет собой двухслойный реактор. Двухслойный реактор имеет внутреннюю поверхность, которая контактирует с расплавленным солевым катализатором, потоком поступающих материалов и потоком продукта, и представляет собой самую внутреннюю поверхность двухслойного реактора. Двухслойный реактор состоит из внутреннего слоя, который имеет толщину внутреннего слоя, наружного слоя, который имеет толщину наружного слоя, границу между наружным слоем и внутренним слоем, и наружную поверхность, представляющую собой самую наружную поверхность двухслойного реактора. В другом варианте осуществления настоящего изобретения наружный слой двухслойного реактора состоит из двух или более подслоев. В еще одном варианте осуществления настоящего изобретения двухслойный реактор содержит наружный слой, внутренний слой, наружную поверхность, внутреннюю поверхность и границу между указанным наружным слоем и указанным внутренним слоем; причем указанный наружный слой изготовлен из материала наружного слоя, имеет толщину наружного слоя и отходит от указанной границы к указанной наружной поверхности; при этом указанный внутренний слой изготовлен из материала внутреннего слоя, имеет толщину внутреннего слоя и отходит от указанной внутренней поверхности к указанной границе; и при этом указанная внутренняя поверхность контактирует с указанным расплавленным солевым катализатором, потоком поступающих материалов и потоком продукта. В еще одном варианте осуществления настоящего изобретения указанный наружный слой содержит два или более подслоев.
В одном варианте осуществления настоящего изобретения толщина внутреннего слоя двухслойного реактора составляет от приблизительно 1 мм до приблизительно 20 мм. В другом варианте осуществления настоящего изобретения толщина внутреннего слоя двухслойного реактора составляет от приблизительно 1,5 мм до приблизительно 10 мм. В еще одном варианте осуществления настоящего изобретения толщина внутреннего слоя двухслойного реактора составляет от приблизительно 2 мм до приблизительно 8 мм. В еще одном варианте осуществления настоящего изобретения толщина внутреннего слоя двухслойного реактора составляет от приблизительно 3 мм до приблизительно 6 мм. В одном варианте осуществления настоящего изобретения толщина наружного слоя двухслойного реактора составляет от приблизительно 1 мм до приблизительно 20 мм. В другом варианте осуществления настоящего изобретения толщина наружного слоя двухслойного реактора составляет от приблизительно 1,5 мм до приблизительно 10 мм. В еще одном варианте осуществления настоящего изобретения толщина наружного слоя двухслойного реактора составляет от приблизительно 2 мм до приблизительно 8 мм. В еще одном варианте осуществления настоящего изобретения толщина наружного слоя двухслойного реактора составляет от приблизительно 3 мм до приблизительно 6 мм.
Расплавленные солевые катализаторы, или поток поступающих материалов, или поток продукта настоящего изобретения может оказывать коррозионное действие на реакторы. Не имеющим ограничительного характера примерами материалов, которые можно использовать в настоящем изобретении либо в качестве материалов стенки, либо в качестве материалов внутреннего слоя, являются стекло; кремнезем; сапфир; титан; медь; серебро; золото; вольфрам; тантал; цирконий; сплавы HASTELLOY® и HAYNES® (сплавы на основе Ni; Haynes International, Inc.; Кокомо, штат Индиана, США); сплавы INCONEL®, INCOLOY® и MONEL® (сплавы на основе Ni; Special Metals Corporation; г. Хантингтон, штат Западная Виргиния, США); и пластиковые материалы (например, политетрафторэтилен (PTFE), полиэфирэфиркетон (PEEK) и полиэфирсульфон (PES)). В одном варианте осуществления настоящего изобретения материал наружного слоя выбран из группы, состоящей из нержавеющей стали и углеродистой стали. В другом варианте осуществления настоящего изобретения материал наружного слоя представляет собой нержавеющую сталь, а материал внутреннего слоя двухслойного реактора представляет собой титан.
В одном варианте осуществления настоящего изобретения однослойный реактор имеет скорость коррозии менее приблизительно 1,3 мм/год. В другом варианте осуществления настоящего изобретения двухслойный реактор имеет скорость коррозии менее приблизительно 1,3 мм/год. Для целей настоящего изобретения скорость коррозии измеряют, взвешивая образец материала стенки или образец материала внутреннего слоя до и после воздействия условий реакции, как известно специалистам в данной области.
В одном варианте осуществления настоящего изобретения указанная скорость коррозии составляет менее приблизительно 1 мм/год. В другом варианте осуществления настоящего изобретения указанная скорость коррозии составляет менее приблизительно 0,5 мм/год. В еще одном варианте осуществления настоящего изобретения указанная скорость коррозии составляет менее приблизительно 0,13 мм/год. В еще одном варианте осуществления настоящего изобретения указанная скорость коррозии составляет менее приблизительно 0,05 мм/год.
В одном варианте осуществления настоящего изобретения температура в ходе указанной дегидратации составляет более приблизительно 50 °C. В другом варианте осуществления настоящего изобретения температура в ходе указанной дегидратации составляет от приблизительно 80 °C до приблизительно 400 °C. В еще одном варианте осуществления настоящего изобретения температура в ходе указанной дегидратации составляет от приблизительно 140 °C до приблизительно 300 °C. В еще одном варианте осуществления настоящего изобретения температура в ходе указанной дегидратации составляет от приблизительно 150 °C до приблизительно 280 °C. В одном варианте осуществления настоящего изобретения температура в ходе указанной дегидратации составляет от приблизительно 180 °C до приблизительно 250 °C. В другом варианте осуществления настоящего изобретения температура в ходе указанной дегидратации составляет приблизительно 220 °C. В еще одном варианте осуществления настоящего изобретения температура в ходе указанной дегидратации составляет приблизительно 150 °C. В еще одном варианте осуществления настоящего изобретения температура в ходе указанной дегидратации составляет приблизительно 160 °C. В одном варианте осуществления настоящего изобретения температура в ходе указанной дегидратации составляет приблизительно 180 °C.
Приведение потока поступающих материалов в контакт с расплавленным солевым катализатором можно осуществлять в вакууме, при атмосферном давлении или при давлении выше атмосферного. В одном варианте осуществления настоящего изобретения приведение в контакт осуществляют при общем давлении, составляющем по меньшей мере приблизительно 0,1 кПа (1 бар). В другом варианте осуществления настоящего изобретения приведение в контакт осуществляют при общем давлении от приблизительно 25 кПа до приблизительно 0,2 кПа (от приблизительно 250 мбар до приблизительно 2 бар). В еще одном варианте осуществления настоящего изобретения приведение в контакт осуществляют при атмосферном давлении.
В одном варианте осуществления настоящего изобретения указанная WHSV составляет от приблизительно 0,02 ч-1 до приблизительно 10 ч-1. В другом варианте осуществления настоящего изобретения указанная WHSV составляет от приблизительно 0,2 ч-1 до приблизительно 2 ч-1. В еще одном варианте осуществления настоящего изобретения указанная WHSV составляет от приблизительно 0,3 ч-1 до приблизительно 1,4 ч-1. В еще одном варианте осуществления настоящего изобретения указанная WHSV составляет от приблизительно 0,3 ч-1 до приблизительно 0,4 ч-1. В одном варианте осуществления настоящего изобретения указанная WHSV составляет приблизительно 0,4 ч-1.
В одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты, или их смеси производят с выходом по меньшей мере 10 мол.%. В другом варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере приблизительно 20%. В еще одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере приблизительно 30 мол.%. В еще одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере 40 мол.%. В одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере приблизительно 60%. В другом варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси получают с выходом по меньшей мере приблизительно 80 мол.%.
В одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с избирательностью по меньшей мере приблизительно 50 мол.%. В другом варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с избирательностью по меньшей мере приблизительно 70 мол.%. В еще одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с избирательностью по меньшей мере приблизительно 80 мол.%.
В одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере приблизительно 10 мол.%, и с избирательностью по меньшей мере приблизительно 50 мол.%. В другом варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере приблизительно 30 мол.%, и с избирательностью по меньшей мере приблизительно 70 мол.%. В еще одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере приблизительно 50 мол.%, и с избирательностью по меньшей мере приблизительно 80 мол.%. В еще одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере приблизительно 80 мол.%, и с избирательностью по меньшей мере приблизительно 80 мол.%.
В одном варианте осуществления настоящего изобретения пропионовую кислоту получают в виде примеси вместе с указанной акриловой кислотой, производными акриловой кислоты или их смесями; и при этом избирательность для указанной пропионовой кислоты составляет менее приблизительно 5 мол.%. В другом варианте осуществления настоящего изобретения пропионовую кислоту получают в виде примеси вместе с указанной акриловой кислотой, производными акриловой кислоты или их смесями; и при этом избирательность для указанной пропионовой кислоты составляет менее приблизительно 1 мол.%.
В одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере приблизительно 10 мол.% и с избирательностью по меньшей мере приблизительно 50 мол.% в течение TOS приблизительно 72 ч; причем пропионовую кислоту производят в виде примеси вместе с указанной акриловой кислотой, производными акриловой кислоты или их смесями; и при этом избирательность для указанной пропионовой кислоты составляет менее приблизительно 5 мол.% в течение указанного TOS приблизительно 72 ч. В другом варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с выходом по меньшей мере приблизительно 30 мол.% и с избирательностью по меньшей мере приблизительно 70 мол.% в течение TOS приблизительно 72 ч; причем пропионовую кислоту производят в виде примеси вместе с указанной акриловой кислотой, производными акриловой кислоты или их смесями; и при этом избирательность для указанной пропионовой кислоты составляет менее приблизительно 1 мол.% в течение указанного TOS приблизительно 72 ч.
В одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с превращением гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей, составляющим более приблизительно 50 мол.%. В другом варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с превращением гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей, составляющим более приблизительно 80 мол.%. В еще одном варианте осуществления настоящего изобретения указанную акриловую кислоту, производные акриловой кислоты или их смеси производят с превращением гидроксипропионовой кислоты, производных гидроксипропионовой кислоты или их смесей, составляющим более приблизительно 90 мол.%.
В одном варианте осуществления настоящего изобретения уксусную кислоту, пировиноградную кислоту, 1,2-пропандиол, гидроксиацетон, димер акриловой кислоты и 2,3-пентандион производят вместе с указанной акриловой кислотой, производными акриловой кислоты или их смесями с выходом менее приблизительно 2 мол.% каждый. В другом варианте осуществления настоящего изобретения уксусную кислоту, пировиноградную кислоту, 1,2-пропандиол, гидроксиацетон, димер акриловой кислоты и 2,3-пентандион производят вместе с указанной акриловой кислотой, производными акриловой кислоты или их смесями с выходом менее приблизительно 0,5 мол.% каждый. В еще одном варианте осуществления настоящего изобретения ацетальдегид производят вместе с указанной акриловой кислотой, производными акриловой кислоты или их смесями с выходом менее приблизительно 8 мол.%. В еще одном варианте осуществления настоящего изобретения ацетальдегид производят вместе с указанной акриловой кислотой, производными акриловой кислоты или их смесями с выходом менее приблизительно 4 мол.%. В одном варианте осуществления настоящего изобретения ацетальдегид производят вместе с указанной акриловой кислотой, производными акриловой кислоты или их смесями с выходом менее приблизительно 3 мол.%.
Поток поступающих материалов можно вводить в реактор с помощью простой трубы или через распылительные форсунки. Не имеющие ограничительного характера примеры распылительных форсунок включают веерные форсунки, работающие под давлением вихревые форсунки, форсунки с аэродинамическим распылом, пневмораспылители, ротационные форсунки и форсунки с диоксидом углерода в сверхкритическом состоянии. В одном варианте осуществления настоящего изобретения диаметр капель потока поступающих материалов составляет менее приблизительно 2 мм. В другом варианте осуществления настоящего изобретения диаметр капель потока поступающих материалов составляет менее приблизительно 500 мкм. В еще одном варианте осуществления настоящего изобретения диаметр капель потока поступающих материалов составляет менее приблизительно 200 мкм. В еще одном варианте осуществления настоящего изобретения диаметр капель потока поступающих материалов составляет менее приблизительно 100 мкм.
Поток продукта можно выводить из расплавленного солевого катализатора различными способами. Не имеющими ограничительного характера примерами способов вывода потока продукта из расплавленного солевого катализатора являются выпаривание, разбавление, вакуумная перегонка, перегонка с водяным паром и газовое отпаривание. При газовом отпаривании можно использовать инертные газы и газы-носители. Не имеющими ограничительного характера примерами отпаривающих газов являются воздух, азот, аргон, монооксид углерода, диоксид углерода и ацетальдегид. В одном варианте осуществления настоящего изобретения указанное приведение в контакт происходит в присутствии отпаривающего газа. В другом варианте осуществления настоящего изобретения указанный отпаривающий газ выбран из группы, состоящей из воздуха, азота, аргона, монооксида углерода и их смесей.
Поток продукта, произведенного при указанной дегидратации, охлаждают с получением потока жидкой акриловой кислоты в качестве потока продукта. Необходимо регулировать время, необходимое для охлаждения потока акриловой кислоты, для устранения полимеризации акриловой кислоты. В одном варианте осуществления настоящего изобретения время пребывания потока продукта на стадии охлаждения составляет менее приблизительно 30 с. В другом варианте осуществления настоящего изобретения время пребывания потока продукта на стадии охлаждения составляет от приблизительно 0,1 с до приблизительно 60 с.
Поток продукта, содержащий акриловую кислоту, производные акриловой кислоты или их смеси, произведенный в соответствии с настоящим изобретением, можно очищать с применением некоторых или всех способов экстракции, высушивания, дистилляции, охлаждения, частичного плавления и декантирования, описанных в документе US20130274518A1 (включенном в данном документ посредством ссылки), для произведения сырой и ледяной акриловой кислоты. После очистки можно полимеризовать сырую и ледяную акриловую кислоту для произведения сверхвпитывающего полимера с применением способов, которые аналогичны таковым, описанным в документе US20130274697A1 (включенном в данном документ посредством ссылки).
В одном варианте осуществления настоящего изобретения способ получения акриловой кислоты, производных акриловой кислоты или их смесей включает приведение потока поступающих материалов, содержащего молочную кислоту, производные молочной кислоты или их смеси, в контакт с расплавленным солевым катализатором в реакторе при определенной температуре; причем указанный расплавленный солевой катализатор содержит ИЖ и кислоту; и при этом в результате указанной дегидратации в указанном реакторе производят акриловую кислоту, производные акриловой кислоты или их смеси. В другом варианте осуществления настоящего изобретения производное молочной кислоты представляет собой 2-APA; ИЖ представляет собой [PBu4]Br, а кислота представляет собой H4P2O7; молярное соотношение ИЖ и кислоты составляет приблизительно 4,75; температура составляет приблизительно 220 °C; а акриловую кислоту получают с выходом по меньшей мере приблизительно 10 мол.%. В еще одном варианте осуществления настоящего изобретения производное молочной кислоты представляет собой лактид; ИЖ представляет собой [PBu4]Br, а кислота представляет собой H4P2O7; молярное соотношение указанной ИЖ и указанной кислоты составляет приблизительно 4,75; температура составляет приблизительно 220 °C; а акриловую кислоту получают с выходом по меньшей мере приблизительно 10 мол.%.
В одном варианте осуществления настоящего изобретения способ получения акриловой кислоты включает приведение потока поступающих материалов, содержащего 2-APA, в контакт с расплавленным солевым катализатором в реакторе при 220 °C, причем расплавленный солевой катализатор содержит [PBu4]Br и H4P2O7 с молярным соотношением 4,75, при этом приведение в контакт осуществляют при атмосферном давлении в присутствии отпаривающего газа; отпаривающий газ представляет собой аргон, и в результате приведения в контакт в реакторе производят акриловую кислоту с выходом по меньшей мере приблизительно 30 мол.%.
В другом варианте осуществления настоящего изобретения способ получения акриловой кислоты включает приведение потока поступающих материалов, содержащего 2-APA, в контакт с расплавленным солевым катализатором в реакторе при 220 °C, причем расплавленный солевой катализатор содержит [PBu4]Br и HBr с молярным соотношением приблизительно 4,75, при этом приведение в контакт осуществляют при атмосферном давлении, а в результате приведения в контакт в реакторе производят акриловую кислоту с выходом по меньшей мере приблизительно 18 мол.%.
В еще одном варианте осуществления настоящего изобретения способ получения акриловой кислоты включает приведение потока поступающих материалов, содержащего 2-APA, в контакт с расплавленным солевым катализатором в реакторе при 220 °C, причем расплавленный солевой катализатор содержит бромид этилтрифенилфосфония ([EtPPh3]Br) и HBr с молярным соотношением приблизительно 4, при этом приведение в контакт осуществляют при атмосферном давлении, а в результате приведения в контакт в реакторе производят акриловую кислоту с выходом по меньшей мере приблизительно 25 мол.%.
В еще одном варианте осуществления настоящего изобретения способ получения акриловой кислоты включает приведение потока поступающих материалов, содержащего лактид, в контакт с расплавленным солевым катализатором в реакторе при 150 °C, причем расплавленный солевой катализатор содержит бромид тетрабутилфосфония ([PBu4]Br) и 2-бромпропионовую кислоту (2-BrPA) с молярным соотношением приблизительно 10, при этом приведение в контакт осуществляют при атмосферном давлении, а в результате приведения в контакт в реакторе производят акриловую кислоту с выходом по меньшей мере приблизительно 47 мол.%.
В одном варианте осуществления настоящего изобретения способ получения акриловой кислоты включает приведение потока поступающих материалов, содержащего лактид, в контакт с расплавленным солевым катализатором в реакторе при 150 °C, причем расплавленный солевой катализатор содержит бромид тетрабутилфосфония ([PBu4]Br) и 2-бромпропионовую кислоту (2-BrPA) с молярным соотношением приблизительно 20, при этом приведение в контакт осуществляют при атмосферном давлении, а в результате приведения в контакт в реакторе производят акриловую кислоту с выходом по меньшей мере приблизительно 52 мол.%.
В одном варианте осуществления настоящего изобретения способ получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой одностадийный процесс; причем поток поступающих материалов для одностадийного процесса представляет собой молочную кислоту, производные молочной кислоты или их смеси; и при этом выходной поток одностадийного процесса представляет собой акриловую кислоту, производные акриловой кислоты или их смеси. В другом варианте осуществления настоящего изобретения поток поступающих материалов одностадийного процесса представляет собой лактид, а выходной поток одностадийного процесса представляет собой акриловую кислоту.
В еще одном варианте осуществления настоящего изобретения способ получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой двухстадийный процесс; причем поток поступающих материалов для первой стадии двухстадийного процесса представляет собой молочную кислоту, производные молочной кислоты или их смеси; при этом выходной поток из первой стадии и поток поступающих материалов второй стадии двухстадийного процесса представляет собой 2-бромпропионовую кислоту (2-BrPA); и при этом выходной поток второй стадии двухстадийного процесса представляет собой акриловую кислоту, производные акриловой кислоты или их смеси. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов первой стадии двухстадийного процесса представляет собой лактид, а выходной поток из второй стадии двухстадийного процесса представляет собой акриловую кислоту.
В одном варианте осуществления настоящего изобретения способ получения акриловой кислоты представляет собой двухстадийный процесс; причем поток поступающих материалов для первой стадии двухстадийного процесса представляет собой лактид; при этом указанная первая стадия включает в себя приведение указанного лактида в контакт с бромидом 3-метил-1-(4-бутансульфоновая кислота)имидазолия ([MIMBS]Br) на срок приблизительно 5 ч при температуре приблизительно 120 °C и при атмосферном давлении; причем 2-бромпропионовую кислоту (2-BrPA) производят с выходом более приблизительно 60 мол.% и избирательностью более приблизительно 95 мол.%; при этом указанную 2-BrPA подают на вторую стадию; причем указанная вторая стадия включает в себя приведение указанной 2-BrPA в контакт с [PBu4]Br в течение приблизительно 3 ч при температуре приблизительно 160 °C и при атмосферном давлении; и при этом производят акриловую кислоту с выходом более приблизительно 45 мол.% и избирательностью более приблизительно 85 мол.%.
В другом варианте осуществления настоящего изобретения способ получения акриловой кислоты, производных акриловой кислоты или их смесей представляет собой трехстадийный процесс; причем поток поступающих материалов для первой стадии трехстадийного процесса представляет собой молочную кислоту, производные молочной кислоты или их смеси; при этом выходной поток из первой стадии и поток поступающих материалов второй стадии трехстадийного процесса представляет собой 2-бромпропионовую кислоту (2-BrPA); причем выходной поток из второй стадии и поток поступающих материалов третьей стадии трехстадийного процесса представляет собой 3-бромпропионовую кислоту (3-BrPA); и при этом выходной поток третьей стадии трехстадийного процесса представляет собой акриловую кислоту, производные акриловой кислоты или их смеси. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов первой стадии трехстадийного процесса представляет собой лактид, а выходной поток из третьей стадии трехстадийного процесса представляет собой акриловую кислоту.
В еще одном варианте осуществления настоящего изобретения способ получения акриловой кислоты представляет собой трехстадийный процесс; причем поток поступающих материалов для первой стадии трехстадийного процесса представляет собой лактид; при этом указанная первая стадия включает в себя приведение указанного лактида в контакт с бромидом 3-метил-1-(4-бутансульфоновая кислота)имидазолия ([MIMBS]Br) на срок приблизительно 5 ч при температуре приблизительно 120 °C и при атмосферном давлении; причем 2-бромпропионовую кислоту (2-BrPA) производят с выходом более приблизительно 60 мол.% и избирательностью более приблизительно 95 мол.%; при этом указанную 2-BrPA подают на вторую стадию; причем указанная вторая стадия включает в себя приведение указанной 2-BrPA в контакт с [PBu4]Br в течение приблизительно 20 ч при температуре приблизительно 160 °C и при атмосферном давлении; при этом 3-бромпропионовую кислоту (3-BrPA) производят с выходом более приблизительно 80 мол.% и избирательностью более приблизительно 90 мол.%; причем указанную 3-BrPA подают на третью стадию; при этом указанная третья стадия включает в себя приведение указанной 3-BrPA в контакт с триоктиламином (TOA) в течение приблизительно 30 минут при температуре приблизительно 180 °C и при атмосферном давлении; и при этом производят акриловую кислоту с выходом более приблизительно 90 мол.% и избирательностью более приблизительно 90 мол.%.
В одном варианте осуществления настоящего изобретения поток поступающих материалов содержит лактид. В другом варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA. В еще одном варианте осуществления настоящего изобретения температура в реакторе составляет от приблизительно 110 °C до приблизительно 240 °C. В еще одном варианте осуществления настоящего изобретения температура в реакторе составляет от приблизительно 130 °C до приблизительно 230 °C. В одном варианте осуществления настоящего изобретения температура в реакторе составляет от приблизительно 150 °C до приблизительно 220 °C. В другом варианте осуществления настоящего изобретения температура в реакторе составляет от приблизительно 160 °C до приблизительно 190 °C. В еще одном варианте осуществления настоящего изобретения температура в реакторе составляет приблизительно 150 °C. В еще одном варианте осуществления настоящего изобретения температура в реакторе составляет приблизительно 170 °C.
В одном варианте осуществления настоящего изобретения время пребывания потока поступающих материалов в реакторе составляет от приблизительно 5 мин до приблизительно 10 дней. В другом варианте осуществления настоящего изобретения время пребывания потока поступающих материалов в реакторе составляет от приблизительно 15 мин до приблизительно 7 дней (168 ч). В еще одном варианте осуществления настоящего изобретения время пребывания потока поступающих материалов в реакторе составляет от приблизительно 30 мин до приблизительно 3 дней (72 ч). В еще одном варианте осуществления настоящего изобретения время пребывания потока поступающих материалов в реакторе составляет от приблизительно 1 ч до приблизительно 2 дней (48 ч). В одном варианте осуществления настоящего изобретения время пребывания потока поступающих материалов в реакторе составляет от приблизительно 2 ч до приблизительно 1 дня (24 ч). В другом варианте осуществления настоящего изобретения время пребывания потока поступающих материалов в реакторе составляет приблизительно 0,33 ч. В еще одном варианте осуществления настоящего изобретения время пребывания потока поступающих материалов в реакторе составляет приблизительно 2 ч. В еще одном варианте осуществления настоящего изобретения время пребывания потока поступающих материалов в реакторе составляет приблизительно 7 ч.
В одном варианте осуществления настоящего изобретения молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA составляет от приблизительно 1 : 0,2 : 0,1 до приблизительно 1 : 5 : 0,1. В другом варианте осуществления настоящего изобретения молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA составляет от приблизительно 1 : 0,5 : 0,1 до приблизительно 1 : 2 : 0,1. В одном варианте осуществления настоящего изобретения молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 1 : 0,1. В еще одном варианте осуществления настоящего изобретения молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 0,1.
В одном варианте осуществления настоящего изобретения молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br составляет от приблизительно 1 : 0,25 до приблизительно 1 : 4. В другом варианте осуществления настоящего изобретения молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br составляет от приблизительно 1 : 0,33 до приблизительно 1 : 3. В еще одном варианте осуществления настоящего изобретения молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br составляет от приблизительно 1 : 0,5 до приблизительно 1 : 2. В еще одном варианте осуществления настоящего изобретения молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br составляет приблизительно 1 : 1. В одном варианте осуществления настоящего изобретения молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br составляет приблизительно 1 : 2.
В одном варианте осуществления настоящего изобретения акриловую кислоту, произведенную в реакторе, удаляют из реактора по мере производства. В другом варианте осуществления настоящего изобретения акриловую кислоту удаляют из реактора посредством дистилляции. В еще одном варианте осуществления настоящего изобретения акриловую кислоту удаляют при помощи отпаривающего газа.
В одном варианте осуществления настоящего изобретения воду удаляют из реактора по мере попадания в реактор или образования в реакторе. В другом варианте осуществления настоящего изобретения воду удаляют из реактора посредством дистилляции. В еще одном варианте осуществления настоящего изобретения воду удаляют при помощи отпаривающего газа.
В одном варианте осуществления настоящего изобретения поток поступающих материалов содержит молочную кислоту и воду, и воду удаляют из реактора. В другом варианте осуществления настоящего изобретения поток поступающих материалов содержит олигомеры молочной кислоты. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов содержит молочную кислоту и воду, а олигомеры молочной кислоты образуют в реакторе. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов содержит молочную кислоту и воду, а олигомеры молочной кислоты и акриловую кислоту производят в реакторе одновременно. В одном варианте осуществления настоящего изобретения поток поступающих материалов содержит молочную кислоту и воду, олигомеры молочной кислоты и акриловую кислоту производят в реакторе одновременно, а произведенную вода удаляют из реактора одновременно с производством олигомеров молочной кислоты и акриловой кислоты.
В другом варианте осуществления настоящего изобретения поток поступающих материалов содержит молочную кислоту и воду, а лактид и акриловую кислоту производят в реакторе одновременно. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов содержит молочную кислоту и воду, лактид и акриловую кислоту производят в реакторе одновременно, а произведенную вод удаляют из реактора одновременно с производством лактида и акриловой кислоты. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов содержит молочную кислоту и воду, лактид и акриловую кислоту производят в реакторе одновременно, а произведенную акриловую кислоту и воду удаляют из реактора одновременно с производством лактида.
В одном варианте осуществления настоящего изобретения поток поступающих материалов содержит лактид, расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 160 °C, время реакции составляет приблизительно 24 ч, а акриловую кислоту производят с выходом приблизительно 58 мол.%. В другом варианте осуществления настоящего изобретения поток поступающих материалов содержит лактид, расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 160 °C, время реакции составляет приблизительно 24 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 58 мол.%. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов содержит лактид, расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 160 °C, время реакции составляет приблизительно 24 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 70 мол.%. В еще одном варианте осуществления настоящего изобретения поток поступающих материалов содержит лактид, расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 160 °C, время реакции составляет приблизительно 24 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 80 мол.%.
В одном варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 170 °C, время реакции составляет приблизительно 7 ч, а акриловую кислоту производят с выходом приблизительно 56 мол.%. В другом варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 170 °C, время реакции составляет приблизительно 7 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 56 мол.%. В еще одном варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 170 °C, время реакции составляет приблизительно 7 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 70 мол.%. В еще одном варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 170 °C, время реакции составляет приблизительно 7 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 80 мол.%.
В одном варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 190 °C, время реакции составляет приблизительно 2 ч, а акриловую кислоту производят с выходом приблизительно 54 мол.%. В другом варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 190 °C, время реакции составляет приблизительно 2 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 54 мол.%. В еще одном варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 190 °C, время реакции составляет приблизительно 2 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 70 мол.%. В еще одном варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 190 °C, время реакции составляет приблизительно 2 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 80 мол.%.
В одном варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 220 °C, время реакции составляет приблизительно 0,33 ч, а акриловую кислоту производят с выходом приблизительно 50 мол.%. В другом варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 220 °C, время реакции составляет приблизительно 0,33 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 50 мол.%. В еще одном варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 220 °C, время реакции составляет приблизительно 0,33 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 70 мол.%. В еще одном варианте осуществления настоящего изобретения расплавленный солевой катализатор содержит [PBu4]Br и 2-BrPA, молярное соотношение молочнокислого эквивалента и [PBu4]Br и 2-BrPA составляет приблизительно 1 : 2 : 01, температура реакции составляет приблизительно 220 °C, время реакции составляет приблизительно 0,33 ч, произведенную акриловую кислоту удаляют из реактора по мере производства, и акриловую кислоту производят с выходом, превышающим приблизительно 80 мол.%.
IV Примеры
Следующие примеры приведены для иллюстрации настоящего изобретения, но не предназначены для ограничения его объема.
ПРИМЕР 1. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br 2,57 : 1, с температурой 220 °C и без отпаривающего газа
18 г твердого солевого катализатора бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) помещали в трехгорлый стеклянный реактор на 100 мл при комнатной температуре и атмосферных условиях и затем нагревали до 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции с использованием конденсатора с водяным охлаждением. Жидкие продукты собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 1,3 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 2. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 71,8 : 28 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 28 готовили, сперва смешивая 0,37 г твердой пирофосфорной кислоты (H4P2O7; 1,86 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 5,5 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 3. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 36 : 14 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 14 готовили, сперва смешивая 0,73 г твердой пирофосфорной кислоты (H4P2O7; 3,71 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 7,0 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 4. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 18 : 7 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 7 готовили, сперва смешивая 1,47 г твердой пирофосфорной кислоты (H4P2O7; 7,43 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 9,6 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 5. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,16 г твердой пирофосфорной кислоты (H4P2O7; 10,94 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 11,1 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 6. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 9 : 3,5 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 3,5 готовили, сперва смешивая 2,94 г твердой пирофосфорной кислоты (H4P2O7; 14,85 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 8,8 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 7. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 2,57 : 1 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 1 готовили, сперва смешивая 10,28 г твердой пирофосфорной кислоты (H4P2O7; 51,99 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 1,4 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 8. Синтез акриловой кислоты из 2-APA с кислотой H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и H4P2O7 1,47 : 1, с температурой 220 °C и без отпаривающего газа
18 г твердого катализатора пирофосфорной кислоты (H4P2O7; 91,02 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) помещали в трехгорлый стеклянный реактор на 100 мл при комнатной температуре и атмосферных условиях и затем нагревали до 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения катализатором 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. В стеклянном реакторе наблюдали неконтролируемое пенообразование, не дающее дистиллята, и, следовательно, выход акриловой кислоты составил 0 мол.%.
ПРИМЕР 9. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором KBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и KBr 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 1,32 г твердого бромида калия (KBr; 10,94 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № P0838) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 0,7 мол.%.
ПРИМЕР 10. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором CaBr2, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и CaBr2 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,23 г твердого бромида кальция (CaBr2; 10,94 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 233749) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 11,8 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 11. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором MgBr2, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и MgBr2 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,06 г твердого бромида магния (MgBr2; 10,94 ммоль, ≥ 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 360074) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 12,9 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 12. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором AlBr3, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и AlBr3 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,98 г твердого трибромида алюминия (AlBr3; 10,94 ммоль, ≥ 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 210072) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 14,3 мол.% и превращение 2-APA ≥ 94 мол.%.
ПРИМЕР 13. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором InBr3, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и InBr3 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 3,92 г твердого трибромида индия (InBr3; 10,94 ммоль, ≥ 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 308285) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 0,8 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 14. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором NiBr2, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и NiBr2 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,44 г твердого дибромида никеля (NiBr2; 10,94 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 217891) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 0,5 мол.%.
ПРИМЕР 15. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором CoBr2, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и CoBr2 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,42 г твердого дибромида кобальта (CoBr2; 10,94 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 334022) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 0,6 мол.%.
ПРИМЕР 16. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором ZnBr2, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и ZnBr2 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,47 г твердого дибромида цинка (ZnBr2; 10,94 ммоль, 99,999%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 230022) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 0,7 мол.%.
ПРИМЕР 17. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором FeBr3, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и FeBr3 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 3,30 г твердого трибромида железа (FeBr3; 10,94 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 217883) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 1,0 мол.%.
ПРИМЕР 18. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором GaBr3, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и GaBr3 14,95 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,76 г твердого трибромида галлия (GaBr3; 8,93 ммоль, 99,999%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 381357) и 14,69 г твердого бромида тетрабутилфосфония ([PBu4]Br; 42,43 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 1,2 мол.%.
ПРИМЕР 19. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором CuBr2, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и CuBr2 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,47 г твердого дибромида меди (CuBr2; 10,94 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 221775) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 8,2 мол.% и превращение 2-APA ≥ 90 мол.%.
ПРИМЕР 20. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором HBr/AlBr3, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr/AlBr3 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,98 г твердого трибромида алюминия (AlBr3; 10,94 ммоль, ≥ 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 210072), 1,88 г жидкой бромоводородной кислоты (HBr; 10,94 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 9,9 мол.% и превращение 2-APA ≥ 93 мол.%.
ПРИМЕР 21. Синтез акриловой кислоты из 2-APA с ионной жидкостью [PBu4]Br и расплавленным солевым катализатором уксусной кислотой (CH3CO2H), с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и уксусной кислоты 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 0,67 г жидкой уксусной кислоты (уксусная кислота; 11,16 ммоль, 100%; Merck Schuchardt OHG, г. Хоэнбрунн, Германия; кат. № 100063) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 99%; Alfa Aesar, г. Карлсруэ, Германия; кат. № A10868) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи шлангового насоса. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 3,4 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 22. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H3PO4, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H3PO4 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 1,26 г жидкой фосфорной кислоты (H3PO4; 10,94 ммоль, 85%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00573.1000) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 6,2 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 23. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H2SO4, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H2SO4 12,2 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,15 г жидкой серной кислоты (H2SO4; 10,94 ммоль, 50%;PanReac AppliChem, г. Дармштадт, Германия; кат. № A2102,2500) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 11,8 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 24. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 51,4 : 20 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 20 готовили, сперва смешивая 0,45 г жидкой бромоводородной кислоты (HBr; 2,61 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) и 18,01 г твердого бромида тетрабутилфосфония ([PBu4]Br; 52,01 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,72 г (134,1 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 7,3 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 25. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 25,7 : 10 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 10 готовили, сперва смешивая 0,90 г жидкой бромоводородной кислоты (HBr; 5,23 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) и 18,02 г твердого бромида тетрабутилфосфония ([PBu4]Br; 52,04 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,78 г (134,6 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 13 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 26. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 15,7 : 6 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 6 готовили, сперва смешивая 1,47 г жидкой бромоводородной кислоты (HBr; 8,54 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,66 г (133,7 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 14,3 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 27a. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 12,2 : 4,75 : 1, температура 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 1,88 г жидкой бромоводородной кислоты (HBr; 10,94 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 18,4 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 27b. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 12,2 : 4,75 : 1, с температурой 160 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 1,88 г жидкой бромоводородной кислоты (HBr; 10,94 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 99%; Alfa Aesar, г. Карлсруэ, Германия; кат. № A10868) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 160 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 160 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,2 мл/мин при помощи шлангового насоса. 2-APA медленно по каплям добавляли в стеклянный реактор. Продукты реакции не подвергали полупорционному удалению из-за низкой температуры реакции 160 °C. Газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в реакционной колбе проводили анализ вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ 1H кЯМР реакционной смеси показал выход акриловой кислоты приблизительно 1 мол.% и превращение 2-APA 66,8 мол.%.
ПРИМЕР 27c. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 12,2 : 4,75 : 1, с температурой 180 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 1,88 г жидкой бромоводородной кислоты (HBr; 10,94 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 99%; Alfa Aesar, г. Карлсруэ, Германия; кат. № A10868) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 180 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 180 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,2 мл/мин при помощи шлангового насоса. 2-APA медленно по каплям добавляли в стеклянный реактор. Продукты реакции не подвергали полупорционному удалению из-за низкой температуры реакции 180 °C. Газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в реакционной колбе проводили анализ вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ 1H кЯМР реакционной смеси показал выход акриловой кислоты приблизительно 1 мол.% и превращение 2-APA 67,0 мол.%.
ПРИМЕР 28. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 10,3 : 4 : 1, температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4 готовили, сперва смешивая 2,23 г жидкой бромоводородной кислоты (HBr; 12,95 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,68 г (133,8 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 18,5 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 29. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 5,1 : 2 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 2 готовили, сперва смешивая 4,47 г жидкой бромоводородной кислоты (HBr; 25,97 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) и 18,02 г твердого бромида тетрабутилфосфония ([PBu4]Br; 52,04 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 18,7 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 30. Синтез акриловой кислоты из 2-APA с кислотой HBr, с молярным соотношением молочнокислого эквивалента (LAe) и HBr 10,3 : 1 и без отпаривающего газа
2,46 г жидкой бромоводородной кислоты (HBr; 14,29 ммоль, 47%; Merck KGaA, г. Дармштадт, Германия; кат. № 1.00304.0500) смешивали с 19,41 г (146,9 ммоль) синтезированной чистой 2-APA, помещали в трехгорлый стеклянный реактор на 100 мл при комнатной температуре и атмосферных условиях и затем нагревали до 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также остаток в трехгорлом стеклянном реакторе анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 0 мол.%.
ПРИМЕР 31. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 24,2 : 4,75 : 1, с температурой 220 °C, и с отпаривающим газом – аргоном
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 4,3 г твердой пирофосфорной кислоты (H4P2O7; 21,9 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 36 г твердого бромида тетрабутилфосфония ([PBu4]Br; 104 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 70 г (530 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,25 мл/мин при помощи шлангового насоса. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции с использованием конденсатора с водяным охлаждением и отпаривающего газа аргона при скорости 200 мл/мин. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 5 ч времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 32 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 32. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 17,7 : 3,5 : 1, с температурой 220 °C, отпаривающим газом – аргоном
Расплавленный солевой катализатор с молярным соотношением 3,5 готовили, сперва смешивая 5,9 г твердой пирофосфорной кислоты (H4P2O7; 30 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 36 г твердого бромида тетрабутилфосфония ([PBu4]Br; 104 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 70 г (530 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,25 мл/мин при помощи шлангового насоса. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции с использованием конденсатора с водяным охлаждением и отпаривающего газа аргона при скорости 200 мл/мин. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 5 ч времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 23 мол.% и превращение 2-APA приблизительно ≥ 97 мол.%.
ПРИМЕР 33. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Cl и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Cl и H4P2O7 10,8 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 2,44 г твердой пирофосфорной кислоты (H4P2O7; 12,34 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого хлорида тетрабутилфосфония ([PBu4]Cl; 8,6 ммоль, 96%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 144800) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты < 1 мол.%.
ПРИМЕР 34. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]I и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]I и H4P2O7 13,9 : 4,75 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4,75 готовили, сперва смешивая 1,9 г твердой пирофосфорной кислоты (H4P2O7; 9,61 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого йодида тетрабутилфосфония ([PBu4]I; 45,66 ммоль, 98%; Alfa Aesar GmbH & Co KG, г. Карлсруэ, Германия; кат. № A16792) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи воронки. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 1 г мезитилена (C6H3(CH3)3; 8,15 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты < 1 мол.%.
ПРИМЕР 35. Синтез акриловой кислоты из 88 мас.% водного раствора молочной кислоты с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 6,6 : 3,5 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 3,5 готовили, сперва смешивая 2,90 г твердой пирофосфорной кислоты (H4P2O7; 14,85 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 10 г 88 мас.% раствора L-молочной кислоты (Corbion Purac Co., г. Ленекса, штат Канзас, США; 97,8 ммоль LAe) подавали в стеклянный реактор с постоянной скоростью подачи 0,33 мл/мин при помощи воронки. Раствор молочной кислоты (LA) медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 0,5 г гидрохинона (C6H4-1,4-(OH)2; 4,52 ммоль, 99,5%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № H17902) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 4 мол.%.
ПРИМЕР 36. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 9 : 3,5 : 1, с температурой 220 °C и без отпаривающего газа
10 г твердого лактида (C6H8O4; 66,61 ммоль, 133,22 ммоль LAe, > 96%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 303143) помещали в трехгорлый стеклянный реактор на 100 мл. Расплавленный солевой катализатор с молярным соотношением 3,5 готовили, смешивая 2,90 г твердой пирофосфорной кислоты (H4P2O7; 14,85 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор и реагент при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. Пока расплавленный солевой катализатор реагент выдерживали при постоянной температуре 220 °C, продукты реакции полупорционно удаляли. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 0,5 г гидрохинона (C6H4-1,4-(OH)2; 4,52 ммоль, 99,5%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № H17902) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 8,8 мол.%.
ПРИМЕР 37. Синтез акриловой кислоты из ETFP с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 3,1 : 3,5 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 3,5 готовили, сперва смешивая 2,90 г твердой пирофосфорной кислоты (H4P2O7; 14,85 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 10 г (46,7 ммоль) синтезированного чистого ETFP подавали в стеклянный реактор с постоянной скоростью подачи 0,33 мл/мин при помощи воронки. ETFP медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 0,5 г мезитилена (C6H3(CH3)3; 4,08 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 15,6 мол.%.
ПРИМЕР 38. Синтез акриловой кислоты из EAPA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 4,2 : 3,5 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 3,5 готовили, сперва смешивая 2,90 г твердой пирофосфорной кислоты (H4P2O7; 14,85 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 10 г (62,4 ммоль) синтезированного чистого EAPA подавали в стеклянный реактор с постоянной скоростью подачи 0,33 мл/мин при помощи воронки. EAPA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 0,5 г мезитилена (C6H3(CH3)3; 4,08 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 2,8 мол.%.
ПРИМЕР 39. Синтез акриловой кислоты из 2-TFPA с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 3,6 : 3,5 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 3,5 готовили, сперва смешивая 2,90 г твердой пирофосфорной кислоты (H4P2O7; 14,85 ммоль, ≥ 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210) и 18 г твердого бромида тетрабутилфосфония ([PBu4]Br; 51,99 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 10 г (53,8 ммоль) синтезированной чистой 2-TFPA подавали в стеклянный реактор с постоянной скоростью подачи 0,33 мл/мин при помощи воронки. 2-TFPA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 0,5 г мезитилена (C6H3(CH3)3; 4,08 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № M7200) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 5 мол.%.
ПРИМЕР 40. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [pTolPPh3]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [pTolPPh3]Br и HBr 9,3 : 4 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4 готовили, сперва смешивая 2,43 г жидкой бромоводородной кислоты (HBr; 14,42 ммоль, 48%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 244260) и 25 г твердого бромида (п-толил)трифенилфосфония ([pTolPPh3]Br; 57,69 ммоль, 100%) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи шлангового насоса. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 0,1 г натриевой соли 3-(триметилсилил)-1-пропансульфоновой кислоты (0,44 ммоль, 97%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 178837) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 7,8 мол.% и превращение 2-APA ≥ 97 мол.%.
ПРИМЕР 41. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [EtPPh3]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [EtPPh3]Br и HBr 10 : 4 : 1, с температурой 220 °C и без отпаривающего газа
Расплавленный солевой катализатор с молярным соотношением 4 готовили, сперва смешивая 2,25 г жидкой бромоводородной кислоты (HBr; 13,35 ммоль, 48%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 244260) и 20 г твердого бромида этилтрифенилфосфония ([EtPPh3]Br; 53,33 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № E50604) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, а затем нагревая катализатор при температуре 220 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения расплавленным солевым катализатором постоянной температуры 220 °C 17,64 г (133,5 ммоль) синтезированной чистой 2-APA подавали в стеклянный реактор с постоянной скоростью подачи 0,5 мл/мин при помощи шлангового насоса. 2-APA медленно по каплям добавляли в стеклянный реактор и полупорционно удаляли продукты реакции. Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 150 мин времени протекания всего процесса в перегонную колбу добавляли 0,1 г натриевой соли 3-(триметилсилил)-1-пропансульфоновой кислоты (0,44 ммоль, 97%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 178837) в качестве внутреннего стандарта, и собранный дистиллят, а также расплавленный солевой катализатор анализировали вне контура при помощи 1H ЯМР (JEOL ECX 400 МГц). Анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 25 мол.% и превращение 2-APA ≥ 97 мол.%.
Представленные в виде таблицы результаты из примеров 1–41 можно видеть в таблице 1 ниже. Все реакции проводили при постоянной температуре расплавленного солевого катализатора 220 °C, если иное не указано особо, и без отпаривающего газа, если иное не указано особо.
ТАБЛИЦА 1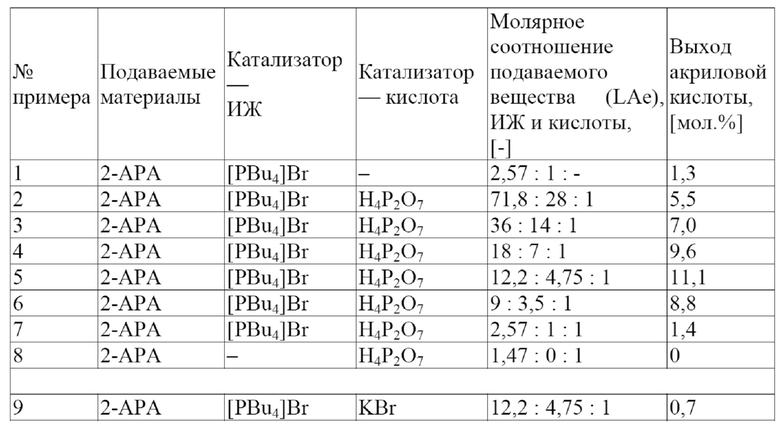
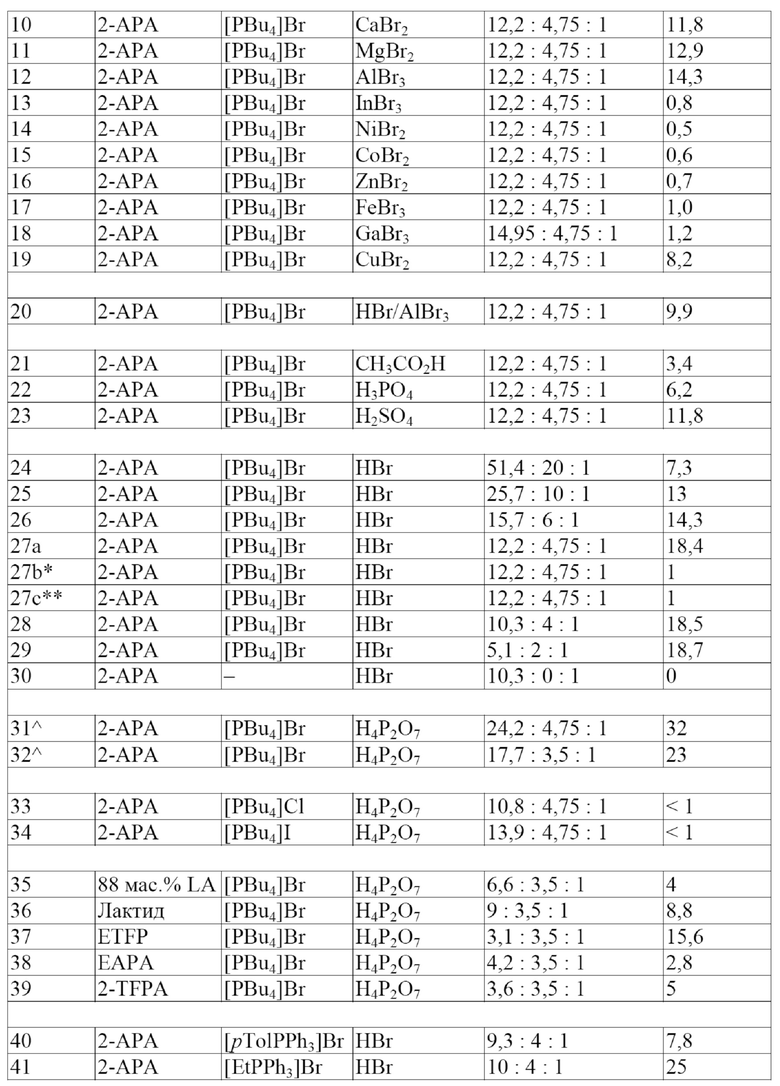
* Проводили при постоянной температуре расплавленного солевого катализатора 160 °C
** Проводили при постоянной температуре расплавленного солевого катализатора 180 °C
^ отпаривающий газ Ar
ПРИМЕР 42. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 1 : 0,1, с температурой 150 °C и со временем реакции 48 ч
17,31 г твердого бромида тетрабутилфосфония ([PBu4]Br; 50 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,60 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-бромпропионовой кислоты (2-BrPA; 5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение [PBu4]Br и 2-BrPA 10. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 48 ч времени протекания всего процесса горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты приблизительно 47 мол.%.
ПРИМЕР 43. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 110 °C и со временем реакции 168 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 110 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 110 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 168 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 24 мол.%.
ПРИМЕР 44. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 130 °C и со временем реакции 168 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 130 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 130 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 168 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 44 мол.%.
ПРИМЕР 45. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 150 °C и со временем реакции 48 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,60 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-бромпропионовой кислоты (2-BrPA; 5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение [PBu4]Br и 2-BrPA 20. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 48 ч времени протекания всего процесса горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты приблизительно 52 мол.%.
ПРИМЕР 46. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 150 °C и со временем реакции 96 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 5,12 г жидкой молочной кислоты (50 ммоль, 88%; Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 96 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 31 мол.%.
ПРИМЕР 47. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 150 °C и со временем реакции 168 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 6,03 г жидкого этиллактата (50 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № W244007) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 168 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 7 мол.%.
ПРИМЕР 48. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 160 °C и со временем реакции 24 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 160 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 160 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 24 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 58 мол.%.
ПРИМЕР 49. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 170 °C и со временем реакции 7 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 170 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 170 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 7 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 56 мол.%.
ПРИМЕР 50. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 190 °C и со временем реакции 2 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 190 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 190 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 2 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 54 мол.%.
ПРИМЕР 51. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 220 °C и со временем реакции 0,33 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 220 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 220 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 0,33 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 50 мол.%.
Представленные в виде таблицы результаты из примеров 42–51 можно видеть в таблице 2 ниже. Во всех примерах расплавленный солевой катализатор содержал [PBu4]Br и 2-BrPA, а лактид представлял собой производное молочной кислоты, содержащееся в потоке поступающих материалов.
ТАБЛИЦА 2
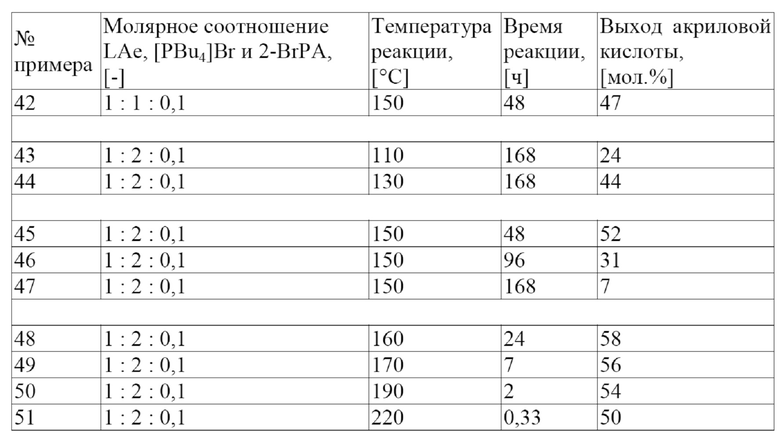
ПРИМЕР 52. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и MgBr2, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и MgBr2 1 : 2 : 0,1, с температурой 150 °C и со временем реакции 48 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,94 г твердого MgBr2 (5 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 360074), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и MgBr2 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 48 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 56 мол.%.
ПРИМЕР 53. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и H4P2O7, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 1 : 2 : 0,1, с температурой 150 °C и со временем реакции 96,5 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,99 г твердого H4P2O7 (5 ммоль, 90%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 83210), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и H4P2O7 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 96,5 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 47 мол.%.
ПРИМЕР 54. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и HBr, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 1 : 2 : 0,1, с температурой 150 °C и со временем реакции 71 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,84 г жидкой HBr (5 ммоль, 48%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 244260), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и HBr 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 71 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 43 мол.%.
ПРИМЕР 55. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и уксусной кислотой, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и уксусной кислоте 1 : 2 : 0,1, с температурой 150 °C и со временем реакции 168 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,3 г жидкой уксусной кислоты (5 ммоль, 100%; VWR International GmbH, г. Дармштадт, Германия; кат. № 20104.334), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и уксусной кислоте 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 168 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 30 мол.%.
ПРИМЕР 56. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и без дополнительной кислоты, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br 1 : 2, с температурой 150 °C и со временем реакции 168 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл, получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br 1 : 2. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 168 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 32 мол.%.
Представленные в виде таблицы результаты из примеров 52–56 можно видеть в таблице 3 ниже. Во всех примерах лактид представлял собой производное молочной кислоты, содержащееся в потоке поступающих материалов, а молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и кислоты составляло 1 : 2 : 0,1.
ТАБЛИЦА 3
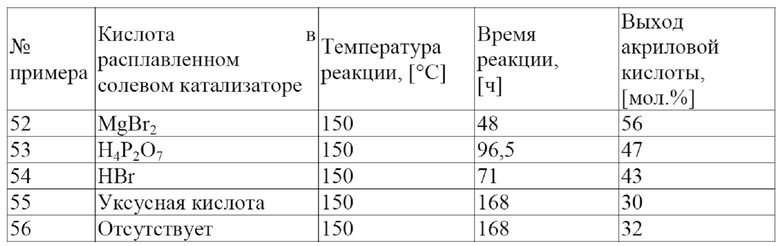
ПРИМЕР 57. Синтез акриловой кислоты из 2-APA с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с температурой 150 °C и со временем реакции 168 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 6,88 г синтезированной чистой 2-APA (50 ммоль) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 168 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 42 мол.%.
ПРИМЕР 58. Синтез акриловой кислоты из 2-формилоксипропионовой кислоты (2-FPA) с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2,5 : 0,125, с температурой 150 °C и со временем реакции 72 ч
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 4,62 г синтезированной чистой 2-FPA (40 ммоль) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2,5 : 0,125. Далее реакционную смесь нагревали до реакционной температуры 150 °C, при непрерывном перемешивании верхнеприводной мешалкой со скоростью 300 об/мин. После достижения реакционной смесью постоянной температуры 150 °C систему порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 72 ч времени реакции горячей расплавленной соли давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты (AAY) приблизительно 35 мол.%.
ПРИМЕР 59. Синтез 2-BrPA из лактида с расплавленным солевым катализатором [MIMBS]Br
Расплавленную солевую среду для бромирования готовили, сперва смешивая 16,370 г твердого MIMBS (75 ммоль, J. Mater. Chem., 2001,11, 1057–1062), 12,642 г 48 мас.% бромоводородной кислоты (HBr; 75 ммоль, 48%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 244260) и 64 г циклогексана (C6H12, 0,76 моль, > 99,5%, Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 33117) при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Двухфазную реакционную смесь нагревали до температуры 69,8 °C, при непрерывном перемешивании магнитным мешальником со скоростью 600 об/мин. Нагруженную протонами и HBr ионную жидкость [MIMBS]Br получали, удаляя воду с использованием аппарата Дина-Старка с внешним нагревом до 90 °C, в конце декантировали циклогексановую фазу после охлаждения стеклянного реактора до комнатной температуры. После реакции выполняли доведение до нужного количества кислоты (75 ммоль) путем добавления 3,4 г 48 мас.% бромоводородной кислоты (HBr; 20 ммоль, 48%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 244260). 1,8 г твердого лактида (12,5 ммоль, L,L-лактид, полимерного сорта, Corbion Purac Co., г. Ленекса, штат Канзас, США) добавляли в реактор, и активированную реакционную смесь нагревали при 120 °C при непрерывном перемешивании верхнеприводной мешалкой со скоростью 600 об/мин. Реакционную смесь порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 300 мин времени протекания всего процесса реакционную смесь гасили 7,92 г метанола (CH3OH, 0,25 моль, 99,8%, безводный, Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 322415) и реакционную смесь анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход 2-BrPA приблизительно 60 мол.% и избирательность более приблизительно 95 мол.%.
ПРИМЕР 60. Синтез акриловой кислоты из 2-BrPA с расплавленным солевым катализатором [PBu4]Br
46,23 г твердого бромида тетрабутилфосфония ([PBu4]Br; 133,5 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) смешивали с 2,29 г жидкой 2-бромпропионовой кислоты (2-BrPA; 14,83 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300) в трехгорлом стеклянном реакторе на 100 мл с молярным соотношением 9 : 1, при комнатной температуре и атмосферных условиях. Реакционную смесь нагревали до 160 °C при непрерывном перемешивании магнитным мешальником со скоростью 450 об/мин. Реакционную смесь смесь порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 3 ч времени протекания всего процесса горячей реакционной смеси давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси смеси методом 1H кЯМР показал выход акриловой кислоты (AA) приблизительно 47 мол.% и избирательность более приблизительно 81 мол.%.
ПРИМЕР 61. Синтез 3-BrPA из 2-BrPA с расплавленным солевым катализатором [PBu4]Br
46,23 г твердого бромида тетрабутилфосфония ([PBu4]Br; 133,5 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) смешивали с 20,68 г жидкой 2-бромпропионовой кислоты (2-BrPA; 133,5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300) в трехгорлом стеклянном реакторе на 100 мл с молярным соотношением 1 : 1, при комнатной температуре и атмосферных условиях. Изомеризационную смесь нагревали до 160 °C при непрерывном перемешивании магнитным мешальником со скоростью 450 об/мин. Изомеризационную смесь порциями нагревали с обратным холодильником, а газообразные побочные продукты направляли в отходящий газ или собирали в гидростатическую колонку. После истечения 20 ч времени протекания всего процесса горячей реакционной смеси давали охладиться до комнатной температуры и анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ изомеризационной смеси методом 1H кЯМР показал выход 3-бромпропионовой кислоты (3-BrPA) приблизительно 79 мол.% и избирательность более приблизительно 90 мол.%.
ПРИМЕР 62. Синтез акриловой кислоты из 3-BrPA с триоктиламином (TOA)
285 г триоктиламина ([CH3(CH2)7]3N; 0,8 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № T81000) смешивали с 123,4 г твердой 3-бромпропионовой кислоты (3-BrPA; 0,8 ммоль, 97%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 101281) в трехгорлом стеклянном реакторе с молярным соотношением 1 : 1, при комнатной температуре и атмосферных условиях. Реакционную смесь нагревали до 180 °C при непрерывном перемешивании магнитным мешальником со скоростью 500 об/мин. После достижения реакционной смесью постоянной температуры 180 °C реакционные продукты полупорционно удаляли при пониженном давлении (9–10 кПа (90–100 мбар)). Жидкие продукты конденсировали и собирали в охлаждаемую водой колбу, а газообразные побочные продукты направляли в отходящий газ. После истечения 30 мин времени протекания всего процесса собранный дистиллят анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ смеси продуктов методом 1H кЯМР показал выход акриловой кислоты приблизительно 90 мол.% и избирательность более приблизительно 90 мол.%.
ПРИМЕР 63. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с использованием удаления продукта in-situ путем реакционной дистилляции при давлении 10 кПа (100 мбар) в течение 3 часов
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 190 °C, при непрерывном перемешивании магнитной мешалкой со скоростью от 800 до 1200 об/мин. После достижения реакционной смесью постоянной температуры 190 °C применяли давление 10 кПа (100 мбар), для запуска реакционной дистилляции. Продукты собирали в охлаждаемые ловушки при температуре от 0 до -197 °C. После 3 часов реакционной дистилляции реакцию прекращали. При выбранных условиях реакции в экспериментальной установке происходит полимеризация высокочистой акриловой кислоты. Таким образом, выход не определяли.
ПРИМЕР 64. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с использованием удаления продукта in-situ путем реакционной дистилляции при давлении 5 кПа (50 мбар) в течение 3 часов
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 190 °C, при непрерывном перемешивании магнитной мешалкой со скоростью от 800 до 1200 об/мин. После достижения реакционной смесью постоянной температуры 190 °C применяли давление 5 кПа (50 мбар) для запуска реакционной дистилляции. Продукты собирали в охлаждаемые ловушки при температуре от 0 до -197 °C. После 3 часов реакционной дистилляции реакцию прекращали. При выбранных условиях реакции в экспериментальной установке происходит полимеризация высокочистой акриловой кислоты. Таким образом, выход не определяли.
ПРИМЕР 65. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с использованием удаления продукта in-situ путем реакционной дистилляции при давлении 2 кПа (20 мбар) в течение 3 часов
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 190 °C, при непрерывном перемешивании магнитной мешалкой со скоростью от 800 до 1200 об/мин. После достижения реакционной смесью постоянной температуры 190 °C применяли давление 2 кПа (20 мбар) для запуска реакционной дистилляции. Продукты собирали в охлаждаемые ловушки при температуре от 0 до -197 °C. Побочные продукты направляли в отходящий газ. При выбранных условиях реакции в экспериментальной установке происходит полимеризация высокочистой акриловой кислоты. Таким образом, выход не определяли.
ПРИМЕР 66. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с использованием удаления продукта in-situ путем реакционной дистилляции при давлении 1 кПа (10 мбар) в течение 3 часов
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 190 °C, при непрерывном перемешивании магнитной мешалкой со скоростью от 800 до 1200 об/мин. После достижения реакционной смесью постоянной температуры 190 °C применяли давление 1 кПа (10 мбар) для запуска реакционной дистилляции. Продукты собирали в охлаждаемые ловушки при температуре от 0 до -197 °C. После 3 часов реакционной дистилляции горячую расплавленную соль и дистиллят анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты приблизительно 11 мол.%, анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 69 мол.%, что дает общий выход акриловой кислоты при реакционной дистилляции приблизительно 80 мол.%.
ПРИМЕР 67. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с использованием удаления продукта in-situ путем реакционной дистилляции при давлении 0,5 кПа (5 мбар) в течение 3 часов
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 190 °C, при непрерывном перемешивании магнитной мешалкой со скоростью от 800 до 1200 об/мин. После достижения реакционной смесью постоянной температуры 190 °C применяли давление 0,5 кПа (5 мбар) для запуска реакционной дистилляции. Продукты собирали в охлаждаемые ловушки при температуре от 0 до -197 °C. После 3 часов реакционной дистилляции горячую расплавленную соль и дистиллят анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты приблизительно 8 мол.%, анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 62 мол.%, что дает общий выход акриловой кислоты при реакционной дистилляции приблизительно 70 мол.%.
ПРИМЕР 68. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с использованием удаления продукта in-situ путем реакционной дистилляции при давлении 1 кПа (10 мбар) в течение 1 часа
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 190 °C, при непрерывном перемешивании магнитной мешалкой со скоростью от 800 до 1200 об/мин. После достижения реакционной смесью постоянной температуры 190 °C применяли давление 1 кПа (10 мбар) для запуска реакционной дистилляции. Продукты собирали в охлаждаемые ловушки при температуре от 0 до -197 °C. После 1 часовой реакционной дистилляции горячую расплавленную соль и дистиллят анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты приблизительно 24 мол.%, анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 29 мол.%, что дает общий выход акриловой кислоты при реакционной дистилляции приблизительно 53 мол.%.
ПРИМЕР 69. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с использованием удаления продукта in-situ путем реакционной дистилляции при давлении 1 кПа (10 мбар) в течение 2 часов
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 190 °C, при непрерывном перемешивании магнитной мешалкой со скоростью от 800 до 1200 об/мин. После достижения реакционной смесью постоянной температуры 190 °C применяли давление 1 кПа (10 мбар) для запуска реакционной дистилляции. Продукты собирали в охлаждаемые ловушки при температуре от 0 до -197 °C. После 2 часов реакционной дистилляции горячую расплавленную соль и дистиллят анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты приблизительно 20 мол.%, анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 42 мол.%, что дает общий выход акриловой кислоты при реакционной дистилляции приблизительно 62 мол.%.
ПРИМЕР 70. Синтез акриловой кислоты из лактида с расплавленным солевым катализатором [PBu4]Br и 2-BrPA, с молярным соотношением молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1, с использованием удаления продукта in-situ путем реакционной дистилляции при давлении 1 кПа (10 мбар) в течение 4 часов
34,62 г твердого бромида тетрабутилфосфония ([PBu4]Br; 100 ммоль, 98%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № 189138) и 3,6 г твердого лактида (25 ммоль, L,L лактид, полимерный сорт, Corbion Purac Co., г. Ленекса, штат Канзас, США) сначала смешивали при комнатной температуре и атмосферных условиях в трехгорлом стеклянном реакторе на 100 мл. Затем к реакционной смеси добавляли 0,77 г жидкой 2-BrPA (5 ммоль, 99%; Sigma-Aldrich Chemie GmbH, г. Тауфкирхен, Германия; кат. № B78300), получая таким образом молярное соотношение молочнокислого эквивалента (LAe) и [PBu4]Br и 2-BrPA 1 : 2 : 0,1. Далее реакционную смесь нагревали до реакционной температуры 190 °C, при непрерывном перемешивании магнитной мешалкой со скоростью от 800 до 1200 об/мин. После достижения реакционной смесью постоянной температуры 190 °C применяли давление 1 кПа (10 мбар) для запуска реакционной дистилляции. Продукты собирали в охлаждаемые ловушки при температуре от 0 до -197 °C. После 4 часов реакционной дистилляции горячую расплавленную соль и дистиллят анализировали вне контура методом 1H ЯМР (JEOL ECX 400 МГц). Анализ реакционной смеси методом 1H кЯМР показал выход акриловой кислоты приблизительно 3 мол.%, анализ дистиллята методом 1H кЯМР показал выход акриловой кислоты приблизительно 72 мол.%, что дает общий выход акриловой кислоты при реакционной дистилляции приблизительно 75 мол.%.
ПРОЦЕДУРА 1. Стабильность образцов твердого материала в жидких химических веществах
Процедура описывает обработку образцов твердого материала в жидких химических веществах при определенных температурах и связанный с этим анализ. Образец твердого материала размером 15 мм x 15 мм x 2 мм очищали и анализировали путем взвешивания, оптической микроскопии и сканирующей электронной микроскопии перед обработкой. Обработку выполняли в сосуде из боросиликатного стекла 3.3 диаметром 30 мм и высотой 200 мм. 30 мл жидкого химического вещества помещали в сосуд так, чтобы он полностью покрывал образец. Химическое вещество в процессе обработки перемешивали магнитным мешальником, покрытым боросиликатным стеклом 3.3, чтобы сводить к минимуму градиенты температуры и концентрации. Образец удерживали опорой, расположенной в 15 мм выше дна сосуда для предотвращения механического контакта с мешальником. Сосуд открывали в атмосферу в верхней части через вертикальную трубку из фторированного этиленпропилена длиной 1 метр и диаметром 10 мм, действующую как обратный холодильник при комнатной температуре. Нижнюю половину сосуда, содержащую образец и химическое вещество, нагревали до определенной температуры «T» в течение определенного времени «t» – индивидуальных для каждой обработки. После обработки образец снова очищали и анализировали путем взвешивания, оптической микроскопии и сканирующей электронной микроскопии.
ПРИМЕР 71. Стабильность боросиликатного стекла 3.3 (Boro 3.3) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 Boro 3.3 испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. Boro 3.3 считают стабильным при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 72. Стабильность кварцевого стекла (SiO2) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 SiO2 испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. SiO2 считают стабильным при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 73. Стабильность сплава Hastelloy C-276 (C-276) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 C-276 испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. C-276 считают стабильным при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 74. Стабильность нержавеющей стали 1.4571 (1.4571) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 1.4571 испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. 1.4571 считают стабильной при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 75. Стабильность углеродистой стали S235 (S235) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 S235 испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. На поверхности можно было наблюдать коррозию. S235 считают нестабильной при воздействии 2-APA при 150 °C.
ПРИМЕР 76. Стабильность алюминия (Al) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 Al испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета или тактильных ощущений. Поверхность была слегка шероховатой. Al считают стабильным с небольшими изменениями при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 77. Стабильность политетрафторэтилена (PTFE) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 PTFE испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PTFE считают стабильным при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 78. Стабильность фторированного этиленпропилена (FEP) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 FEP испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. FEP считают стабильным при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 79. Стабильность перфторалкоксиалкана (PFA) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 PFA испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PFA считают стабильным при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 80. Стабильность полиэфирэфиркетона (PEEK) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 PEEK испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений топологии поверхности или тактильных ощущений. У образца наблюдали небольшое изменение цвета. PEEK считают стабильным с небольшими изменениями при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 81. Стабильность фторэластомера (FKM) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 FKM испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Увеличение массы составляло более 10%, и образец потрескался. Цвет химического вещества изменился. FKM считают нестабильным при воздействии 2-APA при 150 °C.
ПРИМЕР 82. Стабильность силиконового каучука (Sil) при действии 2-ацетоксипропионовой кислоты (2-APA)
В соответствии с ПРОЦЕДУРОЙ 1 Sil испытывали на стабильность при воздействии 2-APA при T = 150 °C в течение t = 24 ч. Увеличение массы составляло менее 10% и было обратимым после высушивания, и не наблюдали изменений топологии поверхности или тактильных ощущений. Sil считают стабильным с небольшими изменениями при воздействии 2-APA до по меньшей мере 150 °C.
ПРИМЕР 83. Стабильность боросиликатного стекла 3.3 (Boro 3.3) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 Boro 3.3 испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. Boro 3.3 считают стабильным при воздействии 2-BrPA до по меньшей мере 100 °C.
ПРИМЕР 84. Стабильность кварцевого стекла (SiO2) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 SiO2 испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. SiO2 считают стабильным при воздействии 2-BrPA до по меньшей мере 100 °C.
ПРИМЕР 85. Стабильность нержавеющей стали 1.4571 (1.4571) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 1.4571 испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. На поверхности можно было наблюдать коррозию. 1.4571 считают нестабильной при воздействии 2-BrPA при 100 °C.
ПРИМЕР 86. Стабильность углеродистой стали S235 (S235) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 S235 испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. На поверхности можно было наблюдать коррозию. S235 считают нестабильной при воздействии 2-BrPA при 100 °C.
ПРИМЕР 87. Стабильность алюминия (Al) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 Al испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. Al считают стабильным при воздействии 2-BrPA до по меньшей мере 100 °C.
ПРИМЕР 88. Стабильность политетрафторэтилена (PTFE) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 PTFE испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PTFE считают стабильным при воздействии 2-BrPA до по меньшей мере 100 °C.
ПРИМЕР 89. Стабильность фторированного этиленпропилена (FEP) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 FEP испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. FEP считают стабильным при воздействии 2-BrPA до по меньшей мере 100 °C.
ПРИМЕР 90. Стабильность перфторалкоксиалкана (PFA) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 PFA испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PFA считают стабильным при воздействии 2-BrPA до по меньшей мере 100 °C.
ПРИМЕР 91. Стабильность полиэфирэфиркетона (PEEK) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 PEEK испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений топологии поверхности или тактильных ощущений. У образца наблюдали небольшое изменение цвета. PEEK считают стабильным с небольшими изменениями при воздействии 2-BrPA по меньшей мере до 100 °C.
ПРИМЕР 92. Стабильность фторэластомера (FKM) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 FKM испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. Увеличение массы составляло более 10%. Поверхность была шероховатой. FKM считают нестабильным при воздействии 2-BrPA при 100 °C.
ПРИМЕР 93. Стабильность силиконового каучука (Sil) при действии 2-бромпропионовой кислоты (2-BrPA)
В соответствии с ПРОЦЕДУРОЙ 1 Sil испытывали на стабильность при воздействии 2-BrPA при T = 100 °C в течение t = 24 ч. Увеличение массы составляло более 10%. Цвет изменился. Sil считают нестабильным при воздействии 2-BrPA при 100 °C.
ПРИМЕР 94. Стабильность боросиликатного стекла 3.3 (Boro 3.3) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 Boro 3.3 испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. Boro 3.3 считают стабильным при воздействии AcOH75 до по меньшей мере 90 °C.
ПРИМЕР 95. Стабильность кварцевого стекла (SiO2) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 SiO2 испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. SiO2 считают стабильным при воздействии AcOH75 до по меньшей мере 90 °C.
ПРИМЕР 96. Стабильность титана класса 2 (TiG2) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 TiG2 испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. TiG2 считают стабильным при воздействии AcOH75 до по меньшей мере 90 °C.
ПРИМЕР 97. Стабильность нержавеющей стали 1.4571 (1.4571) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 1.4571 испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. 1.4571 считают стабильной при воздействии AcOH75 до по меньшей мере 90 °C.
ПРИМЕР 98. Стабильность углеродистой стали S235 (S235) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 S235 испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. На поверхности можно было наблюдать коррозию. S235 считают нестабильной при воздействии AcOH75 при 90 °C.
ПРИМЕР 99. Стабильность алюминия (Al) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 Al испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%. Цвет изменился и поверхность была немного шероховатой. Al считают нестабильным при воздействии AcOH75 по меньшей мере до 90 °C.
ПРИМЕР 100. Стабильность политетрафторэтилена (PTFE) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 PTFE испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PTFE считают стабильным при воздействии AcOH75 до по меньшей мере 90 °C.
ПРИМЕР 101. Стабильность фторированного этиленпропилена (FEP) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 FEP испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. FEP считают стабильным при воздействии AcOH75 до по меньшей мере 90 °C.
ПРИМЕР 102. Стабильность перфторалкоксиалкана (PFA) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 PFA испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PFA считают стабильным при воздействии AcOH75 до по меньшей мере 90 °C.
ПРИМЕР 103. Стабильность полиэфирэфиркетона (PEEK) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 PEEK испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PEEK считают стабильным при воздействии AcOH75 до по меньшей мере 90 °C.
ПРИМЕР 104. Стабильность фторэластомера (FKM) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 FKM испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Увеличение массы составляло более 10%, и образец потрескался. Цвет химического вещества изменился. FKM считают нестабильным при воздействии AcOH75 при 90 °C.
ПРИМЕР 105. Стабильность силиконового каучука (Sil) при действии водного раствора уксусной кислоты 75 мас.% (AcOH75)
В соответствии с ПРОЦЕДУРОЙ 1 Sil испытывали на стабильность при воздействии AcOH75 при T = 90 °C в течение t = 24 ч. Увеличение массы составляло менее 10% и было обратимым после высушивания, и не наблюдали изменений топологии поверхности или тактильных ощущений. Sil считают стабильным с небольшими изменениями при воздействии AcOH75 до по меньшей мере 90 °C.
ПРИМЕР 106. Стабильность боросиликатного стекла 3.3 (Boro 3.3) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 Boro 3.3 испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. Boro 3.3 считают стабильным при воздействии AA до по меньшей мере 20 °C.
ПРИМЕР 107. Стабильность кварцевого стекла (SiO2) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 SiO2 испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. SiO2 считают стабильным при воздействии AA до по меньшей мере 20 °C.
ПРИМЕР 108. Стабильность титана класса 2 (TiG2) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 TiG2 испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. TiG2 считают стабильным при воздействии AA до по меньшей мере 20 °C.
ПРИМЕР 109. Стабильность нержавеющей стали 1.4571 (1.4571) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 1.4571 испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. 1.4571 считают стабильной при воздействии AA до по меньшей мере 20 °C.
ПРИМЕР 110. Стабильность углеродистой стали S235 (S235) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 S235 испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. На поверхности можно было наблюдать коррозию. S235 считают нестабильной при воздействии AA при 20 °C.
ПРИМЕР 111. Стабильность алюминия (Al) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 Al испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. Al считают стабильным при воздействии AA до по меньшей мере 20 °C.
ПРИМЕР 112. Стабильность политетрафторэтилена (PTFE) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 PTFE испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PTFE считают стабильным при воздействии AA до по меньшей мере 20 °C.
ПРИМЕР 113. Стабильность фторированного этиленпропилена (FEP) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 FEP испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. FEP считают стабильным при воздействии AA до по меньшей мере 20 °C.
ПРИМЕР 114. Стабильность перфторалкоксиалкана (PFA) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 PFA испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PFA считают стабильным при воздействии AA до по меньшей мере 20 °C.
ПРИМЕР 115. Стабильность полиэфирэфиркетона (PEEK) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 PEEK испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PEEK считают стабильным при воздействии AA до по меньшей мере 20 °C.
ПРИМЕР 116. Стабильность фторэластомера (FKM) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 FKM испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Увеличение массы составляло более 10%. FKM считают нестабильным при воздействии AA при 20 °C.
ПРИМЕР 117. Стабильность силиконового каучука (Sil) при действии акриловой кислоты (AA)
В соответствии с ПРОЦЕДУРОЙ 1 Sil испытывали на стабильность при воздействии AA при T = 20 °C в течение t = 24 ч. Увеличение массы составляло более 10%. Цвет изменился. Sil считают нестабильным при воздействии AA при 20 °C.
ПРИМЕР 118. Стабильность боросиликатного стекла 3.3 (Boro 3.3) при действии водного раствора молочной кислоты 88 мас.% (LA88)
В соответствии с ПРОЦЕДУРОЙ 1 Boro 3.3 испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. Boro 3.3 считают стабильным при воздействии LA88 до по меньшей мере 150 °C.
ПРИМЕР 119. Стабильность кварцевого стекла (SiO2) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 SiO2 испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. SiO2 считают стабильным при воздействии LA88 до по меньшей мере 150 °C.
ПРИМЕР 120. Стабильность титана класса 2 (TiG2) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 TiG2 испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. TiG2 считают стабильным при воздействии LA88 до по меньшей мере 150 °C.
ПРИМЕР 121. Стабильность сплава Hastelloy C-276 (C-276) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 C-276 испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. На поверхности можно было наблюдать коррозию. C-276 считают нестабильной при воздействии LA88 при 150 °C.
ПРИМЕР 122. Стабильность углеродистой стали S235 (S235) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 S235 испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. На поверхности можно было наблюдать коррозию. S235 считают нестабильной при воздействии LA88 при 150 °C.
ПРИМЕР 123. Стабильность алюминия (Al) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 Al испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%. Можно было наблюдать изменение цвета. Поверхность была слегка шероховатой. Al считают стабильным с небольшими изменениями при воздействии LA88 до по меньшей мере 150 °C.
ПРИМЕР 124. Стабильность политетрафторэтилена (PTFE) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 PTFE испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PTFE считают стабильным при воздействии LA88 до по меньшей мере 150 °C.
ПРИМЕР 125. Стабильность фторированного этиленпропилена (FEP) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 FEP испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. FEP считают стабильным при воздействии LA88 до по меньшей мере 150 °C.
ПРИМЕР 126. Стабильность перфторалкоксиалкана (PFA) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 PFA испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PFA считают стабильным при воздействии LA88 до по меньшей мере 150 °C.
ПРИМЕР 127. Стабильность полиэфирэфиркетона (PEEK) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 PEEK испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PEEK считают стабильным при воздействии LA88 до по меньшей мере 150 °C.
ПРИМЕР 128. Стабильность перфторэластомера (FFKM) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 FFKM испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Увеличение массы составляло менее 10%, и не наблюдали изменений цвета. FFKM считают стабильным с небольшими изменениями при воздействии LA88 до по меньшей мере 150 °C.
ПРИМЕР 129. Стабильность фторэластомера (FKM) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 FKM испытывали на стабильность при воздействии LA88 при T = 150 °C в течение t = 168 ч. Увеличение массы составляло более 10%. FKM считают нестабильным при воздействии LA88 при 150 °C.
ПРИМЕР 130. Стабильность силиконового каучука (Sil) при действии водного раствора молочной кислоты 88 мас.% (LA)
В соответствии с ПРОЦЕДУРОЙ 1 Sil испытывали на стабильность при воздействии LA88 при T = 250 °C в течение t = 168 ч. Увеличение массы составляло более 10%. Цвет изменился. Sil считают нестабильным при воздействии LA88 при 250 °C.
ПРИМЕР 131. Стабильность боросиликатного стекла 3.3 (Boro 3.3) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 Boro 3.3 испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. Boro 3.3 считают стабильным при воздействии [PBu4]Br до по меньшей мере 250 °C.
ПРИМЕР 132. Стабильность кварцевого стекла (SiO2) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 SiO2 испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений топологии поверхности или тактильных ощущений. Цвет химического соединения немного изменился. SiO2 считают стабильным с небольшими изменениями при воздействии [PBu4]Br до по меньшей мере 250 °C.
ПРИМЕР 133. Стабильность титана класса 2 (TiG2) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 TiG2 испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Можно было наблюдать коррозию. TiG2 считают нестабильным при воздействии [PBu4]Br при 250 °C.
ПРИМЕР 134. Стабильность сплава Hastelloy C-276 (C-276) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 C-276 испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Можно было наблюдать коррозию. C-276 считают нестабильным при воздействии [PBu4]Br при 250 °C.
ПРИМЕР 135. Стабильность нержавеющей стали 1.4571 (1.4571) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 1.4571 испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Можно было наблюдать коррозию. 1.4571 считают нестабильной при воздействии [PBu4]Br при 250 °C.
ПРИМЕР 136. Стабильность алюминия (Al) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 Al испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Можно было наблюдать коррозию. Al считают нестабильным при воздействии [PBu4]Br при 250 °C.
ПРИМЕР 137. Стабильность политетрафторэтилена (PTFE) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 PTFE испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PTFE считают стабильным при воздействии [PBu4]Br до по меньшей мере 250 °C.
ПРИМЕР 138. Стабильность перфторалкоксиалкана (PFA) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 PFA испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Изменение массы составляло менее 0,1%, и не наблюдали изменений цвета, топологии поверхности или тактильных ощущений. PFA считают стабильным при воздействии [PBu4]Br до по меньшей мере 250 °C.
ПРИМЕР 139. Стабильность перфторэластомера (FFKM) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 FFKM испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Увеличение массы составляло менее 10% и не наблюдали изменений цвета. FFKM считают стабильным с небольшими изменениями при воздействии [PBu4]Br до по меньшей мере 250 °C.
ПРИМЕР 140. Стабильность фторэластомера (FKM) при действии бромида тетрабутилфосфония ([PBu4]Br)
В соответствии с ПРОЦЕДУРОЙ 1 FKM испытывали на стабильность при воздействии [PBu4]Br при T = 250 °C в течение t = 168 ч. Увеличение массы составляло более 10%. FKM считают нестабильным при воздействии [PBu4]Br при 250 °C.
Вышеприведенное описание представлено только для ясности понимания, и под ним не следует подразумевать какие-либо ненужные ограничения, поскольку модификации в пределах объема настоящего изобретения могут быть очевидны специалисту в данной области техники.
Размеры и величины, описанные в настоящем документе, не следует понимать как строго ограниченные перечисленными точными числовыми значениями. Напротив, если не указано иное, каждый такой размер должен обозначать как указанное значение, так и функционально эквивалентный диапазон, в который входит это значение. Например, размер, описанный как «40 мм», подразумевает «приблизительно 40 мм».
Каждый документ, указанный в настоящем документе, включая перекрестные ссылки или родственный патент или заявку, настоящим включен в полном объеме в настоящий документ путем ссылки, если только не исключен в явной форме или не ограничен иным образом. Упоминание любого документа не является признанием, что он представляет собой предшествующий уровень техники в отношении любого изобретения, описанного или заявленного в настоящем документе, или что в нем самом или в любой комбинации с любой другой ссылкой или ссылками представлено, предложено или описано любое такое изобретение. Кроме того, если какое-либо значение или определение термина в этом документе противоречит какому-либо значению или определению этого же термина в документе, включенном в настоящий документ путем ссылки, преимущество имеет значение или определение, закрепленное за этим термином в настоящем документе.
Хотя в настоящем документе показаны и описаны конкретные варианты осуществления настоящего изобретения, специалистам в данной области будет понятно, что допустимы и другие различные изменения и модификации без отступления от сущности и объема изобретения. Таким образом, подразумевается, что прилагаемая формула изобретения охватывает все такие изменения и модификации в пределах объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОЛУЧЕНИЯ АКРИЛОВОЙ КИСЛОТЫ ИЗ МОЛОЧНОЙ КИСЛОТЫ ИЛИ ЕЕ ПРОИЗВОДНЫХ В ЖИДКОЙ ФАЗЕ | 2017 |
|
RU2711993C1 |
| СПОСОБ ПОЛУЧЕНИЯ АКРИЛОВОЙ КИСЛОТЫ ИЗ МОЛОЧНОЙ КИСЛОТЫ ИЛИ ЛАКТИДА С ИСПОЛЬЗОВАНИЕМ РАСПЛАВЛЕННЫХ СОЛЕВЫХ КАТАЛИЗАТОРОВ | 2018 |
|
RU2714490C1 |
| КАТАЛИТИЧЕСКАЯ КОНВЕРСИЯ ГИДРОКСИПРОПИОНОВОЙ КИСЛОТЫ ИЛИ ЕЕ ПРОИЗВОДНЫХ В АКРИЛОВУЮ КИСЛОТУ И ЕЕ ПРОИЗВОДНЫЕ | 2013 |
|
RU2586327C2 |
| КАТАЛИЗАТОРЫ ДЛЯ КОНВЕРСИИ ГИДРОКСИПРОПИОНОВОЙ КИСЛОТЫ ИЛИ ЕЕ ПРОИЗВОДНЫХ В АКРИЛОВУЮ КИСЛОТУ ИЛИ ЕЕ ПРОИЗВОДНЫЕ | 2013 |
|
RU2591192C2 |
| КАТАЛИТИЧЕСКАЯ КОНВЕРСИЯ МОЛОЧНОЙ КИСЛОТЫ В АКРИЛОВУЮ КИСЛОТУ | 2013 |
|
RU2598380C2 |
| Катализаторы для дегидратации гидроксипропионовой кислоты и ее производных | 2016 |
|
RU2694897C1 |
| КАТАЛИЗАТОРЫ ДЛЯ ПОЛУЧЕНИЯ АКРИЛОВОЙ КИСЛОТЫ ИЛИ ЕЕ ПРОИЗВОДНЫХ | 2013 |
|
RU2586329C2 |
| СПОСОБ ПОЛУЧЕНИЯ АКРИЛОВОЙ КИСЛОТЫ ИЗ ГИДРОКСИПРОПИОНОВОЙ КИСЛОТЫ | 2017 |
|
RU2719485C1 |
| СПОСОБ ПОЛУЧЕНИЯ АКРИЛОВОЙ КИСЛОТЫ ИЛИ ЕЕ ПРОИЗВОДНЫХ | 2013 |
|
RU2587494C2 |
| ИСКУССТВЕННОЕ ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО И НЕТКАНЫЙ ПРОДУКТ ИЛИ МАТЕРИАЛ, СОДЕРЖАЩИЕ ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО | 2017 |
|
RU2732131C1 |
Изобретение относится к расплавленному солевому катализатору для получения акриловой кислоты, производных акриловой кислоты или их смесей, содержащему ионную жидкость (ИЖ) и кислоту; причем указанная ИЖ имеет катион фосфония и бромидный анион (Br-); при этом указанная кислота растворима в указанной ИЖ и выбрана из группы, состоящей из кислоты Льюиса, кислоты Бренстеда и их смесей; причем указанная кислота Льюиса выбрана из группы, состоящей из CaBr2, MgBr2, AlBr3, CuBr2 и их смесей; и при этом указанная кислота Бренстеда имеет pKa менее 5 в воде при 25 °C. Технический результат заключается в увеличении выхода акриловой кислоты, производных акриловой кислоты или их смесей. 13 з.п. ф-лы, 3 табл., 140 пр.
1. Расплавленный солевой катализатор для получения акриловой кислоты, производных акриловой кислоты или их смесей, содержащий ионную жидкость (ИЖ) и кислоту; причем указанная ИЖ имеет катион фосфония и бромидный анион (Br-); при этом указанная кислота растворима в указанной ИЖ и выбрана из группы, состоящей из кислоты Льюиса, кислоты Бренстеда и их смесей; причем указанная кислота Льюиса выбрана из группы, состоящей из CaBr2, MgBr2, AlBr3, CuBr2 и их смесей; и при этом указанная кислота Бренстеда имеет pKa менее 5 в воде при 25 °C.
2. Катализатор по п. 1, в котором указанный катион фосфония выбран из группы, состоящей из алкилзамещенного фосфония, арилзамещенного фосфония, смешанного алкиларилзамещенного фосфония и их смесей.
3. Катализатор по п. 2, в котором указанная ИЖ представляет собой бромид тетрабутилфосфония ([PBu4]Br).
4. Катализатор по п. 2, в котором указанная ИЖ представляет собой бромид этилтрифенилфосфония ([EtPPh3]Br).
5. Катализатор по п. 3, в котором указанная кислота Бренстеда представляет собой пирофосфорную кислоту (H4P2O7).
6. Катализатор по п. 3 или 4, в котором указанная кислота Бренстеда представляет собой бромоводородную кислоту (HBr).
7. Катализатор по любому из предшествующих пунктов, в котором молярное соотношение указанной ИЖ и указанной кислоты Бренстеда составляет от 1 до 30.
8. Катализатор по любому из предшествующих пунктов, в котором молярное соотношение указанной ИЖ и указанной кислоты Бренстеда составляет от 1 до 20.
9. Катализатор по любому из предшествующих пунктов, в котором молярное соотношение указанной ИЖ и указанной кислоты Бренстеда составляет от 2 до 5.
10. Катализатор по любому из предшествующих пунктов, в котором молярное соотношение указанной ИЖ и указанной кислоты Бренстеда составляет 4,75.
11. Катализатор по любому из предшествующих пунктов, в котором молярное соотношение указанной ИЖ и указанной кислоты Бренстеда составляет 4.
12. Катализатор по п. 3, в котором указанная кислота Бренстеда представляет собой серную кислоту (H2SO4).
13. Катализатор по п. 3, в котором указанная кислота Бренстеда представляет собой фосфорную кислоту (H3PO4).
14. Катализатор по п. 3, в котором указанная кислота Бренстеда представляет собой уксусную кислоту (CH3CO2H) или 2-бромпропионовую кислоту (2-BrPA).
| EP 2977380 A1, 27.01.2016 | |||
| US 20100152027 A1, 17.06.2010 | |||
| US 9309180 B2, 12.04.2016 | |||
| АЛКИЛИРОВАНИЕ ПО КОЛЬЦУ АНИЛИНА С ИСПОЛЬЗОВАНИЕМ ИОННЫХ ЖИДКИХ КАТАЛИЗАТОРОВ | 2006 |
|
RU2427567C2 |
| Устройство для выключения рукоятки в ручных лебедках | 1929 |
|
SU19759A1 |
Авторы
Даты
2020-03-03—Публикация
2017-07-27—Подача