Изобретение относится к медицине, а именно к стоматологии, клеточным биотехнологиям, регенеративной медицине и может быть использовано для восстановления поврежденных структур - эмали или создания образцов эмали с последующим применением в клинической практике
Зрелая эмаль представляет собой наиболее твердую минерализованную ткань в организме человека, содержащую более 95% минеральных и менее 1% органических веществ [Chen, H.F.; Tang, Z.Y.; Liu, J.; Sun, K.; Chang, S.R.; Peters, M.C.; Mansfield, J.F.; Czajka-Jakubowska, A.; Clarkson, B.H. Acellular synthesis of a human enamel-like microstructure. Adv. Mater. 2006, 18, 1846-1851]. Учитывая невозможность самопроизвольного восстановления структуры эмали, рассматриваются несколько вариантов ее репарации. Существующие традиционные методы реставрации повреждений эмали не обеспечивают полное соответствие восстановленных повреждений и граничащей с ними естественной эмали по химическому составу, кристаллическим и физико-химическими свойствами. Применяемые материалы не могут хорошо сочетаться с эмалью на границе повреждения, подвергаются риску краевого подтекания, что приводит к развитию гиперчувствительности и вторичному кариесу. В связи с этим особую актуальность приобретают разработки альтернативных стратегий восстановления дефектов эмали, основанных на применении клеточных технологий и использовании стволовых клеток, скэффолдов и факторов роста.
Проведенный анализ существующих биотехнологий восстановления дефектов или создания эмали показал, что методы основываются как на принципе биомиметической минерализации: RU 2535080, US 2012/0148538, US 8466101, WO 2009/157869, так и применении тканевой инженерии и клеточных биотехнологий с применением стволовых клеток, факторов роста и скэффолдов (WO 2015/168022, US 2014/0023979, US 2014/0370515, US 2014/0093481, WO 2014126007 A1, US 8679755 B2, US 20110306135 A1).
Биотехнология, описанная в патенте WO 2015/168022 «Enamel products and methods of use» (русс.«Продукты эмали и методы применения»), включает применение трехмерных культуральных систем (3D), которые могут быть использованы для получения эмали. Изобретение описывает способы культивирования различных типов клеток для получения эмали с помощью описанных моделей, а также методы применения полученных эмалевых продуктов в хирургических пособиях в стоматологии. В качестве возможных источников стволовых клеток могут быть использованы первичный эмалевый орган, пул эпителиальных клеток Малассез, генетически модифицированные клетки. Предлагаются возможные варианты культивирования клеток - как в условиях 2D с последующим переводом в трехмерные структуры, так и исходное культивирование клеток в 3D структурах, применение матригеля и дополнительно вносимых в кулыуральную среду факторов роста - TGF, EGF, инсулино-подобного фактора роста, фактора роста фибробластов, тканевого активатора плазминогена и др. Для 3D культур предлагается использование специализированного культурального пластика AggreWell™ с последующим внесением сформированных сфероидов в специализированные биореакторы ProtoTissue™. Для стимуляции процессов минерализации предлагается дополнительное использование минерализующего раствора (кальций 2,5 mM, фосфаты 1,5 mM), либо возможно использование других минерализующих растворов, содержащих 10% раствора глюконата кальция, 1% фторида натрия, 3% раствор ремодент. В качестве контрольных маркеров дифференцировки in vivo и in vitro использованы амелогенин, амелобластин, тафтелин, энамелин, ММР-20 (матриксная металлопротеиназа-20) и EMSP-1 (сериновая протеаза эмалевого матрикса-1), цитокератин-14. Предлагаемая методика подтверждается результатами, полученными на примере использования иммортализованной культуры кератиноцитов ротовой полости мыши (IMOK). Данная методика включает подробное описание условий культивирования выбранных типов клеток, однако подразумевает использование достаточно большого числа дополнительных внешних факторов роста и минерализующего раствора, а также требует достаточного технического обеспечения, поскольку включает обязательное использование специализированного биореактора и систем для 3D культивирования.
В разработке, запатентованной US 2014/0023979 Regeneration of ameloblast cells and dental enamel in vivo» (русс.«Регенерация амелобластов и эмали зуба in vivo»), предлагается способ лечения зубов при необходимости регенерации эмали зуба и/или амелобластов. Этот способ включает воздействие, по меньшей мере, на часть коронки, корневого канала или периапикальной части ткани зуба и введение эмалевого материала в количестве, достаточном, чтобы способствовать регенерации зубной эмали и/или амелобластов таким образом, что по меньшей мере часть обнаженной коронки, корневого канала или периапикальной ткани находятся в контакте с эмалью.
Патентованная биотехнология US 2014/0370515 «Method of co-culturing human endometrial stem cells and rat embryonic tooth bud cells to obtain ameloblast cells» (русс. «Метод кокультивирования стволовых клеток эндометрия человека и эмбриональных клеток зачатка зуба крысы для получения амелобластов») описывает различные варианты совместного культивирования человеческих эндометриальных стволовых клеток и эмбриональных клеток зачатка зуба крысы для получения амелобластов. Человеческие стволовые клетки эндометрия выделяют у женщин в возрасте 18-40 лет, культивируют, идентифицируют с помощью проточной цитометрии. Клетки крысы выделяют из зачатков зубов эмбрионов и культивируют. После того достижения желаемого количества клеток клетки переносят в культуральный планшет для совместного культивирования и получения амелобластов. Недостатком данного метода является использование различных видовых источников клеток и исключительно экспериментальная апробация данного способа, а также получение лишь дифференцированных клеток - амелобластов без описания достижения конечного результата - эмали.
Биотехнология US 20140093481 «Production of dentin, cementum and enamel by cells» (русс. «Продукция дентина, цемента и эмали клетками»), рассматривает способ формирования минерализованного материала путем совместного культивирования эпителиальных клеток, таких как амелобласты и мезенхимальных клеток, таких как остеобласты или одонтобласты, в минерализирующей среде. Предусмотрено внесение эпителиальных клеток и клеток мезенхимы, а также минерализованной среды для минерализации в матрице. Также описаны способы данного культивирования и способы применения этого метода. Данный способ достаточно близок к разрабатываемому, однако включает использование уже дифференцированных клеток.
Кроме того, изучена и представлена экспериментально возможность использования синтетических и биоактивных наноструктур с возможностью самосборки в физиологических условиях с целью имитации внеклеточного матрикса, окружающего амелобласты [Huang Z, Newcomb CJ, Zhou Y, Lei YP, Bringas P Jr, Stupp SI, et al. The role of bioactive nanofibers in enamel regeneration mediated through integrin signals acting upon C/EBPβ and c-Jun. Biomaterials. 2013;34(13):3303-14]. Амелобласто-подобные клетки (клеточная линия LS8) и эпителиальные клетки первичного эмалевого органа (ЕОЕ) культивировались с полиакриламидным гидрогелем, а также полиакриламид вводился в эпителий эмалевого органа резцов мышиных эмбрионов, которые затем трансплантировались под капсулу почки мыши-хозяина для длительного культивирования [Huang Z, Newcomb CJ, Zhou Y, Lei YP, Bringas P Jr, Stupp SI, et al. The role of bioactive nanofibers in enamel regeneration mediated through integrin signals acting upon C/EBPβ and c-Jun. Biomaterials. 2013;34(13):3303-14]. Биоактивный полиакриламид индуцировал развитие структур гидроксиапатита, подобных естественной эмали за счет воздействия на клетки путем увеличения их пролиферации и дифференцировки при доставке ключевых сигналов интегринов. Описанный метод апробирован экспериментально и трудновыполним в условиях клинической практики. Тем не менее, разработка технологии по управлению клетками первичного эмалевого органа является существенным преимуществом по сравнению с замещением эмали и позволяет рассмотреть возможность разработки эмали, основанной на применении пассированных клеток первичного эмалевого органа с использованием тканевой инженерии.
В эксперименте клетки первичного эмалевого органа свиней также трансплантировали на биоразлагаемые скэффолды in vivo [Masaki J. Honda and Ken-ichiroHata. Enamel Tissue Engineering. In Daniel Eberli Editor. Tissue Engineering, publisher. In tech. 2010]. Свежие клетки пульпы зуба из третьих моляров свиней на ранней стадии формирования коронки вначале помещались на верхушку скэффолда, а затем пересеянные клетки первичного эмалевого органа помещались непосредственно на слой клеток пульпы. Через 4 недели после трансплантации клеток в сочетании с клетками пульпы зуба на скэффолде, было выявлено несколько феноменов, относящихся к амелогенезу [Masaki J. Honda and Ken-ichiroHata. Enamel Tissue Engineering. In Daniel Eberli Editor. Tissue Engineering, publisher. In tech. 2010]. В наиболее зрелых структурах в имплантах была выявлена эмаль. Кроме того, иммунологическая реактивность на амелогенин была выявлена в высоких столбчатых эпителиальных клетках на поверхности дентина или эмали, что свидетельствует о том, что эмаль, созданная в результате тканевой инженерии, содержит хорошо развитые амелобласты. Учитывая совокупность полученных результатов, пассируемые клетки эмалевого органа обладают способностью генерировать эмаль. Продукция эмали в данной культуральной модели увеличивалась, поскольку клетки первичного эмалевого органа поддерживались на недифференцированной стадии в амелобласто-подобной линии клеток на ЗТЗ слое фидеров. Формирование эмали всегда наблюдалось после дентина, который образовывался в имплантах. С другой стороны, при сочетании пассируемых клеток эмалевого органа с пассируемыми клетками пульпы зуба, комплексы эмаль-дентин ни в одном из имплантов выявлены не были [Masaki J. Honda and Ken-ichiroHata. Enamel Tissue Engineering. In Daniel Eberli Editor. Tissue Engineering, publisher. In tech. 2010]. Недостатком использованного способа является применение в качестве основных - клеток первичного эмалевого органа, однако данный тип клеток отсутствует в зубах взрослых, и в качестве альтернативных источников клеток, формирующих эмаль, необходимо рассматривать другие источники, такие как пул эпителиальных клеток Малассез [Masaki J. Honda and Ken-ichiroHata. Enamel Tissue Engineering. In Daniel Eberli Editor. Tissue Engineering, publisher. In tech. 2010], клетки костного мозга [Ни В, Unda F, Bapp-Kuchler S, Jimenez L, Wang XJ, Haikel Y, et al. Bone marrow cells can give rise to Ameloblast like cells. J Dent Res. 2006;85(5):416-21], эпителиальные клетки, полученные из эмбриональных стволовых клеток человека [Li-Wei Zheng, Logan Linthicum, Pamela K, Den Besten, Yan Zhang. The similarity between human embryonic stem cell-derived epithelial cells and ameloblast-lineage cells. Journal of Oral Science. 2013;5:1-6], кератиноциты ротовой полости [Masaki J. Honda and Ken-ichiroHata. Enamel Tissue Engineering. In Daniel Eberli Editor. Tissue Engineering, publisher. In tech. 2010], эпителиальные клетки кожи [Liu Y, Jiang M, Hao W, Liu W, Tang L, Liu H, Jin Y. Skin epithelial cells as possible substitutes for ameloblasts during tooth regeneration. J Tissue Eng Regen Med. 2013;7(12):934-43].
Все использованные подходы способствуют восстановлению эмали, но, применялись только на экспериментальных моделях и позволяли достичь реминерализации или восстановления эмали в различной степени.
Кроме того, разработан ряд клеточных биотехнологий, основной целью которых является создание целостного зуба или нескольких зубов из одного клеточного источника.
Патент US 8679755 В2 «Method of producing tooth, set of teeth and method of producing tissue» (русс.«Метод выращивания зуба, зубного ряда и метод выращивания ткани») 8679755, патентообладатель Organ Technologies Inc, описывает модель культивирования двух типов клеток (мезенхимальных и эпителиальных) внутри носителя, с последующим контактом носителя с клетками почки. В данной модели используются клеточные массы, содержащие только мезенхимальные клетки или эпителиальные клетки. Клеточные массы, находящиеся в непосредственном контакте друг с другом, помещают внутрь поддерживающего носителя и культивируют, при этом в процессе культивирования не достигается перемешивания различных типов клеток, тогда как контакт между клеточными массами сохраняется. Данный способ позволял эффективно воспроизводить взаимодействие между мезенхимальными и эпителиальными клетками, необходимое для формирования тканей зуба.
Патент RU 2521195 С2 «Способ восстановления утраченного зуба и способ изготовления восстановительного материала» содержит данные о возможности изготовления восстановительного материала, используемого для восстановления области утраченного зуба в полости рта. В предлагаемом изобретении используется два возможных варианта комбинаций исходного биологического материала. В качестве первого варианта исходного биологического материала рассматривается клеточная масса, образованная клетками/клеткой из мезенхимальных либо эпителиальных клеток, в качестве второго - клеточная масса, образованная другой клеткой/другими клетками из мезенхимальных либо эпителиальных клеток. Отмечено, что одну из мезенхимальных либо эпителиальных клеток получают из зубного зачатка и указанные клеточные массы располагают в тесном контакте друг с другом без смешивания. Выращивают указанные клеточные массы с формированием целого восстанавливаемого зуба или его зачатка. Затем определяют ориентацию целого восстанавливаемого зуба или его зачатка, сформированного выращиванием, что позволяет внедрить целый восстанавливаемый зуб или его зачаток в области утраченного зуба таким образом, чтобы коронковая часть зуба была направлена внутрь полости рта, при этом зубной зачаток или зуб используют в качестве восстановительного материала для получения эквивалента утраченного зуба в области утраченного зуба. Данное техническое решение предполагает восстановление области утраченного зуба путем внедрения восстанавливаемого зубного зачатка или восстанавливаемого целого зуба, изготавливаемого способом, описанным в данном патенте. Данный способ близок к разрабатываемому, однако его основной целью является восстановление области утраченного зуба за счет внедрения восстанавливаемого зубного зачатка, либо восстанавливаемого целого зуба, но не определенного конкретного фрагмента ткани. В патенте рассматривается возможность использования с целью регенерации зубного зачатка или целого зуба эпителиальных и мезенхимальных клеток, полученных из различных источников, при этом рассматривается только вариант культивирования указанных пулов клеток в тесном контакте друг с другом в присутствии питательной среды, стандартных концентраций сыворотки и применения возможных дополнительных факторов роста.
В патенте WO 2014126007 А1 описан «Method for producing a plurality of teeth from one isolated tooth germ» (русс.«Метод создания нескольких зубов из одного изолированного зубного зачатка»). В данном изобретении предлагается способ получения множества зубов из одного изолированного зубного зачатка с целью увеличения общего числа структур, которые могут быть использованы для трансплантации. Указанный способ получения множества зубов из одного изолированного зубного зародыша, включающего слой эпителиальной ткани и слой мезенхимальной ткани, подразумевает две последовательные стадии: (а) стадии, на которой один изолированный зубной зародыш, включающий слой эпителиальной ткани и слой мезенхимальной ткани, полностью или частично разделен, причем указанное разделение характеризуется тем, что каждая разделенная часть зуба-зародыша разделена так, чтобы включать часть слоя эпителиальной ткани и часть слой мезенхимальной ткани; и (b) стадию, на которой образуется множество зубов путем культивирования разделенного зубного зародыша in vitro или культивирования раздробленного зубного зачатка in vivo у экспериментального животного. Данный способ близок к разрабатываемому, однако его основной целью является получение целостных зубов, а также дробление зубного зачатка, исходно использующегося как источник стволовых клеток с целью получения множества зубных структур.
Основным недостатком применения биотехнологий для восстановления дефектов эмали с помощью стволовых клеток (WO 2007/036232, US 2014/0093481, US 2014/0023979, US 2014/0370515, WO 2016/076929) является сложность получения исходного материала, отсутствие данных о жесткости предлагаемых скэффолдов для генерации амелобластов и существенные ограничения для трансляции в клиническую практику (US 2014/0370515); при использовании различных составов для реминерализации и восстановления дефектов эмали (WO 2009/157869, WO 2015/168022, US 2012/0148538, RU 2535080) - необходимость применения белков, их аналогов в сочетании с различными реминерализующими средами и стволовыми клетками, что существенно затрудняет возможность трансляции в клиническую практику и не обеспечивает стабильной степени восстановления дефектов эмали; способы, описанные в патентах WO 2014126007 A1, US 8679755 В2, RU 2521195 С2, предлагают в качестве конечного результата выращивание целостных биоинженерных структур - зубов, одного, либо нескольких, а также описывают возможность генерации восстановительного материала, используемого для восстановления области утраченного зуба в полости рта, из экспериментально доступных источников - зубных зачатков эмбрионов, либо с использованием эпителиальных и мезенхимальных клеток иного происхождения, например, кроветворных, либо жировой ткани (патент RU 2521195 С2). Все описанные способны в качестве конечной цели имели создание целостных структур - зубного зачатка, либо целого зуба, подразумевая использование для этого именно клеточные источники двух популяций - эпителиальные и мезенхимальные. Однако, учитывая применяемые биоинженерные технологии, все предлагаемые способы характеризуются многостадийностью и значительным числом манипуляций с клетками, что требует многократных воздействий на стволовые клетки как ферментами, нарушающими межклеточные взаимодействия, так и механическими факторами.
Наиболее близким к предлагаемой технологии выращивания эмали является метод выращивания биоинженерного зуба из стволовых эпителиальных и мезенхимальных клеток, описанный в литературе [Takashi Tsuji (ed.), Organ Regeneration: 3D Stem Cell Culture & Manipulation, Methods in Molecular Biology, vol. 1597, DOI 10.1007/978-1-4939-6949-4_8]. В качестве основного источника стволовых клеток авторами рассматривается зубной зачаток эмбриона мыши на сроке эмбрионального развития 14,5 дней, из которого выделяются эпителиальная и мезенхимальная части зубного зачатка с последующим ферментативным разделением тканей на отдельные пулы эпителиальных и мезенхимальных клеток, соответственно. Далее пулы клеток последовательно помещаются в носитель, представленный коллагеном (коллагеновая капля) и культивируются в стерильных условиях инкубатора в течение 14 дней, после чего выполняется помещение сформированного биоинженерного зачатка зуба под капсулу почки на 30-60 дней, достаточных для формирования зуба необходимой длины и гистологически соответствующего обычному зубу.
В качестве прототипа разрабатываемой биотехнологии можно рассматривать патент US 20110306135 A1, патентообладатель Organ Tech Inc, «Method for producing tooth» (русс.«Метод создания зуба»), предусматривающий возможность выращивания зуба желаемой длины в одном направлении. Данный способ описывает двухступенчатую модель культивирования двух типов клеток (мезенхимальных и эпителиальных) внутри поддерживающего носителя на примере коллагенового геля, при обязательном соблюдении непосредственного контакта пулов мезенхимальных и эпителиальных клеток друг с другом. Описана возможность использования стволовых эпителиальных и мезенхимальных клеток из зубного зачатка для формирования целого зуба. В патенте указывается, что существенное значение при определении длины выращиваемого зуба имеет площадь контакта эпителиального и мезенхимального клеточных слоев.
Задачей данного изобретения является получение фрагмента эмали зуба, по биохимическому и гистологическому строению идентичному эмали естественного происхождения.
Технический результат заключается в образовании эмали, по биохимическому и гистологическому строению, идентичной эмали естественного происхождения.
Это достигается за счет в последовательного культивирования целостного фрагмента эпителиальной части зубного зачатка с небольшим фрагментом мезенхимальной ткани, включающий следующие этапы: в чашке Петри формируется капля коллагенового геля объемом 30 мкл, в которую вносится фрагмент ткани - ранее отделенная эпителиальная часть зубного зачатка и небольшой фрагмент связанной с ней мезенхимы, чашка Петри с каплей геля коллагена инкубируется в течение 15 мин при 37°С в инкубаторе в условиях 5% CO2 для затвердевания коллагенового геля, в культуральный планшет вносятся полученные из зубного зачатка мезенхимальные клетки, после чего в лунку помещается вставка для клеточной культуры с диаметром пор 0,4 мкм, на которую с помощью тонкого пинцета переносится сформированная капля коллагенового геля с эпителиальной тканью из зубного зачатка, связанная с незначительным количеством мезенхимальной ткани, через 14 дней развивающаяся эмаль переносится в биологический реактор - под капсулу почки мыши и по истечении 10 недель проводится выделение почки экспериментального животного, а также выделение развившейся эмали из-под капсулы почки.
Для достижения наиболее оптимального результата в предлагаемой модели выращивания эмали используется сохранение необходимого для полноценного амелогенеза контакта между стволовыми и мезенхимальными клетками при их культивировании, что наблюдается в развивающемся эмбрионе в естественных условиях и позволяет разработать и воспроизвести полностью функциональный биоинженерный подход in vitro. Сохранение эпителиально-мезенхимального контакта и взаимодействие между клетками обеспечивает достижение необходимых для полноценного амелогенеза профилей экспрессии генов, сигнальных молекул и сигнальные пути факторов транскрипции.
Эксперименты проводились на зубных зачатках, выделенных из эмбрионов мыши генетической линии C57/BL6 на 14,5 день эмбрионального развития. Выбор данного срока развития мышиных эмбрионов обусловлен минимально достаточной стадией развития зубного зачатка - на данном сроке зуб находится на стадии развития с достаточно четким выделением зубного сосочка, обеспечивающего дальнейшее развитие пульпы зуба и дентин-секретирующих одонтобластов, а также эмалевого узелка, содержащего пул стволовых эпителиальных клеток и формирующего в дальнейшем эмаль.
Животные перед проведением экспериментов содержались в условиях аккредитованного вивария ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России в стандартных условиях, не допускающих попадания патогенных микроорганизмов при естественном освещении и свободном доступе к воде и пище [Приказ №63 МЗ СССР от 10.03.1966; «Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» за №1045-73, утвержденные Главным государственным санитарным врачом СССР от 06.04.1973. Все эксперименты на животных проводились в соответствии с положениями приказа №755 МЗ СССР от 12.08.1977, а также с соблюдением правил Надлежащей лабораторной практики (Good Laboratory Practice, РФ ГОСТ Р-53434-2009). Животные были сопоставимы по возрасту, весу, полу.
Перед началом экспериментов все животные в течение 2 часов находились в условиях лаборатории. После умерщвления мыши-самки генетической линии C57/BL6 живот животного разрезался вдоль средней линии небольшими хирургическими ножницами. У животного удалялась матка, содержащая эмбрионы, и промывалась стерильным раствором PBS без Са2+, Mg2+ (далее - PBS(-)) комнатной температуры. Эмбрионы выделялись из матки. У эмбрионов отрезались головки от тела, отделялись нижние челюсти от головы, после чего нижние челюсти немедленно помещались в холодную (4°С) культуральную среду (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin, 10-mM HEPES). Далее проводилось выделение зачатков нижних моляров, использованных для экспериментов: пересекался язычок нижней челюсти и отделялась одна сторона челюсти. От нижней челюсти отделялся хрящ Меккеля, затем выполнялась резекция ткани на стороне, противоположной хрящу Меккеля. Удалялась вся избыточная ткань вокруг зачатков резца и моляра. При удалении всех необходимых для эксперимента зачатков зубов уже изолированные в ходе эксперимента зубные зачатки обязательно должны находиться в холодной культуральной среде.
Следующим необходимым этапом работы является отделение эпителиальной части зачатка зуба от окружающей его мезенхимы, однако при этом необходимым условием являлось сохранение незначительного количества мезенхимальной ткани, связанной с эпителиальной частью, с целью обеспечения полноценного эпителиально-мезенхимального контакта, необходимого для надлежащего течения процесса амелогенеза и последующего формирования полноценной эмали. Для этого выделенные зачатки зубов необходимо дважды промыть в стерильном PBS (-), после чего добавить 50 ед/мл раствора диспазы и оставить для процесса ферментации при комнатной температуре на 10,5 мин. Завершение ферментативной реакции обеспечивается добавлением культуральной среды (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin). После остановки процесса ферментации зубные зачатки дважды промываются в культуральной среде (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin) с последующим добавлением 1 мкл ДНКазы в 2 мл культуральной среды и инкубацией при комнатной температуре в течение 10 секунд. Под микроскопом проводится отделение эпителиальных и мезенхимальных тканей зубного зачатка с использованием игл 25 G. После разделения эпителиальная ткань зубного зачатка помещается в культуральную среду (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin) при температуре 4°С. Оставшиеся фрагменты мезенхимальной ткани также помещаются в культуральную среду (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin-streptomycin) при температуре 4°С и подвергаются дальнейшей ступенчатой обработке для получения отдельных клеток. Фрагменты мезенхимальной ткани в указанной питательной среде помещаются в пробирки объемом 15 мл и центрифугируются в течение 3 минут при 3000 оборотах/минуту, после чего супернатант отбирается и клеточный осадок еще дважды отмывается PBS (-). После последней отмывки проводится удаление PBS(-) и начинается процесс ферментативного расщепления ткани. С этой целью к осадку мезенхимы добавляется 2 мл смеси раствора PBS(-) и 1,83 мкл коллагеназы I типа и 0,25% трипсина с последующей инкубацией при 37°С в течение 10 минут. Ферментативная реакция завершается добавлением 6 мл культуральной среды (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin-streptomycin) и последующим центрифугированием в течение 5 минут при 3000 оборотах/минуту. После центрифугирования супернатант удаляется до остаточного объема 80 мкл и интенсивно пиппетируется клеточный осадок. После в пробирку вносится 1 мл культуральной среды (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin) и вновь центрифугируется при 3000 оборотах/минуту в течение 3 минут. Супернатант после центрифугирования удаляется до остаточного объема 200 мкл, после чего к оставшейся в пробирке среде добавляется 1 мкл раствора ДНКазы и вновь интенсивно пиппетируется клеточный осадок до получения однородной клеточной суспензии. Далее для обеспечения in vitro необходимых условий культивирования и факторов роста эпителиальная часть зубного зачатка с небольшим фрагментом мезенхимальной ткани помещаются в in vitro систему, состоящую из специализированного поддерживающего носителя - коллагенового геля и культуральной чашки Петри. В чашке Петри формируется капля коллагенового геля (использован Celimatrix type I-А, производства Nitta gelatin, Osaka, Japan) объемом 30 мкл (одна капля для каждого из фрагментов эпителия), в которую вносится фрагмент ткани - ранее отделенная эпителиальная часть зубного зачатка и небольшой фрагмент связанной с ней мезенхимы. Чашка Петри с каплей геля коллагена инкубируется в течение 15 мин при 37°С в инкубаторе в условиях 5% СО2 для затвердевания коллагенового геля. В культуральный 12-луночный планшет вносятся полученные из зубного зачатка мезенхимальные клетки (1 млн клеток/ 500 мкл питательной среды), после чего в лунку помещается вставка для клеточной культуры с диаметром пор 0,4 мкм, на которую с помощью тонкого пинцета переносится сформированная капля коллагенового геля с внесенной структурой - эпителиальная ткань из зубного зачатка, связанная с незначительным количеством мезенхимальной ткани. В лунках кулыурального планшета производится замена культуральной среды, с внесением 10% FBS, 100 мкг/мл аскорбиновой кислоты и 2-мМ L-глутамина. Замена культуральной среды в лунках проиводится 1 раз в 2 дня. Структуры в коллагеновом геле находятся в инкубаторе в течение 14 дней, после чего будут перенесены уже в биологических реактор - под капсулу почки мыши. Экспериментальная мышь, которой будет выполнена имплантация развивающейся структуры, анестезируется и размещается в положении лежа. Лапки животного фиксируются на рабочей поверхности. Проводится сбривание волос на коже животного в области вмешательства, проводится разрез кожи в области спины длиной около 2 см и разделение кожи и фасции. Фасция рассекается и выводится почка. Рассекается примерно 2-3 мм наружной мембраны субренальной капсулы, отделяется пространство между паренхимой почки и наружной мембраной капсулы, куда помещается развивающаяся структура. Далее почка аккуратно возвращается в перитонеальную полость, зашиваются фасция и кожа. Развивающаяся эмаль находится под капсулой почки в течение 10 недель. По истечении необходимого времени развития проводится выделение почки экспериментального животного и выделение развившейся эмали из-под капсулы почки.
Пример
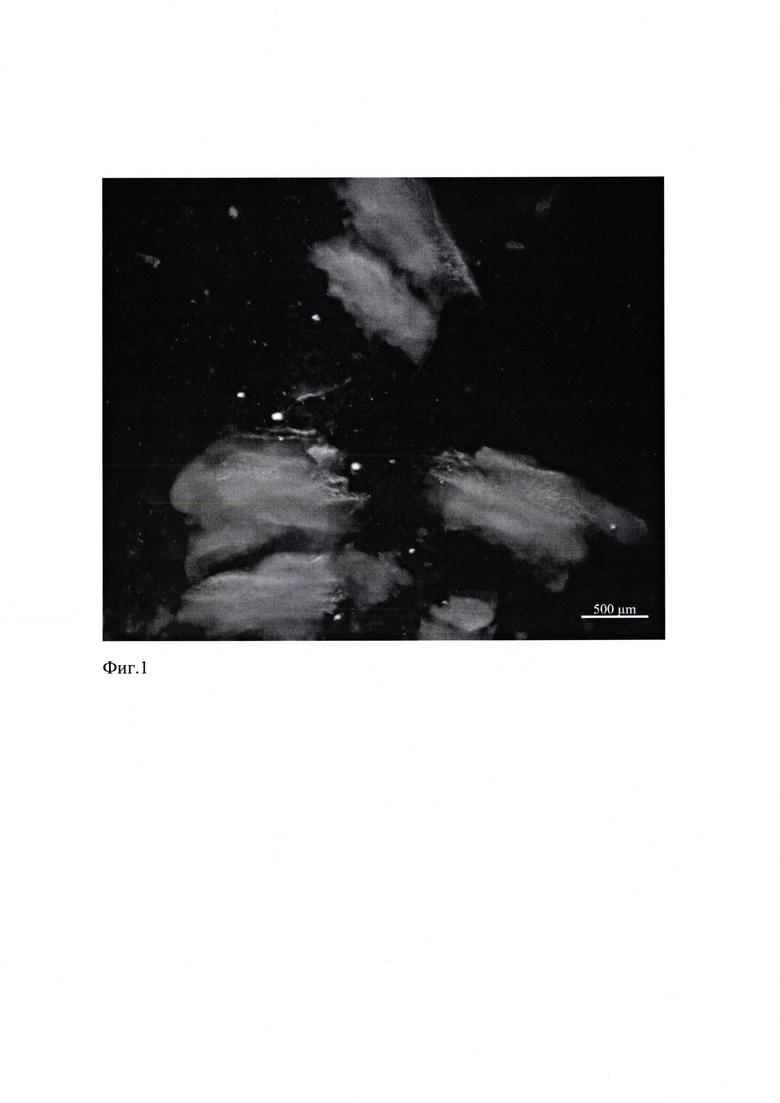
После умерщвления мыши-самки генетической линии C57/BL6 живот животного был разрезан вдоль средней линии небольшими хирургическими ножницами. У животного удалена матка, содержащая 4 эмбриона и промыта раствором PBS без Са2+, Mg2+ (-). Эмбрионы выделены из матки. У эмбрионов отрезаны головки от тела, отделены нижние челюсти от головы, после чего нижние челюсти немедленно помещены в холодную (4°С) культуральную среду (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin-streptomycin, 10 mM HEPES). Далее проведено выделение зачатков нижних моляров, использованных для экспериментов: пересечен язычок нижней челюсти и отделена одна сторона челюсти. От нижней челюсти отделен хрящ Меккеля, выполнена резекция ткани на стороне, противоположной хрящу Меккеля. Удалена вся избыточная ткань вокруг зачатков резца и моляра. При удалении всех необходимых для эксперимента зачатков зубов уже изолированные в ходе эксперимента зубные зачатки обязательно находятся в холодной культуральной среде. (Фиг. 1)
Выполнено отделение эпителиальной части зачатка зуба от окружающей его мезенхимы, однако при этом сохранено незначительное количество мезенхимальной ткани, связанной с эпителиальной частью с целью обеспечения полноценного эпителиально-мезенхимального контакта, необходимого для надлежащего течения процесса амелогенеза и последующего формирования полноценной эмали. (Фиг. 2) Для этого выделенные зачатки зубов дважды промыты в стерильном PBS (-), после чего добавлено 50 ед/мл раствора диспазы для обеспечения процесса ферментации при комнатной температуре на 10,5 мин. Завершение ферментативной реакции обеспечивалось добавлением культуральной среды (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin). После остановки процесса ферментации зубные зачатки дважды промыты в культуральной среде с последующим добавлением 1 мкл ДНКазы в 2 мл культуральной среды и инкубацией при комнатной температуре в течение 10 секунд. Под микроскопом проводится отделение эпителиальных и мезенхимальных тканей зубного зачатка с использованием игл 25 G. После разделения эпителиальная ткань зубного зачатка помещена в холодную культуральную среду (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin) при температуре 4°С.
Оставшиеся фрагменты мезенхимальной ткани также помещались в культуральную среду (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin) при температуре 4°С и подвергались дальнейшей ступенчатой обработке для получения отдельных клеток. Фрагменты мезенхимальной ткани в указанной питательной среде помещались в пробирки объемом 15 мл и центрифугировались в течение 3 минут при 3000 оборотах/минуту, после чего супернатант отбирался и клеточный осадок еще дважды отмывался PBS (-). После последней отмывки проводилось удаление PBS(-) и начинался процесс ферментативного расщепления ткани. С этой целью к осадку мезенхимы добавляли 2 мл смеси раствора PBS(-) и 1,83 мкл коллагеназы I типа и 0,25% трипсина с последующей инкубацией при 37°С в течение 10 минут. Ферментативная реакция завершалась добавлением 6 мл культуральной среды (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin) и последующим центрифугированием в течение 5 минут при 3000 оборотах/минуту. После центрифугирования супернатант удаляли до остаточного объема 80 мкл и интенсивно пиппетировали клеточный осадок. После в пробирку вносили 1 мл культуральной среды (питательная среда DMEM, 10% fetal bovine serum (FBS), 1% penicillin- streptomycin) и вновь центрифугировали при 3000 оборотах/минуту в течение 3 минут. Супернатант после центрифугирования удаляли до остаточного объема 200 мкл, после чего к оставшейся в пробирке среде добавляли 1 мкл раствора ДНКазы и вновь интенсивно пиппетировали клеточный осадок до получения однородной клеточной суспензии.
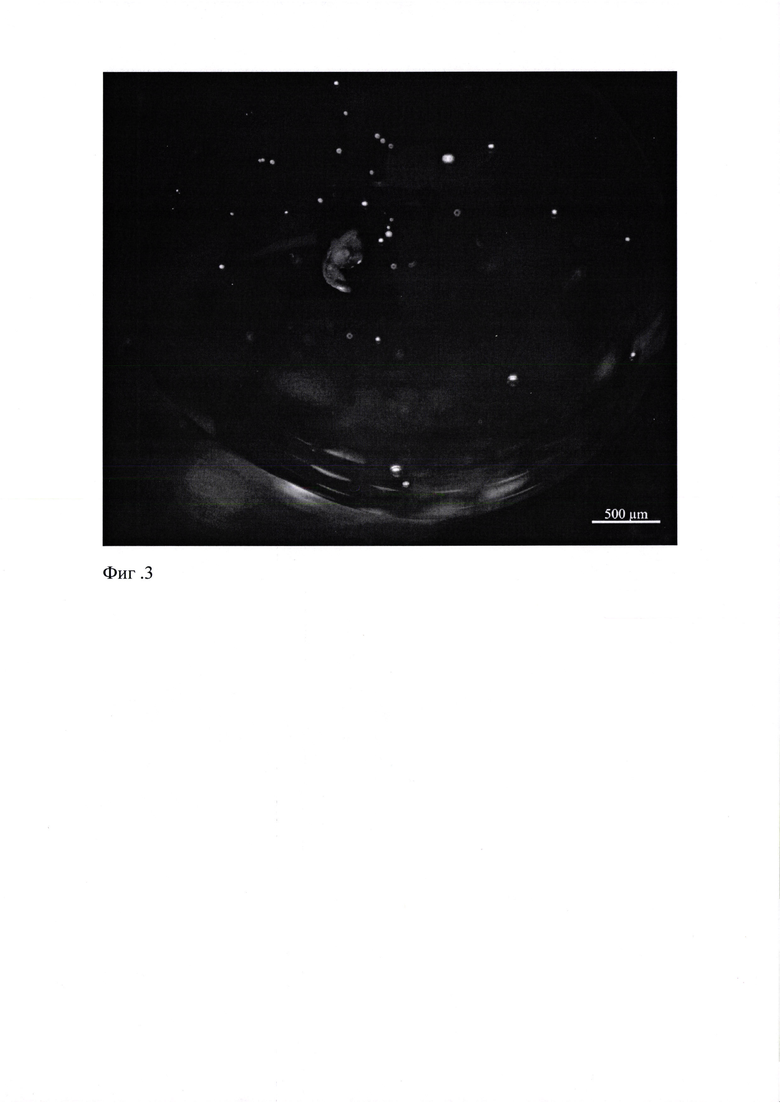
Далее для обеспечения in vitro необходимых условий культивирования и факторов роста эпителиальная часть зубного зачатка с небольшим фрагментом мезенхимальной ткани помещается в in vitro систему, состоящую из специализированного поддерживающего носителя - коллагенового геля и культуральной чашки Петри. В чашке Петри формируется капля коллагенового геля объемом 30 мкл, в которую вносится ранее отделенная эпителиальная засть зубного зачатка и связанные с ней фрагменты мезенхимальной ткани. (Фиг. 3)
Чашка Петри с каплей геля коллагена инкубируется в течение 15 мин при 37°С в инкубаторе в условиях 5% СО2 для затвердевания коллагенового геля. В культуральный 12-луночный планшет, лунки которого заполнены культуральной средой 500 мкл/лунку помещается вставка для клеточной культуры, на которую с помощью тонкого пинцета переносится сформированная капля коллагенового геля с внесенной структурой. Производится замена культуральной среды, с внесением 10% FBS, 100 мкг / мл аскорбиновой кислоты и 2-мМ L-глутамина. Замена культуральной среды в лунках проиводится 1 раз в 2 дня. Структуры в коллагеновом геле находятся в инкубаторе в течение 14 дней, после чего будут перенесены уже в биологических реактор - под капсулу почки мыши. Экспериментальная мышь, которой будет выполнена имплантация развивающейся структуры, анестезируется и размещается в положении лежа. Лапки животного фиксируются на рабочей поверхности. Проводится сбривание волос на коже животного в области вмешательства, проводится разрез кожи в области спины длиной около 2 см и разделение кожи и фасции. Фасция рассекается и выводится почка. Рассекается примерно 2-3 мм наружной мембраны субренальной капсулы, отделяется пространство между паренхимой почки и наружной мембраной капсулы, куда помещается развивающаяся структура. Далее почка аккуратно возвращается в перитонеальную полость, зашиваются фасция и кожа. Развивающаяся эмаль находится под капсулой почки в течение 10 недель. По истечении необходимого времени развития проводится выделение почки экспериментального животного и выделение развившейся эмали из-под капсулы почки. (Фиг. 4)
Полученный образец направлен на гистологическое исследование, а также анализ с помощью электронной растровой микроскопии для получения данных о соответствии структуры полученного образца имеющимся данным о структуре эмали.
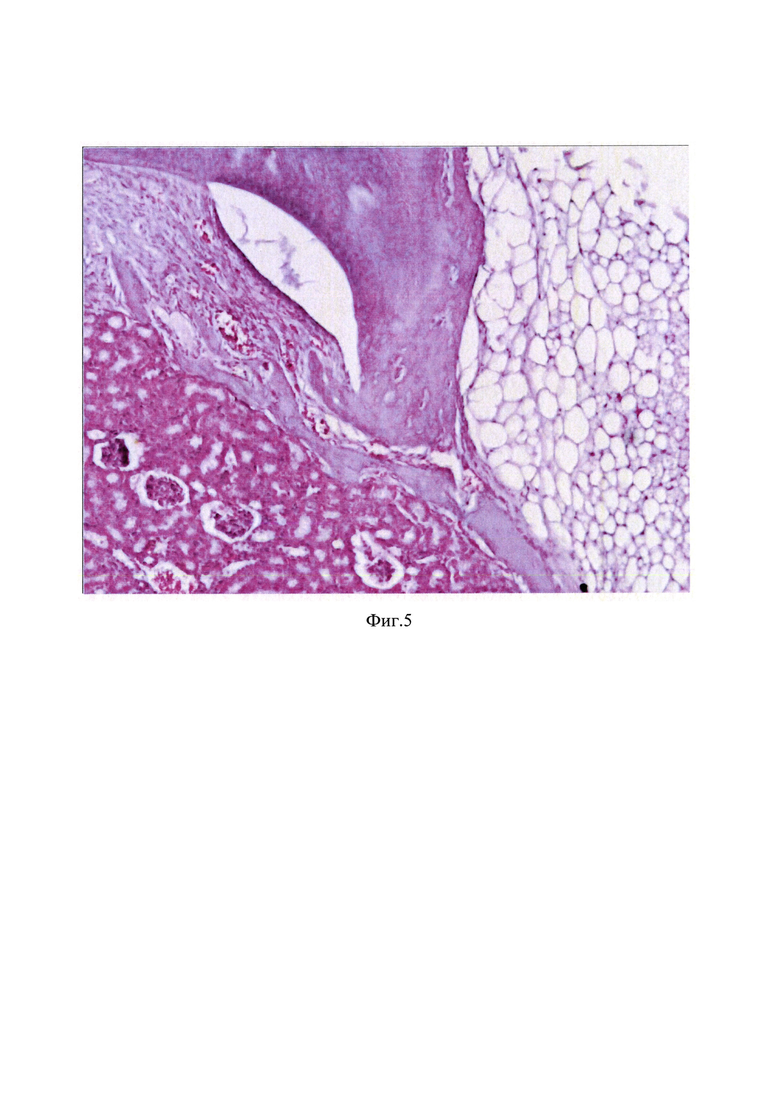
Для гистологического исследования образцы тканей, после фиксации в 10%-м забуференном нейтральном формалине, при необходимости, подвергали предварительной декальцинации (реагент Биодек R, Италия) и под контролем лупы вырезали искомый участок ткани. После дополнительного, второго этапа декальцинации, образцы ткани по общепринятой методике обезвоживали и заливали в парафиновые блоки. Гистологические срезы, толщиной 3-4 мкм, полученные на микротоме «Leica» (Германия) окрашивали гематоксилином и эозином (Фиг. 5). Для получения гистологического среза правильной ориентации, материал многократно дорезали методами ступенчатых и серийных срезов, меняя положение парафинового блока. Гистологические препараты исследовали и фотографировали на микроскопе AxioLab A1 (Carl Zeiss Microscopy, Германия)
Для электронно-микроскопического исследования образцы исследовали с помощью растровых микроскопов «FE Quanta 200 3D» и «FE1 Quanta 600 FEG» (Нидерланды) с функцией бесконтактного определения процентного содержания макро- и микроэлементов. Микроэлементный анализ был сделан с использованием детектора для регистрации спектров характеристического рентгеновского излучения фирмы «ЕРАХ». Детекторы интегрированы с растровым электронным микроскопом «Quanta 600 FEG».
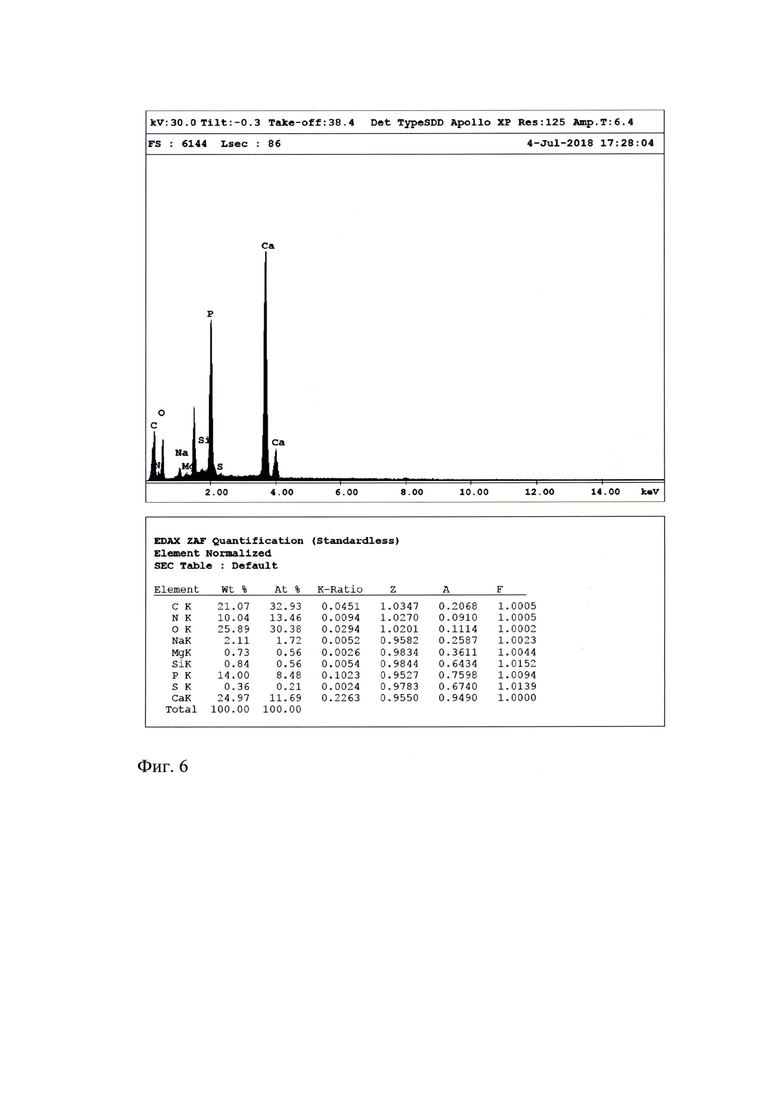
Метод микроэлементного анализа основан на возникновении непрерывного флуоресцентного излучения при бомбардировке исследуемых образцов пучком первичных рентгеновских лучей. Для определения химического состава вещества в сканирующем электронном микроскопе использовали энергодисперсионный спектрометр. Принцип его работы заключается в том, что пучок электронов падает на поверхность образца и взаимодействует с материалом, в результате чего возникает, в том числе, характеристическое рентгеновское излучение, которое регистрируется полупроводниковым детектором. Система обработки сигнала разделяет рентгеновские фотоны по энергиям и, таким образом, получается полный спектр, по которому судят об элементном составе образца-мишени. Если на внешней оболочке атома элемента (например, Са) два электрона, на спектре появляются две близких по длине волны. Проведено изучение содержания 8-и макроэлементов (углерода, азота, кислорода, натрия, магния, фосфора, серы, кальция) и микроэлемента (кремния) (Фиг. 6)
Исследование образца «Эмаль 10.05.18»
Выполненное гистологическое исследование образца с окраской гематоксилином-эозином, представленное на Фиг. 5, показало наличие комплекса из эмали и дентина с окружающими тканями под капсулой почки. Эмаль базофильная, с одной стороны ограничивает щелевидную полсть, с другой - тесно связана с дентином, их соотношение примерно равное. Между ним и тканью почки - фрагмент губчатой костной ткани с костным мозгом между костными балками и полнокровная соединительная ткань, сходная с периодонтальной связкой. Вверху справа - жировая ткань, внизу слева -капсула и часть коркового слоя почки с клубочками, без патологических изменений.
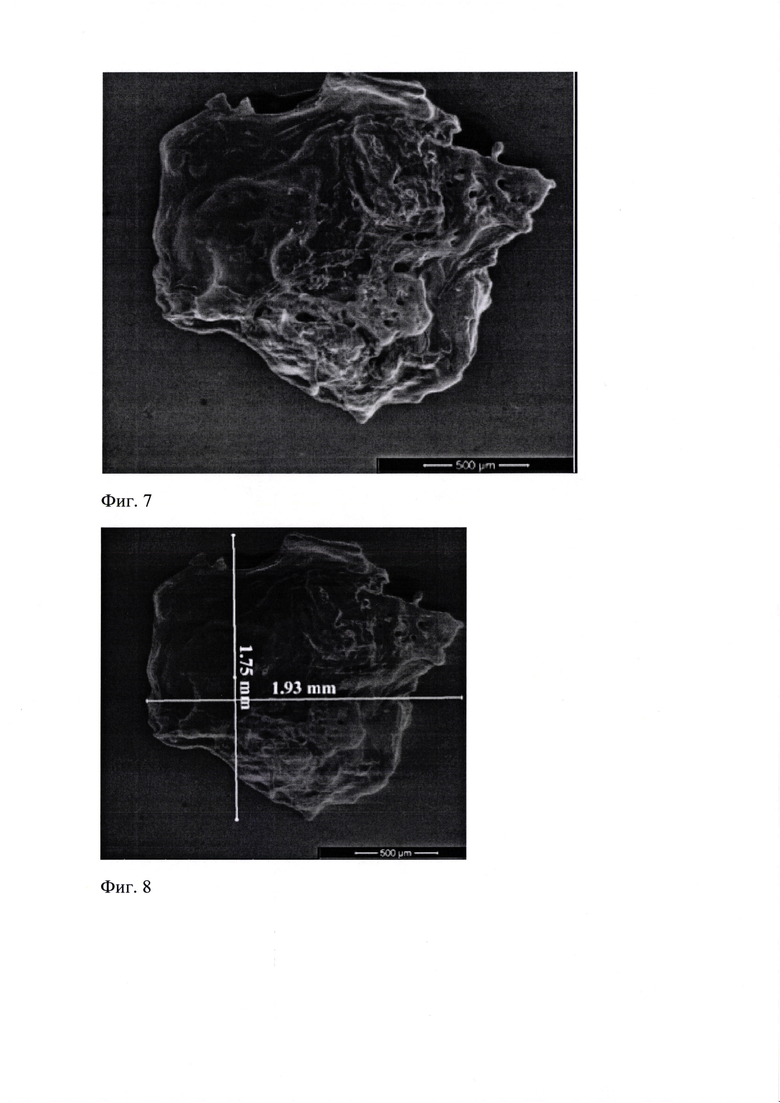
Проведенные исследования образца эмали (Фиг. 7-9) показали, что поверхность образца, размерами 1,93 на 1,75 мм, неоднородная, с выступающими участками роста округлой формы, представлена эмалью и дентином.
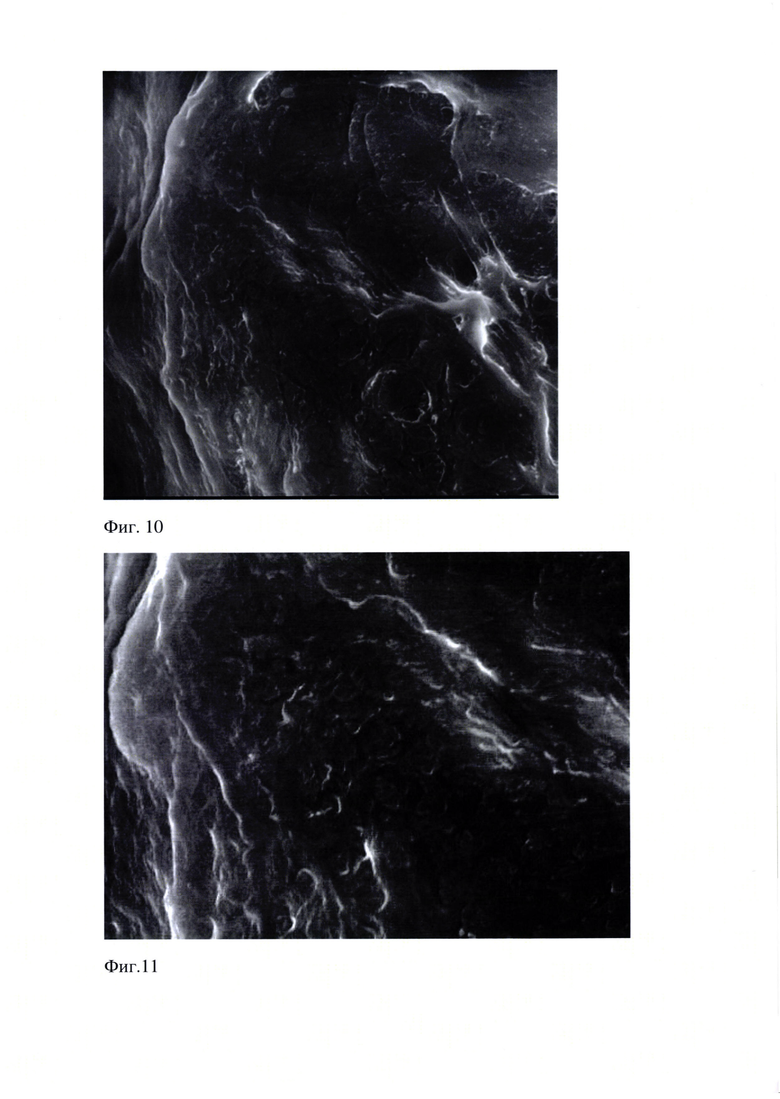
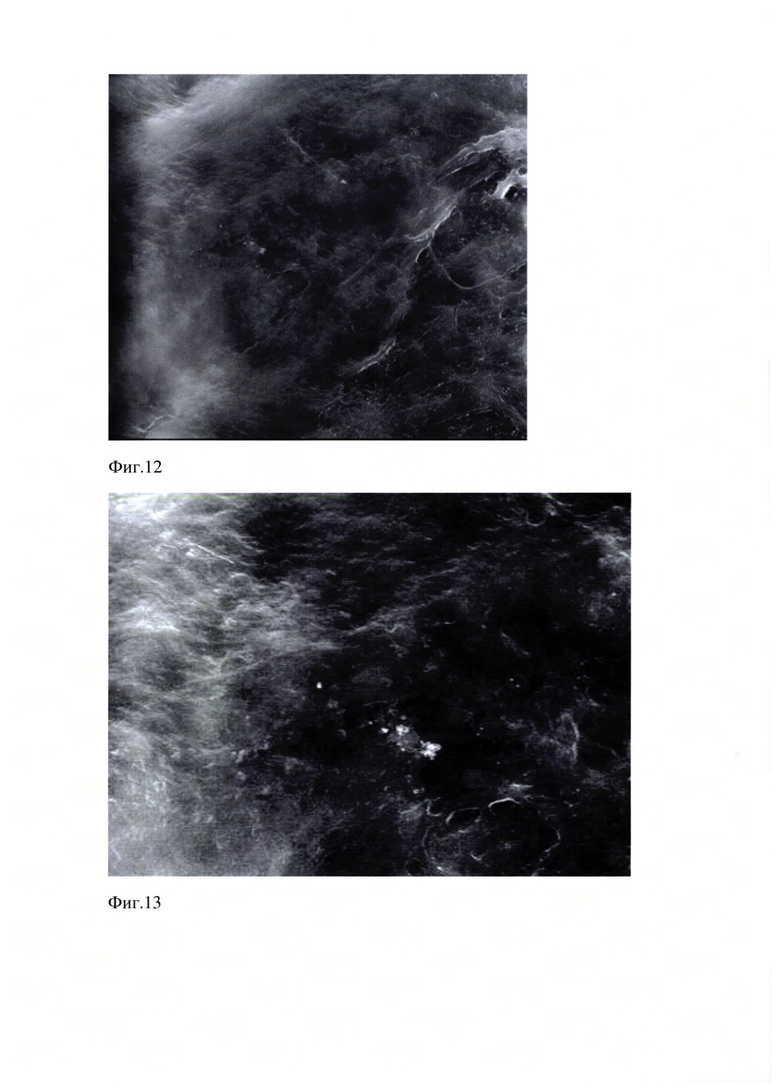
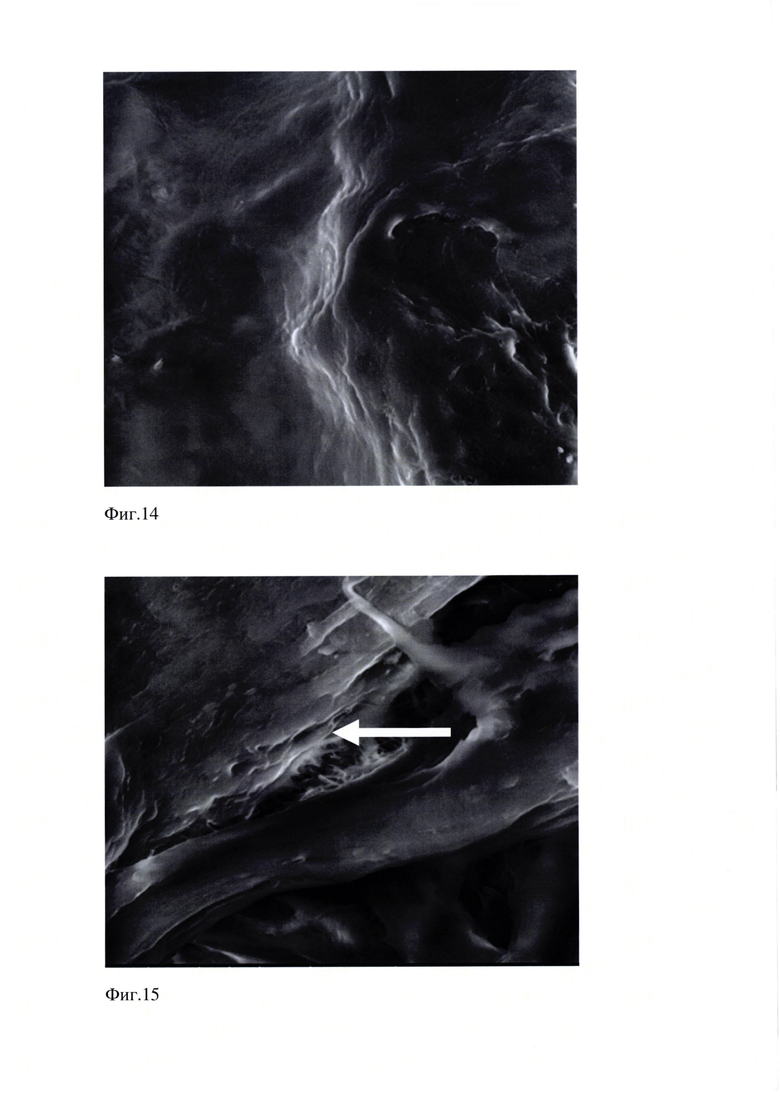
Проведенные исследования образца Фиг. (10-16) эмали показали, что поверхность эмали сглажена, но местами неровная, в отдельных участках видна относительно правильная ориентация призм.
На Фиг. 16-18 показано, что поверхность образца в области дентина неоднородная, с выступающими участками роста округлой формы. В таких участках наблюдаются структуры, сходные со сформированными сосудами. Они окружены формирующейся костной тканью. В срезе вещество, аналогичное дентину, и представленные в большом количестве дентинные трубочки. Дентин по своему строению напоминает грубоволокнистую костную ткань. Канальцы расположены перпендикулярно поверхности и выглядят темными отверстиями на сером фоне интертубулярного дентина. Формирующиеся канальцы в форме неправильного овала, различного диаметра 25,8±5,3 мкм (Фиг. 16), с белым венчиком более минерализованного дентина (Фиг. 18).
Представленные результаты гистологического исследования (Фиг. 5) и данные электронной микроскопии (Фиг. 10-16) согласуются с гистологической структурой и известными данными электронной микроскопии о структуре эмали и возможных вариантах ориентации эмалевых призм в эмали естественного происхождения. Биохимический состав эмали образца по наличию основных микро- и макроэлементов также не отличается от эмали естественного происхождения, кроме того соотношение таких основных элементов, как кальций и фосфор в эмали образца соответствует средним значениям известного диапазона (Hwa-Yen Liu, Jiunn-Hsing Chao, Chun-Yu Chuang, Hung-Lin Chiu,Chung-Wei Yang, Yuh-Chang Sun. Study of P, Ca, Sr, Ba and Pb Levels in Enamel and Dentine of Human Third Molars for Environmental and Archaeological Research // Advances in Anthropology 2013. Vol. 3, No. 2, 71-77; Г. Флейшер. Методы обследования пациента на приеме врача-стоматолога. Руководство для врачей // Ridero // 230 с.)
Таким образом, эмаль исследованного образца по гистологическому и биохимическому составу соответствует эмали зуба мыши естественного происхождения.
Краткое описание фигур.
На Фиг. 1. представлено фото выделенных зачатков зуба мыши генетической линии C57/BL6 (срок развития эмбрионов мыши 14,5 ED).
На Фиг. 2 представлено фото отделения эпителиальной части зачатка зуба (срок развития эмбриона 14,5 ED) и связанные с ним небольшие фрагменты мезенхимальной ткани.
На Фиг. 3 представлено фото эпителиальной части зачатка зуба в капле коллагена.
На Фиг. 4 представлено фото внешнего вида выделенной почки, под капсулой которой в течение 10 недель находился имплантированный образец.
На Фиг. 5 представлено изображение образца «Эмаль в почке». Эмаль базофильная, с одной стороны ограничивает щелевидную полость, с другой - тесно связана с дентином, их соотношение примерно равное. Между ним и тканью почки - фрагмент губчатой костной ткани с костным мозгом между костными балками и полнокровная соединительная ткань, сходная с периодонтальной связкой. Вверху справа - жировая ткань, внизу слева - капсула и часть коркового слоя почки с клубочками, без патологических изменений. Окраска гематоксилином и эозином, х 120.
На Фиг. 6 представлено изображение результатов электронно-микроскопического исследования образца «Эмаль 10.05.18» с микроспектальным анализом образца. Проанализировано содержание 8-и макроэлементов (углерода, азота, кислорода, натрия, магния, фосфора, серы, кальция) и микроэлемента (кремния). Если на внешней оболочке атома элемента (например, Са) два электрона, на спектре появляются две близких по длине волны. Микроспектральный анализ образца. Детектор интегрирован с растровым электронным микроскопом «Quanta 600 FEG».
На Фиг. 7 представлено изображение образца «Эмаль 10.05.18». Поверхность образца, размерами 1,93 на 1,75 мм, неоднородная, с выступающими участками роста округлой формы, представлена эмалью и дентином. Растровая электронная микроскопия. Увеличение 130 x (WD 11.1 мм, spot 5.0, det LFD, HV 20.00 kV, x:11.7430 мм, у: 3.0853 мм, Quanta 600 FEG).
На Фиг. 8 представлено изображение образца «Эмаль 10.05.18». Поверхность образца, размерами 1,93 на 1,75 мм, неоднородная, с выступающими участками роста округлой формы, представлена эмалью и дентином. Растровая электронная микроскопия. Увеличение 130 х (WD 11.2 мм, spot 5.0, det LFD, HV 20.00 kV, x: 11.7210 мм, у: 3.0928 мм, Quanta 600 FEG).
На Фиг. 9 представлено изображение образца «Эмаль 10.05.18». Поверхность образца, размерами 1,93 на 1,75 мм, неоднородная, с выступающими участками роста округлой формы, представлена эмалью и дентином. Растровая электронная микроскопия. Увеличение 130х (WD 11.1 мм, spot 5.0, det LFD, HV 20.00 kV, x: 11.7430 мм, у: 3.0853 мм, Quanta 600 FEG. Шкала 500 мкм.).
На Фиг. 10 представлено изображение образца «Эмаль 10.05.18». Поверхность эмали сглажена, но местами неровная, в отдельных участках видна относительно правильная ориентация призм. Растровая электронная микроскопия. Увеличение 4000 х. (WD 11.4 мм, spot 5.0, det LFD, HV 20.00 kV, x: 11.8805 мм, y: 3.7098 мм, Quanta 600 FEG. Шкала 20 мкм).
На Фиг. 11 представлено изображение образца «Эмаль 10.05.18». Поверхность эмали сглажена, но местами неровная, в отдельных участках видна относительно правильная ориентация призм. Растровая электронная микроскопия. Увеличение 8000х (WD 11.4 мм, spot 5.0, det LFD, HV 20.00 kV, x: 11.8805 мм, y: 3.7098 мм, Quanta 600 FEG. Шкала 20 мкм).
На Фиг. 12 представлено изображение образца «Эмаль 10.05.18». Поверхность эмали сглажена, но местами неровная, в отдельных участках видна относительно правильная ориентация призм. Растровая электронная микроскопия. Увеличение 4000 х (WD 11.4 мм, spot 5.0, det LFD, HV 20.00 kV, x: 11.6898 мм, y: 3.6615 мм, Quanta 600 FEG Шкала 20 мкм).
На Фиг. 13 представлено изображение образца «Эмаль 10.05.18». Поверхность эмали сглажена, но местами неровная, в отдельных участках видна относительно правильная ориентация призм. Растровая электронная микроскопия. Увеличение 8000 х (WD 11.4 мм, spot 5.0, det LFD, HV 20.00 kV, x: 11.6898 мм, y: 3.6615 мм, Quanta 600 FEG. Шкала 20 мкм).
На Фиг. 14 представлено изображение образца «Эмаль 10.05.18». Поверхность эмали сглажена, но местами неровная, в отдельных участках видна относительно правильная ориентация призм. Растровая электронная микроскопия. Увеличение 82000 х (WD 11.4 мм, spot 5.0, det LFD, HV 20.00 kV, x: 11.8523 мм, у: 3.7243 мм, Quanta 600 FEG. Шкала 50 мкм).
На Фиг. 15 представлено изображение образца «Эмаль 10.05.18». Поверхность эмали сглажена, но местами неровная, в отдельных участках видна относительно правильная ориентация призм. Стрелка показывает границу эмали. Растровая электронная микроскопия. Увеличение 4000 х, WD 11.3 мм, spot 5.0, det LFD, HV 20.00 kV, x: 11.3938 мм, у: 2.8835 мм, Quanta 600 FEG. Шкала 20 мкм
На Фиг. 16 представлено изображение образца «Эмаль 10.05.18». Поверхность образца в области дентина неоднородная, с выступающими участками роста округлой формы. Формирующиеся канальцы в форме неправильного овала, различного диаметра 25,8±5,3 мкм. Увеличение 260 х (WD 11.2 мм, spot 5.0, det LFD, HV 20.00 kV, x: 12.2890 мм, у: 3.3220 мм, Quanta 600 FEG. Шкала 400 мкм).
На Фиг. 17 представлено изображение образца «Эмаль 10.05.18». Поверхность образца в области дентина неоднородная, с выступающими участками роста округлой формы. Формирующиеся канальцы в форме неправильного овала. Увеличение 1000 х (WD 11.2 мм, spot 5.0, det LFD, HV 20.00 kV, x: 12.0723 мм, у: 3.0385 мм, Quanta 600 FEG. Шкала 100 мкм)
На Фиг. 18 представлено изображение образца «Эмаль 10.05.18». Поверхность образца в области дентина неоднородная, с выступающими участками роста округлой формы. Формирующиеся канальцы в форме неправильного овала. Увеличение 4000 х (WD 11.3 мм, spot 5.0, det LFD, HV 20.00 kV, x: 12.1065 мм, у: 2.9388 мм, Quanta 600 FEG. Шкала 20 мкм).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЗУБА И ЗУБ, ПОЛУЧЕННЫЙ УКАЗАННЫМ СПОСОБОМ | 2008 |
|
RU2462256C2 |
| Способ индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях путем использования децеллюляризированного матрикса зуба и периодонтальной связки человека | 2022 |
|
RU2813729C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ УТРАЧЕННОГО ЗУБА И СПОСОБ ИЗГОТОВЛЕНИЯ ВОССТАНОВИТЕЛЬНОГО МАТЕРИАЛА | 2009 |
|
RU2521195C2 |
| СПОСОБ СОЗДАНИЯ ЗУБА | 2010 |
|
RU2523559C2 |
| СПОСОБ ФОРМИРОВАНИЯ ЗУБА, ЗУБНОЙ РЯД И СПОСОБ ФОРМИРОВАНИЯ ТКАНИ | 2006 |
|
RU2428140C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИСКУССТВЕННОГО ЗАЧАТКА ЗУБА IN VITRO И ПОЛУЧЕННЫЙ ИМ ИСКУССТВЕННЫЙ ЗАЧАТОК ЗУБА | 2013 |
|
RU2638783C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕЗЕНХИМНОЙ КЛЕТКИ, СПОСОБ ПОЛУЧЕНИЯ ЗУБА И МЕЗЕНХИМНАЯ КЛЕТКА ДЛЯ ФОРМИРОВАНИЯ ЗУБА | 2008 |
|
RU2465325C2 |
| СПОСОБ УЛЬТРАЗВУКОВОЙ ВЕЛОСИММЕТРИИ ДЛЯ ОЦЕНКИ СОСТОЯНИЯ ТВЕРДЫХ ТКАНЕЙ ЗУБОВ | 2022 |
|
RU2790947C1 |
| Тканебиоинженерная конструкция для восполнения объема костной ткани челюстных костей | 2022 |
|
RU2809154C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАРОДОНТИТА | 2010 |
|
RU2440060C1 |





Изобретение относится к медицине, а именно к стоматологии, клеточным биотехнологиям, регенеративной медицине. Выполняют отделение эпителиальной части зачатка зуба от мезенхимы с сохранением фрагмента мезенхимальной ткани. В чашке Петри формируют каплю коллагенового геля объемом 30 мкл, в которую вносят фрагмент ткани - ранее отделенную эпителиальную часть зубного зачатка и фрагмент связанной с ней мезенхимы. Чашку Петри с каплей геля коллагена инкубируют в течение 15 мин при 37°С в инкубаторе в условиях 5% СO2 для затвердевания коллагенового геля. В культуральный планшет вносят полученные из зубного зачатка мезенхимальные клетки. В лунку помещают вставку для клеточной культуры с диаметром пор 0,4 мкм, на которую с помощью пинцета переносят сформированную каплю коллагенового геля с эпителиальной тканью из зубного зачатка, связанную с фрагментом мезенхимальной ткани. Через 14 дней развивающуюся эмаль переносят в биологический реактор - под капсулу почки мыши. По истечении 10 недель проводят выделение почки экспериментального животного, а также выделяют развившуюся эмаль из-под капсулы почки. Способ позволяет получить эмаль, идентичную эмали естественного происхождения по биохимическому и гистологическому строению. 1 пр., 18 ил.
Способ выращивания эмали в эксперименте, заключающийся в культивировании эпителиальной ткани в коллагеновом геле на питательной среде, отличающийся тем, что выполняют отделение эпителиальной части зачатка зуба от мезенхимы с сохранением фрагмента мезенхимальной ткани, после чего в чашке Петри формируют каплю коллагенового геля объемом 30 мкл, в которую вносят фрагмент ткани - ранее отделенную эпителиальную часть зубного зачатка и фрагмент связанной с ней мезенхимы, чашку Петри с каплей геля коллагена инкубируют в течение 15 мин при 37°С в инкубаторе в условиях 5% СO2 для затвердевания коллагенового геля, в культуральный планшет вносят полученные из зубного зачатка мезенхимальные клетки, после чего в лунку помещают вставку для клеточной культуры с диаметром пор 0,4 мкм, на которую с помощью пинцета переносят сформированную каплю коллагенового геля с эпителиальной тканью из зубного зачатка, связанную с фрагментом мезенхимальной ткани, через 14 дней развивающуюся эмаль переносят в биологический реактор - под капсулу почки мыши и по истечении 10 недель проводят выделение почки экспериментального животного, а также выделяют развившуюся эмаль из-под капсулы почки.
| Mirali Panday et al, Enamel biomimetics - fiction of future of dentistry, International Journal of oral science, 2019-01-05 | |||
| Янушевич О.О., Малышев И.Ю., Тканевая инженерия зуба: направления развития, достижения и нерешенные проблемы, Стоматология, 2017, 96, 4, 72-79 | |||
| СПОСОБ ПОЛУЧЕНИЯ МЕЗЕНХИМНОЙ КЛЕТКИ, СПОСОБ ПОЛУЧЕНИЯ ЗУБА И МЕЗЕНХИМНАЯ КЛЕТКА ДЛЯ ФОРМИРОВАНИЯ ЗУБА | 2008 |
|
RU2465325C2 |
| US 20130109093 A1 (ORGAN | |||
Авторы
Даты
2020-03-11—Публикация
2019-02-15—Подача