Изобретение относится к области тканевой инженерии, а именно к биоинженерным конструкциям, включающим девитализированный и/или децеллюляризированный внеклеточный матрикс (англ. extracellular matrix, ЕСМ), продуцированный и собранный клетками организма, который при культивировании в условиях трехмерного пространства (3D) в полученных от человека и заселивших этот матрикс клетках индуцирует дифференцировку в нужные типы клеток.
Объект настоящего изобретения имеет отношение к дисциплинам тканевой инженерии, регенерации ткани и регенеративной медицины, объединяющей методы биоинженерии с принципами наук о жизни для понимания структурных и функциональных связей в нормальных и патологических тканях млекопитающих. Общая цель этих дисциплин - развитие и конечное применение биологических материалов для восстановления, поддержания или улучшения функций ткани. Таким образом, появляется возможность спроектировать и изготовить биоинженерную конструкцию в лаборатории.
Биоинженерная конструкция должна быть функциональной после трансплантации в организм и быть надолго инкорпорирована в организм или постепенно ремоделирована (сделана заново) клетками биоинженерной конструкции или организма реципиента. Выбор носителя/скаффолда является одним из ключевых элементов, от которого во многом зависит конечный успех в реконструкции тканей. Скаффолды обеспечивают не только прикрепление клеток и их рост, но и способствуют формированию необходимой ткани. Выращивание мезенхимальных стволовых клеток (МСК) на скаффолде, который поддерживает формирование и созревание ткани in vitro, является одним из наиболее бурно развивающихся подходов тканевой инженерии. Традиционно для создания биоинженерных конструкций в стоматологии в качестве клеточного материала применяют МСК - плюрипотентные стволовые клетки, обладающие хондрогенной, остеогенной и адипогенной дифференцировкой. В качестве источника таких прогениторных клеток, дифференцирующихся в остеобласты, цементобласты и фибробласты, наиболее часто рассматривают пульпу зуба, апикальный сосочек, периодонтальную связку и выпадающие молочные зубы (Nishimura et al., 2012; Liu et al., 2015). Однако трудности стимуляции экзогенных МСК и контроль их дифференцировки in vivo затрудняют их широкое использование в клинической практике.
Перспективной альтернативой клеточным стратегиям является стимуляция или усиление внутренних механизмов самовосстановления пациента для содействия эндогенного восстановления утраченных/поврежденных тканей (Wang et al., 2018). Эти методы тканевой инженерии in vivo часто называют бесклеточными подходами или эндогенной регенеративной технологией, поскольку они не используют экзогенные источники клеток (Chen et al., 2010b). Основные концепции бесклеточной терапии подчеркивают способность биоактивных материалов стимулировать, усиливать или управлять регенерацией эндогенных тканей. При правильных условиях эндогенные нативные клетки могут быть мобилизованы и стимулированы для образования новых тканей с помощью простого подхода, основанного на биоматериалах (Stevens et al., 2005). Поскольку регенерация тканей, по существу, включает увеличение числа тканеобразующих клеток и реконструкцию каркаса ЕСМ, который поддерживает эти клетки (Vasita, Katti, 2006), бесклеточные подходы направлены на использование подходящего скаффолда для усиления врожденной способности тканей к регенерации (Bu et al., 2010). Благодаря рекрутированию и самонаведению эндогенных МСК множество тканей успешно регенерировали после трансплантации хорошо сконструированных тканеспецифических скаффолдов без использования культивирования МСК (Wu et al., 2018). Успешное проникновение эндогенных резидентных клеток и пребывание их в скаффолде регулируются ответами, генерируемыми окружающей биологической микросредой после имплантации биоматериала, и сами эти ответы во многом зависят от свойств поверхности биоматериалов (Wu et al., 2018).
Децеллюляризованный ЕСМ (dECM) представляет собой ЕСМ, изолированный от тканей и лишенный исходных резидентных клеток; многообещающий естественный биоматериал для тканевой инженерии, предназначенный для поддержки, замены или восстановления поврежденных тканей (Yao et al., 2019). dECM, полученные из нативных тканей, таких как кости, хрящи, кожа и зубные зачатки, или из клеток, таких как остеобласты, хондроциты и МСК, дали обнадеживающие результаты в области регенерации тканей периодонта (Mansour et al., 2017). Например, ЕСМ костной ткани действует как резервуар провоспалительных цитокинов, факторов роста семейства TGF-β, включая несколько BMP, и ангиогенных факторов роста, таких как VEGF, которые необходимы для достижения остеоиндуктивности путем регуляции различных фаз регенерации костной ткани (Papadimitropoulos et al., 2015). Результаты нашего недавнего исследования показали, что dECM зуба индуцирует спонтанную остеогенную дифференцировку клеток надкостницы in vitro (Ivanov et al., 2020). Это позволяет предположить, что dECM является резервуаром факторов, регулирующих рекрутирование и дифференцировку МСК хозяина.
Децеллюляризация определяется как эффективное удаление всего клеточного и ядерного содержимого без отрицательного влияния на состав ЕСМ (Badylak et al., 2009). Сохранение этой наноструктурированной среды и сетчатой структуры из волокнистых и адгезивных белков обеспечивает закрепление клеток и регулирует будущую клеточную активность (Galler et al., 2011). Бесклеточная матрица считается идеальным каркасом для регенерации ткани (Badylak, 2002), а создание бесклеточного каркаса, способного привлекать и поддерживать локальные резидентные клетки, является возможным направлением для инженерии клеточно-дентинной ткани (Galler et al., 2011). Существуют различные подходы к децеллюляризации ЕСМ и, в частности, зуба (Gilpin, Yang, 2017; Porzionato et al., 2018). Продемонстрировано успешное использование децеллюляризированного зуба, а точнее дентальной пульпы, для регенеративной эндодонтии. Третьи моляры были децеллюляризированы тремя различными методами и лучший, по мнению авторов, вариант был рецеллюляризирован стволовыми клетками апикального сосочка с их последующей дифференцировкой в одонтобласто-подобные клетки (Song et al., 2017). В работе Hu с соавторами использовали децеллюляризированный 10% SDS в комбинации с Triton Х-100 матрикс дентальной пульпы свиньи, который был заселен стволовыми клетками пульпы с последующим образованием пульпо-подобной ткани (Ни et al., 2017). Указанный способ децеллюляризации является аналогом и прототипом данного изобретения. Однако dECM в данном изобретении используется не для восстановления тканей пульпы зуба, как в большинстве проводимых работ, а для проспективного восстановления тканей периодонта. Известно изобретение [патент RU 2716594, 13.03.2020], заключающийся в следующем. Корень удаляемого зуба децеллюляризируют путем последовательной обработки раствором 100 мМ ЭДТА-Na2 /10 мМ NaOH в дистиллированной воде в течение суток, 1% водного раствора Triton Х-100 в течение суток, 4.2 мМ раствора хлорида магния, содержащего 20 μg/ml ДНКазы в течение 2-3 часов, промывают эффективным количеством раствора фосфатно-солевого буфера, содержащим смесь антибиотиков - 300 МЕ/мл пенициллина, 300 МЕ/мл стрептомицина и 75 мкг/мл амфотерицина в течение 1 часа. Данное изобретение подразумевает способ децеллюляризации тканей зуба человека, тогда как в представленном изобретении предлагается использовать децеллюляризированные матриксы зуба и периодонтальной связки, полученные схожим способом, для индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях, для чего децеллюляризированные ткани помещают в 3D условия, а именно в коллагеновый гель, имитирующий условия in vivo.
Из документа Д1 (Садовой М.А., Ларионов П.М., Самохин А.Г., Рожнова О.М. Клеточные матрицы (скаффолды) для целей регенерации кости: современное состояние проблемы. "Хирургия позвоночника". 2014;(2):79-86. https://doi.org/10.14531/ss2014.2.79-86) известно, что для реконструкции обширных костных дефектов и регенерации кости используют тканеинженерную стратегию, подразумевающую применение клеточных технологий, а именно использование матриц (скаффолдов), заселенных клетками/МСК, тогда как в заявленном изобретении клетки используются в модели in vitro только для доказательства регенеративного потенциала бесклеточного (децеллюляризированного) матрикса и не подразумевает их использование in vivo, т.е. не предполагает экзогенное введение клеток, таким образом речь идет о бесклеточных технологиях, основанных на стимуляции эндогенных механизмов заживления. В основе концепции бесклеточной терапии лежит способность биоактивных материалов стимулировать, усиливать или управлять регенерацией эндогенных тканей. Успешное проникновение эндогенных клеток и их существование в скаффолде регулируется сигналами, генерируемыми микроокружением, формирующимся после имплантации биоматериала, а сами сигналы во многом зависят от свойств поверхности биоматериалов (Wu et al., 2018). Скаффолды, полученные путем децеллюляризации тканей млекопитающих, не проявляют иммунных ответов и по своей природе содержат тканеспецифические факторы, участвующие в росте и дифференцировке клеток (Parmaksiz et al., 2016), они с успехом используются в исследованиях регенеративной стоматологии (Yao et al., 2019). Кроме того, из документа Д1 (обзора литературы) следует, что для изготовления скаффолдов используют коллаген, тогда как в заявленном изобретении коллагеновый гель не используется для создания скаффолдов, и не подразумевается его использование in vivo, а используется только в модели in vitro исключительно для создания условий подобных in vivo, т.е. создания микроокружения сходного с нативными тканями, показывающий в итоге регенеративный потенциал бесклеточного (децеллюляризированного) матрикса.
Из документа Д2 (Кулаков А.А., Гольдштейн Д.В., Кречина Е.К., Волков А.В., Гаджиев А.К. Регенерация пульпы зуба с использованием аутологичных мезенхимальных стволовых клеток пульпы и обогащенной тромбоцитами плазмы. Стоматология. 2017; 96 (6): 12D16. https://doi.org/10.17116/stomat201796612-16) известно, что авторы для регенерации ткани пульпы в экспериментальной модели частичной резекции пульпы премоляров и моляров миниатюрных свиней использовали аутологичные мультипотентные стромальные клетки пульпы коренных зубов в составе фибриного сгустка (обогащенной тромбоцитами плазмы). В обсуждении авторы, на основании гистологической картины формирование дентиновых мостиков в области регенерации связывают с созреванием функционально активных одонтобластов, не приводя иммуногистохимического подтверждения, тогда как в заявленном изобретении используется специфический маркер одонтобластной дифференцировки - сиалофосфопротеин дентина (DSPP). Кроме того, используемый авторами в документе Д2 способ регенерации in vivo подразумевает использование стволовых/прогениторных клеток (СПК), тогда как в заявленном изобретении клетки используются в модели in vitro только для доказательства регенеративного потенциала бесклеточного (децеллюляризированного) матрикса и не подразумевает их использование in vivo, т.е. не предполагает экзогенное введение клеток, таким образом речь идет о бесклеточных технологиях, основанных на стимуляции эндогенных механизмов заживления. Из литературных данных известно, что наработка СПК ex vivo и их использование in vivo создают большие технические трудности, которые препятствуют клиническому внедрению и коммерческому развитию клеточных технологий (Wang et al., 2018). В связи с этим перспективной альтернативой клеточным технологиям является стимуляция или усиление внутренних механизмов пациента для эндогенного восстановления утраченной/поврежденной кости (Chen et al., 2010а; Wang et al., 2018). Кроме того, из документа Д2 следует, что по данным литературы подкожная трансплантация клеток пульпы, иммобилизованных на скаффолдах и помещенных во фрагмент депульпированного зуба, приводит к формированию ткани схожей с соединительной тканью пульпы, тогда как в заявленном изобретении речь не идет о лечении пульпитов, речь идет о восстановлении периодонтальных (опорных) тканей зуба, т.е. периодонтальной связки, дентина и альвеолярной кости.
Заболевания периодонта - это хроническое воспалительное состояние тканей периодонта, вызванное преимущественно колонизацией грамотрицательными бактериями. В очаге поражения пародонтитом хроническое воспаление в течение длительного времени приводит к прогрессирующему разрушению опорных тканей зуба, и в конечном итоге пораженные зубы удаляются из-за утраты опорных тканей (Hughes et al., 2010).
Конечной целью лечения заболеваний периодонта является восстановление утраченных тканей периодонта, включая цемент, периодонтальную связку и альвеолярную кость. Для этого требуется формирование цемента и альвеолярной кости, функционально связанных с периодонтальной связкой. Традиционные регенеративные подходы направлены на стимулирование роста и дифференцировки резидентных в ткани клеток-предшественников в фибробласты, цементобласты и остеобласты, предотвращая при этом прорастание эпителиальных тканей в периодонтальный дефект. Этот подход, называемый направленной регенерацией тканей, представляет собой применение барьерных мембран с биоактивными молекулами или без них, таких как производные эмалевого матрикса и рекомбинантные факторы роста (Han et al., 2014). Кроме того, аутогенная кость или заменители кости аллогенного, ксеногенного или аллопластического происхождения могут применяться в качестве скаффолда для роста и миграции клеток. Эти вмешательства доказали свою клиническую эффективность. Однако большая разнородность исследований подтверждает непредсказуемость методов лечения, и ни один из существующих вариантов лечения не обеспечивает полной регенерации периодонта (Yamada et al., 2022). Тем временем концепция биомиметиков была использована при изготовлении тканевых инженерных конструкций для регенерации тканей периодонта. Несмотря на большие различия между исследованиями, большинство концепций проектирования сходятся в воспроизведении иерархической организации нативных тканей периодонта, особенно ЕСМ, структурно и функционально в условиях ex vivo (Yamada et al., 2022). Каркасы, таким образом, служат ядром тканевой инженерии, потому что они обеспечивают 3D структурную поддержку и пространственное направление для клеток.
В большинстве случаев способность к регенерации пораженной ткани довольно слабая, и потерянный/поврежденный периодонт может не восстановиться (Xu et al., 2019). Сверхмасштабный дефект и нарушение регенеративной способности, вызванные старением и другими системными заболеваниями, также дополняют локальное воспалительное микроокружение. Использование эндогенных стволовых клеток для дефектных участков посредством взаимодействия клеток с материалом in vivo является первой целью эндогенной регенеративной медицины. Основываясь на этой концепции, несколько скаффолдов в сочетании с факторами роста, антителами и лекарствами были разработаны и применены для улучшения самонаведения клеток и регенерации тканей (Xu et al., 2019).
Более того, dECM, который сохраняет структурные компоненты нативной ткани и содержит множество разнообразных сигналов и факторов роста, также может рекрутировать эндогенные стволовые клетки в место имплантации/трансплантации и управлять их дифференцировкой (Agmon, Christman, 2016). По сравнению с искусственными материалами нативные матрицы вызывают меньше воспалительных реакций и делают терапию более безопасной и более эффективной (Parmaksiz et al., 2016). Фактически, многие биоматериалы или их модифицированные формы уже проложили путь для клинической регенерации пародонта. Создание более специфических конструкций или включение выбранных факторов самонаведения в значительной степени увеличило бы их способность рекрутировать клетки-хозяева и, таким образом, дополнительно индуцировать регенерацию эндогенной ткани (Xu et al., 2019).
Все чаще признается, что микроокружение, которое действует как «почва», оказывает огромное влияние на эндогенные МСК, особенно при патологических состояниях. В патологических условиях микроокружения выживаемость и функции эндогенных МСК нарушаются, что приводит к снижению способности к регенерации. Принимая во внимание этиологическую роль дисфункции МСК, вызванной патологическим микроокружением, в заболеваниях костей и зубов, многообещающей стратегией для облегчения эндогенного восстановления костей и зубов на основе МСК является манипулирование микроокружением стволовых клеток, что является менее дорогим и трудоемким и позволяет избежать хирургической травмы и риска отторжения (Ho-Shui-Ling et al., 2018).
Монослойная (2D) культура клеток лежит в основе современных научных знаний в области клеточной биологии, молекулярной биологии, дифференцировки стволовых клеток, морфогенеза тканей и других процессов. Однако, в монослойной (2D) культуре невозможно реконструировать то микроокружение клетки, которое существует in vivo, и, таким образом, поддерживать функции дифференцированных клеток. Методы культивирования клеток в 3D условиях способны устранить ограничения, свойственные 2D культурам. 3D системы включают в себя многочисленные, динамично взаимодействующие типы клеток и тканей, механические компоненты среды и биохимическое микроокружение. Каждый тип клеток in vivo находится в различном 3D микроокружении. Ниша стволовых клеток тоже трехмерная, и ее биохимия и топология сильно влияют на процесс дифференцировки клеток. Использование природных биополимеров в создании биоинженерных конструкций позволяет максимально имитировать строение и свойства тканей и органов, а также создавать микроокружение со структурой, близкой к строению природных клеточных ниш. Это позволяет достигать эффективного заселения таких искусственных ниш стволовыми клетками и способствовать их практически полной дифференцировке в нужные типы клеток.
Учитывая, что скаффолды действуют как ниши для заселяемых клеток, модификация скаффолдов на основе биоматериалов для воссоздания специфической микросреды рассматривается как перспективный подход для восстановления функций эндогенных стволовых клеток (Ho-Shui-Ling et al., 2018).
Для разработки технологии лечения парадонтита заявителями разработан способ использования комплекса децеллюляризированных тканей зуба и периодонтальной связки человека (далее скаффолды) для тестирования in vitro или для трансплантации субъекту с целью восстановления тканей периодонта. Скаффолды из dECM зуба и периодонтальной связки имеет архитектонику, обеспечивающую надежную адгезию стволовых и прогениторных клеток, их пролиферацию и дифференцировку. В биоинженерной конструкции скаффолды в условиях 3D культивирования индуцируют дифференцировку МСК и прогениторных клеток надкостницы и периодонтальной связки.
Техническим результатом данного изобретения является создание способа индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях путем использования децеллюляризированного матрикса зуба и периодонтальной связки человека.
Ниже приводится обоснование для осуществления настоящего изобретения.
Скаффолды произведены и самособраны клетками организма человека с учетом особенностей окружающих тканей без необходимости в дополнении экзогенными компонентами ЕСМ. Скаффолды, полученные таким образом, могут использоваться для тестирования in vitro или для трансплантации субъекту.
Изобретение представляет собой биоинженерную конструкцию, включающую эндогенно продуцированные и децеллюляризированные ЕСМ/скаффолды и полученные от человека без химически неопределенных или отличных от человеческих биологических компонентов клетки, заселяющие эти dECM/скаффолды.
В предпочтительном способе изобретения биоинженерная конструкция из dECM/скаффолдов зуба и периодонтальной связки и культивированных МСК и прогениторных клеток периодонтальной связки и надкостницы помещается в 3D микроокружение из плотного, прозрачного коллагенсодержащего гидрогеля. Стандартные методы иммуногистохимии показали, что клетки в биоинженерной конструкции положительно окрашивается на остеопонтин (OPn), остеокальцин (OCn), а также DSPP. Наличие указанных компонентов в полностью сформированной культивированной биоинженерной конструкции указывает на то, что конструкция обладает структурными и биохимическими особенностями, приближающимися к таковым особенностям нормальных тканей периодонта. В данном способе биоинженерная конструкция, имеющая маркеры, характерные тканям периодонта человека, заселена культивированными МСК и прогениторными клетками периодонтальной связки и надкостницы в условиях, достаточных для индуцирования одонтогенной и остеогенной дифференцировки.
Таким образом, способ индукции спонтанной одонтогенной и остеогенной дифференцировки МСК и прогениторных клеток периодонтальной связки и надкостницы существующего изобретения включает: (а) децеллюляризацию тканей, содержащих компоненты матриксов, синтезированные эндогенными клетками зуба и периодонтальной связки; (b) культивирование двух типов клеток (МСК и прогениторных клеток надкостницы и периодонтальной связки); (с) использование гидрогеля для создания 3D микроокружения клеткам стадии (b) для их дифференцировки в нужные типы клеток в биоинженерной конструкции, включающей скаффолды и клетки, в котором стадии (а) и (b) могут осуществляться одновременно или последовательно.
Осуществление изобретения проиллюстрировано, но не ограничено, следующими примерами.
Пример 1. Забор и децеллюляризация тканей зуба человека и периодонтальной связки.
Удаление зубов пациентов (1-2 моляры) проводили в плановом порядке по медицинским показаниям. С удаленных зубов пациентов, при соблюдении асептики и антисептики, удаляли периодонтальную связку с окружающей ее тканью, скальпельным лезвием нарезали полоски, толщиной 0.5-0.7 мм. У удаленных зубов пациентов удаляли коронку, оставляя фрагменты зубов без эмали, из которых формировали зубную крошку (2-3 мм) для проведения децеллюляризации. Децеллюляризация ЕСМ по изобретению означает удаление клеток из ЕСМ таким образом, что клетки и остатки клеток удаляются из ЕСМ, с целью получения ЕСМ без клеток, которые его произвели. Другими словами, продуцирующие матрикс клетки, которые производят эндогенные компоненты ЕСМ для формирования биоинженерных конструкций удаляются из ЕСМ. После удаления клеток матрикс, эндогенно продуцированный клетками, остается, но не содержит тех клеток, которые его сформировали. В данном способе изобретения для децеллюляризации ЕСМ используется ряд химических воздействий для удаления клеток, остатков клеток и остаточных клеточных ДНК и РНК. Зубная крошка и фрагменты периодонтальной связки сначала обрабатываются контактированием с эффективным количеством хелатирующего агента, предпочтительно физиологически щелочного для контролируемо ограниченного набухания клеточного матрикса. Хелатирующие агенты усиливают удаление клеток, клеточного детрита и структур базальной мембраны из матрикса, уменьшая концентрацию двухвалентных катионов. Хелатирующий агент, этилендиаминтетрауксусная кислота (ЭДТА) и его натриевая соль ЭДТА-Na2 представляют собой предпочтительные хелатирующие агенты и могут быть сделаны более щелочными посредством добавления гидроксида натрия (NaOH). Концентрации ЭДТА или ЭДТА-Na2 предпочтительно находятся в диапазоне от приблизительно 50 до приблизительно 150 мМ. Предпочтительная концентрация NaOH находится в диапазоне от 0.001 до 0.10 М, наиболее предпочтительно приблизительно 0.01 М. Конечный рН основного хелатирующего раствора должен быть предпочтительно от приблизительно 11.1 до 11.8. В наиболее предпочтительном варианте зубная крошка и фрагменты периодонтальной связки контактируют с раствором 100 мМ ЭДТА-Na2/10 мМ NaOH в дистиллированной воде. Зубная крошка и фрагменты периодонтальной связки контактируют с щелочным хелатирующим агентом путем погружения в него, однако более эффективная обработка получается нежным взбалтыванием крошки/фрагментов ткани и раствора вместе в течение эффективного для обработки времени (в течение суток).
Для дополнительного разрушения мембран и солюбилизации мембранных белков и экстракции ДНК используется 1% водный раствор Triton Х-100 в течение суток. Конечный рН раствора, содержащего поверхностно-активное вещество, должен быть предпочтительно от приблизительно 7.1 до 8.0.
Кроме того, зубная крошка и фрагменты периодонтальной связки контактируют с эффективным количеством кислого раствора, предпочтительно содержащего соли для удаления нуклеиновых кислот, таких как ДНК и РНК. Соли, которые могут использоваться, являются предпочтительно неорганическими хлористыми солями, такими как хлорид натрия (NaCl) или хлорид магния (MgCl2). Предпочтительно хлориды используются в концентрации от приблизительно 1 до приблизительно 5 мМ, наиболее предпочтительно от 3.75 до приблизительно 4.5 мМ. В способе изобретения использован 4.2 мМ хлорид магния (MgCl2), содержащий раствор ДНКазы (20 μg/ml). Зубная крошка и фрагменты периодонтальной связки контактируют предпочтительно погружением в кислотный/солевой раствор, при этом эффективная обработка достигается при осторожном взбалтывании зубной крошки и фрагментов периодонтальной связки вместе с раствором в течение времени, эффективного для обработки (2-3 часа).
Кроме того, зубная крошка и фрагменты периодонтальной связки промывают эффективным количеством раствора фосфатно-солевого буфера (ФСБ), который предпочтительно буферизован до приблизительно физиологического рН. Буферный раствор соли нейтрализует материал, в то же время уменьшая его набухание. Зубную крошку и фрагменты периодонтальной связки погружают в буферный раствор, при этом эффективная обработка достигается при осторожном взбалтывании зубной крошки и фрагмента периодонтальной связки вместе с раствором в течение времени, эффективного для обработки (в течение 1 часа).
После химической очистки ЕСМ зубной крошки и фрагментов периодонтальной связки ополаскиваются ФСБ, содержащим антибиотики (300 МЕ/мл пенициллина +300 МЕ/мл стрептомицина +75 мкг/мл амфотерицина В) в течение 1 часа и хранятся в свежей порции ФСБ с антибиотиками при -70°С.
Результат децеллюляризации ЕСМ представляет собой эндогенно продуцированные ЕСМ, продуцированные клетками зуба и периодонтальной связки, которые были децеллюляризированы от клеток, которые его произвели.
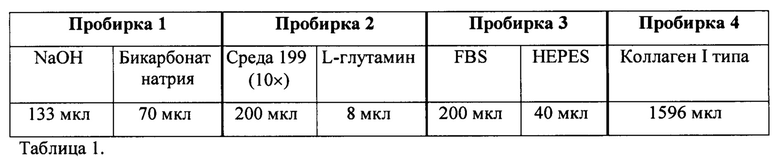
Для контроля децеллюляризации образцы фиксировали в 10% нейтральном формалине, декальцинировали 5%-ной трихлоруксусной кислотой в течение 24 ч, заливали в гистомикс, приготавливали на микротоме серийные срезы и окрашивали их гематоксилин-эозином. Как показал анализ гистологических препаратов с помощью светового микроскопа, полученные скаффолды/dECM зуба состояли из дентина, в котором местами были различимы дентинные канальцы, и покрывающего его снаружи слоя цемента с лакунами на месте удаленных клеток. Скаффолды/dECM периодонтальной связки состояли из волокнистой соединительной ткани. Отсутствие клеток или их остатков в скаффолдах свидетельствовало об эффективности децеллюляризации (фиг. 1).
Децеллюляризированные скаффолды могут использоваться в таком виде, но они также могут быть дополнительно модифицированы химической обработкой, физической обработкой, добавлением других веществ, таких как лекарства, факторы роста, культивируемые клетки, других компонентов матрикса естественного, биосинтетического или полимерного происхождения. Использование децеллюляризированных матриксов одобрено FDA для клинического использования (Heath, 2019).
Пример 2. Оценка индукции спонтанной одонтогенной и остеогенной дифференцировки МСК и прогениторных клеток периодонтальной связки и надкостницы.
1. Выделение МСК и прогениторных клеток.
МСК и прогениторные клетки периодонтальной связки выделяли из периодонтальной связки 1-2 моляров, удаленных в рамках планового ортодонтического лечения с соблюдением стерильных условий. Через 1-2 часа после забора биоптат доставляли в лабораторию в транспортной среде и подвергали ферментной обработке в условиях стерильного бокса. Ткань инкубировали в течение 70 мин при 37°С в растворе, содержащем 2 мг/мл коллагеназы I типа (Gibco, США) и 2 мг/мл диспазы (Gibco). После ферментативной обработки суспензию клеток дважды центрифугировали в течение 10 мин при 600 об/мин в культуральной среде (DMEM, Gibco) и высевали в 6-луночные планшеты для культивирования клеток. Клетки культивировали в ростовой среде DMEM-GlutaMAX (Gibco) с добавлением 15% эмбриональной телячьей сыворотки (англ. fetal bovine serum, FBS, Gibco), 100 ед/мл пенициллина, 100 мг/мл стрептомицина и 2 мМ незаменимых аминокислот (Gibco). По достижении 90-95% конфлуэнтного монослоя клетки снимали 0.25% раствором трипсина в 1 мМ ЭДТА и пересевали в культуральные пластиковые флаконы объемом 25 см2 (Corning) с плотностью 1x105 кл./мл.
МСК и прогениторные клетки надкостницы выделяли из ткани надкостницы альвеолярной кости размером 5x5 мм в рамках планового ортодонтического лечения с соблюдением стерильных условий. Через 1-2 ч после забора биоптат доставляли в лабораторию в транспортной среде и подвергали механической и ферментной обработке в условиях стерильного бокса. После 16-20 ч инкубации в растворе коллагеназы II типа (Sigma, США) измельченный тканевой гомогенат центрифугировали (800 об/мин, в течение 5 мин при t от -18 до -20°С), далее осадок ресуспендировали в ростовой среде DMEM-GlutaMAX (Gibco) с добавлением 10% FBS (Gibco) и антибиотика/антимикотика (Gibco) в стандартной концентрации. Полученную суспензию клеток переносили в культуральные пластиковые флаконы объемом 25 см2 (Corning, США) и культивировали в СО2-инкубаторе при 5% СО2 в течение 10-15 дней до формирования субконфлюэнтного монослоя. Для пассирования использовали смесь растворов 0.25% трипсина и 1 мМ ЭДТА.
2. Оценка клоногенной способности
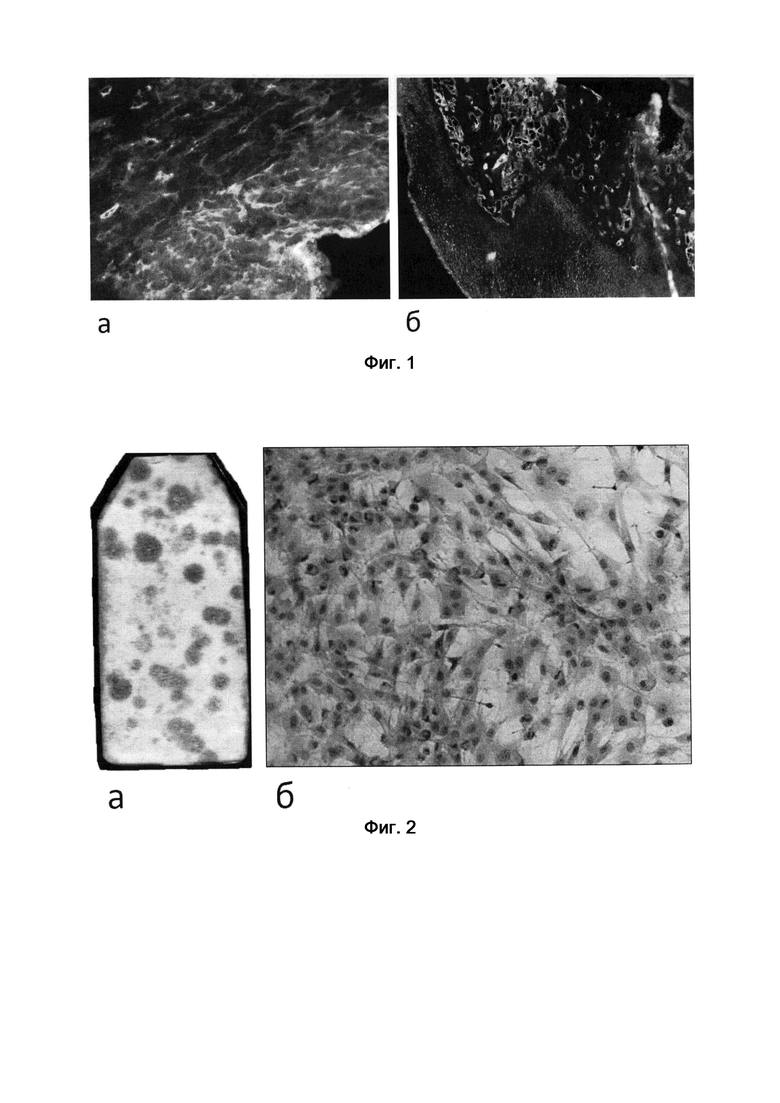
Для оценки способности стромальных клеток к клональному росту, являющейся одной из основных характеристик МСК, использовали первичные культуры клеток надкостницы, посеянных с плотностью 1х106 кл./мл. Через 11-12 сут после посева флаконы с культурами фиксировали 96%-ным спиртом и окрашивали азур-эозином. К этому сроку в культурах присутствовали дискретные макроскопически различимые колонии различной величины, состоящие из фибробластоподобных клеток (фиг. 2). С помощью бинокулярной лупы подсчитывали колонии, содержащие не менее 50 клеток, и определяли эффективность клонирования как число колониеобразующих единиц фибробластов (КОЕ-Ф) на 1x106 посаженных клеток. При трех независимых повторах эксперимента эффективность клонирования клеток надкостницы составила 16,77±1,13, 13,11±0,89 и 16,00±1,19 КОЕ-Ф на 1 млн. клеток.
3. Иммунофенотипическая характеристика клеток
Для подтверждения принадлежности выделенных клеток к категории МСК была выполнена иммуногистохимическая характеристика поверхностных маркеров CD73, CD90 и CD 105, рекомендуемых Международным обществом клеточной терапии для идентификации МСК (Dominici et al., 2006).
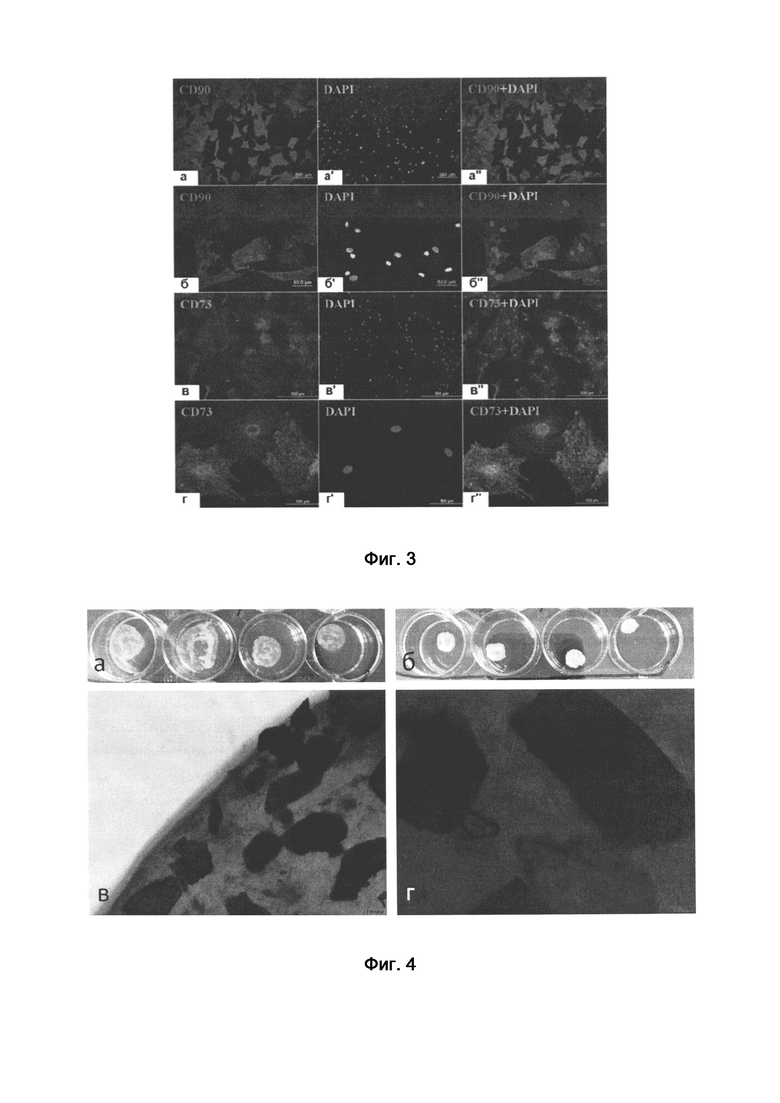
Большинство клеток в культурах клеток надкостницы и периодонтальной связки положительно окрашивались при непрямом иммунофлуоресцентным окрашиванием на CD90, на поверхности большинства из них был также выявлен CD73 и CD 105 с использованием вторых антител, меченных флуорохромом Alexa Fluor 488 или Alexa Fluor 568. Ядра клеток окрашивали Hoechst 33342 или DAPI (фиг. 3).
4. Создание биоинженерных конструкций
Для создания 3D микроокружения клеткам, помещенным в биоинженерную конструкцию, использовали плотные, прозрачные гидрогели, сформированные из коллагена крысы I типа, выделенного из хвостовых сухожилий крысы (Q C11-ACL, ИМТЕК, Россия) по методике описанной ранее (Vorotelyak et al., 2002). Кратко, стерильный 0.34 М раствор NaOH соединяли с 7.5%-ным раствором бикарбоната натрия (Биолот, Россия) (пробирка 1); 10×концентрат питательной среды 199 (Биолот, Россия) соединяли с 3%-ым раствором L-глутамина (Биолот, Россия) (пробирка 2); FBS соединяли с 1 М HEPES (Биолот, Россия) (пробирка 3). В охлажденный раствор коллагена крысы I типа (плотностью 3-5 мг/мл) (пробирка 4), помещенный на лед во избежание быстрого застывания и предотвращения желатинизации, последовательно вносили содержимое пробирок 1, 2 и 3 и перемешивали. В таблице 1 указаны соотношения компонентов для приготовления 2-х мл коллагенового геля, на одну 35-мм чашку Петри (Greiner Bio-One GmbH, Германия). Затем в пробирку 4 последовательно вносили клетки и dECM и тщательно перемешивали. Далее по 1.5 мл гидрогеля с биоинженерной конструкцией переносили в 12-луночные культуральные планшеты (Corning) и помещали в СО2 инкубатор при 37°С.Через 1 ч гель полностью желатинизировался, на следующий день его заливали культуральной средой для МСК (Gibco) и продолжали культивировать в течение 14 сут в СО2 инкубаторе при 37°С со сменой среды через 2-3 сут.
Исследование проводилось отдельно на dECM зубной крошки и периодонтальной связки и при их совместном использовании. Для заселения скаффолдов клетки снимали с флаконов 0.25% раствором трипсина в 1 мМ ЭДТА (Gibco), полученную суспензию клеток подсчитывали, смешивали в соотношении 1 ч клеток периодонтальной связки и 4 ч клеток надкостницы и концентрировали, центрифугируя 5 мин при 1000 об./мин с последующим ресуспендированием осадка в малом количестве среды. На каждый образец скаффолда помещали по 0.5x106 кл. в 100 мкл среды.
5. Гистологический и иммуногистохимический анализ
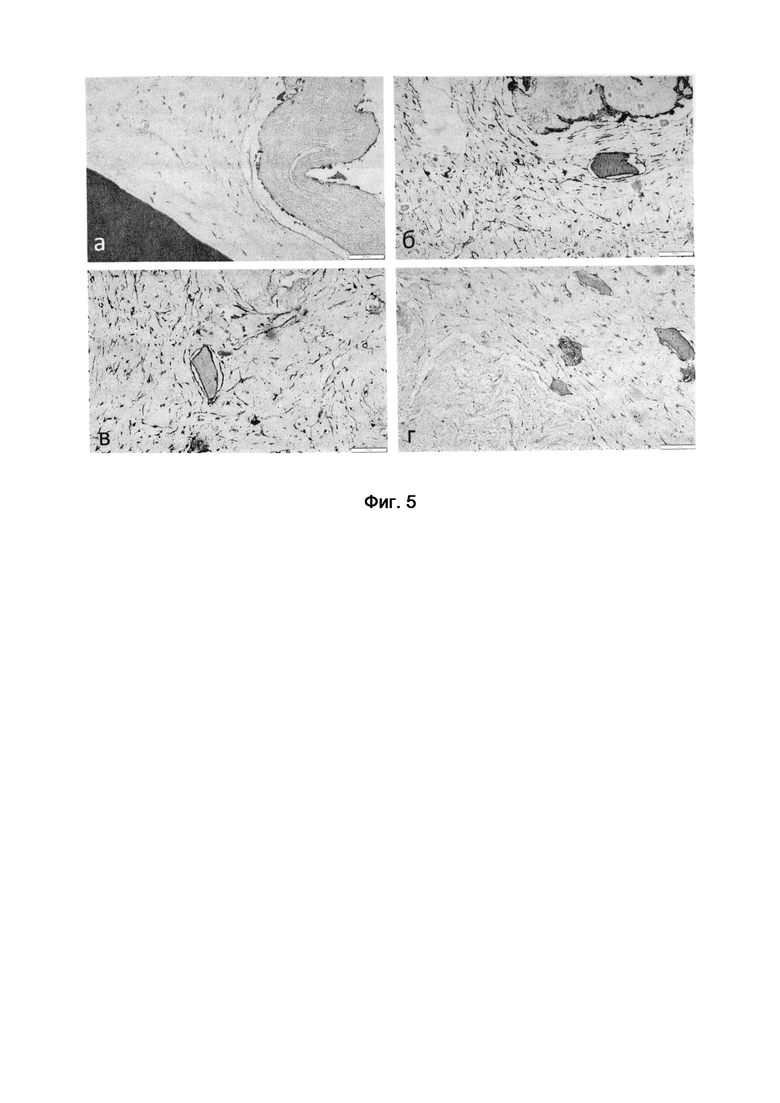
Гистологический анализ показал, что МСК и прогениторные клетки периодонтальной связки и надкостницы активно пролиферируют в коллагеновом гидрогеле и контрактируют его (фиг. 4). МСК и прогениторные клетки способны эффективно заселять поверхности скаффолдов, о чем свидетельствует адгезия клеток и образование ими достаточно плотного слоя на их поверхности (фиг. 5 а).
При этом клетки в коллагеновом гидрогеле при контакте со скаффолдами, демонстрировали интенсивную положительную реакцию на OCn, локализованную преимущественно в связи с клетками, в меньшей степени - в межклеточном веществе (фиг. 5 б) и на OPn (фиг. 5 в). Присутствие этих белков, являющихся специфическими маркерами остеобластов и участвующих в минерализации ЕСМ, свидетельствует о спонтанной реализации остеогенных потенций МСК и прогениторных клеток при 3D культивировании в контакте со скаффолдами. Наряду с этим, часть клеток окрашивалась на DSPP (фиг. 5 г), маркер одонтобластов, что свидетельствует о спонтанной дифференцировки МСК и прогениторных клеток надкостницы и периодонтальной связки в одонтогенном направлении. Хотя считается, что среди всех стволовых клеток зубных тканей одонтогенным потенциалом обладают, в основном, стволовые клетки пульпы зуба (Son et al., 2021), созданное 3D микроокружение индуцирует как остеогенную, так и одонтогенную дифференцировку МСК и прогениторных клеток периодонтальной связки и надкостницы.
Таким образом, результаты гистохимического исследования (реакция на OPn, OCn и DSPP) свидетельствуют, что МСК и прогениторные клетки, культивируемые в коллагеновом гидрогеле, содержащем децеллюляризированные скаффолды зуба и периодонтальной связки в течение 14 дней, способны к спонтанной (без индукторов) дифференцировке в остеогенном и одонтогенном направлениях. Следовательно, биоинженерный комплекс, содержащий децеллюляризированные ткани зуба человека и периодонтальной связки способен модифицировать микроокружение и способствовать спонтанной дифференцировке МСК и прогениторных клеток (экзогенных и эндогенных) в остеогенном и одонтогенном направлениях, что позволяет рассматривать его в виде перспективного материала при лечении пародонтита.
СПИСОК ЛИТЕРАТУРЫ
Кулаков А.А., Гольдштейн Д.В., Кречина Е.К., Волков А.В., Гаджиев А.К. 2017. Регенерация пульпы зуба с использованием аутологичных мезенхимальных стволовых клеток пульпы и обогащенной тромбоцитами плазмы. Стоматология. №96, Т. 6. С. 12-16. https://doi.org/10.17116/stomat201796612-16.
Пат. 2716594 Российская Федерация, МПК А61С 13/00; C12N 1/00 Способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией из децеллюляризированных тканей зуба человека / Иванов А.А., Данилова Т.И., Попова О.П., Латышев А.В.; патентообладатель ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России-№2019120140; Заявлено 27.06.2019; Опубл. 13.03.2020, Бюл. №8 -15 с: 5 ил., 1 табл., 2 пр.
Садовой М.А., Ларионов П.М., Самохин А.Г., Рожнова О.М. 2014. Клеточные матрицы (скаффолды) для целей регенерации кости: современное состояние проблемы. Хирургия позвоночника. №2. С. 79-86. https://doi.Org/10.14531/ss2014.2.79-86.
Agmon G., Christman K.L. 2016. Controlling stem cell behavior with decellularized extracellular matrix scaffolds. Curr. Opin. Solid State Mater. Sci. V. 20. P. 193. 10.1016/j.cossms.2016.02.001.
Badylak S.F. 2002. The extracellular matrix as a scaffold for tissue reconstruction. Semin. Cell Dev. Biol. V. 13. P. 377. 10.1016/S1084952102000940.
Badylak S.F., Freytes D.O., Gilbert T. W. 2009. Extracellular matrix as a biological scaffold material: Structure and function. Acta Biomater. V. 5. P. 1. 10.1016/j.actbio.2008.09.013.
Bu X., Yan Y., Zhang Z., Gu X., Wang M., Gong A., Sun X., Сиг Y., Zeng Y. 2010. Properties of extracellular matrix-like scaffolds for the growth and differentiation of endothelial progenitor cells. J. Surg. Res. V. 164. P. 50. 10.1016/j jss.2009.03.018.
Chen F.M., Zhang J., Zhang M., An Y., Chen F., Wu Z.F. 2010a. A review on endogenous regenerative technology in periodontal regenerative medicine. Biomaterials. V. 31. P. 7892. 10.1016/j.biomaterials.2010.07.019.
Chen F.M., Zhang M., Wu Z.F. 2010b. Toward delivery of multiple growth factors in tissue engineering. Biomaterials. V. 31. P. 6279. 10.1016/j.biomaterials.2010.04.053.
Galler K.M., D'Souza R.N., Federlin M., Cavender A.C., Hartgerink J.D., Hecker S., Schmalz G. 2011. Dentin conditioning codetermines cell fate in regenerative endodontics. J. Endod. V. 37. P. 1536. 10.1016/j.joen.2011.08.027.
Gilpin A., Yang Y. 2017. Decellularization Strategies for Regenerative Medicine: From Processing Techniques to Applications. Biomed Res. Int. V. 2017. P. 1. 10.1155/2017/9831534.
Han J., Menicanin D., Gronthos S., Bartold P. 2014. Stem cells, tissue engineering and periodontal regeneration. Aust. Dent. J. V. 59. P. 117. 10.1111/adj.12100.
Heath D.E. 2019. A Review of Decellularized Extracellular Matrix Biomaterials for Regenerative Engineering Applications. Regen. Eng. Transl. Med. V. 5. P. 155. 10.1007/s40883-018-0080-0.
Ho-Shui-Ling A., Bolander J., Rustom L.E., Johnson A.W., Luyten F.P., Picart C. 2018. Bone regeneration strategies: Engineered scaffolds, bioactive molecules and stem cells current stage and future perspectives. Biomaterials. V. 180. P. 143. 10.1016/j.biomaterials.2018.07.017.
Hu L., Gao Z, Xu J., Zhu Z., Fan Z., Zhang C., Wang J., Wang S. 2017. Decellularized swine dental pulp as a bioscaffold for pulp regeneration. Biomed Res. Int. V. 2017. P. 1. 10.1155/2017/9342714.
Hughes F.J., Ghuman M., Talal A. 2010. Periodontal regeneration: A challenge for the tissue engineer? Proc. Inst. Mech. Eng. Part H J. Eng. Med. V. 224. P. 1345. 10.1243/09544119JEIM820.
Ivanov A.A., Latyshev A.V., Butorina N.N., Domoratskaya E.I., Danilova T.I., Popova O.P. 2020. Osteogenic Potential of Decellularized Tooth Matrix. Bull. Exp.Biol. Med. V. 169. P. 512. 10.1007/s 10517-020-04920-8.
Liu J., Yu F., Sun Y., Jiang В., Zhang W., Yang J., Xu G.-T., Liang A., Liu S. 2015. Concise reviews: Characteristics and potential applications of human dental tissue-derived mesenchymal stem cells. Stem Cells. V. 33. P. 627. 10.1002/stem.l909.
Mansour A., Mezour M.A., Badran Z., Tamimi F. 2017. Extracellular matrices for bone regeneration: A literature review. Tissue Eng. - Part A. V. 23. P. 1436. 10.1089/ten.tea.2017.0026.
Nishimura M., Takase K., Suehiro F., Murata H. 2012. Candidates cell sources to regenerate alveolar bone from oral tissue. Int. J. Dent. V. 2012. P. 1. 10.1155/2012/857192.
Papadimitropoulos A., Scotti C., Bourgine P., Scherberich A., Martin I. 2015. Engineered Decellularized Matrices to Instruct Bone Regeneration Processes. Bone. V. 70. P. 66. 10.1016/j.bone.2014.09.007.
Parmaksiz M., Dogan A., Odabas S., Elgin A.E., Elgin Y.M. 2016. Clinical applications of decellularized extracellular matrices for tissue engineering and regenerative medicine. Biomed. Mater. V. 11.. 10.1088/1748-6041/11/2/022003.
Porzionato A., Stocco E., Barbon S., Grandi F., Macchi V., De Caro R. 2018. Tissue-engineered grafts from human decellularized extracellular matrices: A systematic review and future perspectives. Int. J. Mol. Sci. V. 19.. 10.3390/ijmsl9124117.
Son Y.-B., Rang Y.-K., Lee H.-J., JangS.-J., Bharti D., Lee S.-L., Jeon B.-G., ParkB.-W., Rho G.-J. 2021. Evaluation of odonto/osteogenic differentiation potential from different regions derived dental tissue stem cells and effect of 17p-estradiol on efficiency. BMC Oral Health. V. 21. P. 15. 10.1186/sl2903-020-01366-2.
Song J.S., Takimoto K., Jeon M., Vadakekalam J., Ruparel N.B., Diogenes A. 2017. Decellularized human dental pulp as a scaffold for regenerative endodontics. J. Dent. Res. V. 96. P. 640. 10.1177/0022034517693606.
Stevens M.M., Marini R.P., Schaefer D., Aronson J., Longer R., Shastri V.P. 2005. In vivo engineering of organs: The bone bioreactor. Proc. Natl. Acad. Sci. U. S. A. V. 102. P. 11450. 10.1073/pnas.0504705102.
Vasita R., Katti D.S. 2006. Growth factor-delivery systems for tissue engineering: A materials perspective. Expert Rev. Med. Devices. V. 3. P. 29. 10.1586/17434440.3.1.29.
Vorotelyak E.A., Shikhverdieva A.S., Vasiliev A. V., Terskikh V. V. 2002. Simulation of migration of human epidermal keratinocytes over three-dimensional collagen gel. Biol. Bull. Russ. Acad. Sci. V. 29. P. 24. 10.1023/A:1013233617151.
Wang X., Wang G., Zingales S., Zhao B. 2018. Biomaterials enabled cell-free strategies for endogenous bone regeneration. Tissue Eng. - Part В Rev. V. 24. P. 463. 10.1089/ten.teb.2018.0012.
Wu R.X., Xu X.Y, Wang J., He X.T., Sun H.H., Chen F.M. 2018. Biomaterials for Endogenous Regenerative Medicine: Coaxing Stem Cell Homing and Beyond. Appl. Mater. Today. V. 11. P. 144. 10.1016/j.apmt.2018.02.004.
Xu X.Y, Li X., Wang J., He X.T., Sun H.H, Chen F.M. 2019. Concise Review: Periodontal Tissue Regeneration Using Stem Cells: Strategies and Translational Considerations. Stem Cells Transl. Med. V. 8. P. 392. 10.1002/sctm.l8-0181.
Yamada S., Shanbhag S., Mustafa K. 2022. Scaffolds in periodontal regenerative treatment. Dent. Clin.North Am. V. 66. P. 111. 10.1016/j.cden.2021.06.004.
Yao Q., Zheng Y. W., Lan Q.H, Kou L., Xu H.L., Zhao Y.Z. 2019. Recent Development and Biomedical Applications of Decellularized Extracellular Matrix Biomaterials. Mater. Sci. Eng. С.V. 104. P. 109942. 10.1016/j.msec.2019.109942.
Краткое описание фигур
Фиг. 1. Контроль эффективности децеллюляризации периодонтальной связки (а) и тканей зуба (б). Окраска ядерным красителем DAPI.
Фиг. 2. Колонии стромальных клеток в первичной культуре надкостницы на 11 сут культивирования, а - общий вид культуры, 6 - фрагмент колонии, масштабное увеличение х100. Окрашивание азур-эозином.
Фиг. 3. Поверхностные антигены CD90 (а, б) и CD73 (в, г) в культуре клеток надкостницы 3-го пассажа. Непрямое иммунофлуоресцентное мечение с применением флуорохромов Alexa 568 (а, б) и Alexa 488 (в, г), а'', б'', в'', г'' - совмещение изображений результата иммуномечения и ядер клеток, окрашенных DAPI (а', б', в', г').
Фиг. 4. Контракция коллагенового гидрогеля МСК и прогениторными клетками периодонтальной связки и надкостницы на 3 сут культивирования (а, в) и 10 сут культивирования (б), фазовый контраст (в, г), масштабное увеличение х40 (в), х100 (г) на 3 сут культивирования.
Фиг. 5. Гистологический и иммуногистохимический анализ МСК и прогениторных клеток периодонтальной связки и надкостницы в коллагеновом гидрогеле. МСК и прогениторные клетки периодонтальной связки и надкостницы на поверхности скаффолдов (а). Окрашивание гематоксилин-эозином, масштабное увеличение х200; Иммунопероксидазная реакция на остеокальцин (б), остеопонтин (в) и сиалофосфопротеин десмина (г), масштабное увеличение х200.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией из децеллюляризированных тканей зуба человека | 2019 |
|
RU2716594C1 |
| БИОМАТЕРИАЛ НА ОСНОВЕ БЕСКЛЕТОЧНОГО МАТРИКСА, ПРОИЗВОДИМОГО МЕЗЕНХИМНЫМИ СТРОМАЛЬНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ | 2018 |
|
RU2718907C1 |
| Способ прогнозирования возможного рецидива аденокарциномы поджелудочной железы после ее резекции или воздействия методами локальной деструкции на примере радиочастотной абляции | 2022 |
|
RU2790982C1 |
| Способ создания тканеинженерных конструкций методом биопечати биочернилами для регенерации хрящевой ткани в условиях организма | 2021 |
|
RU2770558C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ИЗ ПУПОВИНЫ ЧЕЛОВЕКА ДЛЯ СОЗДАНИЯ ВЫСОКОРЕГЕНЕРАТИВНОГО РАНЕВОГО ПОКРЫТИЯ | 2022 |
|
RU2795904C1 |
| Способ восстановления функциональных свойств тканеинженерной конструкции диафрагмы | 2017 |
|
RU2654686C1 |
| Способ оценки качества децеллюляризированных матриксов для получения биоинженерных трансплантатов | 2016 |
|
RU2619642C1 |
| ТКАНЕВЫЕ КОНСТРУКЦИИ, ПОЛУЧЕННЫЕ С ПОМОЩЬЮ БИОИНЖЕНЕРИИ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2011 |
|
RU2645473C2 |
| Способ выращивания эмали в эксперименте | 2019 |
|
RU2716485C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ КОСТИ АЛЬВЕОЛЯРНОГО ГРЕБНЯ ЧЕЛЮСТИ И ТКАНЕЙ ПАРОДОНТА С РЕДУЦИРОВАННЫМ РЕГЕНЕРАТОРНЫМ ПОТЕНЦИАЛОМ | 2006 |
|
RU2320285C2 |
Изобретение относится к биоинженерным конструкциям, включающим девитализированный и/или децеллюляризированный внеклеточный матрикс, продуцированный и собранный клетками организма, который при культивировании в условиях 3D-пространства в полученных от человека и заселивших этот матрикс клетках индуцирует дифференцировку в нужные типы клеток. Предложен способ индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях путем использования децеллюляризированных матриксов зуба и периодонтальной связки человека, заселенных клетками, полученными из периодонтальной связки и надкостницы человека, в 3D коллагеновом гидрогеле. Изобретение обеспечивает микроокружение, индуцирующее остеогенную и одонтогенную дифференцировку заселяющих его клеток тканей периодонта с целью замещения утраченных тканей периодонта, способствующее удешевлению биоинженерной конструкции и ускорению сроков заживления. 14 з.п. ф-лы, 5 ил., 1 табл., 2 пр.
1. Способ индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях путем использования децеллюляризированного матрикса зуба и периодонтальной связки человека, который в условиях трёхмерного пространства (3D) индуцирует направленную дифференцировку клеток, полученных от человека и заселивших этот матрикс, и может быть использован в тканевой инженерии и бесклеточной трансплантологии с целью получения тканеинженерной конструкции для исследования клеточных и молекулярных механизмов регенерации тканей периодонта и тестирования лекарств in vitro, а также для индукции регенерации тканей периодонта при парадонтитах, заключающийся в том, что децеллюляризированные матриксы зуба и периодонтальной связки получают девитализирующей обработкой зубной крошки/частиц диаметром 2-3 мм, полученных путем измельчения с помощью электрической мельницы фрагментов зубов с пульпой и цементом, образованных после отделения коронки с эмалью от удаленных в плановом порядке по ортодонтическим показаниям здоровых зубов (1-3 моляров) человека, и фрагментов/полосок толщиной 0.5-0.7 мм периодонтальных связок, отделенных от поверхности средней трети корня зубов человека и нарезанных скальпелем в асептических условиях, путём последовательной обработки раствором 100 мM ЭДТА-Nа2/10 мM NаОН в дистиллированной воде в течение суток, 1% водного раствора Triton Х-100 в течение суток, 4,2 мM раствора хлорида магния (MgCl2), содержащего 20 мкг/мл ДНКазы, при осторожном взбалтывании зубной крошки и фрагментов периодонтальной связки вместе с раствором в течение 2-3 ч, промывают эффективным количеством раствора фосфатно-солевого буфера (ФСБ), содержащего смесь антибиотиков — 300 ME/мл пенициллина, 300 мкг/мл стрептомицина и 75 мкг/мл амфотерицина В, при осторожном взбалтывании зубной крошки и фрагментов периодонтальной связки вместе с раствором в течение 1 часа, часть фрагментов/полосок периодонтальных связок инкубируют при 37°С в течение 70 мин в растворе 2 мг/мл коллагеназы типа и 2 мг/мл диспазы, далее собранные клетки переносят в культуральную среду DMEM, дополненную 5% эмбриональной телячьей сывороткой, и дважды центрифугируют по 10 мин при 600 об/мин и от 18 до 20°С, затем клетки периодотонтальной связки ресуспендируют в полной культуральной среде, состоящей из питательной среды DMEM-GlutaMAX с добавлением 15% эмбриональной телячьей сыворотки, 2 мM незаменимых аминокислот и антибиотиков — 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина, и после пипетирования распределяют в культуральных флаконах без покрытия и культивируют при температуре 37°С и 5% СО2, а периостальную ткань альвеолярной кости человека, полученную в плановом порядке по ортодонтическим показаниям, измельченную ножницами размером 5×5 мм инкубируют при 37°С в течение 16-20 ч в растворе 2 мг/мл коллагеназы II типа, далее раствор пипетируют, гомогенат ткани переносят в культуральную среду DMEM, дополненную 5% эмбриональной телячьей сывороткой, и центрифугируют в течение 5 мин при 800 об/мин и от 18 до 20°C, затем клетки надкостницы ресуспендируют в полной культуральной среде, состоящей из питательной среды DMEM-GlutaMAX с добавлением 10% эмбриональной телячьей сыворотки и антибиотиков-антимикотиков в стандартной концентрации, и после пипетирования распределяют в культуральных флаконах без покрытия и культивируют при температуре 37°С и 5% CO2, клетки периодонтальной связки и надкостницы культивируют до достижения 90-95% конфлюэнтного монослоя и образования первичных культур, затем проводят пассирование клеток первичных культур, используя 0,25% раствор трипсина в 1 мM ЭДТА и субкультивируют в пластиковых культуральных флаконах и в слайд-камерах в плотности 1×105 кл./мл, и в виде суспензии направляют на заселение децеллюляризированных матриксов зуба и периодонтальной связки, причём децеллюляризированные матриксы зуба и периодонтальной связки перед заселением стерилизуют путем последовательного промывания в питательной культуральной среде DMEM с антибиотиками, помещения в 70% спирт на 30 мин, оставления в ламинарном шкафу под ультрафиолетовой лампой в течение 30-40 мин, помещения в питательную культуральную среду DMEM с антибиотиками и заморозки при -20°С, после разморозки децеллюляризированные матриксы зуба и периодонтальной связки переносят в лунки 6-луночного культурального планшета и заливают питательной средой DMEM-GlutaMAX с добавлением 10% эмбриональной телячьей сыворотки и антибиотиков-антимикотиков в стандартной концентрации, далее для заселения клетками децеллюляризированных матриксов в охлажденный раствор коллагена крысы I типа (плотностью 3-5 мг/мл), помещенного на лёд во избежание быстрого застывания и предотвращения желатинизации, последовательно вносят стерильный 0,34 М раствор NаОН с 7,5%-ным раствором бикарбоната натрия, 10× концентрат питательной среды 199 с 3%-ным раствором L-глутамина, эмбриональную телячью сыворотку с 1 М HEPES и перемешивают, затем последовательно вносят суспензию смеси клеток периодонтальных связок и надкостницы (1:4) в конечной концентрации 0.5×106 кл./мл и децеллюляризированные матриксы и тщательно перемешивают, далее по 1,5 мл гидрогеля с биоинженерной конструкцией и клетками переносят в 12-луночные культуральные планшеты и помещают в CO2 инкубатор при 37°С на 17-18 ч, далее гели заливают культуральной средой, состоящей из питательной среды DMEM-GlutaMAX с добавлением 10% эмбриональной телячьей сыворотки и антибиотиков-антимикотиков в стандартной концентрации, и продолжают культивировать в течение 14 сут в CО2 инкубаторе при 37°С со сменой среды через 2-3 сут, далее фиксируют 10% нейтральным формалином и направляют на изучение локализации культивируемых клеток и на иммуногистохимическую (ИГХ) оценку потенциала дифференцировки культивируемых клеток в коллагеновом геле с использованием комбинации децеллюляризированных матриксов зуба и периодонтальной связки.
2. Способ по п. 1, отличающийся тем, что зубную крошку/частицы и фрагменты/полоски периодонтальной связки для девитализирующей обработки помещают в отдельные лунки 6-луночных культуральных планшетов.
3. Способ по п. 1, отличающийся тем, что биоинженерная конструкция представляет собой комбинацию децеллюляризированного матрикса зуба человека и децеллюляризированного матрикса периодонтальной связки человека в объемном соотношении 3:1.
4. Способ по п. 1, отличающийся тем, что для заселения децеллюляризированных матриксов зуба и периодонтальной связки используют клетки периодонтальной связки и надкостницы 3-4 пассажей.
5. Способ no п. 1, отличающийся тем, что суспензию смеси клеток периодонтальной связки и надкостницы предварительно концентрируют путем центрифугирования в течение 5 мин при 1000 об/мин с последующим ресуспендированием осадка в 100 мкл среды.
6. Способ по п. 1, отличающийся тем, что для изучения локализации культивируемых клеток в коллагеновом геле с биоинженерной конструкцией после фиксации его промывают в ФСБ (рН 7,4), декальцинируют с помощью 5%-ной трихлоруксусной кислоты в течение 24 ч, проводят по спиртам с восходящей концентрацией 70, 96 и 100%-ный спирт, заливают в гистомикс, изготавливают гистологические срезы и окрашивают гематоксилином и эозином для световой микроскопии.
7. Способ по п. 1, отличающийся тем, что для контроля эффективности децеллюляризации тканей зуба и периодонтальной связки гистологические срезы децеллюляризированных матриксов, незаселенных культивированными клетками и непомещенных в коллагеновый гель, окрашивают ядерным красителем DAPI.
8. Способ по п. 1, отличающийся тем, что ИГХ оценку потенциала дифференцировки культивируемых клеток в коллагеновом геле с биоинженерной конструкцией проводят методом иммунопероксидазного окрашивания, используя мышиные моноклональные антитела к остеопонтину (OPn), остеокальцину (ОСn) и дентину сиалофосфопротеину (DSPP), а также полимер из набора EnVison FLEX, конъюгированный с пероксидазой хрена (Dako, Дания).
9. Способ по п. 1, отличающийся тем, что культивирование клеток в слайд-камерах проводят в 2-, 4- или 8-луночных слайд-камерах, через 2-3 сут, при достижении клетками субконфлюэнтного слоя, их фиксируют охлажденным ацетоном и направляют на иммуноцитохимическую (ИЦХ) оценку потенциала дифференцировки клеток.
10. Способ по п. 1, отличающийся тем, что ИЦХ оценку потенциала дифференцировки культивированных клеток осуществляют методом иммунофлуоресцентного окрашивания, используя первичные мышиные или кроличьи моноклональные антитела к CD73, CD90 и CD105, вторичные антитела, меченные флуорохромом Alexa Fluor 488 или Alexa Fluor 568, а также ядерные красители Hoechst 33342 или DAPI.
11. Способ по п. 1, отличающийся тем, что для оценки способности культивированных клеток к клональному росту используют первичные культуры клеток, посеянных с плотностью 1×106 кл./мл, которые при достижении 90-95% конфлюэнтного монослоя фиксируют 96% спиртом, окрашивают азур-эозином, и с помощью бинокулярной лупы подсчитывают образовавшиеся колонии, содержащие не менее 50 клеток.
12. Способ по п. 1, отличающийся тем, что используют антибиотики-антимикотики в стандартной концентрации — пенициллин 100 МЕ/мл, стрептомицин 100 мкг/мл и амфотерицин В 25 мкг/мл.
13. Способ по п. 1, отличающийся тем, что децеллюляризированные матриксы зуба и периодонтальной связки после стерилизации для длительного хранения от нескольких дней до нескольких месяцев помещают в питательную культуральную среду DМЕМ с антибиотиками при температуре -70°С.
14. Способ по п. 1, отличающийся тем, что при трансплантации субъекту биоинженерную конструкцию культивируемыми клетками не заселяют.
15. Способ по п. 1, отличающийся тем, что при трансплантации субъекту биоинженерную конструкцию в коллагеновый гель не помещают.
| CN 110616190 A, 27.12.2019 | |||
| TRIVEDI S | |||
| et al., Hydroxyapatite-collagen augments osteogenic differentiation of dental pulp stem cells, Odontology, 2020, vol | |||
| Приспособление для останова мюля Dobson аnd Barlow при отработке съема | 1919 |
|
SU108A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ модулирования для радиотелефона | 1921 |
|
SU251A1 |
| Способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией из децеллюляризированных тканей зуба человека | 2019 |
|
RU2716594C1 |
| КУЛАКОВ А.А | |||
| и др | |||
| Регенерация пульпы зуба с использованием аутологичных мезенхимальных стволовых клеток пульпы и обогащенной тромбоцитами | |||
Авторы
Даты
2024-02-16—Публикация
2022-09-15—Подача