Настоящее изобретение относится к твердому составу для перорального применения, содержащему иринотекан, и способу его получения, и более конкретно к твердому составу для перорального применения, содержащему иринотекан, с улучшенной биологической доступностью и стабильностью, и способу его получения. Предпосылки создания изобретения
Иринотекан, полусинтетический аналог камптотецина, используется в качестве химиотерапевтического средства против рака, в основном против видов метастатического колоректального рака. Иринотекан с химическим названием (S)-4,11-диэтил-3,4,12,14-тетрагидро-4-гидрокси-3,14-диоксо-1Н-пирано[3',4':6,7]-индолизино[1,2-b]хинолин-9-ил-[1,4'-бипиперидин]-1'-карбоксилат имеет структуру, представленную формулой 1.
[Формула 1]
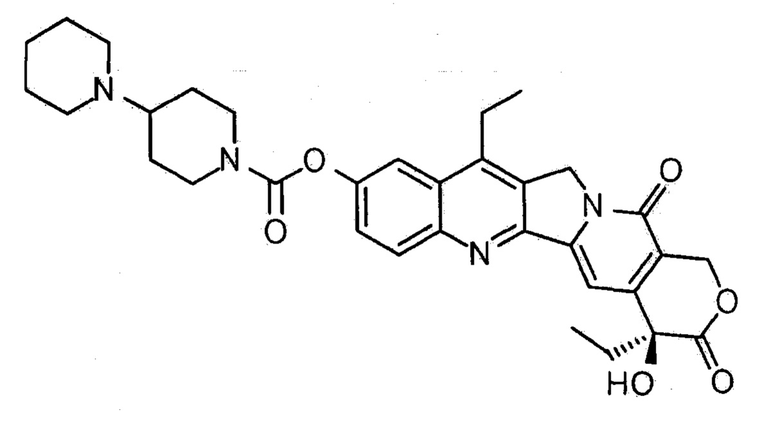
Иринотекан неоднократно исследовали как на доклинических, так и клинических испытаниях. Иринотекан был одобрен Администрацией США по пищевым продуктам и лекарственным веществам (FDA) в качестве терапевтического средства в отношении рака толстой кишки. Иринотекан вызывает противоопухолевую активность в широком ряде различных экспериментальных опухолевых моделей, и был исследован в отношении эффективности, в частности, при раке легкого, раке желудка, раке поджелудочной железы, неходжкинской лимфоме, раке шейки матки, раке головы и шеи, опухоли головного мозга и раке яичников (WO 2001/030351).
Иринотекан представляет собой пролекарство, которое метаболизируется в печени, кишечном тракте и опухолях в активный метаболит SN-38 (7-этил-10-гидроксикамптотецин) карбоксилэстеразами. Эффективность SN-38 столь же сильная, как приблизительно от 100 до 1000 раз иринотекана.
Иринотекан имеет побочные эффекты, такие как тяжелая форма диареи и чрезмерное подавление иммунной системы. Диарея, вызванная иринотеканом, часто может приводить к тяжелой дегидратации, требующей госпитализации или интенсивной терапии. Иммуносупрессия, вызванная иринотеканом, может резко снизить количество лейкоцитов в крови, в частности, количество нейрофилов.
Эффективность иринотекана зависит от режима дозировки. Известно, что долгосрочная более низкая доза является более эффективной и менее токсичной по сравнению с краткосрочной более высокой дозой для иринотекана. Эффективным долгосрочным воздействием иринотекана является пероральное введение с более высокой скоростью метаболизма общего иринотекана до общего SN-38 при пероральном введении, чем при внутривенном (ВВ) введении. Следовательно, существует потребность в разработке составов на основе иринотекана для перорального применения и, в частности, составов на основе иринотекана для перорального применения, которые могут обеспечить достаточную биологическую доступность иринотекана с низкой растворимостью (ЕР 2328557 А), что также может поддерживать стабильность активного ингредиента со временем.
Раскрытие изобретения
Техническая задача
В настоящем изобретении предусматривается твердый состав для перорального применения, содержащий иринотекан, с улучшенной биологической доступностью и стабильностью активного ингредиента.
В настоящем изобретении предусматривается способ получения твердого состава для перорального применения, содержащего иринотекан, с улучшенной биологической доступностью и стабильностью активного ингредиента. Решение задачи
Согласно аспекту настоящего изобретения предусмотрен твердый состав для перорального применения, содержащий иринотекан или его фармацевтически приемлемую соль и подкислитель.
Согласно другому аспекту настоящего изобретения предусмотрен способ получения твердого состава для перорального применения, причем способ включает образование гранул, содержащих иринотекан или его фармацевтически приемлемую соль, разбавитель и связующее вещество; смешивание гранул с разрыхлителем и смазывающим веществом с получением смеси; и необязательно составление полученной в результате смеси; при этом на стадии образования гранул и/или смешивания гранул добавляют подкислитель.
Полезные эффекты изобретения
Согласно одному или нескольким вариантам осуществления настоящего изобретения твердый состав для перорального применения, содержащий иринотекан, полученный с использованием подкислителя, может иметь значительно увеличенную степень растворения активного ингредиента за счет включения подкислителя и может обеспечивать улучшенную биологическую доступность при пероральном введении. Активный ингредиент твердого состава для перорального применения, содержащего иринотекан, может также иметь высокую стабильность со временем, и, таким образом, твердый состав для перорального применения, содержащий иринотекан, может обеспечивать эффективность иринотекана посредством перорального введения, значительно снижая риск возникновения побочных эффектов по сравнению с традиционным введением иринотекана. Следовательно, твердый состав для перорального применения, содержащий иринотекан, согласно любому из вариантов осуществления может иметь улучшенную эффективность и стабильность и сниженные побочные эффекты.
Краткое описание графических материалов
На фиг. 1 представлен график степени растворения твердых составов для перорального применения из примеров 1-6 и сравнительных примеров 1-3, иллюстрирующий результаты 30-минутного теста на растворение, осуществляемого способом с использованием лопастной мешалки согласно Фармакопее США (USP) с применением 900 мл очищенной воды;
на фиг. 2 представлен график, иллюстрирующий результаты анализа количеств неизвестных родственных соединений в твердых составах для перорального применения из примеров 1-6 и сравнительных примеров 1-3, после хранения каждого твердого состава для перорального применения в бутылке из полиэтилена высокой плотности (HDPE) при 60°С в камере в течение 2 недель или.4 недель; и
на фиг. 3 представлен график, иллюстрирующий результаты анализа значений количества общего содержания родственного соединения в твердых составах для перорального применения из примеров 1-6 и сравнительных примеров 1-3, после хранения каждого твердого состава для перорального применения в бутылке из HDPE при 60°С в камере в течение 2 недель или 4 недель.
Подробное описание изобретения
Настоящее изобретение будет описано со ссылкой на иллюстративные варианты осуществления.
Если не указано иное, все термины (включая технические и научные термины), используемые в данном документе, имеют то же значение, обычно понятное специалисту средней квалификации в области, к которой относится настоящее изобретение. Хотя в данном документе и перечислены иллюстративные способы или материалы, другие аналогичные или эквивалентные способы или материалы также входят в объем настоящего изобретения. Все публикации, раскрытые как ссылки в данном документе, включены во всей своей полноте посредством ссылки.
Согласно аспекту настоящего изобретения твердый состав для перорального применения содержит иринотекан или его фармацевтически приемлемую соль в качестве активного ингредиента и подкислитель.
Фармацевтически приемлемая соль может включать соль присоединения кислоты. Соль присоединения кислоты может включать соль неорганической кислоты или соль органической кислоты.
Соль неорганической кислоты может включать гидрохлорид, фосфат, сульфат или дисульфат. Однако, варианты осуществления не ограничены ими. Соль органической кислоты может включать малат, малеат, цитрат, фумарат, бесилат, камсилат или эдисилат. Однако, варианты осуществления не ограничены ими.
Например, фармацевтически приемлемая соль иринотекана может представлять собой гидрохлорид, а в некоторых вариантах осуществления - иринотекана гидрохлорида гидрат, например, иринотекана гидрохлорида тригидрат.
Используемый в данном документе термин "подкислитель" может означать любой материал, который может снижать рН раствора путем растворения в воде. В некоторых вариантах осуществления подкислитель может представлять собой неорганическую кислоту и/или органическую кислоту, которая может снижать рН раствора до 5 или меньше путем растворения в воде.
Неорганическая кислота может включать хлористоводородную кислоту, фосфорную кислоту, дигидрофосфат калия, дигидрофосфата натрия или любые их комбинации. Однако, варианты осуществления не ограничены ими. Органическая кислота может включать лимонную кислоту, молочную кислоту, винную кислоту, фумаровую кислоту, фталевую кислоту, уксусную кислоту, щавелевую кислоту, малоновую кислоту, адипиновую кислоту, фитиновую кислоту, янтарную кислоту, глутаровую кислоту, малеиновую кислоту, яблочную кислоту, миндальную кислоту, аскорбиновую кислоту, бензойную кислоту, метансульфоновую кислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, лауриновую кислоту, арахидиновую кислоту, эруковую кислоту, линолевую кислоту, линоленовую кислоту, олеиновую кислоту, пальмитиновую кислоту, миристиновую кислоту, эдисиловую кислоту, стеариновую кислоту или любые их комбинации. Однако, варианты осуществления не ограничены ими.
В некоторых вариантах осуществления подкислитель может представлять собой С2-С20органическую кислоту, содержащую карбоксильную группу (СООН) или сульфогруппу (SO3H).
В некоторых вариантах осуществления подкислитель может быть выбран из группы, состоящей из уксусной кислоты, адипиновой кислоты, лимонной кислоты, аскорбиновой кислоты, эриторбиновой кислоты, молочной кислоты, пропионовой кислоты, винной кислоты, фумаровой кислоты, муравьиной кислоты, щавелевой кислоты, камсилата, яблочной кислоты, малеиновой кислоты, эдисиловой кислоты, пальмитиновой кислоты, стеариновой кислоты и любых их комбинаций.
В некоторых вариантах осуществления подкислитель может быть выбран из группы, состоящей из уксусной кислоты, лимонной кислоты, молочной кислоты и любых их комбинаций.
В некоторых вариантах осуществления, хотя все зависит от типа подкислителя, количество подкислителя в твердом составе для перорального применения может представлять собой уровень, при котором среда растворения из теста на растворение в течение приблизительно 30 минут с применением способа с использованием лопастной мешалки согласно Фармакопее США (USP) с применением 900 мл очищенной воды может иметь рН от приблизительно 1 до приблизительно 5. Например, количество подкислителя в твердом составе для перорального применения может составлять от приблизительно 0,2 до приблизительно 10,0 частей по весу, а в некоторых вариантах осуществления - от приблизительно 0,2 до приблизительно 5 частей по весу в пересчете на 1 часть по весу иринотекана или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления твердый состав для перорального применения может представлять собой твердый состав для перорального применения, в котором может быть получена среда растворения с рН от приблизительно 1 до приблизительно 5 в тесте на растворение в течение приблизительно 30 минут с применением способа с использованием лопастной мешалки согласно USP с применением 900 мл очищенной воды.
За счет включения подкислителя иринотекан, который известен как лекарственное средство с плохой растворимостью, твердого состава для перорального применения может иметь значительно увеличенную степень растворения, и, таким образом, твердый состав для перорального применения может иметь значительно увеличенную биологическую доступность при пероральном введении. Эта увеличенная биологическая доступность обеспечивает возможность перорального введения твердого состава и, следовательно, улучшает приверженность пациента схеме лечения.
В некоторых вариантах осуществления степень растворения активного ингредиента твердого состава для перорального применения может составлять приблизительно 80% или больше в течение 45 минут теста на растворение с применением способа с использованием лопастной мешалки согласно USP с применением 900 мл очищенной воды, а в некоторых других вариантах осуществления степень растворения активного ингредиента составляет приблизительно 80% или больше в течение 30 минут теста на растворение. По результатам теста обнаружили, что степень растворения активного ингредиента твердого состава для перорального применения, содержащего иринотекан и подкислитель, значительно увеличивалась по сравнению с тем составом, который не содержит подкислитель или содержит ощелачивающее средство (пример теста 2).
Стабильность иринотекана твердого состава для перорального применения согласно любому из вышеописанных вариантов осуществления может быть значительно увеличена со временем за счет включения подкислителя. По результатам теста обнаружили, что твердый состав для перорального применения, содержащий иринотекан и подкислитель, имеет значительное снижение скорости увеличения выхода родственных соединений со временем, по сравнению с тем составом, который не содержит подкислитель или содержит ощелачивающее средство (пример теста 3).
Используемый в данном документе термин "твердый состав" может означать состав, полученный формованием или инкапсулированием лекарственных средств в заданную форму. Твердый состав для перорального применения может быть составлен без ограничения в виде драже, капсулы, таблетки (включая однослойную таблетку, двухслойную таблетку и прессованную таблетку), сухих сиропов или гранул. Однако, варианты осуществления не ограничены ими. Например, твердый состав для перорального применения может быть в виде капсулы, однослойной таблетки или двухслойной таблетки. Когда твердый состав для перорального применения представлен в виде капсулы, капсула может включать гранулы, таблетки или тому подобное.
Твердый состав для перорального применения может дополнительно содержать по меньшей мере одну фармацевтически приемлемую добавку в дополнение к активному ингредиенту и подкислителю. Например, фармацевтически приемлемая добавка может включать по меньшей мере один материал, выбранный из группы, состоящей из разбавителя, связующего вещества, разрыхлителя, смазывающего вещества и любых их комбинаций.
Разбавитель, который может быть использован для увеличения количества, может быть выбран из группы, состоящей из маннита, лактозы, крахмала, микрокристаллической целлюлозы, дигидрофосфата кальция Ludipress® и любых их комбинаций. Однако, варианты осуществления не ограничены ими. Количество разбавителей может составлять от приблизительно 1 до приблизительно 99 вес. %, а в некоторых вариантах осуществления - от приблизительно 20 до приблизительно 80 вес. % в пересчете на общий вес твердого состава для перорального применения.
Связующее вещество может быть выбрано из группы, состоящей из повидона, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилового спирта, натрий-карбоксиметилцеллюлозы и любых их комбинаций. Однако, варианты осуществления не ограничены ими. Количество связующего вещества может составлять от приблизительно 0,5 до приблизительно 15 вес. %, а в некоторых вариантах осуществления - от приблизительно 1 до приблизительно 10 вес. % в пересчете на общий вес твердого состава для перорального применения.
Разрыхлитель может быть выбран из группы, состоящей из кроскармеллозы натрия, кросповидона, натрия крахмалгликолята и любых их комбинаций. Однако, варианты осуществления не ограничены ими. Количества разрыхлителя может составлять от приблизительно 1 до приблизительно 30 вес. %, а в некоторых вариантах осуществления - от приблизительно 2 до приблизительно 7 вес. % в пересчете на общий вес твердого состава для перорального применения.
Смазывающее вещество может быть выбрано из группы, состоящей из стеариновой кислоты, солей металлов стеариновой кислоты (например, стеарата кальция, стеарата магния и т.п.), талька, коллоидного диоксида кремния, сложного эфира сахарозы и жирных кислот, гидрогенизированного растительного масла, воска, сложных эфиров глицерина и жирных кислот, дибегената глицерина и любых их комбинаций. Однако, варианты осуществления не ограничены ими. Количество смазывающего вещества может составлять от приблизительно 0,3 до приблизительно 7 вес. %, а в некоторых вариантах осуществления - от приблизительно 0,5 до приблизительно 5 вес. % в пересчете на общий вес твердого состава для перорального применения.
В некоторых вариантах осуществления твердый состав для перорального применения может содержать от приблизительно 0,1 до приблизительно 500 мг иринотекана или его фармацевтически приемлемой соли в качестве свободного основания, в качестве активного ингредиента в стандартной лекарственной форме. Количество иринотекана или его фармацевтически приемлемой соли в качестве активного ингредиента может составлять от приблизительно 0,5 до приблизительно 50 вес. %, а в некоторых вариантах осуществления - от приблизительно 1 до приблизительно 40 вес. % в пересчете на общий вес твердого состава для перорального применения.
Твердый состав для перорального применения можно вводить млекопитающим, включая людей, с любым показанием иринотекана или его фармацевтически приемлемой соли. Соответственно, твердый состав для перорального применения может быть использован для лечения рака, т.е. различных видов рака, включая без ограничения рак легких, рак желудка, рак поджелудочной железы, неходжкинскую лимфому, рак шейки матки, рак головы и шеи, опухоль головного мозга и рак яичников. В некоторых вариантах осуществления твердый состав для перорального применения может быть использован для лечения рака толстой кишки, например, колоректального рака.
Твердый состав для перорального применения согласно любому из вышеописанных вариантов осуществления может быть получен с использованием любого способа, известного в области получения твердого состава для перорального применения, например, в виде гранул, драже, капсулы или таблетки. В некоторых вариантах осуществления твердый состав для перорального применения согласно любому из вышеописанных вариантов осуществления может быть получен с использованием способа получения влажных гранул или сухих гранул или твердого состава для перорального применения с использованием влажных или сухих гранул. В некоторых вариантах осуществления гранулы могут быть получены путем влажного гранулирования.
Согласно другому аспекту настоящего изобретения способ получения твердого состава для перорального применения согласно любому из вышеописанных вариантов осуществления включает:
образование гранул, содержащих иринотекан или его фармацевтически приемлемую соль, разбавитель и связующее вещество;
смешивание гранул с разрыхлителем и смазывающим веществом с получением смеси и
необязательно составление полученной в результате смеси,
при этом на стадии образования гранул и/или на стадии смешивания гранул добавляют подкислитель.
Вышеуказанные описания твердых составов для перорального применения согласно вышеописанным вариантам осуществления могут быть применимы к способу получения твердого состава для перорального применения согласно любому из вышеописанных вариантов осуществления.
Образование гранул может быть осуществлено с использованием любого способа гранулирования, известного в данной области техники, например, с использованием влажного гранулирования или сухого гранулирования. В некоторых вариантах осуществления образование гранул может быть осуществлено с использованием влажного гранулирования.
Влажное гранулирование может включать смешивание смеси иринотекана или его фармацевтически приемлемой соли и разбавителя со связующим раствором, образование гранул и высушивание гранул. Подкислитель можно добавлять и смешивать по меньшей мере с одним из смеси и связующего раствора.
Растворитель для связующего раствора может представлять собой воду, этанол, изопропанол, ацетон или любые их комбинации. Связующий раствор может быть получен путем добавления связующего вещества и любой добавки, доступной в фармацевтической области, например, поверхностно-активного вещества, буфера или их комбинации, к растворителю. Например, связующий раствор может быть получен путем растворения гидрофильного связующего вещества в этаноле.
Высушивание может быть осуществлено при температуре, не превышающей приблизительно 60°С, а в некоторых вариантах осуществления - при температуре, не превышающей приблизительно 50°С, и в некоторых других вариантах осуществления -при температуре, не превышающей приблизительно 40°С, и в еще других вариантах осуществления - при температуре от приблизительно 20°С до приблизительно 40°С, учитывая стабильность активного ингредиента, путем высушивания воздухом, высушивания в псевдоожиженном слое или высушивания в печи.
Сухое гранулирование может включать гранулирование смеси, содержащей иринотекан или его фармацевтически приемлемую соль, разбавитель, разрыхлитель и связующее вещество, путем вальцевания или прямого прессования. Например, сухое гранулирование может быть осуществлено путем вальцевания. Вальцевание представляет собой способ гранулирования, где порошок прессуют с постоянным давлением при его подаче в зазор между двумя роликами. Вальцевание может быть осуществлено с использованием роликового пресса. Смесь, спрессованная роликом, может быть дополнительно подвергнута процессам измельчения и просеивания с помощью дробилки (например, фитц-мельницы), осциллятора или т.п., если это необходимо.
При сухом гранулировании подкислитель может быть добавлен к смеси, содержащей иринотекан или его фармацевтически приемлемую соль, разбавитель, разрыхлитель и связующее вещество.
При смешивании гранул с разрыхлителем и смазывающим веществом разрыхлитель может представлять собой любой из разрыхлителей, доступных для получения капсулы, содержащей гранулу. В некоторых вариантах осуществления разрыхлитель может быть выбран из группы, состоящей из кроскармеллозы натрия, кросповидона, натрия крахмалгликолята, гидроксипропилцеллюлозы с низкой степенью замещения и любых их комбинаций. Например, разрыхлитель может представлять собой кроскармеллозу натрия. Смазывающее вещество может быть выбрано из группы, состоящей из стеарата магния, талька, стеарилфумарата натрия и любых их комбинаций. Например, смазывающее вещество может представлять собой комбинацию талька и стеарилфумарата натрия. При смешивании гранул с разрыхлителем и смазывающим веществом могут также добавлять подкислитель.
Составление может быть осуществлено с использованием любого способа, известного из области получения твердого состава с использованием гранул, например, с использованием любого известного способа составления таблеток, капсул или сухих сиропов.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Один или несколько вариантов осуществления настоящего изобретения будут теперь описаны более подробно со ссылкой на следующие примеры. Однако эти примеры представлены только с иллюстративными целями и не предназначены для ограничения объема одного или нескольких вариантов осуществления настоящего изобретения.
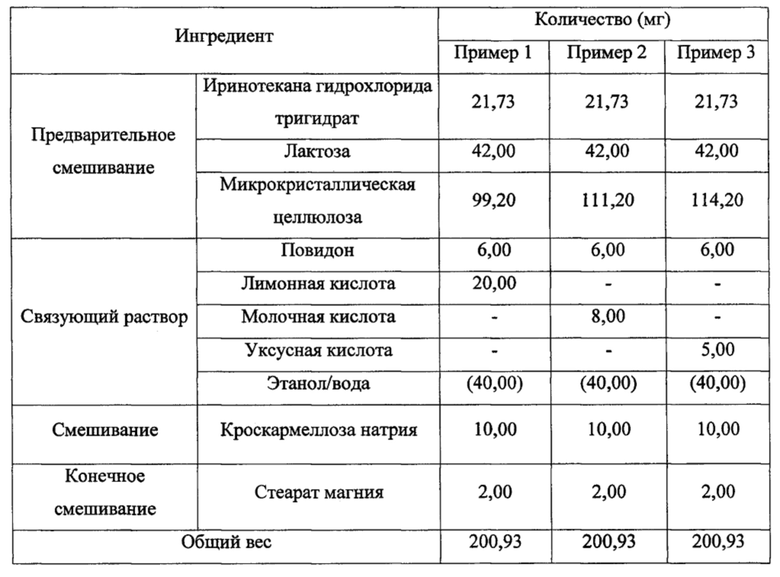
Примеры 1-3. Получение таблеток, содержащих подкислитель (1)
Иринотекана гидрохлорида тригидрат (Dongwoo Fine-Chem, Корея), лактозу и микрокристаллическую целлюлозу смешивали вместе (предварительное смешивание), в соответствии с композициями из таблицы 1, с последующим добавлением связующего раствора, который подкисляли добавлением и растворением лимонной кислоты, молочной кислоты или уксусной кислоты, добавленных в качестве подкислителя в связующий раствор повидона, растворенного в смеси этанола и воды (7:3), к смеси, гранулированием, высушиванием и просеиванием через сито с размером 20 меш с получением, тем самым, влажных гранул иринотекана.
Затем к полученным влажным гранулам иринотекана добавляли кроскармеллозу натрия и смешивали (смешивание) вместе с последующим добавлением стеарата магния к смеси, смешиванием смеси вместе (конечное смешивание) и таблетированием конечной смеси при помощи роторного таблеточного пресса (GRC-18, доступный от Sejong Pharmatech Co., Ltd., Корея) с образованием таблеток с твердостью от приблизительно 5 до приблизительно 12 единиц твердости по Кнупу.
[Таблица 1]
Примеры 4-6. Получение таблеток, содержащих различные количества подкислителя
Таблетки из примеров 4-6 получали таким же способом, что и таблетки в примере 1, в соответствии с композициями из таблицы 2, за исключением того, что использовали различные количества лимонной кислоты в качестве подкислителя.
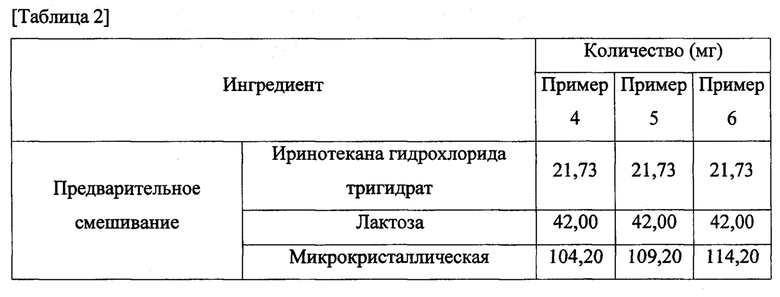

Сравнительные примеры 1-3. Получение таблеток, содержащих ощелачивающее средство
Таблетки из сравнительных примеров 1-3 получали в соответствии с композициями из таблицы 3 таким же способом, что и таблетки в примере 1, за исключением того, что не использовали подкислитель (сравнительный пример 1), и вместо подкислителя использовали карбонат кальция (сравнительный пример 2) или меглюмин (сравнительный пример 3) в качестве ощелачивающего средства.


Тестовый пример 1. Сравнительная оценка рН
Таблетки из примеров 1-6 и сравнительных примеров 1, 2 и 3 подвергали тесту на растворение способом с использованием лопастной мешалки согласно USP с применением 900 мл очищенной воды. Измеряли рН каждой среды растворения через 30 минут после теста на растворение. Результаты приведены в таблице 4.

Ссылаясь на таблицу 4, было обнаружено, что среда растворения из таблеток согласно примерам 1-6, полученных с использованием подкислителя, через 30 минут после теста на растворение имела рН ниже 5,0, тогда как среда из таблеток согласно сравнительным примерам 1, 2 и 3, полученных без использования подкислителя или с использованием ощелачивающего средства, имела рН больше 5,0.
Тестовый пример 2. Тест на растворение
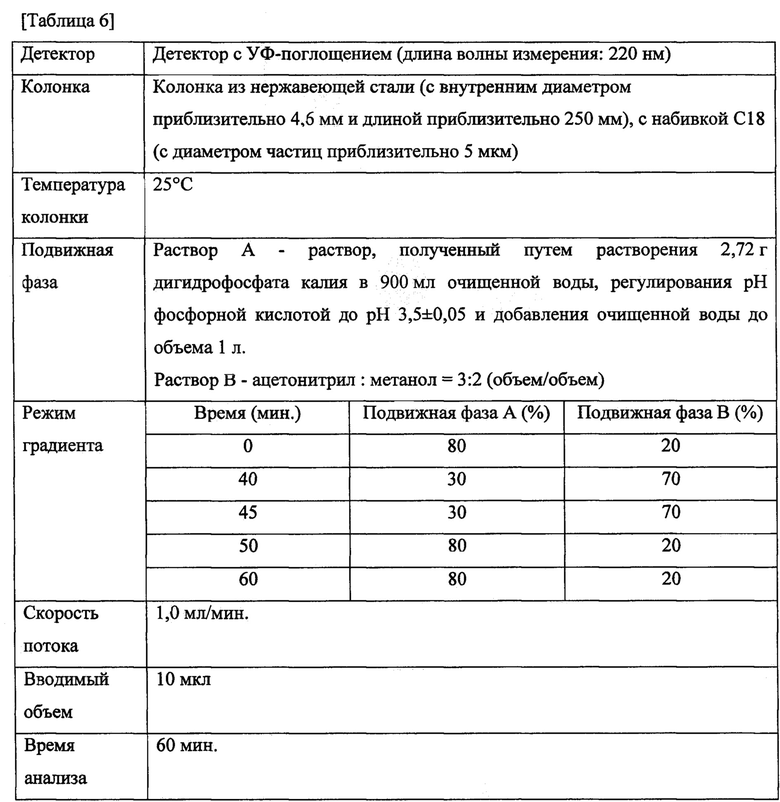
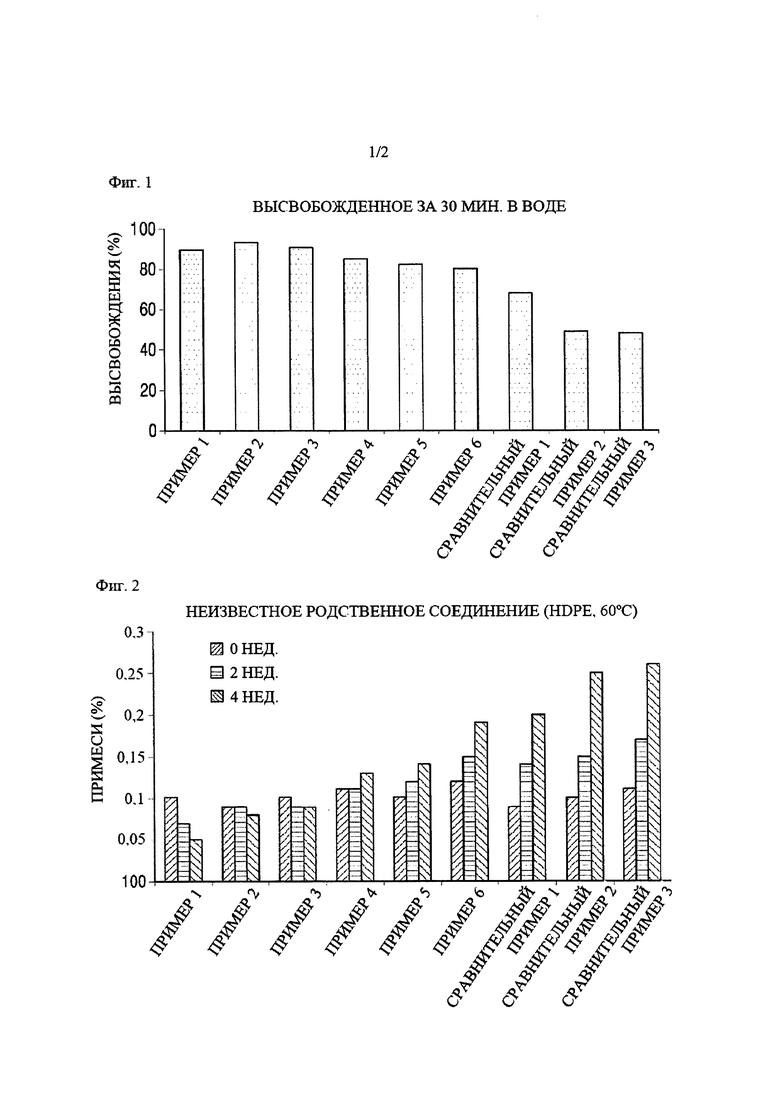
Таблетки из примеров 1-6 и сравнительных примеров 1, 2 и 3 подвергали тесту на растворение способом с использованием лопастной мешалки согласно USP с применением 900 мл очищенной воды. Тестовые образцы получали через 30 минут после теста на растворение и анализировали путем жидкостной хроматографии при следующих условиях для подсчета степени растворения иринотекана гидрохлорида в каждом из примеров. Результаты приведены в таблице 5 и на фиг. 1.
- Колонка: колонка из нержавеющей стали (Inertsil ODS-2, с внутренним диаметром приблизительно 4,6 мм и длиной приблизительно 150 мм), с набивкой С18 (с диаметром частиц приблизительно 5 мкм) для жидкостной хроматографии.
- Температура колонки: 30°С.
- Вводимый объем образца: 20 мкл.
- Подвижная фаза: смешанный раствор метанола, содержащий 0,005 моль/л 1-гептансульфоната натрия и буфер, содержащий уксусную кислоту и ацетат натрия (рН 4,0), в объемном соотношении 11:9.
- Скорость потока: 1,0 мл/мин.
- Детектор: детектор с УФ-поглощением (длина волны измерения: 254 нм)

Как показано в таблице 5 и на фиг. 1, обнаружили, что таблетки из примеров 1, 2, 3, 4, 5 и 6, полученных с использованием подкислителя, имели высокую степень растворения приблизительно 80% или больше в течение 30 минут. Чем выше количество подкислителя, тем выше степень растворения активного ингредиента в течение 30 минут. Однако, обнаруживали, что таблетки из сравнительных примеров 1, 2 и 3 без использования подкислителя или ощелачивающего средства имели значение степени растворения приблизительно 80% или меньше в течение 30 минут, которое ниже значений степени растворения таблеток из примеров 1, 2, 3, 4, 5 и 6.
Тестовый пример 3. Анализ родственного соединения
Для оценки стабильности при хранении таблеток, полученных в примерах 1, 2, 3, 4, 5 и 6 и сравнительных примерах 1, 2 и 3, значения количества неизвестных родственных соединений и общего содержания родственного соединения измеряли при условиях анализа из таблицы 6. В частности, для оценки стабильности при хранении со временем таблетки помещали в бутылки из полиэтилена высокой плотности (HDPE) и хранили при 60°С в камере в течение 2 недель или 4 недель с последующим измерением значений количества родственных соединений, полученных через 2 недели или 4 недели. Результаты анализа приведены в таблицах 7 и 9 и на фиг. 2 и 3.
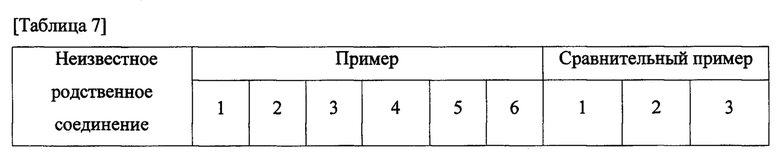
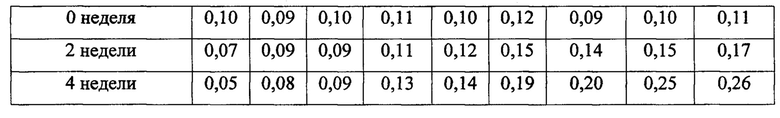
Как показано в таблицах 7 и 8 и на фиг. 2 и 3, обнаружили, что таблетки из примеров 1-6, полученные с использованием подкислителя, практически не характеризовались повышением в отношении содержания родственных соединений в течение 4 недель, тогда как таблетки из сравнительных примеров 1, 2 и 3, полученные без использования подкислителя или с использованием ощелачивающего средства, характеризовались значительным повышением в отношении содержания родственных соединений по сравнению с примерами 1-6.
Хотя данное изобретение было конкретно продемонстрировано и описано со ссылкой на его предпочтительные варианты осуществления, специалистам в данной области техники будет понятно, что в нем можно сделать различные изменения в форме и деталях без отклонения от сущности и объема настоящего изобретения, определенных прилагаемой формулой изобретения. Раскрытые варианты осуществления следует рассматривать только в описательном смысле, а не в целях ограничения. Таким образом, объем настоящего изобретения определен не подробным описанием изобретения, а прилагаемой формулой изобретения, и все различия в пределах объема будут рассматриваться как охваченные настоящим изобретением.

Группа изобретений относится к области медицины, а именно к твердому составу для перорального применения, содержащему влажные гранулы, содержащие иринотекана гидрохлорида тригидрат и подкислитель, где подкислитель выбран из группы, состоящей из уксусной кислоты, лимонной кислоты, молочной кислоты и любых их комбинаций, и к его способу получения. Группа изобретений обеспечивает увеличенную степень растворения активного ингредиента и обеспечивает улучшенную биологическую доступность при пероральном введении. 2 н. и 7 з.п. ф-лы, 3 ил., 8 табл., 6 пр.
1. Твердый состав для перорального применения, содержащий:
влажные гранулы, содержащие
иринотекана гидрохлорида тригидрат и
подкислитель,
где подкислитель выбран из группы, состоящей из уксусной кислоты, лимонной кислоты, молочной кислоты и любых их комбинаций.
2. Твердый состав для перорального применения по п. 1, где количество подкислителя составляет от приблизительно 0,2 части до приблизительно 10 частей по весу в пересчете на 1 часть по весу иринотекана гидрохлорида тригидрата.
3. Твердый состав для перорального применения по п. 1, где твердый состав для перорального применения представлен в форме гранул, капсулы или таблетки.
4. Твердый состав для перорального применения по п. 1, где твердый состав для перорального применения дополнительно содержит фармацевтически приемлемую добавку, выбранную из группы, состоящей из разбавителя, связующего вещества, разрыхлителя, смазывающего вещества и любых их комбинаций.
5. Твердый состав для перорального применения по п. 4, где твердый состав для перорального применения содержит от приблизительно 20 вес. % до приблизительно 80 вес. % разбавителя, от приблизительно 1 вес. % до приблизительно 10 вес. % связующего вещества, от приблизительно 2 вес. % до приблизительно 7 вес. % разрыхлителя или от приблизительно 0,5 вес. % до приблизительно 5 вес. % смазывающего вещества в пересчете на общий вес твердого состава для перорального применения.
6. Твердый состав для перорального применения по п. 1, где твердый состав для перорального применения предназначен для лечения рака.
7. Способ получения твердого состава для перорального применения по любому из пп. 1-6, причем способ включает:
образование гранул, содержащих иринотекана гидрохлорида тригидрат, разбавитель и связующее вещество; и
смешивание гранул с разрыхлителем и смазывающим веществом с получением смеси,
при этом на стадии образования гранул и/или смешивания гранул добавляют подкислитель,
где стадию образования гранул осуществляют путем влажного гранулирования, и
где подкислитель выбран из группы, состоящей из уксусной кислоты, лимонной кислоты, молочной кислоты и любых их комбинаций.
8. Способ по п. 7, дополнительно включающий составление полученной в результате смеси.
9. Способ по п. 7, где влажное гранулирование включает образование гранул путем гранулирования смеси иринотекана гидрохлорида тригидрата и разбавителя в комбинации со связующим раствором, содержащим связующее вещество, при этом подкислитель добавляют к смеси и/или связующему раствору.
| US 2007299099 A1, 27.12.2007 | |||
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ КАРБОКСАМИДНЫХ ИНГИБИТОРОВ ИНТЕГРАЗЫ ВИЧ, СОДЕРЖАЩИЙ КОМПОЗИЦИЮ С КОНТРОЛИРУЕМОЙ СКОРОСТЬЮ ВЫСВОБОЖДЕНИЯ | 2005 |
|
RU2382648C2 |
| US 20050208146 A1, 22.09.2005. | |||
Авторы
Даты
2020-03-13—Публикация
2016-06-20—Подача