Изобретение относится к экспериментальной медицине и фармакологии и может быть использовано для профилактики и коррекции нейродегенеративных заболеваний, вызываемых оксидативным повреждением мозга и сопровождающихся функциональными расстройствами центральной нервной системы (ЦНС).
Ишемические поражения головного мозга являются важнейшими медицинской и социальной проблемами в связи с высокой их распространенностью и тяжелыми последствиями для состояния здоровья населения. Предотвращение прогрессирования этих заболеваний является одной из ключевых задач неврологии [Смирнова И.Н., Федорова Т.Н., Танашян М.М., Суслина З.А. Клиническая эффективность и антиоксидантная активность Мексидола при хронических цереброваскулярных заболеваниях // Нервные болезни. 2006. №1. С. 33-36].
Ведущим фактором гибели нервных клеток при тяжелом гипоксическом воздействии является окислительный стресс, развивающийся при истощении энергетических ресурсов в условиях нехватки кислорода. Перепроизводство активных форм кислорода (АФК) и азота, а также нарушение баланса антиоксидантных ферментных систем организма приводит к разрушению клеточных структур, липидов, белков, ДНК и РНК [Islam М.Т. Oxidative stress and mitochondrial dysfunction-linked neurodegenerative disorders // Neurol. Res. 2017. Vol. 39(1). P. 73-82]. Окислительный стресс играет ключевую роль в этиологии многих заболеваний, включая инсульты [Rodrigo R.,  R.,
R.,  R., Matamala J.M., Carrasco R., Miranda-Merchak A., Feuerhake W. Oxidative stress and pathophysiology of ischemic stroke: novel therapeutic opportunities // CNS Neurol. Disord. Drug Targets. 2013. Vol. 12(5). P. 698-714; Khoshnam S.E., Winlow W., Farzaneh M, Farbood Y., Moghaddam H.F. Pathogenic mechanisms following ischemic stroke // Neurol. Sci. 2017. Vol. 38(7). P. 1167-1186], нейродегенеративные заболевания (НДЗ), такие как болезни Аль цгеймера [Lon go F.M., Massa S.M. Neuroprotective strategies in Alzheimer's disease // NeuroRx. 2004. Vol. 1(1). P. 117-127], боковой амиотрофический склероз [Pollari E., Goldsteins G., Bart G., Koistinaho J., Giniatullin R. The role of oxidative stress in degeneration of the neuromuscular junction in amyotrophic lateral sclerosis // Front. Cell. Neurosci. 2014. Vol. 8. Article 131.], атаксия Фридрейха [Lupoli F., Vannocci Т., Longo G., Niccolai N., Pastore A. The role of oxidative stress in Friedreich's ataxia // FEBS Lett. 2018. Vol. 592(5). P. 718-727], рассеянный склероз [Ohl K., Tenbrock K., Kipp M. Oxidative stress in multiple sclerosis: Central and peripheral mode of action // Exp. Neurol. 2016. Vol. 277. P. 58-67.] и болезнь Паркинсона [Puspita L., Chung S.Y., Shim J.W. Oxidative stress and cellular pathologies in Parkinson's disease // Mol. Brain. 2017. Vol. 10(1). 53.].
R., Matamala J.M., Carrasco R., Miranda-Merchak A., Feuerhake W. Oxidative stress and pathophysiology of ischemic stroke: novel therapeutic opportunities // CNS Neurol. Disord. Drug Targets. 2013. Vol. 12(5). P. 698-714; Khoshnam S.E., Winlow W., Farzaneh M, Farbood Y., Moghaddam H.F. Pathogenic mechanisms following ischemic stroke // Neurol. Sci. 2017. Vol. 38(7). P. 1167-1186], нейродегенеративные заболевания (НДЗ), такие как болезни Аль цгеймера [Lon go F.M., Massa S.M. Neuroprotective strategies in Alzheimer's disease // NeuroRx. 2004. Vol. 1(1). P. 117-127], боковой амиотрофический склероз [Pollari E., Goldsteins G., Bart G., Koistinaho J., Giniatullin R. The role of oxidative stress in degeneration of the neuromuscular junction in amyotrophic lateral sclerosis // Front. Cell. Neurosci. 2014. Vol. 8. Article 131.], атаксия Фридрейха [Lupoli F., Vannocci Т., Longo G., Niccolai N., Pastore A. The role of oxidative stress in Friedreich's ataxia // FEBS Lett. 2018. Vol. 592(5). P. 718-727], рассеянный склероз [Ohl K., Tenbrock K., Kipp M. Oxidative stress in multiple sclerosis: Central and peripheral mode of action // Exp. Neurol. 2016. Vol. 277. P. 58-67.] и болезнь Паркинсона [Puspita L., Chung S.Y., Shim J.W. Oxidative stress and cellular pathologies in Parkinson's disease // Mol. Brain. 2017. Vol. 10(1). 53.].
Одним из основных подходов к снижению повреждения мозга при ишемии/гипоксии, профилактики развития НДЗ и их лечения является воздействие на звенья метаболизма, ответственные за геперпродукцию АФК, и применение антиоксидантов для подавления свободных радикалов [Суслина З.А., Максимова М.Ю. Концепция нейропротекции: новые возможности ургентной терапии ишемического инсульта. Симпозиум НИИ неврологии РАМН «Лечение ОНМК: состояние проблемы» // Нервные болезни. 2004. №3. С. 4-7].
В соответствии с этим для предотвращения распространения необратимых ишемических повреждений, развития нейродегенеративных заболеваний человека рассматривается необходимость разработки и применения нейропротекторных лекарственных средств, избирательно корригирующих эти процессы, способных препятствовать чрезмерному накоплению радикалов и поддерживать собственную антиоксидантную систему организма. А значит защищать ткань мозга от повреждения и сохранять функциональную активность ЦНС.
Известно применение лекарственного средства мемантин - 3,5-диметил-адамантан-1-амин (в виде гидрохлорида), которое является неконкурентным потенциал-зависимым антагонистом NMDA-рецепторов с умеренной степенью аффинности. Мемантин является одним из немногих низкоаффинных терапевтических агентов, использующихся в клинической практике. Обладает ноотропным, церебровазодилатирующим, противогипоксическим и психостимулирующим действием. Клинические исследования показали, что мемантин (20 мг/сут) эффективен при умеренной и тяжелой стадиях болезни Альцгеймера и даже при более тяжелых состояниях [Lipton S.A. Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond // Nat Rev. 2006. Vol. 5. P. 161-170; Reisberg В., Doody R., Stoffler A., Schmitt F., Ferris S., Mobius H.J. Memantine in moderate-to-severe Alzheimer's disease // N. Engl. J. Med. 2003. Vol. 348. P. 1333-1341; Пенг Д., Юан Кс., Зу Р. Применение мемантина гидрохлорида для лечения различных подтипов деменции // Социальная и клиническая психиатрия. 2015, т. 25 №3. С. 69-71; Левин О.С., Васенина Е.Е. Применение Акатинола Мемантина в клинической практике // Современная терапия в психиатрии и неврологии. 2015. №1 С. 24-33]. Обладает побочным действием: головная боль, утомляемость, сонливость, спутанность сознания, галлюцинации, психотические реакции, головокружение, нарушение походки, судороги, артериальная гипертензия, венозный тромбоз/тромбоэмболия, сердечная недостаточность и др. Противопоказания к применению препарата: выраженные нарушения функции почек; беременность; лактация (грудное вскармливание); возраст до 18 лет (недостаточно данных); повышенная чувствительность к компонентам препарата [http://krasnodar.rigla.ru/shop/forms/akatinol_memantin/ дата обращения: 06.05.2019].
Известен лекарственный препарат нимодипин - 3-(метоксиэтил) 5-пропан-2-ил 2,6-диметил-4-(3-нитрофенил)-1,4-дигидропиридин-3,5-дикарбоновая кислота. Обладает рядом фармакологических эффектов: 1) Нейропротекторное действие, 2) Ноотропное действие, 3) Вазотропное действие, 4) Нейромедиаторное действие, 5) Антиатерогенное действие. Нимодипин по своей химической структуре относится к производным дигидропиридина, а по своему механизму действия - к блокаторам потенциал-зависимых кальциевых каналов L-типа. Применяется при ишемическом нарушении мозгового кровообращения, субарахиноидальных кровоизлияниях, в нейрореабилитационный период. В рамках многоцентровых клинических испытаний была установлена высокая эффективность данного препарата (в дозах 90-120 мг/сут в течение 3-6 мес) в нормализации когнитивных и поведенческих функций у больных с сосудистой деменцией и болезнью Альцгеймера. Продемонстрировал эффективность при экспериментальном Паркинсонизме у мышей [Бурчинский С.Г. Антагонисты кальциевых каналов и их возможности в современной неврологии, терапии и нейрохирургии // СЕМЕЙНАЯ МЕДИЦИНА. 2015. №4 (60). С. 121-124; Singh A., Verma P., Balaji G., Samantaray S., Mohanakumar K.P. Nimodipine, an L-type calcium channel blocker attenuates mitochondrial dysfunctions to protect against 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-induced Parkinsonism in mice // Neurochem Int. 2016. Vol. 99. P. 221-232.].
Нимодипин имеет противопоказания: гиперчувствительность, выраженная гипотензия, отек мозга, повышенное внутричерепное давление, тяжелые нарушения функции печени, оказывает побочные действия: гипотензия, спазм периферических сосудов, гипертензия, анемия и тромбоцитопения и другие. Не рекомендуется применять во время работы водителям транспортных средств и людям, профессия которых связана с повышенной концентрацией внимания [http://www.rlsnet.ru/mnn_index_id_1024.htm#protivopokazaniya дата обращения 06.05.2019].
Наиболее близким аналогом является мексидол (2-этил-6-метил-3-гидроксипиридина сукцинат). Эффекты мексидола определяются двумя основными механизмами - антиоксидантным (влияние как на ферментативные, так и неферментативные процессы ПОЛ) и мембранопротекторным, которые обеспечивают ограничение разрушающего действия продуктов ПОЛ, стабилизацию биомембран клеток, сохранение их упорядоченной структурно функциональной организации, в частности липидного бислоя, влияющего на мембраносвязанные рецепторные комплексы, ферменты и ионные каналы [Воронина Т.А. Антмоксидант мексидол. Основные нейропсихотропные эффекты и механизм действия // Психофармакол. Биол. Наркол. 2001. Т. 1. №1. С. 2-12].
Мексидол существенно уменьшает повреждение липопротеиновых структур, восстанавливая активность эндогенной антиоксидантной системы [Смирнова И.Н., Федорова Т.Н., Танашян М.М., Суслина З.А. Клиническая эффективность и антиоксидантная активность мексидола при хронических цереброваскулярных заболеваниях // Нервные болезни. 2006. №1. С. 33-36]. Применяется при состояниях, сопровождающихся гипоксией ткани мозга, обладает ноотропным действием [Пожилова Е.В., Новиков В.Е., Новикова А.В Фармакодинамика и клиническое применение препаратов на основе гидроксипиридина // Вестник Смоленской государственной медицинской академии 2013. Т. 12. №3. С. 56-66].
Недостатками использования мексидола являются побочные эффекты и противопоказаня: острая печеночная и/или почечная недостаточность; повышенная индивидуальная чувствительность к препарату. В связи с недостаточной изученностью действия препарата - детский возраст, беременность, грудное вскармливание [https://www.vidal.ru/drugs/mexidol_14744 дата обращения 06.05.2019].
Технической задачей является создание высокоэффективного способа нейропротекции, препятствующего оксидативному повреждению мозга и защищающего центральную нервную систему от функциональных расстройств, а также характеризующегося минимальными побочными эффектами, либо их отсутствием.
Для достижения технического результата предлагается применять в питьевом рационе обедненную дейтерием воду (ОДВ) в течение 42 дней для коррекции и профилактики метаболических и функциональных нарушений центральной нервной системы.
Технический результат предлагаемого изобретения заключается в создании возможности профилактики и коррекции метаболических и функциональных нарушений центральной нервной системы при стрессовом воздействии на организм, отличающейся применением в качестве протективного средства обедненной дейтерием воды.
Установлено, что дейтерий как микроэлемент незаменим для нормальной функции клеток. Увеличение или уменьшение концентрации дейтерия в потребляемой воде может привести к стимуляции или подавлению различных аспектов биологической активности [Syroeshkin A.V., Antipova N.V., Zlatska A.V., Zlatskiy I.A., Skylska M.D., Grebennikova T.V., Goncharuk V.V. The effect of the deuterium depleted water on the biological activity of the eukaryotic cells // Journal of Trace Elements in Medicine and Biology. 2018. V. 50. P. 629-633]. Так установлено, что повышенное содержание дейтерия в воде приводит к физиологическим, морфологическим и цитологическим изменениям клеток, а также оказывает негативное влияние на клеточный метаболизм. В тоже время потребление воды с пониженным содержанием дейтерия на 20-30% оказывает благотворное влияние на организм [Mosin О., Ignatov I. Studying the Influence of Heavy and Deuterium Depleted Types of Water on Biological Objects // Journal of Medicine, Physiology and Biophysics. 2016. Vol. 22. P. 35-49]. Установлена возможность нутриционной коррекции метаболизма изотопов D/H в крови с помощью ОДВ, а также перспективность использования реакций изотопного обмена для коррекции функционального дисбаланса защитных систем организма [Basov А.А., Elkina А.А., Samkov А.А., Volchenko N.N., Moiseev A.V., Fedulova L.V., Baryshev M.G., Dzhimak S.S. Influence of deuterium depleted water on the isotope D/H composition of liver tissue and morphological development of rats at different periods of ontogenesis // Iranian Biomedical Journal. 2019. Vol. 23(2). P. 129-141].
Имеющиеся данные свидетельствуют о положительном влиянии ОДВ на организм, однако, глубоких исследований нейропротекторного действия ОДВ на центральную нервную систему при окислительном стрессе нами не обнаружено.
Нейропротекторные свойства ОДВ изучали на моделях культивируемых нейронов головного мозга и стрессового воздействия на организм. В экспериментах использовали ОДВ произведенную на установке, разработанной в Кубанском государственном университете [Линия электролитического получения воды с пониженным содержанием дейтерия. Фролов В.Ю., Барышев М.Г., Джимак С.С., Ломакина Л.В., Болотин С.Н., Петриев И.С. патент на полезную модель RUS 134442 16.07.2013]. Определение концентрации дейтерия в полученной воде было проведено на импульсном ЯМР-спектрометре JEOL JNM-ECA 400 MHz по методике ФР. 1.31.1999.00073 «Методика выполнения измерений содержания дейтерия в воде, водно-органических и органических растворах методом спектроскопии ядерного магнитного резонанса». Физиологически полноценную воду с пониженным содержанием дейтерия получали путем добавления в нее минеральных солей (минерализация 314-382 мг/л: гидрокарбонаты - 144-180, сульфаты <1, хлориды - 60-76, кальций - 6, магний - 3, натрий - 50-58, калий - 50-58). В качестве стандартизованной питьевой воды с природной концентрацией дейтерия (150 ppm) использовали дистиллированную воду с аналогичной минерализацией.
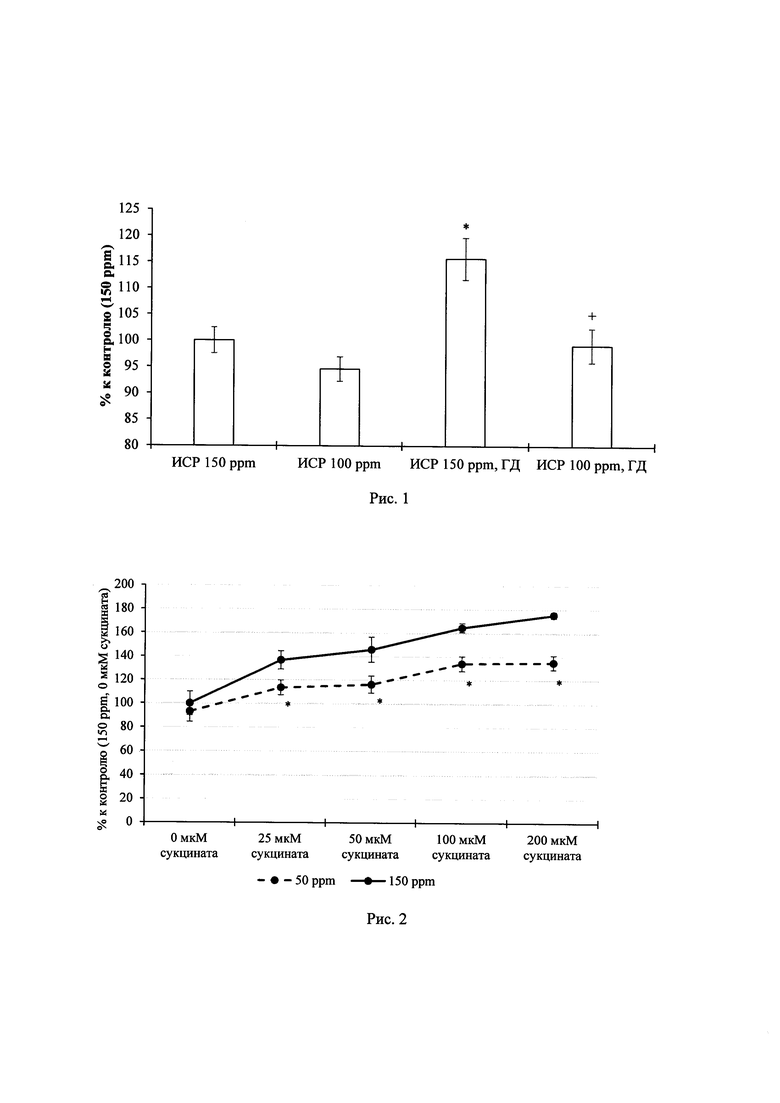
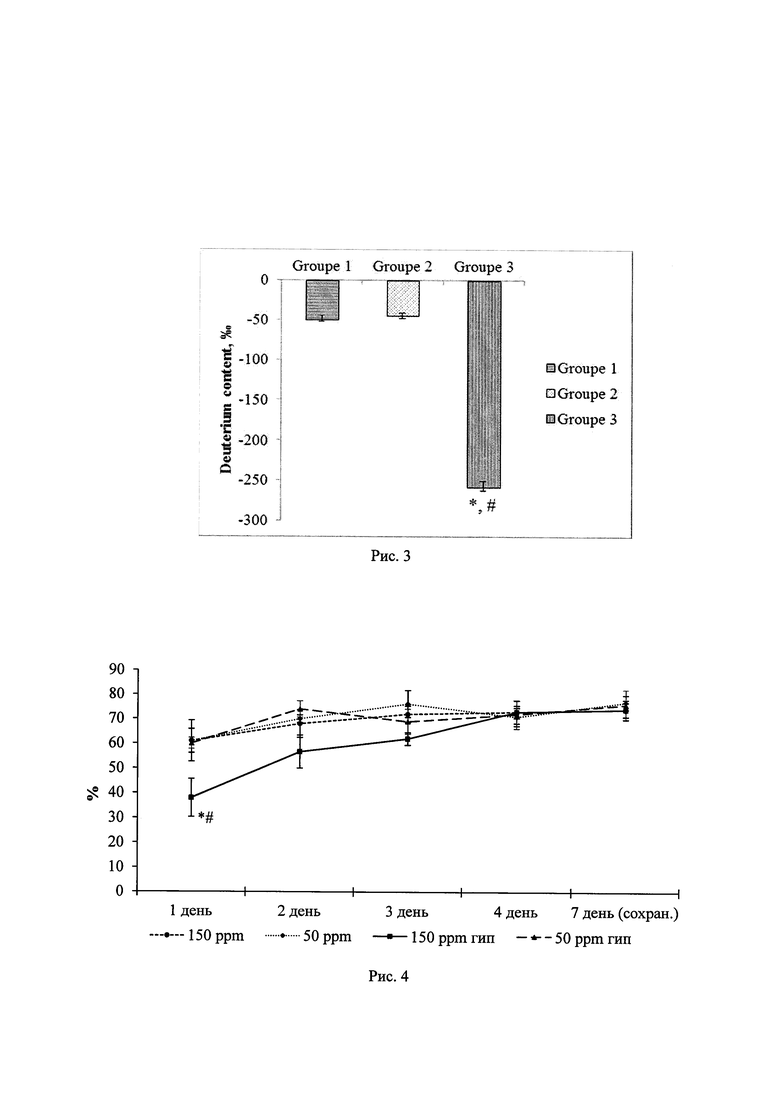
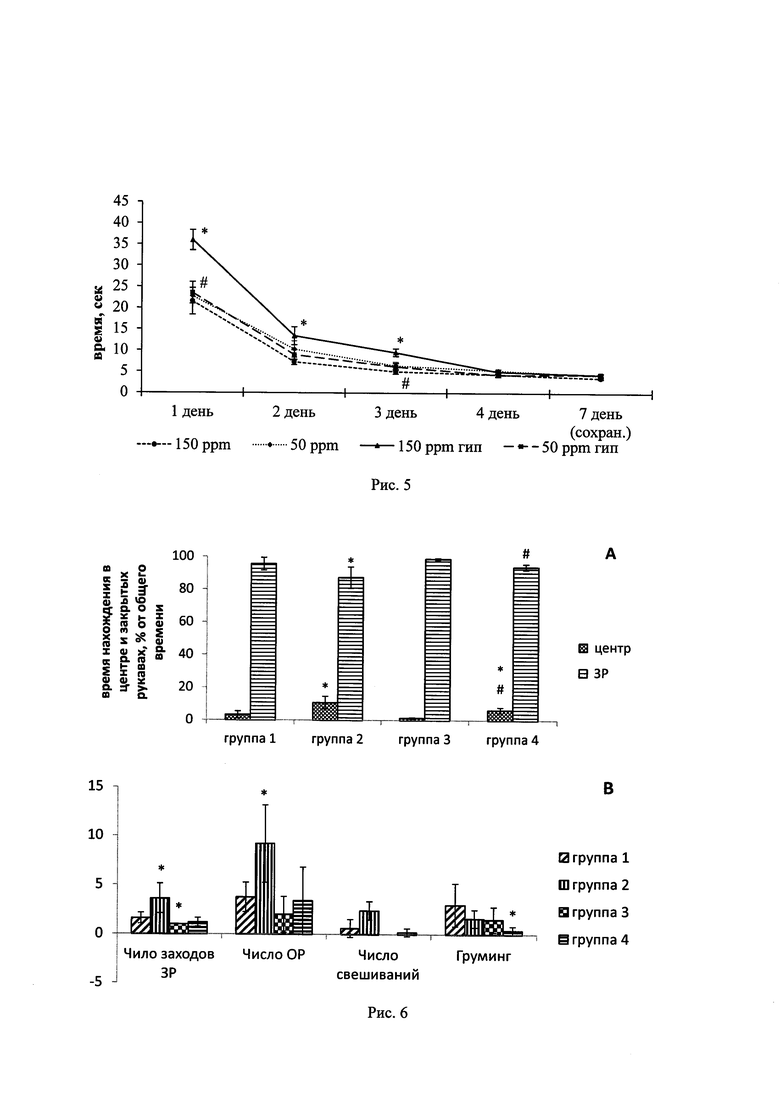
На рис. 1 приведены результаты исследования влияния ОДВ на гибель нейронов при глюкозной депривации. На рис. 2 представлены результаты исследования влияния ОДВ на генерацию активных форм кислорода в культурах нейронов. На рис. 3 представлены результаты исследования влияния потребления ОДВ на содержание дейтерия в ткани мозга. На рис. 4 представлены результаты исследования влияния ОДВ в норме и после воздействия гипоксии на % правильны х побежек в тесте «Т-образный лабиринт». На рис. 5 представлены результаты исследования влияния ОДВ в норме и после воздействия гипоксии на время выполнения условно-рефлекторной реакции в тесте «Т-образный лабиринт», а на рис. 6 - результаты исследования влияния ОДВ в норме и после воздействия гипоксии на поведение крыс в тесте «приподнятый крестообразный лабиринт».
Пример 1. Влияние снижения содержания дейтерия в среде инкубации на выживаемость культивируемых нейронов при глюкозной депривации и на уровень АФК при гипотермии
Эксперименты выполнены на 7-8-дневных культурах нейронов мозжечка 8 дневных крысят линии Wistar, полученных методом ферментно-механической диссоциации [Шурыгина Л.В., Злищева Э.И., Кравцов А.А., Скороход Н.С., Абрамова Н.О. Нейропротекторный эффект комената кальция при окислительном стрессе и глутаматной цитотоксичности на модели культивируемых нейронов мозжечка и спинальных ганглиев // Экспериментальная и клиническая фармакология. 2017. Т. 80. №7. С. 6-10]. Культуры выращивали в 96-луночных планшетах, покрытых поли-L-лизином, в культуральной среде, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ глутамина, 10 мМ буфера HEPES, 25 мМ KCl. В культуры, использованные для определения уровня радикалов, через 24 часа от начала культивирования был добавлен арабинозидмоноцитозид 10 мкМ для предотвращения пролиферации ненейрональных клеток.
Для исследования влияния среды с пониженным содержанием дейтерия на функциональные показатели и уровень гибели нейронов мозжечка использовали инкубационные солевые растворы (ИСР), приготовленные на воде с природным содержанием дейтерия (150 ppm) и на ОДВ с концентрацией дейтерия 50 ppm.
Для определения уровня АФК сформированы группы культур, отличающиеся по содержанию дейтерия в инкубационном солевом растворе (50 и 150 ppm) и по содержанию сукцината, добавленного в раствор для активации дыхательной цепи митохондрий: 0, 25, 50, 100 и 200 мкМ. Инкубационный солевой раствор содержал (мМ): NaCl 154 мМ, KCl 25 мМ, CaCl2 2.3 мМ, MgCl2 1 мМ, NaHCO3 3.6 мМ, Na2HPO4 0.35 мМ, HEPES 10 мМ, glucose 5.6 мМ. Культуры оставляли в среде инкубации на 2 часа. Гипотермия достигалась понижением температуры до 26°С. Известно, что при гипотермии снижается активность антиоксидантных систем клеток, а также может происходить разобщение дыхательной цепи митохондрий, что способно индуцировать гиперпродукцию активных форм кислорода (АФК). Поэтому нами была использована данная модель для оценки влияния ОДВ на образование свободных радикалов, прежде всего АФК. Для обнаружения АФК в культуры добавляли дегидрородамин 123. Время загрузки зонда составляло 30 мин. Затем культуры отмывали и измеряли интенсивность флуоресценции против ИСР при длине волны возбуждения 485 нм, и длине волны испускания 535 нм на многофункциональном ридере для микропланшетов Filter Max F5. Результаты измерения представляли в %, за 100% принимали интенсивность флуоресценции контрольных культур - 150 ppm, без сукцината.
Для определения влияния ОДВ на уровень гибели нервных клеток при глюкозной депривации (ГД) культуры были разделены на 4 группы: 150 и 100 ppm без депривации и 150 и 100 ppm с ГД. Эксперимент проводился в ИСР (мМ): Na2HPO4x12H2O - 0.35, CaCl2 - 2.3, NaCl - 154, KCl - 25, NaHCO3 - 3.6, glucose - 5.6, HEPES - 10, MgCl2×6H2O - 1 (pH 7,3), в который культуры помещали за 2 часа до депривации глюкозы. Депривацию глюкозы проводили в течение 1 часа в инкубационной среде того же состава, но без глюкозы. Затем культуры возвращали в исходный солевой раствор с глюкозой и помещали в CO2-инкубатор. Через 24 часа в культуры был добавлен йодид пропидия (PI) в концентрации 5 мкг/мл на 15 мин. Интенсивность флуоресценции измеряли против солевого раствора после отмывки культур при длине волны возбуждения 535 нм, эмиссии 625 нм на многофункциональном ридере для микропланшетов Filter Max F5. Результаты измерения представляли в процентах, за 100% принимали интенсивность флуоресценции контрольных культур - 150 ppm (150 ppm - природный уровень дейтерия).
Результаты исследований приведены на рисунках 1 и 2.
Анализ результатов исследований (рис. 1) показал, что удаление глюкозы из среды инкубации приводит к повышению уровня гибели нейронов в сравнении с контролем на 15,7% (* - р<0.05 к «ИСР 150 ppm»). В культурах, помещенных в среду с ОДВ и подвергнутых ГД, уровень гибели практически не отличается от контроля (+ - р<0.05 к «ИСР 150 ppm, ГД»).
Некоторое снижение уровня гибели нейроцитов отмечено в культурах, помещенных в ОДВ в отсутствии ГД (на 5,4%) в сравнении с культурой в состав среды которой входит обычная вода и также отсутствует глюкоза, что является признаком отсутствия побочного/токсического действия ОДВ в условиях нормы.
Таким образом, снижение содержания дейтерия в инкубационной среде до 100 ppm препятствует гибели нейронов, индуцируемой глюкозной депривацией.
Анализ результатов экспериментов по влиянию ОДВ на уровень АФК при гипотермии показал, что в культурах, помещенных в среду с 150 ppm дейтерия, при повышении концентрации сукцината (до 200 мкМ) уровень АФК последовательно возрастал (до 175% от контроля). В культурах, помещенных в среду с 50 ppm дейтерия, уровень АФК был ниже при отсутствии сукцината (93% от контроля) и существенно меньше возрастал при повышении концентрации сукцината (до 135% от контроля при 200 мкМ). Отличия достоверны во всех точках с ненулевой концентрацией сукцината (* - р<0.05 к соответствующей точке 150 ppm).
Таким образом, инкубация культур нейронов в среде с пониженным содержанием дейтерия (50 ppm) препятствует накоплению АФК при гипотермии.
Пример 2. Влияние продолжительности потребления ОДВ на содержание МДА в мозге животных при гипоксии
Для изучения возможных сроков применения ОДВ с целью определения ее эффективности в условиях окислительного стресса исследования проводили в условиях нормоксии (без воздействия гипоксии) и при гипоксическом воздействии после 14, 21, 42 и 56 суток применения ОДВ.
Эксперимент выполнен на 58 крысах-самцах линии Wistar в возрасте 2,5-3,0 месяца (массой от 250 до 280 г). Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище в пластмассовых клетках по 3-4 крысы (в соответствии с нормами размещения животных). Условия содержания животных были стандартизированы: температура - (20±3)°С, влажность - (48±2) %, освещение режим день/ночь (с 6.00 до 18.00 / с 18.00 до 6.00). В качестве подстила использовали березовую стружку. На протяжении всего эксперимента животные потребляли стандартный концентрированный комбикорм по ГОСТ Р 50258. Эксперименты проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приказ Минздравсоцразвития РФ от 23.08.2010 N 708н «Об утверждении правил лабораторной практики»).
Оценивали влияние ОДВ на содержание одного из продуктов перекисного окисления липидов - малонового диальдегида (МДА) в тканях головного мозга крыс в условиях нормоксии (без воздействия гипоксии) и через 1 сутки после гипоксического воздействия. Острую гипоксию с гиперкапнией моделировали у крыс, помещая их в герметичные сосуды, емкостью 1 л. Животные находились в таких условиях до появления первого атонального вздоха. После этого крыс извлекали и помещали в стандартные клетки.
Животные были разделены на группы по 5-7 животных в каждой:
1) контроль - крысы, получавшие в рационе воду с концентрацией дейтерия равной естественной (150 ppm), без гипоксического воздействия; 4
2) крысы, получавшие в рационе ОДВ (50 ppm) в течение 14, 21, 42 или 56 дней, без гипоксического воздействия;
3) крысы, получавшие в рационе воду с концентрацией дейтерия равной естественной (150 ppm), подвергнутые острой гипоксии;
4) крысы, получавшие в рационе ОДВ (50 ppm) в течение 14, 21, 42 или 56 дней и подвергнутые острой гипоксии.
Содержание МДА определяли по концентрации окрашенного комплекса, образующегося при взаимодействии МДА с тиобарбитуровой кислотой по методу [Гаврилов В.Б., Гаврилова А.Р., Мажуль Л.М. Анализ методов определения продуктов перекисного окисления липидов в сыворотке крови по тесту с тиобарбитуровой кислотой // Вопр. мед. химии. 1987. Т. 33, №1. С. 118-122].
Статистическую обработку полученных данных проводили с использованием STATISTICA 10. Для оценки достоверности различий выборок в биохимических тестах применяли t-критерий Стьюдента.
Результаты исследования приведены в таблице 1.
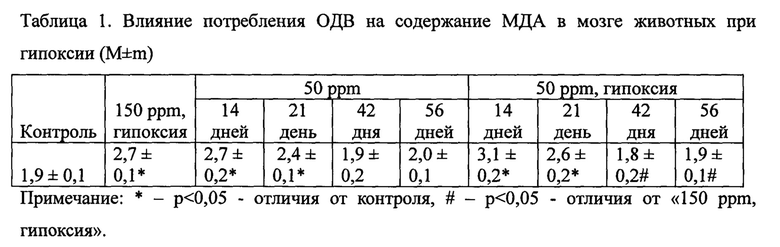
Данные, представленные в таблице 1, свидетельствуют о том, что применение ОДВ в условиях нормы (без гипоксического воздействия) в течение 14 дней увеличивает содержание МДА до уровня такового в группе «150 ppm, гипоксия». И только через 21 сутки применения уровень МДА становится ниже, чем в группе «150 ppm, гипоксия» (на 26%). При применении ОДВ в течение 42 дней как в условиях нормы, так и при воздействии гипоксии содержание МДА остается на уровне контроля (150 ppm). При дальнейшем применении ОДВ (50 ppm в течении 56 суток содержание МДА не изменилось и оставалось на уровне контроля (150 ppm). Полученные данные указывают на то, что оптимальным сроком применения ОДВ при окислительном стрессе является 42-56 суток.
В этой связи исследование влияния ОДВ на метаболические процессы и функциональные свойства ЦНС в экспериментах были выполнены при применении ОДВ в течение 42-х и 56 суток.
Пример 3. Влияние потребления ОДВ на интенсивность свободнорадикального окисления, содержание МДА и активность каталазы в мозге животных при гипоксии
Эксперимент выполнен на 28 крысах-самцах линии Wistar в возрасте 2,5 месяца (массой от 240 до 270 г). Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище в пластмассовых клетках по 3-4 крысы (в соответствии с нормами размещения животных). Условия содержания животных были стандартизированы: температура - (20±3)°С, влажность - (48±2) %, освещение режим день/ночь (с 6.00 до 18.00 / с 18.00 до 6.00). В качестве подстила использовали березовую стружку. На протяжении всего эксперимента животные потребляли стандартный концентрированный комбикорм по ГОСТ Р 50258. Эксперименты проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приказ Минздравсоцразвития РФ от 23.08.2010 N 708н «Об утверждении правил лабораторной практики»).
Влияние ОДВ на про- и антиоксидантные процессы в тканях головного мозга крыс определяли в условиях нормоксии (без воздействия гипоксии) и через 1 сутки после гипоксического воздействия. Острую гипоксию с гиперкапнией моделировали у крыс, помещая их в герметичные сосуды, емкостью 1 л. Животные находились в таких условиях до появления первого атонального вздоха. После этого крыс извлекали и помещали в стандартные клетки.
Животные были разделены на 4 группы по 7 животных в каждой:
группа 1 (контроль) - интактные крысы, получавшие в рационе воду с концентрацией дейтерия равной естественной (150 ppm) в течение шести недель, без гипоксического воздействия;
группа 2 - крысы, получавшие в рационе ОДВ (50 ppm) в течение шести недель, без гипоксического воздействия;
группа 3 - крысы, получавшие в рационе воду с концентрацией дейтерия равной естественной (150 ppm) в течение шести недель, на 43 день эксперимента подвергнутые острой гипоксии;
группа 4 - крысы, получавшие в рационе ОДВ (50 ppm) в течение шести недель, на 43 день эксперимента подвергнутые острой гипоксии.
Влияние на окислительные процессы оценивали по изменению уровня свободнорадикального окисления (СРО) и одного из продуктов перекисного окисления липидов - МДА в тканях головного мозга. Уровень СРО изучали хемилюминесцентным анализом на приборе "SmartLum 5773". Определяли светосумму хемилюминесценции в условных единицах. По интенсивности хемилюминесценции судили о содержании свободных радикалов [Фархутдинов P.P., Лиховских В.А. Хемилюминесцентные методы исследования свободно-радикального окисления в биологии и медицине. Уфа. 1995]. Содержание МДА определяли по концентрации окрашенного комплекса, образующегося при взаимодействии МДА с тиобарбитуровой кислотой по методу [Гаврилов В.Б., Гаврилова А.Р., Мажуль Л.М. Анализ методов определения продуктов перекисного окисления липидов в сыворотке крови по тесту с тиобарбитуровой кислотой // Вопр. мед. химии. 1987. Т. 33, №1. С. 118-122]. Влияние на антиоксидантную систему мозга оценивали по активности каталазы, определенной по убыли перекиси водорода в среде инкубации по методу [Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы // Лаб. дело. 1988. №1. С. 16-19].
Статистическую обработку полученных данных проводили с использованием STATISTICA 10. Для оценки достоверности различий выборок в биохимических тестах применяли t-критерий Стьюдента.
Результаты исследований представлены в таблице 2.
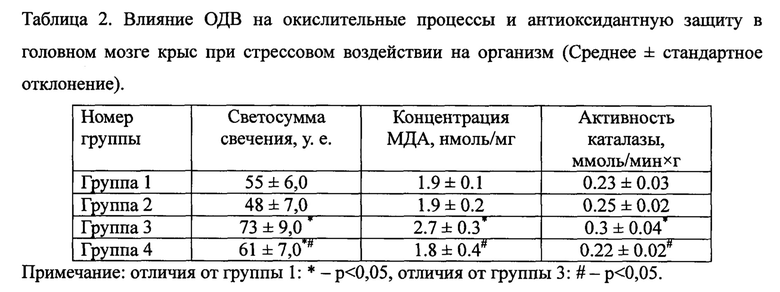
Анализ окислительных процессов в головном мозге крыс в условиях нормы и после гипоксического воздействия показал, что при стрессовом воздействии в головном мозге наблюдается усиление окислительных процессов (табл. 2). Так в головном мозге крыс группы 3 уровень свободных радикалов и содержание МДА достоверно превышали (на 32,0% и 42,1%, соответственно) аналогичные показатели в головном мозге контрольных животных. Увеличилась в этой группе и ферментативная активность каталазы (на 30,4%, р<0,05). В то время как в группе 4 отмечались статистически значимое снижение уровня свободных радикалов (на 16,4%) и МДА (на 50,0%), по сравнению с крысами группы 3 и практически одинаковая в сравнении с контрольной группой ферментативная активность каталазы.
Таким образом, применение ОДВ в условиях стрессового воздействия на организм (острой гипоксии) препятствует развитию окислительных процессов в головном мозге. Применение ОДВ в нормальных условиях практически не оказало влияния на уровень СРО, содержание МДА и активность каталазы, что является признаком отсутствия побочного/токсического действия ОДВ в условиях нормы.
Пример 4. Влияние потребления ОДВ на показатели прооксидантно-антиоксидантного баланса и содержание дейтерия в тканях головного мозга
Исследование было выполнено на 24 крысах линии Вистар в возрасте 3 месяцев (массой от 253 до 286 г), произвольно разделенных на 3 группы:
группа 1 - интактные крысы (n=8), которые получали в рационе минерализованную воду с концентрацией дейтерия равной естественной (150 ppm) в течение 8 недель (гипоксия у них не моделировалась);
группа 2 - крысы (n=8), которые получали в рационе минерализованную воду с концентрацией дейтерия равной естественной (150 ppm) в течение 8 недель, на 57 день эксперимента им моделировали острую гипоксию;
группа 3 - крысы (n=8), которые получали в рационе минерализованную обедненную по дейтерию воду (50 ppm) в течение 8 недель, на 57 день эксперимента им моделировали острую гипоксию.
В период проведения эксперимента животных содержали в стандартных условиях вивария при свободном доступе к воде и пище. Условия содержания животных были стандартизированы: температура - (20±3)°С, влажность - (48±2)%, освещение режим день/ночь (с 6.00 до 18.00 / с 18.00 до 6.00). В качестве подстила использовали березовую стружку. На протяжении всего эксперимента животные потребляли стандартный концентрированный комбикорм по ГОСТ Р 50258. Эксперименты проводили в соответствии с требованиями Приказа МЗ РФ №267 от 19 июня 2003 года «Об утверждении правил лабораторной практики».
Острую гипоксию с гиперкапнией моделировали, помещая крыс в герметично закрытый сосуд объемом 1 литр, в котором крысы находились под непрерывным мониторингом до появления первого атонального вздоха, после чего крыс извлекали и помещали обратно в клетку. Через сутки после моделирования гипоксии проводили декапитацию, после чего головной мозг извлекали и помещали на 1 сутки в жидкий азот.
В супернатанте тканей головного мозга определяли: активность каталазы, ГПО, ГР, СОД; количество продуктов, реагирующих с тиобарбитуровой кислотой; содержание SH-групп; общую АОА.
Метод определения активности каталазы был основан на регистрации скорости утилизации пероксида водорода (Н2О2) в реакционной смеси, в которую вносили 200 мкл супернатанта. О скорости утилизации Н2О2 судили по выраженности понижения экстинкции реакционной смеси при 260 нм, на которой пероксид водорода имел максимум светопоглощения [Beers R., Sizer I. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase // J. Biol. Chem. 1952. Vol. 195. P. 133-140]. Активность фермента выражали в миллимолях Н2О2, разрушенного за 1 минуту в 1 литре супернатанта, или ммоль/(мин⋅л).
Активность СОД определяли с помощью метода, основанного на торможении аутоокисления кверцетина в результате присутствия СОД в супернатанте. При участии СОД происходит дисмутация супероксидного анион-радикала, который образуется при окислении раствора кверцетина, инициируемого внесением N,N,N1,N1-тетраметилэтилендиамином в присутствии О2 [Костюк В.А., Потапович А.И., Ковалева Ж.И. Простой и чувствительный метод определения супероксиддисмутазы, основанный на реакции окисления кверцитина // Вопросы медицинской химии. 1990. Т. 36. Вып. 2. С. 88-91]. Активность фермента выражали в процентах ингибирования окисления кверцетина (%), которые рассчитывали по формуле: А=(Econ-Еехр)/Econ⋅100, где Econ - разница между концентрациями кверцетина через 15 секунд и 15 минут в контрольной пробе, Еехр - разница между концентрациями кверцетина через 15 секунд и 15 минут в опытной пробе, 100 - проценты (%).
Также с целью более углубленного исследования механизмов реализации антиоксидантной защиты в тканях головного мозга рассчитывали интегральный показатель КАТ/СОД (активность КАТ/ активность СОД).
Активность ГПО определяли по методу, основанному на способности ГПО обеспечивать реакцию взаимодействия восстановленной формы глутатиона с гидроперекисью трет-бутила. При этом активность энзима оценивали по изменению концентрации восстановленной формы глутатиона в двух пробах: до инкубации с модельным субстратом и после проведения инкубации. Концентрацию восстановленной формы глутатиона оценивали с помощью цветной реакции с 5,5'-дитиобис(2-нитробензойной) кислотой [Robyt J.F., Ackerman R.J., Chittenden C.G. Reaction of protein disulfide groups with Ellman's reagent: a case study of the number of sulfhydryl and disulfide groups in Aspergillus oryzae α-amylase, papain and lysozyme // Arch. Biochem. Biophys. 1971. Vol. 147. P. 262-269]. Расчет активности ГПО в супернатанте производили путем учета изменений содержания восстановленной формы глутатиона в этих пробах до и после их инкубации с гидроперекисью трет-бутила. Ферментативную активность выражали в микромолях разности концентраций глутатиона опытной и контрольной пробах за 1 минуту в 1 литре супернатанта, или мкмоль/(мин⋅л).
Активность ГР определяли, регистрируя уменьшение концентрации никотинамидадениндинуклеотидфосфата (НАДФН). Метод изучения был основан на НАДФН-зависимом каталитическом превращении окисленного глутатиона (GS-SG) в его восстановленную форму (GSH). Ферментную активность выражали в микромолях разности концентраций НАДФН до и после проведения инкубации за 1 минуту в 1 литре супернатанта, или мкмоль/(мин⋅л) [Карпищенко А.И. Медицинские лабораторные технологии. Справочник. - СПб.: Интермедика, 2002. 600 с.].
Содержание SH-групп определяли по методу, основанному на способности тиоловых групп при взаимодействии с 5,5'-дитио-бис (2-нитробензойной кислотой) образовывать окрашенный тионитрофенильный анион, имеющий максимум поглощения при 412 нм [Ellman G.L. Tissue sulfhydryl groups // Arch. Bioch. Biophys. 1959. Vol. 82. P. 70-77].
Также определяли площадь Fe2+-индуцированной вспышки ХЛ по методике [Vladimirov Y.A., Proskurnina E.V., Izmajlov D.Y. Kinetic chemiluminescence as a method for the study of free radical reactions // Biophysics. 2011. T. 56. №6. C. 1055-1062]. Измерение интенсивности свечения проводили в течение 10 минут.
Для определения содержания дейтерия образцы головного мозга лиофилизировали в вакуум-сублимационной сушилке «LS-1000» [Basov А.А., Bykov I.M., Fedulova L.V., Dzhimak S.S., Barishev M.G. Correction of oxidative metabolism in blood and tissues of the internal organs in laboratory animals using isotopic D/H exchange reactions // Medical news of North Caucasus. 2016. Vol. 11. Iss. 1. P. 103-107]. Изотопный состав лиофилизированного мозга лабораторных животных определяли на масс-спектрометре DELTAplus [Baryshev M.G., Basov А.А., Bolotin S.N., Dzhimak S.S., Kashaev D.V., Fedosov S.R., Frolov V.Yu., Shashkov D.I., Lysak D.A., Timakov A.A. NMR, EPR, and Mass Spectroscopy Estimates of the Antiradical Activity of Water with Modified Isotope Composition // Bulletin of the Russian Academy of Sciences. Physics, 2012, Vol. 76. No. 12, pp. 1349-1352]. Твердые образцы складывали в металлическую фольгу и помещали в камеру сгорания с использованием автоматического пробоотборника CARLO ERBA AS 200-LS. Изменения в изотопном составе выражали в промилле (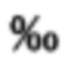 ; одна тысячная) с использованием стандартной дельта-записи δ:
; одна тысячная) с использованием стандартной дельта-записи δ:
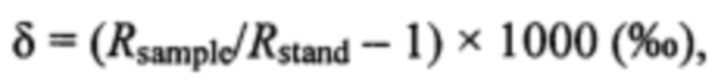
где R - отношение изотопов, a Rsample и Rstand - отношение D/H в исследуемом зонде и стандарте (155,76 ppm). Измерения в твердотельных образцах были откалиброваны по международному образцу (IAEA-CH-7; 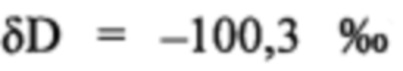 ) и различным внутренним проверенным стандартам.
) и различным внутренним проверенным стандартам.
Результаты исследований представлены в таблице 3.
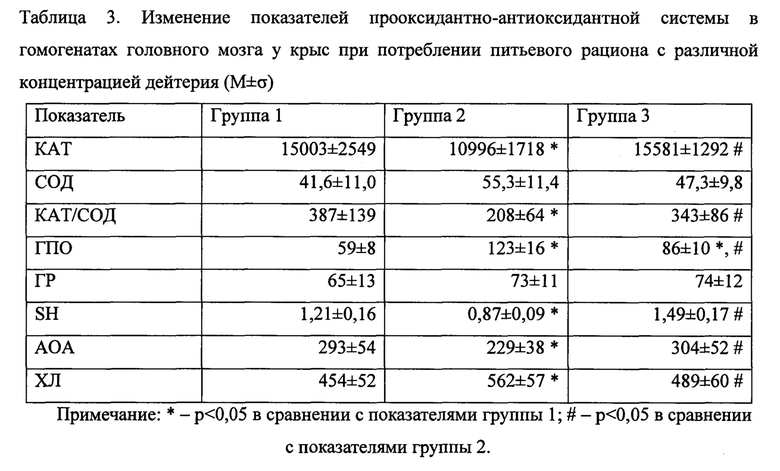
Изменения, наблюдающиеся в ткани головного мозга, характеризовались рядом особенностей функционирования прооксидантно-антиоксидантной системы, проявляющихся, в том числе, достоверным снижением активности каталазы в гомогенатах мозга крыс второй группы на 26,7%, при отсутствии достоверных изменений в сравнении с контролем в группе 3 (табл. 3). В то же время, активность СОД была повышена значительно сильнее в группе 2 по сравнению с группами 1 и 3 (на 32,9% и 16,8% соответственно), что можно охарактеризовать как более сбалансированную работу ферментов первой и второй линии антиокислительной защиты в нейроцитах у крыс, потреблявших воду, обедненную по дейтерию, чем у животных с обычным питьевым рационом при развитии изменений в нервной ткани, обусловленных гипоксическим повреждением. При этом интегральный показатель КАТ/СОД в группе 3 достоверно не отличался от среднего значения контрольной группы, тогда как в группе 2 установлено достоверное снижение этого показателя на 46,3% по сравнению с группой 2 и 39,4% по сравнению с данными в группе 3 (табл. 3), что свидетельствует о повышенном риске нарушения в обезвреживании не только свободных радикалов, но и реактивных молекул (пероксидов), которые могут значительно утяжелять течение окислительного стресса, образуя в результате своего неферментативного распада токсичные вторичные радикалы, запускающие каскадные цепные реакции перекисного окисления биологических молекул в тканях головного мозга.
Также выявлено повышение активности ГПО (на 108,5% и 45,8%) и ГР (на 12,3% и 13,8%) в сравнении с контролем в группах 2 и 3 соответственно (табл. 3), что указывает на значительное напряжение функционирования ферментов тиолового цикла с более оптимальным соотношением активности ГПО и ГР у крыс, потреблявших воду с концентрацией дейтерия 50 ppm. У крыс второй группы существенный дисбаланс в работе ферментов антиокислительной защиты проявлялся наибольшим уменьшением содержания восстановленного глутатиона по сравнению с группами 1 и 3 (на 28,1% и 41,6%), а также меньшей АОА гомогената мозга (на 21,9% и 24,7%) и повышенным показателем ХЛ (на 23,8% и 14,9%), отражающими наименьшую устойчивость нервной ткани при гипоксии у животных, потребляющих обычный питьевой рацион в отличии от крыс, которых поили обедненной по дейтерию водой. Это подтверждает более значительный распад клеточных структур нейроцитов при развитии гипоксии у крыс, потребляющих питьевой рацион с естественной концентрацией дейтерия.
Таким образом, потребление крысами ОДВ приводит к достоверному уменьшению большинства указанных патологических биохимических сдвигов и повышению адаптационного потенциала, повышая резистентность нервной ткани к острому гипоксическому повреждению.
Результаты исследования влияния потребления ОДВ на содержание дейтерия в ткани мозга представлены на рисунке 3.
Как видно из рисунка 3, наблюдалось достоверное уменьшение содержания дейтерия в лиофилизированной ткани головного мозга у животных в группе 3 (в 5,3 и 5,9 раза) по сравнению с крысами из групп 1 и 2 (* - р<0,05 в сравнении с показателями группы 1; # - р<0,05 в сравнении с показателями группы 2), что свидетельствует о том, что наблюдаемый протекторный антиоксидантный эффект является следствием этого снижения содержания дейтерия в ткани мозга.
Пример 5. Влияние потребления ОДВ на процесс обучения и уровень тревожности экспериментальных животных
Эксперимент выполнен на 28 крысах-самцах линии Wistar в возрасте 2,5 месяца (массой от 240 до 270 г). Влияние ОДВ на функциональное состояние ЦНС крыс определяли в условиях нормоксии (без воздействия гипоксии) и через 1 сутки после гипоксического воздействия.
Острую гипоксию с гиперкапнией моделировали у крыс, помещая их в герметичные сосуды, емкостью 1 л. Животные находились в таких условиях до появления первого атонального вздоха. После этого крыс извлекали и помещали в стандартные клетки.
Эксперименты проводились в первой половине светового дня. Животные были разделены на 4 группы по 7 животных в каждой:
группа 1 (контроль) - интактные крысы, получавшие в рационе воду с концентрацией дейтерия равной естественной (150 ppm) в течение шести недель, без гипоксического воздействия;
группа 2 - крысы, получавшие в рационе ОДВ (50 ppm) в течение шести недель, без гипоксического воздействия;
группа 3 - крысы, получавшие в рационе воду с концентрацией дейтерия равной естественной (150 ppm) в течение шести недель, на 43 день эксперимента подвергнутые острой гипоксии;
группа 4 - крысы, получавшие в рационе ОДВ (50 ppm) в течение шести недель, на 43 день эксперимента подвергнутые острой гипоксии.
Функциональное состояние ЦНС животных исследовали в тестах «приподнятый крестообразный лабиринт» (ПКЛ) и «Т-образный лабиринт» [Буреш Я., Бурешова О., Хьюстон Д.П. Методики и основные эксперименты по изучению мозга и поведения. 1991. Москва. 399 с.; Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых физиологических веществ. Москва. 2005]. В тесте ПКЛ оценивали состояние тревожности экспериментальных животных. Приподнятый крестообразный лабиринт с рукавами длиной 90 см, имел два открытых и два закрытых рукава, высота стенок 15 см. Учитывали число заходов в закрытые рукава лабиринта, число стоек и свешиваний, число заходов в открытые рукава лабиринта и число подходов к дистальному концу открытых рукавов, а также время пребывания в открытых, закрытых рукавах и центре лабиринта. Все показатели в этих тестах регистрировали в течение 5 мин наблюдения.
Выработку условного рефлекса с положительным подкреплением оценивали в тесте «Т-образный лабиринт». После приучения животных к лабиринту вырабатывали навык чередования право- и левосторонних побежек на положительном подкреплении. Для повышения мотивации обучение проводили на фоне пищевой депривации. Крыс, подвергавшихся 48-часовой пищевой депривации, помещали в стартовый отсек «Т-образного лабиринта», в одном из рукавов которого располагалась кормушка с пищей. Через 30 с после посадки крыс открывали дверцу стартового отсека. Щелчок открывания дверцы служил условным раздражителем. Учитывали следующие показатели: процент правильных побежек, время выполнения условно-рефлекторной реакции. В течение 4 суток обучения для выработки навыка двустороннего чередования право- и левосторонних побежек каждое животное совершало по 20 побежек ежедневно. Затем через 2 суток проверялось сохранение памятного следа. Данные побежек усреднялись за каждый день.
Статистическую обработку полученных данных проводили с использованием STATISTICA 10. Для оценки достоверности различий выборок в поведенческих тестах применяли U-критерий Мана-Уитни.
Результаты исследований в тесте Т-образный лабиринт представлены на рисунках 4 и 5.
Исследование влияния воды с пониженным содержанием дейтерия (50 ppm) на выработку условного рефлекса с положительным подкреплением у крыс в условиях нормы и гипоксии с гиперкапнией в Т-образном лабиринте (рис. 4) показало, что ОДВ в норме не оказывает влияния на обучаемость животных (один из признаков отсутствия побочного действия). Число правильных побежек в группе 2 (50 ppm) во все дни обучения практически не отличалось от таковых в контроле. Достоверно ниже (на 23,0%), чем в контроле в первый день обучения было число правильных побежек у животных группы 3 («150 ppm, гипоксия»; * - р<0,05, по сравнению с группой «контроль 150 ppm», # - р<0,05 - достоверность в сравнении с группой «50 ppm, гипоксия»). На второй день процент правильных побежек в этой группе хотя и повысился до 56,7%, однако был ниже, чем в контроле (68,0%). Тенденция к повышению обучаемости крыс в группе 3 (150 ppm, гипоксия) и приближению показателей к контрольным значениям отмечалась и в последующие дни. На четвертый день процент правильных побежек практически не отличался от контроля. В то время как в группе 4 (50 ppm, гипоксия) доля правильных побежек во все дни исследования находилась на уровне контроля (группа 1) и достоверно превышала уровень таковой в группе 3 в первый день.
Кроме того, установлено, что при выполнении побежек (рис. 5) в группе 3 (150 ppm, гипоксия) отмечались изменения во времени выполнения условно-рефлекторной реакции (УРР). Так в первый день обучения у всех животных время принятия решения было самым длительным, при этом время выполнения УРР в группе 3 (150 ppm, гипоксия) достоверно превышало (на 66,7%) таковое в контрольной группе (150 ppm) и на 52,7% в группе крыс, получавших воду с пониженным содержанием дейтерия (50 ppm) и подвергнутых гипоксии (группа 4). И, хотя время принятия решения с каждым днем постепенно сокращалось во всех группах, в группе 3 оно было более длительным, чем в контроле (с 1 по 3 день), и достоверно более продолжительным (1 и 3 дни), чем в группе 4 (* - р<0,05 достоверность по сравнению с группой «150 ppm», # - р<0,05 - достоверность «50 ppm, гипоксия» в сравнении с «150 ppm, гипоксия», данные представлены в виде М ± m). И только на четвертый день обучения время выполнения УРР во всех группах практически не отличалось от контроля (группа 1). Также установлено, что в группе 2 показатель во все дни не отличался от контроля.
Через 2 суток после окончания обучения у всех животных сохранились навыки условно-рефлекторной реакции двустороннего чередования право- и левосторонних побежек, при этом существенных отличий между группами не было. Не было отличий и во времени выполнения условно-рефлекторной реакции.
Таким образом, установлено, что длительное применение ОДВ в норме не оказывает влияния на обучаемость животных, в то время как применение ее до гипоксического воздействия (воздействие амнезирующего фактора) способствует сохранению обучаемости и памяти на уровне контроля, т.е. оказывает выраженный протективный антиамнестический эффект.
Результаты исследований в приподнятом крестообразном лабиринте представлены на рисунке 6.
Результаты изучения влияния воды с модифицированным (D/H) изотопным составом (50 ppm) на тревожность крыс в нормальных условиях и после воздействия гипоксии с гиперкапнией в тесте ПКЛ показали, что через сутки после гипоксии (рис. 6) у крыс, принимавших воду с природным содержанием дейтерия (группа 3), наблюдался более высокий в сравнении с животными в группе 1 (контроль) уровень тревоги, что проявлялось в снижении числа заходов в закрытые рукава на 37,5%, снижении числа ориентировочных реакций на 46,7%, отсутствии свешиваний с открытых рукавов лабиринта. Животные этой группы меньше времени (на 66,7%) находились в центре и более длительный период времени в закрытых рукавах (* - р<0.05, по сравнению с группой 1, # - р<0.05 - достоверность в сравнении с группой 3, данные представлены М ± σ). В открытые рукава не заходили, тогда как контрольные животные провели в них 2% времени.
У крыс 4 группы (50 ppm, гипоксия) отмечалась значительно менее выраженная тревожность в сравнении с 3 группой (150 ppm, гипоксия). Так, крысы, получавшие ОДВ и подвергшиеся гипоксии, больше времени находились в центре и меньше в закрытых рукавах (р<0,05). У этих животных отмечалась более высокая исследовательская активность (число ориентировочных реакций было выше на 41,2%), более низкая частота груминга (на 73,3%), наблюдались свешивания. В открытые рукава не заходили, как и крысы группы 3.
У животных 2 группы (50 ppm) уровень тревоги практически по всем показателям был достоверно ниже, чем у контрольных животных.
Таким образом, анализ поведенческих реакций через сутки после воздействия гипоксии с гиперкапнией в тесте ПКЛ показывает, что у крыс, принимавших воду с природным содержанием дейтерия и подвергшихся гипоксическому воздействию, отмечается высокий уровень тревожности. Длительное (в течение 42 дней) применение ОДВ как в условиях нормы, так до гипоксии способствует значительному снижению эмоциональной тревожности животных.
Как указывалось выше, основной целью нейропротекции при ишемии/ гипоксии является предотвращение распространения необратимого ишемического повреждения. Нейропротекция представляет собой сумму всех средств воздействия, направленных на защиту нейронов от повреждающих факторов [Muresanu D.F. Neuroprotection and neuroplasticity - a holistic approach and perspectives // Journal of Neurologikal Sciens. 2007. Vol. 257. P. 38-43]. Известно также, что для проведения доклинических испытаний препаратов предназначенных для лечения заболеваний с дегенеративными расстройствами исследования выполняют на культивируемых клетках и модельных животных [Andersen Julie K. Oxidative stress in neurodegeneration: cause or consequence? // Nature Reviews Neuroscience. 2004. V. 5. S18-S25].
Нами исследовано влияние сниженного содержания дейтерия на выживаемость культивируемых нейронов мозжечка крыс при глюкозной депривации и на уровень АФК при гипотермии, антиоксидантные, стресс - и нейропротекторные свойства ОДВ в тканях головного мозга экспериментальных животных в условиях нормоксии (без воздействия гипоксии) и через 1 сутки после гипоксического воздействия. Анксиолитическое и антиамнестическое действие потребления ОДВ в норме и условиях гипоксии с гиперкапнией.
Результаты исследований показали, что снижение содержания дейтерия в инкубационной среде до 100 ppm препятствует гибели нейронов, индуцируемой глюкозной депривацией. Показано также, что снижение в культуральной среде содержания дейтерия до 50 ppm препятствует накоплению АФК в культурах при гипотермии. Установлено, что применение ОДВ в условиях стрессового воздействия на организм (острой гипоксии) статистически значимо защищает головной мозг от развития окислительных процессов. В то время как применение ОДВ в нормальных условиях практически не оказывает влияния на уровень СРО, содержание МДА и активность каталазы (рис. 1, 2, табл. 1, 2, 3).
При оценке влияния потребления ОДВ на показатели прооксидантно-антиоксидантного баланса и содержание дейтерия в тканях головного мозга установлено достоверное уменьшение содержания дейтерия в лиофилизированной ткани головного мозга у животных потреблявших ОДВ (в 5,3 и 5,9 раза) по сравнению с крысами, потреблявших воду с природным содержанием дейтерия, указывающий на то, что наблюдаемый протекторный антиоксидантный эффект является следствием этого снижения содержания дейтерия в ткани мозга. То есть потребление крысами ОДВ приводит к достоверному уменьшению большинства исследованных негативных проявлений метаболических процессов в головном мозге при окислительном стрессе и повышению адаптационного потенциала, повышая резистентность нервной ткани к острому гипоксическому повреждению.
Анализ влияния потребления ОДВ на процесс обучения и уровень тревожности экспериментальных животных (анксиолитическое и антиамнестическое действие потребления ОДВ до гипоксического воздействия) показал, что применение ОДВ как в условиях нормы, так до гипоксии способствует значительному снижению эмоциональной тревожности животных. В то время как у крыс, принимавших воду с природным содержанием дейтерия и подвергшихся гипоксическому воздействию, отмечается высокий уровень тревожности. Установлено также, что применение ОДВ в норме не оказывает влияния на обучаемость животных, в то время как применение ее до гипоксического воздействия (воздействие амнезирующего фактора) способствует сохранению обучаемости и памяти на уровне контроля, т.е. оказывает выраженный протективный антиамнестический эффект.
Токсичность ОДВ мы оценивали по показателям свободнорадикального окисления и перекисного окисления липидов в мозге экспериментальных животных (табл. 1, 2), Результаты исследований показали, что применение ОДВ в условиях стрессового воздействия на организм (острой гипоксии) препятствует развитию окислительных процессов в головном мозге. Применение ее в нормальных условиях в течение 42 и более дней практически не оказало влияния на уровень СРО, содержание МДА и активность каталазы, что является признаком отсутствия побочного/токсического действия ОДВ в условиях нормы.
Полученные нами результаты исследований свидетельствуют о том, что длительное применение питьевого рациона с пониженным содержанием дейтерия может быть использовано для коррекции и профилактики патологических состояний центральной нервной системы, развитие которых связано с окислительным повреждением ткани и функциональными расстройствами, при отсутствии побочного воздействия. Полученные данные в выполненных нами экспериментах указывают на то, что ОДВ в питьевом рационе не обладает токсичностью.
Применение обедненной по дейтерию воды расширяет спектр средств с антиоксидантными, стресс- и нейропротекторными свойствами для профилактики и коррекции патологических состояний центральной нервной системы, патогенез которых связан с оксидативным повреждением ткани головного мозга и функциональными расстройствами ЦНС.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ лечения головного мозга при острой гипоксии с гиперкапнией | 2022 |
|
RU2803387C1 |
| НЕЙРОПРОТЕКТОРНОЕ ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО | 2013 |
|
RU2528914C1 |
| АНТИОКСИДАНТНОЕ, СТРЕСС-И НЕЙРОПРОТЕКТОРНОЕ ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО-КОМЕНАТ КАЛИЯ | 2012 |
|
RU2514632C1 |
| НЕЙРОПРОТЕКТОРНОЕ ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО | 2014 |
|
RU2561045C1 |
| ПРИМЕНЕНИЕ L-КАРНОЗИНА ДЛЯ ПРИГОТОВЛЕНИЯ НАНОПРЕПАРАТА, ОБЛАДАЮЩЕГО АНТИГИПОКСИЧЕСКОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2482867C1 |
| Способ получения средства, обладающего нейропротективным, метаболическим действием | 2023 |
|
RU2826494C1 |
| Мицелярный комплекс липоевой кислоты с карнозином для защиты млекопитающих от окислительного стресса | 2016 |
|
RU2647435C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИРАДИКАЛЬНЫМИ, ЦЕРЕБРОПРОТЕКТОРНЫМИ И ПРОТИВОИШЕМИЧЕСКИМИ СВОЙСТВАМИ | 2010 |
|
RU2445090C1 |
| Церебропротекторное средство | 2017 |
|
RU2648451C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИТИЕВОЙ СОЛИ КОМЕНОВОЙ КИСЛОТЫ И ПРИМЕНЕНИЕ ЕЕ КАК АНТИОКСИДАНТНОГО СТРЕСС- И НЕЙРОПРОТЕКТОРНОГО СРЕДСТВА | 2011 |
|
RU2477722C1 |
Изобретение относится к экспериментальной медицине и фармакологии и может быть использовано для профилактики и коррекции нейродегенеративных заболеваний, вызываемых оксидативным повреждением мозга и сопровождающихся функциональными расстройствами центральной нервной системы (ЦНС). Способ профилактики и коррекции нарушений метаболического и функционального состояния ЦНС в условиях стресса включает введение протективного средства, обладающего антиоксидантными свойствами, в качестве которого используют обедненную дейтерием воду в течение не менее 42 дней. 1 з.п. ф-лы, 6 ил., 3 табл., 5 пр.
1. Способ профилактики и коррекции нарушений метаболического и функционального состояния центральной нервной системы в условиях стресса, включающий введение протективного средства, обладающего антиоксидантными свойствами, отличающийся тем, что в качестве протективного средства используют обедненную дейтерием воду.
2. Способ по п. 1 отличается тем, что замена воды с природным уровнем дейтерия на обедненную по дейтерию воду производится в течение не менее 42 дней.
| T | |||
| Strekalova et al | |||
| Deuterium content of water increases depression susceptibility: The potential role of a serotonin-related mechanism / Behavioural Brain Research, 2015, 277, pages 237-244 | |||
| L.G | |||
| Boros et al | |||
| Submolecular regulation of cell transformation by deuterium depleting water exchange reactions in the tricarboxylic acid substrate cycle |
Авторы
Даты
2020-03-18—Публикация
2019-09-27—Подача