Изобретение относится к области биологически активных фармацевтических и медицинских композиционных материалов и препаратов, и может быть использовано в. хирургии при восстановлении и лечении костной ткани.
В настоящее время в медицинской практике для замены и восстановления костной ткани широко используют биоматериалы на основе фосфатов кальция, такие как Ca10(PO4)6F2 (фторапатит - ФАП), но главным образом - Ca10(PO4)6(OH)2 (гидроксиапатит - ГАП), которые практически идентичны по структуре и химическому составу природной костной ткани и обладают выраженным остеотропным поведением в биологических средах. Эти вещества обладают чрезвычайной хрупкостью, и проблема лечения патологий и восстановления различных дефектов костной ткани с применением ГАП и/или ФАП остается весьма актуальной, поскольку недостатком биокерамики на основе апатитов являются: низкая механическая прочность и трещиностойкость, невысокая адгезия на металлической или керамической основе имплантата, особенно малопористого, что ограничивает широкое использование ГАП (ФАП), как для ликвидации дефектов костных тканей, так и создания покрытий с повышенной биосовместимостью на имплантате. Улучшить свойства биоматериалов на основе ГАП (ФАП) возможно за счет добавления к частицам ГАП и/или ФАП связующего агента, в частности желатина, частично гидролизованного белка коллагена.
Известен материал - искусственная каменная кальцинированная ткань, которая предназначена для восстановления функции и формы твердых: тканей живого вещества, в состав материала входит органический материал-водный раствор коллагена или желатина, смешанный с неорганическим материалом - смесью порошков кальций водородфосфата и тетракальцийфосфата (патент Япония №JP 2018-68467; МПК A61K 6/033. A61K 6/08, A61L 27/02, A61L 27/12; 2018 г.).
Недостатком известного материала является использование в качестве неорганического компонента смеси порошков кальций водородфосфата и тетракальцийфосфата, структура и химический состав которых не отвечают полностью природной костной ткани и не обладают явно выраженным остеотропным поведением в биологических средах.
Известен материал, используемый в качестве основы для восстановления костной ткани при лечении костного туберкулеза, который содержит допированный стронцием измельченный до нанометрового размера гидроксиапатит, желатин и лечебный препарат - альгинат натрия (заявка CN 109432498; МПК A61L 27/12, A61L 27/22, A61L 27/50, A61L 27/54, A61L 27/5; 2019 г.).
Однако специфическое назначение известного материала обусловливает сложность его состава, а именно использование допированного гидроксиапатита, получение которого предполагает дополнительный синтез исходного компонента, например, взаимодействием олеатов металла с раствором трибутилфосфата.
Известно композиционное покрытие для репарирования костных дефектов, которое включает желатин и гидроксиапатит, с добавкой сшивающего агента, который представляет собой гидрофильный радикал гидроксил или амино (одно из веществ: этандиоевая кислота, янтарная кислота или пимелиновая кислота), которые смешивают в соответствии с массовым соотношением 5÷8 : 5÷10 : 2÷4, и смесь помещают в один из растворителей: вода, тетрагидрофуран, эфир (заявка CN 109481733; МПК A61L 27/32, A61L 27/34, A61L 27/50, A61L 27/58; 2019 г.) (прототип).
Однако недостатком известного биоактивного покрытия является использование гидрофильного агента, что может при удалении влаги привести к увеличению пористости, при этом прочность на разрыв составляет 30-50 МПа.
Таким образом, перед авторами стояла задача разработать биоактивное покрытие для восстановления костной ткани оптимального состава максимально близкого к костной ткани, обладающего наряду с повышенной адгезионной прочностью (прочностью на разрыв) невысокой пористостью на поверхности имплантата или поврежденной ткани, при этом с высокой биодеградацией, способствующей регенерации костной ткани при различных костных патологиях, возможностью изготовления костных имплантатов и замещения дефектов, обладающее остеотропным поведением в биологических средах.
Поставленная задача решена в предлагаемом биоактивном покрытии для восстановления костных тканей, содержащем апатит и желатин, которое содержит апатит с размером частиц не более 10 мкм при следующем соотношении компонентов (масс. %):
При этом биоактивное покрытие по п. 1 содержит в качестве апатита гидроксиапатит или фторапатит.
В настоящее время из патентной и научно-технической литературы не известно биоактивное покрытие для восстановления костных тканей, содержащее апатит с размером частиц не более 10 мкм и желатин при соотношении компонентов (масс. %):
Исследования, проведенные авторами, подтвердили возможность получения биоактивного покрытия с использованием различных основ (титана, никеля, керамики), обеспечивающего высокую адгезию на поверхности как компактных, так и пористых; материалов и хорошую механическую прочность за счет невысокой пористости покрытия. При этом достаточным и необходимом условием является соблюдение предлагаемого состава покрытия, как по соотношению компонентов, так и по размерности частиц используемого апатита. При содержании апатита менее 35 масс. %, а водного раствора желатина более 65 масс. % возникает вероятность не полного равномерного покрытия поверхности основы, что ведет к снижению адгезии, а при содержании апатита более 55 масс. %, а водного, раствора желатина менее 45 масс. % возникает вероятность появления несмоченных раствором желатина частиц апатита, что ведет к снижению механической прочности. Размер частиц апатита должен быть в диапазоне ≤10 мкм, так как крупные включения, более 10 мкм будут снижать прочность покрытия из-за увеличения границы раздела фаз, что приводит к ухудшению пропитки частиц раствором желатина.
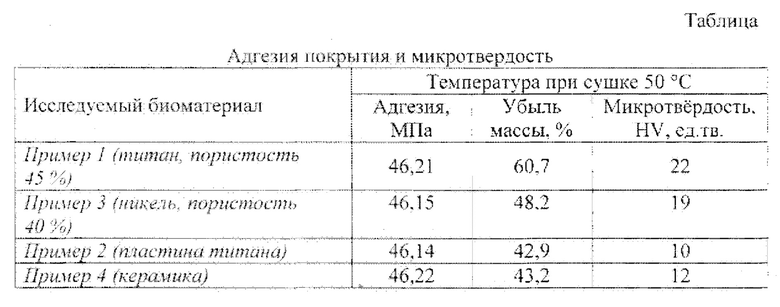
Предлагаемое покрытие может быть получено следующим образом. Для получения 5-10 масс. % водного раствора желатина желатин заливают соответствующим количеством воды и выдерживают 15 минут для набухания, после чего нагревают на водяной бане до температуры 60-80°C и перемешивают до полного растворения желатина, в теплый водный раствор вводят мелкокристаллический порошок гидроксиапатита или фторапатита с крупностью частиц не более 10 мкм, проводят тщательное смешивание до полной гомогенизация, то есть смачивания всех частичек. Полученную суспензию наносят на основу (пористый титан, пористый никель, титан, керамика) простым смачиванием или смазыванием поверхности основы. Затем полученные заготовки высушивают на воздухе в течение 24 часов или в. сушильном шкафу при температуре ниже 100°С (50-75°C) в течение 1-2 часов. В результате получают прочное покрытие из биоактивного материала на металлической (титан, никель) или керамической основе. Микротвердость покрытия (среднее значение) и адгезия приведены в таблице.
Прочность сцепления биоактивного покрытия с основой определяли методом центробежного отрыва (центрифуга СМ-6М, ELMI; центростремительное ускорение 500 м/с2). По полученным методом центробежного отрыва данным была рассчитана адгезионная прочность покрытий (табл.) на матрицах различной пористости и различного состава (титан, никель, керамика) в соответствии с формулой:
P=Fцентр/S=m ω2⋅r/S где
Р - адгезионная прочность, Н/м2;
m - масса покрытия, кг;
ω - угловая скорость вращения в момент разрыва, с-2;
r - расстояние от центра масс до оси вращения центрифуга, м;
S - площадь, контакта покрытия и подложки, м2.
На фиг. 1. представлена микроструктура биоактивного покрытия.
На фиг. 2. представлено микроизображение биоактивного покрытия со сформированной пористостью.
На фиг. 3. представлено биоактивное покрытие на титановой пластине.
Предлагаемое техническое решение иллюстрируется следующими примерами:
Пример 1. Берут 1 грамм желатина и заливают 20 мл воды (5 масс. % водный раствор желатина), выдерживают 15 минут для набухания, после нагревают на водяной бане до температуры 60°С и перемешивают до полного растворения желатина, в теплый раствор вводят мелкокристаллический порошок гидроксиапатита состава Ca10(PO4)6(OH)2 в количестве 10 грамм (крупность частиц не более 10 мкм), проводят тщательное смешивание до полной гомогенизации, то есть смачивания всех частиц. Полученную суспензию наносят на основу из пористого титана простым смачиванием. Затем полученную заготовку сушат на воздухе в течение 24 часов. В результате получают прочное покрытие из биоактивного материала состава, масс. %: 5 масс. % водный раствор желатина - 65, гидроксиапатит - 35, на металлической (пористый титан) основе. Микротвердость покрытия (среднее-значение) и адгезия в таблице.
Пример 2. Берут 2 грамм желатина и заливают 20 мл воды (10 масс. % водный раствор желатина), выдерживают 15 минут для набухания, после нагревают на водяной бане до температуры 80°С и перемешивают до полного растворения желатина, в теплый раствор вводят мелкокристаллический порошок фторапатита состава Ca10(PO4)6F2 в количестве 24 грамм (крупность частиц не более 10 мкм), проводят тщательное смешивание до полной гомогенизации, то есть смачивания всех частиц. Полученную тестообразную суспензию наносят путем смазывания на основу - титановую пластину с помощью шпателя. Затем полученную заготовку сушат в сушильном шкафу при температуре 50°C в течение 1 часа. В результате получают прочное покрытие из биоактивного материала на металлической (титан) основе состава, масс. %: 10 масс. % водный раствор желатина - 45, фторапатит - 55. Микротвердость покрытия (среднее значение) и адгезия представлены в таблице.
Приме 3. Берут 1 грамм желатина и заливают 20 мл воды (5 масс. % водный раствор желатина), выдерживают 15 минут для набухания, после нагревают на водяной бане до температуры 60°С и перемешивают до полного растворения желатина, в теплый раствор вводят мелкокристаллический порошок гидроксиапатита состава Ca10(PO4)6(OH)2 в количестве 20 грамм (крупность частиц не более 10 мкм), проводят тщательное смешивание до полной гомогенизации, то есть смачивания всех частиц. Полученную суспензию наносят на основу из пористого никеля простым смачиванием. Затем полученную заготовку сушат на воздухе в течение 24 часов. В результате получают прочное покрытие из биоактивного материала состава, масс. %: 5 масс. % водный раствор желатина - 50, гидроксиапатит - 50, на металлической (пористый никель) основе. Микротвердость покрытия (среднее значение) и адгезия в таблице.
Пример 4. Берут 2 грамм желатина и заливают 20 мл воды (10 масс. % водный раствор желатина), выдерживают 15 минут для. набухания, после нагревают на водяной бане до температуры 80°С и перемешивают до полного растворения желатина, в теплый раствор вводят мелкокристаллический порошок фторапатита состава Ca10(PO4)6F2 в количестве 24 грамм (крупность частиц не более 10 мкм), проводят тщательное смешивание до полной гомогенизации, то есть смачивания всех частиц. Полученную тестообразную суспензию наносят путем смазывания на керамическую основу с помощью шпателя. Затем полученную заготовку сушат в сушильном шкафу при температуре 75°С в течение 2 часов. В результате получают прочное покрытие из биоактивного материала на керамической основе состава, масс. %: 10 масс. % водный раствор желатина - 45, фторапатит - 55. Микротвердость покрытия (среднее значение) и адгезия представлены в таблице.
Таким образом, авторами предлагается биоактивное покрытие для восстановления костных тканей оптимального состава максимально близкого к костной ткани, обладающее наряду с повышенной адгезионной прочностью (прочностью на разрыв) невысокой пористостью, обеспечивающей высокую микротвердость, на поверхности имплантата или поврежденной ткани, при этом с высокой биодеградацией, способствующей регенерации костной ткани при различных костных патологиях, возможностью изготовления костных имплантатов и замещения дефектов, обладающее остеотропным поведением в биологических средах.
| название | год | авторы | номер документа |
|---|---|---|---|
| Биоактивное покрытие на основе гидроксиапатита для восстановления костной ткани | 2024 |
|
RU2829755C1 |
| Композиционный материал на основе гидроксиапатита для костных имплантатов и способ его получения | 2021 |
|
RU2771382C1 |
| Биоактивный композиционный материал для замещения костных дефектов и способ его получения | 2018 |
|
RU2683255C1 |
| Состав для получения композиционного биоматериала на основе гидроксиапатита | 2024 |
|
RU2827698C1 |
| Биомедицинский материал на основе гидроксиапатита и способ его получения | 2022 |
|
RU2782925C1 |
| Биорезорбируемый материал и способ его получения | 2017 |
|
RU2652429C1 |
| Биоматериал на основе гидроксиапатита | 2020 |
|
RU2735032C1 |
| Способ изготовления гранул из биоактивного материала на основе гидроксиапатита или фторапатита | 2021 |
|
RU2753529C1 |
| Сухая смесь на основе гидроксиапатита для водных суспензий для нанесения покрытий на костные имплантаты и водная суспензия на ее основе | 2022 |
|
RU2797279C1 |
| Композиционный биоматериал на основе гидроксиапатита и способ его получения | 2023 |
|
RU2816008C1 |



Изобретение относится к фармацевтической промышленности, а именно к биоактивному покрытию для восстановления костных тканей. Биоактивное покрытие для восстановления костных тканей, содержащее гидроксиапатит или фторапатит с размером частиц не более 10 мкм и 5-10 масс.% водный раствор желатина, взятые в определенных соотношениях. Вышеописанное покрытие максимально близкого состава к костной ткани обладает повышенной адгезионной прочностью (прочностью на разрыв), невысокой пористостью, обеспечивающей высокую микротвердость на поверхности имплантата или поврежденной ткани, при этом с высокой биодеградацией. 3 ил., 1 табл.
Биоактивное покрытие для восстановления костных тканей, содержащее апатит и желатин, отличающееся тем, что оно содержит гидроксиапатит или фторапатит с размером частиц не более 10 мкм при следующем соотношении компонентов, масс.%:
гидроксиапатит или фторапатит - 35÷55;
5-10 масс.% водный раствор желатина - 45÷65.
| CN 109481733 A, 19.03.2019 | |||
| CN 10432498 A, 08.03.2019 | |||
| JP 2018068467 A, 10.05.2018 | |||
| KR 20120036217 A, 17.04.2012. |
Авторы
Даты
2020-03-25—Публикация
2019-08-19—Подача