Изобретение относится к медицине, а именно к экспериментальной онкологии и может быть использовано для изучения патогенеза меланомы.
Модели генно-инженерных (GEM) мышей успешно применялись на протяжении десятилетий при моделировании рака человека (см. Frese K.K, Tuveson D.A. Maximizing mouse cancer models. Nat Rev Cancer. 2007; 7(9): 645-658). Мыши обеспечивают соответствующую платформу проспективных исследований для изучения конкретных гипотез и причинных ассоциаций при заболеваниях человека. Более того, постоянный прогресс в генной инженерии позволяет более точно контролировать пространственные и временные гены, улучшая способность повторять события в канцерогенезе и прогрессировании заболевания (см. Lewandoski М. Conditional control of gene expression in the mouse. Nat Rev Genet. 2001; 2(10): 743-755).
Известно, что меланома возникает в результате злокачественной трансформации меланоцитов, которые представляют собой специализированные пигмент-продуцирующие клетки, происходящие из развивающегося нервного гребня (см. Lin J.Y., Fisher D.E. Melanocyte biology and skin pigmentation. Nature. 2007; 445(7130): 843-850).
У человека меланоциты преимущественно расположены в эпидермальном слое кожи, но также присутствуют в луковицах волосяного фолликула, глазах, внутреннем ухе, слизистых оболочках, центральной нервной системе и при более низкой плотности во многих внутренних органах (см. Dupin Е., Le Douarin N.M. Development of melanocyte precursors from the vertebrate neural crest. Oncogene. 2003; 22(20): 3016- 3023). Следовательно, меланома в основном развивается в коже, но может встречаться и в других местах.
Этиология, гистопатология и генетические характеристики меланом очень разнообразны, что приводит к очень сложному и гетерогенному заболеванию.
Клинически меланома классифицируется в соответствии с характером ее роста (поверхностное распространение меланомы - лентиго), анатомическим расположением (кожная, слизистая или акральная меланома) или состоянием пигментации (меланотическая и амеланотическая меланома) (см. Bastian B.C. The molecular pathology of melanoma: an integrated taxonomy of melanocytic neoplasia. Annu Rev Pathol. 2014; 9: 239-271). Меланома может быть представлена несколькими из этих фенотипов; например, кожная меланома. Более того, последние достижения в геномном анализе позволяют классифицировать молекулярные подтипы меланомы, а их связь с патологическими признаками открывают новые возможности для диагностики (см. Cancer Genome Atlas, N. Genomic Classification of Cutaneous Melanoma. Cell. 2015; 161(7): 1681-1896). Мы сосредоточимся на кожной меланоме, так как это наиболее частый тип у людей.
Меланома кожи является самым смертоносным типом рака кожи и в последние несколько десятилетий его заболеваемость постоянно увеличивается (см. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015; 65(1): 5-29). Меланома может возникать из доброкачественного поражения, называемого невусом, с нерегулярной морфологией, пигментацией и характером роста.
На ранней стадии прогрессирования трансформированные меланоциты расширяются горизонтально в эпидермисе, приводя к фазе радиального роста меланомы. По мере продвижения к фазе вертикального роста клетки меланомы проникают в нижележащую дерму. На поздних стадиях клетки метастатической меланомы достигают сосудистых и лимфатических узлов, а затем распространяются в дистальные отделы (см. Miller A.J., Mihm М.С., Jr Melanoma. N Engl J Med. 2006; 355(1): 51-65). Метастатическая меланома по своей природе устойчива к большинству обычных химиотерапевтических средств и показатели выживаемости пациентов обычно низкие. Таким образом, определение ключевых элементов развития меланомы и их взаимодействия имеет решающее значение для разработки более эффективных стратегий профилактики и лечения.
В этом отношении моделирование необходимо для расшифровки системы, демонстрирующей высокую сложность, такой как рак, и для определения основных факторов, способствующих заболеванию. В общем, процесс моделирования состоит из пяти этапов: 1) определение вопроса для оценки и используемой системы; 2) определение задействованных критических переменных; 3) тестирование модели; 4) сравнение полученных и ожидаемых результатов; 5) корректировка системы для улучшения модели и подтверждения новой гипотезы (см. Thomas R.M., Van Dyke Т., Merlino G., Day C.P. Concepts in Cancer Modeling: A Brief History. Cancer Res. 2016; 76(20): 5921-5925).
Как только объем вопроса, нацеленного на исследование (например, этиология, патогенез или терапевтические ответы), будет установлен, соответствующие «движущие факторы» должны быть предположены и внедрены в модельную систему. Затем модель подвергается определенному маневру для проверки гипотезы, например, УФ-облучению, активации онкогена или терапевтическому лечению. Результаты должны быть сопоставлены с данными в человеческой популяции: эпидемиологическими, патогенетическими или геномными, чтобы оценить актуальность гипотезы. Неожиданные или непредсказуемые результаты предоставят информацию для определения новой комбинации движущих факторов для следующего цикла моделирования. В этом смысле GEM являются мощным инструментом для моделирования рака человека и сыграли особенно важную роль в нашем современном понимании меланомогенеза и прогрессирования.
Этапы развития предшественников меланоцитов у людей и мышей во многом похожи, что делает мышей пригодными для моделирования меланоцитарной патологии человека. Более того, современные технологии генной инженерии позволяют гибко контролировать множественные генетические аллели независимо друг от друга, что позволяет построить модель для проверки многофакторной гипотезы. Модели GEM были использованы для решения трех основных аспектов биологии меланомы: исходные события и мутации, необходимые для злокачественной трансформации, идентификация биомаркеров для диагностики и разработка новых и улучшение известных методов лечения. Современные технологии генной инженерии позволяют гибко контролировать множественные генетические аллели независимо друг от друга, что позволяет построить модель для проверки многофакторной гипотезы (см.  Day С.P., Merlino G., Zaidi М. R. Genetically engineered mouse models of melanoma. Cancer, 2017; 123 (S11): 2089-2103).
Day С.P., Merlino G., Zaidi М. R. Genetically engineered mouse models of melanoma. Cancer, 2017; 123 (S11): 2089-2103).
В частности, модели GEM могут быть использованы в диагностических и терапевтических исследованиях. Клинический исход меланомы сильно зависит от стадии заболевания на момент постановки диагноза. GEM помогут различить доброкачественные и злокачественные поражения и поражения с высоким риском развития метастазирования, что позволяет обнаруживать диагностические биомаркеры. Кроме того, меланома может возникать из нормальных меланоцитов без предраковой стадии. Например, до 80% меланом не имеют гистологических признаков ранее существовавших невусов.
Исследования в моделях GEM могут дать представление и об этом наблюдении. GEM обеспечивают платформу для доклинического тестирования эффективности лекарств и идентификации биомаркеров с предсказательной реакцией и механизмов устойчивости. Хорошим примером является CreER T2, BRAF V600E модель мыши Pten flox/flox, которая внесла значительный вклад в лучшее понимание молекулярных механизмов устойчивости к ингибиторам BRAF V600E (см. Sullivan R.J., Flaherty K.Т. Resistance to BRAF-targeted therapy in melanoma. Eur J Cancer. 2013; 49(6): 1297-1304; см. Smith M.P., Sanchez-Laorden В., O'Brien K., Brunton H., Ferguson J., Young H., Dhomen N., Flaherty K.T., Frederick D.T., Cooper Z.A., Wargo J.A., Marais R., Wellbrock C. The immune microenvironment confers resistance to MAPK pathway inhibitors through macrophage-derived TNF alpha. Cancer Discov. 2014; 4(10): 1214-1229).
За последние два десятилетия мышиные модели сыграли жизненно важную роль в продвижении нашего понимания молекулярных основ процесса меланомагенеза. С учетом того, что в моделирование мышей внедряются все более изощренные молекулярные технологии и сравнительно недавний взрыв геномных данных, ведущий к выявлению более редких генов-драйверов, продвинувших наше понимание генеза, прогрессирования и метастазирования меланомы. Несколько основных направлений остаются недооцененными и недостаточно изученными.
Например, связь между старением и меланомой или молекулярными подтипами и гетерогенностью меланомы остается недостаточно изученной и может принести большую пользу от разработки соответствующих моделей. Будущие исследования на моделях GEM позволят определить, являются ли молекулярные механизмы инициации меланомы общими или различными между этими категориями. Исследования показали, что спектры ультрафиолета могут вызывать меланому у мышей HGF/SF-Tg по разным механизмам (см. Noonan F.P., Zaidi M.R., Wolnicka-Glubisz A., Anver M.R., Bahn J., Wielgus A., Cadet J., Douki Т., Mouret S., Tucker M.A., Popratiloff A., Merlino G., DeFabo E.C. Melanoma induction by ultraviolet A but not ultraviolet В radiation requires melanin pigment. Nat Commun. 2012; 3: 884). Такие результаты помогут установить связь между канцерогенными механизмами и гетерогенностью опухоли, облегчая анализ геномных данных по меланоме человека.
«Активатор плазминогена типа урокиназы» или просто «урокиназа» (uPA) является ключевой сериновой протеазой, участвующей в превращении неактивного плазминогена в активный плазмин, который, в свою очередь, функционирует в ряде событий канцерогенеза. Несколько исследований продемонстрировали участие системы uPA-uPAR на ранних стадиях образования опухоли. Например, прогрессирование меланомы было нарушено у мышей с дефицитом uPA (см. Shapiro R.L., Duquette J.G., Roses D.F., Nunes I., Harris M.N., Kamino H., et al. Induction of primary cutaneous melanocytic neoplasms in urokinase-type plasminogen activator (uPA)-deficient and wild-type mice: cellular blue nevi invade but do not progress to malignant melanoma in uPA-deficient animals. Cancer Res. 1996; 56(15): 3597-3604).
Установлено, что РНК-опосредованное ингибирование как uPA, так и uPAR одновременно запускает апоптоз в клетках рака молочной железы через активацию различных белков каспазы (см. Subramanian R., Gondi C.S., Lakka S.S., Jutla A., Rao J.S. siRNA-mediated simultaneous downregulation of uPA and its receptor inhibits angiogenesis and invasiveness triggering apoptosis in breast cancer cells. Int J Oncol. 2006; 28(4): 831-839.10.3892/ijo.28.4.831).
Было показано, что компоненты системы uPA могут увеличивать пролиферацию клеток посредством протеолитической активации различных типов факторов роста, таких как фактор роста эндотелия сосудов (VEGF), EGF, фактор роста фибробластов-2 (FGF-2) и TGF-β, а также молекулы адгезии, такие как интегрины α5β1 (см. Aguirre-Ghiso J.A., Liu D., Mignatti A., Kovalski K., Ossowski L. Urokinase receptor and fibronectin regulate the ERKMAPK to p38MAPK activity ratios that determine carcinoma cell proliferation or dormancy in vivo. Mol Biol Cell. 2001; 12(4): 863-879.10.1091/mbc.12.4.863; см. Duffy M.J., McGowan P.M., Gallagher W.M. Cancer in vasion and metastasis: changing views. Journal of Pathology. 2008; 214(3): 283-293; см. Ulisse S., Baldini E., Sorrenti S., D'Armiento M. The urokinase plasminogen activator system: a target for anti-cancer therapy. Curr Cancer Drug Targets. 2009; 9(1): 32-71.10.2174/ 156800909787314002).
Считается доказанным, что хроническая боль не симптом какого-то заболевания, а самостоятельная патология, требующая изучения и лечения (см. Яхно Н.Н., Кукушкин М.Л. Хроническая боль: медико-биологические и социально-экономические аспекты. Вестник РАМН. 2012; 9: 54-58). Боль снижает сопротивляемость организма к развитию злокачественных опухолей и является одним из самых постоянных симптомов у онкологических больных, при прогредиентном течении заболевания частота ее увеличивается (см. Кит О.И., Франциянц Е.М., Котиева И.М., Каплиева И.В., Трепитаки Л.К., Бандовкина В.А., Розенко Л.Я., Черярина Н.Д., Погорелова Ю.А. Некоторые механизмы повышения злокачественности меланомы на фоне хронической боли у самок мышей. Российский журнал боли. 2017; 2(53): 14-20; см. Leppert W., Zajaczkowska R., Wordliczek J., Dobrogowski J., Woron J., Krzakowski M. Pathophysiology and clinical characteristics of pain in most common locations in cancer patients. J. Physiology and Pharmacology. 2016; 67(6): 787-799).
Техническим результатом настоящего изобретения является разработка способа активации роста экспериментальной меланомы B16/F10 у мышей, нокаутированных по гену uPA.
Поставленная цель достигается тем, что мышам линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu воспроизводят хроническую нейрогенную боль путем перевязки седалищных нервов с обеих сторон, через 2 недели подкожно под лопатку вводят суспензию опухолевых клеток мышиной меланомы B16/F10 в физиологическом растворе в объеме 0,5 мл и в разведении 1:10.
Измененный генотип мышей способствует торможению злокачественного роста меланомы. Создание модели хронической нейрогенной боли за 2 недели до перевивки меланомы приводит к интенсификации злокачественного процесса. Сравнение двух вариантов медленного и быстрого роста меланомы позволяет выявить патогномоничные признаки, влияющие на развитие меланомы кожи.
Изобретение «Способ отмены генетически детерминированного ингибирования злокачественной опухоли в эксперименте» является новым, так как оно неизвестно в области экспериментальных исследований в онкологии о модификации роста меланомы B16/F10 у мышей.
Новизна изобретения заключается в использовании мышей линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu, в организме которых развитие меланомы B16/F10 идет по замедленному «сценарию», при ее стандартной подкожной перевивке. Воспроизведение модели хронической нейрогенной боли, предваряющее подкожную перевивку меланомы B16/F10, у мышей линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu усиливает злокачественный потенциал меланомы - активизирует ее рост, отменяя генетически детерминированное замедление развития меланомы.
Изобретение «Способ отмены генетически детерминированного ингибирования злокачественной опухоли в эксперименте» является промышленно применимым, так как может быть использовано в научно-исследовательских учреждениях онкологического профиля для воспроизведения экспериментальной модели интенсификации хронической нейрогенной болью замедленного роста меланомы кожи у мышей линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu.
Характеристика животных линии C57BL/6-Plautm1. 1BugThisPlauGFDhu/ GFDhu: окраска шерсти - черная, метод модификации - целевая мутация (нокаут) с получением белка (uPA), неспособного связываться с рецептором активатора плазминогена урокиназного типа. Животные-мутанты могут использоваться в исследованиях хронического воспаления ткани, механизмов фибринолиза, онкогенеза и роста сосудов в тканях.
«Способ отмены генетически детерминированного ингибирования злокачественной опухоли в эксперименте» выполняется следующим образом.
Разнополым мышам линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu предварительно создают модель хронической нейрогенной боли. Все манипуляции с животными производятся в боксе. Инструменты, посуду, руки дезинфицируют общепринятым способом. Каждому животному вводят ксила-золетиловый наркоз: за 10 минут до основного наркоза с целью премедикации животному внутримышечно вводят ксилазин (препарат Ксила) в дозе 0,05 мл/кг массы тела (по инструкции), затем - Золетил-50 в дозе 10 мг/100 г массы тела.
После наступления медикаментозного сна ассистент фиксирует мышь в положении на животе, удаляет шерсть сзади в районе проекции седалищных нервов и смазывает кожу 70% спиртом. Экспериментатор в стерильных условиях выделяет седалищный нерв, накладывает на него лигатуру, ушивает рану послойно и обрабатывает шов 5% спиртовым раствором йода.
Через 2 недели после заживления операционной раны подкожно под лопатку вводят взвесь меланомы B16/F10 в той же дозе и объеме, что и у мышей без боли. Контролем служат мыши линии C57BL/6 соответствующего пола с меланомой B16/F10, перевитой в той же дозе и объеме, как и у мышей линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu, на фоне хронической нейрогенной боли.
Объем опухолевого узла замеряли перед гибелью животных - через 3 или 4 недели.
В таблице 1 представлены результаты изучения влияния хронической нейрогенной боли на злокачественный рост меланомы В16 у самцов и самок мышей с нормальным и измененным геномом.
Разнополым мышам линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu подкожно вводят 0,5 мл взвеси опухолевых клеток мышиной меланомы B16/F10 в физиологическом растворе в разведении 1:10. Для этого, соблюдая все условия асептики, описанные выше, ассистент фиксирует мышь спиной кверху, предварительно удалив шерсть и обработав кожу 5% спиртовым раствором йода чуть ниже правой лопатки. Экспериментатор рукой в стерильной перчатке захватывает кожную складку, в центре которой прокалывает кожу и вводит опухолевую взвесь. Затем извлекает иглу, место введения плотно прижимает ватным тампоном, смоченным в 70% спирте с небольшим добавлением йода, на 1 минуту, чтобы исключить вытекание вводимой взвеси. Контролем служат мыши линии C57BL/6 соответствующего пола с перевивкой меланомы B16/F10 в той же дозе и объеме, что и у мышей линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu.
Другой группе животных: разнополым мышам линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu предварительно создают модель хронической нейрогенной боли. Все манипуляции с животными производятся в боксе. Инструменты, посуду, руки дезинфицируют общепринятым способом. Каждому животному вводят ксила-золетиловый наркоз: за 10 минут до основного наркоза с целью премедикации животному внутримышечно вводят ксилазин (препарат Ксила) в дозе 0,05 мл/кг массы тела (по инструкции), затем - Золетил-50 в дозе 10 мг/100 г массы тела.
После наступления медикаментозного сна ассистент фиксирует мышь в положении на животе, удаляет шерсть сзади в районе проекции седалищных нервов и смазывает кожу 70% спиртом. Экспериментатор в стерильных условиях выделяет седалищный нерв, накладывает на него лигатуру, ушивает рану послойно и обрабатывает шов 5% спиртовым раствором йода.
Через 2 недели после заживления операционной раны подкожно под лопатку вводят взвесь меланомы B16/F10 в той же дозе и объеме, что и у мышей без боли. Контролем служат мыши линии C57BL/6 соответствующего пола с меланомой B16/F10, перевитой в той же дозе и объеме, как и у мышей линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu, на фоне хронической нейрогенной боли.
Объем опухолевого узла замеряли перед гибелью животных - через 3 или 4 недели.
Как видно из результатов, представленных в таблице 1, объем опухолевого узла у мышей линии C57BL/6 была практически одинаковой и у самцов, и у самок. Уменьшение объема опухоли под влиянием хронической нейрогенной боли у животных этой линии было связано с меньшей продолжительностью их жизни.
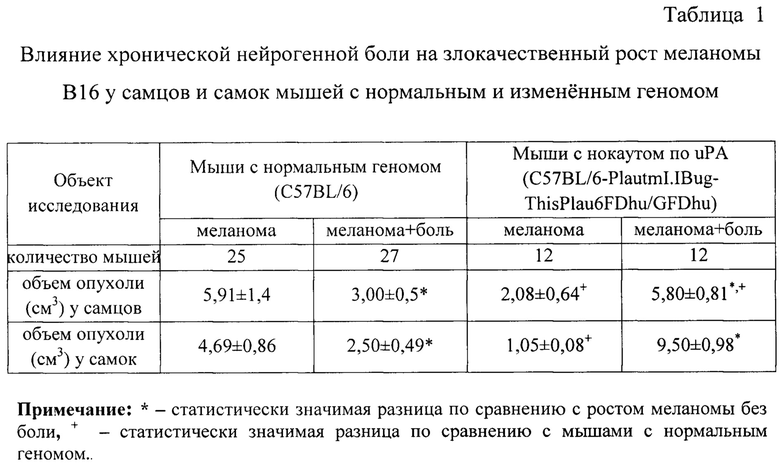
Объем опухолевого узла у мышей-нокаутов без хронической нейрогенной боли был меньше, чем у соответствующих животных линии C57BL/6: у самцов - в 1,97 раза, у самок - в 1,87 раза. Объем опухолевого узла у мышей-нокаутов с хронической нейрогенной болью был больше, чем у соответствующих животных линии C57BL/6 с хронической нейрогенной болью: у самцов - в 1,9 раза, у самок - в 3,8 раза. Объем опухолевого узла у мышей-нокаутов с хронической нейрогенной болью был больше, чем у животных линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu без хронической нейрогенной боли: у самцов - в 2,8 раза, у самок - в 9 раз.
Очевидно, что хроническая нейрогенная боль стимулирует рост меланомы у мышей обоего пола линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu, т.е. отменяет генетически детерминированное замедление роста опухоли, вызванное нокаутом гена урокиназы.
Технико-экономическая эффективность «Способа отмены генетически детерминированного ингибирования злокачественной опухоли в эксперименте» заключается в том, что предварительное перед перевивкой меланомы В16 создание у мышей линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu хронической нейрогенной боли приводит к интенсификации роста меланомы, замедленного нокаутом по гену урокиназы. Это дает возможность изучать патогенез меланомы, что важно для клиники, а также проводить поиск мишеней для таргетной терапии меланомы. Способ экономичен, доступен.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ модификации развития аденокарциномы в эксперименте | 2020 |
|
RU2743960C1 |
| СПОСОБ МОДИФИКАЦИИ ХРОНИЧЕСКОЙ БОЛЬЮ ЗЛОКАЧЕСТВЕННОГО РОСТА МЕЛАНОМЫ В У МЫШЕЙ | 2017 |
|
RU2650587C1 |
| Способ моделирования первично-множественного роста злокачественных опухолей с подавлением одной опухоли другой в условиях первичного иммунодефицита | 2021 |
|
RU2750127C1 |
| Способ предотвращения развития инфаркта миокарда мышей с меланомой, развившейся на фоне хронической нейрогенной боли | 2022 |
|
RU2786322C1 |
| Способ образования опухолевых узлов меланомы в организме экспериментальных животных | 2022 |
|
RU2796892C1 |
| СПОСОБ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ ЦЕЛЬНОКЛЕТОЧНЫХ ПРОТИВООПУХОЛЕВЫХ ВАКЦИН | 2010 |
|
RU2458120C1 |
| Способ создания полинеоплазии со стимуляцией опухолевого роста в условиях первичного иммунодефицита в эксперименте | 2021 |
|
RU2751930C1 |
| Способ усиления роста меланомы В16/F10 по сравнению с ростом меланомы В16/F10 при самостоятельной перевивке и замедления роста LLC (карциномы Льюиса) по сравнению с ростом LLC при самостоятельной перевивке при первично-множественных злокачественных опухолях на фоне первичного иммунодефицита | 2021 |
|
RU2759487C1 |
| Способ экспериментальной биотерапии меланомы В16/F10 | 2022 |
|
RU2779698C1 |
| СПОСОБ СОЗДАНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ КАРЦИНОМЫ ЛЬЮИСА В УСЛОВИЯХ ГИПЕРТИРЕОЗА | 2023 |
|
RU2824963C1 |
Изобретение относится к медицине, а именно к экспериментальным исследованиям в онкологии. Мышам линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu, нокаутированным по гену урокиназы - uРА, воспроизводят хроническую нейрогенную боль путем перевязки седалищных нервов с обеих сторон. Через 2 недели подкожно под лопатку вводят суспензию опухолевых клеток мышиной меланомы B16/F10 в физиологическом растворе в объем. Способ позволяет отменить генетически детерминированное ингибирование меланомы В16/F10 и дает возможность изучить патогенез опухоли. 1 табл.
Способ отмены генетически детерминированного ингибирования злокачественной опухоли в эксперименте, заключающийся в том, что мышам линии C57BL/6-PlautmI.IBug-ThisPlau6FDhu/GFDhu, нокаутированным по гену урокиназы - uРА, воспроизводят хроническую нейрогенную боль путем перевязки седалищных нервов с обеих сторон, через 2 недели подкожно под лопатку вводят суспензию опухолевых клеток мышиной меланомы B16/F10 в физиологическом растворе в объеме 0,5 мл и в разведении 1:10.
| СПОСОБ МОДИФИКАЦИИ ХРОНИЧЕСКОЙ БОЛЬЮ ЗЛОКАЧЕСТВЕННОГО РОСТА МЕЛАНОМЫ В У МЫШЕЙ | 2017 |
|
RU2650587C1 |
| US 20190082664 A1, 21.03.2019 | |||
| Кит О.И | |||
| и др | |||
| Динамика тканевой системы регуляторов плазминогена при меланоме кожи на фоне хронической боли у самок мышей, Известия высших учебных заведений, Северо-Кавказский регион, Естественные науки, Трансляционная медицина, 2018, т.5, 2, с.38-46 | |||
| Pérez-Guijarro E et al | |||
| Genetically | |||
Авторы
Даты
2020-04-13—Публикация
2019-08-01—Подача