Изобретение относится к онкологии, а именно к экспериментальной онкологии, и может быть использовано для изучения свойств митохондрий меланомы формировать опухолевые узлы меланомы.
Традиционно считается, что метастазирование не является основной причиной смерти от рака. Для возникновения метастатического поражения раковые клетки претерпевают ряд фенотипических изменений, которые позволяют приобрести способность к миграции, способность выживать в кровотоке и в ткани назначения, а также потенциал для пролиферации при достижении любого органа. Хотя миллионы раковых клеток способны выходить из первичной опухоли в кровь или лимфу, очень немногим удается инициировать вторичное поражение в удаленном органе (см. Falletta P., Goding C. R., Vivas-García Y. Connecting Metabolic Rewiring With Phenotype Switching in Melanoma. Frontiers in cell and developmental biology. 2022; 10:930250. https://doi.org/10.3389/fcell.2022.930250).
Чтобы оторваться из первичной опухоли и выжить за ее пределами, инвазивным опухолевым клеткам требуется метаболическая гибкость, во-первых, для подпитки процесса миграции, требующего больших затрат энергии (см. Zanotelli M. R., Goldblatt Z. E., Miller J. P., Bordeleau F., Li J., VanderBurgh J. A., et al. Regulation of ATP Utilization during Metastatic Cell Migration by Collagen Architecture. Mol. Biol. Cell. 2018; 29:1-9. 10.1091/mbc.E17-01-0041), а во-вторых, для того, чтобы выдержать среду, ограничивающую питательные вещества, с которой они могут столкнуться.
Для метастазирования опухолевым клеткам необходима метаболическая перестройка, которая обеспечивает быструю и обратимую адаптацию к энергетическим и биосинтетическим требованиям на каждом этапе распространения метастазов. Более того, различные и динамичные микросреды, с которыми сталкивается мигрирующая опухолевая клетка, сами по себе могут быть факторами метаболических изменений (см. Boroughs L. K., Deberardinis R. J. Metabolic Pathways Promoting Cancer Cell Survival and Growth. Nat. Cell Biol. 2015;17:351-359. 10.1038/ncb3124). Таким образом, основными факторами метастазирования, вероятно, являются обратимые изменения внутри и снаружи первичной опухоли, которые приводят к транскрипционной, трансляционной и метаболической перестройке, что в свою очередь вызывают распространение метастазов.
Меланома, самая смертоносная форма рака кожи, возникающая в результате онкогенной трансформации клеток, принадлежащих к меланоцитарной линии (см. Shain A. H., Bastian B. C. From Melanocytes to Melanomas. Nat. Rev. Cancer. 2016; 16:345-358. 10.1038/nrc.2016.37). Хотя изучение генетических изменений имеет важное значение для понимания механизмов, участвующих в возникновении меланомы, имеющиеся данные свидетельствуют о том, что мутационного ландшафта меланомы недостаточно, чтобы объяснить, почему происходит метастатическое распространение. Несмотря на то, что онкогенные мутации могут способствовать метастатическому процессу (см. Pogrebniak K. L., Curtis C. Harnessing Tumor Evolution to Circumvent Resistance. Trends Genet. 2018;34:639-651. 10.1016/j.tig.2018.05.007), они вряд ли будут основными движущими силами, поскольку время, необходимое для возникновения новых прометастатических мутаций, больше, чем период, в течение которого обычно появляются метастазы. Недавнее исследование, проведенное на 50 различных типах опухолей, показало, что некоторые мутации часто можно обнаружить в опухолях со специфическими метастатическими паттернами. Например, мутации NF1 в меланоме преобладают при метастазировании в легкие, в то время как более высокая частота мутаций PTEN обнаруживается при метастазировании в мозг. Однако авторы выявили отсутствие уникальных мутаций или набора мутаций, которые могли бы служить надежными индикаторами для прогнозирования метастатического поведения (см. Nguyen B., Fong C., Luthra A., Smith S. A., DiNatale R. G., Nandakumar S., et al. Genomic Characterization of Metastatic Patterns from Prospective Clinical Sequencing of 25,000 Patients. Cell. 2022; 185: 563-575. e11. 10.1016/j.cell.2022.01.003). Более того, первичные опухоли и метастазы очень часто имеют одинаковую мутационную способность (см. Makohon-Moore A. P., Zhang M., Reiter J. G., Bozic I., Allen B., Kundu D., et al. Limited Heterogeneity of Known Driver Gene Mutations Among the Metastases of Individual Patients with Pancreatic Cancer. Nat. Genet. 2017;49:358-366. 10.1038/ng.3764), поддерживая роль мутаций в инициации метастазов, но не в качестве управляющих метастатическим процессом (см. Patel S. A., Rodrigues P., Wesolowski L., Vanharanta S. Genomic Control of Metastasis. Br. J. Cancer. 2021; 124:3-12. 10.1038/s41416-020-01127-6).
Опухолеобразование и распространение метастазов зависят от митохондриальной биоэнергетики, главным образом, через дыхание, передачу сигналов и динамику (см. Kumar S., Ashraf R., Aparna C. K. Mitochondrial Dynamics Regulators: Implications for Therapeutic Intervention in Cancer. Cell Biol. Toxicol. 2021; 1: 3. 10.1007/s10565-021-09662-5). Митохондрии находятся в центре клеточного метаболизма и сигнальных каскадов (см. Lee KS, Song J. Migrating cells shed damaged mitochondria into the environment Mitochondrial quality control coupled with cell migration in an in vivo mammalian model. Cells Mol. 2021;44(11):781-783. doi:10.14348/molcells.2021.5007. PMID: 34819395; PMCID: PMC8627835). Эти органеллы должны адаптироваться к окружающей среде, чтобы отвечать требованиям клеточного метаболизма. Точно так же клетка должна «знать» о митохондриальной активности и удовлетворять их потребности посредством активации специальных программ экспрессии генов. В результате, системы двунаправленной связи между митохондриями и ядром эволюционировали, и антероградные сигналы и ретроградные пути от митохондрий к ядру стали действовать согласованно для удовлетворения специфических метаболических потребностей раковой клетки (см. Shteinfer-Kuzmine A., Verma A., Arif T., Aizenberg O., Paul A., Shoshan-Barmaz V. Mitochondria and Nucleus Cross-Talk: Signaling in Metabolism, Apoptosis, and Differentiation, and Function in Cancer. IUBMB Life. 2021; 73:492-510. 10.1002/iub.2407). Рядом авторов рассматривается также роль динамики митохондрий в регуляции опухолеобразования и метастазирования меланомы. Например, маркеры деления и слияния митохондрий, такие как белок 1 (DRP1), митохондриальный белок деления 1 (FIS1) и митофузины, оказались повышены в образцах опухолей пациентов по сравнению с их здоровыми тканями и в значительной степени этот факт был связан с метастазированием (см. Soares C. D., de Lima Morais T. M., Mariano F. V., Altemani A., Corrêa M. B., Reis R. R. D. dos, et al. Expression of Mitochondrial Dynamics Markers during Melanoma Progression: Comparative Study of Head and Neck Cutaneous and Mucosal Melanomas. J. Oral Pathol. Med. 2019; 48:373-381. 10.1111/jop.12855). Более того, уровни TMX1 и TMX3, трансмембранных белков с оксидоредуктазной активностью, которые способствуют коммуникации ER-митохондрий, повышаются в клетках меланомы пациентов и связаны с плохим исходом заболевания (см. Zhang X., Gibhardt C. S., Will T., Stanisz H., Körbel C., Mitkovski M., et al. Redox Signals at the ER-mitochondria Interface Control Melanoma Progression. EMBO J. 2019;38. 10.15252/embj.2018100871).
Важно отметить, что митохондриальная динамика, то есть деление / слияние, глубоко вовлечен в регуляцию различных функций митохондрий и каскада метастазов. Однако роль динамики митохондрий в инвазии и метастазировании раковых клеток остается весьма спорной (см. Denisenko TV., Gorbunova AS., Zhivotovsky B. Mitochondrial Involvement in Migration, Invasion and Metastasis. Front Cell Dev Biol. 2019;7:355. doi: 10.3389/fcell.2019.00355. PMID: 31921862; PMCID: PMC6932960).
Митохондрии являются очень важными и сложными органеллами, которые влияют на образование опухолей и распространение метастазов через различные механизмы, включая регуляцию метаболизма, окислительно-восстановительный статус, сигнализацию и пути гибели клеток. В недавних публикациях было освящено существование сложного взаимодействия между функциями, связанными с митохондриями, и динамикой митохондрий. Следовательно, нарушение функций митохондрий способствует образованию опухолей и метастазов. Однако механизмы, связывающие динамику митохондрий с развитием метастазирования, остаются малоизученными. Кроме того, для успешной борьбы со злокачественным процессом следует учитывать гибкость митохондрий, позволяющую раковым клеткам адаптироваться к изменяющейся микросреде и стрессам. Таким образом, лучшее понимание процессов, регулируемых митохондриями, и их сложного взаимодействия с митохондриальным биогенезом является основой для новых перспективных терапевтических стратегии для лечения рака (см. Denisenko TV, Gorbunova AS, Zhivotovsky B. Mitochondrial Involvement in Migration, Invasion and Metastasis. Front Cell Dev Biol. 2019;7:355).
Nagase H. et al. (2021) исследовали роль митохондрий в метастатическом потенциале при злокачественном процессе и обнаружили, что ядерный и цитоплазматический обмен высоко метастатических митохондрий с мутацией G13997A и низкометастатических раковых опухолей с мтДНК дикого типа может привести к замещению митохондрий в низкометастатических клетках на митохондрии из высокометастатических клеток, что приводит к увеличению метастатического потенциала. И наоборот, не наблюдалось признаков метастазирования в высоко метастатических клетках, которые включали митохондрии из клеток с низким уровнем метастазирования (см. Nagase H., Watanabe T., Koshikawa N., Yamamoto S., Takenaga K., Lin J. Mitochondria: Endosymbiont bacteria DNA sequence as a target against cancer. Cancer Sci. 2021;112(12):4834-4843. doi: 10.1111/cas.15143. Epub 2021 Oct 4. PMID: 34533888; PMCID: PMC8645765).
Исследования последнего десятилетия показали существование горизонтального митохондриального переноса между эукариотическими клетками, особенно в раковых клетках, что позволило выявить новый механизм развития и прогрессирования опухоли. Несколько исследований in vitro показали, что межклеточный перенос митохондрий происходит естественным образом. Исследование Kitania T. et al. (2014) доказало, что экзогенные митохондрии человека интернализуются в изогенные клетки во время экспериментов in vitro. Чтобы избежать ложноположительных результатов, авторы прикрепили зонд к донорским митохондриям и клеткам-реципиентам. Трансмиссионная электронная микроскопия подтвердила, что изолированные и обогащенные митохондрии сохранили морфологически интактную внешнюю мембрану. Кроме того, их поверхность была заряжена отрицательно, что свидетельствует о сохранении потенциала митохондриальной мембраны после выделения. Флуоресцентная микроскопия показала, что митохондрии, меченные DsRed, были интернализованы в изогенные эндометриоидные клетки карциномы, экспрессирующие GFP, путем простой совместной инкубации. Кроме того, было обнаружено, что эндометриоидные карциномы (ЭМС), экспрессирующие GFP, несущие митохондрии, меченные DsRed, имеют одно ядро, что исключает возможность слияния клеток между ЭМС, экспрессирующими GFP, и ЭМС, содержащими митохондрии, меченные DsRed. Методами проточной цитометрии подтвердили наличие отдельной популяции двойных положительных клеток GFP и DsRed (см. Kitania T., Kamib D.,Kawasakib T., Nakataa M., Matobaa S., Gojob S. Direct Human Mitochondrial Transfer: A Novel Concept Based on the Endosymbiotic Theory. Transplantation Proceedings. 2014; 46 (4): 1233-1236).
В другом исследовании также было показано, что митохондрии, выделенные из ткани печени мыши путем ксеногенного переноса в клетки человека, лишенные функциональных митохондрий (клетки ρ0), восстанавливали функцию дыхания (см. Katrangi E., D’Souza G., Boddapati S.V., Kulawiec M., Singh K.K., Bigger B., Weissig V. Xenogenic transfer of isolated murine mitochondria into human rho0 cells can improve respiratory function. Rejuvenation Res. 2007;10:561-570. doi: 10.1089/rej.2007.0575.). Эти результаты доказывают возможность применения митохондриальной трансплантации в терапии митохондриальных заболеваний (см. Park A., Oh M., Lee SJ., Oh KJ., Lee EW., et al. Mitochondrial Transplantation as a Novel Therapeutic Strategy for Mitochondrial Diseases. Int J Mol Sci. 2021;22(9):4793. doi: 10.3390/ijms22094793.).
Появляется все больше доказательств того, что мезенхимальные стволовые клетки (МСК) способны передавать митохондрии различным клеткам, включая эндотелиальные клетки, кардиомиоциты и эпителиальные клетки, для восстановления повреждений тканей (см. Feng Yu., Zhu R., Shen J., et al. Human bone marrow mesenchymal stem cells rescue chemotherapy-stressed endothelial cells by transporting mitochondria through tunneling nanotubes. Stem cells and development. 2019;28(10):674-682. doi: 10.1089/scd.2018.0248.). Митохондриальный перенос осуществляется по средствам туннельных нанотрубок (TNT), внеклеточных везикул и слияния клеток (см. Sinha P., Islam MN., Bhattacharya S., Bhattacharya J. Intercellular mitochondrial transport: bioenergetic crosstalk between cells. Contemporary Opinion in Genetics and Development. 2016;38:97-101. doi: 10.1016 / j.gde.2016.05.002; см. Yang F., Zhang Y., Liu S., Xiao J., He Y., et al. Tunneling Nanotube-Mediated Mitochondrial Transfer Rescues Nucleus Pulposus Cells from Mitochondrial Dysfunction and Apoptosis. Oxid Med Cell Longev. 2022;4:3613319. doi: 10.1155/2022/3613319.). Перенос митохондрий через TNT используется в качестве основного способа переноса митохондрий, а также является важным и эффективным путем межклеточной коммуникации, который опосредует межклеточные взаимодействия. Недавние исследования показали, что злокачественные клетки с измененным окислительным фосфорилированием импортируют здоровые (функциональные) митохондрии из окружающих стромальных клеток для стимулирования синтеза пиримидина и клеточной пролиферации. Было показано, что высоко энергетические митохондрии имеют фундаментальное значение в процессах миграции, инвазии и метастазирования опухолевых клеток (см. Nahacka Z., Novak J., Zobalova R., Neuzil., J. Miro proteins and their role in mitochondrial transfer in cancer and beyond. Frontiers in cell and developmental biology. 2022; 10: 937753. https://doi.org/10.3389/fcell.2022.937753).
В физиологических условиях митохондрии могут перемещаться между клетками с помощью различных способов контакта, включая туннелирование нанотрубок, внеклеточные везикулы, межклеточное слияние, GAP-соединения (см. Wang J., Li H., Yao Y., Zhao T., et al. Stem cell-derived mitochondria transplantation: a novel strategy and the challenges for the treatment of tissue injury. Stem Cell Res Ther. 2018;9:106. doi: 10.1186/s13287-018-0832-2; Hough KP., Trevor JL., Strenkowski JG., Wang Y., et al. Exosomal transfer of mitochondria from airway myeloid-derived regulatory cells to T cells. Redox biology. 2018;18:54-64. doi: 10.1016/j.redox.2018.06.009). Основываясь на этих знаниях, McCully и коллеги использовали митохондриальную трансплантацию в качестве терапевтического подхода к лечению ишемии, как в эксперимента, так и в клинике (дети) (см. Mccully JD., Masuzawa A., Black KM., Pacak CA., et al. Transplantation of autologously derived mitochondria protects the heart from ischemia-reperfusion injury. Am J Physiol. 2013;304:H966-H982. doi: 10.1152/ajpcell.00261.2012). Ряд авторов о митохондриальной трансплантации сообщают как о «волшебном» излечении (см. Bertero E, Maack C, O'Rourke B. Mitochondrial transplantation in humans: «magical» cure or cause for concern? J Clin Investig. 2018;128:5191-5194. doi: 10.1172/JCI124944), поскольку здоровые органеллы, выделенные из неповрежденной ткани, после инъекции в очаг ишемии перемещаются к поврежденным клеткам, восстанавливают производство энергии АТФ и улучшают сократительную функцию кардиомиоцитов за 10 мин. (см. Masuzawa A., Black KM., Pacak CA., Ericsson M., Barnett RJ., Drumm C., Seth P., Bloch DB., Levitsky S., Cowan DB., Mccully JD. Transplantation of autologously derived mitochondria protects the heart from ischemia-reperfusion injury. Am J Physiol. 2013;304:H966-H982. doi: 10.1152/ajpcell.00261.2012).
Таким образом, известно, что изменение метаболизма митохондрий необходимо меланоме для осуществления процесса метастазирования, известно также, что митохондрии могут самостоятельно перемещаться между клетками. Однако все вышеописанное движение касается интактных митохондрий, которые регулируют нарушенный метаболизм различных клеток. И не известно такое свойство митохондрий меланомы, как способность формировать в организме опухолевые структуры.
Техническим результатом настоящего изобретения является разработка способа, позволяющего выявить свойства митохондрий меланомы образовывать опухолевые узлы в организме экспериментальных животных путем трансплантации митохондрий, выделенных из меланомы кожи.
Поставленная цель достигается тем, что самцам мышей линии C57BL/6 внутримышечно и Balb/c Nude внутрибрюшинно трансплантируют митохондрии, изолированные из меланомы В16/F10 в соотношении 5,2 мг белка на 1 животное в 0,4 мл физиологического раствора.
Изобретение «Способ выявления свойств митохондрий меланомы образовывать опухолевые узлы в организме экспериментальных животных» является новым, так как оно неизвестно в области экспериментальных исследований в онкологии о свойствах митохондрий, изолированных из меланомы, вызывать развитии опухолевых узлов меланомы в организме животных в 100% случаев, при парентеральном введении.
Новизна изобретения заключается в использовании митохондрий, изолированных из меланомы В16/F10, для воспроизведения в организме мышей линии C57BL/6 и Balb/c Nude вновь образованных опухолевых узлов меланомы. Проведение экспериментальной митохондриальной трансплантации приводило к росту в организме животных очагов меланомы, доказанных при морфологическом исследовании.
Для лучшего понимания способа приводим фигуры.
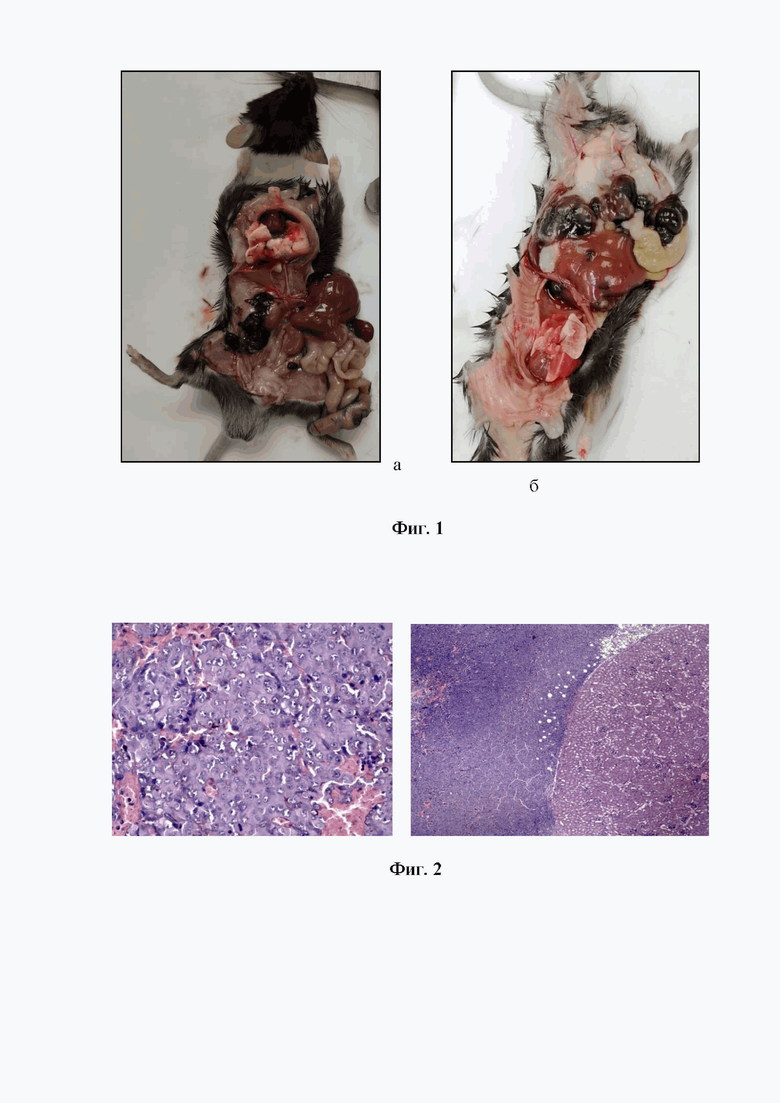
На фигуре 1 изображена внутримышечная трансплантация митохондрий изолированных из меланомы B16/F10. Мыши самцы линии C57BL/6. Опухолевый узел меланомы в брюшной полости, плотно спаянный с правой почкой, опухолевый отсев в семенном канатике и жировой клетчатке (а); диссеминация по брюшине, опухолевые узлы в брыжейке тонкой и толстой кишки, печени (б).
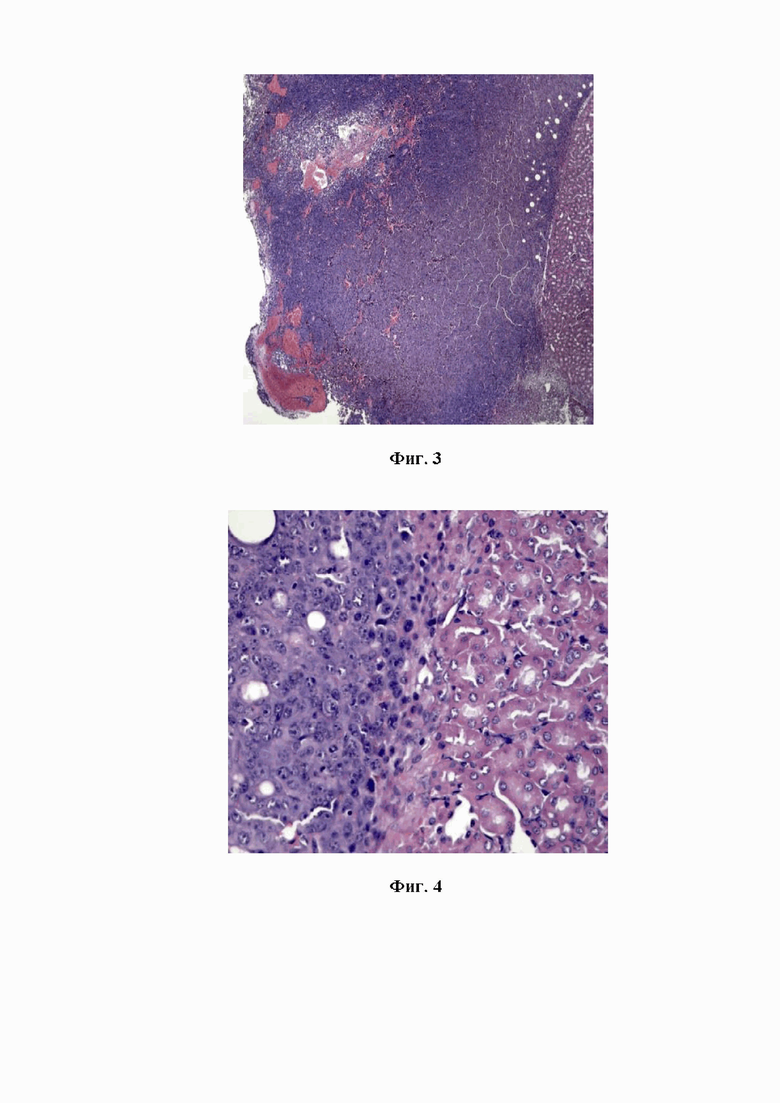
На фигуре 2 изображено разрастание опухолевых клеток с образованием крупного узла меланомы на границе с почкой.
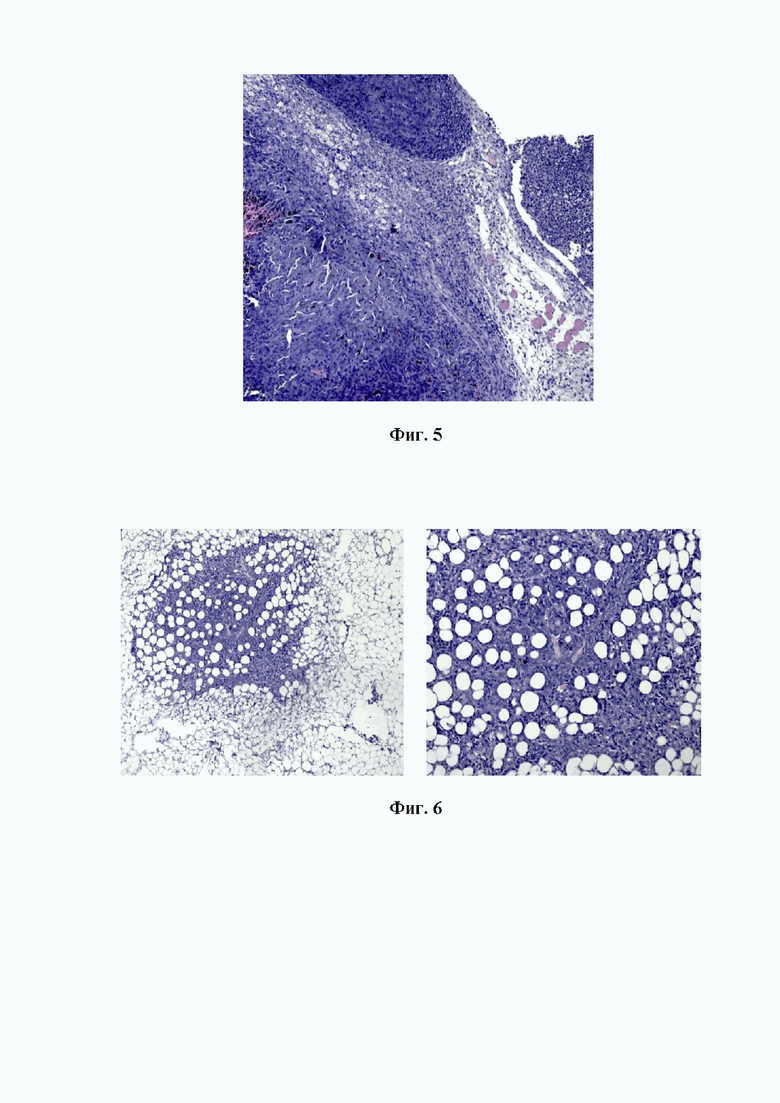
На фигуре 3 изображен общий вид опухолевой конгломерации, образованной в паранефральной клетчатке. Крупные очаги кровоизлиянии по периферии злокачественного новообразования. На снимке при малом увеличении (об. х10) можно отметить участки проникновения меланоцитов через капсулу почки.
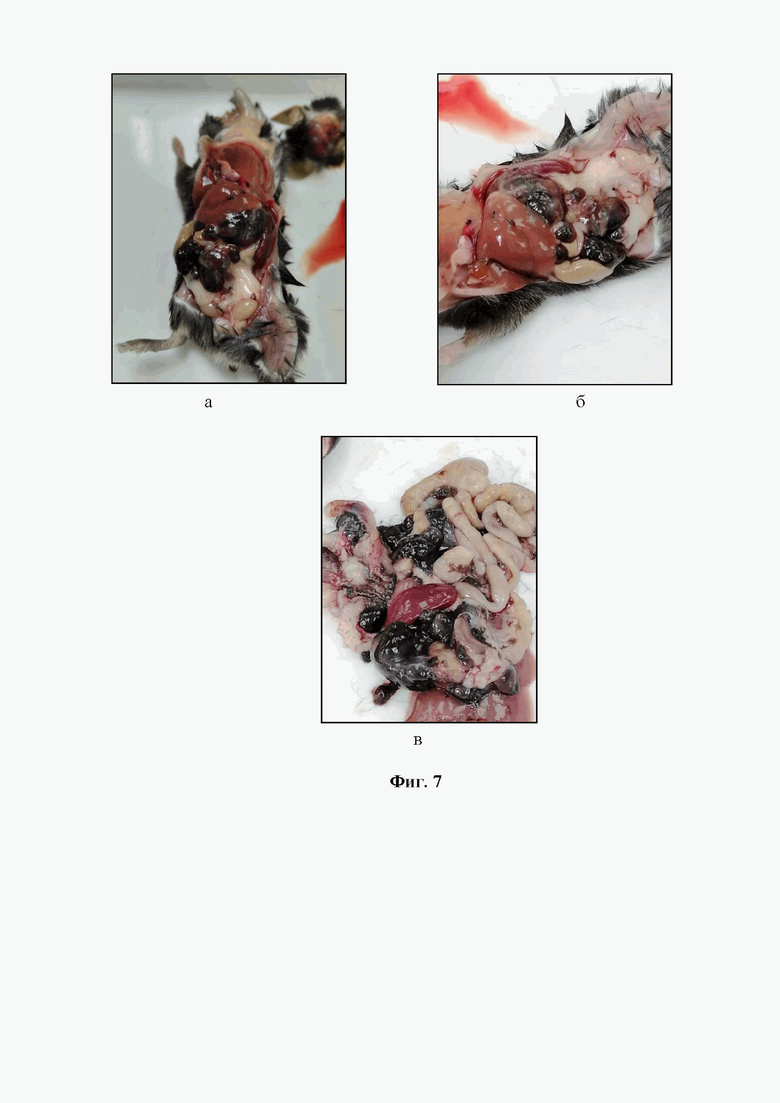
На фигуре 4 при большем увеличении (об. х40) четко прослеживается линия «наплыва» ткани меланомы на здоровые структуры почечных канальцев.
На фигуре 5 изображено формирование на периферийных участках жировой клетчатки самостоятельных более мелких опухолевых узлов меланомы В-16.
На фигуре 6 изображен опухолевый узел в клетчатке семенного канатика. Отсутствие капсулы опухолевого узла, подчеркивающее инвазивное проникновение клеток по межклеточному пространству жировой клетчатки и распространение по сходному сценарию использования ролевых факторов соединительной ткани (коллагеновых волокон, фибробластов, жировых капсул, элементов крови).
На фигуре 7 изображены мыши самцы линии C57BL/6. Поражение внутренних органов (а,б) и органокомплекс (в) после внутримышечной трансплантацией митохондрий изолированных из меланомы B16/F10.
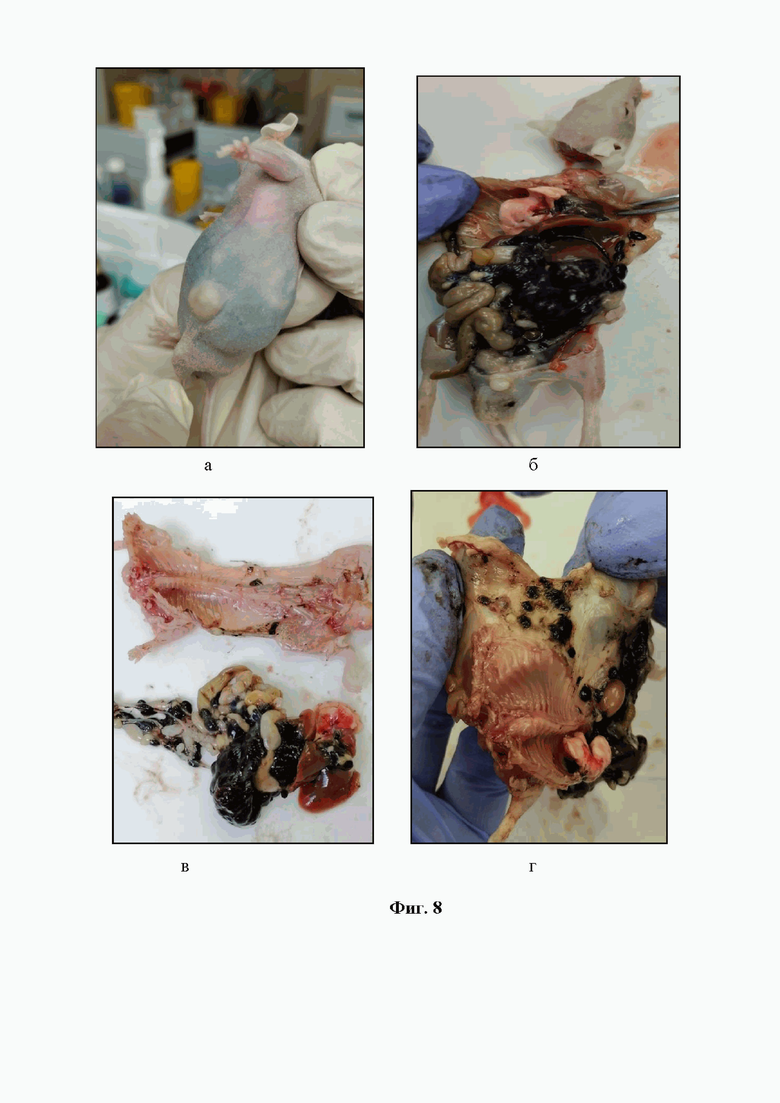
На фигуре 8 изображена внутрибрюшинная трансплантация митохондрий изолированных из меланомы B16/F10. Мыши самцы линии Balb/c Nude. Вид животного с внутрибрюшинной трансплантацией митохондрий изолированных из меланомы B16/F10 (а). Опухолевое поражение органов брюшной полости после внутрибрюшинной трансплантацией митохондрий изолированных из меланомы B16/F10 (б). Органокомплекс мыши после внутрибрюшинной трансплантацией митохондрий изолированных из меланомы B16/F10 (в). Опухолевое поражение кожи после внутрибрюшинной трансплантацией митохондрий изолированных из меланомы B16/F10 (г).
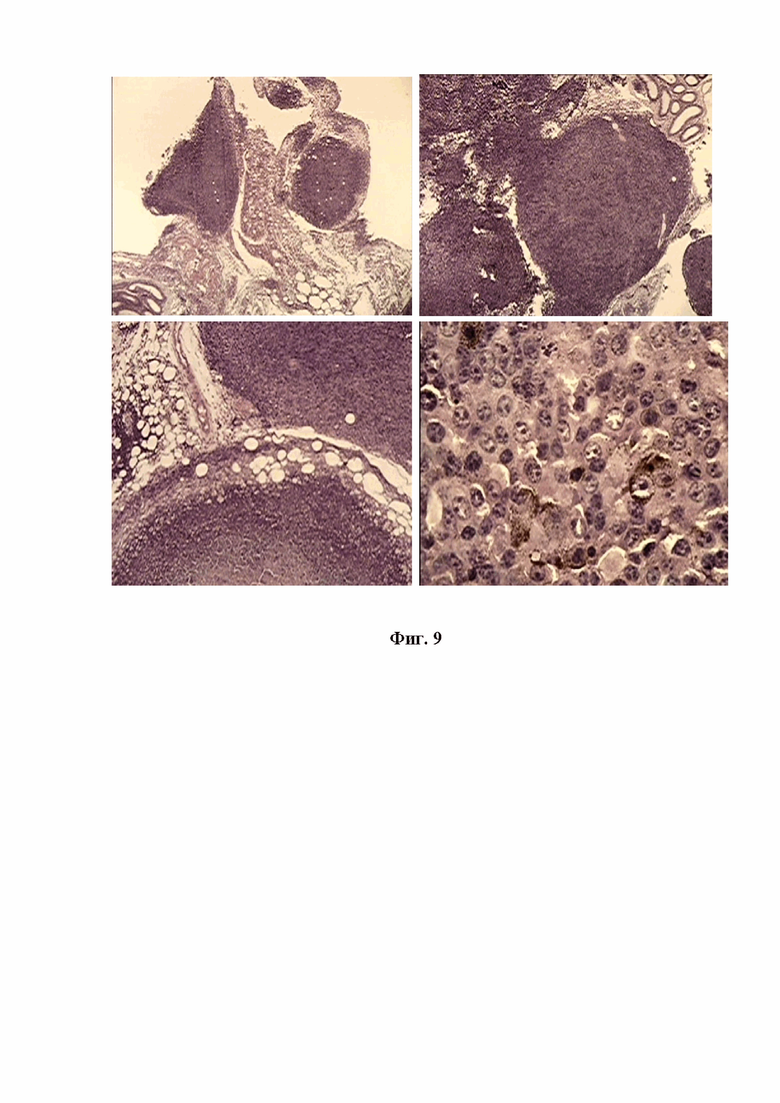
На фигуре 9 изображена микрокартина многочисленных опухолевых узлов разных размеров, сформированных в брыжейке мышей Nude при внутрибрюшинной трансплантации митохондрий меланомы В16. Окр.гематоксилин-эозином. Ув.об.х10, х100
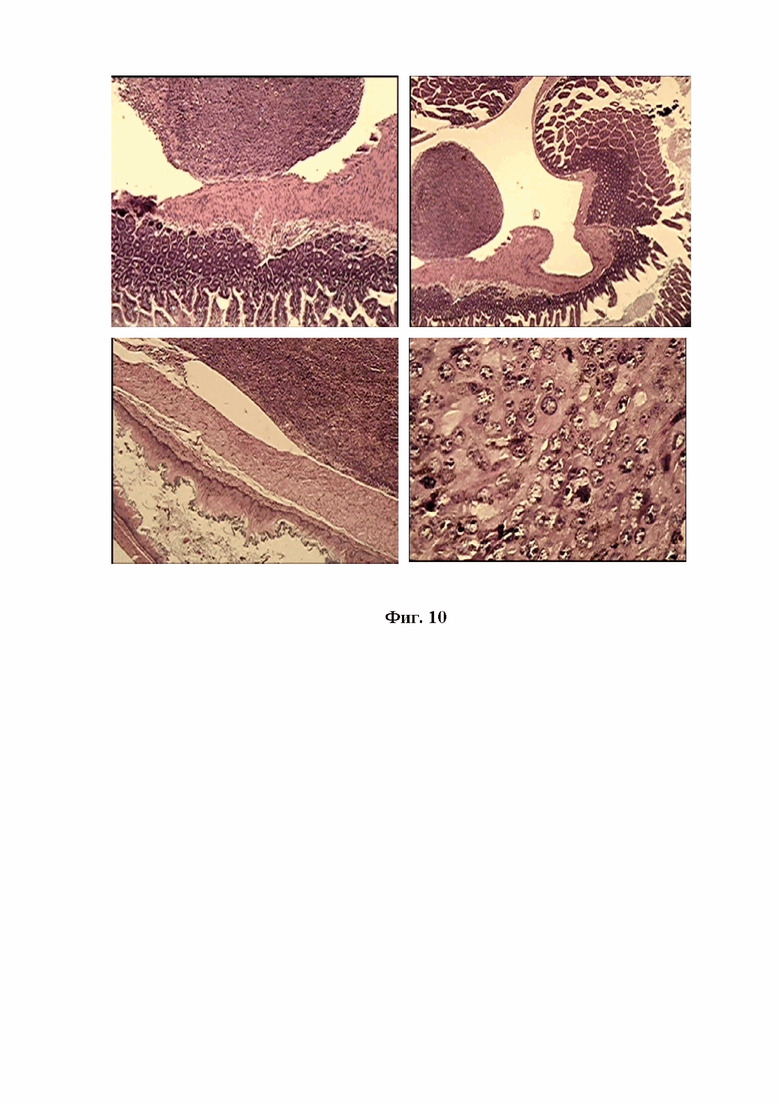
На фигуре 10 изображена микрокартина опухолевых узлов, сформированных в петлях кишечника мышей Nude при внутрибрюшинной трансплантации митохондрий меланомы В16. Окр.гематоксилин-эозином. Ув.об.х10, х100
На фигуре 11 изображена микрокартина опухолевого поражения печени мышей Nude при внутрибрюшинной трансплантации митохондрий меланомы В16. Окр.гематоксилин-эозином. Ув.об.х10, х40, х100.
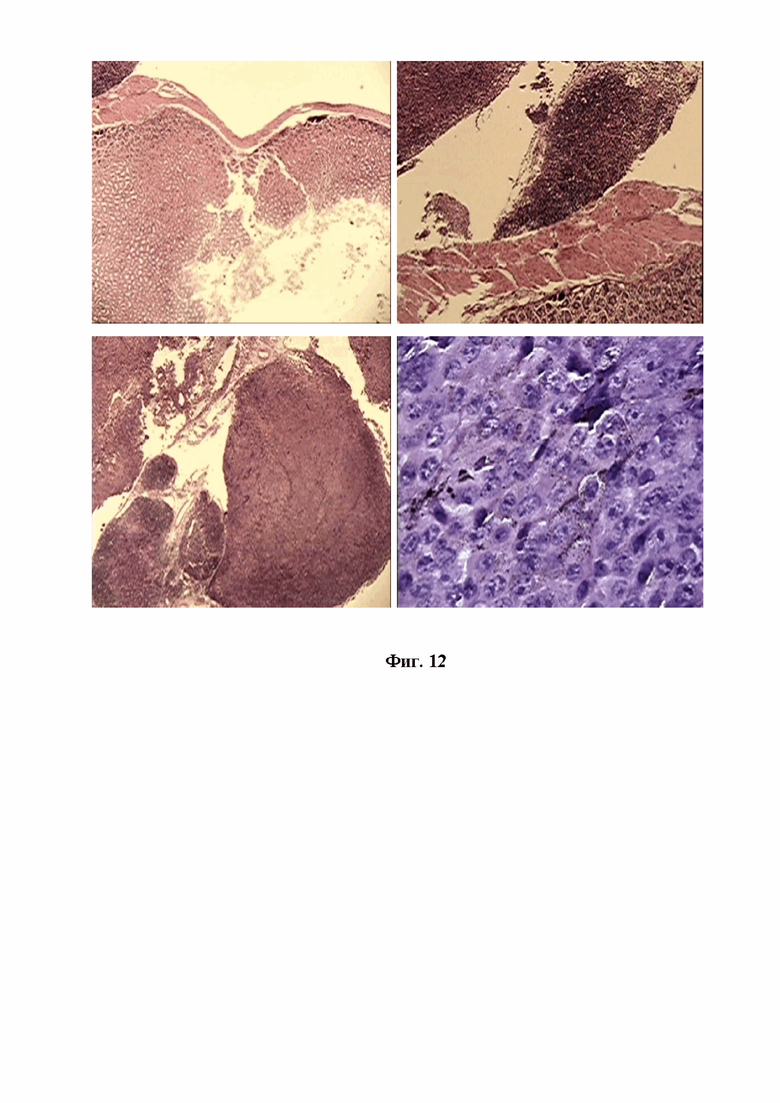
На фигуре 12 изображена микрокартина множественных опухолевых узлов в перигастральной области, не затрагивающих стенки и полость желудка мышей Nude при внутрибрюшинной трансплантации митохондрий меланомы В16. Окр.гематоксилин-эозином. Ув.об.х10, х40, х100.
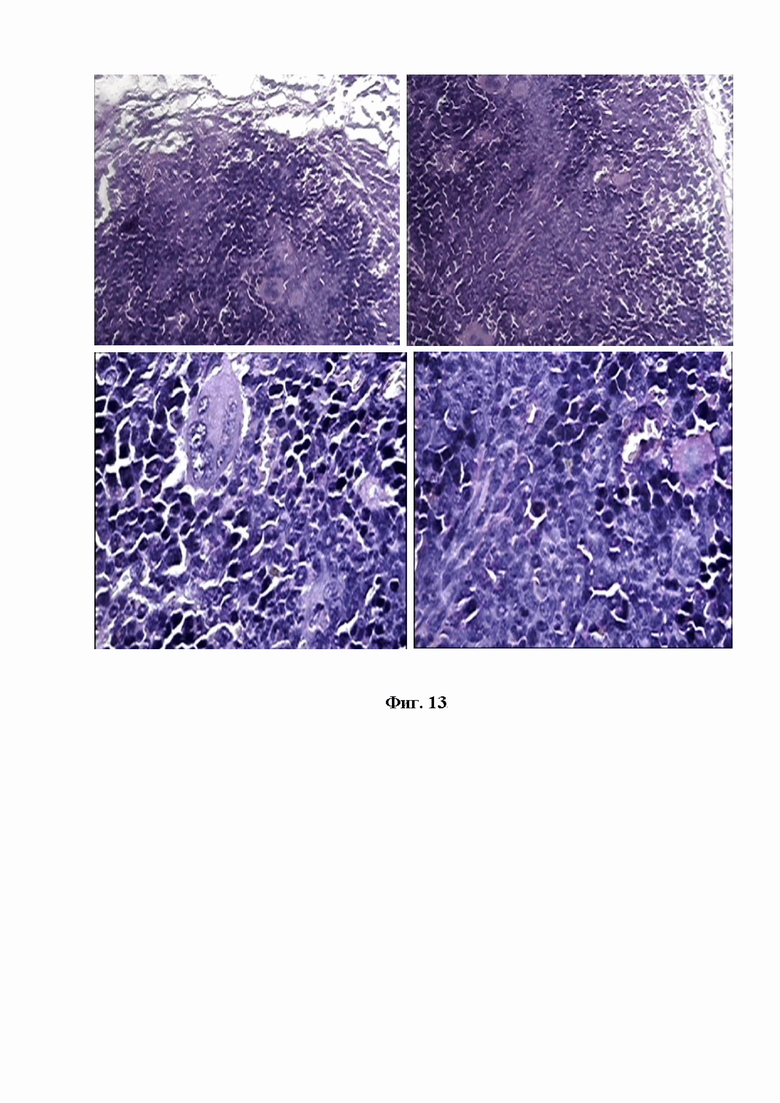
На фигуре 13 изображена микрокартина опухолевого поражения селезенки мышей Nude при внутрибрюшинной трансплантации митохондрий меланомы В16. Полное стирание архитектоники органа, множество разрушающихся мегакариоцитов, бурный рост опухолевых меланоцитарных клеток в виде тяжей и опухолевых булов. Окр.гематоксилин-эозином. Ув.об.х10, х40, х100.
На фигуре 14 изображена микрокартина опухолевого поражения паранефральной клетчатки мышей Nude при внутрибрюшинной трансплантации митохондрий меланомы В16. Сходный механизм вовлечения ресурсов рыхлой соединительной ткани (жировая клетчатка, кровь, рекрутирование фибробластов) для новообразования меланоцитов. Окр.гематоксилин-эозином. Ув.об.х10, х40, х100.
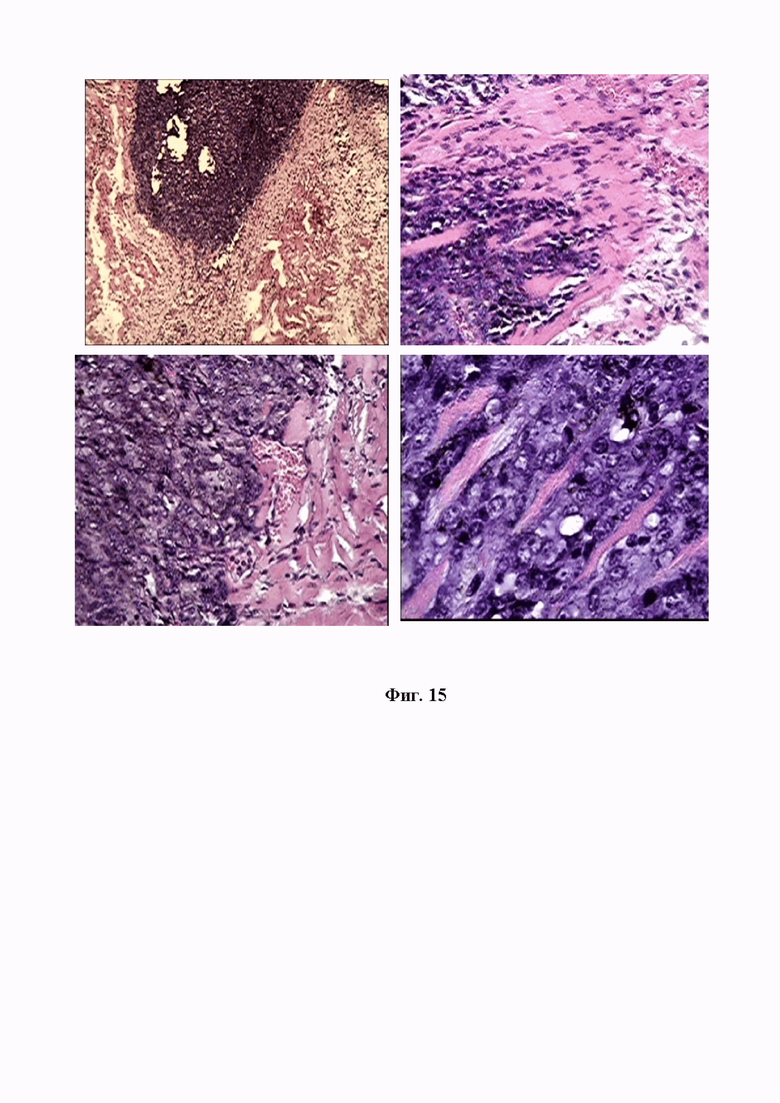
На фигуре 15 изображена микрокартина формирования опухолевых узлов в коже мышей Nude при внутрибрюшинной трансплантации митохондрий меланомы В16. Опухолеобразующие конгломерации митохондрий, внедряющиеся в виде тяжей в мышечную прслойку кожи. Окр. гематоксилин-эозином. Ув.об.х10, х40, х100.
«Способ выявления свойств митохондрий меланомы образовывать опухолевые узлы в организме экспериментальных животных» выполняется следующим образом.
Воспроизведение меланомы В16/F10. Самцам мышей линии C57BL/6 кожу спины ниже угла левой лопатки вводят 0,5 мл взвеси опухолевых клеток мышиной меланомы В16/F10 в физиологическом растворе в разведении 1:20. Для этого, соблюдая все условия асептики, ассистент фиксирует мышь спиной кверху, предварительно обработав кожу 5% спиртовым раствором йода. Экспериментатор рукой в стерильной перчатке захватывает кожную складку, в центре которой прокалывает кожу и вводит опухолевую взвесь В16/F10. После извлечения иглы места введения плотно прижимает ватным тампоном, смоченным в 70% спирте с небольшим добавлением йода, на 1 минуту, чтобы исключить вытекание опухолевого материала.
Выделение митохондрий из меланомы. Через 2 недели после перевивки, мышь линии C57BL/6 с перевитой меланомой кожи В16/F10 умерщвляют с помощью гильотины, извлекают ткань меланомы. Митохондрии выделяют с применением дифференциального центрифугирования на высокоскоростной рефрижераторной центрифуге Avanti J-E, BECMAN COULTER, USA по методу Егоровой М.В. и Афанасьева С.А. (см. Егорова М.В., Афанасьев С.А. Выделение митохондрий из клеток и тканей животных и человека: Современные методические приемы. Сибирский медицинский журнал. 2011;26(1-1):22-28; Гуреев А.П., Кокина А.В., Сыромятникова М.Ю., Попов В.Н. Оптимизация методов выделения митохондрий из разных тканей мыши. Вестник ВГУ, серия: химия, биология, фармация. 2015; 4: 61-65). Для разрушения межклеточных связей, клеточной стенки и плазматических мембран применяют механическую обработку тканей с измельчением ножницами и гомогенизацией в стеклянном гомогенизаторе с тефлоновым пестиком (гомогенизатор Поттера-Эльвегейма). На каждый грамм ткани добавляют по 10 мл стерильной среды выделения (0,22 М маннитол, 0,3 М сахароза, 1мМ ЭДТА, 2 мМ TRIS-HCL, 10мМ HEPES, pH 7,4). Ткани гомогенизируют и центрифугируют первый раз 10 мин при скорости 1000 g, температура 0-2°С, второе и третье центрифугирование осуществляется при 20000 g, 20 мин, температура 0-2°С. Между центрифугированием проводят процедуру ресуспендирования осадка митохондрий в среде выделения. Митохондрии дополнительно очищают от лизосом, пероксисом, меланосом и т.п., центрифугируя в 23% градиенте Перколла. Суспензию субклеточных структур наслаивают на градиент Перколла, центрифугируют 15 мин при 21000 g, после этого наблюдается разделение на 3 фазы, оставляют нижний слой митохондрий и ресуспендируют средой выделения. Следующую промывку митохондрий осуществляют путем центрифугирования в течение 10 мин при 15000 g, температура 0-2°С. Митохондриальные образцы разводят 0,9% раствором NaCl до концентрация белка 5,2 мг белка в 0,4 мл физиологического раствора.
Трансплантация митохондрий, изолированных из меланомы. Мышам самцам линии C57BL/6 (n=6) в мышцу и линии Balb/c Nude (n=7) внутрибрюшинно одноразово вводят свежеизолированные митохондрии меланомы из расчета 5,2 мг белка на 1 животное в 0,4 мл физиологического раствора.
Контролем служат мыши-самцы линии C57BL/6 и линии Balb/c Nude, которым одноразово в мышцу и внутрибрюшинно соответственно вводили 0,4 мл физиологического раствора.
Всех животных умерщвляли путем декапитации на гильотине через 2 недели после парентеральной трансплантации митохондрий, изолированных из меланомы.
Особенности развития очагов меланомы при внутримышечной трансплантации митохондрий, изолированных из меланомы, мышам линии C57BL/6 представлены на фигурах.
Всего в эксперименте было задействовано 6 самцов мышей линии C57BL/6. При вскрытии через две недели у двух самцов отмечен рост опухолевого узла меланомы в брюшной полости, плотно спаянный с правой почкой, опухолевый отсев в семенном канатике и жировой клетчатке. У 4 животных диссеминация по брюшине, опухолевые узлы в брыжейке тонкой и толстой кишки, печени (см. Фиг.1,7).
Особенности развития очагов меланомы при внутрибрюшинной трансплантации митохондрий, изолированных из меланомы, мышам линии Balb/c Nude (n=7) представлены на Фиг. 8.
Морфологическое исследование опухолевых узлов.
Морфологический контроль внутренних органов мышей Nude спустя 2 недели после внутрибрюшинной трансплантации митохондрий меланомы В16 свидетельствовал об опухолевом поражении висцеральной клетчатки и органов брюшной полости (см. Фиг. 9-15).
В первую очередь было выявлено тотальное поражение брыжейки, где отмечалось множество мелких и крупных узлов клеток меланоцитарной природы, трансформированных из элементов рыхлой соединительной ткани с участием компонентов жира, крови, рекрутированных митохондриями фибробластов, лимфоидных элементов. Новообразованные опухолевые клетки представляли типичную для меланомы эпителиоидного типа клеточную структуру с несколькими крупными ядрышками и значительным содержанием гранул свойственного пигмента меланина (см. Фиг .9).
В петлях кишечника мышей Nude в результате внутрибрюшинной трансплантации митохондрий меланомы В16 было отмечено формирование опухолевых узлов разного размера, плотно прилегающих к стенкам тонкого и толстого кишечника, но не прорастающих в их полость. Исследование опухолевых узлов при увеличении объектива х100 выявило характерное для меланомы строение клеток доминирующей округлой формы на разных этапах патологического митоза, а также распыление пигмента меланина с характерным оттенком коричневого цвета (см. Фиг. 10).
Было отмечено значительное поражение структуры печени, на участках которой отмечались крупные и мелкие очаги кровоизлияния. На представленных снимках (см. Фиг. 11) отчетливо проявлялись значительные конгломерации трансплантируемых митохондрий вытянутой формы, соседствующие с единичными меланоцитами или укомплектованными в опухолевые булы или псевдосинцитии.
В области желудка, так же как и кишечника мышей Nude, было отмечено множество прилегающих в непосредственной близости к мышечной стенке желудка опухолевых узлов, но не прорастающих в полость желудка. При детальном рассмотрении этих узлов четко проявлялась структура плотно расположенных меланоцитов округлой или овоидной формы с характерным распределением ядерного материала и наличием распыленных или скомпанованных гранул пигмента меланина (см. Фиг. 12).
Морфологический контроль селезенки мышей Nude при внутрибрюшинной трансплантации митохондрий меланомы В16 свидетельствовал о полном стирании архитектоники органа в результате прогрессивного опухолевого роста. Атакующая динамика злокачественных клеток включала как образование тяжей меланоцитов веретеновидной формы, так внедрение крупных опухолевых булов, несущих в себе несколько новообразованных клеток меланомы округлой формы. При обследовании множества полей зрения не было отмечено участков с сохранившимися фолликулами белой пульпы, а в красной пульпе обнаруживалось большое количество мегакариоцитов с признаками деградации и разрушения. Очевидно, что начальная реакция селезенки на опухолевое вторжение, напрямую была связана с активацией бластных клеток типа мегакариоцитов, которые делегируются для восполнения клеточного состава селезенки (см. Фиг. 13).
Микрокартина опухолевого поражения паранефральной клетчатки мышей Nude при внутрибрюшинной трансплантации митохондрий меланомы В16 представляла особый интерес, поскольку нами было проведено аналогичное исследование при внутримышечной трансплантации выделенных из той же меланомы митохондрий мышей другой линии. Был установлен сходный механизм вовлечения ресурсов рыхлой соединительной ткани (жировая клетчатка, кровь, рекрутирование фибробластов) для новообразования меланоцитов и формирования опухолевого узла (см. Фиг. 14). Как видно из представленных фигур, паранефральная клетчатка служит адекватной метаболической нишей для полноценной реализации митохондриальной программы. Возникающие на ее поверхности мелкие очаги опухолевых клеток в полном смысле обладают достачно мощным строительным ресурсом и метаболическими компонентами, включающими необходимые для клеточной энергетики липиды, полисахариды, белки, биохимически активную свободнорадикальную среду.
Внутрибрюшинная трансплантация митохондрий, выделенных из меланомы В16, сопровождалась образованием нескольких не очень крупных узлов меланоцитарной опухоли в подкожной клетчатке и мышечном слое (см. Фиг. 15). На фигуре можно видеть как происходит вторжение микрогранул митохондрий меланомы В16 на фоне расслоения мышечных волокон и тянущихся «языков» трансформированных озлокачествленных миоцитов. Как видно, частые очаги кровоизлияния подпитывают территорию продвижения опухолевого массива клеток, которые «мимикрируют» под формообразование пучков мышечных волокон. При максимальном увеличении микроскопа (об. х100), определялось уникальное построение новообразованных меланоцитов в параллельные пучки, подобные мышечным, что свидетельствует о низкой дифференцированности и высочайшей приспособляемости злокачественных клеток.
Морфологический анализ ткани сердца и легких свидетельствовал об отсутствии опухолевого поражения этих органов. Вместе с тем, в легких отмечалось значительное кровонаполнение сосудов, участки кровоизлияния, расширение бронхиального дерева и альвеол. В сердечной мышце можно было видеть мелкие очаги кровоизлияния и некроза.
Исследование микроструктуры висцеральных органов мышей Nude, подвергнутых внутрибрюшинной трансплантации митохондрий меланомы В16 позволяет предположить следующее. На наш взгляд, процесс митохондриального канцерогенеза представляет реализацию особых свойств митохондрий, прежде всего связанных с генетической программой митохондриальной ДНК, которая осуществляет самосборку утраченной клеточной структуры меланоцитов из доступных ресурсов рыхлой соединительной ткани организма-реципиента, включая липиды, полисахариды, белки, а также рекрутизацию фибробластов, как основного каркаса для перепрограммирования здоровых клеточных форм. Это подтверждается развитием множественных крупных и мелких опухолевых узлов в соответствующих тканях, образующих паранефральную клетчатку, брыжейку, межпетельные пространства тонкого и толстого кишечника, клетчатку семенного канатика, подкожную клетчатку и мышечный слой, а также регистрируется тотальное поражение паренхимы печени и селезенки. Отмечено, что на данном 2-х недельном сроке митохондриального канцерогенеза не отмечается опухолевой инвазии в полые органы - желудок и кишечник, несмотря на тесное прилегание опухолевых узлов к их поверхности. Вне прямого опухолевого влияния оказываются легкие и сердце, что не исключает опосредованного влияния злокачественного процесса, подтвержденного морфологическими признаками функционального напряжения этих жизненно важных органов.
Итоги морфологического контроля изменений внутренних органов экспериментальных животных позволили составить основу первичной доказательной базы, которая представляет визуальный ряд событий, разворачивающихся в организме мышей-рецепиентов. Последнее обстоятельство свидетельствует о механизмах митохондриального канцерогенеза и способности «свободных» форм митохондрий злокачественных клеток в ускорении индукции вторичного процесса опухолевой прогрессии.
Проведенные исследования выявили ранее неизвестные свойства митохондрий, изолированных из меланомы кожи В16/F10, вызывать при парентеральном введении развитие опухолевых узлов меланомы в организме животных, доказанных при морфологическом исследовании. Это ранее не известный факт в экспериментальной онкологии, позволяющий проводить изучение новых свойств митохондрий клеток меланомы.
Изобретение «Способ выявления свойств митохондрий меланомы образовывать опухолевые узлы в организме экспериментальных животных» является промышленно применимым, так как может быть использовано в научно-исследовательских учреждениях онкологического профиля для воспроизведения экспериментальной трансплантации митохондрий, изолированных из опухоли, изучения новых свойств митохондрий клеток меланомы вызывать при парентеральном введении в организме животных рост и развитии опухолевых узлов меланомы.
Технико-экономическая эффективность «Способа выявления свойств митохондрий меланомы образовывать опухолевые узлы в организме экспериментальных животных» заключается в том, что применение парентеральной трансплантации митохондрий, изолированных из меланомы В16/F10, у мышей-самцов линии C57BL/6 и Balb/c Nude вызывает рост и развитие в организме очагов меланомы. Это дает возможность изучать патогенез злокачественного роста под влиянием трансплантации митохондрий, изолированных из меланомы, и механизм митохондриального воздействия, вызывающего развитие опухолевых очагов меланомы, что важно для клиники, так как доказывает новый ранее не известный механизм диссеминации меланомы. Способ экономичен, доступен.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ экспериментальной биотерапии меланомы В16/F10 | 2022 |
|
RU2779698C1 |
| Способ предотвращения развития инфаркта миокарда мышей с меланомой, развившейся на фоне хронической нейрогенной боли | 2022 |
|
RU2786322C1 |
| Способ индуцирования роста аденокарциномы ободочной кишки человека в органах экспериментальных животных | 2023 |
|
RU2799251C1 |
| СПОСОБ ВЫБОРА МИТОХОНДРИЙ ДЛЯ ЭКСПЕРИМЕНТАЛЬНОЙ ТЕРАПИИ МЕЛАНОМЫ В16-F10 | 2022 |
|
RU2794762C1 |
| Способ формирования опухолевого роста в легких экспериментальных животных | 2023 |
|
RU2810431C1 |
| Способ обнаружения свойств митохондрий глиобластомы человека индуцировать экстракраниальный диффузный опухолевый рост в органах экспериментальных животных | 2023 |
|
RU2794641C1 |
| Способ моделирования первично-множественного роста злокачественных опухолей с подавлением одной опухоли другой в условиях первичного иммунодефицита | 2021 |
|
RU2750127C1 |
| Способ усиления роста меланомы В16/F10 по сравнению с ростом меланомы В16/F10 при самостоятельной перевивке и замедления роста LLC (карциномы Льюиса) по сравнению с ростом LLC при самостоятельной перевивке при первично-множественных злокачественных опухолях на фоне первичного иммунодефицита | 2021 |
|
RU2759487C1 |
| Способ создания полинеоплазии со стимуляцией опухолевого роста в условиях первичного иммунодефицита в эксперименте | 2021 |
|
RU2751930C1 |
| Способ отмены генетически детерминированного ингибирования роста злокачественной опухоли в эксперименте | 2019 |
|
RU2718671C1 |


Изобретение относится к онкологии, а именно к экспериментальной онкологии, и может быть использовано для образования опухолевых узлов меланомы в экспериментальных животных. Для этого самцам мышей линии С57ВL/6 внутримышечно и Balb/c Nude внутрибрюшинно одноразово трансплантируют митохондрии, изолированные из меланомы В16/F10, в соотношении 5,2 мг белка на 1 животное в 0,4 мл физиологического раствора. Изобретение позволяет изучать патогенез злокачественного роста под влиянием трансплантации митохондрий, изолированных из меланомы, и механизм митохондриального воздействия, вызывающего развитие опухолевых очагов меланомы. 15 ил.
Способ образования опухолевых узлов меланомы в организме экспериментальных животных, заключающийся в том, что самцам мышей линии С57ВL/6 внутримышечно и Balb/c Nude внутрибрюшинно одноразово трансплантируют митохондрии, изолированные из меланомы В16/F10, в соотношении 5,2 мг белка на 1 животное в 0,4 мл физиологического раствора.
| Способ моделирования лимфогенного и гематогенного метастазирования мышиной меланомы В у белых нелинейных крыс | 2016 |
|
RU2615908C1 |
| Способ отмены генетически детерминированного ингибирования роста злокачественной опухоли в эксперименте | 2019 |
|
RU2718671C1 |
| АНДРОНОВА Н.В | |||
| и др | |||
| МОДЕЛИРОВАНИЕ ПОДКОЖНОГО КСЕНОГРАФТА МЕЛАНОМЫ КОЖИ ЧЕЛОВЕКА MEL RAC С МУТАЦИЕЙ NRAS НА ИММУНОДЕФИЦИТНЫХ МЫШАХ ДЛЯ ДОКЛИНИЧЕСКОГО ИЗУЧЕНИЯ ТАРГЕТНЫХ ПРОТИВООПУХОЛЕВЫХ СРЕДСТВ / Российский биотерапевтический журнал, 2016, N 3, т | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| СЕНЬКОВА А.В | |||
| и др | |||
Авторы
Даты
2023-05-29—Публикация
2022-10-25—Подача