ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому выделенному полипептиду, обладающему трансаминазной активностью, полинуклеотиду, кодирующему полипептид, микроорганизму, содержащему полинуклеотид, и способу дезаминирования аминосоединения с применением полипептида или микроорганизма.
УРОВЕНЬ ТЕХНИКИ
Адипиновая кислота представляет собой соединение, являющееся двухосновной карбоновой кислотой, характеризующееся молекулярной формулой (СН2)4(СООН)2. Адипиновая кислота широко применялась в качестве сырья для получения нейлоновой смолы, пластификаторов для пластмасс и красителей и фармацевтических препаратов. В частности, адипиновая кислота имеет очень высокую коммерческую ценность как важный промежуточный продукт для получения полиамидов, таких как нейлон 6,6.
Адипиновую кислоту получают главным образом химическим способом, включающим двухстадийный процесс с применением углеводородного соединения в качестве сырья. Точнее говоря, циклические соединения, такие как фенол, циклогексан, циклогексен и бензол применяют в качестве исходных веществ и подвергают превращению в масло на основе спиртокетона (KA-масло), называемое циклогексанон или циклогексанол. Затем посредством процесса окисления с применением азотной кислоты получают адипиновую кислоту. Такой химический процесс является высокоэффективным и экономически целесообразным, однако применение бензола как сырья и образование огромного количества оксида азота как побочного продукта считается проблемой. В дополнение к этим проблемам, в связи с усиленным в последнее время экологическим регулированием возникла необходимость в экологически благоприятных способах получения адипиновой кислоты. В связи с этим, начали предприниматься усилия по получению адипиновой кислоты посредством микроорганизмов. Однако путь биосинтеза или биодеградации 6-аминокапроновой кислоты, которую можно применять в качестве промежуточного соединения для получения адипиновой кислоты, еще не известен. Если 6-аминогруппа 6-аминокапроновой кислоты удаляется, и в нее вводится кетонная группа, образуется полуальдегид адипиновой кислоты, и ожидается, что с помощью реакции с участием альдегиддегидрогеназы представляется возможным синтез адипиновой кислоты (Guerrillot L. et al., Eur J Biochem., 1977, 81(1):185-92; Vandecasteele, J.P. et al., Methods Enzymol., 1982, 89: 484-490). Ферментативная реакция превращения 6-аминокапроновой кислоты в адипиновую кислоту, которая состоит из того же числа атомов углерода, что и 6-аминокапроновая кислота, высоко ценится как новая технология, а также за ее высокую коммерческую значимость. Однако фермент или микроорганизм, которые могут участвовать в требуемой реакции, неизвестны.
В связи с этим авторы настоящего изобретения выделили новый микроорганизм, обладающий активностью в отношении дезаминирования, исследуя дезаминирование 6-аминокапроновой кислоты, и, следовательно, был найден новый фермент из нового микроорганизма, что тем самым довершало настоящее изобретение.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
В настоящем изобретении предусмотрен новый выделенный полипептид, обладающий трансаминазной активностью.
В настоящем изобретении предусмотрен полинуклеотид, кодирующий полипептид.
В настоящем изобретении предусмотрен микроорганизм, трансформированный для обеспечения экспрессии нового полипептида.
В настоящем изобретении предусмотрен способ дезаминирования аминосоединения, а также способ превращения полуальдегидного соединения в аминосоединение с применением полипептида, обладающего трансаминазной активностью.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
В одном аспекте настоящего изобретения предусмотрен выделенный полипептид, обладающий трансаминазной активностью, при этом полипептид содержит аминокислотную последовательность под SEQ ID NO: 7 или аминокислотную последовательность, характеризующуюся 75% гомологией с SEQ ID NO: 7.
Термин "полипептид, обладающий трансаминазной активностью", используемый в данном документе, относится к полипептиду, обладающему активностью в отношении катализирования обратимой реакции переноса аминогруппы между аминокислотой и α-кетокислотой. Трансаминаза может быть названа аминотрансферазой.
Термин "полипептид", используемый в данном документе, относится к полимеру из аминокислот. Как правило, форма, в которой несколько аминокислот связаны вместе, называется пептидом, а форма, в которой множество аминокислот связаны вместе, называется белком. Приблизительно 20 типов аминокислот, которые составляют белок, связаны друг с другом посредством химического связывания с образованием полипептида. Обладающий трансаминазной активностью полипептид по настоящему изобретению может включать аминокислотную последовательность под SEQ ID NO: 7. Кроме того, поскольку аминокислотная последовательность характеризуется по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 90%, например, по меньшей мере 95%, и, например, по меньшей мере 99% гомологией с SEQ ID NO: 7, полипептид может содержать любую аминокислотную последовательность без ограничения, при условии, что аминокислотная последовательность полипептида обладает трансаминазной активностью в отношении катализа реакции переноса аминогруппы. Кроме того, при условии, что аминокислотная последовательность полипептида является биологически эквивалентной таковой у полипептида или обладает активностью, эквивалентной таковой у полипептида, полипептид может включать вариант или аналог аминокислотной последовательности.
Термин "гомология", используемый в данном документе, относится к степени идентичности последовательности по отношению к данной полипептидной последовательности или полинуклеотидной последовательности, где степень может быть выражена в процентах. В настоящем описании гомология последовательности, идентичной данной полипептидной последовательности или полинуклеотидной последовательности, или гомология последовательности, обладающей сходной активностью с таковой данной полипептидной последовательности или полинуклеотидной последовательности, представлена в виде "% гомологии". Например, гомологию можно определить посредством применения стандартного программного обеспечения, например, BLAST 2.0, для расчета параметров, таких как вес выравнивания, идентичность и подобие. В качестве альтернативы, гомологию можно идентифицировать путем сравнения последовательностей в соответствии со способом гибридизации, таким как саузерн-гибридизация, осуществляемым в определенных условиях жесткости. Определенные и соответствующие условия для способа гибридизации можно определить с учетом способов, хорошо известных специалисту в данной области.
Полипептид, обладающий трансаминазной активностью, может быть получен из P. stutzeri. Точнее говоря, полипептид может быть получен из P. stutzeri CJ-MKB (KCCM11587P). В одном варианте осуществления авторы настоящего изобретения выделили P. stutzeri CJ-MKB, который представляет собой новый штамм, который может использовать 6-аминокапроновую кислоту в качестве источника азота, за счет чего осуществляется получение новой трансаминазы.
Обладающий трансаминазной активностью полипептид по настоящему изобретению может осуществлять дезаминирование аминосоединения. Аминосоединение может включать по меньшей мере одно, выбранное из группы, состоящей из N-ацетилорнитина, гамма-аминомасляной кислоты (4-аминомасляной кислоты), 5-аминовалериановой кислоты и 6-аминокапроновой кислоты, но не ограничивается ими. В частности, аминосоединение может представлять собой 5-аминовалериановую кислоту или 6-аминокапроновую кислоту. Известно, что общеизвестная N-ацетилорнитин-трансаминаза использует в качестве субстрата N-ацетилорнитин и N-сукцинил-L-2-амино-6-оксопимелат. Однако неизвестно, используется ли в качестве субстрата гамма-аминомасляная кислота, 5-аминовалериановая кислота или 6-аминокапроновая кислота (Rajaram V, Ratna Prasuna Р, Savithri HS, Murthy MR. Structure of biosynthetic N-acetylornithine aminotransferase from Salmonella typhimurium: studies on substrate specificity and inhibitor binding, Proteins, 2008, 70(2):429-441). Однако полипептид по настоящему изобретению может использовать в качестве субстрата, в дополнение к N-ацетилорнитину, гамма-аминомасляную кислоту, 5-аминовалериановую кислоту или 6-аминокапроновую кислоту для катализа таким образом реакции дезаминирования. В одном варианте осуществления N-ацетилорнитин, гамма-аминомасляная кислота, 5-аминовалериановая кислота или 6-аминокапроновая кислота могут подвергаться дезаминированию с помощью полипептида по настоящему изобретению, и это можно подтвердить по образованию глутамата.
В другом аспекте в настоящем изобретении предусмотрен полинуклеотид, кодирующий полипептид, обладающий трансаминазной активностью.
Термин "полинуклеотид", используемый в данном документе, относится к полимеру из нуклеотидов, в котором нуклеотидные мономеры связаны по длине цепи посредством ковалентных связей, и обычно относится к нити дезоксирибонуклеиновой кислоты (ДНК) или нити рибонуклеиновой кислоты (РНК), имеющим определенную или  длину.
длину.
Полинуклеотид может содержать нуклеотидную последовательность, кодирующую полипептид под SEQ ID NO: 7, или полипептид характеризуется по меньшей мере 75% гомологией с SEQ ID NO: 7. В частности, полинуклеотид может содержать последовательность оснований под SEQ ID NO: 4. Кроме того, полинуклеотид может содержать последовательность, характеризующуюся по меньшей мере 80%, например, по меньшей мере 90%, например, по меньшей мере 95% гомологией с SEQ ID NO: 4, при условии, что последовательность представляет собой нуклеотидную последовательность, кодирующую белок, обладающий трансаминазной активностью в соответствии с настоящим изобретением. Кроме того, ввиду вырожденности генетического кода, полинуклеотид может включать вариант нуклеотидной последовательности, кодирующей ту же аминокислотную последовательность.
В другом аспекте в настоящем изобретении предусмотрен микроорганизм, трансформированный для обеспечения экспрессии полипептида, обладающего трансаминазной активностью. В частности, микроорганизм трансформирован для обеспечения экспрессии полинуклеотида, кодирующего полипептид, обладающий трансаминазной активностью, и более конкретно, может быть трансформирован рекомбинантным вектором, с которым полинуклеотид функционально связан.
Полипептид и полинуклеотид соответственно являются такими, как описано выше.
Термин "функционально связанный", используемый в данном документе, означает, что последовательность гена функционально связана с промоторной последовательностью, которая инициирует и опосредует транскрипцию полинуклеотида, кодирующего полипептид, обладающий трансаминазной активностью, в соответствии с настоящим изобретением. Связь с вектором экспрессии может быть обеспечена с применением технологии генетической рекомбинации, известной в данной области. Например, сайт-специфическое расщепление ДНК и связывание могут осуществляться с применением фермента, вносящего однонитевой разрыв, и фермента, обеспечивающего связывание.
Термин "вектор экспрессии", используемый в данном документе, относится к ДНК-конструкции, включающей последовательность оснований полинуклеотида, который кодирует целевой белок, который функционально связан с подходящей контрольной последовательностью, так что целевой белок может быть экспрессирован в подходящей клетке-хозяине. Контрольная последовательность может включать промотор для инициации транскрипции, любую операторную последовательность для контроля транскрипции, последовательность, кодирующую подходящий участок связывания рибосомы в мРНК, и последовательность для контроля транскрипции и терминации трансляции. Вектор может быть трансформирован в подходящего хозяина, а затем может быть обеспечена его репликация или функциональность независимо от генома хозяина. Кроме того, вектор может интегрироваться собственно в геном хозяина. Вектор, применяемый в настоящем изобретении, конкретно не ограничен, при условии, что вектор реплицируется в хозяине, и можно применять любой вектор, известный в данной области техники. Примеры традиционно применяемого вектора представляют собой естественную или рекомбинантную плазмиду, космиду, вирус и бактериофаг, но не ограничиваются ими. Если вектор экспрессии, содержащий полинуклеотид, кодирующий полипептид, обладающий трансаминазной активностью, трансформирован или трансфицирован в клетку-хозяина, требуемый полипептид, обладающий трансаминазной активностью, может быть экспрессирован в клетке-хозяине.
Термин "трансформация", используемый в данном документе, относится к введению вектора, который содержит кодирующий целевой белок полинуклеотид, в клетку-хозяина для обеспечения экспрессии в клетке-хозяине белка, кодируемого полинуклеотидом. До тех пор, пока обеспечивается экспрессия в клетке-хозяине, трансформированный полинуклеотид может включать все типы в любом случае, независимо от того, вставлен ли трансформированный полинуклеотид в хромосомы клетки-хозяина, или трансформированный полинуклеотид находится вне хромосом клетки-хозяина. Способ трансформации вектора по настоящему изобретению в клетку включает любой способ введения основания в клетку, и, например, трансформацию можно осуществлять путем выбора подходящих стандартных методов, известных в данной области техники, таких как электропорация, совместное осаждение фосфатом кальция, ретровирусная инфекция, микроинъекция, способ с использованием DEAE-декстрана, катионных липосом и т.п. Однако способ трансформации не ограничивается ими.
Термин "трансформированный микроорганизм", используемый в данном документе, относится к любому микроорганизму, включающему как прокариотический микрооргнизм, так и эукариотический микроорганизм, при условии, что микроорганизм может экспрессировать полипептид, обладающий трансаминазной активностью. Микроорганизм может представлять собой штамм микроорганизма, принадлежащего к роду Escherichia, Erwinia, Serratia, Providencia, Corynebacterium или Brevibacterium. Например, микроорганизм может принадлежать к роду Escherichia, и например, может представлять собой Eschericia coli.
В другом аспекте в настоящем изобретении предусмотрен способ дезаминирования аминосоединения, при этом способ включает добавление полипептида, обладающего трансаминазной активностью, или микроорганизма, экспрессирующего полипептид, в раствор, содержащий аминосоединение.
Что касается способа, полипептид, обладающий трансаминазной активностью, описан выше.
Что касается способа, микроорганизм, экспрессирующий полипептид, обладающий трансаминазной активностью, может быть трансформирован рекомбинантным вектором, который содержит полинуклеотид, кодирующий полипептид, обладающий трансаминазной активностью. Такой трансформированный микроорганизм описан выше. Микроорганизм можно добавлять к раствору, содержащему аминосоединение, в виде культуры микроорганизма или лизата микроорганизма.
Аминосоединение может включать, например, по меньшей мере одно, выбранное из группы, состоящей из N-ацетилорнитина, гамма-аминомасляной кислоты, 5-аминовалериановой кислоты и 6-аминокапроновой кислоты, но не ограничивается ими. Кроме того, аминосоединение может включать, например, гамма-аминомасляную кислоту, 5-аминовалериановую кислоту или 6-аминокапроновую кислоту.
Раствор, содержащий аминосоединение, может включать по меньшей мере одно, выбранное из группы, состоящей из пирувата, оксалоацетата и α-кетоглутарата, в дополнение к пиридоксальфосфату. Пиридоксальфосфат может быть необходим в качестве кофермента в трансаминазной реакции с участием полипептида по настоящему изобретению. Кроме того, пируват, оксалоацетат и α-кетоглутарат можно использовать в качестве акцепторов амина для акцептирования аминогруппы, которая высвобождается из аминосоединения в ходе реакции.
Кроме того, способ дезаминирования аминосоединения может дополнительно включать выделение соединения, из которого удаляется аминогруппа, из продукта реакции. Соединение, из которого удаляется аминогруппа, может включать по меньшей мере одно, выбранное из группы, состоящей из N-ацетилглутамат-5-полуальдегида, полуальдегида янтарной кислоты, полуальдегида глутаровой кислоты и полуальдегида адипиновой кислоты, но не ограничивается ими. Что касается способа выделения соединения, из которого удаляется аминогруппа, из клетки или культуры, в зависимости от способа культивирования, соединение, из которого удаляется аминогруппа, извлекают или выделяют из культуры с применением подходящего способа, известного из уровня техники. Например, можно применять центрифугирование, фильтрование, анионообменную хроматографию, кристаллизацию и HPLC, но варианты осуществления не ограничиваются указанным.
В другом аспекте в настоящем изобретении предусмотрен способ получения аминосоединения, при этом способ включает добавление полипептида, обладающего трансаминазной активностью, или микроорганизма, экспрессирующего полипептид, в раствор, содержащий соединение, представляющее собой полуальдегид.
Что касается способа получения аминосоединения, полипептид, обладающий трансаминазной активностью, описан выше. Полипептид, обладающий трансаминазной активностью, также обладает каталитической активностью для осуществления обратной реакции дезаминирования аминосоединения, так что соединение, представляющее собой полуальдегид, может превращаться в аминосоединение. Соединение, представляющее собой полуальдегид, может включать по меньшей мере одно, выбранное из группы, состоящей из N-ацетилглутамат-5-полуальдегида, полуальдегида янтарной кислоты, полуальдегида глутаровой кислоты и полуальдегида адипиновой кислоты, но не ограничивается ими. Что касается способа получения аминосоединения, раствор, содержащий соединение, представляющее собой полуальдегид, может дополнительно включать глутамат или аспартат, в дополнение к пиридоксальфосфату.
Кроме того, способ получения аминосоединения может дополнительно включать выделение полученного аминосоединения из раствора. Аминосоединение может включать по меньшей мере одно, выбранное из группы, состоящей из N-ацетилорнитина, гамма-аминомасляной кислоты, 5-аминовалериановой кислоты и 6-аминокапроновой кислоты, но не ограничивается ими. Выделение полученного аминосоединения можно осуществлять с помощью подходящего способа, известного из уровня техники.
Способ дезаминирования аминосоединения можно применять для получения адипиновой кислоты. Что касается способа получения адипиновой кислоты, трансаминазу по настоящему изобретению или лизат микроорганизма, содержащий трансаминазу, можно добавлять к раствору, содержащему 6-аминокапроновую кислоту в качестве аминосоединения, а затем можно обеспечить синтез адипиновой кислоты из полуальдегида адипиновой кислоты, который образуется в результате превращения 6-аминокапроновой кислоты, с применением подходящего способа, известного из уровня техники. Синтез адипиновой кислоты из полуальдегида адипиновой кислоты можно осуществлять предпочтительно с помощью реакции с участием альдегиддегидрогеназы.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Сначала был обнаружен обладающий трансаминазной активностью полипептид по настоящему изобретению. Кроме того, способ дезаминирования аминосоединения с применением полипептида можно применять для биотехнологического способа получения адипиновой кислоты. Иначе говоря, принимая во внимание получение адипиновой кислоты с применением традиционного химического способа, настоящее изобретение является ценным в контексте обеспечения основы для биотехнологического получения адипиновой кислоты с применением нового пути.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 представляет собой фотографию, на которой показано, что штамм, отобранный с применением минимальной среды, которая содержит 6-аминокапроновую кислоту в качестве источника азота, образует биопленку. В частности, на ней показан продукт, полученный путем культивирования одной колонии и осуществления по отношению к ней центрифугирования, и проиллюстрировано разделение продукта на биопленку и штамм с применением дистиллированной воды.
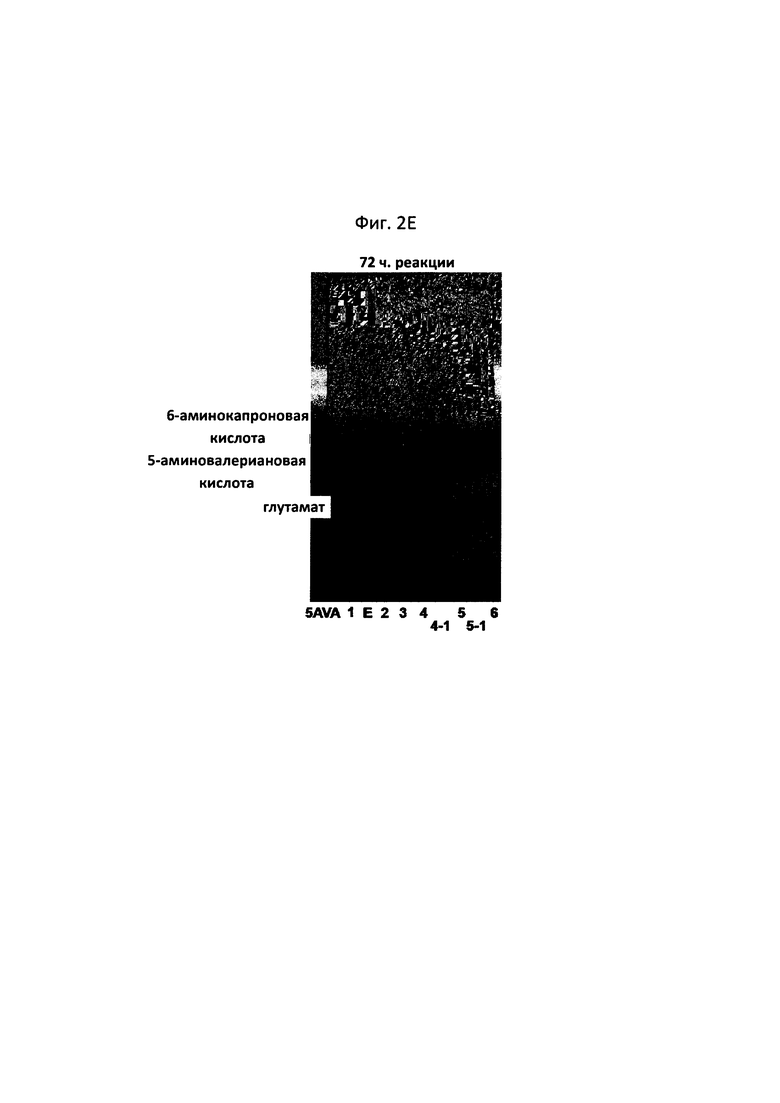
На фигурах 2A-2F показаны сравнительные результаты в отношении получения глутамата и степени разрушения субстрата на TLC в зависимости от различных концентраций 5-аминовалериановой кислоты, 6-аминокапроновой кислоты, альфа-кетоглутаровой кислоты и пиридоксальфосфата, а также присутствия и отсутствия каждого из субстратов:
[5AVA: 10 мМ 5-аминовалериановой кислоты (стандарт); 1: 20 мМ 6-аминокапроновой кислоты (стандарт); 2: P. stutzeri CJ-MKB + 20 мМ 6-аминокапроновой кислоты; 3: P. stutzeri CJ-MKB + 10 мМ 6-аминокапроновой кислоты и 20 мМ 5-аминовалериановой кислоты; 4: P. stutzeri CJ-MKB + 20 мМ 6-аминокапроновой кислоты, 10 мМ альфа-кетоглутарата и 0,1 мМ пиридоксальфосфата; 4-1: P. stutzeri CJ-MKB + 20 мМ 6-аминокапроновой кислоты и 10 мМ альфа-кетоглутарата; 5: P. stutzeri CJ-MKB + 10 мМ 6-аминокапроновой кислоты, 20 мМ 5-аминовалериановой кислоты, 10 мМ альфа-кетоглутарата и 0,1 мМ пиридоксальфосфата; 5-1: P. stutzeri CJ-MKB + 10 мМ 6-аминокапроновой кислоты, 20 мМ 5-аминовалериановой кислоты и 10 мМ альфа-кетоглутарата; 6: P. stutzeri CJ-MKB + 20 мМ 6-аминокапроновой кислоты и 20 мМ глутамата; Е: 10 мМ глутамата (стандарт)].
Фиг. 3 представляет собой изображение результатов SDS-PAGE, на котором показано, что растворимые белки сверхэкспрессированы в Е. coli, трансформированных генами обладающего трансаминазной активностью полипептида по настоящему изобретению:
[Т: клеточный лизат; S: растворимый белок].
На фиг. 4 показаны результаты TLC по реакционной способности полипептида по отношению к аминосоединениям с применением клеточного лизата Е. coli, в котором обладающий трансаминазной активностью полипептид по настоящему изобретению сверхэкспрессирован:
[1: реакция между сверхэкспрессированным pETDuet1 (пустой вектор) и 4-аминомасляной кислотой; 2: реакция между сверхэкспрессированным обладающим трансаминазной активностью полипептидом по настоящему изобретению и 4-аминомасляной кислотой; 4: реакция между сверхэкспрессированным pETDuet1 и 6-аминокапроновой кислотой; 5: реакция между сверхэкспрессированным обладающим трансаминазной активностью полипептидом по настоящему изобретению и 6-аминокапроновой кислотой; 7: реакция между сверхэкспрессированным pETDuet1 и N-ацетилорнитином; 8: реакция между сверхэкспрессированным обладающим трансаминазной активностью полипептидом по настоящему изобретению и N-ацетилорнитином; и 10: глутамат (стандарт)].
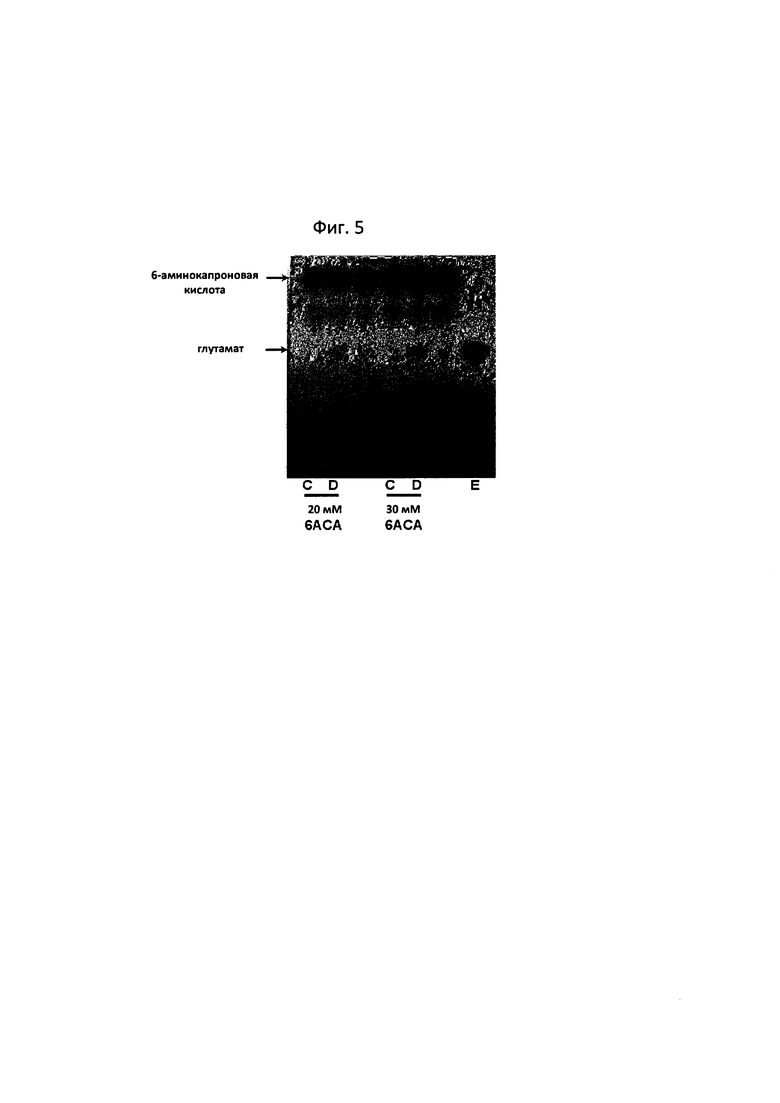
На фиг. 5 показаны результаты TLC, показывающие количество глутамата, образующегося в результате реакции превращения с применением обладающего трансаминазной активностью полипептида по настоящему изобретению при повышении концентрации 6-аминокапроновой кислоты:
[С: реакция между сверхэкспрессированным pETDuet1 и 6-аминокапроновой кислотой; D: реакция между сверхэкспрессированным обладающим трансаминазной активностью полипептидом по настоящему изобретению и 6-аминокапроновой кислотой и Е: 10 мМ глутамат (стандарт)].
Фиг. 6 представляет собой изображение результатов SDS-PAGE, на котором показаны результаты сверхэкспрессии трансаминаз N-ацетилорнитина, полученных из пяти штаммов Pseudomonas, и обладающего трансаминазной активностью полипептида по настоящему изобретению в Е. coli.
Фиг. 7 представляет собой график, на котором показаны результаты анализа снижения количества 6-аминокапроновой кислоты с применением LC-масс-спектрометрии спустя 1 час реакции между 6-аминокапроновой кислотой и трансаминазами N-ацетилорнитина, полученными из пяти штаммов Pseudomonas, и обладающим трансаминазной активностью полипептидом по настоящему изобретению.
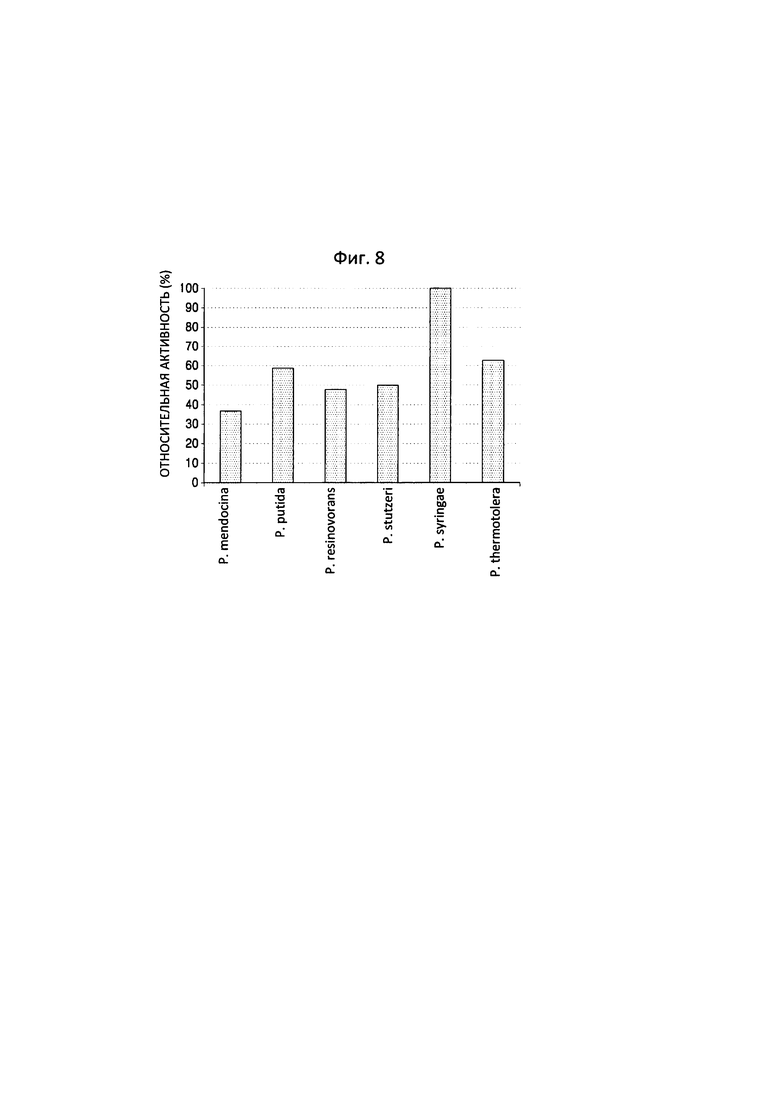
На фиг. 8 показаны результаты сравнения для тех же образцов, что и на фиг. 7, в отношении степени образования альдегида в соответствии со значением относительной активности, определенным с использованием реактива Шиффа.
Фиг. 9 представляет собой график, на котором показаны результаты анализа снижения количества N-ацетилорнитина с применением LC-масс-спектрометрии после проведения реакции между N-ацетилорнитином и трансаминазами N-ацетилорнитина, полученными из пяти штаммов Pseudomonas, и обладающим трансаминазной активностью полипептидом по настоящему изобретению.
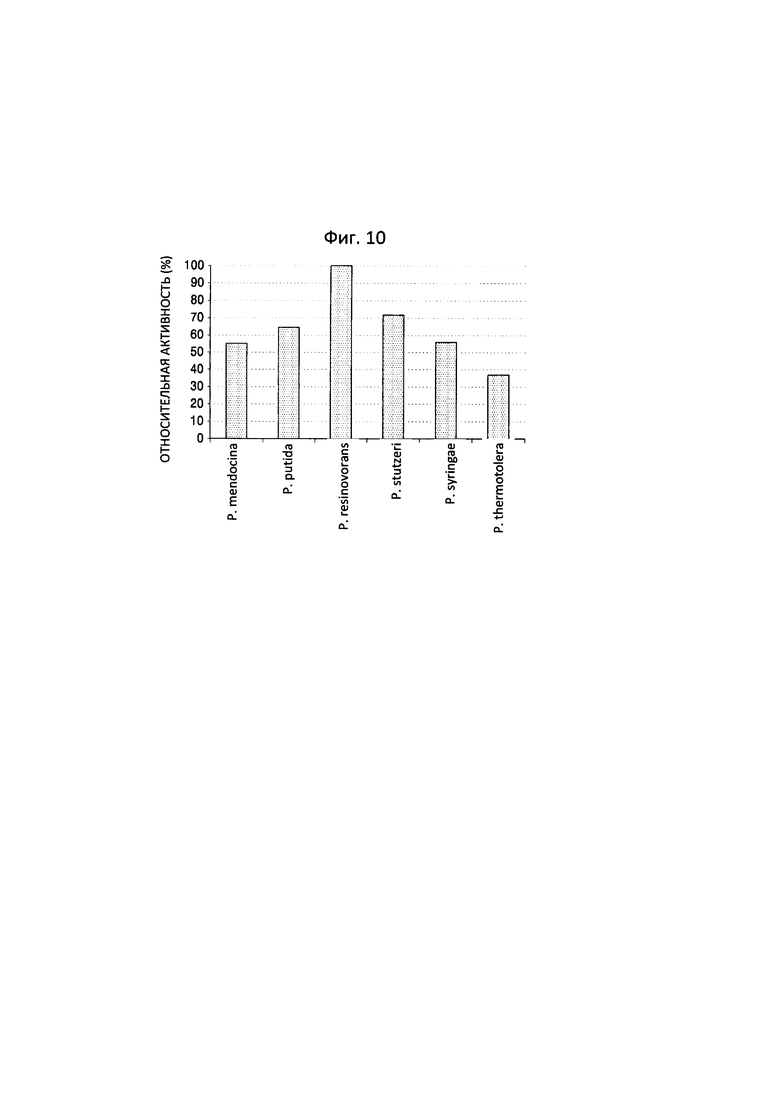
Фиг. 10 представляет собой график, на котором показаны результаты анализа снижения количества гамма-аминомасляной кислоты с применением LC-масс-спектрометрии после проведения реакции между гамма-аминомасляной кислотой и трансаминазами N-ацетилорнитина, полученными из пяти штаммов Pseudomonas, и обладающим трансаминазной активностью полипептидом по настоящему изобретению.
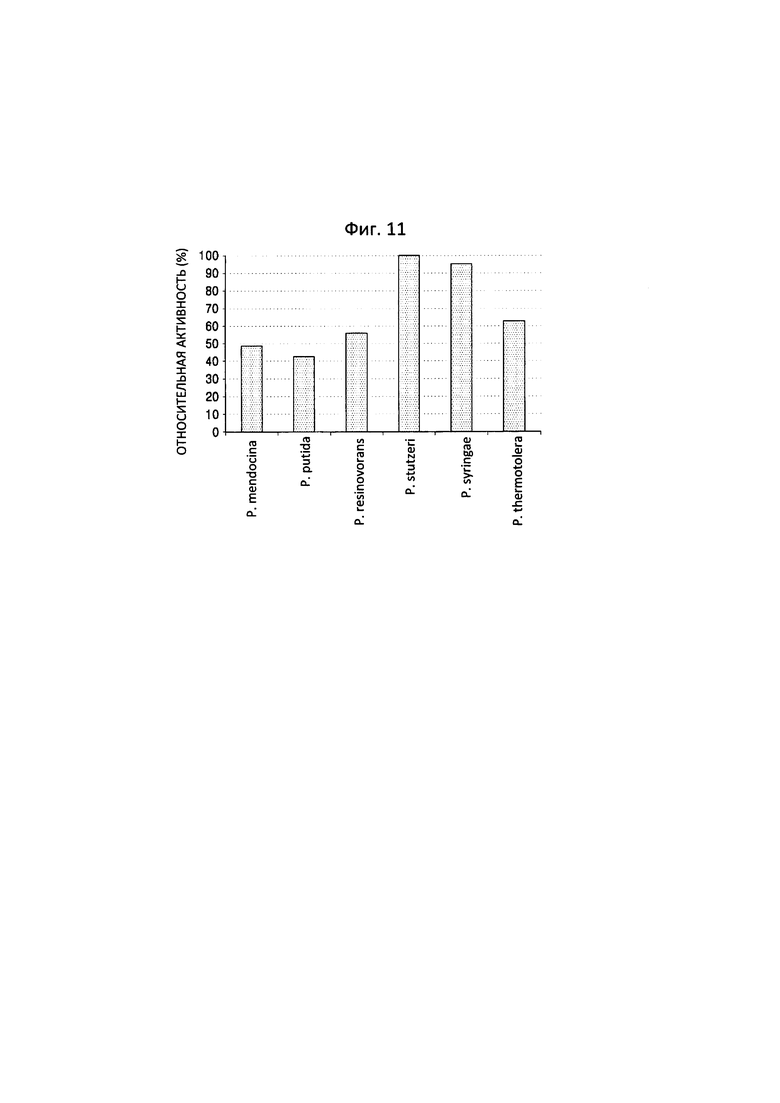
Фиг. 11 представляет собой график, на котором показаны результаты анализа снижения количества 5-аминовалериановой кислоты с применением LC-масс-спектрометрии после проведения реакции между 5-аминовалериановой кислотой и трансаминазами N-ацетилорнитина, полученными из пяти штаммов Pseudomonas, и обладающим трансаминазной активностью полипептидом по настоящему изобретению.
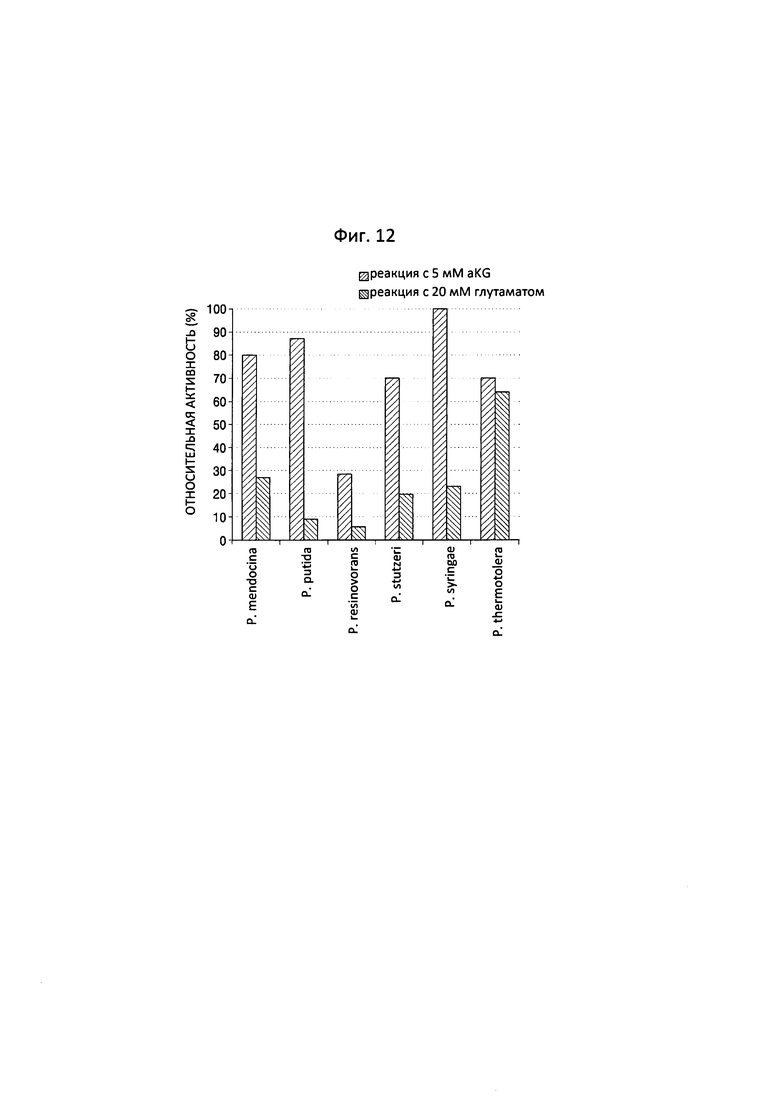
Фиг. 12 представляет собой график, на котором показаны результаты, полученные при сравнении относительной ферментативной активности, определенной с использованием реактива Шиффа, по результатам реакции с 6-аминокапроновой кислотой и повторной индукции ее обратной реакции для оценки обратной реакции обладающего трансаминазной активностью полипептида по настоящему изобретению.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее в данном документе один или несколько вариантов осуществления будут описаны более подробно со ссылками на следующие примеры. Однако эти примеры не предназначены для ограничения объема настоящего изобретения.
Пример 1. Идентификация микроорганизма с применением 6-аминокапроновой кислоты в качестве источника азота
1) Скрининг микроорганизма с применением 6-аминокапроновой кислоты в качестве источника азота и анализ 16S rRNA
6-аминокапроновая кислота (6-АСА) использовалась в качестве источника азота, и новый штамм, P. stutzeri CJ-MKB, который способен дезаминировать 6-АСА, был отобран посредством субкультивирования. Для отбора минимальную среду, в которой можно культивировать микроорганизм, готовили по составу из таблицы 1. В данном случае источник азота для штамма культуры представлял собой 6-АСА.


В частности, образец почвы из завода Gimpo Plant компании CJ Cheiljedang, расположенного в районе Гаянг-дон, Сеул, Корея, культивировали в среде с составом, приведенным в таблице 1, при температуре 37°С и при скорости 200 об./мин. Культивируемые кандидатные штаммы снова культивировали до тех пор, пока их оптическая плотность не достигала 0,5, в условиях, при которых применяли ту же среду с оптической плотностью при первичном инокулировании (OD600), составляющей 0,05, при температуре 37°С и при скорости 200 об./мин. Затем микроорганизм, который культивировали в среде с составом, приведенным в таблице 1, отбирали посредством пятикратного субкультивирования. Отобранный микроорганизм изначально был назван 'CJ-MKB', и проводили последующий эксперимент для подтверждения того, что отобранный штамм являлся новым микроорганизмом.
Штаммы CJ-MKB, культивируемые в жидкой среде, высевали и распределяли на чашке М9 с агаром для получения колоний. Полученные из них колонии были устойчивыми к ампициллину в концентрации 25 мг/мл. Кроме того, было обнаружено, что вокруг колоний образовывалась светлая биопленка. Две колонии отбирали и снова культивировали в жидкой среде М9, и с применением набора для получения геномной ДНК экстрагировали геномную ДНК. Для идентификации полученного генома анализировали последовательности рибосомальных 16S РНК (16S rRNA). В данном случае для анализа последовательностей 16S rRNA микроорганизма применяли широко используемые праймеры, такие как 27F (AGA GTT TGA ТСС TGG СТС AG; SEQ ID NO: 18) и 1492R (GGT TAC CTT GTT ACG ACT T; SEQ ID NO: 19), и, соответственно, было подтверждено, что 16S rRNA генома CJ-MKB имела последовательность оснований SEQ ID NO: 1.
Программу BLAST, предоставляемую Национальным центром биотехнологической информации (NCBI), применяли для поиска штамма с высокой степенью гомологии нуклеиновой кислоты с SEQ ID NO: 1 (http://blast.ncbi.nlm.nih.gov/Blast.cgi CPROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome). В результате было подтверждено, что штамм характеризовался последовательностью, аналогичной 16S rRNA каждого из штамма P. stutzeri NBRIS11, гамма-протеобактерии BP44-iso8, некультивируемого бактериального клона 9, штамма Escherichia coli ВМ0446 и бактерии семейства enterobacteriaceae ВМ005 соответственно.
Несколько микроорганизмов рода Pseudomonas, как известно, вырабатывают экзополисахарид с образованием биопленки. Кроме того, микроорганизмы рода Pseudomonas также были устойчивыми к бета-лактамным антибиотикам, таким как пенициллин. С учетом информации о последовательностях 16S rRNA штамма CJ-MKB, устойчивости к ампициллину и наличия биопленки, продемонстрированной в ходе культивирования, с высокой вероятностью ожидалось, что отобранный штамм представляет собой микроорганизм рода Pseudomonas. Одну колонию, полученную на чашке со средой М9 с агаром, содержащей 25 мг/мл ампициллина, культивировали в бульоне LB, а затем центрифугировали при скорости 13000 об./мин. в течение 1 минуты, за счет чего осуществляется получение культуры штамма (фиг. 1). Когда к полученному штамму добавляли дистиллированную воду и смешанный раствор слегка встряхивали, биопленка и штамм легко отделялись друг от друга.
2) Анализ последовательностей для оксидоредуктазы
Для определения того, являлся ли отобранный штамм микроорганизмом рода Pseudomonas, анализировали, имеет ли новый штамм CJ-MKB последовательность оснований оксидоредуктазы, которая есть у рода Pseudomonas. В данном случае заново сконструированные праймеры, такие как NCPPB 5Р (ATGAGCAAGACTAACGAATCCC; SEQ ID NO: 20) и NCPPB 3Р (TCCAGAATGGCCAGCCCGCG; SEQ ID NO: 21), применяли для проведения анализа последовательностей. В результате было подтверждено, что отобранный штамм имеет последовательность оснований SEQ ID NO: 2.
В результате анализа с применением программы BLAST NCBI в отношении последовательности оснований SEQ ID NO: 2, было подтверждено, что последовательность оснований SEQ ID NO: 2 содержит ту же последовательность, что и молибдоптерин-связывающая последовательность оксидоредуктазы известного штамма P. stutzeri А1501. В связи с этим, было подтверждено, что отобранный новый штамм CJ-MKB представлял собой микроорганизм рода Pseudomonas.
3) Анализ последовательностей для трансаминазы
Поскольку было подтверждено, что нуклеотидная последовательность, характеризующаяся гомологией, представляет собой короткую последовательность из 714 оснований, подгруппу микроорганизма невозможно было правильно классифицировать. В связи с этим, для подтверждения подгруппы анализировали последовательности нуклеиновой кислоты дополнительного белка. Если микроорганизм использовал 6-АСА в качестве источника азота, ожидалось, что среди трансаминаз, в ферментативную реакцию превращения вовлечены, в частности, трансаминаза N-ацетилорнитина или трансаминаза 4-аминобутирата. Соответственно, была подтверждена последовательность оснований белка с двумя видами ферментативной активности.
В частности, для сравнительного анализа последовательности оснований для трансаминазы N-ацетилорнитина, присутствующие в геномах P. stutzeri А1501 и отобранного штамма CJ-MKB, argD_F2 (праймер для 5': ATTTAAGGATCCGTCCGCCCCGCACACCCCGG; SEQ ID NO: 22) и argD_R2 (праймер для 3': ATTTAAGAGCTCTCAGGCCTGGGTCAGCGTC; SEQ ID NO: 23), применяли для анализа последовательностей нуклеиновой кислоты с помощью ПЦР. В результате было подтверждено, что трансаминаза N-ацетилорнитина P. stutzeri А1501 и трансаминаза N-ацетилорнитина нового микроорганизма имели последовательности оснований SEQ ID NO: 3 и SEQ ID NO: 4 соответственно.
Аналогичным образом, для сравнительного анализа последовательности оснований для трансаминазы 4-аминобутирата P. stutzeri А1501 и отобранного штамма, gabT_F (праймер для 5': ATTTAACATATGCAACGCCGTGTCGCCGCCGTTCC; SEQ ID NO: 24) и gabT_R (праймер для 3': ATTTAAGAATTCTCAGGTCAGCTCGTCGAAACACT; SEQ ID NO: 25), применяли для проведения ПЦР. В результате было подтверждено, что P. stutzeri А1501 и отобранный штамм имели последовательности оснований SEQ ID NO: 5 и SEQ ID NO: 6 соответственно.
Для сравнительного анализа последовательностей оснований для трансаминазы N-ацетилорнитина P. stutzeri А1501 и отобранного штамма применяли множественное выравнивание последовательностей. В результате было подтверждено, что из 1221 последовательностей нуклеиновых кислот отличались 13 нуклеиновых кислот (гомология нуклеиновых кислот: 98,9353%). Кроме того, аналогично описанному выше, результаты сравнительного анализа последовательностей нуклеиновых кислот трансаминазы 4-аминобутирата P. stutzeri А1501 и отобранного штамма подтвердили, что из 1257 последовательностей нуклеиновых кислот отличалась 21 нуклеиновая кислота (гомология нуклеиновых кислот: 98,3294%).
В заключение, было подтверждено, что отобранный штамм P. stutzeri CJ-MKB характеризовался наиболее высокой гомологией с P. stutzeri А1501 среди известных на данный момент геномных последовательностей микроорганизмов, и, таким образом, он представляет собой новый штамм. Соответственно, отобранный штамм был депонирован 22 октября 2014 года в Корейском центре культур микроорганизмов, и ему был присвоен номер доступа KCCM11587P.
Пример 2. Идентификация реакционной способности в отношении дезаминирования у Р. stutzeri CJ-MKB
P. stutzeri CJ-MKB подвергали оценке реакционной способности в отношении дезаминирования 5-аминовалериановой кислоты и 6-аминокапроновой кислоты. Поскольку трансаминазная реакция представляет собой реакцию замещения между аминогруппой и кетонной группой, субстраты и продукты легко идентифицировали с помощью цветной реакции, в которой продукты реакции, которые подвергали разделению веществ с применением тонкослойной хроматографии (TLC), можно было легко идентифицировать с помощью цветной реакции на определение аминогруппы с нингидрином. Для подтверждения трансаминазной активности у P. stutzeri CJ-MKB осуществляли реакцию с целой клеткой. Когда P. stutzeri CJ-MKB культивировали и оптическая плотность культуры достигала 0,7, культуру субкультивировали на новой среде М9. В данном случае 6-аминокапроновую кислоту и 5-аминовалериановую кислоту использовали в качестве источника азота, а затем клетки культивировали. В культуру добавляли альфа-кетоглутарат и пиридоксальфосфат, необходимые для среды, и для подтверждения степени дезаминирования 5-аминовалериановой кислоты и 6-аминокапроновой кислоты затем осуществляли TLC. В данном случае объем реакционной смеси составлял 100 мкл, и с помощью TLC подтверждали образование глутамата и степень разрушения субстрата, которые зависели от различных концентраций 5-аминовалериановой кислоты, 6-аминокапроновой кислоты, альфа-кетоглутарата и пиридоксальфосфата, а также присутствие и отсутствие каждого субстрата. После того, как была завершена проявка TLC, материал, содержащий аминогруппу, проявляли 3% раствором нингидрина. В соответствии с результатами TLC было подтверждено, что количество 5-аминовалериановой кислоты и 6-аминокапроновой кислоты снижалось, и образовывался глутамат (см. фигуры 2A-2F).
Как показано на фиг. 2F (97-часовая реакция, дорожка 4), было подтверждено, что в случае штамма, к которому добавляли 20 мМ 6-аминокапроновой кислоты, 10 мМ альфа-кетоглутарата и 0,1 мМ пиридоксальфосфата, за 97 часов прореагировала вся 6-аминокапроновая кислота. В сравнении со случаем, когда трансаминазная реакция была полностью завершена, скорость реакции 6-аминокапроновой кислоты была медленной, однако снижение количества 6-аминокапроновой кислоты наблюдалось в TLC даже в отсутствие пиридоксальфосфата (см. фиг. 2F, 97-часовая реакция, дорожка 4-1). Когда 5-аминовалериановая кислота и 6-аминокапроновая кислота присутствовали одновременно, снижение количества 6-аминокапроновой кислоты не подтверждалось (см. фиг. 2F, 97-часовая реакция, дорожки 5 и 5-1). В связи с этим, когда P. stutzeri CJ-MKB культивировали в условиях с минимальной средой, было установлено, что 6-аминокапроновая кислота и 5-аминовалериановая кислота конкурируют между собой как источники азота.
Из результата этого эксперимента было подтверждено, что P. stutzeri CJ-MKB может использовать 6-аминокапроновую кислоту в качестве единственного источника азота, и в присутствии альфа-кетоглутарата и пиридоксальфосфата дезаминирование 5-аминовалериановой кислоты и 6-аминокапроновой кислоты ускорялось (см. фигуры 2A-2F). На фигурах 2D и 2Е (24-часовая реакция, дорожка 5; и 72-часовая реакция, дорожка 4), подтверждали небольшое количество глутамата, но при этом глутамат не накапливался непрерывно. Глутамат образовывался наряду с реакцией 6-аминокапроновой кислоты, и большая часть образуемого глутамата использовалась в качестве источника амина, и, тем самым, было установлено, что глутамат подвергался быстрому превращению без накапливания в клетках.
Пример 3. Индукция сверхэкспрессии нового обладающего трансаминазной активностью полипептида по настоящему изобретению в штамме Е. coli и оценка реакционной способности полипептида
1) Индукция сверхэкспрессии полипептида, обладающего трансаминазной активностью, и получение из штаммов P. stutzeri CJ-MKB в штаммах Е. coli
Для подтверждения активности фермента, который предположительно является трансаминазой, и, как ожидается, вовлечен в реакцию дезаминирования в новом штамме P. stutzeri CJ-MKB, который был отобран и идентифицирован в примере 1, проводили следующий эксперимент. С помощью анализа последовательностей была подтверждена последовательность оснований гена (далее в данном документе называемого "argD"), кодирующего трансаминазу P. stutzeri CJ-MKB (SEQ ID NO: 4).
С целью экспрессии и очистки осуществляли клонирование путем добавления His-метки на 5-концевой последовательности оснований argD для экспрессии. В частности, для получения трансформированного штамма рекомбинантный argD, полученный из P. stutzeri CJ-MKB, вводили в Е. coli Rosetta с применением вектора для экспрессии в Е. coli pETDuet1 (Merch Millipore, Дармштадт, Германия) Затем полученный трансформированный штамм добавляли в 3 мл бульонной среды LB, в которую добавляли 50 мг/мл ампициллина, и штамм культивировали при температуре 37°С в течение 12 часов. Культивируемый штамм культивировали при температуре 37°С в 50 мл среды LB, содержащей антибиотики. Как только его оптическая плотность (при длине волны 600 нм) достигала 0,8, индуцировали экспрессию, а затем штамм дополнительно культивировали при температуре 18°С в течение 48 часов. Культивируемый штамм промывали и разрушали с применением соникатора. Затем сверхэкспрессированные растворимые белки после разрушения идентифицировали по результатам SDS-PAGE на геле (фиг. 3).
Трансформированный Е. coli Rosetta был назван 'Е. coli Rosetta СС04-0057' и депонирован в Корейском центре культур микроорганизмов (KCCM) 22 октября 2014 года под номером доступа KCCM11588P.
2) Оценка реакционной способности в отношении дезаминирования для лизата Е. coli, в котором были сверхэкспрессированы обладающие трансаминазной активностью полипептиды по настоящему изобретению
Реакционную способность каждого из аминосоединений (гамма-аминомасляная кислота, 6-аминокапроновая кислота и N-ацетилорнитин) оценивали с применением лизата Е. coli, в котором сверхэкспрессирована трансаминаза N-ацетилорнитина из примера 3-1. Добавляли 10 мМ каждого их трех аминосоединений, 10 мМ альфа-кетоглутарата и 0,1 мМ пиридоксальфосфата и оценивали активность сверхэкспрессированной трансаминазы N-ацетилорнитина. В 50 мМ буфера HEPES (рН 8,0) добавляли 50 мкл лизата Е. coli, в котором индуцировали сверхэкспрессию, и субстраты для проведения реакции в объеме 100 мкл. Через 30 минут реакции при температуре 37°С с помощью TLC определяли степень дезаминирования 6-аминокапроновой кислоты (фиг. 4).
Наблюдали, что сверхэкспрессированная трансаминаза N-ацетилорнитина характеризуется высокой реакционной способностью в отношении N-ацетилорнитина, который, как известно, является основным субстратом (дорожка 8 из фиг. 4). В частности, наблюдали, что количество N-ацетилорнитина значительно снижалось, при этом количество глутамата, который является сореагентом трансаминазы, значительно повышалось. Кроме того, если реакцию осуществляли с 6-аминокапроновой кислотой в качестве субстрата, образование глутамата наблюдали невооруженным глазом (дорожка 5 из фиг. 4).
Кроме того, по повышению концентрации 6-аминокапроновой кислоты, таким же образом, как при описанной выше оценке реакционной способности, количество глутамата, образуемого в реакции превращения, анализировали с помощью TLC (фиг. 5). В результате, как показала реакция (фиг. 5D), было подтверждено, что, если концентрацию 6-аминокапроновой кислоты удваивали (20 мМ) или утраивали (30 мМ), повышалось образование глутамата. Следовательно, было подтверждено, что превращение 6-аминокапроновой кислоты с помощью трансаминазы N-ацетилорнитина представляло собой типичную ферментативную реакцию, в которой количество продукта повышается с повышением количества субстрата.
В заключение, исходя из вышеприведенных результатов, было подтверждено, что, если ген полипептида, обладающего трансаминазной активностью, полученный из P. stutzeri CJ-MKB, был трансформирован и сверхэкспрессирован в Е. coli, то полипептид по настоящему изобретению характеризовался активностью в отношении дезаминирования 6-аминокапроновой кислоты.
Пример 4. Оценка активности трансаминазы N-ацетилорнитина, полученной из различных штаммов Pseudomonas, в отношении дезаминирования
Оценивали активность полипептида в отношении дезаминирования 6-аминокапроновой кислоты, где полипептид был получен из P. stutzeri CJ-MKB и обладал трансаминазной активностью, как в примере 3. В связи с этим, гены трансаминаз N-ацетилорнитина, полученные из микроорганизмов рода Pseudomonas, таких как P. mendocina, P. putida, P. resinovorans, P. syringae и P. thermotolerans, которые считаются способными к осуществлению той же реакции биоконверсии, как описано выше, экспрессировали в Е. coli для оценки их реакционной способности.
1) Сравнение гомологии трансаминаз N-ацетилорнитина, полученных из различных штаммов Pseudomonas
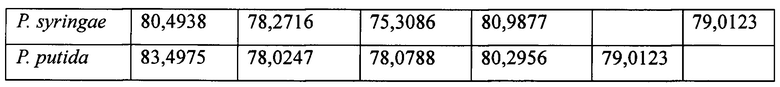
Пять штаммов отбирали из микроорганизмов рода Pseudomonas, а затем нуклеотиды, предоставляемые Национальным центром биотехнологической информации (http://www.ncbi.nlm.nih.gov), и программу для работы с геномом применяли для идентификации генов и аминокислотных последовательностей трансаминаз N-ацетилорнитина, полученных из P. mendocina, P. putida, P. resinovorans, P. syringae и P. thermotolerans. Затем сравнивали гомологию с аминокислотной последовательностью полипептида, полученного из P. stutzeri CJ-MKB, и обладающего трансаминазной активностью (таблица 2). Каждый из ферментов, полученных из микроорганизмов рода Pseudomonas, продемонстрировал по меньшей мере приблизительно 75% гомологию относительно друг друга.

2) Выделение и очистка трансаминаз N-ацетилорнитина, полученных из пяти штаммов Pseudomonas, и полипептида по настоящему изобретению
Гены трансаминаз N-ацетилорнитина из пяти штаммов Pseudomonas и ген полипептида, обладающего трансаминазной активностью, полученного из P. stutzeri CJ-MKB, по настоящему изобретению, были получены в примере 4-1 и экспрессированы в Е. coli аналогичным образом, как в примере 3-1. Затем получали белки, очищенные с применением колонки для His-метки. В результате сравнения белков, полученных на SDS-PAGE геле, было подтверждено, что белки были очищены надлежащим образом (фиг. 6).
3) Оценка дезаминирующей активности трансаминаз N-ацетилорнитина, полученных из пяти штаммов Pseudomonas, и полипептида по настоящему изобретению в отношении 6-аминокапроновой кислоты
Проверяли реакционную способность белков, очищенных в примере 4-2, в отношении 6-аминокапроновой кислоты (дорожки 3, 5, 7, 9, 11 и 13 из фиг. 6). В частности, в реакционный раствор, содержащий 20 мМ 6-аминокапроновой кислоты, 10 мМ альфа-кетоглутамата и 0,1 мМ пиридоксальфосфата, добавляли каждую очищенную трансаминазу N-ацетилорнитина в концентрации 0,5 мг/мл от общего реакционного раствора. Затем в перемешанный раствор добавляли 50 мМ HEPES (рН 8,0) и осуществляли реакцию в объеме 100 мкл. Спустя 1 час реакции при температуре 37°С 10 мкл образца с завершенной реакцией разбавляли 990 мкл этанола для устранения ферментативной активности. Затем в условиях со скоростью 14000 об./мин., температурой 4°С и продолжительностью реакции 10 минут осуществляли центрифугирование, и 10 мкл супернатанта разбавляли 990 мкл стерильной дистиллированной воды. Затем для анализа степени снижения количества 6-аминокапроновой кислоты применяли жидкостную хроматографию с масс-спектрометрией, LC-MASS.
В результате было подтверждено, что трансаминаза N-ацетилорнитина, полученная из P. syringae, продемонстрировала 56,69% превращение 6-аминокапроновой кислоты, тогда как полипептид, полученный из P. stutzeri CJ-MKB, продемонстрировал 45,52% превращение 6-аминокапроновой кислоты, относительно других сравниваемых штаммов.
Для сравнения степени образования альдегида с использованием относительных значений активности, определенных с применением реактива Шиффа (фиг. 8) применяли тот же образец. В реакции с 20 мМ 6-аминокапроновой кислоты, 10 мкл реакционной смеси разбавляли 180 мкл 50 мМ буфером HEPES (рН 8,0) и в него добавляли 10 мкл реактива Шиффа для реакции при комнатной температуре в течение 30 минут. В данном случае образец фермента, к которому не добавляли субстрат, и образец субстрата, к которому добавляли только субстрат, применяли в качестве контрольных образцов. Сравнивали относительные показатели ферментативной активности на основе значений поглощения при длине волны 490 нМ с применением ридера для 96-луночных планшетов (фиг. 8).
Образование альдегида в образце для реакции трансаминазы N-ацетилорнитина, полученной из P. thermotolerans, согласно измерению было выше, по сравнению с результатами LC-масс-спектрометрии, однако общий уровень реакции был того же порядка. Кроме того, было подтверждено, что результаты LC-масс-спектрометрии и результаты анализа с использованием реактива Шиффа коррелировали.
4) Оценка дезаминирующей активности трансаминаз N-ацетилорнитина, полученных из штаммов рода Pseudomonas, и полипептида по настоящему изобретению в отношении N-ацетилорнитина, гамма-аминомасляной кислоты и 5-аминовалериановой кислоты в качестве субстратов
В отношении различных субстратов оценивали реакционную способность трансаминаз N-ацетилорнитина, которые были получены из пяти микроорганизмов рода Pseudomonas, и реакционную способность которых идентифицировали в примере 4-3, и реакционную способность полипептида по настоящему изобретению. Вместе с 10 мМ альфа-кетоглутамата и 0,1 мМ пиридоксальфосфата добавляли N-ацетилорнитин, гамма-аминомасляную кислоту или 5-аминовалериановую кислоту в концентрации 10 мМ от общего реакционного раствора, и трансаминазу N-ацетилорнитина добавляли в концентрации 0,5 мг/мл от общего реакционного раствора, для осуществления реакции при температуре 37°С в течение 1 часа. 10 мкл из 100 мкл реакционной смеси разбавляли 180 мкл 50 мМ буфером HEPES (рН 8,0) и использовали 10 мкл реактива Шиффа для 30-минутной реакции. Затем для сравнения показателей ферментативной активности применяли ридер для 96-луночных планшетов.
Реакция дезаминирования N-ацетилорнитина, который, как известно, является основным субстратом трансаминазы N-ацетилорнитина, продемонстрировала наиболее высокую активность, в случае получения из P. mendocina (фиг. 9).
В отношении гамма-аминомасляной кислоты, наиболее высокая реакционная способность была показана для трансаминазы N-ацетилорнитина, полученной из P. resinovorans (фиг. 10).
В отношении 5-аминовалериановой кислоты, наиболее высокая реакционная способность была показана для полипептида, полученного из P. stutzeri CJ-MKB (фиг. 11).
Пример 5. Оценка активности полипептида, обладающего трансаминазной активностью, полученного из P. stutzeri CJ-MKB, в отношении осуществления обратной реакции
В соответствии с примером 4 было подтверждено, что трансаминазы N-ацетилорнитина, полученные из различных штаммов Pseudomonas, и полипептид по настоящему изобретению, обеспечивали превращение в полуальдегид адипиновой кислоты и т.п. путем дезаминирования аминосоединения, такого как 6-аминокапроновая кислота. В примере 5, в случае реакции, обратной реакции из примера 4, для подтверждения реакционной способности в отношении превращения полуальдегида адипиновой кислоты в 6-аминокапроновую кислоту, избыток глутамата обрабатывали в присутствии полуальдегида адипиновой кислоты, образуемого под действием трансаминазы N-ацетилорнитина, для подтверждения таким образом того, превращается ли полуальдегид адипиновой кислоты в 6-аминокапроновую кислоту.
Сначала 5 мМ 6-аминокапроновой кислоты, 5 мМ альфа-кетоглутарата и 0,1 мМ пиридоксальфосфата готовили с 50 мМ буфером HEPES (рН 8,0) в объеме 100 мкл, и к ним добавляли трансаминазы N-ацетилорнитина, полученные из пяти штаммов Pseudomonas, и полипептид по настоящему изобретению в концентрации 0,5 мг/мл от общего реакционного раствора, за счет чего осуществлялась реакция при температуре 37°С в течение 1 часа. После завершения реакции образец, полученный в результате реакции, обрабатывали при температуре 100°С в течение по меньшей мере 5 минут для устранения таким образом ферментативной активности. Термически обработанный образец центрифугировали при скорости 14000 об./мин. в течение 10 минут при температуре 4°С, а затем 10 мкл супернатанта разбавляли 180 мкл 50 мМ буфером HEPES (рН 8,0) (прямая реакция, реакция с альфа-кетоглутаратом (α-KG)).
Кроме того, для индукции реакции, обратной описанной выше реакции, готовили образец объемом 200 мкл и обрабатывали его в условиях, аналогичных описанным выше. После осуществления по отношению к нему центрифугирования, к 97 мкл супернатанта добавляли 20 мМ глутамата и 0,5 мг/мл фермента. Затем, в объеме 100 мкл, образец для реакции подвергали реакции при температуре 37°С в течение 1 часа, с последующей обработкой при температуре 100°С в течение 5 минут. Затем по отношению к нему осуществляли центрифугирование при скорости 14000 об./мин. в течение 10 минут при температуре 4°С, а затем 10 мкл супернатанта разбавляли 180 мкл 50 мМ буфером HEPES (рН 8,0) (обратная реакция, реакция с глутаматом).
Полученный образец подвергали реакции с 10 мкл реактива Шиффа в течение 30 минут, и для сравнения показателей ферментативной активности применяли ридер для 96-луночных планшетов. В результате при сравнении значений, полученных с применением ридера для 96-луночных планшетов, после реакции с реактивом Шиффа было подтверждено, что трансаминазы N-ацетилорнитина, полученные из 5 штаммов Pseudomonas, и полипептид по настоящему изобретению, обеспечивали превращение полуальдегида адипиновой кислоты в 6-аминокапроновую кислоту (фиг. 12).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2,4-ДИГИДРОКСИБУТИРАТА | 2013 |
|
RU2645260C2 |
| Микроорганизм для продуцирования путресцина и способ получения путресцина с его использованием | 2015 |
|
RU2653453C1 |
| МИКРООРГАНИЗМЫ ДЛЯ ПОЛУЧЕНИЯ ПУТРЕСЦИНА И СПОСОБ ПОЛУЧЕНИЯ ПУТРЕСЦИНА С ИХ ИСПОЛЬЗОВАНИЕМ | 2011 |
|
RU2573923C2 |
| МИКРООРГАНИЗМЫ, ИМЕЮЩИЕ УЛУЧШЕННУЮ ОРНИТИН-ПРОДУЦИРУЮЩУЮ СПОСОБНОСТЬ, И СПОСОБ ПОЛУЧЕНИЯ ОРНИТИНА С ИХ ИСПОЛЬЗОВАНИЕМ | 2011 |
|
RU2567669C2 |
| Микроорганизм для продуцирования диамина и способ получения диамина с его использованием | 2015 |
|
RU2672323C2 |
| ХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ СПИРОИНДОЛОНОВ И ИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2013 |
|
RU2662815C2 |
| Микроорганизм рода Corynebacterium для продуцирования L-аргинина и способ получения L-аргинина с использованием этого микроорганизма | 2015 |
|
RU2671106C1 |
| Микроорганизм для продуцирования диамина и способ получения диамина с его использованием | 2015 |
|
RU2696504C2 |
| БИОЛОГИЧЕСКИЙ СИНТЕЗ ДИФУНКЦИОНАЛЬНЫХ АЛКАНОВ ИЗ АЛЬФА-КЕТОКИСЛОТ | 2009 |
|
RU2496880C2 |
| РЕКОМБИНАНТНЫЙ МИКРООРГАНИЗМ, ОБЛАДАЮЩИЙ ПОВЫШЕННОЙ СПОСОБНОСТЬЮ ПРОДУЦИРОВАТЬ ПУТРЕСЦИН, И СПОСОБ ПОЛУЧЕНИЯ ПУТРЕСЦИНА С ИСПОЛЬЗОВАНИЕМ ЭТОГО МИКРООРГАНИЗМА | 2013 |
|
RU2603089C2 |











Способ дезаминирования аминосоединения, при этом способ включает добавление выделенного полипептида, обладающего трансаминазной активностью в отношении аминосоединения, при этом указанный полипептид содержит аминокислотную последовательность SEQ ID NO: 7 или аминокислотную последовательность, характеризующуюся по меньшей мере 75% гомологией с SEQ ID NO: 7, или микроорганизма, трансформированного полинуклеотидом, кодирующим указанный выделенный полипептид, в раствор, содержащий аминосоединение, где аминосоединение представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из гамма-аминомасляной кислоты, 5-аминовалериановой кислоты и 6-аминокапроновой кислоты. 5 н. и 3 з.п. ф-лы, 12 ил., 2 табл., 5 пр.
1. Способ дезаминирования аминосоединения, при этом способ включает:
добавление выделенного полипептида, обладающего трансаминазной активностью в отношении аминосоединения, при этом указанный полипептид содержит аминокислотную последовательность SEQ ID NO: 7 или аминокислотную последовательность, характеризующуюся по меньшей мере 75% гомологией с SEQ ID NO: 7, или микроорганизма, трансформированного полинуклеотидом, кодирующим указанный выделенный полипептид, в раствор, содержащий аминосоединение, где аминосоединение представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из гамма-аминомасляной кислоты, 5-аминовалериановой кислоты и 6-аминокапроновой кислоты.
2. Способ по п. 1, где раствор дополнительно содержит пиридоксальфосфат в дополнение по меньшей мере к одному, выбранному из группы, состоящей из пирувата, оксалоацетата и альфа-кетоглутарата.
3. Способ получения аминосоединения, при этом способ включает:
добавление полипептида, обладающего трансаминазной активностью в отношении аминосоединения, при этом указанный полипептид содержит аминокислотную последовательность SEQ ID NO: 7 или аминокислотную последовательность, характеризующуюся по меньшей мере 75% гомологией с SEQ ID NO: 7, или микроорганизма, трансформированного полинуклеотидом, кодирующим указанный выделенный полипептид, в раствор, содержащий соединение, представляющее собой полуальдегид, которое включает по меньшей мере одно, выбранное из группы, состоящей из полуальдегида янтарной кислоты, полуальдегида глутаровой кислоты и полуальдегида адипиновой кислоты, и аминосоединение представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из гамма-аминомасляной кислоты, 5-аминовалериановой кислоты и 6-аминокапроновой кислоты.
4. Композиция для дезаминирования аминосоединения, при этом композиция содержит выделенный полипептид, обладающий трансаминазной активностью в отношении аминосоединения, при этом указанный полипептид содержит аминокислотную последовательность SEQ ID NO: 7 или аминокислотную последовательность, характеризующуюся по меньшей мере 75% гомологией с SEQ ID NO: 7, или микроорганизм, трансформированный полинуклеотидом, кодирующим указанный выделенный полипептид, с целью обеспечения экспрессии указанного выделенного полипептида, где аминосоединение представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из гамма-аминомасляной кислоты, 5-аминовалериановой кислоты и 6-аминокапроновой кислоты.
5. Применение выделенного полипептида, обладающего трансаминазной активностью в отношении аминосоединения, при этом указанный выделенный полипептид содержит аминокислотную последовательность SEQ ID NO: 7 или аминокислотную последовательность, характеризующуюся по меньшей мере 75% гомологией с SEQ ID NO: 7, или микроорганизма, трансформированного полинуклеотидом, кодирующим указанный выделенный полипептид, с целью обеспечения экспрессии указанного выделенного полипептида в дезаминировании аминосоединения, где аминосоединение представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из гамма-аминомасляной кислоты, 5-аминовалериановой кислоты и 6-аминокапроновой кислоты.
6. Применение по п. 5, где микроорганизм представляет собой Escherichia.
7. Применение выделенного полипептида, обладающего трансаминазной активностью в отношении аминосоединения, при этом указанный выделенный полипептид содержит аминокислотную последовательность SEQ ID NO: 7 или аминокислотную последовательность, характеризующуюся по меньшей мере 75% гомологией с SEQ ID NO: 7, или микроорганизма, трансформированного полинуклеотидом, кодирующим указанный выделенный полипептид, с целью обеспечения экспрессии указанного выделенного полипептида в получении аминосоединения путем добавления указанного выделенного полипептида или указанного микроорганизма в раствор, содержащий соединение, представляющее собой полуальдегид, которое включает по меньшей мере одно, выбранное из группы, состоящей из полуальдегида янтарной кислоты, полуальдегида глутаровой кислоты и полуальдегида адипиновой кислоты, и аминосоединение представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из гамма-аминомасляной кислоты, 5-аминовалериановой кислоты и 6-аминокапроновой кислоты.
8. Применение по п. 7, где микроорганизм представляет собой Escherichia.
| NCBI, GenBank Accession No | |||
| WP_048329493.1, acetylornithine aminotransferase [Pseudomonas stutzeri], 26.06.2015; Найдено в Интернет по адресу: www.ncbi.nlm.nih.gov/protein/852276940?sat=46&satkey=47044874; | |||
| NCBI, GenBank Accession No | |||
| WP_017245727.1, succinyldiaminopimelate aminotransferase [Pseudomonas stutzeri], 27.06.2013; Найдено в Интернет |
Авторы
Даты
2020-04-14—Публикация
2016-06-03—Подача